Partie
Expérimentale
CHAPITRE 3
MATERIELS ET METHODES
Dans ce chapitre, nous abordons
les différents aspects pratiques de notre étude, à savoir
la méthodologie employée pour la préparation et la
caractérisation de l'adsorbant utilisé. Nous décrivons
ensuite le mode de préparation des solutions, les techniques de mesure
et d'analyse ainsi que le mode opératoire suivi pour l'étude de
la cinétique d'adsorption de l'adsorbat utilisé qui est le bleu
de méthylène sur le Musa acuminata.
3.1. Matériels et Réactifs
3.1.1. Matériels
Les matériels suivant ont été
utilisés au cours de cette étude :
1. Adsorbeur (LACOPE ADS- 3) ;
2. Ballon jaugé (100 mL, 1000 mL, 2000
mL) ;
3. Becher ;
4. Cellule de 1 cm en quartz et en verre ;
5. Creuset ;
6. Entonnoir ;
7. Flacon en verre et plastique ;
8. Papier aluminium ;
9. Pied gradué :
10. Pipette (0,5 mL, 2 mL, 5 mL, 10 mL, 23 mL, 50 mL) ;
11. Pissette (100 mL et 1000 mL) ;
12. Seringue (5 mL, 10 mL);
13. Tamis (diamètre de 1 mm) ;
14. Tube à essai (5 mL et 10 mL).
3.1.2. Appareillage
15. Agitateur oscillant (VEL 300 LEUVEN);
16. Balance analytique de marque JINNUO JT 2003B;
17. Broyeur ;
18. Centrifugeuse de
marque Labofuge 200 Heraeus ;
19. Dessiccateur ;
20. Etuve de marque
Heraeus de type électrique ;
21. Four de marque Heraeus ;
22. pH mètre (HANNA INSTRUMENTS);
23. Spectrophotomètre UV-visible de
marque Hack, SP1105.
3.1.3. Réactifs
1. Acide chlorhydrique (HCl); 37%
2. Bleu de méthylène trihydraté
(produit FLUKA AG, Bucha SG) ;
3. Chlorure de sodium (NaOH);
4. Eau distillée ;
5. Epluchures de Musa acuminata
3.2. Méthodes
Expérimentales
3.1.4. Préparation du Bioadsorbant
Les échantillons des épluchures de
Musa acuminata ont été collectés
dans le dépôt des bananes se trouvant au marché
Matadi Kibala dans la commune de Mont Ngafula.
Les épluchures de Musa acuminata ont
été coupés en petits morceaux et lavés à
l'eau de robinet, pour enlever les impuretés puis à l'eau
distillée pour la stérilisation des échantillons.
Ensuite, les échantillons de Musa acuminata ont
été séchés dans le Laboratoire de Chimie Organique,
Physique, Eau et Environnement, LACOPE, en sigle, au moyen de
l'énergie solaire, à l'air libre, pendant deux semaines, en vue
de prévenir toute éventuelle altération des
propriétés physicochimiques des échantillons.
La masse séchée a été
broyée à afin d'obtenir des échantillons homogènes
pour le besoin des études de laboratoire, donnant des grains de petite
taille, généralement inférieure à 1mm. Les figures
5 à 7 représentent les épluchures de Musa
acuminata dans leur état brut après collecte, après
deux semaines de séchage et après broyage. Ces
échantillons ont été ensuite isolés
mécaniquement au moyen d'un tamiseur dont la dimension des mailles
correspond à un diamètre inférieur à 1mm. Seuls les
grains représentant la masse d'échantillons qui passe par les
mailles de tamis de 1mm ont été considérés et
utilisés comme bioadsorbant MA pour les essais d'adsorption. Les tamisat
ainsi recueillis ont été mis à l'étuve pendant 48 h
à 105 oC pour chasser de l'eau ; c'est aussi une autre
forme de séchage. En somme la préparation du bioadsorbant
comporte cinq étapes, repris dans la figure 5.
Collecte
Séchage
Eau de Robinet
Broyage
Lavage
Eau distillée
Tamisage
Mise à l'étuve
Figure 5 : Etape de préparation d'un
Bioadsorbant (Michée N'kwady)



Figure 7 : Epluchure de Musa acuminata
après deux semaines de séchage (Photo Michée
N'KWADY)
Figure 6 : Epluchures de Musa acuminata
à l'Etat brut (Photo Michée N'KWADY)


Figure 8 : Echantillon de Musa acuminata
après broyage
3.1.5. Caractéristiques du
bioadsorbant
La connaissance des propriétés physico-chimiques
et structurelles d'un matériau quel qu'il soit, est nécessaire
pour contribuer à la compréhension de beaucoup de
phénomènes, tels que l'adsorption, la désorption,
l'échange ou autres. Dans ce but, le bioadsorbant MA a
été caractérisé en utilisant différents
paramètres de caractérisation.
a. Taux d'humidité
L'humidité a été déterminée
par séchage du Bioadsorbant dans une étuve. A cet effet, 5 g de
bioadsorbant MA contenus dans un creuset sont
placés dans une étuve (Heraeus de type électrique)
à 105°C pendant 48 h. La masse étuvée a
été pesée après refroidissement dans un dessicateur
et le taux d'humidité est alors déterminé par la relation
suivante :
% H =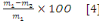 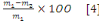
Avec :
% H : teneur d'humidité
m1 : masse initiale du B.A
m2 : masse du B. A après
séchage
b. Taux des cendres
Le pourcentage de la cendre a été
déterminé par calcination du 5 g du bioadsorbant M
A. A cet effet la masse du bioadsorbant a été
placée dans un four à moufles (Naber, model N7/H) à 550
°C pendant 8 h. Le taux de cendre est calculé selon la
relation :
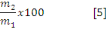
Avec :
m1 : Masse initiale du bioadsorbant
m2 : masse obtenue après
calcination
c. Teneur en matières sèches
(MS)
La teneur en matière sèche est
déterminée en déduisant la masse d'eau de la masse totale
du bioadsorbant.
d. pH du point de charge zéro ou nulle
(pHzpc)
La valeur de pH pour lequel, la charge nette de la surface du
adsorbant est nulle est appelée pHzpc. Ce paramètre est
très important dans les phénomènes d'adsorption, surtout
quand des forces électrostatiques sont impliquées dans les
mécanismes. Une façon simple et rapide pour déterminer le
pHzpc est de placer 1000 mg de bioadsorbant dans 100 mL de solutions de NaCl
0,01 M compris entre 3 et 12, pH ajustés par addition des solutions de
HCl 0,1M ou de NaOH 0,1M. Les suspensions sont maintenues en agitation,
à température ambiante, pendant 72 h. Le pH final de chacune des
solutions est alors déterminé. On porte sur un graphe le pH final
en fonction du pH initial. L'intersection de la courbe avec l'axe qui passe par
le zéro donne le point isoélectrique ou pHzpc.
| 


