|

REPUBLIQUE DEMOCRATIQUE DU CONGO
UNIVERSITE DE KAMINA
FACULTE DE MEDECINE
BP 279
ETUDE CLINIQUE, THERAPEUTIQUE ET
EVOLUTIVE DE L'ANEMIE PALUSTRE
CHEZ LES ENFANTS AGES DE 0 A 5 ANS
(Cas de l'hôpital JASON SENDWE)
Du 01 janvier 2012 au 31 décembre 2013
Par : Ivan NGELEKA KAKOKA
Mémoire présenté et défendu en vue de
l'obtention du titre de Docteur en Médecine
Directeur : CT Dr Augustin MUTOMBO MULANGU
ANNEE ACADEMIQUE 2013-2014

I
CONTENU
EPIGRAPHE IV
IN MEMORIUM V
DEDICACE VI
AVANT PROPOS VII
LISTE DES FIGURES ET TABLEAUX IX
RESUME X
INTRODUCTION 1
Etat de la Question 1
Problématique 2
Choix et intérêt du sujet 2
Objectifs 2
Subdivision du travail 3
CHAPITRE I : GENERALITES SUR LE PALUDISME GRAVE 4
I.1. Définition 4
I.2. Etiologie 4
I.2.1. Cycle du développement du plasmodium 4
I.3. Physiopathologie du Paludisme Grave 7
I.3.1. Hypothèse mécanique : 7
I.3.2. Hypothèse humorale ou immunologique 8
I.3.3. Résumé Physiopathologique 9
I.4. Diagnostic 10
I.4.1. Diagnostic clinique 10
I.4.2. Diagnostic biologique 13
I.5. Traitement du paludisme 14
I.5.1. Traitement préventif 15
I.5.2. Traitement curatif 15
I.5.3. Les Complications 16
CHAPITRE II : LES ANEMIES 18
II.1. DEFINITION 18
II.2. ETIO-PHYSIOPATHOLOGIE 18
II.2.1. Anémie liée à la formation des
Globules Rouges. 18
II.2.2. Anémies liées au métabolisme du
Globule Rouge 19
II.2.3. Anémies liées à la synthèse
de l'Hémoglobine 20
II.2.4. Anémies particulières 21
II.3.

II
CLASSIFICATION DES ANEMIES 21
II.4. DIAGNOSTIC 22
II.4.1. Clinique 22
II.4.2. Paraclinique ou Biologique 22
II.5. DIAGNOSTIC POSITIF 23
II.5.1. Anémie Arégénérative : Taux
de réticulocytes ? 120 000/mm3 23
II.5.2. Anémies régénératives : Taux
de réticulocytes ? 120 000/mm3 25
II.6. PRISE EN CHARGE 27
II.6.1. Préventif 27
II.6.2. Curatif 28
CHAPITRE III : MATERIELS ET METHODES 29
III.1. Présentation du cadre de travail 29
III.1.1. Historique 29
III.1.2. Situation Géographique 30
III.1.3. Organisation - Fonctionnement 30
III.2. Matériel et Méthodes 31
III.3. Difficultés rencontrées 32
CHAPITRE IV : RESULTATS 33
IV.1. ETUDE DESCRIPTIVE 33
IV.1.1. Aspects Sociodémographiques 33
IV.1.2. Caractéristiques Cliniques 36
IV.1.3. Aspects Thérapeutiques et évolutifs 37
IV.2. ETUDE ANALYTIQUE 39
IV.2.1. Mortalité et aspects sociodémographiques
39
IV.2.2. Mortalité et aspects cliniques 41
IV.2.3. Mortalité et aspects thérapeutiques 42
CHAPITRE V : DISCUSSION 44
Commune de résidence 44
Mois d'hospitalisation 44
Age 44
Sexe 45
Clinique 45
Traitement avant 46
Traitement pendant l'hospitalisation 46
Evolution 46

III
CONCLUSION 48
RECOMMANDATIONS 49
AUX AUTORITES GOUVERNEMENTALES : 49
AU PERSONNEL SOIGNANT : 49
A LA POPULATION 49
BIBLIOGRAPHIE 50

IV
EPIGRAPHE
« L'éternel est celui qui change le
rocher en étang, le roc en source d'eau. »
(Psaumes 114V8)
« Avant de voler il faut apprendre à se
tenir debout avoir les ailles n'est pas
suffisant.»
Inconnu

V
IN MEMORIUM
A toi ma mère MWAPE CHEMBO
Berthe
Les mots m'ont toujours manqués pour
exprimer toute l'affection que j'avais pour toi.
Ton amour et tes valeurs humaines m'ont
inspiré et guidé à apprendre un métier sacerdotal :
la médecine, j'aurai voulu que tu restes pendant très longtemps
à nos côtés, mais hélas rien ne peut contre la
volonté de Dieu ; que ton âme repose en paix
maman.

VI
DEDICACE
Je dédie affectueusement ce travail
A mon père MWIKA KAKOKA Ricky
A ma famille
A mes frères et soeurs
A la prunelle de mon coeur MUSAU MPOYI Léontine
A mes amis
A ma grande famille chrétienne.
Récoltez ce présent travail comme couronnement de
vos biens faits et l'aboutissement de vos prières.

VII
AVANT PROPOS
Voici aujourd'hui que nous nous trouvons à la fin de
notre carrière estudiantine qui nous a couté la tête
d'éléphant. La volonté, la détermination, le
courage, l'endurance, la patience et la persévérance sont les
armes qui nous ont conduit jusqu'à ce seuil pour l'élaboration et
la finalisation de ce travail.
La réalisation de ce travail est pour nous à la
fois un couronnement de tous nos efforts pour tant de privations et un
témoignage de notre passage dans ce monde scientifique. Le succès
de ce travail ne découle pas uniquement de nos propres efforts car la
réussite d'une oeuvre d'art n'est pas toujours le fruit du seul effort
de l'artiste, mais celui des efforts conjugués de plusieurs
personnes.
Nous tenons de prime abord à remercier ce bon Dieu qui,
pour sa bonté et par sa bienveillance, nous a créés et
nous a toujours gardé à chaque moment de notre vie quotidienne. A
toi Dieu d'amour, de vérité, de tendresse, d'honneur et gloire
à jamais.
Nous exprimons notre gratitude d'une manière
très considérée au Directeur de ce travail CT Dr MUTOMBO
MULANGU Augustin qui, en dépit de ses multiples occupations a
accepté de nous prendre en charge pour la direction de ce travail. Sa
disponibilité, sa patience et ses remarques ont permis de conduire ce
travail à bon port.
Nous pensons à tout le corps professoral de la
faculté de médecine, aux autorités académiques de
l'université de Kamina, à tous ceux qui, depuis la petite
école ont apportés une pierre pour ériger l'édifice
de notre formation.
Nous disons sincèrement merci au Docteur olivier
MUKUKU, qui nous a fait grand honneur en acceptant la codirection de ce travail
et n'a ménagé aucun effort pour faire accoucher cet oeuvre avec
une rigueur scientifique approuvée, nous vous exprimons notre
extrême respect et reconnaissance.
Nous réitérons nos remerciements à papa
Ricky MWIKA, papa Austin MWANDWE, maman marie KAMWASHA, Docteur John MANENGA,
en leur qualité d'encadreur ; plus proche des enfants, vous êtes
pour nous un exemple de rigueurs, d'amour et du travail bien fait, ce travail
est une expression de notre conviction.
Disons merci à la prunelle de notre coeur pour son
encouragement, patience, amour, dévouement ainsi que le silence quand
c'était nécessaire et la parole quand exigeait en la personne de
Léontine MUSAU.

VIII
Notre profonde gratitude va droit aux personnes
ci-après Vinay CIANDA, grâce SIMPASA, éloge MWANDWE,
Arlette MANDA, Christel CHANDA, Laurette KALAMBI, martine MPHIRI, Jocelyn
MWANDWE, Eli CHANDA, Vanessa MWANDWE, Gauthier MWANDWE, Samuel MWANDWE, vous
qui ne cessez de nous encourager et nous pousser de l'avant.
Nos sentiments les plus dévoués s'adressent
à vous : Dr Chantal MILOLO, Freddy KAPE, Dr Mick CHONGO, Dr Michel
KABAMBA.
Recevez l'expression de notre profonde gratitude.
A nos compagnons de lutte, ceux avec qui nous partageons les
mêmes objectifs, nourrissons les mêmes ambitions, affrontons les
tunnels de la vie estudiantine : pierre NTWADI, Guy BULUNGA, Gabriel LWANG,
Kevin MULOLO, Stéphanie MUSANGILAYI, Stella NDALA, nénette
BUKASA, Laurianne KIBWE, joatham BANZE, Chris BANZE, Manuella TSHISWAKA,
léonard TSHIZUBU.
A toute la majorité utile qui n'est pas citée
dans ces quelques lignes, trouvent ici l'expression de ma profonde
reconnaissance et me permettent de taire leur nom.
Ivan NGELEKA KAKOKA

IX
LISTE DES FIGURES ET TABLEAUX
Figures
- - - - - - - -
|
Figure N° 1 : Cycle Parasitaire
|
7
|
|
Figure N° 2 : Schéma physiopathologique
|
.9
|
|
Figure N° 3 : Répartition des cas selon le mois
d'admission
|
..33
|
|
Figure N° 4 : Distribution des cas selon la Commune de
Résidence
|
..34
|
|
Figure N° 5 : Répartition des cas selon le Sexe
|
35
|
|
Figure N° 6 : Répartition des cas selon les Signes
Cliniques
|
36
|
|
Figure N° 7 : Répartition des cas selon
l'évolution
|
..38
|
|
Figure N° 8 : Mortalité et mois d'admission
|
.40
|
Tableaux
Tableau N° I : Répartition des malades selon
l'année d'admission ..33
- Tableau N° II : Répartition des cas selon
l'âge 34
- Tableau N° III : Répartition des cas selon le
Diagnostic .34
|
l'hospitalisation .37
Tableau N° V : Répartition des Patients en fonction
du Traitement reçu pendant
|
|
l'hospitalisation
|
.37
|
|
Tableau N° VI Mortalité et aspects
sociodémographiques
|
39
|
|
Tableau N° VII : Mortalité et Signes cliniques
|
41
|
|
Tableau N° VIII : Mortalité et Diagnostic
associé à l'anémie palustre
|
..41
|
|
Tableau N° IX : Mortalité et traitement reçu
avant l'admission
|
.42
|
|
Tableau N° X : Mortalité et Traitement reçu
pendant l'hospitalisation
|
..43
|
- Tableau N°IV : Répartition des Patients en fonction
du Traitement reçu avant
-
- - - - -

X
RESUME
Le paludisme est une maladie endémique touchant
près de 107 pays et territoires, demeure de nos jours la première
parasitose la plus redoutable, menaçant ainsi la vie des enfants surtout
ceux de moins de 5 ans dans le monde particulièrement en Afrique
subsaharienne.
Ce travail est une étude rétrospective et
descriptive réalisée à l'hôpital Jason Sendwe au
cours de la période allant du 1er janvier 2012 au 31
décembre 2013. Cent trente enfants souffrant d'anémie palustre
grave ont fait l'objet de notre étude.
Après analyse, il ressort que l'âge moyen
25,9#177; 17,9% ; le sexe féminin prédomine avec 57,7% ; et les
pathologies associée, la drépanocytose 17,7% et la fièvre
bilieuse hémoglobinurique 12,1%
Les signes cliniques les plus retrouvés sont la
tachypnée 89,2%, la pâleur 83%, la fatigue 80,3% et la
splénomégalie 73%.Avant l'hospitalisation la quinine a
été utilisée dans 79,2% de cas. L'évolution est
marquée par le décès dans 17,7%.
En conclusion, des facteurs de risque étudié
nous montre qu'aucun paramètres clinique semblent avoir de l'influence
sur l'évolution fatale des enfants âgés de moins de 5 ans
touchés par le paludisme grave forme anémique.

1
INTRODUCTION
Etat de la Question
Le paludisme est une érythrocytopathie fébrile
et hémolysante due à la présence et au
développement dans le foie puis dans les hématies d'un
hématozoaire du genre Plasmodium. Il est transmis à l'homme par
la piqure infectante d'un moustique : l'anophèle femelle. Sur plus de
500 espèces d'anophèles connues, près d'une cinquantaine
seulement sont capables de transmettre la maladie [1]. De cinq espèces
plasmodiales (falciparum, malaria, vivax, ovale et knowlesi)
actuellement responsables de cette infection chez l'homme, le P.
faliciparum est plus redoutable car il tue chaque année plus d'un
million de personnes qui sont en majorité des enfants de moins de 5 ans
[2]. Il est aussi une cause fréquente de l'anémie chez les
enfants et les femmes enceintes, et est à l'origine de 25-35% des
consultations ambulatoires 20-45% des hospitalisations et de 15-35% de
décès [2].
Dans les zones endémiques, il peut être la cause
primaire de la moitié de tous les cas d'anémie
sévère avec un taux de l'hémoglobine <5,0 g/l et
l'hématocrite <15% [3]. Il s'agit donc d'un problème de
santé publique, responsable d'absentéisme scolaire et de
gêne considérable des activités de production et un frein
potentiel au développement des pays d'endémie palustre.
Cependant, en 2012, le paludisme touchait 107 pays et
territoires (zones à risque de transmission) et 3,2 milliards de
personnes y étaient exposés. On estime à 350-500 millions
le nombre d'épisodes palustres cliniques qui se produisent chaque
année [2].
Plusieurs chercheurs se sont intéressés à
ce fléau à cause de sa morbidité chez les enfants de moins
de 5 ans, les femmes enceintes ainsi que les personnes faiblement
immunisées en vue de stimuler les organismes spécialisés
à multiplier les programmes de lutte contre le paludisme. Dans beaucoup
des pays, les programmes de contrôle du paludisme avaient connu de
succès remarquables, mais la résistance des moustiques aux
insecticides a entrainé une recrudescence de la maladie et
l'éclosion de nouvelles épidémies. Ainsi des souches de
Plasmodium falciparum résistante à la chloroquine sont
apparues. Malgré les efforts entrepris pour réduire la
transmission de la maladie et améliorer son traitement, il y a eu peu
d'évolution depuis les années 1990 [4].

2

3
Problématique
Parmi les différentes formes de gravité du
paludisme, l'anémie sévère occupe une place importante
dans la littérature. Mais tout au long de nos recherches, nous nous
sommes rendu compte qu'il y a peu des travaux consacrés à cette
forme de gravité au pays (RDC) particulièrement à
Lubumbashi ainsi que sur les facteurs de risque de mortalité
dépendant uniquement de l'anémie palustre grave chez l'enfant.
Notre question principale est donc la suivante : quel est
le poids du paludisme grave forme anémique à Lubumbashi
précisément à l'hôpital Sendwe et comment est sa
prise en charge ?
? L'anémie palustre grave toucherait- elle tous les
enfants exposés au risque d'infection sans distinction aucune ?
? Quelle est l'évolution des enfants de moins de cinq ans
touchés par l'anémie palustre grave ? ? La mortalité due
au paludisme grave forme anémique serait-elle liée à
certains facteurs de risque à Lubumbashi ?
Choix et intérêt du sujet
Dans la pratique courante, la forme anémique du
paludisme constitue une préoccupation quotidienne pour les
pédiatres et les autres personnels de santé ainsi que les parents
car elle est responsable de taux élevés de morbidité et de
mortalité surtout chez les enfants de moins de cinq ans.
Le présent travail s'inscrit donc dans une
démarche de retracer l'anémie grave du paludisme chez l'enfant de
moins de cinq ans à Lubumbashi et d'en donner le profil
épidémiologique, clinique, thérapeutique et
évolutif ainsi que les facteurs de risque de mortalité.
Les résultats issus de ce travail permettront
l'amélioration de connaissances et la bonne compréhension des
aspects spécifiques du paludisme dans notre milieu.
Objectifs
? Objectif général :
contribuer à l'amélioration des connaissances et à la
prise en charge de l'anémie palustre grave à Lubumbashi.
? Objectifs spécifiques :
o Déterminer le profil épidémiologique
des enfants atteints de la forme anémique du paludisme grave ;
o Déterminer les signes cliniques rencontrés au
cours de cette forme de gravité du paludisme dans notre milieu ;
o Etablir le bilan thérapeutique des enfants atteints
de l'anémie palustre grave à l'hôpital Sendwe de Lubumbashi
;
o Rechercher les facteurs associés à la
mortalité liés au paludisme grave forme anémique.
Subdivision du travail
Hormis l'introduction, ce travail contient deux grandes
parties. La première est essentiellement théorique et
présente les généralités sur le paludisme grave
forme anémique chez l'enfant. La deuxième partie concerne nos
recherches sur le terrain et présente le cadre d'étude, les
matériels et méthodes, les résultats et la discussion.
Enfin la conclusion, les recommandations et les références
bibliographiques clôturent notre travail.

4
CHAPITRE I : GENERALITES SUR LE PALUDISME GRAVE
I.1. Définition
Le paludisme grave est une complication grave du paludisme
à plasmodium falciparum [10] ; c'est l'ensemble des manifestations
cliniques et biologiques liée à l'infection par le plasmodium et
susceptibles d'engager le pronostic vital à brève
échéance [4].
I.2. Etiologie
Selon leurs apparitions et leurs virulences,
1. Le Plasmodium Falciparum
2. Le Plasmodium Vivax
3. Le Plasmodium Ovale
4. Le Plasmodium Malariae
5. Et on y ajoute le Plasmodium Knowlesi de découverte
récente.
Ce sont des protozoaires intercellulaires dont la
multiplication est asexuée (ou schizogonique) chez l'homme et
sexuée (ou sporogonique) chez le moustique vecteur qui est
l'anophèle femelle. [5]
Au cours de leur cycle biologique, les plasmodies changent
sans cesse d'aspect et de taille, par suite de l'alternance de phases de
croissance.
I.2.1. Cycle du développement du plasmodium
S'effectue dans deux hôtes différents :
- Chez l`anophèle : c`est un cycle sexué
- Chez l`homme : c`est un cycle asexué
Au cours de la piqûre, le moustique infesté
injecte avec sa salive des centaines des parasites, sous forme de
sporozoïtes fusiformes qui ne restent dans la circulation sanguine qu'une
demi-heure. Ils gagnent rapidement le foie où s'effectue le cycle exo
érythrocytaire primaire (cycle pré érythrocytaire,
schizogonie tissulaire primaire) : les sporozoïtes pénètrent
dans les hépatocytes où ils se « cachent » sous le nom
de Crypto zoïdes : ceux-ci grossissent.
Leur noyau se divise et en une semaine environ, et constitue
un schizonte mature ou corps bleu, qui est basophile, volumineux contenant
quelques milliers de noyaux, déformant l'hépatocyte hôte et
repoussant son noyau en périphérie.

5
L'éclatement du corps bleu libère des nombreux
mérozoïtes qui pour la plupart s'emboisent dans les capillaires
sinusoïdaux et passent dans la circulation, amorçant les
premières schizogonies sanguines.
En cas d'infestation par le plasmodium vivax, ou plasmodium
ovale, certains mérozoïtes restent peut être dans le foie,
pénètrent dans des hépatocytes sains, effectuant un cycle
exo érythrocytaire secondaire (schizogonie tissulaire secondaire)
à l'origine des nouveaux corps bleus susceptibles de ré
ensemencer pendant des mois ou même des années le sang en
Mérozoïtes et de déterminer des reviviscences schizogoniques
(=érythrocytaires).
Ce type de rechute n'existe pas avec les plasmodiums
falciparum et malariae. Le cycle exo érythrocytaire secondaire par
colonisation d'hépatocytes saines à partir des
Mérozoïtes du corps bleu primitif est actuellement remis en
question. On pense que certains Cryptozoïtes peuvent rester quiescents
pendant un temps variable. Il y aura ainsi deux populations de
sporozoïtes, les uns évoluant immédiatement jusqu'au stade
de corps bleu intra hépatique et les autres, appelés
hypnozoïtes restant endormis dans les hépatocytes.
Le Plasmodium falciparum (et le plasmodium malariae) ne
comportent ni hypnozoïtes ni schizogonie tissulaire secondaire.
Dans le sang s'effectue le cycle asexué
érythrocytaire, chaque mérozoïte pénètre par
endocytose dans une hématie et s'y transforme en trophozoïtes :
celui-ci mesure 2 à 3 u et possède une volumineuse vacuole
nutritive qui refoule en périphérie son cytoplasme et son noyau.
Il grossit et son noyau se divise : c'est alors une schizonte qui se charge de
pigment malarique ou hémozoïne. La multiplication des noyaux dont
chacun s'entoure d'une plage cytoplasmique forme une schizonte mûre ou un
corps en Rosaces.
L'hémoglobine se dégrade et, dans
l'hématie parasitée apparaissent des granulations de
SCHÜFFNER (pour le plasmodium vivax et ovale), des tâches de MAURER
(pour le plasmodium falciparum) ou rien (pour le plasmodium malariae).
Le corps en rosace ou une schizonte mûre se dilate et
éclate; cet éclatement contemporain de l'accès
fébrile libère des Mérozoïtes qui vont parasiter des
Hématies vierges et effectuer des nouveaux cycles
schizogoniques érythrocytaires. Chaque cycle érythrocytaire dure
48H pour le plasmodium vivax, Pl. ovale ou falciparum et 72 H pour le
plasmodium malariae.
Lors de l'éclatement des rosaces,
l'hémozoïne libérée est phagocytée soit dans
le sang par des polynucléaires neutrophiles ou des monocytes, qui
deviennent mélanifères soit par des histiocytes dans le foie
(cellules de Kupffer), la rate ou la moelle
hématopoïétique.

6
Dans le sang s'amorce enfin le cycle sexué ou
sporogonique. Après plusieurs cycles schizogoniques, apparaissent dans
les hématies des éléments à potentiel sexuel qui
sont les gamétocytes mâles et femelles.
Chez l'anophèle femelle s'effectue le cycle
sexué ou sporogonique. En prenant son repas sanguin sur un
paludéen, l'anophèle femelle absorbe des Trophozoïtes, des
schizontes, des rosaces et des gamétocytes. Les éléments
asexués sont digérés et seuls les gamétocytes
ingérés assurent la poursuite du cycle.
Dans l'estomac du moustique, le gamétocyte mâle
se transforme en gamète par ex flagellation, le gamétocyte
femelle par expulsion de corpuscules chromatiniens. La fécondation du
gamète femelle donne un oeuf mobile : c'est l'ookinète qui
traverse la paroi de l'estomac de l'anophèle et se fixe au niveau de sa
face externe formant l'oocyste dans lequel s'individualisent les
sporozoïtes libérés par éclatement de l'oocyste. Ces
derniers gagnent avec prédilection les glandes salivaires de
l'anophèle.
La durée du cycle sporogonique varie de 10 à 40
jours selon la température de l'espèce plasmodiale. Elle est de
12 jours pour le plasmodium falciparum. Le cycle s'arrête lorsque la
température moyenne est inférieure à 16°C pour le
plasmodium vivax et à 18°C pour le plasmodium falciparum.
En résumé on distingue trois étapes qui sont
:
1. L'étape anophélienne avec son
cycle sexué ou sporogonique
2. L'étape humaine tissulaire avec son
cycle asexué ou schizogonique, hépatique et le stockage
éventuel d'hypnozoïtes
3. L'étape humaine vasculaire ou
érythrocytaire avec son cycle asexué (schizogonique) et
l'amorce du cycle sexué.
Retenons que le cycle exo érythrocytaire est d'une
semaine et que le plasmodium falciparum est l'espèce la plus redoutable,
celle qui tue, c'est aussi la plus largement répandu. [5 ,6].

7
Figure 1 : cycle parasitaire [7]
I.3. Physiopathologie du Paludisme Grave
Il y a deux hypothèses :
- Hypothèse mécanique
- Hypothèse humorale ou immunologique
I.3.1. Hypothèse mécanique :
Se repose sur l'observation d'obstruction de la micro
circulation capillaire. Cette obstruction est due à la
cytoadhérence des hématies parasitées sur les cellules de
l'endothélium vasculaire.
Cette cytoadhérence est provoquée par l'acte des
adhésines plasmodiales et des récepteurs cellulaire. Ces
adhésines plasmodiales sont des substances d'origine parasitaire. Ce
sont donc des exo antigènes qui s'individualisent à partir du
plasmodium intra érythrocytaires pour se fixer à la surface des
hématies (RESA ring infected erythrocyt surface).
Les récepteurs cellulaires sont des récepteurs
endothéliaux parmi lesquels nous avons : la thrombospondine,
glycoprotéine, CD36, les ICAM secrétées par des cellules
endothéliales comme les macrophages, les plaquettes sanguines.
Les sécrétions de ces récepteurs
endothéliaux, sont augmentées par l'activation des cellules par
les TNF á (Tumor Necrosis Factor á).

8
I.3.2. Hypothèse humorale ou immunologique
Est soutenue par les sécrétions des cytokines
qui sont les médiateurs cellulaires comme les TNF. Ces cytokines sont
secrétées par les macrophages et jouent un rôle très
important dans la survenue du neuro-paludisme.
Le taux sanguin des TNF chez l'homme est corrélé
à la mortalité et à la gravité due au paludisme. Le
TNF et l'IL1 modifient la perméabilité vasculaire, augmentent la
cyto-adhérence et déclenchent le phénomène
d'immunité humorale. Le TNF n'est pas le seul médiateur
impliqué dans le déclenchement du neuro-paludisme, il fait partie
d'un ensemble des médiateurs indirects.
La sécrétion d'autres médiateurs comme le
PA, les PGN, les NO, qui jouent un rôle dans le déclenchement du
neuro-paludisme. Notons que le NO est très toxique dans le cerveau et
peut conduire à un coma et entrainer la mort.
Les autres facteurs adjuvants sont :
a. Facteurs parasitaires comme :
- La sensibilité de la souche aux antipaludéens
;
- L'importance de l'inoculum avec possibilité de
développer une parasité mie élevée sans que la
réponse immunitaire puisse en contrôler l'évolution.
- La virulence de la souche avec augmentation de la vitesse
de la multiplication et la capacité élevée de la
production des diverses cytokines et de provoquer le phénomène de
cytoadhérence
b. Facteurs liés à l'hôte
> Génétique ;
> Immunologique ;
> Drépanocytose ;
> Déficience en G6PD ;
> Groupe HLA ;
> Les ag HLA de la première classe comme HLA BW53
entrainent 40% de
protection contre le neuro-paludisme ;
> Les ag HLA de la deuxième classe ne protègent
pas du tout en HLA DRW13
c. Facteurs immunologiques : le
neuro-paludisme ne survient presque pas chez un sujet immunisé
d. Nutritionnels : on se réfère
au rôle de l'acide para amino- benzoïque (PABA). Note que dans le
MPC il y a une carence en PABA, d'où les malnutris sont
protégés de faire le paludisme. [5]
9
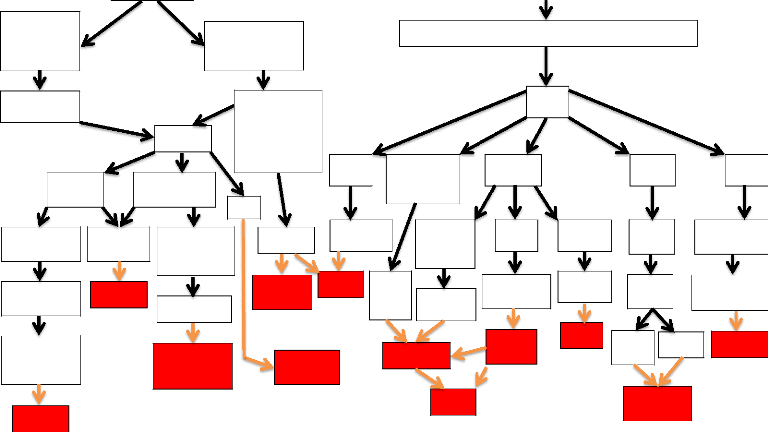
I.3.3. Résumé Physiopathologique
THEORIE MECANIQUE THEORIE HUMORALE
Hématies saines
Agglomération
avec
hématies
Parasitées
Phénomène de Rosette
Libération des phospholipides
Infiltration
hémorragique
péri-vasculaire
Lésions de
l'endothélium
C.I.V.D
En aval : Ischémie
Hypoxie
circulatoire
ACIDOSE
En amont :
Stase vasculaire
OEdème Aigu du Poumon (OAP)
Transsudation
Bouchon
Augmentation
de la Pression
Hydrostatique
Figure 2 : Schéma physiopathologique [7]
Hématies parasitées
Présence de
KNOBS
ligands (Protéines)
NTA
Récepteurs
protéiques
de
l'endothélium
capillaire
Cyto-adhérence
Hémoglobin urie
Hémolyse
Insuffisance Rénale (I.R)
Anémie
Moelle osseuse
Dysérythro-poïèse
Hyperth ermie
(Fièvre)
Convulsions
Dérèglement
centre
thermo
Régulateur
Cellules immunocompétentes (Macrophages et Lymphocytes)
?° Radicaux libres
(Oxydation)
Souffrance cérébrale
COMA
?° de la
Néoglucogenè
Circulation sanguine
Hypo-
glycémie
?° de CPK
T.N.F
Vasodilatat ion
Libération de NO
CHOC
Myoglo-binurie
?°
Myoglobi
Insuffisance Rénale (I.R)
Rabdo-myolyse
Muscles striés
Oligurie
Troubles hydro Électrolytiques
Vomissements et Diarrhées
ACIDOSE
Tube digestif
Séquestration
|
Actions des toxines du Plasmodium
|

10
I.4. Diagnostic
I.4.1. Diagnostic clinique
L'évaluation clinique du paludisme grave repose sur les
critères talques défis par l'Organisation Mondiale de
Santé (OMS) [7].
I.4.1.1. Neuro-paludisme ou Paludisme
Cérébral
Le coma à réactif est le signe principal du
neuro-paludisme associé à la fièvre. La profondeur du coma
est appréciée par l'échelle de Glasgow (valeur de 3
à 14) chez l'enfant qui sait parler, ou par l'échelle de Blantyre
(valeur de 0 à 5) utilisable à tout âge chez les jeunes
enfants ne sachant pas parler. Chez l'enfant, un coma vrai est défini
par un score de Glasgow ? 9 ou de Blantyre ? 2 ou ? 3 avec impossibilité
de localiser la douleur.
Le coma n'est retenu comme lié au paludisme que s'il
persiste plus d'une heure après l'administration du diazépam
[8].
Il est toujours important d'utiliser la même
définition du coma.
En effet, on trouve dans la littérature des
évolutions variables d'une étude, ce qui limite
considérablement la comparaison des différents résultats.
[9]
Chez l'enfant, le coma peut survenir 12 à 24 heures
seulement après le début de la fièvre ; le début
volontiers brutal d'emblée ou succèdent à une convulsion
généralisées. Le coma est calme, hypotonique, un syndrome
pyramidal est parfois noté.
Des convulsions volontaires répétées,
voire un état de mal convulsif survient fréquemment au cours de
son évolution. [10]
La présence d'une hypotonie de
décérébration ou de décortication témoigne
d'une atteinte évoluée annonciatrice d'un engagement
cérébral en l'absence d'un traitement adapté. Devant un
coma fébrile, il faut éliminer une méningite
bactérienne, ce d' autant que des associations avec le neuro-paludisme
sont décrites surtout chez le nourrisson. [10]
I.4.1.2. L'anémie grave
Elle est définie par un taux d'hémoglobine
inférieur à 5% (5 g/dl) ou d'hématocrite inférieur
à15% ; la nouvelle définition n'exclut pas les anémies
microcytaires [10]. La pâleur des téguments est le signe clinique
clé, il faudra rechercher les signes d' intolérance d' une
insuffisance cardiaque droite puis globale et au maximum d' un collapsus ou des
troubles de
11

12
conscience fait redouter une évolution fatale possible
et impose une transfusion dans les meilleures délais .
I.4.1.3. L'hypoglycémie
Elle est définie par un taux sanguin de glucose
inférieur à 2,2 mmol /l (400mg/dl). Il faut la rechercher
systématiquement en cas de trouble de la conscience ou de convulsion
chez l'enfant, associée à des taux abaissés d'insuline et
de c-peptide, elle est essentiellement attribuée au paludisme [11] et
non à la quinine qui a un effet insulino-sécréteur
observé chez la femme enceinte.
I.4.1.4. L'acidose métabolique
Elle est définie par un taux plasmatiques de
bicarbonate inferieur à 15mmol /l ou à un excès de base
supérieur à -10mmol/l .Elle peut s'accompagner ou non d'une
acidemie (PH capillaire ou artériel inférieur à 7,35)
.Elle est essentiellement liée à une hyperlactémie
définie par un taux de lactate plasmatique supérieur à
5mmol/l, qui constituée aussi un indicateur de paludisme grave [12].
I.4.1.5. Insuffisance rénale
Elle se définie par une diurèse inferieure
à 12ml/kg/24h ou par une créatininémie restant
élevée par rapport à l'âge malgré la
réhydratation initiale ; elle est rare chez l'enfant, une
protéinurie du type tubulaire surtout, plus rarement glomérulaire
est fréquemment constituée [13].
I.4.1.6. Trouble de conscience sans coma
Les troubles ont été considérés
comme un de gravité par la conférence de consensus
français sur le paludisme d'importation de 1999[14].
Ils sont maintenant intégrés par l'OMS à
la définition du paludisme grave [15] .Ils sont définis par un
score de Glasgow modifié, compris entre 9 et 14 ou un score de Blantyre
entre 2 et 5.
I.4.1.7. Prostration
La prostration se définit comme l'incapacité
pour l'enfant à s'assoir sans aide (pour un enfant en âge de le
faire) ou se nourrir (pour le nourrisson). Il suffit désormais de
considérer le paludisme comme grave [16].
I.4.1.8. Syndrome de détresse respiratoire
Ce critère fréquent chez l'enfant est de grande
valeur pronostique a été ajouté à la suite des
travaux au Kenya [17].Il comporte un battement prolongé des ailes du
nez, un tirage intercostal, et surtout une dyspnée de Kussmol.
I.4.1.9. Convulsions multiples
A partir de deux convulsions dans les 24h quel que soit leur
caractère généralisé ou local, il s'agit d'un
paludisme grave. Ce critère est beaucoup plus fréquent chez
l'enfant que chez l'adulte.
En zone d'endémie palustre, la survenue d'une
convulsion lors d'un état fébrile est très
évocatrice d'un paludisme, mais elle ne suffit pas à
définir la gravité [18]. Au cours d'un accès palustre, une
crise convulsive peut être attribuée seulement à la
fièvre. Cependant il ne faut pas la banaliser, les convulsions
fébriles du paludisme survenant plus fréquemment à un
âge plus tardif que lors des autres affections fébriles [19] C'est
pourquoi sa constatations doit faire craindre un paludisme
cérébral débutant [20].
I.4.1.10. Collapsus circulatoire
Il est défini par une hypotension artérielle
(pression artérielle systolique inferieure à 50mmHg en dessus de
5ans, ou à 80 mm Hg au-delà de 5ans) associée à des
signes périphérique de choc : extrémités froides
pouls petits et filants. Il est le plus souvent lié à une
coïnfection (bacille à gram négatif notamment) ou à
une infection nosocomiale.
I.4.1.11. OEdème pulmonaire
L'oedème pulmonaire est rare chez l'enfant, il
répond maintenant à une définition radiologique. Son
évolution est volontaires retardée des quelques jours, en
relation fréquente avec une réhydrations excessive.
I.4.1.12. Saignements anormaux
Le saignement peuvent être cutanés ou muqueux,
ils sont rare chez l'enfant et sont le plus souvent rapportés à
une coagulation intravasculaire disséminée (CIVD) bien que
celle-ci ne permette pas de parler de paludisme grave en l'absence
d'hémorragie.
13
I.4.1.13. Ictère
Sa définition actuelle est clinique, il est moins
fréquente chez l'enfant que chez l'
adulte.sa constatation suffit à
caractériser la gravité chez le nouveau-né en zone
d'endémie, il peut prendre la marque d'un ictère néonatal
de diagnostic délirant. [11]
I.4.1.14. L'hémoglobinurie
Seul son caractère macroscopique avec constatation
d'urines rouge porto ou noire est un critère de gravit é. Devant
ce tableau, il faut également évoquer une fièvre bilieuse
hémoglobinurie, dont le diagnostic repose sur le contraste entre la
sévérité du tableau clinique de la constatation de
parasité mie faibles ou absentes. Cette complication rare mais
redoutable du paludisme à plasmodium falciparum est en effet
définie cliniquement par l'association d'une fièvre et d'une
hémoglobinurie macroscopique (Black Water Fever des anglo-saxons). Elle
résulte d'une hémolyse intra vasculaire pouvant entrainer une
insuffisance rénale.
I.4.1.15. Hyper-parasitémie
La relation entre le parasite mies et la gravité du
paludisme, varie selon le niveau et l'Age chez les enfants non immuns vivant en
zone de paludisme instable, un parasite mie supérieure à 4%
représente un critère de gravité [21]. En zone de
transmission holo ou hyper endémique, une densité parasitaire
supérieure à 20% est requise pour indiquer un paludisme grave.
I.4.2. Diagnostic biologique
I.4.2.1. Le diagnostic spécifique
Il est basé sur les examens parasitologiques et
sérologiques :
a) Les méthodes classiques on distingue :
? La goutte épaisse :
C'est l'examen de référence de l'OMS ; elle est largement
utilisée pour le diagnostic de routine ;
? Le frottis sanguin : il
permet l'étude morphologique des hématozoaires et le diagnostic
différentiel entre les espèces plasmodiales.
b) Les méthodes nouvelles
Elles permettent la reconnaissance des molécules du
parasite : la coloration fluorescente des acides nucléique par
l'acridine orange (CAO) ou par le Benzothiocarboxypurine (BCP), le QBC
(Quantitative Buffyl Coat) et la technique de kawa moto font appel à
l'AO. Les méthodes ne permettent pas d'apporter un diagnostic
d'espèce, même pas une densité parasitaire.

14
Avant de débuter le traitement, on effectue, chaque
fois que possible un prélèvement sanguin pour l'étude des
résistances in vitro aux antipaludiques. [5]
La détection d'antigène parasitaire : test sur
bandelettes réactives contenant un anticorps monoclonal :
Le parasite et l'ICT malaria Pf test détecte
l'antigène HRP-L (Histidinrich protéine) et sont
spécifiques du plasmodium falciparum ;
Le test ICT malaria PF/PV détecte l'antigène
HRP-2 de plasmodium falciparum, celui de plasmodium vivax et probablement celui
de de plasmodium ovale.
Le test optimal détecte la PCDH (parasite lactate
déshydrogénase de plasmodium falciparum et de l'ensemble de
plasmodium. [5]
c) L'examen sérologique
Il repose sur plusieurs techniques ; l'immunofluorescence,
l'hémoglobination, l'immuno-transfert et l'ELISA. Il n'a pas sa place
pour le diagnostic des accès palustres: difficulté
d'interprétation (infection en cours ou paludisme
antérieures).
I.4.2.2. Les autres données biologiques
Une anémie Normocytaire normochrome ; on note un taux
bas ou normal des leucocytes, il est élevé dans les infections
sévère ;
La vitesse de sédimentation, le taux de
protéines-c-réactive, le degré de viscosité du
plasma sont élevés ; on note une thrombopénie ?105/ml ;
dans les infections sévères : le Temps de Quick, le Temps de
Céphalines Actives peut être allongé. [5]
I.5. Traitement du paludisme
Le paludisme à plasmodium, compte tenu de la
rapidité d'évolution chez l'enfant constitue une urgence
thérapeutique majeure. En présence des signes de gravités,
le traitement antiparasitaire est fondamental. Cependant, sa modalité
différente de celles du traitement du paludisme simple et la prise en
charge de la complication prend une grande importance pour limiter la
mortalité qui reste élevée, même dans les centres
équipés de moyens modernes de réanimation.
Parmi les produits schizonticides érythrocytaires, la
quinine et les dérivées de l'Artémisinine sont les seuls
indiqués dans le traitement des accès graves.
15
Chez un patient qui a pris la Quinine 48 h00 avant ou la
Méfloquine 7 jours avant, commencé directement avec la dose
d'entretien de 10 mg de sel de quinine/kg de poids corporel.
I.5.1. Traitement préventif
- La lutte anti vectorielle :
o Mesures anti vectorielles individuelles : application des
répulsifs sur la peau, des appareils électroniques
émettant des sons prétendant éloigner les moustiques,
protection vestimentaire ou port des vêtements couvrants et
pulvérisés des produits répulsifs
o Mesures domiciliaires
? Durant le sommeil : usage des moustiquaires
imprégnés à l'insecticide
o Efficacité des mesures de protection dans la lutte
anti palustre : Désherbage, ramassage des boites de conserves
déjà ouvertes, drainage des égouts, des eaux stagnantes,
refaire les caniveaux, etc.
I.5.2. Traitement curatif
Adultes
La quinine est le médicament de choix pour le
traitement de cette forme de paludisme. Elle sera administrée en
intraveineuse à la dose de charge de 20 mg de sel de quinine par kg de
poids corporel dans 5-10 ml de solution isotonique (glucose à 5 %) par
kg de poids corporel pendant 4 heures, chez un patient qui n'a pas reçu
de la quinine 48 h00 avant ou de la Méfloquine 7 jours avant.(5)
[22]
La dose d'entretien de 10 mg de sel de quinine/kg de poids
corporel sera administrée 12 heures après le début de la
dose de charge, en calculant le temps à partir du début de la
perfusion précédente.
Répéter la dose d'entretien toutes les 12 heures
jusqu'à ce que le malade soit capable d'avaler.
Il est rare de continuer cette perfusion au-delà de 3
à 4 jours. Ensuite passer à 10 mg de sel de quinine/kg par voie
orale toutes les 8 heures pour compléter les 7 jours de traitement.
16
Dans tous les cas, la transfusion doit être
contrôlée avec soin, en particulier chez les malades gravement
anémiques. [5]
En cas de prise confirmée des plantes
médicinales traditionnelles, le prestataire des soins devra bien
apprécier le cas avant d'administrer la quinine à la dose de
charge. [5]
Enfants
Chez les enfants, la dose de charge et d'entretien suit le
même régime que chez l'adulte. Mais si l'enfant, même
éveillé ne sait pas encore avaler, répéter la dose
d'entretien toutes les 12 heures jusqu'à ce que le malade puisse avaler.
Ensuite passer à la quinine orale 10 mg/kg toutes les 8 heures pour
compléter les 7 jours de traitement. [5]
I.5.3. Les Complications
Les complications ou les affections associées suivantes
nécessitent une attention
spéciale :
Hyperthermie
Administrer des antipyrétiques ou anti-inflammatoires
non-stéroïdiens (même par tube nasogastrique).
En sachant qu'il existe parfois un risque de saignement gastro-
intestinal.
Convulsions
Administrer de préférence le diazépam
à la dose de 0,3-0,5 mg /kg par voie rectale chez l'enfant. L'adulte
peut recevoir 0,15 mg / kg, jusqu'à une dose maximale de 10 mg par
injection intraveineuse. Si les crises sont répétées,
administrer le phénobarbital à la dose de10À15 mg/kg TM.
[5]
Anémie
Une transfusion du sang frais compatible et testé sera
envisagée lorsque l'hématocrite d'un patient normalement
hydraté tombe en dessous de 15 % ou l'hémoglobine < 6g/dl.
Le sang entier est administré à la dose de 20
ml/kg. Si la fonction rénale est bonne, de petites doses de
furosémide (1mg/kg) intraveineuses peuvent être
administrées pendant la transfusion sanguine pour éviter la
surcharge circulatoire.

17
Hémoglobinurie
Il est important de continuer le traitement antipaludique chez
les malades à paludisme confirmé malgré l'association
hypothétique entre ces médicaments et l'hémolyse.
Chez les malades avec oligo-anurie et niveaux croissants
d'urée sanguine et de créatinine, la dialyse
péritonéale ou l'hémodialyse peut être
nécessaires.
Hypoglycémie
Il faut exclure l'hypoglycémie chez tous les cas de
paludisme grave. Chez un malade comateux, si on ne peut pas exclure
l'hypoglycémie, il faudra administrer une dose de 20À50 ml de
dextrose 50 % en IV pendant 5À10 minutes. [5]
Acidose métabolique
Elle est corrigée par l'amélioration de la
volémie (diurèse dans le cas où on ne peut pas mesurer la
volémie) et l'augmentation de l'oxygène de l'air inspiré.
Une administration du bicarbonate IV sera envisagée si le pH
artériel baisse en dessous de 7,20.

18
CHAPITRE II : LES ANEMIES
II.1. DEFINITION
L'anémie se définit comme étant une
diminution du taux d'hémoglobine en dessous de deux déviations
standard (-2DS) par rapport à la moyenne pour l'âge.
Confère le tableau ci-dessous. [23]
Tableau numéro 1 montrant les normes de
l'hémoglobine en fonction de l'âge
|
Age
Hémoglobine
|
Nouveau- né
|
3 - 6
mois
|
|
6 mois - 2ans 2 - 6 ans
|
6 - 12 ans
|
12 -18 ans
garçons
|
12 - 18
ans Fille
|
|
Moyenne g/100ml
-2DS g/10ml
|
16,5
13,5
|
11,5
9,5
|
12,5
10,5
|
12,5
11,5
|
13,5
11,5
|
14,5
13,5
|
14
12
|
II.2. ETIO-PHYSIOPATHOLOGIE
Les mécanismes physiopathologiques des anémies se
situent à trois niveaux :
> Au niveau de formation des globules rouges,
> Au niveau de métabolisme de globules rouges,
> Et au niveau de synthèse de l'hémoglobine.
II.2.1. Anémie liée à la formation des
Globules Rouges.
La formation des globules rouges
(érythropoïèse) comprend les étapes suivantes :
· Stimulées par érythropoïèse,
les proérythroblastes se transforment en érythroblastes
· Les érythroblastes perdent leurs noyaux pour se
transformer en réticulocytes ;
· Les réticulocytes, après un
séjour de 2 à 3 jours dans la moelle, seront
libérés dans la circulation où elles perdent l'apparence
morphologique des globules rouges après avoir perdu leurs mitochondries
et leurs ribosomes [24].
Pendant ce processus, quelques anomalies peuvent avoir lieu et
conduire à des anémies dites Mégaloblastiques. Ce sont des
anémies généralement déficitaires, dont nous
pouvons citer :

19
La carence doit être associée à d'autres
maladies comme la kwashiorkor pour qu'elle entraine une anémie.
II.2.1.1. Anémies par Carence en Vitamine B12 ou
Anémies pernicieuse ou Maladie de BIERMER.
Para-cliniquement, on constate que les globules rouges sont de
grande taille et nucléés et finissent par se transformer en
macrocytes par perte de leurs noyaux. Ce type de globule sont appelées
Mégaloblastes et sont généralement phagocytes. On observe
ainsi une atrophie de la muqueuse d'origine auto-immune.
II.2.1.2. Anémie par carence en acide folique ou
anémie de la grossesse
Elle est d'origine nutritionnelle chez les enfants et sujets
âgés dans les milieux favorables. Elle peut aussi être
liée à une mal absorption, à augmentation du besoin
physiologique (cas de grossesse), à certaines pathologies secondaires
exigeant un traitement par les anticonvulsivants (diphényle +
y-dentoïne), à une maladie hépatique et un alcoolisme
chronique. [25]
II.2.2. Anémies liées au métabolisme
du Globule Rouge
Le globule rouge à des exigences métaboliques
plus ou moins modestes compte tenus de la structure simplifiée. Il faut
l'implication des éléments nécessaires pour un
métabolisme complet, faute de quoi une anémie survient parmi ces
éléments citons :
II.2.2.1. Les Anémies par anomalie du
métabolisme du fer
1. Anémie ferriprive ou martiale
Elle est la plus fréquente de toutes les
anémies au niveau mondial. Les globules rouges sont hypochromes et
microcytaires suite à l'augmentation des besoins physiologiques en fer,
par l'hémorragie gastro-intestinale, utérine parfois
rénale et urinaire.
2. Anémie sidéroblastique
C'est une anémie par surcharge en fer. Elle est
observée surtout en cas d'anémie chronique et peut être due
à l'augmentation de l'absorption intestinale du fer en cas
d'inefficacité de l'érythropoïèse ou par des
multiples transfusions. [25]
II.2.2.2. Anémie par carence en acides
aminés

20
II.2.2.3. Anémie par carence en G6PD
Le déficit de cette enzyme dans les globules rouges
peut déclencher une anémie carentielle hémolytique grave
après la prise de certains médicaments oxydant comme la quinine ;
ou peut induire un ictère néonatal, tellement qu'elle joue un
rôle très important dans la voie glycolytique, seule source
d'énergie dans le métabolisme du globule rouge.
II.2.2.4. Anémie par carence en vitamine B6
La carence en vitamine B6 peut entrainer une anémie
hypochrome hyper sideremique. Ce défi s'observe le plus souvent chez les
nourrissons et se traduit par des crises convulsives.
II.2.2.5. Anémie par carence en vitamine C
Elle s'associe à d'autres maladies ou la carence en
vitamine C seulement. L'anémie est due à une malabsorption
intestinale du fer.
II.2.2.6. Anémie par carence cuivre
La carence en cuivre entraine des anémies semblables
presque à celles entrainées par la carence en vitamine C.
II.2.3. Anémies liées à la
synthèse de l'Hémoglobine
L'hémoglobine est un pigment comprenant 2 sous
unités : l'hème et la globine. Lors de sa synthèse,
quelques anomalies (héréditaires ou acquises) peuvent avoir lieu
et conduire ainsi à la synthèse d'une hémoglobine
anomale.
II.2.3.1. La Drépanocytose ou Anémie
SS
Affection héréditaire très
fréquentes en Afrique noire. L'anomalie de l'hémoglobine est due
à la substitution de l'acide glutamique en position 6 de la chaine
polypeptidique de l'hémoglobine par la valine [25].
Chez un sujet SS, ce phénomène induit une
déformation des hématies leur imposant la forme en «
croisant » ou en « faucilles ». Les hématies ainsi
déformées seront incapables de traverser la microcirculation et
subiront une hémolyse prématurée.
II.2.3.2. La Thalassémie
C'est une maladie héréditaire due à un
déficit de synthèse ou à une anomalie de synthèse
d'une des chaines de la globine. Quand l'anomalie se situe sur la chaine alpha,
on parle de á-thalassémie, et quand c'est sur la chainef3, on
parle de f3-thalassémie.

21
[26]
L'affection est très rare en Afrique noire mais
très fréquent en Afrique du nord (dans le bassin
méditerranéen)
II.2.3.3. La Méthémoglobinémie
Dans une hémoglobine normale, le fer est toujours
bivalent (Fe2+) et la capture de l'oxygène en dépend ;
tandis que dans la méthémoglobinémie, une des
hémoglobines anormales, le fer prend la valence III, et la capture de
l'oxygène devient impossible.
Ici l'anémie est déclarée lorsque le
sang, en dehors de l'hémoglobine dans les proportions supérieures
à 30 gr/dl.
II.2.4. Anémies particulières
II.2.4.1. Anémies hémolytiques
Ce sont des anémies causées par une destruction
primaire des globules rouges par plusieurs mécanismes :
? Hémolyse extravasculaire : globules rouges pris par
phases de foie, de la rate.
? Hémolyse intravasculaire : réaction anticorps,
antigène, destruction par des parasites (plasmodium...)
II.2.4.2. Anémies hémorragiques
Anémie due à une perte exagérée du
sang suite à une rupture de vaisseaux sanguins surtout les
artères [25].
II.3. CLASSIFICATION DES ANEMIES
L'hémogramme donne aussi d'autres paramètres
importants et qui sont pris en considération lorsqu'on veut classer les
anémies. Ce sont :
Le volume moyen globulaire(VGM) qui permet, chez l'adulte, de
qualifier une anémie en :
o Normocytaire : si le VGM est compris entre 80 et 100FL ;
o Microcytaire : si le VGM?80FL ;
o Macrocytaire : si le VGM?100FL
GR
VGM ???? X100 90 #177; 10
|
|

22
[26]
La concentration corpusculaire moyenne en hémoglobine
(CCMH)
o Normalement entre 32 et 36 g/dl ; permet alors de qualifier
l'anémie de normochrome
o L'anémie est hypochrome si la CCMH?32g/dl
Hb
CCMH ??100 32 #177;2%
Ht
|
|
Le taux des réticulocytes :
o Une anémie est dite
régénérative (périphérique) si les
réticulocytes sont ?120Giga/L
o Une anémie est dite
arégénérative (centrale) si les réticulocytes sont
?120 Giga/L.
II.4. DIAGNOSTIC
II.4.1. Clinique
II.4.1.1. Signes Fonctionnels
En fonction de l'âge, rapidité d'installation,
activité physique, pathologie sous-jacente :
- Signe cardiovasculaires : dyspnées, palpitation,
lipothymie, douleur thoraciques - Signes neurosensoriels : acouphènes,
vertiges, céphalées.
II.4.1.2. Signes Généraux
Asthénie physique puis intellectuelle.
II.4.1.3. Signes Physiques
Pâleur cutanéo -muqueuse, souffle d'insuffisance
mitrale anorganique, signes évocateurs d'un mécanisme (cheveux
sec, ongles cassants, chéilite : anémie ferriprive ;
ictère ; hémolyse ; glossite ; trouble neurologique ; carence en
vitamine B12 ; hypotrophie ; retard staturo-pondéral ; hippocratisme
congénital).
II.4.2. Paraclinique ou Biologique
L'hémogramme, ou NFS, étudie les cellules du sang.
Il comporte :
- Une étude quantitative des cellules :
numération des globules rouges, des globules blancs et des plaquettes,
mesure ou calcul de l'hématocrite, dosage de l'hémoglobine,
étude des constantes ou indices érythrocytaires et
plaquettaires.

23
- Une étude qualitative des cellules : formule
leucocytaire, étude de la morphologie des cellules sanguines.
II.5. DIAGNOSTIC POSITIF
Le diagnostic étiologique de l'anémie repose
prioritairement sur le
VGM.il rend compte de la taille des globules
rouges. Le VGM est normalement compris entre 80 et 100 U3 fl. Puis la TCMH et
la CCMH qui sont la quantité moyenne d'hémoglobine contenue dans
un GR et la quantité d'hémoglobine contenue dans un GR et la
quantité d'hémoglobine contenue dans 100 ml d'hématies
respectivement.
Leucocytes et thrombocytes : une
diminution des leucocytes et des thrombocytes avec la présence
d'anémie sans augmentation des réticulocytes indique une
perturbation au niveau de la cellule souche (anémie aplasique,
Myélodysplasie ou infiltration de la moelle). Une anémie avec une
thrombopénie (et réticulocytose) peut signifier un
mécanisme auto Àimmun (complication du syndrome
Lympho-prolifératif ou collagénose) ou une micro-angiopathie.
Frottis du sang périphérique :
l'examen des GR sur le frottis sanguin aide fortement au
diagnostic ferriprive (anisocytose se manifestant plus précocement que
la microcytose et la diminution de CCMH),plusieurs hémoglobinopathies
(thalassémie, drépanocytose) et les anomalies de la membrane
érythrocytaire (sphérocytose, ovalocytose,
élliptocytose).La présence de neutrophiles hyper-segmentés
est plus sensible que le VGM pour détecter une carence en acide folique
ou vitamine B12, car la macrocytose peut être masquée par une
thalassémie ou une carence en fer surajoutées.
Réticulocytes : le taux de
réticulocytes sert à apprécier l'état de la
production érythrocytaire de la moelle osseuse. Une anémie
régénérative (réticulocytes=120 000 /mm 3
en présence d'anémie signifient une origine centrale
(carentielle, aplasie médullaire ou érythroïde). [27]
II.5.1. Anémie Arégénérative
: Taux de réticulocytes ? 120 000/mm3
II.5.1.1. Anémie microcytaire et ou hypochrome
VGM < 80 fl. chez l'adulte (< 75 fl. chez l'enfant)
CCMH < 27 g /dl.

24

25

26
L'existence d'une microcytose traduit une anomalie de
synthèse de l'hémoglobine, et dans la grande majorité des
cas, est la carence en fer. Le dosage du fer nous permettra de
différencier les anémies microcytaires à fer bas et
anémies microcytaires à fer normal.
· Exploration du fer :
Soit le dosage de la ferritinémie, soit le dosage de
fer sérique +CFT (TIBC) + CS.
La ferritine : est la principale protéine
conservant le fer dans le corps. La concentration de la ferritine dans le
sérum est directement proportionnelle aux mises en réserve du fer
total dans le corps.
Anémie par carence martiale ou anémie
ferriprive : La carence en fer se traduit par une anémie
microcytaire, hypochrome hypo-sidéremique. La ferritinémie est
abaissé, le fer sérique est abaissé, la CFT est
augmentée, le CS diminue
· Carence en Vit. B12 ou acide folique
(les anémies mégaloblastiques)
+ Frottis sanguin : présence de granulocytes
neutrophiles géants avec noyau polylobé (?6 lobes, jusqu'à
12)
+ Myélogramme : Moelle richement cellulaire,
paraissant bleue au faible
grossissement du fait
de nombreuse proérythroblastes ; mégacaryocytes présent
(nombre diminué ; souvent difficile d'apprécier
les modifications de taille).
+ Dosage de la vitB12 sérique ; Dosage de l'acide
folique.
+ Test de schilling : ce test permet de distinguer
l'anémie de Biermer de la malabsorption de vitB12.
· Les Syndromes Myélodysplasiques (SMD) :
Maladies retrouvées essentiellement chez l'adulte après
50 ans.
> Hémogramme : Leucopénie avec
neutropénie et thrombopénie fréquente
> Myélogramme : En général la moelle
est richement cellulaire ; érythroblastopénie ; diverses
anomalies morphologiques sont observables.
· Les aplasies médullaires :
+ Myélogramme : moelle pauvre ou dépourvue de
cellules de l'hématopoïèse et la biopsie
ostéo-médullaire.
II.5.2. Anémies régénératives :
Taux de réticulocytes ? 120 000/mm3
Les plus souvent un mécanisme précis
détruit précocement les GR, et la moelle osseuse compense ou
essaie de compenser cette par une augmentation de production.
On recherchera en premier lieu un syndrome hémorragique
et une hyper-
hémolyse.
Les deux seules causes de réticulocytose
élevée. En l'absence de ses deux causes, on évoquera une
réparation d'une insuffisance de l'érythropoïèse
(dans ce dernier cas, le contexte est le plus souvent évident telle une
chimiothérapie). [27]
II.5.2.1. Les Anémies Hémorragiques
Ces anémies sont provoquées par des
hémorragies aigues, externes ou surtout internes (essentiellement
digestives). [28]
Il est souvent évident (trouble de l'hémostase,
anticoagulant, AINS), parfois plus difficile si l'anémie n'est pas
extériorisée (intérêt du toucher rectal). On
recherchera un contexte évocateur, des signes de choc, des signes
d'anémie aigue (pâleur, soif, vertiges, asthénie).
II.5.2.2. Les anémies Hémolytiques
Ces sont des anémies liées à la destruction
excessive des hématies par :
- Hémolyse extra corpusculaire :
l'hématie est normale, détruit par un agent qui lui est
extérieur. Et les causes sont :
o Infectieuses :
? Parasitaires (paludisme) : Frottis sanguin, goutte
épaisse
? Bactériennes (Bartonella, Clostridium Perfringens) :
Hémoculture
o Toxiques : Causes toxiques chimique et
médicamenteuses ;
o Toxines : Venins de Serpents, Toxines de
Champignons, Piqûres d'insectes
o Mécaniques ou par fragmentation des
hématies : Elles sont dues à la destruction des GR dans la
circulation, soit sur des turbulences provoquées par des
prothèses, soit lors du passage dans les vaisseaux profondément
altérés.
Frottis sanguin : une anomalie morphologique
caractéristique : la schizocytose.
o Immunologique : trois types d'anémie
hémolytique immunologique existent :
? Auto-Anticorps (avec parfois un syndrome cryopathique)
? Allo-Anticorps (transfusion, mal hémolytique du
nouveau-né Rh+ mère Rh-)
· Anticorps immuno-allergiques d'origine
médicamenteuse.
Test immunologiques :
y' Le test de coombs direct (TCD)
détecte les anticorps situés à la surface des GR par un
anticorps Anti-IgG, Anti-IgA, Anti-C), dépiste une auto-immunisation
anti-érythrocytaire.
y' Le test de coombs indirecte (TCI)
détecte les anticorps sériques libres dans le sérum,
dépiste des agglutinines irrégulières
(allo-immunisation).
- Hémolyse corpusculaire : Elle peut
être due à des anomalies de membranes, de l' Hb ou enzymatiques
:
o Anomalies de membranes :
· Sphérocytose
héréditaire (maladie de MINKOWSKI-Chauffard).
· Elliptocytose héréditaire (affection
génétique de transmission).
Frottis sanguin : étude de la
résistance osmotique immédiate et après 24h,
électrophorèse des protéines membranaires.
o Anomalies de l'hémoglobine
? Drépanocytose ou hémoglobinose S (Hb A2 3% ; Hb S
80% ; Hb F 15-20%) et autres hémoglobinoses : C, D, E, H, SC, M.
· Frottis sanguin
· Le test de la falciformation consiste à
provoquer la polymérisation de l'Hb S en soumettant les hématies
qui en contiennent à l'hypoxie. Après quelques minutes, les GR
drépanocytaires prennent leur forme caractéristique de
«Faux» ou Faucilles.
· Electrophorèse de l'Hb ? La thalassémie
o Anomalies Enzymatiques : déficit en
G6PD et PK : dosage de G6PD et de PK.
II.5.2.3. Anémies Normocytaires : VGM normal (80
à 100 fl.)
La moelle osseuse ne produit qu'un nombre réduit de GR,
insuffisant pour maintenir l'Hb sanguine à un niveau normal.
- L'insuffisance rénale : l'absence ou la
diminution de la sécrétion d'Erythropoïétine. ?
Dosage de la créatinine, Dosage de l'Urée, Dosage de l'EPO

27
- L'insuffisance endocrine : (Thyroïde,
Hypopituitarisme, corticosurrénale) ? Dosage de T3, T4, TSH
- Les Maladies hépatiques : 3/4 des
patients avec cirrhose présentent une anémie
? Dosage de transaminases (TGP & TGO), Dosage de la
Bilirubine libre, Le TP élevé. - La Myélodysplasie
: Myélogramme
II.6. PRISE EN CHARGE
Le traitement de l'anémie consiste à
diagnostiquer et traiter les maladies sous-jacentes. Et le plan du traitement
de l'anémie tient compte des éléments ci-après :
La sévérité de la maladie ;
La cause sous-jacente ;
Les maladies et complications Co-existantes ;
L'âge du patient ;
L'Etat général ;
Ses antécédents médicaux ;
Et d'autres facteurs
Il implique un plan à multiple facettes qui traite les
causes sous-jacentes : le
traitement des anémies par carence en Fer ou en Vitamines
B12, comprends généralement un
régime alimentaire bien équilibré. [24]
Elles peuvent être traitées avec des
suppléments de Fer et de Vit. B12 et le saignement et perte importante
de sang peuvent être traités avec une transfusion sanguine.
Le traitement de l'anémie tiendra compte de
l'étiologie de chaque type d'anémie avec deux volets :
Préventif et Curatif.
Les objectifs pour ce traitement sont corriger les troubles et
rétablir la physiologie normale et prévenir les récidives
; alors que le traitement Prophylactique, visera à prévenir la
survenue des troubles susceptibles d'entrainer l'anémie.
II,6,1, Préventif
Souvent plusieurs causes sont associées aux
anémies, d'où la nécessité du respect d'un certain
nombre des mesures hygiéno-diététiques ; de fournir, aux
patients en général et aux enfants en particulier, des nutriments
nécessaire pour une érythropoïèse normale.

28
En guise de prévention toujours, on cherchera à
lutter contre tout facteur capable de favoriser la survenue de
l'anémie.
II.6.2. Curatif
Le traitement médical consiste à transfuser
systématiquement du sang iso-groupe et compatible au patient d'on l'Hb ?
5 À 7g% selon les signes de gravité. La transfusion est
envisagée lorsque l'Ht?20% chez un enfant normal et Ht?15% chez le
Drépanocytaire. Avec des signes d'intolérance :
V' Asthénie majeure ;
V' Dyspnée sévère ;
V' Signe de décompensation cardiaque, du Choc, ou
OEdème Aigu du Poumon (OAP). [24] La quantité de sang à
donner est de 20ml de Sang/Kg ; et en cas de Concentré ou Culot
Globulaire on donne la moitié (soit 10ml/Kg).
En cas d'insuffisance cardiaque décompensée ou
de malnutrition ou bien d'autres Syndromes d'Hémato-ascitique, envisager
le Culot Globulaire ou le Sang Total à raison de 10ml/Kg/prise avant ou
au début de la Transfusion. Si une Insuffisance Cardiaque est
associée, il faut digitaliser en administrant 0,03 à 0,05mg/Kg ;
1/2 ; 1/4 ; ... toutes les 8 heures. [25].

29
CHAPITRE III : MATERIELS ET METHODES
III.1. Présentation du cadre de travail
III.1.1. Historique
L'Hôpital Provincial de
Référence Jason Sendwe appelé jadis
Hôpital Prince Léopold fut construit en
1928.
Cet hôpital fut construit sous ordre social et
humanitaire pour la lutte contre des maladies endémiques dues à
la poussée démographique afin d'éviter la contagion dans
l'hôpital reine Elisabeth (hôpital pour les blancs).
Cet hôpital dont l'édification n'a pas
été une tâche facile fut construit en deux phases à
savoir :
? Première phase : partie pavillonnaire fut construite en
1928, elle avait 350 lits. Elle abrite plusieurs services hospitaliers,
techniques et généraux.
? Seconde phase : édifice à étages en
1958, toutefois une aile sera construite par la suite, les travaux seront
interrompus suite aux événements malheureux qui avaient suivi
l'indépendance du pays.
C'est un hôpital de l'Etat, qui sera géré
jusqu'en 1962 par l'Etat lui-même ; suite à l'installation du camp
de réfugiés de triste mémoire entre la Ruashi où se
trouvait l'hôpital universitaire de l'Université Officiel du Congo
et se verront obliger de déménager pour s'installer à
Sendwe.
C'est l'année même de l'inauguration du
bâtiment à étages.
A partir de 1974, la Gécamines dirige l'hôpital
pour des raisons d'ordre social, dont la plus importante fut le souci du
président de la république de permettre à la population de
la ville de bénéficier les soins de qualité et à
bon prix.
Deux ans plus tard, l'Université quittera pour aller
s'installer à l'ancienne clinique Reine Élisabeth, actuellement
Cliniques Universitaires.
Compte tenu des difficultés d'ordre économique
qui ont entrainé la faillite de la Gécamines, l'autorité
politique en concertation avec le gouvernement provincial du Katanga,
l'Université de Lubumbashi, la Gécamines et le Consulat de
Belgique, avait jugé bon de reprendre la gestion de l'hôpital et
la confiée à l'Université de Lubumbashi qui en reprit la
direction à partir du 30 septembre 2005.
30
L'hôpital Sendwe avec sa capacité de 1200 lits
est classé en deuxième position après l'hôpital
général de Kinshasa (ex Mama-Yemo). Il dessert pour ainsi dire la
population de toutes les communes de Lubumbashi mais aussi celle venant de tout
le reste du Katanga, de deux Kasaï et du Sud-Kivu.
Vu son importance bien que disposant de 1200 lits, il connait
un pourcentage d'occupation de plus de 100%.
III.1.2. Situation Géographique
L'Hôpital Provincial de Référence Jason
Sendwe est situé dans la partie Est de la
commune de Lubumbashi. Il est limité :
- Au Nord par l'avenue Sendwe
- Au Sud par l'avenue des Ecoles
- A l'Est par le lycée Wema
- A l'Ouest par l'avenue Likasi.
III.1.3. Organisation - Fonctionnement
De par sa capacité d'accueil (estimée à
1200 lits) et sa complexité en services ; cet hôpital dessert la
majeure partie du district de Lubumbashi. Cet hôpital a un coût de
soins très abordable comparativement aux autres formations
médicales. C'est ce qui explique l'affluence des malades issus des
différentes couches sociales qui viennent y recevoir des soins.
En son sein se trouvent organisés différents
Services et Spécialités :
|
1.
|
Les Quatre Services fondamentaux :
|
2.
|
Les Services médico-techniques
|
|
> La Chirurgie
|
|
+ Le Laboratoire
|
|
> La Gynéco-obstétrique
|
|
+ La Radiologie
|
|
> La Médecine Interne
|
|
+ La Kinésithérapie
|
|
> La Pédiatrie
|
|
|
|
|
4.
|
Les Services médicaux spécialisés
|
|
3.
|
Les Services Généraux
|
|
V' La Psychiatrie
|
|
? La Cuisine
|
|
V' La Réanimation
|
|
? La Buanderie
|
|
V' La Dermatologie
|
|
? La Morgue
|
|
V' La Dentisterie
|
|
? Le Bureau d'entretien
|
|
V' L'Oto-Rhino-Laryngologie
|
|
? Les Services Administratifs
|
|
V' L'Ophtalmologie
|
|
|
|
V' La Stomatologie
|
Pour notre travail, seul le Service de Pédiatrie nous a
intéressés.

31
III.2. Matériel et Méthodes
Notre étude a été réalisée
à l'Hôpital Jason Sendwe situé dans la ville de Lubumbashi,
province du Katanga en République Démocratique du Congo.
Il s'agit d'une étude rétrospective et
descriptive menée sur une période de 2 ans allant du 1er
janvier 2012 au 31 décembre 2013.
La population étudiée était
constituée d'enfants âgés de 0 à 5 ans
hospitalisés pour paludisme grave forme anémique.
Ont été retenu dans notre étude les patients
ayant les caractéristiques suivantes :
a) Diagnostic du paludisme grave forme anémique retenu
par le staff médical en fonction des critères définies par
l'OMS [10].
b) Suivi d'un traitement jusqu'à la fin selon le
schéma standard du service fait
principalement de la quinine et/ou des dérivés
à base d'Artémisinine en forme injectable.
Nous avons éliminé de notre étude tout
enfant âgé de plus de 5 ans, tout enfant avec taux d'Hb=5g%, tout
cas de désertion ou sortie sans avis médical préalable et
tout malade sans goutte épaisse faite, Fiches incomplètes ou
manquant des renseignements exploitables pour l'étude.
Les variables étudiées étaient les suivantes
:
y' Paramètres sociodémographiques : commune de
résidence, mois d'admission, âge et sexe ; y' Paramètres
cliniques : fièvre, pâleur, fatigue, tachypnée,
ictère, splénomégalie, signe d'intolérance à
l'anémie et diagnostic associé ;
y' Aspects thérapeutiques et évolutifs :
traitement avant hospitalisation, traitement pendant l'hospitalisation et
évolution (guérison ou décès).
Les données recueillies ont été
analysées à l'aide du logiciel Epi-Info version 7.0.8.3.
L'analyse et l'interprétation ont utilisé le calcul de la
proportion, de la moyenne et l'écart-type (ET), de la médiane et
le test de Khi carré (de Yates ou de Fisher lorsque recommandé),
l'intervalle de confiance à 95% et le seuil de signification de 5%.
y' Notre taille d'échantillon est de 130 cas

32
III.3. Difficultés rencontrées
Toutefois au cours de nos recherches, nous nous sommes
heurtés à de nombreuses difficultés, notamment :
? La disparition de certaines fiches de consultation au service
des archives ;
? Le manque de quelques renseignements utiles sur les malades
dans leurs dossiers médicaux,
souvent incomplets ;
? Le diagnostic imprécis ou absent sur certaines fiches
notamment l'imprécision quant à la
localisation et aux caractères de l'affection ainsi que du
traitement prescrit ;
? L'absence dans d'autres fiches de l'évolution des
complications du paludisme grave ;
? Le coût élevé des examens de
laboratoire.
Ces difficultés ont amenuisé sensiblement notre
échantillon d'étude.

33
Cette figure nous montre l'évolution mensuelle
des cas de paludisme grave forme anémique au cours de la période
d'étude. Le pic est observé au mois de mars (23 cas sur 130 soit
17,7%).
CHAPITRE IV : RESULTATS
IV.1. ETUDE DESCRIPTIVE
IV.1.1. Aspects Sociodémographiques
IV.1.1.1. L'année d'admission
Tableau I : Répartition des malades selon
l'année d'admission
Année Effectif Pourcentage
|
2012
|
71
|
54,6
|
|
2013
|
59
|
45,4
|
|
Total
|
130
|
100
|
De ce tableau, il ressort que 54,6% de nos patients ont
été admis en 2012. IV.1.1.2. Le mois d'admission

Pourcentage
20
18
16
14
12
10
4
8
6
2
0
7,7
16,9 17,7
13,8
9,2
6,9
Mois
3,8
4,6
6,2
4,6
3,1
5,4
Figure 3 : Cas répartis selon le mois
d'admission

34
IV.1.1.3. La Commune de résidence

Pourcentage
40
25
20
35
30
15
10
0
5
Annexe Kampemba Lubumbashi Katuba Kenya Ruashi
Commune
33,8
25,4
23,8
13,1
3,1
0,8
Figure 4 : Distribution des cas selon la commune de
résidence
De cette figure, il ressort que la commune Annexe vient en
tête avec 33,8% des cas (44/130) suivie des communes Kampemba et
Lubumbashi avec respectivement 25,4% et 23,8%.
IV.1.1.4. L'âge
Tableau II : Répartition des cas selon
l'âge
|
|
|
Age (mois)
|
Effectif
|
Pourcentage
|
|
<6
|
11
|
8,5
|
|
6-11
|
20
|
15,4
|
|
12-23
|
30
|
23,0
|
|
24-35
|
23
|
17,7
|
|
36-47
|
16
|
12,3
|
|
48-59
|
30
|
23,0
|
|
Total
|
130
|
100
|
L'âge moyen de nos patients est de 25,9#177;17,9 mois ;
le patient le plus jeune avait 2 mois et le plus âgé avait 59
mois. Les tranches d'âge allant de 12 à 23 mois et de 48 à
59 mois étaient les plus touchées avec chacune 23,1% des cas.

35
IV.1.1.5. Le sexe

42,3
57,7
Féminin Masculin
Figure 5 : Cas répartis selon le
sexe
Cette figure nous montre que le sexe féminin est
prédominant avec 57,7% (75/130). Le sexe ratio F/M est de 1,36.

36
Dix-sept virgule sept pourcent de nos patients étaient
drépanocytaires et 12,3% avaient une fièvre bilieuse
hémoglobinique.
IV.1.2. Caractéristiques Cliniques
IV.1.2.1. Les signes cliniques
Pourcentage
100%
40%
90%
80%
70%
60%
30%
20%
50%
10%
0%
Fièvre Pâleur Fatigue Tachypnée
Intolérence à
l'anémie
70
30
83
17
80,8
19,2
Signes cliniques
89,2
10,8
28,5
71,5
Ictère
91,5
8,5
Présente Absente
Figure 6 : Distribution des cas selon les signes
cliniques
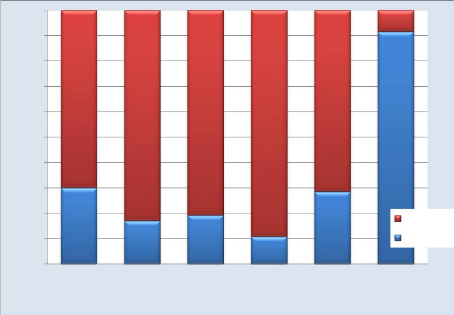
Cette figure nous montre que le signe clinique le plus
présent chez nos patients est la tachypnée (116/130 soit 89,2%)
suivie de la pâleur (108/130 soit 83%) de la fatigue (105 /130 soit
80,8%) et de splénomégalie (73%). L'ictère est le signe le
moins présent (11/130 soit 8,5%).
IV.1.2.2. Le diagnostic associé
Tableau III : Répartition des malades selon le
diagnostic associé à l'anémie palustre
Diagnostic associé Effectif
Pourcentage
Aucun 77 59,2
Drépanocytose 23 17,7
FBH 16 12,3
SCAF 12 9,2
Pneumonie 2 1,5
Total 130 100
37
IV.1.3. Aspects Thérapeutiques et
évolutifs
IV.1.3.1. Le traitement reçu avant
hospitalisation
Tableau IV : Distribution des patients en fonction du
traitement reçu avant l'hospitalisation
Effectif
Traitement (n=130) Pourcentage
Antipyrétiques 64 49,2
Quinine 37 28,5
Antibiotiques 24 18,5
Transfusion 10 7,7
ACT 7 5,4
Chloroquine 4 3,1
Aucun 31 23,8
Les antipyrétiques ont été le
médicament le plus administré à nos patients avant
l'hospitalisation (49,2%) suivis de la quinine (28,5%). Sept virgule sept
pourcent ont été transfusés. Seulement 31 patients n'ont
rien reçu comme traitement avant l'hospitalisation.
IV.1.3.2. Le traitement reçu pendant
l'hospitalisation
Tableau V : Distribution des patients en fonction du
traitement reçu pendant l'hospitalisation
Effectif
Traitement (n=130) Pourcentage
Transfusion 130 100
Quinine 103 79,2
Perfusion 97 74,6
Antipyrétiques 61 46,9
Antibiotiques 30 23,1
CTA 27 20,8
Des 130 patients, la totalité ont été
transfusé et 103 soit 79,2% ont reçu de la quinine. Les ACT ont
été administrés dans 20,8% des cas.

38
IV.1.3.3. L'évolution
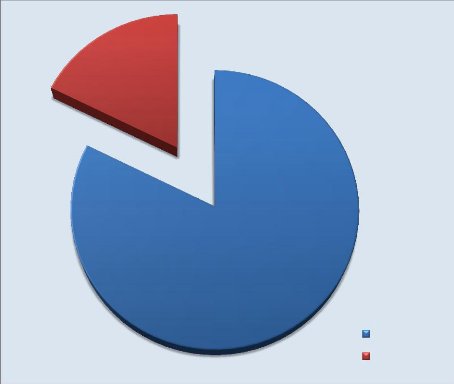
17,7%
82,3%
Guérison Décès
Figure 7 : Cas répartis selon
l'évolution Des 130 patients, nous avons enregistré
23 décès soit 17,7%.

39
IV.2. ETUDE ANALYTIQUE
IV.2.1. Mortalité et aspects
sociodémographiques
Tableau VI : Mortalité et aspects
sociodémographiques
|
Variable
|
Décès
(n=23)
|
Guérison
(n=107)
|
p
|
|
n
|
%
|
n
|
%
|
|
Age
<24 mois
|
14
|
23,0
|
47
|
77,0
|
|
|
|
|
|
|
0,2123
|
|
=24 mois
|
9
|
13,0
|
60
|
87,0
|
|
|
Sexe
Féminin
|
13
|
17,3
|
62
|
82,7
|
|
|
|
|
|
|
0,9145
|
|
Masculin
|
10
|
18,2
|
45
|
81,8
|
|
|
Commune Lubumbashi
|
9
|
29,0
|
22
|
71,0
|
|
|
Kampemba
|
7
|
21,2
|
26
|
78,8
|
|
|
Annexe
|
4
|
9,1
|
40
|
90,9
|
|
|
|
|
|
|
0,3037
|
|
Katuba
|
2
|
11,8
|
15
|
88,2
|
|
|
Kenya
|
1
|
25,0
|
3
|
75,0
|
|
|
Ruashi
|
0
|
0,0
|
1
|
100
|
|
Statistiquement, il ressort du tableau VI que tous les aspects
sociodémographiques étudiés ne sont pas significativement
associés à la mortalité chez les enfants atteints de
paludisme grave forme anémique. (p?0,05)
Cliniquement, nous avons trouvé que les enfants
âgés de moins de 24 mois, ceux de sexe masculin et ceux
résidant dans la commune de Lubumbashi décédaient plus que
ceux âgés de 24 mois ou plus, ceux de sexe féminin et ceux
résidant dans d'autres communes.
S'agissant du mois d'admission, bien que nous ayons
constaté des taux élevés au cours des mois d'août et
d'octobre (33,3% chacun), l'analyse statistique ne montre aucune
différence significative entre les différents mois de
l'année comme nous le montre la figure 6.

40
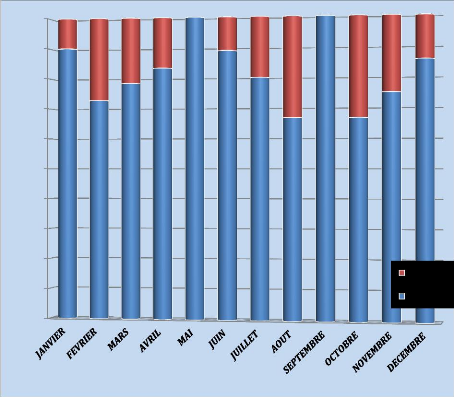
100%
20%
30%
80%
50%
40%
90%
60%
10%
70%
0%
90
10
27,3
72,7
21,7
78,3 83,3
16,7
100
Mois d'admission
0
88,9
11,1
20
80
66,7
33,3
100
0
66,7
33,3
25
75
Décès
Guérison
85,7
14,3
X2=8,8 ; p=0,6341
Figure 8: Mortalité et mois
d'admission
41
Il ressort de ce tableau que la mortalité
n'était liée à aucun diagnostic qui était
associé à l'anémie palustre.
IV.2.2. Mortalité et aspects cliniques
IV.2.2.1. Mortalité et signes cliniques
|
Tableau VII : Mortalité et signes
cliniques
|
|
|
|
|
Variable
|
Décès
(n=23)
|
Guérison
(n=107)
|
p
|
|
n
|
%
|
n
|
%
|
|
Fièvre
|
|
|
|
|
|
|
Présente
|
18
|
19,8
|
73
|
80,2
|
0,4825
|
|
Absente
|
5
|
12,8
|
34
|
87,2
|
|
|
Fatigue
|
|
|
|
|
|
|
Présente Absente
|
20
3
|
19,0
12,0
|
85
22
|
81,0
88,0
|
0,5636
|
|
Tachypnée
|
|
|
|
|
|
|
Présente Absente
|
21
2
|
18,1
14,3
|
95
12
|
81,9
85,7
|
1,0000
|
|
Pâleur
|
|
|
|
|
|
|
Présente Absente
|
20
3
|
18,5
13,6
|
88
19
|
81,5
86,4
|
0,7634
|
|
Ictère
|
|
|
|
|
|
|
Présente Absente
|
1
22
|
9,1
18,5
|
10
97
|
90,9
81,5
|
0,6878
|
|
Signe d'intolérance à
l'anémie
|
|
|
|
|
Présent
|
19
|
20,4
|
74
|
79,6
|
0,3076
|
|
Absent
|
4
|
10,8
|
33
|
89,2
|
|
De tous les signes cliniques notés chez nos patients,
aucun signe n'est significativement associé à la mortalité
des enfants souffrant d'anémie sévère due au paludisme.
IV.2.2.2. Mortalité et diagnostic associé
à l'anémie palustre Tableau VIII : Mortalité et diagnostic
associé à l'anémie palustre
|
Décès
|
|
Guérison
|
p
|
|
Diagnostic associé
|
n
|
%
|
n
|
%
|
|
Aucun
|
15
|
19,5
|
62
|
80,5
|
0,1146
|
|
Drépanocytose
|
6
|
26,1
|
17
|
73,9
|
0,0645
|
|
FBH
|
2
|
12,5
|
14
|
87,5
|
0,5249
|
|
Autres*
|
0
|
0
|
14
|
100
|
-
|
|
Total
|
23
|
17,7
|
107
|
82,3
|
|
FBH : fièvre bilieuse hémoglobinurique ;
Autres : pneumonie et souffrance cérébrale aigue
fébrile

42
IV.2.3. Mortalité et aspects
thérapeutiques
IV.2.3.1. Mortalité et traitement reçu
avant admission dans notre service Tableau IX : Mortalité et traitement
reçu avant admission (dans notre service)
|
Variable
|
Décès
(n=23)
|
Guérison
(n=107)
|
p
|
|
n
|
%
|
n
|
%
|
|
Antibiotiques
|
|
|
|
|
|
|
Oui
|
5
|
20,8
|
19
|
79,2
|
|
|
|
|
|
|
0,8804
|
|
Non
|
18
|
17,0
|
88
|
83,0
|
|
|
Antipyrétiques
Oui
|
13
|
20,3
|
51
|
79,7
|
|
|
|
|
|
|
0,5884
|
|
Non
|
10
|
15,2
|
56
|
84,8
|
|
|
Transfusion
Oui
|
1
|
10,0
|
9
|
90,0
|
|
|
|
|
|
|
1,0000
|
|
Non
|
22
|
18,3
|
98
|
81,7
|
|
|
Quinine
Oui
|
5
|
13,5
|
32
|
86,5
|
|
|
|
|
|
|
0,5941
|
|
Non
|
18
|
19,4
|
75
|
80,6
|
|
|
Chloroquine
Oui
|
1
|
25,0
|
3
|
75,0
|
|
|
|
|
|
|
0,5456
|
|
Non
|
22
|
17,5
|
104
|
82,5
|
|
|
CTA
|
|
|
|
|
|
|
Oui
|
2
|
28,6
|
5
|
71,4
|
|
|
|
|
|
|
0,6065
|
|
Non
|
21
|
17,1
|
102
|
82,9
|
|
CTA : combinaison thérapeutique à base
d'artémisinine
De ce tableau IX, il ressort qu'aucun de traitements
administrés à nos patients avant leur admission dans le service
n'était associé statistiquement au décès lié
au paludisme grave forme anémique (p>0,05). Cliniquement, nous
constatons que les enfants qui n'ont pas reçu la transfusion et la
quinine sont décédés plus que ceux qui les ont
reçus (18,3% et 19,4% contre 10% et 13,5%) ; ensuite, les enfants ayant
reçu la chloroquine, les CTA et les antibiotiques sont
décédés plus que ceux qui ne les ont pas reçus
(25%, 28,6% et 20,8% contre 17,5%, 17,1% et 17%).

43
IV.2.3.2. Mortalité et traitement reçu
pendant l'hospitalisation Tableau X : Mortalité et traitement
reçu pendant l'hospitalisation
|
Variable
|
Décès
(n=23)
|
Guérison
(n=107)
|
p
|
|
n
|
%
|
n
|
%
|
|
Antibiotiques
|
|
|
|
|
|
|
Oui
|
3
|
10,0
|
27
|
90,0
|
|
|
|
|
|
|
0,2799
|
|
Non
|
20
|
20,0
|
80
|
80,0
|
|
|
Antipyrétiques
Oui
|
10
|
16,4
|
51
|
83,6
|
|
|
|
|
|
|
0,8929
|
|
Non
|
13
|
18,8
|
56
|
81,2
|
|
|
Quinine
Oui
|
16
|
15,5
|
87
|
84,5
|
|
|
|
|
|
|
0,3289
|
|
Non
|
7
|
25,9
|
20
|
74,1
|
|
|
Perfusion glucosée
Oui
|
14
|
14,4
|
83
|
85,6
|
|
|
|
|
|
|
0,1598
|
|
Non
|
9
|
27,3
|
24
|
72,7
|
|
|
CTA
|
|
|
|
|
|
|
Oui
|
7
|
25,9
|
20
|
74,1
|
|
|
|
|
|
|
0,3289
|
|
Non
|
16
|
15,5
|
87
|
84,5
|
|
CTA : combinaison thérapeutique à base
d'Artémisinine
De ce tableau, nous constatons que les enfants qui n'ont pas
reçu les antibiotiques, les antipyrétiques, la quinine et la
perfusion glucosée sont décédés plus que ceux qui
les ont reçus et en plus, les enfants qui ont reçu des CTA sont
décédés plus que ceux qui ne les ont pas reçus ;
mais l'analyse statistique ne montre pas de différence significative
(p>0,05).
44
CHAPITRE V : DISCUSSION
Le paludisme grave forme anémique vient en
première position devant toutes les autres formes de gravité du
paludisme [30-32].
Selon Tchokoteu [33], la survenue plus fréquente de
l'anémie grave au cours du paludisme parmi les enfants âgés
de moins de 5 ans serait en rapport avec le faible niveau d'immunisation des
sujets de cette tranche d'âge et l'association d'autres affections
anémiantes telles que la malnutrition, les parasitoses intestinales et
les hémoglobinopathies.
Commune de résidence
Malgré que toutes les communes soient touchées
par cette maladie, nous constatons que la commune Annexe vient en tête
avec 33,8% des cas (44/130) suivie des communes Kampemba et Lubumbashi avec
respectivement 25,4% et 23,8%. Cette fréquence élevée
pourrait s'expliquer par sa forte densité de la population et au fait
que cette commune possède des centres de santé de
référence qui a une moindre capacité d'accueil poussant
ainsi les malades à venir se faire soigner dans notre milieu de
travail.
Mois d'hospitalisation
Bien que l'accès palustre soit présent au
courant de toute l'année dans notre milieu, nous remarquons que, dans
notre série, des prévalences élevées ont
été enregistré du mois de décembre jusqu'au mois de
mai. Cette période correspond à la saison des pluies. Cette
observation a été faite par plusieurs auteurs dans d'autres
milieux d'Afrique où sévit le paludisme [30].
Age
L'âge moyen de nos patients est de 25,9#177;17,9 mois.
Le plus jeune avait 2 mois et le plus âgé avait 59 mois. Notre
moyenne est comparable à celles trouvées par Fendel [34] au Gabon
en 2010, Dzeing-Ella [31] et Kouam-Kouam [35] qui notent des moyennes
respectives de 27 mois, 25,5 mois (#177;19,2) et 23,1 mois (#177;13,5). En
2002, dans son étude menée au Nord du Ghana, Mockenhaupt [36]
avait noté une moyenne d'âge de 21 mois.
Par contre, d'autres auteurs ont noté des moyennes
inférieures à la nôtre tel est cas de Soulama [37] et de
Malamba [38] qui rapportent respectivement des moyennes de 15,6 mois
(#177;10,8) et de 14,4 mois.
45

46

47
Dans notre série, 46,9% des enfants avaient un
âge est inférieur ou égal à 2 ans. Nos
résultats sont comparables à ceux de Bassat [39] et de
Dzeing-Ella [31] qui ont noté des taux respectifs de 58,1% et 68%.
Bouyou-Akotet [40], dans son étude
réalisée en 2009 à Libreville (Gabon), affirme que le
risque de développer une anémie au cours d'un paludisme grave est
significativement plus élevé chez les enfants dont l'âge
est inférieur ou égal à 2 ans. En 2008 à Kilifi
(Kenya), Kai [41] avait un constat identique et confirme que la moyenne
d'âge des enfants qui présentent un paludisme grave forme
anémique se situe entre 12 et 36 mois.
Sexe
Nous avons observé une nette prédominance du
sexe féminin avec 57,7% des cas. Le sexe ratio est de 1,36. Nos
résultats contredisent ceux de plusieurs auteurs ont aussi trouvé
un sexe ratio en faveur des garçons : une étude menée en
1998 à Antananarivo (Madagascar) par Raobijaona [42] relève un
sexe ratio de 1,4. Chiabi [43] à Yaoundé (Cameroun) en 2004, Asse
[44.] et Gebre [45] ont eu 1,2. Malamba en 2007 à Kampala (Ouganda) [38]
ont trouvé 1,1. Enfin, Kouam-Kouam [35], Dzieng-Ella [31] et Tchoukoteu
[33] enregistrent une légère prédominance masculine avec
un sexe ratio de 1,05.
Letoutourier, cité par Mutombo [30], pense que la
concentration sérique des Ig M plus élevée chez la femme
que chez l'homme donne à penser qu'une relation existerait entre le taux
des Ig M d'un sujet et le nombre de chromosome X, ce qui permettrait à
la fille (ou femme) de mieux résister à l'agression
paludéenne que son homologue masculin ou tout au moins d'atténuer
chez la fille (ou femme) la sévérité de la maladie ; car
au cours de l'infestation de l'organisme par le Plasmodium falciparum,
celle-ci stimule les lymphocytes B et il s'ensuit l'apparition des Ig M d'abord
et puis des Ig G tributaires de l'immunité humorale.
Clinique
Dans notre série, plus de 4/5 de nos patients
étaient pâles, tachypnéiques et asthéniques. La
splénomégalie était présente dans 73% des cas
à l'admission. La constatation significative dans notre série de
la splénomégalie chez nos patients témoigne du
caractère hémolytique d'origine paludéenne de ce trouble
en l'absence d'une hémoglobinopathie, d'un trouble nutritionnel ou d'une
autre cause chez nos malades. Dans la série de Gebre [32], la
splénomégalie a été notée chez 50,4% des cas
alors que dans celle de Tchoukoteu [33] elle a été notée
dans 86% des cas.
En ce qui concerne la fièvre, Kouam-Kouam [35] note
96,6% de patients fébriles et Bassat [39] lui trouve 69,1%. Notre faible
taux (70%) de patients fébriles pourrait s'expliquer par le fait que
près de la moitié de cas (49,2%) avait pris un
antipyrétique avant de venir en consultation.
Traitement avant
Notre étude rapporte que 37% des patients ont
reçu un antipaludéen (quinine, dérivées
d'arthémisinine, chloroquine) avant d'être admis à
l'hôpital. Pour Tchokouteu [33], ce taux est de 27% des cas. Nos chiffres
sont inférieurs à ceux trouvés par Kouam-Kouam [35] qui
rapporte 79,7%.
Le manque d'amendement après cette administration du
médicament est plus en rapport avec un sous-dosage des antipaludiques
administrés souvent par des personnes peu informées sur le plan
médical comme nous le constatons dans notre milieu.
Traitement pendant l'hospitalisation
Presque quatre patients sur cinq de nos patients (79,2%)
était soumis sous un traitement fait de la quinine. Le paludisme grave
à Plasmodium falciparum est une des grandes urgences
thérapeutiques tropicales surtout chez l'enfant, du fait de la
rapidité d'évolution. Parmi les produits schizonticides
érythrocytaires indiqués dans le traitement des accès
graves, la quinine reste le produit de référence. Dans le
paludisme grave de l'enfant, la quinine intraveineuse reste le traitement de
choix en France. Le volume apparent de distribution de la quinine est
inférieur chez l'enfant à celui de l'adulte, mais son
élimination est plus rapide de sorte que, aux posologies usuelles, la
clairance systémique et les concentrations plasmatiques sont comparables
chez l'enfant et chez l'adulte [46]. En l'absence d'étude
pharmacocinétique chez le nouveau-né, le traitement repose sur la
quinine aux mêmes posologies que chez l'enfant plus âgé. Le
relais par voie orale est effectué selon l'état du patient par la
quinine à la même posologie, ou bien par les dérivés
d'Arthémisinine [47].
Evolution
L'anémie grave a provoqué le décès
de 17,7% des patients de notre série. Nos résultats sont
superposables à ceux de Sanou [48] qui rapporte 12,5% de
décès. Raobijaona [42] trouvent dans sa série un taux de
létalité proche au nôtre qui est 14,5%. Par contre,
d'autres
auteurs rapportent des taux inférieurs au nôtre :
4,4% pour Bassat [39], 8,9% pour Dzeing-Ella [31] et 9% pour Malamba [38].
Selon l'Organisation Mondiale de la Santé,
l'anémie grave est la forme de gravité la plus fréquente
et responsable de la majorité des décès chez l'enfant
[47].

48
CONCLUSION
A l'issue de notre étude sur le paludisme grave forme
anémique menée à l' HGPR Jason Sendwe de janvier 2012
à Décembre 2013, les points saillants ci-après ont
été retenus :
> Concernant le mois d'admission, le pic est observé au
courant de mars (17,7%) ;
> La commune la plus touchée est la commune
Annexe(33,8) ;
> L'Age moyen est de 25,9 #177; 17,9 mois ;
> Le sexe féminin est prédominant (57,7%) ;
> Les signes cliniques les plus présents sont la
tachypnée (89,2%), la pâleur (83%), la
fatigue (80,8%), et la splénomégalie (73%).
> Les pathologies les plus souvent associées sont la
drépanocytose (17,7%) et la FBH
(12,1%)
> La quinine est l'antipaludéen le plus
administrés avant l'hospitalisation (28,5%) et
pendant l'hospitalisation (79,2%)
> L'évolution est marquée par le
décès dans 17,7% ;
> Des facteurs de risque de décès
étudiés nous montre que ni les paramètres
sociodémographiques, ni les paramètres cliniques,
ni les aspects thérapeutiques ne
semblent avoir de l'influence sur l'évolution fatale des
enfants âgés de moins de 5 ans
touchés par le paludisme grave forme anémique
(p?0,05).
49
RECOMMANDATIONS
Au terme de cette étude nous proposons les recommandations
suivantes respectivement :
AUX AUTORITES GOUVERNEMENTALES :
> De bien vouloir mettre en oeuvre et renforcer de
façon systématique , équitable et efficace des programme
nationaux pour la lutte contre le paludisme , la diffusion de
l'information , sensibilisation adaptée à notre
pays ;
> D'intensifier la formation de tous les professionnels de
santé et promouvoir l'éducation communautaire, y compris le
conseil en santé ;
> Promouvoir une coopération internationale efficace
dans la lutte contre le paludisme. > D'équiper les hôpitaux des
matériels de laboratoire capables de diagnostiquer tôt le
paludisme, d'assurer une bonne banque de sang ;
> De promouvoir la construction des structures de santé
proche de la population.
AU PERSONNEL SOIGNANT :
> De mettre en oeuvre un circuit de suivi et de prise en
charge urgente des enfants avec paludisme grave forme anémique.
> De bien vouloir respecter le schéma standard admis
sur le plan national pour la meilleure prise en charge du paludisme grave forme
anémique.
A LA POPULATION
> De consulter rapidement en cas de crise de paludisme
> D'éviter d'assurer une automédication devant
tous signes plaidant en faveur du paludisme ou d'une anémie.

50
BIBLIOGRAPHIE
1. Médecine Tropicale (Marc Gentilini) 2eme
édition 1993
2. WHO. Diagnostic et prise en charge du paludisme grave
à falciparum (WHO/ CDS/ CPE/ SMT/ 2000.4 Ré 1partie I) 2012.
3. WHO.Paludisme-diagnostic (Who/HTM/MAL/2006-1108
4. Larousse médical Ivuef 2003
5. Diagnostic et prise en charge du paludisme grave à
plasmodium falciparum (Module II kin octobre 2001) Programme national de lutte
contre le paludisme
6. Parasitologie et mycologie (E.Condolfi, D. Fillisetti,
V.Lescher-BRV, O. Villard, j. Waller) université Louis Pasteur de
Strasbourg institut parasitologique et de pathologie tropicale 2007
7.
http://www.dpd.cdc.gov/dpdx
consulté le 3 Janvier 2015
8. Denis M. et Mouchet j .paludisme,
université francophonies, paris, 1991
9. Rbijoana H. Randrianotahina C. et Razana Mparany, Le
paludisme grave de l'enfant observé au service de pédiatrie du
centre hospitalier de Befetalanana à Antananarivo (Madagascar) en
1996-1998
10. J. Koko, D. Dufillot, A.M. Zima-ebeyard, TH Duongo ? aspects
cliniques et approche épidémiologique du paludisme de l'enfant
à Libreville, Gabon ? médecine d'Afrique noire 1999.
11. WHO. Severe falciparum malaria. Trans R soc Trop Med Hyg
2000; 94 suppl: 1-90.
12. WHITE et al, 1987 ; KAWONG et al, 1990
13. WHO, 2000, SP/LF, 1999
14. Waller et al, 1995 ; IMBERT et al, 1999
15. SPILF et al 1999
16. WHO, 2004
17. WHO, 2000
18. MARCHK et al, 1995
19. GENDRELD et al, 1984 ; WATTANAGOONY et al, 1994
20. GENDREL et al, 1984 ; AKPEDEGO et al 1993 ; NEWTON R et al,
2000
21. SPILF, 1999
22. Lanckriet C. bureau j. cap de vielle H. Gody j.C, Olivier
siopathis R.M ? morbidité et mortalité dans le service de
pédiatrie a Blanqui au cours de l'année 1990" en pédiatrie
(paris) 1992, pp39, 125-130.
23.

51
Diagnostic et prise en charge du paludisme grave à
plasmodium falciparum (OMS juin 2002)
24. Antoine bourillon et al 5eme éd .pg 373
; tableau 16.1 ; 376 ; 377 ;
25. M.balaka ekwalanga PhD, cours de biologie clinique, U552
INSERM-IMEA, unité de recherches Antiviral, Hôpital BICHAT : 38,
rue H.HUCHARD.75018, paris France ;
26. Gentilini Marc et al, Médecine tropical,
Flammarion, 4eme éd paris, 1986, pg 583 ;
27. Yaba cours d'hématologie université de
Lubumbashi troisième doctorat 2011-2012 inédit gp 6 ;
28.
http://www.Mémoire online
L'utilité des analyses médicales pour le diagnostic des
anémies 2010 par Djamel AICHE ; lue le 17/03/2011.
29.
http://pro.msd-france.com/secure/html/manuel_merc/11hema2.tml
lue le 26/01/2015 15:15:32 ;
30. http//www.Google repli. Net-page principal-coeur, le sang
et la circulation. Lue le 22/02/2015 ;
31. Mutombo MA, Mukuku O, Kabuya MS, Lubala T, Bugeme M,
Ilunga PM, Mubinda KP, Mutombo KA, Luboya NO. Paludisme grave et malnutrition
sévère chez l'enfant de 6 à 59 mois. Rev. méd. Gd.
Lacs 2013; 2 (3): 416-424.
32. Dzeing-Ella, Nze-Obiang PC, Tchoua R, Planche T, Mboza B,
Mbounja M, Muller-Römer U, Jarvis J, Kendjo E, Ngou-Milama E, Kremsner PG,
Krishna S, Kombila M. Sévère falciparum malaria in Gabonese
children: clinical and laboratory features. Malaria Journal 2005, 4:1-8.
33. Gebre B, Negash Y. Severe malaria among children in
Gambella, western Ethiopia. Ethiop J Health Dev. 2002; 16 (1): 61-70.
34. Tchokoteu PF, Bitchong-Ekono C, Tietche F, Tapko JB,
Ekobo AS, Douala-Mouteng V, Moukoudi A, Ali A, Juimo AG, Mbede J, Nkoulou H.
Les formes graves du paludisme de l'enfant dans un service de pédiatrie
générale à Yaoundé, Cameroun. Bull Soc Pathol Exot
2005.
35. Fendel R, Brandts C, Rudat A, Kreidenweiss A, Steur C,
Appelmann I, Ruehe B, Schröder P, Berdel We, Kremsner Pg, Mordmüller
B. Hemolysis Is Associated with Low Reticulocyte Production Index and Predicts
Blood Transfusion in Severe Malarial Anemia. Plos One 2010; 5(4): 1-8.
36.

52
Kouam-Kouam CM, Abena-Obama MT, Forlack EA, Beyeme-Owono M,
Manga E, Mbede J, Etame E. Prise en charge pré-hospitalière de
l'accès palustre grave de l'enfant âgé de 6 à 59
mois. Med Afr Noire 2004; 51 (1): 15-22.
37. Mockenhaupt FP, Ehrhardt S, Burkhardt J, Bosomtwe SY,
Laryea S, Anemana SD, Otchwemah RN, Cramer JP, Dietz E, Gellert S, Bienzle U.
Manifestation and outcome of severe malaria in children in Northern Ghana. Am J
Trop Med Hyg 71(2): 2004, 167À172
38. Soulama I, Sawadogo M, Nebie I, Diarra A, Tiono AB,
Konate A, Sirima SB. Diversité génétique de Plasmodium
falciparum et pathogénie de l'anémie palustre
sévère chez des enfants de moins de 5 ans de la province du
Boulgou, Burkina Faso. Bull Soc Pathol Exot 2006; 99 (3): 166-170.
39. Malamba S, Hladik W, Reingold A, Banage F, McFarland W,
Rutherford G, Mimbe D, Nzaro E, Downing R, Mermin J. The effect of HIV on
morbidity and mortality in children with severe malarial anemia. Malaria
Journal 2007; 6:143-150.
40. Nhacolo A, Macete E, Mandomando I, Aponte JJ,
Menéndez C, Alonso PL. Malaria in rural Mozambique. Part II: children
admitted to hospital. Malaria Journal 2008, 7:37-50.
41. Bouyou-Akotet MK, Dzeing-Ella A, Kendjo E, Etoughe D,
Ngoungou EB, Planche T, Koko J, Kombila M. Impact of Plasmodium falciparum
infection on the frequency of moderate to severe anemia in children below 10
years of age in Gabon. Malaria Journal 2009, 8:166-174.
42. Kai OK, Roberts DJ. The pathophysiology of malarial
anemia: where have all the red cells gone? BMC Médicine 2008,
6:24-27.
43. Raobijaona H, Randrianotahina CH, Razanamparany M. Le
paludisme grave de l'enfant observé au Service de Pédiatrie du
Centre Hospitalier de Befelatanana à Antananarivo(Madagascar) en
1996-1998. Arch. Insti Pasteur Madagascar 2000; 66 (1&2) : 23-25.
44. Chiabi A, Tchokoteu PF, Toupouri A, Mbeng Tb, Wefuan J.
The clinical spectrum of severe malaria in children in the east provincial
hospital of Bertoua, Cameroon. Bull Soc Path Ex 2004 ; 97 (4):239-243.
45. Asse KV, Brouhy O, PLO KJ. Paludisme grave de l'enfant au
centre hospitalier universitaire (CHU) de Bouaké en République de
Côte d'Ivoire. Arch Ped 2003; 10 (1): 62.
46.

53
Gebre B, Negash Y. Severe malaria among children in Gambella,
western Ethiopia. Ethiop J Health Dev. 2002; 16 (1): 61-70.
47. Debord T, Imbert P, Saïssy JM, Roué R. Conduite
pratique du traitement antiparasitaire d'une forme grave de paludisme à
Plasmodium falciparum. Med Mal Infect 1999; 29 (3) : 356-371.
48. Imbert P, Gendrel D. Traitement du paludisme chez l'enfant :
paludisme grave. Med Trop 2002; 62 : 657-664.
49. Sanou I, Pare J, Traore S, Modiano D, Kam KL, Kabore J,
Lamizana L, Sawadogo SA, Guiguemde TR. Formes cliniques du paludisme grave en
milieu hospitalier pédiatrique à Ouagadougou. Cahiers
Santé 1997; 7 : 13-17.
| 


