|

République Algérienne Democratique et
Populaire
Ministère de l'enseignement supérieur et de
la recherche scientifique
Université Ferhat
ABBAS-Setif
FACULTE DES SCIENCES DE LA NATURE ET DE LA
VIE
DEPARTEMENT : BIOCHIMIE
MEMOIRE DE MASTER
Domaine : Sciences de la nature et de la vie
Filière : Biochimie
Spécialité : Analyses
Biochimiques
Théme
Effet scavenger des radicaux oxygénés et
inhibiteur de la xanthine
Oxydoreductase des extraits de Cachrys libanotis
.L
Présenté par: Encadré par :
Melle KESKAS Narimen Pr.BAGHIANI Abderahmane
Jury de soutenance :
Président: M. ARRAR lekhmici Prof.UFAS Setif
Encadreur : M. BAGHIANI Abderrahmane Prof.UFAS Setif Examinateur:
Mme.BOUMERFEG Sabah MCB CUBBA
Promotion : Juin 2011
Laboratoire : Biochimie Appliquée
jilAlÇ
|
äLu~1Ç
|
Ñ1-0
|
***A:41 Ñæ'~ Ê
_"&1_A1
|
c.,~~LAÇ
JA-1Ç
|
~~~~~ ~å ~~ÇÑ~~Ç ~~å
~~ ~~~Ç
|
r,L.)Ç ~~) -. Lola
,.Ç41Ç coi .4121Ç c=1Ç
coi A.4.6.A1Ç
(XO)
c~w.Çiii1 w.Âj.1Ç
r4i.yÇ *42.u `.,4:1.
Cachrys libanotis L
. É~$Â5~ ÉÏ 7%Ç ~!.
!8 æ ~~~~Ç'9"~ ~$Â:%~Ç
AÂ 7.18 Ü>
CibtilÇ LÅ C~5æ.41Ç A-$
Lola á., -.
C~1ÇÏ.4Â 150 Ïæw. coi
.4:-Ñ -:."
ÏæÏ~%> ~~~~Ç 2"?
~~
~~. >9Ç É~/~~Ç
Ê~~H
SDS-PA GE
1
7.97
&
ÊÑS9.æ
. á /
=
XO
IC50)
Ç ÊÑwC Si æ
..
C~~æ.4
& / ~~:9Ï / áyzi- ~
#177; 0.11
2261 Ü> +.6,1Ç
&'K ~"9Ç ~~) *<~
&~'~Å P +" , ~~~ 10 ~~Â
Ê ~~~ L
. &~'~(Ç Éæ ~~ MÇ N"#$
ì~>
#177;
= IC50) ã #~Ç
N"#$%Ç &~ ãÑ~0æÑ~"9~Ç N"#$%>
Ú~~~~
ãÑ~0æÑ~"9~Ç N"#$
ì~> ~~? 0 2~~~~~Ç +",
( LIA / & 0.006
0.138
(
L /
æ 0.002
& 0.001 #177; 1.048 Úi.~A
(LA / & 0.001 #177; 0.222 = IC50) cytochrome
c Ú ~ÑÇ cic :~~ 10 .4Â
0.084 #177; 2.68 æ 0.015 #177; 0.415 =
IC50) ã #~Ç N"#$%Ç &~ Ê .1-
J.~Ç u-01&:L.-4-4-1 .
Ê ~Â~%~Ç ~~å á %1Ç
~~~ 9U> V< ~~", L!W~%~Ç X. ~<~Ç
äÅ
. `~~.:1Ç LA- (
LIA /
&
AZÇÒÅ C:..Ç.9". t+).1Ç
w4Â:AlÇ i:..7Ç 1.41. 40.1.1"
4Ç ÖÇ..tÇ Ì.C coa
..1~~11Ç
. ÉizlÇ
Ñæ:4Ç
RESUME : L'objectif principal de cette
étude est l'évaluation de l'effet inhibiteur des extraits des
racines de la plante cachrys libanotis, utilisée en
médecine traditionnelle en Algérie, sur la xanthine oxydase (XO)
et de ses propriétés inhibitrices. La XO a été
purifiée du lait bovin avec un rendement de17.97 mg/l, un rapport
protéine/flavine de 7.18, et avec une bande majeure d'environ 150 KDa,
en SDS-PAGE, indiquant une pureté acceptable de l'enzyme.
L'activité spécifique de l'enzyme purifiée a
été de 2261 nmol/min/mg protéine. L'EAc inhibe la XO (IC50
= 0.11#177; 0.006mg/ml) et la réduction du cytochrome c (IC50 = 0.415
#177; 0.015mg/ml), suivi par l'ECh avec des IC50 de la XO et de la
réduction du cyt c de (0.138 #177; 0.002 et 0.222 #177; 0.001mg /ml)
respectivement. Enfin, l'EBr a un faible effet sur la XO (IC50 = 1.048#177;
0.001 mg / ml), possède l'effet inhibiteur de la réduction du cyt
c le plus faible avec une IC50 de (2.68 #177; 0.084). Les résultats
obtenus suggèrent que ces produits naturels peuvent être
utilisés pour traiter les maladies qui nécessitent l'inhibition
de la XO et le piégeage des radicaux libre
.
SUMMARY: This study was conducted to search
for xanthine oxidase (XO) inhibitors from Cachrys libanotis
L.root extracts traditionally used in folk medicine in Algeria.
XO was purified from fresh bovine milk with yields of 17.97 mg / L, protein /
flavine ratio of 7.18 and a major band, on SDSPAGE, of approximately 150 KDa,
indicating an acceptable purity of the enzyme. The total specific activity of
the purified enzyme was of 2261 nmol / min / mg protein. The EAc showed the
highest inhibitory properties on the XO activity (IC50 = 0.11 #177; 0.006 mg /
ml), followed by ECh with IC50 of XO inhibitory activity 0.138
#177; 0.002 mg / ml and EBr with an IC50 1.048 #177; 0.001 mg
/ ml. Whereas, the inhibition of cyt c reduction the highest activity was that
of ECh with IC50 ( 0.222 #177; 0.001 mg / ml), followed by EAc and EBr extracts
with an IC50 of (0.415 #177; 0.015 mg a /ml and 2.68 #177; 0.084 mg / ml),
respectively. These results suggest that these natural products could be used
to treat lot of diseases, where inhibition of XO and free radical scavenging
activity are necessary.
REMERCIEMENTS
J'ai eu la chance et le plaisir d'effectuer ce travail
de
recherche à la Faculté des Sciences de la
nature et de la vie à
l'Université Ferhat Abbas de Sétif,
Cependant, je tiens à
remercier tous les enseignants sans exception y
compris
l'encadrement administratif de notre université sans
pour
autant oublier le president du jury en l'occurrence
le
professeur Monsieur ARRAR Lekhmici, sous la direction
de
mon Professeur Mr Baghiani Abderrahmane en qui je lui
dois
toute ma reconnaissance pour les efforts et le temps et
la
patience qu'il a toujours déployé en ma
faveur.
Le sentiment que je ressens profondément est un
grand
honneur pour moi d'être suivie durant toutes mes
études par
sa bonne volonté qui m'a encouragée à
chaque fois de
poursuivre ce parcours dont mon mérite est
l'aboutissement à
mon voeux tant souhaité et attendu par moi et les
miens quant
à mon travail qui s'est vu mené à bon
terme.
On n'oublie pas de remercier madame BOUMERFEG Sabah
D'avoir bien voulu accepter de porter leur propre
jugement
sur mon travail fourni.
ainsi que tous ceux qui m'ont aidés de près ou
de loin au
niveau de laboratoire, madame Benzidan
Nadia,Sana,Meriem
DEDICACE
Je dédie ce travail à mes parents, Je tiens
à souligner le grand
sentiment que je porte envers mon père lequel
à toujours su
m'accompagner et marquer sa présence à mes
cotés devant
des situations peu difficiles que j'ai rencontré
durant toute la
période de mes études.
À ma soeur Ibtissem à mes frères Sif,
Noufel,
Adnen et à touts mes amies et collegues
Meriem
Iman,Sarah,
A tous ceux que j'aime
Sommaire
|
LISTE DES ABREVIATIONS
|
|
|
INTRODUCTION
|
1
|
|
REVUE BIBLIOGRAPHIQUE
|
|
|
1. La xanthine oxydoréductase
|
2
|
|
1.1. Structure
|
..3
|
|
1.2. Propriétés enzymatique
|
3
|
|
1.3.Interconvertion xanthine déshydrogénase
/oxydase
|
5
|
|
1.4.Distribution et localisation de la XOR
|
5
|
|
1.5.Rôles physiologiques et physiopathologique de la XOR
|
5
|
|
1.5.1. Rôles physiologiques
|
6
|
|
1.5.2. Rôles physiopathologiques de la XOR
|
6
|
|
1.5.3. Rôle de la XOR dans l'inflammation et
l'ischémie / réperfusion
|
.6
|
|
2. Le stress oxydatif
|
8
|
|
2.1. Les especes oxygénés réactives (ROS) .
|
8
|
|
2.2. Nature et sources cellulaires des (ROS)
|
..8
|
2.2.1 le radical anion superoxyde 8
2.2.2 Le peroyde d'hydrogene 9
2.2.3 Le radical hydroxyle 9
2.2.4 L'oxygène singulier 10
2.3 Les especes nitrogenes réactives 10
2.3.1Le monoxyde d'azote 10
|
3. Stress oxydant et ses conséquences biologiques
|
.11
|
|
4. Les principales cibles des
(ROS)
|
12
|
|
4.1 Les lipides
|
.12
|
|
4.2 Les proteines
|
.12
|
|
4.3 Les acides nucleiques (ADN)
|
13
|
|
5.Les maladies liées au stress oxydant
|
.13
|
|
6.Systhemes de défences antioxydants
|
.13
|
|
6.1 Systhèmes enzymatique
|
14
|
|
6.2. Systhème non enzymatiques
|
. .15
|
|
7. Les polyphénols
|
..15
|
|
7.1. Les acides phénoliques
|
..16
|
|
7.2. Les tannins
|
.16
|
|
7.3. Les flavonoïdes
|
..16
|
|
7.3.1. Structure et classification des flavonoïdes
|
16
|
|
7.3.2. Localisation et distribution des flavonoïdes
|
17
|
|
7.3.3. Effets biologiques et pharmacologiques des
flavonoïdes
|
.18
|
|
7.3.4. Activité antioxydante des flavonoides
|
..18
|
|
8. Piégeage direct de radicaux libres
|
18
|
|
8.2. Inhibition enzymatique
|
19
|
|
9. La plante médicinale Cachrys libanotis
L.
|
..19
|
|
9.1. Description de la plante
|
....19
|
|
9.2. Répartition
|
19
|
|
9.3. Classification classique
|
20
|
|
9.4. Description
|
20
|
|
5.4. Utilisation traditionnelle de la plante
|
20
|
|
MATERIEL ET METHODES
|
|
|
1. Matériel biologique
|
..21
|
|
1.1. Réactifs chimiques
|
..21
|
|
2. Méthodes
|
.21
|
|
2.1. Purification de la xanthine oxydase
|
21
|
|
2.2. Contrôle de pureté de la XO
|
22
|
|
2.3. Estimation de l'activité enzymatique de la XO
|
23
|
|
2.4. Extraction des flavonoïdes d'Cachrys libanotis
|
23
|
|
2.5. Fractionnement de l'extrait brut
|
24
|
|
2.6. Dosage des composés phénoliques
|
25
|
|
2.7.Dosage des flavonoides
|
26
|
|
2.8. Dosage des tannins
|
26
|
|
2.7. Inhibition de l'activité de la xanthine oxydase par
les extraits d'Cachrys libanotis.27
|
|
|
2.8.Effet scavenger des extraits d'Cachrys libanotis sur
le superoxyde produit par la
OX
|
28
|
RESULTATS ET DISCUSSION
1. Purification, contrôle de pureté et estimation
de l'activité de la xanthine oxydase
|
.29
|
2. Extraction et dosage des polyphénols, des
flavonoïdes et des tannins
|
.31
|
3. Inhibition de la xanthine oxydase par les extraits
d'Cachrys libanotis
|
|
32
|
|
4. Effet scavenger des extraits d'Cachrys libanotis sur
l'O2°- produit par la XO 35
REFERENCES BIBLIOGRAPHIQUES 39
LISTE DES ABREVIATIONS
AqE Aqueous extract
BMXO Bovine milk xanthine oxidase
CAT Catalase
CBB Coomassie brillant blue
ChE Chloroform extract
cyt c cytochrome c
DTT Dithiothreitol
EAc Extrait d'acétate d'éthyle
EaE Ethyl acetate extract
EAq Extrait aqueux
EBr Extrait brut
ECh Extrait de chloroforme
EDTA Ethylenediaminetetraacetic acid
EHx Extrait d'héxane
FAD Flavine adénine
dinucléotide
FADH2 Flavine adénine dinucléotide
réduit
GPx Glutathion peroxydase
GR Glutathion réductase
GSH Gluthathion réduit
GSSG Glutathion disulfure oxydé
H2O2 Peroxyde d'hydrogène
HxE Hexane extract
I % Pourcentage d'inhibition
IC50 % Concentration inhibitrice de 50 %
LOO° Lipid peroxide radical
MeOH Méthanol
Mo Molybdène
NAD+ Nicotinamide adénine
dinucléotide
NADH Nicotinamide adénine
dinucléotide réduit
NADP+ Nicotinamide adénine
dinucléotide phosphate
NADPH Nicotinamide adénine
dinucléotide phosphate réduit
NADPHO Nicotinamide adénine
dinucléotide phosphate réduit oxydase
NO° Radical nitroxyle
NO2 - Nitrite
NOS NO synthase
O2 °- Radical superoxide
OH° Radical hydroxyle
ONOO- Peroxynitrite
PFR Protein to flavine ratio
RNS Reactive nitrogene species
ROS Reactive oxygen species
SDS Sodium dodecyl sulphate
SDS-PAGE Sodium dodecyl sulfate- polyacrylamid
gel electrophoresis
SEM Standard error of the mean
SOD Superoxyde dismutase
TEMED N,N,N'N' Tetramethylenediamine
XDH Xanthine déshydrogénase
XO Xanthine oxydase
XOR Xanthine oxydoréductase
INTRODUCTION
Depuis l'antiquité, le monde a connu l'utilisation des
plantes dans le traitement des maladies humaines, il s'agit de la
médicine traditionnelle. Actuellement, la pharmacie utilise toujours une
forte proportion de médicaments d'origine végétale. Entre
autres, la recherche trouve chez les plantes des molécules actives, Ces
molécules peuvent être des enzymes, des protéines ou
d'autres molécules de faible poids moléculaire tels que les
vitamines (Halliwell, 1996), les caroténoïdes (Edge et al., 1997),
les flavonoïdes, les anthocyanines ainsi que d'autres composés
phénoliques (Sanchez-Moreno et al., 1998).
La xanthine oxydoréductase (XOR) est une enzyme
responsable de la production de l'anion superoxyde (O2°-) et de
peroxyde d'hydrogène (H2O2), ces deux
espèces oxygénées peuvent être des
précurseurs des autres espèces réactives soit de
l'oxygène (ROS) soit de nitrogène (RNS) qui sont
impliquées dans les grands dommages cellulaires et tissulaires dont leur
surproduction provoque des lésions directes de molécules
biologiques tels que l'ADN, les protéines, les lipides et les glucides.
L'implication de ces espèces réactives dans le vieillissement et
dans les maladies chroniques telles que l'athérosclérose, le
diabète, le cancer et certaines maladies inflammatoires ou
neurodégénératives est maintenant reconnue.
Les flavonoïdes représentent une classe de
métabolites secondaires (Markak, 2003), où ils agissent: sur le
scavenger des ROS, l'inhibition des enzymes et la chélation des traces
métalliques responsables de la production de ROS et enfin sur la
protection des systèmes de défense antioxydants (Halliwell,
1994).
Dans la présente étude on a essayé
d'étudier l'activité inhibitrice de différents extraits de
Cachrys libanotisL. Cette plante est utilisée en Algérie
comme un anti inflammatoir pour le rhumatisme, où elle présente
des propriétés antirhumatismales,
L'objectif de ce présent travail consiste à
extraire les différents composés actifs (polyphénoles et
flavonoïdes) de Cachrys libanotis L, leurs dosages et
l'étude de leurs effets inhibiteurs. Pour montrer l'activité
inhibitrice de notre plante, on a choisi de tester sa capacité d'inhiber
la XO comme une source génératrice des radicaux libres, son effet
scavenger sur l'O2°-qui est peu réactif par
lui-même, mais représentant un précurseur d'espèces
plus agressives.
REVUE BIBLIOGRAPHIQUE
1. La xanthine oxydoréductase

XOR
XOR
La xanthine oxydoréductase (XOR) est un complexe
métalloflavo-protéine, qui a été découverte
la première fois au niveau du lait bovin par Schardinger (1902). Chez
les mammifère XOR existe sous deux formes interconvertibles: la xanthine
déshydrogénase (XDH; EC 1.1.1.204 ) est la forme la plus dominant
in vivo et la xanthine oxydase (XO; EC 1.1.3.22) Bien que la XOR peut
réagir avec plusieurs substrats dont les purines, les pyrimidines et les
ptérines (Krenitsky et al., 1974), la propriété
catalytique principale la plus connue est le catabolisme des purines où
elle convertit l'hypoxanthine en xanthine et la xanthine en acide urique qui
est le produit finale du catabolisme des purines chez l'homme (Parks and
Granger, 1986) (figure 1)
1.1. Structure
La XOR est une enzyme homodimère constituée de
deux sous unités identiques de 150kDa de chacune, chaque sous
unités est partagé en 3 domaines :
- le domaine C terminale de 85kDa (590-1332
acides aminés) est le molybdo-protéique (Mo) -
le domaine central de 40kDa (226-531 acides aminés), est une
molécule de flavine adénine di nucléotides
(FAD)
- le domaine N terminale de 20kDa (1-165
acides aminés) se constitue de deux sousdomaines, avec deux centres
(Fe2/S2) combinés jusqu'à quatre résidu
de cystéine (figure 2) (Bray, 1975)

Figur2 : Structure secondaire et tertiaire de
la XOR. A, structure secondaire de la XOR, les flèches
indiquent les sites de clivage par la trypsine (Lys186, Lys552) (Amaya et
al., 1990), les étoiles indiquent les résidus de
cystéine modifiés dans la conversion réversible de XOR
(Cys535, Cys992) (Nishino and Nishino, 1997). B, domaines de
sous-unité de la XOR, leurs tailles et leurs cofacteurs associés
(Enroth et al., 2000). C, structure
cristallisée de l'homodimère de la XOR bovine (Enroth et al.,
2000).
1.2 Les propriété enzymatique
Le mécanisme réactionnel de la XOR est
constitué de deux demi-réactions indépendantes;
réductive et oxydative (Berry and Hare, 2004). La demi-réaction
réductive a eu lieu au site Mo où se produit une hydroxylation
oxydative du substrat (RH) avec réduction simultanée de l'enzyme
(Xia et al. 1999). Le NADH est le seul substrat réducteur qui
réagit avec le centre FAD et non avec le centre Mo (Berry and Hare,
2004). Les inhibiteurs de la XOR sont généralement des analogues
du substrat, tels que l'allopurinol, oxypurinol et certaines purines et
pyrimidines, inactivent l'enzyme en agissant sur le site Mo (Berry and Hare,
2004; Pacher et al., 2006).
Contrairement à la réaction
demi-réductive, la réaction demi-oxydative prenne lieu au site
FAD qui transfert des électrons aux accepteurs physiologiques (O2 et
NAD+) (Hille and Nishino, 1995). La réoxydation de l'enzyme
réduite permet d'oxyder l'oxygène en O
·- 2 et en H2O2
(Hille and Massey, 1981).

O2 + H2O O
·- 2 + H2O2
Les trois centres redox peuvent aussi transférer les
électrons entre eux (Figure 3) (Massey and Edmonson,
1970). Cependant, les accepteurs artificiels d'électrons (Ferricyanure
ou bleu de methylène) reçoivent leurs électrons des
centres Fe/S.

La XOR a deux formes inactives, démolybdo et
désulfo-XOR, ces formes représentent environ 60 % de l'enzyme du
lait bovin et plus de 97 % du lait humain (Baghiani et al., 2002;
2003). Ces deux formes ne peuvent pas oxyder les composés qui
réagissent au niveau du centre Mo, mais elles peuvent réagir avec
le NADH au niveau du centre FAD (Bray, 1975). Dans la forme désulfo,
l'atome de soufre au niveau du site Mo est remplacé par un atome
d'oxygène. Cette enzyme désulfo peut récupérer son
activité après une résulfuration en l'incubant avec des
composés sulfurés comme le (Na2S) (Baghiani et al.,
2003).
1.3. Interconversion xanthine
déshydrogénase/oxydase
La XOR existe sous deux formes: forme
déshydrogénase (XDH : forme D, EC.1.1.1.204) et forme oxydase (XO
: forme O, EC.1.1.3.22) (Della Corte et al., 1969; Waud and
Rajagopalan, 1976). La XOR existe dans la plupart des tissus des
mammifères sous forme déshydrogénase (Berry and Hare,
2004). Les deux formes de l'enzyme catalysent des réactions impliquant
des substrats analogues, mais chacune préfère des accepteurs
d'électrons différents. Les deux formes réduisent
l'oxygène moléculaire mais la forme D peut réduire aussi
le NAD qui est son préférable accepteur d'électrons
(Martin et al., 2004). La réduction de
l'oxygène conduit à la formation de
l'O
·- 2 et de H2O2. La conversion de
la forme D à la forme O de l'enzyme se fait par deux mécanismes
enzymatiques. Le traitement de la XOR par des protéases tels que la
trypsine, la chymotrypsine, ou la pancréatine conduit à la
formation d'une forme O irréversible (Della Corte et al., 1969;
Stirpe and Della Corte, 1969). La conversion réversible se produit par
l'oxydation des groupements sulfhydriles (SH) (Nishino and Nishino, 1997).
1.4-Distribution et localisation de la XOR
La XOR est largement distribuée dans l'organisme
vivant, les bactéries, les levures, les insectes, certain nombre
d'espèces des plantes, ainsi que chez les mammifères au niveau de
la glande mammaire, très abadant dans le lait (Harrison ; 2002 Nakagawa
et al .2007) et localisé à forte concentration dans le cytoplasme
et la membrane cellulaire et surtout dans les cellules hépatiques ou
elle possède une activité très élevée, les
cellules endothéliales des capillaires sanguines (Harrison, 2002)
1.5. Rôles physiologiques et physiopathologiques de
la XOR
1.5.1-Rôles physiologiques
LA (XOR) est une enzyme qui a une propriété
catalytique très importante est le catabolisme des purines en urate.
In vitro, la XOR a des propriétés antimicrobiennes par
sa capacité d'inhiber la croissance bactérienne (Hancock et
al. 2002). In vivo, dans le lait maternel, la XOR joue
le même rôle (Stevens et al., 2000). Une
activité antioxydante est attribuée à l'enzyme par le
biais de la production de l'urate. La XOR est suggérée d'avoir un
rôle dans d'autres processus physiologiques tel que les mécanismes
de transduction du signal (Meneshian and Bulkley, 2002).
1.5.2. Rôles physiopathologiques
La XOR est également une source importante des radicaux
libres (superoxyde), elle produit l'O2
·- et de H2O2, ces
deux espèces oxygénées peuvent être par la suite des
précurseurs des autres espèces réactives quelque soit de
l'oxygène (ROS) ou de nitrogène (RNS) qui sont impliquées
dans les grands dommages cellulaires et tissulaires. Ces espèces
réactives peuvent induire un changement structural des molécules
biologiques; les lipides, les protéines et l'ADN, ces modifications vont
impliquer dans la physiopathologie de plusieurs maladies. La XOR joue un
rôle important dans différentes formes de pathologies humaines
telles que les maladies inflammatoires, les lésions
post-ischémiques, les dommages tissulaires et vasculaires et les
maladies cardiaques chroniques (Pacher et al., 2006).
1.5.3. Rôle de la XOR dans l'inflammation et
l'ischémie / réperfusion
La XOR produit les ROS qui provoquent les lésions
ischémiques dues au catabolisme de l'ATP pendant l'hypoxie, ce qui
entraine une augmentation de concentration de l'hypoxanthine
(Figure4). Lorsque la concentration intracellulaire de L'ATP
est diminuée, il se produit un déséquilibre dans le
gradient ionique de part et d'autre de la membrane plasmique permettant ainsi
la pénétration de Ca2+ à l'intérieur de
la cellule. L'augmentation de la concentration cytoplasmique en Ca2+
provoque l'activation des protéases Ca2+- dépendantes
(Granger et al., 1981; Mc Cord, 1985) qui catalysent la conversion
irréversible de la XDH, prédominante in vivo, en XO
(Figure 4) (Della Corte and Stirpe, 1968; Granger et
al., 1981; Kooij et al., 1992).Dans la réperfusion, la
XO oxyde l'hypoxanthine accumulé en xanthine, laquelle
redevient acide urique, et réduit l'O2 en O2°- et
H2O2 (Figure 4) (Hille and
Massey, 1981). L'interaction entre ces deux espèces par
la réaction de Haber-Weiss produit le radical hydroxyle, provoquant
ainsi des lésions tissulaires (Huang et al., 2001).
Durant l'inflammation, la XOR est activée par plusieurs
types d'interférons, tels que TNF á et C5a, qui
incite la conversion de la XDH en XO (Friedl et al., 1989). Cependant, la
production de ROS s'élève et provoque l'activation de NF-KB
régulateur de la production des cytokines (TNF-, IL-1, IL-2 et IL-6)
(Schreck and Baeuerle, 1991; Burdon and Gill, 1993).
la XOR permet la production des espèces
réactives oxygènes qui peuvent réagir avec les
composés de la membrane cellulaire, tel l'acide arachidonique, pour
produire des lipides chimio-attractants des neutrophiles amplifiant ainsi la
réponse inflammatoire (Perez et al., 1990).
La XOR, impliquée dans le déroulement de la
réaction physiologique de l'inflammation, contribue également
dans son amplification par sa capacité de production des ROS. Par
exemple ; dans l'arthrite rhumatoïde, la XOR amplifie l'inflammation
synoviale conduisant à l'érosion de l'os et la propagation de la
maladie (Blake et al ., 1997)

Figure 4 : Mécanisme de
génération des ROS par la XOR dans les tissus lors du
processus
d'ischémie / réperfusion (Granger et al., 1981).
2. Stresse oxydatif
Le stress oxydatif est un déséquilibre dans la
balance métabolique cellulaire durant laquelle, la
génération d'oxydants accable le système de
défenses antioxydants, que ce soit par une augmentation de la production
d'oxydants et/ou par une diminution des défenses antioxydants (Sorg,
2004).
2.1. Les espèces oxygénées
réactives (ROS)
Les espèces oxygénées réactives
(ROS) regroupent les radicaux libres de l'oxygène (radical superoxyde,
radical hydroxyle, monoxyde d'azote, etc...) ainsi que certains
dérivés réactifs non radicalaires dont la toxicité
est plus importante tels que le peroxyde d'hydrogène et le peroxynitrite
(Bartosz, 2003).
2.2. Nature et sources cellulaires des ROS
Divers types cellulaires et tissus donnent naissance aux ROS
par des réactions enzymatiques ou par auto-oxydation au cours de leur
métabolisme normale et parfois en réponse à un stimuli
spécifique. Dans ce contexte, plusieurs exemples peuvent être
cités. (Figure 5).
2.2.1. Le radical anion superoxyde
Par sa configuration électronique l'oxygène
moléculaire est un radical qui possède deux électrons non
appariés; les spins de ses deux électrons son parallèles
lui attribuant une stabilité relativement grande.
Dans l'organisme, une partie de cet oxygène
moléculaire peut capter Un électron conduisant à la
formation du radical superoxyde (O2 ?-); (Koechilin-Ramonatxo,
2006).
O2+ e - -------------------------------------- O2
?-
La poussée respiratoire (respiratory burst) des
polynucléaires neutrophiles constitue une source cellulaire importante
de l'anion superoxyde qui est produit au niveau de la NADPHoxydase, Cette
enzyme normalement dormante est activée lorsque la cellule phagocytaire
est stimulée pour produire l'O2 ?-. Cette production
est à l'origine de la synthèse des molécules comme le
peroxyde d'hydrogène (H2O2) ou
l'hypochlorite (ClO?-) indispensables à la
digestion du matériel phagocyté (Babior et al,.2002).
NADPH oxydase
NADPH + 2O2-- NADP+ + H + 2O2 ?-
Le système enzymatique xanthine/xanthine oxydase
intervient aussi dans la production du
superoxyde au cours de l'oxydation de la xanthine en acide urique
selon la réaction suivante
Xanthine oxydase
Xanthine + 2O2 + H2O Acide urique + 2O2
?- + 2H+
2.2.2. Le peroxyde d'hydrogene
Le peroxyde d'hydrogène
(H2O2) se forme par la dismutation
spontanée ou enzymatique du radical superoxyde (Pal Yu, 1994), La
dismutation enzymatique est catalysée principalement par le superoxyde
dismutase (SOD)
(SOD)
2O2.- +
2H+ O2 + H2O2
En plus de la SOD, il existe d'autres enzymes produisant
H2O2, comme les oxydases (la
glycoxylate oxydase, la D-aminoacide oxydase) présentes
particulièrement dans les peroxysomes (kohen et nyska et al., 2002).
Cependant, ces oxydases peuvent catalyser directement la réduction
divalente d'oxygène moléculaire produisant ainsi le peroxyde
d'hydrogène sans former le radical superoxyde (Del Rio et al.,
1996).(Figure 5)
2.2.3. Le radical hydroxyle
Le radical hydroxyle (OH?) est
formé principalement par la dégradation du
H2O2 en présence de
métaux de transition sous leur forme réduite, ainsi
H2O2 associé à du
fer ferreux conduit à la réaction de Fenton.
Fe2+ + H2O2 .-- Fe3+ +
OH- + OH?
H2O2 peut également
réagir avec le radical superoxyde, aboutissant là encore à
la production du OH?, ce mécanisme
réactionnel est appelé réaction d'Haber et Weiss (Sorg,
2004).
Fe (III)/Cu(II)
O2 ?- + H2O2 O2 + OH- +
OH?
D'autres voies de formation de
l'OH? sont : la décomposition de l'acide
peroxonitrique et la réaction de l'acide hypochloreux avec O2
?- (Bartosz, 2003). Le radical hydroxyle est le plus réactif de
toutes les espèces dérivées de l'oxygène, il
réagit avec de nombreuses espèces moléculaires se trouvant
dans son voisinage (protéine, lipide, ADN). (Figure
5).
2.2.4. L'oxygène singulier
Pour l'oxygène moléculaire l'état triplet
(biradical) est plus stable que l'état singulier Il peut être
produit par plusieurs réactions biochimiques d'oxydation incluant la
peroxydase et la lipooxygénase, par la réaction entre divers ROS
ou en présence de la lumière, de l'oxygène et de photo
sensibilisateur comme la porphyrine, tel est le cas de la porphyrie
erythropoétique- congénitale (Sorg, 2004). (Figure
5)
Lumière + photo sensibilisateur
3 O 2 1 O 2
O2 ?- +M (n+1)+ 1O2 + M n+
H2O2 + ONOO - 1 O2 + NO2 - + H2O
2.3. Les espèces nitrogènes réactives
2.3.1. Le monoxyde d'azote
Le monoxyde d'azote (NO?) est produit
par l'oxydation de l'un des atomes N terminaux de la L-arginine, cette
réaction est catalysée par le nitrique oxyde synthase (NOS)
(Sorg, 2004) selon la réaction suivante
Nitrique oxyde synthase
O2 + Arginine + NADPH NO? + Citrulline +
H2O + NADP +
Le NO devient délétère pour les cellules
notamment en réagissant avec le O2 ?- pour former un
puissant oxydant le peroxynitrite (ONOO
·) qui peut secondairement se
décomposer en d'autres oxydants comme leNO2 et le
OH
· (Densiov et Afanas'ev, 2005).
(Figure 5)

Figure 5: Les principales sources
cellulaires des ROS (D'après Bonnefont-Rouseelot.,
2003)
3. Stress oxydant et ses conséquences
biologiques
L'accumulation des ROS a pour conséquence l'apparition
de dégâts cellulaires et tissulaires souvent irréversibles
dont les cibles biologiques les plus vulnérables sont les
protéines les lipides et l'acide désoxyribonucléique
(Halliwell et Whiteman 2004; Valko et al., 2007) (Figure 6)

Figure 6 : Cibles biologiques et endommagement
oxydatifs induits par les ROS(D'après
Kohen et Nyska, 2002).
4. Les principales cibles des ROS
4.1. Les lipides
Les acides gras polyinsaturés (AGPI) sont la cible
privilégiée des ROS en raison de leurs Hydrogènes bis
allyliques facilement oxydables. Comme ces derniers sont les lipides majeurs
des membranes cellulaires et des lipoprotéines, on comprend leurs
vulnérabilités particulières. Les produits d'oxydation
formés peuvent participer en tant que second messager à la
régulation de fonctions métaboliques, de l'expression des
gènes et de la prolifération cellulaire. Ils peuvent aussi, et
surtout, se comporter comme des substances toxiques responsables des
dysfonctionnements et d'altérations cellulaires (perte d'acides gras
polyinsaturés, diminution de la fluidité membranaire,
modification de l'activité des enzymes et des récepteurs
membranaires, libération du matériel à partir du
compartiment subcellulaire) (Beckman et Ames, 1998 ; Lehucher-Michel, 2001)
4.2. Les protéines
Les protéines sont constitués principalement par
des acides amines qui sont la cible des ROS les acides aminés
soufrés (cystéine et méthionine) et aromatiques (tyrosine,
tryptophane) devient les plus sensibles Si la majorité des acides
aminés peuvent oxydés par les ROS. L'oxydation des acides amines
génère des groupements hydroxyles et carbonyles sur les
protéines mais peut également induire des modifications
structurales plus importantes, (Martinez-Cayuela, 1995 ; Lehucher-Michel et
al., 2001 ; Valko et al,. 2007). Les protéines modifiées
deviennent généralement plus sensibles à l'action des
protéases et sont alors dirigées vers la dégradation
protéolytique au niveau du protéasome (Jung et al., 2007).
4.3. Les acides nucléiques (ADN)
Les bases puriques, pyrimidiques et le désoxyribose
sont la cible privilégiée des ROS, ils sont alors
transformés en produits de fragmentations et en bases oxydées,
(Martinez-Cayuela, 1995).
La guanine est facilement transformée en
8-hydroxy-2'-déoxyguanosine (8-OHdG) qui est éliminée par
des enzymes de réparation de l'ADN. Si ces systèmes de protection
sont débordés ou défectueux, les altérations du
matériel génétique s'accumuleront au sein de l'ADN
représentant ainsi la première étape impliquée dans
la mutagenèse, la carcinogenèse et le vieillissement
(Lehucher-Michel et al., 2001 ; Favier, 2003 ; Valko et al., 2006).
5. les maladies liées au stress oxydant
Les ROS peuvent produire différents maladies qui sont mentionne
dans le tableau suivant
Tableau1: Les principales affections
liées à la production des ROS
Lésions de réperfusion post-ischémique
(Zweier et Talukder, 2006)
Maladies auto-immunes (Halliwel et guetteridge, 1999)
Arthrite rhumatoïde (Ahsan et al2003)
Maladies inflammatoires (Densiov et Afanas'ev, 2005)
Athérosclérose (Harrison et al, 2003)
Maladies d'Alzheimer, de parkinson (Sorg, 2004)
Emphysème (Lechuer-Michel et al,. 2001)
Diabète sucré (Pal Yu, 1994)
Certains cancers (Valko et al., 2007)
Anémie drépanocytaire (Martinez-Cayuela, 1995)
6. Systèmes de défenses antioxydants
Un antioxydant peut être défini comme toute
substance capable, à concentration relativement faible, d'entrer en
compétition avec d'autres substrats oxydables et ainsi retarder ou
empêcher l'oxydation de ces substrats (Berger, 2006). Les cellules
utilisent de nombreuses stratégies anti-oxydantes et consomment beaucoup
d'énergie pour contrôler leurs niveaux d'espèces
réactives de l'oxygène. Les défenses antioxydantes de
notre organisme peuvent se diviser en systèmes enzymatiques et
systèmes non enzymatiques (Goudable et Favier, 1997).
6.1. Systèmes enzymatiques
a) La superoxyde dismutase
Comme l'indique son nom, la superoxyde dismutase (SOD)
accélère la dismutation de l'anion superoxyde en peroxyde
d'hydrogène, Il existe plusieurs isoenzymes de SOD; SOD ferreux
(Fe-SOD), SOD à cuivre (Cu-SOD) et SOD à manganèse
(Mn-SOD) qui diffèrent selon la localisation chromosomique du
gène, leur contenu métallique, leur structure quaternaire et leur
localisation cellulaire (Zelko et al., 2002).
b) La catalase
Présente en particulier dans les hématies et
les peroxysomes hépatiques. Elle agit en synergie avec la SOD puisque
son rôle est d'accélérer la dismutation du peroxyde
d'hydrogène en eau et en oxygène moléculaire (Sorg,
2004).
c) Les glutathions peroxydases et
réductases
Ces deux enzymes sont localisées dans le cytosol et
dans les mitochondries. La glutathion peroxydase est une
sélénoenzyme (Se-GPx) qui joue un rôle très
important dans la détoxification du peroxyde d'hydrogène, mais
aussi d'autres hydroperoxydes résultants de l'oxydation du
cholestérol ou des acides gras en couplant la réduction de ces
dérivés réactifs avec l'oxydation de substrats
réducteurs comme le glutathion (GSH). La glutathion réductase
(GR), quant à elle, a pour rôle de régénérer
le GSH à partir du GSSG tout en utilisant le NADPH comme un cofacteur
(Martínez-Cayuela, 1995 ; Sorg, 2004).

6.2. Systèmes non enzymatiques
a. LA vitamine E
(á-tocophérol)
La vitamine E se fixe à la membrane cellulaire et
inhibe la chaîne de réactions de peroxydation des lipides en
capturant un radical lipidique peroxyle (LOO°). Elle devient
à son tour un radical moins actif que le LOO° et pourra
alors être pris en charge par une autre molécule antioxydante
(Hasani, et al., 2007)
b. La vitamine C (acide ascorbique)
L'acide ascorbique est une vitamine hydrosoluble, qui se trouve
dans le cytosol et dans le fluide extracellulaire. Elle peut capter directement
l'O2°- et l'OH°. Elle peut
aussi réduire le
c. Les caroténoïdes
Les caroténoïdes sont des pigments liposolubles
de couleur jaune, orangée à rouge, (Cuzzocrea et al.,
2001). Ce sont des piégeurs de l'1O2 et de LOO, mais ils
peuvent également neutraliser les radicaux libres. Le lycopène
piège les radicaux libres avec de l'1O2 dans les tissus
rétiniens, prévenant la dégénérescence, qui
est la première cause de cécité chez la personne
âgée (Landrum et al., 1997; Blumberg, 1997).
d. Les flavonoïdes
La famille des polyphénols, ils sont
considérés comme des pigments quasi universels des
végétaux, dont plusieurs sont responsables de couleur vive des
fleurs, des fruits et des feuilles (Pietta, 2000 ; Ghedira, 2005).
7. Les polyphénols
Les composés phénoliques sont des
métabolites secondaires, d'un poids moléculaire
élevé. Ils sont largement distribués dans le règne
végétal (Haslam, 1993). La structure de base qui les
caractérise est la présence d'un ou plusieurs noyaux aromatiques
auxquels sont directement liés un ou plusieurs groupement hydroxyles
libres ou engagés dans une autre fonction (éther, ester)
(Harborne, 1994).
7.1. Les acides phénoliques
Une fonction carboxylique et un hydroxyle phénolique.
La pratique courante en phytochimie conduit à réserver l'emploi
de cette dénomination aux seules dérivés des acides
benzoïque (acides-phénols en C6-C1) et cinnamiques
(acides-phénols en C6-C3) Comme exemple d'acides phénoliques, on
cite : acide caféique, acide protocatechique, acide ferulique, acide
sinapique et acide gallique (Hallman ,et al., 1997) Ont une distribution
très large. Ils possèdent notamment un grand pouvoir antioxydant,
c'est-à-dire qu'ils neutralisent les radicaux libres qui endommagent les
cellules, ce qui a pour effet de renforcer les défenses immunitaires
(Kim ,2000).De plus, certains composés poly-phénoliques sont des
agents antibiotiques, anti-diarrhéiques, antiulcéreux et
anti-inflammatoires. Ils peuvent ainsi être utilisés dans le
traitement des maladies comme l'hypertension, la faiblesse vasculaire, les
allergies et l'hypercholestérolémie (Kondratyuk et al., 2004).
7.2. Les tanins
Les tanins inhibent la peroxydation lipidique des
mitochondries du foie et des microsomes mais aussi l'oxydation de l'acide
ascorbique et du linoléate. Lors de la peroxydation les tannins donnent
des protons face aux radicaux libres, et ainsi des radicaux tanniques stables
sont formés. Ce qui permet de stopper la réaction en chaîne
de l'auto-oxydation lipidique. Les effets bénéfiques du
thé vert ne sont plus à prouver. Le thé par ses
polyphénols en particulier le gallate d'épigallocatéchine,
possède des propriétés antioxydantes et capte les radicaux
libres. Les polyphénols du thé vert ont en plus des
propriétés antimutagènes; des propriétés
anticancéreuses qui ont été démontrées
(Ekoumou, 2003).
7.3. Les flavonoïdes
Ce sont des pigments responsables de la coloration des fleurs,
possèdent tous un même squelette de base à 5 atomes de
carbones, constitué de 2 unités aromatiques ,2 cycles en
C6 (A et B) reliés par une chaine en
C3 (Brunton ,1999)
7.3.1. Structure et classification des
flavonoïdes
Ils ont une origine biosynthétique commune et par
conséquent, possèdent tous un même squelette de base
à quinze atomes de carbones, constitué de deux unités
aromatiques; deux cycles en C6 (A et B), reliés par un
hétérocycle en C3 (Figure7) (Brunneton,
1999; Pietta, 2000).

Figure7: Structure générale du
noyau des flavonoïdes
(D'après Heim et al., 2002)
Les 14groups différents ont été
identifiés dont six groupes sont particulièrement les
plus
répandus et les mieux caractérisés, flavones,
isoflavones, flavanones, flavanols, flavonols,
anthocyanidines (Heim et al.,
2002 ; Hendrich., 2006). Les composés de chaque classe se
distinguent entre eux par le nombre, la position et la nature
des substituants (groupements hydroxyles, méthoxyles et autres. . .) sur
les deux cycles aromatiques A et B (Heim et al., 2002). Dans les
flavonoïdes au sens strict, le Deuxième cycle benzène (B) se
lie à l'hétérocycle (C) en position 2. Lorsque la liaison
s'effectue en position 3, les composés résultants sont
appelés isoflavonoïdes. En plus, l'hétérocycle (C)
peut être une pyrone (flavone) ou son dihydrodérivé
(flavanone). La fixation d'un groupement hydroxyle (OH) sur le carbone 3 dans
les deux cas précédents constitue respectivement les flavonols et
les flavanonols (Birt et al., 2001). À l'état naturel, on trouve
très souvent les flavonoïdes sous forme de glycosides. Une ou
plusieurs de leurs fonctions hydroxyles sont alors glycosylés. La partie
du flavonoïde autre que le sucre est appelée aglycone ou
génine, l'unité glycosidique la plus commune est le glucose mais
par fois elle peut être glucorhamnose, galactose, arabinose ou rhamnose
(Heim et al., 2002).
7.3.2. Localisation et distribution des
flavonoïdes
Les flavonoïdes sont des métabolites secondaires
des plantes. Ces molécules ont été identifiées dans
presque toutes les parties de la plante : les feuilles, les racines, les tiges,
les fleures, les graines et l'écorce (Lee et al., 1994). Les
flavonoïdes sont trouvés dans les fruits, les légumes, les
noix, les herbes, les épices, aussi bien que dans le thé et le
vin rouge.
En effet, le thé, les agrumes, les pommes, l'huile
d'olive, les oignons, le cacao et plusieurs autres fruits et légumes
sont très riches en flavonoïdes, les flavanols et les flavonols y
seraient les plus abondants (Schewe et Sies, 2003).
7.3.3. Effets biologiques et pharmacologiques des
flavonoïdes
La principale propriété, initialement
attribuée aux flavonoïdes, est d'être vasculoprotectrices et
vagotoniques, car ils sont capables de diminuer la perméabilité
des capillaires sanguins et de renforcer leur résistance (Brunneton,
1999). Actuellement, les flavonoïdes sont connus par de remarquables
activités pharmaco biologiques comme entre autres des effets,
antivirales, antimicrobiens et anticancéreux (Narayana et al., 2001 ;
Seyoum et al., 2006) antiallergiques, anti-inflammatoires, anti-thrombotiques,
anti-tumoraux et hépato protecteurs (Middleton et al., 2000). Ces
activités sont attribuées en partie aux propriétés
anti-oxydantes de ces composés naturels.
7.3.4. Activité antioxydante des
flavonoïdes
Ces dernières années, une importance
particulière a été accordée aux
propriétés antioxydantes des flavonoïdes qui sont
attribuées à; (i) leur capacité de
piéger directement les RL, (ii) de chélater les
ions métalliques impliqués dans la production des ROS via
les réactions de Fenton et Haber-Weiss, (iii)
d'inhiber quelques enzymes en particulier les oxydases, (iv)
d'activer les enzymes antioxydantes et (v) de réduire
les radicaux á- tocophéryl (Cotelle 2001; Lin et
Weng.,2006 ; Heim et al., 2002).
8. Piégeage direct des radicaux libres
Les flavonoïdes (Flav-OH) sont thermo dynamiquement
capables de réduire les radicaux libres oxydants
(R
·) comme le superoxyde, le radical peroxyle, le radical
alkoxyle et le OH
· par transfert d'hydrogène.
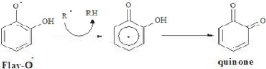
Réaction des flavonoïdes avec les ROS (D'après
Densiov et Afanas'ev, 2005)
Le radical aroxyle résultant
(Fl-O
·) peut réagir avec un autre radical
libre pour former une structure quinone stable. En outre, le radical aroxyle
peut interagir avec l'oxygène pour donner une quinone et un anion
superoxyde. La capacité des flavonoïdes d'agir comme antioxydants
dépend donc, non seulement du potentiel redox du couple Flav-
O
·/Flav-OH, mais aussi de la réactivité du radical
aroxyle. (Rice-Evans, 2001).
8.2. Inhibition enzymatique
Les flavonoïdes sont capables d'inhiber une large gamme
d'enzymes génératrices du O2 ?- et d'autres ROS,
comme la xanthine oxydase, la protéine kinase C, la cyclooxygenase,
lipooxygénase, monoxygénase microsomal, et la glutathion
S-Transferase. Les flavonoïdes ayant une moitié catéchol sur
le cycle B inhibent la succinoxidase mitochondriale et la NADH oxydase (Pietta,
2000 ; Densiov et Afanas'ev, 2005).
9. La plante médicinale Cachrys libanotis L.
9.1. Description de la plante
C'est une plante aromatique et astringique. Ses grains sont
extrêmement acarides, elle possède des pétales
lancéolés égaux et courbés à leur sommet, le
fruit très gros, ovoïdes, anguleux muni d'une écorce
épaisse et d'une substance fongueuse, a des fleurs jaunes.
9.2. Répartition
Il s'agit d'une espèce méditerranéenne
présentant dans le sud de la France, Espagne, Portugal, Italie et le
nord de l'Afrique, plus particulièrement en Algérie et en
Tunisie. Elle croît dans les coteaux arides et ensoleillés.

9.3. Classification classique
Règne : Plantae
Division : Angiospermae(spermatophyta) Classe :
Dicotyledones
Ordre : Umbelliflorae
Famille : Umblliferae
Genre : Cachrys
Espèce : Cachrys libanotis L. (tutin et al .
,1968)
9.5. Description botanique Nom en
français : Amarinthe lisse
Nom en arabe : ä !WÇ Ñ %J
Nom local : <a Ç
9.5. Utilisation traditionnel de la plante
Cette plante est utilisée traditionnellement pour
diminuer les douleurs résultantes du rhumatisme, son utilisation
était sous forme de compresse sur les articulations du genou et ainsi
utilisée pour les bébés qui avaient la difficulté
dans premier tâtant
Matériel et méthode
1. Matériel biologique
Lait bovin d'une ferme de la région de Sétif
collecté le jour de l'expérience, sang bovin de l'abattoir de
Sétif. La récolte de la plante Cachrys libanotis
L.a été effectuée au mois de décembre
2010 à la région d'Ain Touta (Wilaya de Batna).la plante a
été identifié par Professeur Oudjhih Bachir
département d'agronomie l'université de Batna
1.1. Réactifs chimiques
Dithiothreitol (DTT), bicine, sulfate d'ammonium, Sodium
Dodecyl Sulphate (SDS), gel d'héparine-agarose, xanthine, allopurinol,
cytochrome c, Quercitine, rutine, acide gallique, acide tannique, Tween 40,
Bleu de Coomassie Brillant (CBB) G250, Acrylamide, Bisacrylamide, proviennent
tous de Sigma-Aldrich, les autres réactifs et solvants (méthanol,
nbutanol, n-hexane, chloroforme, acétate d'éthyle;
Parmi l'appareillage utilisé: rotavapeur (BÜCHI),
centrifugeuse 3-K30 (Sigma), 1601 Shimadzu spectrophotomètre et le
spectrophotomètre UV-Vis à double faisceau (Techcomp).
2. Méthodes
2.1. Purification de la xanthine oxydase
La purification de la xanthine oxydase du lait bovin (BMXO) a
été conçue suivant la technique de Nakamura et Yamazaki
(1982) modifiée par Baghiani et al. (2003). le lait bovin a
été centrifugé à 5000 rpm pendant 20 minutes. La
crème extraite à partir de la centrifugation, a été
dissoute dans un tampon composé de phosphate de potassium 0,2 M, 1mM
EDTA et 5mM de DTT. Ce mélange a été soumis à une
agitation douce durant 1h 30 mn, puis recentrifugé à 5000 t/m
/20mn. Le surnagent récupéré additionné
progressivement de 15 % (V/V) du butanol froid (-20°C) et de sulfate
d'ammonium 15% (P/P), sous agitation pendant 1 heure, une fois de plus
centrifugé à 10000 T/m pendant 20 mn. Apres cette
opération, une autre filtration du surnageant sur de la laine de verre
est intervenue, d'ou la XO à été précipité
par un ajout progressif de sulfate d'ammonium 20% (P/V) sous agitation douce
durant une nuit, puis centrifugation à 11000T/M pendant 30 mn. Le
précipité (brunâtre) a été
récupéré doucement et resuspendu dans 20 ml de tampon
héparine (NaH2PO4 / Na2HPO4 25 mM, contenant 1 mM d'EDTA, (pH = 6.2), et
dialysé contre ce même tampon pendant une nuit sous agitation.
Afin d'éliminer les impuretés insolubles, le dialysat a
été centrifugé à
18000 rpm pendant 60 min. Après filtration à
travers un filtre de 45 JIm, le produit final constitue
l'extrait brut de la XO.
L'extrait brut obtenu a été déposé
sur une colonne chromatographique contenant un gel d'héparine-agarose
équilibré et lavé par le même tampon
héparine. La XO a été récupérée de la
colonne par le tampon héparine contenant 0.2 M de NaCl, et
dialysée contre un tampon Bicine 50 mM, pH 8.3, pendant une nuit. Enfin,
l'enzyme a été répartie en aliquotes de 0.5 ml et
conservée à -20 °C jusqu'à son utilisation. La
colonne a été régénérée par lavage
avec une solution de NaCl 1 M puis avec le tampon héparine pour une
nouvelle utilisation.
2.2. Contrôle de pureté de la XO
La pureté de l'enzyme purifiée a
été estimée par électrophorèse sur gel de
polyacrylamide en présence de sodium dodécyl sulfate (SDS-PAGE)
et par le rapport protéine / flavine PFR (Protein to Flavin Ratio),
correspondant à la lecture de l'absorbance aux longueurs d'ondes 280 nm
et 450 nm (A280nm / A450nm). Une valeur 5 ou proche de 5 est un bon signe de
pureté (Bray, 1975).
> L'Électrophorèse sur le gel de
polyacrylamide
L'électrophorèse sur gel de polyacrylamide
(SDS-PAGE) a été réalisée selon la méthode
de Laemmli (1970); le gel de séparation (10 % d'acrylamide et 2.74 % de
bis-acrylamide) a été préparé dans un tampon
Tris-HCl (0.125 M, pH 6.8) contenant 0.1 % de SDS (P/V) et
polymérisé par ajout de 0.042 % de N,N,N'N' Tetramethylene
diamine (TEMED) (V/V) et 0.1% de persulfate d'ammonium (P/V). Le gel de
concentration a été préparé dans le même
tampon Tris-HCl (0.125 M, pH 6.8) contenant 0.1% de SDS (P/V) et
polymérisé par ajout de 0.1% de TEMED (V/V) et 0.1% de persulfate
d'ammonium (P/V). Les échantillons (XO, environ 1 mg / ml) ainsi que les
standards des poids moléculaires (1 mg / ml) ont été
préparés dans une solution échantillon constituée
d'un tampon Tris-HCl (62.5 mM, pH 6.8), 2 % de SDS (P/V), 20 % de
glycérol (V/V) et 0.005 % de bleu de bromophénol (P/V). Ensuite,
ils ont été chauffés à 100 °C pendant 5
minutes. Les standards des poids moléculaires (Sigma) utilisés
sont de 29000 Da à 205000 Da.
La migration électro phorétique a
été réalisée dans un tampon Tris-HCl (25 mM)
contenant
0.192 M de glycine et 0.1 % de SDS (P/V) par application d'un
courant électrique de 10 mA
jusqu'à ce que les
protéines pénètrent dans le gel de séparation,
l'ampérage a été ensuite
augmenté jusqu'à 37- 45 mA. Les protéines
séparées ont été colorées pendant au moins
une heure dans une solution de bleu de Coomassie 0.2 % (P/V) contenant 10 %
d'acide acétique (V/V), 45 % de méthanol (V/V) dans de l'eau
distillée. Le gel a été ensuite décoloré par
une solution d'acide acétique 5-10 % (V/V).
2.3. Estimation de l'activité enzymatique de la
XOR
L'activité totale de la XOR a été
estimée en suivant l'augmentation de la production de l'acide urique
à 295 nm, en présence de 100 jtM de xanthine
comme substrat de l'enzyme et 500 uM de NAD+ comme accepteur
d'électrons dissous dans un tampon Bicine buffer à pH 8.3 (Avis
et al., 1956). L'activité de la forme oxydase a été
mesurée par la même méthode mais en absence de
NAD+:
L'activité enzymatique totale = l'activité de la
forme O + l'activité de la forme D
L'activité enzymatique a été exprimée
en nombre de nano mole d'acide urique produit dans une minute par milligramme
de l'enzyme (nmols / min).
2.4. Extraction des flavonoïdes Cachrys libanotis
Les racines de la plante sont préalablement
nettoyées, séchées et broyées à l'aide d'un
mortier, 200 g de la poudre de Cachrys libanotis est mise à
macérer dans un mélange méthanol/eau (85 % V/V) à
un rapport de 1/10 (P/V), sous agitation douce pendant une nuit à
température ambiante. L'extrait hydro alcoolique est
récupéré dans un premier temps après filtration du
mélange au niveau du coton puis sur verre fritté (entonnoir
N°03) pour récupérer le filtrat 1 et conservé
à 4°C. L'extraction a été
répétée une fois et le précipité a
été complété à 1 L par le méthanol
50% pour avoir le filtrat 2 qui a été mélangé avec
le filtrat 1. Le mélange obtenu a été filtré pour
la dernière fois sur papier filtre. Le méthanol est
éliminé du filtrat par évaporation sous pression
réduite dans un rotavapeur (BÜCHI). Permettant ainsi d'obtenir un
extrait caractérisé par une couleur jaune foncée, qui est
considéré comme étant l'extrait brut (EBr) de Cachrys
libanotis. Un volume 50 ml de cet extrait a été soumis
à une évaporation jusqu'à l'élimination de l'eau
puis conservé à -20°C jusqu'à son utilisation puis
déterminer leur valeur en matière sèche ainsi que le
rendement d'extraction. Le volume restant sera fractionné
ultérieurement.
2.5. Fractionnement de l'extrait brut
L'extrait brut est fractionné selon la méthode
de Markham (1982) modifié par Boumarfag (2006), en utilisant une
série de solvants à polarité croissante (Figure
8). L'extrait brut est initialement mélangé avec
l'hexane (1 V/V), après décantation la phase organique
supérieure est récupérée. Cette étape est
refaite plusieurs fois avec renouvellement du solvant jusqu'à ce qu'il
devient transparent. L'hexane est par la suite évaporé et
l'extrait résultant est considéré comme étant la
fraction de l'hexane (EHx). La phase aqueuse inférieure est soumise
à un autre fractionnement par le chloroforme pour donner l'extrait du
chloroforme (ECh), et enfin par l'acétate d'éthyle pour donner la
fraction de l'acétate d'éthyle (EAc), en suivant les mêmes
étapes que le premier fractionnement par l'hexane. Le raffinat qui en
résulte représente la fraction aqueuse (EAq) les cinq fractions
ont été conservées à -20°C jusqu'à
utilisation. (Figure8).

Figure 8:Les étapes du
fractionnement de l'extrait brut de Cachrys libanotis.
Markham
(1982)
2.5.1. Dosage des composés
phénoliques
La teneur en composés phénoliques des
différents extraits de Cachrys libanotis a été
estimée par la méthode de Folin-Ciocalteu selon (Li et
al., 2007) qui est basée sur la réduction en milieux alcalin
de la mixture phosphotungstique (WO42-) phosphomolybdique ( MoO42-) de
réactif de Folin par les groupements oxydables des composés
phénoliques, conduisant à la
formation de produits de réduction de couleur bleue.
Ces derniers présentent un maximum d'absorption à 765 nm dont
l'intensité est proportionnelle à la quantité de
polyphénols présents. La concentration des polyphénols
totaux est calculée à partir de l'équation de
régression de la gamme d'étalonnage établie avec l'acide
gallique (0-160 jtg/ml) et est exprimée en
jig d'équivalent d'acide gallique par milligramme
d'extrait (jig EAG/mg d'extrait) , dans l'échantillon
(Georgé et al., 2005). Brièvement, 1 ml de
réactif de Folin (10 fois dilué) est ajouté à 200
jil d'échantillon ou standard (préparés
dans le méthanol ou l'eau distillée) avec des dilutions
convenables, Après 4 min, 800jil d'une solution de
carbonate de sodium (75 mg/ml) sont additionnés au milieu
réactionnel. Après 2 h d'incubation à température
ambiante l'absorbance est mesurée à 765nm.
La concentration des poly phénols totaux est
calculée à partir de l'équation de régression de la
gamme d'étalonnage établie avec l'acide gallique (0-160
jig/ml) et est exprimée en jig
d'équivalent d'acide gallique par milligramme d'extrait
(jig EAG/mg d'extrait).

1,4

y = 0,0074x + 0,1167
R2 = 0,9968
|
Absorbance
|
1,2
1 0,8 0,6 0,4 0,2
0
|
0 50 100 150
concentration ug/ml
Figure 9 : courbe d'étalonnage de
l'acide gallique. Chaque point de la courbe représente la
moyenne
#177; SEM (n =3).
2.5.2. Dosage des flavonoïdes
La méthode du trichlorure d'aluminium (Bahorun et al.
1996) est utilisée pour quantifier les flavonoïdes dans les
extraits de Cachrys libanotis . À 1 ml d'échantillon ou
standard (préparés dans le méthanol) est ajouté 1
ml de la solution d'AlCl3 (2% dans le méthanol). Après 10
minutes de réaction, l'absorbance est lue à 430
nm. La concentration des flavonoïdes est déduite à partir
d'une gamme d'étalonnage établie avec la quercétine (0-40
jtg/ml) et est exprimée en microgramme
d'équivalent de quercétine par milligramme d'extrait
(jtg EQ/mg d'extrait).

1,4

y = 0,0318x + 0,0193
R2 = 0,9962
y = 0,0164x + 0,0173
R2 = 0,9935
|
Absorbance
|
1,2
1 0,8 0,6 0,4 0,2
0
|
0 10 20 30 40
ug/ml
Figure10: courbe d'étalonnage de la
Quercetine () et Rutine(?).Chaque point des deux
courbes
représente la moyenne #177; SEM (n = 3)
2.5.3. Dosage des tanins
La capacité de précipiter l'hémoglobine a
été déterminé par l'hémoanalyse en utilisant
le sang frais bovin selon la méthode décrite par Bate smith
(1973). Brièvement, un volume de sang hémolysé (absorbance
=1.6) a été mélangé avec un volume d'extraits.
L'absorbance de surnageant (4000 rpm pendant 10 min à4°c) est
mesuré à 576 nm contre une solution blanc. La courbe
d'étalonnage est construite avec l'acide tannique (0-600ug/ml) et
l'efficacité de précipitation des solutions test est
exprimée par équivalent d'acide tannique.
0,9
0,8
0,7
absorbance
0,6
0,5
0,4
0,3
0,2

0,1
0
0 200 400 600 800
concentration ug/ml
Figure11: courbe d'étalonnage de
l'acide tannique. Chaque point de la courbe représente la
moyenne
#177; SEM (n = 3).
2.5.4. Inhibition de l'activité de la xanthine
oxydase par les extraits de Cachrys libanotis
L'effet inhibiteur des extraits de Cachrys libanotis
sur l'activité de la XO a été étudié
spectrophotométriquement en suivant la quantité de l'acide urique
produit par oxydation de 100 uM de xanthine dissous dans un tampon phosphate de
sodium saturé on air (Na2HPO4 / NaH2PO4, 50 mM, pH 7.4, contenant 0.1 mM
d'EDTA), en présence de plusieurs concentrations de chaque extrait de
Cachrys libanotis (préparées dans le tampon phosphate de
sodium ou dans le méthanol) (Robak and Gryglewski, 1988 ; Boumerfeg et
al., 2009). L'absorbance a été lue à 295 nm, et
l'activité inhibitrice de ces extraits a été
comparée par rapport au standard allopurinol qui est l'inhibiteur
spécifique de la XO. Après ajout de la XO, la réaction a
été suivie pendant 60 secondes et l'activité inhibitrice
des extraits de Cachrys libanotis a été exprimée en
pourcentage d'inhibition (I %) calculé ainsi:
I % = [(AC - AE) / AC] × 100
AC: absorbance en absence de l'inhibiteur (contrôle
négatif) AE: absorbance en présence de l'inhibiteur
la concentration de l'inhibiteur (Y = a X + b). Elle a
été exprimée en mg/ml et comparée avec celle de
l'allopurinol; IC50 = (50 - b) / a
2.5.5. Effet scavenger des extraits de cachrys
libanotis sur O2°- produit par la XO
L'effet scavenger des extraits de Cachrys libanotis
sur l'O2°- produit par la XO a été
déterminé en suivant la réduction du cytochrome c à
550 nm (Robak and Gryglewski, 1988). Le milieu réactionnel a
été composé d'un tampon phosphate de sodium (50 mM, pH
7.4, 0.1 mM d'EDTA) bien saturé en oxygène aérien,
contenant 100 uM de xanthine et 25 uM de cytochrome c et en présence de
plusieurs concentrations de chacun des extraits de Cachrys libanotis
(préparées dans le méthanol ou dans le tampon
phosphate de sodium). La réaction est suivie pendant 60 secondes
après ajout de la XO. L'activité inhibitrice de la
réduction du cytochrome c par les extraits de Cachrys libanotis
a été exprimée en pourcentage d'inhibition (I %)
calculé ainsi:
I % = [(AC - AE) / AC] × 100
AC: absorbance en absence de l'extrait (contrôle
négatif)
AE: absorbance en présence de l'extrait
L'IC50 de chaque extrait (concentration
inhibitrice de la réduction de 50 % du cytochrome c) a été
par la suite calculée à partir de l'équation qui
détermine le pourcentage d'inhibition en fonction de la concentration de
l'extrait.
RESULTATS ET DISCUSSION
1. Purification, contrôle de pureté et
estimation de l'activité de la XO
La purification de la XO a été
réalisée par la méthode décrite par Nakamura et
Yamazaki (1982) modifiée par Baghiani et al., (2003) à
partir du lait bovin frais, par une série de centrifugations puis
précipitation au sulfate d'ammonium, suivie d'une chromatographie
d'affinité sur colonne de gel d'héparine basée sur
l'affinité de la XO aux glycosaminoglycanes sulphatés. Le
rendement de la purification est de 17.97 mg d'enzyme
purifiée par litre du lait bovin frais. Il est similaire à ce qui
est trouvé par Baghiani et al., (2002; 2003).
Le spectre d'absorption caractéristique de la XO par un
balayage spectrophotométrique (UVVis) a présenté trois
pics majeurs à 280, 325 et 450 nm (Figure 12A) qui est
similaire aux résultats obtenus par les travaux de Abadeh et al.,
(1992), Baghiani et ses collaborateurs (2002; 2003), Benboubetra et al, (2004).
Le rapport protéine / flavine PFR a été calculé
comme suit: A280nm / A450nm. La XOR purifiée a un PFR de7.18, donc
l'enzyme purifiée a une pureté acceptable parce qu'une valeur
proche de 5 est considérée comme critère de pureté
(Bray, 1975).
La pureté de l'enzyme a été
confirmée par une électrophorèse (SDS-PAGE). Le chemin
électrophorétique a présenté une bande majeure
d'approximativement 150 KDa (Figure12B) ce qui est similaire
aux résultats des études effectués en 2003 par Baghiani et
ses collaborateurs, et en 2004 par Atmani et ses collaborateurs.


PM 1 2
150 000
PM
220 000
100 000
65 000
40 000
30 000
Figure 12: Spectre d'absorption UV-Vis
(A), électrophorèse (SDS-PAGE)
(B) de la XO purifiée. B1: XO pure
(150 000 Da), B2: Standards des poids moléculaires (220
000; 100 000; 65000; 40 000; 30 000)
L'activité totale et l'activité de la forme
oxydase de l'enzyme purifiée a été estimée en
présence de xanthine comme un substrat réducteur et de NAD+ et
d'O2 comme substrat oxydant, et le pourcentage de la forme oxydase a
été par la suite calculé. Donc, l'enzyme pure a
présenté une activité totale de 2261 nmol / min / mg
protéine, et le pourcentage de la forme oxydase (XO) de l'enzyme a
été de 89 % (Tableau 2). Ces résultats
sont similaires à ceux de Baghiani et al., (2003), qui indiquent, que
l'activité de la XOR du lait des différentes espèces
mammifères est liée à la forme inactive démolybdo
de l'enzyme.
Tableau 2: L'activité totale et oxydase
de la XOR purifiée à partir du lait bovin frais.
Activité (nmol /min / mg protéine)*
Pourcentage de Rapport
la forme protéine/flavine
Totale Forme oxydase (XO) oxydase (XO) (PFR)
2261 2011 89 7.18
2. Extraction et dosage des polyphénols, des
flavonoïdes et des tannins
L'extraction des flavonoïdes de la racine de Cachrys
libanotis a été effectuée par les solvants organiques
à partir d'une poudre végétale. Cette extraction a permis
d'obtenir cinq extraits. Selon Newman et al., (1974) et Markham et
al., (1982) les composés que pourraient contenir les
différents extraits préparés seraient comme suit:
l'extrait brut peut contenir des flavonoïdes, des acides aminés,
des terpènes, des cires et des tannins, l'extrait d'hexane qui est en
générale constitué de lipides et de flavonoïdes
aglycones hautement méthoxylés, l'extrait du chloroforme est plus
riche en flavonoïdes aglycones, l'extrait d'acétate d'éthyle
contient les flavonoïdes glycosylés en particulier mono, di et
tri-glycosylés et l'extrait aqueux peut être constitué des
flavonoïdes les plus polaires (di, tri et tetra-glycosylés).
Le calcule des rendements par rapport au poids de la poudre
végétale (Tableau 3) a montré que l'EBr a
(15.2 #177; 0.16 %),. l'ECh a un rendement de (0.26 #177;
0.007 % )qui est 7 fois inférieur à celui de l'EAq, l'EAc (0.208
#177; 0.008 %) est le plus faibles et 7 fois inférieurs à celui
de l'EAq et enfin l'EAq représente le rendement le plus
élevé (7.38 #177; 0.10%)
Tableau3: Le rendement des extraits de Cachrys
libanotis et ses teneurs en polyphénols totaux, tanins et en
flavonides.
|
Rendement
|
Polyphénols
|
Flavonoïdes
|
|
|
Les
|
(%)
|
totaux
|
Tanins
|
|
|
|
extraits
|
|
(mgEAG/g E)
|
mg EQ / g E
|
mg ER / g E
|
|
|
EBr
|
15.2 #177; 0.16
|
175.34 #177; 1.42
|
0.50 #177; 0.0069
|
1.24 #177; 0.03
|
0.055 #177; 0.004
|
|
ECh
|
0.26 #177; 0.007
|
12.90 #177; 6.014
|
0.002 #177;0.0011
|
0.067 #177; 0.022
|
0.08 #177; 0.018
|
|
EAc
|
0.208 #177; 0.008
|
17.30 #177; 2.033
|
0.26 #177; 0.28
|
0.38 #177; 0.29
|
0.1 #177; 0.015
|
|
EAq
|
7.38 #177; 0.10
|
124.64 #177;.1.077
|
0.39 #177; 0.011
|
1.062 #177; 0.003
|
0.06 #177; 0.005
|
Chaque valeur représente la moyenne #177; SEM (n = 3).
majorité des effets pharmacologiques des plantes est
dû à ces substances, un dosage des polyphénols totaux et
des flavonoïdes des quatre extraits (EBr, ECh, EAq et EAc) de
Cachrys libanots, a été effectué pour en
estimer les teneurs.
Les polyphénols totaux dans ces extraits sont
dosés selon la méthode de Folin-Ciocalteu selon (Li et
al., 2007). D'après les résultats présentés
dans le (Tableau 3), l'EBr (175.34 #177; 1.42
ug EAG/g E), pour l'ECh qui contient presque la moitié de la
quantité de polyphénols trouvée dans l'ECh (12.90 #177;
6.01 ug EAG/g E) l'EAc (17.30 #177; 2.033). L'EAq est le plus riche en
polyphénols (124.64 #177; 1.077 ug EAG/g E). La détermination des
taux des flavonoïdes par la méthode de trichlorure d'aluminium
révèle que l'EBr représente la fraction la plus riche en
flavonoïdes avec une teneur (0.50 #177; 0.006mg EQ / g E), ensuite l'EAq
avec (0.39 #177; 0.01 mg EQ/g E) et enfin l'EAc et l'ECh (0.26 #177; 0.28 ;
0.002 #177; 0.001mg EQ/g E ) Si les calcules sont effectués à
partir de la courbe d'étalonnage de la rutine, la concentration des
flavonoides dans ces extraits est doublée parce que la pente de la
courbe d'étalonnage de la rutine égale à la moitié
de celle de la quercétine (Figure 10, section
matériel et méthodes).pour les tanins, selon nos resultats on
peut considerer que la partie racine la plante de Cachrys libanotis
est pauvre des tanins.(Tableau 3)
3. Inhibition de la xanthine oxydase par les extraits
de Cachrys libanotis
L'effet inhibiteur des extraits de Cachrys libanotis
sur l'activité de la XO du lait bovin a été
évaluée spectrophotométriquement à 295 nm. Les
résultats obtenus montrent que tous les extraits inhibent
l'activité de la XO très significativement d'une maniére
dose depandante.(Figure 13)
A

Inhibition %
100
40
80
60
20
0
0 0,5 1 1,5 2 2,5
Concentration mg/ml
B
0 0,05 0,1 0,15 0,2 0,25

Inhibition %
100
40
80
60
20
0
Concentration mg/ml
C
0 0,05 0,1 0,15 0,2 0,25

Inhibition %
100
40
80
60
20
0
Concentration mg/ml
Figure 13 : Effet inhibiteur des extraits de
Cachrys libanotis. Chaque point représente la
moyenne #177;
SD (n = 3). (A) : Extrait brut, (B) : Extrait chloroform, (C) : Extrait
éthyl acétate
(IC50 = 0.138 #177; 0.002 mg/ml, 1.048 #177;
0.001 mg/ml), respectivement. L'ECh et l'EAc ont un effet presque 32 et 26 fois
inferieur à l'allopurinol (IC50 = 0.00419#177;0.00036)
(Adjadj, 2009), respectivement, alors que l'EBr est presque 250 fois plus
faible.




Figure14: Les concentrations des extraits de
Cachrys libanotis, qui inhibent 50 % de
l'activité de la XO.
Chaque valeur représente la moyenne #177; SD (n = 3).
Il existe des substances qui inhibent la XO en bloquant la
fixation du substrat au sites actifs de l'enzyme (Skibo, 1986; Sanders et
al., 1997), donc l'inhibition de l'activité de la XO par les
extraits Cachrys libanotis est traduite par la présence d'un ou
de plusieurs composés agissant sur les sites actifs, Mo et FAD, de
l'enzyme. Chose qui confirme la corrélation entre nos résultats
de l'activité inhibitrice de l'enzyme, cette activité peut etre
attribuée à la presence des flavonoides glycosylés. De
nombreuses études ont évalué l'effet inhibiteur de
différentes plantes sur l'activité de la XO (Owen and Johns,
1999; Kong et al., 2000; Sweeney et al., 2001; Zhu et
al., 2004; Ferraz Filha et al., 2006; Umamaheswari et
al., 2007; Boumerfag et al.,2009 ;Baghiani et al., 2010), cette
activité inhibitrice est peut être attribuée a la
présence de différents composés bioactifs tels que les
polyphénols (Costantino et al., 1992; Chiang et al.,
1994), les tannins (Schmeda-Hirschmann et al., 1996) et les
flavonoïdes (Iio et al., 1985; Hanasaki et al., 1994;
Cos et al., 1998; Lin et al., 2002; Van Hoorn et
al., 2002; Da Silva et al., 2004).
Cos et ses collaborateurs (1998) ont déterminé la
relation entre la structure chimique des
flavonoïdes et leurs
activités inhibitrices de la XO. Ils ont montré que la
présence de la double
liaison entre les carbones C2 et C3 et
l'absence du groupe hydroxyle en C3 des flavonoïdes
augmentent leur activité inhibitrice. Malgré que
les deux extraits Ch et l'Ac contenant une quantité faible en
flavonoides comparent a l'EBr, il ce peut que l'ECh et EAc contient des
substances avec une structure spécifique qui pourraient être
à l'origine de son activité inhibitrice le plus puissante.
4. Effet scavenger des extraits de Cachrys libanotis
sur l'O2°- produit par la XO
Pour étudier l'effet scavenger des extraits de
Cachrys libanotis sur l'anion superoxyde produit par la XO, la
réduction du cytochrome c (cyt c) par l'O2°- a
été suivie à 550 nm. Les résultats ont
montré que les extraits inhibent la réduction du cyt c, d'une
manière dose-dépendante (Figure15). Les
résultats des IC50 des trois extraits de
Cachrys libanotis sont représentés dans le
(Tableau 5). L'effet inhibiteur de la réduction du cyt
c le plus puissant est celui de l'ECh (IC50 = 0.222 #177;
0.001mg/ml), suivie par EAc (IC50 = 0.415 #177; 0.015mg/ml)
qui a un effet presque 2 fois inférieur à celui de l'ECh et
6.5 fois superieur à celui de l'EBr qui est le plus
faible (IC50 = 2.68 #177; 0.084mg/ml).
Tableau 5:les concentrations des extraits de
Cachrys libanotis , qui inhibent la reduction de 50% du cyt c par
l'O2°- produit par la XO.
|
Les extraits
|
EBr
|
|
ECh
|
|
EAc
|
|
|
IC50 (mg/ml)
|
2.68
|
#177; 0.084
|
0.222
|
#177; 0.001
|
0.415
|
#177; 0.015
|
A
|
Inhibition %
|
100 80 60 40 20 0
|
|
0 2 4 6
Concentration mg/ml
B
|
Inhibition %
|
100 80 60 40 20 0
|
|
|
|
0 0,2 0,4 0,6
Concentration mg/ml
C

Inhibition %
100
40
80
60
20
0
0 0,5 1
Concentration mg/ml
Figure 15 : Effet scavenger des extraits de
Cachrys libanotis. Chaque point représente la
moyenne #177;
SD (n = 3). (A) : Extrait brut, (B) : Extrait chloroform, (C) : Extrait
éthyl acétate
L'inhibition de la réduction du cyt c est dû
à l'effet inhibiteur de la XO et / ou l'effet scavenger sur
l'O2°- produit par cette enzyme (Valentao et al.,
2002). Les IC50 des trois extraits de Cachrys
libanotis, sont représentés dans la (Figure
16) Pour l'EBr, IC50 de la production de l'acide urique
à partir de l'oxydation de la xanthine par la XO est presque 2.5 fois
plus faible que celle inhibitrice de la réduction du cyt c. La
même chose pour l' l'EAc qui a une IC50 de la réduction
cyt c presque 4 fois supérieur à celle inhibitrice de la XO.
Alors que l'ECh a une IC50 de la réduction
du cyt c presque double de celle inhibitrice de la XO.
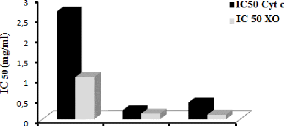

Figure 16: Effet inhibiteur de la
réduction du cyt c par l'O2° produit par la XO des
extraits de
Cachrys libanotis. Chaque point représente la
moyenne #177; SD (n = 3).
L'effet scavenger des radicaux libres par les
différents constituants des plants est peut être dû aux
acides phénoliques (Kimura et al., 1985; Hatono et
al., 1989) et aux flavonoïdes (Hatono et al., 1989).
Plusieurs études ont établi des relations entre les structures
chimiques des flavonoïdes et leur capacité à piéger
les radicaux libres (Jovanovic et al., 1994; Cotelle et al.,
1996; Bors et al., 1997; Cos et al., 1998; Dugas et
al., 2000). Les composés les plus actifs sont ceux qui combinent
les trois critères suivants: la structure ortho-dihydroxy sur le cycle B
(groupement catéchol), la double liaison -C3 adjacente
à la fonction 4-oxo et la présence du groupe 3-OH en combinaison
avec la double liaison -C3 (Rice-Evans et al., 1996; Furuno
et al., 2002). Selon Cos et
al.la classification des flavonoïdes qui
possèdent un effet inhibiteur de l'enzyme et au même temps une
activité anti radicalaire. Ces substances peuvent être classer
à la class C, cette classe a une propriété très
spécifique qui contient un hydroxyle au niveau du carbone
(-C3).malgré que l'ECh a un teneur de flavonoïde plus faible que
l'EAc et l'Br l'ECh est le plus elevée comme scavenger, ce qui peut
indiquer que les extraits contient des molécules avec une structure
spécifique pour l'activité scavenger.
On conclusion, les résultats de notre présent
travail montrent que les deux extraits de Cachrys libanotis, ECh et
EAc ont un effet relativement élevé sur l'inhibition de l'acide
urique et la réduction du cyt c, ce qui est peut être dû
à la richesse des deux extraits en polyphénols et en
flavonoïdes specifique . La diminution de la production de l'acide urique
est suivie par une diminution de la production de l'anion superoxyde. Donc,
l'inhibition de la réduction du cyt c par les extrais de Cachrys
libanotis.L est dû soit à l'inhibition de la XO ou à
l'effet scavenger sur le radical superoxyde, ce qui est en accord avec les
résultats de Fridovich (1970). Wu et Ng (2008) ont
démontré que les extraits de Momordica charantia
abbreviata possèdent un
effet inhibiteur de la XO et un effet scavenger sur le
superoxyde très élevés. Les résultats de notre
travail ont montrés que l'ECh possède un effet scavenger proche
à celui de l'inhibition de la XO, alors que les deux extraits (EAc et
EBr) ont un effet inhibiteur plus élevé que leur effet scavenger
sur le superoxyde.
REFERENCES BIBLIOGRAPHIQUES
Abadeh S., Killacky J., Benboubetra M. and Harrison R. (1992).
Purification and patial characterisation of xanthine oxidase from human milk.
Biochem. Biophys. 1117, 25- 32.
Adjadj .M.(2009),Propriétés antioxydantes et
activité inhibitrice de la xanthine oxydase des extraits de la plante
Médicinale Ajuga iva. Département de biologie Animale
86,pp(51-52)
Amaya, Y., Yamazaki, K., Sato, M., Noda, K., Nishino, T.,
Nishino, T. (1990) Proteolytic conversion of xanthine dehydrogenase from the
NAD-dependent type to the O2- dependent type. Amino acid sequence of rat liver
xanthine deshydrogenase and identification of the cleavage
sites of the enzyme protein during irreversible conversion by trypsin. J.
Biol. Chem. 265: 14170-14175
Atmani D., Benboubetra M. and Harrison H. (2004). Goat's milk
xanthine oxidoreductase is grossly deficient in molybdenum. J. Dairy Res.
71, 7-13.
Avis P.G., Bergel F. and Bray R.C. (1956). Cellular constituents.
The chemistry of xanthine oxidase. Part III. Estimations of the cofactors and
the catalytic activities of enzyme fractions from cow's milk. Journal of
the Chemistry Society, 1219-1226
Babior, B.M., Lambeth, J.D., Nauseef, W. (2002) The neutrophil
NADPH Oxidase. Archive of Biochemistry and Biophysics. 397:
342-344.
Baghiani A., Arrar, L., Benboubetra, M. (2002) Purification and
comparative kinetic study of the milk molybdoflavoenzyme, xanthine
oxidoreductase, from different species. In «Chapman S., Perham R.
Scrutton N. and Weber R. (Eds.), Flavins and flavoproteins 2002».
Agency for Scientific Publications, Berlin. pp: 837-844.
.
Baghiani, A., Harrison, R., Benboubetra, M. (2003) Purification
and partial characterisation of camel milk xanthine oxidoreductase. Arch.
Physiol. Biochem. 111: 407-414.
Bahorun, T., Gressier, B., Trotin, F., Brunete, C., Dine, T.,
Vasseur, J., Gazin, J.C., Pinkas, M., Luycky, M., Gazin, M. (1996) Oxygen
species scavenging activity of phenolic extracts from hawthorn fresh plant
organs and pharmaceutical preparations. Arzneimittel-Forschung. 46:
1086-1089.
Bartosz, G. (2003) Generation of reactive oxygen species in
biological systems. Comments on Toxicology. 9: 5-21.
Beckman, K.B., Ames, B.N. (1998) The free radical theory of aging
matures. Physiological reviews. 78: 547-581.
Benboubetra M., Baghiani A., Atmani D. and Harrison H. (2004).
Physiochemical and kinetic properties of purified sheep's milk xanthine
oxidoreductase. J. Dairy Sci. 87, 1580- 1584.
Berger, M.M. (2006) Manipulations nutritionnelles du stress
oxydant : état des connaissances. Nutrition Clinique et
Métabolisme. 20: 48-53
Berry, C.E., Hare, J.M. (2004) Xanthine oxidoreductase
and cardiovascular disease: molecular mechanisms and
pathophysiological implications. J. Physiol. 555 (3):
589- 606.
Beta T., Nam S., Dexter J.E. and Sapirstein H.D. (2005).
Phenolic content and antioxidant
activity of pearled wheat and Roller-Milled
fractions. Cereal Chem. 82, 390-393
Birt, D.F., Hendrich, S., Wang, W. (2001) Dietary agents in
cancer prevention: flavonoids and isoflavonoids. Pharmacology &
therapeutics. 90: 157-177
Blake D.R., Stevens C.R., Sahinogla T.M., Ellis G., Gaffney
K., Edmonds S., Benboubetra M., Harrison R., Jawed S., Kanezler J., Miller
T.M., Winyord P.G. and Zhang Z. (1997). Xanthine oxidase; four roles for the
enzyme in rheumatoid pathology. Biochem. Soc. Trans.
25, 812-816
Blumberg,J.,Frei. B. 2007 . Why clinical trials of vitamin E
and cardiovascular diseases may be fatally flawed . commentary on «the
Realationship Between dose of vitamin E and
suppression of oxidative stress in Humans .Free Radical Biology
and Medicine. 43:1374-1376.
Bonnefont-Rousselot, D., Thérond, P., Delattre, J.
(2003) Radicaux libres et anti-oxydants. IN : Biochimie pathologique:
aspects moléculaires et cellulaires. Delattre, J ., Durand, G .,
Jardillier, J.C. Eds: Médecine-sciences. Flammarion (Paris),
Pp: 59-81
Bors W., Michel C. and Stettmaeir K. (1997). Antioxidant effects
of flavonoids. Biofactors. 6, 343-355.
Boumerfeg, S., Baghiani, A., Messaoudi, D., Khennouf, S., Arrar,
L. (2009) Antioxidant properties and xanthine oxidase inhibitory effect of
Tamus communis L. root extracts. Phytotherapy Research.
23: 283-288
Bray R.C. (1975). Molybdenum iron-sulfer flavin hydroxylases and
related enzymes. In '' Boyer P.D (Eds.), The enzymes" 3rd
Ed. Academic Press, New York. pp: 299-419.
Brunneton J (1999). Flavonoïdes. In : Pharmacognosie,
Phytochimie: Plantes médicinale, 3ème édition,
Technique et Documentation (Paris), pp: 310-353.
Burdon R.H. and Gill V. (1993). Cellular generated active oxygen
species and Hella Cell proliferation. Free Rad. Res. Comm.
19, 203-213
Chiang H.C., Lo Y.J. and Lu F.J. (1994). Xanthine oxidase
inhibitions from leaves of Alsophila spinulosa (Hook) Tryon.
Journal of Enzyme Inhibitions 8, 61-71.
flavonoids as inhibitors of xanthine oxidase and superoxide
scavengers. J. Nat. Prod. 61, 71-76.
.
Costantino L., Albasini A., Rastelli G. and Benvenuti S.
(1992). Activity of polyphenolic crude extracts as scavengers of superoxide
radicals and inhibitors of xanthine oxidase. Planta Med.
58, 342-345.
Cotelle N., Bernier J.L., Catteau J.P., Pommery J., Wallet J.C.
and Gaydou E.M. (1996).
Antioxidant properties of hydroxy-flavones. Free
Radic. Biol. Med. 20, 35-43.
Cotelle, N. (2001) Role of flavonoids in oxidative stress.
Current topics in medicinal chemistry. 1: 569- 590.
Da Silva S.L., Da Silva A., Honório K.M., Marangoni S.,
Toyama M.H. and Da Silva A.B.F. (2004). The influence of electronic, steric and
hydrophobic properties of flavonoid compounds in the inhibition of the xanthine
oxidase. Journal of Molecular Structure (Theochem)
684, 1-7.
Del Rio, L.A., Corpos, F.J., Sandalio, L.M.., Corpas, F.J.,
Pastori, G.M., Bueno, P., LopezHuertas, E. (1996) Peroxisoms as a source of
superoxide and hydrogen peroxide in stressed plants. Biochemical Society
Transactions. 24: 434-438.
Della Corte E. and Stirpe F. (1968). The regulation of rat liver
xanthine oxidase: activation by proteolytic enzymes. European Journal of
Biochemistry Letters. 2, 83-84.
Della Corte E. and Stirpe F. (1972). The regulation of rat
liver xanthine oxidase: involvement of thiol groups in the conversion of the
enzyme activity from dehydrogenase (type D) into oxidase (type O) and
purification of the enzyme. Biochem. J. 126,
739-745.
Della Corte, E., Gozzetti, G., Novello, F., Stirpe, F. (1969)
Properties of the xanthine oxidase from human liver.
Biochim. Biophys. Acta. 191: 164-166.
Densiov, E.T., Afanas'ev, I.B. (2005) IN: Oxidation and
antioxidants in organic chemistry and biology. Eds: Taylor &
Francis Group (U.S.A), Pp: 703-861.
Dugas A.J., Castaneda-Acosta J., Bonin G.C., Price K.L.,
Fischer N.H. and Winston G.W. (2000). Evaluation of the total peroxyl
radical-scavenging capacity of flavonoids: structure-activity relationships.
J Nat Prod. 63, 327-331
Edge, R., Mcgarvey, D. J., Truscott, T. G. (1997) The carotenoids
as antioxidants. Journal of Photochemistry and Photobiology: B,
Biology. 41: 189-200
Ekoumoun(2003).Etude phytochimique et pharmacologique de 5
recettes traditionlles utilizes dans le traitement des infections urinaires et
la cystite .these de doctorat de l'université de Bamako
Enroth, C., Eger, B.T., Okamoto, K., Nishino, T., Nishino, T.,
Pai, E.F. (2000) Crystal structures of bovine milk xanthine
dehydrogenase and xanthine oxidase: structure-based mechanism
of conversion. Proc. Natl. Acad. Sci. U S A. 97:
10723-10728
Evans.WJ.(2000).Vitamin E,VitaminC ,and exercise.Am.Jchimi
.Natur.72, 6475-6525.
Favier A. (2003). Le stress oxydant. Intérêt
conceptuel et expérimental dans la compréhension des
mécanismes des maladies et potentiel thérapeutique.
L'actualité chimique, 108- 115.
Fridovich I. (1970). Quantitative aspects of the production of
superoxide anion radical by milk xanthine oxidase. J. Biol. Chem.
245, 4053-4057
Friedl H.P., Till G.O., Ryan U.S. and Ward P.A. (1989).
Mediator-induced activation of xanthine oxidase in endothelial cells. FASEB
J: Officinal Publication of the Federation of American Societies for
Experimental Biology. 3, 2512-2518
Furuno K., Akasako T. and Sugihara N. (2002). The contribution of
the pyrogallol moiety to the superoxide radical scavenging activity of
flavonoids. Biol. Pharm. Bull. 25, 19-23
Georgé, S., Brat, P., Alter, P., Amiot, J.M. (2005) Rapid
determination of polyphénols and vitamin C in plant-derived products.
Journal of Agricultural and Food Chemistry. 53: 1370-1373.
Ghedira, K. (2005) Les flavonoïdes : structure,
propriétés biologiques, rôle prophylactique et emplois en
thérapeutique. Phytothérapie. 4: 162-169
Goudable, J ., Favier, A. (1997) Radicaux libres
oxygénés et antioxydants. Nutrition Clinique et
Métabolisme. 11: 115-20
Granger, D.N., Rutili, G., McCord, J.M. (1981) Superoxide
radicals in feline intestinal ischemia. Gastroenterology.
81: 22-29.
Halliwell, A., Gutteridge, J.M.C. (1999) The antioxidant of human
extracellular fluids. Archives of biochemistry and biophysics. 280:
1-8.
Halliwell, B. (1994) Free radicals and antioxidants: a personal
view. Nutr. Rev. 52: 253-265.
Halliwell, B. (1996) Ascorbic acid in the prevention and
treatment of cancer. Alternative Med. Rev. 3:
174-186.
Halliwell, B., Whiteman, M. (2004) Measuring reactive species and
oxidative damage in vivo and in cell culture : how should you do it
and what do the results mean?. British journal of pharmacology. 142:
31-2.
Hanasaki Y., Ogawa S. and Fukui S. (1994). The correlation
between active oxygens scavenging and antioxidative effects of flavonoids.
Free Radic. Boil. Med. 16, 845- 850.
Hancock J.T., Salisbury V., Ovejero-Boglione M.C., Cherry R.,
Hoare C., Eisenthal R. and Harrison R. (2002). Antimicrobial properties of
milk: dependence on presence of xanthine oxidase and nitrite. Antimicrob.
Agents. Chemother. 46, 3308-3310
Harbone ,J.B. (1994). Phenolics in natural products : their
chemistry and biological significance Eds .Mann J. Davidson RS, Hobbs JB
.Longman (London),chap 6:361- 388
Harrison R. (2002) Structure and function of xanthine
oxidoreductase: where are we now? Free Radical Biology and Medicine.
33, 774-797.
Hasani, P., Yasa, N., Vosough-Ghanbari, S., Mohammadirad, A.,
Dehghan, G., Abdollahi, M. (2007) In vivo antioxidant potential of
Teucrium polium, as compared to á-tocopherol. Acta
Pharmceutica. 57: 123-127. O0166101, 2001
Hatono T., Edamatsu R., Hiramatsu M., Mori A., Fujita Y.,
Yasuhara T., et al. (1989). Effects of the interaction of tannins with
co-existing substances VI. Effects of tannins and related polyphenols on
superoxide anion radical and on DPPH radical. Chemical & Pharmaceutical
Bulletin 37, 2016-2021.
Heim, E.K., Tagliaferro, A.R., Bobilya, D.J. (2002) Flavonoid
antioxidants : chemistry , metabolism and structure-activity relationships.
The Journal of Nutritional Biochemistry. 13: 572-584.
Hendrich, A.B. (2006) Flavonoid-membrane interactions : possible
consequence for biological effects of some polyphenolic compounds. Acta
pharmacologica Sinica. 27: 27-40.
Hille, R., Massey, V. (1981) Studies on the oxidative
half-reaction of xanthine oxidase. J. Biol. Chem.
256: 9090-9095
Hille, R., Nishino, T. (1995) Xanthine oxidase
and xanthine dehydrogenase. FASEB. J.
9: 995-1003
Huang Y.T., Ghio A.J., Nozik-Grayck E. and Piantadosi C.A.
(2001). Vascular release of nonheme iron in perfused rabbit lungs. American
Journal of Physiology. 280, 474-481.
Iio M., Moriyama A., Matsumoto Y., Takaki N. and Fukumoto M.
(1985). Inhibition of Xanthine oxidase by flavonoids by folate compounds and
amethopterin. Journal of Biological Chemistry 259,
12-15.
Jovanovic S.V., Steenken S., Tosic M., Marjanovic B. and Simic
M.G. (1994). Flavonoids as antioxidants. J. Am. Chem. Soc.
116, 4846-4851.
Jung, T,. Bader, N., Grune, T. (2007) Oxidized proteins :
intracellular distribution and recognition by the proteasome. Archives of
Biochemistry and Biophysics. 462: 231- 237.
Kimura Y., Okuda T., Hatono T., Agata I., and Arichi S.
(1985). Effects of extracts of leaves of Artemisia species and caffeic acid and
chlorogenic acid on lipid metabolic injury in rats fed peroxidized oil.
Chemical & Pharmaceutical Bulletin 33,
2028-2034
Koechlin-Ramonatxo, C. (2006) Oxygen , oxidative stress and
antioxidant supplementation ,or an other way for nutrition in respiratory
diseases. Nutrition clinique et métabolique. 20:165-177.
Kohen, R., Nyska, A. (2002) Oxidation of biological systems :
oxidative stress phenomena, antioxidants, redox reactions and methods for their
quantification. Toxicologic Pathology. 30: 620-650
Kondratyuk.TP.Pezzutoj.M. (2004)Natural product polyphenols of
relevance to humain helth .Journal of Agriculture and Food. Chemistry 52
France, 2004, 1344-1349
Kong L.D, Cai Y., Huang W.W., Cheng C.H. and Tan R.X. (2000).
Inhibition of xanthine oxidase by some Chinese medicinal plants used to treat
gout. J. Ethnopharmacol. 73, 199-207.
Kooij A., Bosch K.S., Frederiks W.M., Van Noorden C.J.F.
(1992) High levels of xanthine oxidoreductase in endothelial, epithelial and
connective tissue cells in rat tissues. A relation between localization and
function. Virchows Archiv [B] Cell Pathology 62,
143-150
Krenitsky, T.A., Tuttle, J. V., Cattau, E.L., Wang, P. (1974)
A comparison of the distribution and electron acceptor specificities of
xanthine oxidase and aldehyde oxidase. Comp. Biochem.
Physiol. B. 49: 687-703.
Laemmli U.K. (1970). Cleavage of structural proteins during the
assembly of the head of bacteriophage T4. Nature 227,
680-685.
Landrum JT,Bone RA, Joa H, et al. (1997) A one year study of the
macular pigment: the effect of 140 days of a lutein supplement .Exp Eye Res .
1997;57-62
Lee, Y.J., Erdos, G., Hou, Z., Kim, S.H., Kim, J.H., Cho, J.M.,
Corry, P.M. (1994)Mechanism of quercetin-induced suppression and delay of heat
shock gene expression and thermotolerance
Lehucher-Michel, M.P., Lesgards, J.F., Delubac, O., Stocker, P.,
Durand, P., Prost, M. (2001) Stress oxydant et pathologies humaines. La
Presse médicale. 30: 1076-1081.
Li, H.B., Cheng, K.W., Wong, C.C., Fan, K.W., Chen, F., Jiang, Y.
(2007) Evaluation of
antioxidant capacity and total phenolic content of different
fractions of selected microalgae. Food chemistry.
102: 771-776.
Lin C.M., Chen C.S., Chen C.T., Liang Y.C. and Lin J.K.
(2002). Molecular modeling of flavonoids that inhibits xanthine oxidase.
Biochem. And Biophys. Res. Commun. 294, 167-172.
Lin, J.K., Weng, M.S. (2006) Flavonoids as Nutraceuticals. In :
The science of flavonoids. Grotewold,.Eds, Springer, Pp:
217.
Markak, A. (2003). Radiolyse gamma des flavonoïdes. Etude
de leur réactivité avec les radicaux issus des alcools :
Formation de depsides. Thèse pour obtenir le grade de Docteur de
l'Université de Limoges. 1-187.
Markham K.R. (1982). Techniques of flavonoid identification.
Academic press, London, Chap. 1 and 2: 1-113.
Martin, H.M., Hancock, J.T., Salisbury, V., Harrison, R.
(2004) Role of Xanthine Oxidoreductase as an Antimicrobial Agent, INFECTION
AND IMMUNITY. 72: 4933- 4939.
Massey, V., Edmondson, D. (1970) On the mechanism of inactivation
of xanthine oxidase by cyanide. J. Biol. Chem. 245:
6595-6598.
Mc Cord J.M. (1985). Oxygen-derived free radicals in post
ischemic tissue injury. New England Journal of Medicine.
312, 159-163.
Meneshian, A., Bulkley, G.B. (2002) The physiology of
endothelial xanthine oxidase: from urate catabolism to
reperfusion injury to inflammatory signal transduction. Microcirc.
9: 161-175.
Middleton, E., Kandaswami, C., Theoharidies, T.C. (2000) The
effects of plant flavonoids on mammalian cells : implications for inflammation,
heart disease and cancer. Pharmacological reviews.
52: 673-751
Nakagawa A, Sakamoto S, Takahashi M, Morikawa H, Sakamoto A.
(2007).The RNAi mediated silencing of xanthine dehydrogenase impairs growth and
fertility and accelerates leaf senescence in transgenic arabidopsis plants.
Plant Cell Physiol 2007;48:1484-95
Nakamura M. and Yamazaki I. (1982). Preparation of bovine milk
xanthine oxidase as a dehydrogenase form. The Journal of
Biochemistry 92, 1279-1286
Narayana, K.R., Reddy, M.S., Chaluvadi, M.R., Krishina, D.R.
(2001) Bioflavonoids classification, pharmacological, biochemical effects and
therapeutic potential. Indian Journal of Pharmacology. 33: 2-16
Newman P.R., Timmerman B.N. and Marby T.J. (1974). Laboratory
manual for the systematic identification of flavonoids.
Nishino, T., Nishino, T. (1997) The conversion from the
dehydrogenase type to the oxidase type of rat liver xanthine
dehydrogenase by modification of cysteine residues with fluorodinitrobenzene.
J. Biol. Chem. 272: 29859-29864
Owen P.L. and Johns T. (1999). Xanthine oxidase inhibitory
activity of northeastern North
American plant remedies used for gout.
Journal of Ethnopharmacology 64, 149-1
Pacher, P., Nivorozhkin, A., Szabó, C. (2006)
Therapeutic Effects of Xanthine Oxidase Inhibitors: Renaissance Half a Century
after the Discovery of Allopurinol. Pharmacol. Rev. 58: 87-114.
Paker,L.Tritschler,HJ.Wessel,K(1997) Neuroprotection by the
metabolic antioxydant alpha - lipocacid.Free Radical .Biol.Med-22, 359-378
Pal Yu, B. (1994) Cellular defences against damage from reactive
oxygen species . Physiopathological Reviews.
74: 139-155.
Parks, D.A., Granger, D.N. (1986) Xanthine
oxidase: biochemistry, distribution, and physiology. Acta. Physiol.
Scand. 548: 87-99.
Perez H.D., Weksler B.B. and Goldstein I.M. (1990). Generation
of a chemotactic lipid from arachidonic acid by exposure to a superoxide
generating system. Inflammation. 4, 313- 328.
Pietta, P.G. (2000) Flavonoids as antioxidants. Journal of
natural products. 63: 1035-1042.
Rice-Evans C.A., Miller N.J., and Paganga G. (1996).
Structure-antioxidant activity relationships of flavonoids and phenolic acids.
Free Radical Biology & Medicine 20, 933-956.
Rice-Evans,C. (2001) Flavonoid as Antioxidants. Current
medicinal chemistry. 8: 797-807.
Sanchez-Moreno, C., Larrauri, J. A., Saura-Calixto, F. (1998) A
procedure to measure the antiradical efficiency of polyphenols. J. Sc.
Food. Agricul.76: 270-276.
Sanders S., Eisenthal R.S. and Harrison R. (1997). NADH oxidase
activity of human xanthine
oxidoreductase - reneration of superoxyde anion.
Eur. J. Biochem. 245, 541-548.
Sanders, S., Eisenthal R., Harriso, R. (1997) NADH oxidase
activity of human xanthine
oxidoreductase generation of superoxide anion.
Eur. J. Biochem. 245: 541-548.
Schardinger, F. (1902) Über das Verhalten der Kuhmilch
gegen Methylenblau und seine Verwendung zur Unterscheidung von ungekochter und
gekochter Milch. Untersuch Nahrungs Genussmittel. 5:
1113-1121.
Schewe, T., Sies, H. (2003) Flavonoids as protectants against
prooxidant enzymes. Biologie médicale. 34:
243-253
Schmeda-Hirschmann G., Zuniga J., Dutra-Behrens M. and
Habermehl G. (1996). Xanthine oxidase inhibitory activity of flavonoids and
tannins from Hexachlamys edulis (Myrtaceae). Phytotherapy
Research 10, 260-262.
Schreck R. and Baeuerle P.A. (1991). A role for oxygen radicals
as second messengers. Trends in Cellular Biology. 1,
39-42.
Seyoum, A., Asres, K., El-Fiky, F.K.(2006) Structure-radical
scavenging activity relationships of flavonoids . Journal of phytochemistr
.67: 2058-2070.
Skibo E.B. (1986). Non competitive and irreversible inhibition
of xanthine oxidase by benzimidazole analogues acting at functional flavin
adenine dinucleotide cofactor. Biochemistry 25,
4189-4194.
Sorg, O.(2004) Oxidative stress: a theoretical model or a
biological reality. Comptes Rendus Biologies. 327:
649-662.
Stevens, C.R., Millar, T.M., Clinch, J.G., Kanczler, J.,
Bodamyali, T., Blake, D.R. (2000) Antibacterial properties of
xanthine oxidase in human milk. Lancet.
356: 829-830
Stirpe F. and Della Corte E. (1969). The regulation of rat
liver xanthine oxidase - conversion in vitro of the enzyme activity from
dehydrogenase (type D) to oxidase (type O). J. Boil. Chem. 244,
3855-3863.
Tutin ,Par.P?Quezel et S.SAMTA (1968)Edition du centre National
de la recherche scientifique .15quai anatole -France-Paris.
Valentao P., Fernndes E., Canvalho E., Andrade P.B., Seabra
R.M. and Bastos M.L. (2002).
Antioxidant activity of Hypericum
androsaenium infusion scavenging effect on
Valko, M., leibfritz, D., Moncol, J., Cronin, M.
T. D., Mazur, M., Telser, J. (2007) . Free
radicals and antioxidants in normal physiological functions and
human disease. Biocell. 39: 44-84.
Van Hoorn D.E.C., Nijveldt R.J., Van Leeuwen P.A.M., Hofman Z.,
M'Rabet L., De Bont D.B.A. and Van Norren K. (2002). Europ. J. of Pharm.
451, 111-118.
Wang, J., Mazza, G. (2002) Effects of Anthocyanins and Other
Phenolic Compounds on the Production of Tumor Necrosis Factor
á in LPS/IFN-ã-Activated RAW
264.7 Macrophages. J. Agric. Food. Chem.
50: 4183-4189.
Waud W.R. and Rajagopalan K.V. (1976). Purification and
properties of the NAD+-dependent (type D) and O2-dependent (type O)
forms of rat liver xanthine dehydrogenase. Arch. Biochem. Biophys.
172, 354-364.
Wu S.J. and Ng L.T. (2008). Antioxidant and free radical
scavenging activities of wild bitter melon (Momordica charantia Linn.
var. abbreviata Ser.) in Taiwan. L.W.T. 41, 323-
330
Wu, X.M. Sawada, M. Carlson, J.C. (1992). Stimulation of
phospholipase A2 by xanthine oxidase in the rat corpus luteum. Biol.
Reprod. 47, 1053-1058.
Xia, M., Dempski, R., Hille, R. (1999) The reductive
half-reaction of xanthine oxidase - reaction with aldehyde
substrates and identification of the catalytically labile oxygen. J. Biol.
Chem. 274: 3323-3330
Zelko, IN., Marian, TJ., Folz, RJ. (2002) Superoxide dismutase
multigene family : a comparison of the CuZn-SOD (SOD1), Mn-SOD (SOD2), and
EC-SOD (SOD3) gene structures, evolution, and expression. Free radical
biology & medicine. 33: 337-349.
cia:%1.4.11
Ñ A. *A:41 Ñæ~~ Ê
!"#~$%~ 4Ç j11:Ç
j:S~ jå ~ ÇÑ ~Ç baå Cy .
1Ç
.40 -3 Lola
J:Ç34Ç coi 44121Ç c=1Ç
ci d",1JJL1Ç
~$Â:%~Ç &~'~(Ç ~~~<~
=%~
Cachrys libanotis
. É~$Â5~ ÉÏ 7.1Ç +..
.8 æ a~~ÇiSII .Â:%1Ç
r61)Ç
ä ZÇ
c1Å
~~~æ~~~Ç ~~$~ ÊÑ~Cæ
150 Ïæ-. 0 ~$~.Ñ J SDS-PAGE
(XO)
.41 ')€11Ç É.4Ç ÊJil
%Â
~~~~Ç'9"~
7.18 Ü>
@~ 17.97 ÏæÏ)A4
j".Ç 2"? CYA
~~0DE~Ç
. á /
. 2261 Ü> +~<%~Ç &'K ~"9Ç
~~) *<~Ç ÊÑ~C A æ
C~~æ.- & / ~~~CÏ / áyzi-
-
&~'~(Ç Éæ ~~ Lola á1: %A
d-31.ÇÏJ1. &~'~Å J
.045 +", ;11. 10 ~~Â Ê ~~~ L~~MÇ N"#$
ì-4 ..
jd&:1/~Ç &~
ãÑ~0æÑ~"9~Ç
ja=d&:14/4.1. Ú_44.
|
(JA /
|
& 0.006 #177; 0.11
|
=
|
IC50)
|
XO
|
|
~~? coi 2~~~~~Ç +",
(JA /
& 0.001 #177; 1.048
æ 0.002 #177; 0.138
=
IC50)
ã #1Ç
=
0.222

=
0.415
IC50)
cytochrome c Ú ~ÑÇ +", ~~~ 10
~~ ãÑ~0æÑ~"9~Ç c111-" ì.4
ã #~Ç N"#$%Ç &~ Ê ~~J L~~Ç N"#~J.4
Ú_~1.
L.s.4.L' 441a
J.z141Ç z. ~11Ç äÅ
. yo.:1Ç +",
(JA /
æ 0.015 #177;
@~ 0.084 #177; 2.68
&~'~(Ç P 40:1.1***
calÇ ÖÇj."Ç ÌD, 0
"41..lÇ Ê 4ÂJAIÇ ~3å á %1Ç ~~~
9U>
. ÉiZ3Ç Ñæ34Ç
.?ÇÒÅ C:11Ç-S33 t~.%1Ç
`6ÂjAlÇ
RESUME : L'objectif principal de cette
étude est l'évaluation de l'effet inhibiteur des extraits des
racines de la plante cachrys libanotis, utilisée en
médecine traditionnelle en Algérie, sur la xanthine oxydase (XO)
et de ses propriétés antioxydants. La XO a été
purifiée du lait bovin avec un rendement de17.97 mg/l,
un rapport protéine/flavine de 7.18, et avec une bande majeure d'environ
150 KDa, en SDS-PAGE, indiquant une pureté acceptable de l'enzyme.
L'activité spécifique de l'enzyme purifiée a
été de 2261 nmol/min/mg protéine. L'EAc donne la plus
puissante inhibition en vers XO avec un IC50 de (IC50 = 0.11#177;
0.006mg/ml)suivi par l'ECh et l'EBr (IC50 =0.138#177; 0.002 et
1.048#177; 0.001mg /ml) par contre l'inhibition de la l'ECh donne la plus
grande inhibition en vers la reduction de cyt c avec un (IC50 = 0.222 #177;
0.0015mg/ml), suivi par l'EAc et l'EBr respectivement avec (0.415 #177; 0.015et
2.68 #177; 0.084mg /ml), les résultats obtenus suggèrent que ces
produits naturels peut être utiliser pour traiter les maladies qui
nécessites l'inhibition de la XO et le scavenger des radicaux libres
IC50)
SUMMARY: This study was conducted to search
for xanthine oxidase (XO) inhibitors from Cachrys libanotis
L.root extracts traditionally used in folk medicine in Algeria.
XO was purified from fresh bovine milk with yields of 17.97 mg / L, protein /
flavine ratio of 7.18 and a major band, on SDSPAGE, of approximately 150 KDa,
indicating an acceptable purity of the enzyme. The total specific activity of
the purified enzyme was of 2261 nmol / min / mg protein. The EAc showed the
highest in inhibitory properties on the XO activity (IC50 = 0.11 #177; 0.006 mg
/ ml), followed by ECh with IC50 for XO inhibitory activity of
0.138 #177; 0.002 mg / ml then EBr with an IC50 (
1.048#177;0.001 mg / ml). Whereas, the inhibition of cyt c reduction the
highest activity was that of ECh with IC50of 0.222 #177; 0.001 mg / ml),
followed by EAc then EBr extracts with an IC50 of 0.415 #177; 0.015 mg a /ml
and 2.68 #177; 0.084 mg / ml, respectively. These results suggest that these
natural products could be used to treat lot of diseases, where inhibition of XO
and free radical scavenging activity are necessary.
| 


