|
République Algérienne
Démocratique Et Populaire
Ministère De L'enseignement Supérieur
et de la Recherche Scientifique
Université Abou Bekr Belkaid
Faculté Des Sciences
Département De Biologie
Laboratoire De Recherche : Produits Naturels
Mémoire en vue de l'obtention du Diplôme de
Magistère en Biologie
Option : Produits Naturels : Activité
Biologique et Synthèse
Recherche de nouvelles souches fongiques
productrices d'antibiotiques à partir du sol et des concrétions
sédimentaires des grottes de Aïn Fezza.
Thème :
Présentée
par :
Melle KHOLKHAL Wahiba
Soutenue le :
Devant le Jury :
Président :
Mr TALEB BENDIAB S.M Professeur
Examinateurs :
· Mr. CHABANE SARI D Professeur
· Mr. ABDELOUAHED J Docteur
· Mme. HASSAINE H Maître assistant
Chargé de cours
Promoteur : Mr.
MOUSSAOUI A Maître de conférence
Année universitaire 2005-2006
![]()
Ø A mes chères parent
Ø Soeurs et frères
Ø Ma famille
Ø Les personnes que je connais
![]()
A NOTRE DIEU
![]()
äÙÑÇ
áÊäÇãí ÎØÑ
ÇáÈßÊíÑíÇ
ÇáãÞÇæãÉ
ááãÖÇÏÇÊ
ÇáÍíæíÉÑßÒäÇ
í ÏÑÇÓÊäÇ
Úáì ÇáÈÍË Úä
ãæÇÏ ØÈíÚíÉ
ãÖÇÏÉ
ááÈßÊíÑíÇ
ãä Õá ØÑíÇÊ
ãÛÇÑÇÊ Úíä
ÒÉ.
ÍíË ÞãäÇ
ÈÎÐ ÚíäÇÊ ãä
ÇáÊÑÈÉ æ
ÇáÊÔßíáÇÊ
ÇáÊÑÓÈíÉ
áËáÇË
ãÛÇÑÇÊ åä
Úáì
ÇáÊæÇáí:ÛÇÑ
ÇáÕÎÑÇäÛÇÑ
æáÇÏ ÌÚíÏí
æÛÇÑ Èäí ÚÇÏ
æ Ðáß ãÇ Èíä
ÔåÑ äæãÈÑ æ
ãÇÑÓ.ÎÖÚÊ
åÐå ÇáÚíäÇÊ
áÚãáíÇÊ
ÇáÚÒá
ÇáÊÇÖáí
ááØÑíÇÊ.
ÇáÚÒáÇÊ
ÇáãÓÊÈÞì
ÚáíåÇ åí
ØÑíÇÊ
ÇáÈíäíÓáíæã
ÍíË ÚÏÏåã 152
ÚÒáÉ.æ ÇáÊí
Êã ÚÒáåÇ í
ãÚÙãåÇ ãä
ÊÑÈÉ ÛÇÑ
ÇáÕÎÑÇä æ
äÞØÉ ÇáÎÐ(2
)ÇáæÇÞÚÉ
Úáì ÈÚÏ 185 ã ãä
ÇáãÏÎá
ÇáÑÆíÓí
áãÛÇÑÉ Èäí
ÚÇÏ.
ÈÇáãæÇÒÇÉ
ãÚ ÚÒáÇÊ
ÇáÈíäíÓíáíæã
ÇßÊÔäÇ æÌæÏ
ÚÒáÉ ÊßÊÔ
áæá ãÑÉ í
ãÎÊÈÑäÇ.æ
ÇáÊí Êã
ÚÒáåÇ ÞØ ãä
ÚíäÇÊ äÞØÉ
ÇáÎÐ 2 áÛÇÑ
Èäí ÚÇÏ.Êã
ÊÔÎíÕåÇ ãä
ØÑ ÇáãÊÍ
ÇáæØäí
ÇáÑäÓí
ááÊÇÑíÎ
ÇáØÈíÚí
Úáì äåÇ
ãä äæÚ «
Beauveria felina »
Êã ÍÕ
ÚÇáíÉ 80 ÚÒáÉ
ÈíäíÓíáæã
ÖÏ ÈÚÖ
ÇáäæÇÚ ãä
ÇáÈßÊíÑíÇ38
ãäåÇ ÙåÑÊ
ÚÇáíÊåÇ ÖÏ
ÇáÈßÊíÑíÇ
ÇáãÓÊåÏÉ.ÇáÇäÊÞÇÁ
ÇáËÇäæí á14
ãäåÇ ßÔ ÙåæÑ
ÚÇáíÉ
ßÇÈÍÉ ÖÏ
ÈßÊíÑíÇ
ãÓÊåÏÉ
æÇÍÏÉ Úáì
ÇáÞá.
ÇáÚÒáÉ
ÇáÊÇÈÚÉ
áäæÚ« Beauveria felina »
ÙåÑÊ íÖÇ
ÚÇáíÉ ÊÌÇå
ÇáÈßÊíÑíÇ
.Pseudomonas aeruginosa
ÒÑÚ åÐå
ÇáÚÒáÉ í
æÓØ ÓÇÆá
ÓãÍ áäÇí äÓ
ÇáæÞÊ
ÈÏÑÇÓÉ
ÇáäÇÊÌ ãä
ÇáãÖÇÏÇÊ
ÇáÍíæíÉ
ÇáãÊæÇÌÏÉ í
ÈíÆÉ
ÇáÊÛÐíÉÇáåíÇÊ
ÇáåæÇÆíÉ æ
ÇáåíÇÊ
ÇáÞÇÚÏíÉ.
íãÇ íÎÕ
ÇáÓÇÆá ËÈÊÊ
ÇáÏÑÇÓÉ Úáì
ãÏì ËáÇËÉ
ÔåÑ ÚÏã æÌæÏ
ÚÇáíÉ ÊÐßÑ
ÈÇáãÞÇÈá
ÕÇÑÊ ÚÇáíÉ
ÇáåíÇÊ ÈÚÏ
ÚãáíÇÊ
ÇáÇÓÊÎáÇÕ
Úä ØÑíÞ
ãÐíÈÇÊ ÐÇÊ
ÞØÈíÇÊ
ãÎÊáÉ ÌÏ
ãÚÊÈÑÉ
ÎÕæÕÇ Êáß
ÇáäÇÊÌÉ Úä
ÇáÇíÊÇäæá
ãÞÇÑäÉ ÈÊáß
ÇáäÇÊÌÉ Úä
ãÓÊÎáÕ
ÇáÈÊÑæá.
![]()
En vue du risque augmenté jour après jour des
bactéries résistantes aux antibiotiques, nous nous sommes
intéressés dans notre travail à la recherche de nouveaux
produits naturels antibactériens d'origine les champignons des grottes
de Aïn Fezza.
Afin d'atteindre notre objectif, on a procédé
à des prélèvements d'échantillons de sol de trois
grottes (Ghar Sokhrane, Ghar Ouled
Djaâdi et Ghar Beni Aâd), ainsi que des
concrétions sédimentaires. Ces prélèvements
effectués entre le mois de novembre et mars (2004-2005), ont
été suivis par des isolements sélectifs des
champignons.
Les isolats retenus sont ceux qui appartiennent au genre
«Penicillium » et qu'ils sont du
nombre de 152 souches. La source principale de ces isolats était les
échantillons du sol du prélèvement du mois de
décembre du Ghar Sokhrane et le point de
prélèvement P2 (situé à
185 m de l'entrée du Ghar Beni
Aâd).
Parallèlement des souches de
«Penicillium », on a
révélé la présence d'une souche observée
pour la première fois dans notre laboratoire. Cette souche était
isolée seulement des échantillons du point de
prélèvement P2 de Ghar Beni
Aâd (sol et concrétions sédimentaire).
D'après l'identification réalisée par le
Muséum National d'Histoire Naturelle de France, la
souche appartient à l'espèce « Beauveria
felina ».
Le test d'antibiose de 80 souches de
«Penicillium » a été
effectué, seul 38 présentent une activité contre les
bactéries-cibles utilisées, le criblage secondaire de 14 entre
eux a révélé l'exhibition de 7 souches d'une
activité inhibitrice contre aux moins une bactérie-cible. La
souche appartenant à l'espèce « Beauveria
felina » a présenté aussi une
activité intéressante contre la bactérie-cible
Pseudomonas aeruginosa.
La culture en milieu liquide de cette souche, nous a
permis d'étudier la production des substances antibactériennes
dans le surnageant, le mycélium aérien et enfin le
mycélium du substrat. Concernant le surnageant, l'activité
antibactérienne étudiée durant les trois mois d'incubation
n'était pas exprimé, cependant l'activité
antibactérienne du mycélium (aérien et substrat)
effectuée après l'extraction par des solvants de polarité
différentes était très intéressantes dans le cas de
l'extraction par l'éthanol par rapport à l'extraction par
l'éther de pétrole éthylique.
![]()
Bacterial resistance to the actual antibiotic is mostly in
dangerous progress, why we have interest to research new natural antibacterial
product that Ain Fezza's grottos fungi
contains.
To attempt our objective, samples were taken from the soil of
three grottos (Ghar Sokhrane, Ghar Ouled
Djaâdi and Ghar Beni Aâd), and from there
stalactite.
This sampling was been taken place between November and March,
continued by selective isolation of these fungi.
The restrains of this operation were one of the
«Penicillium » genera, with a number of 152
strains. The principal sources of these restrains were from the Ghar
Sokhrane's samples which are taken place in December, and
P2 point situated at 185 m from the entrance
of Ghar Beni Aâd.
With the «Penicillium »
strains, we were isolated one never seen in our laboratory, which was from
samples of P2 point.
Muséum National d'Histoire Naturelle de France
was identify this strain as « Beauveria
felina » species.
Antibacterial activity's test has been effectuated over 80
strains. Only 38 of there have an activity against bacteria. The secondary
screening of 14 from them revealed that 7 were an antibacterial activity.
Moreover, « Beauveria felina »'s
strain showed a good antibacterial activity against
Pseudomonas aeruginosa.
Submerged culture for this strain permit to investigate the
production of antibacterial substances in linger, aerial mycelium and submerged
mycelium.
For three months, the study of linger's antibacterial activity
did not be express, but after extraction with a different polarity solvents ,
it was more interesting for aerial mycelium and submerged mycelium by using
ethanol compared with petrol ethylic ether .
![]()
Tableau 1 : Description des stations de
prélèvements.
Tableau 2 : Isolement des souches de
« Penicillium ».
Tableau 3 : Origine de la souche 23 B.
Tableau 4 : Caractéristiques culturaux de la
souche 23 B.
Tableau 5 : Criblage primaire des souches de
Penicillium.
Tableau 6 : Origine des souches du groupe (3).
Tableau 7 : Criblage secondaire des souches de
Penicillium
Tableau 8 : Identification de la souche 27G1.
Tableau 9 : Activité antibactérienne des
extraits étheriques et éthanoliques du mycélium
(aérien et substrat).
![]()
Figure 1 : Protée (Proteus anguinus).
Figure 2 : Isaria guignardi sur
Quedius mesomelinus.
Figure 3 : Situation des stations de
prélèvements.
Figure 4 : Les stations de prélèvements.
Figure 5 : Aspect microscopique du Beauveria
felina.
Figure 6 : Beauveria felina sur différent
milieu de culture.
Figure 7 : Activité antibactérienne de la
souche 29S2 dans le deuxième criblage.
Figure 8 : Aspect cultural de la souche 27
G1.
Figure 9 : Beauveria felina sur milieu
liquide.
Figure 10 : Activité antibactérienne de la
souche 23B « Beauveria felina » contre la
bactérie-cible Enterobacter cloacea (5).
Figure 11 : Isaria felina.
![]()
USA : United States America.
% : pourcentage.
°C: degré celsus.
m : mètre.
n° : numéro.
Gr : grossissement.
Diam : diamètre.
Km : kilomètre.
v/an : visiteurs par
année.
g : gramme.
mn : minute.
ml : millilitre.
aw : activité
de l'eau.
nm : nanomètre.
mm : millimètre.
pH : nombre d'hydrogène.
al : collaborateurs.
![]()
INTRODUCTION.........................................................1
CHAPITRE 1 : SYNTHESE BIBLIOGRAPHIQUE
1- les
Champignons :...............................................................2
1-1-
Généralité:........................................................................................2
1-2- Caractéristiques
générales :...............................................................2
1-3 -
Classification :..................................................................................3
1-4- Écologie des
champignons :................................................................4
1-5-les principaux producteurs
d'antibiotique :..........................................5
2- La
grotte:.............................................................................6
2-1- l'homme
préhistorique :.....................................................................6
2-2- L'homme
musulman :........................................................................6
2-3- L'homme
Algérien :...........................................................................8
2-4- Les historiens :
..................................................................................8
2-5- Un
préhistorien :..............................................................................9
2-6-Un spéléologue :
.................................................................................9
2-7- Un biospéléologue :
.........................................................................9
2-8- Un
microbiologiste :.........................................................................11
2-9- Un botaniste :
..................................................................................11
2-10- Un mycologue :
..............................................................................12
3-De nouvelles souches fongiques productrices
d'antibiotiques:.....................................................................14
CHAPITRE2 : MATÉRIELS ET
MÉTHODES
1- Le site d'étude
:..................................................................15
2- MATERIELS ET
METHODES :.............................................16
2-1- Isolement et
identification :...............................................................16
2-2- Test
d'antibiose :..............................................................................19
2-3- Production des substances
antibactériennes :.....................................21
CHAPITRE 3 : RÉSULTATS ET
INTERPRÉTATION
1- Description des stations de
prélèvement : ............................24
2- Isolement et
dénombrement :..............................................26
3- La souche 23
B :..................................................................27
3-1- Origine
d'isolement :........................................................................27
3-2-
Identification :.................................................................................27
3-3- Identification de
l'espèce :................................................................32
4- Test
d'antibiose :................................................................33
4-1- Les souches de
Penicillium :..............................................................33
4-2- Beauveria
felina :..............................................................................38
5- Productions des substances
antibactériennes:......................38
5-1- Activité antibactérienne du
surnageant :............................................38
5-2- Activité antibactérienne du
mycélium (aérien et
substrat) :.................40
CHAPITRE 4 :
DISCUSSION :.......................................43
CONCLUSION :..........................................................59
RÉFÉRENCES
BIBLIOGRAPHIQUES............................60
Annexe
INTRODUCTION
![]()
Les infections bactériennes étaient depuis
l'antiquité la cause principale des mortalités (choléra,
peste, tuberculose....) ; mais depuis 1928 le monde a changé, enfin
on a une arme contre ces bactéries, un antibiotique
sécrété par Penicillium notatum
nommé la pénicilline.
On croyait, que le problème de ces infections était
résolu jusqu'au 1947, dont les premiers cas de la résistance
acquise au traitement à la pénicilline d'infections aux
staphylocoques furent remarqués. Ces phénomènes de
résistance ne firent pas grande impression à l'époque
(LOMBARD, 2005).
En 1999, aux USA, le premier cas de résistance totale
aux 12 grandes familles d'antibiotiques est remarqué. La situation est
particulièrement grave dans les hôpitaux nord-américains,
où, selon la Food and Drug Administration, 20% des cas d'infections
nosocomiales, sont dus à des bactéries multi-résistantes
(LEEB, 2004).
Alors, les scientifiques ne cessent de chercher des armes plus
puissantes, utilisant ainsi différentes méthodes ;
l'isolement des souches fongiques à partir de différents milieux
naturels allant des sommets montagneux aux profondeurs des océans.
Cependant, l'un des milieux naturels négligés dans ce combat
était les grottes.
Ces grottes constituent pour certain, si on dit pas la plupart,
l'abri des créatures et des monstres, le cible des chasseurs d'Or, et
mêmes pour les biologistes ce milieu était un laboratoire
d'étude de l'évolution des espèces et le facteur
d'adaptation.
Or, ils ont négligé ce que peut donner ce milieu
à l'humanité et plus spécifiquement à la
santé humaine. En partant de l'histoire des «
ÕÍÇÈ Ç áßå »,
et les phénomènes d'antagonistes qui peuvent être intenses
par l'effet des conditions extrêmes de ce milieu, on a une grande chance
de trouver les champignons les plus producteurs d'antibiotiques.
Alors, pour isoler ce type de champignon, notre programme de
travail a consisté à :
1- Choisir le site de prélèvement, les stations,
ainsi les points de prélèvement.
2- Effectuer des prélèvements à partir du
sol et des concrétions sédimentaires.
3- Faire des isolements sur différents milieux de
culture.
4- Réaliser le test d'antibiose des souches fongiques
sélectionnées sur une gamme de bactéries-cible par
utilisation de différente méthode.
5- Identifier les souches fongiques les plus puissantes.
6- Essai d'étudier la production des substances
antibactériennes par la souche fongique la plus puissante.
CHAPITRE I
SYNTHESE BIBLIOGRAPHIQUE
1- les Champignons :
1-1- Généralité:
Les Champignons, encore appelés "Fungi" (contraction du
latin "funus", funéraille, et d'ago", produire) ou mycètes (du
grec mukês, champignon), sont aujourd'hui érigés en
règne autonome, au même titre que les Procaryotes
(Archéobactéries, bactéries, Cyanobactéries), les
Protistes, les Végétaux et les Animaux. Leur nombre est
évalué à ce jour à environ 80.000 espèces
(PURVES et al, 1994 ; BOIRON, 2005).
1-2- Caractéristiques
générales :
D'après Bouchet et
al (1999) et Boiron (2005) :
- Ils sont eucaryotes ;
- Ils ont une paroi cellulaire
chitineuse ;
- Thallophytes : ils ne
possèdent ni feuilles, ni tiges, ni racines. Leur appareil
végétatif, ou thalle, est constitué d cellules
allongées qui peuvent se présenter de deux façons :
* Cloisonnées et articulées entre elles,
et sont alors appelées hyphes (c'est le cas le plus fréquent);
* Pas de cloison les séparant les unes des autres. On
parle alors de structure coenocytique et de siphon.
- Ils peuvent être pluricellulaire ou unicellulaire
(levure). Les filaments ou (hyphes) s'associent pour former le mycélium,
ces hyphes restent généralement indifférenciés et
inorganisées. Seuls quelques groupes fongiques sont capables de produire
certaines structures différenciées de leurs filaments
végétatifs (vésicules, chlamydospores, boucles, des
corémies ou « synnémas », ou des
sclérotes).
- Se reproduisent
par des spores, selon un mode asexué et/ou sexué.
- Hétérotrophes : la nutrition
carbonée est dépendante de la présence de matières
organiques préformées, ce qui conditionne, suivant les
circonstances, leur vie saprophytique, parasitaire ou symbiotique.
- Ils exploitent pour cela leur environnement
immédiat, absorbant les matières organiques de trois
façons différentes:
* Les champignons saprophytes exploitent la matière
organique morte ou en décomposition (feuilles mortes, débris
végétaux ou animaux, excréments).
* Les champignons parasites exploitent la matière
organique vivante, qu'il s'agisse de végétaux, d'animaux (y
compris les hommes).
* D'autres champignons préfèrent la symbiose,
association avec un végétal autotrophe, chacun des deux
organismes tirant profit de cette association. La symbiose permet parfois de
créer des êtres nouveaux, comme les lichens.
1-3 - Classification :
Les champignons ont fait l'objet de classifications complexes
(BARNETT et BARRY, 1972 ; BOTTON et al, 1990 ;
BOUCHETet al, 1999 ; BOIRON, 2005) :
Division 1 : GYMNOMYCOTA (cellule
dépourvu de paroi. présence de myxamibes et de plasmodes).
Division 2 :
MASTIGOMYCOTA (présence de spore mobile).
Division
3 : AMASTIGOMYCOTA (pas de cellule mobile).
Elle est divisée en quatre Sous embranchement :
a- ZYGOMYCOTINA : Elle est
présentée essentiellement par les zygomycètes, elles
comprennent environ 200 espèces, rassemblent des champignons
saprophytes, ainsi que des champignons parasites d'insectes (Entomophthorales),
de Nématodes et d'Amibes (Zoopagales), et de plantes.
Les Zygomycètes : Ils sont
caractérisés par
- Un mycélium siphonné ou coenocytique.
- Reproduction asexuée le plus souvent
par sporocystospore.
- Reproduction sexué par fusion de
gamétocyste.
b- ASCOMYCOTINA ou
ASCOMYCÈTE : Les Ascomycètes comprennent
environ 15.000 espèces, auxquelles il faut ajouter un nombre à
peu près équivalent d'espèces lichénisantes. Ils
sont caractérisés par :
- Un mycélium cloisonné ou unicellulaire
(levure) ;
- Reproduction asexué par des conidies ;
- Reproduction sexué par formation de spore
méiotique (ascospores) dans des asques.
c- BASIDIOMYCOTINA ou
BASIDIOMYCÈTES : Il existe environ 20.000 espèces,
sont les champignons que l'on peut considérer comme les plus
perfectionnés. ils sont caractérisés par :
- Un
mycélium cloisonné ou unicellulaire (levure).
- Reproduction asexué par des
conidies.
- Reproduction sexué par formation de
méiospore (basidiospore) dans des basides.
d- DEUTEROMYCOTINA
(Deutéromycètes ou champignons
imparfaits) :
Encore appelés Adélomycètes, les
Deutéromycètes ne constituent pas un groupe naturel, mais d'un
ensemble artificiel regroupant environ 15.000 espèces (plus du quart des
champignons actuellement connus).
- Thalle en général cloisonné ou
unicellulaire.
- Ne présentant jamais, ou très
exceptionnellement, de forme de reproduction sexuée.
- La plupart présentent, néanmoins, des
affinités d'Ascomycètes.
- Ils se reproduisent uniquement par voie
végétative au moyen de spores asexuées (conidie) ou par
simple fragmentation du mycélium (arthroconidie).
Les Deutéromycètes se divise en
trois classes :
- Les Blastomycètes : Levures avec
ou sans pseudomycélien.
- Les Hyphomycètes : Champignons
filamenteux, stériles (Agonomycétales) ou
produisant leurs spores directement sur les hyphes ou sur des conidiophores
simple ou agrégés (Moniliales).
- Les Coelomycètes : Conidies
produites dans des pycnides (Sphaeropsidiales) ou dans des
acervules (Mélanconiales).
1-4- Écologie des champignons :
Les champignons ont développé des adaptations très
diverses, de telle sorte qu'on les trouve dans pratiquement tous les milieux du
monde. Les plus répandues sont les Penicillium et les Aspergillus. On
les trouve sous tous les climats et sous toutes les latitudes (FLORENT,
1993 ; TACHENON, 1999).
Quelques espèces sont adaptées à
la sécheresse, d'autres vivent au contraire dans l'eau (eaux douces,
océans, ou eaux usées). Certaines supportent bien des pressions
osmotiques élevées (dans les milieux très salés, ou
très sucrés, par exemple) et arrivent à contaminer les
salaisons, le miel, ou les confitures. Des champignons aimant la chaleur se
trouvent dans les composts (à 70-75 oC) Mais on trouve aussi
des champignons dans les toundras arctiques ; en haute montagne, l'hygrophore
printanier se récolte à la fonte des neiges (2 oC) ;
et certains champignons peuvent encore pousser dans les chambres
réfrigérées (Sporotrichum
carnis) peut altérer des viandes pourtant
conservées à - 5 oC.
Dans des conditions défavorables (froid ou
chaleur intense, manque d'eau), ce sont des spores particulières qui
constituent les formes de résistance (pouvant
régénérer un mycélium plusieurs dizaines
d'années après sa formation). Étant donné leur mode
de nutrition, les champignons peuvent, à la différence des autres
végétaux, pousser dans une obscurité complète
(grotte). Ils peuvent aussi vivrent à des profondeur de 3200 m dans le
sol (LOCQUIN, 1984 ; TACHENON, 1999).
1-5-les principaux producteurs d'antibiotique :
Depuis, la quête de nouveaux antibiotiques se poursuit
de plus belle. Quelque 10 000 antibiotiques d'origine naturelle sont connus
à ce jour, Dont la majorité sont issues de «
simples » micro-organismes, tel que les champignons. Tous ne sont pas
employés, les effets toxiques de certains d'entre eux empêchent
leur utilisation en médecine humaine et vétérinaire.
(GAUTHIER, 1993 ; LOMBARD, 2005).
Il s'en suit que très peu d'antibiotique provient des
champignons appartenant aux Basidiomycotina ;
par contre environ (20 %) provient des champignons imparfaits
Deutromycotina
(Penicillium, Cephalosporium
et Aspergillus).
(TURNER, 1975 ; DEMAIN, 1981 ; BERDY, 1985 ; BRETON et
al 1989 ; BOUCHET et al, 1999).
En revanche, le développement de deux seulement de ces
antibiotiques (la pénicilline G et la
céphalosporine), notamment par le biais de leurs dérivés
d'hémisynthèse, a été tel qu'ils
représentent aujourd'hui environ 60 % du marché mondial des
antibiotiques (FLORENT, 1993).
*Penicillium : Ce champignon ubiquiste connus
dans l'histoire des antibiotiques par l'espèce Penicillium notatum
n'est que la forme conidienne imparfaite de champignons du genre
Eurotium (BOUCHET et al ; 1999).
Sa classification dans le monde des champignons selon Bouchet
et al (1999).
Règne :
Mycète;
Embranchement :
Amastigomycota ;
Sous-embranchement :
Deuteromycotina ;
Classe :
Hyphomycete ;
Ordre :
Moniliales ;
Famille :
Moniliaceae ;
Genre :
Penicillium.
2- LA GROTTE :
La grotte pour l'homme signifie beaucoup ;
qu'il soit un préhistorique, un musulman, un algérien (citoyen
simple ou un révolutionnaire), un préhistorien, un historien, un
spéléologue, un biospéléologue, un microbiologiste,
un botaniste ou un mycologue. Ce qu'elle signifie alors ?
2-1- l'homme préhistorique :
Il y a bien fort longtemps que les grottes existent.
Nos ancêtres ont les utilisées comme des abris ; d'abord refuges, se sont transformées en
lieux d'inhumation, en centres culturels, et sont devenues le support des
premières oeuvres d'art de l'humanité. La plus ancienne trace
humaine dans un milieu souterrain date de 47 600 ans, dans la grotte
de Bruniquel (ANONYME 1, 2001).
2-2- L'homme musulman :
Chez les musulmans, les événements les
plus importants qu'a connu l'Islam ont été
liés à trois grottes (Hira, Thaur et enfin sourate « El kahf
».
a- La grotte de
« Hira » : Elle est attachée à
trois événements.
- Avant la révélation, elle était le
refuge de Mohammed (SAW), ou il effectue ses retraites
spirituelles ;
- La révélation des premiers versets du
Qoran (sourate Alaq n°
96 du Qoran)
- Le premier mot révélé dans cette
grotte, était une invitation de l'humanité à la science,
la recherche et la connaissance de notre créateur
« ALLAH » : « ÇÞÑ »
b-la grotte
« Thaur » : Cette grotte témoigne
- La fin du période mecquoise et le
début du période médinoise : le
départ d'une nouvelle ère de l'Islam.
- Le soutient du prophète Mohammed
(SAW) et son compagnon Abou Baker dans la grotte par
dieu. Allah le Très Haut a dit dans
sourate « El Taouba » : «
(39) ÅöáÇøó
ÊóäúÕõÑõæåõ
óÞóÏú
äóÕóÑóåõ
Çááøóåõ
ÅöÐó
ÂÎúÑóÌóåõ
ÇáÐöíäó
ßóóÑõæÇú
ËóÇäöíó
ÇóËúäóíúäö
ÅöÐú åõãóÇ
öí
ÇöáúÛóÇÑö
ÅöÐú
íóÞõæáõ
áöÕóÇÍöÈöåö
áÇó
ÊóÍúÒóäö
Åöäøó
Âááøóåó
ãóÚóäóÇ
óóäúÒóáó
Âááøóåõ
ÓóßöíäóÊóåõ
Úóáóíúåö æó
óíøóÏóåõ
ÈöÌõäõæÏò
áóãú
ÊóÑóæúåóÇ
æó ÌóÚóáó
ßóáöãóÉó
ÂáÐöíäó
ßóóÑõæÇú
ÇáÓøõúáóì
æó ßóáöãóÉõ
Çááøóåö
åöíó
ÂáúÚõáúíóÇ
æó Çááøóåõ
ÚóÒöíÒñ
Íóßöíãñ
(40)
c- Sourate « El
kahf » : Cette sourate raconte l'histoire des hommes
avec leur chien qu'ils sont refugés avec leur foi à l'unique dieu
dans une grotte. Allah le Très Haut a dit : «
ÇöáúÍóãúÏõ
áöáøóåö
ÇáøóÐöí
óóäúÒóáó
Úóáóì
ÚóÈúÏöå
ÇáúßöÊóÇÈó
æó áóãú
íóÌúÚóáú
áóåõ
ÚöæóÌðÇ (1)
ÞóíøöãðÇ
áöíõäúÐöÑó
ÈóúÓðÇ
ÔóÏöíÏðÇ
ãöäú
áóÏõäúåõ æó
íõÈóÔøöÑó
Âáúãõæãöäöíäó
ÂáÐöíäóö
íóÚúãóáõæäó
ÂáÕøóÇáöÍóÇÊö
óäøó áóåõãõ
óÌúÑðÇ
ÍóÓóäðÇ(2 )
ãóÇßöËöíäó
öíåö óÈóÏðÇ (3)
æó íõäúÐöÑó
ÂáÐöíäó
ÞóÇáõæÇú
ÇÊøÎóÐó
Âááøóåõ
æóáóÏðÇ (4)ãóÇ
áóåõã Èöåö
ãöäõ Úöáõãò
æó áÇó
áÂÈóÇÆöåöãú
ßóÈÑóÊú
ßóáöãóÉó
ÊóÎúÑõÌõ
ãöäó
óúæóÇåöåöã
õ Åäú
íøóÞõæáõæäó
ÅöáÇøó
ßóÐöÈðÇ(5)
óáóÚóáøóßó
ÈóÇÎöÚñ
äøóúÓóßó
Úóáóì
ÁóÇËóÑöåöãõ
Åöäú áøóãú
íõæãöäæõÇú
ÈöåóÐóÇ
ÇóáúÍóÏöíËö
óÓóÇð (6) ÅäøóÇ
ÌóÚóáúäóÇ
ãóÇ Úóáóì
ÂáÂÑúöÖ
öÒíäóÉð
áóåóÇ
öáäóÈúáõæóåõãõ
íøõåõãõ
ÍúÓóäõ
ÚóãóáÇð (7) æó
ÅäøóÇ
áóÌóÇÚöáõæäó
ãóÇ
ÚóáóíúåóÇ
ÕóÚöíÏðÇ
ÌõÑõÒðÇ
(8)Âãú
ÍóÓöÈúÊó
äøó ÕúÍóÇÈó
Çóáúßóåúö
æó
ÇáÑóÞöíãö
ßóÇäõæÇú
ãöäó
ÂíóÇÊöäóÇ
ÚóÌóÈðÇ (9) ÅÐó
Âæóì
ÇóáúöÊúíóÉõ
Åöáóì
Çóáúßóåúö
óÞóÇáõæÇú
ÑóÈøóäóÇ Áó
Ç ÊöäóÇ ãöä
áøóÏõäúßó
ÑóÍúãóÉð æó
åóíøöÆú
áóäóÇ ãöäó
ÂãúÑöäóÇ
ÑóÔóÏðÇ (10)
óÖóÑóÈúäóÇ
Úóáóì Áó ÇÐó
Çäöåöãú öí
Çáßóåúö
Óöäöíäó
ÚóÏóÏðÇ (11)
Ëõãøó
ÈóÚóËúäóÇåõãú
áöäóÚúáóãó
íøõ
ÇáúÍöÒúÈóíúäö
ÍúÕóì áöãóÇ
áóÈöËõæÇú
ãóÏðÇ (12)
äøóÍúäõ
äóÞõÕøõ
Úóáóíúßó
äóÈóåõã
ÈöÇáÍóÞøö
Åäøóåõãú
öÊúíóÉñ
ÇãóäõæÇ
ÈöÑóÈøöåöãú
æó
ÒöÏúäóÇåõãú
åõÏðì (13) æó
ÑóÈóØúäóÇ
Úóáóì
ÞõáõæÈöåöãõ
öÅÐú
ÞóÇãõæÇú
óÞóÇáõæÇú
ÑóÈøõäóÇ
ÑóÈøõ
ÇáÓøóãóÇæóÇÊö
æó ÇáÂÑúÖö
áóäú
äóÏúÚõæóÇú
ãöäú Ïõæäöåö
ÅöáóåðÇ
áøóÞóÏú
ÞõáúäóÇ
ÅöÐðÇ
ÔóØóØðÇ (14)
åóÄõáÇóÁö
ÞóæúãõäóÇ
ÇöÊøóÎóÐõæÇú
ãöäú Ïõæäöåö
Áó ÂáöåóÉð
áøóæúáÇó
íóÇÊõæäó
Úóáóíúåöã
ÈöÓõáúØóÇäò
Èóíøöäò
óãóäó
ÂÙúáóãõ
ãöãøóäö
ÇöúÊóÑóì
Úóáóì
Âááøóåö
ßóÐöÈðÇ(15) æó
öÅÐö
ÇöÚúÊóÒóáúÊõãõæåõãú
æó ãóÇ
íóÚúÈõÏõæäó
ÅöáÇøó
Âááøóåó
óúæõ Çú
Åöáóì
Çóáúßóåúö
íóäúÔõÑú
áóßõãú
ÑóÈøõßõãú
ãöäú
ÑóÍúãóÊöåö
æó
íõåóíøöÆú
áóßõãú ãöäú
ÂãúÑößõãú
ãøóÑúöÞðÇ (16)
æó ÊóÑóì
ÂáÔøóãúÓó
ÅöÐóÇ
ØóáóÚóÊú
ÊøóÒøóÇæóÑõ
Úóäú
ßóåúöåöãú
ÐóÇÊó
Çáíóãöíäö
æó ÅöÐóÇ
ÛóÑóÈóÊú
ÊóÞúÑöÖõåõãú
ÐóÇÊó
ÂáÔøöãóÇáö
æó åõãú öí
óÌúæóÉò
ãöäúåõ
Ðóáößó ãöäú
ÂíóÇÊö
Çöááøóåö
ãóäú
íøóåúÏö
Çöááøóåõ
óåõæó
ÂáãõåúÊóÏö
æó ãóäú
íõÖúáöáú
óáóäú
ÊóÌöÏó
ãøõÑúÔöÏðÇ(17).
áóåõ
æóáöíøðÇ
Plus tard, les grottes ont
représenté pour beaucoup de savants et Imam la Mosquée
où il est bon de s'y rendre afin de se retirer de ce monde
matérialiste et donner ainsi à leur âme sa nourriture
spirituelle.
2-3- L'homme Algérien :
Chez les algériens,
elle signifie :
* Les dessins de l'homme préhistorique du
Tassili ;
* Le refuge des algériens au cours des invasions ;
* Le refuge des combattants révolutionnaires ;
*Les enfumades et les emmurements des grottes pendant la
colonisation française de l'Algérie.
2-4- Les historiens :
Elle signifie la rédaction de la
célèbre Muqadima d'Ibn Khaldoun, dont elle était
réalisée dans une des grottes de l'ouest algérien (la
grotte de Sidi Khaled). La Muqadima est le témoin du déclin de
la civilisation musulmane et le début de la colonisation de l'Afrique
par les espagnols et les européens.
Cette Muqadima qu'elle a fait d'Ibn Khaldoun selon
Arnold Toynbee : « il a conçu et formulé
une philosophie de l'Histoire qui est sans doute le plus grand travail qui ait
jamais été créé par aucun esprit dans aucun temps
et dans aucun pays »
2-5- Un
préhistorien :
Pour l'homme préhistorien
l'intérêt de l'étude des sites préhistoriques et
paléontologiques des grottes a été montré
après la découverte des spécimens d'Ursus
speleus en 1774, par l'Allemand Esper, dans une grotte
de Westphalie
C'est en effet dans les dépôts
d'alluvions dans les grottes que la contemporanéité de l'homme et
d'espèces disparues est établie par Édouard Lartet, au
19e siècle, et qu'ont été
instaurées la chronologie et la classification des industries du
paléolithique ( ANONYME 1, 2001 )
2-6-Un spéléologue :
Pour le spéléologue, les grottes
constituent son terrain d'étude. Pour cela il recouvre de nombreux
domaines scientifiques dont la finalité est la connaissance de ce milieu
spécifique, le monde souterrain.
La grotte pour eux est un système
apparaît quand un courant d'eau chargé de gaz carbonique creuse
une roche calcaire fissurée, le plus souvent par des contraintes
(tectonique des plaques par exemple). Cette dissolution du calcaire forme les
grottes. Le bicarbonate de calcium Ca (HCO3)2 est un composant en
équilibre : quand la température de l'eau ou la pression
partielle de l'oxyde de carbone CO2 diminuent l'équilibre chimique
évolue dans le sens de la précipitation « la formation
de concrétions » (DUBOIS et GRELLET, 1997).
Pour le géologue, les
concrétions sédimentaires renseignent sur les climats et les
séismes anciens (DUBOIS et GRELLET, 1997).
2-7- Un
biospéléologue :
Pour un biospéléologue ; les
grottes, et la vie qui s'est développée dans ce milieu
très particulier, ont reçu un intérêt grandissant
depuis quelques décennies pour des recherches faunistiques,
génétique et physiologique. Cette recherche (la
biospéléologie) est un domaine scientifique a connue la
lumière grâce à la découverte d'une espèce
cavernicole Thyphlocirolana moraguesi en 1904 par
E.G.Racovitza (GRAUR, 2001).
Les recherches faites avant celles du savant roumain
n'attribuaient au milieu souterrain que peu de chances d'existence de la vie.
Partant de la découverte du cavernicole dans la grotte de Cueva del
Drach, il a cherché avec son collègue R. Jeannel à
démontrer, et il l'a réussi d'une façon brillante, que la
faune des cavernes est beaucoup plus riche et variée que l'on pensait et
que son étude peut aboutir à des résultats
intéressantes (GRAUR, 2001).
En 1986, une découverte remarquable a
été retenu l'attention : un réseau souterrain
étanche de 240m et à 25m de profondeur en Roumanie, partiellement
noyé, abritant une faune d'invertébrés isolés
depuis plusieurs millions d'années, comprenant 46 espèces dont 28
nouvelles, vivant dans une atmosphère pauvre en oxygène (POMEROL
et RENARD, 1997).
Les animaux cavernicoles sont classés en
trois catégories : les troglophiles, espèces
fréquentes dans les grottes ; les trogloxènes, hôtes
occasionnelles des cavernes ; les troglobies, espèces permanents
des cavernes (JEANNEL, 1937 ;
TERCAFS, 1997).
Sur les parois stalagmitées vivent de
nombreuses espèces troglobies appartenant surtout aux insectes. Ils
présentent des caractères morphologiques en rapport avec leur
adaptation à ce milieu .Tous sont aveugles, dépigmentés,
de taille plus grande que les espèces similaires du domaine
épigé ; leurs formes sont grêles, les membres
démesurément allongés (JEANNEL, 1937;
TERCAFS, 1997).
Les troglobies aquatiques ; se trouvent dans les
systèmes aquifères endogènes ; on ne les rencontre
que dans les systèmes hydrographiques d'une certaine importance. Les
crustacés sont les plus représenté (des crevettes
aveugles) ; les vertébrées dont le protée le
cavernicole le plus anciennement décrit (1768) ; des poissons
aveugles (JEANNEL, 1937;
TERCAFS, 1997) (Fig. 1).
Les guanobies constituent un autre groupe d'animaux
cavernicole (insectes, acariens, vers, mollusque...etc.) qu'ils ne
présentent aucun caractère d'adaptation au milieu
souterrain : tous sont pigmentés, ailés, pourvus d'yeux
(JEANNEL, 1937). 
Fig 1 : Protée (Proteus
anguinus) (ANONYME 2, 2005).
2-8- Un microbiologiste :
Pour un microbiologiste l'étude de la
microflore des cavernes a plusieurs voies :
a- Recherche des peuplements permanents des
sédiments de grottes et étudier leurs activités
métaboliques ; comme il a dit Caumartin (1959) « Un
sédiment de grotte est abondamment et originalement peuplé ;
il n'est jamais stérile ; les sondages effectués dans des
masses sédimentaires importantes ont montré qu'il est illusoire
d'espérer atteindre une zone rigoureusement stérile »,
et il a ajouté « des organismes inférieurs, non
photosynthétisants et non hétérotrophes,
ferrobactériales et thiobactériales par exemple, peuvent
parfaitement tirer d'un milieu minéral carbonaté ou
sulfuré bien équilibré, l'énergie nécessaire
à leur métabolisme ».
b- Isolement de la flore bactérienne des cavernes (sol,
eau et air) et l'étude de l'origine de cette flore. D'après
Mason-Williams et Benson-Evans, (1967) « la composition de la flore
bactérienne de l'air des cavernes est liée aux facteurs externe
comme les excréments animales, les vêtements et les
torrents »
c- L'analyse microbiologique des cavernes afin
d'évaluer l'effet des microorganismes sur la détérioration
des dessins d'homme préhistorique (ARROYO et al, 1997).
2-9- Un botaniste :
Maheu (1906) a constaté, en
examinant la flore des cavernes, qu'elle est restreinte. Elle l'est d'autant
plus qu'on s'éloigne davantage des conditions normales de la surface
L'ordre de décroissance de la flore à
partir de la surface du sol est identique à la classification de la
série végétal ce sont d'abord les Phanérogames qui
disparaissent, les Cryptogames vasculaires ensuite, puis les Muscinées.
Le facteur le plus important qui influence sur cette flore est la
lumière (MAHEU, 1906 ; MASON-WILLIAMS et BENSON-EVANS, 1967). Sous
ce rapport, elle peut se diviser en quatre zones :
a- Zone des ouvertures et de la surface ;
b- Zone des parois ;
Ces deux zones, mieux éclairées, sont
abondamment pourvues de végétaux, notamment de Mousses.
c- Zone du fond des gouffres (obscurité
partielle) : Elle montre un certain nombre d'espèces
généralement modifiées ;
d- Zone des galeries (obscurité absolue) :
Elle n'est habitée que par certaines Algues pauvre en chlorophylle.
2-10- Un mycologue :
Tandis que depuis fort longtemps la faune des
cavernes était étudiée ; la flore souterraine
était par contre à peu prés délaissée
(VALVASOR, 1689). C'est la fin du 16iéme siècle qu' a
connu la première étude sérieuse des champignons
cavernicoles ; Scopoli (1760) les décrivit et fus
frappé par leurs déformations : « elle prend
la forme de Lithophytes et des coraux du fond de la mer ».
Depuis cette époque, les recherches se sont
multipliées ; la curiosité des mycologues fut mise en
éveil par les champignons nombreuses, déformées, d'aspect
et de structure bizarres, qui peuplent les parois souterraines des galeries de
mines. C'est de cette époque que datent les célèbres
travaux de Bulliard (1791), Humboldt (1793) et de Bolton (1795) qui fourmillent
déjà d'observations intéressantes (MAHEU, 1906).
Par ailleurs plusieurs chercheurs (De Candolle,
Charneaux, Fries, Roumeguére) ont été occupés par
l'étude des champignons cavernicoles en les comparant aux espèces
de la surface (MAHEU, 1906).
Une étude systématique des
espèces souterraines par Maheu (1906) a classé les espèces
récoltée dans deux embranchement Ascomycètes et
Basidiomycètes et dont certaines d'entre eux sont classé
actuellement parmi les Deutéromycètes.
*Ascomycètes : Ces
champignons sont représentés par des espèces peu
variées.
- Isaria guignardi :
Espèce a été trouvée en parasite sur un
insecte « Quedius
mesomelinus » récolté
à l'obscurité totale dans les catacombes de Paris, sous la rue de
la Tombe-Issoire. (Fig 2).
- Hypocrea : Ce genre présente un
dimorphisme (ATKINSTON, 1891) dont sa forme conidienne Trichoderma
est la plus répondue dans les cavités souterraines par rapport a
l'autre forme ; une espèce de ce même genre rapprochant
à Hypocrea rufa a été trouvée dans les
mines de Loire et dont sa forme conidienne Trichoderma viride se
trouve dans la plupart des mines ou cavernes.
*Basidiomycètes : Ils sont plus nombreux
que les Actinomycètes et parmi eux ce sont les espèces
porées qui dominent ; dont Polyporus sulfureus
est une des plus répandues.
Dans les classifications actuelles, certains genres
ont été classés autrement comme le cas du
« Isaria », dont elle est classée
d'après (BARNETT et BARRY, 1972) parmi les
Deutéromycètes.
Hypocrea/ Trichoderma appartient
aux Sous-embranchement des Ascomycètes, Ordre des
Hypocreales, Famille des Hypocreaceae (CHAVERRI et SAMUELS,
2004).
Plus des travaux de Maheu ; d'autre recherches
ont été réalisées afin d'étudier les
champignons cavernicoles :
Went (1969) a trouvé
régulièrement l'espèce Cephalosporium
lamellaecola dans les extrémités des stalactites. Ses hyphes
prennent une part active à la croissance épitaxique des cristaux
de calcite.
    
Fig. 2. Isaria guignardi sur
Quedius mesomelinus. 1.
Touffes mycéliennes sur la partie dorsale de l'animal. 2. Localisation
des filaments fertiles et mycéliens. 3. Eléments coremiés
portant les conidiophores. Gr. 800 diam. 4. Constitution des hyphes aux points
d'insertion sur la cuticule du Coléoptère. Gr. 800 diam. 5. Une
des touffes supérieures. Gr. 20 diam (MAHEU, 1906).
L'analyse et l'étude des moisissures responsable de la
biodétérioration des dessins préhistoriques des cavernes
(CANEVA et SALVADORI, 1988 ; ARROYO et al, 1997).
3- De nouvelles souches fongiques productrices
d'antibiotiques :
L'obtention de nouvelles souches fongiques
productrices d'antibiotiques d'après Bouchet et
al (1999) nécessite :
- Un grand échantillonnage à partir d'un milieu
naturel : l'air, sol, d'eau douce ou salée, provenant des
contrées les plus diversifiées, allant des sommets montagneux aux
profondeur des océans.
- Isolement, purification et sélection des souches
fongiques.
- Les études de criblage primaire
« screening » en utilisant des souches
cibles (bactérie ou champignons) ; parfois on passe à un
deuxième criblage.
- Isolement, purification et identification des
molécules actives par le biais des différentes techniques de la
chimie extractive.
CHAPITRE II
MATERIELS ET METHODES
1- LE SITE D'ETUDE :
Le village Aïn Fezza, le lieu de nos
prélèvements, se situe à 12 Km à l'est du centre
ville de Tlemcen, à altitude 860 m par rapport au niveau de mer. Son
ancien nom Ifri désigne sa nature montagneux et qui englobe plusieurs
grottes et cours d'eau.
Dans notre travail, on a choisi trois stations (grottes) (Fig.
3).
*Station 1 « Ghar
Sokhrane » : Grotte nom explorée, elle
était utilisée comme un refuge des combattants de
libération pendant la colonisation française dont son ouverture
était explosée durant cette période. Actuellement,
l'accès à cette grotte est devenu difficile à cause de cet
incident.
Cette grotte est liée à l'histoire d'un
combattant de libération qu'était jeté dans cette grotte,
après qu'il était torturé par l'armé
française, après 12 jours de jeûne et de gaz toxique
envoyé par l'armé, il était sorti avec un état
stable.
*Station 2 « Ghar d'Ouled
Djaâdi » : Elle était exploitée
auparavant pour l'utilisation humaine (l'élevage des bétails,
stockage des fourrages). Elle a une longueur qui dépasse 20 m et une
largeur 5 m et une profondeur géologique 3 m.
*Station 3 « Ghar Beni
Aâd » : La plus grande grotte visitable en monde,
elle est caractérisé par une longueur de 700 m, et une profondeur
qui dépasse 18 m, situé à 7 Km du sud-est du chef-lieu de
la commune de Aïn Fezza.
Cette grotte s'insère dans un relief montagneux
chahuté avec un affleurement rocheux très net. De
l'intérieur, c'est une importante cavité creusée dans la
roche calcaire du massif de Tlemcen et qui s'incruste dans un ensemble de
jurassique supérieur (dolomie) donnant ainsi une gamme de formes
karstiques.
Elle existe depuis 65000 ans, elle a été
découverte par les berbères une ou deux années avant
Jésus Christ. Pendant la guerre de libération algérienne,
elle a servi comme un refuge des combattants qui accédaient non pas par
l'ouverture principale mais par une faille qui fut bombardée par la
suite. Durant les années 70, elle était l'attraction principale
des touristes où la fréquentation a atteint 4500 v/an en 1971
(ANONYME 3, 2006).
1
2
 Fig. 3. Situation des stations de
prélèvements. 1. Ghar Sokhrane. 2. Ghar
d'Ouled Djaâdi. Grottes. Ghar Beni
Aâd. Fig. 3. Situation des stations de
prélèvements. 1. Ghar Sokhrane. 2. Ghar
d'Ouled Djaâdi. Grottes. Ghar Beni
Aâd.
Carte d'état major : Terny
Echelle : 1/50000
Source : Parc National de Tlemcen.
2- MATERIELS ET METHODES :
2-1- Isolement et identification :
2-1-1- Echantillonnage :
On a réalisé au niveau de chaque station, 1
à 3 points de prélèvements « P » au
moyen de 10 échantillons par point. Ces prélèvements
effectués entre le mois de Novembre et Mars (2004-2005) ont
été pris à partir du sol et des concrétions
sédimentaires.
Ceux du sol, ont été effectués par des
spatules stériles ; et ceux des concrétions
sédimentaires, par frottement à la surface avec des
écouvillons stériles.
2-1-2- Examen direct :
Cet examen a été réalisé a l'oeil
nue au moment du prélèvement, afin de détecter la
présence du mycélium au niveau des points de
prélèvement, ainsi d'autre caractéristiques (la flore, la
faune...etc.).
2-1-3- Isolement et sélection des souches :
a- Milieu de culture :
On a utilisé dans nos isolements, différents
milieux de culture :
* CDA (Czapek Dextrose Agar)
* ISP2 (International Streptomyces
Project)
* MEA (Malt Extract Agar)
* MYEA (Malt Yeast Extract Agar)
* PDAa (Potatoes Dextrose Agar
acidifié)
* PDAR (Potatoes Dextrose Agar +
Rose Bengal)
* SGA (Soil Glucose Agar)
* YSA (Yeast Starch Agar).
Afin d'inhiber la croissance des bactéries, ainsi
ralentir la croissance de certains champignons envahissantes on a
utilisé des milieux additionnés d' Acide lactique, Rose Bengal,
Amphotericine B et Ampicilline.
La préparation de ces milieux a été
effectuée en référant à Ramirez (1982), Botton et
al (1990) et Khelil (1997).
b- La mise en culture :
On a additionné 5 g de chaque échantillon de sol
à 45 ml d'eau physiologie homogénéisé
ensuite, pendant 30 mn à l'aide d'un agitateur magnétique, puis
dilué de 10 en 10 ( 10-2 à 10-3 ).
Les solutions mères des échantillons des
concrétions sédimentaires, ont été
préparées par l'imprégnation des écouvillons dans 7
ml d'eau physiologie, agitées ensuite, pendant 30 mn à
l'aide d'un Vortex.
On a étalé 1 ml des suspensions sur les milieux
d'isolements précédemment coulés en boites de
Pétri. L'incubation a été effectuée à
25°C pendant 7 à 15 jours.
c- Purification et conservation :
Les souches isolées ont été
purifiées par repiquage successif sur le même milieu d'isolement.
Les souches pures ont été repiquées sur le même
milieu coulé en pente dans des tubes à vis, puis conservés
à 4°C.
2-1-4- Identification :
a- Identification préliminaire :
Les souches pures ont été
caractérisées par, leurs aspects culturaux et morphologiques.
· Les caractéristiques
culturaux : Ils ont été
déterminés par le diamètre des colonies, la couleur, la
forme et la sécrétion des pigments diffusible.
· Les caractéristiques
morphologiques : Ils ont été
déterminés par la technique de microculture; qui consiste
à cultiver les moisissures sur des lames menées de petits
carrés de PDAa solidifié et les couvrir par des
lamelles, ensuite les conditionner dans une chambre stérile et humide et
les incuber à 25°C pendant 3 à 5 jours. Après
l'incubation, on effectue les observations des lames grâce à un
microscope de type Zeiss au grossissement × 10, × 40 et ×
100.
b- Identification de l'espèce :
Afin d'identifier l'espèce de certaines souches
importantes dans notre travail, on a utilisé deux techniques :
* Technique1 : C'est la
technique de « Single Spore » décrit par Ramirez
(1982).
Cette méthode est basée sur la relation entre
l'aw du milieu de culture et la température d'incubation.
Elle consiste à l'inoculation des spores de cultures jeunes dans des
tubes à hémolyse contenant une suspension à base de 0,2 %
d'Agar et 0,05 ml de Tween 80. La culture, ensuite, se fait sur quatre milieux
de cultures différents.
* CDA (Czapek Dextrose Agar)
*CYA (Czapek Yeast Agar)
*G25N ( 25% Glycérol Nitrate Agar)
* MEA (Malt Extract Agar)
Les ensemencements ont été effectués
comme indiquée dans le schéma ci dessous :
 CDA CYA
CYA G25N MEA CDA CYA
CYA G25N MEA
25°C 4°C
37°C 25°C 25°C
Après 14 jours d'incubation, les
caractéristiques culturaux du souche à identifier sur
différents milieux ont été comparées aux guide de
Ramirez (1982) afin d'apprécier l'espèce qu'elle appartienne.
* Technique 2 : Cette technique
était utilisée pour certaines souches afin de donner plus
d'information sur leurs caractéristiques culturaux suivant la
composition du milieu de culture et le temps d'incubation. Pour la
réaliser, on a utilisé deux méthodes :
- Culture en boite de Pétri :
Elle consiste à l'inoculation des spores de cultures jeunes dans des
tubes à hémolyse contenant une suspension à base de 0,2 %
d'Agar et 0,05 ml de Tween 80. La culture, ensuite, se fait sur
sept milieux de culture :
* AFPA (Aspergillus Flavus / Parasiticus
Agar)
* ISP2 (International
Streptomyces Project)
* MEA (Malt Extract Agar)
* MYEA (Malt Yeast Extract Agar)
* YEA (Yeast Extract Agar)
* YESA (Yeast Extract Starch Agar): Ce milieu
était préparé dans notre laboratoire à base de deux
milieux de culture YEA et YSA. Il n'a aucune
référence bibliographique, c'est le résultat de notre
travail.
* YSA (Yeast Starch Agar).
Les ensemencements ont été effectués par
un seul point. Après 14 jours d'incubation à 25°C, on a
noté les caractéristiques culturaux sur chaque milieu de
culture.
-Culture en récipient :
L'étude des caractéristiques culturaux a
été suivie sur le milieu YSA (250 ml du milieu dans un
récipient de 2 litre) pendant 30 jours à température fixe
25°c.
- Identification de l'espèce :
Elle était réalisée à l'aide du
« Muséum National d'Histoire Naturelle.
France ».
2-2- Test d'antibiose :
2-2-1- Microorganisme cible :
Dans notre travail, on a utilisé comme microorganisme
cible neuf souches bactériennes dont trois provient du
laboratoire « Antibiotiques, Antifongique :
Physico-chimie, Synthèse et Activité biologique »
(Tlemcen).
· Escherichia coli (1')
(ATCC 25922)
· Pseudomonas aeruginosa (2) (ATCC
27853)
· Staphylococcus aureus (3) (ATCC
25923)
Cependant, que les autres souches provient du laboratoire
« Produits Naturels »
(Tlemcen).
* Les souches :
· Escherichia coli (1) 5044172.
· Citrobacter freundï
· Enterobacter cloacea (5) 1305573.
· Klebsiella pneumoneae
(6) 5215773.
· Listeria monocytogenes (7) (ATCC 19111).
· Proteus mirabilis (8) 0536040.
· Salmonella typhi (9) 4404540.
2-2-2- Préparation de l'inoculum
bactérien :
La préparation d'un lot de « Semences
d'essai » des souches bactériennes a été
réalisée sur Gélose nutritive en tubes inclinés et
conservés à 4°C. Vingt quatre heures avant le test
d'antibiose, on a effectué des précultures en Bouillon nutritif
à partir des souches bactériennes conservées. Ces
précultures ont été incubées à 37°C.
Lors des essais, ces précultures sert à la
préparation des suspensions bactériennes dans l'eau physiologie
et ajustées, ensuite, à l'aide d'un Spectrophotomètre de
type (JEN WAY, 6405 UV/Vis), à 1×108 bactéries
/ml par mesure de la transmission optique à 640 nm (DE BILLERBECK,
2000).
2-2-3- La réalisation du test :
Le test d'antibiose dépend des résultats
d'isolement et d'identification des champignons, qu'ils nous ont posés
de faire deux méthodes selon les souches isolées :
· METHODE 1 : Utilisée pour
le premier groupe de champignons.
Ø Le criblage primaire :
Elle était réalisée par la méthode de culture en
milieu liquide inspiré de la méthode décrit par Khelil
(1997) et Saadoun et al (1999) et, qui consiste
à inoculer des souches fongiques pures dans un flacon de 250 ml
contenant 50 ml du milieu Yeast Glucose Succhrose (YGS) et l'incuber, ensuite,
à 25°C. Après 14 jours d'incubation le contenue de chaque
flacon, a subi une filtration sur un papier filtre. Le surnagent était
récupéré. Afin d'effectuer le test d'antibiose sur une de
ces trois bactéries cible Escherichia coli (1),
Pseudomonas aeruginosa (2) et Staphylococcus aureus
(3), trois disques de papier ont été
imprégnés du surnageant et posés en surface du milieu de
culture « Gélose nutritif » coulé en boite de
Pétri et ensemencé par la suspension bactérienne.
Après 24 heure d'incubation la présence d'une zone clair autour
des disques révèle la présence des substances
antibactériennes dans le surnageant.
Ø Le criblage
secondaire : Les souches révélant une
activité antibactérienne importante dans le premier criblage, ont
subi ce criblage afin de tester leur activité en changeant la
méthode et en élargissant la gamme des
bactéries-cible (neuf espèces bactériennes). Ce test
inspiré de la méthode décrit par Saadoun et al
(1999), consiste à ensemencer des souches fongiques sur le milieu
PDAa coulé en boite de Pétri. Après 14 jours
d'incubation à 25°C, trois disques d'agar ont été
coupés et déposés sur le milieu Mueller Hinton
ensemencé préalablement par la suspension bactérienne.
Après 24 heures d'incubation à 37°C, la présence
d'une zone clair autour des disques révèle la présence des
substances antibactériennes dans le disque d'agar.
· METHODE 2 :
Utilisé pour le deuxième groupe
fongique. Cette méthode a été réalisée sous
sa forme décrite ci-dessous, après qu'on a remarqué que la
formation des hyphes aériens agrégés par ce groupe
fongique a arrêtée la croissance de certains contaminants
fongiques de la culture des souches de ce groupe.
La méthode consiste à inoculer les champignons
dans un récipient contenant 100 ml du milieu YSA. Après 20 jours
d'incubation à 25°C, les filaments aérien ont
été récolté et homogénéisé
dans 50 ml d'eau distillé stérile. Trois disques de papier filtre
ont été imprégnés de cette suspension et
déposé, ensuite, sur le milieu Mueller Hinton ensemencé
préalablement par une suspension bactérienne
(Pseudomonas aeruginosa (2) ).
Après incubation à 37°C pendant 24 heures la lecture
était effectuée comme la première méthode.
2-3- Production des substances
antibactériennes :
Cette partie a été effectuée pour une
seule souche fongique sélectionnée en fonction des
résultats précédents (isolement, identification et test
d'antibiose).
Afin de tester la production des antibiotiques de cette
souche, qu'ils soient des antibiotiques exogènes ou endogènes, on
a utilisé le milieu de culture YESLa (Yeast Extract Starch
Liquid acidifié) et la méthode suivante :
Tout d'abord, on a désinfecté le
récipient du culture qui est de volume 4 l ; on a placé, ensuite,
les supports en verre (pipette pasteur) de manière qu'il forme un
support du mycélium, puis on a désinfecté l'ensemble (le
récipient et les supports) et enfin on a versé 2000 ml du milieu
de culture YESLa.
A ce moment, on a préparé notre inoculum en
utilisant la technique de support cellulosique de spores décrit par De
Biller Beck (2000).
On a coupé un fil de coton commercialisée en 10
morceaux de 60 cm de long, on les a placés ensuite, dans une boite en
verre et on les a stérilisés à l'autoclave pendant 20 mn.
Après la stérilisation, 30 ml de la suspension
fongique ajustée à (1×108 spore/ml) en utilisant
la cellule de Thomas a été versée dans la boite de
Pétri, ensuite l'ensemble a subit un séchage pendant deux heure
sous hotte à flux laminaire de type (Cytostar 13164).
En denier lieu, les supports de spores ont été
placés dans le récipient de manière qu'ils soient
immergés. L'incubation a été effectuée à
température ambiante.
Cette méthode était réussite après
plusieurs essais, en améliorant à chaque fois la technique par
l'analyse des résultats de chaque essai. En plus, elle était
réalisée avant l'identification de l'espèce de cette
souche par le « Muséum National d'Histoire Naturelle.
France ».
2-3-1- Activité antibactérienne du
surnageant :
Elle a été réalisée par la
méthode de disque imprégné du surnageant décrite
dans le criblage primaire, en utilisant comme bactéries cibles (les
neuf) bactéries citées précédemment et le milieu de
culture Mueller Hinton.
L'étude de l'activité antibactérienne a
été suivie pendant trois mois.
2-3-2- Activité antibactérienne du
mycélium (aérien et substrat) :
Après trois mois d'incubation, le mycélium total
a subi des extractions par les solvants organiques polaire et apolaire
(éthanol et éther de pétrole éthylique), afin de
tester l'activité antibactérienne du mycélium
aérien et celle du substrat.
· Extraction par l'éthanol :
Cette méthode a été décrite par Ravindra
et al (2004).
Ø Le mycélium aérien :
On a broyé 0.5g du mycélium aérien dans 50
ml d'éthanol par un broyeur de type (IKAR WERKE) avec une
vitesse 13500 tours / mn pendant 15 mn, la phase liquide a été
séparée du culot par filtration. Cette opération a
été répétée en additionnant 25 ml du solvant
au culot récupéré. Le filtrat a été
déshydraté ensuite, par passage sur sulfate de sodium anhydre (
Na 2 SO4 ), puis évaporé sous vide à
température 45°C et avec une vitesse rotatif 150 tour/mn
grâce à un évaporateur rotatif de type ( Laborota 4000
efficient ) . Le résidu ainsi obtenu a été conservé
à 4°C.
Ø Le mycélium du substrat : On a
broyé 15 g du mycélium dans 150 ml d'éthanol pendant 15 mn
par le même type de broyeur et la même vitesse de broyage.
après la filtration, l'opération est répétée
en additionnant 75 ml ensuite 25ml d'éthanol. Pour les autres
étapes le même protocole d'extraction du mycélium
aérien.
· Extraction par l'éther de pétrole
éthylique : Cette méthode a été
inspirée de la méthode décrite par
Ravindra et al (2004).
Ø Le mycélium aérien : On a
broyé 0.2 g du mycélium aérien dans 25 ml d'eau
distillé pendant 15 mn par le même type de broyeur et la
même vitesse de broyage, on a ensuite, ajouté 25 ml d'éther
de pétrole éthylique afin d'obtenir deux phases de
séparation ; la phase aqueuse a subi une deuxième extraction
par 20 ml d'éther de pétrole éthylique et la phase
étherique a été récupérée. Les phases
étheriques récupérées ont été
déshydratées par passage sur Na 2 SO4,
ensuite évaporées par le même type d'évaporateur et
la même température. Le résidu obtenu est conservé
ensuite à 4°C.
Ø Le mycélium du
substrat : On a broyé 20g du mycélium dans 200
ml d'eau distillé pendant 15 mn par le même type de broyeur et
avec la même vitesse, ensuite on a ajouté 200 ml d'éther de
pétrole éthylique afin d'obtenir deux phase. La phase
étherique était récupérée et la phase
aqueuse a subi des extractions successifs par l'éther de pétrole
éthylique (100 ml, 50 ml et 30 ml). On a ensuite suivie le
même démarche d'extraction décrite auparavant.
· Le test d'antibiose : On a
solubilisé tout d'abord les résidus par 5 ml du même
solvant d'extraction ensuite, on a réalisé ce test en utilisant
les neufs bactéries-cible et la méthode de disque
imprégné. Le control négative (l'éther de
pétrole éthylique et l'éthanol).
CHAPITRE III
RESULTATS ET INTERPRETATIONS
1- Description des stations de
prélèvement :
Le tableau 1 et la figure 4 illustrent les
caractéristiques de chaque station (la faune, la flore, la mycoflore, la
profondeur et la surface des points de prélèvement).
Le choix des points de prélèvements de la
station 3 était effectué en fonction de l'origine du sol
tapissant. On a retenue dans nos prélèvements seulement ceux qui
ont un sol tapissant endogène (propre à la grotte).
Tableau 1 : Description des stations de
prélèvements.
|
Station
|
Point de prélèvement
« Px »
|
profondeur
|
Surface
Lar/lon
|
Faune
|
Flore
|
mycoflore
|
|
Station 1
|
P
|
10 m
|
3m/ 10m
|
Insectes et chauve-souris
|
Les algues (l'entrée)
|
-
|
|
Station 2
|
P
|
10 m
|
5m/ 20m
|
Porc-épic
|
-Des arbres
(l'entrée).
-Détritus végétaux et fourrages
(l'intérieur)
|
-
|
|
Station 3
|
P1
|
76 m
|
10m/ 10m
|
-
|
-
|
-
|
|
P2
|
185 m
|
-
|
Tapis mycélien foncé en Décembre et
atténué en Mars
|
|
P3
|
280 m
|
-
|
-
|
|
P4
|
60 m
|
Pigeons
|
-
|
* Les points de prélèvements (P1,
P2, P3, P4) ont été
situés en empruntant le chemin aménagé à
l'intérieur de la grotte. P1 à gauche du chemin
supérieur. P2, P3 et P4 à droite
du chemin inférieur.
D
F
B
E
C
A
     
Fig.4. Les stations de
prélèvement. A, B et C. Station 1 (Ghar Sokhrane). D. Point de
prélèvement P2 de la station 3 (Ghar Beni Aâd).
E. Un échantillon du point de prélèvement P2 de
la station 3. F. Station 2 (entrée).
2- Isolement et dénombrement :
Afin d'atteindre notre objectif (l'isolement des champignons
producteurs d'antibiotiques), on a limité notre étude sur le
genre Penicillium.
Après l'étude des caractéristiques
culturaux et morphologiques des souches isolées, 152 souches de
Penicillium ont été
sélectionnées (Tableau 2).
Tableau 2 : Isolement des souches de
« Penicillium ».
|
Mois de prélèvement
|
Station
|
Point de prélèvement
|
Type de substrat et dilution
|
Nombre de souche
|
|
Novembre
|
Station 1
|
P
|
Sol (10-1)
|
15
|
|
Station 2
|
3
|
|
Décembre
|
Station 1
|
P
|
Sol (10-1)
|
37
|
|
Station 3
|
P1
|
4
|
|
P2
|
25
|
|
P3
|
7
|
|
Mars
|
Station 3
|
P2
|
Sol (10-1)
|
15
|
|
Concrétion
|
30
|
|
P3
|
Concrétion
|
12
|
|
P4
|
Sol (10-1)
|
0
|
|
Concrétion
|
3
|
D'après le tableau, on a constaté que le nombre
de souche de « Penicillium » isolé du sol
était plus élevé au niveau du station 1 ; 15 isolat
en Novembre et 37 isolat en Décembre . Cependant le nombre le plus
faible est celui du station 2 (3 isolat).
Concernant la station 3, le nombre de souche de
« Penicillium » le plus élevé
était isolé à partir des échantillons de sol du
point de prélèvement P2 dont on a isolé 25
souches en mois de Décembre et 15 souches en mois de Mars.
Les résultats d'isolement de
« Penicillium » aux niveau du P4 a
révélé l'absence total d'isolats.
A propos des souches de
« Penicillium » isolées des
concrétions sédimentaires, on a remarqué que le nombre le
plus élevé était à partir des échantillons
du point de prélèvement P2 (30 isolats) suivie par
P3 (12 isolats) et en dernier lieu P4 (3 isolats).
En résumé, on a constaté que la station 1
et le point de prélèvement P2 de la station 3 ont
été la source principale de nos isolats de
« Penicillium ».
3- La souche 23 B :
Au cour de la sélection des souches de
« Penicillium », on était
attiré par une des souches isolées qu'on l'avait vue pour la
première fois dans notre laboratoire, la souche 23 B, alors on a
essayé de l'identifier en étudiant les caractéristiques
culturaux (Technique 2) et morphologiques
(Technique de microculture).
3-1- Origine d'isolement :
La présence de cette souche dans nos isolements a
été répétée dans plusieurs
échantillons avec les deux types de substrats (sol et
concrétion), pour les deux prélèvement (Décembre et
Mars) et en utilisant différents milieux d'isolement.
Les résultats d'isolements de cette souche ont
révélées sa présence seulement au niveau du point
de prélèvement P2 de la station 3 (Tableau 3).
Tableau 3 : Origine de la souche 23 B.
|
Mois
|
Station
|
Point de prélèvement
|
Type de substrat
|
Milieu d'isolement
|
|
Décembre
|
3
|
P2
|
Sol
|
MEA, PDAa, SGA
|
|
Mars
|
Sol et concrétion
|
ISP2, MEA, YSA
|
3-2- Identification :
L'observation microscopique des lames (Fig. 5), nous a permis
d'observer au grossissement × 100:
* Des hyphes cloisonnée
* Les hyphes aériens s'allonge et se condense, alors
les conidiophores sont érigés en faisceaux.
* Les cellules conidiogenese (1 à 2 cellule) sont
portées par une cellule légèrement enflée.
* Ces cellules comprennent 2-4 denticules.
* Les conidies ont la forme d'une morula.
E
F
D
C
A
 B B
    
Fig. 5. Aspect microscopique du Beauveria
felina.
-Au grossissement × 10 : A.
Les hyphes aériens agrégés en synnemata.
-Au grossissement × 100 : B. Un hyphe
cloisonné. C. Les hyphes enchevauchés.
D. L'agrégation des hyphes en synnemata. E. Les
cellules conidiogenese.
F. Les conidies en morula.
En étudiant les caractéristiques culturaux, on a
remarqué que la coloration et le diamètre du colonie, la couleur
des hyphes aériens, leur largeur et leur longueur diffère d'un
milieu à l'autre (Tableau 4 et Fig. 6).
En plus, on a constaté que cette souche a donné
une croissance importante sur milieu YESA par rapport aux autres milieux de
culture.
Tableau 4 : Caractéristiques culturaux de la
souche 23 B.
|
Le milieu de culture
|
Diamètre du colonie (mm)
|
Couleur du substrat
|
Couleur des hyphes aériens
|
Autre caractéristique
|
|
ISP2
|
25
|
Rose
|
Rose
|
Des hyphes aériens agrégés mince et
très condensés
|
|
YEA
|
35
|
Beige
|
Blanche
|
Des hyphes aériens agrégés très
minces, la longueur 6mm, arrangées en cercle.
|
|
MEA
|
70
|
Marron
|
Blanche
|
Des hyphes aériens agrégés très
courts
|
|
MYEA
|
42
|
Marron
|
Blanche
|
Des hyphes aériens agrégés condensé
au centre du colonie
|
|
AFPA
|
22
|
Marron
|
Marron
|
Des hyphes aériens agrégés non
observé
|
|
YSA
|
35
|
Beige
|
Blanche
|
Des hyphes aériens agrégés
dressés, recouvert la colonie, longueur 7mm
|
|
YSEA
|
40
|
Beige
|
Blanche
|
colonie recouverte d'hyphes aériens
agrégés embranchés, ont une largeur1mm, une longueur
10mm
|
La culture en récipient,
nous a permis de suivre les caractéristiques de la souche 23B
durant un mois (Fig. 6).
- Après une semaine de l'ensemencement, les hyphes
aériens ont une longueur de 8 mm, ensuite ils donnent des
embranchements 1 à 3 d'un seul point.
- Après un mois, les hyphes aériens
agrégés ont dépassé 55 mm de longueur.
- on a révélé aussi la
sécrétion d'exsudat et l'absence d'une odeur
caractéristique.
G
H
E
F
C
D
A
B
       
Fig. 6. Beauveria felina sur différent milieu de
culture, coulé
-En boite de pétrie : A. ISP2.
B. YEA. C. MEA. D. MYEA. E: AFPA. F. YESA ;
-En récipient : G. YSA ;
-En tube à essai : H. YSA. La présence
d'exsudat.
3-3- Identification de l'espèce :
Après cette étude réalisé dans
notre laboratoire « Produits naturelles »,
on est passé à un autre laboratoire afin d'identifier
l'espèce de cette souche « Muséum National
d'Histoire Naturelle. France ».
L'espèce est alors « Beauveria
felina » (Decandolle : Fries)
J.W Carmichael (autrefois Isaria
felina). La Lettre du
muséum.
Cette lettre a été accompagnée par un
article qui décrit les caractéristiques de cette espèce.
Notre recherche bibliographique, a
révélé que cette espèce appartient à la
famille des « Stilbaceae », caractérisée par
l'association des conidiophores en un synnemata , ordre des
« Moniliales », classe des
« Hyphomycetes », groupe
« Deuteromycotina », Division 3 des champignons
« Amastigomycota »(Barnett et Barry, 1972 ).
4- Test d'antibiose :
4-1- Les souches de Penicillium :
Afin de réaliser le test d'antibiose des souches de
Penicillium on a utilisé la
méthode 1.
4-1-1- Criblage primaire :
Parmi 152 souches isolées, on a réalisé
le criblage primaire sur seulement 80 souches.
Les résultats de ce criblage ont montrées que 38
souches présentent une activité contre une des trois
bactéries-cible (Escherichia coli
(1), Pseudomonas aeruginosa
(2) et Staphylococcus
aureus (3)). Le tableau 5 représente les
résultats du criblage.
Tableau 5 : Criblage primaire des souches de
Penicillium.
|
Bactéries -cible
|
Zone d'inhibition
|
Nombre de souches
|
|
Escherichia coli
(1)
|
Groupe (1)
|
7
|
|
Groupe (2)
|
4
|
|
Groupe (3)
|
1
|
|
Pseudomonas aeruginosa
(2)
|
Groupe (1)
|
6
|
|
Groupe (2)
|
14
|
|
Groupe (3)
|
2
|
|
Staphylococcus aureus
(3)
|
Groupe (1)
|
2
|
|
Groupe (2)
|
3
|
|
Groupe (3)
|
0
|
*Les diamètres des zone d'inhibition
sont englobés dans des groupes :groupe (1)de 6 mm à 10
mm ; groupe (2) de 10 mm à 14 mm ; le groupe (3) de 14 mm
à 16 mm .
D'après le tableau, on a constaté que la plupart
des souches de Penicillium testées ont
exercées une activité inhibitrice entre 11 mm et 14 mm dont 14
souches uniquement dans le cas du bactérie-cible
Pseudomonas aeruginosa.
Le nombre des souches du groupe (1) était moins
important par rapport au groupe (2).
D'après ce même tableau, on a remarqué que
certaines souches ont présenté une activité importante
« le groupe (3) » dont la zone d'inhibition était
entre 14 mm et 16 mm. Pour cette raison, on a essayé de présenter
l'origine d'isolement de ces souches (Tableau 6).
Tableau 6 : Origine des souches du groupe (3).
|
Souche
|
Station
|
Point de prélèvement
|
Le type de substrat
|
Le mois de prélèvement
|
La zone d'inhibition et bactérie cible
|
|
31S2
|
Station 1
|
P
|
Sol
|
Décembre
|
15 mm Pseudomonas aeruginosa
|
|
27G1
|
Station 3
|
P2
|
Sol
|
Décembre
|
16mm Pseudomonas aeruginosa
|
|
6G1
|
Station 3
|
P2
|
Sol
|
Décembre
|
16mm Escherichia coli
|
D'après le tableau, on a remarqué que les
souches du groupe (3) proviennent tous des prélèvements du sol du
mois de Décembre, et dont l'origine du prélèvement
était différent : la souche 31S2 provient du
station 1 et les deux autres souches 27G1 et 12 G1
proviennent du point de prélèvement P2 de la
station 3.
4-1-2- Criblage secondaire :
Nous avons retenu pour ce test 14 souches de
Penicillium révélant une
activité antibactérienne plus ou moins important par rapport aux
autres souches testées dans le premier criblage.
Les résultats du deuxième criblage ont
montré que seules 7 souches ont présenté une
activité antibactérienne contre aux moins une
bactérie-cible.
Les résultats du premier et du deuxième
criblage de ces souches sont illustrés dans le tableau 7.
Tableau 7 : Criblage secondaire des souches de
Penicillium
|
Souche
|
Criblage primaire
|
Criblage secondaire
|
|
1
|
2
|
3
|
1'
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
18S1
|
8
|
/
|
/
|
-
|
-
|
8
|
-
|
-
|
-
|
-
|
-
|
-
|
|
29S2
|
/
|
14
|
/
|
-
|
-
|
-
|
-
|
-
|
-
|
8
|
15
|
20
|
|
14G1
|
/
|
/
|
11
|
-
|
9
|
8
|
-
|
-
|
-
|
-
|
11
|
18
|
|
27G1
|
/
|
16
|
/
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
14
|
16
|
|
32G1
|
/
|
13
|
/
|
-
|
-
|
11
|
-
|
-
|
-
|
-
|
11
|
-
|
|
34G1
|
/
|
14
|
/
|
9
|
-
|
8
|
7
|
7
|
-
|
-
|
10
|
8
|
|
40G1
|
/
|
10
|
/
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
8
|
14
|
* Les bactéries-cibles sont représentées
par des numérotations :
1 : Escherichia coli ;
2 : Pseudomonas aeruginosa ;
3 : Staphylococcus aureus ;
1' : Escherichia coli ;
4 : Citrobacter freundï ;
5: Enterobacter cloacea ; 6 :
Klebsiella pneumoneae ; 7 : Listeria
monocytogenes; 8 : Proteus
mirabilis ; 9 : Salmonella
typhi.
* Les chiffres indiquent le diamètre des zones
d'inhibition exprimées en mm y compris celui du disque.
* (-) indique l'absence d'une zone d'inhibition notable.
* (/) indique un test non réalisé.
D'après les résultats du deuxième
criblage (Tableau 7 et Fig. 7), on a constaté que la plupart des
souches testées ont exercées une activité inhibitrice
contre les deux bactéries-cible Salmonella
typhi et Proteus
mirabilis.
Dans le cas du bactérie-cible Salmonella
typhi, l'activité
antibactérienne la plus importante était observée chez la
souche 29S2 (20 mm), suivie par 14G1 , 27G1,
40G1et en dernier lieu 34G1. Les souches 32G1
et 18S1 n'ont exhibées aucune activité contre
cette bactérie-cible.
La zone d'inhibition provoquée par la souche 29S2
contre la bactérie-cible Proteus mirabilis (15
mm) était aussi la plus importante par rapport aux autres souches de
Penicillium testées dont 27G1 avec une zone
d'inhibition (14 mm), suivie par 14G1(11 mm), 32G1 (11 mm),
34G1(10 mm) et en dernier lieu 40G1(8 mm). L'activité
antibactérienne du 18S1 n'était pas
exprimée.
Cependant, l'activité antibactérienne contre les
autres bactéries- cible Escherichia coli
(1'), Pseudomonas aeruginosa,
Staphylococcus aureus, Citrobacter
freundï, Enterobacter
cloacea, Klebsiella
pneumoneae et Listeria
monocytogenes était faible (7 mm à 9 mm) ou non
exprimée. Seul l'activité antibactérienne de la souche
32G1 contre Staphylococcus aureus
qu'elle était remarquable (11 mm).
En comparant ces résultats à ceux du premier
criblage, on a remarqué que les zones d'inhibitions obtenues durant le
deuxième criblage étaient nettement inférieur a ceux
obtenues en criblage primaire.
A titre d'exemple, les zones d'inhibitions des souches de
Penicillium contre la bactérie- cible
Pseudomonas aeruginosa en premier criblage
étaient entre 10 mm et 16 mm, tandis qu'en deuxième criblage la
plupart des zones d'inhibitions des mêmes souches ont été
non exprimées.
En résumé, le premier et le deuxième
criblage nous ont permis à révéler une activité
antibactérienne plus ou moins important chez la plupart des souches dont
certaines d'entre eux ont présentées une activité
importante autant en premier criblage qu'en deuxième (la
souche 27G1) ; tandis que d'autre ont
révélées une activité importante dans le criblage
primaire et une activité faible ou négligeable en deuxième
criblage.
4-1-3- Identification de la souche 27G1 :
Du fait de l'importance de l'activité
antibactérienne de la souche 27G1, il nous a
paru utile d'identifier l'espèce de cette souche en utilisant La
technique « 1».
Cette technique, nous a permis de rapprocher la souche
à l'espèce ....(Tableau 8 et Fig. 10)
Tableau 8 : Identification de la souche
27G1.
|
Les souches
|
Milieux de culture et température
d'incubation
|
|
CDA
25°C
|
CYA
|
G25N
25°C
|
MEA
25°C
|
|
37°C
|
4°C
|
|
27G1
|
40 mm
|
|
30 mm
|
|
|
|
|
|
|
|
|
A
B



Fig. 7. L'activité antibactérienne
de la souche 29S2 dans le deuxième criblage. A.
Contre la bactérie-cible Proteus mirabilis (8). B. Contre la
bactérie-cible Salmonella typhi (9).
A
B
 
Fig. 8. Aspect cultural de la souche 27
G1. A. Sur le milieu CYA (4°C). B. Sur le milieu CDA
(25°C).
4-2- Beauveria felina :
Le test d'antibiose de la souche 23 B identifiée
précédemment comme l'espèce Beauveria
felina, a été effectué selon la
méthode 2.
Après 20 jours d'incubation de cette souche, 330 mg de
filaments ont été récoltés et
homogénéisés dans 50 ml d'eau distillée
stérile. Le test d'antibiose de cette suspension contre la
bactérie-cible Pseudomonas aeruginosa a
révélé une zone d'inhibition d'une valeur de 14mm.
5- PRODUCTION DES substances
antibactérienneS:
Plus des résultats d'isolements et d'identification
intéressante de la souche 23B, nous avons montré dans le test
d'antibiose que les filament aériens agrégés (ou
synnemata) de cette souche ont exhibés une activité
antibactérienne importante contre la bactérie-cible
Pseudomonas aeruginosa.
De ce fait, on a essayé dans cette partie
d'étudier en même temps l'activité antibactérienne
du surnageant et celle du mycélium avec ses deux formes (aérien
agrégés et substrat) en utilisant la culture en milieu liquide
(Fig. 9).
5-1- Activité antibactérienne du
surnageant :
L'étude de l'activité antibactérienne du
surnageant contre les neuf bactéries- cible au cours de trois mois
d'incubation, n'a révélée aucune activité
notable.
1
2
A
B
 
Fig.9. Beauveria felina sur milieu
liquide. A. Vue général. B.1. Les hyphes aériens
agrégés.2. Le mycélium du substrat.
5-2- Activité antibactérienne du
mycélium (aérien et substrat) :
Les résultats d'activités
antibactériennes du mycélium (aérien et substrat)
après les opérations d'extractions sont illustrées dans le
tableau 9.
Tableau 9 : L'activité antibactérienne des
extraits étheriques et éthanoliques du mycélium
(aérien et substrat).
|
Solvant d'extraction
|
Substance test
|
Bactérie -cible
|
|
1'
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
Ethanol
|
Mycélium aérien
|
13
|
14
|
15
|
11
|
14
|
12
|
13
|
12
|
12
|
|
Mycélium du substrat
|
12
|
-
|
10
|
11
|
12
|
8
|
8
|
13
|
13
|
|
Contrôle négative
|
7
|
7
|
10
|
8
|
9
|
7
|
7
|
9
|
8
|
|
Ether de pétrole éthylique
|
Mycélium aérien
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Mycélium du substrat
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Contrôle négative
|
8
|
-
|
9
|
7
|
8
|
9
|
-
|
7
|
7
|
* Les bactéries-cibles sont représentées
par des numérotations :
1' : Escherichia coli ;
2 : Pseudomonas aeruginosa ;
3 : Staphylococcus aureus ;
4 : Citrobacter freundï ;
5 : Enterobacter cloacea ;
6 : Klebsiella pneumoneae ;
7 : Listeria monocytogenes;
8 : Proteus mirabilis ;
9 : Salmonella typhi.
* Les chiffres indiquent le diamètre des zones
d'inhibition exprimées en mm y compris celui du disque.
* (-) indique l'absence d'une zone d'inhibition
notable.
Le tableau 9 et la figure 10 montrent que l'extrait
étherique du mycélium qu'il soit aérien ou du substrat n'a
présenté aucune activité antibactérienne contre les
bactéries-cible .
Cependant les extraits éthanoliques des filaments
aériens et du substrat ont révélés une
activité antibactérienne importante contre la majorité des
bactéries-cibles.
Par ailleurs, l'extrait éthanolique du mycélium
aérien (synnemata) a présenté un pouvoir
antibactérien plus important par rapport à celui du substrat
surtout dans le cas du bactérie-cible Pseudomonas
aeruginosa dont la zone d'inhibition de l'extrait du
mycélium aérien était 14 mm, cependant celui du
mycélium du substrat n'a présenté aucune
activité.
En résumé, l'étude de l'activité
antibactérienne de la souche 23B appartenant à
l'espèce Beauveria felina a montré que
les extraits éthanoliques du mycélium avec ses deux formes
(aérien et substrat) ont exercées une activité
antibactérienne contre la majorité des
bactéries-cibles.
F
E
C
D
B
A
     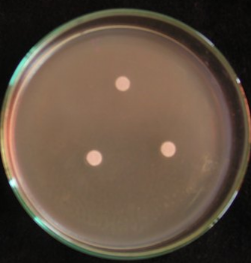
Fig. 10. L'activité
antibactérienne de la souche 23B « Beauveria
felina » contre la bactérie-cible Enterobacter
cloacea (5).
- Le control négative : A. Ethanol. B. Ether de
pétrole éthylique.
- Les filaments aériens agrégés : C.
L'extrait éthanolyque. D. L'extrait étherique.
- Les filaments du substrat : E. L'extrait
éthanolyque. F. L'extrait étherique.
CHAPITRE IV
DISCUSSION GENERALE
![]()
La résistance des bactéries aux antibiotiques, a
imposée beaucoup de chercheurs dans le monde entier d'utiliser toutes
les méthodes dans l'espoir de minimiser le danger de ces
bactéries, dont l'une de ces méthodes était l'isolement de
nouvelles souches fongiques productrices d'antibiotiques à partir des
milieux naturels.
Notre travail, basé sur la recherche de ce type de souche
fongique à partir du sol et des concrétions sédimentaires
des grottes de Ain Fezza a pu rattacher les isolats ont deux groupes. Le
premier était la cible de notre recherche, dès le début,
représenté alors par les souches du genre
Penicillium. Tandis que le deuxième, sa
présence dans notre étude était liée beaucoup plus
au hasard que d'autre chose, représentée alors par les souches de
l'espèce Beauveria felina.
A partir des résultats d'isolement et d'identification des
souches de Penicillium, on a constaté que la
plupart des 152 isolats proviennent des échantillons du sol de la
station 1 et les échantillons du sol et des concrétions
sédimentaires du point de prélèvement P2
situé à 185 m de l'entrée de la station 3.
D'un autre côté, la station 2 et les points de
prélèvements P1, P3 et
P4 situés respectivement à 60 m, 280 m et 76 m de
l'entrée de la station 3, ont donné une fraction infime d'isolats
de Penicillium.
Par ailleurs, tout être vivant a besoin de se nourrir, de
boire et de respirer. Ces trois exigences ont contribué à la
distribution des êtres vivants dans notre planète, y compris les
champignons.
La matière nutritive, l'eau et l'air sont aussi sous la
dépendance d'autres facteurs qui peuvent agir directement ou
indirectement sur la répartition des champignons souterrains. Prenons la
matière nutritive.
Dans notre travail, la richesse de certaines stations et points
de prélèvement en matière nutritive est peut être
attribué à plusieurs facteurs, telle que la lumière.
Selon Jeannel (1937) :« Aux
entrées des grottes, la lumière du jour pénètre
plus ou moins loin ; dans les parties profondes du domaine souterrain
l'obscurité est totale, éliminant toute possibilité, pour
les plantes à chlorophylles, de croître. ». L'absence de
ces plantes, ou généralement les organismes
photosynthétiques, dans ce domaine surtout dans les endroits plus
profonds influence sur sa richesse en matière organique
végétale et animale ; or on sait, que ces organismes sont
les principaux producteurs de la matière dans la chaîne
alimentaire.
Revenons à nos stations de prélèvement, si
on prend la station 1, on trouve que les algues vertes gagnent une surface
importante de l'entrée (Fig. 4.B). Ces algues sont une bonne source
alimentaire pour l'abondance des champignons du genre
« Penicillium » dans les échantillons des
dix mètres premiers du sol de cette station. Mais on peut pas attribuer
cette abondance seulement à la présence des organismes
photosynthétiques. Pourquoi ?
La station 2, est aussi caractérisée par une
végétation plus importante à l'entrée (les arbres
fruitiers), or la fraction infime de nos isolats de
Penicillium provient des échantillons du sol
de cette station. La question qui peut se poser, est ce que le type de
végétation a une influence sur ces résultats (arbres
fruitiers ou algues vertes) ?
Cependant, le point de prélèvement
« P2 » a donné une fraction importante d'
isolats de « Penicillium », bien qu'il soit
situé à 185 m de l'entrée de la station 3
(obscurité total) où on a presque aucune chance d'existence
d'organismes photosynthétiques.
De ce fait, la présence de la matière organique
végétale sous l'influence de la lumière solaire peut jouer
un rôle dans l'abondance des champignons du genre
« Penicillium » dans ces stations, mais peut
être ce n'est pas le plus important.
Outre, cette source de matière nutritive, d'autres peuvent
intervenir de façon plus importante dans l'abondance du
« Penicillium ». Prenons les animaux, ils
constituent par leurs cadavres et leurs excréments une bonne source de
la matière organique. L'eau joue un rôle aussi important qu'on
peut l'imaginer ; par ses mouvements superficiels et souterrains, elle
entraîne des détritus végétaux et des organismes en
petite taille.
Selon Tercafs (1997) : « La biomasse totale
existant dans les milieux souterrains est généralement faible.
Presque toute l'énergie disponible provient de deux sources
extérieures. Un premier apport, très important, est
constitué de détritus végétaux et d'organismes de
petite taille entraînés par les eaux souterraines (eaux de
percolation et eaux libres). Le second apport provient de l'entrée
régulière d'organismes actifs (trogloxènes) " non
consommateurs " qui viennent peupler l'écosystème. L'exemple le
plus frappant est celui des chauves-souris qui vont se nourrir au-dehors, mais
dont le guano libéré dans les grottes est le point de
départ d'une faune inféodée considérable».
En ce qui concerne nos stations de prélèvement, on
a remarqué d'après le tableau 1 qu'il y avait une
différence entre les sources d'énergie des stations de
prélèvement et même entre ceux des points de
prélèvement de la même station.
Si on prend la station 1, on remarque que les sources
d'énergies sont peut être assurées en grande partie par les
animaux observés aux cours de nos prélèvement
(chauve-souris et insectes) plus les eaux pluviales
pénétrées à travers l'entrée de cette
station.
En rapportant ces observations aux résultats d'isolement
des souches de « Penicillium », on peut dire que
la présence de la matière nutritive représentée par
ces deux types d'apports ont une grande responsabilité sur l'abondance
des isolats de« Penicillium » dans les
échantillons de sol de cette grotte. Mais ils ont pas peut être la
grande responsabilité.
Prenons la station 2, cette station caractérisée
par la présence d'une source de matière organique
végétale importante, elle a aussi révélé la
présence d'autres sources d'énergies considérable du point
de vue quantitatif. En citant le porc-épic, détritus
végétal, fourrages, activité humaine et les bestiaux, on
dit que cette station a un apport énorme en matière organique et
à partir de son sol on peut isoler une fraction importante de souche de
« Penicillium », or c'est le contraire. Pourquoi,
alors ?
Au niveau de cette station, on a remarqué que la surface
mouillée par l'eau était limitée seulement à
proximité de son entrée, alors que l'eau était un apport
d'énergie important. Donc les résultats d'isolement de cette
station peuvent être dus à l'eau.
Par ailleurs, si on prend la station 3 on remarque le même
cas que la station 2, dont on a isolé une fraction très infime de
souche de
« Penicillium » à
partir des échantillons du sol du point de prélèvement
P4, bien qu'il abrite un nombre considérable de pigeons,
alors que le point de prélèvement P2 était
notre source principale d'isolats de
« Penicillium » pourtant on n'a
remarqué aucune trace d'animaux aux cours de nos
prélèvements.
C'est peut être du à l'eau, bien que tous les point
de prélèvement de cette station soient alimentés par les
eaux d'infiltration. Mais, si on prend la remarque concernant la couleur du
tapis mycélien du point de prélèvement P2
qu'était foncé en période sèche
(décembre), et clair avec des hyphes bien visualisés après
la période neigeuse (mars), on peut penser que les eaux d'infiltration
ont un rôle important dans l'abondance des souches de
« Penicillium », puisque les eaux
d'infiltration ont été plus intense en mois de mars.
Par suite de ces résultats, on pose plusieurs questions,
est ce que c'était le type de matière nutritive qui est
responsable des résultats d'isolement
du « Penicillium » et pas la
quantité, ou bien c'était l'eau qui a la grande
responsabilité ?
D'un autre côté, le type d'apport de la
matière nutritive de l'extérieur des trois stations, ainsi l'eau
sont peut être lié indirectement à la forme de
l'entrée de chaque station. Prenons la station 1, l'ouverture
très étroite de cette station, plus la verticalité des
deux mètres premiers de la station (Fig. 4.B) a rendu l'accès de
l'homme et des vertébrés difficile par rapport à la
station 2 dont elle est caractérisé par une entrée
très large et une grotte horizontale, contrairement à l'eau dont
il peut pénétrer facilement dans le cas de la station 1, par
rapport à l'autre station.
La station 3 considérée comme un lieu touristique
intéressant, à son entrée il y a une grande porte
grillée éliminant toute possibilité des
vertébrés d'accès à travers. Les pigeons
observés au niveau du point de prélèvement P4
(le point de prélèvement le plus proche à l'entrée)
ont été entrés par une ouverture en haut de
l'entrée. La forme de l'entrée de cette station, ne peut jouer
aucun rôle dans l'alimentation de nos points de prélèvement
en eau.
A l'égard de la matière nutritive, les champignons
des grottes ont besoin de l'eau et d'air comme tout être vivant.
A propos de ces deux éléments
Jeannel a dit en 1937 « Il ne semble pas que l'air et l'eau
aient une composition spéciale dans le domaine souterrain. L'eau est
saturée de calcaire, comme bien des eaux superficielles ».
Dans le monde souterrain, l'eau et l'air ne semblent pas qu'ils
ont une composition spéciale mais ils peuvent influencer sur l'abondance
des champignons du genre
« Penicillium », aussi ils
peuvent être influencés par d'autres facteurs. Alors, voyons quel
rôle ils peuvent jouer dans nos stations de prélèvement.
Prenons l'eau.
En analysant les résultats des observations sur terrain,
on remarque qu'il existe une différence entre l'alimentation des trois
stations en eau. L'eau alimentant les deux stations 1 et 2 était
d'origine pluviale entrée par l'ouverture principale des grottes, dont
il est plus remarquable dans le cas de la station 1 que l'autre station vue la
forme de son entrée. Cependant, l'eau alimentant la station 3 est comme
origine l'eau d'infiltration plus des sources de cours d'eaux présents
au niveau des points de prélèvement P2 et
P3.
Par suite de ces résultats, on peut dire que l'eau est
suffisante au niveau de tous les sites d'étude à l'égard
de la station 2.
Parallèlement à la matière organique et
l'eau, les champignons ntant qu'organismes hétérotrophes ont
besoin d'oxygène pour vivre. Cependant, l'approvisionnement du milieu
souterraine en oxygène et comme tous les autres milieux (terrestre,
aquatique,...) est sous la dépendance de l'activité des
organismes photosynthétiques dégageant l'oxygène.
Alors, on peut dire que plus l'activité
photosynthétique de ces organismes est plus importante, plus le milieu
s'enrichit en oxygène. Or, le milieu souterrain est
caractérisé par l'absence de la lumière, surtout dans les
galeries les plus profondes, alors que c'est un facteur important pour
l'assimilation chlorophyllienne ; ce qui a rendu ce milieu, un des milieux
les plus pauvres en oxygène. Par contre, ce milieu est
caractérisé par un apport énorme de gaz carbonique
libéré aux cours des précipitations calciques et le
ruissellement des eaux souterraines.
Selon Jeannel (1937) « On
connaît un assez grand nombre de grottes à acide carbonique. Ce
gaz remplit les bas-fonds et y forme des lacs gazeux où toute vie est
impossible. Lorsqu'il coule en ruisseaux aériens dans les galeries
souterraines, il rend l'air irrespirable pour l'homme ».
Si on prend en considération la relation proportionnelle
entre l'oxygène et les organismes photosynthétiques, on peut dire
que parmi nos stations de prélèvement les plus riches en
oxygène étaient la station 1et la station 2 ; tandis que les
plus pauvres sont les points de prélèvements de la station 3.
Donc les deux stations 1 et 2 ont été des milieux favorables
à l'abondance des champignons du genre
Penicillium, alors que les résultats
d'isolement ont été appropriés dans le cas de la station 1
et non dans le cas de la station 2.
Concernant la station 3, les résultats d'isolement des
souches de Penicillium ont été
remarquables. L'absence des producteurs d'oxygène, plus l'infiltration
des eaux aux niveaux de tous les points de prélèvement peut les
transformer en milieu très pauvre en oxygène et riche en gaz
carbonique, alors que le point de prélèvement P2
situé à 180 m de l'entrée, où la chance d'existence
des organismes chlorophylliens est négligeable, a été la
source principale de nos isolats de penicillium.
D'après ces résultats, on peut dire que les
organismes photosynthétiques endogènes n'étaient pas le
seul facteur limitant d'oxygène dans ces stations, et surtout la station
3. L'oxygène est peut être apporté aux cours des
renversements des courants d'air entre la grotte et l'extérieur, dont on
peut remarquer que la largeur de la grotte dans le cas de la station 3 peut la
transformer en un stock d'oxygène, et surtout à proximité
de l'entrée. Cependant, le point de prélèvement
P2 est très éloigné de l'entrée et
même de l'autre ouverture.
Le problème ne se pose pas à la distance entre ce
point de prélèvement et les deux entrées de la station
puisqu' elle n'est pas énorme, l'oxygène est suffisant ; mais
c'est la rétention de l'oxygène par le sol, qu'elle peut poser
les problèmes ; et surtout, lorsqu'on lie ce que vient à
l'influence de l'oxygène et gaz carbonique sur la microflore tellurique
et son activité abordé par Dommergues (1969) :
« Le sol est formé de particules
élémentaires (sable, limon, argile) assemblées en
agrégats et constituant un système poreux (phase solide) dont les
espaces libres sont occupés par l'atmosphère du sol (phase
gazeuse) ou par de l'eau (phase liquide ou solution du sol). Les proportions
relatives des phases gazeuses et liquides variant en fonction de
l'humidité, il est difficile de dissocier l'étude de
l'aération du sol de celle de l'humidité : en effet, lorsque
le sol est gorgé d'eau, la phase gazeuse est inexistante et les
échanges avec l'atmosphère libre sont très
faibles. ».
D'après ce paragraphe, on peut dire que la teneur
très élevé en eau du sol du point de
prélèvement P2 (Fig. 4.D et E) peut réduire sa
teneur en gaz! ! !
Mais, peut être c'est vrai si les gaz du sol n'existent que
dans la phase gazeuse ; or, ils n'existent pas seulement dans la phase
gazeuse mais aussi dans les autres phases, phase liquide ou ils sont dissouts
et à l'état adsorbé sur les particules constituant la
phase solide, dont les gaz dissous joue un rôle
biologique important dans la solution du sol, car la plupart des
microorganismes telluriques ne sont pas en contact direct avec
l'atmosphère du sol mais sont recouverts d'un film d'eau plus ou moins
épais dans lequel diffusent les gaz de l'atmosphère (DOMMERGUES,
1969).
Donc, on peut penser que c'est à l'oxygène dissout
qu'on peut rattacher l'abondance des souches de
Penicillium dans ce point, alors que les solutions du
sol sont caractérisées par une concentration en oxygène
beaucoup plus faible et une concentration en gaz carbonique beaucoup plus
élevée que l'atmosphère du sol avec lesquelles elles sont
en contact (DOMMERGUES, 1969).
Après qu'on a discuté l'approvisionnement en
oxygène de ce point de prélèvement, on y trouvé
toujours devant l'impossibilité de ce point d'être un milieu
convenable et même très convenable à l'abondance des
champignons du genre Penicillium. La preuve le tapis
mycélienne (Fig. 4.D et E).
Sans oublier les résultats d'isolement des souches
de Penicillium à partir des concrétions
en mois de mars, on peut attribuer ces résultats dans la majeur partie
aux eaux d'infiltration, qu'elle peut apporter la matière nutritive,
l'eau et l'oxygène. Et, dont Maheu (1906) a dit à propos des
champignons (supérieur) trouvés sur les concrétions :
« La présence du substratum et surtout sa nature
ne doit pas être sans influence sur le développement de ces
champignons. Dans un grand nombre de grottes, les concrétions calcaires
qui recouvrent entièrement le sol s'opposent aux efforts des
mycéliums pour trouver leur nourriture. En effet, ce n'est
qu'exceptionnellement que des formes naines croissent sur des stalactites qui
semblent ne présenter aucune particule alimentaire ; mais
dés qu'apparaissent les matières organiques : boues
liquides, humus, détritus de feuilles, les champignons plus ou moins
bien développés se multiplient rapidement ».
D'un autre côté, les résultats d'isolement
des souches de Penicillium peut être
attribué à notre travail expérimental dont les conditions
de travail (milieux de culture, température d'incubation, pH...ect) ont
permis peut être à la croissance de certaines en faveur
d'autres.
Enfin, on doit faire la remarque sur l'interprétation et
la discussion des résultats d'isolements des souches de
Penicillium, c'est vrais les résultats
apportées dans notre travail étaient ceux des souches
sélectionnées et pas isolées ; mais si on prend les
résultats, à titre exemple, de la station 1 et du point de
prélèvement P2 de la station 3 le nombre réel
des souches isolées étaient beaucoup plus important que celui des
souches sélectionné ; cependant que le nombre réel
des souches des autres stations et les points de prélèvements
était le même que celui des souches sélectionné.
C'est pour cette raison qu'on a dit que la station 1et le point de
prélèvement P2 de la station 3 ont été
caractérisés par l'abondance de nos champignons cible.
Parallèlement à l'isolement des souches de
Penicillium, on a révélé la
nouveauté dans notre laboratoire d'une souche présent uniquement
dans les échantillons du point de prélèvement
P2 de la station 3. L'étude de ces caractéristiques
morphologiques et culturales, suivie par une identification proprement dite par
le Musium National d'Histoire Naturelle de France, a
montré que la souche appartient à l'espèce
Beauveria felina.
D'après l'article qui a accompagné la lettre du
Musium National d'Histoire Naturelle de France, les
caractéristiques morphologiques et culturaux de la souche 23 B ont
présenté une grande similitude avec celle décrit par De
Hoog (1972) en article ci-dessous.
Isaria felina (DC. per Fr.) Fr.
Clavaria (?) felina DC. - Fl. fr. 6:30. 1815; per Fr. -
Syst. mycol. 1: 496. 1821 = Fibrillaria felina (DC. per Fr.) Pers. -
Mycol. eur. 1:53. 1822 = Isaria felina (DC. per [p. 16] Fr.)
Fr. - Syst. mycol. 3: 271. 1832 = Penicillium felinum (DC. per Fr.)
Biourge - Cellule 33: 102. 1923.
Isaria felina (DC. per Fr.) Fr. var. suina
Sacc. - Michelia 2: 561. 1882.
Isaria felina (DC. per Fr.) Fr. var.
aviaria Sacc. - Michelia 2: 561. 1882.
Isaria edwalliana P. Henn. - Hedwigia 43: 209. 1904.
Isaria felina (DC. per Fr.) Fr. var. domestica
Speg. - An. Mus. nac. Hist. nat. B. Aires 23: 121. 1912.
Isaria felina (DC. per Fr.) Fr. var.
cuniculina Ferr. - Fl. ital. crypt., Fasc. 6, Hyphales p. 152.
1910.
Isaria felina (DC. per Fr.) Fr. var. pirina
El. Marchai & Et. Marchai - Bull. Soc. R. bot. Belg. S4: 134. 1921.
Isaria fimicola Sternon - Bull. Soc. R. bot. Belg. 55:
145. 1923.
Isaria cretacea van Beyma - Zentbl. Bakt. ParasitKde,
Abt. 2, 91: 350. 1935 = Beauveria cretacea (van Beyma)
Matsushima - Microf. Solomon Isl., Papua-New Guinea p. 7. 1971.

Fig. 11. Isaria felina. a. conidial
structures; b. conidiogenous cells; c. conidia.
Colonies in vitro attaining a diameter of 8-14 mm in 8
days, forming in fresh isolates a dense felt, from which several white,
positively phototropic synnemata arise (Taber & Vining, 1963), up to 70 mm
high and constantly 1 mm wide, terete, tomentose, usually unbranched, or
occasionally branched at the apex, in old strains appearing lanose to floccose;
at first white, later becoming yellowish. Reverse uncoloured or yellowish to
yellow brown. Exudate rarely produced, odour absent. Submerged hyphae
hyaline, smooth-walled, 1-3 um wide. Hyphae of the aerial mycelium hyaline,
smooth-walled, 1-4.5 um wide, creeping, ascendent or fasciculate, bearing
orthotropic conidiogenous cells, solitarily or in small groups; sometimes 1-2
conidiogenous cells are supported by a slightly swollen stalk [p. 17] cell.
Conidiogenous cells not elongating, consisting of a swollen, flask
shaped or curved, occasionally elongate basal part, mostly 3-8.5 x 2-2.5 um,
and a short, irregular conidiiferous portion, mostly comprising 2-4 denticles;
in age a short geniculate rachis may be formed. Conidia hyaline,
smooth, subglobose, ellipsoidal or ovoidal, sometimes with a pointed base,
(2.5-) 3-4 (-4.5) x (2-) 2.5-3 (-3.5) um. No chlamydospores were observed.
Mycelium on natural substrate forming a thin layer of hyaline
hyphae, from which several white, erect synnemata arise, up to 80 mm high and
constantly 0.5-1 mm wide, usually unbranched. Perfect state unknown.
Material examined
Herbarium specimens
Isaria felina in herb. Fries (UPS), probably
collected by F. Chevallier.
Fibrillaria felina in herb. Persoon (L), Nos.
910.262.101 and 910.262.106, leg. F. Chevallier.
Isaria felina in herb. PC under No. 1534; ex herbarium
Durieux de Maisonneuve, leg. L. Motelay, 1879.
Isaria fimicola in herb. BPI (type), cultures on
carrot.
Isaria fimicola in herb. Shear (BPI), leg. P. Marchal,
Gembloux, Belgium, 1924.
Isaria felina var. suina Sacc. in
herb. Bresadola (BPI), type, on dung, Torino, Italy.
Isaria felina in herb. Bommer & Rousseau
(B), on rabbit dung, 1882.
Isaria edwalliana in herb. S, on carnivore
dung, Sao Paulo, Brazil, 1903.
Isaria felina ex herb. Sydow (S), on rat dung,
Leipzig, Germany, leg. B. Auerswald.
Living strains
CBS 110.08 sent in 1908 by A. F. Blakeslee.
CBS 250.34, type culture of Isaria cretacea,
Epsom, Great Britain, sent in 1934 by D. Hutchinson.
CBS 235.36 isolated by H. A. Diddens from pupa of Anaitis
efformata, Soest, sent in 1936 by R. Tolman.
CBS 236.36 isolated from rabbit dung, Erlangen, Germany, sent in
1936 by H. Greis.
CBS 217.37 isolated from mouldy leaves, sent in 1936 by D.
Hellinga.
CBS 312.50 isolated from rabbit dung, sent in 1950 by K. B.
Boedijn under No. BR 17/50.
CBS 313.50 isolated as culture contaminant, sent in 1950 by Lab.
Microbiology, Delft.
CBS 229.58 sent in 1958 by O. Verona.
CBS 648.66 sent in 1966 by F. J. Herrero, Buenos Aires,
Argentina.
CBS 173.71 isolated from porcupine dung, Ontario, Canada, sent in
1969 by D. Malloch under No. TRTC 45685.
En analysant les informations apportées par l'article, on
a trouvé quelques différences. Prenons l'embranchement des
synemmata ; le lectotype décrit en article est fréquemment
non branché (usually unbranched). Ce n'est pas le cas
pour notre souche (Fig. 7).
En plus, si on prend le paragraphe «Mycelium on
natural substrate forming a thin layer of hyaline hyphae, from which several
white, erect synnemata arise, up to 80 mm high and constantly 0.5-1 mm wide,
usually unbranched. Perfect state unknown.» de l'article
ci-dessus, on remarque que la souche décrite dans cette article a
formé sur son milieu naturel des synnemata de grande taille (80 mm en
longeur et 0.5 à 1 mm en largeur).
Dans le cas de la souche 23B, on ne peut pas trouver ses
caractéristiques sur son milieu naturel (le point de
prélèvement P2 de la station 3). On a observé,
seulement, un tapis mycélien dont on ne peut pas distinguer ses
composants (Fig.4.D) ; sa couleur et sa forme ne peuvent nous donner aucun
renseignement des champignons qui tapissent ce point de
prélèvement. Est-ce que c'est
Penicillium ou bien Isaria
felina ou même d'autres champignons hors ces deux types et
que les techniques d'isolement par suspension-dilution n'ont pas permis de les
détecter.
Devant le problème posé, est ce que le tapis
mycélien est celui d' Isaria felina ou pas, on
essayera de discuter la différence entre le lectotype décrit en
article est la souche 23 B du point de vue croissance sur le milieu
naturelle.
En prenant d'abord, l'origine des souches d'Isaria
felina décrit en article si dessus. Qu'est ce qu'on
trouve ? On trouve que les souches ont été isolées
dans la plupart des cas à partir des excréments d'animaux. En
plus, ces souches ont présenté un caractère très
remarquable : leurs synnemata sont phototropique,
Or, notre souche 23 B et toutes les souches qui lui ressemblent
ont été isolées du sol et des concrétions
sédimentaires d'un point situé à 185 m de l'entrée
d'une grotte (Ghar Beni Aâd), alors l'origine est totalement
diffèrent des autres souches, c'est une souche cavernicole.
Si on considère que le tapis mycélien est celui
d'Isaria felina, qu'est ce qu'on peut dire ?
On peut dire, que même si le tapis mycélien est
celui d'Isaria felina, les hyphes n'ont pas les
mêmes caractéristiques que celle décrites par l'article. La
différence observée est peut être attribuée à
plusieurs facteurs, la matière nutritive, l'oxygène,
l'humidité et enfin la lumière.
Si on prend le biotope des souches citées par l'article,
on trouve que c'est des milieux riches en matière nutritive puisque ce
sont des excréments d'animaux, carotte,...ect. Les autres facteurs n'ont
pas été cités.
Contrairement, à nos souches qui sont isolées d'un
milieu extrême où l'apport en matière nutritive, ainsi en
oxygène pose plusieurs questions du fait des caractéristiques du
point de prélèvement P2 évoquées en
haut. La lumière joue un rôle important puisque les synnemata des
souches citées en article sont phototropique, alors que le biotope de la
souche 23 B est caractérisé par une obscurité total.
Par ailleurs, si on considère que le tapis mycélien
est pas à Isaria felina, on peut dire que les
spores de cette espèce ont été conservés dans le
sol et sur les stalactites, et que les caractéristiques du point de
prélèvement P2 n'ont pas permis le
développement de ces spores. En effet, les moisissures sont parfois
condamnées à un mode de conservation originale. Dans les parties
de réseaux soumises aux courants d'air ascendantes ou descendantes,
notamment à proximité des entrées, les apports organiques,
à la surface des sédiments, peuvent être suffisants -
l'humidité par ailleurs ne faisant que rarement défaut - pour
permettre un début de développement des spores qui les
accompagnent. Ce développement est réduit et on isole
fréquemment, notamment dans les galeries de faible volume ouvertes aux
pollutions, à coté de cours filaments mycélien vides,
à parois épaisses, de grosses spores à parois
épaisses également, mais rarement des sporanges. Ces grosses
spores sont capables ultérieurement d'un développement normal. Le
court mycélium issu de la germination, après avoir
rassemblé son cytoplasme, donne des sortes d'oïdies qui sont
plutôt des kystes correspondant à un stade de conservation
(CAUMARTIN, 1959).
Mais le problème ne s'arrête pas, est ce que le
tapis mycélien est celui d'Isaria felina ou
pas, et encore est ce que Isaria felina est
présent au niveau du point de prélèvement P2
à l'état végétatif ou à l'état de
spore, mais de quel facteur, elle est peut être influencé sous les
deux états.
Les interactions entre les composantes de la mycoflore du sol de
ce point peuvent jouer le rôle, comment ?
Selon Dommergues (1969) « Lorsque l'on inocule un sol
stérile avec un microorganisme quelconque, ce dernier s'y installe
sans difficulté, à condition, bien entendu, qu'il dispose d'un
substrat convenable et qu'il ne soit pas gêné par des facteurs
écologiques défavorables, pH excessif ou insuffisant par exemple.
Par contre, si l'inoculation porte sur un sol non stérile, elle est
souvent vouée à l'échec : c'est ainsi que de nombreux
microorganismes pathogènes pour l'homme, les animaux ou les plantes, ne
se conservent pas dans les sols biologiquement actifs. Cet échec de
l'introduction d'un microorganisme étranger dans un sol non
stérile s'explique par l'intervention de processus antagonistes divers,
dont les principaux sont la compétition, l'antibiotisme, la
prédation et le parasitisme. ».
D'après ce paragraphe, on peut dire que nos souches
d'Isaria felina ont été peut être
à l'état de spore, si c'est le cas, pas seulement à cause
des conditions d'environnement mais les interactions peuvent jouer un
rôle, surtout celles de type antagonistes.
L'un de ces interactions le plus intéressentes est la
mycostase ou phénomène d'inhibition de la germination des spores
fongiques en contact avec le sol, même si les conditions d'environnement
sont favorable à leurs germination. Il est expliqué soit par la
déficience du sol en substrat nécessaire à la germination
d'où apparition d'une compétition très vive entre ces
spores d'une part et les autres éléments de la microflore d'autre
part, soit par la diffusion dans le sol de substances inhibitrices
(mycostatiques), en particulier d'antibiotiques (DOMMERGUES, 1969).
On comprend que, si Isaria felina est
présent au niveau de ce point de prélèvement à
l'état de spore, elle est peut être sous l'influence des
interactions antagonistes, mais si elle est à l'état
végétatif, de quel type d'interaction elle est peut être
soumise ?
Premièrement, on doit faire la remarque sur la
différence entre le tapis mycélien et la forme
végétative. Lorsqu'on a dit le tapis mycélien est celui
d'Isaria felina, on a peut être
négligé un peu le cas ou le tapis mycélien est
formé d'une part par Penicillium, qu'on a
révélé auparavant leur abondance au niveau de ce point, et
d'autre part par Isaria felina et même d'autres
champignons.
Si c'est le cas, on peut dire que ces composantes du tapis
mycélien sont peut être sous la dépendance des interactions
synergiques, qui a rendu ce point de prélèvement un milieu
favorable autant pour Penicillium que pour
Isaria felina malgré les points
d'interrogation accompagnant les conditions d'existences au niveau de ce
point.
Si ce n'est pas le cas, on peut dire que cette espèce a
peut être exercé des interactions antagonistes contre les autres
champignons.
Quoiqu'on parle de la différence observée entre les
caractéristiques du lectotype décrit en article et celles de la
souche 23 B, on ne peut pas négliger la différence entre les deux
origines d'isolement. Alors, si on analyse bien les données de cet
article, qu'est ce qu'on peut dire ?
Hors l'origine d'isolement, l'article n'a pas donné des
informations concernant, sous quelle conditions de croissance a donné
cette espèce la forme décrite en paragraphe si dessus ( la
température, la luminosité et l'humidité), ainsi l'origine
exacte pas seulement des excréments mais aussi des animaux, des
champignons, des carottes...ect. Est-ce qu'ils ont une relation avec les
grottes ?
On essayera d'établir cette relation par le schéma
suivant :
Transport de spores
Excréments
Lapin
Souris
Porc-épic
Carottes
Champignons
Grottes
Excréments
Aliments
Pourquoi on a pensé à cette relation ? Peut
être parce qu'on a trouvé que l'origine d'isolements des souches
d'Isaria felina de l'article ont une relation avec
les grottes ; surtout, lorsqu'on parle du porc-épic dont l'habitat
principal de cet animal c'est les cavités souterraines, et même
quand on parle des autres origines, ils ont une relation avec le monde
souterrain.
Par ailleurs, cette relation peut nous diriger vers une
problématique, est ce que Isaria felina est
une espèce cavernicole ou c'était les animaux cités par
l'article qui ont transporté ces spores à l'intérieur de
la grotte de Beni Aâd.
Avant de terminer, nous devons faire la remarque qu'en
laboratoire on a isolé plusieurs souches de cette même
espèce et à partir de plusieurs échantillons du point de
prélèvement P2 et on a fait plusieurs essais
d'isolement pour éviter les probabilités que cette espèce
d'être un simple contaminant de nos cultures.
On peut ajouter que ce point de prélèvement n'est
pas un endroit préférable aux touristes de la grotte, puisqu'elle
n'est pas concrétionné en formes attirantes. Pourquoi on a dit
ça, tout simplement pour éviter la probabilité que les
souches isolées de cette espèce sont à l'origine les pieds
des touristes.
Afin d' atteindre notre objectif de départ que
c'était l'isolement des souches fungiques à activité
antibactérienne ; on a utilisé deux méthodes, dont
l'une était utilisée pour les souches de
Penicillium, pendant que l'autre était
utilisée pour la souche 23 B.
Concernant la première méthode les souches ont
été passées par deux criblages, afin de
sélectionner les souches les plus puissantes de point de vue
d'activité antibactérienne. En passant par le criblage primaire,
on a révélé la présence d'une activité
inhibitrice chez 38 souches de Penicillium parmi 80
souches testées contre une des trois bactéries-cible.
Les souches de Penicillium les plus
puissantes ont été d'origine la station 1 et le point de
prélèvement P2 de la station 3.
Le criblage secondaire a montré que parmi 14 souches de
Penicillium testées seulement 7 souches qui
ont révélé une activité antibactérienne
contre aux moins une bactérie-cible dont la plupart ont exercée
l'activité inhibitrice contre les deux bactéries-cible
Salmonella typhi et
Proteus mirabilis.
Par suite de ces résultats, on peut dire que les zones
d'inhibitions obtenues en deuxième criblage ont été
nettement inférieures à ceux obtenues en premier criblage des
mêmes souches de Penicillium. Cela est peut
être attribué à la méthode utilisée.
En effet, le milieu de culture peut jouer un rôle important
dans les résultats d'activité antibactérienne (TAKAHASHI
CTAKADA et al, 1994 ; BERNAN et al, 1994) ;
dont il peut influencer par différentes voies, par sa composition, sa
richesse en matière nutritive, son pH et même son état que
ce soit liquide ou solide. Alors, le fait que le milieu de culture
utilisé pour la production des antibiotiques par la méthode de
culture en milieu liquide soit le milieu (YGS) et celui de culture en milieu
solide soit (PDA ac) peut influencer sur les résultats
d'antibiose.
Selon Gaden-Junior (2000), la production des métabolites
est sous l'influence de la composition des milieux de cultures, sa richesse en
nutriment, plus d'autres aspects. Différentes sources de carbones et
d'azotes peuvent agir sur la synthèse des enzymes impliqués dans
le métabolisme primaire et secondaire. Les microorganismes sont capables
d'utiliser une large variété de sources de carbones et d'azotes.
Pourtant, beaucoup de voies de métabolismes secondaires sont
affectées négativement par les sources favorables à la
croissance (SANCHEZ et DEMAIN, 2002).
Plus la composition des milieux de culture, le pH peut influencer
sur les résultats d'antibiose puisqu'il est différent. Le pH
du milieu (YGS) neutre, pendant que celui du (PDA
ac) est acide.
Par ailleurs, il faut ajouter que les conditions de laboratoire
peuvent influencer sur les résultats. Alors, comment ?
Les essais effectués aux cours de notre étude en
laboratoire, nous ont imposé à réfléchir ce n'est
pas seulement à la différence observée entre les deux
méthodes mais aussi les différences observées, quelque
fois, entre les résultats d'une même méthode. Et on a fini
par dire que les conditions climatiques ont peut être joué un
rôle important dans l'expression de l'activité
antibactérienne chez les souches de
Penicillium. Pourquoi ?
On a remarqué que les tests d'antibiose effectués
en climat froid ont donné des résultats positifs, tandis que ceux
effectués en climat chaud ont donné dans la plupart du temps des
résultats négatifs. Cela est peut être attribué
à la production des antibiotiques par les souches de
Penicillium, peut être elle est affectée
par la période sèche même en utilisant des étuves
à 25°C, cela n'est pas sans inconvénient.
Ces remarques, nous font penser à l'origine d'isolement
(les grottes) et les conditions de ce milieu (température,
humidité...ect).
Par ailleurs, les résultats d'antibiose des souches de
Penicillium que ce soit en premier criblage, qu'en
deuxième ont été la preuve de la richesse des grottes et
spécifiquement la station 1 et le point de prélèvement
P2 de la station 3 en producteurs d'antibiotiques. Ces sites
d'études que leurs caractéristiques (la matière organique,
l'humidité, l'oxygène...ect), n'ont pas fait défaut
à la présence des champignons du genre
Penicillium, ont favorisé la
compétition entre ces champignons et les autres éléments
de la microflore du sol, donc la présence des producteurs
d'antibiotiques les plus puissants.
En effet, dans la nature les antibiotiques représentent un
atout pour les bactéries et les moisissures qui les synthétisent.
Cet atout leur permet de nuire à leurs compétiteurs pour mieux
s'accaparer les substances nutritives disponibles dans leur environnement
(GAUTHIER, 1993).
Enfin, nous devons faire remarquer que l'activité
antibactérienne des souches testées peut être plus
importante en milieu naturel que celle exhibée en laboratoire, du fait,
premièrement, aux conditions extrême de nos sites d'étude,
plus le choix de milieu de culture et les conditions de production des
antibiotiques.
Avant de terminer, on ne peut pas oublier un autre
témoignage des résultats d'antibiose des souches de
Penicillium, c'était premièrement, les
caractéristiques du point de prélèvements
P2.
Plus, l'histoire du combattant dans la station 1 avec les
blessures et le jeûne pendant 12 jours au lieu qu'elle s'aggravait, elle
s'est stabilisée. Peut être cet état était du
à la présence des organismes producteurs d'antibiotiques.
A propos de la souche 23 B appartenant à l'espèce
Isaria felina, le résultat d'activité
antibactérienne obtenue par la méthode 2 a montré que les
filaments aériens agrégés libèrent dans l'eau
distillée des substances antibactériennes.
Par ailleurs, les résultats des tests de production des
substances antibactériennes exogènes et endogènes ont
montré une activité négligeable du surnageant, et
parallèlement une activité importante de l'extrait
éthanolique du mycélium (aérien et substrat).
En effet, les filaments aériens agrégés de
cette espèce étaient le cible de beaucoup de chercheurs de
molécules insecticides et même des molécules antifongiques
(GUO et al, 2005). L'étude de l'activité
antibactérienne d' isarfiline contre les bactéries-cibles
(Bacillus subtilus, Escherichia coli et Staphylococcus
aureus), effectuée par Guo et al (2005), a
révélé l'absence d'une activité notable. Alors que
peut on dire de nos résultats ?
La présence d'une activité inhibitrice de la souche
23 B contre les bactéries- cible est peut être attribuée
à plusieurs facteurs ; au milieu de culture, au protocole
d'extraction, aux bactéries- cible, à la souche elle-même
pour des raisons peut être liées plus aux facteurs d'antagonistes
(cités en haut).
Il faut ajouter que l'absence d'une activité
antibactérienne notable du surnageant, ça ne veut pas dire que la
souche n'a pas des substances antibactériennes exogènes ; la
composition du milieu de culture, son pH, ainsi son volume peut influencer sur
les résultats.
Ailleurs, les résultats d'activités
antibactériennes des extraits éthanoliques et étheriques
du mycélium peuvent nous faire penser à la nature hydrophile de
la substance active, puisque l'activité était concentrée
dans l'extrait éthanolique.
CONCLUSION
![]()
En début, la résistance des bactéries aux
antibiotiques nous a incité à la recherche de nouvelles
substances antibactériennes dans le monde souterrain ; or notre
travail a permis non seulement d'accomplir cet objectif, mais aussi
de :
- Ouvrir la porte du monde souterrain de l'Algérie et plus
exceptionnellement le monde fongique.
- Exploiter les fameuses grottes de Aïn Fezza.
- Ouvrir la porte des explorations des grottes de Tlemcen.
- Isoler de nouvelles souches fongiques originales du monde
souterrain de notre région, propres à notre pays.
- Traverser l'ère d'étude des déformations
morphologiques de la flore et la faune souterraine vers l'ère des
molécules thérapeutiques d'origine souterraines.
Alors, on peut dire que ce travail n'est qu'un début.
REFERENCES
BIBLIOGRAPHIQUES
Anonyme 1 (2001). Encyclopédie : la
Spéléologie.
http://www. Cds
06.free.Fr/commission/com-promotion/definition/yahoo.html.
Anonyme 2 (2005). Cavernicoles.
http://www. Univ-ubs.fr/ecologie/cavernicoles.html.
Anonyme 3 (2006). Parc National de Tlemcen. Fiche descriptive
sur les zones humides Ramsar.
Arroyo G, Arroyo I et Arroyo E (1997). Microbiological
analysis of Maltaviesa Cave (Caceres), Spain. International Biodeterioration
and biodegradation. Vol. 40. No. 2-4. Pages 131-139.
Atkinston G (1891). On the structure and dimorphism of
Hypocrea tubaeformis. In : Contribution
à l'étude de la flore souterraine de France (Maheu J).
Thèse de Doctorat, 190 p.
Barnett HL et Barry B.Hunter (1972). Illustrated genera of
imperfect fungi.3émeEd. Burgess Publishing Company, 160p.
Berdy J (1985). Screening classification and Identification of
microbial products. In : Microbiologie industrielle, Les microorganismes
d'intérêt industriels (Florent. J). Ed. Lavoisier Tec et Doc.
612p.
Bernan V S, Montenegro D A, Korshalla J D, Maiese W M,
Steinberg D A et Grreesttein M (1994). Bioxalomycins new antibiotics produced
by the marine Streptomyces sp. In: Isolation, characterisation and
antimicrobial activity of marine halophilic Actinopolyspora species
AH1 from the west coast of India (Kokare CR, Mahadik KR, Kadam SS et Chopade B
A). Current Science, Vol. 86. No. 4-25.
Boiron P (2005). Mycologie. Thèse soutenue dans
d'autre université
Botton B, Breton A, Fevre M, Gauthier S, Guy PH, Larpent
JP, Reymond P, Sanglier JJ, Vayssier Y et Veau P (1990). Moisissures utiles et
nuisibles, importance industrielle. 2iémeEd. Masson. 426p
Bouchet P H, Guignard J L, Villard J (1999). Les champignons,
Mycologie fondamental et appliquée. Ed. Masson : Paris. 194 p.
Breton A, Theilleux J, Sanglier JJ et Vobis G (1989).
Organismes producteurs : Biologie, taxonomie et
écologie. In : microbiologie industrielle, Les microorganismes
d'intérêt industriels (Florent. J). Ed. Lavoisier Tec et Doc.
612p.
Caneva G et Salvadori O (1988). Biodeterioration of Stone. The
deterioration and Conservation of Stone. In : Microbiological analysis of
Maltaviesa Cave (Caceres), Spain. International Biodeterioration and
biodegradation (Arroyo G, Arroyo I et Arroyo E). Vol. 40. No. 2-4. Pages
131-139.
Caumartin V (1959).Quelques aspects nouveaux de la microflore
des cavernes. Ann. Spéléol.14 :147-157.
Chaverri P et Samuels GJ (2004).
Hypocrea/Trichoderma (Ascomycota, Hypocreales,
Hypocreaceae) : Species with green Ascospores. Studies in Mycology. 48:
1-116
De Billerbeck GV (2000). Activité antifongique de
l'huile essentielle de Cymbopogon nardus (l.) W. Watson sur
Aspergillus niger. Évaluation d'un bioréacteur
pour l'étude de l'effet inhibiteur de substances volatiles en phase
vapeur. Thèse de doctorat
De Hoog GS (1972). The genera Beauveria,
Isaria, Tritirachium and Acrodontium gen. nov.
Studies in Mycology. 1 : 40.
Demain AL (1981). Industrial microbiology, Science In :
Microbiologie industrielle, Les microorganismes d'intérêt
industriels (Florent. J). Ed. Lavoisier Tec et Doc. 612 p.
Dommergues I (1969). La biologie des sols. Presses
Universitaires de France : Paris. 125p.
Dubois P et Grellet B (1997). Les concrétions des
grottes enregistrent climats et séismes. Pour la Science. N°
231.
Florent J (1993). Microbiologie industrielle, les
microorganismes d'intérêts industriels. Ed. Lavoisier Tec et Doc.
612 p.
Gaden-Junior EL (2000). Fermentation process kinetics.
Biotechnol. Bioeng. 67, 629-639.
Gauthier (1993). Les antibiotiques : l'envers du miracle.
L'Agora, Vol. 1. N°.3.
Graur A (2001). Emil Racovitza entre Paris, Bucarest et le
pôle sud (Bucarest matin).
http://www. Bucarest-matin.Ro/ARHIVI/2001 FEB/1122
info. html.
Guo YX, Liu QH, Ng TB et Wang HX (2005). Isarfelin, a peptide
with antifungal and insecticidal activities from Isaria felina.
Peptides. Accepted 16 May 2005.
Jeannel R (1937). Les Etres Vivants, Plantes -Animaux ;
Les milieux et Leurs Faunes ; Le Domaine Souterrain. Encyclopédie
Française. Tome 7 .5'54-11, 5'54-16 pp.
Khelil N (1997). Etude des antibiotiques
biosynthétisés par des bactéries filamenteuse
extrêmophiles, notamment Metallogenium sp. Thèse de
Magister, option Biologie Moléculaire et Cellulaire. Ins. Sc. Nat.
Tlemcen.
Leeb M (2004). « A Schot in the arm » in
Nature. N° 431. P. 892-893. In : la course de vitesse entre les
antibiotiques et les bactéries pathogènes
résistantes : analyse et discussion de quelques pistes (Lombard
F).
Locquin M (1984). Mycologie générale et
structurale. Ed. Masson. P. 551.
Lombard F (2005). La course de vitesse entre les antibiotiques
et les bactéries pathogènes résistantes : analyse et
discussion de quelques pistes
Maheu J (1906).Contribution à l'étude de la
flore souterraine de France. Ed. Masson, Paris, 190p, in-8°. Thèse
de Doctorat présentée à la faculté des sciences de
Paris pour obtenir le grade de Docteur en sciences naturelles.
Mason-Williams A et Benson-Evans K (1967). Summary of results
obtained during a preliminary investigation into the bacterial and botanical
flora of caves in south Wales. Int. J. Speleol. 2 :397-402.
Pomerol C et Renard M (1997). Elément de
Géologie. 11iéme Ed. Masson. 629p.
Purves WK, Orians GH et Heller HC (1994). Le monde vivant.
Traité de biologie. Sciences/ Flammarion. 1224p.
Ramirez C (1982). Manual and atlas of the penicillia.
Amsterdam - New York - Oxford . Elsevier Biomedical press. 874p.
Ravindra G, Ranganayaki RS, Raghothama S, Srinivasan MC,
Gilardi RD, Karle IL et Balaram P (2004). Two Novel
Hexadepsipeptides with Several Modified Amino Acid Residues Isolated from the
Fungus Isaria.Chemistry and Biodiversity. Vol.1.
Saadoun I, Hameed KM et Moussaoui A (1999). Characterization
and analysis of antibiotic activity of some aquatic actinomycetes. Microbios.
99: 173-179.
Sanchez S et Demain AL (2002). Metabolic regulation of
fermentation processes. In : Antibacterial activity from Penicillium
corylophilum Dierckx (Silva MG, Furtado NAJC, Pupo MT, Fonseca MJV, Suraia
S, Filho AADS et Bastos JK). Microbiological Research. 159. 317-322.
Scopoli JA (1760). Flora carniolica Viennæ. In:
Contribution à l'étude de la flore souterraine de France (Maheu).
Ed. Masson, Paris, 190p, in-8°. Thèse de Doctorat.
Tachenon A (1999). LA Science des champignons. http:// www.
Tachenon. Com
Takahashi Ctakada T, Yamada T, Minoura K, Uchida K, Matsumura
E et Numata A (1994). Halichomycin, a new class of potent cytotoxic macrolide
produced by an actinomycetes from a marine fish. In: Isolation,
characterisation and antimicrobial activity of marine halophilic
Actinopolyspora species AH1 from the west coast of India (Kokare CR,
Mahadik KR, Kadam SSet Chopade BA). Current Science, Vol. 86. No. 4-25.
Tercafs R (1997). Les
animaux cavernicoles.
http://www.
pragmasoft.be/carnets/bio/animcav/tercafs.html.
Turner WB (1975). Commercially important secondary
metabolites. In : Microbiologie industrielle, Les microorganismes
d'intérêt industriels (Florent. J). Ed. Lavoisier Tec et Doc. 612
p.
Valvasor JWF (1689). Die Ehre des Herzogthums Crain. In :
Contribution à l'étude de la flore souterraine de France (Maheu).
Ed. Masson, Paris, 190p, in-8°. Thèse de Doctorat.
Went (1969). In : Mycologie générale et
structurale (Locquin M). Ed. Masson. P. 551.
ANNEXES
Composition des milieux de cultures
Ø Eau physiologie
- Chlorure de sodium
9 g
- Eau distillée
1000 ml
Ø Bouillon nutritif
- Peptone
15 g
- Extrait de levure 5 g
- NaCl 5 g
- Eau distillée 1000 ml
- pH 7,4
Ø Gélose nutritive
- Extrait de viande 3 g
- Peptone 5 g
- Agar 15 g
- Eau distillée
1000 ml
- pH 7,4
Ø Mueller Hinton
- Macération de viande 300 ml
- Peptone de caséine 17, 5 ml
- Amidon 1,5 ml
- Agar
17 g
- pH 7,4
Ø CDA (Czapek Dextrose Agar)
- NaNO3 3 g
- MgSO4
0,5 g
- KH2PO4 1,5 g
- FeSO4 0,05 g
- KCl 0,5 g
- Succrose 30 g
- Agar 15 g
Ø ISP2 (International
Streptomyces Project)
- Extrait de levure 4 g
- Extrait de Malt 10 g
- Glucose 4 g
- Agar 15 g
- Eau distillée 1000 ml
- Ampicilline 2 ml
- Fungisone 1 ml
Ø MEA (Malt Extract Agar)
- Extrait de Malt 20 g
- Glucose 5 g
- Agar 15 g
- Eau distillée 1000 ml
Ø MYEA (Malt Yeast Extract Agar)
- Extrait de Malt 20 g
- Glucose 5 g
- Extrait de levure 10 g
- Agar 15 g
- Eau distillée 1000 ml
Ø PDA (Potatoes Dextrose
Agar)
- Pomme de terre 200 g
- Eau distillée 700 ml
Chauffage et filtration : le filtrat +
- Succrose 10 g
- Agar
15 g
- Eaux distillée 1000 ml
* PDAa (Potatoes Dextrose
Agar acidifié):
200 ml de PDA + 1,5 ml d'acide lactique (25%)
* PDAR (Potatoes Dextrose
Agar + Rose Bengal):
200 ml de PDA + 2 ml de Rose Bengal.
Ø SGA (Soil Glucose Agar)
- Sol 500 g
- Eau ditillée 1000 ml
Bouillir 30 mn et filtration, filtrat +
- Glucose 10 g
- Agar 15 g
- Eau distillée 1000 ml
Ø YSA (Yeast Starch Agar)
- Amidon soluble 15 g
- Extrait de levure 4 g
- K2HPO4 0,5 g
- MgSO4 0,5 g
- Agar 15 g
- Eau distillée 1000
ml
Ø CYA (Czapek Yeast Agar)
- K2HPO4 1 g
- Czapeks concentré 10 ml
- Extrait de levure 5 g
- Succrose 30 g
- Agar 20 g
- Eau distillée 1000 ml
* Czapeks concentré
- NaNO3 300 g
- MgSO4 50 g
- KCl 50 g
- FeSO4 1 g
- Eau distillée 1000 ml
Ø G25N ( 25% Glycérol Nitrate
Agar)
- K2HPO4 0,75 g
- Czapeks concentré 7,5
ml
- Extrait de levure 3,7 g
- Glycérol 250 g
- Agar 12 g
- Eau distillée 750 ml
Ø AFPA (Aspergillus Flavus /
Parasiticus Agar)
- Peptone bactériologique 10 g
- Extrait de levure 20 g
- Citrate de fer ammoniacal 0,5 g
- Chloramphénicol 100 mg
- Dichloran 1 ml (0,2% : 2g de Dichloran dans 100 ml
d'éthanol)
- Agar 15 g
- Eau distillée 1000 ml
Ø YEA (Yeast Extract Agar)
- Peptone 5 g
- Extrait de levure 3 g
- Agar 20 g
- Eau distillée 1000 ml
Ø YESA (Yeast Extract Starch Agar)
- Peptone 5 g
- Extrait de levure 3 g
- Amidon soluble 15 g
- Extrait de levure 4 g
- K2HPO4 0,5 g
- MgSO4 0,5 g
- Agar 15 g
- Eau distillée 1000
ml
Ø YGS (Yeast Glucose Succrose)
- Succrose 20 g
- Glucose 20 g
- Extrait de levure 20 g
- Eau distillée 1000 ml
| 
