|

REPUBLIQUE DE CÔTE D'IVOIRE
Union-Discipline-Travail
Ministère de l'Enseignement Supérieur et de
la Recherche Scientifique
UPR de Génétique
Année Universitaire
2020-2021
MEMOIRE
Présenté pour l'obtention du
Diplôme de MASTER de
Biotechnologie, Biosécurité et
Bioressources de l'Université
Félix
HOUPHOUET-BOIGNY
Spécialité : Génétique et
Amélioration des Espèces
DJEZOU KOUADIO MELITON
ANALYSE DE LA DIVERSITÉ DES
CHAMPIGNONS
MYCORHIZIENS À ARBUSCULES ASSOCIÉS AU MAÏS
DANS
QUATRE ZONES DE PRODUCTION EN CÔTE D'IVOIRE
Numéro d'ordre
1061/2021
Soutenu publiquement Le 6 octobre 2021
Composition du jury
M. FATOGOMA Sorho Professeur Titulaire UFHB
Président
M. TIECOURA Kouakou Maître de Conférences
UFHB Superviseur
M. KOUASSI Abou Bakari Maître-Assistant UFHB
Directeur
M. SOKOURI Didier Paulin Maître de
Conférences UFHB Examinateur

DEDICACE
Ce mémoire est dédié :
? A mon grand-père PAPA NOUVEAU pour
ses conseils et prières.
? A ma mère AMESSAN GNAHON NATHALIE,
brave femme pour son amour et ses prières
? A tous mes frères et soeurs pour le
soutien moral
II
REMERCIEMENTS
Le présent travail est le fruit de la collaboration
franche entre le Laboratoire de Biotechnologie, Agriculture et Valorisation des
Ressources Biologiques de l'Unité de Formation et de Recherche (UFR)
Biosciences de l'Université Félix HOUPHOUET-BOIGNY, l'Institut
Africain pour le développement économique et social (INADES) et
le Fonds Interprofessionnel pour la Recherche et le Conseil Agricole
(FIRCA).
Nombreuses sont les personnes qui, de près ou de loin,
ont contribué à la réalisation de ce travail et à
qui je voudrais rendre hommage à travers ces quelques lignes.
Au Professeur KOUAMELAN Essetchi Paul, Doyen de l'UFR
Biosciences, pour avoir accepté mon inscription au sein de cette UFR.
Au Professeur N'GUETTA Assanvo Simon-Pierre, de l'Unité
Pédagogique et de Recherche (UPR) de Génétique de
l'Université Félix HOUPHOUËT-BOIGNY, Directeur du
Laboratoire de Biotechnologie, Agriculture et Valorisation des Ressources
Biologiques qui a accepté mon inscription en MASTER
Au Dr SOKOURI Didier Paulin, Maître de
Conférences à l'Unité Pédagogique et de Recherche
(UPR) de Génétique de l'Université Félix
HOUPHOUËT-BOIGNY pour ses encouragements
Je manifeste ma profonde gratitude au Dr KOUASSI Abou
Bakari, Maître-Assistant à l'UPR de
Génétique de l'Université Félix
HOUPHOUËT-BOIGNY, Directeur de ce travail. Vous avez
énormément contribué à la réalisation de ce
travail. En plus de vos qualités scientifiques, vos soutiens ont
été importants pour moi. .
J'exprime ma profonde reconnaissance au Dr DROH Germain,
Assistant à l'UPR de Génétique de l'Université
Félix HOUPHOUËT-BOIGNY, pour m'avoir suivi au quotidien. Qu'il soit
remercié pour tout le soutien. Merci infiniment Docteur d'avoir choisi
de travailler avec moi sur votre projet dénomé «
Promotion du biocompost associé aux champignons mycorhiziens
à arbuscules (CMA) dans la production du maïs (Zea mays) en
Côte d'Ivoire ». Ce projet a été
financé par le Fond Compétitif pour l'Innovation Agricole Durable
(FCIAD) sous la référence du contrat N° 18 62
/FIRCA/INADES/FDCI-FCIAD/2018. Que Dieu vous le rende au centuple.
De même, je manifeste également ma profonde
gratitude au Dr TIECOURA Kouakou, Maître de Conférences à
l'UPR de Génétique pour les susgestions et sa
disponibilité en tant que superviseur de ce mémoire
Enfin, j'adresse mes vifs remerciements à tous ceux qui
m'ont apporté leur concours et que je ne peux citer individuellement
III
TABLE DES MATIÈRES
DEDICACE I
REMERCIEMENTS II
TABLE DES MATIÈRES III
SIGLES ET ABREVIATIONS V
LISTE DES FIGURES VI
LISTE DES TABLEAUX VII
Introduction 1
I.- Synthèse bibliographique 4
I.1-Identité et ressource du maïs
4
I.1.1- Origine et morphologie du maïs 4
I.1.3- Contraintes liées à la culture du
maïs 5
I.2- Situation des champignons mycorhiziens dans le monde
vivant 5
I.2.1- Champignons mycorhiziens à arbuscules (CMA)
5
I.2.1.1- Origine et distribution des CMA 5
I.2.1.2- Classification des champignons mycorhiziens
à arbuscules 6
I.2.2- Différentes symbioses mycorhiziennes
6
I.2.3- Cycle de développement des champignons
mycorhiziens à arbuscules 8
I.2.4- Bénéfices de la symbiose
mycorhizienne à arbuscules 10
I.2.5- Effet des facteurs écologiques sur les
communautés des CMA 12
II- Matériels et méthodes 13
II.1- Site d'échantillonnage 13
II.2- Matériel 13
II.2.1- Matériel végétal
13
II.2.2- Matériel fongique 13
II.2.3- Matériel technique et chimique
13
II.3- Méthodes 14
II.3.1- Méthode de prélèvement des
échantillons de sols 14
II.3.2- Détermination des propriétés
physico-chimiques des échantillons de sols 17
II.3.2- Isolement des spores de CMA 18
II.3.3- Détermination de l'abondance des spores
dans chaque échantillon de sol 18
II.3.4- Analyse de la diversité des spores et
identifications des champignons mycorhiziens 18
II.3.5- Analyse statistique des données de la
diversité des spores 19
III-RESULTATS 20
III.1-Propriétés chimiques des sols des
différents sites d'échantillonnage 20
III.2- Densités moyennes des spores de champignons
mycorhiziens à arbuscules 20
III.2.1- Densités moyennes des spores de CMA selon
leurs tailles 23
IV
III.2.2- Densités moyennes de spores de CMA selon
leurs couleurs 26
III.3- Diversité des communautés de
champignons mycorhiziens à arbuscules 33
III.3.1- Familles de champignons mycorhiziens à
arbuscules dans les échantillons de sol 33
III.3.2- Genres de champignons mycorhiziens à
arbuscules dans les échantillons des sols 33
IV- Discussion 38
V- Conclusion et perspectives 42
V.1- Conclusion 42
V.2- Perspectives 43
REFFERENCES BIBLIOGRAPHIQUES 42
Annexes 52
V
SIGLES ET ABREVIATIONS
ANADER : Agence Nationale d'Appui au Développement
Rural
CMA : Champignons mycorhiziens à arbuscules
Cmol : Centimole
CNRA : Centre National de Recherche Agronomique
FCIAD : Fond Compétitif pour l'Innovation Agricole
Durable
FIRCA : Fonds Interprofessionnel pour la Recherche et le
Conseil Agricole
INADES : Institut Africain pour le Développement
Economique et Social
INVAM : Collection Internationale de Cultures de Champignons
Mycorhiziens à Vésicules
et à Arbuscules (International Culture Collection of
Vesicular - Arbuscular Mycorrhizal Fungi)
Km : Kilomètre
Mm : millimètre
PNIA : Plan National d'investissement Agricole
PVLG : Polyvinyle glycérol
PPA : Prepenetration apparatus
UFHB : Université Félix Houphouët-Boigny
UPR : Unité de Pédagogie et de Recherche
VI
LISTE DES FIGURES
Figure 1: Phylogénie actuelle des Glomeromycota 7
Figure 2: Les principales symbioses mycorhiziennes et leurs
structures inter et intra racinaires 11
Figure 3: Localisation des zones de prélèvement des
échantillons de sol sur les cartes administratives
des régions d'étude 16
Figure 4: Abondances
relatives (%) des spores de couleur jaunâtre, blanchâtre,
marron-clair et
marron-fonce dans les échantillons de sols des
localités prospectées 31
Figure 5: Spores de champignons
mycorhiziens à arbuscules observées au microscope optique
(grossissement 40x) dans du polyvinyle glycerol 36
VII
LISTE DES TABLEAUX
Tableau I : Coordonnées géographiques des sites
de prélèvement d'échantillon de sol des quatre zones
d'échantillonnage 15
Tableau II :
Caractéristiques physico-chimiques des échantillons de sols des
zones prospectées .. 231 Tableau III : Densités moyennes des
spores de champignons mycorhiziens à arbuscules (nombre de
spores/100g de sol) dans les échantillons de sols des
zones prospectées 22
Tableau IV : Densités moyennes de spores
(nombre de spores/100g de sol) par site de prélèvement
des échantillons de sol dans les différentes
localités prospectées 24
Tableau V : Densités moyennes
des spores (Nombre de spores / 100g de sol) de 200, 90, et 45um de
diamètre dans les échantillons de sol des zones
prospectées 25
Tableau VI : Densités moyennes des spores
(nombre de spores/100g de sol) de 200, 90 et 45um de
diamètre dans les échantillons de sol des zones
prospectées 27
Tableau VII : Densités moyennes (nombre de
spores / 100g de sol) des spores de CMA de couleur
28
Tableau VIII : Densités moyennes (nombre de
spores / 100g de sol) des spores de couleur jaunâtre, blanchâtre,
marron-clair et marron-foncé par site de prélèvement des
échantillons de
sol des zones prospectées 32
Tableau IX : Proportions des genres de CMA dans les
echantillons de sol des zones prospectees 35
INTRODUCTION
1
Introduction
Le développement des plantes dépend de leurs
interactions avec le milieu environnemental, notamment avec les microorganismes
du sol. La dynamique de cette interaction dépend de plusieurs facteurs
tels que, entre autres : les caractéristiques physiologiques des plantes
et des microorganismes, les propriétés physicochimiques du sol et
les conditions climatiques (Haney et al., 2015; Köhl
et al., 2016; Pii et al., 2015). Les microorganismes
du sol remplissent des fonctions environnementales essentielles dont la
fertilisation du sol. En décomposant la matière organique, ils
rendent des nutriments disponibles pour les plantes (Driai,
2016).
Dans les pays en voie de développement, la forte
croissance démographique et la pression sur les terres cultivables ont
entraîné la surexploitation des ressources naturelles (terres,
forêts, ...) obligeant les producteurs à adopter de mauvaises
pratiques culturales (Tano, 2012). Par ailleurs, l'agriculture
moderne privilégie l'apport de phosphore et d'autres
éléments minéraux, rapidement assimilables par les plantes
ainsi que l'utilisation de pesticides aux dépens d'autres
méthodes plus respectueuses de l'environnement. Ces
systèmes d'exploitation inappropriés engendrent la baisse
continue de la fertilité des sols et des pertes de
biodiversité (FAO et al., 2015).
Le maïs (Zea mays L.) constitue une
source importante de revenus et d'alimentation des populations dans le monde,
en Afrique et particulièrement en Côte d'Ivoire. Il constitue
effectivement l'aliment de base de nombreuses populations ivoiriennes et
surtout celles du centre et du nord. Sa production nationale, d'environ 661 285
t en 2013, est passée à 1 025 000 t en 2017 (FAO,
2017). Cette production ivoirienne comparée à celles des
pays voisins, d'après les estimations de la FAO, semble connaître
une croissance relativement lente.
Malgré les programmes de recherche et de redynamisation
de la filière maïs initiés par le Plan National
d'investissement Agricole (PNIA) et mis en oeuvre à travers le Fonds
Interprofessionnel pour la Recherche et le Conseil Agricole (FIRCA) ; l'Agence
Nationale d'Appui au Développement Rural (ANADER) ; le Projet d'Appui
à la Production Agricole et à la Commercialisation (PROPACOM) et
le Centre National de Recherche Agronomique (CNRA), les difficultés
perdurent. Cette situation pourrait se justifier par les
irrégularités pluviométriques, les crises
politico-militaires et les problèmes de fertilité des sols. Pour
restaurer la fertilité des sols de façon durable, il est
impératif d'utiliser des techniques efficaces et respectueuses de
l'environnement (Crossay, 2018). Une des solutions les plus
prometteuses très utilisée dans le monde mais peu connue en
Côte d'Ivoire, est l'utilisation des champignons mycorhiziens à
arbuscules (CMA).
Ces champignons du sol s'associent de façon symbiotique
aux racines de 80 % des plantes terrestres pour former des organes mixtes
appelés mycorhizes. Grâce aux réseaux mycéliens et
aux mycorhizes, les CMA améliorent l'absorption de l'eau et des
éléments minéraux chez les plantes (Labidi et
al., 2012), la tolérance des plantes aux stress abiotiques
tels que les polluants (Debiane et al., 2008 ;
2
Lenoir et al., 2016) et aux stress
biotiques dus aux pathogènes (Dalpé, 2005). Il a
été montré qu'une forte amélioration de la
croissance des plantes et de la fertilité des sols est obtenue avec ces
CMA (Marulanda et al., 2007 ; Shen et Wang, 2011).
Les champignons mycorhiziens facilitent l'installation des plantes
dans les sols pollués et contribuent à l'élimination des
polluants en stimulant l'activité des populations microbiennes au niveau
de la rhizosphère (Lenoir et al., 2016).
Les CMA se propagent via des spores. Selon les taxonomistes et
les biologistes, les spores constituent les principales structures permettant
l'identification et la caractérisation des différents genres de
ces CMA. Ainsi, plusieurs études de diversité, de performance et
d'inoculation de CMA ont été réalisées à
travers le monde (Rodríguez-López et al., 2015 ;
Droh et al., 2016 ; Manga et al., 2017 ; Bossou et
al., 2019). Cependant, la diversité des
CMA et leurs rôles restent encore mal connus. Il est donc
nécessaire de mettre d'abord l'accent sur l'étude de la
diversité des CMA afin de connaitre la structuration de cette
diversité avant leur intégration dans tout programme
d'amélioration des productions végétales et de lutte
contre la dégradation de l'environnement.
En Côte d'Ivoire, les recherches sur les CMA sont
à leurs débuts. Ainsi les quelques travaux déjà
réalisés ont permis de constituer une collection de champignons
endomycorhiziens associés au manioc (Voko Bi et al.,
2013), au cacaoyer dans les régions du GOH, de la NAWA, et de
SAN-PEDRO (Droh, 2017), au fromager et au makoré
(Anguiby et al., 2019). Ces travaux ont permis non
seulement d'identifier les espèces de CMA constituant les populations de
Glomeromycota associées à ces cultures mais aussi de montrer la
diversité des espèces en fonction des cultures. Par ailleurs
Zézé et al. (2007) ont
étudié la diversité des champignons mycorhiziens dans la
forêt de la téné. Pour l'amélioration de la
productivité d'une culture, par l'amélioration de la
fertilité des sols, des données sur les CMA dans sa
rhizosphère sont indispensables. En ce qui concerne le maïs, pour
le moment, très peu d'informations sont disponibles en ce qui concerne
les espèces de CMA dans sa rhizosphère. La présente
étude s'inscrit donc dans le cadre de l'analyse des communautés
de CMA associés à la rhizosphère du maïs des zones de
Bouaflé, Bouaké, Ferkessédougou et Niéllé en
Côte d'Ivoire. L'objectif général est de déterminer
la diversité des CMA dans la rhizosphère du maïs ainsi que
l'effet des paramètres physico-chimiques du sol sur l'abondance et la
diversité de ces communautés fongiques.
Les objectifs spécifiques de ce travail sont :
- Déterminer, pour chacune des zones
prospectées, l'abondance des spores de champignons mycorhiziens dans la
rhizosphère du maïs ;
- Identifier, à partir des caractéristiques
morpho-métriques et structurales des spores, les différents
genres de champignons mycorhiziens associés au maïs ;
- Déterminer les paramètres physico-chimiques du
sol pouvant influencer positivement ou négativement la multiplication de
chacun des genres de CMA observés
3
Ces objectifs spécifiques découlent des
hypothèses suivantes :
- Les champignons mycorhiziens associés aux maïs
diffèrent selon les zones de cultures ;
- Les paramètres physico-chimiques du sol ont un effet
sur l'abondance et la structuration de la diversité des champignons
mycorhiziens associés au maïs
Le présent mémoire de Master qui rapporte
l'ensemble des travaux effectués comporte quatre parties. La
première partie présente une synthèse bibliographique sur
les CMA. La deuxième partie est consacrée aux matériel et
méthodes utilisés. La troisième partie présente les
résultats suivis de la discussion. La conclusion et les perspectives qui
se dégagent constituent la quatrième partie de ce
mémoire.
1ère PARTIE :
SYTHESE BIBLIOGRAPHIQUE
4
I.- Synthèse bibliographique
I.1-Identité et ressource du maïs
I.1.1- Origine et morphologie du maïs
Le maïs est originaire d'Amérique centrale, plus
précisément des hauts plateaux du Mexique et de la Bolivie. Le
nom botanique du maïs est Zea mays. À partir de ces
régions, le maïs s'est répandu dans le monde, à
travers les migrations et les explorations, jusqu'à atteindre l'Afrique
de l'ouest (Bambara, 2012). Le maïs est cultivé en
Côte d'Ivoire et en Afrique de l'Ouest depuis le XVIème
siècle. Dans les zones forestières, le maïs a
également pris progressivement une place considérable en
permettant la mise en culture des zones topographiquement élevées
complémentant ainsi le riz, céréale traditionnelle,
cultivé en bas-fond, et s'associant relativement bien avec le manioc,
l'igname, le riz et le taro. Dès le XVIIème
siècle, le maïs est donc une culture relativement bien
implantée du Nord au Sud de la Côte d'Ivoire et qui accompagne,
grâce à son potentiel de stockage et à sa forte
productivité, la diversification socio-économique, l'urbanisation
et le développement d'un commerce vivrier (RONGEAD - ONG
CHIGATA, 2014).
Le maïs appartient à la classe des
monocotylédones, l'ordre des cypérales et la famille des
poacées (graminées). Le maïs est une espèce à
pollinisation croisée où les inflorescences femelles
(épis) et les inflorescences mâles (panicules) sont
disposées à des endroits distincts sur la plante, à
l'aisselle d'une feuille gaine et au sommet respectivement.
I.1.2- Importance nutritionnelle du maïs
Le maïs (Zea mays) est la première
production céréalière dans le monde. En Afrique
Subsaharienne, le maïs est produit principalement pour l'alimentation
humaine et secondairement à l'alimentation animale. Il est
consommé soit frais ou braisé soit en produits transformés
tels que, entre autres, la farine, l'amidon, l'éthanol et le sirop de
cuisson (Tshiabukole, 2018). En Côte d'Ivoire, le
maïs constitue l'aliment de base de nombreuses populations, surtout celles
du centre et du nord. La production ivoirienne du maïs représente
68% de la production céréalière nationale
(Minagri, 2010). Le maïs compose la moitié des
apports en calories, en protéines en Afrique subsaharienne. Les glucides
qu'il apporte sont facilement assimilables par l'organisme, et sa richesse en
fibres contenues essentiellement dans les téguments du grain aident
à réguler le transit intestinal. Le maïs est une source
intéressante de vitamines, notamment de vitamine B ; précieuse
pour l'équilibre nerveux et musculaires. Les « barbes de maïs
» sont employées en pharmacie, sous forme de décoction ou
d'extrait liquide, car leur teneur en vitamine K leur donne des vertus
antihémorragiques. De plus la richesse du maïs en
oligo-éléments: (potassium, phosphore, magnésium, calcium,
fer et zinc) fait de sa consommation un gage de bonne santé
(Yapi et al., 2017).
5
I.1.3- Contraintes liées à la culture du
maïs
La production ivoirienne du maïs est passée de 661
285 tonnes en 2013 à 1 025 000 tonnes en 2017 (FAO, 2017)
grâce à une augmentation des surfaces cultivées et
un climat favorable à la culture. Cependant de sérieux risques
pèsent sur cette production. Ce sont notamment :
- les irrégularités pluviométriques au
cours de la saison culturale qui ont différents effets dépressifs
sur la croissance et le développement du maïs (Tshiabukole,
2018). Comme chez beaucoup de plantes, le rendement maximal potentiel
du maïs est réduit en cas d'une contrainte hydrique.
- les problèmes de fertilités des sols
liés à l'utilisation d'intrants chimiques ainsi qu'aux mauvaises
pratiques agricoles. Ces pratiques ont un effet polluant entrainant une
acidité des terres cultivables.
Par conséquent, si la Côte d'Ivoire veut
améliorer le niveau de production et la qualité des terres
cultivables, elle doit adopter de nouvelles pratiques respectueuses de
l'environnement pour la fertilité des sols.
I.2- Situation des champignons mycorhiziens dans le monde
vivant I.2.1- Champignons mycorhiziens à arbuscules (CMA)
I.2.1.1- Origine et distribution des CMA
Des preuves récentes indiquent que l'évolution
des premières plantes à partir d'eucaryotes non
photosynthétiques s'est produite dans un environnement d'eau douce par
engloutissement et domestication d'une cyanobactérie
photosynthétique qui a ensuite évolué vers les
chloroplastes ( Ponce-Toledo et al., 2017).
L'émergence et l'érosion des continents ont
provoqués des dépôts sédimentaires. Les
rivières et les estuaires se sont alors chargés en
sédiments et ont permis l'émergence d'algues vivant en eaux peu
profondes. L'assèchement des sédiments a entrainé une
évolution des algues en bryophytes. Une innovation importante
était nécessaire pour permettre aux plantes d'acquérir de
l'eau et des nutriments indispensables à leur survie en l'absence
d'organes d'absorption spécialisés tels que les racines ; c'est
la naissance des symbioses mycorhiziennes à arbuscules. Ces champignons
ont joué un rôle important dans la colonisation des milieux
terrestres par les plantes grâce à leur implication dans
l'absorption des éléments nutritifs (Smith et Read,
2008). Plusieurs études de fossiles montrent des structures
fongiques très semblables à celles typiquement observées
chez les CMA actuels. Selon Redecker et al. (2000) et Delaux
(2017), la symbiose mycorhizienne à arbuscule a une origine
monophylétique dans l'ordovicien il y a environ 480 millions
d'années. D'autres fossiles datent du dévonien inferieur (environ
415 millions d'année). Les champignons mycorhiziens se trouvent dans de
nombreux environnements et leur succès écologique reflète
une forte diversité génétique et physiologique des
champignons endophytes
6
(Bonfante et Anca, 2010). Les endomycorhizes
existent dans tous les sites naturels à l'exception des zones
tourbeuses, des dunes récentes, des dépôts morainiques
(dépôts de sables, cailloux et d'argile). La diversité et
la distribution des CMA résultent des processus écologiques
agissant sur les communautés végétales, fongiques, la
température et sur le pH des sols .
I.2.1.2- Classification des champignons mycorhiziens
à arbuscules
Les récentes études morphologiques et
phylogénétiques ont permis de regrouper les espèces
mycorhiziennes à arbuscules dans le phylum des
Gloméromycètes distinguées par quatre ordres : les
Glomérales, les Paraglomerales, les Archaeosporales et les
Diversisporales (Redecker et al., 2013). Les
Gloméromycètes présentent une grande diversité
morphologique, notamment au niveau des spores dont la taille, la couleur et la
forme sont très variables suivant les espèces
étudiées. Actuellement l'embranchement des
gloméromycètes compte environ 291 espèces
décrites en quatre ordres, onze familles et vingt-six genres
(figure 1) .
I.2.2- Différentes symbioses mycorhiziennes
Les champignons mycorhiziens forment, dans les racines, des
organes spécialisés appelés mycorhizes. La façon
dont le champignon interagit avec les racines de la plante hôte, et
particulièrement la nature de l'interface qui se forme entre la plante
hôte et le champignon confère au mycorhize une organisation qui
lui est propre. Ainsi, trois grands types de symbioses mycorhiziennes peuvent
être distingués :
Les ectomycorhizes se rencontrent
principalement chez les plantes ligneuses, arbres et arbustes (Pinaceae,
Betulaceae), des régions tempérées, montagneuses et
impliquent une très grande variété de champignons
Basidiomycètes (Boletus, Russula), Ascomycètes
(Tuber, Elaphomyceses). Au cours de l'interaction, le partenaire
fongique forme un manchon d'hyphes autour de certaines racines et s'insinue
entre les cellules de l'épiderme et du cortex externe sans jamais
pénétrer les cellules végétales pour former un
réseau appelé réseau de Hartig. C'est au niveau de ce
réseau que se font les échanges d'éléments
nutritifs entre le champignon et la plante. Les hyphes extraracinaires
recouvrent complètement la radicelle pour former un manteau d'hyphes
étroitement entrelacées à partir duquel elles
prolifèrent et s'étendent dans le sol à la recherche des
éléments nutritifs. Le mycélium
extraracinaire se propage à l'extérieur de la racine de deux
façons : la première sert à l'exploration du compartiment
sol et à l'absorption des nutriments dans celui-ci tandis que la
deuxième forme, par agglomération autour de la racine, un manchon
pseudo-parenchymateux aussi appelé « manchon gainant ».

7
Figure 1: Phylogénie actuelle des Glomeromycota
(Redecker et al., 2013)
8
Les endomycorhizes : les
champignons impliqués dans ce type de mycorhize sont surtout
des Zygomycètes. Le mycélium pénètre entre les
cellules du cortex des racines, franchit les parois des cellules en repoussant
leur plasmalemme sans les traverser. Dans ces cellules, il différencie
une structure dont la morphologie permet de distinguer plusieurs types
d'endomycorhizes : les endomycorhizes à vésicules et arbuscules,
les endomycorhizes éricoïdes et les endomycorhizes
orchidoïdes
Les ectendomycorhizes
présentent, à la fois, des structures
ectomycorhiziennes, caractérisées par un manteau mycélien
et un réseau de Hartig et des structures endomycorhiziennes,
caractérisées par la pénétration des hyphes
à l'intérieur des cellules racinaires. Ces hyphes
présentent, à l'intérieur des cellules, différents
degrés de prolifération. Les mycorhizes arbutoïdes se
caractérisent par un manchon mycélien mince, des hyphes
extra-racinaires, un réseau de Hartig bien développé et
des hyphes qui pénètrent à l'intérieur des cellules
pour former des pelotons. Les mycorhizes monotropoïdes possèdent
des hyphes qui forment un réseau de Hartig et d'autres qui
pénètrent à l'intérieur des cellules entrainant une
invagination des parois cellulaires. (Figure 2)
I.2.3- Cycle de développement des champignons
mycorhiziens à arbuscules
Les CMA sont des biotrophes obligatoires car ils sont
hétérotrophes pour le carbone et incapables de compléter
leur cycle de vie de manière asymbiotique (Smith et Read, 2008).
Le cycle de développement des CMA peut être divisé
en une série de trois phases : (i) la phase asymbiotique comprenant la
germination des spores, la ramification et le développement des hyphes
germinatifs, (ii) la phase présymbiotique caractérisée par
un dialogue chimique entre les deux symbiotes (plante hôte et champignon
mycorhizien), (iii) la phase symbiotique comprenant la prolifération des
hyphes, la pénétration à l'intérieur des racines et
la mise en place des formes intraracinaires. La formation d'une mycorhize
arbusculaire s'installe grâce à la succession des interactions
entre le champignon du sol et la plante-hôte.
- Phase asymbiotique : germination de la spore et
ramification de l'hyphe germinative Les CMA produisent un grand nombre
de spores stockant de grandes quantités d'éléments
carbonés, principalement sous forme de lipides de réserve. Durant
cette phase, les spores des CMA peuvent germer spontanément et produire
un hyphe germinatif et quelques ramifications primaires sans stimulus
exogène (Requena et al., 2007). En l'absence
de reconnaissance d'hôte, la germination peut ralentir, voire être
interrompu. Cependant, la spore garde suffisamment de ressources
carbonées afin de pouvoir répéter la germination.
L'arrêt de la germination avant l'épuisement complet des
ressources serait une stratégie des CMA pour augmenter les chances de
rencontre avec une racine hôte appropriée et la coloniser
(Bago et al., 2000)
9
- Phase présymbiotique : le dialogue chimique
entre une plante et un champignon mycorhizien
Les deux partenaires communiquent à travers des signaux
qu'ils envoient dans le sol et qui leur permettent d'être informés
de leurs présences respectives avant tout contact physique entre les
symbiotes (Bonfante et Genre, 2010). En effet, les plantes
produisent des exsudats racinaires, les strigolactones, et des composés
volatiles tels que le CO2 capables de stimuler la germination, d'induire une
ramification des hyphes et de modifier l'activité métabolique du
CMA (Besserer et al., 2008). Ainsi, les hyphes
germinatifs s'allongent et forment, par ramification, un réseau
mycélien présymbiotique se développant en direction de la
racine. En réponse à cette stimulation par la plante, les CMA
produisent, à leur tour, des molécules appelées « Myc
factors » qui leur permettent d'être reconnus par la plante. Les
facteurs « Myc » vont entrainer chez la plante, l'activation de la
voie de signalisation de la symbiose (Delaux et al., 2013)
et provoquer une augmentation de la formation de racines
latérales (Genre et al., 2013). Une fois ces
premiers signaux échangés, les deux partenaires mettent en place
une régulation génique propre à l'établissement de
la symbiose (Maillet et al., 2011).
- Phase symbiotique : colonisation des racines de
l'hôte par le champignon
Au contact de la racine, les hyphes du CMA s'arrondissent et
s'aplatissent sur la paroi des cellules épidermiques et se ramifient
jusqu'à développer un appressorium (ou hyphopodium) : structure
bien différenciée et spécialisée dans la
reconnaissance entre les deux partenaires (Genre et al.,
2005). La formation de cette structure indique que le champignon a
reconnu une plante hôte potentielle. Les cellules végétales
réorganisent leur cytosquelette, forment un système membranaire
de pré-pénétration, appelée "prepenetration
apparatus" (PPA), permettant au champignon de pénétrer dans
la racine. Le champignon colonise la racine et forme des hyphes dans l'espace
intercellulaires du cortex racinaire, entre dans la racine pour atteindre la
zone corticale afin de développer des structures hyper-ramifiées
appelées arbuscules, lieu d'échange entre les deux partenaires.
Ces structures sont entourées d'une membrane plasmique
péri-arbusculaire séparant le champignon du cytoplasme
végétal (Bonfante et Genre, 2010). Après
la formation des arbuscules, certaines espèces de CMA forment des
structures sphériques appelées vésicules. Ces
vésicules sont produites à l'intérieur du cortex racinaire
et peuvent avoir une position intracellulaire ou intercellulaire selon les
espèces de CMA. Les vésicules jouent le rôle d'un organe de
stockage de réserves lipidiques étant donné qu'elles
renferment des quantités abondantes de lipides ainsi que de nombreux
noyaux (Smith et Read, 2008). De manière concomitante
au développement dans la racine, le champignon va se développer
dans le sol en un mycelium extra-racinaire. Le mycélium extra-racinaire
s'organise en un réseau très dense d'hyphes, qui peut former
jusqu'à plusieurs mètres d'hyphes par cm3 de sol. Ces
structures vont puiser eau et sels minéraux du sol puis les
transporter
10
vers la racine. C'est aussi à ce moment-là que
le champignon va produire de nouvelles spores, structures de reproduction et de
dissémination des CMA, terminant ainsi son cycle de vie.
I.2.4- Bénéfices de la symbiose
mycorhizienne à arbuscules
L'interaction mycorhizienne est une association à
bénéfices mutuels. Les échanges nutritionnels
réciproques sont au centre de l'association mycorhizienne et agissent en
tant que composants régulateurs assurant le bon fonctionnement de la
symbiose (Javot et al., 2007a). Les CMA, incapables
de réaliser la photosynthèse, dépendent de leurs
partenaires et consomment 4 à 20 % du carbone fixé par la plante
sous forme de hexoses (Doidy et al., 2012).
Les CMA améliorent la croissance, la nutrition
hydrominérale des plantes, la régulation de la conductance
stomatique, l'accumulation de composés osmorégulateurs, une
meilleure transpiration et une augmentation de l'activité
photosynthétique (Leye et al., 2015 ; Ouattara et
al., 2019). L'amélioration de la croissance et la
nutrition hydrominérale des plantes se justifie par le réseau
d'hyphes qui agit comme une extension des racines de la plante hôte,
améliorant ainsi son efficacité d'explorer le sol. En outre, ces
champignons permettent une meilleure résistance des plantes aux stress
abiotiques et biotiques (Ferrol et al., 2009). Cette
protection se ferait par un changement dans la physiologie de la plante par le
changement des modifications dans l'équilibre hormonal et le profil
transcriptionnel jusqu'aux modifications au niveau des métabolismes
primaires et secondaires selon plusieurs mécanismes (Wehner
et al., 2010). Par ailleurs, les CMA possèdent la
propriété d'agir sur la macroaggrégation des constituants
du sol et donc sur sa stabilité. Les hyphes produisent des
polysaccharides extracellulaires auxquels des microaggrégats, d'un
diamètre inférieur à 250 ìm, sont attachés
pour former des macroaggrégats stables, de diamètre
supérieur à 250 ìm (Tisdall, 1994). Un
des polysaccharides serait en fait une glycoprotéine : la glomaline
(Wright et Upadhyaya, 1998) dont la concentration dans les
sols dépend de la plante hôte et du champignon associé
(Rillig et al., 2002). Les CMA favorisent la
coexistence entre plusieurs espèces végétales
améliorant ainsi la productivité et la biodiversité
végétales dans ces écosystèmes (Kisa et
al., 2007).
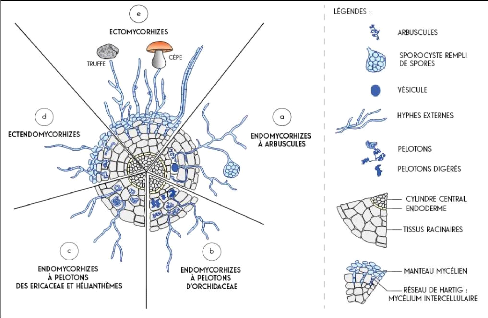
11
Figure 2: Les principales symbioses mycorhiziennes et
leurs structures inter et intra racinaires ( Sélosse et Le Tacon, 1998
cité par Droh, 2017)
12
I.2.5- Effet des facteurs écologiques sur les
communautés des CMA
La capacité des CMA du sol à se
développer et à former des mycorhizes sur les cultures
diffère selon les systèmes de culture. Selon Garbaye
(2013) et Dai et al. (2014) la colonisation racinaire, le
nombre de spores, le développement des CMA ainsi que la diversité
des CMA sont influencés par les pratiques culturales et le type de sol.
Le travail du sol aurait donc une double conséquence, d'une part la
rupture de la structure physique du sol et d'autre part celle du réseau
extramatriciel des champignons qui, en étant rompu peut s'avérer
moins efficace pour l'absorption des nutriments mais aussi pour la colonisation
racinaire. Aussi l'apport de fertilisants minéraux, en augmentant
l'offre du sol en éléments biodisponibles, peut réduire
voire supprimer la symbiose mycorhizienne. La rotation culturale à un
impact positif sur la richesse, la diversité et l'abondance des
propagules mycorhiziennes dans le sol. Elle apparait alors comme un bon moyen
pour conserver la diversité fongique indigène des sols agricoles
(Higo et al., 2018), Les produits phytosanitaires
utilisés en agriculture ont des effets indésirables sur les CMA.
Les pesticides réduisent la biomasse mycorhizienne en inhibant la
colonisation et la sporulation des CMA (Wang et al., 2019;
Suciu et al., 2019). Les CMA sont également
influencés par les facteurs environnementaux. La
sporulation et la densité des spores associées à la plante
hôte spécifique varient selon les saisons, les facteurs
édaphiques tels que le pH et le taux de Phosphore et d'humidité
du sol (Cardoso et Kuyper, 2006). La lumière est un
facteur limitant. En effet, elle stimule le développement des CMA.
L'ombre, par contre, réduit non seulement la colonisation des racines
par les CMA et leur sporulation mais aussi la réponse de la plante au
mycorhize (Goltapeh et al., 2008).
2e PARTIE :
MATERIEL ET METHODES
13
II- Matériels et méthodes
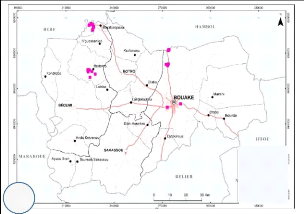
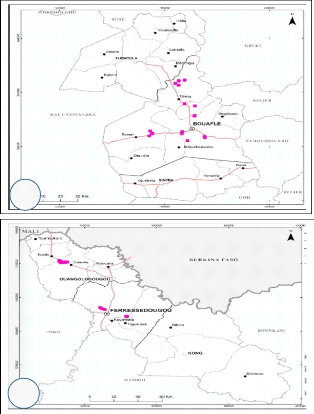
II.1- Site d'échantillonnage
Les échantillons de sol ont été
prélevés en Côte d'Ivoire dans des plantations de maïs
des zones de Bouaflé, Bouaké, Ferkessédougou et
Niellé. L'étude a été réalisée plus
précisément dans les régions de la Marahoué au
Centre-Ouest , du Gbêkê au Centre et du Tchologo au Nord qui
constituent la plus importante zone de production du maïs dans le pays
(Figure 3). Ces régions se caractérisent par
différents couverts végétaux. En effet, la
végétation varie de la forêt aux savanes arborées et
arbustives dans les régions de la Marahoué et du
Gbêkê à une savane herbeuse dans la région du
Tchologo (Dibi et al., 2008). Ces régions ont
un climat chaud et pluvieux de type tropical humide avec une hauteur moyenne
des précipitations de l'ordre de 899 à 1400 mm de pluie
(Goula et al., 2007). Le régime
pluviométrique est de type bimodal avec une saison sèche, de
novembre à mai, et une saison pluvieuse de juin à octobre. Les
températures varient de 26 à 28°C (Ahossane, 2010).
Le sol qui est soit argilo-sableux soit argilo-sablo-limoneuse, avec
une bonne rétention d'eau, comprend des zones de bas-fonds et de
marécages. Le relief, dominé par les plaines et plateaux, est peu
accidenté.
La position géographique des différents sites
d'échantillonnage (Tableau I) a été
déterminée à l'aide d'un GPS de marque GARMIN eX20.
Celui-ci a été étalonné à partir du niveau
de la mer pris comme repère zéro de l'altitude.
II.2- Matériel
II.2.1- Matériel végétal
Le matériel végétal est constitué de
plants de maïs (Zea mays L.) de la variété locale
II.2.2- Matériel fongique
Le matériel fongique est constitué de spores de
champignons mycorhiziens à arbuscules (CMA) contenues dans les
échantillons de sols colleectés dans la rhizosphère de
maïs des zones de Bouaflé (région de la Marahoué),
Bouaké (région du Gbêkê), Ferkessédougou et
Niéllé (région du Tchologo).
II.2.3- Matériel technique et chimique
Le matériel technique utilisé dans cette
étude est constitué :
- Une tarière de 5 cm de diamètre et 20 cm de
profondeur a été utilisé pour le prélèvement
des échantillons de sol
- Des sachets en plastique pour la conservation des
échantillons de sol prélevés
14
- Quatre tamis de diamètre de maille 500, 200, 90 et 45
um ont été utilisés pour l'isolement des spores de
champignons mycorhiziens à arbuscules (CMA)
- Une centrifugeuse a été utilisée pour
séparer les spores de CMA des particules du sol suivant le gradient de
densité
- Des boites de Pétri dont le fond est tapisé
par du papier filtre ont été utilisés pour recuperer les
spores de CMA
- Une loupe et un microscope de marque Leica version 3.4.0 ont
été utilisés pour l'observation des spores de CMA
Le matériel chimique est constitué :
- Une solution de saccharose 50 %
- Une solution physiologique constituée de NaCl à 9
%
- Un milieu de montage permanent constitué du
Polyvinyle glycérol (polyvinyle alcool 16,6g, d'acide lactique 100ml, de
glycérol 10ml, et d'eau distillée 100ml)
II.3- Méthodes
II.3.1- Méthode de prélèvement des
échantillons de sols
Dans chacune des zones prospectées, les
échantillons de sol ont été prélevés dans
cinq localités (sites de prélèvement). Dans chaque
localité, l'échantillonnage a été
réalisé dans une plantation de maïs parmi celles suivies par
l'Institut Africain pour le développement économique et social
(INADES) dans le cadre de ses programmes de recherche. Dans chaque plantation,
trois échantillons de sol ont été prélevés,
avec une tarière, dans la strate de 0-20 cm de profondeur, au pied de
trois différents plants de maïs choisis de façon
aléatoire. Tous les échantillons de sol collectés ont
été transportés à Abidjan et conservés
à l'Unité de Pédagogie et de Recherche (UPR) de
génétique de l'université Félix
Houphouët-Boigny (UFHB) en vue de l'extraction et l'analyse des spores de
CMA qu'ils contiennent.
Tableau I : Coordonnées géographiques des
sites de prélèvement d'échantillon de sol des Quatre zones
d'échantillonnage
Régions Zones Localités Latitudes
Longitudes
|
Marahoué Bouaflé
|
BFL1 7°18'38" Nord 5°49"50"Ouest
BFL2 7°18'23" Nord 5°49'42" Ouest
BFL3 7°4'41" Nord 5°44'46" Ouest
BFL4 6°57'9" Nord 5°48'29" Ouest
BFL5 6°56'23" Nord 5°58'37" Ouest
|
|
Gbêkê Bouaké
|
BK1 7°51'34" Nord 5°29'00" Ouest
BK2 8°05'23" Nord 5°28'300" Ouest
BK3 8°06'16" Nord 5°29'22" Ouest
BK4 7°52'00" Nord 5°30'24" ouest
BK5 7°58'11" Nord 5°03'07" 0uest
|
F1 9°38'05" Nord 5°12'56" Ouest
F2 9°39'16" Nord 5°15'09" Ouest
Ferké F3 9°33'25" Nord
5°02'56" Ouest
F4 9°38'28" Nord 5°14'07" Ouest
F5 9°39'07" Nord 5°14'55" Ouest
Tchologo
N1 10°08'29" Nord 5°31'12" Ouest
N2 10°08'08" Nord 5°31'33" Ouest
Niéllé N3 10°07'47" Nord
5°33'10" Ouest
N4 10°08'28" Nord 5°30'20" Ouest
N5 10°09'34" Nord 5°33'53" Ouest
15
Légende = BFL1 : Campement Siaka 1 :
BFL4 ; Campement Siaka 2 ; BFL3 : Nakaha ; BFL4 : Garango ; BFL5 : Gobazra ;
BK1 : Bouakaman 1 ; BK2 : Bouakaman 2 ; BK3 : Bouakaman 3 : BK4 : Bodokro ;
BK20 : Joichienkro ; F1 : Ferké ville ; F2 : Légouvogo 2 ; F3 :
Kporgo ; F4 : Légouvogo 4 ; F5 : Légouvogo ; N1 : Walouavogo 1 ;
N2 : Walouavogo 2 : N3 : Dramanavogo 3 ; N4 : Walouavogo 4 ; N5 : Walouvogo5
b
c
a
NIELLE
Légende :
b
c
a
Voie Bitumée
Principale ville
Localité d'étude Voie non
bitumée
Région de la Marahoué Région du
Gbêkê
Région du Tchologo
16
Figure 3: Localisation des zones de
prélèvement des échantillons de sol sur les cartes
administratives des régions d'étude.
17
II.3.2- Détermination des
propriétés physico-chimiques des échantillons de sols
Chacun des échantillons de sol a été
divisé en deux parties. La première moitié a
été utilisée pour l'extraction des spores de CMA et la
seconde moitié a été utilisée pour
déterminer les paramètres physico-chimiques que sont : le pH, la
capacité d'échange cationique (CEC), le phosphore assimilable, le
taux de carbone organique, la teneur en éléments K+,
Ca2+, Na+ et la teneur en azote total (Annexe
1).
- Le pH a été mesuré
avec un pH-mètre électronique. Pour chaque échantillon, 20
grammes de sol ont été mis en suspension dans 50 ml d'eau
distillée. Dans cette suspension, le pH-mètre est plongé
et le pH est déterminé.
- Le taux de carbone organique (C_Org) a
été déterminé par la méthode de
Walkley et Black (1934) décrite par Schulte et
Hoskins (1984).
- La teneur en phosphore assimilable (P) a
été déterminée par la méthode Bray-l
(Mathieu et Pieltain, 2003). La détermination de la
teneur en phosphore s'effectue en deux étapes. La première
étape consiste à digérer et à oxyder toutes les
formes de phosphore avec du persulfate de potassium en milieu acide sous
pression à 121 °C et la seconde étape consiste à
faire réagir l'ion orthophosphate avec l'ion molybdate et l'ion
antimoine pour former un complexe phosphomolybdate. L'acide ascorbique permet
ensuite de réduire le complexe phosphomolybdate pour provoquer
l'apparition du bleu de molybdène dont l'absorbance mesurée
à 660 nm est proportionnelle à la concentration de l'ion
orthophosphate dans l'échantillon de sol.
- La teneur en azote total (N) a
été mise en évidence par la méthode de Kjeldahl
(Demay, 1995). La teneur en azote est déterminée
par dosage acide-base, après minéralisation à l'aide d'un
excès d'acide sulfurique concentré et chaud, en présence
d'un mélange de catalyseurs (K2S04 et CuSO4).
- La teneur en éléments majeurs
K+, Ca2+, Na+ a
été mise en évidence par extraction à
l'acétate d'ammonium EDTA à pH = 7. Une suspension de sol et de
solution d'extraction (KCl) a été agitée durant une heure
pour en extraire les éléments dits de réserve.
Après filtration, la teneur de ces éléments,
exprimée en Centimole par kilogramme, a été
déterminée.
- La capacité d'échange cationique
(CEC) a été déterminée par dosage
des ions ammonium échangés par l'ion K+ du KCl.
18
II.3.2- Isolement des spores de CMA
Cent grammes de chaque échantillon de sol sec ont
été prélevés pour l'isolement des spores de
champignons mycorhiziens qui a été réalisé suivant
la méthode de tamisage humide décrite par Gerdemann et
Nicholson (1963). La technique consiste à mettre en suspension
100g de sol dans 1 litre d'eau afin de séparer les propagules fongiques
des particules du sol. La suspension de sol a été versée
sur une série de tamis disposés l'un au-dessus de l'autre dans
l'ordre décroissant des diamètres de mailles de 500, 200, 90 et
45um. À l'issu de cette étape, les débris
végétaux, les cailloux et les fragements de racines sont retenus
dans le tamis de 500 um. Les fractions retenues dans les tamis de 200, 90 et
45um de diamètre de mailles ont été par la suite
transférées séparément dans des tubes de
centrifugation. Pour chaque fraction, une solution de saccharose à 50 %
a été ajoutée dans chaque tube. Le mélange a
été centrifugé à 2000 rpm pendant 10 min. Le
surnageant, qui contient les spores et les fines particules du sol a
été récupéré. Ce surnageant a
été reversé sur la colonne de tamis de 200, 90 et 45um de
diamètre de mailles et le culot a été rejeté. Les
spores contenues dans chaque tamis ont été rincées
à l'eau de robinet pour éliminer le saccharose. Elle ont
été ensuite récupérées dans une boîte
de Pétri de 9,5 cm de diamètre dont le fond est tapissé de
papier filtre quadrillé.
II.3.3- Détermination de l'abondance des spores
dans chaque échantillon de sol
Les boîtes de Pétri contenant le filtrat de
chaque tamis ont été placées sous une loupe binoculaire
pour observer les spores. Dans chaque boite de Pétri, les spores ont
été comptées par types en fonction de leurs couleurs et de
leurs tailles. A l'aide d'une pipette Pasteur, les types de spores ont
été séparés et déposés dans
différentes boîtes de Pétri sur du papier filtre
humidifié avec une solution physiologique constituée de NaCl
à 9 %. Pour chaque zone d'échantillonnage, la densité des
spores a été ensuite déterminée. Elle se
définit comme étant le nombre de spores dans 100g de sol sec
(spores/100g de sol). L'abondance relative (AR) a
été également déterminée pour chaque type de
spore (Johnson et al., 1991) par la formule suivante
:
Nombre total d'un type de spore
observé dans tous les sols
AR = x 100
Nombre total de spores observées dans tous
les sols
II.3.4- Analyse de la diversité des spores et
identifications des champignons mycorhiziens
Les spores ont été placées sur une lame
de microscope, dans deux milieux de montage permanent : 1) le Polyvinyle
glycérol (PVLG) sans coloration préalable constitué de
polyvinyle alcool (16,6g), d'acide lactique (100ml), de glycérol (10ml),
et d'eau distillée (100ml) et 2) le PVLG coloré au réactif
de Melzer. Elles ont ensuite été observées au
grossissement (Gx40) sous un microscope de marque Leica version 3.4.0.
L'analyse de la diversité des spores et l'identification des champignons
mycorhiziens ont été réalisées en
considérant l'apparence générale (taille, couleur) et les
structures
19
pariétales des spores (nombre de couches cellulaires,
épaisseur de la paroi cellulaire) ainsi que la présence de
structures caractéristiques propres à certains taxons (bouclier
de germination, saccule sporifère, bulbe (hyphe) suspenseur, cellule
sporogène). Les spores observées ont été
décrites et comparées aux spécimens de la collection
Internationale de Cultures de Champignons Mycorhiziens à
Vésicules et à Arbuscules (International Culture Collection
of Vesicular - Arbuscular Mycorrhizal Fungi) (INVAM , 2021)
afin de les identifier.
II.3.5- Analyse statistique des données de la
diversité des spores
Les analyses statistiques ont été
réalisées avec les logiciels STATISTICA version (7.1) et IBM Spss
Statistics 22. Les densités moyennes des spores ont été
soumises à des analyses de variances à un critère de
classification (localité de collecte des échantillons de sol).
Ces analyses ont été réalisées pour tester l'effet
des paramètres physico-chimiques du sol sur la diversité des CMA
et de faire ressortir l'existence ou non de différences significatives
entre les zones de production de maïs. Le test de Student-Newmann-Keuls et
de Turkey au seuil de 5 % ont été utilisés pour comparer
les valeurs moyennes de densités en vue d'identifier les
rhizosphères de maïs présentant les meilleurs
paramètres physico-chimiques et les plus grandes diversités de
CMA.
TROISIÈME PARTIE :
RESULTATS ET DISCUSSION
20
III-RESULTATS
III.1-Propriétés chimiques des sols des
différents sites d'échantillonnage
Les valeurs des paramètres physico-chimiques des sols
sont présentées dans le tableau II. Les pH ont
des valeurs allant de 6,21 à 6,47. Les analyses de variance n'ont
révélé aucune différence significative entre les pH
des sols des sites d'échantillonnage, au risque d'erreur á = 5 %
(p-value = 0,0811). Les sols présentent cependant des différences
significatives pour leurs teneurs en phosphore assimilable (p-value= 0,003), en
cation Ca2+ (p-value = 0,02), en cation K+ (p-value =
0,0008) ainsi que pour leur capacité d'échange cationique, CEC
(p-value = 0,0276). Les sols de Niellé et Ferké ont les valeurs
les plus élevées de teneur en phosphore assimilable,
respectivement de 117,30 g/kg et 117,88 g/kg. Les sols de Bouaflé (1,27
Cmol.kg-1) et Bouaké (1,72 Cmol.kg-1)
ont les plus faibles teneurs en cation Ca2+.
Aucune différence significative n'a été
observée entre les sols pour leurs teneurs en carbone organique (p-value
= 0,267), en azote total (p-value= 0,126), en magnésium (p-value =
0,374) et en ion Na+ (p-value = 0,33). Il en est de même pour
le rapport "teneur en carbone organique teneur en azote organique", C/N
(p-value = 0,89).
III.2- Densités moyennes des spores de
champignons mycorhiziens à arbuscules
Le tableau III présente les
densités moyennes de spores dans les échantillons de sol de
chaque zone. La densité moyenne la plus faible 145,06 #177; 70,91 et la
plus grande 263,6 #177; 120 a été observée respectivement
dans les échantillons de sol des zones de Bouaké et
Bouaflé. Les densités moyennes de spores de CMA dans la
régions du Tchologo sont de 189,26 #177; 70,73 et 195,6 #177; 103,11
spores par 100g de sol respectivement dans les échantillons de sol des
zones de Ferké et à Niellé. L'analyse de variance de la
densité de spores de CMA dans les échantillons de sols a permis
de mettre en évidence des différences significatives entre les
zones prospectées, au risque d'erreur de 5 % (F = 2,811093 ; p-value =
0,047600).
21
Tableau I : Caracteristiques physico-chimiques des
echantillons de sols des zones prospectees
|
pH
|
C
|
N
|
C/N
|
P
|
CEC
|
Ca2+
|
Mg2+
|
K+
|
Na+
|
|
BFL
|
6,38#177;0,32
|
1,01#177;0,4
|
0,10#177;0,04
|
10,40#177;0,86
|
60,17#177;16,27b
|
7,20#177;3,46b
|
1,27#177;0,51b
|
0,73#177;0,18
|
0,10#177;0,01c
|
0,11#177;0,08
|
|
BK
|
6,21#177;0,15
|
1,30#177;0,65
|
0,12#177;0,05
|
10,83#177;1
|
73,32#177;16,7b
|
6,97#177;2,33b
|
1,72#177;0,97b
|
0,78#177;0,16
|
0,10#177;0,01c
|
0,11#177;0,03
|
|
FK
|
6,47#177;0,34
|
1,32#177;0,5
|
0,12#177;0,04
|
11,15#177;0,98
|
117,88#177;49,21a
|
10,04#177;6,42a
|
2,38#177;1,04ab
|
0,82#177;0,2
|
0,14#177;0,02a
|
0,15#177;0,11
|
|
NL
|
6,35#177;0,18
|
1,60#177;0,75
|
0,14#177;0,06
|
10,92#177;0,96
|
117,30#177;50,48a
|
12,18#177;4,79ab
|
3,11#177;1,93a
|
0,63#177;0,15
|
0,11#177;0,01b
|
0,15#177;0,1
|
|
P-value
|
0,0811
|
0,267
|
0,126
|
0,89
|
0,003
|
0,0276
|
0,02
|
0,374
|
0,0008
|
0,330,33
|
|
Significativité
|
ns
|
ns
|
ns
|
ns
|
**
|
*
|
*
|
ns
|
**
|
ns
|
NB : Dans une même colonne, les
valeurs suivies de la même lettre ne sont pas significativement
différentes au seuil de 5 % Legende : BK :
Bouaké ; FK : Ferké ; NL :
Niéllé ; BFL : Bouaflé
pH = potentiel d'hydrogène, C
= carbone organique, N = azote total,
C/N = rapport "carbone organique sur azote total", P = phosphore
assimilable, CEC = capacité d'échange
cationique, Ca2+ = ion calcium,
Mg2+ = ion magnésium,
K+ = ion potassium, Na+
= ion sodium ; ns : non significatif ; * :
significatif ; ** : très significatif ; F=
statistique du test de Fisher, p-value =
probabilité d'erreur associée au test de Fisher
22
Tableau II : Densités moyennes de spores de
champignons mycorhiziens à arbuscules (nombre de spores/100g de sol)
dans les échantillons de sols des zones prospectées
|
Zones
|
Densité moyenne de
spores (nombre de
spores/100g
de sol)
|
Test de Fisher
|
|
F
|
p-value
|
|
BOUAFLE
|
263,60 #177; 120 a
|
2,811093
|
0,047600
|
|
BOUAKE
|
145,06 #177; 70,91 b
|
|
FERKE
|
189,26 #177; 70,73 ab
|
|
NIELLE
|
195,6 #177; 103,11 ab
|
Les valeurs de densité moyenne de spores suivies de la
même lettre ne sont pas significativement différentes au seuil de
5 %
F= statistique du test de Fisher,
p-value = probabilité d'erreur associée au test
de Fisher
23
Dans chaque zone prospectée, les densités de
spores ont été significativement différentes entre les
sols des localités d'échantillonnage, au risque d'erreur de 5%.
Dans la zone de Bouaflé, la densité moyenne de spores la plus
forte 398 #177; 86,97 et la plus faible 138,66 #177; 11,37 a été
observée dans les échantillons de sol des localités BFL3
de Nakaha et BFL1 du campement Siaka, respectivement. À Bouaké,
la plus forte 211 #177; 121,87 et la plus faible 65,66 #177; 11,93
densité moyenne de spores ont été obtenue dans les
échantillons de sol des localités BK1 et BK 2 de Bouakaman. Dans
la zone de Ferké (p = 0,026), la densité moyenne de spores la
plus forte 291,33 #177; 82,51 et la plus faible 127,66 #177; 63,37 a
été observée dans les échantillons de sol
localités F1 de Ferké Ville et F4 de Legouvogo, respectivement.
Dans la zone de Niéllé, la densité moyenne de spores de
CMA la plus faible 107 #177; 9,53 et la plus forte 296,66 #177; 4,61 a
été obtenue dans les échantillons de sol des
localités N1 et N4 situés à Walouavogo (Tableau
IV).
III.2.1- Densités moyennes des spores de CMA
selon leurs tailles
Le tableau V présente les
densités moyennes de spores de 200, 90 et 45 um de diamètre dans
les échantillons de sol. Les analyses de variance ont montré des
différences significatives entre les sols des zones prospectées
pour leurs densités en spores de 200um (p-value = 0,000713) et 90 um
(p-value = 0,010973) de diamètre, au risque d'erreur de 5%. Pour les
spores de 200 um, la densité moyenne la plus forte 10,40 #177; 7,18 et
la plus faible 5,20 #177; 2,11 a été observée à
Bouaflé et à Bouaké, respectivement. Il en est de
même pour les spores de 90um de diamètre avec une densité
de 178,80 #177; 85,52 à Bouaflé et de 78,60#177;44,49 à
Bouaké. Par contre, il n'y a aucune différence significative
entre les sols des zones prospectées (á = 5% ; F = 2,461669 ;
p-value = 0,071965) pour leurs densités en spores de 45um de
diamètre.
Dans les sols de toutes les zones, la proportion de spores de
90 um de diamètre est supérieure à celles des spores de
200 et 45 um de diamètre. Ainsi l'abondance relative (AR) des spores de
90 um à Bouaflé, Bouaké, Ferké et Niellé
sont de 67,83 ; 54,18 ; 63,61 et 61,94 %, respectivement.
24
Tableau III : Densités moyennes de spores
(nombre de spores/100g de sol) par site de prélèvement des
échantillons de sol dans les différentes zones
prospectées
|
Zones
|
Sites de
prélèvement
|
Densité moyenne de
spores (nombre
de
spores/100g de sol)
|
Test de Fisher
F p-value
|
|
BOUAFLE
|
BFL 1 BFL 2 BFL 3 BFL 4 BFL 5
|
138,66 #177; 11,37 c 281,33 #177; 58,52
abc 398 #177; 86,97 a 342 #177; 54,11
ab 158 #177; 99,13 bc
|
0,055
|
0,004
|
|
BOUAKE
|
BK 1
BK 2
BK 3
BK 4
BK 5
|
211 #177; 121,87 a 65,66 #177; 11,93 b
180,66 #177; 19 a 121,33 #177; 8,08 ab
146,66 #177; 32,39 ab
|
3,694093
|
0,042649
|
|
FERKE
|
F 1
F 2
F 3
F 4
F 5
|
291,33 #177; 82,51 a 180 #177; 31,04 ab
165 #177; 14,79 ab 127,66 #177; 63,37 b
182,33 #177; 24,78 ab
|
4,437
|
0,026
|
|
NIELLE
|
N 1
N 2
N 3
N 4
N 5
|
107 #177; 9,53 b
135 #177; 60,90 b 290,66 #177; 142,11 a
296,66 #177; 4,61 a 148,66 #177; 66,76
b
|
7,305602
|
0,005090
|
Pour chaque zone prospectée, les valeurs de
densités moyennes de spores suivies de la même lettre ne sont pas
significativement différentes, au seuil de 5 %, entre les sites de
prélèvement.
F = statistique du test de Fisher,
p-value = probabilité d'erreur associée au test
de Fisher
25
Tableau IV : Densités moyennes des spores (Nombre
de spores / 100g de sol) de 200, 90, et 45um de diamètre dans les
échantillons de sol des zones prospectées
|
Densités des spores
|
|
Diamètre des spores
Zones
|
200 um
|
90 um
|
45 um
|
|
BOUAFLE
|
10,40#177;7,18 a
|
178,80#177;85,52 a
|
74,40#177;53,06
|
|
BOUAKE
|
5,20#177;2,11 b
|
78,60#177;44,49 b
|
61,27#177;33,89
|
|
FERKE
|
6,80#177;8,44 ab
|
120,40#177;41,20 b
|
62,07#177;37,75
|
|
NIELLE
|
6,13#177;5,10 ab
|
119,93#177;50,57 b
|
69,53#177;62,79
|
|
F
|
6,547204
|
4,070893
|
2,461669
|
|
p-value
|
0,000713**
|
0,010973*
|
0,071965 ns
|
Légende : * = significatif ; ** = très significatif
; ns = non significatif
Pour chaque type de spores, les valeurs de densités
moyennes suivies de la même lettre ne sont pas significativement
différentes, au seuil de 5 %,
F= statistique du test de Fisher,
p-value = probabilité d'erreur associée au test
de Fisher
26
Dans les zones de Bouaflé, Bouaké et
Niellé, aucune différence significative n'a été
observée entre les sols des sites d'échantillonnage, pour leurs
densités en spores de 200 et 90um de diamètre, respectivement
(Tableau VI). Par contre, des différences
significatives ont été mises en évidence entre les sites
de prélèvement des échantillons de sol pour la
densité en spores de 45um de diamètre. Dans la zone de
Bouaflé, les échantillons de sol des sites BFL4 de Garango et
BFL5 de Gobazra ont eu, respectivement, la plus forte 132,67 #177; 48,01 et la
plus faible 15,33 #177; 13,61 densité moyenne de spores de 45 um. A
Bouaké, la plus forte 100,00 #177; 43,59 et la plus faible 25,00 #177;
5,00 densité moyenne a été observée dans les sols
des sites BK1 et BK2 de Bouakaman. Dans la zone de Niellé, la plus forte
139,33 #177; 80,75 et la plus faible 19,33 #177; 13,61 densité moyenne a
été observée dans les sites de prélèvement
N3 de Dramanavogo et N1 de Walouavogo.
En ce qui concerne la zone de Ferké, des
différences significatives ont été mises en
évidence entre les densités des spores de 200 um (p-value =
0,000) et 45 um (p-value = 0,015038) dans les sites de
prélèvement des échantillons de sol. Ainsi, pour les
spores de 200 um de diamètre, la densité la plus forte 21,33
#177; 4,16 et la plus faible 0,00 #177; 0,00 a été
observée dans les échantillons de sol des sites F5 et F4 de
Legouvogo. Pour la densité des spores de 45 um, la plus forte 120,00
#177; 43,59 et la plus faible 35,00 #177; 5,00 densités a
été observée dans les sites F1 et F5, respectivement, de
Legouvogo. Par ailleurs, aucune différence significative n'existe entre
les sites de prélèvement en ce qui concerne la densité de
spores de 90 um de diamètre
III.2.2- Densités moyennes de spores de CMA
selon leurs couleurs
Le tableau VII présente les
densités moyennes de spores de couleur jaunâtre, blanchâtre,
marron-clair et marron-foncé dans les échantillons de sol. Les
analyses de variance ont montré des différences significatives
entre les sols des zones prospectées, pour leurs densités en
spores de couleur jaunâtre (p-value = 0,035063), blanchâtre
(p-value = 0,000120), marron-clair (p-value = 0,000042) et marron-foncé
(p-value = 0,024041), au risque d'erreur de 5%. Pour les spores de couleur
jaunâtre, la plus forte 164,67 #177; 87,78 et la plus faible 83,80 #177;
49,15 densité moyenne a été observée à
Bouaflé et à Bouaké, respectivement. En ce qui concerne
les spores de couleur blanchâtre, la densité moyenne la plus forte
37,40 #177; 27,57 et la plus faible 12,60 #177; 9,32 a été
observée à Bouaflé et à Ferké. Les spores de
couleur marron-clair ont été plus denses dans les
échantillons de sol de la zone de Ferké 31,60 #177; 30,43) et
moins denses 12,13 #177; 9,18) dans la zone de Bouaké.
27
Tableau V : Densités moyennes des spores (nombre
de spores/100g de sol) de 200, 90 et 45um de diamètre dans les
échantillons de sol des zones prospectées
|
Zones
|
Sites de
prélèvement
|
|
Diamètre des spores
|
|
|
200 um
|
90 um
|
45 um
|
|
BFL 1 BFL 2
|
10 #177; 9,17
10 #177; 6
|
93,33 #177; 11,55
195,33 #177; 75,80
|
35,33 #177; 12,86 bc 76 #177; 40,84
abc
|
|
BFL 3
|
15,33 #177; 5,77
|
270 #177; 81,41
|
112,67 #177; 23,86 ab
|
|
BOUAFLE
|
|
|
|
|
|
BFL 4
|
4,67 #177; 6,43
|
204,67 #177; 33,84
|
132,67 #177; 48,01 a
|
|
BFL 5
|
12 #177; 8,72
|
130,67 #177; 96,01
|
15,33 #177; 13,61 c
|
|
p-value
|
0,739888 ns
|
0,216173 ns
|
0,004*
|
|
BK 1
|
5,33 #177; 2,31
|
105,67 #177; 86,32
|
100 #177; 43,59 a
|
|
BK 2
|
4,67 #177; 3,06
|
36 #177; 11,14
|
25 #177; 5 b
|
|
BK 3
|
4,67 #177; 1,15
|
102,67 #177; 6,11
|
73,33 #177; 25,17 ab
|
|
BOUAKE
|
|
|
|
|
|
BK 4
|
4,67 #177; 1,15
|
56,67 #177; 17,93
|
60 #177; 20 ab
|
|
BK 5
|
6,67 #177; 3,06
|
92 #177; 15,62
|
48 #177; 19,29 ab
|
|
p-value
|
0,291526 ns
|
0,218 ns
|
0,048*
|
|
F 1
|
4,67 #177; 3,06 bc
|
166,67 #177; 47,51
|
120 #177; 43,59 a
|
|
F 2
|
7,33 #177; 4,62 b
|
106 #177; 23,58
|
66,67 #177; 20,82 ab
|
|
F 3
|
0,67 #177; 1,15 c
|
122,67 #177; 16,17
|
41,67 #177; 7,64 b
|
|
FERKE
|
|
|
|
|
|
F 4
|
0 #177; 0 c
|
80,67 #177; 47
|
47 #177; 20,66 b
|
|
F 5
|
21,33 #177; 4,16 a
|
126 #177; 25,53
|
35 #177; 5 b
|
|
p-value
|
0,0001**
|
0,072 ns
|
0,015038*
|
|
N 1
|
5,33#177;4,16
|
82,33#177;18,82
|
19,33#177;13,61 b
|
|
N 2
|
6,67#177;8,08
|
106,67#177;55,87
|
21,67#177;7,64 b
|
|
N 3
|
6,67#177;4,16
|
144,67#177;67
|
139,33#177;80,75 a
|
|
NIELLE
|
|
|
|
|
|
N 4
|
7,33#177;3,06
|
170,67#177;37,54
|
118,67#177;42,39 ab
|
|
N 5
|
4,67#177;8,08
|
95,33#177;21,39
|
48,67#177;15,28 ab
|
|
p-value
|
0,113555 ns
|
0,118490 ns
|
0,031974*
|
Légende : * = significatif ; ** = très significatif
; ns = non significatif
Pour chaque zones prospectée et pour chaque type de spore,
les densités moyennes suivies de la même lettre ne sont pas
significativement différentes, au seuil de 5 %, entre les sites de
prélèvement des échantillons de sol.
F= statistique du test de Fisher,
p-value = probabilité d'erreur associée au test
de Fisher.
28
Tableau VI : Densités moyennes (nombre de spores /
100g de sol) des spores de CMA de couleur
|
Jaunâtre, Blanchâtre, Marron- clair et
Marron- foncé des échantillons de sol des zones
prospectées
|
|
Jaunâtre
|
Couleurs des spores
Blanchâtre Marron- clair
|
Marron- foncé
|
|
Zones
|
|
BOUAFLE
|
164,67 #177; 87,78 a
|
37,40 #177; 27,57 a
|
15,73 #177; 14,60 ab
|
36,60 #177; 24,04 a
|
|
BOUAKE
|
83,80 #177; 49,15 b
|
14,20 #177; 17,87 b
|
12,13 #177; 9,18 b
|
15,40 #177; 10,13 b
|
|
FERKE
|
110,27 #177; 49,51 ab
|
12,60 #177; 9,32 b
|
16,73 #177; 9,35 ab
|
22,47 #177; 14,87 ab
|
|
NIELLE
|
128,07 #177; 65,17 ab
|
14,07 #177; 10,38 b
|
31,60 #177; 30,43 a
|
28,87 #177; 17,96 ab
|
|
F
|
3,070678
|
8,274475
|
9,344666
|
3,392969
|
|
p-value
|
0,035063*
|
0,000120**
|
0,000042**
|
0,024041*
|
Légende : * = significatif ; ** = très
significatif
Pour chaque type de spores, les densités moyennes de CMA
suivies de la même lettre ne sont pas significativement
différentes, au seuil de 5 %, entre les localités
prospectées.
F = statistique du test de Fisher,
p-value = probabilité d'erreur associée au test
de Fisher
29
Les abondances relatives des spores de différentes
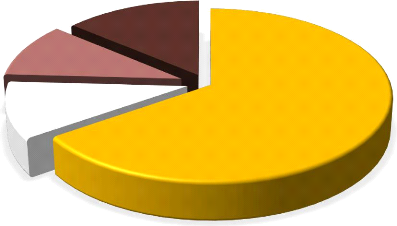
couleurs sont présentées sur la (figure 4). Les
spores de couleur jaunâtre sont les plus abondantes dans l'ensemble des
échantillons des sols avec un pourcentage de 65 %. Elles sont suivies
par les spores de couleur marron-foncé avec un pourcentage de 14 %. Les
spores blanchâtres et marron-clair sont les moins nombreuses avec des
abondances relatives respectives de 11 et 10 %
Le Tableau VIII présente les
densités moyennes de spores de couleur jaunâtre, blanchâtre,
marron-clair et marron-foncé par site de prélèvement des
échantillons de sol dans chacune des zones prospectées. A
Bouaflé, Bouaké, Ferké et Niellé, des
différences significatives ont été observées entre
les sols des sites d'échantillonnage, pour leurs densités en
spores de couleur blanchâtre et marron-foncé,
respectivement.
Pour les spores de couleur blanchâtre, les plus fortes
densités ont été observées dans les sols des sites
de prélèvement BFL2 du campement Siaka 72,67 #177; 18,58 de
Bouaflé, BK1 du village Bouakaman 42 #177; 24,25 de Bouaké, F1 de
Ferké ville 26 #177; 10 et N4 du village Walouavogo de Niellé 26
#177; 12,17. Les plus faibles densités ont été
notées dans les sols des sites BFL1 du campement Siaka 14 #177; 5,29
à Bouaflé, BK5 du village Joachinkro de Bouaké 3,33 #177;
3,06, F3 du village Kporgo de Ferké 8 #177; 5,29 et N5 du village
Dramanavogo de Niellé 4,67 #177; 4,16.
En ce qui concerne les spores de couleur marron-foncé,
les sols des sites BFL3 du village Nakaha de Bouaflé 68 #177; 23,58, BK1
du village Bouakaman de Bouaké 27,67 #177; 2,08, F1 de Ferké
ville 42,67 #177; 19,01 et N4 du village Walouavogo de Niellé 53,33
#177; 3,06 ont présenté les plus fortes densités moyennes.
Les plus faibles densités moyennes ont par ailleurs été
observées dans les sols des sites BFL2 du campement Siaka de
Bouaflé 14 #177; 13,11, BK2 du village Bouakaman de Bouaké 0,67
#177; 1,15, F2 du village Legouvogo de Ferké 11,33 #177; 2,31 et N1 du
village Walouavogo de Niellé 11,33 #177; 7,57.
Les densités des spores de couleur jaunâtre ont
été significativement différentes entre les sites de
prélèvement des échantillons de sol dans les zones de
Bouaflé et Bouaké. Par contre, il n'existe aucune
différence significative entre les sites de prélèvement
à Ferké et Niellé. Dans la zone de Bouaflé, les
échantillons de sol des sites BFL3 de Nakaha et BFL5 de Gobazra ont eu,
respectivement, la plus forte 238 #177; 74 et la plus faible 93,33 #177; 90,69
densité moyenne. A Bouaké, la densité moyenne la plus
forte 158,67 #177; 48,01 et la plus faible 30 #177; 6,93 a été
observée dans les sols des sites BK1 et BK2 de Bouakaman.
Dans les zones de Bouaflé, Bouaké et
Niellé, les sites de prélèvement des échantillons
de sol diffèrent significativement par leurs densités en spores
de couleur marron-clair. Par contre, il n'existe aucune
30
différence significative entre les sites de
prélèvement à Ferké. Dans la zone de
Bouaflé, les échantillons de sol des sites BFL3 de Nakaha et BFL5
de Gobazra ont eu, respectivement, la plus forte 33,33 #177; 22,48 et la plus
faible 6 #177; 5,29 densité moyenne. A Bouaké, la densités
moyenne la plus forte 21,33 #177; 3,51 et la plus faible 1,33 #177; 2,31 a
été observée dans les sols des sites BK5 de Joachinkro et
BK3 de Bouakaman. Dans la zone de Niellé, la plus forte 72,67 #177;
12,70 et la plus faible 8 #177; 13,86 densité moyenne a
été observée dans les sites de prélèvement
N4 de Walouavogo et N5 de Dramanavogo.
Spores Marron-claires
10%
Spores Blanchatres
11%
Spores Marron-foncées
14%
Spores Jaunatres
65%
31
Figure 4: Abondances relatives (%) des spores de
couleur jaunâtre, blanchâtre, marron-clair et marron-fonce dans les
échantillons de sols des zones prospectées
32
Tableau VII : Densités moyennes (nombre de
spores / 100g de sol) des spores de couleur jaunâtre, blanchâtre,
marron-clair et marron-foncé par site de prélèvement des
échantillons de sol des zones prospectées
|
|
|
|
|
|
|
Couleurs des spores
|
|
|
Zones
|
Sites de prélèvement
|
Jaunâtre
|
Blanchâtre
|
Marron-clair
|
Marron -foncé
|
|
BFL 1
|
94 #177; 5,29 b
|
14 #177; 5,29 b
|
8 #177; 3,61 b
|
21 #177; 2,65 b
|
|
BFL 2
|
162 #177; 59,23 ab
|
72,67 #177; 18,58 a
|
14,67 #177; 12,22 ab
|
14 #177; 13,11 b
|
|
BFL 3
|
238 #177; 74 a
|
26 #177; 14 b
|
33,33 #177; 22,48 a
|
68 #177; 23,58 a
|
|
BOUAFLE
|
|
|
|
|
|
|
BFL 4
|
236 #177; 76,60 a
|
60 #177; 12,17 a
|
16,67 #177; 9,87 ab
|
32 #177; 17,78 ab
|
|
BFL 5
|
93,33 #177; 90,69 b
|
14,33 #177; 12,50 b
|
6 #177; 5,29 b
|
48 #177; 12,49 ab
|
|
p-value
|
0,046*
|
0,001*
|
0,0142*
|
0,011*
|
|
BK 1
|
158,67 #177; 48,01 a
|
42 #177; 24,25 a
|
18,33 #177; 8,02 a
|
27,67 #177; 2,08 a
|
|
BK 2
|
30 #177; 6,93 b
|
4,67 #177; 8,08 b
|
4,67 #177; 3,06 b
|
0,67 #177; 1,15 b
|
|
BK 3
|
86 #177; 10,39 ab
|
6,67 #177; 3,06 b
|
1,33 #177; 2,31 b
|
14,33 #177; 8,39 a
|
|
BOUAKE
|
|
|
|
|
|
|
BK 4
|
75,67 #177; 5,51 b
|
14,33 #177; 2,08 ab
|
15 #177; 6,56 a
|
17,67 #177; 4,51 a
|
|
BK 5
|
68,67 #177; 34,95 b
|
3,33 #177; 3,06 b
|
21,33 #177; 3,51 a
|
16,67 #177; 7,64 a
|
|
p-value
|
0,008739*
|
0,025403*
|
0,003*
|
0,002*
|
|
F 1
|
171,33 #177; 68,01
|
26 #177; 10 a
|
30 #177; 10
|
42,67 #177; 19,01 a
|
|
F 2
|
76 #177; 18,33
|
11,33 #177; 6,43 ab
|
15,33 #177; 6,11
|
11,33 #177; 2,31 b
|
|
F 3
|
110 #177; 25,06
|
8 #177; 5,29 b
|
12 #177; 6,25
|
16 #177; 6 b
|
|
FERKE
|
|
|
|
|
|
|
F 4
|
76 #177; 46
|
12,33 #177; 5,51 ab
|
14,33 #177; 8,02
|
14,67 #177; 7,02 b
|
|
F 5
|
118 #177; 15,62
|
5,33 #177; 5,03 b
|
12 #177; 5,29
|
27,67 #177; 10,12 ab
|
|
p-value
|
0,351092 ns
|
0,029*
|
0,907896 ns
|
0,025*
|
|
N 1
|
81 #177; 25,63
|
9,33 #177; 4,62 bc
|
17 #177; 2,65 b
|
11,33 #177; 7,57 b
|
|
N 2
|
84 #177; 61,61
|
8,33 #177; 5,69 bc
|
15,67 #177; 10,79 b
|
21,67 #177; 12,58 ab
|
|
N 3
|
188,67 #177; 89,27
|
22 #177; 3,46 ab
|
44,67 #177; 41,05 ab
|
26,67 #177; 21,39 ab
|
|
NIELLE
|
|
|
|
|
|
|
N 4
|
156,67 #177; 29,01
|
26 #177; 12,17 a
|
72,67 #177; 12,70 a
|
53,33 #177; 3,06 a
|
|
N 5
|
130 #177; 59,09
|
4,67 #177; 4,16 c
|
8 #177; 13,86 b
|
31,33 #177; 11,02 ab
|
|
p-value
|
0,133033 ns
|
0,040417*
|
0,023178*
|
0,018*
|
Pour chaque zones, dans une même colonne, les
densités moyennes de spores suivies de la même lettre ne sont pas
significativement différentes entre les sites de
prélèvement au seuil de 5%.
F= statistique du test de Fisher,
p-value = probabilité d'erreur associée au test
de Fisher
33
III.3- Diversité des communautés de
champignons mycorhiziens à arbuscules
III.3.1- Familles de champignons mycorhiziens à
arbuscules dans les échantillons de sol
Sur la base des caractéristiques
morpho-métriques et structurales des spores, 13 familles de champignons
mycorhiziens à arbuscules ont été identifiées dans
les échantillons de sols. Les familles les plus
représentées sont celles des Glomeraceae, des
Acaulosporaceae et des Gigasporaceae qui ont
été observées à Bouaflé, Bouaké,
Ferké et Niéllé. L'analyse de variance des densités
de spores a révélé, au risque d'erreur á = 5%, des
différences significatives seulement entre les abondances de spores de
Glomeraceae (F = 5,67917 ; p = 0,007618) dans les sols des 4 zones. La
plus forte densité 385#177;219,48 et la plus faible densité
123,8#177;65,44 de spores de Glomeraceae a été obtenue dans les
échantillons de sols de Bouaflé et Bouaké, respectivement.
Les 12 autres familles de CMA, ont été observées dans les
sols de 3, 2 ou 1 des 4 zones. Ainsi des spores de Pacisporaceae, de
Scutellosporaceae et de Racocetraceae ont été
observées dans les échantillons de sols de Bouaké,
Ferké et Niéllé. Par ailleurs, des spores
d'Archeosporaceae ont été observées à
Bouaflé et Ferké, celles d'Ambisporaceae ont
été mises en évidence dans les échantillons de sol
de Bouaké et Ferké tandis que celles de Diversisporaceae
ont été observées à Bouaké et
Niellé. Enfin, seuls les échantillons de sol de Bouaflé
ont présenté des spores de Sacculosporaceae alors que
des spores de Paraglomeraceae, de Dentiscutataceae et
d'Entrosphosparaceae ont été observées
exclusivement dans les échantillons de sol de Bouaké
(Annexe 2).
III.3.2- Genres de champignons mycorhiziens à
arbuscules dans les échantillons des sols
Les genres de champignons mycorhiziens à arbuscules mis
en évidence dans les échantillons de sols sont
présentés dans le Tableau IX. Huit genres de
champignons mycorhiziens à arbuscules appartenant à cinq familles
ont été observés dans la zone de Bouaflé. Les
genres Glomus et Acaulospora avec les proportions de 43,83 %
et 37,10 %, respectivement, sont les plus représentatifs. Les genres
Funneliformis (6,01 %), Gigaspora (5,04 %), Septoglomus
(3,75 %), Rhizophagus (1,05 %), Archaeospora (1,05 %) et
Sacculospora (0,8 %) sont les moins abondants.
Dans la zone de Bouaké, 14 genres de CMA appartenant
à 11 familles ont été identifiés dans les
rhizosphères de maïs. Les genres Glomus et Acaulospora
sont les plus représentatifs avec les proportions 22,8 % et 42,86
%. Les 12 autres genres de CMA, Gigaspora (5,07 %), Funneliformis
(2,17 %), Septoglomus (4,34 %), Scutellospora (4,52 %),
Cetraspora (0,86 %), Racocetra (1,92 %), Pacispora
(1,05 %), Ambispora (1,11 %), Paraglomus (1,52 %),
Viscospora (1,11 %), Dentiscutata (1,11 %) et
Diversispora (1,05%) sont minoritaires.
Dans la zone de Ferké, 11 genres de CMA appartenant
à 8 familles ont été observées. Les genres
Glomus et Acaulospora sont les plus représentatifs
avec les proportions 31,15 % et 40,4 %
34
respectivement. Les genres Gigaspora (5,50 %),
Funneliformis (4,84 %), Septoglomus (4,84 %),
Scutellospora (2,29 %), Archaeospora (1,62 %), Pacispora
(1,53 %), Ambispora (1 %), Rhizophagus (0,64 %),
et Cetraspora (0,62 %), sont minoritaires.
Dix genres de CMA appartenant à six familles ont
été observés dans les échantillons de sol de la
zone de Niéllé, Les genres Glomus et Acaulospora
sont les plus abondants avec les proportions de 21 % et 39,16 %. Ils sont
suivis par les genres Gigaspora (10,57 %), Funneliformis
(9,73 %) et Septoglomus (6,82 %). Les genres Scutellospora
(4 %), Racocetra (1,66 %), Cetraspora (1,33 %),
Rhizophagus (1,25 %), et Pacispora (1,11 %) sont
minoritaires. Les différents genres des champignons mycorhiziens
identifiés par leurs spores respectives sont représentés
dans les Figures 5 (5.a et 5.b).
35
Tableau VIII : Proportions des genres de CMA dans les
echantillons de sol des zones prospectees
Familles Genres Bouaflé Bouaké Ferké
Niéllé
|
Glomeraceae
|
Glomus 43,83% 22,80% 31,15% 21%
Funneliformis 6,01% 2,17% 4,84% 9,73%
Septoglomus 3,75% 4,34% 4,84% 6,25%
Rhizophagus 1,50% 0,64% 1,25%
|
Acaulosporaceae Acaulospora 37,10% 42,86% 40,40%
39,16%
Gigasporaceae Gigaspora 5,04% 5,07% 5,50% 10,57%
Scutellosporaceae Scutellospora 4,52% 2,29% 4%
Cetraspora 0,86% 0,62% 1,33%
Racocetraceae
Racocetra 1,92% 1,66%
Pacisporaceae Pacispora 1,05% 1,53% 1,11%
Ambisporaceae Ambispora 1,11% 1%
Archaeosporaceae Archaeospora 1,05% 1,62%
Paraglomeraceae Paraglomus 1,52%
Sacculosporaceae Sacculospora 0,80%
Entrophosparaceae Viscospora 1,11%
Dentiscutataceae Dentiscutata 1,11%
Diversisporaceae Diversispora 1,05%
Indéterminés 0,92% 8,51% 5,57% 3,94%

200 um
90 um
90 um
A
D E F
90 um
G H
M
90 um
J
200 um
200 um 90 um
45 um
B C
90 um
200 um
N
K
90 um
O
90 um
I
90 um L
90 um
36
Figure 5 a Spores de champignons mycorhiziens
à arbuscules observées au microscope optique (grossissement 40x)
dans du polyvinyle glycerol
Glomus sp1 (A), Gigaspora sp 1 (B),
Gigaspora sp 2 (C), Glomus sp2 ( D), Sacculospora sp
(E), Acaulospora sp1 (F), Septoglmous sp1 (G),
Acaulospora sp2 (H), Racocetra sp (I), Funneliformis
sp (J), Ambispora sp (K), Archaeospora sp (L),
Septoglomus sp2 (M), Glomus sp3 (N), Glomus sp4
(0)

200 um
200 um
200 um 200 um 200 um
200 um
J K
M N O
G H
D E
A B
90 um
200 um
90 um 90 um
90 um
200 um
200 um
90 um
C
L
200 um
F
I
37
Figure 5 b : Spores de champignons
mycorhiziens à arbuscules observées au microscope optique
(Grossissement 40x) dans du Polyvinyle glycérol
Acaulospora sp (A), Scutellospora sp (B),
Funneliformis sp (C), Glomus sp1 (D), Racocatra sp
(E), Diversispora sp (F), Gigaspora sp (G), Cetraspora
sp (H), Sacculospora sp (I), Glomus sp (J),
Septoglomus sp (K), Spores non identifiées (L, M, N, O)
DISCUSSION
38
IV- Discussion
Les échantillons de sol prélevés dans la
rhizosphère de plants de maïs à Bouaflé,
Bouaké, Ferké et Niéllé ont un pH
légèrement acide compris entre 6,21 et 6,47. Ces valeurs moyennes
de pH se situent dans la gamme de pH de sols favorables à une bonne
absorption racinaire des éléments nutritifs (Ognalaga,
2015). Les teneurs en phosphore assimilable sont comprises entre 60,17
et 117,88 g/kg de sol. Comparativement aux données de Siene
et al. (2020) qui ont obtenu des teneurs comprises entre 9,44
et 13,84 mg/kg de sol à Korhogo, les sols de Bouaflé,
Bouaké, Ferké et Niéllé ont une teneur
élevée en Phosphore assimilable. Les teneurs en potassium et en
magnésium comprises respectivement entre 0,1 et 0,14 Cmol/Kg de sol et
entre 0,63 et 0,83 Cmol/Kg de sol sont inférieures à celles
obtenues par Rincón, Droh, Villard et al. (2021)
dans les sols des régions de la Nawa, du Goh et de San-Pedro,
qui se situent respectivement entre 0,9 et 0,24 Cmol/Kg de sol ; entre 0,79 et
2,78 Cmol/Kg de sol. Elles sont par ailleurs inférieures au seuil
critique défini par Landon (1984) qui est de 4 Cmol/Kg
pour le potassium et de 0,5 Cmol/kg pour le magnésium.
Au niveau du rapport C/N, les valeurs obtenues sont comprises entre
10,4 et 11,15. Cela traduit une minéralisation normale de l'azote et par
conséquent sa biodisponibilité (Aké et
al., 2018). Ces caractéristiques physico-chimiques
montrent que les sols échantillonnés sont propices au
développement de la vie des micro-organisqmes telluriques dont les CMA
(Ognalaga, 2015).
En moyenne 138,66 #177; 11,37 à 398 #177; 86,97 ; 65,66
#177; 11,93 à 211 #177; 121,87; 127,66 #177; 63,37 à 291,33 #177;
82,51 et 107 #177; 9,53 à 296,66 #177; 4,61 spores de CMA ont
été observées dans 100 g de sol dans la rhizosphère
des plants de maïs, respectivement, dans les zones de Bouaflé;
Bouaké, Ferké et Niéllé. Ces données sont
particulièrement basses comparativement aux densités de spores de
CMA, de l'ordre 3259 #177; 32 à 12501,5 #177; 1850,5 et 4016 #177; 0,89
à 5036 #177; 0,72 spores/ 100 g de sol, rapportées dans les
cultures de maïs au bénin (Bossou et al.,
2019) et au Brésil (Castelli et al.,
2014). Il en est de même des densités de 842 à
1469 spores/ 100 g de sol observées dans les champs de manioc en
Côte-d'Ivoire (Voko et al., 2013) et de 358
#177; 0,25 à 535 #177; 0,05 spores/ 100 g de sol obtenues dans les
rhizosphères de fromagers (Ceiba pentandra) et et de
Makoré (Tieghemella heckelii), respectivement (Anguiby
et al., 2019). Cependant, des densités de spores de
CMA plus faibles, de l'ordre 15 à 38 spores/100 g de sol, ont
été rapportées dans différents types de
végétations forestières au sein de la foret classée
de la Téné en Côte-d'Ivoire (Zézé
et al., 2007). Il apparait des résultats de ces
diffférentes études que la densité des spores de CMA
serait liée aux caractéristiques physico-chimiques et aux taux
d'humidité des sols ainsi qu'aux types de végétations, de
cultures et de pratiques culturales. En effet, Egli et Brunner (2002)
ainsi que Kodjo et al. (2013) ont
indiqué que les sols pauvres en éléments minéraux,
surtout en phosphore et azote, favorisent le bon fonctionnement de la
mycorhization. Par contre, les fortes teneurs en phosphore et azote
réduisent la
39
mycorhization des plantes et par conséquent elles
diminuent leur prolifération. Tawaraya (2003) a par
ailleurs souligné que la dépendance mycorhizienne des plantes
hôtes diminue avec la quantité de phosphore disponible dans le sol
car elles n'ont pas besoin des hyphes mycorhiziens pour une meilleure
absorption du phosphore à partir de la solution du sol.
Conformément aux résultats de ces auteurs, les
différences significatives observées, dans la présente
étude, entre les sols des localités prospectées, pour
leurs teneurs en phosphore assimilable, en cation Ca2+, en cation
K+ ainsi que leurs capacités d'échange cationique
(CEC) peuvent justifier les différences entre leurs densités en
spores de CMA. Les végétations varient aussi de la forêt
aux savanes arborée et arbustive à Bouaflé et
Bouaké (Dibi et al., 2008) à une zone
de savane herbeuse dans les zones de Ferké et Niéllé.
Ainsi, comme l'ont mis en évidence (Njeru et al., 2014
; Lohest, 2018 ; Touré et al., 2021),
le couvert végétal est certainement un facteur important
ayant déterminé les différences d'abondance et de
diversité des CMA observées dans cette étude. Le taux
d'humidité des sols influence également l'abondance des
propagules de CMA (Cardoso et Kuyper, 2006). Dans les zones de
Bouaflé et Bouaké, le cumul des précipitations a
été de 46,8 mm et 59,4 mm de pluie, respectivement, pour les mois
de Novembre et Décembre alors qu'aucune pluie n'est tombée
à Ferké et Niéllé (Infoclimat,
2020). Ce déficit hydrique a un éffet négatif sur
la croissance des plantes et réduit la symbiose mycorhizienne du fait
que les CMA sont des biotrophes obligatoires. En ce qui concerne l'influence
des types de culture sur la densité des spores de CMA dans la
rhizosphère, Garbaye (2013) a rapporté que les
racines du maïs sont moins abondantes, trapues et dépourvues de
poils absorbants et donc particulièrement dépendantes des
CMA. Par ailleurs, au Maroc, Meddich et al.
(2017) ont montré que les fréquences de mycorhization
des racines du maïs sont plus élevées que celles des
palmiers dattiers.
Des spores de couleurs jaunâtre, blanchâtre,
marron-claire et marron-foncé ont été observées
dans les échantillons de sol. Les spores de couleur jaunâtre avec
un taux de 65 % sont les plus abondantes dans les rhizosphères de
maïs. Elles sont suivies des spores de couleur marron-foncé 14 %,
blanchâtres 11 %, et des spores de couleurs marron-clair 10 %. Ces
données difffèrent de celles de Bossou et al.
(2019) et Mohammedi (2018) qui
ont remarqué une abondance des spores de couleur noire respectivement
dans les sols de cultures du maïs au Bénin et du palmier dattier au
Maroc. Concernant leurs tailles, des spores de CMA de 200, 90 et 45 um de
diamètre ont été observés. Les spores de 90 um de
diamètre sont les plus abondantes avec un pourcentage de 62,72. Elles
sont suivies des spores de 45 um (33,68 %) et 200 um (3,6 %) de
diamètre. Ces résultats sont en accord avec ceux de Dione
(2007) et Johnson et al. (2013) qui ont
remarqué que l'abondance des spores de CMA est inversement
proportionnelle à leur taille.
40
Sur la base des caractéristiques
morpho-métriques et structurales des spores, dix-sept genres de CMA
appartenant à treize familles ont été identifiés
sur l'ensemble des sites prospectés. La famille des Glomeraceae
représentée par les genres Glomus, Funneliformis,
Septoglomus et Rhizophagus ainsi que les familles des Acaulosporaceae
et des Gigasporaceae représentées par les genres
Acaulospora et Gigaspora, respectivement, sont les plus
abondantes. La diversité de familles et de genres de CMA
identifiées dans l'ensembles des zones prospectées dans cette
étude est supérieure à celles obtenues par Bossou
et al. (2019) et Koffi et al. (2021)
qui ont observé quatre genres réparties en quatre
familles et cinq genres réparties en trois familles, respectivement dans
les sols de culture du maïs au Benin et en Côte d'Ivoire. En outre,
Droh (2017) n'a mis en évidence que 5 familles
(Acaulosporaceae, Diversisporaceae, Gigasporaceae,
Glomeraceae et Paraglomeraceae) se déclinant en 7 genres
(Acaulospora, Diversispora, Otospora, Gigaspora, Racocetra, Glomus et
Paraglomus) dans la rhizosphère de cacaoyers dans trois zones
agroécologiques de la Côte d'Ivoire.
Sidibé et al. (2015) ont aussi mis en
évidence, sur l'igname, dans trois zones agroécologiques, 7
genres (Acaulospora, Ambispora, Claroideoglomus, Glomus, Gigaspora,
Pascispora et Scutellospora) de CMA. Cependant, comme l'ont
déjà mentionné Castelli et al.
(2014), Bossou et al. (2019) et
Koffi et al. (2021), sous culture de maïs au
Brésil, au Benin et en Côte d'Ivoire, les genres Glomus,
Acaulospora et Gigaspora sont les plus abondants dans les
échantillons de sols qui ont été analysés dans
cette étude. Des résultats similaires ont été
obtenus par Voko et al. (2013) qui ont
remarqué, sous culture de manioc en Côte d'Ivoire, une
prédominance des genres Glomus et Acaulospora. Les
résultats de ces différentes études concordent avec les
conclusions de nombreux auteurs qui ont montré que les
écosystèmes en général, et plus
particulièrement ceux d'Afrique de l'ouest, sont dominés par les
familles des Glomeraceae, Acaulosporaceae et
Gigasporaceae (Singh et Adholeya, 2013 ; Barnes et
al., 2016 ; Soka et Ritchie, 2018). La prédominance de ces
familles, notamment celles des Glomeraceae et Acaulosporaceae
dans les zones tropicales en Afrique de l'ouest (Voko et
al., 2013) serait due à leur grande adaptabilité
aux conditions de stress (Lenoir et al., 2016) du
fait de leur propagation préférentielle par les structures de
résistance que sont les spores (Brito et al.,
2012).
Les genres Glomus, Acaulospora et Gigaspora
et plus largement les familles des Glomeraceae, Acaulosporaceae
et Gigasporaceae représentent des symbiotes
généralistes qui peuvent coloniser une grande diversité de
plantes hôtes (Öpik et al., 2010).
Cependant, certains des autres genres (Funneliformis, Septoglomus,
Rhizophagus, Scutellospora, Cetraspora, Racocetra, Pacispora, Ambispora,
Archaeospora, Paraglomus, Sacculospora, Viscospora, Dentiscutata et
Diversispora) identifiés dans l'ensemble des
échantillons de sol pourraient être des CMA spécialistes
associés à la culture du maïs, aux autres espèces de
plantes cultivées ou aux plantes adventices poussant dans les
41
différentes zones prospectées. En analysant les
communautés mycorhiziennes arbusculaires sur des arbres forestiers de
différents âges, Diédhiou et al. (2010)
et Bennett et al. (2013) ont mis en
évidence un remplacement des CMA généralistes par des CMA
spécialistes au fur et à mesure que les plantes vieillissent.
Aussi, les échantillons de sol ayant été
prélevés après la récolte des épis, dans des
champs portant des plants de maïs secs, des genres de CMA
identifiés pouraient êtres spécifiques des plants
âgés.
QUATRIEME PARTIE :
CONCLUSION ET PERSPECTIVES
42
V- Conclusion et perspectives V.1- Conclusion
Cette étude s'inscrit dans un programme de recherche en
amélioration durable de la production du maïs en Côte
d'Ivoire par une optimisation de la nutrition minérale ainsi que la
résistance aux facteurs environnementaux tels que le changement
climatique, la sècheresse et les pathogènes. C'est pourquoi, les
travaux réalisés ont eu pour objectif principal d'identifier des
communautés de CMA associées à la culture du maïs.
Ainsi cette étude a porté sur les caractéristiques
physico-chimiques des sols et plus partuclièrement sur l'abondance des
champignons mycorhiziens à arbuscules en fonction de la couleur et de la
taille de spores et sur leur diversité suivant les
caractéristiques morphométriques des spores.
Les analyses physico-chimiques ont montré que les
échantillons de sols prélevés dans les rhizosphères
de maïs dans les zones de Bouaké, Bouaflé,
Niéllé et Ferké se caractérisent par un pH
légèrement acide compris entre 6,21 et 6,47. Les sols de
Bouaké et Bouaflé contiennent par ailleurs des teneurs en
éléments minéraux (phosphore assimilable, cation
Ca2+, cation Na+, cation K+) plus
élevées que celles des sols de Ferké et
Niéllé. Ces caractéristiques physico-chimiques sont
propices au développement de la vie dans les sols de ces 4 zones et
à une bonne absorption racinaire des éléments nutritifs
Du point de vue quantitatif, la densité de spores de
CMA a été plus élevée dans les sols de
Bouaflé 263,60 spores/100 g de sol suivie des sols de
Niéllé 195,6 spores/100 g de sol , Ferké 189,26 spores/100
g de sol ; et de Bouaké 145,06 spores/100 g de sol. Suivant la taille,
les spores de 90 um de diamètre sont les plus abondantes avec un
pourcentage de 62,72. Elles sont suivies des spores de 45 um ( 33,68 %) et 200
um (3,6 %) de diamètre. Par ailleurs, les spores de couleur
jaunâtre avec une proportion de 65 % sont les plus abondantes dans les
rhizosphères de maïs. Elles sont suivies des spores de couleur
marron-foncé (14 %), blanchâtres (11 %) et des spores de couleurs
marron-clair (10%). Sur la base des caractéristiques
morpho-métriques des spores, dix-sept genres de CMA appartenant à
treize familles ont été identifiées dans l'ensemble des
sites. La famille des Glomeraceae représentée par les
genres Glomus, Funneliformis, Septoglomus et Rhizophagus ainsi que les
familles des Acaulosporaceae et des Gigasporaceae
représentées par les genres Acaulospora et
Gigaspora, respectivement, sont les plus abondantes. Outre leurs
teneurs en éléments minéraux, les 4 zones
prospectées présentent différents couverts
végétaux et taux d'humidité qui ont certainement
été les facteurs déterminants les différences
d'abondance et de diversité des CMA.
En somme, cette étude a permis d'en savoir d'avantage
sur la composition des communautés de CMA et les caractéristiques
physicochimiques des sols dans la rhizosphère des plants de maïs
dans les régions de Bouaké, Bouaflé, Niéllé
et Ferké en Côte d'Ivoire. Ces données permettront
d'identifier
43
les types de CMA et les densités optimales à
utiliser en vue d'amender les sols pour améliorer les rendements des
cultures de mäis.
V.2- Perspectives
Les résultats de cette étude soulèvent
quelques préoccupations :
- Les échantillons de sol ont été
prélevés entre les mois de novembre-décembre et sur des
plants de maïs secs (en fin de croissance) alors que la structure des
communantés de CMA peut varier d'une saison à une autre. Ainsi,
des résultats différents auraient pu être obtenus à
une autre période de l'année
- Les communautés de CMA peuvent varier selon les
stades de dévéloppement des plantes. Les racines de maïs
pourraient de ce fait certainement porter des communautés de CMA
différentes en fonction du niveau de croissance des plantes.
Différentes perspectives de recherche peuvent donc
être envisagées en vue de trouver les réponses à ces
préoccupations. Il s'agira de :
1) prélever :
a) des échantillons de sol sur diverses
périodes de l'année et dans différentes régions
afin de mieux connaitre la structuration des communautés de CMA à
travers des interpretations biogéographiques et réaliser une
cartographie de leur repartition en Côte d'Ivoire ;
b) des échantillons de sol à différents
stades de développement des plants de maïs afin de mieux aprehender
la dynamique des communautés de CMA qui leurs sont associées.
2) évaluer :
a) la résistance des genres de CMA les plus
fréquemment rencontrés dans les échantillons de sol,
Glomus, Acaulospora et Gigaspora notamment, face aux
différentes pratiques culturales et aux conditions changeantes de
l'environnement ;
b) la capacité des différents genres de CMA
à améliorer, séparémment ou en mélange, la
qualité des sols afin de développer des inocula à base de
ces genres pour augmenter le rendrement des cultures de maïs en Côte
d'Ivoire.
RÉFÉRENCES
BIBLIOGRAPHIQUES
42
REFFERENCES BIBLIOGRAPHIQUES
Ahossane K., 2010.- République de
Côte d'Ivoire : Communication Nationale sous la convention
cadre des Nations Unies sur les Changements Climatiques. 9
mars 2010 à Abidjan (Côte d'Ivoire). 217 p.
Aké H. T. B., Tra Bi T., Dogbo O. D.,
2018.- Caractéristiques physico-chimiques des composts à
base de sous-produits de ferme de Songon en Côte d'Ivoire. Int. J.
Biol. Chem. Sci., 12(1) : 596-609
Anguiby B. L. A., Ouattara G., Bomisso E. L., N'goran
B., Ouattara B., Coulibaly S. A., Aké S., 2019.- Evaluation du
statut mycorhizien d'arbres de Ceida pentandra, Gaertn et
Tieghemella heckelii (A. Chev), pierre, du jardin botanique de
Bingerville en Côte d'Ivoire. Journal of Applied Biosciences,
138: 14092-14105
Bago B., Azcon-Aguilar C., Goulet A., Piche Y., 2000.
- Branched absorbing structures (BAS) : a feature of the extraradical
mycelium of symbiotic arbuscular mycorrhizal fungi. New Phytologist,
139: 375-388.
Bambara F. A. A., (2012 ).- Optimisation de
la fertilisation azotée du mais en culture pluviale dans l'ouest du
BURKINA FASO : utilisation du modèle agronomique DSSAT. Mémoire
d'ingénieur du développement rural (option Agronomie),
Université Polytechnique de BOBO-DIOULASSO, Burkina Faso 42 p
Barnes C. J., Maldonado C., Frøslev T. G.,
Antonelli A. et Rønsted N., 2016. - Unexpectedly high
beta-diversity of root-associated fungal communities in the Bolivian Andes.
Frontiers in Microbiology, 7 : 1-13.
Bennett A., Daniell T., Öpik M., Davison J.,
Moora M., Zobel M., Selosse M. A., Evans D., 2013.-Arbuscular
mycorrhizal fungal networks vary throughout the growing season and between
successional stages. PloS one, 8 : 83241.
Besserer A., Bécard G., Jauneau A., Roux C.,
Séjalon-Delmas N., 2008.- GR24, a synthetic analog of
strigolactones, stimulates the mitosis and growth of the arbuscular mycorrhizal
fungus Gigaspora rosea by boosting its energy metabolism. Plant
physiology, 148: 402-13.
Bonfante P., et Anca I-A 2010.- Plants,
Mycorrhizal Fungi, and Bacteria: A Network of Interactions. Plant Hormones
1:363-383
Bonfante P., et Genre A., 2010.- Mechanisms
underlying beneficial plant-fungus interactions in mycorrhizal symbiosis.
Nature Communications. 1-48.
43
Bossou L. D. R., Houngnandan H. B., Adandonon A.,
Zoundji C., 2019.- Diversité Des Champignons Mycorhiziens
Arbusculaires Associés à La Culture Du Maïs (Zea
Mays L.). International journal of biological chemical sciences,
13(2): 597-609.
Brito I., Goss M. J., Carvalho M., Chatagnier O.,
Tuinen D. V., 2012.- Impact of tillage system on arbuscular mycorrhiza
fungal communities in the soil under Mediterranean conditions. Soil and
Tillage Research, 121: 63 - 67.
Cardoso I.M., Kuyper T.W., 2006.- Mycorrhizas
and tropical soil fertility. Agri. Ecosy. Envir., 116 : 72-84.
Castelli M., Urcoviche R.C., Gimenes R. M. T. et
Alberton O., 2014.- Diversité des champignons mycorhiziens
arbusculaires chez le maïs sous différentes gestions des sols et
traitement des semences avec un fungicide. Journal de l'alimentation, de
l'agriculture et de l'environnement, 12 (2) : 486-491.
Crossay Thomas., 2018.-
Caractérisation taxonomique des champignons mycorhiziens
à arbuscules natifs des sols ultramafiques de Nouvelle-Calédonie
; analyse de leur synergie permettant l'adaptation des plantes à ces
milieux extrêmes. Thèse de doctorat en microbiologie des sols de
l'Université de la Nouvelle-Calédonie, 224p
Dai M., Hamel C., Bainard L. D., Arnaud M. S., Grant
C. A., Lupwayi N. Z., Malhi S. S., Lemke R., 2014.- Negative and
positive contributions of arbuscular mycorrhizal fungal taxa to wheat
production and nutrients uptake efficiency in organic and conventional systems
in the Canadian prairie. Soil Biology and Biochemistry, 74:.
156-166
Dalpe Y. 2005.- Mycorrhizae: a potential tool
for plant protection but not a panacea. Phytoprotection 86: 53-59.
Debiane D., Garçon G., Verdin A., Fontaine J.,
Durand R., Grandmougin-Ferjani A., Shirali P., & Sahraoui A. L. H., 2008.-
In vitro evaluation of the oxidative stress and genotoxic
potentials of anthracene on mycorrhizal chicory roots. Environmental and
Experimental Botany, 64, 120-127. Delaux P.-M., Bécard G.,
Combier J-P., 2013.- NSP1 is a component of the Myc signaling pathway.
New Phytol, 199 :59-65.
Delaux P. M., 2017.- Phylogénomique
comparative des associations symbiotiques. Nouveau Phytol., 213 :
89-94.
Demay, F., 1995.- Dosage de løazote
total par methode de Kjeldahl. BTS BioAnalyses & Contrôles.
Bioanalyses, 3p.
44
Dibi N. H, Yao C., Adou Y., N'guessan., Koné
M., Yao S. C., 2008.- Analyse de la diversité floristique du
parc National de la Marahoué, Centre-Ouest de la Côte d'Ivoire.
Afrique Science, 3: 552-579
Diédhiou A., Selosse M. A., Galiana A.,
Diabaté M., Dreyfus B., BÂ A., DE Faria S., Béna G., 2010.-
Multi-host ectomycorrhizal fungi are predominant in a Guinean tropical
rainforest and shared between canopy trees and seedlings. Environmental
Microbiology, 12 : 2219-2232
Dione B., 2007.- Valorisation des
communautés de champignons mycorhiziens associés aux plantes
pionnières dans la domestication des essences forestières en
milieu sahélien. Diplôme national de master en sciences et
technologie. 46p
Doidy J., van Tuinen D., Lamotte O., Corneillat M.,
Alcaraz G., Wipf D., 2012.- The Medicago truncatula sucrose
transporter family : Characterization and implication of key members in carbon
partitioning towards arbuscular mycorrhizal fungi. Molecular Plant. 5,
1346-1358.
Driai Sihem, 2016.- Impact des polluants
d'origine industrielle sur le développement des champignons mycorhiziens
à arbuscules, sur leur diversité et sur la viabilité
microbienne des sols des agro-écosystèmes du Nord-est
algérien. Thèse de doctorat, 137p
Droh G., Kouassi A. B., Kouadjo Z. C. G., Zeze A.,
Nguetta A. S., Sanders I. R., 2016.-Effect of two AMF on growth of
cocoa seedlings (Theobroma cacao L.) in greenhouses. Global
Journal of Advanced Research, 3(3), 157-164
Droh G., 2017.- Diversité
génétique des champignons mycorhiziens à arbuscules
associes au cacaoyer (Théobroma cacao L.) de Côte
d'Ivoire : cas de la rhizosphère des cacaoyères des
régions du Gôh, de la Nawa et de San-Pédro. Thèse de
doctorat en biologie de l'université Félix Houphouët Boigny,
UFR Biosciences, 196 p
Egli S. et Brunner I., 2002.- Les mycorhizes
Une fascinante biocénose en forêt (Institut fédéral
de recherches), 8p
FAO., 2017.- Données de l'alimentation et
de l'
agriculture. www.fao.org.
Consulté le 10/05/2021
FAO, FIDA, PAM., 2015.- L'État de
l'insécurité alimentaire dans le monde 2015. Objectifs
internationaux 2015 de réduction de la faim : Rome, FAO.
Ferrol N., González-Guerrero M., Valderas A.,
Benabdellah K., Azcón-Aguilar C., 2009.-Survival strategies of
arbuscular mycorrhizal fungi in Cu-polluted environments. Phytochem.
Rev, 8 : 551-559.
45
Garbaye J., 2013.- La symbiose mycorhizienne,
une association entre les plantes et les champignons. Ed. Quae, Versailles, 251
p.
Genre A., Chabaud M., Balzergue C., 2013.-
Short-chain chitin oligomers from arbuscular mycorrhizal fungi trigger
nuclear Ca2+ spiking in Medicago truncatula roots and their
production is enhanced by strigolactone. New Phytol., 198 :190-202.
Genre A, Chabaud M, Timmers T, Bonfante P, Barker DG.,
2005.- Arbuscular mycorrhizal fungi elicit a novel intracellular
apparatus in medicago truncatula root epidermal cells before infection. The
Plant Cell 17: 3489- 3499.
Gerdemann J. W. & Nicolson T. H.., 1963.-
Spores of endogone species from soil by wet sieving and decanting.
Trans. Br. Myc. Soc., 46 : 235 - 244.
Giovannetti M., Avio L., Sbrana C., 2010.-
Fungal spore germination and pre-symbiotic mycelial growth :
physiological and genetic aspects. Koltai H., Kapulnik Y. (eds) Arbuscular
mycorrhizas: Physiology and Function, 2nd Edition. Springer Science + Business
Media.
Goltapeh E. M., Danesh Y. R., Prasad R., Varma A.,
2008.- Mycorrhizal fungi: what We Know and what neutral should we
know. A. Varma (ed) Mycorrhiza, 3-27.
Gosling P., Hodge A., Goodlass G., Bending G. D.,
2006.- Arbuscular mycorrhizal fungi and organic farming.
Agriculture, Ecosystems and Environment, 113 :17-35.
Goula B., Brou K., Brou T., Savané I., Vamoryba
F. & Bernard S., 2007.- Estimation des pluies exceptionnelles
journalières en zone tropicale : cas de la Côte d'Ivoire par
comparaison des lois Lognormale et de Gumbel. Journal Des Sciences
Hydrologiques, 52(1), 49-67
Haney C. H., Samuel B. S., Bush J., Ausubel F. M.,
2015.- Associations with rhizosphere bacteria can confer an adaptive
advantage to plants. Nat Plants., 1 : 15051.
Hawksworth, D. L., 1995.- The fungal
dimension of Biodiversity: magnitude, significance and conservation.
Mycological Research, 95 : 641-655.
Higo M., Sato R, Serizawa A, Takahashi Y, Gunji K,
Tatewaki Y, Isobe K., 2018.- L'application du phosphore et le couvert
des cultures peuvent-ils modifier les communautés fongiques
arbusculaires et le rendement du soja après un système de
rotation des cultures non fertilisé au phosphore de cinq ans. Peer
j, 6(7) : 4606
Infoclimat., 2020.- Climatologie de
l'année
2020.
www.infoclimat.fr. Consulté le 22/08/2020.
46
INVAM, 2021.- International culture collection
of VA Mycorrhizal fungi, consulté le 15 Juillet 2021. http/
www.invam.caf.wvu.edu.
Javot H., Pumplin N., Harrison M.J., 2007a.-
Phosphate in the arbuscular mycorrhizal symbiosis: transport
properties and regulatory roles Plant. Cell and Environment 30:
310-322.
Johnson J. M., Houngnandan P., Kane A., Sanon K.,
Neyra M., 2013.- Diversity patterns of indigenous arbuscular
mycorrhizal fungi associated with rhizosphere of cowpea Vigna unguiculata
L. Walp. In Benin, West Africa. Pedobiologia, 56 (3): 121- 128
Johnson N. C., Zak D. R., Tilman D. & Pfleger F.
L., 1991.- Dynamics of vesicular - arbuscular mycorrhizae during old
field succession. Oecologia, 86: 348 - 358
Kisa M., Sanon A., Thioulouse J., Assigbetse K., Sylla
S., Spichiger R., Dieng L., Berthelin J., Prin Y., Galiana A., Lepage M.,
Duponnois R., 2007.- Arbuscular mycorrhizal symbiosis counterbalance
the negative influence of the exotic tree species Eucalyptus camaldulensis
on the structure and functioning of soil microbial communities in a
sahelian soil. FEMS Microbiology Ecology, 62: 32-44.
Kodjo S., Adjanohoun A., Akondé T. P.,
Aïhou K., Kpagbin G., Gotoechan H., Igue A. M., 2013.- Diagnostic
participatif de la fertilité des sols des exploitations agricoles
à base de maïs Zea mays dans les départements du
Zou et des Collines au Bénin. Bulletin de la Recherche Agronomique
du Bénin (BRAB), 2013 : 3953.
Koffi G. A., Dibi E. A. D. B., Anon H. A., Ndoye F.,
Bakhoum N., Diouf D., Dabonné S.,
2021.-Diversité des champignons mycorhiziens
arbusculaires associés à la culture du maïs et de l'arachide
au nord de la Côte d'Ivoire. Revue internationale des
biosciences, 18 (3): 240-250.
Köhl L., Lukasiewicz C. E., Heijden M. G., 2016.-
Establishment and effectiveness of inoculated arbuscular mycorrhizal
fungi in agricultural soils. Plant Cell Environ., 39 :136-146.
Labidi S., Jeddi B. F., Tisserant B., Debiane D.,
Rezgui S., Grandmougin-Ferjani A., Lounès-Hadj Sahraoui, A., 2012.-
Role of arbuscular mycorrhizal symbiosis in root mineral uptake under
CaCO3 stress. Mycorrhiza. 22, 337-345.
Landon J. R., 1984.- Booker tropical Soil
Manuel, A handbook for soil survey and agricultural land evaluation in the
tropics and subtropics, paperback, longman, Booker Tate limited Oxon, Royaume
Uni, 474 p
47
Lecomte J., St-Arnaud M., Hijri M.,
2011.-Isolation and identification of soil bacteria growing at the
expense of arbuscular mycorrhizal fungi. FEMS Microbiology Letters
,317(1) : 43-51.
Lenoir I., Fontaine J., Lounès-Hadj Sahraoui A.,
2016.- Arbuscular mycorrhizal fungal responses to abiotic stresses : A
review. Phytochemistry, 123 : 4-15.
Lenoir I., Lounès-Hadj Sahraoui A.,
Frédéric L., Yolande D., Joël F., 2016a.-
Arbuscular mycorrhizal wheat inoculation promotes alkane and polycyclic
aromatic hydrocarbon biodegradation : Microcosm experiment on aged-contaminated
soil. Environmental Pollution, 213 : 549-560.
Leye E.H.M., N'diaye M., Diouf M. et Diop T., 2015.
- Etude comparative de l'effet de souches de champignons mycorhiziens
arbusculaires sur la croissance et la nutrition minérale du
sésame cultivé au Sénégal. African Crop Science
Journal, 23, pp. 211-219.
Lohest I., 2018.- Influence de la composition
spécique de couverts végétaux sur les paramètres
physiques, chimiques et biologiques du système sol-plante : étude
des champignons mycorhiziens à arbuscules. Mémoire de
Bioingénieur des sciences agronomiques, Université catholique de
Louvain 103 p
Maillet F, Poinsot V, André O,
Puech-Pagès V, Haouy A, Gueunier M, Cromer L, Giraudet D, Formey D,
Niebel A, Martinez EA, Driguez H, Bécard G, Dénarié J.,
2011.- Fungal lipochitooligosaccharide symbiotic signals in arbuscular
mycorrhiza. Nature 469: 58-63.
Manga A., N'Diaye F., Diop A. F., 2017.- Le
champignon arbusculaire Glomus aggregatum améliore la nutrition
minérale d'Acacia seyal soumis au stress salin progressif.
International journal of biological and chemical sciences, 11(5):
2352-2365
Marleau J., Dalpé Y., St-Arnaud M., Hijri M.,
2011.- Spore development and nuclear inheritance in arbuscular
mycorrhizal fungi. BMC Evolutionary Biology, 11(1) : 51.
Marulanda A., Porcel R., Barea J. M., 2007.-
Drought tolerance and antioxidant activities inlavender plants colonized by
native drought-tolerant or drought-sensitive Glomus species. Microbial
Ecology, 54(3) : 543-552.
Mathieu C. et Pieltain F., 2003.- Analyse
chimique des sols. TEC. & DOC., 387p
Meddich A., Ait El Mokht M., Said W., Boumezzough A.,
2017.- Evaluation des potentialités mycorhizogènes en
lien avec les paramètres physico-chimiques des sols de palméraies
du maroc (Marrakech et tafilalet). Cahier agriculture, 26 (4):
45012
48
MINAGRI., 2010.- Production
céréalière en Côte-d'Ivoire. Document 1 du
séminaire national sur les potentialités et les contraintes de la
production céréalière, juillet 2010, Abidjan,
Côted'Ivoire, 15-20.
Mohammedi Siham 2018.- Biodiversité et
aptitude des champignons mycorhiziens arbusculaires isolés des
palmeraies de Ouargla à mycorhizer le blé et l'orge.
Mémoire de master de l'université Kasdi Merbah Ouargla,
Algérie 48 p
Njeru E. M., Avio L., Sbrana C., Turrini A., Bocci G.,
Bàrberi P., Giovannetti M., 2014.- First evidence for a major
cover crop effect on arbuscular mycorrhizal fungi and organic maize growth.
Agronomy for Sustainable Development, 34(4) :841-848
Ognalaga M., Odjogui P. I. O., Lekambou J. M., Poligui
R. N.. -2015, Effet des écumes à cannes à sucre,
de la poudre et du compost de à base de Chromolaena odorata
(L.) King R. M. & H. E. Rob sur la croissance de l'oseille de
Guinée (Hibiscus sabdariffa L.). Int. J. Biol. Chem.
Sci., 9(5): 25072519.
Öpik M, Vanatoa A, Vanatoa E, Moora M, Davison J,
Kalwij JM, Reier Ü, Zobel M., 2010.- La base de données en
ligne MaarjAM reveals les modèles de distribution mondiaux et
écosystémiques des champignons mycorhiziens arbusculaires
(Glomeromycota). Nouveau Phytol 188:223-241
Ouattara B., Abo K., Tuo S., Bolou Bi B.A.,
Chérif M. et Koné D., 2019.- Arbuscular mycorrhizal
symbiosis decreases Sclerotinia caused by Sclerotium rolfsii Sacc. in tomato
(Solanum lycopersicum L.). Plant Pathology Journal, 18, pp.
22-30.
Pii Y., Mimmo T., Tomasi N., Terzano R., Cesco S.,
Crecchio C., 2015.- Microbial interactions in the rhizosphere:
beneficial influences of plant growth-promoting rhizobacteria on nutrient
acquisition process. A review Biol Fertil Soils, 51 :403-415.
Ponce-Toledo R. I., Deschamps P., Lopez-Garcia P.,
Zivanovic Y., Benzerara K., Moreira D., 2017.- Une
cyanobactérie d'eau douce à ramification précoce à
l'origine des plastes. Curr. Biol., 27 : 386-391.
Redecker D., Kodner R., Graham L.E., 2000 .-
Champignons glomaliens de l'Ordovicien.Science, 289 :
1920-1921. 10.1126 / science.289.5486.1920
Redecker D., Schüssler A., Stockinger H.,
Stürmer S. L., Morton J. B., Walker C., 2013.- An evidence-based
consensus for the classification of arbuscular mycorrhizal fungi
(Glomeromycota). Mycorrhiza, 23(7): 515-31
49
Requena N, Serrano E, Ocón A, Breuninger M.,
2007.- Plant signals and fungal perception during arbuscular
mycorrhiza establishment. Phytochemistry 68: 33-40.
Rillig M. C., Wright S. F., Eviner V. T., 2002.-
The role of arbuscular mycorrhizal fungi and glomalin in soil
aggregation: comparing effects of five plant species. Plant and Soil,
238: 325-333.
Rincón, C., Droh, G., Villard, L., Masclaux, F.
G., N'guetta A. S-P., Zeze A., Sanders I. R., 2021. - Hierarchical
spatial sampling reveals factors influencing arbuscular mycorrhizal fungus
diversity in Côte d'Ivoire cocoa plantations. Mycorrhiza 31,
289-300.
https://doi.org/10.1007/s00572-020-01019-w
Rodríguez-López C. P, Navarro de
León A., Arboleda-Valencia J. W., Valencia-Jimenez A., Valle-Molinares
R. H., 2015.- Hongos micorrizógenos arbusculares asociados a
plantas de Zea mays L. en un agroecosistema del Atlántico,
Colombia. Agronomie, 23 (1) : 20-34.
RONGEAD - ONG CHIGATA., 2014.- Redynamiser les
productions, l'accès au marché et le conseil agricole pour les
filières vivrières et commerciales du Nord de la Côte
d'Ivoire. Projet, 58p.
Ruíz-Sánchez M., Aroca R., Mufioz Y.,
Polon R., Ruiz-Lozano J. M., 2010.- The arbuscular mycorrhizal
symbiosis enhances the photosynthetic efficiency and the antioxidative response
of rice plants subjected to drought stress. Journal of plant physiology 167:
862- 869. . Schulte, E. E et Hoskins, B. 1984.- Recommended
Soil Organic Matter Tests, 63-74
Selosse, M. A., & Le Tacon, F., 1998. The
land flora: A phototroph-fungus partnership? Trends in Ecology and Evolution.
13(1):15-20.
Selosse M. A et Rousset F., 2011.- The
plant-fungal marketplace. Science, 333: 828-829
Shen S. K., Wang Y. H., 2011.- Arbuscular
mycorrhizal (AM) status and seedling growth response to indigenous AM
colonisation of Euryodendron excelsum in China: implications for
restoring an endemic and critically endangered tree. Australian Journal of
Botany, 59(5): 460-467.
Sidibé, D., Fofana, I. J., Silué, S.,
Diarassouba, N., Zézé, A., Nguetta, S. P. A., 2015.-
Evaluation of Symbiosis Effect of Some Arbuscular mycorrhizal Fungi on
Growth of Yams (Dioscorea Alata) on Experimental Conditions.
Journal of Pharmaceutical, Chemical and Biological Sciences, 3,
346357
Siene L. A. C., Doumbouya, M., TRAORE M. S., Conde M.,
N'Guettia T. V. F., KONE M., 2020.- Effet de quatre types de
fertilisants sur la croissance et la productivité de deux
génotypes de
50
maïs (Zea mays L.) en cas d'un semis tardif
à Korhogo au Centre-Nord de la Côte d'Ivoire. Int. J. Biol.
Chem. Sci. 14(1): 55-68
Singh R et Adholeya A., 2013.- Diversity of AM
(Arbuscular mycorrhizal) Fungi in Wheat Agro-climatic Regions of India.
Virol. Mycol., 2 :116.
Smith S. E. et Read D. J., 2008.- Mycorrhizal
symbiosis. 3rd eds. London: Academic Press.
Soka G. E. et Ritchie M. E., 2018. - Arbuscular
mycorrhizal spore composition and diversity associated with different land uses
in a tropical savanna landscape, Tanzania. Applied Soil Ecology, 125:
222-232.
Strullu D. G., 1991.- Les mycorhizes des arbres
et des plantes cultivées. Techniques et Documentation Lavoisier. Paris.
242 p
Suciu N., Vasileiadis S., Puglisi E., Pertile G., Tourna
M., Karas P. A., 2019.- L'azadirachtine et la trifloxystrobine n'ont
eu aucun effet inhibiteur sur les fonctions microbiennes clés du sol,
même à des taux de dose élevés. Appl. Soil
Ecol., 137 : 29-38.
Tano A. M., 2012.- Crise cacaoyère et
stratégies des producteurs de la sous-préfecture de Méadji
au Sud-Ouest ivoirien. Doctorat de l'Université Toulouse 2 Le Mirail.
261pp.
Tawaraya K., 2003.- Arbuscular mycorrhizal
dependency of dierent plant species and cultivars. Soil Science and Plant
Nutrition, 49(5) :655-668
Taxter R., 1922.- A revision of Endogonaceae.
Proc. Am. Acad. Arts Sci., 57: 291-350.
Tisdall M. J., 1994.- Possible role of soil
microorganisms in aggregation in soils. Plant and Soil 159 :
115-121.
Touré G. P. T., Nandjui J., Koné A. W.,
Kouadjo A. G. Z., Ebou A., Tiho S., Zézé A.,
2021.-Diversité des champignons mycorhiziens à
arbuscules et interactions avec le système sol-litière dans un
écotone forêt-savane, Côte d'Ivoire. Étude et
Gestion des Sols, 28 : 93 - 104
Tshiabukole J. P. K. 2018.- Evaluation de la
sensibilité aux stress hydriques du maïs (Zea mays L.)
cultivé dans la savane du Sud-Ouest de la RD Congo, cas de Mvuazi.
Thèse de Doctorat, Faculté des Sciences Agronomiques,
Département de Phytotechnie, Université Pédagogique
Nationale, RD Congo, p. 162
Voko Bi D-R. R., Ahonzo-Niamke S. L.,
Zézé A., 2013.- Impact des propriétés
physicochimiques des sols de culture du manioc sur l'abondance et la
diversité des communautés de champignons
51
mycorhiziens à arbuscules dans la zones
agroécologique d'azaguié, sud-est de la cote d'ivoire.
Agronomie Africaine, 25 (3): 251 - 264.
Walldey A. & Black I. A., 1934.- An
examination of the Oegtjareff method for determining soil organic malter and a
proposed modification of the chromic acid titration method. Soil Sci.,
37 : 2938.
Wang F., Zhou T., Zhu L., Wang X., Wang J., Wang J.,
2019.- Effets de l'application successive
de métaxyle sur
les micro-organismes du sol et la dynamique des résidus. Ecol.
Indic. 103 194-201.
Wehner J., Antunes P. M., Powell J. R., Mazukatow J.,
Rillig M. C., 2010.- Plant pathogen protection by arbuscular
mycorrhizas: a role for fungal diversity. Pedologia, 53: 197-201.
Wright S. F., Upadhyaya A., 1998. - A survey
of soils for aggregate stability and glomalin, a glycoprotein produced by
hyphae of arbuscular mycorrhizal fungi. Plant and Soil, 198 :
97-107.
Yapi M., De K., Okou W.., 2017.- Fiche
technicoéconomique du maïs en Côte d'Ivoire. Rapport ANADER,
Abidjan, 42 p
Zézé A., Ouattara B., Brou C. Y., Van
Tuinen D., Diallo-Attah H., Sangare A., 2007.-Distribution et
abondance de spores de champignons endomycorhizogènes à
arbuscules dans différents types de forets de la TENE en Côte
d'Ivoire. Agronomie Africaine 19 (2) : 103 - 111.
ANNEXES
52
Annexes 1 : Méthodes d'analyse physico-chimique
des échantillons de sol
? Dosage du carbone organique
Pour le dosage du carbone organique, la méthode de
Walkley- Black a été utilisée.
Peser 5g de sol et l'introduire dans l'erlenmeyer ;
Verser 10 ml de K2Cr2O7 à l'aide d'une pipette ;
Ajouter 10 ml de H2SO4 concentré à l'aide d'une
pipette automatique ;
Ajouter 100 ml d'eau déminéralisée plus
quelques gouttes de phénantroline ;
Agiter sur un agitateur magnétique puis titrer avec le sel
de Mohr jusqu'au virage.
? Dosage du phosphore assimilable
Le phosphore est présent dans le sol sous diverses
formes dont le phosphore assimilable et le phosphore total. La teneur en
phosphore assimilable a été déterminée par la
méthode Bray-l. Cette méthode consiste à faire
réagir l'ion orthophosphate avec l'ion molybdate et l'ion antimoine pour
former un complexe phosphomolybdate après digestion et oxydation de
toutes les formes de phosphore avec du persulfate de potassium en milieu acide
sous pression à 121 °C.
Peser 5 g de sol dans une fiole erlenmeyer ;
Ajouter 35 ml de solution d'extraction dans les fioles
erlenmeyer et agiter à la main pendant une minute au moins ;
Filtrer immédiatement les solutions obtenues ;
Prélever 5 ml du filtra dans une fiole jaugée ;
Ajouter 10 ml molybdate d'ammonium 1% ;
Agiter à la main et ajouter 2 ml de chlorure de cyanure
;
Bien mélanger et compléter le volume avec de l'eau
distillée ;
Laisser pendant 5 minutes et commences mesurer au
spectrophotomètre l'intensité de la coloration bleue du molybdate
selon l'ordre de préparation des solutions colorantes.
53
? Dosage de l'azote total
L'azote peut se trouver sous forme minérale et
organique (protéines, phosphoamino-lipides...) ; pour le doser dans sa
totalité, il faut détruire les composés organiques de
manière à obtenir tout l'azote sous une même forme
minérale. Pour le dosage de l'azote total, la méthode de Kjeldahl
a été utilisée.
Peser dans un papier 1g d'échantillon de sol. Plier le
papier et introduire la prise d'essai dans un matra. Faire un témoin
avec le papier.
Ajouter dans les matras :
- un comprimé de catalyseur Kjeldahl - 10 ml de H2SO4
concentré d = 1,83
- 10 ml de H2O2 à 110 volumes, les ajouter très
doucement, en évitant les projections et en opérant sous la
hotte
Placer les matras sur le bloc de minéralisation
préalablement réglé sur 800° C sous la hotte et les
coiffer des cloches d'évacuation de vapeur. Chauffer jusqu'à ce
que les minéralisants soient limpides. Retirer les matras du bloc, les
laisser se refroidir. Ajouter 30 ml d`eau déminéralisée
dans les matras et bien mélanger afin d'éviter la
cristallisation
Préparer un bécher de 250 ml, y verser 50 ml de
la solution déminéralisée plus 20 ml d'acide borique avec
indicateur coloré et le placer sous l'appareil à distillation.
Vérifier que l'embout plonge dans la solution. Ajouter 40 ml de soude en
abaissant la poignée alkali. Abaisser la manette steam en position
open
Effectuer le dosage rapidement après la fin de la
distillation avec l'acide sulfurique 0,1N ou 0,2N jusqu'au virage de
l'indicateur coloré (passage du vert au rose violet). Neutralisation
à pH = 4,95
? Capacité totale d'échange et bases
échangeables
La méthode à l'acétate d'ammonium pH = 7.
Alors 10g de sol sont introduits dans une colonne de percolation. Du coton est
placé au niveau inférieur pour éviter l'entraînement
des particules. La percolation à l'acétate permet de
déplacer les bases échangeables. La capacité totale
d'échange est déterminée par dosage des ions ammoniums
échangés l'ion K+ du KCl.
- Extraction des bases et dosage de Ca2+,
Mg2+, Na+, K+
Mettre 10g de sol dans une colonne de percolation ;
le robinet étant fermé, saturer le sol avec
l'acétate d'ammonium pendant une nuit ;
54
placer une fiole de 100 cm3 sous le robinet et
l'ouvrir à débit faible (goutte à goutte) ;
rajouter l'acétate NH4 par fraction jusqu'à
remplissage de la fiole (trait de jauge), on estime que les bases
échangeables du complexe absorbant sont remplacées par l'ion
NH4+.
laver le sol avec 100 ml d'éthanol (95%) et jeter le
liquide ;
ensuite percoler 250 ml de KCl et le recueillir dans une fiole de
500 ml
prendre 10 ml du percolât à la pipette, le verser
dans un bécher ;
diluer à 50 ml avec l'eau distillée ;
ajouter 1 ml de KCN à 1% et 5 ml de chlorhydrate de tri
éthanol amine 50% ;
ajouter 10 ml de soude ;
ajouter 4 gouttes de solution de calceïne ;
titrer avec EDTA N/50.
Dentiscutataceae
Villes
Glomeraceae
Racocetraceae
Pacisporaceae
Gigasporaceae
Entrophosparaceae
Ambisporaceae
Acaulosporaceae
Scutellosporaceae
Diversisporaceae
Paraglomeraceae
Sacculosporaceae
Archaeosporaceae
55
Annexe 2 : Abondance des familles de champignons
mycorhiziens à arbuscules dans les différentes zones
Bouaflé
Bouaké
Ferké
Niéllé
F-Value
P-value
|
37,6#177;40,02
14,4#177;13,45
27,8#177;20,58
44,2#177;75,61
|
385#177;219,48 a
123,8#177;65,44
b
169,4#177;103,47
ab
190,8#177;103,42
ab
|
190,60#177;82,88
155,60#177;126,94
225,60#177;82,66
219,20#177;115,92
|
10,80#177;24,15
0 #177; 0
3,40#177;7,6
0 #177; 0
|
3,4#177;7,6
0 #177; 0
0 #177; 0
0 #177; 0
|
0 #177; 0
6,6#177;14,76
6,8#177;9,31
5#177;11,18
|
0 #177; 0
15,4#177;10,24
7#177;9,59
24,4#177;29,8
|
0 #177; 0
15,8#177;22,12
3,4#177;7,6
26,4#177;36,49
|
0 #177; 0
4,8#177;10,73
4,2#177;9,39
0 #177; 0
|
0 #177; 0
6,6#177;14,76
0 #177; 0
0 #177; 0
|
0 #177; 0
6,6#177;14,76
0 #177; 0
4,8#177;10,73
|
0 #177; 0
4#177;8,94
0 #177; 0
0 #177; 0
|
0 #177; 0
4,8#177;10,73
0 #177; 0
0 #177; 0
|
|
2,72537
0,0786 ns
|
5,67917
0,007618
|
0,54356
0,7150 ns
|
0,809
0,547 ns
|
1,005
0,509ns
|
0,468
0,739 ns
|
2,052
1,147 ns
|
1,556
0,256 ns
|
0,6701
0,715 ns
|
1,003
0,509 ns
|
0,683
0,669 ns
|
1,006
0,509
ns
|
1,002
0,509 ns
|
NB : Dans une même colonne, les chiffres suivis des
mêmes lettres ne sont pas significativement différents au seuil de
5 %
56
|
Familles
|
Bouaflé
|
Bouaké
|
Ferké
|
Niéllé
|
|
Glomeraceae
|
45,09%
|
29,31%
|
29,47%
|
35%
|
|
Acaulosporaceae
|
27,10%
|
42,86%
|
39,40%
|
39,16%
|
|
Gigasporaceae
|
5,04%
|
5,07%
|
5,5%
|
8,57%
|
|
Sacculosporaceae
|
0,8%
|
|
|
|
|
Pacisporaceae
|
|
1,05%
|
1,53%
|
1,11%
|
|
Scutellosporaceae
|
|
4,52%
|
1,29%
|
4%
|
|
Racocetraceae
|
|
2,78%
|
0,62%
|
2,99%
|
|
Ambisporaceae
|
|
1,11%
|
0,5%
|
|
|
Archaeosporaceae
|
1,05%
|
|
0,62%
|
|
|
Entrophosparaceae
|
|
1,11%
|
|
|
|
Dentiscutataceae
|
|
1,11%
|
|
|
|
Paraglomeraceae
|
|
1,52%
|
|
|
|
Diversisporaceae
|
|
1,05%
|
|
|
57
Annexe 3 : Proportion des genres de CMA observés
dans les différents sites d'échantillonnage
|
Genres
|
N1
|
N2
|
N3
|
N4
|
N5
|
F1
|
F2
|
F3
|
F4
|
F5
|
|
Glomus
|
12,11%
|
30,41%
|
34,33%
|
14,30%
|
17,66%
|
37,65%
|
19,37%
|
30%
|
|
46,66%
|
|
Acaulospora
|
61,11%
|
35,29%
|
25%
|
46,66%
|
27,77%
|
40,47%
|
46,87%
|
36,36%
|
36,36%
|
36,66%
|
|
Scutellospora
|
|
5,88%
|
8,33%
|
|
5,55%
|
|
3,12%
|
|
|
3,33%
|
|
Septoglomus
|
7,55%
|
7,88%
|
|
|
18,66%
|
4,76%
|
3,12%
|
|
9,09%
|
3,33%
|
|
Funneliformis
|
21,66%
|
10,88%
|
|
|
16,11%
|
|
|
10%
|
9,09%
|
3,33%
|
|
Gigaspora
|
5,55%
|
16,76%
|
|
20%
|
10,55%
|
|
6,25%
|
6,66%
|
4,54%
|
10%
|
|
Pacispora
|
|
|
|
|
5,55%
|
|
3,12%
|
|
4,54%
|
|
|
Rhizophagus
|
|
|
8,33%
|
|
|
|
|
|
4,54%
|
|
|
Ambispora
|
|
|
|
|
|
2,38%
|
|
|
|
|
|
Sacculospora
Racocetra
|
|
|
8,33%
|
|
|
|
|
|
|
|
|
Cetraspora
|
|
|
|
6,66%
|
|
|
3,12%
|
|
|
|
|
Diversispora
|
|
5,88%
|
|
|
|
|
|
|
|
|
|
Dentiscutata
|
|
|
|
|
|
|
|
|
|
|
|
Archaeospora
|
|
|
|
|
|
|
3,12%
|
|
|
|
|
Paraglomus
|
|
|
|
|
|
|
|
|
|
|
|
Viscospora
|
|
|
|
|
|
|
|
|
|
|
Légende : N1= site de
prélèvement de Walouavogo1 ; N2= site de
prélèvement de Walouavogo2 ; N3= site de
prélèvement de Dramanevogo3 ; N4= site de
prélèvement de Walouavogo4 ; N5= site de
prélèvement de Dramanevogo5 ; F1= site de
prélèvement de Ferké-ville ; F2= site de
prélèvement de Lgouvogo2 ; F3= site de prélèvement
de Kporgo3 ; F4= site de prélèvement de Legouvogo4 ; F5= site de
prélèvement de Legouvogo
58
|
Genres
|
BFL1
|
BFL2
|
BFL3
|
BFL4
|
BFL5
|
BK1
|
BK2
|
BK3
|
BK4
|
BK5
|
|
Glomus
|
41,25%
|
45,29%
|
41,03%
|
42,10%
|
46%
|
15,78%
|
14,28%
|
17,39%
|
44,44%
|
22,22%
|
|
Acaulospora
|
35%
|
39,41%
|
37,58%
|
20,52%
|
53,03%
|
52,63%
|
57,14%
|
43,47%
|
22,22%
|
38,88%
|
|
Scutellospora
|
|
|
|
|
|
|
7,14%
|
4,34%
|
5,55%
|
5,55%
|
|
Septoglomus
|
12,50%
|
|
6,89%
|
5,26%
|
|
|
|
13,04%
|
|
5,55%
|
|
Funneliformis
|
|
5,88%
|
17,24%
|
10,52%
|
|
|
|
4,34%
|
5,55%
|
|
|
Gigaspora
|
6,25%
|
11,76%
|
|
5,26%
|
1,92%
|
|
14,28%
|
|
5,55%
|
5,55%
|
|
Pacispora
|
|
|
|
|
|
5,26%
|
|
|
|
|
|
Rhizophagus
|
|
11,76%
|
|
|
|
|
|
|
|
|
|
Ambispora
|
|
|
|
|
|
|
|
|
|
5,55%
|
|
Sacculospora
|
|
|
|
|
3,84%
|
|
|
|
|
|
|
Racocetra
|
|
|
|
|
|
5,26%
|
|
4,34%
|
|
|
|
Cetraspora
|
|
|
|
|
|
|
|
4,34%
|
|
|
|
Diversispora
|
|
|
|
|
|
5,26%
|
|
|
|
|
|
Dentiscutata
|
|
|
|
|
|
|
|
|
5,55%
|
|
|
Archaeospora
|
|
|
|
5,26%
|
|
|
|
|
|
|
|
Paraglomus
|
|
|
|
|
|
5,26%
|
|
|
|
|
|
Viscospora
|
|
|
|
|
|
|
|
|
|
5,55%
|
Légende : BFL1= site de
prélèvement de campement siaka1 ; BFL2 = site de
prélèvement de campement siaka2 ; BFL3= site de
prélèvement de Nakaha ; BFL4= site de prélèvement
de Garango ; BFL5= site de prélèvement de Gobazra ; BK1= site de
prélèvement de Bouakaman1 ; BK2= site de
prélèvement de Bouakaman2 ; BK3= site de
prélèvement de Bouakaman3 ; BK4= site de
prélèvement de Bodokro ; BK5= site de prélèvement
de Joachinkro
59
Annexe 4 : Proportion des familles de CMA
observés dans les différents sites d'échantillonnage
|
Familles
|
BFL1
|
BFL2
|
BFL3
|
BFL4
|
BFL5
|
BK1
|
BK2
|
BK3
|
BK4
|
BK5
|
|
Glomeraceae
|
44%
|
52,93%
|
55,16%
|
57,88%
|
36%
|
15,78%
|
14,28%
|
34,77%
|
49,99%
|
27,77%
|
|
Acaulosporaceae
|
25,00%
|
29,41%
|
27,58%
|
10,52%
|
43,03%
|
52,63%
|
57,14%
|
43,47%
|
22,22%
|
38,88%
|
|
Gigasporaceae
|
6,25%
|
11,76%
|
|
5,26%
|
1,92%
|
|
14,28%
|
|
5,55%
|
5,55%
|
|
Sacculosporaceae
|
|
|
|
|
3,84%
|
|
|
|
|
|
|
Pacisporaceae
|
|
|
|
|
|
5,26%
|
|
|
|
|
|
Scutellosporaceae
|
|
|
|
|
|
|
7,14%
|
4,34%
|
5,55%
|
5,55%
|
|
Racocetraceae
|
|
|
|
|
|
5,26%
|
|
8,68%
|
|
|
|
Ambisporaceae
|
|
|
|
|
|
|
|
|
|
5,55%
|
|
Archaeosporaceae
|
|
|
|
5,26%
|
|
|
|
|
|
|
|
Entrophosparaceae
|
|
|
|
|
|
|
|
|
|
5,55%
|
|
Dentiscutataceae
|
|
|
|
|
|
|
|
|
5,55%
|
|
|
Paraglomeraceae
|
|
|
|
|
|
5,26%
|
|
|
|
|
|
Diversisporaceae
|
|
|
|
|
|
5,26%
|
|
|
|
|
Légende : BFL1= site de
prélèvement de campement siaka1 ; BFL2 = site de
prélèvement de campement siaka2 ; BFL3= site de
prélèvement de Nakaha ; BFL4= site de prélèvement
de Garango ; BFL5= site de prélèvement de Gobazra ; BK1= site de
prélèvement de Bouakaman1 ; BK2= site de
prélèvement de Bouakaman2 ; BK3= site de
prélèvement de Bouakaman3 ; BK4= site de
prélèvement de Bodokro ; BK5= site de prélèvement
de Joachinkro
60
|
Familles
|
N1
|
N2
|
N3
|
N4
|
N5
|
F1
|
F2
|
F3
|
F4
|
F5
|
|
Glomeraceae
|
33%
|
41,17%
|
41,66%
|
13,30%
|
44%
|
32,41%
|
12,49%
|
30,00%
|
22,72%
|
43,32%
|
|
Acaulosporaceae
|
61,11%
|
35,29%
|
25,00%
|
46,66%
|
27,77%
|
40,47%
|
46,87%
|
36,36%
|
36,66%
|
36,66%
|
|
Gigasporaceae
|
5,55%
|
11,76%
|
|
20,00%
|
5,55%
|
|
6,25%
|
6,66%
|
4,54%
|
10,00%
|
|
Sacculosporaceae
|
|
|
|
|
5,55%
|
|
|
|
|
|
|
Pacisporaceae
|
|
|
|
|
5,55%
|
|
3,12%
|
|
4,54%
|
|
|
Scutellosporaceae
|
|
5,88%
|
8,33%
|
|
5,55%
|
|
3,12%
|
|
|
3,33%
|
|
Racocetraceae
|
|
|
8,33%
|
6,66%
|
|
|
3,12%
|
|
|
|
|
Ambisporaceae
|
|
|
|
|
|
2,38%
|
|
|
|
|
|
Archaeosporaceae
|
|
|
|
|
|
|
3,12%
|
|
|
|
|
Entrophosparaceae
|
|
|
|
|
|
|
|
|
|
|
|
Dentiscutataceae
|
|
|
|
|
|
|
|
|
|
|
|
Paraglomeraceae
Diversisporaceae
|
|
5,88%
|
|
|
|
|
|
|
|
|
Légende : N1= site de
prélèvement de Walouavogo1 ; N2= site de
prélèvement de Walouavogo2 ; N3= site de
prélèvement de Dramanevogo3 ; N4= site de
prélèvement de Walouavogo4 ; N5= site de
prélèvement de Dramanevogo5 ; F1= site de
prélèvement de Ferké-ville ; F2= site de
prélèvement de Lgouvogo2 ; F3= site de prélèvement
de Kporgo3 ; F4= site de prélèvement de Legouvogo4 ; F5= site de
prélèvement de Legouvogo5
|
|



