CHAPITRE III
40
Résultats et Discussions
Chapitre III : Résultats et Discussions
Ce chapitre comporte tous les résultats et discussions
des travaux effectués sur le terrain et au laboratoire. L'inventaire des
Orthoptères de la région d'étude, l'exploitation des
résultats par les indices écologiques et analyse statistiques
seront traités. Le cycle biologique des Acridiens les plus
fréquents fera l'objet d'une étude. Enfin, le régime
alimentaire des espèces les plus abondantes sera examiné.
III.1. Inventaire concernant la faune
Orthoptérologique de la vallée du M'Zab
Pour les insectes Orthoptéroïdes, la
dernière synthèse systématique a été
réalisée par Chopard (1943), qui a
proposé des clés d'identification pour les genres et les
espèces. La classification des Acridoidea (groupe Acridomorpha) a
été profondément remaniée depuis Dirsh
(1965). Plusieurs genres et espèces ont été
révisés ainsi que des nouvelles espèces
identifiées. A titre d'exemple ce qui a été
identifié jusque là par les Orthoptéristes comme
Aiolopus thalassinus (Fabricius, 1781) dans le domaine
méditerranéen occidental relève la plupart du temps d'une
autre espèce, en réalité : Aiolopus puissanti.
Ainsi, Aiolopus thalassinus est apparemment une espèce euro
sibérienne, pénétrant assez peu dans le domaine
méditerranéen, alors qu'Aiolopus puissanti paraît
être une espèce confinée à la région
méditerranéenne, dont elle occupe les deux rives (Defaut,
2005). Si une liste actualisée des espèces a
été récemment proposé pour Ensifera
(Mohamed Sahnoun et al., 2010), rien n'existe pour faciliter
les études de Caelifera, même si ils comprennent plusieurs
espèces potentiellement ravageuses (Duranton et al.,
1982). Pour notre étude l'identification des spécimens
jusqu'à l'espèce a été réalisée
à l'aide des clés taxonomiques de Chopard
(1943); Dirsh (1965), ainsi que le catalogue des
Orthoptères Acridomorpha de l'Afrique du Nord-ouest (Louveaux et
al., 2019). La classification des Orthoptères a
été actualisée à l'aide du fichier en ligne des
espèces d'Orthoptères (Cigliano et al.,
2019). L'identification d'une espèce se fait en plusieurs
étapes par élimination : ex. antennes (ensiformes, filiformes...)
fémur postérieur (long, étroit...), pronotum (en selle,
trapézoïdal, comprimé, bord postérieur arrondi, Bord
postérieur subanguleux...), carènes médiane (coupée
par le sillon...), nervure intercalée (serrulée, non
serrulée), Ailes (hyalines, colorées...), Plaque
sous-génitale (en pointe, courbée vers le haut, incisée
à l'apex,). Le Tableau 17 ci-dessous présente l'inventaire des
Orthoptères recensés dans neuf stations de la vallée du
M'Zab (Ghardaïa), durant la période allant de Septembre 2016
jusqu'à Août 2019.
41
Résultats et Discussions
Tableau 17 : Inventaire d'Orthoptères de
neuf sites de la vallée du M'Zab
|
Sous Ordres
|
Familles
|
Sous Familles
|
Espèces
|
|
Caelifera
|
Acrididae
|
Acridinae
|
Acrida turrita (Linné, 1758)
|
|
Truxalis nasuta (Linné, 1758)
|
|
Cyrtacanthacridinae
|
Anacridium aegyptium (Linné, 1764)
|
|
Schistocerca gregaria (Forskål, 1775)
|
|
Eremogryllinae
|
Notopleura saharica (Krauss, 1902)
|
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836)
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889)
|
|
Heteracris annulosa (Walker, 1870)
|
|
Heteracris harterti (Bolivar, 1913)
|
|
Heteracris littoralis (Rambur, 1838)
|
|
Heteracris minuta (Uvarov, 1921)
|
|
Gomphocerinae
|
Ochrilidia filicornis (Krauss, 1902)
|
|
Ochrilidia geniculata (Bolivar, 1913)
|
|
Ochrilidia gracilis (Krauss, 1902)
|
|
Ochrilidia harterti (Bolivar, 1913)
|
|
Omocestus africanus (Harz, 1970)
|
|
Omocestus lucasii (Brisout de Barneville, 1850)
|
|
Oedipodinae
|
Aiolopus puissanti (Defaut, 2005)
|
|
Aiolopus simulatrix (Walker, 1870)
|
|
Aiolopus strepens (Latreille, 1804)
|
|
Acrotylus longipes (Charpentier, 1845)
|
|
Acrotylus patruelis (Herrich-Schäffer, 1838)
|
|
Hyalorrhipis calcarata (Vosseler, 1902)
|
|
Hilethera aeolopoides (Uvarov, 1922)
|
|
Locusta migratoria (Fabricius, 1781)
|
|
Morphacris fasciata (Thunberg, 1815)
|
|
Oedaleus senegalensis (Krauss, 1877)
|
|
Sphingoderus carinatus (Saussure, 1888)
|
|
Sphingonotus azurescens (Rambur, 1838)
|
|
Sphingonotus obscuratus lameerei (Finot, 1902)
|
|
Sphingonotus octofasciatus (Serville, 1839)
|
|
Sphingonotus pachecoi (Bolivar, 1908)
|
|
Sphingonotus paradoxus (Bei-Bienko, 1948)
|
|
Sphingonotus rubescens (Walker, 1870)
|
|
Sphingonotus savignyi (Saussure, 1884)
|
|
Vosseleriana fonti (Bolivar, 1902)
|
|
Tropidopolinae
|
Tropidopola cylindrica (Marschall, 1836)
|
|
Dericorythidae
|
Dericorythinae
|
Dericorys millierei (Bonnet & Finot, 1884)
|
|
Pamphagidae
|
Pamphaginae
|
Eunapiodes sp. (Bolivar, 1907)
|
|
Thrinchinae
|
Tmethis cisti (Fabricius, 1787)
|
|
Tuarega insignis (Lucas, 1851)
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Krauss, 1877)
|
|
Pyrgomorpha conica (Olivier, 1791)
|
|
Tenuitarsus angustus (Blanchard, 1836)
|
|
Tetrigidae
|
Tetriginae
|
Paratettix meridionalis (Rambur,
1839)
|
|
Ensifera
|
Tettigoniidae
|
Phaneropterinae
|
Phaneroptera nana (Fieber, 1853)
|
|
Conocephalinae
|
Conocephalus fuscus (Fabricius, 1793)
|
|
2
|
6
|
15
|
47
|
42
Résultats et Discussions
Au total, 31944 individus d'Orthoptères appartenant
à 47 espèces, 28 genres, 15 sous familles, six familles et deux
sous ordres ont été capturés dans neuf sites de la
vallée du M'Zab, durant la période s'étalant de Septembre
2016 à Août 2019 (Tableau 17).
Les 47 espèces d'Orthoptères, ont
été recensées au cours de 324 prospections et dans 3240
quadrats de 25m2. Le sous Ordre des Caelifères est
représenté par le groupe des Tetrigoidea avec une famille :
Tetrigidae, une sous famille : Tetriginae et une espèce Paratettix
meridionalis (Rambur, 1839). Le groupe des Acridomorpha comporte deux
super-familles : Acridoidea et Pyrgomorphoidea. Cette dernière comporte
une famille : Pyrgomorphidae et une sous famille : Pyrgomorphinae. Par contre
les Acridoidea comportent trois familles : Acrididae, Dericorythidae et
Pamphagidae (Tableau 18).
Tableau 18. Résumé du nombre de
sous-familles, genres et espèces pour chaque famille
d'Orthoptères de la vallée du M'Zab
|
Sous Ordre
|
Groupes
|
Familles
|
Nombre
|
|
Sous
Familles
|
Genres
|
Espèces
|
|
Caelifera
|
Tetrigoidea
|
Tetrigidae
|
1
|
1
|
1
|
|
Acridomorpha
|
Pyrgomorphidae
|
1
|
2
|
3
|
|
Acrididae
|
8
|
20
|
37
|
|
Dericorythidae
|
1
|
1
|
1
|
|
Pamphagidae
|
2
|
2
|
3
|
|
Ensifera
|
Tettigonioidea
|
Tettigoniidae
|
2
|
2
|
2
|
|
2
|
3
|
6
|
15
|
28
|
47
|
La famille des Acrididae est la plus représentée
avec huit sous-familles : Acridinae, Cyrtacanthacridinae, Eremogryllinae,
Calliptaminae, Eyprepocnemidinae, Gomphocerinae, Oedipodinae et
Tropidopolinae.
Alors que la famille des Pamphagidae est
représentée par deux sous familles : Pamphaginae et Thrinchinae.
Par contre la famille des Dericorythidae a une seule sous famille :
Dericorythinae,
Le sous ordre des Ensifères comporte une seule famille
: Tettigoniidae, Cette dernière est représentée par deux
sous familles : Phaneropterinae et Conocephalinae. Les sous familles des
Orthoptères les plus représentées en espèces sont
les Oedipodinae, Gomphocerinae, Eyprepocnemidinae et Pyrgomorphinae avec
respectivement 19, 6, 5, et 3 espèces. Les Acridinae,
Cyrtacanthacridinae et Thrinchinae comportent deux espèces chacune. Les
autres sous familles telles que les Eremogryllinae, Calliptaminae,
Tropidopolinae, Pamphaginae, Dericorythinae, Tetriginae, Phaneropterinae et
Conocephalinae sont représentées par une seule espèce.
Résultats et Discussions
Les espèces en surbrillance (Tableau 17) ont
été capturées pour la première fois dans la
région d'étude. Ils s'agissent de Notopleura saharica
(Krauss, 1902), Heteracris littoralis (Rambur, 1838), Heteracris
minuta (Uvarov, 1921), Aiolopus puissanti (Defaut, 2005),
Aiolopus simulatrix (Walker, 1870), Hilethera aeolopoides
(Uvarov, 1922), Morphacris fasciata (Thunberg, 1815),
Oedaleus senegalensis (Krauss, 1877), Sphingoderus carinatus
(Saussure, 1888), Sphingonotus paradoxus (Bei-Bienko, 1948), et
Tropidopola cylindrica (Marschall, 1836).
La figure 6 montre une dominance de trois sous-familles
d'Acrididae : les Oedipodinae, les Gomphocerinae et Eyprepocnemidinae, Elles
représentent respectivement (40,4%), (12,8%) et (10,6%). Au sein de la
sous famille des Oedipodinae, le genre Sphingonotus est le plus
nombreux en espèces dans cette liste d'inventaire avec 7 espèces
soit 14,9 % de l'effectif total des espèces recensées. Les
espèces les plus rencontrées au cours de nos prospections sont au
nombre de sept. Par ordre de fréquence d'observations on peut citer :
Acrotylus patruelis (Herrich-Schäffer, 1838), Ochrilidia
gracilis (Krauss, 1902), Acrida turrita (Linné, 1758),
Pyrgomorpha cognata (Krauss, 1877), Aiolopus strepens
(Latreille, 1804), Morphacris fasciata (Thunberg, 1815) et
Heteracris annulosa (Walker, 1870),
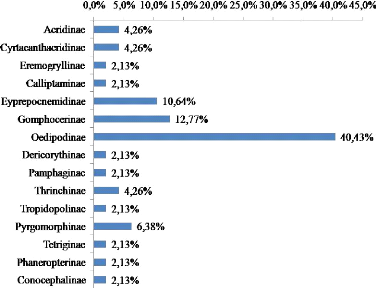
43
Figure 6. Pourcentages des différentes
sous-familles d'Orthoptères de la région d'étude
44
Résultats et Discussions
L'enquête sur les Orthoptères de la vallée
du M'Zab, dans le Sahara septentrional de l'Algérie, a été
menée sur une période de trois ans, de septembre 2016 à
août 2019, afin de compléter et de confirmer les informations sur
la faune de cette région. Au cours de l'enquête, un total de 47
espèces d'Orthoptères a été recensé sur neuf
sites. Ce nombre est à comparer aux 57 espèces acridiennes
inventoriées dans la région de Biskra (Moussi,
2012), aux 46 espèces Caelifères au niveau du grand
Sahara algérien (Ould El Hadj, 2004) et
également aux 31, 28 et 21 espèces d'Orthoptères
recensées dans la région de Ghardaïa des travaux respectifs
de Zergoun (1991,1994), Babaz (1992) et
Yagoub (1995), semblent satisfaisants. Actuellement, le nombre
d'espèces d'Orthoptères décrites en Algérie est
d'environ 289 espèces (Cigliano et al., 2019).
Dans ce cas avec 47 espèces, la vallée du M'Zab présente
16,3 % de la faune Orthoptérique Algérienne. La liste taxonomique
actualisée sur Caelifera en Algérie atteste de la présence
de 154 espèces / sous-espèces (Cigliano et al,,
2019). Le chiffre de 45 Caelifera recensé dans la vallée
du M'Zab présente 29,2 % du total des Caelifères de
l'Algérie. Ces derniers sont répartis en 5 familles : Acrididae
(37 espèces), Pamphagidae (3 espèces), Pyrgomorphidae (3
espèces), Dericorythidae (1 espèces), et Tetrigidae (1
espèces),
Des données taxonomiques actualisées sur
Ensifera en Algérie notent de la présence de 136 espèces /
sous-espèces (Cigliano et al,, 2019)
réparties en 7 familles : Gryllidae (53 espèces),
Trigonidiidae (06 espèces), Mogoplistidae (06 espèces),
Gryllotalpidae (03 espèces), Myrmecophilidae (05 espèces),
Anostostomatidae (une espèce), Tettigoniidae (62 espèces ). La
vallée du M'Zab ne présente qu'une seule famille : Tettigoniidae
représentée par deux espèces à savoir
Phaneroptera nana (Fieber, 1853) et Conocephalus fuscus
(Fabricius, 1793). Ce chiffre de deux espèces est évidemment
très faible si on le compare aux espèces d'Ensifères
notées en Algérie. Cela est probablement dû au faite que
les représentants des Ensifères sont étroitement
inféodés aux biotopes hygrotrophes et certains ont une
activité nocturne.
III.2. Estimation de la richesse
spécifique
La richesse en espèces est l'une des composantes de la
diversité les plus importantes en écologie communautaire, car
c'est un concept clé dans plusieurs théories biologiques et
stratégies de conservation (Magurran, 2004). Cependant,
le nombre d'espèces détectées dépend
remarquablement de l'échantillonnage (Gotelli & Colwell,
2011) et nécessite une attention particulière pour les
données estimées à partir d'échantillons de
terrain (MacKenzie, 2006). Lors d'un échantillonnage
des peuplements d'Orthoptères d'une région, une question revient
toujours à l'esprit qui est : comment savoir quand arrêter
l'échantillonnage ?
45
Résultats et Discussions
Au fur et à mesure que plus d'individus sont
contactés, le taux de découverte de nouvelles espèces
diminue généralement. Une fois que nous avons trouvé 20
espèces par exemple, nous devrons peut-être augmenter le nombre
d'échantillonnage pour trouver la 21ème espèce
et un nombre encore plus grand pour trouver la 22ème
espèce, car la plupart des espèces communes ont probablement
été rencontrées. Un problème pratique qui se pose
lors de la mesure de la richesse et de la diversité des espèces
consiste à déterminer quand vous avez suffisamment
collecté pour arrêter l'échantillonnage. Heureusement, les
statisticiens ont mis au point un certain nombre de techniques permettant
d'utiliser cette baisse du taux de découverte pour estimer la richesse
totale en espèces du site. La caractérisation de la
diversité spécifique des différents habitats a
été faite grâce aux courbes d'accumulation de la richesse
spécifique. Ces courbes sont largement utilisées dans la
comparaison de la diversité spécifique observée dans
différents sites d'un paysage (Ugland et al., 2003 ;
Kalinganire et al., 2005). Par ailleurs, ces courbes
d'accumulation de la richesse spécifique fournissent une importante
information sur la représentativité de l'échantillonnage
par rapport à la biodiversité de la zone d'étude,
c'est-à-dire le nombre d'espèces rencontrées en fonction
de l'effort d'échantillonnage. Concrètement, elles permettent
d'estimer la richesse spécifique si les milieux ont été
suffisamment échantillonnés (Niyukuri et al.,
2014). Afin de comparer la richesse en espèces des assemblages
des Orthoptères des différents milieux de la vallée du
M'Zab, des courbes d'accumulation d'échantillons randomisées ont
été calculées et extrapolées à 36
échantillons à l'aide du logiciel Estimâtes S
(Colwell, 2013). Les courbes de raréfaction basées sur
des échantillons ont été tracées ensemble pour
chaque site afin de vérifier l'exhaustivité de
l'échantillonnage. En analysant la richesse spécifique des neuf
biotopes échantillonnés dans la vallée du M'Zab, nous
constatons que le milieu cultivé Ben Isguen présente une richesse
spécifique plus élevée par rapport aux autres (Figure 7).
Pour le milieu cultivé Ben Isguen, le nombre de 24 espèces est
atteint après 36 échantillons, ce qui suggère qu'aucun
autre échantillon n'était nécessaire après le
36ème échantillon. Le nombre cumulatif
d'espèces pour chaque milieu cultivé variait entre 24
espèces à Ben Isguen, 22 espèces à Ghardaïa et
16 espèces à El Atteuf pour les milieux cultivés. Ces
nombres cumulatifs d'espèces sont atteints respectivement après
le 36ème, 29ème et 15ème
échantillon. Au niveau des palmeraies de Ben Isguen, Ghardaïa et El
Atteuf, le nombre cumulatif d'espèces est respectivement 18,16 et 15
espèces, Ces chiffres sont enregistrés respectivement
après le 16ème, 14ème et
10ème échantillon.
Résultats et Discussions

46
Figure 7. Courbes d'accumulation de la
richesse spécifique des neuf sites d'étude
47
Résultats et Discussions
Les milieux naturels de Ben Isguen, Ghardaïa et El Atteuf
notent respectivement 21,17 et 14 espèces, Ces nombres cumulatifs sont
atteints respectivement après le 19ème,
15ème et 13ème échantillon. Les
courbes de raréfaction ont montré que l'échantillonnage
était suffisant sur chaque site. Les courbes basées sur les
échantillons ont atteint toutes les asymptotes. Les méthodes non
paramétriques d'estimation de la richesse en espèces
réelle ont indiqué que l'inventaire de chaque habitat
était complet. Malgré l'effort d'échantillonnage suffisant
et même si les principales biotopes de la vallée du M'Zab ont
été visitées et apportent l'essentiel des informations,
d'autres localités de la région d'étude pourraient
être échantillonnées. Malgré des différences
dans les efforts d'échantillonnage, Les assemblages les plus riches
étaient ceux des milieux cultivés de Ben Isguen et Ghardaïa,
et les plus pauvres, ceux de palmeraie et milieu naturel d'El Atteuf.
III.3. Variation saisonnière de la
densité des Orthoptères
Les densités maximales caractérisent les
relevés effectués en milieux cultivés (163 individus
à 118 individus pour 100 m2). Inversement, les
densités les plus faibles (3 à 4 individus pour 100
m2) correspondent aux milieux naturels et les palmeraies, Les
figures 8,9 et 10 montrent la variation saisonnière de la densité
de population d'Orthoptères (adultes et larves) pendant la
période de l'étude.

A : Automne ; H : Hiver ; P : Printemps ; E : Eté
Figure 8. Variation saisonnière de la
densité de population d'Orthoptères (adultes et larves)
enregistrée au cours de la période d'étude dans les
milieux cultivés.
48
Résultats et Discussions
La densité totale des sauterelles a varié au
cours de la période d'étude. Des densités plus
élevées ont été atteintes en Eté 2018 dans
les milieux cultivés (163 individus / 100 m2) à Ghardaïa,
(156 individus / 100 m2) à Ben Isguen et (118 individus / 100 m2) pour
El Atteuf. Des densités plus faibles ont été
enregistrées en Hiver 2017 dans les milieux naturels. On note (3
individus / 100 m2) à Ghardaïa et Ben Isguen. Les plus faibles
densités ont été marquées aussi dans la palmeraie
d'El Atteuf durant la saison hivernale des trois ans d'étude (4 à
5 individus pour 100 m2).

A : Automne ; H : Hiver ; P : Printemps ; E : Eté
Figure 9. Variation saisonnière de la
densité de population d'Orthoptères (adultes et larves)
enregistrée au cours de la période d'étude dans les
palmeraies
Les densités étaient plus élevées
dans les sites moins perturbés de Ben Isguen et Ghardaïa. Des
résultats similaires ont été observés par
Cigliano et al., (2002) dans le comté de
Benito Juarez, sud de la Pampa, en Argentine, où les habitats non
perturbés ont entraîné une augmentation globale
densités de sauterelles.
Les assemblages des Orthoptères peuvent différer
en densité, en dominance et en composition spécifique en raison
des différences de végétation, d'humidité, de sol
et de température de l'habitat (Joern, 1982).
49
Résultats et Discussions

A : Automne ; H : Hiver ; P : Printemps ; E : Eté
Figure 10. Variation saisonnière de la
densité de population d'Orthoptères (adultes et larves)
enregistrée au cours de la période d'étude dans les
milieux naturels
Le pic observé en Eté pourrait s'expliquer par
les fortes températures. La plus faible densité notée en
Hiver pourrait s'expliquer par des températures basses. En effet les
densités ont eu tendance à augmenter par temps chaud et sec dans
notre étude. Ce résultat ne concorde pas avec ceux
enregistrés dans le sud Argentine, où la densité des
sauterelles n'a pas été affectée par les
précipitations et la température saisonnières
(Wysiecki et al., 2011). Durant la Saison hivernal la
majorité des Acridiens sont en diapause (embryonnaire, larvaire ou
imaginale). Au printemps les insectes en général et les
Orthoptères en particulier augmentent leur effectif à cause des
éclosions des oeufs et la reprise de leur activité. Le
recouvrement végétal devient important durant le Printemps, ce
qui favorise une élévation progressive en espèces et en
individus des Acridiens. En général la densité des
criquets commence à augmenter en Printemps pour atteindre le maximum en
Eté. Cette densité élevée est maintenue durant
l'Automne pour diminuer progressivement jusqu'à la mauvaise saison.
Ainsi, le moment des précipitations et le temps ensoleillé
peuvent jouer un rôle très important dans la détermination
de la densité des sauterelles (Stauffer & Whitman,
1997).
III.4. Abondance relative
Le (Tableau 19) regroupe l'abondance relative des 47
espèces d'Orthoptères des 9 stations d'études. Les
prospections menées entre 2016 et 2019 ont permis de recenser un
total
50
Résultats et Discussions
de 47 espèces sur neuf stations de la vallée du
M'Zab. Les trois milieux cultivés : Ben Isguen, Ghardaïa et El
Atteuf enregistrent respectivement 24, 22 et 18 espèces.
Tableau 19. Abondance relative (%) des
Orthoptères dans 9 stations de la vallée du M'Zab
|
Code
|
Stations
|
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
Actu
|
3,49
|
3,09
|
3,47
|
6,64
|
6,03
|
4,38
|
-
|
-
|
-
|
|
Trna
|
0,92
|
0,74
|
-
|
1,48
|
-
|
-
|
3,92
|
3,33
|
4,18
|
|
Scgr
|
-
|
-
|
-
|
-
|
-
|
-
|
0,93
|
0,70
|
1,01
|
|
Demi
|
-
|
-
|
-
|
-
|
-
|
-
|
0,52
|
-
|
-
|
|
Anae
|
-
|
-
|
-
|
2,10
|
3,61
|
2,22
|
-
|
-
|
-
|
|
Caba
|
0,01
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Nosa
|
1,48
|
1,30
|
-
|
-
|
-
|
-
|
6,39
|
7,49
|
9,36
|
|
Head
|
0,43
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Hean
|
4,89
|
5,17
|
5,12
|
4,40
|
5,35
|
3,87
|
-
|
-
|
-
|
|
Heha
|
2,69
|
-
|
-
|
3,65
|
-
|
3,81
|
-
|
-
|
-
|
|
Heli
|
4,33
|
4,27
|
4,08
|
3,79
|
-
|
-
|
-
|
-
|
-
|
|
Hemi
|
0,29
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Ocfi
|
0,92
|
1,07
|
1,06
|
-
|
9,75
|
9,08
|
-
|
-
|
-
|
|
Ocge
|
3,03
|
3,35
|
4,91
|
3,37
|
8,34
|
7,75
|
-
|
-
|
-
|
|
Ocgr
|
14,37
|
14,52
|
16,31
|
17,89
|
20,00
|
18,48
|
-
|
-
|
-
|
|
Ocha
|
3,23
|
4,68
|
-
|
-
|
-
|
11,49
|
-
|
-
|
-
|
|
Omaf
|
-
|
-
|
-
|
-
|
1,63
|
-
|
-
|
-
|
-
|
|
Omlu
|
-
|
-
|
-
|
-
|
1,24
|
-
|
-
|
-
|
-
|
|
Aipu
|
1,98
|
2,05
|
2,65
|
2,58
|
2,82
|
4,19
|
-
|
-
|
-
|
|
Aisi
|
1,98
|
1,70
|
2,02
|
2,51
|
-
|
-
|
-
|
-
|
-
|
|
Aist
|
10,80
|
9,88
|
10,35
|
12,46
|
7,49
|
6,79
|
-
|
-
|
-
|
|
Aclo
|
4,02
|
3,20
|
3,35
|
-
|
-
|
-
|
14,12
|
15,91
|
20,23
|
|
Acpa
|
12,0%
|
12,75
|
14,46
|
11,46
|
8,06
|
-
|
2,94
|
-
|
-
|
|
Hyca
|
-
|
-
|
-
|
-
|
-
|
-
|
1,08
|
-
|
-
|
|
Hiae
|
2,01
|
2,56
|
0,23
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Lomi
|
-
|
0,11
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Mofa
|
9,33
|
9,53
|
11,38
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Oese
|
-
|
0,04
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Spca
|
-
|
1,23
|
-
|
-
|
-
|
-
|
5,15
|
5,38
|
6,70
|
|
Spaz
|
-
|
1,67
|
-
|
-
|
-
|
-
|
6,75
|
7,02
|
-
|
|
Sppa
|
-
|
-
|
-
|
-
|
-
|
-
|
0,46
|
0,64
|
1,01
|
|
Sppr
|
-
|
-
|
-
|
-
|
-
|
-
|
5,31
|
7,02
|
-
|
|
Spob
|
-
|
-
|
-
|
-
|
-
|
-
|
1,55
|
1,35
|
1,30
|
|
Spoc
|
-
|
-
|
-
|
-
|
-
|
-
|
2,16
|
1,64
|
1,15
|
|
Spru
|
-
|
-
|
-
|
-
|
-
|
-
|
11,64
|
11,05
|
13,10
|
|
Spsa
|
-
|
-
|
-
|
-
|
-
|
-
|
14,37
|
15,91
|
17,28
|
|
Vofo
|
-
|
-
|
-
|
-
|
-
|
-
|
1,29
|
0,88
|
-
|
|
Eusp
|
-
|
-
|
-
|
-
|
-
|
-
|
0,10
|
-
|
-
|
|
Pycg
|
8,12
|
9,36
|
10,67
|
9,05
|
8,00
|
7,37
|
3,19
|
1,64
|
2,52
|
|
Pyco
|
7,00
|
7,73
|
8,78
|
7,67
|
7,04
|
6,03
|
3,14
|
2,63
|
3,38
|
|
Tean
|
1,85
|
-
|
-
|
-
|
-
|
-
|
11,18
|
11,81
|
12,38
|
|
Tuin
|
-
|
-
|
-
|
-
|
-
|
-
|
3,81
|
-
|
-
|
|
Tmci
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
5,61
|
6,41
|
|
Trcy
|
-
|
-
|
-
|
3,06
|
-
|
-
|
-
|
-
|
-
|
|
Pame
|
0,83
|
-
|
1,15
|
4,61
|
4,34
|
5,97
|
-
|
-
|
-
|
|
Cofu
|
-
|
-
|
-
|
1,72
|
3,55
|
4,89
|
-
|
-
|
-
|
|
Phna
|
-
|
-
|
-
|
1,55
|
2,76
|
3,68
|
-
|
-
|
-
|
|
47
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
100%
|
MCBI : milieu cultivé Ben Isguen ; MCGH : milieu
cultivé Ghardaïa ; MCEA : milieu cultivé El Atteuf ; PABI :
palmeraie Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA : palmeraie El
Atteuf ; MNBI : milieu naturel Ben Isguen ; MNGH : milieu naturel Ghardaïa
; MNEA : milieu naturel El Atteuf
51
Résultats et Discussions
On remarque que les cinq Acridiens les plus abondants
(Ochrilidia gracilis, Acrotylus patruelis, Aiolopus
strepens, Morphacris fasciata et Pyrgomorpha cognata)
renferment plus de 57,5 % des spécimens des trois milieux
cultivés. Les proportions des cinq espèces abondantes se
présentent différemment d'une station à une autre durant
la période d'étude. On rencontre deux espèces à
très faible abondance dans les milieux cultivés. Ces
espèces sont : Calliptamus barbarus (un seul spécimen)
dans le milieu cultivé Ben Isguen et Oedaleus senegalensis
(trois spécimens) dans le milieu cultivé Ghardaïa.
Globalement, Ochrilidia gracilis est apparue comme l'espèce la
plus abondante lors des relevés, puisqu'elle est présente en
grande abondance dans les milieux cultivés. Son abondance varie de
(14,4% à 16,3%) dans les habitats cultivés. Acrotylus
patruelis vient en deuxième position avec une abondance qui varie
de (14,5% à 12%). Aiolopus strepens, Morphacris fasciata
et Pyrgomorpha cognata présentent une abondance relative
de (8,1% à 11,4%).
Dans les trois palmeraies : Ben Isguen (PABI), Ghardaïa
(PAGH) et El Atteuf (PAEA), on a recensé respectivement 18, 16, et 15
Orthoptères, Ochrilidia gracilis enregistre le plus fort
pourcentage au niveau des palmeraies. Les valeurs de l'abondance de ce
Gomphocerinae sont de 20 % à Ghardaïa, 18,5 % à El Atteuf et
17,9 % à Ben Isguen. En deuxième position vient Aiolopus
strepens (12,5 %) à Ben Isguen, Ochrilidia harterti
(11,5%) à El Atteuf et Ochrilidia filicornis (9,8 %)
à Ghardaïa.
Les milieux naturels : Ben Isguen (MNBI), Ghardaïa (MNGH)
et El Atteuf (MNEA) révèlent la présence respective de 21,
17 et 14 Caelifères. Dans les milieux naturels, 55,7 % du peuplement des
Caelifères est représenté par seulement quatre
espèces. Ces Acridiens sont : Acrotylus longipes (16,4%°,
Sphingonotus savignyi, (15,7%), Sphingonotus rubescens
(11,85%) et Tenuitarsus angustus. Le milieu naturel Ben Isguen
renferme une seule espèce observé une seule fois, il s'agit
d'Eunapiodes sp.
Selon Bonnet et al., (1997), le type
de milieu influence non seulement la présence des espèces
d'Orthoptères, mais aussi leur abondance relative. Dans le cas de notre
travail, nous avons constaté une influence de la structure de la
végétation sur la composition, la richesse et le nombre
d'individus. En effet, comme nous avons pu le constater, le nombre d'individus
des Orthoptères diminue à mesure que la végétation
est perturbée. La perturbation des milieux cultivés a un effet
sur l'abondance des Orthoptères. L'impact de perturbation est
étroitement lié à son intensité. Dans le milieu
cultive Ben Isguen, l'intensité des travaux agricoles est relativement
faible. Le milieu cultivé Ghardaïa la perturbation est
modérée. Par contre le milieu cultivé El Atteuf,
l'intensité des travaux agricoles est plus prononcée. D'où
l'abondance des criquets est élevée dans les milieux non
perturbés. Un milieu non
52
Résultats et Discussions
perturbé conduit à une augmentation de la
végétation adventice principalement graminéenne. Cette
dernière est très appréciée par un grand nombre
d'espèces d'Orthoptères telles que les Gomphocerinae, c'est le
cas d'Ochrilidia gracilis. Defaut (2000), note que
l'ouverture d'un milieu à la végétation dense conduit
presque inévitablement à une augmentation d'Orthoptères.
La diminution de l'intensité agricole contribuait à l'apparition
de beaucoup de surfaces nues qui favorisent le développement des
Oedipodinae telle qu'Acrotylus patruelis. Au niveau des palmeraies et
autour du palmier dattier s'installe une végétation
graminéenne très dense. Cette dernière est
représentée principalement par Cynodon dactylon et
Setaria verticillata. Ces deux Poaceae créent un microclimat
humide et favorisent l'installation en nombre très important de
Gomphocerinae. Le relief rocailleux des milieux naturels et l'accumulation du
sable au niveau des Oueds est un habitat favorable pour plusieurs
espèces telle que : Sphingonotus savignyi, Sphingonotus
rubescens, Acrotylus longipes et Tenuitarsus angustus.
Ces quatre dernières espèces sont abondantes dans les milieux
naturels.
III.5. Constance ou Fréquence
d'Occurrence
Les données des fréquences d'occurrences
relatives aux classes des espèces d'Orthoptères
inventoriés dans les neuf sites de la vallée du M'Zab sont
reportées dans le tableau 20.
Dans les sites MCBI, MCGH, PABI, MNBI et MNGH le nombre de
classe de constance des espèces Acridiennes calculée selon la
règle de Sturge est de six classes. Les intervalles de classes dans ces
biotopes sont respectivement 17,52%, 16,88%, 14,59%, 17,62% et 14,82%. Par
contre les habitats MCEA, PAGH, PAEA et MNEA enregistrent cinq classes de
constances des Orthoptères. Leurs intervalles de classes est
respectivement 15,09%, 13,97%, 12,78% et 14,52%. Le Tableau 21 regroupe les
classes de constance calculées des espèces d'Orthoptères
recensées dans les neuf d'étude choisies à la
vallée du M'Zab.
Dans les milieux cultivés presque la moitié des
espèces sont omniprésentes, soit 43,6% des espèces
présentes dans ces biotopes (Figure 11). C'est le cas de
d'Ochrilidia gracilis, Aiolopus strepens, Acrotylus
patruelis, Morphacris fasciata, Pyrgomorpha cognata, et
Pyrgomorpha conica. En deuxième positon viennent les
espèces constantes avec 29%. Les espèces régulières
et accessoires dans les trois sites notent une valeur de 12,9%. Il n'y a pas
d'espèces accessoires dans l'habitat El Atteuf. Les espèces
accidentelles et rares sont très faiblement représentées
ou absentes dans les milieux cultivés. Calliptamus barbarus et
Oedaleus senegalensis sont rares dans respectivement le milieu cultive
Ben Isguen et Ghardaïa.
53
Résultats et Discussions
Tableau 20. Constance (%) des espèces
d'Orthoptères inventoriés dans les neuf sites de la vallée
du M'Zab
|
Code
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
Actu
|
97,22
|
86,11
|
97,22
|
97,22
|
86,11
|
91,67
|
-
|
-
|
-
|
|
Trna
|
75
|
66,67
|
-
|
63,89
|
-
|
-
|
72,22
|
66,67
|
75
|
|
Scgr
|
-
|
-
|
-
|
-
|
-
|
-
|
47,22
|
30,56
|
33,33
|
|
Demi
|
-
|
-
|
-
|
-
|
-
|
-
|
22,22
|
-
|
-
|
|
Anae
|
-
|
-
|
-
|
69,44
|
72,22
|
-
|
-
|
-
|
-
|
|
Caba
|
2,78
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Nosa
|
41,67
|
41,67
|
-
|
-
|
-
|
-
|
44,44
|
44,44
|
47,22
|
|
Head
|
50
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Hean
|
80,56
|
91,67
|
80,56
|
80,56
|
75
|
69,44
|
-
|
-
|
-
|
|
Heha
|
80,56
|
-
|
-
|
83,33
|
-
|
72,22
|
-
|
-
|
-
|
|
Heli
|
81
|
83,33
|
75
|
86,11
|
-
|
-
|
-
|
-
|
-
|
|
Hemi
|
33,33
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Ocfi
|
81
|
80,56
|
69,44
|
-
|
86,11
|
77,78
|
-
|
-
|
-
|
|
Ocge
|
86,11
|
86,11
|
88,89
|
80,56
|
88,89
|
88,89
|
-
|
-
|
-
|
|
Ocgr
|
100
|
100
|
100
|
100
|
100
|
100
|
-
|
-
|
-
|
|
Ocha
|
66,67
|
63,89
|
-
|
-
|
-
|
100
|
-
|
-
|
-
|
|
Omaf
|
-
|
-
|
-
|
-
|
33,33
|
-
|
-
|
-
|
-
|
|
Omlu
|
-
|
-
|
-
|
-
|
30,56
|
-
|
-
|
-
|
-
|
|
Aipu
|
77,78
|
69,44
|
77,78
|
72,22
|
66,67
|
75
|
-
|
-
|
-
|
|
Aisi
|
80,56
|
66,67
|
75
|
77,78
|
-
|
-
|
-
|
-
|
-
|
|
Aist
|
100
|
100
|
100
|
100
|
91,67
|
91,67
|
-
|
-
|
-
|
|
Aclo
|
86,11
|
75
|
75
|
-
|
-
|
-
|
77,78
|
77,78
|
77,78
|
|
Acpa
|
100
|
100
|
97,22
|
100
|
91,67%
|
-
|
50%
|
-
|
-
|
|
Hyca
|
-
|
-
|
-
|
-
|
-
|
-
|
41,67
|
-
|
-
|
|
Hiae
|
52,78
|
55,56
|
25
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Lomi
|
-
|
16,67
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Mofa
|
100
|
94,44
|
97,22
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Oese
|
-
|
8,33
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Spca
|
-
|
33,33
|
-
|
-
|
-
|
-
|
44,44
|
47,22
|
50
|
|
Spaz
|
-
|
44
|
-
|
-
|
-
|
-
|
50
|
44,44
|
-
|
|
Sppa
|
-
|
-
|
-
|
-
|
-
|
-
|
19,44
|
25
|
30,56
|
|
Sppr
|
-
|
-
|
-
|
-
|
-
|
-
|
33,33
|
52,78
|
-
|
|
Spob
|
-
|
-
|
-
|
-
|
-
|
-
|
38,89
|
36,11
|
33,33
|
|
Spoc
|
-
|
-
|
-
|
-
|
-
|
-
|
50
|
47,22
|
38,89
|
|
Spru
|
-
|
-
|
-
|
-
|
-
|
-
|
80,56
|
80,56%
|
83,33
|
|
Spsa
|
-
|
-
|
-
|
-
|
-
|
-
|
66,67
|
69,44
|
66,67
|
|
Vofo
|
-
|
-
|
-
|
-
|
-
|
-
|
30,56
|
33,33
|
-
|
|
Eusp
|
-
|
-
|
-
|
-
|
-
|
-
|
5,56
|
-
|
-
|
|
Pycg
|
100
|
100
|
97,14
|
100
|
100
|
94,44
|
86,11
|
72,22
|
63,89
|
|
Pyco
|
100
|
100
|
61,11
|
100
|
100
|
94,44
|
97,22
|
86,11
|
88,89
|
|
Tean
|
50
|
-
|
-
|
-
|
-
|
-
|
66,67
|
75
|
61,11
|
|
Tuin
|
-
|
-
|
-
|
-
|
-
|
-
|
38,89
|
-
|
-
|
|
Tmci
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
66,67
|
61,11
|
|
Trcy
|
-
|
-
|
-
|
50
|
-
|
-
|
-
|
-
|
-
|
|
Pame
|
63,89
|
-
|
|
66,67
|
66,67
|
72,22
|
-
|
-
|
-
|
|
Cofu
|
-
|
-
|
-
|
25
|
38,89
|
38,89
|
-
|
-
|
-
|
|
Phna
|
-
|
-
|
-
|
25
|
30,56
|
41,67
|
-
|
-
|
-
|
(-) : Espèce absente ; MCBI
: milieu cultivé Ben Isguen ; MCGH : milieu
cultivé Ghardaïa ; MCEA : milieu cultivé El
Atteuf ; PABI : palmeraie Ben Isguen ; PAGH :
palmeraie Ghardaïa ; PAEA : palmeraie El Atteuf ;
MNBI : milieu naturel Ben Isguen ; MNGH :
milieu naturel Ghardaïa ; MNEA : milieu naturel El
Atteuf
54
Résultats et Discussions
Tableau 21. Classes de constance
calculées des espèces d'Orthoptères recensées dans
les neuf d'étude choisies à la vallée du M'Zab entre
Septembre 2016 et Aout 2019.
|
Sites
|
omniprésentes
|
constantes
|
régulières
|
accessoires
|
Accidentelles
|
rares
|
|
MCBI
|
[100-82,48[
|
[82,48-64,96[
|
[64,96-47,44[
|
[47,44-29,92[
|
[29,92-12,4[
|
[12,4- 2,78]
|
|
MCGH
|
[100-83,12[
|
[83,12-66,24[
|
[66,24-49,36[
|
[49,36-32,48[
|
[32,48-15,6[
|
[15,6- 8,33]
|
|
MCEA
|
[100-84,91[
|
[84,91-69,82[
|
[69,82-54,73[
|
[54,73-39,64[
|
[39,64-24,55[
|
-
|
|
PABI
|
[100-85,41[
|
[85,41-70,82[
|
[70,82-56,23[
|
[56,23-41,64[
|
[41,64-27,05[
|
[27,05-25]
|
|
PAGH
|
[100-86,03[
|
[86,03-72,06[
|
[72,06-58,09[
|
[58,09-44,12[
|
[44,12-30,15[
|
-
|
|
PAEA
|
[100-87,22[
|
[87,22-74,44[
|
[74,44-61,66[
|
[61,66-49[
|
[49-36,22[
|
-
|
|
MNBI
|
[100-82,38[
|
[82,38-64,76[
|
[64,76-47,14[
|
[47,14-29,52[
|
[29,52-11,9[
|
[11,9-5,56]
|
|
MNGH
|
[100-85,18[
|
[85,18-70,36[
|
[70,36-55,54[
|
[55,54-40,72[
|
[40,72-25,9[
|
[25,9-11,08[
|
|
MNEA
|
[100-85,48[
|
[85,48-70,96[
|
[70,96-56,44[
|
[56,44-41,92[
|
[41,92-27,4 [
|
-
|
(-) : Espèce absente ; MCBI : milieu cultivé Ben
Isguen ; MCGH : milieu cultivé Ghardaïa ; MCEA : milieu
cultivé El Atteuf ; PABI : palmeraie Ben Isguen ; PAGH : palmeraie
Ghardaïa ; PAEA : palmeraie El Atteuf ; MNBI : milieu naturel Ben Isguen ;
MNGH : milieu naturel Ghardaïa ; MNEA : milieu naturel El Atteuf.
Calliptamus barbarus et Oedaleus senegalensis
sont rares dans respectivement le milieu cultive Ben Isguen et
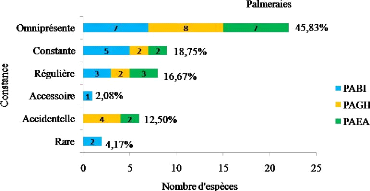
Ghardaïa. Au niveau des palmeraies les espèces omniprésentes
dominent toutes les catégories de constances. Elles enregistrent une
valeur de 45,8% (Figure 12). Nous citerons à titre d'exemple
Pyrgomorpha cognata, Pyrgomorpha conica, Ochrilidia
gracilis et Acrida turrita. Les espèces constantes et
régulières représentent presque le même taux, ils
marquent respectivement 18 ,7% et 16,7%. Une seule espèce accessoire est
observée dans la palmeraie Ben Isguen, il s'agit de Tropidopola
cylindrica. Ce dernier biotope ne présente pas d'espèces
accidentelles, par contre il marque deux espèces rares c'est le cas de
Phaneroptera nana et Conocephalus fuscus.

Figure 11. Constance des Orthoptères dans
les trois milieux cultivés de la vallée du M'Zab
Résultats et Discussions
Les milieux naturels se caractérisent par les
catégories d'espèces accessoires, constantes et
régulières, avec des taux respectives de 26,9%, 23,1% et 21,1%
(Figure 13). Les espèces omniprésentes quant à eux sont
très faiblement représentées au niveau de ces biotopes.
Parmi les espèces omniprésentes de ces habitats, on cite
Pyrgomorpha cognata, Pyrgomorpha conica et Sphingonotus
rubescens. Les espèces accidentelles notent un taux de 17,3%. Les sites
milieux naturels Ben Isguen et Ghardaïa enregistrent une espèce
rare chacun, ils s'agissent d'Eunapiodes sp et Sphingonotus
pachecoi (Tableau 21).
55
Figure 12. Constance des Orthoptères dans
les trois palmeraies de la vallée du M'Zab

Figure 13. Constance Orthoptères dans les
trois milieux naturels de la vallée du M'Zab
Dans la région de Ghardaia, Zergoun (1994)
note que les valeurs les plus élevées de la constance en
milieu cultivé sont notées chez Acrotylus patruelis,
Ochrilidia gracilis et Pyrgomorpha cognata, ce qui confirme
nos résultats. Dans les Monts de Tlemcen, Mekkioui
56
Résultats et Discussions
& Mesli (2010), notent qu'Acrotylus
patruelis est accessoire dans la station à exposition nord et
constante dans la station à exposition sud. Alors que dans la
vallée du M'Zab, cet Oedipodinae est omniprésent. Calliptamus
barbarus est constante dans les stations du Moyen Atlas marocain
(Essakhi et al., 2014), par contre elle a
été observé qu'une seule fois dans le milieu
cultivé Ben Isguen. Pour Magurran & Henderson
(2003), les communautés écologiques peuvent être
divisées en deux groupes ; les espèces de base qui sont
fréquentes et les espèces occasionnelles qui sont rares.
III.6. Diversité Alfa
Les indices de diversité permettent d'apprécier
la diversité des milieux différents. Un indice de
diversité est fonction de la richesse et de la structure de la
communauté (Ramade, 2009). Pour quantifier la
diversité, le recours aux indices est devenu très répandu.
Cependant le choix de l'indice doit être approprié pour être
objectif. Souvent l'utilisation de plusieurs indices est nécessaire pour
avoir une perception plus juste de la situation (Magurran
2004). L'intérêt de ces indices est de permettre des
comparaisons globales de peuplements différents ou de l'état d'un
même peuplement saisi à des moments différents, en faisant
référence ou non à un cadre spatio-temporel concret. Ces
indices correspondent à une mesure de la composition en espèces
d'un écosystème, en termes de nombre et de leur abondance
relative (Barbault, 1992; Legendre & Legendre, 1998). Les
mesures les plus courantes de la biodiversité sont la richesse
spécifique (S), l'indice de diversité de Shannon-Weaver (H'), et
l'indice de Pielou (J) et l'indice de diversité de Simpson (1-D) et
l'inverse de l'indice de Simpson (1/D). Selon Morris (2014),
le terme "indice de diversité de Simpson" est souvent utilisé de
manière imprécise. Cela signifie que les trois indices (indice de
Simpson, indice de diversité de Simpson et l'inverse de l'indice de
Simpson), qui sont étroitement liés, ont été
cités sous le même terme selon différents auteurs. Par
conséquent, il est important de déterminer quel indice a
été utilisé dans une étude particulière si
des comparaisons de diversité sont souhaitées. Les valeurs de la
diversité Alpha (richesse taxonomique, diversité de
Shannon-Weaver, équitabilité de Pielou et diversité de
Simpson) des différents habitats sont consignées dans le Tableau
22. La richesse spécifique (S) varie d'un biotope à un autre
(Tableau 22), elle est relativement plus faible en milieu naturel El Atteuf (14
espèces) qu'en milieu cultivé Ben Isguen (24 espèces).
Le plus haut indice de diversité de Shannon-Weaver
(2,76) également l'indice de diversité Simpson (0,92) et
l'inverse de l'indice de diversité Simpson (12,70) a été
trouvé dans le milieu cultivé Ben Isguen, ce qui indique sa plus
haute diversité d'espèces (24 espèces) dans
57
Résultats et Discussions
ce type de milieu, car la plus grande valeur de ces deux indices
de diversité révéler la plus grande diversité
d'espèces.
Tableau 22 Diversité Alpha des
Orthoptères des neuf sites de la vallée du M'Zab
|
Stations
|
S
|
N
|
H'
|
J
|
D
|
1-D
|
1/D
|
|
Milieu cultivé Ben Isguen
|
24
|
7357
|
2,76
|
0,87
|
0,08
|
0,92
|
12,70
|
|
Milieu cultivé Ghardaïa
|
22
|
7528
|
2,69
|
0,87
|
0,08
|
0,92
|
12,06
|
|
Milieu cultivé El Atteuf
|
16
|
5738
|
2,46
|
0,89
|
0,10
|
0,90
|
9,95
|
|
Palmeraie Ben Isguen
|
18
|
2906
|
2,62
|
0,91
|
0,09
|
0,91
|
11,08
|
|
Palmeraie Ghardaïa
|
16
|
1775
|
2,56
|
0,92
|
0,09
|
0,91
|
10,83
|
|
Palmeraie El Atteuf
|
15
|
1575
|
2,56
|
0,95
|
0,09
|
0,91
|
11,15
|
|
Milieu naturel Ben Isguen
|
21
|
1955
|
2,73
|
0,90
|
0,08
|
0,92
|
12,98
|
|
Milieu naturel Ghardaïa
|
17
|
1712
|
2,48
|
0,88
|
0,10
|
0,90
|
9,98
|
|
Milieu naturel El Atteuf
|
14
|
1389
|
2,27
|
0,86
|
0,12
|
0,88
|
8,06
|
S : Richesse spécifique, N
: nombre d'individus, H' : Shannon-Weaver, J
: L'indice de Pielou, D : L'indice de Simpson,
1-D : L'indice de diversité de Simpson, 1/D
: L'inverse de l'indice de Simpson.
L'indice de diversité minimal de Shannon-Weaver (2,27),
de Simpson (0,88) et de l'inverse de Simpson (8,06) a été
noté dans le milieu naturel El Atteuf, ce qui montre sa plus faible
diversité d'espèces (14 espèces). Ces valeurs
témoignent que la diversité en espèces de ce biotope est
la plus faible parmi les neuf milieux étudiés.
Les valeurs de l'équitabilité de Pielou (J) dans
les différents milieux d'étude, varient entre 0,86 et 0,95,
Cependant les milieux qui présentent un indice de diversité
élevé ne sont pas forcement les plus homogène et
équilibrée dans la structure de leur peuplement
d'Orthoptères. En effet les milieux cultivés de Ben Isguen et
Ghardaïa ont un indice de diversité de Shannon-Weaver important,
par contre leurs valeurs d'équitabilité indiquent que ces
biotopes sont moins équilibrés. Selon Marcon
(2015), les indices d'équitabilité informent seulement
sur la régularité du nombre d'individus par espèce. Ces
résultats concernant l'équitabilité indiquent la
présence d'espèces dominantes dans les milieux cultivés de
Ben Isguen et Ghardaïa. L'inverse de l'indice de Simpson traduit bien
cette dominance, En effet dans ces deux derniers milieux la valeur de cette
indice est élevé, elle est respectivement égale à
12,70 et 12,06. D'après Blondel (1995), une valeur de
(H') même élevée ne peut être
interprétée en matière de perturbation d'un milieu que si
elle est accompagnée de l'indice d'équitabilité de Pielou
(J). La prise en compte de ces deux valeurs de manière synchrone est
donc nécessaire pour apprécier l'état du milieu. Sachant
que le milieu cultivé d'El Atteuf est perturbé par les
activités agricoles, cela se traduit par une faible diversité
spécifique (14) et par conséquent un indice de diversité
(2,27) et équitabilité (0,86) moins considérée que
les autres milieux.
58
Résultats et Discussions
La diversité des espèces est aussi fortement
influencée par la température, les précipitations,
l'humidité, types de sol, et types de végétation.
III.6.1. Variation saisonnière de la
diversité
Pour mieux comprendre les variations de diversité entre
les sites d'étude, on doit comparer les indices de diversité en
fonction des saisons.
III.6.1.1. Indice de diversité de Shannon-Weaver
(H')
Les variations saisonnières de l'indice de
diversité de Shannon-Weaver dan les neuf sites sont
présentées dans la Tableau 23.
Tableau 23. Variation saisonnière de
l'indice de diversité de Shannon-Weaver dans les neuf sites de la
région d'étude
|
Saison
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
A2016
|
2,67
|
2,58
|
2,38
|
2,68
|
2,55
|
2,57
|
2,33
|
2,22
|
1,74
|
|
H2017
|
2,44
|
2,17
|
2,13
|
2,28
|
1,84
|
2,23
|
1,30
|
1,38
|
1,52
|
|
P2017
|
2,65
|
2,29
|
2,21
|
2,28
|
2,13
|
2,18
|
2,30
|
2,18
|
2,19
|
|
E2017
|
2,62
|
2,56
|
2,52
|
2,55
|
2,61
|
2,50
|
2,42
|
2,27
|
1,75
|
|
A2017
|
2,61
|
2,55
|
2,28
|
2,60
|
2,54
|
2,46
|
2,16
|
1,92
|
2,04
|
|
H2018
|
2,53
|
2,34
|
2,26
|
2,25
|
2,08
|
2,19
|
1,55
|
1,48
|
1,69
|
|
P2018
|
2,70
|
2,67
|
2,34
|
2,46
|
2,26
|
2,38
|
2,36
|
2,21
|
2,09
|
|
E2018
|
2,74
|
2,73
|
2,46
|
2,63
|
2,58
|
2,58
|
2,44
|
2,29
|
1,96
|
|
A2018
|
2,66
|
2,61
|
2,43
|
2,66
|
2,56
|
2,53
|
2,18
|
2,00
|
1,65
|
|
H2019
|
2,44
|
2,23
|
2,16
|
2,18
|
2,04
|
2,27
|
1,44
|
1,52
|
1,50
|
|
P2019
|
2,73
|
2,70
|
2,36
|
2,41
|
2,29
|
2,39
|
2,31
|
2,20
|
2,09
|
|
E2019
|
2,74
|
2,70
|
2,43
|
2,59
|
2,57
|
2,55
|
2,40
|
2,24
|
1,93
|
MCBI : milieu cultivé Ben Isguen ;
MCGH : milieu cultivé Ghardaïa ; MCEA
: milieu cultivé El Atteuf ; PABI : palmeraie
Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA
: palmeraie El Atteuf ; MNBI : milieu naturel Ben
Isguen ; MNGH : milieu naturel Ghardaïa ; MNEA
: milieu naturel El Atteuf ; A : Automne ; H
: Hiver ; P : Printemps ; E :
Eté
Dans la présente étude, la valeur de l'indice de
la diversité de Shannon-Weaver (H') variait de 1,30 à 2,74. Ces
indices enregistrent le minimum en Hiver et le maximum en Eté. En effet
les valeurs de l'indice de la diversité de Shannon-Weaver les plus
élevés sont enregistrées principalement durant les
Eté 2018 et 2019 dans le milieu cultivé Ben Isguen, ils
enregistrent une valeur de 2,74. La deuxième valeur élevée
de l'indice de la diversité de Shannon-Weaver a été
noté durant l'Eté 2018 dans le milieu cultivé
Ghardaïa et au printemps 2019 dans le milieu cultivé Ben Isguen.
Cette valeur importante durant les saisons Printemps et Eté s'explique
par le faite que durant ces deux saisons, les sites concernés ont
atteint leur diversité maximal en nombre et en espèces
d'Orthoptères. Les conditions climatiques et la végétation
ont un rôle primordial dans cette situation. De plus la plus part des
espèces Acridiennes ont
59
Résultats et Discussions
achevés leur cycle biologique. Les valeurs les plus
faibles de l'indice de la diversité de Shannon-Weaver ont
été marquées durant l'Hiver des trois ans d'étude.
Ces valeurs ont été notées dans les milieux naturels Ben
Isguen (1,3) et Ghardaïa (1,38). Cette diminution de diversité est
due probablement à la réduction du couvert végétal
et que durant l'Hiver la majorité des Orthoptères sont en
diapause embryonnaire, larvaire ou imaginale. Aucune différence
significative de la variation saisonnière sur l'indice de
diversité de Shannon-Weaver des Orthoptères dans les trois
palmeraies n'a été trouvée (Test de Kruskal-Wallis,
p-value = 0,32). La même chose était vraie pour la variation
saisonnière de l'indice de diversité de Shannon-Weaver des
milieux naturels (Test de Kruskal-Wallis, p-value = 0,14). Au contraire, la
variation saisonnière de l'indice de diversité de Shannon-Weaver
dans les trois milieux cultivés était significativement
différente (test de Kruskal-Wallis, p-value = 0,00046).
III.6.1.2. Indice d'Equitabilité de Pielou
(J)
Les valeurs de la variation saisonnière de l'indice
d'Equitabilité de Pielou (J) dans les neuf biotopes sont groupées
dans le Tableau 24.
Tableau 24. Variation saisonnière de
l'indice d'Equitabilité de Pielou (J) dan les neuf sites de la
région d'étude.
|
Saison
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
A2016
|
0,65
|
0,66
|
0,67
|
0,81
|
0,80
|
0,87
|
0,64
|
0,61
|
0,52
|
|
H2017
|
0,60
|
0,67
|
0,70
|
0,69
|
0,57
|
0,78
|
0,74
|
0,79
|
0,76
|
|
P2017
|
0,67
|
0,66
|
0,65
|
0,65
|
0,76
|
0,81
|
0,59
|
0,68
|
0,69
|
|
E2017
|
0,65
|
0,65
|
0,78
|
0,71
|
0,85
|
0,81
|
0,56
|
0,57
|
0,48
|
|
A2017
|
0,64
|
0,64
|
0,70
|
0,74
|
0,79
|
0,78
|
0,62
|
0,45
|
0,77
|
|
H2018
|
0,63
|
0,80
|
0,73
|
0,79
|
0,80
|
0,81
|
0,67
|
0,62
|
0,60
|
|
P2018
|
0,68
|
0,72
|
0,69
|
0,73
|
0,80
|
0,83
|
0,66
|
0,65
|
0,67
|
|
E2018
|
0,67
|
0,70
|
0,73
|
0,77
|
0,82
|
0,88
|
0,57
|
0,58
|
0,51
|
|
A2018
|
0,65
|
0,64
|
0,71
|
0,79
|
0,81
|
0,84
|
0,63
|
0,62
|
0,58
|
|
H2019
|
0,68
|
0,66
|
0,66
|
0,68
|
0,70
|
0,80
|
0,53
|
0,57
|
0,56
|
|
P2019
|
0,70
|
0,75
|
0,71
|
0,70
|
0,83
|
0,84
|
0,63
|
0,60
|
0,62
|
|
E2019
|
0,68
|
0,68
|
0,71
|
0,74
|
0,81
|
0,85
|
0,55
|
0,55
|
0,49
|
MCBI : milieu cultivé Ben Isguen ;
MCGH : milieu cultivé Ghardaïa ; MCEA
: milieu cultivé El Atteuf ; PABI : palmeraie
Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA
: palmeraie El Atteuf ; MNBI : milieu naturel Ben
Isguen ; MNGH : milieu naturel Ghardaïa ; MNEA
: milieu naturel El Atteuf ; A : Automne ; H
: Hiver ; P : Printemps ; E :
Eté
En général l'équitabilité
enregistre le minimum en Hiver et le maximum en Printemps-Eté. Cet
indice variait de 0,45 à 0,85. Durant la période
Eté-Automne, le site palmeraie El Atteuf marque les valeurs les plus
élevées de l'équitabilité. Dans cet habitat
l'équirépartition atteint 0,88 en Eté 2018, et 0,87 en
Automne 2016. Il semble que durant les saisons d'Eté et Automne les
espèces Acridiennes sont équitablement réparties dans les
sites. Cet équilibre est
60
Résultats et Discussions
probablement dû aux bonnes conditions d'humidité,
température et végétation de l'habitat durant cette
période de l'année. Par contre les plus faibles valeurs de
l'équitabilité sont observé durant les saisons Eté
et Automne dans les milieux naturels. Les indices les plus faibles ont
été notés dans le milieu naturel Ghardaïa (0,45) en
Automne 2017 et dans le milieu naturel El Atteuf (0,48) durant l'Eté
2017. Ce déséquilibre dans la répartition des
espèces dans le milieu naturel peut s'explique par le faite que durant
l'Eté et une partie de l'Automne les températures dans ces
milieux atteignent des valeurs très élevé, par
conséquent les Acridiens cherchent l'humidité pour ce
protégé des valeurs extrême de températures. La
variation saisonnière de l'équitabilité dans les trois
milieux cultivés (Test de Kruskal-Wallis, p-value = 0,017) et les trois
palmeraies (Test de Kruskal-Wallis, p-value = 0,00052) était
significativement différente. Par contre, aucune différence
significative de la variation saisonnière de
l'équitabilité des Acridiens dans les trois milieux naturels
(Test de Kruskal-Wallis, p-value = 0,84). Selon Marcon (2015),
le maximum de diversité sera atteint quand les espèces auront une
répartition équitable.
III.6.3. L'inverse de l'indice de Simpson
L'indice de Simpson donne plus de poids aux espèces
abondantes qu'aux espèces rares (Schlaepfer & Bütler,
2002). Pour mieux présenter les variations saisonnières
de la diversité de Simpson nous avons préférés
d'utiliser l'inverse de l'indice de Simpson, Le Tableau 25 montre les
différences de l'inverse de l'indice de Simpson dans les neuf habitats
selon les saisons,
Tableau 25. Variation saisonnière de
l'inverse de l'indice de Simpson dans les neuf sites de la région
d'étude
|
Saison
|
MCBI
|
MCGH
|
MCEA
|
PABI
|
PAGH
|
PAEA
|
MNBI
|
MNGH
|
MNEA
|
|
A2016
|
11,79
|
10,91
|
9,23
|
12,35
|
10,49
|
11,31
|
7,76
|
6,54
|
3,85
|
|
H2017
|
9,36
|
7,66
|
7,42
|
7,70
|
4,15
|
7,70
|
3,21
|
3,43
|
3,93
|
|
P2017
|
11,24
|
8,21
|
7,86
|
7,67
|
6,97
|
7,97
|
7,31
|
7,26
|
6,80
|
|
E2017
|
10,36
|
10,53
|
10,66
|
9,20
|
11,88
|
10,42
|
6,75
|
6,02
|
3,86
|
|
A2017
|
10,59
|
9,75
|
7,91
|
11,01
|
10,35
|
9,48
|
6,04
|
4,34
|
6,23
|
|
H2018
|
10,22
|
9,12
|
8,32
|
8,08
|
6,62
|
7,36
|
3,35
|
3,44
|
4,11
|
|
P2018
|
11,30
|
11,01
|
7,92
|
9,45
|
7,94
|
8,89
|
8,70
|
7,54
|
6,92
|
|
E2018
|
12,89
|
13,12
|
10,05
|
11,06
|
11,21
|
11,88
|
8,53
|
7,70
|
5,18
|
|
A2018
|
12,08
|
11,55
|
10,02
|
12,35
|
11,20
|
10,62
|
6,59
|
5,57
|
3,86
|
|
H2019
|
9,54
|
7,56
|
7,05
|
7,26
|
5,78
|
8,03
|
2,90
|
3,56
|
3,48
|
|
P2019
|
11,99
|
11,63
|
8,24
|
9,09
|
8,35
|
9,29
|
8,08
|
7,45
|
6,76
|
|
E2019
|
13,14
|
12,89
|
9,88
|
10,45
|
11,04
|
10,86
|
8,24
|
7,27
|
4,97
|
MCBI : milieu cultivé Ben Isguen ;
MCGH : milieu cultivé Ghardaïa ; MCEA
: milieu cultivé El Atteuf ; PABI : palmeraie
Ben Isguen ; PAGH : palmeraie Ghardaïa ; PAEA
: palmeraie El Atteuf ; MNBI : milieu naturel Ben
Isguen ; MNGH : milieu naturel Ghardaïa ; MNEA
: milieu naturel El Atteuf ; A : Automne ; H
: Hiver ; P : Printemps ; E :
Eté
61
Résultats et Discussions
La valeur de l'inverse de l'indice de Simpson variait de 3,21
à 13,14, Cet indice enregistre le minimum en Hiver et le maximum en
Eté.
La valeur de l'inverse de l'indice de Simpson commence par 1
comme le plus petit nombre possible. Ce cas représenterait une
communauté qui ne contient qu'une seule espèce. Plus la valeur
est élevée, plus la diversité est grande. La valeur
maximale est le nombre d'espèces dans l'échantillon. On constate
que cet indice augmente à partir de Printemps pour atteindre son maximum
Eté et Automne. Le milieu cultivé Ben Isguen enregistre une
valeur maximale de 13,14 durant l'Eté 2019. Cette valeur
représente le nombre d'espèces dominantes dans ce biotope pendant
cette période. Bien que cet habitat renferme 24 espèces,
l'inverse de l'indice de Simpson n'a pas pris en considération 11
espèces d'Acridiens. Les plus faibles valeurs de l'inverse de l'indice
de Simpson sont marquées en Hiver. Cela est du au faite durant la saison
hivernal la richesse spécifique est faible dans les différents
habitats. De plus l'inverse de l'indice de Simpson donne plus de poids aux
espèces abondantes. L'inverse de l'indice de Simpson permet de faire
varier l'indice dans le même sens que la diversité : plus la
diversité spécifique est élevée plus l'indice est
fort. Par exemple : s'il y a 24 espèces dans un site, la valeur maximale
de l'inverse de l'indice de Simpson est de (24). Un habitat dominé par
plusieurs espèces est considérée comme moins
diversifiée que celui dans le quel plusieurs espèces
différentes ont une abondance similaire. Le milieu naturel Ben Isguen
enregistre la plus faible valeur de l'inverse de l'indice de Simpson durant
l'Hiver 2017. Aucune différence significative de la variation
saisonnière sur l'inverse de l'indice de Simpson des Orthoptères
dans les trois palmeraies n'a été trouvée (Test de
Kruskal-Wallis, p-value = 0,057). La même chose était vraie pour
la variation saisonnière de l'indice de Simpson des milieux naturels
(Test de Kruskal-Wallis, p-value = 0,14). Quant à la variation
saisonnière l'inverse de l'indice de Simpson des Orthoptères dans
les trois milieux cultivés était significativement
différente (test de Kruskal-Wallis, p-value = 0,0024). Le nombre
d'espèces des Orthoptères augmentent à partir du Printemps
jusqu'à l'Automne, pour diminuer ensuite pendant l'Hiver. Ceci est
cohérent avec les observations faites par Zergoun (1991,1994)
et Babaz (1992) dans la région de
Ghardaïa.
III.7. Analyse factorielle des
correspondances
Nous avons cherché à savoir comment se
distribuaient les différentes espèces d'Orthoptères au
sein des neuf stations de la Vallée du M'Zab. La matrice des
données (9 stations x 47 espèces) a été soumise
à une Analyse Factorielle des Correspondances (AFC),
62
Résultats et Discussions
suivie d'une classification ascendante hiérarchique (CAH).
Chaque étiquette est composée des 2 premières lettres du
nom générique accolées aux 2 premières du nom
spécifique.

Figure 14. Représentation des
espèces et des stations dans le plan F1-F2 de l'AFC
Les deux premiers axes F1 et F2 de l'AFC englobent 62,72% de
la variance totale du nuage de points avec des contributions partielles
respectives de 45.31% et 17.41%. Ce taux étant supérieur à
50%, de ce fait l'exploitation des résultats par l'analyse factorielle
des correspondances (A.F.C) peut se faire uniquement avec l'axe1 et 2. La
représentation graphique de l'analyse factorielle des correspondances
(Figure 14) montre une répartition des stations dans trois quadrants
différents, les trois stations palmeraies (palmeraie Ben Isguen,
palmeraie Ghardaïa et palmeraie El Atteuf) dans le premier quadrant, le
deuxième quadrant occupé par les trois stations milieux
cultivés (milieu cultivé Ben Isguen, milieu cultivé
Ghardaïa et milieu cultivé El Atteuf) alors que le troisième
quadrant rassemble les trois stations milieux naturels (milieu naturel Ben
Isguen, milieu naturel Ghardaïa et milieux naturel El Atteuf).
Si nous considérons l'ensemble des espèces
d'Orthoptères sur le plan défini par l'axe 1 et 2, nous
constatons l'existence de neuf groupes d'espèces : Le groupe (A)
comprend les espèces présentes en commun dans les milieux
cultivés et palmeraies : Ochrilidia geniculata (Ocge),
Ochrilidia gracilis (Ocgr), Aiolopus strepens (Aist),
Acrida turrita (Actu), et Heteracris
63
Résultats et Discussions
annulosa (Hean). Le groupe (B) contient des
espèces présentes uniquement sur les trois sites de collecte
palmeraies : Anacridium aegyptium (Anae), Conocephalus fuscus
(Cofu) et Phaneroptera nana (Phna). Le groupe (C) regroupe les
espèces communes aux trois sites de collecte milieu naturel, c'est le
cas de Schistocerca gregaria (Scgr), Sphingonotus obscuratus
lameerei (Spob), Sphingonotus rubescens (Spru), Sphingonotus
pachecoi (Sppa), Sphingonotus savignyi (Spsa) et Sphingonotus
octofasciatus (Spoc). Le groupe (D) représente les espèces
communes aux neuf stations d'études. Ces espèces peuvent
fréquenter différents biotopes. C'est le cas de Pyrgomorpha
cognata (Pycg) et Pyrgomorpha conica (Pyco). Le groupe (E) est
composé de deux espèces : Morphacris fasciata (Mofa) et
Hilethera aeolopoides (Hiae). Le groupe (F) regroupe les
espèces présentes uniquement dans le milieu cultivé Ben
Isguen : Calliptamus barbarus (Caba), Heteracris adspersa
(Head) et Heteracris minuta (Hemi). Le groupe (G) est
composé de Locusta migratoria (Lomi) et Oedaleus
senegalensis (Oese). Ces espèces sont présentes uniquement
dans le milieu cultivé Ghardaïa. Le groupe (H) est composé
d'espèces qui caractérisent uniquement le milieu naturel Ben
Isguen. Ces Acridiens sont : Tuarega insignis (Tuin), Dericorys
millierei (Demi), Hyalorrhipis calcarata (Hyca) et Eunapiodes
sp (Eusp). Le groupe (I) représente les espèces
rencontrées uniquement dans la palmeraie Ghardaïa. Ces
Caelifères sont : Omocestus africanus (Omaf) et Omocestus
lucasii (Omlu).
L'axe F1 ordonne apparemment les espèces selon leurs
affinités écologiques. La position de chaque espèce sur
cet axe exprime son degré vis-à-vis d'un ensemble de facteurs
écologiques tels que l'humidité, la luminosité et le
couvert végétal. En effet, les espèces qui
préfèrent l'humidité vivent dans des zones moins
ensoleillées et dans des parcelles recouvertes d'herbes denses et sont
situées du côté négatif de l'axe 1, telles que
Phaneroptera nana, Conocephalus fuscus, Paratettix
meridionalis, Heteracris adspersa et les espèces du genre
Ochrilidia. Du côté positif de l'axe 1, on trouve des
espèces xérophiles qui préfèrent vivre dans des
endroits secs. Ces lieux sont caractérisés par une
végétation très dispersée et un rayonnement solaire
très important. Parmi les espèces qui préfèrent ces
conditions on cite entre autres : Sphingonotus rubescens,
Sphingonotus pachecoi et Sphingonotus obscuratus lameerei.
Les différents gradients, qui sont le gradient d'humidité, le
gradient de luminosité et le gradient de végétation
varient de gauche à droite : de l'environnement le plus humide, à
végétation plus dense et le moins ensoleillée, vers le
milieu le plus sec, la végétation moins dense et plus
ensoleillée. Ould El Hadj (1991) indique la
présence d'Heteracris adspersa dans des environnements secs. En
revanche, Zergoun (1994) a signalé que cette
espèce est présente dans des zones plus humides. Près de
l'origine se trouve un groupe d'espèces
64
Résultats et Discussions
relativement indifférentes aux facteurs
d'humidité, d'ensoleillement et de couverture végétale.
C'est le cas de Pyrgomorpha cognata, Pyrgomorpha conica et
Acrotylus patruelis. Sur les axes F1 et F2, les espèces sont
réparties en fonction de leur présence dans les environnements
d'étude. Sur la partie positive de l'axe F2, on trouve les
espèces du genre Sphingonotus qui fréquentent les sites
de collecte des milieux naturels. Sur la partie négative de l'axe F2, on
trouve les espèces des milieux cultivés et palmeraies. Ainsi,
l'importance de la composition floristique des milieux, l'intensité des
travaux agricoles et le mode d'irrigation sont des facteurs très
importants dans la répartition des criquets dans différents
biotopes. Le milieu cultivé d'El-Atteuf, qui a connu une forte
activité agricole lors de notre échantillonnage, est moins riche
que les deux autres milieux cultivés. Le désherbage a
détruit une grande partie des plantes spontanées telles que les
Poaceae. En fait, la couche herbacée contribue fortement à la
richesse en espèces de criquets. Ainsi, l'activité agricole a un
impact négatif sur les criquets. En revanche, certaines espèces
telles que les Oedipodinae, généralement abondantes sur un sol
nu, peuvent être favorisées dans cette zone. L'irrigation par
aspersion a un effet négatif sur la richesse en criquets. Sachant que la
plupart des criquets préfèrent les endroits chauds et
ensoleillés, ce type d'irrigation créera un environnement humide
et, par conséquent, exclura de nombreuses espèces qui
rechercheront des environnements plus secs.
III.8. Classification hiérarchique
ascendante
En guise de synthèse, nous avons réalisé
une classification hiérarchique ascendante basée sur la
similitude de Sorensen des 9 peuplements étudiés en se basant
seulement sur la présence/absence des espèces dans les
différents biotopes (Figure 15). Le dendrogramme de similarité
est divisé en 2 groupes : Un 1er groupe est formé par
MNBI, MNGH et MNEA. Ce sont les milieux naturels (lits d'oueds)
caractérisés par un faible taux de recouvrement
végétal. Cette dernière est installée sur un sol
rocailleux avec quelques endroits sablonneux. Ces biotopes abritent une
Acridofaune thermophile telle que Tuarega insignis, Sphingonotus
rubescens, Sphingonotus obscuratus lameerei, Sphingonotus
savignyi, Sphingonotus paradoxus, etc. Les milieux naturels
forment une association homogène qui ne peut pas être
divisé en sous-groupes.
Le 2ème groupe est formé par
l'Acridofaune des milieux cultivés et palmeraies notamment, MCBI, MCGH,
MCEA, PABI, PAGH, et PAEA. Ces habitats présentent un recouvrement
végétal assez important par apport aux milieux naturels, une
irrigation plus au moins fréquente et le sol est sablonneux-limoneux
végétation assez caractérisés par la
présence des espèces arboricoles.
65
Résultats et Discussions
Similarité
Figure 15. Dendrogramme de similarité
entre les neuf peuplements Orthoptérologique
Ces biotopes abritent des Orthoptères phytophiles telle
que Ochrilidia gracilis et géophiles telles que Acrotylus
patruelis. Ce groupement est ensuite scindé en 2 sous groupes, l'un
est composé par les milieux cultivé (MCBI, MCGH, et MCEA) et
l'autre par les palmeraies (PABI, PAGH et PAEA). Les milieux cultivés
sont caractérisé par une végétation moins dense,
mais plus riche en espèces herbacées. Ces biotopes abritent les
Acridiens mésohygrophiles, c'est le cas de la plupart des
Caelifères tels qu'Aiolopus strepens, Acrida turrita,
Heteracris annulosa, Morphacris fasciata, Acrotylus
patruelis, Pyrgomorpha cognata, etc. Les palmeraies
présentent une végétation un peu dense par apport aux
milieux cultivés, moins de plantes herbacées, et strate
arboricole plus importantes. Toutes ces caractéristiques vont
crée un microclimat humide qui favorise les Orthoptères
hygrophiles telles que Phaneroptera nana, Conocephalus
fuscus, Paratettix meridionalis, Omocestus africanus,
Omocestus lucasii et l'espèce arboricole Anacridium
aegyptium.
III.9. Cycle biologique des principales espèces
Acridiennes de la vallée du M'Zab
Les stades de développement des criquets comprennent
l'oeuf, la larve et l'adulte. Chaque individu progresse à travers ces
étapes dans l'ordre présenté, mais la durée de
chaque étape et la période de l'année où se produit
une étape donnée varie selon les espèces (Capinera
& Sechrist, 1982). Plus une espèce est abondante par ses
effectifs et sa durée de présence, plus les conclusions
concernant son cycle biologique seront précises.
66
Résultats et Discussions
Nous rapportons ici les résultats d'une étude
d'un an sur la phénologie de 26 espèces d'Orthoptères
(Caelifères) communes de la vallée du M'Zab. Les
échantillonnages ont été réalisés une fois
par mois, pour la période s'étalant de janvier à
décembre 2018. Les données mensuelles sont établies
d'après la moyenne des relevés quantitatifs obtenus sans
distinction de milieu ce qui tend peut-être à étaler les
cycles ; mais les valeurs de densités obtenues, vont données un
approche mieux discutable. Pour chaque espèce étudiée, un
graphe est construit, il porte sur les densités larvaires et imaginales
reportées à 100 m2 et indique leur évolution
selon chaque mois de l'année. Les espèces rares présentes
dans les différents biotopes ne sont pas prises en considération,
car toutes les espèces évoquées dans l'étude du
cycle biologique avaient fait l'objet de présence à l'état
larvaire et imaginal durant leurs cycles de vie. Trois espèces n'ont
été vues qu'une ou deux fois dans les biotopes : Eunapiodes
sp., Calliptamus barbarus et Oedaleus senegalensis.
Selon Monard (1986), la présence de ces espèces
peut s'expliquer par la nature des biotopes adjacents, ou par leur
mobilité. Il ya aussi le cas des espèces observées
uniquement à l'état imaginal, aucune larve n'a été
observée ; C'est le cas d'Anacridium aegyptium, Locusta
migratoria, Schistocerca gregaria, Hyalorrhipis
calcarata, Sphingonotus obscuratus lameerei, Sphingonotus
octofasciatus, Sphingonotus pachecoi, Vosseleriana
fonti, Dericorys millierei, Omocestus africanus,
Omocestus lucasii, Ochrilidia filicornis, Heteracris
adspersa, Heteracris minuta, Tropidopola cylindrica et
Paratettix meridionalis. L'observation des criquets uniquement
à l'état imaginal est dû d'après Monard
(1986), à deux éventualités possibles : les oeufs
sont déposés en dehors de la zone prospectée et seuls les
imagos évoluent dans le biotope, le reste du cycle biologique
s'effectuant dans des milieux adjacents ; le comportement des larves
diffère énormément de celui des imagos et elles
passeraient totalement inaperçues. Les résultats obtenus peuvent
être présentés en fonction du nombre de
générations et le type d'arrêt de développement
(Gillon, 1974 ; Lecoq, 1978 ; Squitier & Capinera, 2002 ;
Bounechada et al., 2006 ; Moussi, 2012). Les photos des
spécimens d'Acridiens utilisées dans cette partie proviennent de
la collection du muséum de Paris (Louveaux et al.,
2019).
III.9.1. Espèces à une seule
génération annuelle
Une génération acridienne correspond à la
succession des états qui relie un oeuf de la génération
parentale à un oeuf de la génération fille (Lecoq,
2010). Plus de tiers (38.46%) des d'espèces de
Caelifères dont le type de cycle a pu être établi ont une
génération annuelle. D'après nos observations sur le
terrain et les courbes des fluctuations de densité des imagos et
67
Résultats et Discussions
des larves des Orthoptères étudiés, on
peut diviser ces espèces univoltines en trois catégories : les
espèces Printanières, les espèces Estivales et les
espèces de l'Eté-Automne.
III.9.1.1. Espèces
Printanières
Les espèces qui caractérise cette
catégorie sont Notopleura saharica, Tenuitarsus
angustus, Tmethis cisti et Tuarega insignis (Figure 16).
Le pic de la densité des larves a été enregistré en
février pour Notopleura saharica, Tenuitarsus
angustus, et Tmethis cisti ; et en mars pour Tuarega
insignis. Les premiers adultes ont été capturés entre
février et juin pour ces insectes. On a observé un accouplement
de Notopleura saharica en fin juin. Les premières
éclosions auront lieu probablement avec les premières pluies de
l'automne ; cela s'explique par l'enregistrement de larves à partir
d'octobre pour Notopleura saharica. Ces Acrididae passent
l'hiver en diapause larvaire. Ces résultats sont en accord avec ceux de
Moussi (2012) dans la région de Biskra. La même
observation a été réalisée pour Tmethis cisti
dans la région de Djelfa par Khadraoui & Ouanouki
(2001).
III.9.1.2. Espèces Estivales
De juin à septembre les fluctuations de la
densité imaginale de Sphingoderus carinatus, Sphingonotus
azurescens, Sphingonotus savignyi et Sphingonotus paradoxus
sont importantes. On note des pics de densité des adultes durant
l'Eté chez les quatre Oedipodinae. Pour chaque Acridien la
densité des larves augmente brutalement en mai et redescend.
Probablement l'éclosion s'effectue au mois d'avril et
les premiers imagos s'observent à partir du mois de juin à
juillet. La densité des adultes ces espèces décroît
à partir de septembre et s'annule en Hiver (Figure 17).
Cet ensemble de faits nos amènent à noter que
Sphingoderus carinatus, Sphingonotus azurescens,
Sphingonotus savignyi et Sphingonotus paradoxus sont des
espèces d'Eté à une seule génération
annuelle et à diapause embryonnaire. Cette conclusion relative à
la phénologie de Sphingoderus carinatus et Sphingonotus
savignyi correspond aux observations réalisées par
Moussi (2012).
68
Résultats et Discussions

Figure 16. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces
Printanières :
a) Notopleura saharica,
b) Tenuitarsus angustus, c)
Tmethis cisti
et d) Tuarega insignis de
la vallée du M'Zab
69
Résultats et Discussions

Figure 17. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces Estivales
:
a) Sphingoderus carinatus, b)
Sphingonotus azurescens, c) Sphingonotus
savignyi
et d) Sphingonotus paradoxus de la
vallée du M'Zab.

70
Résultats et Discussions
III.9.1.3. Espèces de
l'Eté-Automne
La densité imaginale d'Hilethera aeolopoides
augmente rapidement pour atteindre son maximum vers juillet et août
; elle décroit ensuite pour s'annuler vers novembre (Figure 18). La
durée de présence larvaire de cet Oedipodinae est courte, puisque
les larves sont observées uniquement d'avril à juin. La
densité des larves atteint son pic vers mai. Cette conclusion relative
aux périodes d'Hilethera aeolopoides ne correspond pas aux
observations réalisées par Moussi (2012). Cet
auteur indique en effet qu'Hilethera aeolopoides présente trois
générations par an dans la région de Biskra. Il note que
les adultes et les larves de cet Orthoptère sont présents
pratiquement toute l'année.
Figure 18. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces de
l'Eté-
Automne : a) Hilethera aeolopoides,
b) Ochrilidia harterti de la vallée du
M'Zab.
Les premiers imagos, identifiés comme appartenant
à l'espèce Ochrilidia harterti, apparaissent le mois de
juin ; pour atteindre un pic de densité des imagos vers septembre. Le
développement larvaire de cette espèce dure de mai à
août. Les éclosions des oeufs de ces deux Caelifères ont
lieu donc beaucoup plus tard que dans la majorité des cas. On peut
penser qu'Hilethera aeolopoides et Ochrilidia harterti
présentent une seule génération d'Eté-Automne
à diapause larvaire longue.
71
Résultats et Discussions
III.9.2. Espèces à deux
générations annuelles
Les espèces à deux générations
annuelles représentent (42.3%), soit 11 espèces de l'ensemble des
Orthoptères dont le cycle phénologique a été
étudié.
III.9.2.1. Espèces à deux
générations annuelles avec reproduction continue
Aiolopus puissanti, Aiolopus strepens et
Morphacris fasciata se caractérisent par la présence de
deux pics de densité larvaire et imaginale ; les adultes et les larves
de ces Acridiens ont été capturés toute au long de
l'année. (Figure 19).

Figure 19. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à
deux
générations annuelles avec reproduction continue :
a) Aiolopus puissanti, b)
Aiolopus
strepens et c) Morphacris
fasciata de la vallée du M'Zab.
72
Résultats et Discussions
L'étude de l'évolution de la densité des
larves et des adultes des populations d'Aiolopus puissanti,
Aiolopus strepens et Morphacris fasciata montre que ces trois
Oedipodinae sont bivoltines. La reproduction de ces Caelifères semble
continue.
D'après les travaux de Hamdi (1989)
dans la région médio-septentrionale de l'Algérie,
de Benrima (1990) dans la région de Koléa de
Guecioueur (1990) dans la région de Lakhdaria, de
Fellaouine (1989) dans la région de Sétif de
Zergoun (1991,1994) et de Douadi (1992) dans
la région de Ghardaïa ; Aiolopus strepens est
présente à l'état adulte pendant presque toute
l'année. Les larves quant à elles commencent a apparaître
au mois d'avril. Ces auteurs notent que Aiolopus strepens
présente une seule génération annuelle et passe
l`hiver à l'état imaginal. Dans la zone soudanienne de la
région de Saria, Burkina Faso ; Morphacris fasciata
présente une reproduction continue, avec trois
générations par an (Lecoq, 1978).
III.9.2.2. Espèces à deux
générations annuelles à hivernation larvaire
Les courbes d'évolution des densités imaginales
et larvaires d'Acrotylus longipes, Aiolopus simulatrix,
Heteracris annulosus, Heteracris littoralis, Heteracris
harterti et Truxalis nasuta présentent deux maximums au
cours de l'année (Figure 20).
Les six Orthoptères continuent cependant à
être épisodiquement capturés à l'état
larvaire au cours de la période hivernale. On peut penser que ces
Acrididae présentent deux générations par an,
avec une diapause larvaire pendant l'hiver.
C'est effectivement ce qu'observe Moussi (2012)
à Biskra pour Acrotylus longipes, Heteracris
annulosus et Truxalis nasuta.
A Sétif comme à Lakhdaria, Truxalis nasuta
présente une seule génération annuelle
(Fellaouine, 1989 ; Guecioueur. 1990). Dans la région
de Ghardaïa, selon Zergoun (1991) et Babaz
(1992), Truxalis nasuta est univoltine avec une diapause
larvaire automno-hivernale.
73
Résultats et Discussions
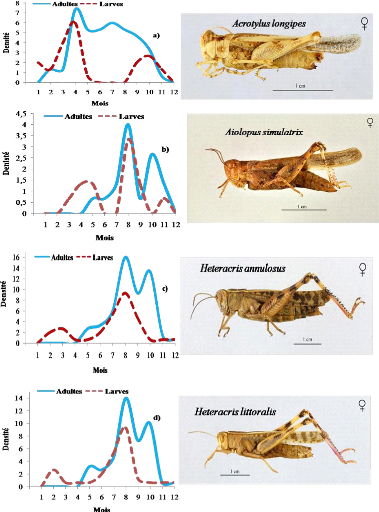
74
Résultats et Discussions
Figure 20. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à
deux
générations annuelles à hivernation larvaire :
a) Acrotylus longipes, b)
Aiolopus simulatrix, c)
Heteracris
annulosus, d) Heteracris littoralis,
e) Heteracris harterti
et f)
Truxalis nasuta de la vallée du M'Zab.
III.9.2.3. Espèces à deux
générations annuelles à hivernation
embryonnaire
Les densités larvaires sont maximales pendant avril et
août pour Sphingonotus rubescens. Cet Oedipodinae apparaît
sous forme d'imagos à partir de mai jusqu'à décembre. Il
semble que la deuxième génération de cet Acridien
dépose leurs oeufs dans le sol vers la fin d'Automne. Les
densités larvaires et imaginales d'Ochrilidia geniculata
présentent deux pics. Les densités larvaires et imaginales
de Sphingonotus rubescens et Ochrilidia geniculata s'annulent
en hiver (Figure 21). Les observations du cycle de Sphingonotus rubescens
et Ochrilidia geniculata dans la vallée du M'Zab montre
que ces criquets présentent deux générations par an et
passent l'hiver en diapause embryonnaire. Nos résultats sont en accord
avec ceux de Moussi (2012). A Sétif
(Fellaouine, 1989) et à Ghardaïa (Babaz,
1992) notent que Sphingonotus rubescens présente une
seule génération par an avec une diapause embryonnaire
automno-hivernale. Zergoun (1991,1994), montre que cet
Oedipodinae présente une seule génération annuelle et
hiverne à l'état embryonnaire.
75
Résultats et Discussions

Figure 21. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à deux
générations annuelle à hivernation embryonnaire :
a) Ochrilidia geniculata et b)
Sphingonotus rubescens, de la vallée du M'Zab.
III.9.3. Espèces à trois
générations annuelles
A part Acrida turrita, les effectifs d'Acrotylus
patruelis, Pyrgomorpha cognata, Pyrgomorpha conica et
Ochrilidia gracilis sont élevés ; elles constituent
alors une part importante du peuplement de la vallée du M'Zab. On
observe chez ces cinq Orthoptères trois pics de densités durant
l'année, aussi bien pour les larves que pour les imagos (Figure 22). Le
résultat obtenu semble bien confirmer l'existence de trois
générations par an chez ces cinq Acrididae. En zone sahélo
soudanienne, Acrotylus patruelis présente trois
génération par an complétée par une diapause
imaginale en saison sèche (Launois et al.,
1996). Ould-El-Hadj (2004) à Ouargla et
Moussi (2012) à Biskra confirment nos résultats
de Pyrgomorpha cognata et Pyrgomorpha conica. Les
résultats de Guendouz-Benrima et al., (2011)
dans la plaine de Mitidja et ceux de Moussi à Biskra sont en
accord avec nos observations pour trois générations par an chez
Acrida turrita. De même pour Acrotylus patruelis
(Ould El Hadj, 2004 ; Guendouz-Benrima et al., 2011 ;
Moussi, 2012) soutiennent notre hypothèse.
76
Résultats et Discussions

Figure 22. Evolution mensuelle des
densités larvaires et d'adultes pour les espèces à trois
générations annuelles : a) Acrotylus
patruelis, b) Acrida turrita,
c) Pyrgomorpha cognata, d)
Pyrgomorpha conica et e) Ochrilidia gracilis
de la vallée du M'Zab.
77
Résultats et Discussions
Par contre chez Ochrilidia gracilis, Zergoun
(1991) et Babaz (1992), notent que dans la
région de Ghardaïa, les adultes de ce Gomphocerinae sont
présents Jusqu'en novembre puis ils disparaissent durant l'hiver, pour
réapparaître à nouveau au printemps. Selon ces auteurs
l'espèce hiverne à l'état larvaire et possède une
génération annuelle.
III.10. Etude qualitative et quantitative du
régime alimentaire des principales espèces Acridiennes de la
vallée du M'Zab.
La quantité et la qualité de l'alimentation
influencent considérablement les caractéristiques de croissance
des populations acridiennes. La natalité, la mortalité et
à la limite la dispersion, en sont effectuées (Duranton
et al., 1982). Les insectes qui se nourrissent sur une ou
quelques plantes étroitement apparentées sont appelées
monophages. Les insectes oligophages se nourrissent d'un certain nombre
d'espèces végétales, toutes appartenant à
même famille de plantes. Les insectes polyphage semblent exercer peu de
choix et accepter beaucoup de plantes appartenant à différentes
familles (Schoonhoven et al., 2005). Environ 60% de
toutes les espèces d'Acridiens connues sont polyphages et 25% sont
graminivores, mais peu d'espèces sont classés comme monophages
(Picaud et al., 2003). D'après Le Gall
(1989), l'herbivore monophage ne consomme qu'une seule espèce
végétale, voire quelques espèces très proches d'un
même genre. Les espèces oligophages sont celles dont le spectre
trophique est limité à un genre ou à une famille
végétale donnée. Le polyphage est un acridien dont le
régime concerne différentes espèces issues de plusieurs
familles végétales.
Les objectifs assignés à cette étude sont
d'une part de combler le manque d'études relatives aux régimes
alimentaires de ces Acridiens dans notre région d'étude, et
d'autre part, de vérifier est ce que l'abondance de ces
Caelifères dans les milieux cultivés causera des
dégâts aux cultures, ou s'attaquants uniquement aux plantes
adventices.
Nous allons étudier le régime alimentaire de
sept espèces acridiennes abondantes dans le milieu cultivé
à savoir : Aiolopus strepens (Latreille, 1804), Acrotylus
patruelis (Herrich-Schäffer, 1838), Morphacris fasciata
(Thunberg, 1815), Acrida turrita (Linnaeus, 1758), Heteracris
annulosa Walker, 1870, Ochrilidia gracilis (Krauss, 1902) et
Pyrgomorpha cognata Krauss (1877). L'ensemble des ces espèces
sont récoltées dans le milieu cultivé (Touzouz) entre 2017
et 2018, durant les mois allant de mai à octobre. Pour chacune de ces
espèces acridiennes nous avons choisi 25 mâles et 25 femelles,
soit un total de 350 individus. L'étude du régime alimentaire des
principales Acridiens a été faite en se basant sur l'analyse
comparative d'une épidermothèque de référence des
espèces végétales présentent dans le
78
Résultats et Discussions
milieu cultivé avec celles trouvées dans les
fèces des différents Caelifères. La détermination
du régime alimentaire, par la méthode de l'analyse microscopique
du contenu des fèces est la plus objective par rapport à l'examen
des contenus du tube digestif du faite qu'elle ne perturbe pas
l'équilibre démographique des populations.
Une étude qualitative du régime alimentaire des
principales espèces Acridiennes a été
réalisée selon la méthode classique des fréquences,
et complétée par une estimation quantitative des plantes
ingérées par la méthode dite de la « fenêtre
». Sur la base de celle-ci, un indice d'attraction pour chaque
espèce végétale a été calculé
à partir des surfaces foliaires ingérées par chaque
individu.
III.10.1. Etude qualitative de la consommation chez
les imagos des principales espèces Acridiennes dans le milieu
cultivé (Touzouz).
Pour exprimer les résultats d'analyses des
espèces végétales présentes dans les fèces
nous avons calculé la fréquence relative proposée par
Le Gall & Gillon (1989). C'est le rapport entre le nombre
de fois où des fragments d'une espèce végétal sont
observés dans les fèces de l'espèce Acridienne sur le
nombre total des fragments végétaux toutes espèces
confondus observés dans les fèces de l'espèce
d'Orthoptère considérée. Le calcul des fréquences
relatives des épidermes des espèces végétales
observés dans les fèces des sept Orthoptères sont
consignés dans le Tableau 26 ci-dessous.
L'analyse des fèces de 350 individus de sept
espèces de Caelifères : Acrotylus patruelis,
Ochrilidia gracilis, Aiolopus strepens, Pyrgomorpha
cognata, Heteracris annulosa, Acrida turrita et
Morphacris fasciata, montre que ces espèces consomment 22
espèces végétales parmi les 30 présentes dans la
station d'étude, ce qui représente un taux d'exploitation de la
niche trophique de 73,3 % (Photos 4).
Cependant, l'analyse de leur spectre alimentaire, montre que
sur les 30 espèces présentes dans leur habitat, sept n'ont pas
été ingérées par ces Acrididae. Les
Orthoptères analysés ont consommés 12 familles de plantes
sur les 15 présentes dans le biotope, soit 80 %. Les Poaceae sont les
mieux représentées avec huit plantes, soit 34,8. Sur les 22
plantes consommées, il n'existe pas de différence notable entre
mâles est femelles pour la fréquence des espèces
végétales dans les fèces des sept Acridiens
étudiés. Les seules différences sont notées chez
Acrotylus patruelis où les mâles n'ont pas
ingérés Tribulus terrestris et Rumex vesicarius
; de même les mâles de Morphacris fasciata n'ont pas
consommés Sonchus oleraceus et les femelles n'ont pas
utilisés Convolvulus arvensis.
79
Résultats et Discussions
Tableau 26. Fréquence (%) des
espèces végétales présentes dans les fèces
des sept espèces Acridiennes dans le milieu cultivé (Touzouz)
|
Espèces
|
ACP
|
OCG
|
AIS
|
PYC
|
HEA
|
ACT
|
MOF
|
|
Vitis vinifera
|
-
|
-
|
4,21
|
-
|
-
|
-
|
-
|
|
Lagenaria siceraria
|
-
|
-
|
-
|
16,74
|
22,61
|
-
|
-
|
|
Cucurbita maxima
|
-
|
-
|
-
|
17,6
|
11,56
|
-
|
-
|
|
Cucumis melo
|
-
|
-
|
-
|
-
|
9,04
|
-
|
-
|
|
Capsicum annuum
|
-
|
-
|
-
|
6,44
|
6,03
|
-
|
-
|
|
Solanum melongena
|
-
|
-
|
-
|
15,45
|
18,59
|
-
|
-
|
|
Solanum lycopersicum
|
-
|
-
|
-
|
16,31
|
13,06
|
-
|
-
|
|
Mentha pulegium
|
-
|
-
|
5,26
|
18,45
|
5,02
|
-
|
-
|
|
Cynodon dactylon
|
27,98
|
30,07
|
33,68
|
9,01
|
6,03
|
29,79
|
29,6
|
|
Setaria verticillata
|
20,83
|
22,88
|
14,74
|
-
|
8,04
|
26,24
|
22,37
|
|
Polypogon monspeliensis
|
13,09
|
16,34
|
11,58
|
-
|
-
|
16,31
|
21,05
|
|
Digitaria commutata
|
-
|
9,80
|
-
|
-
|
-
|
-
|
-
|
|
Anisantha sterilis
|
11,9
|
14,38
|
-
|
-
|
-
|
12,76
|
16,45
|
|
Hordeum murinum
|
-
|
6,54
|
-
|
-
|
-
|
-
|
-
|
|
Phragmites australis
|
-
|
-
|
10,53
|
-
|
-
|
14,89
|
-
|
|
Cyperus rotundus
|
8,93
|
-
|
13,68
|
-
|
-
|
-
|
-
|
|
Sonchus oleraceus
|
3,57
|
-
|
6,31
|
-
|
-
|
-
|
5,92
|
|
Convolvulus arvensis
|
-
|
-
|
-
|
-
|
-
|
-
|
4,61
|
|
Amaranthus hybridus
|
4,76
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Tribulus terrestris
|
1,78
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Rumex vesicarius
|
4,17
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Malva parviflora
|
2,98
|
-
|
-
|
-
|
-
|
-
|
-
|
|
22
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
ACP : Acrotylus patruelis ;
OCG : Ochrilidia gracilis ; AIS :
Aiolopus strepens ; PYC : Pyrgomorpha cognata
; HEA : Heteracris annulosa ;
ACT : Acrida turrita ; MOF : Morphacris
fasciata ; (-) : Espèce absente.
Dix plantes ont été consommées par
Acrotylus patruelis, soit 33,3 % des végétaux
présents dans le site d'étude. Les espèces les plus
consommées par cet Oedipodinae sont Cynodon dactylon, Setaria
verticillata et Polypogon monspeliensis. En deuxième
position on retrouve Heteracris annulosa avec neuf espèces
végétales consommées. Cet Orthoptère a
ingéré trois Cucurbitaceae, trois Solanaceae, deux
Poaceae et une Lamiaceae. La plante la plus préférée par
cet insecte est Lagenaria siceraria, avec une présence dans les
fèces de 22,6 %. Les Poaceae représentées par Setaria
verticillata (8 %) et Cynodon dactylon (6 %) sont faiblement
fréquentes dans les fèces de cet Acridien. Aiolopus strepens a
consommé huit plantes. Cynodon dactylon est la plus
ingérées par ce Caelifère, avec un taux de 33,7 %. Cet
insecte a fait l'exception de s'alimenter de Vitis vinifera, mais avec
une présence faible dans les fèces de 4,2 %. Pyrgomorpha
cognata a prélevée sept espèces
végétales. Mentha pulegium est la plus fréquente
dans les fèces de ce criquet. A part Cucumis melo et
Setaria verticillata qui n'ont pas été consommées
par cet Acridien, ce Pyrgomorphinae présente presque le même
spectre alimentaire qu'Heteracris annulosa. Six végétaux
ont été
80
Résultats et Discussions
consommés par Morphacris fasciata. Cet
Oedipodinae a ingéré quatre Poaceae, une Asteraceae et une
Convolvulaceae. L'espèce la plus fréquente dans les fèces
de cet insecte est Cynodon dactylon, avec un taux de 29,6 %. Parmi les
15 familles végétales présentent dans le biotope,
Ochrilidia gracilis a utilisé que les Poaceae. Les plantes
rencontrées dans les fèces de ce Gomphocerinae sont : Cynodon
dactylon (30,1 %), Setaria verticillata (22,9 %), Polypogon
monspeliensis (16,3 %), Anisantha sterilis (14,4 %),
Digitaria commutata (9,8 %) et Hordeum murinum (6,5 %).
Même cas pour Acrida turrita, où on note sa
préférence unique pour la famille des Poaceae. En effet cet
Acridinae a ingéré Cinq Poaceae qui sont : Cynodon
dactylon (29,8 %), Setaria verticillata (26,2 %), Polypogon
monspeliensis (16,3%), Phragmites australis (14,9 %) et
Anisantha sterilis (12,8 %).
Photos 4. Epidermes des principales
espèces végétales trouvées dans les fèces
des Acridiens
Cependant, l'analyse du spectre alimentaire de cinq
Acrididae de la cuvette d'Ouargla a montrée que sur les 28
espèces présentes dans leur habitat, 20 espèces
végétales ont été consommées par ces
sautériaux (Ould Elhadj, 2001). Les vingt deux plantes
ingérées par les sept Orthoptères se distribuent entre
huit Poaceae, trois Cucurbitaceae, trois Solanaceae, une
Vitaceae, une Cyperaceae, une Lamiaceae, une Asteraceae, une Convolvulaceae,
une Amaranthaceae, une Zygophyllaceae, une Polygonaceae et une Malvaceae. Les
Acridiens analysés ont utilisés au moins une Poaceae. Il
s'avère que sur les sept espèces Acridiennes
étudiées, trois espèces montrent une
préférence marquée pour les Poaceae c'est le cas de
Aiolopus strepens, Morphacris fasciata et Acrotylus
patruelis. Au vu de la fréquence des épidermes des
espèces végétales dans les fèces des sept
Caelifères, chaque espèce présente
81
Résultats et Discussions
une utilisation alimentaire caractérisée par le
choix des plantes ingérées. Acrotylus patruelis est
l'Acridien qui a ingéré plus d'espèces
végétales. En effet sur les 22 végétaux
consommés, cet Oedipodinae a utilisé 10 espèces
végétales. On peut qualifier cette espèce de Polyphage ou
d'insecte à régime alimentaire mixte. Ce criquet a
ingéré sept familles végétales différentes.
Malgré la polyphagie d'Acrotylus patruelis, ce dernier montre
une préférence marqué pour les graminées.
Zergoun (1994), dans la région de Béni Isguen
note qu'Acrotylus patruelis consomme 7 espèces
végétales parmi les 20 présentes dans la station
d'étude. Hamdi (1992), dans les dunes fixées du
littoral algérois signale qu'Acrotylus patruelis
présente le spectre alimentaire le plus restreint en espèces
végétales parmi les acridiens étudiés. Neufs
espèces végétales ont été consommées
par cet Oedipodinae, soit 15% de l'ensemble des espèces
inventoriées dans la station d'étude. Dans la cuvette d'Ouargla
Acrotylus patruelis a utilisé 14 végétaux sur 28
plantes de la station d'étude (Ould Elhadj, 2001). En
Afrique soudano-sahélienne, Acrotylus patruelis a
été signalée comme une espèce à
régime alimentaire mixte (Launois-Luong & Lecoq,
1989). Heteracris annulosa a consommé neuf plantes
appartenant à quatre familles végétales, avec une
préférence nette envers les Cucurbitaceae et Solanaceae. Cet
Eyprepocnemidinae présente un régime alimentaire mixte qu'on peut
qualifier de polyphage à tendance non graminivore. Aiolopus strepens
a préféré huit plantes dont cinq Poaceae, une
Vitaceae, une Cyperaceae et une Asteraceae. Malgré la polyphagie de cet
Oedipodinae, il présente une tendance vers la consommation des
graminées. Dans la région de Tlemcen, cet Acrididae a
consommé uniquement 6 espèces végétales sur 37
végétaux présents dans l'aire échantillonnée
(Medane, 2013). Pyrgomorpha cognata a
ingéré les mêmes espèces végétales
qu'Heteracris annulosa à l'exception de Setaria
verticillata et Cucumis melo. Ce Pyrgomorphinae est polyphage
avec une certaine préférence pour Mentha pulegium. Cet
Acridien a ingéré une seul Poaceae avec une faible
fréquence ce qui indique que cet insecte est non graminivore. Dans la
région d'Ouargla, Pyrgomorpha cognata a utilisé 42,9%,
des plantes de la station d'étude (Ould Elhadj, 2001).
Morphacris fasciata a consommée six plantes, dont quatre
Poaceae, une Asteraceae et une Convolvulaceae. Cet Oedipodinae présente
une très grande préférence pour les graminées. Ce
Caelifère présente un régime alimentaire polyphage avec
une tendance très marqués envers les graminées.
Ochrilidia gracilis a ingérée six Poaceae. Ce
Gomphocerinae a une préférence seulement pour les
graminées. A la lumière de ce résultat, on peut qualifier
cet Acridien d'oligophage. La même constatation est faite pour Acrida
turrita, cet Acridinae a consommée seulement quatre Poaceae.
Fahim (2011) note qu'au Maroc, Acrida turrita se
nourrit exclusivement des graminées. Ce résultat est en accord
avec celui obtenu par Benrima (1993)
82
Résultats et Discussions
dans la région de Mitidja. On distingue des Acridiens
phytophiles telles que Ochrilidia gracilis, Heteracris annulosa
et Pyrgomorpha cognata. D'autres espèces sont
géophiles c'est le cas d'Acrotylus patruelis, Morphacris
fasciata et un peu moins pour Aiolopus strepens et Acrida
turrita.
III.10.2. Etude quantitative de la consommation chez
les imagos des principales espèces Acridiennes dans le milieu
cultivé (Touzouz)
Nous parton de l'hypothèse que le recouvrement global
des espèces végétales présentes dans le transect
est le même à la même époque pour les deux
années d'étude, les quantités d'épidermes
végétaux rejetés dans les excréments sont
proportionnelles à celle ingérées, on admet aussi comme
hypothèse de travail que les coefficients de digestibilité des
différentes espèces végétales consommées
sont égaux et une espèce végétale est plus ou moins
consommée aussi bien par les mâles que par les femelles. De plus
chez les Orthoptères, la taille des femelles est supérieure
à celle des mâles, la biomasse végétale
consommée sera automatiquement proportionnelle à la taille des
individus.
III.10.2.1. Acrotylus patruelis
Les résultats l'étude quantitative de la
consommation chez les imagos d'Acrotylus patruelis sont
consignés dans le Tableau 27.
Il est à constater que Cynodon dactylon est
l'espèce végétale la plus consommée par apport aux
autres plantes. Elle présente un taux de consommation de 36,2 %. Cela
est dû probablement au taux de recouvrement élevé (4,9 %)
de cette graminée.
Tableau 27. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Acrotylus patruelis en milieu
cultivé de Touzouz
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
138,4
|
36,24
|
7,38
|
|
Setaria verticillata
|
3,43
|
98,2
|
25,71
|
7,49
|
|
Polypogon monspeliensis
|
1,08
|
48,6
|
12,73
|
11,78
|
|
Anisantha sterilis
|
0,29
|
35,5
|
9,30
|
32,07
|
|
Cyperus rotundus
|
0,39
|
22,4
|
5,86
|
15,02
|
|
Sonchus oleraceus
|
0,35
|
9,7
|
2,54
|
7,26
|
|
Amaranthus hybridus
|
0,34
|
11,3
|
2,96
|
8,7
|
|
Tribulus terrestris
|
0,31
|
3,5
|
0,92
|
2,97
|
|
Rumex vesicarius
|
0,49
|
6,8
|
1,78
|
3,63
|
|
Malva parviflora
|
0,21
|
7,5
|
1,96
|
9,33
|
|
Total = 10
|
11,8
|
381,9
|
100
|
105,63
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction
83
Résultats et Discussions
A part les Poaceae, toutes les autres familles notent un taux
de consommation faible. L'espèce végétale la moins
consommée est Tribulus terrestris (0,9 %). Sur les quatre
Poaceae consommées par cet Acridien, Cynodon dactylon
présente l'indice d'attraction le plus faible (7,4). En revanche
Anisantha sterilis présente l'indice d'attraction le plus
élevé (32,1), malgré son taux de consommation
réduit (9,3 %) et le faible taux de recouvrement (0,3) (Figure 23).

Figure 23. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par
Acrotylus patruelis et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz
III.10.2.2. Heteracris annulosa
Les résultats l'étude quantitative de la
consommation chez les imagos d'Heteracris annulosa sont
consignés dans le Tableau 28
Tableau 28. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Heteracris annulosa en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Lagenaria siceraria
|
2,39
|
116,6
|
17,9
|
7,49
|
|
Cucurbita maxima
|
2,26
|
105,3
|
16,16
|
7,15
|
|
Cucumis melo
|
2,21
|
89,9
|
13,8
|
6,24
|
|
Capsicum annuum
|
2,54
|
53,4
|
8,2
|
3,23
|
|
Solanum melongena
|
2,26
|
107,2
|
16,45
|
7,28
|
|
Solanum lycopersicum
|
2,26
|
96,5
|
14,81
|
6,55
|
|
Mentha pulegium
|
2,51
|
29,3
|
4,5
|
1,79
|
|
Cynodon dactylon
|
4,91
|
25,7
|
3,94
|
0,8
|
|
Setaria verticillata
|
3,43
|
27,6
|
4,24
|
1,24
|
|
9
|
24,77
|
651,5
|
100
|
41,77
|
RG : Recouvrement global ; S :
surface moyenne ; T : taux de consommation ; IA
: indice d'attraction
Le taux de consommation chez Heteracris annulosa marque
une tendance pour Lagenaria siceraria (17,9 %), Solanum melongena
(16,45 %) et Cucurbita maxima (16,2 %).
84
Résultats et Discussions
Figure 24. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Heteracris annulosa et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz. Ces plantes ont respectivement presque le
même taux de recouvrement 2,4, 2,3 et 2,3 et indice d'attraction 7,5,
7,1, et 7,3. Le taux de consommation le plus faible est noté chez
Cynodon dactylon (3,9), de même pour l'indice d'attraction (0,8)
(Figure 24).
III.10.2.3. Aiolopus strepens
Les résultats l'étude quantitative de la
consommation chez les imagos d'Aiolopus strepens sont consignés
dans le Tableau 29.
Tableau 29. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus de Aiolopus strepens en milieu
cultivé de Touzouz.
|
Espèces
|
RG(%)
|
S (mm)
|
T
|
IA
|
|
Vitis vinifera
|
4,24
|
9,12
|
2,3
|
0,54
|
|
Mentha pulegium
|
2,51
|
12,75
|
3,22
|
1,28
|
|
Cynodon dactylon
|
4,91
|
120,42
|
30,42
|
6,19
|
|
Setaria verticillata
|
3,43
|
87,04
|
21,99
|
6,41
|
|
Polypogon monspeliensis
|
1,08
|
77,15
|
19,49
|
18,05
|
|
Phragmites australis
|
0,78
|
44,63
|
11,27
|
14,49
|
|
Cyperus rotundus
|
0,39
|
34,25
|
8,65
|
22,18
|
|
Sonchus oleraceus
|
0,35
|
10,53
|
2,66
|
7,6
|
|
Total 8
|
17,69
|
395,89
|
100
|
76,74
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction
Aiolopus strepens présent le meilleur taux de
consommation pour trois Poaceae : Cynodon dactylon (30,4 %),
Setaria verticillata (22 %) et Polypogon monspeliensis (19,5
%). Le taux de consommation le plus faible est enregistré par Vitis
vinifera (2,3 %). Malgré leur taux de consommation important,
Cynodon dactylon et Setaria verticillata présentent
respectivement
85
Résultats et Discussions
un indice d'attraction faible (6,2) et (6,4) chez cet
Acridien. Le recouvrement végétal le plus important est
enregistré chez Cynodon dactylon (4,9 %) et Vitis vinifera
(4,2 %). Sonchus oleraceus note le recouvrement
végétal le plus faible (0,35 %). L'indice d'attraction le plus
fort est marqué chez Cyperus rotundus (22,2), malgré son
taux de consommation faible (8,65) (Figure 25).

Figure 25. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Aiolopus strepens et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz.
III.10.2.4. Pyrgomorpha cognata
Les résultats l'étude quantitative de la
consommation chez les imagos de Pyrgomorpha cognata sont
consignés dans le Tableau 30.
Tableau 30. Recouvrement global (RG), surface
moyenne (S), taux de consommation (T) et indice d'attraction (IA) des plantes
consommées par 50 individus de Pyrgomorpha cognata en milieu
cultivé de Touzouz
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Lagenaria siceraria
|
2,39
|
36,5
|
10,83
|
4,53
|
|
Cucurbita maxima
|
2,26
|
40,8
|
12,11
|
5,36
|
|
Capsicum annuum
|
2,54
|
11,5
|
3,41
|
1,34
|
|
Solanum melongena
|
2,26
|
43,6
|
12,94
|
5,73
|
|
Solanum lycopersicum
|
2,26
|
65,3
|
19,38
|
8,58
|
|
Mentha pulegium
|
2,51
|
90,5
|
26,86
|
10,70
|
|
Cynodon dactylon
|
4,91
|
48,7
|
14,46
|
2,95
|
|
7
|
19,13
|
336,9
|
100
|
39,18
|
RG : Recouvrement global ; S :
surface moyenne ; T : taux de consommation ; IA
: indice d'attraction Chez Pyrgomorpha cognata, le taux de
consommation et l'indice d'attraction sont respectivement important pour
Mentha pulegium (26,9 %) et (10,7) et Solanum lycopersicum
(19,4 %) et (8,6). La plus faible valeur du taux de consommation est
notée chez
86
Résultats et Discussions
Capsicum annuum (3,4 %), de même pour l'indice
d'attraction où on enregistre un chiffre de (1,3). Cynodon dactylon
marque un indice d'attraction consommée faible (2,95),
malgré son taux de recouvrement (4,9 %) important par apport aux autres
plantes (Figure26).
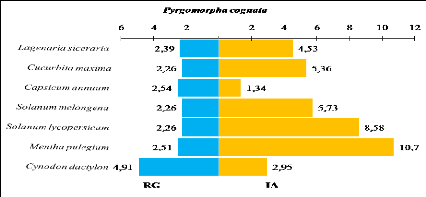
Figure 26. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Pyrgomorpha cognata et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz.
III.10.2.5. Morphacris fasciata
Les résultats l'étude quantitative de la
consommation chez les imagos de Morphacris fasciata sont
consignés dans le Tableau 31.
Tableau 31. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus de Morphacris fasciata en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
112,4
|
32,7
|
6,66
|
|
Setaria verticillata
|
3,43
|
87,5
|
25,46
|
7,42
|
|
Polypogon monspeliensis
|
1,08
|
65,7
|
19,11
|
17,69
|
|
Anisantha sterilis
|
0,29
|
47,2
|
13,73
|
47,34
|
|
Sonchus oleraceus
|
0,35
|
17,5
|
5,09
|
14,54
|
|
Convolvulus arvensis
|
0,28
|
13,4
|
3,9
|
13,93
|
|
6
|
10,34
|
343,7
|
100
|
107,58
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction Morphacris fasciata n'est
pas attirée par Cynodon dactylon (6,7) et Setaria
verticillata (7,4), mais leur taux de consommation respective (32,7 %) et
(25,5 %) est important. Anisantha sterilis marque l'indice
d'attraction le plus élevé (47,3), malgré son taux de
recouvrement faible (0,30 %). Les plantes les moins consommées sont
Sonchus oleraceus (5,1 %) et Convolvulus arvensis (3,9 %),
alors que leurs indice d'attraction est respectivement (14,5) et (13,9) le
double des espèces végétales les plus consommées
(Figure 27).
87
Résultats et Discussions
Figure 27. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Morphacris fasciata et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz
III.10.2.6. Ochrilidia gracilis
Les résultats l'étude quantitative de la
consommation chez les imagos d'Ochrilidia gracilis sont
consignés dans le Tableau 32.
Tableau 32. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Ochrilidia gracilis en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
140,5
|
24,84
|
5,06
|
|
Setaria verticillata
|
3,43
|
117,3
|
20,74
|
6,05
|
|
Polypogon monspeliensis
|
1,08
|
98,5
|
17,42
|
16,13
|
|
Anisantha sterilis
|
0,29
|
78,3
|
13,84
|
47,72
|
|
Digitaria commutata
|
0,20
|
80,5
|
14,23
|
71,15
|
|
Hordeum murinum
|
0,39
|
50,5
|
8,93
|
22,90
|
|
6
|
10,3
|
565,6
|
100
|
169,01
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction Parmi les six Poaceae
consommées par Ochrilidia gracilis, on note un taux de
consommation élevé pour Cynodon dactylon (24,8 %) et
Setaria verticillata (20,7 %). Par contre l'indice d'attraction de ces
deux graminées est faible (5,1) et (6,05) et leurs taux de recouvrement
respective est plus élevé (4,9 %) et (3,4 %). Digitaria
commutata a un taux de recouvrement le plus faible parmi les
espèces végétales consommées par ce Gomphocerinae.
Cependant, cette graminée marque une valeur importante de (71,15) pour
l'indice d'attraction. Le faible taux de consommation est enregistré
chez Hordeum murinum (8,9 %) (Figure 28).
88
Résultats et Discussions
Figure 28. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Ochrilidia gracilis et leurs taux de recouvrement au niveau du
milieu cultivé Touzouz.
III.10.2.7. Acrida turrita
Les résultats l'étude quantitative de la
consommation chez les imagos de d'Acrida turrita sont consignés
dans le Tableau 33.
Tableau 33. Recouvrement global, surface
moyenne, taux de consommation et indice d'attraction des plantes
consommées par 50 individus d'Acrida turrita en milieu
cultivé de Touzouz.
|
Espèces
|
RG (%)
|
S (mm)
|
T (%)
|
IA
|
|
Cynodon dactylon
|
4,91
|
192,5
|
28,51
|
5,81
|
|
Setaria verticillata
|
3,43
|
168,6
|
24,97
|
7,28
|
|
Polypogon monspeliensis
|
1,08
|
112,5
|
16,66
|
15,43
|
|
Anisantha sterilis
|
0,29
|
106,3
|
15,75
|
54,31
|
|
Phragmites australis
|
0,78
|
95,2
|
14,1
|
18,08
|
|
5
|
10,49
|
675,1
|
100
|
100,91
|
RG : Recouvrement global ; S
: surface moyenne ; T : taux de consommation ;
IA : indice d'attraction
Le taux de consommation relativement important pour les cinq
Poaceae, mais avec une certaine tendance pour Cynodon dactylon (28,5
%) et Setaria verticillata (25 %). Par contre leurs indices
d'attraction sont respectivement les plus faibles (5,8) et (7,3). L'indice
d'attraction le plus important est enregistré chez Anisantha
sterilis (54,3). Le taux de recouvrement de cette graminée par
contre est le plus faible (0,3 %) (Figure 29).
89
Résultats et Discussions

Figure 29. Comparaison entre les indices
d'attraction des espèces végétales ingérées
par Acrida turrita et leurs taux de recouvrement au niveau du milieu
cultivé Touzouz.
Les résultats obtenus par l'étude quantitative
montrent qu'Acrotylus patruelis, Aiolopus strepens,
Morphacris fasciata, Ochrilidia gracilis et Acrida
turrita présentent un taux de consommation élevé pour
Cynodon dactylon. Par contre, l'indice d'attraction de cette Poaceae
est très faible pour les cinq Acridiens. Cependant les plantes les plus
ingérées ne sont pas forcément les plus
appétissantes. Nous avons montré aussi, que la plus part des
Acridiens ont consommées au moins une Poaceae, ce qui peut être
expliqué selon Singer & Stireman (2001) par
l'abondance de ces végétaux dans la nature. Ces résultats
semblent en accord avec ceux de Essakhi et al.,
(2015). De plus les graminées possèdent moins de
composés secondaires (pyrrolizidines, quinolizidines et tannins) que les
dicotylédones, qui sont généralement répulsifs pour
les acridiens (Capinera et al., 1997). D'autre part,
le bon équilibre en eau des plantes est un facteur essentiel de leurs
utilisations. Certes, un apport localisé d'eau d'irrigation, inscrit
dans un contexte aride joue également un rôle important dans le
maintient de ces Poaceae en turgescence (Ould Elhadj, 2001).
Nos résultats montrent aussi, qu'une espèce
végétale moins abondante dans le biotope peut être
très attirée par les criquets. C'est le cas d'Anisantha
sterilis chez Acrida turrita, Morphacris fasciata et
Acrotylus patruelis ; de même pour Digitaria commutata
chez Ochrilidia gracilis. D'après Launois-Luong
(1975), le choix de nourriture chez les criquets n'est pas lié
à l'abondance des plantes ingérées. Le choix de la
nourriture d'acridiens peut être influencé par d'autres facteurs,
tels que molécules de dissuasion ou de stimulation (Le Gall,
1989), architecture des plantes et couleur (Picaud et al.
2002). Certaines de ces fonctionnalités peuvent être
détectées par des organes sensoriels, tels que les organes
olfactifs ou gustatifs des sensilles des antennes
90
Résultats et Discussions
(Chen et al., 2003),
chimiorécepteurs sur les palpes (Jin et al.,
2006), et des sensilles du labre (El Ghadraoui et
al., 2002 ; Zaim et al., 2013). La taille du corps
des criquets devrait être liée à la quantité de
biomasse consommée afin de soutenir les demandes métaboliques de
ces insectes (Schmitz & Price, 2011). En effet les grands
Acridiens tels que Acrida turrita et Heteracris ont
ingérés une quantité de nourriture plus importante que les
moins grands tels que Pyrgomorpha cognata et Acrotylus
patruelis. La biomasse consommée est quantifiée en somme
moyenne des surfaces ingérées. Les résultats relatives
à la quantification de l'alimentation et 1' analyse de l'indice
d'appétence confirment la forte sélectivité des sept
espèces Acridiennes à l'égard des plantes disponibles dans
leur biotope. De plus cette étude quantitative a donnée à
chaque plante consommée son importance réelle. C'est dire qu'une
plante peut être fréquente dans les fèces d'un criquet,
mais à des quantités faibles. Parmi les sept Orthoptères
analysés, cinq sautériaux s'attaquent uniquement aux plantes
adventices. Par contre Heteracris annulosa et Pyrgomorpha cognata
consomment des plantes cultivées telles que Lagenaria
siceraria, Cucurbita maxima, Cucumis melo, Solanum
melongena, Solanum lycopersicum, Capsicum annuum et
Mentha pulegium. Les dégâts sur ces plantes sont
importants au fur et à mesure que la densité d'Heteracris
annulosa et Pyrgomorpha cognata augmente dans les parcelles de
ces cultures. De plus cet Eyprepocnemidinae et ce Pyrgomorphinae sont
phytophiles. Cependant, Acrotylus patruelis, et Morphacris
fasciata sont rarement observés sur végétation, ils
sont géophiles. En outre, les spécialistes d'un habitat risquent
l'extinction locale lorsque leurs plantes hôtes et / ou leurs habitats
sont modifiés ou détruits car ils ne s'adaptent pas facilement
aux changements de plantes hôtes ou d'habitats (Keller et
al., 2013). En effet Heteracris annulosa et
Pyrgomorpha cognata sont très liées à leurs
plantes hôtes. La densité de ces criquets diminue très
considérablement avec le changement des cultures.
|
|


