|
Octobre 2010
REPUBLIQUE TUNISIENNE
|
MINISTERE DE L'ENSEIGNEMENT
SUPERIEUR ET DE LA
RECHERCHE
SCIENTIFIQUE
UNIVERSITE DU 7 NOVEMBRE A
CARTHAGE
|
|
MINISTERE DE L'AGRICULTURE, DES
RESSOURCES
HYDRAULIQUES ET DE LA
PÊCHE
|
INSTITUTION DE LA RECHERCHE ET DE L'ENSEIGNEMENT
SUPERIEUR AGRICOLES
INSTITUT NATIONAL AGRONOMIQUE DE TUNISIE
Département Agronomie et Biotechnologie
Végétale
Mémoire de mastère
Présenté par :
Zoubeir CHAMEKH
Spécialité : Agronomie et
Biotechnologie Végétale Option :
Ressources Phytogénétiques et Biotechnologie
Analyse de la réponse de quelques
génotypes de blé
dur (Triticum turgidum ssp durum) à la
contrainte
saline dans trois Gouvernorats du centre de la
Tunisie
Devant le jury composé de :
Mme Hajer AMARA Président de jury
Mr Youssef TRIFA Directeur de mémoire
Mme Nadhira BEN AISSA Membre examinateur
Mr Ali SEHLI Membre examinateur
Mr Makrem BEL HAJ FRAJ Membre examinateur
Dédicaces
Je dédie ce modeste travail à la mémoire
d'un très cher et exceptionnel père Boujemã
qui repose en paix. Nulle dédicace ne serait exprimer ma
tristesse suite à une disparition si cruelle.
A Ma chère mère Zohra
Pour son amour et sa tendresse, qu'elle trouve ici l'expression
de ma profonde gratitude, de tout mon attachement et de mon amour infini. A mes
frères Adli, Zied, Aladin et ma soeur
Amani.
A mes cousins Fawzi et Lassaãd
qui m'ont aidé à surmonter toutes les difficultés
rencontrées au cours de cet mémoire.
A mes amis
(Ines, Imen, Majdi, Toufik, Ahmed, Khayri et
Najla) qui font mon
équilibre, pour leur présence dans ma vie.
Remerciement
Ce document est le fruit d'un travail dont je suis l'heureux
dépositaire. Que les personnes de l'équipe dans la quelle j'ai eu
le plaisir de travailler reçoivent toute ma gratitude.
Cette mémoire n'aurait pas vu le jour sans la
confiance, la patience et la générosité de mon encadreur,
Monsieur Youssef TRIFA, que je veux particulièrement
remercier. Je voudrais aussi le remercier pour le temps et la
disponibilité qu'il m'a accordés tout au long de ces
années, d'avoir cru en mes capacités et de m'avoir fourni
d'excellentes conditions de travail au sein de son équipe à
l'INAT. De plus, les conseils qu'il m'a procurés tout au long de la
rédaction, ont toujours été clairs et enrichissants, me
facilitant grandement la tâche et me permettant la finalisation de ce
mémoire.
Cette mémoire a été
réalisée dans le cadre d'un projet de recherche
fédéré « PRF Centre » financé par le
Ministère de l'Agriculture et des Ressources Hydrauliques. Je tiens
à remercier du fond du coeur Mme Hajer AMARA,
coordinatrice de l'action de recherche, pour la confiance
qu'être m'a témoigné, pour les précieux conseils et
grande disponibilité. Cette année a été pour moi
très enrichissante, tant sur le plan professionnel que sur le plan
humain. Qu'être trouve ici l'expression de toute ma reconnaissance, de ma
profonde admiration et de ma respectueuse considération.
Je tiens tout d'abord à remercier les membres du jury
d'avoir accepté de lire et d'évaluer ce mémoire. Mes plus
vifs remerciements vont au professeur Mme Hajer AMARA de
m'avoir fait l'honneur d'accepter de présider le jury. Que soient
également remerciés M. Ali SAHLI, M.
Makrem BELHAJ FRAJ Mme BEN AISSA Nadhira pour
avoir accepté d'examiner ce travail, pour leurs remarques et leurs
persévérances dans la lecture de ce travail.
Je remercie bien vivement Monsieur Saleh
REZGIU, Maitre de conférences et Monsieur Makrem BELHAJ
FRAJ à l'INAT qui a mené avec tant de soins et de
patience les résultats statistiques de ce travail.
Il m'est agréable d'exprimer mes remerciements les plus
sincères à touts les personnels de l'office des terres
Domaniales, l'institut des Grandes Culture et le Centre de
Formation Professionnel Agricole de Souassi qui n'ont pas
hésité à me fournir l'aide nécessaire pour
accomplir ce travail.
J'adresse mes plus sincères remerciements aux
ingénieurs du projet à l'INAT « PRF», Zied
Hammami et Noureddine Ghrabe qui ont fortement
aidé à l'aboutissement de ce travail. Ses
conseils et ses commentaires m'ont été fort
utiles et m'on aidé pour le bon achèvement de ce travail.
Je tiens à remercier Mr Baraket Mokhtar
pour son suivi, en étant membre du laboratoire de «
Amélioration Génétique des céréales»,
et ses conseils tout au long de cette année.
Je tiens également à remercier Mme
Sawsen Ayadi, pour ses précieux conseils et sa grande
disponibilité, aussi bien pour les discussions que j'ai eu la chance
d'avoir avec elle, ses suggestions et sa contribution au démarrage de
mes travaux de mémoire.
Je tiens à exprimer toute ma gratitude à Mme
Ayed Sourour pour son aide précieuse lors de la
réalisation du travail expérimental.
Je remercie aussi Mr Karmous Chahine
assistant à l'Ecole Supérieure Agricole de Mateur pour
son aide, ses conseils et son orientation.
Je transmets mes remerciements à tous les membres de
l'unité de recherche « Amélioration Génétique
des céréales » : Zohra Malleh, Kalthoum Harbaoui Rim
Jeribi, Zina Barbouche, Souha Aribi Kacem, Ines Labidi, Warda
Jandoubi, Rim Bedoui, Sahbi Farjaoui, Kais, Najet et Ahlem. Tous m'ont
aidé à un moment ou un autre, scientifiquement, techniquement ou
moralement.
Cette mémoire m'a donné l'occasion de rencontrer
et de travailler avec des personnes absolument épatantes. Il est
difficile de leur dire ici à quel point j'ai été
touchée par tout ce qu'ils ont fait pour moi.
i
Résumé ii
Abstract iii
Liste des tableaux iv
Liste des figures v
Liste des photos vii
Liste des abréviations viii
Introduction 1
Problématique 2
1. Problème de salinisation 3
1.1. Origine de la salinité 3
1.1.1. La salinité primaire 3
1.1.2. La salinité secondaire 4
1.2. Composantes de la salinité 4
1.2.1. Le stress osmotique 5
1.2.2. Le stress ionique 5
1.2.3. Le stress nutritionnel 5
1.2.4. Le stress oxydatif 6
2. Effet de la salinité sur les plantes
6
2.1. Effet de la salinité sur la germination et
la levée 7
2.2. Effet de la salinité sur la morphologie de
la plante 8
2.2.1. Effet de la salinité sur l'architecture de
la plante 8
2.2.2. Effet de la salinité sur la partie
aérienne 8
2.2.3. Effet de la salinité sur la partie
racinaire 8
2.3. Effet de la salinité sur la physiologie de
la plante 9
2.3.1. Effet de la salinité sur le
développement et la croissance de la plante 9
2.3.2. Effet de la salinité sur les
échanges gazeux et la photosynthèse 9
2.3.3. Effet de la salinité sur la physiologie de
la reproduction 10
2.3.4. Effet de la salinité sur le rendement
agronomique 10
3. Tolérance des plantes à la
salinité 11
3.1. Les halophytes 11
? Les plantes de type inclusif (includer) 12
? Les plantes de type exclusif (excluder) 12
3.2. Les glycophytes 12
4. Tolérance des céréales à
la salinité 12
5. Mécanisme de la tolérance à la
salinité des plantes 13
5.1. Contrôle de l'absorption et le transport du
sodium 13
5.2. Régulation de la concentration cytoplasmique
de sodium 14
5.3. Le transport de sodium 15
5.3.1. L'efflux de sodium 15
5.3.2. Compartimentation vacuolaires de sodium
15
5.4. Prélèvement de Potassium
16
6. Les plantes face au stress salin 16
6.1. Signalisation cellulaire 16
6.2. La croissance et le développement des
plantes sous stress salin 17
6.3. Les différents types de réponses des
plantes à la salinité 18
6.4. Importance de ces mécanismes 19
7. Mécanisme d'adaptation des plantes à la
salinité 20
7.1. Les mécanismes d'adaptation morphologiques
20
7.1.1. Réduction de la surface foliaire
20
7.1.2. Fermeture des stomates 21
7.1.3. Réduction de la transpiration
21
7.2. Les mécanismes d'adaptation physiologiques et
biochimiques 22
7.2.1. L'ajustement osmotique 22
7.2.2. Tolérance au chlorure (Cl-)
23
7.2.3. Synthèse des antioxydants 23
1. Matériel végétal 25
2. Réseau multilocal d'évaluation des
variétés 25
2.1. Caractéristiques climatiques du
réseau d'essais 25
2.2. Caractéristiques édaphique du
réseau d'essais 26
2.2.1. Analyse du sol 26
2.2.2. Analyse de l'eau d'irrigation 26
3. Dispositif expérimental 26
4. Itinéraire technique de conduite des
expérimentations 27
4.1. Opérations d'implantation 27
4.2. Pilotage de la fertilisation et de l'irrigation
28
5. Mesure d'évaluation des génotypes
29
5.1. Mesure des paramètres agronomiques
30
5.2. Dosage des ions minéraux 31
6. Analyses statistiques 32
3. Elaboration du rendement 35
3.1. Rang de variation des variables 35
3.2. Classement général des
génotypes 36
3.3. Analyse multivariée 37
4. Interaction variété x
salinité 40
5. Effet de la salinité sur les
paramètres agronomiques 44
5.1. Taux de levée 46
5.2. La hauteur de la végétation
47
5.3. Surface foliaire 48
5.4. Matière sèche produite
49
5.5. Nombre d'épis par m2
50
5.6. Nombre de grains par épi 51
5.7. Le poids de mille grains 52
7. Modèles d'élaboration du rendement
55
7.1. Relation entre le rendement en grain et le
rendement biologique 55
7.2. Relation entre la biomasse au stade floraison et
le nombre de grains 56
Conclusions et perspectives 58

(Triticum turgidum ssp durum)
(p<0,001)
X
Ward Bled Jneh khottifa, Bayadha
Jneh khottifa,
Ward Bled Bayadha

II
Résumé
Le blé dur est considéré comme une
culture stratégique en Tunisie. Toutefois, la croissance de cette
culture et l'amélioration de son rendement son limités par la
salinité des sols et des eaux d'irrigation.
Notre étude s'intègre dans le cadre d'une
recherche multidisciplinaire qui vise le comportement des différents
génotypes de blé dur sous irrigué par l'eau
chargée.
Vingt cinq génotypes de blé dur (Triticum
turgidum ssp durum) ont été cultivés au centre de la
Tunisie dans trois sites expérimentaux : Echbika (gouvernorat de
Kairouan), Sidi Bouzid et Souassi (gouvernorat de Mahdia). Ces sites
différents principalement par la salinité de l'eau d'irrigation
qui est respectivement de 2,3, 4,5 et 6,8 g/l.
Les expériences réalisées ont
porté sur les paramètres agronomiques et physiologiques.
L'analyse de la variance a montré que l'effet
génotype et l'effet site (salinité) sont hautement significatifs
(p<0,001) pour tous les paramètres étudiés, indiquant
une large variabilité entre les génotypes et entre les sites. Des
interactions génotype X site sont observées pour les
différents paramètres indiquant une variabilité
génotypique pour la salinité.
Les analyses de corrélations montrent que le rendement
en grain est positivement corrélé, avec la matière
sèche produite et négativement corrélé, avec le
taux de réduction de la surface foliaire ainsi que l'accumulation de
sodium dans les feuilles drapeaux.
L'analyse en composantes principales a permis de partager les
génotypes étudiés en trois groupes : un premier groupe,
formé par les génotypes améliorés les plus
performants, se caractérisant par le nombre d'épis et le nombre
de grains le plus élevé. Un deuxième groupe,
composé par les génotypes autochtones, se caractérisant
par un faible rendement en grain et une forte production de biomasse au stade
floraison.
Les trois génotypes (Jneh khottifa, Bayadha et Ward
Bled) ont composé le troisième groupe avec un rendement en grain
et une production de biomasse importants.
Par ailleurs, cette étude nous a permis de
sélectionner quelques génotypes autochtones pour leur
tolérance à la salinité Jneh Khottifa, Bayadha et Ward
Bled qui peut être l'objet d'un programme d'amélioration.
Mots-clés : salinité,
blé dur, rendement, centre de la Tunisie.
Abstract
In Tunisia, durum wheat is one of the major strategic
cultures. Thus, salinity can represent a limit to the extension of irrigated
cereals.
Our study is included on multidisciplinary research and aimed
at improving of different irrigated durum wheat genotypes by assessing
agronomic and physiologic traits.
Twenty-five genotypes of durum wheat (Triticum turgidum ssp
durum) were evaluated for differences in agronomic and physiologic components
to different salinity treatments at three experiments sit in the center of
Tunisia: Echbika (governorate of Kairouan), Sidi Bouzid and Souassi
(governorate of Mahdia). These differ mainly by the salinity of the irrigation
water, which are respectively 2.3, 6.8 and 4.5 g. L-1.
Analysis of the variance for all the agronomic and physiologic
parameters showed that the effect cultivar and the effect sit (treatment) are
highly significant (p < 0,001). From this analysis, these characteristics
showed also significant effect for Interactions' genotype X sit and differences
in responses of the genotypes between the three environments.
The correlation shows that grain yield is positively
correlated to dry weight and negatively correlated to the reduction rate of the
foliar surface and the accumulation of sodium in flag leaves.
Principal component analysis showed that genotypes could be
divided into three groups:
The first group, formed by the improved genotypes, remained
the most important which the highest number of spikes and number of grains.
The second group, consisted by the lenders genotypes,
characterized by a low grain yield and an important biomass production.
Both genotypes (Jneh khottifa and Bayadha) were composed the
third group which is characterized by an important grain yield and biomass
production.
This study indicates that the response of the lenders
genotypes like Jneh Khottifa and Bayadha is better than the others and they
were improved on the breeding programs.
III
Keywords: salinity, durum wheat, grain yield,
center of Tunisia.
iv
Liste des tableaux
Tableau 1 : Génotypes de blé dur
utilisés dans l'expérience.
Tableau 2 : Date de semis des différents
sites expérimentaux.
Tableau 3 : Pilotage des irrigations.
Tableau 4: Analyse de l'eau d'irrigation au
niveau des trois sites.
Tableau 5 : Statistiques descriptives des
variables nombre de plantes NP, PMG, NG, BAFLO, NE et le NP des
différentes variétés de blé dur cultivées
aux niveaux des trois sites. Tableau 6 : Analyse de la
variance (carré moyen et test f) relative aux paramètres
d'élaboration du rendement (taux de germination, hauteur de la
végétation, surface foliaire, biomasse au stade anthèse,
biomasse au stade floraison, nombre d'épis/m2, nombre
d'épillets par épi, nombre de grains par épi, le poids de
mille grains et le rendement) évalué chez les différents
génotypes de blé dur.
V
Liste des figures
Figure 1 : Diminution du pourcentage de
germination avec l'augmentation de la salinité (Lauchli et Grattan,
2007).
Figure 2 : Développement racinaire du
blé en situation de stress (A) ou normal (B), d'après Taiz et
Zeiger (2006).
Figure 3 : Classification des plantes selon leur
niveau de tolérance à la salinité en fonction de la
concentration en sel (Munns et Tester, 2008).
Figure 4 : Les points de contrôle et de la
régulation de transport du sel au niveau de la plante (Munns, 2002).
Figure 5 : Les transporteurs ioniques de Na+ au
niveau cellulaire (Mansour et al., 2003). Figure 6 :
Signalisation cellulaire du stress salin (Zhu, 2003).
Figure 7 : Schématisation des deux phases
de développement des plantes tolérantes et sensible sous stress
salin (Munns, 2002).
Figure 8 : Le dispositif expérimental en
alpha bloc (Belhaj Fraj, Comm. Pers.).
Figure 9 : Procédure
d'échantillonnage à chaque parcelle élémentaire
(Belhaj Fraj, Comm. Pers.).
Figure 10 : Classement générale
des génotypes selon le rendement biologique (axe des abscisses) et le
rendement en grain (axe d'ordonnées).
Figure 11 : Analyse en composantes principales,
(A) projection des variables sur les deux axes ACP1 et ACP2, (B) distribution
des génotypes dans le plan sur les deux axes ACP1 et ACP2
Figure 12 : Analyse en composantes principales
(Site Kairouan), Projection des variables sur les axes ACP1 et ACP2 et
répartition des génotypes dans le plan des axes ACP1 et ACP2.
Figure 13 : Analyse en composantes principales (Sidi Bouzide),
Projection des variables sur les axes ACP1 et ACP2 et répartition des
génotypes dans le plan des axes ACP1 et ACP2. Figure 14 :
Analyse en composantes principales (Site Souassi), Projection des
variables sur les axes ACP1 et ACP2 et répartition des génotypes
dans le plan des axes ACP1 et ACP2. Figure 15 : Taux de
levée des différents génotypes aux niveaux des trois sites
expérimentaux. Figure 16 : Hauteur de la
végétation au stade anthèse des différents
génotypes aux niveaux des trois sites expérimentaux.
Figure 17 : Surface foliaire de la feuille
drapeau au stade anthèse des différents génotypes et au
niveau des trois sites expérimentaux.
vi
Figure 18 : La biomasse aérienne au
stade anthèse des différents génotypes aux niveaux des
trois sites expérimentaux.
Figure 19 : Nombre d'épis par
m2 au stade maturité complète des différents
génotypes aux niveaux des trois sites expérimentaux.
Figure 20 : Nombre de grains par épi
au stade maturité complète de différents génotypes
aux niveaux des trois sites expérimentaux.
Figure 21 : Poids de mille grains au stade
maturité complète des différents génotypes aux
niveaux des trois sites expérimentaux.
Figure 22 : Teneurs en Na+ au
stade anthèse au niveau de la feuille drapeaux de différents
génotypes aux niveaux des trois sites expérimentaux.
Figure 23 : Relations entre le rendement en
grain et le rendement biologique chez les génotypes autochtones et ceux
améliorés.
Figure 23 : Relation entre le nombre de grain
et la biomasse au stade floraison, chez les génotypes
améliorés et ceux autochtones.
vii
Liste des photos
Planche 1 : vue général de la
parcelle expérimentale. Planche 2 : Vue
générale du système d'irrigation.
VIII
Liste des abréviations
(1) : Aoudhay
(2) : Jneh Khottifa
(3) : Beskri Pubescent
(4) : Agili
(5) : Bidi AP4
(6) : Azizi
(7) : Bayadha
(8) : Swebei Algia
(9) : Derbessi
(10) : Mahmoudi
(11) : Souri
(12) : INRAT69
(13) : Ward Bled
(14) : Arbi
(15) : Hamira
(16) : Sbay
(17) : Chili
(18) : Agili Glaber
(19) : Richi
(20) : Razzak
(21) : Karim
(22) : Om Rabia
(23) : Nasr (24): Maali
(25) : Khiar
ix
APX : Ascorbate peroxydases
ABA : Acide abscissique
ATP : Adénosine triphosphate
AtNHX : Antiport Na+ /H+
vacuolaire
ACP: Analyse en composantes principales
BNG: Banque Nationale des gènes
(Tunis)
BAFLO : Biomasse au stade floraison
BAMAT : Biomasse au stade maturité
Cl-: Ion chlorure
Ca2+: Ion calcium
CAT: catalases
CO2 : Hydroxyde de carbone
°C : Degré Celsius
CE: Conductivité électrique
FAO: Organisation des Nations Unies pour
l'Alimentation et l'Agriculture
GST: Glutathion-S-transférases
GPX : Glutathion peroxydases
g/l: Gramme par litre
HKT1: High-Affinity K+ Transporter 1
HKT2: High-Affinity K+ Transporter 2
H+-ATP ase : Pompe H+ ATP
ase
HNO- 3: Nitrate K+ :
Potassium
X
Kna1 : Locus
Kg/ha: Kilogramme par hectare
Mha : Million hectare
m2 : Mètre carré
m: Mètre
Mg: Milli gramme
mM : Milli molaire
mS cm-1: Milli siemens par
centimètre
ml : Milli litre
mg/g MS: Milligramme par gramme de
matière sèche
Na+: Sodium
NO3-: Nitrate
NADPH : Nicotinamide dinucléotide
phosphate
NaCl: Chlorure de sodium
Nax1 : Gène d'exclusion de sodium
Nax2 : Gène d'exclusion de sodium
NE : Nombre d'épis
NG : Nombre de grains
NP : Nombre de plantes
OTD : Office de terres domanial
OMS : Organisation mondiale de la
santé
PR : Partie racinaire
PA : Partie aérienne
xi
PMG : Poids de mille grains
ROS : Espèces
réactives d'oxygènes
RuBP : Ribulose Biphosphate
SOD : Superoxyde-dismutases
SF : Surface foliaire
RDT : Rendement en grain
SOS1 : Salt overly sensitive
TRE : Teneur relatif en eau
t/ha : Tonne par hectare
Analyse bibliographique
1
Introduction
Dans les régions arides et semi-arides, l'eau constitue
le principal facteur limitant l'extension et l'intensification des cultures
céréalières (Alem et al., 2002). En outre, le
recours à l'irrigation complémentaire est limité par la
qualité médiocre de l'eau d'irrigation qui est de plus en plus
chargée en sels. La salinité est l'un des facteurs abiotiques
majeurs qui influent la production et les rendements des espèces
cultivées, notamment les céréales irriguées.
L'effet dépressif du sel se manifeste à partir d'un seuil
critique de concentration caractéristique de l'espèce ou de la
variété. La salinité affecte presque la totalité
des processus de développement des plantes, de la levée,
jusqu'à la maturité. Il existe de nombreuses indications chez le
blé dur d'un potentiel génétique considérable pour
la tolérance au stress salin (Munns et al., 2008). La Tunisie
est concernée par ce problème vue l'importante partie de ses sols
affectés par le sel (1,8 millions d'hectares soit 10% de superficie
totale du pays) ainsi que la qualité d'eau médiocre
employée dans l'irrigation, la salinité affecte environ le tiers
des superficies irrigués (FAO, 2008). La productivité agricole en
Tunisie notamment céréalière se retrouve ainsi
confrontée à deux contraintes abiotiques, la salinité et
la sécheresse Ainsi, l'amélioration de la production agricole via
la valorisation des sols salés et l'utilisation des eaux chargées
pour l'irrigation nécessite la compréhension des
mécanismes physiologiques de tolérance des plantes à la
salinité. En outre, la résistance aux stress dépend
fortement du stade de développement de la plante, des techniques
culturales, des conditions climatiques et édaphiques.
Plusieurs critères de tolérance physiologiques
et agronomiques ont été identifiés à
l'échelle des organes et de la plante entière et sont
utilisés dans le but de la discrimination entre les différents
génotypes pour la résistance au stress salin. C'est par cette
voie que l'on pourra sélectionner des espèces ou des
génotypes céréaliers susceptibles de s'adapter aux milieux
salés avec la production de rendements appréciables.
Dans cette situation, des programmes d'amélioration des
céréales sont indispensables pour améliorer la production
ainsi que l'adaptation aux différentes conditions climatiques et
édaphiques. L'amélioration génétique est
basée sur l'utilisation de la variabilité
génétique. Il est certes vrai que les stratégies
d'amélioration des céréales ont beaucoup apporté
sur le plan quantitatif pour subvenir aux besoins sans cesse croissants,
cependant les nouvelles génotypes à haut potentiel productif
s'avèrent de plus en plus sensibles aux divers types de stress. Par
contre les variétés traditionnelles connues pour leur
rusticité auraient d'une part une bonne adaptation aux conditions
pédoclimatiques et qu'au relief accidenté des champs de
culture.
2
Problématique
La Tunisie s'est engagée dans un programme visant
l'augmentation de la superficie irriguée en céréales afin
de limiter au maximum la fluctuation interannuelle de la production nationale.
La sélection de génotypes de blé dur adaptés
à l'irrigation par de l'eau chargée dans le centre de la Tunisie
est donc une nécessité primordiale. Dans le cadre de la
participation de notre laboratoire au projet de recherche
fédéré PRF Centre «Amélioration de la
production du blé irrigué au centre de la Tunisie», nous
nous sommes proposé d'étudier le comportement de quelques
génotypes de blé dur autochtones et améliorés sous
irrigation par de l'eau chargée en se basant sur des critères
morphologiques et physiologiques. Notre travail de recherche vise donc
l'étude de la variabilité génétique pour la
tolérance à la salinité entre vingt cinq génotypes
de blé (Triticum turgidum ssp durum) soumis à la
contrainte saline dans trois gouvernorats du centre (Kairouan, Mahdia et Sidi
Bouzid), afin de sélectionner les meilleurs génotypes convenables
à la culture dans ces zones arides du centre du pays.
3
1. Problème de salinisation
La salinisation est un processus d'enrichissement du sol en
sels solubles qui aboutit à la formation d'un sol salin (Keren, 2000 ;
Levy, 2000 ; Brady et Weil, 2002 ; Essington,
2004). Elle a été identifiée comme un
processus majeur de la dégradation des terres, et à l'origine de
la diminution de la production sur de nombreux périmètres
irrigués, particulièrement dans les zones arides et semi-arides
(El-Hendawy, 2004).
Généralement, le monde perd en moyenne 10 ha de
terres cultivables par minute dont 3 ha (plus de 1,5Mha par an) à cause
de la salinisation (Kovda, 1983). Aujourd'hui, il y a à peu près
400Mha des terres qui sont affectées par la salinisation (Bot et
al., 2000). En Afrique, près de 40Mha sont affectés par la
salinisation, soit près de 2% de la surface totale. Au Proche-Orient,
près de 92Mha sont affectés par la salinisation, soit environ 5%
de la surface totale. En Tunisie la surface irriguée est de 0,4Mha dont
les 25% sont touchés par la salinité (FAO, 2008).
1.1. Origine de la salinité
La salinisation des terres est à 80% d'origine
naturelle. On parle alors de salinisation "primaire", due aux sels se formant
lors de l'altération des roches ou à des apports naturels
externes (Bryssine, 1961).
Alors que 20% des terres salinisées ont une origine
"anthropique". On parle alors de la salinisation "secondaire", induite par
l'activité humaine, liée aux pratiques agricoles et en en
particulier à l'irrigation (FAO, 2008).
1.1.1. La salinité primaire
La salinité primaire ou naturelle est le
résultat de l'accumulation des sels sur une longue période de
temps, dans le sol ou les eaux souterraines (Antipolis, 2003), elle est
causée par trois processus naturels.
Le premier est l'altération des roches mères
contenant des sels solubles. C'est le processus d'altération des roches
qui se décomposent et libèrent des sels solubles de divers types,
principalement les chlorures de sodium qui est le plus soluble (Li et al.,
2006), de calcium et de magnésium, et avec moins de
quantité, les sulfates et les carbonates (Mermut et Arshad, 1987).
Le deuxième est le dépôt des sels
océaniques par le vent et la pluie. «Sels cycliques" qui sont des
sels de l'océan amenés par le vent et déposés par
la pluie, qui sont principalement les chlorures de sodium. L'eau de pluie
contient de 6 à 50 mg de sel par kg d'eau, la concentration des sels
diminue avec l'éloignement de la côte.
4
L'intrusion de l'eau de mer dans les nappes près des
côtes est due à une inversion du gradient hydraulique à
cause de la surexploitation des nappes souterraines.
L'utilisation de l'eau de cette nappe à des fins
d'irrigation entraîne l'intrusion de l'eau saline près de la zone
racinaire. L'effet est amplifié par la présence d'une surface
évaporatrice. Dans ce cas le volume de l'eau et la masse des sels
augmentent donc la concentration en sels augmente ou diminue en fonction de la
salinité initiale de la zone racinaire. Mais en général le
résultat final est une augmentation.
La quantité de sel stocké dans le sol varie en
fonction du type de sol, elle est faible pour les sols sableux et
élevée pour les sols argileux. Elle est également
inversement proportionnelle à la pluviométrie moyenne
annuelle.
1.1.2. La salinité secondaire
La salinisation secondaire est le résultat des
activités humaines qui modifient l'équilibre hydrologique du sol
entre l'eau appliquée (irrigation ou de pluie) et l'eau utilisée
par les cultures (transpiration). Les causes les plus communes sont le
défrichement et le remplacement de la végétation
pérenne par les cultures annuelles, ainsi que les systèmes
d'irrigation utilisant l'eau riche en sels ou ayant un drainage insuffisant
(Antipolis, 2003). Selon la FAO (Food and Agriculture Organization), la
totalité des terres irriguées dans le monde est de 230 millions
d'hectares, 45 millions d'hectares sont touchés par la salinité
(19,5 %) et sur 1500 millions d'hectares de terres agricole arides, 32 millions
d'hectares (2%) sont devenus salins, à causes de la salinisation
secondaire.
Dans de nombreuses zones irriguées, le niveau des
nappes phréatiques a augmenté en raison de la quantité
excessive d'eau appliquée associée à un mauvais drainage.
Dans la plupart des projets d'irrigation situés dans les zones arides et
semi-arides, les problèmes de l'engorgement et la salinisation du sol
ont atteint des proportions graves. La plupart des systèmes d'irrigation
du monde sont à l'origine de la salinité secondaire, la
sodicité ou l'engorgement.
1.2. Composantes de la salinité
Les données classiques sur les effets de la
salinité chez les plantes mettent en relief trois principales
composantes par lesquelles la salinité affecte la croissance: le stress
osmotique, le stress ionique, le stress nutritionnel et le stress oxydatif
(Guetadahan et al., 1998 ; Rodriguez et al., 2005).
Il n'est souvent pas possible de distinguer la contribution de
chacune de ces voies à l'inhibition de la croissance au niveau de la
plante entière.
5
1.2.1. Le stress osmotique
La première conséquence de la salinisation tient
à la modification du potentiel osmotique de la solution du sol, lorsque
la teneur en sels croit (Cheverry et al., 1996). Plus la solution du
sol est salée, plus la pression osmotique est élevée et
plus il est difficile pour les racines d'extraire l'eau de la réserve du
sol. il en résulte un ralentissement
de la croissance (Song et al., 2005). La concentration en sels
dépend de la teneur en eau du sol et augmente avec le
desséchement. C'est pourquoi l'excès de sels qui affecte les
plantes est atteint beaucoup plus rapidement dans un sol sableux que dans un
sol argileux qui piège les ions Na+ via les charges
négatives de l'argile (Chinnusamy et al., 2005).
Les plantes absorbant l'eau par osmose, cette absorption est
conditionnée par la différence de potentiel hydrique entre la
racine et le sol (Cramer et Bowman, 1993). La plupart des plantes sont capables
d'ajuster leur potentiel osmotique interne en fonction de celui
extérieur (Pujol et al., 2001). Mais cette régulation,
très variable selon les espèces et présente des limites
(Läuchli et Epstein, 1990).
1.2.2. Le stress ionique
L'accumulation des ions toxiques Na+ et
Cl- au niveau du mésophylle des feuilles, affecte la
croissance et le métabolisme de la plantes (Chinnusamy et Zhu, 2004). Le
sel endommage les structures lipidiques et protéiques des membranes
plasmiques (Pical et al., 1999).La présence de ces ions
perturbent l'activité enzymatique cellulaire (Hasegawa et al.,
2000) principalement dans les tissus photosynthétiques (Bounaqba,
1998).
La toxicités ionique peut être le résultat
du remplacement de K+ par Na+ au niveau des sites actifs
de protéines induisant aussi un changement des structure
protèiques et enzymatiques (Chinnusamy et al., 2005).
1.2.3. Le stress nutritionnel
La salinité n'est pas une simple affaire de
concentrations élevées de Na+ et de Cl-.
Le calcium, le sulfate, les carbonates peuvent être
présents, avec le bore ou le sélénium à des
concentrations excessives. En même temps, d'autres nutriments,
particulièrement le phosphore et l'azote, peuvent ne pas être
présents ou disponibles en quantités suffisantes pour permettre
des taux de croissance élevés (Gorham, 1996). La présence
de sels en excès dans le substrat de culture peut entrainer une
limitation de l'alimentation en nutriments indispensables. Ce
déséquilibre nutritionnel est une cause possible des
réductions de
6
croissance sur sel, lorsque des ions essentiels comme
I+, Ca2+ ou NO3- deviennent limitant (Soltani
et al., 1990).
1.2.4. Le stress oxydatif
Les espèces réactives d'oxygènes (ROS)
sont habituellement générés par l'activité
cellulaire normale avec des faibles concentrations, comme la photo respiration
et la B-oxydation des acides gras, et dans ces conditions, la plante
possède des enzymes et des métabolites antioxydants suffisants
pour faire face à cette faible concentration (Yazici et al.,
2007).
De nombreux travaux montrent que des métabolites
enzymatiques et non enzymatiques antioxydants telles que les
superoxyde-dismutases (SOD), les ascorbate peroxydases (APX), les catalases
(CAT), des glutathion-S-transférases (GST) et les glutathion peroxydases
(GPX) s'accumulent plus pendant le stress salin (Sudhakar et al.,
2001).
Une conséquence des stress environnementaux, comprenant
le stress salin, est l'apparition du stress oxydatif (Hernandez et al.,
2001), c'est-à-dire l'accumulation d'espèces
réactives d'oxygène (ROS) à des concentrations
élevées (Azevedo et al., 2006), qui endommagent les
structures cellulaires (Smirnoff, 1993 ; Parent et al., 2008). Ces
derniers sont à l'origine du dysfonctionnement de l'appareil
photosynthétique et les autres troubles métaboliques (Rahnama et
Ebrahimzadeh, 2005). La plupart d'entre eux sont des peroxydes
d'hydrogène, des radicaux hydroxyles et des anions superoxyde (Azevedo
et al., 2006).
La tolérance des plantes à la contrainte saline
est fortement corrélé à leur capacité de
synthèse des antioxydants nécessaire pour faire face au ROS et de
maintient leur concentration à faible niveau dans les cellules lors du
stress (Reddy et al., 2004).
Par ailleurs, Demiral et Turkan (2004), ont montré que
les plantes ont développé des systèmes de défense
antioxydants enzymatique et non enzymatique contre les radicaux libres en
limitant leur génération.
2. Effet de la salinité sur les plantes
La salinité constitue un facteur limitant non
négligeable pour l'agriculture mondiale (Hillel, 2000). L'effet de la
salinité se manifeste généralement chez la plupart des
plantes cultivées par un effet dépressif sur la croissance et le
développement (Munns et al., 1995).
Cet effet néfaste se traduit par des changements
morphologiques, physiologiques, biochimiques et moléculaires qui affecte
négativement la croissance et la productivité
végétale (Wang et al., 2001 ; Ashraf et Harris,
2004).
7
2.1. Effet de la salinité sur la germination et la
levée
La germination a été utilisée pour le
criblage aux stress abiotiques chez le blé et notamment chez le
blé dur, elle pourrait constituer un test rapide de tolérance
à la salinité (Mallek-Maalej et al., 1998 ; Ben Naceur
et al., 2001 ; Klay, 2004). Ce dernier a un effet nocif sur la
germination qui peut être de nature soit osmotique soit toxique (Abdelly,
1997). La salinité agit également sur la germination en
ralentissant sa vitesse, ce qui expose plus les semences aux risques (Slama,
2004).il a été démontré que la salinité
inhibe la germination par son effet osmotique (Jamil et al., 2006 ;
Karmous, 2007), qui se traduit par la difficulté qui trouve l'embryon
à absorber la quantité d'eau nécessaire pour
déclencher les processus métaboliques (Slama, 2004).
La germination et l'installation de la plantule
s'avèrent les stades les plus sensibles pour les céréales
(Lachaal, 1992). La salinité réduit significativement la
précocité de germination des semences, alors que le pourcentage
de cette dernière s'avère moins influencé par le stress
salin (Devron et Sifi, 2003). Elle affecte tout les processus de germination
suite à la baisse du potentiel hydrique autour des graines, ce qui rend
l'eau inaccessible à cette dernière pour la réhydratation
et la reprise de la vie active de l'embryon (Maas et Poss, 1989).
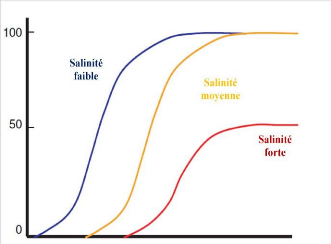
Figure 1 : Diminution du pourcentage de
germination avec l'augmentation de la salinité
(Lauchli et Grattan,
2007).
8
2.2. Effet de la salinité sur la morphologie de la
plante
2.2.1. Effet de la salinité sur l'architecture
de la plante
L'architecture de la plante est profondément
modifiée. Sous un stress osmotique, même très
modéré et ne présentant pas de symptômes flagrants,
se traduit chez beaucoup d'espèces par une modification importante de
l'architecture de la plante. Par exemple, chez des dicotylédones comme
le pois ou la vigne, le nombre de ramifications et le nombre d'organes
élémentaires (phytomères) de la tige sont drastiquement
réduits (Lecoeur et al., 1995 ; Belaygue et al., 1996
; Lebon et al., 2004). Il en va de même chez les
graminées, où le nombre de talles est réduit en cas d'un
stress osmotique (Courtois et al., 2000). Les processus mise jeu et
les signalétiques sont des contrôles actifs de la plante mettant
en jeu des signalétiques hormonales et l'expression de gènes
induits par le stress, et non la conséquence passive du stress ou d'un
manque de nutriments.
2.2.2. Effet de la salinité sur la partie
aérienne
L'effet de la salinité se traduit
généralement par une réduction de la croissance
végétative, qui est en fonction de la division et
l'élongation cellulaire. Elle retarde la croissance des pousses qui sont
plus sensible au sel que les racines (Läuchli et Epstein, 1990).
Selon Katerji et al. (2006) l'effet du sel se traduit
généralement par une réduction de la croissance en
hauteur. Pour les céréales, l'effet majeur de la salinité
sur la partie aérienne se traduit par une réduction du nombre de
talles et de feuilles (El-Hendawy et al., 2005).
2.2.3. Effet de la salinité sur la partie
racinaire
La salinité affecte le développement de la
plante en particulier la croissance des racines (Läuchli et Epstein,
1990). Bayuelo et al. (2002) ont montré que la salinité
augmente le rapport PR/PA. En effet, les plantes maintiennent une croissance
racinaire relativement importante sous forte contrainte saline, l'augmentation
du rapport PR/PA qui s'ensuit semble être associée à une
augmentation de leur tolérance au sel. Kafkai (1991) suggère que,
sous contrainte saline, la plante dépense plus d'énergie
photosynthétique pour maintenir un statut hydrique élevé
et pour la production de racines en vue de la recherche d'eau et/ou la
réduction de la perte d'eau. Dans ces conditions, il semble que
l'arrêt de la croissance foliaire soit déclenche par des signaux
hormonaux (Schuppler et al., 1998 ; Munns, 2002) et qu'une part
importante des photosynthètats soit alors réallouée a la
croissance racinaire. C'est l'une des réponses anatomiques clefs aux
stress osmotiques chez de nombreuses espèces, dont le caractère
adaptatif apparait évident puisqu'une augmentation du ratio masse des
racines/
9
masse de la canopée maximise la surface d'absorption de
l'eau en diminuant la surface d'évaporation (Munns, 2002).
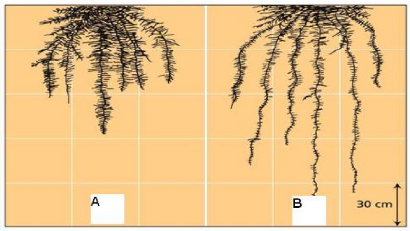
Figure 2 : Développement racinaire du
blé en situation de stress (A) ou normal (B), d'après Taiz et
Zeiger (2006).
2.3. Effet de la salinité sur la physiologie de la
plante
2.3.1. Effet de la salinité sur le
développement et la croissance de la plante
La salinité retarde le développement des
feuilles et le tallage, mais elle pousse la plante vers la maturité
(Munns et Rawson, 1999 ; Maas et Poss, 1989). L'observation des changements de
développement de l'apex, lors de la croissance végétative
jusqu'à la phase reproductive, a permis à ces auteurs de
constater que la salinité accélère la phase reproductive.
Ces auteurs ont constaté aussi que la phase terminale de la formation
des épillets se produit environ deux semaines plus tôt chez le
blé soumis à un stress par rapport aux non stressé. Ainsi
que l'anthèse a lieu plus tôt pour les plantes sous stress, mais
le tallage a été retardé de plusieurs jours. Grieve et al.
(2001), ont découvert que le stress augmente le phyllochrone
(l'intervalle entre l'apparence des feuilles successives sur la tige principale
en fonction du temps thermique) et réduit le nombre des feuilles
engagée sur la tige principale.
2.3.2. Effet de la salinité sur les
échanges gazeux et la photosynthèse
La salinité affecte l'activité physiologique de
la feuille, et plus particulièrement la photosynthèse, qui
présente la cause principale de la réduction de la
productivité végétale (Alem et al., 2002). Selon
Munns et Tester (2008), la réduction de la photosynthèse est
liée à la diminution du potentiel hydrique foliaire, qui est
à l'origine de la fermeture des stomates (Price et Hendry, 1991 ; Allen,
1995), qui cause la réduction de la conductance stomatique
10
11
(Orcutt et Nilsen, 2000). La diffusion du CO2 à
l'intérieur des stomates devient alors limitée et sa fixation au
niveau des chloroplastes diminue (Graam et Boyer, 1990), par conséquence
la régénération du RuBP (Ribulose Biphosphate) devient
limitée (Gimenez et al., 1992). Le contrôle et la
régulation stomatique fait intervenir la turgescence cellulaire mais
également des signaux racinaires, comme l'acide Abscissique (ABA) (Zhang
et Davies, 1989 ; Davis et al., 1994). La turgescence cellulaire
intervient de manière plus ou moins directe au niveau du chloroplaste :
directement par le maintien du volume du chloroplaste, et indirectement, par
son effet sur l'ouverture stomatique, qui contrôle la conductance, et
conditionne l'utilisation de l'énergie photochimique (ATP, NADPH) dans
les chloroplastes (Gupta et Berkowitz, 1987).
2.3.3. Effet de la salinité sur la physiologie
de la reproduction
La salinité réduit le taux de croissance de la
plante du blé et ces organes reproducteurs (Hu et al., 2005).
Khan et Abdullah (2003), ont étudié l'effet de la salinité
sur la physiologie de la reproduction, ils ont constaté que le nombre du
pollen dans deux différents types de cultivars de blé a
été réduit de 24 à 37%. L'effet de l'accumulation
du sel dans le méristème de blé sur la reproduction et le
développement ont été étudié par Munns et
Rawson (1999), Ils ont constaté que les courtes périodes de
stress salin pendant l'organogenèse peuvent avoir des
conséquences irréversibles sur la fertilité de
l'épi de blé, elle provoque l'avortement des ovaires.
2.3.4. Effet de la salinité sur le rendement
agronomique
Les composantes du rendement tel que le nombre de talles par
plante, le nombre d'épis, le nombre d'épillets par épi et
le poids du grain, sont élaborés de façon
séquentielle dans le temps. Katergi et al. (1994) et Saadollah
Houshmand et al. (2005) ont montré que tous les
paramètres de rendement chez le blé dur subissent une
réduction sous l'action de la salinité et que, plus la
salinité est élevée plus le rendement est réduit.
De même, les travaux de Hamdy et al. (2005) ont montré
que le rendement en grains et le poids des grains sont significativement
affectés aussi bien chez le blé que chez l'orge en condition
d'irrigation avec une eau saumâtre et que la salinité a un effet
néfaste sur le remobilisation des réserves au cour de la phase de
remplissage des grains. Cette réduction du rendement en grains est
principalement attribuée au déclin du poids de l'épi et du
poids de 1000 graines. (Saadollah et al., 2005). Au stade
végétatif, la salinité affecte le développement de
l'épi et baisse le rendement (Maas et Grieve, 1990). Lorsque le
blé est soumis à un stress salin au cours de l'épiaison ou
la différenciation de l'épi, le nombre d'épillets par
épi est réduit ainsi que le nombre des grains (Munns et Rawson,
1999). La salinité diminue le rendement plus souvent en réduisant
le nombre de
pointes portant les épillets (El-Hendawy et al.,
2005). Par conséquent Maas et Grieve (1990) ont conclu que la
salinité doit être évitée avant et pendant le
développement de l'épillet pour attendre le plus haut potentiel
de rendement.
Grieve et al. (2001) ont mené une autre
étude sur l'effet du sel sur le blé de printemps où la
salinité a été imposée et retirée, avant ou
après, 1) stade premier feuille, 2) Etape double crête, et 3) la
formation de l'épi terminal. Ils ont constaté que les rendements
des céréales ont été maximisés lorsque le
stress salin a été retardé jusqu'après la formation
de l'épi terminal ou par le retrait du stress à la fin du stade
premier feuille au stade de double crête. D'autre part, ils ont
trouvé que la salinité réduit la durée de la phase
d'ouverture du primordial épillet, même si elle n'a aucun effet
sur le taux d'ouverture. Cette combinaison d'effets a provoqué une
réduction du nombre de grains par épillet, affectant gravement le
potentiel de rendement de ce type de blé.
3. Tolérance des plantes à la
salinité
Munns et Tester (2008) ont établit les limites de
tolérance à la salinité de espèces
d'intérêt agronomique, leurs classification est
déterminé selon le taux de réduction du rendement sous
l'effet du sel à divers concentration mesurer en (mM) (figure 3).

Figure 3 : Classification des plantes selon
leur niveau de tolérance à la salinité en fonction de la
concentration en sel (Munns et Tester, 2008).
3.1. Les halophytes
Les halophytes sont des plantes capables de se
développer et de croitre sous un régime salin de 300 mM de NaCl
(Tester et Davenport, 2008).ces plantes sont capables d'accumulé le
12
sodium dans leurs matières foliaires à des
concentrations élevées. Le sodium est stockés dans les
vacuoles (Glenn et al., 1999), ainsi que ces plantes présentent
une modification de leurs enzymes ce qui permettre une forte adaptation
à la contrainte saline (Flowers et Dalmond, 1992), ces plantes sont
classées selon Levigneron et al. (1995) en deux
catégories.
? Les plantes de type inclusif (includer)
La plante de type includer capte le sel, qui parvient aux
feuilles de la même façon que l'eau, par le mouvement ascendant de
la sève dans les vaisseaux. A l'intérieur des cellules, le sel
est alors stocké dans les vacuoles (qui sont des compartiments
fermés au sein de la cellule) grâce à des systèmes
de "pompes" moléculaires. Le sel est ainsi isolé. (Levigneron
et al., 1995 ; Levitt, 1980).
? Les plantes de type exclusif (excluder)
La plante de type excluder empêche le sel de remonter
jusqu'aux feuilles. Une première barrière existe au niveau de
l'endoderme, couche interne des cellules de la racine. Cependant, cette
barrière peut être interrompue, en particulier lors de
l'émergence et des ramifications de la racine. D'autres
mécanismes limitent le passage de sel des racines vers les feuilles
(Levigneron et al., 1995 ; Levitt, 1980).
3.2. Les glycophytes
Les glycophytes ne sont pas capables de survivre dans des
conditions salin mais ils utilisent certaines stratégies des halophytes
pour faire face au sel (Yokoi et al., 2002). Les glycophytes ont des
comportements soit inclusifs ou exclusifs selon les génotypes
(Chinnusamy et al., 2005).
4. Tolérance des céréales à
la salinité
La tolérance des céréales à la
salinité dépend de la variabilité génétique
telle que certaines espèces résistent à ce type de stress
biotique que d'autres. Notamment l'effet toxique des sels est moins
prononcé chez le blé tendre que le blé dur. Ce
caractère lui est conféré grâce à la
présence du Kna1, un gène responsable à l'exclusion du
sodium (Munns et al., 2008). L'orge, dépasse ces deux derniers
et arrive à croitre normalement dans des conditions
considérées comme limitantes. En effet, en additions à
l'exclusion de sodium, la plante d'orge se sert d'un autre mécanisme de
tolérance à la salinité qui se manifeste par
l'emprisonnement des sels dans un compartiment bien spécifique dans la
feuille. Ceci non seulement lui épargne leurs effets toxiques mais aussi
contrebalance la pression osmotique du sol (Munns, 2008).
Une des approches de l'amélioration de la
tolérance à la salinité chez les céréales se
base sur les ressources phylogénétiques préexistantes soit
des espèces sauvages ou apparentés.
13
Particulièrement, l'hybridation du blé dur avec
l'espèce sauvage Triticum monococcum a permis le transfert de
deux gènes responsables à la tolérance à la
salinités, Nax1 et Nax2. Le premier gène, exclue le
Na+ du xylème des racines et de la gaine des feuilles tans
disque le deuxième ne l'exclue que des racines et permet ainsi un ratio
plus élevé du K+/Na+ au niveau des
feuilles. (Caitlin et al., 2007 ; Munns et al., 2008). L'introduction
de ces deux gènes a permis l'amélioration de la tolérance
à la salinité de 25% par rapport au témoin chez le
blé dur (Munns, 2008). De même, ces gènes ont montré
leurs efficacités chez le blé tendre. L'hybridation avec une
espèce apparentée, Horneum marinum, a
conféré d'avantage une grande tolérance à la
salinité chez le blé tendre amélioré (Munns et
al., 2008).
5. Mécanisme de la tolérance à la
salinité des plantes
Les mécanismes de la tolérance à la
salinité se situent à des différents niveaux de la
plantes. Le contrôlée se fait essentiellement dans les vacuoles
(Niu et al., 1995 ; Yeo, 1998 ; Horie et Schroeder, 2004) , à
l'échelle de la plante entière, et éventuellement dans les
organes les moins sensibles (Cheeseman, 1988 ; Munns, 1993) pour
contrôler l'absorption, le transport et le stockage du sel.
5.1. Contrôle de l'absorption et le transport du
sodium
Les mécanismes physiologiques de tolérance
à la salinité au niveau de la plante entière
dépendent de la capacité de la plante de contrôler
l'absorption et le transport du sel à différentes niveaux
différents de la plante (Munns et Tester, 2008) (Figure 4).
-Contrôle de l'entrée de Na+ dans les
cellules épidermiques et corticales des racines. L'absorption initiale
de Na+ et Cl- se produit de l'exoderme à
l'épiderme, les flux apoplastique se produisent à travers
l'endoderme, la régulation de l'entrée initiale de Na+
dans les cellules corticales des racines est donc importante pour la
tolérance des plantes à la salinité (Zhu, 2001).
-Contrôle de l'entrée de Na+ dans le
xylème
L'entrée des ions Na+ dans les cellules
s'effectue grâce à des transporteurs à forte
affinité de K+, ou par des canaux de faible affinité
appelée des canaux cationiques non sélectifs qui sont fortement
influencés par les ions Ca2+. Ces canaux cationiques
permettent l'entrée d'une grande quantité des ions Na+
à partir d'un sol très salé si elles ne sont pas bien
réglementées (Amtmann et Sanders, 1999).
-Retrait du Na+ de la sève du
xylème
Le retrait de Na+ du xylème s'effectue au
niveau de la partie supérieure des racines, la partie inférieure
des tiges, et au niveau des pétioles ou des gaines foliaires.
14
15
Dans de nombreuses espèces, les ions Na+
sont conservés dans la partie supérieure du système
racinaire et dans la partie inférieure de la tige, indiquant un
échange de Na+ par K+ dans les cellules de la
stèle de la racine ou dans les faisceaux vasculaires aux niveaux des
tiges et des pétioles (Munns et al., 2006).
-Retranslocation de Na+ dans le phloème
La retranslocation de Na+ et Cl- dans le
phloème, s'effectue chez les espèces les plus tolérantes,
ce qui garantit que le sel n'est pas exporté vers les jeunes tissus
foliaires en croissance.
-Excrétion du sel sur la surface foliaire par les
glandes
Certaines halophytes possèdent ces types de cellules
spécialisées d'excrétion du sel.
Les halophytes ont bien développé des
mécanismes pour contrôler l'absorption, le transport et
l'excrétion de sel. Alors que les glycophytes s'appuient sur les trois
premiers mécanismes, avec des degrés divers alors que le
4ème est spécifique de quelques halophytes.

Figure 4 : Les points de contrôle et de
la régulation de transport du sel au niveau de la plante
(Munns, 2002).
5.2. Régulation de la concentration cytoplasmique de
sodium
La présence du sel au niveau du cytoplasme inhibe
l'activité presque de la totalité des enzymes, donc les
mécanismes de tolérance à la salinité, au niveau
cellulaire, se traduisent par le maintien du sel en dehors du cytoplasme, et
leur compartimentation dans les vacuoles de la cellule. Cela se produit dans la
plupart des espèces et s'explique par les concentrations
élevées du sel (supérieure à 200
mM) présents dans les feuilles qui fonctionnent toujours normalement,
alors que de telles concentrations détruisent complètement
l'activité des l'enzymes in vitro (Munns et al., 1983).En
général, les ions Na+ commencent a inhibé
l'activité des enzymes à une concentration ionique
supérieure à 100 mM alors que la dose toxique de Cl-
n'est pas encore bien définie bien que approximativement elle est dans
la même gamme de la concentration des ions Na+.
5.3. Le transport de sodium
Les canaux ioniques et les transporteurs qui régulent
les mouvements du sel à travers les membranes des cellules ont
été examinés par plusieurs chercheurs, il n'y a aucun
transporteur spécifique des ions Na+ mais ils font
l'entrée par la concurrence avec d'autres cations, en particulier, les
ions K+ (Amtmann et Sanders, 1999 ; Blumwald, 2000 ; Schachtman et
Liu, 1999 ; Tyerman et Skerritt, 1999).
5.3.1. L'efflux de sodium
Les ions Na+ peuvent être effluées du
cytoplasme par un antiport Na+/H+, poussés par le
gradient de pH à travers le plasmalemme (Blumwald, 2000). Ces transports
et ces processus travaillent ensemble pour contrôler la concentration
cytoplasmique des ions Na+.
Le potentiel négatif de la membrane plasmique des
cellules végétales favorise le transport passif des ions
Na+ dans les cellules. Ces ions pénètrent dans les
cellules végétales par les transporteurs de potassium à
haute affinité HKT1 (Rus et al., 2001 ; Maser et al.,
2001) et les canaux cationiques non sélectifs (Amatmann et Sanders,
1999) (Figure 5).
5.3.2. Compartimentation vacuolaires de sodium
La séquestration vacuolaire des ions Na+
réduit non seulement leurs concentrations dans le cytoplasme, mais
contribue également à l'ajustement osmotique qui maintient
l'absorption de l'eau de solution saline. D'autres organites, tels que les
plastes et les mitochondries, peuvent également accumuler des ions
Na+ et contribuer ainsi à la compartimentation
intracellulaire de ces ions toxiques. Chez l'Arabidopsis, les antiports AtNHX1
et AtNHX2 de la famille de Na+/H+ antiports jouent un
rôle déterminant au niveau dans le compartimentage de
Na+ (Blumwald, 2000). Les antiports AtNHX1 et AtNHX2 sont
localisées dans la membrane tonoplaste, et leurs niveaux de
transcription sont régulés par l'ABA au cours d'un stress
osmotique (Yokoi et al., 2002 ; Dietz et al., 2001) montrent
que les niveaux de transcription des antiports vacuolaire H+-ATP ase
également augmentent lors d'un stress salin.

16
Figure 5 : Les transporteurs ioniques de
Na+ au niveau cellulaire (Mansour et al., 2003).
5.4. Prélèvement de Potassium
Dans les conditions optimales, les plantes maintiennent un
haut ratio cytosolique K+/Na+.
Le stress salin entraîne la diminution de ce ratio, du
fait que les ions Na+ sont en concurrence avec les ions K+, ce qui
est défavorable pour les processus biochimiques cellulaires. De
même, une forte concentration de potassium augmente le potentiel
osmotique qui entraîne une entrée d'eau à partir du milieu
extérieur (Claussen et al., 1997). Le prélèvement
de K+ est essentiel pour la turgescence cellulaire et le
déroulement des processus biochimiques sous stress salin. Le niveau de
transcription des gènes codant pour les transporteurs de K+
reflète probablement une différence de capacité de la
plante à prélever le K+ sous stress salin. Par exemple
chez Arabidopsis, le stress salin augmente le niveau de transcription du
gène AtKC1correspondant à un transporteur de K+ (Pilot
et al., 2003).
6. Les plantes face au stress salin
6.1. Signalisation cellulaire
La signalisation du stress peut être de deux origines
soit liées aux ions spécifiques du sel qui est la plus probable
ou leur effet osmotique qui active la synthèse de l'acide abscissique
(ABA) induit la transcription du gène AtNHX1 qui code pour la
synthèse des transporteurs vacuolaires qui permet la
séquestration de ions Na+ (Shi et Zhu, 2002). Les ions
Na+ extracellulaire peuvent être détectés soit
par un récepteur membranaire (des protéines
17
membranaires) ou par des enzymes sensibles aux ions
Na+ cytoplasmique. Les protéines membranaires
Na+/If+ antiport peut être un capteur possible de
Na+ SOS1 (Shi et al., 2000) ainsi que transporteur (Zhu,
2003).

Figure 6: Signalisation cellulaire du stress
salin (Zhu, 2003).
6.2. La croissance et le développement des plantes
sous stress salin
Pour comprendre les divers mécanismes responsables de
la tolérance à la salinité de ces espèces, il est
nécessaire de savoir si leur croissance est affectée par l'effet
osmotique du sel dans le sol, ou\ et de son effet toxique dans la plante.
L'analyse de la réponse d'une plante au stress salin,
montre que la réduction de la croissance se déroule en deux
phases (figure 7) :
? une réponse rapide face à l'augmentation de la
pression osmotique à l'extérieur.
? une réponse plus lente en raison de l'accumulation de
Na+ dans les feuilles. Dans la première phase osmotique, (qui
commence immédiatement après l'augmentation de la concentration
du sel à un niveau seuil de la solution du sol), le taux de la
croissance diminue d'une façon significative (Munns, 1993). Le niveau
seuil est d'environ 40 mM de NaCl pour la plupart des plantes, ou moins pour
les plantes sensibles comme le riz et Arabidopsis. Cela est en grande partie
sous l'effet osmotique du sel autour des racines qui rend l'eau partiellement
inaccessible à la plante.
18
La seconde phase commence lorsque le sel s'accumule à
des concentrations élevée et devient toxique (100 mM) (Wyn et
Gorham, 2002), les vieilles feuilles qui ne sont plus en expansion, et n'ont
pas le pouvoir de diluer le sel accumulé, meurent. Pour les plantes
sensible la vitesse à laquelle les feuilles meurent est plus grande que
la vitesse à laquelle les nouvelles feuilles sont produites, la
capacité photosynthétique de la plante diminue et la plantes
meure. Tandis que pour les plantes tolérantes les jeunes feuilles se
forment rapidement et fournirent les glucides nécessaires pour maintenir
les différentes activités vitales de la plante (Munns et Tester,
2008).

Figure 7: Schématisation des deux
phases de développement des plantes tolérantes et sensible sous
stress salin (Munns, 2002).
6.3. Les différents types de réponses des
plantes à la salinité
Les mécanismes de tolérance à la
salinité peuvent être classés en trois
catégories:
? La tolérance au stress osmotique
Le stress osmotique diminue la croissance et la
productivité des plantes (Ashraf, 1994). Il ralentit le taux de division
et d'expansion des cellules, en causant une perte de turgescence qui
liée à l'insuffisance de l'eau du a l'augmentation du sel autour
des racines. Les diminutions du potentiel hydrique foliaire et de la teneur
relative en eau de la plante (TRE) observées
19
conduisent à une diminution des capacités
photosynthétiques chez la plante (Tezara et al., 2002).
Face à l'augmentation des forces de rétention de
l'eau dans un sol au cours de dessiccation, un ajustement osmotique peut se
manifester, mais à des degrés variables, chez la plupart des
végétaux. Les métabolites impliqués dans cet
ajustement sont assez variés. De fortes accumulations en potassium et en
nitrates ont été mises en évidence chez le blé
(Munns et al., 1979). L'augmentation de la teneur foliaire en
saccharose contribuerait au maintien d'une pression osmotique
élevée limitant les pertes d'eau par transpiration.
? L'exclusion de Na+ des limbes
Sous un stress salin l'exclusion de Na+ de la
plante par des divers mécanismes, ne garantie pas son accumulation avec
des concentrations toxiques dans les feuilles. Cet accumulation de
Na+ se manifeste par un effet toxique après un jour et peut
aller à une semaine, selon les espèces, et causes la mort des
feuilles âgées prématurément (Munns et Tester,
2008). Certaines espèces
? Tolérance des tissus
La tolérance des tissus exige la compartimentation
intracellulaire de Na+ et Cl- pour éviter leurs
effets toxiques dans le cytoplasme, en particulier dans les cellules de
mésophile de la feuille. La toxicité se produit après
l'augmentation de Na+ à des concentrations
élevées dans les feuilles (Munns et Tester, 2008). Cette
concentration peut être tolérée par les tissus par deux
types d'adaptations anatomiques au niveau cellulaire :
-Augmentation de la taille des cellules en raison de
l'augmentation du volume vacuolaire, suite de la séquestration des ions
toxique à l'intérieure des vacuoles.
-Partitionnement des ions à l'intérieure de
cellules, les processus de transport intracellulaires des ions toxiques
favorisent le cloisonnement de la feuille ce qui garantie que ces ions ne
seront pas stockés dans les mêmes cellules. Chez l'orge par
exemple soumis à un stress salin, il ya une grande accumulation de
Cl- dans l'épiderme et non pas dans le mésophiles,
contrairement aux ions K+, mais il n'existe aucune preuve de
partitionnement des ions Na+.
6.4. Importance de ces mécanismes
L'importance relative de ces différents processus varie
clairement avec l'espèce (c'est-à-dire, la stratégie de
certaines espèces végétales pour répondre au stress
salin) (Epstein et al., 1980), mais probablement elle varie aussi bien
en fonction de la durée d'exposition à la salinité, la
concentration de sel, et éventuellement les conditions environnementales
locales, notamment
20
l'approvisionnement en eau du sol et l'humidité relatif
de l'air, et donc le taux de transpiration des feuilles et leurs potentiel
hydrique (Greenway et Munns, 1980).
7. Mécanisme d'adaptation des plantes à
la salinité
La réponse à la salinité se manifeste
généralement chez la plupart des plantes cultivées par un
effet dépressif sur la croissance et le développement (Munns
et al., 1995). Cette réponse varie considérablement en
fonction du genre, de l'espèce et même de l'écotype ou de
la variété (Epstein et al., 1980 ; Cramer et al.,
1994). Selon le degré de la salinité dans le milieu, les
glycophytes en particulier sont exposées à des modifications de
leur comportement morpho-physiologique (Ben Naceur et al., 2001),
biochimique (Grennan, 2006) et minéral (Martinez et al., 2007). Ainsi,
les plantes réagissent à ces variations de la salinité
dans le biotope soit en déclenchant des mécanismes de
résistance (Batanouny, 1993) ou en disparaissant (Chamard, 1993).
7.1. Les mécanismes d'adaptation morphologiques
7.1.1. Réduction de la surface foliaire
La diminution du taux de croissance des feuilles, après
une augmentation de la salinité est due principalement à l'effet
osmotique du sel autour des racines. Ces effets provoquent la perte d'eau des
cellules foliaires, mais cette perte de volume et de turgescence ne dure pas
longtemps en raison du mécanisme d'ajustement osmotique, malgré
cela, le taux d'allongement et d'élongation de la cellule est
réduit. Cette réduction conduit finalement à l'apparition
des feuilles de faible surface foliaire mais plus épais.
La diminution de la surface foliaire se présente comme
étant une stratégie développée par le blé
dur, pour atténuer la limitation de la disponibilité de l'eau
dans les conditions de stress salin (Steduto et al., 2000). Alem
et al. (2002), a prouvé que le blé dur, qui affiche les
plus importantes diminutions de la surface foliaire, se présente comme
celui qui a le mieux résolu ses problèmes hydriques, alors que le
blé tendre, qui a moins réduit sa surface foliaire, n'a pas pu
résoudre ces problèmes à cause de la forte transpiration
et la faible turgescence liée à l'insuffisance d'eau. La
limitation de la diminution de la surface foliaire et la fermeture des stomates
dans le cas du blé tendre a permis à ce dernier de mieux
conserver les potentialités photosynthétiques du couvert
végétal (Sarda et al., 1993).
Cependant, au stade épiaison avec un stress salin
modéré, le blé dur se distingue par la mise en oeuvre
d'une autre stratégie, qui consiste à limiter les effets de la
diminution de la surface foliaire par une meilleure adaptation du
système photosynthétique, qui se traduit par une augmentation de
l'intensité photosynthétique. Cette augmentation, malgré
qu'elle permette de
21
compenser partiellement la diminution de la surface foliaire,
reste insuffisante pour assurer un niveau de photosynthèse du couvert
végétal qui garantît un rendement en grain normal.
Finalement, la stratégie du blé tendre, qui consiste, dans les
conditions de stress salin, à conservé leur surface foliaire pour
préserver ces potentialités photosynthétiques, et
malgré le risque des problèmes hydriques, se montre plus efficace
que celle développée par le blé dur. Ainsi, la diminution
du rendement en grain est moins prononcée dans le cas du blé
tendre que dans celui du blé dur, et ceci pour les deux niveaux de
stress salin (Alem et al., 2002).
7.1.2. Fermeture des stomates
La réduction de la transpiration est l'un des
critères les plus importants de la tolérance à la
salinité qui est corrélé avec la perception précoce
du signal de stress. L'effet primaire de la salinité est lié
à l'inhibition de la croissance induite par le déficit hydrique.
Les signaux de stress hydrique peuvent être détecté par
l'accumulation de l'ABA (Montero et al., 1998 ; sibole et al.,
2000). La perception du signal induit des mécanismes d'adaptation
ou de tolérance au sel. Par exemple, certaines espèces vivent
dans un environnement riche en sel peuvent survivre en limitant la
transpiration par la fermeture des stomates (Sibole et al., 2003).
Dans des conditions salines, l'assimilation du carbone photosynthétique
qui est le coeur de la croissance foliaire et la productivité, est
strictement réglementée par l'ouverture réduite des
stomates. Cette réduction au lieu d'être néfaste peut
être avantageuse pour les variétés tolérantes (Munns
et Tester, 2008).
7.1.3. Réduction de la transpiration
A l'échelle de quelques minutes, de la perception du
signale de stress la plante peut réduire sa transpiration en fermant ses
stomates (pores microscopiques, environ 10 000 par cm2 de feuille).
La réduction de transpiration améliore l'état hydrique des
tissus car les racines continuent à absorber l'eau alors que la
transpiration est réduite. La signalétique du contrôle
stomatique fait intervenir des messages de type chimique qui transitent entre
les racines et les feuilles par la sève xylémienne, en
particulier le pH de la sève (Wilkinson et Davies, 1997) et la
concentration d'une hormone végétale, l'acide abscissique,
synthétisée par les organes en dessèchement (Davies, 1991
; Tardieu et Davies 1993). Des plantes transformées qui
synthétisent plus de cette hormone gardent un état hydrique plus
favorable et survivent plus longtemps au stress (Iuchi et al., 2001 ;
Borel et al., 2001). Une conséquence importante de ce
mécanisme est que la plante réduit sa transpiration avant
d'être en "stress" cellulaire.
Plus tard, la plante ajuste sa transpiration via des
réductions de la surface foliaire, avec une variabilité
génétique importante de ces réductions. La surface
foliaire est un déterminisme
22
important de la transpiration. Une des premières
réactions des plantes au déficit hydrique causé par la
salinité est de réduire la surface foliaire au travers des
différents mécanismes. Il existe une variabilité
génétique importante des degrés de réaction de la
croissance au cour d'un stress (Zhang et al., 1999 ; Reymond et
al., 2003).
7.2. Les mécanismes d'adaptation physiologiques et
biochimiques
7.2.1. L'ajustement osmotique
L'ajustement osmotique joue un rôle primordial dans la
résistance ou la tolérance des plantes à la contrainte
saline (Munns, 2002). Les végétaux sont capables de supporter le
déficit hydrique engendré par le stress salin, en ajustant plus
ou moins rapidement leur potentiel osmotique avec celui du milieu
extérieur, de manière à maintenir un gradient de potentiel
hydrique entre la plante et le milieu salin (Chinnusamy et al., 2004).
En effet, la tolérance à la salinité, dans le cas d'un
abaissement du potentiel hydrique, s'exprime par un maintien de la turgescence
(Garg et al., 2002 ; Moinuddin et al., 2005) grâce au
phénomène d'ajustement osmotique qui apparaît aujourd'hui
comme un mécanisme majeur d'adaptation aux stress ionique et osmotique
et s'exprime par la capacité d'un végétal à
accumuler, au niveau symplasmique et de manière active, des ions tels
que les K+ (Parida et Das, 2005 ; Navarro et Rubio, 2006 ; Munns
et al., 2006 ; Teakle et al., 2007), des composés
organiques tels que les sucres solubles (Ottow et al., 2005) et
certains amino-acides comme la proline (Morant-Manceau et al., 2004 ;
Ayliffe et al., 2005).
Sous un stress salin Popova et al. (2002, 2003) ont
montré une expression accrue de NADP-isocitrate
déshydrogénase spécifique qui est impliquée dans la
biosynthèse de la proline. Cette dernière permet le maintien de
nombreuses fonctions physiologiques (photosynthèse, transpiration,
croissance...) (Grennan, 2006 ; Martinez et al., 2007) et intervient
à tous les stades du développement du végétal,
(Malasses, 1996).
Les osmorégulateurs permettent une protection des
membranes et des systèmes enzymatiques surtout dans les organes jeunes,
et la proline semble jouer un rôle dans le maintien des pressions
cytosol-vacuole et la régulation du pH (Ottow et al., 2005). Si
les ions Na+ et Cl-sont accumulés dans les
vacuoles de la cellule, les ions K+ et les solutés organiques
devraient s'accumuler dans le cytoplasme et les organites pour
équilibrer la pression osmotique. Les solutés organiques qui
s'accumulent le plus souvent sous stress salin sont la proline et la glycine
bétaïne, bien que d'autres molécules peuvent s'accumuler
à des moindres degrés (Hasegawa et al., 2000). De
même des sucres solubles comme les sucres simples (glucose, fructose...),
les sucres alcool (glycérol et inositol) et les sucres complexes
(tréhalose,
23
raffinose et fructane) ont été identifiés
comme des composes impliqués dans l'ajustement osmotique (Yokoi et
al., 2002).
7.2.2. Tolérance au chlorure (Cl-)
Pour les espèces qui accumulent de fortes
concentrations de Cl- dans leurs feuilles et non pas de
Na+ (par exemple le soja et les espèces qui sont couramment
cultivés sur des sols riches en Cl- tels que les vignes et
les agrumes...), la toxicité de Cl- est plus importante que
celle de Na+. Cependant, cette déclaration n'implique pas que
Cl- est métaboliquement plus toxique que Na+, mais
plutôt que ces espèces sont mieux adaptées à
l'exclusion de Na+ à partir des feuilles que le
Cl-.
Par exemple, la concentration de Na+ n'augmente pas
dans les limbes de la vigne même après culture de plusieurs
années sur des sols salins, l'exclusion de Na+ commence a
s'effectuer à partir des racines, des tige, puis les pétioles,
d'une manière à éviter son transport vers les feuilles,
alors que la concentration de Cl- augmente progressivement dans le limbe et
atteint des niveaux toxiques (Prior et al., 2007). Ainsi,
Na+ bien que plus toxique, est correctement géré par
la plante que le Cl-, qui apparaît alors comme le composant le plus
toxique.
De nombreuses études ont été faites pour
déterminer si Na+ est plus, ou moins, toxique que
Cl- par l'utilisation des différents sels a produits
équivalent des ions Na+ et Cl- mais n'ont pas
aboutit à des corrélations significatives, en raison de la
difficulté à modifier la concentration extérieure d'un ion
par un autre sans changer la pression osmotique de la solution externe ou le
taux d'absorption d'autres ions.
Pour le blé dur, la variation génétique
de la tolérance à la salinité est en corrélation
avec l'accumulation de Na+ dans les feuilles, et n'ont pas avec
l'accumulation de Cl- (Gorham et al., 1987 ; Gorham et
al., 1990).
7.2.3. Synthèse des antioxydants
Les espèces réactives d'oxygènes (ROS)
sont habituellement générés par l'activité
cellulaire normale avec des faibles concentrations, comme la photo respiration
et la B-oxydation des acides gras, et en conditions des stress, dans ces
conditions, la plante possède des enzymes et des métabolites
antioxydants suffisants pour faire face à cette faible concentration
(Yazici et al., 2007).
De nombreux travaux montrent que des métabolites
antioxydants enzymatiques telles que la vitamine C et la vitamine E, et non
enzymatiques telles que les superoxyde-dismutases (SOD), les ascorbate
peroxydases (APX), les catalases (CAT), des glutathion-S-transférases
24
(GST) et les glutathion peroxydases (GPX) s'accumulent plus
pendant le stress salin (Sudhakar et al., 2001).
Une conséquence des stress environnementaux, comprenant
le stress salin, est l'apparition du stress oxydatif (Hernandez et al.,
200), c'est-à-dire l'accumulation d'espèces réactives
d'oxygène (ROS) à des concentrations élevées
(Azevedo Neto et al., 2006), qui endommagent les structures
cellulaires (Parent et al., 2008 ; Smirnoff,1993). Ces derniers sont
à l'origine du dysfonctionnement de l'appareil photosynthétique
et les autres troubles métaboliques (Rahnama et Ebrahimzadeh, 2005). La
plupart d'entre eux sont des peroxydes d'hydrogène, des radicaux
hydroxyles et des anions superoxyde (Neto et al., 2006).
La tolérance des plantes à la contrainte saline
est fortement corrélé à leur capacité de
synthèse des antioxydants nécessaire pour faire face au ROS et de
maintient leur concentration à faible niveau dans les cellules lors du
stress (Reddy et al., 2004).
Par ailleurs, Demiral et Turkan (2004), ont montré que
les plantes ont développé des systèmes de défense
antioxydants enzymatique et non enzymatique contre les radicaux libres en
limitant leur génération.
Matériel et méthodes
25
1. Matériel végétal
Le matériel végétal étudié
au cours de cette expérimentation est constitué de vingt cinq
génotypes de blé dur (Triticum turgidum ssp durum), dont 19
génotypes autochtones et six variétés
améliorées (Tableau 1). Les semences ont été
fournies par la Banque Nationale des Gènes (BNG, Tunis, Tunisie).
Tableau 1 : Génotypes de blé dur
utilisés dans l'expérience.
|
Génotypes autochtones
(1) Aoudhay (11) Souri
|
Génotypes améliorés
(20) Razzek
|
|
(2) Jneh Khottifa
|
(12) INRAT 69
|
(21) Karim
|
|
(3) Beskri Pubescent
|
(13) Ward Bled
|
(22) Om Rabiaa
|
|
(4) Agili
|
(14) Arbi
|
(23) Nasr
|
|
(5) Bidi AP4
|
(15) Hamira
|
(24) Maali
|
|
(6) Azizi
|
(16) Sbey
|
(25) Khiar
|
|
(7) Bayadha
|
(17) Chili
|
|
|
(8) Swebei Algia
|
(18) Agili Glaber
|
|
|
(9) Derbessi
|
(19) Richi
|
|
|
(10) Mahmoudi
|
|
|
2. Réseau multilocal d'évaluation des
variétés
Les expérimentations ont été conduites dans
trois stations différentes au centre de la Tunisie. -Au centre
d'expérimentations de l'institut de grande culture Echbika (Site
Kairouan).
- A la ferme du centre de formation professionnel agricole de
Souassi (Site Mahdia).
-A la ferme de l'office des terres domaniales (OTD) Touilla (Site
Sidi Bouzid).
2.1. Caractéristiques climatiques du réseau
d'essais
Les conditions climatiques (température min et max et
la pluviométrie) ont été enregistrées durant le
déroulement des essais de Echbika et Sidi Bouzid (Annexe 1 et 2). Le
site d'Echbika est caractérisée par une pluviométrie
totale de 98 mm alors que le site de Sidi Bouzid a enregistré une faible
pluviométrie n'a pas dépassé 55,8 mm. Les moyennes des
températures min et max semblent être similaire dans les deux
sites, en effet, elles sont de l'ordre de 9,11 et 21 ,9 °C respectivement.
L'évapotranspiration de référence (ET0) des deux sites a
été estimée par le logiciel MABIA-ET0 (Jabloun et Sahli,
2004) pour déterminer les besoins en eau de la culture de blé en
irrigué.
26
2.2. Caractéristiques édaphique du
réseau d'essais
2.2.1. Analyse du sol
Une analyse du sol avant le semis et après la
récolte des trois stations a été effectuée, pour
cela nous avons prélevé un échantillon de chaque bloc sur
trois horizons (0-20, 20-40 et 40-60 cm) pour déterminer les
paramètres suivants : Le pH du sol a été mesuré
avec un pH-mètre dans un extrait de 1/25 selon le procédé
de Pawels et al., (1992) ; La conductivité électrique ECe a
été mesurée dans un extrait de 1/5 selon le
procédé de Pawels et al., (1992) ; Les teneurs en sodium, le
potassium et le calcium ont été déterminés par
photométrie de flamme après extraction avec l'acétate
d'ammonium (1N) selon la méthode présentée par Pawels et
al., (1992).
2.2.2. Analyse de l'eau d'irrigation
- Site de Kairouan : l'eau d'irrigation de cette station
provient d'un forage profond ; elle est caractérisée, par une
conductivité qui ne dépasse pas 2,8 mS cm-1.
- Site de Mahdia: l'eau d'irrigation de cette station provient
d'un puits; la conductivité de cette eau est de 9,25 mS cm-1.
- Site de Sidi Bouzid : l'eau d'irrigation provient d'un
forage profond ; elle possède une conductivité de 6,23 mS cm-1 et
présente un risque élevé de salinisation des sols.
L'analyse des eaux d'irrigation utilisées durant
l'essai a permet de déterminé les paramètres suivants : la
mesure du pH s'effectue à l'aide d'un pH-mètre directement sur
les échantillons d'eau de chaque site ; la conductivité
électrique a été mesurée dans les
échantillons d'eaux par un conductiviomètre ; Les teneurs en
sodium, le potassium et le calcium sont déterminés au
photomètre à flamme, les valeurs obtenues sont projetés
sur la courbe d'étalonnage (Annexe1).
3. Dispositif expérimental
Le dispositif expérimental est en alpha blocs complets
randomisé, avec trois répétitions afin d'équilibrer
le voisinage de chacune des variétés (CycDesignN 4, David
Whitaker, 2009). Chaque parcelle élémentaire (plot ou
unité expérimentale) occupée par une variété
donnée est constituée de dix rangs de 1 m de long, espacés
de 0,2 m soit une superficie de 2m2. Chaque bloc est occupé
de 25 parcelles élémentaires ayant des dimensions 2m × 1m
espacées les unes des autres de 0,5m. Les blocs sont espacés de
2m. Ainsi, la surface occupée par l'essai est de
7×40=210m2 (Figure 3).

8
12
24
13
25
19
24
7
25
5
15
8
3
18
6
12
16
13
22
17
20
2
20
9
21
1
4
19
14
11
10
23
15
25
16 1 6
2
21
18 22 21
9
1
11
5
2
8
3
14
15 7 10
27
28
12
10
18
23
Figure 8: Dispositif expérimental en
alpha bloc (Belhaj Fraj, Comm. Pers.).
22
17
13
11
5
24
19
9
4
14
3
7
16
6
17
20
4
23
4. Itinéraire technique de conduite des
expérimentations
4.1. Opérations d'implantation
Les travaux de préparation du sol ont consisté en
un labour moyen à l'aide d'un outil a
disques en deux passages, pour le déchaumage et la
préparation du lit de semences. Les dates
de semis sont résumées dans le tableau 2. La
densité de semis est de 300 grains/m2. Cet essai a
été protégé par un filet
anti-moineaux et une clôture (Figure 1).
Tableau 2 : Dates de semis aux
différents sites expérimentaux.
Site expérimental code Date de semis
Kairouan, Chbika S1 24 Novembre 2009
Mahdia, Souassi S2 03 Décembre 2009
Sidi Bouzid* S3 14 janvier 2010*
*Le retard de semis enregistré au site de Sidi Bouzid (1,5
mois) est attribué aux attaques des oiseaux lors du premier semis.

Planche 1 : vue général de la
parcelle expérimentale
4.2. Pilotage de la fertilisation et de l'irrigation
La dose totale d'azote apportée étant de 75
kg/ha répartie équi-proportionnellement en trois apports aux
stades trois feuilles, début tallage et épiaisons, sous forme
d'ammonitrate (33,3 % d'N). L'épandage d'ammonitrate a été
pratiqué manuellement afin d'effectuer une répartition
homogène à chaque plot. Les irrigations ont été
effectuées à la goutte à goutte (Figure 2) à une
fréquence moyenne d'une fois tous les quatre jours, la dose de chaque
irrigation et la quantité totale d'eau utilisée sont
résumées dans tableau 3.
Tableau 3 : Pilotage des irrigations.
|
Site
|
Dose
|
Surface irriguée
|
Nombre d'irrigations
|
Quantité totale
|
|
Kairouan
|
20,5mm
|
210m2
|
20
|
410 mm
|
|
Souassi
|
20,5mm
|
210m2
|
20
|
410 mm
|
|
Sidi Bouzid
|
15mm
|
210m2
|
30
|
450 mm
|

29
Planche 2 : Vue générale du
système d'irrigation.
5. Mesure d'évaluation des génotypes
Cette étude présentera les principaux
paramètres utilisés pour décrire et identifier les 25
génotypes de blé dur étudiés soit au stade
floraison, soit au stade maturation, en se basant sur l'échelle de
Zadoks pour chaque paramètre mesuré, ainsi que leurs interactions
avec son environnement, selon la procédure d'échantillonnage
suivante (Figure 4).
Au niveau de chaque plot, trois prélèvements de
plante ont été effectué sur deux rangs de 0,5m chacune.
Cet échantillonnage a servi de mesurer des paramètres
agronomiques et physiologiques. Le premier prélèvement a
été réalisé à la levée pour
déterminer le nombre de plantes par unité de surface, le
deuxième au stade floraison pour déterminer le nombre de talles
par plantes, la biomasse et la surface foliaire, alors que le troisième
échantillonnage a été effectué au stade
maturité pour déterminer les composantes de rendement. Le reste
de la placette a servi pour la récupération des semences.

30
Figure 9: Procédure
d'échantillonnage à chaque parcelle élémentaire
(Belhaj Fraj, Comm. Pers.).
5.1. Mesure des paramètres agronomiques
Le nombre des plantes est déterminé au stade
trois feuilles suite à un comptage manuel sur une placette de
0,25m2 de chaque parcelle élémentaire. La hauteur de
la plante est mesurée au stade anthèse chez tous les
génotypes étudiés. La mesure prise, en centimètre,
du collet jusqu'au sommet de l'épi terminal du maître brin sur
trois plantes prises au hasard. Le nombre de talles herbacées est
déterminé au stade floraison sur trois plantes de chaque parcelle
élémentaire. Le nombre de talles épiées est
déterminé au stade floraison sur trois plantes de chaque parcelle
élémentaire. La surface foliaire de la feuille drapeaux a
été mesurée au stade floraison sur trois plantes par
parcelle élémentaire. Les feuilles ont été
scannées par un scanner de résolution (150 pixcel) et la
superficie a été déterminée à l'aide d'un
logiciel de traitement des images (Image-Pro Plus 6.0).
La matière sèche appelé biomasse a
été déterminée au stade floraison et à la
récolte. Les échantillons de trois plantes prises au hasard par
parcelle élémentaire ont été séchés
à l'étuve à 80°C pendant 48 heures, avant leur
pesée à l'aide d'une balance (Mettler) au 1/100 g.
31
A la récolte, nous avons effectué un
échantillonnage au niveau de chaque parcelle élémentaire.
Le prélèvement des échantillons est effectué sur
deux lignes de 0,5 m au centre de la parcelle pour éviter l'effet
bordure. L'échantillonnage s'effectue donc sur une superficie de
0,25m2, puis les différents paramètres seront
estimés sur 1m2. Toutes les plantes situées dans la
placette sont arrachées et servent à déterminer les
paramètres suivants ; Le poids moyen des épis a été
déterminé sur les épis collectés à la
récolte, après leur séchage à l'étuve,
à 80°C, pendant 48 heures. Le Nombre d'épillets par
épi est déterminé suite à un comptage manuel des
épillets de cinq épis pris au hasard de chaque parcelle
élémentaire. Pour la détermination du nombre de grains par
épi, 20 épis pris au hasard de chaque parcelle
élémentaire ont fait l'objet d'un battage suivi d'un comptage du
nombre de grains résultants moyennant un compteur à grains
électronique. Les grains des 20 épis sont pesés. Le poids
de mille grains est alors déterminé. L'estimation du rendement
est effectuée par la conversion du rendement du gramme par mètre
carré en quintaux par hectare.
5.2. Dosage des ions minéraux
-Protocole
Le matériel végétal utilisée est
les feuilles drapeaux du talles principale de trois plantes pour chaque
parcelle élémentaire qui sont séchés à
l'étuve à 70-80°C jusqu'à l'obtention d'un poids
constant, par la suite ces échantillons sont réduit en poudre
à l'aide d'un broyeur suivie d'une calcination.
-Principe de minéralisation
500 mg du matériel végétal sont
introduits dans des capsules en quartz. Les capsules sont placées dans
un four dont la température est augmentée progressivement
jusqu'à 200°C et qui est ainsi maintenue jusqu'à la fin du
dégagement de fumées puis on l'augmente la température
jusqu'à 450°C et on la maintient pendant 2 heures.
Après refroidissement, les cendres sont
humectées avec quelques gouttes d'eau distillée puis on ajoute 20
ml de HNO3 dilué au 1N. Puis on évapore à sec sur une
plaque chauffante. Après avoir ajouté 20 ml de HNO3 dilué
au 1N, on laisse en contact 10 minutes et on filtre dans des fioles
jaugées de 50ml. Après avoir ajusté avec de l'eau
distillée au trait de jauge puis homogénéisé par
agitation manuelle, les solutions sont transvasées dans des godets
préalablement rincés avec de l'eau distillée.
-Dosage du sodium (photométrie à flamme)
32
Les solutions sont passées au dosage par photomètre
à flamme. Les valeurs obtenues sont projeté sur l'axe des
abscisses pour déterminer les concentrations en sodium à partir
de la courbe d'étalonnage (Annexe 3), puis on les converties en teneur
en sodium (mg/g MS). -Dosage de potassium (photométrie à
flamme)
Ce dosage se fait aussi par le même principe,
l'étalonnage du photomètre pour le dosage de potassium est
similaire à celui de sodium.
6. Analyses statistiques
Toutes les variables réponse mesurées sur tous
les génotypes ont été analysées selon le
modèle d'analyse de la variance compatible avec le plan
expérimental, pour tester les effets du site et du génotype et
leurs éventuelles interactions sur la variation des paramètres
étudiés. Les moyennes des différents paramètres
mesurées sont déterminées sur trois plantes. La
comparaison des moyennes a été réalisée par le
teste de déférence significatif (LSD) au seuil de 1 et 5%.
L'étude de la corrélation a été
basée sur la moyenne des observations à travers les 3
répétitions de chaque génotype et pour les
différents caractères mesurés. Cette analyse permet
d'apprécier corrélation entre deux variables quantitatives. De ce
fait, elle est utilisée pour identifier la relation des
caractères étudiés entre eux.
A la suite, des statistiques descriptives ont
été effectuées sur les scores originaux des variables
réponses. Une analyse en composante principale (ACP) a été
réalisée pour étudier la répartition des
génotypes en fonction des paramètres étudiés. Ces
analyses ACP ont été réalisées e utilisant le
logiciel XLSTAT 2003 version 5.2.
1
Résultats et discussions
33
1. Dynamique de salinisation du sol
Le degré de salinisation d'une superficie
irriguée dépend de plusieurs facteurs dont (i) la qualité
de l'eau d'irrigation, (ii) les caractéristiques du sol et (iii) les
conditions climatiques. Chacun de ces facteurs fait intervenir un certain
nombre de paramètres. La salinisation d'un sol peut être due
à la combinaison de l'un ou de plusieurs de ces facteurs.
L'accumulation progressive des sels peut entrainer une perte
de la fertilité du sol, surtout quand les sels de sodium dominent.
L'effet négatif du sel se traduit par une dégradation de la
structure du sol et une modification de sa perméabilité suite
à une dispersion des argiles par substitution de Ca2+ par
Na+. L'irrigation et les pluies entrainent un lessivage du
Ca2+ échangé, d'où une dégradation de la
structure du sol (Kelley, 1963).
La caractérisation des sols de chaque site a
été réalisée avant le semis. Dans le but d'analyser
sommairement l'évolution de la salinisation du sol, nous avons
procédé à une seconde analyse de la conductivité
électrique et du pH après la récolte et ce au niveau des
trois sites (annexes 5 et 6).
L'étude morphologique des sols a montré la
prédominance d'une texture argileuse au niveau du site de Kairouan,
sableuse au niveau du site de Souassi et sablo-limoneuse à Sidi Bouzid.
La texture au niveau des sites S2 et S3 confère aux sols un pouvoir
filtrant très important.
1.1. pH
Le pH est généralement compris entre 7,6 et 8,2,
il est en générale de faible alcalinité (Annexe 5 et
6).
1.2. Teneur en sels
La conductivité électrique constitue un bon
indicateur de la teneur du sol en matières minérales dissoutes,
elle nous renseigne sur la teneur en sels dans le sol.
Au niveau du site de Kairouan, la salinité augmente
progressivement avec la profondeur, elle passe de 1,19 g/kg de sol dans le
niveau (0-20 cm) à 2,8 g/kg dans le niveau (40-60 cm) ce qui est
expliqué par l'accumulation du sel dans les niveaux profonds par
infiltration.
La solution extraite du sol, au niveau du site de Souassi,
montre une salinité élevée allant de 1,96 à 6,02
g/kg. Les teneurs les plus faibles sont enregistrées entre 0-20cm 2,03
g/kg mais, elles augmentent avec la profondeur et atteignent des valeurs
très élevées (6,79 g/kg). La texture sableuse du sol
favorise l'infiltration des eaux et l'accumulation des sels aux niveaux
profonds. Cette forte salinité est attribuée à la
qualité de l'eau d'irrigation préalablement salée (Robert,
1998).
34
A Sidi Bouzid ce sont la texture sablo-limoneuse des sols et le
degré de salinité des eaux d'irrigation qui ont favorisé
l'accumulation des sels dans les niveaux profonds.
2. Analyse de l'eau
L'eau d'irrigation constitue le principal facteur de
différence entre les trois sites. Les résultats de l'analyse
chimique des eaux d'irrigation sont illustrés dans le tableau 4 :
Tableau 4: Analyse de l'eau d'irrigation au
niveau des trois sites.
|
Site
|
pH
|
CE mS/cm
|
[Na+] ppm
|
[K+] ppm
|
Salinité g/l
|
|
Kairouan
|
7,98
|
2,29
|
1380
|
20
|
1,9
|
|
Souassi
|
7,39
|
9,25
|
5600
|
14
|
6,47
|
|
Sidi Bouzid
|
7,43
|
6,28
|
4200
|
18
|
4,39
|
2.1. pH
Le pH est important à connaitre, il permet
indirectement l'évaluation de l'agressivité chimique des eaux. Au
niveau des trois sites le pH est généralement compris entre 7,4
et 7,9, n'étant pas acides ou fortement alcalines, les eaux d'irrigation
sont peu agressives par rapport aux constituants du sol.
2.2. Teneur en sels
La salinité peut être calculée à
partir de la conductivité électrique (CE) qui est l'expression de
la charge des éléments dissous et rend compte de la
minéralisation des eaux par la quantité d'ions en solution
(Nicod, 1973).
La salinité la plus forte est enregistrée au
niveau du site S2, elle est de 6,79 g/kg suivi de celle enregistrée dans
le site S3 (4,34 g/kg). Quant à la conductivité la plus faible,
de l'ordre de 1,96 g/kg, elle est enregistrée au niveau du site S1.
La salinité des eaux des deux sites (S2 et S3),
dépassent 1,75 g/kg (tableau1), valeur seuil fixée par les normes
européennes et l'OMS (OMS, 2000). Elles appartiennent aux classes 3 et 4
de moyenne et mauvaise qualité (Ministère de l'environnement,
2002) et constitue un facteur limitant pour la productivité agricole et
un risque de salinisation des sols.
Au niveau de site S1 la conductivité électrique
de l'eau est dans les normes, et considérée de bonne
qualité pour l'agriculture et ne constitue pas un risque de
salinisation.
35
3. Elaboration du rendement
3.1. Rang de variation des variables
Pour l'ensemble du réseau multi local
d'évaluation des variétés autochtones de blé dur en
comparaison aux variétés témoins améliorées,
le rendement en grains obtenu a varié de 2,3 à 6,2 t ha-1
(Tableau 5). Ces rendements sont comparables à ceux obtenus dans des
conditions de culture intensive. La réduction du rendement a
été de 44% dans le site Sidi Bouzid, elle est due à un
retard de semis d'un mois à la date conventionnelle de semis. De plus,
le site de Souassi ayant la salinité de l'eau d'irrigation la plus
élevée a enregistré des rendements élevés,
ceci est en relation avec le précédent des cultures
maraîchères. La moyenne de rendement de 4,1 t/ha correspond
à un peuplement épis de 320 épis/m2 et d'un
peuplement levé de 270 plantes/m2 sont dans la norme de
production intensive de blé dur (Lattiri, 1992). La salinité de
l'eau d'irrigation a provoqué la réduction du BA FLO, SF, NE,
NGNE et PMG de 21, 26, 36, 35 et 13%, respectivement.
Le nombre d'épis est fortement corrélé au
nombre de grains (R2=0,81), la biomasse au stade floraison est
corrélée au nombre de plantes (R2=0,75) et le nombre
de grains est négativement corrélés au nombre de plantes
(R2=-0,5) (Annexe 9). Ces différents variables ont des rangs
de variation similaires. En effet, les rendements les plus faibles ont
été obtenus au niveau du site de Sidi Bouzid, alors que les
rendements les plus élevés ont été obtenus au
niveau du site de Kairouan.
Tableau 5 : Statistiques descriptives des
variables : NP, PMG, NGNE, BIO FLO, NE et le
rendement RDT des différentes variétés de
blé dur cultivées au niveau des trois sites.
|
NP
|
NE
|
BIO
FLO
|
NGNE
|
PMG
|
RDT
|
|
Minimum
|
191
|
234
|
98
|
5037
|
41
|
23
|
|
1er quartile
|
236
|
278
|
129
|
6590
|
44
|
31
|
|
Médiane
|
249
|
322
|
153
|
7513
|
47
|
38
|
|
3ème quartile
|
256
|
355
|
175
|
9263
|
50
|
50
|
|
Maximum
|
267
|
410
|
219
|
10917
|
57
|
62
|
|
Moyenne
|
243
|
319
|
154
|
7752
|
47
|
41
|
|
Ecart-type
|
18
|
45
|
33
|
1515
|
4
|
11
|
NP, nombre de plantes ; NE, nombre d'épis/m2
; BIOFLO, biomasse au stade floraison ; NGNE, nombre de grains/épis ;
PMG, poids de mille grains ; RDT, rendement en grains.
36
L'effet du stress salin semble influencer plus
l'élaboration du rendement des différentes variétés
testées en préfloraison, la réduction du nombre
d'épis est en corrélation avec celle de la biomasse
aérienne totale, ce qui est en accord avec les résultats de
Sevilla (1995) qui a considéré le nombre d'épis comme la
première composante du rendement ayant une corrélation
génétique significative avec le rendement.
3.2. Classement général des
génotypes
Le classement général des variétés
sur les moyennes des trois sites à permet la distinction de quatre
groupes : le premier est composé par les variétés
améliorées Razzek (20), Karim (21), Om Rabiaa (22), Nasr
(23), Maali (24) et Khiar (25), le deuxième groupe est
composé par les variétés autochtones Jneh Khottifa
(2), Ward Bled (13,) Bayadha (7) et Richi (19). Le
troisième groupe est composé par les variétés
anciennes Derbessi (9), INRAT 69 (12) et Chili (17) à faible
production en grain et en paille. Le quatrième groupe est formé
par les variétés anciennes Aoudhay (1), Beskri Peubscert (3),
Agili (4), Bidi AP4 (5), Azizi (6), Swebei Algia (8), Mahmoudi (10), Souri
(11), Arbi (14), Hamira (15), Sbey (16) et Agili Glabre (18) (Figure
13).
Les variétés améliorées (premier
groupe) sont plus performantes par rapport aux autochtones et se
caractérisent par un rendement en grain important et un faible rendement
biologique. Les variétés du deuxième groupe sont
caractérisés par un rendement biologique importante et un
rendement en grain plus au moins considérable et se rapprochent des
variétés améliorées et peuvent donc avoir une
double utilisation en grain et en paille. Les variétés du
troisième groupe sont caractérisées par un rendement
faible en grain et en paille. Les variétés du quatrième
groupe sont plutôt caractérisées par un rendement
biologique important mais un faible rendement en grains.
Nos résultats ont montré que le potentiel de
production des variétés améliorées dépasse
celui de toutes les autres variétés testées, confirmant
ainsi des travaux antérieurs notamment ceux de de Maamouri et
al. (1998). Le rendement en grains est une caractéristique
variétale et son amélioration serait donc une tâche
relativement complexe. Ces difficultés sont attribuées au fait
que le rendement en grains est un caractère polygénique,
conditionné par le potentiel génétique de la
variété et largement affecté par l'environnement
(Abbassenne et al., 1998).
60
I
55
50
45
40
35
30
Rendement en grain
25I
20
37
|
24
20
23 21
|
|
22
25
13
|
|
7
19
|
II
2
|
|
II
|
9
17
|
12
|
8
6 4 11
10
15 5
16
18
|
3
|
1
|
14
IV
|
1000 1200 1400 1600 1800
Rendement biologique
Figure 10 : Classement général
des variétés selon le rendement biologique (axe des abscisses) et
le rendement en grains (axe d'ordonnées).
3.3. Analyse multivariée
L'analyse en composantes principales (ACP) permet une
meilleure discrimination des variétés selon les variables
utilisées pour la discrimination. Ainsi, une ACP a été
réalisé pour vérifier le classement
précédant réalisé sur la moyenne des trois sites.
L'ACP présentée dans la figure 14, donne une estimation de la
variabilité représentée par chaque. En se limitant aux
deux premiers axes, l'analyse en composantes principales montre que les deux
axes (ACP1 et ACP2) représentent 69% de la variabilité totale. Le
nombre de grains par épi (NGNE), le nombre d'épis par
m2 (NE), le rendement en grain (RDT), la biomasse au stade floraison
(BIO FLO), la biomasse au stade maturité complète (BIO MAT) et
à moindre degré la surface foliaire (SF) sont les
paramètres qui discriminent le mieux les variétés
étudiées. L'axe (ACP1) représente 52% de la
variabilité totale. Il représente une combinaison linéaire
des paramètres NE, NGNE, PMG et RDT. L'axe (ACP2) représente 18%
de la variabilité totale, il est influencé par BIO FLO, SF et BIO
MAT. Le rendement (RDT) semble représenter le composant le plus
important généré par cette ACP (Figure 11). En tenant
compte de la signification des axes, nous avons analysé la
répartition des variétés dans le plan engendré par
les deux axes ACP1 et ACP2. La distribution des individus montre l'existence de
trois
38
groupes de variétés. Le premier groupe est
formé par les variétés améliorées Razzek
(20), Karim (21), Om Rabiaa (22), Nasr (23), Maali (24) et Khiar (25) qui
se caractérisent par le nombre d'épis, le nombre de grains, le
PMG et le rendement les plus importants et une faible production en
matière sèche au stade floraison et maturité. Le second
groupe est formé par les variétés autochtones Jneh
Khotifa (2), Bayadha (7), et Richi (19) qui se caractérisent par un
rendement en grain et un rendement biologique importants. Alors que le reste
des variétés Aoudhay (1), Beskri Peubscert (3), Agili (4),
Bidi AP4 (5), Azizi (6), Swebei Algia (8), Derbessi (9), Mahmoudi (10), Souri
(11), INRAT 69 (12) Arbi (14), Hamira (15), Sbey (16), Chili (17) et
Agili Glabre (18) se trouvent confondues et forment le troisième
groupe qui se caractérise par le nombre d'épis, le nombre de
grains, le PMG et le rendement en grain les plus faibles et une importante
production en matière sèche. Les deux premiers groupes sont
diamétralement opposés au troisième groupe par rapport
à l'axe de la composante principale (ACP2), et ont montré une
similarité pour le nombre de grains, le nombre d'épis et le
rendement et semblent être les plus performants. En effet leur
productivité est étroitement liée aux nombre d'épis
et de grains élevés par unité de surface. Le
troisième groupe se montre le moins performant (figure 14).
39
|
Axe ACP1 (45 %)
|
-4 -2 0 2 4
Axe ACP1 (45 %)
|
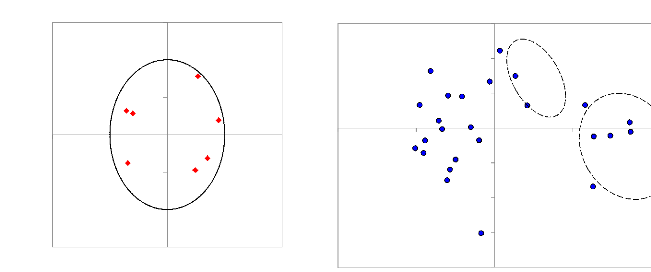
1,5
1
0,5
0
Axe ACP2 (18 %)
-0,5
-1
Variables (axes F1 et F2 : 64 %)
NE
BIO FLO
BIO MAT
NGNE PMG
-1,5
RDT
SF
-2 -1 0 1 2
Individus (axes F1 et F2 : 64 %)
13
1
17
3
5
2
19
22
7
14
15 4
10
16 9
18
8
6
1
20
2 23
21
25
24
3
2
-3
-4
1
0
-1
Axe ACP2 (18 %)
-2
(A) (B)
Figure 11 : Analyse en composantes principales,
(A) projection des variables sur les deux axes ACP1 et ACP2, (B) distribution
des variétés dans le plan sur les deux axes ACP1 et ACP2.
40
4. Interaction variété x
salinité
4.1. Site Kairouan
Les données centrées réduites montrent
que les variables NG, RDT et NGNE sont les plus corrélées au
premier axe ACP1, alors que BIO MAT et BA FLO au deuxième axe ACP2.
L'analyse en composantes principales (Figure 12) réalisée sur
l'ensemble des variétés sous un régime hydriques non salin
ou témoin a permet d'identifier des groupes de variétés
ayant des caractéristiques semblables. Les deux premiers axes expliquent
une très bonne part de la variabilité existante (69%). Le plan
formé par ces deux axes nous a permis de départager les
variétés en trois principaux groupes. Le premier groupe est
constitué des variétés améliorées Razzek
(20), Karim (21), Om Rabiaa (22), Nasr (23), Maali (24) et Khiar (25) qui
se caractérisent par le nombre d'épis, nombre de grains, poids de
mille grains et le rendement en grain le plus élevé et une faible
biomasse au stade floraison et maturité, elles sont
considérées comme les plus performantes. Le second groupe
renferme les variétés Jneh Khottifa (2), Bayadha (7),
Derbessi (9) et Richi (19) qui s'écartent statistiquement et
forment un groupe qui a tendance à se rapprocher du premier groupe. Ce
groupe se caractérise par un nombre d'épis, un nombre de grains
et un rendement en grains et en paille important, qui leur confère une
dualité d'utilisation. Le troisième groupe est constitué
par les génotypes autochtones Aoudhay (1), Beskri Peubscert (3,)
Agili (4), Bidi AP4 (5), Azizi (6), Swebei Algia (8), Mahmoudi (10), Souri
(11), INRAT 69 (12), Arbi (14), Hamira (15), Sbey (16), Chili (17) et
Agili Glabre (18) qui se caractérisent par une production de
biomasse au stade floraison et maturité important et ayant le nombre
d'épis, le nombre de grains et le rendement en grains le plus faible et
sont considérées comme variétés à vocation
fourragère.
L'analyse en composante principale a permet d'élargir
nos connaissances sur les potentialités de rendement des
différentes variétés de blé dur sous irrigation par
l'eau chargée et de les regrouper selon leurs caractères
semblables.
L'évaluation des différentes
variétés au champ et sous conditions non stressantes, montre la
performance des variétés améliorées et des
variétés autochtones Jneh Khottifa (2), Bayadha (7), et Richi
(19) pour la production en grains par rapport au reste des
variétés testées.
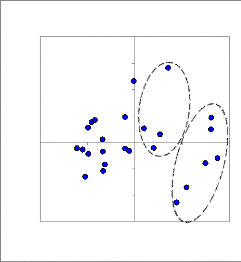
Axe ACP2 (18 %)
-1
-2
-3
4
3
2
0
1
-4 -2 0 2 4
Individus (axes ACP1 et ACP2 : 69 %)
3
16
514
18
17 10
Axe ACP1 (52 %)
1
12
15
11
6
4
9
8
13
19
7
2
21
23
24
25
22
20

-00Axe ACP2 (18 %)
Ax
-0,5
-1,5
1,5
-1
,5
0
1
-1,5 -1 -0,5 0 0,5 1 1,5
Variables (axes ACP1 et ACP2 : 69 %)
Axe ACP1 (52 %)
BIO
FLO
SF
BIO MAT
NGNE PMG
NE
RDT
41
Figure 12 : Analyse en composantes principales
(Site Kairouan), Projection des variables sur
les axes ACP1 et ACP2 et
répartition des variétés dans le plan des axes ACP1 et
ACP2.
4.2. Site Sidi Bouzid
L'analyse en composante principale des différents
paramètres mesurés au niveau du site Sidi Bouzid (Figure 13) a
montré que les paramètres RDT, NGNE, NE et le PMG se trouvent
corrélés au deuxième axe, alors que les paramètres
BIO MAT et BIO FLO se trouvent corrélés au premier axe
inversement à ce qui a été noté au niveau des
autres sites. La distribution des variétés dans le plan suivant
les deux axes n'a pas gardé le même regroupement. Les
variétés apparaissent dispersées dans le plan, ce qui ne
permet pas de les classer selon la contribution des deux axes. Ces
constatations peuvent être expliquées par
l'hétérogénéité notée au niveau de la
parcelle expérimentale liée aux diverses contraintes naturelles
durant cette compagne et influant le rendement, ainsi que le retard du semis
d'un mois par rapport à la date conventionnelle de semis ce qui
influence négativement le rendement.

Axe ACP2 (25 %)
Variables (Axes ACP1 et ACP2 : 53
%)
- 0,5
- 1,5
0,5
1,5
-1
0
1
-2 -1 0 1 2
Axe ACP1 (29 %)
NGNE
NE
RDT
PMG
SF
BIO MAT
BIO FLO
3
2
1
0
- 1
- 2
Axe ACP2 (25 %)
- 3
- 4
5
8
15 162
18
13
4
Individus (Axes ACP1 et ACP2 : 53 %)
20
25
21
9 1
23
24
22
6
12
-4 -2 0 2 4
Axe ACP1 (29 %)
7
11
14 3
17
10
19
42
Figure 13 : Analyse en composantes principales
(Sidi Bouzid), Projection des variables sur
les axes ACP1 et ACP2 et
répartition des variétés dans le plan des axes ACP1 et
ACP2.
4.3. Site Souassi
L'analyse de la figure 14, montre que les variables NG, NGNE,
PMG et RDT sont les plus corrélée au premier axe ACP1 et les
variables BA FLO et BA MAT au deuxième axe ACP2. L'analyse en
composantes principales réalisée sur l'ensemble des
variétés sous régimes hydriques salin a permis
d'identifier des groupes de variétés ayant des
caractéristiques semblables. Les deux premiers axes qui ont
été retenus, expliquent une très bonne part de la
variabilité existante soit 64%. Le plan formé par ces deux axes
nous a permis de départager les variétés en trois
principaux groupes selon leurs caractéristiques semblables. Le premier
groupe est constitué des variétés améliorées
Razzek (20), Karim (21), Om Rabiaa (22), Nasr (23), Maali (24) et Khiar
(25) qui sont caractérisées par un haut rendement en grains
et considérées comme les plus performantes. Le second groupe est
constitué par les variétés (Jneh Khotifa (2), Bayadha
(7) et Ward Bled (13) qui forment un groupe qui a tendance à se
rapprocher du premier groupe. Ce groupe se caractérise par un rendement
en grains et en paille important leur confèrant une double vocation en
grains et en fourrage. Le troisième groupe renferme les
variétés autochtones Aoudhay (1), Beskri Peubscert (3), Agili
(4), Bidi AP4 (5), Azizi (6), Swebei Algia (8), Derbessi (9), Mahmoudi (10),
Souri (11), INRAT 69 (12), Arbi (14), Hamira (15), Sbey (16), Chili (17),
Agili Glabre (18,), et Richi (19) caractérisées
par une faible production en grains et une forte production de
biomasse, et peuvent être à destination fourragère.
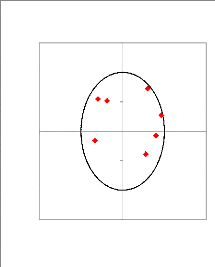
Axe ACP2 (19 %)
-0,5
-1,5
0,5
1,5
-1
0
1
Variables (Axes ACP1 et ACP2 : 64 %)
-2 -1 0 1 2
Axe ACP1 (44 %)
BIO FLO
BIO MAT
SF
NGNE PMG
NE
RDT

Axe ACP2 (19 %)
-1
-2
-3
4
3
2
0
1
-4 -2 0 2 4
Individus (Axes ACP1 et ACP2 : 64
%)
10
3
Axe ACP1 (44 %)
16
18
5
14
17
11
12
415
1
8
6
9
19
7
13
2
22
23
21
20
24
25
43
Figure 14 : Analyse en composantes
principales (Site Souassi), Projection des variables sur les axes ACP1 et ACP2
et répartition des variétés dans le plan des axes ACP1 et
ACP2.
4.4. Conclusion
L'analyse en composante principale a permis d'élargir
nos connaissances sur le comportement des différentes
variétés de blé dur cultivées sous irrigation par
l'eau chargée. Cette analyse a permis également de regrouper ces
variétés selon les différents paramètres
étudiés. En effet, les ACP au niveau des trois sites ont permis
de classer les variétés en trois groupes. Le premier renferme les
variétés améliorées qui restent les plus
productives en grains. Le deuxième groupe est formé par les
variétés Jneh Khottifa (2), Bayadha (7) qui se
distinguent par la dualité d'utilisation en grains et en paille. Le
reste des variétés locales forment le troisième groupe,
elles se caractérisent par une faible production en grains et un
rendement considérable en paille. Sous stress salin les
variétés améliorées et à moindre
degré les variétés autochtones Jneh Khottifa (2)
et Bayadha (7) restent les plus productives en grains. Le
génotype Ward Bled (13) apparait plus productif sous stress
salin (site Souassi) et pourrait être considéré comme
génotype tolérant, alors que le génotype Richi
(19) se montre le plus sensible et apparait moins productif au niveau de
ce site.
44
5. Effet de la salinité sur les
paramètres agronomiques
La différence de salinité des eaux d'irrigation
qui représente le principal facteur de variation entre les trois sites
d'expérimentation, semble induire pour l'ensemble des génotypes
du blé dur des perturbations significatives de la croissance, du
développement et du rendement. L'analyse de la variance effectuée
sur l'ensemble des génotypes étudiés révèle
un effet significatif du site pour tous les paramètres. La
différence entre les génotypes est hautement significative pour
la plupart des paramètres étudiés. Nous avons aussi
observé des interactions Site X Génotypes significatives ce qui
indique que les génotypes étudiés ont des comportements
différents vis-à-vis du stress salin et se caractérisent
par une variabilité génotypiques importantes (Tableau 6).
45
Tableau 6 : Analyse de la variance
(carré moyen et test f) relative aux paramètres
d'élaboration du rendement (taux de germination, hauteur de la
végétation, surface foliaire, biomasse au stade anthèse,
biomasse au stade floraison, nombre d'épis/m2, nombre
d'épillets par épi, nombre de grains par épi, le poids de
mille grains et le rendement) évalués chez les différents
génotypes de blé dur.
|
Source de variation
|
ddl
|
Taux de
levée %
|
Hauteur
de la
|
Surface foliaire
|
Biomasse au Biomasse
au stade anthèse au stade
|
Nombre épis/m2
|
Nombre PMG
de (g)
|
Rendement en grain (g)
|
|
|
|
végétation
|
stade anthèse (g)
|
maturité
|
|
grains/épi
|
|
|
|
|
(cm)
|
(cm2)
|
|
(g)
|
|
|
|
|
|
Sites
|
2
|
4997.72**
|
5010.05**
|
619.32**
|
208822.67**
|
23306679.96**
|
204528.07*
|
3099.3**
|
1215.87*
|
28706.57**
|
|
|
|
|
|
|
|
*
|
|
*
|
|
|
R(s)
|
6
|
7.24
|
1.73
|
0.21
|
1612.81
|
764536.21
|
486.04
|
77.50
|
99.12
|
487.53
|
|
Génotypes
|
24
|
353.40**
|
3718.71**
|
47.38**
|
8643.01**
|
458677.48**
|
28745.92**
|
82.68**
|
123.23**
|
1276.84**
|
|
Site X
|
48
|
95.42**
|
129.52**
|
18.52**
|
3421.02*
|
169029.24**
|
14833.99**
|
30.23*
|
57.94**
|
588.32**
|
|
Génotype
|
|
|
|
|
|
|
|
|
|
|
|
Erreur
|
150
|
11.12
|
3.06
|
0.10
|
2169.22
|
148747.56
|
174.04
|
18.78
|
25.24
|
96.946
|
p>0.05 ns: test non significatif, 0.01<p<0.05* :
significatif, P<0.01**: hautement significative.
46
5.1. Taux de levée
L'analyse de la variance du taux de la levée a
montré un effet significatif au seuil de 1% des sites, des
génotypes ainsi que l'interaction Site X Génotype (Tableau 6).
Le taux de la levée des différents
génotypes sous les conditions hydriques normales sont similaires et
proches de 100%. Cependant, sous l'effet du stress salin, tous les
génotypes ont montré une réduction du taux de la
levée comparativement au témoin (figure 15). La réduction
la plus importante est enregistrée au niveau de site Souassi sous un
stress sévère de 6,8 g/l.
Levée %
120
100
40
20
60
80
0
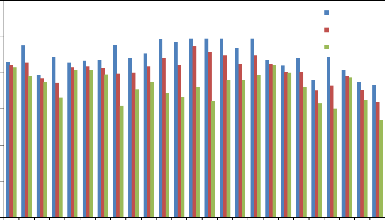
Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 15 : Taux de levée des
différents génotypes aux niveaux des trois sites
expérimentaux.
L'interaction Génotypes X Environnement est
significative au seuil de 1%. Ainsi, nous avons observé que les
génotypes Beskri Pubescent (3), Bidi AP4 (5), Azizi (6), Bayadha (7),
Agili Glaber (18) et à moindre degré le génotype
amélioré Nasr (23) sont faiblement affectés par la
contrainte saline. Par ailleurs, la baisse de taux de levée est
significative chez tous les génotypes (Figure 15).
Globalement, nos résultats montrent l'effet
dépressif du sel sur le taux de la levée des différents
génotypes de blé dur avec des degrés variables, ce qui
concorde avec les travaux de Mallek-Maalej et al. (1998), Allagui et al. (1994)
et Rachidai et al. (1994) qui ont montré que la salinité
réduit significativement le taux de la levée.
47
5.2. La hauteur de la végétation
La hauteur de la végétation est un
paramètre indicateur de l'effet inhibiteur du sel sur la croissance des
plantes (Katerji et al, 2006). L'analyse de la variance de la hauteur de la
végétation sous trois niveaux de salinité chez les
génotypes de blé étudiés a montré un effet
significatif au seuil de 1% des sites, des génotypes et l'interaction
Site X Génotype (Tableau 6).
La hauteur de végétation au stade floraison des
différents génotypes et dans les trois sites est indiquée
dans la figure 16.
|
Hauteur de la végétation (cm)
|
160 140 120 100
80
60
40
20
0
|
|
|
|
|
|
Chbika
|
|
|
|
|
|
|
|
|
|
|
|
|
Sidi Bouzide
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Souassi
|
|
|
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 16 : Hauteur de la
végétation au stade anthèse des différents
génotypes aux niveaux
des trois sites expérimentaux.
L'analyse de la hauteur des plantes au stade anthèse
montre une distinction claire entre les génotypes
améliorés et les génotypes autochtones. En effet, ces
derniers sont caractérisés par une paille haute quelque soit le
niveau de salinité. Ceci est largement documenté et est du au
fait que les génotypes améliorés contiennent des
gènes de nanisme (Dghaiss, 2000). Dans l'ensemble, il y a une
réduction de la croissance de la partie aérienne avec
l'augmentation de la salinité des eaux d'irrigations de chaque site. La
hauteur des plantes au niveau du site de Souassi est parfois supérieure
à celle au niveau du site de Sidi Bouzide, bien que ce dernier
48
soit de moindre salinité. Cela peut s'expliquer par le
précèdent cultural au niveau du site de Souassi, mais surtout par
le semis tardif au niveau du site de Sidi Bouzid.
L'interaction Génotype X Environnement est
significative au seuil de 1%. Ainsi, nous avons observé que les
génotypes Jneh Khottifa (2), Beskri Pubescent (3), Agili (4) et à
moindre degré les génotypes amélioré sont
faiblement affectés par la contrainte saline. Par ailleurs, la baisse de
la hauteur est significative chez tous les génotypes (Figure 16). La
réduction de la hauteur de la végétation aux niveaux des
deux sites irrigués avec de l'eau chargée pourrait être
expliquée par l'effet dépressif de la salinité sur la
croissance des tiges en hauteur, ce qui est en accord avec les résultats
de Garcia-Legaz et al. (1993) qui ont montré que la salinité
affecte négativement la croissance de la partie aérienne de la
plante. La réduction de la hauteur des plantes sous l'effet du stress
salin n'est pas un bon indicateur de la tolérance ou de la
sensibilité d'un génotype. En effet, plusieurs travaux conduits
sur le blé dur indiqueraient que la réduction de l'accroissement
des tiges serait une stratégie d'adaptation à la contrainte
saline (Ben Naceur, 2001, Saqib, 2004, Handy, et al., 2005).
5.3. Surface foliaire
La surface foliaire est le siège de l'activité
photosynthétique, chez les céréales, une
variété dont la surface foliaire n'est pas réduite sous
l'effet de la salinité contribuerait mieux au transfert des assimilats
des feuilles vers les épis, et donc au remplissage des grains, qu'une
variété dont les feuilles sont réduites sous l'effet du
stress salin. Ce paramètre de sélection est d'une importance
majeure dans la sélection des variétés tolérantes
et pourrait être considéré plus fiable que la hauteur de la
végétation (Ben Naceur et al, 2001). Cependant, la
réduction de la surface foliaire, sous l'effet de la salinité,
peut être également considérée comme étant
une stratégie utilisée par les génotypes de blé dur
et de blé tendre pour résoudre leur problème hydrique
suite à l'action primaire de la salinité Alem et al. (2002).
L'analyse de la variance du paramètre surface foliaire,
mesuré sur la feuille drapeau au stade anthèse, et sous les trois
niveaux de salinité chez les génotypes de blé dur a
montré un effet hautement significatif des sites, des génotypes
et de l'interaction Site X Génotype (Tableau 6).
Les génotypes améliorés sont
caractérisés par une plus faible surface foliaire de la feuille
drapeau que les génotypes locaux. Par ailleurs, la salinité
réduit le développement de la feuille drapeau. L'effet est plus
visible chez les plantes cultivées à Sidi Bouzid pour
l'écrasante majorité des génotypes et pourrait être
expliquée par le semis tardif. Concernant l'interaction Génotypes
X Environnement, qui est significatif au seuil de1%, une nette distinction
existe
49
dans la réponse à la salinité entre les
génotypes améliorés et les génotypes autochtones.
En effet, nous avons observé que la surface foliaire n'est que
très faiblement affectée par la salinité chez les
génotypes améliorés (Figure 17).
Surface foliaire (cm2)
25
20
15
10
0
5
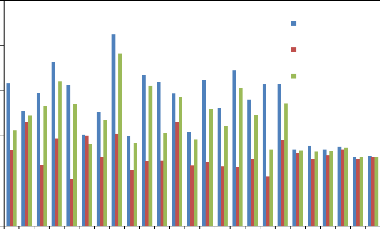
Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 17 : Surface foliaire de la feuille
drapeau au stade anthèse des différents génotypes et
au
niveau des trois sites expérimentaux.
5.4. Matière sèche produite
La production de matière sèche a
été utilisée par plusieurs auteurs comme critère de
sélection pour la tolérance à la salinité
(Kingsbury et Epstein, 1984; Menguzza et al., 2000).
L'analyse de la variance relative à la matière
sèche produite au stade anthèse a montré un effet
significatif au seuil de 1% des sites, des génotypes et des
différences significatives au seuil de 5% pour l'interaction Site X
Génotype (Tableau 6). La figure 18 montre que les génotypes
autochtones se caractérisent par la production de matière
sèche la plus importante par rapport aux génotypes
améliorés. Sous l'effet de la salinité une
réduction significative de la biomasse aérienne a
été enregistrée chez tous les génotypes. Ce qui
montre l'effet négatif de la salinité la croissance
végétative conformément à ce que Bou Aouina et al.
(1998) et Shaquibe, (2004) ont montré sur le blé dur et sur le
blé tendre respectivement. L'interaction Génotype X Environnement
est significative au seuil de 5 %, la biomasse des génotypes
50
améliorés et le génotype Aoudhay (1) est
faiblement réduite par la salinité contrairement aux restes des
génotypes.
Biomasse anthèse (g)
250
200
350
300
150
100
50
0
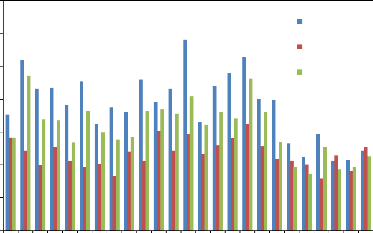
Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 18 : La biomasse aérienne au
stade anthèse des différents génotypes aux niveaux des
trois sites expérimentaux.
Il est à noter que le site de Sidi Bouzid se
caractérise par une faible biomasse aérienne au stade
anthèse. En effet, les semis tardifs impliquent un raccourcissement du
stade tallage et donc une limitation de l'émission de talles, dont la
conséquence principale est la réduction de la biomasse
végétale.
5.5. Nombre d'épis par m2
L'analyse de la variance relative au nombre d'épi par
m2 a montré un effet hautement significatif des sites, des
variétés et de l'interaction Site X Génotype (Tableau
6).
Le nombre d'épis par unité de surface est un
paramètre important qui conditionne le rendement. La figure 19 indique
que les génotypes améliorés et les génotypes locaux
Jneh Khottifa (2), Bayadha (7) et Ward Bled (13) se caractérisent par le
nombre d'épis le plus important. L'augmentation de la salinité de
l'eau d'irrigation des sites affecte négativement la formation des
épis conformément à plusieurs travaux (Saadollah et al.
2005, Eugene et Maas, 1996) L'interaction Génotypes X Environnement est
significative au seuil de 5% a montré
51
qu'il existe des génotypes dont le nombre d'épis
n'est pas affecté significativement par la salinité à
savoir Aoudhay (1) et Beskri Pubescent (3) (Figure 19).
Nombre d'épis/m2
400
200
600
500
300
100
0

Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 19 : Nombre d'épis par
m2 au stade maturité complète des différents
génotypes aux
niveaux des trois sites expérimentaux.
Le nombre d'épis enregistré au niveau du site
Sidi Bouzid est plus faible à celui trouvé au niveau du site de
Souassi et serait expliqué par le retard de semis au Sidi Bouzid d'un
mois par rapport à la date conventionnelle de semis.
5.6. Nombre de grains par épi
Le nombre de grains, qui mesure la fertilité de
l'épi est une caractéristique variétale très
influencée par l'environnement. L'analyse de la variance du nombre de
grains montre des effets hautement significatifs des sites, des
génotypes, ainsi que l'interaction Site X Génotype (Tableau
6).
Le nombre de grains qui mesure la fertilité des
épis montre bien que tous les génotypes améliorés
présentent le nombre de grains par épi les plus
élevés. Seulement, certains génotypes autochtones ont un
nombre de grains par épi comparable :Jneh Khottifa (2), Bayadha (7),
Ward Bled (13) et Richi (19).
L'analyse de la figure 20 relative au nombre de grains par
épi montre que la salinité réduit significativement ce
paramètres. Ces résultats montrent que l'augmentation de la
salinité de
52
l'eau d'irrigation est associée au déclin du
nombre des grains par épi chez tous les génotypes de blé
dur étudiés. Ce qui est en accord avec les travaux de Boubaker,
et al. (1991). En conditions de stress salin, Katergi et al. (1994) et
Saadollah et al. (2005) ont prouvés que les paramètres de
rendement sont affectés négativement chez le blé dur par
la salinité. Alors, que Farooq, (2006) a considéré que la
réduction de ces paramètres pourrait être
considérée comme un indice de tolérance à la
salinité.
Le semis tardif au niveau de Sidi Bouzid, peut
néanmoins expliquer le fait que le nombre de grains par épi soit
faible au niveau de ce site.
Nombre de grains/épis
40
25
20
35
30
15
10
0
5

Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 20 : Nombre de grains par épi
au stade maturité complète de différents génotypes
aux niveaux des trois sites expérimentaux.
5.7. Le poids de mille grains
Chez les céréales, le poids de mille grains
(PMG) est un paramètre qui décrit la capacité
d'accumulation des substances de réserves en conditions
environnementales optimales. Le remplissage des grains se fait essentiellement
par les assimilats récemment photosynthétisés. Les
limitations qui apparaissent à ce niveau (remplissage du grain) sont
liées beaucoup plus à la capacité des grains au stockage
(puits), qu'aux capacités photosynthétiques (source). Cependant,
les conditions climatiques peuvent influencer le PMG (Grignac, 1964 ;
Meynard,
53
1987). Cependant, dans les conditions de stress et dans
certains cas, la diminution du nombre de grains est compensée par
l'expression du composant poids de mille grains (PMG). L'analyse de la variance
liée au PMG montre un effet significatif au seuil de 1% des sites, des
génotypes ainsi que l'interaction Site X Génotype (Tableau 6).
La comparaison des moyennes entre les différents
génotypes a montré que les génotypes Swebei Algia (8),
Richi (19) et les génotypes améliorés se
caractérisent par le PMG le plus important. La variation du poids de
mille grains en conditions normales, stress modéré et stress
sévère montre bien que le poids de mille grains est
significativement affecté par la salinité (Figure 21). Cela est
conforme aux travaux de Handy et al. (2005) sur blé tendre et ceux de
Shaquibe, (2004) sur blé et sur orge
PMG (g)
40
70
20
60
50
30
10
0
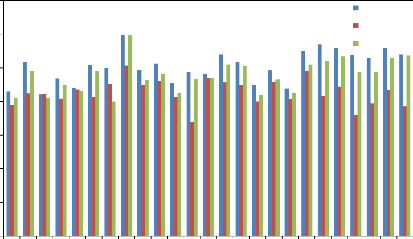
Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 21: Poids de mille grains au stade
maturité complète des différents génotypes aux
niveaux des trois sites expérimentaux.
Lorsque le stress s'intensifie, les différents
génotypes subissent une réduction importante de leurs PMG, ce qui
pourrait être expliqué par les problèmes causés par
la salinité au niveau de la remobilisation des réserves pendant
la phase du remplissage. L'interaction Génotypes X Environnement est
significative et il semblerait que le PMG est peu affecté par la
salinité chez les génotypes Beskri Pubescent (3), Bidi AP4
(5), Ward Bled (13) et Richi (19).
54
6. Teneurs en sodium (Na+)
Une des stratégies de tolérance au niveau de la
plante entière consiste en une limitation de transport de Na+
vers les parties aériennes et précisément aux feuilles et
donc à une capacité de recirculation de sodium des feuilles vers
les racines via le phloème. L'accumulation de Na+ au niveau
de la feuille drapeau, associée à une mauvaise compartimentation
vacuolaire, entraine une diminution de la croissance végétative
(Munns et James, 2003 ; Poustini et Siosemardeh, 2004 ; Munns et al., 2006).
L'examen de la figure 22 montre qu'il existe une différence
significative d'accumulation de sodium aux niveaux des feuilles des
différents génotypes de blé dur étudiés.
Ainsi, tous les génotypes améliorés et les
génotypes Jneh Khottifa (2), Bayadha (7) et Ward Bled (13) accumulent
moins de Na+ dans ses feuilles que les autres génotypes dans
les conditions non stressées.
Na+ (mg/g de matière
sèche)
4
0
7
6
5
3
2
1
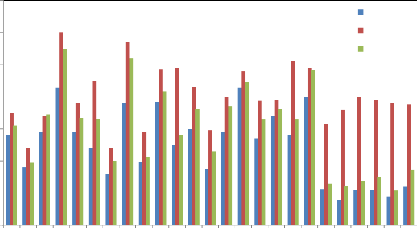
Chbika
Sidi Bouzide Souassi
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
25
Génotypes
Figure 22: Teneurs en Na+ au stade
anthèse au niveau de la feuille drapeau de différents
génotypes aux niveaux des trois sites expérimentaux.
L'effet des sites est significatif, en effet, l'augmentation
de la salinité des eaux d'irrigation de chaque site entraine une
augmentation des teneurs foliaire en sodium. Il est très
intéressant de noter que les génotypes améliorés
ont accumulé de très fortes doses de sodium au niveau du site de
Sidi Bouzid, bien que celui ci soit moins chargé en sel que le site de
Souassi. Il est possible que cela soit du à une plus faible dilution de
cet ions étant donné que la biomasse
55
végétale totale au stade anthèse est
relativement faible pour ce site. Par ailleurs, l'interaction Génotypes
X Environnement est significative, pour l'ensemble des génotypes on a
remarqué que les génotypes Jneh Khottifa (2), Bayadha (7) et Ward
Bled (13) ont montré une grande stabilité d'accumulation de
sodium foliaire par rapport aux autres génotypes.
7. Modèles d'élaboration du rendement
7.1. Relation entre le rendement en grain et le rendement
biologique
Le rendement en grains est étroitement
corrélé à la matière sèche
végétative élaborée à la floraison. En
effet, une corrélation linéaire significative est
préalablement présente pour les génotypes
améliorés et le coefficient de régression est de l'ordre
0,6, alors qu'elle été non significative pour les
génotypes locaux et le coefficient de régression est de l'ordre
de 0,15 (Figure 23).
t/h
Génotypes améliorés
? Génotypes autochtones

y = 0,2569x + 2,7522 R2 = 0,6044
y = 0,1722x + 0,9207 R2 = 0,1591
t/h
7
6
|
Rendement en grain
|
5 4 3 2
|
1
0
10 12 14 16 18 20
Rendement biologique
Figure 23 : Relations entre le rendement en
grain et le rendement biologique chez les
génotypes autochtones et
ceux améliorés.
Une nette différence a été trouvé
entre les deux pools géniques (amélioré et autochtones)
qui traduit bien la différence de rendement en grain. Des
résultats similaires entre le rendement en grain et la biomasse au stade
maturité ont été trouvés par Leterme et al. (1994).
En fait, ils ont déduit que l'augmentation du rendement en grain est
proportionnel à l'augmentation de la biomasse pour les
variétés améliorés. Ces résultats nous
montre que les génotypes améliorés ont des rendements en
grain est corrélé a la production de la matière
sèche, cependant
56
l'augmentation de la biomasse n'a pas d'effet sur le rendement
en grain pour les génotypes autochtones. Ces résultats
révèlent que le rendement biologique a une grande importance sur
la fertilité des épis. Il pourrait être
considéré comme un critère fiable pour l'estimation du
rendement en grain dans les environnements affectés par la
salinité ce qui est en accord avec les études de Kings et Epstein
(1984) et Menguzza et al. (2000).
7.2. Relation entre la biomasse au stade floraison et le
nombre de grains
Le nombre de grains par unité de surface est une
composante assez complexe qui fait appel au nombre d'épillets par
épi et au nombre de grains par épillet. Elle est
considérée comme l'une des composantes clé de la
détermination du rendement (Sinclair et Jamieson, 2006). Le nombre de
grains peut être corrélé à la production de
matière sèche (Figure 24). Des relations linéaires ont
été trouvées pour les deux pools géniques. Une
relation linéaire significative pour les génotypes
améliorés et le coefficient de régression est de l'ordre
de 0,72. Alors que pour les génotypes locaux n'est pas significatives et
le coefficient de régression est de l'ordre de 0,19.

Génotypes améliorés
? Génotypes autochtones
y = 678,48x + 1335,3 R2 = 0,7246
2
7
13
y = 362,6x + 1664 R2 = 0,1949
|
Nombre de grain
|
12000 11000 10000 9000 8000 7000 6000 5000
4000
|
t/ha
10 12 14 16 18 20
Biomasse floraison
Figure 24 : Relation entre le nombre de grain
et la biomasse au stade floraison, chez les
génotypes
améliorés et ceux autochtones.
Le nombre de grains est beaucoup plus important lorsque la
biomasse au stade floraison est importante. D'après nos résultats
il apparait clair que le nombre de grain augmente avec l'augmentation de la
biomasse au stade floraison. Ceci n'est valable que pour les génotypes
amélioré. Des relations similaires ont été
trouvées par Meynard et Sebillotte (1994). En
57
conséquence, le nombre de grain par épi, qui
mesure la fertilité, est une caractéristique variétale,
très influencée par l'environnement et les paramètres de
production. De se fait, l'augmentation de la biomasse augmente la
fertilité des épis. Ces résultats sont également
atténués par Couvreur (1981) et cité par Halilat
(2004).
Conclusions et
perspectives
58
Conclusions et perspectives
La salinisation des ressources en sols constitue un
problème majeur en Tunisie. De ce fait, le développement de
variétés tolérantes à des seuils
élevés de salinité constitue une solution durable pour
l'extension de la céréaliculture en irrigué, et plus
particulièrement dans les régions du Centre.
Notre travail a visé l'étude de la
variabilité génotypique de certains paramètres
morphologiques, agronomiques et physiologiques de quelques cultivars de
blé dur (Triticum turgidum ssp durum) sous un régime d'irrigation
au niveau de trois sites au Centre de la Tunisie caractérisés par
des niveaux de salinité différents.
Notre travail a permis de réaliser une partie de la
première phase de ce projet en aboutissant à faire ressortir que
le stress salin a un effet dépressif sur la croissance et le
développement des plantes, avec des degrés variables selon le
génotype et le traitement salin. Une différence
génotypique, notée pour tous les paramètres
étudiés, nous a permis de mettre en évidence que la
salinité réduit le taux de levée, la hauteur de la
végétation, la biomasse au stade floraison, le nombre
d'épis par unité de surface, le nombre de grain et le rendement
en grain et en paille. Ainsi, nous avons constaté que les
génotypes améliorés et les deux génotypes Jneh
Khottifa (2) et Bayadha (7) montrent une préservation de leur surface
foliaire afin de mieux préserver leurs potentialités
photosynthétiques et leur rendement en grain en comparaison aux
génotypes autochtones.
Concernant les critères physiologiques, nous avons
montré que les génotypes étudiés sont sensiblement
affectés par le degré de salinité et ceci est
montré par la teneur en sodium accumulé dans les feuilles
drapeaux. En effet, les génotypes améliorés et les quatre
génotypes autochtones Jneh Khottifa (2), Bayadha (7) Derbessi (9) et
Ward Bled (13) ont toujours présenté des taux faibles en sodium
dans leurs feuilles drapeaux comparativement aux autres génotypes.
D'après les travaux de Munns et James 2003, ces génotypes
seraient porteurs de caractères de tolérance à la
salinité et pourraient être de potentiels parents dans un
programme de sélection visant le développement de
variétés tolérantes à ce type de stress.
De point de vue rendement, l'analyse en composantes
principales a confirmé nos résultats cités
précédemment. Celle-ci a montré que les génotypes
améliorés ont été les plus productifs sous
différents régimes hydriques et salins comparativement aux
génotypes autochtones, à l'exception des deux génotypes
Jneh Khottifa et Bayadha qui ont tendance à se comporter de façon
meilleure et se caractérisent par un rendement considérable.
59
Le développement de tels génotypes qui
différent par leur tolérance à la salinité
permettrait par la suite une étude pluriannuelle de la
variabilité inter spécifique des principaux génotypes
tolérants à la salinité qui pourrait nous permettre
d'établir des modèles d'élaboration du rendement. Il
permettrait aussi une étude des stratégies d'adaptation à
la contrainte saline des différents génotypes tolérants et
une étude éco physiologique pour élucider les
mécanismes clés de tolérance à la salinité
de ces génotypes.
Références bibliographiques
60
Références bibliographique
- Alem C., Labhilili M., Brahimi K., Jlibene M.,
Nasrallah N., and Filali-Maltouf A., 2002. Adaptations hydrique et
photosynthétique du blé dur et du blé tendre au stress
salin. C. R. Biologies, Vol. 325 :1097-1109.
- Allagui M., Andreotti V., Cuartero J.
1994 Détermination de critères de
sélection pour la tolérance de la tomate à la
salinité. À la germination et au stade plantule. Ann INRAT 1994 ;
67 : 45-65.
- Allah C.,1991. Grown tomato under saline
conditions. 1991. In : Allah CR, ed. Plant Salinity. Research, New Chellenges,
1991 : 201-12.
-Allen R.D., 1995. Dissection of oxidative
stress tolerance using transgenic plants. Plant Physiol. 107:1049-1054.
- Amtmann A. and Sanders D., 1999. Mechanisms of
Na+ uptake by plant cells. Adv. Bot. Res. 29, 76-112.
- Antipolis S., 2003. Les menaces sur les sols
dans les pays méditerranéens. Les cahiers du plan bleu, Vol.2 :
44-49.
-Ashraf M., 1994. Breeding for salinity
tolerance in plant. Crit. Rev.Plant Sci. 13, 17-42 -Ashraf M. and
Harris P., 2004. Potential biochemical indicators of salinity
tolerance in plants.Plant Sci., 166: 3-6.
- Ayliffe M., Mitchell H., Deuschle K. and Pryor A.,
2005. Comparative analysis in cereals of a key proline catabolism
gene. Mol Gen Genomics. 274: 494-505
-Azevedo Neto A., Prisco J., Eneas-Filho J., De Abreu C.,
Gomes- Filho E., (2006) Effect of salt stress on antioxidative enzymes
and lipid peroxidation in leaves and roots of salt-tolerant and saltsensitive
maize genotypes. Environ Exp Bot 56:87-94.
-Batanouny K.,1993 . Ecophysiology of halophytes
and their traditional use in the Arab world. Advanced Course on halophyte
utilisation in Agriculture,12 Sept.,Agadir, Marocco. -
Bayuelo-Jiménez J.., Craig R. and Lynch J.P., 2002.
Salinity tolerance of Phaseolus species during germination and early seedling
growth. Crop Sci., 42, 2184-2192.
- Benaceur M., Rahmoun C., Sdiri H., Medahi M. and Selmi
M., 2001. Effet du stress salin sur la germination, la croissance et
la production de grains de blé. Secheresse, 12 (3): 167-174.
-Bizid E. Zid E. and Grignon C., 1988.
Tolérance à NaCl et sélectivité K+/Na+ chez les
triticales. Agronomie 1988 ; 8 : 23-7.
61
- Binet P., 1982, Production primaire et
accumulation des bio-éléments au niveau d'une population pure
d'Atriplex hastata L. des rives de l'estuaire de la seine, Oecol. Plant 317,
219-230.
-Blumwald, E. Aharon G., and Apse M., 2000.
Sodium transport in plants. Biochim. Biophys. Acta 1465, 140-151.
-Blumwald E., 2000. Sodium transport and salt
tolerance in plant cells. Current Opinion in Cell Biology. 12, 431-434.
-Bot A., Nachtergaele F, and Young A., 2000.
Land resource potential and constraints at regional and country
levels. World Soil Resources Report N° 90. Rome: FAO of UN.
-Boyer J.S., 1982. Science,
218, 443 - 448.
-Brady N.C. and Weil R.R., (2002) :The nature
and properties of soils. 13th edn. Prentice Hall, Upper saddle river, NJ,
USA.
-Bryssine (1961) : la salinité du sol et
ses problèmes .
-Cheeseman J.M., (1988):Mechanisms of
salinity tolerance in plants. Plant Physiology 87: 547- chloride and sodium
sulphate. Physiologia Plantarum 120: 482-490.
- Chinnusamy V., Schumaker K. and Zhu J. K ., 2004.
Molecular genetics perspectives on cross-talk and specificity in
abiotic stress signalling in plants. J of Experimental Botany. 55: 225-236.
-Claire P., Nicolas C. and James D.,2008.
Formes réactives de l'oxygène, stress et mort cellulaire chez les
plantes. C. R. Biologies 331 (2008) 255-261.
-Cramer G.R. and D.C. Bowman., 1993. Cell
elongation control under stress conditions. In: Handbook of Plant and Crop
Stress, M Pessarakli (Ed.). Marcel Dekker, New York, pp. 303- 319.
- Devron J. and Sifi B., 2003. Fixation
symbiotique de l'azote et développement durable dans le bassin
méditerranéen. Editions Quae,417 p.
- Dietz KJ., Tavakoli N., Kluge C., Mimura T., Sharma
S., Harris G., Chardonnens A., Golldack D.. Significance of the V-type
ATPase for the adaptation to stressful growth conditions and its regulation on
the molecular and biochemical level. J Exp Bot 2001, 52:1969-1980.
- Ehret D., Radmann R., Harvery B., Cipywnyk A.
1990. Salinity induced calcium defi ciencies in wheat and barley.
Plant Soil 128, p. 143-151.
-Epstein E., Norlyn J.D. , Ruch D.W. , Kinsbury R.W. ,
Cunningham A.F. , Wrona A.F., 1980. Saline culture of crops: a genetic
approach, Science (2310) 399-404.
62
-Essington M.E., 2004. Soil and water chemistry,
an integrative approach. CRC Press, USA. -Flowers T., Troke J., Yeo F.,
A., R., 1977. The mechanism of salt tolerance in halophytes. Annu.
Rev. Plant Physiol. 28:89-121.
- Garcia-Legaz MF., Ortiz JM., Garcia-Lidon A., Cerda
A., 1993. Effect of salinity on growth, ion content
and CO2 assimilation rate in lemon varieties on different rootstocks.
Physiologia Plantarum 1993 ; 89 : 427-32.
- Garg A., Kim K., Owens J., Ranwala T., Choi A., Kochian
Y.V. and Wu R.J., 2002. Trehalose accumulationin rice plants confers
high tolerance levels to different abiotic stresses. Proc. Natl. Acad. Sci. USA
99: 15898-15903.
-Goldhirs A., Hankamer B. and SLirs
SH.,1990.Hydroxyproline and proline content and cell
wall of Sunflower,Peanut and Cotton under salt stress.Plant
Sci.,69,p.2732.
-Gorham J., Hardy C., Wyn Jones R. G., Joppa L. R. ,Law
C.N. 1987. Chromosomal location of a K/Na discrimination character in
theDgenome of wheat. Theor. Appl. Genet. 74:584- 88 .
- Gorham J., Wyn Jones R. G and Bristol A., 1990.
Partial characterization of the trait for enhanced K+ and Na+
discrimination in the D genome of wheat. Planta 180:590-97.
- Grattan S. R., and Oster J. D. 2003. Use and
reuse of saline-sodic waters for irrigation of crops. In: S.S. Goyal, S.K.
Sharma and D.W. Rains (eds.), Crop Production in Saline Environments: Global
and Integrative Perspectives. Haworth Press, New York. pp 131-162. -
Greenway H., and Munns R., 1980. Mechanisms of salt tolerance
in nonhalophytes, Ann. Rev. Plant Physiol. 31 (1980) 149-190.
- Grennan A. K., 2006. High Impact Abiotic
Stress in Rice. An «Omic» Approach; Plant Physiology, April 2006,
Vol. 140, pp. 1139-1141.
-Hasegawa P.M., Bressan R. A., Zhu J. K. and Bohnert H.
J., 2000. Plant cellular and molecular responses to high salinity.
Annu. Rev. Plant Physiol. Plant Mol. Biol. 51, 463-499. -Hernandez
J.A., Ferrer M.A., Jimenez A., Ros-Barcelo A., and Sevilla F., 2001.
Antioxidant systems and O2/H2O2 production in the apoplast of Pisum
sativum L. leaves: its relation with NaCl induced necrotic lesions in minor
veins. Plant Physiol., 127: 817-31. -Hillel D., 2000. Salinity
Management for Sustainable Irrigation. The World Bank, Washington, D.C.
-Horie T. and Schroeder JI., (2004): Sodium
transporters in plants. Diverse genes and physiological functions. Plant
Physiology 136: 2457-2462.
63
- Hu Y., Fricke Y.W. and Schmidhalter U., 2005
b. Salinity and the growth of non-halophytic grass leaves: the role of
mineral nutrient distribution. Funct. Plant Biol. 32:973- 985.
-Jabloun, M., et Sahli, A. 2004. MABIA-ETo :
Un logiciel pour l'estimation de l'évapotranspiration de
référence. 11ème Journées Scientifiques sur les
Résultats de la Recherche Agronomique.
-Jabloun, M., et Sahli, A. 2008. Evaluation
of FAO-56 methodology for estimating reference evapotranspiration using limited
climatic data, Application to Tunisia. Agricultural Water Management. 95,
707-715.
- Karmous C., 2007. Contribution à
l'étude des mécanismes de tolérance à la
salinité au stade juvénile chez le blé dur (Triticum durum
Desf.) : aspects physiologique, biochimique et moléculaire. Thèse
de doctorat en agronomie et science de la production végétale.
INAT, Tunis : 211p.
-Kafkai U., 1991. Root growth under stress.
In: Waisel Y., Eshel A. & Kafkafi U., eds. Plant roots: the hidden half.
New York, USA: Marcel Dekker, 375-391.
-Keren R., 2000. Salinity. In: Sumner M.E.
(Ed). Handbook of Soil Science. CRC Press, NY,USA, pp G3-G25.
- K. Latiri-Souki, C. Aubry, T. Doré and M.
Sebillotte ., 1992. Élaboration du rendement du blé dur
en conditions semi-arides en Tunisie : relations entre composantes du rendement
sous différents régimes de nutrition azotée et hydrique.
Agronomie Vol. 12 No. 1 p. 31 (1992).
-Leterme P ., Manichon H., Roger-Estrade J., 1994.
Analyse intégrée des rendements du blé tendre et
de leurs causes de variation dans un réseau de parcelles d'agriculteurs
du Thymerais. Agronomie 1994 ; 14.341.361.
- Levigneron A., Félice L., Gérard V.,
Pierre B., Pierre F. and Francine C.D., 1995. Les plantes face au
stress salin. Cahiers Agricultures 1995 ; 4: 263-73.
-Levy G.J., 2000. Sodicity. In: Sumner M.E.
(Ed). Handbook of Soil Science. CRC Press,NY, USA, pp G27-G62.
- Maalej-Mallek E., Boulesnam F. and Ben Salem M.,
1998. Effet de la salinité sur la germination de graines de
céréales cultivées en Tunisie. Cahiers Agricultures 1998 ;
2 : 153-6. - Meynard JM., Sebillotte M., 1994.
L'élaboration du rendement du blé, base pour
l'étude des autres céréales à paille. In : Le Point
sur l'élaboration du rendement (D Picard, L Combe, eds), Éditions
INRA, Paris, 31-51.
64
- Maas E.V., and Poss J.A., 1989a. Salt
sensitivity of wheat at different growth stages. Irrig. Sci. 10:29-40.
-Mermut A.R., and Arshad M.A., 1987.
Significance of sulfide oxidation in soil salinization in southern
Saskatchewan, Canada. Soil Sci. Amer. J. 51:247-251.
- Malasses L., 1996. Economie de production et
de consommation; Ed ujas; pp 32-40.
- Mashali A., Suarez D. L., Nabhan H. and Rabindra R.
2005. Integrated management for sustainable use of salt-affected
soils. FAO Soils Bulletin.
- Martinez JP., Silva H., Ledent JF., and Pinto M.,
2007. Effect of drought stress on the osmotic adjustment, cell wall
elasticity and cell volume of six cultivars of common beans (Phaseolus vulgaris
L.) European journal of agronomy. Jan., Vol. 26,1,p. 30-38.
- Maser P., Gierth M., and Schroeder J. I., 2002.
Molecular mechanisms of potassium and sodium uptake in plants. Plant
and soil, Vol. 247 :43-54.
- Maser P., Eckelman B., Vaidyanathan R., Horie T.,
Fairbairn DJ, Kubo M., Yamagami M., Yamaguchi K., Nishimura M., Uozumi N. et
al.: Altered shoot/root Na+ distribution and bifurcating salt
sensitivity in Arabidopsis by genetic disruption of the Na+ transporter AtHKT1.
FEBS Lett 2002, 531:157-161.
-Maurel C., and Chrispeels MJ., 2001.
Aquaporins, a molecular entry into plant water relations. Plant
Physiol. 125: 135-138.
- Moinuddin A., Fischer R., Sayre K.and Reynolds MP.
2005.Osmotic Adjustment in Wheat and Relation to Grain Yield under
Water Deficit Environments.Agro.J.97:1062-1071. -Montero E., Cabot C.,
Poschenrieder Ch. and Barcelo J., 1998. Relative importance of osmotic
stress and ion-specific effects on ABA-mediated inhibition of leaf expansion
growth in Phaseolus vulgaris. Plant Cell and Environment. 21: 54-62.
- Morant-Manceau A., Pradier E. and Tremblin G., 2004.
Osmotic adjustment, gas exchanges and chlorophyll fluorescence of a
hexaploid triticale and its parental species under salt stress. J. Plant
Physiol. 161. 25-33
-Munns R., Greenway H. and Kirst G.O., 1983.
Halotolerant eukaryotes. In Physiological Plant Ecology. III.
Responses to the Chemical and Biological Environment. Eds. O L Lange, P S
Nobel, CB Osmond and H Zeigler. pp. 59-135. Encycl. Plant Physiol., New Series,
Vol. 12C. Springer, Berlin.
-Munns R., 1993. Physiological processes
limiting plant growth in saline soils: some dogmas and hypotheses. Plant, Cell
and Environment 16: 15-24.
65
-Munns, R. and Rawson H.M., 1999. Effect of
salinity on salt accumulation and reproductive development in the apical
meristem of wheat and barley. Aust. J. Plant Physiol. 26:459-464.
-Munns R., 2002. Comparative physiology of salt
and water stress; Plant, Cell and Environment 25, 239-250.
-Munns R., 2005. Genes and salt tolerance:
bringing them together. New Phytol. 167:645-63 -Munns R., Richard
A.J.and Lauchli A., 2006. Approaches to increasing the salt tolerance
of wheatand other cereals. Journal of Experimental Botany, Vol. 57, No. 5, pp.
1025-1043, -Munns R., 2008. Sodium excluding genes from durum
wheat and sea barleygrass improve sodium exclusion of bread wheat. 2nd
International Salinity Forum Salinity, water and society-global issues, local
action.
- Navarro A. R. and Rubio F., 2006.
High-affinity potassium and sodium transport systems in plants Journal
of Experimental Botany; 57(5):1149-1160.
-Niu X., Bressan R.A., Hasegawa P.M. and Pardo J.M.,
(1995): Ion homeostasis in NaCl stress environments. Plant Physiology
109: 735-742.
-Orcutt D.M. and Nilsen E.T. ,(2000): Physiology
of plants under stress. John Wiley & Sons Inc., New York, NY, USA.
- Ottow E., Brinker M., Fritz E., Teichmann T., Kaiser
W., Brosche M., Kangasjarvi J., Jiang X. and Polle A., 2005. Populus
euphratica Displays Apoplastic Sodium Accumulation, Osmotic Adjustment by
Decreases in Calcium and Soluble Carbohydrates, and Develops. -Parida
A.K. and Das A.B., 2005. Salt tolerance and salinity effects on
plants: A.Rev.Ecotoxicol.nviron. Safety,60:324-349.
- Parent C., Capelli N. and Dat J., 2008. Formes
réactives de l'oxygène, stress et mort cellulaire chez les
plantes. C. R. Biologies 331 (2008) 255-261.
- Pitman MG. and A. Läuchli. 2002. Global
impact of salinity and agricultural ecosystems. In: Salinity: Environment -
Plants - Molecules, A. Läuchli and U. Lüttge (Eds.). Kluwer Academic
Publishers, Dordrecht, pp. 3-20.
-Price A.H. and Hendry G.A.F., 1991.
Iron-catalysed oxygen radical formation and its possible contribution
to drought damage in nine native grasses and three cereals. Plant Cell
Environ.14:477-484.
66
-Prior L. D., Grieve A. M., Bevington K. B., Slavich
P. G., 2007. Long-term effects of saline irrigation water on
`Valencia' orange trees: relationships between growth and yield, and salt
levels in soil and leaves. Aust. J. Agric. Res. 58:349-58.
-Pujol J.A., Calvo J.F. and RamírezDíaz
L., 2001.Seed germination, growth and osmotic adjustment in response
to nacl in a rare succulent halophyte from south eastern spain. Journal:
Wetlands,Vol.: 21, N° 2, pages: 256264.
- Rachidai A., Driouich A., Ouassou A., El Hadrami
I. . Effet du stress salin sur la germination du blé dur
(Triticum durum Desf.). Rev Amélior Prod Agr Milieu Aride 1994 ; 6 :
209-28.
-Rahnama H., Ebrahimzadeh H., 2005. The
effect of NaCl on antioxidant enzyme activities in potato seedling. Biol Plant
49(1):93-97.
-Ramanjulu S. and Bartels D., 2002. Drought
and dessication-induced modulation of gene expression in plants. Plant Cell Env
25: 141-151.
-Reddy AR., Chaitanya KV. and Vivekanandan M., 2004.
Drought-induced responses of photosynthesis and antioxidantmetabolism
in higher plants. J Plant Physiol 161:1189-1202. -Rhodes D.,
Nadolska-Orczyk A., Rich P.J., 2002. Salinity, osmolytes and
compatible solutes. In Salinity: Environment Plants Molecules, ed. A
L·auchli, U L· uttge, pp. 181-204. Dordrecht, Netherlands:
Kluwer.
-Rodriguez M., Canales E., and Borras-Hidalgo O.,
2005. Molecular aspects of abiotic stress in plants. Biotechnol.
Aplicada 22:1-10.
-Romero JM., Maronon T. and Murillo. 1994. Long
term responses of Melilotus segatalis to salinity. II Nutrient absorption and
utilization. Plant Cell Environment. 17: 1249-1255. - Rus A., Yokoi S.,
Sharkhuu A., Reddy M., Lee BH., Matsumoto TK., Koiwa H., Zhu JK., Bressan RA.,
Hasegawa PM.,. AtHKT1 is a salt tolerance determinant that controls
NaR entry into plant roots. Proc Natl Acad Sci USA 2001, 98:14150-14155.
-Sakurai J., Ishikawa F., Yamaguchi T., Uemura M., and
Maeshima M., 2005. Identification of 33 rice aquaporin genes and
analysis of their expression and function. Plant Cell Physiol. 46: 1568-77.
- Sarda X., Vansuyt G., Tousch D., Casse-Delbart F.,
Lamaze T., 1993, Les signaux racinaires de la régulation
stomatique, Tolérance à la sécheresse des
céréales en zones méditerranéenne. Diversité
génétique et amélioration variétale,
Éditions Inra, Paris (Les colloques, n° 64), pp. 75-79.
67
-Schachtman D. and Liu W ., 1999. Molecular
pieces to the puzzle of the interaction between potassium and sodium uptake in
plants.Trends Plant Sci. 4, 281-287.
-Schroeder JI., Allen GJ., Hugouvieux V., Kwak JM. and
Waner D., 2001. Guard cell signal transduction. Annual Review of Plant
Physiology and Plant Molecular Biology. 52: 627-658
-Sibole JV., Montero E., Cabot C., Poschenrieder Ch.
and Barcelo J., 1998. Role of sodium in the ABA mediated long-term
growth response of bean to salt stress. Physiologia Plantarum. 104: 299-305.
-Sibole JV., Montero E., Cabot Cn., Poschenrieder Ch.
and Barcelo J. ,2000. Relationship between carbon partitioning and
Na+, Cl- and ABA allocation in fruits of salt-stressed bean. Journal of Plant
Physiol.157: 637-642.
-Sibole JV., Cabot C., Poschenrieder C., and Barcelo
J., 2003. Efficient leaf ion partitioning, an overriding condition for
abscisic acid-controlled stomatal and leaf growth responses to NaCl
salinization in two legumes. Journal of Experimental Botany. 54: 21112119
-- Steduto P., Albrizio R., Giorio P. and Sorrentino
G., 2000. Gas exchange response and stomatal and non-stomatal
limitations to carbon assimilation of sunflower under salinity 144 (3)
243-255.
- Song J., Feng G., Tian C., and Zhang F., 2005.
Strategies for Adaptation of Suaeda physophora, Haloxylon ammodendron
and Haloxylon persicum to a Saline Environment During Seed-Germination Stage.
Annals of Botany. 96: 399-405
-Sudhakar C., Lakshmi A., Giridarakumar S., 2001.
Changes in the antioxidant enzyme efficacy in two high yielding
genotypes of mulberry (Morus alba L.) under NaCl salinity. Plant Sci
141:613-619
-Suga S., Komatsu S. and Maeshima M., 2002.
Aquaporin isoforms responsive to salt and water stresses and
phytohormones in radish seedlings. Plant Cell Physiol. 43: 1229-1237.
- Teakle N., Flowers L., Real T.J., D and Colmer T.
D., 2007. Lotus tenuis tolerates the interactive effects of salinity
and waterlogging by `excluding' Na+ and Cl- from the xylem. Journal of
Experimental Botany, published online on May 17, 2007.
-Termaat A., Munns R. 1986. Use of
concentrated macronutrient solutions to separate osmotic from NaCl-specific
effects on plant growth. Australian Journal of Plant Physiol. 13: 509-522.
68
-Tyerman S.D. and Skerrett IM., 1999. Root
ion channels and salinity. Sci. Hort. 78, 175- 235.
-Kovda V. A., 1983. Loss of productive land
due to salinization. Ambio, 12, 91-93
-White P. J. and Broadly M. R .,2001.
Chloride in soils and its uptake and movement within the plant: a
review. Ann. Bot. 88, 967-988.
-Wyn Jones RG., Storey R., Leigh R.A., Ahmad N., and
Pollard A., 1977. A hypothesis on cytoplasmic osmoregulation. In
Regulation of Cell Membrane Activities in Plants, ed. E Marr'e, O Cifferi, pp.
121-36. Amsterdam, Netherlands: Elsevier
- Wyn Jones RG., Gorham J., 2002. Intra- and
inter-cellular compartmentation of ions. In: Läuchli A, Lüttge U,
eds. Salinity: Environment - Plants - Molecules. Dordrecht, the Netherlands:
Kluwer, 159-180.
-Xiao-gang Li, Feng-min Li ,Qi-fu Ma and Zhi-jun Cui
2006. Interactions of NaCl and Na2SO4 on soilorganic C mineralization
after addition of maize straws. Soil Biol. Biochem. 38:2328-2335.
- Xiong L. and Zhu, J.K. 2002. Molecular and
genetic aspects of plant responses to osmotic stress. Plant, cell and
Environment 25: 131-139.
- Yakoubi-Tej M. 1992. Rôle des
interactions ioniques dans la tolérance du triticale à NaCl.
Tunis : Faculté des Sciences de Tunis, 63 p.
-Yazici I., Turkan F., Sekmen A.H., and Demiral T.,
2007. Salinity tolerance of purslane (Portulaca oleracea L.) is
achieved by enhanced antioxidative system, lower level of lipid peroxidation
and proline accumulation. Environ Exp Bot 61(1):49-57.
-Yeo A.R. and Rowers T.J., 1998: Accumulation
and localization of sodium ions within the shoots of rice (Oyza satina)
varieties differing in salinity resistance. Physiol. Plant. 56: 343348.
Annexes
69
Annexe 1 : Evolution de la température
maximale et minimale et la pluviométrie au niveau du site d'Echbika
(Kairouan).
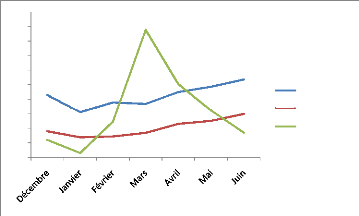
45
40
50
35
30
25
20
15
10
0
5
TO Max TO Min
Pluviométrie
Annexe 2 : Evolution de la température
maximale et minimale et la pluviométrie au niveau du
site de Sidi Bouzid
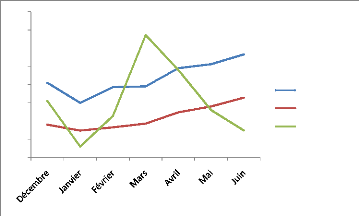
40
35
30
25
20
15
10
0
5
TO Max TO Min
Pluviométrie
Annexe 3: Gamme de solutions filles
d'étalonnage de sodium.
|
Solution mère (en ml)
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Eau distillée
|
q.s.p. 100 ml
|
|
Concentration massique en mg de sodium par litre
|
5
|
10
|
15
|
20
|
25
|
30
|
70
Annexe 4: Gamme de solutions filles
d'étalonnage de Potassium.
|
Solution mère (en ml)
|
0,1
|
0,2
|
0,3
|
0,4
|
0,5
|
|
Eau distillée
|
q.s.p. 100 ml
|
|
Concentration massique en mg de sodium par litre
|
1,5
|
3
|
4,5
|
6
|
7,5
|
Annexe 5 : Courbe d'étalonnage de sodium et de
potassium.
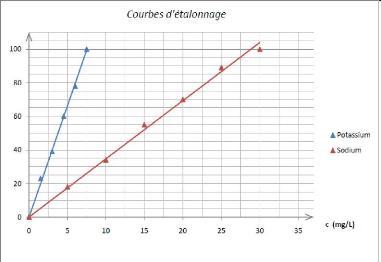
Annexe 6 : Le photomètre à flamme.

71
Annexe 7 : Analyse du sol avant le semis
|
Site Kairouan
|
Site Souassi
|
Site Sidi Bouzid
|
|
Niveau cm
|
pH
|
CE mS/cm
|
pH
|
CE
|
pH
|
CE mS/cm
|
|
0-20
|
8,50
|
1,21
|
7,83
|
2,8
|
7,88
|
2,26
|
|
20-40
|
8,14
|
4,16
|
7,91
|
5,6
|
8,04
|
3,08
|
|
40-60
|
7,91
|
5,53
|
8,09
|
8,6
|
8,15
|
5,59
|
Annexe 8 : Analyse du sol après la
récolte
|
Site Kairouan
|
Site Souassi
|
Site Sidi Bouzid
|
|
Niveau cm
|
pH
|
CE mS/cm
|
pH
|
CE mS/cm
|
pH
|
CE mS/cm
|
|
0-20
|
8,2
|
1,70
|
7,8
|
2,9
|
7,7
|
4,43
|
|
20-40
|
7,81
|
4,79
|
7,7
|
6,6
|
7,7
|
5,5
|
|
40-60
|
7,68
|
4
|
7,7
|
9,7
|
7,6
|
6,5
|
Annexe 9 : corrélation entre les variables (ACP
générale).
|
Variables
|
NP
|
BAflo
|
NGNE
|
NG
|
RDT
|
SF
|
|
NP
|
1
|
0,758
|
-0,632
|
-0,491
|
-0,628
|
0,363
|
|
BAflo
|
0,758
|
1
|
-0,459
|
-0,377
|
-0,633
|
0,412
|
|
NGNE
|
-0,632
|
-0,459
|
1
|
0,704
|
0,681
|
-0,268
|
|
NG
|
-0,491
|
-0,377
|
0,704
|
1
|
0,832
|
-0,524
|
|
RDT
|
-0,628
|
-0,633
|
0,681
|
0,832
|
1
|
-0,545
|
|
SF
|
0,363
|
0,412
|
-0,268
|
-0,524
|
-0,545
|
1
|
72
Annexe 10 : cosinus carrés des variables (ACP)
au niveau de chaque site
|
Variables
|
Site Kairouan
|
Site Souassi
|
Site Sidi Bouzide
|
|
Facteur
|
F1
|
F2
|
F1
|
F2
|
F1
|
F2
|
|
Baflo
|
0,457
|
0,173
|
0,493
|
0,162
|
0,018
|
0,679
|
|
NGNE
|
0,711
|
0,005
|
0,562
|
0,003
|
0,469
|
0,169
|
|
BY
|
0,054
|
0,826
|
0,102
|
0,761
|
0,093
|
0,557
|
|
RDT
|
0,919
|
0,036
|
0,874
|
0,060
|
0,943
|
0,000
|
|
NG
|
0,850
|
0,074
|
0,778
|
0,109
|
0,891
|
0,002
|
|
PMG
|
0,254
|
0,022
|
0,197
|
0,003
|
0,024
|
0,008
|
|
SF
|
0,829
|
0,040
|
0,636
|
0,175
|
0,720
|
0,018
|
Annexe 11:Matrice de corrélation des
variables
|
NP
|
NE
|
BAflo
|
NG
|
PMG
|
|
NP
|
1
|
-0,162
|
0,758
|
-0,491
|
-0,262
|
|
NE
|
-0,162
|
1
|
-0,139
|
0,812
|
-0,042
|
|
BAflo
|
0,758
|
-0,139
|
1
|
-0,377
|
-0,312
|
|
NG
|
-0,491
|
0,812
|
-0,377
|
1
|
0,192
|
|
PMG
|
-0,262
|
-0,042
|
-0,312
|
0,192
|
1
|
|
En gras, valeurs significatives (hors diagonale) au seuil
alpha=0,050 (test bilatéral)
|
| 


