|
UNIVERSITE CLAUDE BERNARD LYON 1
FACULTE DE PHARMACIE DE LYON
INSTITUT DES SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
Année 2010
L'IRM DE DIFFUSION ET DE PERFUSION DANS L'ACCIDENT
VASCULAIRE CEREBRAL
MEMOIRE BIBLIOGRAPHIQUE
Présenté dans le cadre de l'Unité
d'Enseignement de Master 1 :
TRACEURS, EXPLORATIONS FONCTIONNELLES ET METABOLIQUES
PAR :
Micakel TAFAZZOLI
Né le 19 décembre 1988
A NICE
L'IRM de diffusion et de perfusion dans l'Accident
Vasculaire Cérébral
SOMMAIRE
Préambules 2
Introduction 3
I Rappels des principes physiques de l'IRM
4
1) Résonnance 4
2) Relaxation 4
3) IRM de diffusion 6
4) IRM de perfusion 7
II Apport diagnostique de l'IRM de perfusion et
diffusion 8
1) L'apport de l'IRM par rapport aux autre méthodes
dans le diagnostic de l'AVC 8
2) La supériorité des IRM de diffusion et
perfusion par rapport aux autres IRM
dans le diagnostic de l'AVC 9
3) Observation des AVC à la phase hyper aiguë
(dans les 6 premières heures) 11
III Apport pronostique : Evaluation du risque
hémorragique et de l'évolution
Lésionnelle sous traitement
thrombolytique. 13
1) Apport pronostique de l'ADC 13
2) Etude des paramètres de perfusion et scores
cliniques 16
3) NEURiNFARCT : un nouveau système de pronostic
basé sur l'IRM de diffusion. 18
Conclusion 22
Annexe 23
Bibliographie 24
Préambules :
A l'heure où le gouvernement prend conscience, via son
« plan d'actions national AVC 2010-2014 »1(*), du problème de
santé publique que représente l'accident vasculaire
cérébral (AVC), il paraît intéressant d'observer les
moyens d'étude de cette maladie.
Le but de ce mémoire est de faire l'état des
connaissance sur l'utilité de l'IRM de diffusion et de perfusion dans
l'AVC. Il s'appuie principalement sur des thèses et des publications
scientifiques prouvant leurs dires par des études de cas et des
comparaisons avec d'autres études plus anciennes. Ainsi, les chiffres et
statistiques présentés sont en accord avec ceux de la
littérature.
L'AVC s'il n'est pas pris en charge dans les premières
heures suivant l'apparition des premiers symptômes, s'avère
mortel. C'est pourquoi nous nous attarderons particulièrement sur les
images prises à la phase hyperaiguë.
Introduction :
L'AVC est la 3e cause de mortalité et la 1ère
cause de handicap ce qui en fait un enjeu de santé publique majeur. La
symptomatologie varie selon le territoire artériel concerné. Le
signe d'AVC le plus fréquent est l'hémiplégie, il peut
être accompagné d'aphasie et de troubles sensitifs.
L'OMS définit l'accident vasculaire
cérébral (AVC) comme « développement rapide de
signes localisés ou globaux de dysfonction cérébrale avec
des symptômes durant plus de 24 heures, pouvant conduire à la
mort, sans autre cause apparente qu'une origine vasculaire ». Les AVC
comprennent à la fois les accidents de nature ischémique (AIC) et
ceux de nature hémorragique (hémorragie intra parenchymateuse ou
intra méningée). Les AIC représentent 80% des AVC. Le type
de lésion conditionne la décision thérapeutique (voir
feuille annexe).
L'AVC en urgence constitue une véritable course contre
la montre. Ce tableau montre la perte neuronale lors de l'AVC ischémique
(Jeffrey L et al. Stroke 2006;37) en corrélation avec une perte
d'espérance de vie :
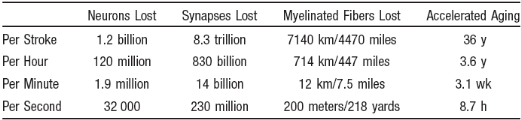
.
Deux types d'accidents ischémiques peuvent
s'observer :
- La
thrombose, provoquée par un caillot sanguin qui se forme
localement à l'intérieur d'une artère
cérébrale ou provoqué par une plaque d'athérome
obstruant une artère cérébrale
- L'AVC
embolique provoqué par un caillot qui se forme ailleurs dans
l'organisme, dans une artère irriguant le coeur, le cou ou les carotides
et parvient au cerveau par la circulation sanguine.
Les facteurs de risques principaux sont : l'hypertension
artérielle (facteur principal), le sexe masculin, le diabète,
l'âge élevé, le tabac,
l'hypercholestérolémie, les cardiopathies ischémiques ou
emboligènes et l'alcool (notamment à partir de 3 verres).
Après avoir effectué quelques rappels sur l'IRM,
nous nous intéresserons à l'apport diagnostique des images de
perfusion et diffusion, puis à leur utilité dans le pronostic
d'AVC.
I Rappels des principes physiques de l'IRM
Les noyaux ont un spin tournant autour de l'axe
nucléaire et engendrant un dipôle magnétique qui s'exprime
par une grandeur appelée moment magnétique et noté 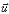 , orienté de manière quelconque. , orienté de manière quelconque.
En présence d'un champ magnétique B0 statique,
les moments magnétiques prennent deux orientations antiparallèles
correspondant à deux états d'énergie.
1) La
Résonance
Pour observer la résonance, il faut fournir une
énergie par un second champ magnétique B1 de plus faible
intensité, permettant aux noyaux de passer de l'état fondamental
à l'état excité. B1, perpendiculaire à B0, tourne
autour de celui-ci à une vitesse angulaire ù. B1 est une
impulsion radiofréquence de 180°. Lorsque la fréquence de
rotation de B1 est égale à la fréquence de
précession (ou fréquence de Larmor), il y a résonance et
passage du spin à un niveau d'énergie supérieur.
L'ensemble protons alignés dans le champ
magnétique sont représentés par un vecteur de
magnétisation 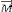 . .
Si on supprime le champ B1, le vecteur 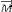 a tendance à revenir à sa position initiale c'est
à dire colinéaire à l'axe Oz en suivant un mouvement de
précession. Sa composante My se déphase et tend alors vers 0, de
même pour Mx, tandis que Mz croît. La décroissance de My se
fait de façon exponentielle et engendre un courant induit dans une
bobine réceptrice (en cuivre) située sur l'axe Oy. a tendance à revenir à sa position initiale c'est
à dire colinéaire à l'axe Oz en suivant un mouvement de
précession. Sa composante My se déphase et tend alors vers 0, de
même pour Mx, tandis que Mz croît. La décroissance de My se
fait de façon exponentielle et engendre un courant induit dans une
bobine réceptrice (en cuivre) située sur l'axe Oy.
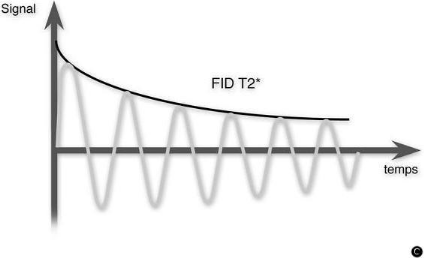
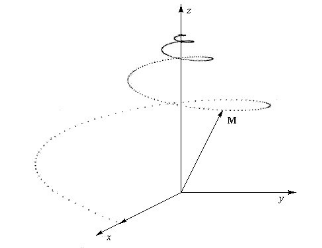
Mouvement de précession et signal FID
reçu.
Une fois amplifié, le signal induit capté par la bobine est
appelé FID (Free Induction Decay) ou encore signal de précession
libre. Le signal FID représente un ensemble de sinusoïdes amorties
en fonction du temps. La transformée de Fourier du signal permet
d'obtenir l'amplitude et la fréquence des signaux mesurés, ce qui
permet leur traitement informatique et la reconstitution d'images.
2) La
relaxation
On parle de relaxation quand  revient à sa position d'équilibre. On peut la
décomposer en deux phénomènes, la relaxation longitudinale
et la relaxation transversale. revient à sa position d'équilibre. On peut la
décomposer en deux phénomènes, la relaxation longitudinale
et la relaxation transversale.
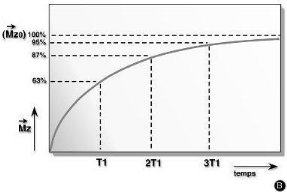
La relaxation longitudinale
A l'équilibre Mz = Mo,
Suite à la mise en résonnance : Mz = 0
Le retour de Mz à sa valeur de départ Mo est
exponentielle et caractérise la relaxation longitudinale.
La constante de temps T1 est le temps nécessaire pour
que les protons atteignent les deux tiers de leur aimantation. Elle
dépend en fait de la mobilité des atomes d'hydrogène ou de
celle des molécules auxquelles ils sont liés.
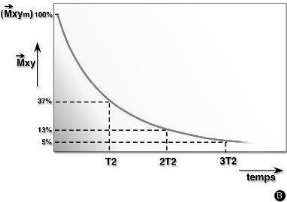
La relaxation transversale
Elle se caractérise par le temps de relaxation T2. T2
est en réalité le temps pendant lequel l'intensité
décroît de deux tiers de sa valeur initiale. Ce temps de
relaxation T2 est toujours inférieur au temps de relaxation T1.
Ces temps de relaxation T1 et T2 vont varier pour un tissu
donné selon l'organisation physico-chimique de l'eau dans ce tissu, et
c'est sur ces variations que l'on s'appuie pour détecter au sein d'un
tissu les modifications liées à la présence d'une
lésion. Les temps de relaxation T1 et T2 des tissus dépendent
donc de la mobilité des noyaux d'hydrogène présents dans
ces tissus : ces temps de relaxation augmentent avec l'hydratation de ces
tissus.
Le temps de relaxation transversale apparent (visible sur le
figure Mouvement de précession et signal FID reçu) est
appelé T2*.
3) IRM de diffusion
Dans une IRM de diffusion, le signal est enregistré
suite à une impulsion radiofréquence classique de 180°. Mais
de part et d'autre de cette impulsion sont appliqués deux gradients
opposés, d'intensité importante et identique.
Les protons immobiles déphasés par le premier
gradient seront rephasés par le second ce qui n'engendrera pas de
modification du signal.
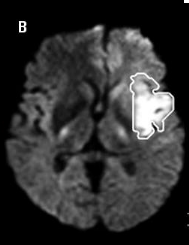
Les protons mobiles déphasés par le premier
gradient seront mal rephasés par le second, d'où une chute du
signal.
Ci contre une image d'IRM de diffusion avec en
blanc la zone ischémiée :
Source:http://www.webneurologie.com/fr/pros/print/e-docs/00/04/55/0C/texte_alt_jlenro00129_gr2.jpg
L'IRM de diffusion permet de calculer un paramètre
appelé ADC (ADC = Apparent Diffusion Coefficient).
Ce coefficient est calculé automatiquement par des
logiciels à partir d`une comparaison de 2 images acquises au même
niveau du cerveau (image pondérée en T2 et image
pondérée en diffusion). L'ADC en un point du cerveau correspond
à la pente de décroissance du signal sur une échelle
logarithmique entre l'image pondérée en T2 et l'image
pondérée en diffusion. Il est traduit en chaque point du cerveau
sur la carte d'ADC par une échelle de couleur.
Une forte décroissance du signal entre les deux images
traduit donc un ADC élevé, et une décroissance faible un
ADC faible. L'ADC est une mesure du degré de restriction du mouvement
des protons.
4) IRM de perfusion
La perfusion peut s'étudier de manière en
IRM :
- Méthode de marquage intrinsèque du flux
(rarement utilisée, elle consiste à marquer par une saturation ou
une inversion les spins du sang artériel avant qu'ils n'entrent dans le
volume de tissulaire étudié).
- Méthode utilisant des traceurs exogènes. La
technique la plus utilisée consiste à marquer le secteur
vasculaire en étudiant l'effet du premier passage d'un produit de
contraste exogène injecté en bolus. Les chélates de
Gadolinium (ou de fer) possédant un effet T2 et T2* seront
utilisés (bien que le Gadolinium possède un effet T1
prédominant, l'effet T2 sera plus utile ici). Des séquences Echo
Planar (système très rapide permettant d'acquérir
l'ensemble d'un plan en seule excitation) permettent d'évaluer la
cinétique de passage du traceur.
Au premier passage, le produit de contraste étant
très concentré, un effet T2* sera enregistré. La
présence de la barrière hémato encéphalique
empêchant le chélate de Gadolinium de diffuser à
l'extérieur des vaisseaux, il va y avoir une différence de
magnétisation entre l'espace intra vasculaire et extra vasculaire. Cela
produit de inhomogénéités de champs accentuant l'effet
T2*.
II Apport diagnostique de l'IRM de perfusion et
diffusion
1) L'apport de l'IRM par rapport aux autre méthodes
dans le diagnostic de l'AVC
Dans son étude cas Typhaine MIQUEL GOULENOK
révèle que sur 30 patients atteints d'endocardite infectieuse
avec complications cérébrales (dont 80% présentaient un
AVC), l'atteinte cérébrale est toujours visible sur l'IRM alors
qu'elle n'est visible que dans 81% des examens TDM. Ceci démontre la
meilleure sensibilité de l'IRM de diffusion par rapport au scanner. Elle
indique également que l'IRM permet de voir précocement les
lésions ischémiques et hémorragiques et est une technique
non invasive permettant de visualiser les anévrismes
cérébraux (à condition qu'ils soient supérieur
à 5mm). Grace à l'IRM elle obtient une corrélation
clinico- radiologique plus précise utile dans les décisions
thérapeutiques (délai de réalisation de la chirurgie,
choix du matériel prothétique...). Le nombre d'effet
indésirable de l'IRM est moins important que ceux de
l'artériographie et de la TDM cérébrale. En effet, ces
deux dernières techniques présentent une potentielle
toxicité rénale liée à l'injection d'iode ;
toxicité s'ajoutant à celle de certains antibiotiques et à
la potentielle atteinte glomérulaire de l'endocardite infectieuse. Au
contraire, aucun effet indésirable n'a été constaté
suite à l'injection de Gadolinium chez la population
étudiée.
Son étude révèle également que des
microbleeds (ou microsaignement : lésions punctiformes en
hyposignal, d'un diamètre de 5 à 10 mm) sont observés chez
57% des patients étudiés, et sont fréquemment
associés à des lésions ischémiques. Or, la
séquence T2* de l'IRM est la seule méthode permettant de
visualiser ces micro saignements. On sait aujourd'hui que la présence de
micro saignement est corrélée au risque de récidive
d'AVC.
Des études [10] rapportent que la prévalence de
ces microbleeds est de 18 à 68% chez les sujets présentant un
AVC, alors qu'ils apparaissent chez seulement 4,7% des sujets sains.
L'hétérogénéité de ces résultats
provient des critères radiologiques choisis et de la difficultée
de détection de ces microsaignement. Environ 13% des patients ayant eut
un AVC présentent toujours ces microsaignements.
2) La supériorité des IRM de diffusion et
perfusion par rapport aux autres IRM dans le diagnostic de l'AVC
L'étude de Michaël Metzger fut
réalisée sur 37 patients. Le premier examen (à J0) fut
réalisé en moyenne à 10h34 après l'apparition des
premiers symptômes. Les résultats des différentes
techniques IRM sont résumés dans le tableau suivant :
|
|
Méthode utilisée
|
nombre de patients
|
soit en pourcentage
|
|
Présence de sang visualisé
|
à J0
|
T2
|
1
|
2,7%
|
|
FLAIR
|
1
|
2,7%
|
|
Diffusion
|
1
|
2,7%
|
|
Perfusion
|
1
|
2,7%
|
|
à J5
|
T2
|
6
|
16,2%
|
|
FLAIR
|
4
|
10,8%
|
|
Diffusion
|
6
|
16,2%
|
|
Infarctus récent visualisé
|
à J0
|
T2
|
12
|
32,4%
|
|
FLAIR
|
21
|
56,8%
|
|
Diffusion
|
34
|
91,9%
|
|
Perfusion
|
34
|
91,9%
|
|
à J5
|
T2
|
29
|
78,4%
|
|
FLAIR
|
32
|
83,8%
|
|
Diffusion
|
33
|
89,2%
|
|
Perfusion
|
25
|
67,5%
|
Source [5] (voir bibliographie) résumé des
résultats pages 53 à 55
Ces résultats montrent que dans la phase aigue (J0), la
présence de sang est visualisable de la même manière
quelque soit la technique d'IRM utilisée. A J5 l'hémorragie est
mieux visible en séquences de diffusion et T2 qu'en FLAIR. Par contre
sensibilité de l'IRM de diffusion pour le diagnostic d'infarctus est la
meilleure à J0 et J5.
Cette étude indique que les 3 patients dont les
lésions n'ont pas été détectées en diffusion
sont différents des 3 patients dont les lésions n'ont pas
été détectées en perfusion. On constate qu'en
urgence (J0), les sensibilités en T2 et FLAIR sont faible alors qu'elles
sont bonnes pour l'IRM de diffusion et perfusion. L'association perfusion et
diffusion donne une sensibilité idéale dans cette étude
(100% des AVC détectés). L'auteur précise aussi qu'en T2,
aucun infarctus récent n'était diagnostiqué lorsque le
délai était inférieur à 6h.
Il est à noter que les 3 patients ayant une perfusion
normale avaient seulement de petits infarctus lacunaires, facilement visible en
diffusion. Cependant, les 3 patients dont la diffusion était normale
n'auraient pu être diagnostiqué sans une orientation clinique
précise. La seule lecture des cartes de perfusion s'avère
insuffisante pour établir un diagnostic pour les lésions de
petite taille. De plus, contrairement aux lésions de diffusion, il est
difficile de distinguer les anomalies de perfusions ancienne des anomalies
récentes. On s'aperçoit également que les lésions
non détectées en diffusion et perfusion à J0 ne le sont
toujours pas à J5.
Rappels concernant l'évolution de l'AVC2(*) :
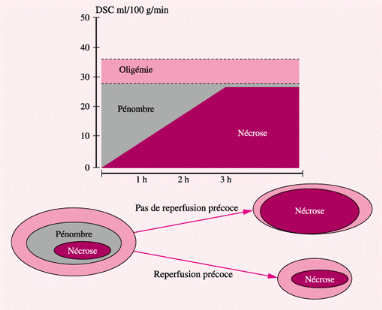
Nécrose : zone d'infarctus
irréversible.
Pénombre: ischémie
réversible, tissu à risque de nécrose
Oligémie: tissu à risque si
hypotension, hyperthermie hyperglycémie...
DSC : Débit sanguin cérébral
On sait également que l'IRM de diffusion/perfusion est
très bien corrélée avec le volume final de
l'infarctus :
- la zone hypoperfusée est souvent plus large que la
zone ischémiée
- la différence entre les 2 (zone hypoperfusée
sans anomalie de diffusion) définit une zone à risque d'extension
de l'ischémie mais potentiellement récupérable (zone de
pénombre ischémique).
La zone de pénombre (ou mismatch) correspond à
la différence visible entre l'image en diffusion et l'image en
perfusion. Cette zone est en acidose tissulaire. Seul l'association des images
de perfusion et diffusion permet de voir cette zone à risque de
nécrose.
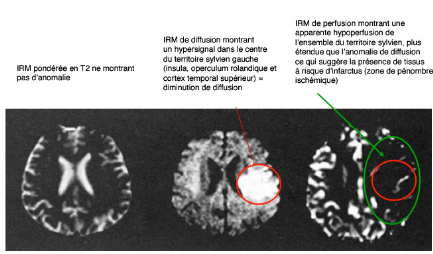
http://www.facbordeaux.com/tel/AVC.pdf
3) Observation des AVC à la phase hyper aiguë
(dans les 6 premières heures)
L'étude de A-C Januel [4] porte sur 12 patients
atteints d'AVC ayant pu bénéficier d'un IRM et d'une TDM dans les
6 heures après l'apparition des premiers symptômes.
Pour tous les patients ont été
pratiqués :
- à J0, une TDM et une IRM
- à J4 +/- 1jour une TDM et une IRM
- à J120 une IRM seule
Ses résultats sont résumés dans le
tableau ci dessous :
|
Pourcentage d'AVC détecté (nombre de patients)
|
|
|
à J0
|
à J4
|
|
TDM
|
50% (6)
|
91,67% (11)
|
|
IRM
|
T2
|
|
FLAIR
|
|
Diffusion
|
100% (12)
|
|
Perfusion
|
91,67% (11)
|
Ces résultats confirment en tout point ceux obtenus
dans les études précédentes. L'IRM de diffusion est encore
positive chez tous les patients. En effet tous leurs ADC sont diminués
par rapport au coté opposé pris comme référence.
Cette baisse est de 40% en moyenne. Ici encore, le patient présentant
une IRM de perfusion négative a un infarctus de très petite
taille.
Cette étude montre aussi qu'à J4 chez un patient
( différent du patient ayant une perfusion négative) aucune
anomalie n'est visible quel que soit la technique utilisée. Ce sujet
présentait un accident ischémique rapidement régressif. Ce
type de cas est très rare et a été très peu
observé chez l'homme.
Bien que des cas de réversibilité
complète des lésions ischémiques avec anomalie visible
précocement en imagerie de diffusion, aient été
rapportés, la zone de signal anormal détectée en IRM de
diffusion est considérée comme le territoire minimum de ce que
sera la zone de nécrose de l' infarctus, pour toutes les lésions
de plus de 1 ml.
Conclusion :
Le scanner (largement utilisé) associé à
des signes cliniques évocateur permet en urgence d'établir
l'absence d'un accident hémorragique mais est peu sensible aux accidents
ischémiques (80% des AVC). Dans les premières heures après
la survenue des premiers symptômes, la TDM a une sensibilité
beaucoup trop faible pour pouvoir être fiable. De même à la
phase aigue une simple IRM pondérée en T2 manque de
sensibilité. Au contraire, l'IRM pondéré en diffusion
associé à une IRM de perfusion permet un diagnostic très
précoce des accidents ischémique avec une sensibilité
très bonne. La taille de l'altération initiale en diffusion est
corrélée à l'évolution clinique et au volume final
de nécrose (zone irréversible).
L'observation des images de diffusion et perfusion permet
également de distinguer les zones de nécrose et de
pénombre ischémie. La taille de la zone de pénombre
s'avèrera utile pour le clinicien désirant évaluer le
risque hémorragique.
III Apport pronostique : Evaluation du risque
hémorragique et de l'évolution lésionnelle sous traitement
thrombolytique.
1) Apport pronostique de l'ADC
Les services de neurologie et d'imagerie des Cliniques
Universitaires Saint-Luc (UCL) ont également participé à
l'évaluation de l'imagerie de diffusion comparées aux autre
séquences d'IRM à la phase hyper aiguë de l'AVC (dans les 6
premières heures). A partir d'une série de 57 patients, la
précision diagnostique de l'imagerie de diffusion était de 95%
avec une sensibilité et une spécificité de 89% et 92%, des
valeurs prédictives positive et négative de 97 et 70%.
L'ADC a d'abord été mesuré dans des zones
considérées normales, controlatérale à la zone
ischémiée. Calculée à partir de 21 cas, les
valeurs moyenne de l'ADC pour les différents patient ont
été comparés. Ces mesures permettaient de mettre en
évidence de très importantes
hétérogénéités intra-lésionnelles et
de très larges écart type.
L'hétérogénéité des valeurs d'ADC pourrait
être due à des artefacts de mesure. En effet, la zone
d'intérêt peut être contaminée par la présence
de substance grise, de vaisseaux... Ainsi, dans des zones dites saines, des
écarts types de #177; 20% étaient constatées. Mais
l'hétérogénéité des valeurs de l'ADC peut
aussi être la conséquence de
l'hétérogénéité des lésions
tissulaires et de l'évolution différente des lésions dans
le temps. Les écarts types constatées pouvaient ainsi atteindre
individuellement 48%. D'autres études démontrent que la zone
ischémiée est constituée de composantes à ADC
réduit, normal mais aussi plus élevé, ces dernières
permettant de mettre en doute la notion de coeur (nécrose) et de zone de
pénombre et donc de remettre en cause le modèle
physiopathologique de l'infarctus cérébral. La mesure d'un ratio
d'ADC (appelé ADCr) entre la zone ischémiée et la zone
controlatérale apporterait plus d'informations. Ces études ont
montré chez leurs patients une évolution clinique satisfaisante
pour des valeurs d'ADCr supérieures à 0,77 et un mauvais
pronostic pour des valeurs inférieures à 0,59. La mesure de
l'ADCr serait donc le marqueur de la gravité des lésions
ischémiques et permettrait de prévoir l'évolution de la
maladie.
Une autre étude [2] cherchait à
déterminer un seuil d'hypoperfusion à partir duquel une baisse
d'ADC serait visible ainsi qu'une potentielle corrélation entre
débit sanguin cérébral relatif (DSCr) et ADC.
L'hypothèse était que la baisse d'ADC n'évolue pas de
façon linéaire avec le DSCr : l'ADC demeurant normal
jusqu'à un certain niveau d'hypoperfusion, puis étant
légèrement diminué dans la zone de pénombre, et
enfin chutant brutalement dans la zone d'hypoperfusion sévère au
dessous d'un seuil de débit. Ainsi, une relation de forme sigmoïde,
entre ADC et DSCr serait possible. Les observations réalisées au
CHU de Caen portent sur 7 patients ayant eut une IRM en moyenne 6h (min 4h -
max 10h) après les premiers signes cliniques. Pour les patients
plusieurs zone d'intérêt (ROI) ont été défini
pour la zone d'infarctus (et pour la zone de mismatch).
Cette étude prouva que la relation entre diffusion et
modification de perfusion est non linéaire et qu'une diminution d'ADC
est significativement visible pour une diminution de la perfusion d'au moins
50%. Ces résultats, bien qu'ils soient en accord avec de ceux
d'études menés sur des animaux, n'ont été obtenus
qu'à partir d'un faible échantillon de patients.
L'étude de J.B. Pialat [7] inclus 52 patients. Des IRM
ont été effectués à J0 (à moins de 7h
après les premiers symptômes) , J1 (pour contrôler l'effet
de la thrombolyse) et à J60. Tous les patients ont été
traités par un activateur recombinant du plasminogène ou rt-PA
(traitement classique de l'AVC, voir feuille annexe).
Le risque hémorragique étant majoré par
la thrombolyse, il doit être évalué avant la mise en route
du traitement. Son analyse de l'ADC a été effectuée dans
la zone de mismatch. Il a classé les pixels en plusieurs classes en
fonction de leur ADC en comptant le nombre total de pixels (nombre absolu de
pixels) et en rapportant ce nombre au nombre total de pixels dans la
lésion (pourcentage de pixels). En pourcentage de pixels il trouva une
différence significative pour les classes de pixels d'ADC <
250×10-6 mm3.s-1. Il existe donc un seuil
au dessous duquel le risque hémorragique est plus élevé en
cas de traitement (50% de transformation hémorragique). Dans ce cas
également, il n'y a pas de différence d'ADC en valeur absolu
entre les patients ayant une hémorragie et ceux n'en ayant pas. Mais
dans cette étude, l'explication pourrait provenir du fait que les
volumes des lésions sont différent pour ces deux populations. En
effet, les volumes sont de 107,31 #177; 34,22 cm3 pour le groupe
ayant une hémorragie et de 79,79 #177; 53,47 cm3 pour le
groupe sans hémorragie. L'auteur indique que « cette
différence est sensible même si elle n'est pas
significative (p=0,074). Le fait que le volume soit plus important noie
les pixels d'ADC bas dans les pixels de valeur plus élevée
». Ainsi, le risque hémorragique pourrait simplement être
corrélé à la taille de la lésion. En fait cette
notion existe déjà puisque les hypodensités
étendues visible au scanner à J0 sont une contre indication
à la thrombolyse et au traitement anticoagulant. Le risque
hémorragique peut donc être approché par l'ADC, mais un
seuil valable pour tous les patients et dans tous les hôpitaux ne peut
être déterminé avec un si petit échantillon de
valeurs. Cependant la mesure de l'ADC reste un outil intéressant pour
évaluer le volume de nécrose à la phase hyper aiguë
de l'AIC. Par ailleurs, il a déjà été prouvé
qu'il y a une répartition « en bulbe d'oignon » des
valeurs d'ADC (très basses au centre des lésions et de plus en
plus élevées en allant vers la périphérie). Ainsi
certaines études (comme l'étude faite par les UCL) montrent qu'il
est possible d'établir une valeur seuil d'ADCr compris entre 70 et 80%.
L'ensemble de ces études montre donc que l'ADC semble
généralement diminuer en cas d'AVC. En effet l'ADC diminue pour
toute diminution de perfusion d'au moins 50%. Cependant l'ADC peut rapidement
varier au cours du temps pour un même individu et de nombreux cas de
baisse d'ADC non significatif ont été rapportés. Cela en
fait un paramètre inexact pour l'évaluation de l'évolution
de l'AVC. Cependant, l'ADCr (ratio entre la région
ischémiée et la région controlatérale) est un
indicateur plus sur du devenir de la nécrose et du risque
hémorragique. Aucune étude de grande envergure n'a établi
de valeur seuil pouvant être appliquée dans tous les centres
d'urgence, mais une valeur seuil entre 70 et 80% semble ressortir.
Il est classiquement admis que le coefficient apparent de
diffusion est réduit les premiers jours de l'infarctus, puis augmente
par la suite (pseudo normalisation), pour devenir hyper intense pendant la
phase de chronicité. L'analyse transversale de multiples étude
démontre [9] une réduction maximale du coefficient de diffusion
apparaît en moyenne 33 heures après la survenue des signes
cliniques, reflétant degré d'ischémie. Ceci permet de
distinguer trois phases d'infarctus, hyperaiguë (moins de 6h),
subaiguë (4 à 10 jours), et chronique. Cette progression naturelle
(patients non traités) est variable en fonction des études. Cette
variabilité peut provenir des différentes techniques
utilisés et/ou d'une possible reperfusion précoce :
- dans les premières heures : la zone
ischémiée (oedème cytotoxique) est en hyposignal alors que
le T2 est normal
- au bout d'une semaine : pseudo-normalisation, disparition de
l'hyposignal ;
- cicatrice, séquelle : hypersignal (augmentation de
l'eau extracellulaire au sein de la cicatrice qui correspond donc à une
augmentation du coefficient de diffusion).
2) Etude des paramètres de perfusion et scores
cliniques
L'étude de A-C. Januel [4] montre une
corrélation entre la taille de l'infarctus final et l'ischémie
visible en perfusion et diffusion à J0 et J4. Elle prouve aussi que les
NIHSS initial et final sont corrélé au volume initial de
l'ischémie mesurée en IRM. Le NIHSS (National Institute of Health
Stroke Scale) est une évaluation donnant un score clinique visant
à déterminer la présence et la gravité de l'AVC.
A-C. Januel évalua également grâce à
l'échelle de Rankin, la sévérité du handicap
fonctionnel des patients à J120. Ses résultats indiquent que seul
le volume de perfusion est corrélé avec le score de Rankin
à long terme. Elle confirma aussi la corrélation entre les score
du NIHSS et de Rankin. Dans son étude, les patients dont le NIHSS est
inférieur à 12 ont un volume lésionnel initial de taille
inférieure à 50 cm3. Inversement, lorsque NIHSS>12,
le volume lésionnel initial est supérieur à 100
cm3. Elle montre aussi que les 8 patients ayant un AVC dû
à une occlusion artérielle cérébrale avaient des
scores cliniques et un handicap fonctionnel (J120)
« péjoratifs » comparé aux reste de
l'échantillon.
L'étude de J.B. Pialat prit également en compte
divers paramètres de perfusion tel que le débit sanguin relatif
(ou flux sanguin cérébral relatif rrCBF), le temps de transit
moyen relatif (rMTT), le volume sanguin régional relatif (rrCBV), le
temps d'arrivé au pic TTP, et la valeur absolue du pic de
relaxivité maximale (Peak). Peak, rrCBF et rrCBV sont relatifs au
coté opposé (rrCBF = rCBFlésion/rCBFmiroir). Ses
conclusions montrent que seul le rMTT mesuré à J0 est
significativement corrélé à la reperfusion observée
à J1. Cette corrélation est intéressante car elle
permettrait potentiellement d'envisager la capacité de reperfusion du
territoire avant la mise en route du traitement. Il remarque que le temps de
transit moyen relatif (rMTT) est plus élevé chez les patients qui
recanalisent (revascularisent leur zone de pénombre après
administration d'un traitement) que chez les patients qui ne recanalisent pas.
Ceci pourrait s'expliquer par le fait que les branches artérielles
distales pourraient se recanaliser plus facilement le sang mettrait donc plus
de temps à arriver au niveau de la zone de nécrose.
Il étudia aussi l'évolution clinique en
évaluant la sévérité des séquelles à
2 mois grâce à l'IRM et au NIHSS. Il chercha à
établir une corrélation entre NIHSS et IRM de perfusion. Il
utilisa la méthode des rangs de spearman (méthode d'étude
statistique de corrélation utilisée lorsque les distributions des
variables sont asymétriques). Le flux sanguin cérébral
relatif (rrCBF) apparaît corrélé aussi bien
corrélé au NIHSS en diffusion qu'en perfusion. Cela illustre
l'importance du débit sanguin dans la survenue des altérations
neuronales et confirme les résultats précédents [4] sur un
plus grand échantillon. En pratique clinique, le principal objectif
thérapeutique reste le pronostic fonctionnel, et prédire
l'évolution tardive (ici à J60) du patient peut aider à
mieux cibler la population pouvant tirer un bénéfice à
être traitée.
Le peak est corrélé avec le NIHSS et la
diffusion. L'interprétation de ce résultat reste flou. Il peut
être dû à la stase du produit qui provoquerait une
importante baisse de signal. Cependant, il faudrait qu'un volume important de
produit de contraste arrive jusqu'au lieu de lésion.
Les résultats d'autres équipes [3] montrent que
la zone de pénombre ischémique est caractérisée en
moyenne par 73% d'augmentation de la MTT et 29% d' augmentation rrCBV. De plus
un CBF réduit dans une zone de CBV normale peut suggérer que
quelques perfusions résiduelles par des collatérales
dilatées subsistent. Pour tous les sujets de l'étude ayant eut
une IRM de diffusion et de perfusion : si un défaut de perfusion
(mesuré par le rMTT) est plus grand que la zone de nécrose
visible en IRM de diffusion alors, on observe l'extension de la lésion
ischémique dans les jours suivant. Cela signifie qu'en présence
d'une zone de pénombre ischémique à J0, la taille de la
zone nécrosée ne peut qu'augmenter. A l'inverse, en absence de
zone de pénombre ischémique, il n'y a pas forcément
d'extension de la nécrose initiale sur les images mesurées au
7e jour. Cette publication montre également que les valeurs
du rrCBF de 37% et du rrCBV de 47% caractérisent la zone de
pénombre alors que le RCBF n'est que de 12% dans la partie
nécrosée. Les rCBF et rCBV permettent donc d'identifier les
tissus potentiellement récupérable peu après les
débuts de l'AVC.
Pour conclure nous pouvons affirmer que les paramètres
de diffusion (ADCr) et de perfusion (CBF et CBV) sont, tout comme la taille
initiale de l'infarctus, indissociable de l'évolution de la maladie
(mesuré par le NIHSS). La disponibilité des séquences de
diffusion ont transformé l'apport de l'IRM en urgence en permettant la
distinction entre les lésions aiguës et les lésions
séquellaires. De plus, grâce aux images de diffusion et perfusion
effectuées dans les premières heures, les aires d'infarctus
irréversible peuvent être définies avec fiabilité,
de même que l'hémorragie intracrânienne et le tissu
ischémié potentiellement récupérable. Cela permet
d'évaluer le risque hémorragique du traitement.
L'inconvénient de la plus part des études
utilisées dans ce chapitre est qu'elles ont effectué pour leurs
paramètres étudiés, une normalisation par les
régions dites « mirroir » de
l'hémisphère controlatéral. Les valeurs s'expriment alors
en pourcentage par rapport au coté opposé. L'obtention de ce
ratio permet de s'affranchir de nombreux problèmes techniques (dilution
du bolus, patient avec insuffisance cardiaque, échelle arbitraire des
rCBF et rCBV à chaque examen ne permettant de comparaison directe...).
Le problème est qu'en cas d'ischémie, l'hémisphère
controlatéral présente souvent des modifications
hémodynamiques pouvant aller de l'hyper débit compensatoire
à l'hypo perfusion. Ces modifications varient en fonction des individus
et ne peuvent pas être correctement évalués.
Il ressort de ces études qu'une grande proportion des
patients ayant un mismatch et étant traités par rt-PA ont eu une
amélioration significative du score NIHSS. En présence d'un
mismatch, les patients traités par rt-PA ont un taux de recanalisation
plus important, une augmentation de la reperfusion, ainsi qu'une plus grande
proportion de tissu sévèrement hypoperfusé
n'évoluant pas vers l'infarctus. Ces études montrent
également que les patients ayant un mismatch entre perfusion et
diffusion et une recanalisation après leur traitement ont une expansion
de la zone nécrosée plus faible que celle observée chez
les patients avec le même pattern mais sans recanalisation.
3) NEURiNFARCT : un nouveau système de
pronostic basé sur l'IRM de diffusion.
L'étude est basée sur 98 patients de 60 ans de
moyenne d'âge. Le premier IRM a été passé en moyenne
2,3 h après les premiers symptômes. NEURiNFARCT a pour but
d'établir une image de prédiction automatique du devenir de
l'infarctus et de sa progression potentielle dans le cerveau du patient, ce qui
permettrait au neurologue d'estimer le rapport bénéfice/risque
des traitements existants pour limiter cette progression. Il s'agit d'un
algorithme obtenu grâce à la carte d'ADC créée suite
à l'IRM faite dès admission des patients.
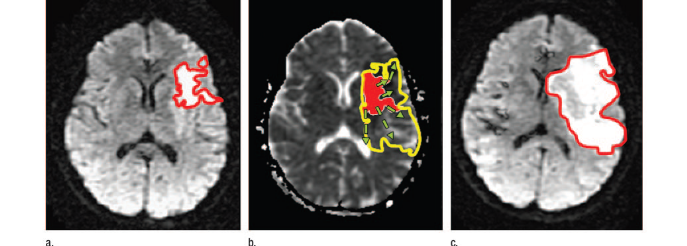
Source [8] : Principe de fonctionnement de
NEURiNFARCT, observation chez un patient de 49 ans
A: A l'admission (104 min) l'infarctus déjà
formé (16,3 cm3)est identifié grâce à une
séquence IRM de diffusion classique.
B: L'infarctus déjà formé est
reporté sur la carte du coefficient apparent de diffusion
(dérivée automatiquement de l'IRM de diffusion A). Le logiciel
estime la taille finale de l'infarctus à 84,1 cm3.
C : Infarctus final mesuré en IRM de
diffusion : 126,9 cm3 .
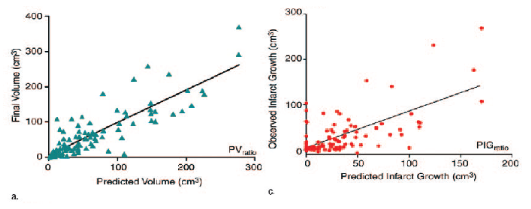
Cet algorithme procède à une simulation de
manière itérative (voxel par voxel) de l'évolution de
l'infarctus. Ici encore un ratio d'ADC a été pratiqué et
les résultats montrent qu'une valeur seuil d'ADCr peut être
établie à 0,93 (ADClésion = 0,93ADCmirroir). Ce seuil est
différent de celui décrit par l'étude
précédente faite aux UCL. Cela peut s'expliquer par l'utilisation
de machines ou de séquences différentes. Comme le montre ces
graphiques, l'étude montra une corrélation entre le volume final
de l'infarctus et le volume prédit par l'algorithme.
Les chercheurs voulurent ensuite observer s'il y avait une
corrélation entre la prédiction faite par le logiciel et la
revascularisation. Ils étudièrent également l'effet de
l'heure où la première IRM fut prise. Ils n'observèrent
aucune corrélation entre l'heure où l'IRM fut prise et la
prédiction de l'infarctus. Une revascularisation complète ou
partielle fut observée chez 70 patients et il n'y eut aucune
revascularisation chez 20 patients (1 individu eut un IRM non
interprétable). Ils constatèrent que chez les patients ayant eut
une revascularisation, la réelle croissance de l'infarctus était
même plus faible que celle prédite.
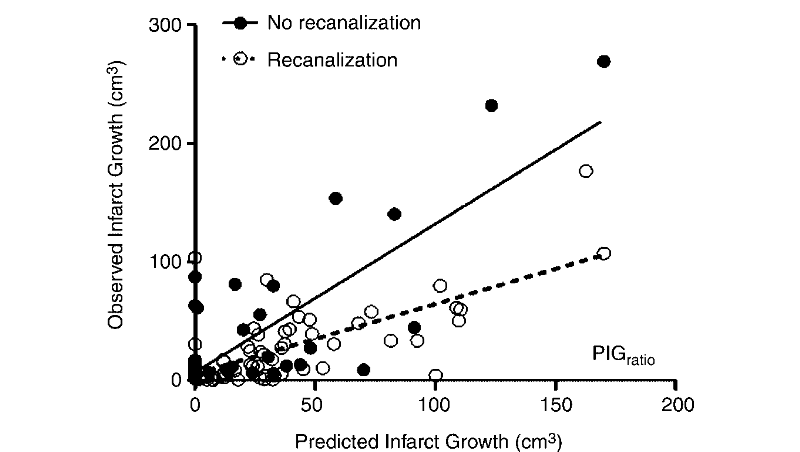
Le graphique ci dessus, la corrélation entre la
possible revascularisation et la prédiction de la croissance de
l'infarctus établie par leur algorithme.
La méthode NEURiNFARCT permet également de
prévoir la zone de pénombre et présente l'avantage de
n'utiliser que des images faites en IRM de diffusion.. Ainsi l'injection de
produit de contraste (effectué pour l'IRM de perfusion) n'est plus
nécessaire. Elle est entièrement automatisée ce qui
apporte un gain de temps dans les situations d'urgence.
Cette méthode a quelques limitations : il n'a pas
encore été prouvé que la méthode peut travailler
avec des données provenant de différents systèmes
d'imagerie par résonance magnétique dans d'autres centres. Une
version de l'algorithme pouvant être distribué à d'autres
centres est en cours de développement.
Conclusion :
L'inconvénient sur les valeurs seuil d'ADC et de l'ADCr
est que ces valeurs seuil varient en fonction de l'étude. Cela pourrait
être du aux paramètres d'acquisition variant entre
différentes machines (nombre de Tesla, temps d'écho, angle de
bascule etc.) . Cependant une équipe a montré que deux examens
réalisés chez des rats à 15 minutes d'intervalle
révélait déjà des différences dans les
valeurs d'ADC (Shen et al., 2003). évolue avec le temps.
Etant donné les variations de valeurs d'ADC en fonction
des appareils, des séquences et du temps, le développement de
l'algorithme de NEURiNFARCT sera difficile.
Les nombreuses corrélations définies au cours de
ce mémoire offrent d'intéressantes perspectives d'avenir. La mise
au point d'un algorithme permettant d'évaluer l'évolution de la
taille de la zone nécrosée à partir de l'ADCr dans un
centre IRM semble être un premier pas vers la mise au point de
méthodes automatiques permettant de prévoir le risque
hémorragique et l'évolution des symptômes. En effet, si
cela s'avère possible, l'intégration de tous paramètres
présentant une corrélation avec la taille de l'infarctus et le
NIHSS dans un unique algorithme, permettrait une prise en charge optimale de
l'AVC. Cela nécessiterait cependant une standardisation des
échelles de rCBF et rCBV ainsi que l'évaluation des modifications
de tous les paramètres au cours du temps.
La variation des paramètres d'acquisition (puissance du
champ magnétique, temps d'Echo, temps de relaxation etc.) entre les
différents centres d'examen n'a pas encore permis de consensus sur une
méthode de pronostic fiable et applicable partout.
A l'heure actuelle, aucune étude IRM de grande
envergure (sur quelques milliers de patients) n'a été
menée dans la phase hyperaiguë de l'AVC. Une telle étude
intégrant toutes les variables connues (facteurs de risque,
paramètres radiologiques et scores cliniques) et établissant
toutes éventuelles corrélation entre eux pourrait permettre une
avancée majeur dans la prédiction de l'évolution de l'AVC
et de ses symptômes. De plus, la mesure des différents
coefficients de diffusion et perfusion pourraient permettre d'obtenir des
données précises sur l'évolution de l'ischémie dans
les premières heures. La détermination de valeurs seuils pour
plusieurs paramètres pourrait permettre d'établir
précisément la réversibilité ou non d'une zone
lésion.
Conclusion :
Les IRM de diffusion et de perfusion sont des techniques
rapide apportant dès les premières minutes de l'AVC de nombreuses
informations orientant la décision thérapeutique.
L'association de ces IRM permet notamment de délimiter
et différencier immédiatement les zones de nécroses et
ischémies. Non invasive et faisant preuve d'une très bonne
sensibilité, et spécificité à la phase
hyperaiguë, elle s'impose comme la méthode d'imagerie de
référence pour le diagnostic d'AVC. Une absence de mismatch
signifiant une absence tissu potentiellement récupérable, un
traitement thrombolytique s'avère inutile et même dangereux,
puisqu'il augmenterait le risque d'hémorragie. Elle est également
un outil de recherche puisqu'elle peut évaluer le territoire de
reperfusion chez les patients traités. Les différents
paramètres mesurés grâce à cette méthode
permettraient également de prédire l'évolution clinique du
patient. En effet l'ADC et la taille initiale de l'infarctus étant
corrélés à sa taille finale. Enfin l'IRM de diffusion
permet également de différencier les AVC anciens et
récents : tout AVC avec restriction de diffusion étant un
AVC de moins de 10 jours. L'IRM apporte aussi une meilleure concordance entre
les observateurs pour apprécier la lésion et son
étendue.
Bien qu'étant la meilleure approche en cas de suspicion
d'AVC, l'IRM de perfusion et diffusion n'est toujours pas pratiquée en
première intention car souvent indisponible (faible nombre d'appareils
IRM dans les hôpitaux). La TDM reste donc l'examen de premier recours
dans la majorité des cas.
Annexe
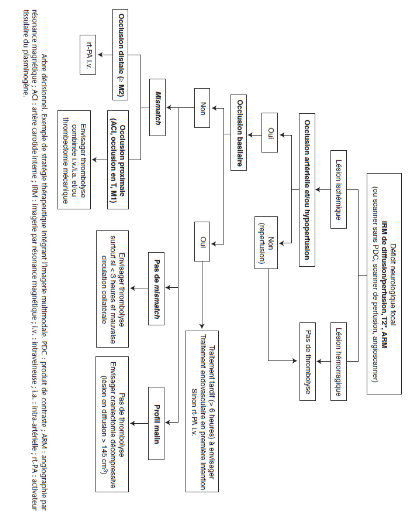
Source [10] page 9 (voir bibliographie)
Bibliographie
[1] G. COSNARD, T. DUPREZ, C. GRANDIN, A.M. SMITH et
A. PEETERS, Imagerie de diffusion et de perfusion par
résonance magnétique de l'encéphale.
http://www.md.ucl.ac.be/loumed/118,%201999/129-140.PDF
[2] M. HAMON et al. Relation quantitative
des modifications de la diffusion et de la perfusion au sein du parenchyme
cérébral au cours de l'accident ischémique aigu,
Journal of Neuroradiology, volume 32 (2), p.118-124 Paris ; mars 2005.
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B8JDT-4R5DSGR-3J&_user=10&_coverDate=03%2F31%2F2005&_rdoc=1&_fmt=high&_orig=search&_sort=d&_docanchor=&view=c&_searchStrId=1439392119&_rerunOrigin=google&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=9f1215073b1a547dcab7023da0a3ed7a
ou
http://www.em-consulte.com/es/article/126708
[3] W-D. HEISS, Ischemic penumbra:
Evidence from functional imaging in man. Journal of Cerebral Blood Flow
& Metabolism volume 20, p.1276-1293. Juin 2000
http://www.nature.com/jcbfm/journal/v20/n9/full/9590980a.html
[4] JANUEL, Anne-Christine. Apport
pronostique de l'IRM (1 Tesla) de diffusion et de perfusion à la phase
hyperaiguë des Accidents Vasculaires Cérébraux
ischémique. Th Doctorat Méd, UJM Saint-Etienne; 2001.
[5] METZGER, Michaël.
Intérêt diagnostique de l'IRM de diffusion et perfusion dans
l'accident vasculaire cérébral Ischémique à la
phase aigue. Th Doctorat Méd, UJF Grenoble; 2001.
[6] MIQUEL GOULENOK Typhaine. Endocardite
infectieuse et complications cérébrales, à la
lumière de l'IRM : à propos de 30 cas. Th Doctorat
Méd, Paris V ; 2009.
[7] PIALAT, Jean-Baptiste. IRM de
diffusion et perfusion et accident ischémique cérébral
aigu : Evaluation du risque hémorragique et de l'évolution
lésionnelle sous traitement thrombolytique. Th Doctorat Méd,
Lyon 1; 2004.
[8] C. ROSSO, N. HEVIA-MONTIEL, S. DELTOUR,
E. BARDINET, D. DORMONT, S. CROZIER, S. BAILLET, et Y. SAMSON.
Prediction of infarct growth based on apparent diffusion coefficient:
penumbral assessment without intravenous contrast. RADIOLOGY,
publié en ligne sur le site de radiology, le 18 novembre 2008.
http://radiology.rsna.org/content/250/1/184.full
[9] B. XERRI, Y. MATILLON et
al. Rapport de l'ANAES (Agence Nationale d'Accréditation et
d'Evaluation en Santé), service d'évaluation des technologies,
Imagerie de l'accident-vasculaire cérébral aigu, Juin
2002.
http://sfnv-france.com/pdf/Recommandations-ANAES5802B.pdf
[10] M. Wiart , T.H. Cho, N. Nighoghossian.
Apports de l'IRM multimodale au diagnostic des AVC ischémiques,
Journal de Radiologie, Volume 89 (10) p. 1215, octobre 2008.
http://www.em-consulte.com/article/216550
MEMOIRE BIBLIOGRAPHIQUE
Mickael TAFAZZOLI : L'IRM DE DIFFUSION
ET DE PERFUSION DANS L'ACCIDENT VASCULAIRE CEREBRAL
RESUME :
Basée sur des études de cas, nous avons chercher
à effectuer une mise au point sur les différents
paramètres de diffusion et de perfusion permettant de diagnostiquer et
d'évaluer l'évolution des AVC. L'ensemble de ces analyses
aboutissent à des résultats similaires. Il s'avère qu'il
est possible d'établir certaines corrélations entre ces
paramètres physiques et les scores reflétant la progression des
signes cliniques. L'établissement de valeurs seuil relatives au
coté opposé pour chaque variable permettrait la mise au point
d'algorithmes sophistiqués permettant une appréciation plus
précise du devenir de la pathologie. Les paramètres tels que le
rCBF, rCBV et ADCr se montrent de bon indicateur de la situation
présente et future du patient.
A l'heure actuelle la prise en charge de l'AVC à la
phase hyperaiguë reste un enjeu majeur de santé publique et les
informations données pars l'IRM de diffusion et de perfusion sont
capitales. Cependant le manque de disponibilité en urgence de tels
appareils est toujours à déplorer et constitue un problème
important de gestion dans les Unité Neuro-Vasculaires (UNV).
* 1
http://www.cofemer.fr/UserFiles/File/planAVC17avr2010.pdf
* 2 Source : Magali Bisbal,
ACCIDENT VASCULAIRE CEREBRAL :QUELLE PLACE POUR LA FIBRINOLYSE ?
DESC Réanimation Médicale, Clermont Ferrand juin
2008.
| 


