|

Université des Sciences et Technologie-MOHAMED
BOUDIAF- Oran
USTO
Faculté des Sciences
Département de Chimie Industrielle
THÈSE
Pour obtenir le titre de
MAGISTER
Option: INGENIERIE BIOMOLECULAIRE
Présentée par
Mr. CHARCHAR ABDELHAK
Synthèses et Activité Anti- Microbiennes
de Bis-N-Nucléosides Dérivée de L-
Acide Tartrique
Directeurs de thèse :
Encadreur : Mr. Professeur. ADIL
ALI -OTHMANE
Co- Encadreur : Mr.
BENOUALI DJILALI
Soutenance prévue le : 17 /06 / 2008
JURYS
- Mr.ILIKTI Hocine .M.C. (Président)
USTO
-Mr. TABTI Boufaldja. Pr.( Examineur) U. ABOUBAKR
BELKAID TLEMCEN
- Mme. ZRADNI Fatima Zohra. M.C (Examinateur)
USTO
Année Universitaire 2007-2008

Liste des
abréviations
ADN : acide
déoxyribonucléique
ANP : analogues de
nucléosides phosphonates
ARN : acide
ribonucléique
CCM : chromatographie sur couche
mince
DMSO : diméthyl
sulfoxide
HIV : virus
d'immunodéficience humaine
HSV : virus de l'herpès
simplex
IR : infrarouge
Rf : rapport frontal
TMS :
tétraméthylsilane
PNA : L'acide
nucléique de peptide
RMN : résonance magnétique
nucléaire
Tf : température de
fusion
LNA : acide nucléique
verrouillé
VHS : viral hemorragic
septicemia
VZV : varicella-Zoster
virus
DHPG :
9-(1,3-dihydroxy-2-propoxymethyl) guanine
NDG :
9-(2,3-dihydroxy-1propoxymethyl) guanine
CMI : concentration minimale inhibitrice
SOMMAIRE
INTRODUCTION
GENERALE.............................................................................................2
PARTIE A: (THEORIQUE)
CHAPITRE 1 : Acide
Tartrique
A-1-1.Introduction.......................................................................................................6
A-1-2.
Propriétés.........................................................................................................7
A-1-3.
Caractéristiques................................................................................................9
A-1-4. La Chiralité d'acide
Tartrique...............................................................................10
A-1-5. Acide (2R,3S)
-Tartrique........................................................................................12
CHAPITRE 2 : Nucléosides
Introduction......................................................................................................................15
A-2-1- Les Nucléosides et
Nucléotides : Définition ; Structures
...........................................16
A-2-2- Structure et Fonction de
l'ADN............................................................................19
A-2-3- Naturelles
Nucléosides.........................................................................................20
A-2-4- Description et Classification
des Analogues de Nucléosides......................................25
A-2-5- Synthèse des
Nucléosides...................................................................................43
A-2-5-1- Méthode de
Hilbert et
Johnson.................................................................43
A-2-5-2- Méthode de
Vorbrüggen...........................................................................44
A-2-6- Synthèse d'Acyclo-
N-Nucléosides..........................................................................46
A-2-7- Nucléoside
Antibiotiques........................................................................................50
PARTIE B:( RESULTATS ET DISCUTIONS)
Objet de
travail.............................................................................................................53
CHAPITRE1 : Synthèse
B-1-1- L(+) tartrate de
diéthyles........................................................................................56
B-1-2- Di hydrazides L (+)
tartrique....................................................................................56
B-1-3- Bis-1, 3,4-oxadiazole-5-thione
.................................................................................57
B-1-4-Bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) tartaric acid..........................................58
B-1-5- Bis-(4-arabinosidene-amino
-5-mercapto-4H-[1,2,4] triazol-3-yl) tartaric acid ....................59
CHAPITRE 2 : Tests
Biologiques
B-2-1- Les Essais
Biologiques.............................................................................................62
B-2-2- Résultats des Tests
Biologiques.................................................................................66
B-2-3- Description des Résultats des
Tests
Biologiques...........................................................68
PARTIE C:( EXPEREMENTALE)
C-1-Généralité.................................................................................................................71
C-2- Synthèse et
Identification.............................................................................................73
C-2-1- Préparation de L (+)
tartrate de
diéthyles..................................................................73
C-2-2- Préparation de
Dihydrazides L (+)
Tartrique..............................................................74
C-2-3-Préparation
de Bis-1,
3,4-Oxadiazole-5-Thione............................................................74
C-2-4- Préparation de
Bis-(4-amino-5-mercapto-4H-[1,2,4]Triazol-3-yl)
.....................................75
C-2-5- Préparation de
Bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4]
Triazol.......................76
C-3- Les Essais
Biologiques.................................................................................................77
CONCLUSION
GENERALE.................................................................................................80
BIBLIOGRAPHIE................................................................................................................82
ANNEXE
INTRODUCTION GÉNÉRALE
INTRODUCTION
GÉNÉRALE
Les nucléosides constituent les éléments
fondamentaux des acides nucléiques (ADN ou ARN).
L'importance biologique de ces composes est apparue des la
première moitie du vingtième siècle en raison de leur
rôle dans la transmission de l'information génétique et
dans la synthèse des protéines. Cette fonction
particulière implique que ces composes, après quelques
modifications, constitue une source importante d'agents
thérapeutiques.
Les très nombreuses recherches effectuées
depuis les trois dernières décennies, ont montre des applications
des nucléosides comme antirétroviraux, antiviraux et
anticancéreux. Si des molécules comme l'AZT
(3'-azido-3'-désoxythymidine, anti-HIV), le
(2',3'-didéhydro-2',3'-didésoxythymidine, également
anti-HIV) ou l'acyclovir [9-(2-hydroxyéthoxyméthyl) guanine, anti
herpes] ont été largement médiatisées, on ne
dispose que d'un éventail relativement modeste de molécules
réellement actives.
La Chimie des Biomolécules est extrêmement
délicate car ceux-ci
Présentent de nombreux centres réactionnels
aussi bien sur la partie base que
Sur la partie sucre. La modification chimique de ces composes
nécessite donc une attention particulière aussi bien dans le
choix des réactions employées que dans les protections des
diverses fonctions.
La recherche de nouvelles molécules de types
nucléosides acycliques reste un sujet
d'actualité, en particulier en raison des
phénomènes de résistance virale
qui peuvent apparaitre vis a vis de telle ou telle structure.
Avec les nucléosides antibiotiques En raison du grand nombre de cibles
l'activité de ces composes ne peut cependant que très
difficilement être prédite a l'avance, il est donc
nécessaire de synthétiser de
nouvelles molécules et de les tester ; La
modification du nucléoside peut être effectuée soit au
niveau de la partie base soit au niveau de la partie sucre.
Au cours de ce travail, nous nous sommes proposes
de synthétiser
quelques nucléosides originaux en raison de leur impact
vis a vis de Nombreux virus et retrovirus. Par ailleurs, nous nous sommes
intéressés a la synthèse oxadiazole et de nouveaux
analogues nucléosides Triazoliques ; Ce dernier
est un antibactérien et plus exactement un agent antifungique qui
crée un lien chimique fort avec les bases de l'ADN.
Le
bis-(4-amino-5-mercapto-4H-[1,2,4] triazol-3-yl) acide
tartrique , Bis-1, 3,4-oxadiazole-5-thione et le
dernier nucléoside avec bis-(4-arabinosidene-amino
-5-mercapto-4H-[1,2,4] triazol-3-yl) acide tartrique :ont été
synthétisés de l'acide l-tartrique et caractérisés
par IR.NMR et activité biologique contre les micro-organismes :
Escherichia coli ATTC 25922, Pseudomonas aeruginosa
ATTC10145, la pseudotuberculose ATTC 911, l'enterocoque ATTC
faecalis 29212, Staphylococcus aureus ATTC 25923, les
albicans ATTC 60193 ; en général les
bactéries :Escherichia coli ATCC
25922 (Gram négatif) et Staphylococcus aureus
ATCC 25923 (Gram
positif) ; Candida albicans ATCC 60193
(fungique bactérie) ;elles correspondent aux souches de
référence utilisées pour valider les tests de
sensibilité aux notre molécules. les résultats ont
prouvé que les composés ont différents effets.
PARTIE A (THEORIQUE)
PARTIE A (THEORIQUE)
CHAPITRE 1
ACIDE TARTRIQUE
A-1-1. Introduction
L'acide tartrique,
connu depuis l'Antiquité sous la forme1 du
"sel acide de potassium", a été découvert en 1769 par le
chimiste suédois Scheele, qui fit bouillir du tartre avec de la craie et
décomposa le produit en présence d'acide sulfurique ; qui
parvint à l'extraire en décomposant son sel de calcium par apport
d'acide sulfurique, méthode d'extraction encore utilisée de nos
jours.
Il existe 4 formes stéréo-isomères d'acide
tartrique, mises en évidence par Louis Pasteur lors de ses travaux de
recherche sur l'activité optique des molécules
dissymétriques (1848-1860). Très répandu dans le
règne végétal, l'acide tartrique L(+) est la seule forme
naturelle. On le trouve dans de nombreux fruits, en particulier le raisin.
Entrent dans sa fabrication, au titre de matières premières, des
résidus naturels exclusivement issus de la vinification, et l'eau est le
seul solvant utilisé en cours de process.
L`acide tartrique2 est le nom usuel
de l'acide 2,3-dihydroxybutanedioïque a pour formule brute
C4H6O6. et de poids
moléculaire150gm/mole. Sa formule semi-développée est
HOOC-CHOH-CHOH-COOH. La vigne est le seul végétal à
produire de l'acide tartrique et à l'accumuler dans ses fruits qui sont
les baies de raisins. Il s'y trouve à l'état
libre3 et à l'état salifié
avec de nombreux sel minéraux et principalement le calcium et le
potassium (pour former le tartrate de calcium et le bitartrate de potassium).
Ces deux sels sont très 2peu soluble dans
les vins, leurs présence en excès provoque des
précipitations dans le vin (cristallisation tartrique).
Il peut être synthétisé. C'est le principal
acide du
vin (provenant du
raisin), sous sa forme
D(+).
Les ions tartrates sont utilisés
1dans la
liqueur de
Fehling pour tester la présence d'
aldéhydes. Le
tartrate de potassium évite une cristallisation du vin en bouteille,
phénomène exploité dès l'antiquité par les
grecs et les romains.
A-1-2-
Propriétés
L'acide tartrique active la
salivation1 ; il est légèrement
laxatif et diurétique. Il se présente sous la forme de cristaux
transparents incolores solubles dans l'eau. Les sels de l'acide tartrique sont
les tartrates qui sont toujours à craindre et sont évités
en traitant le vin par le froid, pour éliminer le maximum de tartre,
éventuellement en ajoutant un inhibiteur de cristallisation (acide
métatartrique). On détecte l'acide tartrique par le
résorcinol.
Ø isomérie


Acide Tartrique L
Acide Tartrique D
Fig A-1-Les Isomères d'Acide
tartrique
Louis Pasteur
2a étudié l'activité optique
des isomères optiques des
tartrates. La fermentation
des jus de raisin produit sur la surface interne du récipient une
croûte blanche de tartrate acide de potassium ou
tartre brut. Le tartre brut,
bouilli en présence d'
acide
chlorhydrique dilué, précipite sous forme de tartrate de
calcium, par addition d'hydroxyde de calcium. Son traitement par de l'
acide sulfurique
dilué libère la forme
dextrogyre (D) de l'acide
tartrique, composé qui fait tourner le plan de
polarisation de la
lumière polarisée vers la droite. L'acide D-tartrique a une
température de fusion de 170 °C et est facilement soluble dans
l'eau et l'alcool. Il est insoluble dans l'éther. Il existe une autre
forme de l'acide tartrique, l'acide L-tartrique (
lévogyre). Elle a
la même structure que la forme D, mais fait tourner le plan de
polarisation de la lumière vers la gauche. Cet acide fut
préparé pour la première fois par Louis Pasteur, à
partir du sel d'ammonium et de sodium. L'acide tartrique préparé
en laboratoire est un mélange équimolaire des formes dextrogyre
(D) et lévogyre (L). Ce mélange, dit
racémique, ne
modifie pas la direction du plan de polarisation de la lumière. Il
existe une autre variété, l'acide mésotartrique, qui ne
modifie pas non plus la direction du plan de polarisation de la
lumière.

Fig-A-2- Les formes d'Acide Tartrique
A-1-3. Caractéristiques
Physico-chimique :
Cristaux incolores 3(ou poudre
cristalline blanche), transparents, très résistants,
dépourvus d'eau, stable à la lumière et à l'air et
sans odeur. L'acide tartrique confère au vin une saveur acide; en
présence équilibrée, il donne au vin une sensation
gustative de fraîcheur alors qu'en quantité insuffisante le vin
paraît mou et plat. L'acide tartrique participe aussi au maintien du pH
du vin (bas), il permet ainsi le contrôle de l'implantation de certains
micro-organismes (y compris les bactéries indésirables comme
celles responsables de la maladie de la tourne).
Ø Solubilité :
· Eau à 20°C ? très soluble,
· Alcool à 95%vol. ? 379g/L,
· Glycérol ? soluble.
Ø Utilisations
Les
applications courantes3 de l'acide tartrique L(+)
se situent dans les secteurs alimentaire, pharmaceutique et vinicole
:
· Pour l'acidification des moûts de vin.
·
Comme acidifiant et stimulateur du goût dans les bonbons, gelées,
confitures, nectars de fruits, crèmes glacées, gélatines
et pâtes.
· Dans les conserves de fruits, légumes,
poissons où il intervient comme antioxydant synergique et stabilise
également le Ph, la couleur, le goût et la valeur
nutritive.
· Dans les graisses et huiles où il
prévient le rancissement par son effet antioxydant.
· Dans
la préparation de boissons gazeuses. Il est utilisé comme acide
solide dans les cachets contre les indigestions et les maux de tête.
Lorsqu'on les met dans l'eau, l'acide se dissout et réagit avec le
bicarbonate de sodium pour libérer du
dioxyde de
carbone gazeux.
· Comme émulsifiant et conservateur
dans la fabrication de pains et de viennoiseries industrielles.
· Dans l'industrie pharmaceutique où il sert d'excipient et de
support du principe actif aidant à corriger la basicité.
· Sa stabilité et sa grande solubilité en font une
source d'acidité très prisée pour les poudres et cachets
effervescents.
Toutefois, l'acide tartrique L(+) est également
employé dans d'autres domaines :
· Dans l'industrie
du ciment et du plâtre, où son pouvoir de retardateur de prise
rend plus aisées les manipulations.
· Pour le polissage et le nettoyage des métaux.
A-1-4-La Chiralité d'Acide
Tartrique
|

Acides (2R, 3R)-Tartrique
|

Acides (2S, 3S)-Tartrique
|
Il existe deux acides tartriques chiraux :
· le (+)-(2R,
3R)-2,3-dihydroxybutane-1,4-dioïque (image de gauche) se trouve
à l'état naturel dans de nombreux fruits ;
· le (-)- (2S,
3S)-2,3-dihydroxybutane-1,4-dioïque (image de droite) est
l'énantiomère du précédent.
|
Ces composés 4sont
dessinés ci-dessous en utilisant la
représentation
de Cram.

Une représentation utile est la
projection de
Fischer. Il faut faire attention que contrairement à ce que pourrait
laisser croire un examen rapide de ces projections, il n'existe pas de centre
de symétrie dans ces molécules. En effet la chaîne
carbonée n'est pas plane mais cambrée vers l'arrière.

(2R, 3R) (2S, 3S)
Fig A-3- Configuration Absolue d'Acide
Tartrique
Les configurations absolues 4sont
données par les
règles
de Cahn , Ingold, Prelog. Ces molécules constituent le couple de
configuration relative (R*R*).
Les acides (2R, 3R) et (2S, 3S)
tartriques sont largement utilisés dans la préparation de
nombreux réactifs chiraux. Ils constituent une source de
chiralité à la fois pratique et de coût modique. Un exemple
est la préparation du ligand
DIOP d'un
complexe au ruthénium utilisé comme catalyseur
d'hydrogénation
énantiosélective.
A-1-5-
Acide (2R, 3S)-Tartrique
Bien qu'il y ait
deux atomes de carbone asymétriques4 dans
leur molécule, il existe trois et non quatre acides tartriques car les
configurations (2R, 3S) et (2S, 3R) sont
les mêmes :

La molécule ci-dessous est superposable à son image
dans un miroir. Elle n'est donc pas chirale. Il s'agit d'un exemple de
composé
méso.
|
L'acide (2R, 3S)-2,
3-dihydroxybutane-1,4-dioïque encore appelé acide
mésotartrique est un diastéréo-isomère des
acides (2R, 3R) et (2S, 3S) tartriques.
On peut obtenir ses sels par traitement des acides (2R,
3R) et (2S, 3S) tartriques par une base forte
à chaud.
|
La molécule d'acide (2R, 3S)-tartrique,
possède une conformation dans laquelle on trouve un plan de
symétrie S situé entre les atomes de carbone 2 et 3. Ce plan
apparaît nettement sur la représentation de Cram de la
conformation éclipsée (B) ou sur la
projection de
Fischer (C) de la molécule.

Notons qu'il existe des
conformations
chirales de l'acide (2R, 3S)-tartrique. Ces conformations
possèdent la même énergie potentielle microscopique et
elles sont donc en quantités égales. Les propriétés
macroscopiques de l'acide (2R, 3S)-tartrique sont celles
d'une molécule achirale.
PARTIE A (THEORIQUE)
CHAPITRE 2
Nucléosides
INTRODUCTION
Les chercheurs, et plus particulièrement les
chimistes, s'intéressent depuis longtemps
aux nucléotides. Durant les années 50, la
découverte de la structure de l'acide
désoxyribonucléique (ADN) et la
compréhension du rôle des acides nucléiques au coeur des
cellules, ont suscité un vif intérêt au sein
du corps scientifique. L'inhibition du
fonctionnement des acides nucléiques a fait l'objet de
nombreux travaux en particulier il a
clairement été démontré que les
analogues de nucléosides interfèrent avec les
nucléosides
naturels, modifiant ainsi le métabolisme cellulaire. Les
propriétés thérapeutiques de ces
composés sont très variables : anti tumorales ou
antivirales. Ces dernières années, une grande
variété de composés hétérocycliques
soutenant l'anneau 1H-1,2,4-triazole Ont été due
synthétisés à leurs activités biologiques de large
spectre comprenant
activities5-7 :
anti-inflammatoire, insecticide, antiviral et anti tumoral, dont certaines ont
été développées en agents commercialement
antifongiques tels que le triadimefon, le triadimenol et le diniconazole ils
ont précédemment synthétisé beaucoup de genres de
composés hétérocycliques tels que les
dérivés 1,3,4-oxadiazole, 1,2,4-triazole, 1,3,4-thiadiazole et
1,2,3-triazole qui ont montré la croissance
8-10de normalisation :antibactérienne,
antituberculose et de plantes. Il est bien connu que la synthèse des
nucléosides tende à contenir la multi-structure dans une
molécule. L'activité biologique d'un Nucléoside
peut être améliorée par la promotion de sa
combinaison avec la microstructure des cellules et de l'accumulation de
diverses activités biologiques résultant de l'incorporation de
différents noyaux hétérocycliques et
non-hétérocycliques dans elle. Incité par les faits
mentionnés ci-dessus et en vue de obtenez nouveau et améliorez
les agents biologiquement actifs.
Dans ce chapitre introductif, nous nous proposons de
décrire la structure des
nucléosides ainsi que leurs rôles dans les
traitements de l'herpès. Cela passera par
une nécessaire présentation d'autres notions que
sont les nucléotides, les polynucléotides ainsi
que les acides nucléiques.
A- 2-1- LES NUCLEOSIDES ET NUCLEOTIDES :
DEFINITION, STRUCTURE
Comme nous l'avons mentionné dans l'introduction
générale, les nucléosides sont des
molécules naturelles d'une importance capitale car ils
jouent un rôle essentiel dans de très
nombreux processus biologiques. Ce sont des précurseurs de
l'acide désoxyribonucléique
(ADN) et de l'acide ribonucléique (ARN) .
Les nucléosides sont des
glycosylamines8 faits en attachant un
nucléobase (souvent désigné simplement sous le nom de la
base) à un ribose ou à un anneau de deoxyribose. Les exemples de
ces derniers incluent la cytidine, l'uridine, l'adénosine, la guanosine,
la thymidine et l'inosine. En bref, un nucléoside est une base
liée pour sucrer. Les nucléosides peuvent être
phosphorylés par les kinases spécifiques dans la cellule,
produisant les nucléotides, qui sont les modules moléculaires de
l'ADN et de l'ARN.
Des nucléosides sont produits pendant que la
deuxième étape dans la digestion d'acide nucléique, par
lequel les nucleotidases décomposent des nucléotides (tels que le
nucléotide de thymine) en nucléosides (tels que la thymidine) et
phosphate. Les nucléosides, à leur tour, sont plus tard
décomposés en lumen du système digestif par des
nucleosidases en bases et ribose (ou deoxyribose) azoté, et
intérieur la cellule par des phosphorylases de nucléoside en
bases azotées, et ribose-1-phosphate (ou deoxyribose-1-phosphate).
Des nucléosides peuvent être produits en
combinant des nucléobases avec des anneaux de deoxyribose aussi bien
(Figure A-4). Les nucléosides diffèrent des
nucléotides en ayant un groupe d'hydroxyle attaché au carbone le
numéro 5 (celui qui ne sont pas dans l'anneau) du ribose, plutôt
que d'un ou plusieurs des groupes de phosphate.
Ces acides sont constitués de sous unités
appelées nucléotides, qui renferment le patrimoine
héréditaire de chaque individu et le code
génétique permettant à chaque cellule de reproduire
deux cellules filles en tous points identiques aux modèles
parentaux.
Du point de vue structural, les nucléosides
résultent de l'assemblage d'une base azotée
(purique ou pyrimidique) et d'une partie glucidique (ribose pour
l'ARN et désoxyribose pour
l'ADN), reliées entre elles par une liaison carbone-azote
(Figure A-4)

Fig A-4- Structure générale d'un
nucléoside
Les nucléotides résultent de la phosphorylation
des nucléosides. Ainsi on appelle nucléotide, tout motif complet
qui comporte un groupe phosphate, un sucre et une base azotée
(Figure A-5).
La liaison entre les différents nucléosides d'un
nucléotide est assurée par de l'acide
phosphorique qui estérifie les fonctions alcool en
position 3' et 5' du sucre.

Fig A-5 : Structure
général de ribo- et désoxyribonucléotide
On appelle oligonucléotides et
polynucléotides , des macromolécules constituées par
L'enchaînement de plusieurs nucléotides
reliés entre eux par une liaison 3',5'-phosphodiester.
Un seul groupement phosphoryle réunit les deux
nucléotides contigus en estérifiant d'une part
L'hydroxyle en position 3' d'un premier nucléotide et
d'autre part l'hydroxyle en position 5'
de l'autre nucléotide (Figure A-6).

Fig A-6 : Schéma d'un
binucléotide
A- 2-2- STRUCTURE ET FONCTION DE L'ADN
J.D. Watson et F.H.C. Crick.1 ont proposé en 1953, une
structure de l'ADN. Elle
Comprend deux chaînes de poly nucléotides
présentant dans l'espace une configuration
hélicoïdale : elles s'enroulent autour d'un axe
central imaginaire en formant une double hélice
(Figure A-7).
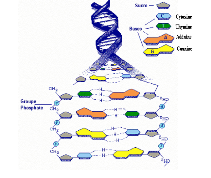
Fig A-7 : Structure de l'ADN
Ces deux brins de nucléotides sont
antiparallèles, les deux squelettes pentose-phosphate se
trouvent sur les bordures extérieurs de l'hélice,
alors que les bases azotées se font face à
l'intérieur et s'apparient par des liaisons
hydrogène qui maintiennent ensemble les deux brins.
Dans cette double hélice, chacune des bases azotées
a un complément exclusif : l'adénine est
toujours appariée avec la thymine et la guanine avec la
cytosine (ces bases sont
respectivement représentées par les lettres A, T, G
et C). (Figure A-8).

Fig A-8 : Appariement des bases par liaisons
hydrogène
A-2-3- Naturels
Nucléosides
Dans la dernière partie du 20ème siècle
l'industrie pharmaceutique a développé un intérêt
croissant pour les analogues des nucléotides et des nucléosides.
Les nucléotides sont des esters de phosphate des
nucléosides, se composant d'une partie de sucre, d'un ribose
(â--D-ribofuranose) et d'un désoxyribose 2 (2-deoxy- â
-D-ribofuranose), respectivement ; ceux-ci sont liés à une base
de purine ou de pyrimidine par une obligation â -N-glycosidique par N9 de
la purine et du N1 de la base hétérocyclique de pyrimidine.
L'adénine de bases de purine (6-aminopurine) et la
guanine (2-amino-6-oxypurine) sont communes à l'ARN et à l'ADN,
de même que la cytosine de base de pyrimidine (aminopyrimidine 2-oxy-4-).
Cependant, le uracile de base de pyrimidine (2,4-dioxy-pyrimidine) est
seulement trouvé en ARN tandis que thymine, (pyrimidine
2,4-dioxy-5-méthyle) l'appareillement bas l'équivalent, est
trouvé en ADN. Invariablement, en tous les nucléosides naturels,
la configuration au centre anomérique (C-1 ') est â. Tableau
A-2-1
En 1909, on a proposé le terme "nucléoside" par
Levene et Jacobs pour décrire les dérivés d'hydrate de
carbone des purines et du pyrimidines11.(adenine ou
la guanine) ou la base hétérocyclique de pyrimidine (cytosine,
thymine ou uracile) par l'intermédiaire d'une obligation glycosidique,
par le N-9 de la purine ou le N-1 de la base de pyrimidine .
Il n'avait pas lieu jusqu'aux années 60, cette chimie
impliquant des nucléosides et des nucléotides a fourni
l'infrastructure fondamentale et la méthodologie synthétique
nécessaires pour produire de nombreux nucléosides naturels et
structurellement modifiés biologiquement actifs. L'activité
biologique des agents anticancéreux tels que 5-fluoro-2'-deoxyuridine
(FUDR), arabinosylcytidine (ara-C), 8-azainosine, avec la découverte
d'un nucléoside antiviral efficace :arabinosyladenosine (ara-A) et
l'agent antitumoral , toyocamycin a indiqué
la valeur potentielle des analogues modifiés de
nucléoside en tant qu'agents chimio-
thérapeutiques12 ;13
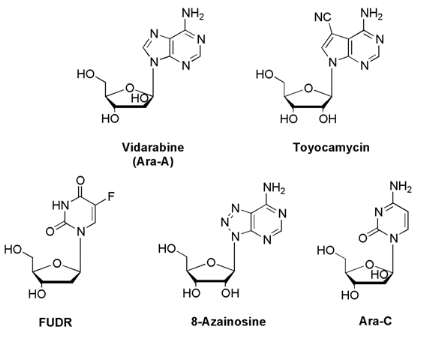
Fig A-9- Nucléosides Agents
chimiothérapie
Plus tard ; l'importance de ces analogues de
nucléoside a été réaffirmée avec
l'apparition d'HIV comme agent étiologique principal
d'AIDS.14 que la première drogue
approuvée pour le traitement d'HIV était le nucléoside
modifié AZT qui empêche HIV-1
transcriptase.15 renversé
en outre, plusieurs autres analogues de nucléoside impliqués dans
l'inhibition du transcriptase HIV-1 renversé, à savoir le ddC, le
ddI, les d4T et les 3TC, ont fourni bien plus de signification à
l'utilisation des analogues de nucléoside en tant qu'agents
chimiothérapeutiques biologiquement efficaces (le figure
A-10).14,16 ,17

Fig A-10- Nucléoside efficaces de
HIV
D'autres approches aux modifications des purines ont
impliqué l'incorporation d'autres hétéroatomes tels que le
soufre ou l'oxygène, qui permettent à la partie
hétérocyclique de maintenir son
aromaticité18. Les modifications impliquant
d'autres bases hétéro aromatique telles que le démuni de
pyrimidines aussi intensivement étudié que des purines,
cependant, leurs modifications ont principalement eu comme conséquence
les nucléosides pyrimidine-basés par aza/deaza et les
systèmes19 prolongés d'anneau de
pyrimidine. 5-Azacytidine, avec son analogue 2'-deoxy, a montré
l'activité biologique significative contre des cellules de la
leucémie L1210 et est actuellement employé dans la
médicine.

Fig A-11- Nucléosides pyrimidine
modifiés biologiquement efficaces
Une autre modification structurale qui a été
intensivement employée est le remplacement isosteric de l'oxygène
de furanose de la partie de sucre avec une sous-unité de
méthylène (où X = CH2) ayant pour
résultat un nucléoside carbocyclique (Figure A-12).

Fig A-12- Quelques
modifications de la partie de ribose
Tableau A-2-1. Nucléoside et deoxynucleoside naturale
A-2-4- Description et Classification des
Analogues de Nucléosides:
Dans la médecine plusieurs analogues de
nucléoside sont employés en tant qu'agents antiviraux ou
anticancéreux. La polymérase virale incorpore ces composés
avec des bases de non-canon. Ces composés sont activés dans les
cellules en étant converti en nucléotides, ils sont
administrés comme nucléosides puisque les nucléotides
chargés ne peuvent pas facilement croiser des membranes de
cellules5. Dans la biologie moléculaire
plusieurs analogues de sucre de l'épine dorsal existent. En raison de la
basse stabilité de l'ARN, qui est enclin à l'hydrolyse, on
emploie plusieurs analogues plus stables de l'alternative nucleoside/nucleotide
qui lient correctement à l'ARN10. Ceci est
réalisé en employant un sucre différent d'épine
dorsale. Ces analogues incluent LNA, le morpholino, PNA.
Un acide nucléique verrouillé
(LNA)8 (Figure A-13) souvent désigné
sous le nom de l'ARN inaccessible, est un nucléotide modifié
d'ARN. La partie de ribose d'un nucléotide de LNA est modifiée
avec un pont supplémentaire reliant les carbones 2'et 4'.
L'acide nucléique de peptide
(PNA)8 :est un polymère artificiellement
synthétisé semblable à l'ADN ou à l'ARN et est
employé dans la recherche biologique et les traitements médicaux.
PNA n'est pas connu pour se produire naturellement sous les formes modernes de
la vie.

Fig
A-13- Acide nucléique verrouillé LNA
Ces bandes de nucléotides d'un sucre non-canon,
dideoxyribose qui manque du groupe de l'hydroxyle 3'(qui accepte le phosphate)
et ne peut pas donc obligation avec la prochaine base, terminant la
chaîne comme les polymérases d'ADN la confondent avec un
deoxyribonucleotide régulier.
Les analogues de nucléosides9
constituent des structures aptes à inhiber les virus ;
Les nucléosides sont classifiés dans deux
catégories principales :
des N-nucléosides et des C-nucléosides. Les
anciens sont des nucléosides ayant une obligation entre le carbone
anomérique de la partie de sucre et l'azote de la partie basse tandis
que les derniers ont une obligation entre le carbone anomérique et le
carbone de la base.
En outre, chaque partie du sucre ou de la base peut être
modifiée. Les changements de la partie de sucre de nucléosides
incluent des modifications des substituants de sucre et du remplacement de
l'oxygène avec un autre atome. Ces changements peuvent produire des
variations importantes d'activité et de degré
biologiques10 de toxicité sélective,
aussi bien que dans leurs propriétés chimiques et physiques
respectives. En particulier, les modifications du 2'- et les 3'- des positions
ont produit des composés avec une large gamme d'activité
biologique.
La substitution de l'oxygène 4'-d'anneau avec d'autres
hétéroatomes affecte la conformation et les
propriétés biologiques du nucléoside. Des
nucléosides dont X l'oxygène d'anneau du sucre est
remplacé par le carbone, l'azote, le soufre, et le phosphore s'appellent
généralement les nucléosides carbocycliques,
azanucléosides, thionucléosides, et phosphanucléosides,
respectivement (Figure A-14). Un exemple d'une utilisation
médicale de cette classe des nucléosides a été le
4'-thionucleosides, qui montre un large spectre d'activité biologique et
de stabilité chimique et enzymatique
augmentée6.
Les nucléosides cycliques,
Ces nucléosides sont des didésoxynucléosides qui, sous
leur forme triphosphatée, interfèrent avec la réplication
virale de deux manières : soit en inhibant la transcriptase inverse par
compétition avec les substrats naturels, soit par incorporation dans la
chaîne d'ADN proviral en formation20. Dans ce
dernier cas ils agissent en tant que terminateurs de la chaîne du fait
qu'ils ne possèdent pas d'hydroxyle en 3'.
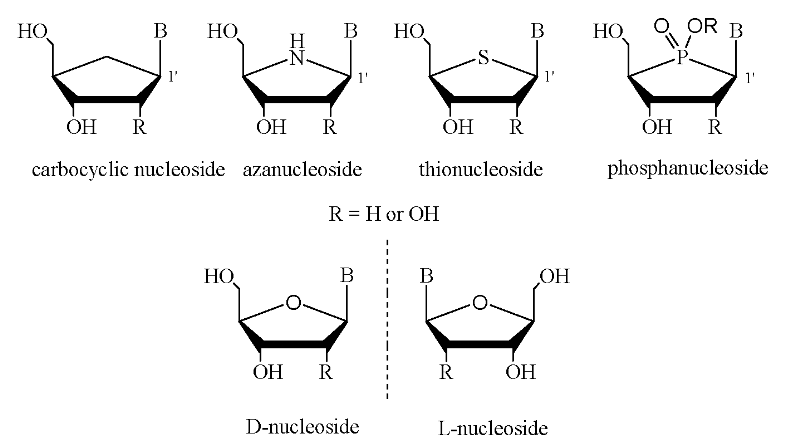
Fig A-14- Analogues de Nucléoside
CLASSIFICATIONS DES ANALOGUES DE
NUCLEOSIDES
Nucléosides Cycliques
Nucléosides Acycliques

Seco-AcycloNucléoside
Acyclo Nucléoside

X=O,N,S,P,C,Si......ect

X=O: Nucléoside
(Normal)
X=N : Azanucleoside
X=S : Thionucleoside
X= P : Phosphanucleoside
X= C : Carboxylique nucleoside
Z=Zero,1,2,3,......ect ; Y= N,O,S,C, ..ect; K=
Zero;,N,O,S,C,.ect
X-Cyclique-Y ;K-Nucléoside
X-Acyclo-Y ;K-Nucléoside
X-Seco-Acyclo-Y ;K-Nucléoside
X= O= Normal
Nucléoside
Y,K=N: Cyclo -N-Nucleoside
Acyclo-N-Nucleoside
Seco-Acyclo-N-Nucleoside
Y,K=O: Cyclo -O-Nucleoside
Acyclo-O-Nucleoside Seco-Acyclo-O
-Nucleoside
Y,K=S: Cyclo -S-Nucleoside
Acyclo-S-Nucleoside Seco-Acyclo-S
-Nucleoside
Y,K=C: Cyclo-C- Nucleoside
Acyclo-C-nucleoside Seco-Acyclo-C
-Nucleoside
X=N= Aza Nucléoside
Y,K= N Aza-Cyclo-N-Nucléoside
Aza-Acyclo-N-Nucléoside
Aza-Seco-Acyclo-N-Nucléoside
Y,K=O Aza-Cyclo-O-Nucléoside
Aza-Acyclo-O-Nucléoside
Aza-Seco-Acyclo-O-Nucléoside
Y,K=S Aza-Cyclo-S -Nucléoside
Aza-Acyclo-S -Nucléoside Aza-Seco-Acyclo-S
-Nucléoside
Y,K=C Aza-Cyclo-C -Nucléoside
Aza-Acyclo-C -Nucléoside Aza-Seco-Acyclo-C
-Nucléoside
X=S =Thio Nucléoside
Y,K= N Thio-Cyclo-N-Nucléoside
Thio-Acyclo-N-Nucléoside
Thio-Seco-Acyclo-N-Nucléoside
Y,K=O
Thio-Cyclo-O-Nucléoside
Thio-Acyclo-O-Nucléoside
Thio-Seco-Acyclo-O-Nucléoside
Y,K=S Thio-Cyclo-S -Nucléoside
Thio-Acyclo-S -Nucléoside Thio-Seco-Acyclo-S
-Nucléoside
Y,K=C Thio-Cyclo-C -Nucléoside
Thio-Acyclo-C -Nucléoside Thio-Seco-Acyclo-C
-Nucléoside
X=C = Carboxylique
Nucléoside
Y,K= N
Carbo-Cyclo-N-Nucléoside
Carbo-Acyclo-N-Nucléoside
Carbo-Seco-Acyclo-N-Nucléoside
Y,K=O Carbo-Cyclo-O-Nucléoside
Carbo-Acyclo-O-Nucléoside
Carbo-Seco-Acyclo-O-Nucléoside
Y,K=S Carbo-Cyclo-S
-Nucléoside Carbo-Acyclo-S -Nucléoside
Carbo-Seco-Acyclo-S -Nucléoside
Y,K=C Carbo-Cyclo-C -Nucléoside
Carbo-Acyclo-C -Nucléoside
Carbo-Seco-Acyclo-C -Nucléoside
Fig A-15-Classification des Nucléosides
et des Analogues de Nucléoside
Ø Pour X= O et Y= N :
Cyclique-N-Nucléoside, exemple :
est le plus grand groupe ; les membres classiques sont (T),
21-23 3'-amino-3'-deoxyadenosine 24
-25 (Fig A-16) le decoyinine (angustmycin A);
psicofuranine (d'angustmycinC) 26 -27;
3'-deoxyadenosine (cordycepin) 28-29, et
arabinofuranosyladenine (Ara A).
Ils sont tous les analogues d'adénosine avec des sucres
modifiés. Le triphosphate de Cordycepin a été
employé intensivement pour étudier le mécanisme
synthèse de ARN. Ara A, d'abord d'isolement dans l'éponge marine
et plus tard des filtrats de culture de streptomyces
d'antibiotiques30-31, est employé
actuellement comme agent antiviral. 2'-Amino-2'-deoxyadenosine (Fig
A-16) a été découvert comme métabolite
d'Actinomadura ayant l'activité
d'antimycoplasma32.
 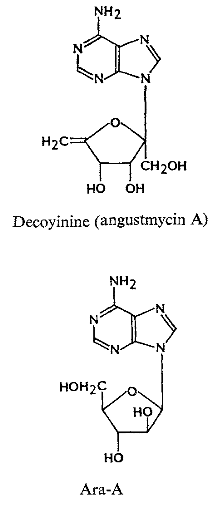 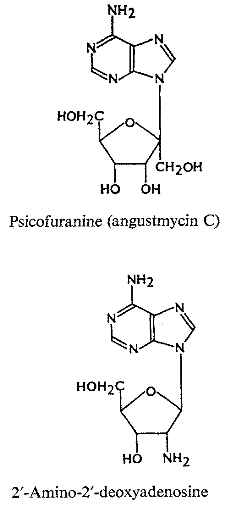

Fig A-16-Cyclique -N-nucléoside
Avec :l'AZT (Retrovir®),33
le ddI (Videx®)34,
le d4T (Zerit®)35
Ø Pour X=O et
Y=C :Cyclique-C-Nucléoside , exemple :
Formycins A (Fig A-17) et B sont des
nucléosides de pyrazolopyrimidine. Pyrazomycin (pyrazofurin) est un
nucléoside de pyrazole. Showdomycin a un anneau de maleimide et le
minimycin (oxazinomyciri) a un anneau d'oxazinedione. La chimie et la biologie
de ce groupe ont été intensivement passé en
revue36-39 .que ce groupe de nucléoside a
été montré pour avoir un précurseur
biosynthétique commun, glutamate et comme montré
dans (Fig A-17), l'anneau de maleimide du showdomycin
est formée de carbons-2, 3, 4 et 5 de
glutamate40-41 ,cependant de minimycin utilise les
carbones-3, 4 et 5,42 -43et l'anneau de pyrazole de
formycin44 -45et de
pyrazofurin46 est formé de les carbones-1,
2, 3 et 4.
 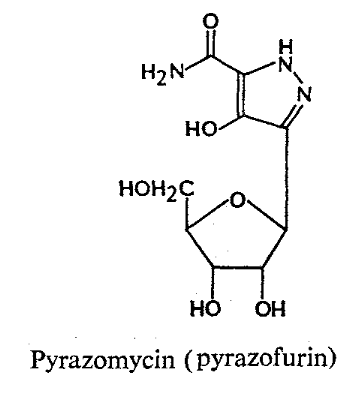  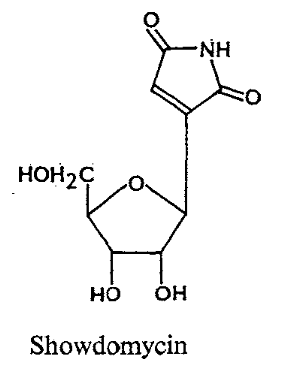 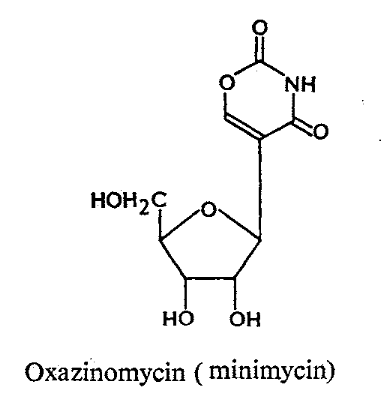
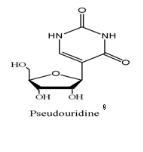
Fig A-17-Cyclique -C -nucléoside
Les C-Nucléosides ont C1 'de leurs parties de sucre
liées à différents hétérocycles par une
obligation de carbone-carbone. Bien que les N-nucléosides, avec un lien
glycosidique de
C1'-N soient naturellement prédominants, il y a
également les C-nucléosides normaux, avec un lien glycosidique de
C1'-C.
Due à leur obligation glycosidique de c-c,
C-nucléosides sont stable à l'hydrolyse enzymatique et montrent
souvent les propriétés d'antibactérien, antivirales et
antitumorales. En outre, beaucoup de C-nucléosides normaux et
artificiels ont été récemment synthétisés et
on l'a constaté que la plupart d'entre elles possède des
activités biochimiques.
Isonucleosides sont une classe spéciale des
nucléosides modifiés en lesquels la partie basse est
située le carbone à 2'- ou à 3'- de sucre.
La synthèse des isonucléosides est basée sur
le fait que même avec la transposition de la base
hétérocyclique au 2'- ou 3'-position, l'arrangement spatial entre
la base et le groupe 5'-hydroxy est maintenu, et la "nouvelle" obligation
glycosidique est plus stable vers l'hydrolyse enzymatique que la
classique6.
les L-nucléosides, les énantiomères des
D-nucléosides normaux, ne sont pas généralement
identifiés par les enzymes mammifères normales, mais sont
identifiés par les enzymes virus-codées ou bactériennes.
Ceci a comme conséquence la toxicité minimale de centre serveur
et la bonne activité d'antiviral/antibacterial. Par conséquent
elles sont récemment devenues d'intérêt en raison de leur
activité antivirale potentielle contre
HIV6.
Ø Pour X=O et K=O Cyclique-O
-Nucléoside , exemple :

Ø Pour X=O et K=S Cyclique-S
-Nucléoside : exemple :

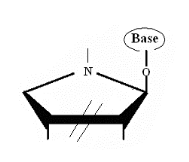
Ø Pour X= N , Y= N :Aza-Cyclique
-N-Nucléoside :
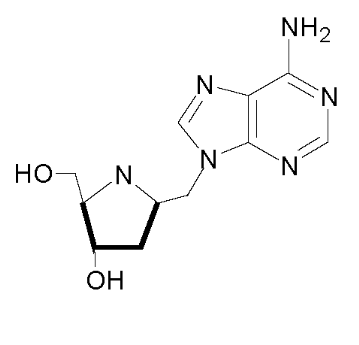
Fig A-18-
Azanucleoside47
Ø Pour X= N , K=O :Aza-Cyclique
-O-Nucléoside : Formule
Générale :
Ø Pour X= N , K=S :Aza-Cyclique
-S-Nucléoside : Formule
Générale :
Ø Pour X= N ,
K=C :Aza-Cyclique -C-Nucléoside : Formule
Générale :
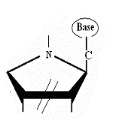
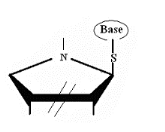
Ø Pour X= S , Y= N :
,Thio-Cyclique-N-Nucléoside
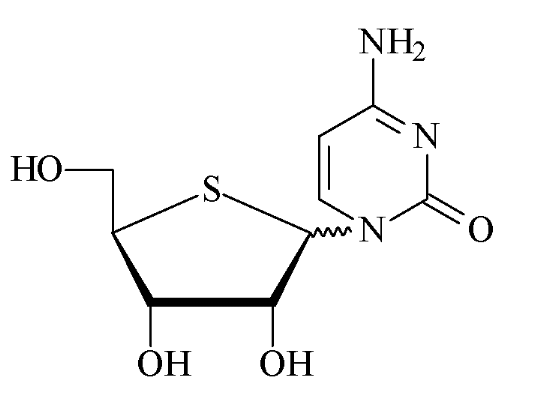
Fig A-19 -
Cytidin48

Fig A-20- Derivées de
4'-Thiotoyocamycin
en 1972, à des Bobek, Whistler et
Bloch49 ont réussi les
4'-Thio-Derivées de composé de l'antibiotique Toyocamycin
(7-Cyano-7-deazaadenosin,) 50,51 (Fig
A-20) ainsi que les autres dérivés
représentés. Le Toyocamycin lui-même est plus significatif
un dérivé dans pur importante d'activité anti-Tumeur. Tous
le Nucléoside représenté ont montré clairement un
effet inhibitrice sur cela dans vitro-Wachstum de L-1210 les cellules.
4'Thiotoyocamycin lui-même se sont avérés dehors plus
activement.
Ø Pour X= S , K=O : Thio-Cyclique-O
-Nucléoside : exemple:

Biothiopolymére
Ø Pour X= S , K=S : ,Thio-Cyclique-S
-Nucléoside: exemple:

Ø Pour X=S, Y= C : Thio-Cyclique -C
-Nucléoside : exemple :

Fig
A-21-Tiazofurin52
Les nucléosides carboxyliques, en lesquels la partie
de D-ribose du nucléoside est remplacée par un système de
cyclopentane 53, sont stables vers l'hydrolyse par
des phosphorylases et montrent souvent le biostabilité augmenté.
Le remplacement d'Isostérique de l'oxygène du furanose avec un
groupe de méthylène a été montré pour avoir
non seulement comme conséquence la résistance enzymatique
améliorée54;55, mais la
toxicité également réduite des nucléosides
carbocycliques comparés aux
conventionnels56.
Cette modification structurale qui a été
intensivement employée est le remplacement de l'oxygène de la
partie de sucre avec une sous-unité de méthylène
(où X = CH2-) ayant pour résultat un nucléoside
carbocyclique.
Ø Pour X= C ,Y= N : Carbocyclique-N
-Nucléoside :

Fig A-22-
Lobucavir57
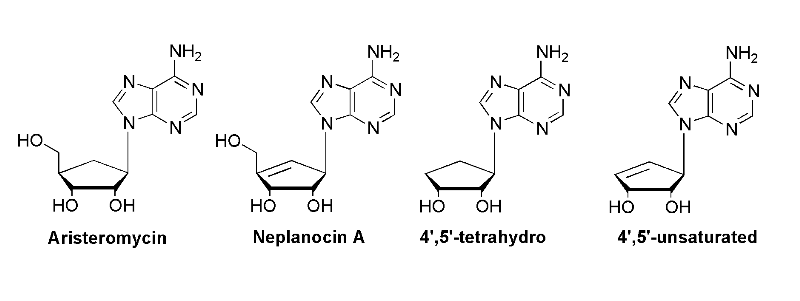
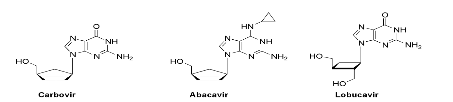
Fig A-23- Nucléosides Carbocycliques
Antiviraux
l'aristeromycin et le neplanocin A Carbocycliques et
leur dérivées ont montré l'activité biologique
significative contre SAHase et ADN MeTase, une autre cible enzymatique
importante pour les agents antiviraux, antiparasitaires et anticancéreux
(Fig A-23).58,59 bien que les
nucléosides carbocylique soient synthétiquement provocants, une
génération des nucléosides carbocycliques antiviraux
extrêmement efficaces tels que le carbovir, l'abacavir et le lobucavir
ont été produits.
Ø Pour X= C ,K =O : Carbocyclique-O
-Nucléoside : Formule
Générale :

Ø Pour X= C , K =S : Carbocyclique-S
-Nucléoside : Formule
Générale :

Ø Pour X=C , Y= C :Carbocyclique-C
-Nucléoside :

Fig A- 24-
[3-(4-Amino-5H-pyrrolo[3,2-d]pyrimidin-7-yl)-1-hydroxymethylcyclopentyl]
Methanol52
Les efforts étendus dans la recherche des
agents chimiothérapeutiques contre le cancer et la maladie infectieuse
virale ont mené à la découverte d'une
variété d'analogues biologiquement actifs de nucléoside, y
compris nucleosides60 carbocyclique
abacavir61 et
C-nucléosides62. C-nucléoside
carbocyclique est une classe unique des nucléosides en lesquels
l'hétérocycle est relié à une partie de sucre par
une obligation de c-c au lieu de l'obligation de C-N des nucléosides
normaux. Les C-Nucléosides ont suscité l'attention
considérable due non seulement de la stabilité chimique mais
également des activités biologiques intéressantes des
composés naturels tels que le : showdomycin, les formycins,
l'oxazinomycin, etc.63 en outre, plusieurs
C-nucléosides synthétiques biologiquement actifs tels que le
pseudoisocytidine64 ;
thiazufurin65.
En outre, les nucléosides contenant des parties de
sucre avec deux hétéroatomes dans l'anneau de sucre se sont
avérés être les agents antiviraux tout à fait
efficaces, particulièrement le dioxo- et les
oxothio-nucléosides.
Les nucléosides acycliques, d'autre part,
diffèrent des nucléosides conventionnels parce que l'anneau de
sucre est remplacé par une partie
acyclique66. Le premier nucléoside acyclique
pour montrer l'inhibition sélective de la réplique de HSV
était acyclovir, un nucléoside basé par guanosine dont
l'efficacité clinique comme agent antiviral a stimulé un grand
intérêt pour les nucléosides acycliques.
Donc Les analogues de nucléosides acycliques : qui
contient seco et acyclo nucleosides comprenant les dérivées
l'acyclovir, le pencyclovir, le gancyclovir et leur prodrogues (le
valacyclovir et le famcyclovir). Ils constituent les traitements de premiers
choix contre les infections au VHS12.
Cependant, ces derniers antiviraux ne sont pas encore
approuvés pour le traitement de l'infection au VHS mais ont tout de
même démontré une efficacité dans l'inhibition de la
réplication du VHS .
En prendre maintenant des exemples sur les nucléosides
acycliques le plus courants :
v
X-Seco-Acyclo-Y-Nucléoside
Pour la classification des Seco -Acyclo
-Nucléoisides67il ya 5 groupes
principal :

a)-Seco
-Acyclo-Nucléoside avec un
débranchement :
  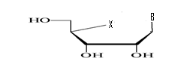
b)-Diseco
-Acyclo-Nucléoside avec deux
débranchement :

 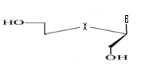 
c)-Triseco
-Acyclo-Nucléoside avec Trois
débranchement :
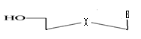 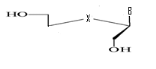 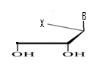 
d)-Tetraseco -Acyclo-Nucléoside avec
Quatre débranchement :
 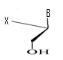 
e)-Pentaseco -Acyclo-Nucléoside avec Cinq
débranchement :

 Avec X= O ; S ; C Avec X= O ; S ; C
Ø Pour X= O ; Y=N : Seco
-Acyclo-N-Nucléoside
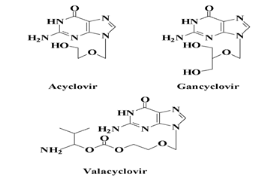
Fig A-25- Seco -Acyclo-N-Nucléoside
anti VHS
L'Acyclovir et ses dérivés :
l'Acyclovir est un analogue de la 2'-désoxyguanosine. Sa
découverte a été la plaque tournante du
traitement des infections herpétiques et, depuis
plusieurs années, l'Acyclovir et ses dérivés
sont considérés comme le traitement de choix des
infections au VHS-1, VHS-2 et au VZV. Il démontre une
efficacité remarquable et est très
peu toxique.
Ø Pour X= O ; Y=C : Seco -Acyclo-C
-Nucléoside

Fig A-26-Seco-Pseudouridines
67
Ø Pour X=C ; Y=N : Seco -Acyclo-N
-Nucléoside

Pour acyclonucléoside :
la formule en général :
v
X-Acyclo-Y,K-Nucléoside
Ø Pour
X-Acyclo-N-Nucléoside : Formule
générale : 
Pour
· X=O : Acyclo-N-Nucléosides
· X=N : Aza-acyclo-N-Nucléoside
· X=S : Thio-acyclo-N-Nucléoside
· X=C :Carbo-acyclo-N-Nucléoside
Ø Pour X-Acyclo-O
-Nucléoside : Formule
générale :
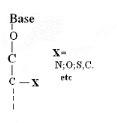
Pour
· X=O : Acyclo-O -Nucléoside
· X=N : Aza-acyclo-O -Nucléoside
· X=S : Thio-acyclo-O -Nucléoside
· X=C :Carbo-acyclo-O -Nucléoside
Ø Pour X-Acyclo-S
-Nucléoside : Formule
générale :
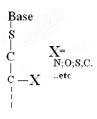
Pour
· X=O : Acyclo-S -Nucléoside
· X=N : Aza-acyclo-S -Nucléoside
· X=S : Thio-acyclo-S -Nucléoside
· X=C :Carbo-acyclo-S -Nucléoside
Ø Pour X-Acyclo-C
-Nucléoside : Formule
générale :

Pour
· X=O : Acyclo-C -Nucléoside
· X=N : Aza-acyclo-C -Nucléoside
· X=S : Thio-acyclo-C -Nucléoside
· X=C :Carbo-acyclo-C -Nucléoside
voici quelques exemples : qui utilisent comme des agents
antiviral et anti tumeur : (Fig A-27)
 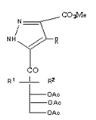
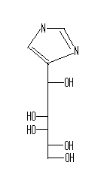
Pyrazole
69
Thiadiazole
68 Avec
R1= H ; R2= OAc
Hypoxanthine70
Oxadiazolines70
Imidazole70
Fig A-27 -Acyclonucléoside
A-2-5- Synthèse des
Nucléosides :
Une des étapes clés de la synthèse des
nucléosides est le couplage de la base
Pyrimidine, purine ou autre, avec le glucide comme exemple. Nous
nous proposons d'abord de présenter brièvement quelques
méthodes de couplage les plus courantes.
A-2-5-1- Méthode de Hilbert et
Johnson
Parallèlement à ces méthodes employant des
sels de métaux lourds, Hilbert et Johnson6
ont développé une procédure de couplage également
appelée méthode de quaternisation.
Elle est appliquée principalement pour la synthèse
de nucléosides pyrimidiques.
Elle s'effectue par condensation de 2,4-dialcoxypyrimidines sur
des halogénures acétylés, selon le mécanisme
suivant (schéma A-1) :

Schéma A-1-
Méthode de couplage de Hilbert et Johnson
Cette méthode donne des rendements variables qui sont
influencés par plusieurs facteurs :
- la facilité de dissolution du sucre
halogéné, favorisée par l'utilisation de solvants tels
que l'acétonitrile .
- l'aptitude du groupe alkyle R du sel quaternaire
intermédiaire à subir l'attaque nucléophile de l'ion
halogénure X- ; il est possible dans certains cas d'utiliser un
catalyseur tel que HgBr2 qui, en se complexant avec le sel
quaternaire, favorisera l'élimination du groupe :
R en position 2 .
- l'électronégativité du substituant Y en
position 5
A-2-5-2- Méthode de
Vorbrüggen
En remarquant que les catalyseurs de Friedel-Crafts
permettent la conversion
des 1-acyloxy sucres acétylés en leur
dérivés 1-acétylés et 1-halogénés,
Vorbrüggen et Coll7. ont tenté la
réaction avec des pyrimidines et des sucres per-acétylés
ou 1-acétylé-2,3,5-
tribenzoylés.
La réaction est réalisée à
température ambiante dans un solvant polaire (1,2-dichloroéthane,
acétonitrile ou mélange des deux en proportions variables).
Après divers essais réalisés avec différents
catalyseurs de Friedel et Crafts (ZnCl2, TiCl4, AlCl3, SnCl4 ou BF3-Et2O), il
apparaît que la combinaison 1,2-dichloroéthane/SnCl4 donne de bons
résultats.
Ce solvant ainsi que l'acétonitrile sont d'utilisation
aisée car ils sont facilement purifiables et
permettent un chauffage à plus de 70°C si
nécessaire7. Cependant l'emploi de l'un ou
de
l'autre engendre des modifications du comportement des
réactions (temps, proportions des
produits N-1 et N-3 substitués sur les bases
pyrimidiques).
La quantité de catalyseur employée
dépend de la nature du réactif glucidique utilisé :
0,25 éq. sont suffisants pour réaliser un couplage
entre une base silylée et un sucre halogéné
en position anomérique, alors que 0,75 à 1,5
éq. sont nécessaires dans le cas de sucres
1-Ométhyle ou 1-O-acétyle, ces derniers
étant moins sensibles mais moins réactifs.
Le mécanisme de la réaction de glycosylation
(Schéma A-2) met en jeu la participation
du groupement en position 2 du sucre : le groupement acyloxy
(acétyle ou benzoyle)
intervient pour former un intermédiaire
«sucre-cation» cyclique qui encombre la face
. L'attaque nucléophile de la base silylée se fait
alors préférentiellement sur la face .

Schéma A-2-Mécanisme du couplage
de Vorbrüggen appliqué aux bases pyrimidiques
La méthode de Vorbrüggen est devenue la plus
fréquemment employée dans la synthèse
des nucléosides en raison de ses nombreux avantages :
- elle peut être appliquée non seulement aux
pyrimidines et à leurs dérivés, mais aussi
aux purines, aux thiazoles et à d'autres
hétérocycles azotés ;
- la fixation du groupe TMS sur la base est très
aisée ;
- le TMS s'élimine facilement en fin de réaction au
cours du traitement ;
- les rendements obtenus sont élevés du fait de
l'activation par des groupes TMS pour
l'attaque nucléophile ;
- la possibilité d'utiliser des sucres
1-acétylés ou 1-O-méthylés plus stables et
facile
d'accès.
A-2-6- Synthése d'Acyclo-
N-Nucléosides
Les transformations de la partie base
d'hétérocyclique ont eu comme conséquence des analogues de
nucléoside avec une variété d'applications
thérapeutiques71. D'ailleurs,
l'élaboration de la méthodologie synthétique et, en
particulier, le développement en chimie d'accouplement de
carbone-carbone a produit des méthodes efficaces pour la
génération de beaucoup de composés de roman.
Comme nous l'avons montré au précédent,
l'acyclo -Nucléoside est l'un des
composés à présenter une action
significative sur les bactéries. A l'heure actuelle, on ne
connaît que très petite nombre de
dérivés de l'acyclo-N-Nucléoside possédant un
caractère antiviral reconnu.
La recherche de composés, si possible plus actifs que ceux
existant72, constitue donc une
étapeimportante dans le domaine de la chimie fine. De nombreuses
équipes de recherche se sontintéressées à la
synthèse d'analogues de l'acyclo-N-Nucléoside.
Ces analogues sont synthétisés par modification de
la partie glucidique des nucléosides. Les acyclonucléosides
peuvent être considérés comme étant de la famille
qu'ils possèdent la fonction éther ainsi que le groupement
hydroxyle.
Par rapport aux
nucléosides73, ils gardent le même
squelette carboné et la chiralité du
carbone anomérique, par contre ils perdent la
rigidité de la partie glucidique puisqu'il n'y a
plus de liaison entre les carbones 2' et 3'.
Pour notre part, nous présentons: la synthèse, la
caractérisation structurale et l'évaluation
antivirale de quelques analogues N-acycliques de
nucléosides portant comme partie base,
dérivée de triazol.
Sur la base des considérations ci-dessus, les analogues
originaux de N-acyclo nucléoside ont dirigé sur
l'intérêt considérable toujours réveillé
renversé de transcriptase74 Dans l'espoir
d'élucider et/ou de trouver de meilleurs agents
thérapeutiques, les analogues du deoxynucléoside 3'-modifie
semblent être l'une des cibles
recommandées75.
Ils agissent en tant qu'inhibiteurs d'enzyme ou en tant que
terminateurs à chaînes d'ADN-polymérisation virale dus au
manque ou changement du groupe 3'-hydroxyle.
Le N modifié -nucléosides a attaché au
hétérocycle original à la partie anomérique de
sucre, ont également maintenu l'attention, et ils ont obtenu une
nouvelle classe des analogues de nucléoside de
hétérocycle.76
l'accès à nouveau des N-acyclonucléosides,
visant pour présenter l'intérêt biologique en tant
qu'agents antiviraux ou anticancéreux, a été
également étudiés.
Le nucléoside et leurs analogues ont émergé
en tant qu'agents thérapeutiques importants dans le traitement de
plusieurs maladies virales77, comprenant
AIDS.77-78 Ceux-ci fonctionnent à
côté de bloquer le transcriptase renversé
virally-codé (RT).75 que la majorité
d'analogues de nucléoside se composent des modifications des substrats
normaux dans la base hétérocyclique ou dans la partie de
sucre.76 Les analogues azotées de
acyclonucléoside ont l'activité efficace
anti-HIV et sélective. Dans l'adition, dû au manque de la
tringlerie conventionnelle de glycoside, ils sont stables in vivo au fendage
par des phosphorylases et des hydrolases79,80. Ces
dernières années, nous sommes devenus intéressés
à explorer le potentiel thérapeutique des
N-acyclonucléosides81,82, Les études
théoriques structurales employant des méthodes laissent
établir que les paramètres principaux structuraux comme distance
entre la base et l'hydroxyle groupent ou la position relative entre la base
hétérocyclique et le sucre15, sont
très semblables à ceux des nucléosides normaux.
La découverte des isomères structuraux
N-acyclonucléosides 77-84:
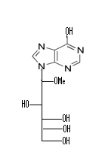
comme :9-(1,3-dihydroxy-2-propoxymethyl) guanine (DHPG) et
9-(2,3-dihydroxy-1propoxymethyl) guanine(iso-DHPG) (Fig A-28) comme
drogues antivirales efficaces et fortement sélectives pour le traitement
des infections recto du virus d'herpès (HSV) a stimulé une
recherche étendue des nucléosides acycliques qui sont des agents
antiviraux plus efficaces. Jusqu'ici85,
les études de structure-activité ont prouvé
que la chaîne latérale des nucléosides acycliques joue un
rôle principal dans l'activité antivirale (phosphorylation). En
conséquence, beaucoup de chimistes de nucléoside ont
dirigé leurs efforts vers la synthèse des analogues de
DHPG ; NDG (iso-DHPG) et d'autres N-acyclonucléosides avec de
divers chaînes latérales.
D'autre part, les N-nucléosides sont une grande classe
des anti métabolites. Les drogues importantes de cette classe sont le
brednin, le pyrazofurin et la ribavirine et ses
analogues86 qui sont dotées
d'activité immunosuppressive, antitumorale et antivirale,
respectivement.

DHPG NDG
Fig A-28- Structures de DHPG et NDG
La recherche actuelle présente une voie commode pour
la préparation d'une série d'analogues DHPG et NDG dans lesquels
les dérivés de triazole remplacent la partie de guanine. Pour
mener aux nouveaux acyclonucleosides d'azole, la réaction a
été effectuée par l'intermédiaire d'un
cycloaddition 1,3-dipolar 16,18entre les azotures
acycliques de sucre à l'avance préparés qui
réagissent comme diène avec de l'acétylène
(Schéma A-3) ; Ces composés ont été
alors examinés par des études in vitro pour des activités
antivirales.

Schéma A-3-
Préparation Analogue NDG à base Triazol
A-2-7- Nucléoside
Antibiotiques
Sur la base des considérations ci-dessus, les analogues
originaux de nucléoside ont dirigé sur l'intérêt
considérable toujours réveillé renversé de
transcriptase 87 . Dans l'espoir d'élucider
et/ou de trouver de meilleurs agents thérapeutiques, les analogues du
N-nucléosides 88 . Ils agissent en tant
qu'inhibiteurs d'enzyme ou en tant que terminateurs à chaînes
d'ADN. les nucléosides a attaché au
hétérocycle original à la partie anomèrique de
sucre, ont également maintenu l'attention, et ils ont obtenu une
nouvelle classe des analogues de nucléoside de
hétérocycle,qui se comportent la plupart du temps comme des
substrats biologiquement
active 89 .
Des Nucléosides Antibiotiques sont trouvés en tant
que groupes divers de N-Nucléosides. Ils incluent une
variété de modifications structurales des nucléosides,
menant souvent aux molécules complexes. Leurs activités
biologiques sont également étendues, y compris
l'antibactérienne, antifongique, antitrypanosomal, antitumoral,
antiviral, herbicide, insecticide. Elle n'étonne pas que les
nucléosides antibiotiques montrent de telles activités
biologiques diverses, parce que les nucléosides jouent des rôles
dans les voies métaboliques cellulaires les plus fondamentales telles
que des porteurs de métabolite, des donateurs d'énergie, des
messagers secondaires, et des cofacteurs pour différentes enzymes.
Ainsi, non seulement la synthèse d'acide nucléique mais
également la synthèse de protéine, et la synthèse
de glycoprotéine : sont des cibles des nucléosides
antibiotiques.
des nucléosides antibiotiques ont été
passés en revue par Suhadolnik dans 197090et
1979.91-93 en 1982, passé en revue leur
biochimie et Buchanan et Wightman94 passé en
revue la chimie. Cependant, des douzaines de nouveaux nucléosides
antibiotiques ont été découvertes dans la
dernière décennie et leurs rôles biologiques ont
été déterminés. En cette partie, des
nucléosides antibiotiques de actuellement sont
énumérés avec leurs structures ; Leur chimie et
biologie ont été brièvement passées en revue, pour
éviter de recouvrir avec des revues précédentes.
Nucléosides antibiotiques ont été classifiés sur
la base de leurs structures, cette classification est conventionnelle ;
certains des nucléosides antibiotiques possèdent les dispositifs
structuraux couvrant plus de deux groupes dans la classification des
nucléosides.

Fig A-29- Nucléoside Antibiotique
Neplanocins A -D et F sont des produits très efficaces ;
comme l'aristeromycin ,ils sont des analogues carbocycliques
d'adénosine, ayant un anneau époxyde-cyclopentane ou d'anneau
Cyclopentane. Neplanocin A : a des activités antitumorales et
antivirales fortes. Mais son activité antimicrobienne est
limitée. Plusieurs synthèses totales ont été
réalisé 95-97 .le produit n'est pas
phosphorylée en cellules et la molécule intacte empêche
fortement l'hydrolase en cellules. Seulement un nombre restent de
composés sont connus dans ce groupe.
Oxanosine98 : est unique en structure et dans
l'activité biologique. La structure en laquelle N-l de guanosine est
remplacé par l'oxygène a été établi par
analyse X-ray.99 ce nucléoside a
montré l'activité faible contre les bactéries
gram-négatives se sont avérés pour empêcher
Escherichia coli GMP synthétase.100 que le
mécanisme de l'activité antitumorale a été
étudié.
PARTIE B (RESULTATS ET DISCUTION)
PARTIE B (RESULTATS ET DISCUTION)
CHAPITRE 1
SYNTHESE
OBJET DU TRAVAIL
Le but de ce travail de recherche est le développement
de stratégies synthétiques permettant d'accéder
efficacement à des analogues de nucléosides acyclique de
façon stéréocontrôlée. Inspiré par la
structure des triazoles, ce projet pourrait mener à la découverte
de nouveaux prototypes moléculaires. Les amino triazole et
leurs dérivés acycliques, ont une importance biologique
significative, et ce pour plusieurs raisons. En effet, ces composés
démontrent une variété de propriétés telles
des activités antibactériennes et antifungiques
Dans le cadre de l'élaboration d'un nucléoside
modifiés abordé au Laboratoire de
Chimie biomoléculaire, nous nous proposons de
synthétiser, de caractériser et
d'évaluer les potentialités
antibactérienne et antifungique d'analogues de nucléosides
acycliques produit (b-6)
à base d'acide L(+) tartrique.
Afin de synthétiser le produit
(b-6) : ce acyclonucléoside à base d'acide
L(+) tartrique, nous avons adopté la stratégie
représentée sur le schéma synthétique (B.1)
suivante :
b-1

(H2SO4+
T=110°C + 7h+CH2OH)
b-2
(NH2NH2.H2O+C2H5OH)
b-3

(CH3OH+KOH+NH2NH2+Tamb+17h+4h)
(CS2+C2H5OH+KOH+T°=110°C +4h)
b-4
b-5
(L-Arabinose+C2H5OH+Hcl+Tamb+4h)
b-6
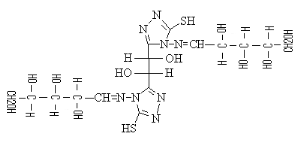
Schéma B-1: Schéma
Synthétique
B-1-
Synthèse :
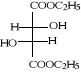
B-1- 1- L (+)tartrate de
diéthyles (b-2)

Schéma B-2 :
estérification d'acide L(+) tartrique
la réaction d'acide L(+) tartrique
(b-1) avec l'éthanol en présence 101Acide
chlorhydrique comme catalyseur a donné l'ester L (+) tartrate de
diéthyles (b-2) , Nous avons tout d'abord
utilisé les conditions opératoires qui ont conduit aux meilleurs
rendements . L'analyse CCM indique l'apparition de la
tâche de l'ester. Rf = 0.41
(éluant A) . R= 96%
CARACTERISATION SPECTRALE
Le spectre IR (Annexe2) de diéthyles L (+) tartrates
(b-2), montre l'apparition d'une bande large située à 3439.6
cm-1 caractéristique du groupement OH et une
bande aiguë et intense centrée à 1730.1 cm-1
caractéristique aux vibrations du groupement carbonyle
C=O.
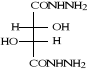
B-1- 2- di hydrazides L
(+) tartrique (b-3) :
Schéma B-3: Synthèse de
di hydrazide tartrique
di hydrazides L (+) tartrique (b-3) est
obtenue par réaction101de l'ester tartrique
diéthylique (b-2) avec l'éthanol et L'hydrazine hydratée
64 % respectivement, par agitation magnétique à
température ambiante. La réaction est spontanée et est
totale après 25 minutes d'agitation. Le produit est obtenu avec un
Rendement de 84 %.
Le point de fusion du produit obtenu est de
176 °C
L'analyse CCM indique l'apparition de la
tâche de produit (b-3) : Rf = 0.27
(éluant B)
CARACTERISATION SPECTRALE
L'analyse infrarouge (Annexe 3) indique Trois bandes
à 3364.6 cm-1, 3311.0 cm-1 et 3294.4 cm-1
attribuées aux vibrations du groupement amine NH
et une bande moyenne à 3175.2 cm-1 attribuée au
groupement CH alkyl chaine. Deux bandes intenses
caractéristiques au groupement carbonyle C=O
centrées à 1657.1 cm-1 et 1612.3 cm-1 et
déplacées vers les faibles fréquences traduisant
l'établissement d'une forte liaison hydrogène
intramoléculaire.il ya une bande à 3422.6 cm-1
attribuée au groupement OH.
B-1- 3- bis-1, 3,4-oxadiazole-5-thione
(b-4) :
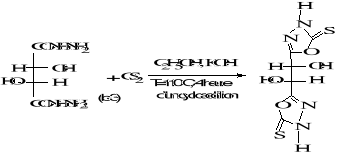
(b-4)
Schéma B-4: Synthèse de
bis-1, 3,4-oxadiazole-5-thione
La réaction de dihydrazides tartrique
(b-3) avec le CS2 dans l'eau en
présence101de KOH conduit au produit : bis-1,3,4-
oxadiazole-5- thione tartrique (b-4), après une 4heure de reflux, avec
un meilleur rendement de 72%. Le produit est obtenu sous forme
de fibres jaunes blanches.
Le point de fusion du produit obtenu est de
186 °C
L'analyse CCM indique l'apparition de la
tâche de produit (b-4) : Rf = 0.62
(éluant C).
CARACTERISATION SPECTRALE
Le spectre infrarouge (Annexe4) présente deux bandes
larges à 3350.2 cm-1, 3230 cm-1 attribuées
au groupement NH. Deux bande large situé à
3051.2 cm-1 ; 2890cm-1 attribuée aux
vibrations du groupement CH alkyl chaine, et une bande
à 3463.2 correspondant au groupement OH.
La bande aigue et intense centrée à 1634
cm-1 est caractéristique au groupement C=N
et deux bandes aigus et intenses à 1459.6 cm-1 et 1406.1
cm-1 représentent le groupement C=S. La
bande aiguë et intense située à 1093.8 est attribuée
au groupement C-O-C. d'après la
structure (b-4) en peux montrer que il ya un équilibre
tautomérique qui permet de donner la possibilité d'enolization en
obtient un enol .
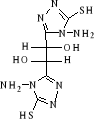
B-1- 4- bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) acide tartrique (B-5)
 (b-3) (b-3)  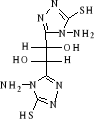 (b -5) (b -5)
Schéma B-5:
Synthèse de bis-(4-amino-5-mercapto-4H-[1,2,4] triazol-3-yl) acide
tartrique
La réaction de dihydrazides tartrique
(b-3) avec CH3OH absolu en
présence140 CS2 et
Hydrazine 67% après 17 heures à Tamb en obtient le
composé Bis-(4-amino-5-mercapto-4H-[1,2,4] triazol-3-yl) acide tartrique
(b-5) dans les conditions opératoires
spécifiques,
Avec un rendement de 70%
Le point de fusion du produit obtenu est de 122
°C
L'analyse CCM indique l'apparition de la
tâche de produit (b-5) : Rf = 0.80
(éluant D)
CARACTERISATION SPECTRALE
Le spectre infrarouge (Annexe 5) présente trois bandes
à 1605.9 cm-1 correspond au vibration du groupement
C=N ; et à environ de
1946.9 cm-1 une faible bande correspond au
groupement SH qui traduisant
l'établissement d'une forte liaison hydrogène
intramoléculaire, nous avons aussi voir un large bande
entre 3041cm-1 correspond au groupement CH alkyl
chaine ; la bande à 3330 cm-1
attribuées groupement NH ; il ya une bande
à 3422.7 cm-1 attribuée au groupement
OH.
Pour RMN 1H (CDCL3) :
(Annexe 6) la disparition des protons au niveau 2.063ppm correspond au
SH(S,1H, SH) ; au niveau 6.501ppm
correspond au groupement alkyl (m.4H, 2CH2O alkyl
chaine ) ; et au niveau 2.3 correspond fonction amine 2.3-2.5
ppm (S,1H ,NH)102.
Pour RMN
13C(CDCL3) : (Annexe
7) au niveau de 23.78 ppm correspond au C-C (m, 2C,
C-C) , entre 50.72-64.23 ppm correspond
(S,1C,CH2O) , au niveau de 180.36 ppm (S,1C, C=N) ,
au niveau de 206.38 ppm (S, 1C,
C-N)
B-1- 5-
bis-(4-arabinosidene-amino5-mercapto-4H-[1,2,4] triazol-3-yl)acide
tartrique(b-6)
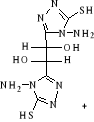  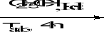 
(b-5)
L-Arabinose (b-6)
Schéma B-6:
bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4] triazol-3-yl) acide tartrique
La réaction de bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) acide tartrique (b-5) avec le sucre L(+)
Arabinose en présence de éthanol avec HCl concentré avec
chauffage douce,102 permet me donner le composé :
Bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4] Triazol-3-yl)
tartaric acid (b-6) sous
forme un Sirop marron, Avec un bon rendement de 75.33%
L'analyse CCM indique l'apparition de la
tâche de produit (b-6) : Rf = 0.72
(éluant E)
CARACTERISATION SPECTRALE
Le spectre infrarouge (Annexe 8) présente trois bandes
larges à 1550.49 cm-1 correspond au vibration du groupement
C=N ; et à environ de
2359.48 cm-1 une faible bande correspond
au groupement SH, nous avons aussi voir un large bande entre
2973.7 à 2884.02 cm-1
correspond102 au groupement CH alkyl chaine ;
et entre 3334-3631 attribuées au groupement OH.
1H NMR (CDCL3)
(Annexe 9) : il ya une disparition des proton au
niveau :1.091-1.147ppm qui correspond au
(m,9H,CH2O Arabinose) ,
2.1ppm correspond
(S.1H,SH); 2.3-2.5
ppm correspond (S,1H,N=CH) qui montre
que il ya griffage au niveau fonction amine de composé (b-5);
3.7ppm correspond (m,4H,2CH2O alkyl
chaine).
PARTIE B (RESULTATS ET DISCUTION)
CHAPITRE 2
Tests biologiques
B-2-1-Les Essais Biologiques
Tout au long de ce travail de synthèse organique, nous
avons préparé des composés organiques .L'évaluation
de l'activité biologique de produits préparés est une
bonne méthode pour découvrir de nouvelles substances bio-actives
et la recherche de nouveaux composés biologiquement actifs
suscite un intérêt de plus en plus Croissant, notamment
dans le domaine de la nucléoside103. C'est
pourquoi nous avons souhaité évaluer l'activité de nos
produits préparés vis-à-vis de diverses bactéries
choisis.
Différentes stratégies de découverte de
telles molécules sont employées. Ainsi, de
nouvelles générations des nucléosides ont
été développées. Cependant, ces nouveaux
composés sont souvent de structures proches de celles de
molécules déjà existantes, laissant présager
l'émergence d'une résistance rapidement. Une autre
stratégie consiste à découvrir de nouvelles classes de
nucléosides ayant un mécanisme d'action inédit. Ces
dernières années, seule une nouvelle classe les
oxazolidinones104 a été mise sur le
marché. Une troisième stratégie est axée sur
l'identification de nouvelles cibles bactériennes et le nombre croissant
degénomes bactériens séquencés permet
d'accélérer ces recherches. Enfin, la découverte de
nouveaux nucléosides peut découler de criblages de
molécules synthétisées par les laboratoires de chimie
biomoléculaire de recherche et dont l'activité biologique
potentielle n'a pas encore été explorée. Cette
stratégie est utilisée avec un succès inattendu par la
réside dans le fait que les criblages peuvent conduire à
l'émergence de nouvelles classes de molécules de structures
inédites.
Comme type important d'antibactériens et
antifungiques, les composés de triazole sont fortement
efficaces et absorbent. Actuellement, les études sur
des dérivés de triazole sont principalement concentrés sur
des acyclonucléosides à base triazole en tant que seul groupe
actif. Le rapport des analogues nucléosides de triazole qui contiennent
le groupe de triazole comme base et tout autre groupe actif de son
dérivées dans un nucléoside simple a été
trouvé où les alkyliques-substitués au triazole ont
également montré effects8 biologique
intéressant.
Les dérivées de N-acyclo nucléosides qui
contient amino -triazole a été connu comme
anti thyroïdienne15de large-gamme et avoir le
mécanisme différent avec du triazole
compounds.9 mais des composés de triazole
contenant N reste toujours un l'axe Afin de rechercher de nouveaux analogues
nucléoside de triazole avec une bio activité plus
élevée, A notre niveau les composés
susmentionnés :(b-2), (b-3),(b-4) et (b-5) et (b-6) (Schéma
B.1) ont été synthétisés et
caractérisés par chromatographie CCM , IR, T°fusion ,
analyse RMN 1H et 13C.
Les activités biologiques de ces composés ont été
examinées, Les activités antibactériennes et antifungique
de notre composés synthétisés ont été
déterminées par la zone d'inhibition constituée par ces
composés contre la contrainte bactérienne d'essai
particulier ; Dans ce test, les produits les plus intéressants
seront donc ceux dont la CMI est la plus faible, c'est-à-dire ceux pour
lesquels le moins de substance est nécessaire pour inhiber totalement la
croissance cellulaire ; voir photo (1 et 2)
Les activités antibactériennes et
antifungiques de ces composés
synthétisés ont été déterminées dans
vitro en utilisant de méthode de disque papier filtre
contre de diverses bactéries pathogènes telles que des
bactéries du gramme (+) : Yersinia
pseudotuberculosis ATCC 911; Staphylococcus
aureus ATCC 25923 ; Enterococcus faecalis ATCC 29212 ;
et le gramme (-): Escherichia coli ATCC 25922, Pseudomonas
aeruginosa ATCC 10145, Candida albicans ATCC 60193 (fungique
activité).
Les composés examinés ont été dissous
en diméthylsulfoxyde (DMSO) ; Les produits ont été
dissous en diméthylsulfoxyde (DMSO) pour préparer les solutions
courantes d'extrait.
Différentes concentrations ont été choisis
(62.5, 125, 250, 500 ìg/ml). Tandis que des analyses étaient
faites sur tous les composés synthétisés.
L'activité antibactérienne et antifungique de
tous les composés dans DMSO contre les bactéries,
mentionnées dans les Tableaux N° B-1 et B-2
b-4
b-6
b-5
b-2
b-3

Photo1: Souche de Candida Albicans ATCC 60193
b-3
b-6
b-2
b-5
b-4
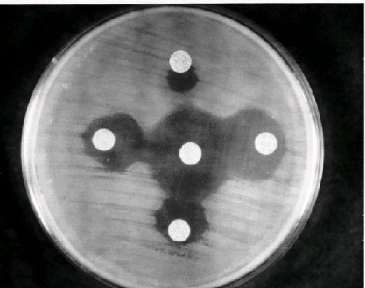
Photo2: Souche de Pseudomonas Aeruginosa ATCC 10145
B-2-2 : Résultats des Testes
Biologiques
Tableau B-1 :
Résultats des tests biologiques : activité
antibactérienne et activité antifungique
|
Composées
|
ACTIVITE ANTIBACTERIENNES
|
ACTIVITE
ANTIFUNGIQUE
|
|
GRAM POSITIF (+)
|
GRAM NEGATIF (-)
|
|
Y.p.tuberculosis
|
S.aureus
|
E.faecalis
|
E. coli
|
P.aeruginosa
|
C.albicans
|
|
b-2
|
+
|
+
|
+
|
+
|
+
|
+
|
|
b-3
|
+
|
+
|
+
|
+
|
+
|
+
|
|
b-4
|
+
|
+
|
+
|
+
|
++
|
+
|
|
b-5
|
+
|
+
|
+
|
++
|
++
|
++
|
|
b-6
|
+
|
+
|
+
|
++
|
+
|
++
|
Avec :
+> 5 mm : Composé légèrement active
++> 7mm : Composé
Modérément active
+++>9mm : Composé Fortement active
Tableau B-2 :
Résultats des tests biologiques : Concentration minimale
inhibitrice CMI
|
Composées
|
CMI : concentration minimale inhibitrice
|
|
GRAM POSITIF +
|
GRAM NEGATIF -
|
FUNGIQUE
|
|
Y.p.tuberculosis
|
S.aureus
|
E.faecalis
|
E. coli
|
P.aeruginosa
|
C.albicans
|
|
b-2
|
-
|
-
|
-
|
-
|
-
|
-
|
|
b-3
|
-
|
-
|
-
|
-
|
-
|
-
|
|
b-4
|
125
|
250
|
125
|
125
|
250
|
125
|
|
b-5
|
250
|
125
|
125
|
500
|
500
|
125
|
|
b-6
|
125
|
250
|
250
|
250
|
250
|
500
|
Avec : CMI : concentration minimale inhibitrice
Mg/Ml
CMI: concentration minimale inhibitrice: plus
petite concentration d'antibiotique qui inhibe toute culture visible d'une
souche bactérienne après 18 heures de culture à 37°C.
Cette valeur caractérise l'effet bactériostatique d'un
antibiotique.
B-2-3 :Description des Résultats des
Tests Biologiques
L'analyse des résultats montre que les composés
(b-2) et (b-3) n'ont pas d'activité antibactérienne ou
antifungique.
Il peut observer aussi que les composés (b-4),(b-5),(b-6)
étaient aucun activité vers bactéries gram (+) ; Il
peut observer aussi que les composés(b-4), (b-5),(b-6) étaient
modérément en activité vers quelque différentes
contraintes des bactéries choisis .
On peut dire que Les différentes activités des
composés synthétisés surgissent en raison des
différents groupes présents. Composé (b-4) contient le
groupe C=S, ainsi que le composé
(b-5) contient le groupement NH2 et SH ; et
composé (b-6) contient le SH et OH :
· Contre E. coli encore le
composé (b-5) et (b-6) a montré l'activité Moyenne, avec
concentration minimale inhibitrice CMI entre (1/2- 1/4) [C], ces deux
composés contiennent le groupe NH2 et SH et N-N
respectivement, qui sont avérés efficaces contre le
E. coli Les autres composés n'ont montré
aucun effet du tout.
· Contre P. aeruginosa le
composé (b-4) et (b-5) a également
montré l'activité contre ces bactéries avec concentration
minimale inhibitrice CMI entre (1/2- 1/4) [C] ; les composés
(b-2), (b-3),(b-6) n'ont montré aucune activité du tout contre
cette bactérie.
· Alors que les composés montraient une certaine
activité antifungique contre C.albicans ; le (b-5) a
montré l'activité moyenne mais avec une très bonne
concentration minimale inhibitrice CMI 1/8 [C] qui indique importance de ce
molécule ; suivie de (b-6) avec un concentration minimale
inhibitrice CMI 1/2 [C] . Tous autres
composés n'ont eu aucun effet sur C. albicans.
· On a observé aucune activité
antibactérienne contre le Y.p.tuberculosis ,
E.faecalis et S.aureus pour tous les composés .
Ainsi, les groupes de remplacement dans différents
composés ont différents effets contre différentes
bactéries. On l'observe des résultats ci-dessus que le groupe
amine dans composé (b-5) était efficace contre
certaines bactéries étudiées dans la recherche de Gram(-)
et il a une importance activité antifungique C.albicane . Les
bactéries susceptibles de Gram(+) Y.p.tuberculosis est des
E.faecalis et S.aureus le plus résistantes aux notre
composés.
PARTIE C (EXPERiMENTALE)
C-1 :
Généralité
Tableau : C-1 : Les
Réactifs et Solvants utilisées
|
Réactifs et solvants
|
Structure
|
Tf
( °C)
|
M
(g/mole)
|
Densité
|
Origine
|
Teb
(°C)
|
|
Acide L(+) tartrique
|
COOH(CHOH)2COOH
|
170
|
150.09
|
-
|
Prolabo
|
-
|
|
L(+) Arabinose
|
C5H10O5
|
153-164
|
150.13
|
-
|
-
|
-
|
|
Acide sulfurique
|
H2SO4
|
-
|
98.07
|
1.84
|
Organics*
|
-
|
|
Acide chlorhydrique
|
HCl (30 %)
|
-
|
36.46
|
1.15
|
Organics*
|
-
|
|
Bicarbonate de sodium
|
NaHCO3
|
-
|
85.009
|
-
|
Biochem**
|
-
|
|
Hydroxyde de potassium
|
KOH
|
-
|
65.11
|
-
|
Biochem**
|
-
|
|
Hydrazide hydraté (98 %)
|
NH2NH2 .H2O (64%)
|
-
|
50.06
|
1.03
|
-
|
-
|
|
Di sulfure de carbone (99.9%)
|
CS2
|
-
|
76.13
|
1.2621
|
Prolabo
|
-
|
|
Gel de silice
|
SiO2
|
-
|
-
|
-
|
Prolabo
|
-
|
|
Benzène (99.8 %)
|
C6H6
|
5.5
|
78.11
|
0.878-
|
-
|
80.1
|
|
Chloroforme (99.6 %)
|
CHCl3
|
63.5
|
119.38
|
1.478-1.484
|
Prolabo
|
61.2
|
|
Dichlorométhane (99.5 %)
|
CH2Cl2
|
-
|
84.93
|
1.33
|
Prolabo
|
-
|
|
Acétone
|
CH3COCH3
|
-
|
58.08
|
0.79
|
Biochem**
|
-
|
|
Méthanol (98 %)
|
CH3OH
|
-
|
32.04
|
0.79
|
Biochem**
|
-
|
|
Ethanol (95 %)
|
C2H5OH
|
-
|
46.07
|
0.81
|
Biochem**
|
-
|
|
Diméthylesulfoxyde (DMSO) (99%)
|
(CH3)2SO
|
18.4
|
78.13
|
1.84
|
-
|
189
|
|
Chlorure de sodium
|
NaCl
|
-
|
57
|
-
|
-
|
-
|
|
Iode
|
I2
|
-
|
-
|
-
|
Prolabo
|
-
|
C-1-1-Température de
fusion : Les points de fusion(Tf) sont
mesurés dans un capillaire à point de fusion avec un appareil
GALLENKAMP (Tmax= 400 °C) (Laboratoire chimie organique).
C-1-2-Chauffage :
Le mélange réactionnel est porté au
reflux sur un bain d'huile (huile de
silicone).
C-1-3-Chromatographie :
Les CCM sont effectués au moyen de couches minces avec gel
de silice (60A° TLC) GMBHD-3440 ESCHWEGE (PROLABO) sur des plaques en
verre (0,2x7x4) cm, Ces dernières sont préparées au niveau
de notre laboratoire. que l'on active, après séchage, à
100°C pendant 2 heures à l'étuve. La
révélation se fait directement sous atmosphère de
diiode ; Après élution dans le solvant approprié.
Le chromatographie sur papier aluminium est effectué au
moyen des papier aluminium ...
Les éluants utilisés sont :
Éluant A : éthanol /benzène ;
1/4 ;V/V
Éluant B : éthanol / benzène ;
2/1 ; V/V
Éluant C : éthanol / benzène ;
2/1 ; V/V
Éluant D : éthanol / benzène ;
2/1 ; V/V
Éluant E : éthanol / benzène ;
2/2 ; V/V
C-1-4- IR : Les spectres IR ont
été enregistrés sous forme de pastille KBr dans un
spectromètre JASCO FT/IR entre 400 et 4000 cm-1 (laboratoire
de synthese organique appliquer -Université d'Oran) et laboratoire
régional des analyses (central -police).
C-1-5- RMN : les spectres de
résonances magnétiques nucléaires (RMN) ont
été
Enregistrés sur les spectromètres Brucker AC 200
et avance 300 Mhz.
les déplacement chimiques (ä) sont données
en ppm par rapport au pic de solvant
pris comme référence interne.
Organics* : Produit of stinnes chemicals-Deutschland-
Biochem **: (Chemopharma) trucker 30084; Georgia -USA-
C-2 - Synthèse et
Identification :
C-2-1- Préparation de L (+) tartrate de
diéthyles (b-2)
Dans un ballon bicol de 100 ml, muni d'une agitation
magnétique et d'un réfrigérant, on introduit l'acide L(+)
tartrique (b-1, 1.5gm , 0,01 mole) dans l'éthanol 10
ml.
On additionne1 ml d'acide sulfurique concentré. Le
mélange est porté au reflux sur un bain d'huile, à une
température de 110 C°, pendant 7 heures. Rf =
0.41 (éluant A)
La solution est refroidie à l'aide d'un bain de glace,
puis transvasée dans une ampoule à décanter, à la
quelle on a ajouté 15 ml d'une solution aqueuse saturée de NaCl.
Après extraction par dichloro-méthane et après agitation,
on sépare la phase organique. La quantité de l'ester dissoute
dans la phase aqueuse est neutralisée avec une solution de bicarbonate
de sodium jusqu'à pH = 7 puis extraite par le dichlorométhane (3
fois 10ml). Les phases organiques sont rassemblées,
séchées sur sulfate de sodium anhydre Na2SO4
puis filtrées. Le dichlorométhane est éliminé
par évaporation. l'ester L (+) tartrate de
diéthyles est obtenu sous forme d'une huile blanche jaunâtre.
(b-2 ; 1.43gm ; 96%)
IR (KBr) ,í (cm-1) : 3439.6(OH),
1730.1(C=O, ester)
C-2-2- Préparation de di hydrazides L
(+) tartrique (b-3)
Dans un Erlen Meyer de 200 ml muni d'une agitation
magnétique, on introduit
l'ester L (+) tartrate de diéthyles
(b-2 ; 5,0 gm ; 0,025mole). On additionne
d'éthanol 35ml et d'hydrazine hydratée 20 ml respectivement.
Rf = 0.27 (éluant B)
Le mélange réactionnel précipite, la
réaction est considérée comme totale après 25
minutes d'agitation. Après filtration de solide sous pression
réduite. le
produit di hydrazides L (+) tartrique est obtenu,
sous forme de cristaux blanches (b-3 ;
4.2 gm ; 84%) .L'hydrazide est recristallisé dans un
mélange de solvant eau/méthanol.
Tf = 176°C
IR (KBr) ,í (cm-1) : 3422.6 (OH),
1657.1, 1612.3 (C=O ), 3364.1, 3300.2, 3294.4 (NH, liaison),
3175.2 (CH alkyl
chaine)
C-2-3- Préparation de bis-1,
3,4-oxadiazole-5-thione (b-4)
Dans un ballon tri col de 250 ml, muni d'une
agitation magnétique et d'un reflux ;
on place di hydrazides L (+)
tartrique (b-3; 5 gm ; 0.028 mole) dissoute dans
d'eau distillée 30 ml, on additionne de KOH (10 g dissoute dans d'eau
distillée 10 ml), puis on y ajoute lentement le CS2 (80 ml),
La solution se colore en orange. Le mélange est porté au reflux
sur un bain d'huile à une température de 110 °C, pendant
4heure. Rf = 0.62 (éluant C)
La solution est refroidie à la température
ambiante puis acidifiée avec de l'acide chlorhydrique HCl (30 %)
jusqu'à pH = 5.
Après filtration de solide, l'excès de solvant
et réactif (eau et CS2) est évaporé sur un
bain d'huile ; Le résidu est lavé trois
fois par d'acétone (50 ml).
Après recristallisation de solide le bis-1,
3,4-oxadiazole-5-thione (b-4 ;
3.6gm ; 72%) est obtenu sous forme : des fibres jaunes
blanches.
Tf = 186 °C
IR (KBr) ,í (cm-1) : 3463.2 (OH),
1459.6 ,1406,1 (C=S ), 1634 (C=N) , 3350,2 , 3230 (NH),
3051.2, 2890 (CH alkyl
chaine), 1093.8 ( C-O-C)
C-2-4- Préparation de
bis-(4-amino-5-mercapto-4H-[1,2,4] triazol-3-yl)acide
tartrqiue(b-5)
Le di hydrazides L (+) tartrique
(b-3 ; 5gm ; 0.028 mole) a
été ajouté à l'alcool CH3OH absolu
(35ml) ; contenant de KOH (1.5 gm) à la température
ambiante. le bisulfure de carbone CS2 10ml a été
ajouté et le mélange a été remué à la
température ambiante pour 17 h.
Le mélange a été dilué avec
déchlorométhane (20ml) et remué pour un autre 1h.
Rf = 0.80 (éluant
D)
L'hydrate d'hydrazine (67%) (10 ml) a été
graduellement ajouté au sel de potassium KCl(2gm) dissous dans l'eau
(20ml) avec l'agitation et le mélange a été
chauffé au reflux doucement pour 4 heures l'où le sulfure
d'hydrogène a évolué et la couleur du mélange de la
réaction changé en couleur vert-foncé, il a
été alors refroidi et acidifié avec HCl concentré
à pH 1.00. Un produit solide de bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) acide tartrique (b-5 ; 3.5gm ; 70 %)
jaune claire a séparé hors de ce qui a été
filtré, lavé avec de l'eau et cristallisé par
l'éthanol .
Tf = 122 °C
IR (KBr) ,í (cm-1) : 1946.9 (SH),
1605.9 (C=N) , 3330 (NH2), 3041 ( CH alkyl chaine ),
3422.7(OH libre).
1H NMR
(CDCL3) : 2.063(S,1H,SH),6.501 (m.4H, 2CH2O alkyl
chaine ),2.3-2.5 (S,1H ,NH)
13C NMR : 23.78 (m, 2C,C-C) ,
50.72-64.23 (S,1C,CH2O) , 180.36 (S,1C, C=N) ,206.38(S,1C,
C-N)
C-2-5- Préparation de
bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4] triazol-3-yl) acide tartrique
(b-6)
Un mélange du bis-(4-amino-5-mercapto-4H-[1,2,4]
triazol-3-yl) acide tartrique
(b-5 ; 1.5
gm ; 005 mole) et de Arabinose (1.75gm ; 0.011mole ) en
éthanol (25mL) a été traité avec HCl
concentré (0.5 ml) et chauffé au reflux pour 4 h.
Rf = 0.72 (éluant E).
Une fois que refroidi, le mélange de la réaction a
été filtré pour donner le produit :
bis-(4-arabinosidene-amino -5-mercapto-4H-[1,2,4] triazol-3-yl)
acide tartrqiue
(b-6 ; 1.13gm ; 75.33% )
sous forme un sirop marron.
IR (KBr) ,í (cm-1) : 2358.48 (SH) ,
1550 (C=N) , 2973.7-2884 (CH alkyl chain), 3631-3334(OH
libre).
1H NMR (CDCL3):
1.091-1.147(m, 9H,CH2O Arabinose) ,2.1 (S.1H,SH), 2.3-2.5
(S,1H,N=CH),
3.7(m,
4H,2CH2O alkyl chaine)
C-3-Les Tests Biologiques
L'activité antibactérienne et antifungique des
déférents composée synthétisés sont
présentées dans le tableau : B-1 et B-2.
les micro-organismes d'essai ont été obtenus
à partir de l'université d'Alexandrie,
(Alexandrie, Egypte). Les produits ont été
pesés et dissous en diméthylsulfoxyde (DMSO) pour préparer
les solutions courantes d'extrait de 10 mg/mL. Les tests de mesure
d'activité antibactérienne et antifungique sont en
général réalisés sur Escherichia
coli ATCC 25922 (Gram négatif) et
Staphylococcus aureus ATCC
25923 (Gram positif) ;
Candida albicans ATCC 60193 (fungique
bactérie), car elles correspondent aux souches de
référence utilisées pour valider les tests de
sensibilité aux notre molécules. Dans le cadre de ce test,
l'activité antibactérienne et antifungique du composé est
évaluée sur souches des bactéries sensibles,
c'est-à dire non résistantes aux notre composés
(b-2),(b-3) ,(b-4) ,(b-5) ,(b-6). Si un composé présente une
activité antibactérienne ou antifungique, la croissance des
bactéries sera inhibée. Dans ce test, les produits les plus
intéressants seront donc ceux dont la CIM est la plus faible,
c'est-à-dire ceux pour lesquels le moins de substance est
nécessaire pour inhiber totalement la croissance cellulaire.
Mode opératoire
La méthode de disque de papier filtre a été
exécutée deux fois en utilisant le milieu frais d'agar de Mueller
Hinton. Ce milieu d'agar a été inoculé avec 0.5mL des
cultures contenant environ 106 CFU/ml (Colony Forming Unit/millilitre.) Des
disques de papier filtre (diamètre de 5 millimètres)
saturés avec des solutions de chaque composé (concentrations 10
mg/mL-1 DMSO) ont été placés sur les
médias indiqués d'agar, Le temps d'incubation était 24 h
au 37°C. Le disque blanc d'essai avec DMSO a été
employé. L'activité inhibitrice a été
évaluée en mesurant le diamètre de la zone claire
observé autour du disque (en millimètre),
La concentration d'inhibition de minimum (CIM) examine
chaque 1 ml de la concentration originale [ c ] (10 mg/ ml-1) dans
DMSO des composés (b-2), (b-3), (b-4), (b-5), (b-6),ont
été diluées avec DMSO pendant cinq fois à :
1/2 [ c ], 1/4[ c ], 1/8 [ c ], 1/16[ c ] Les activités
antibactériennes et antifungique de notre composés
synthétisés ont été déterminées par
la zone d'inhibition constituée par ces composés contre la
contrainte bactérienne d'essai .
CONCLUSION GENERALE
Conclusion Général
Au cours de ce travail, nous nous sommes intéresses
a la synthèse d'un nucléoside
nous avons préparé dans une première
partie une nouvelle molécule hétérocyclique. Il s'agit du
1,3,4-oxadiazole-thione dérivé de l'acide L(+) tartrique à
partir des produits intermédiaires à savoir le ester L(+)
tartrate de diéthyles(b-2) et le dihydrazides L(+) tartrique(b-3).
Dans une seconde partie, nous avons mis au point la
synthèse de Triazole de types amino triazole (b-5) à partir de
composé (b-3) dihydrazides L(+) tartrique, ensuite en essayer de griffer
le sucre L(+) arabinose sur fonction amine de composé (b-5) ; de
tel façon en obtient un nucléoside acyclique (b-6) Qui montre une
activité biologique tester.
L'ensemble des composés
synthétisés a été isolé, et
caractérisé par les méthodes physiques et spectroscopiques
usuelles telles la spectroscopie infrarouge, le point de fusion et la
chromatographie sur couche mince, RMN.
Vu les résultats très satisfaisants, Cette
étude mériterait d'être étendu à d'autres
produits pour donne un chemin vers les nucléosides à base de
sucre.
Enfin, ce travail ouvre une perspective dans le domaine
de biomolécule qui intéresse par les molécules bioactifs
.
Les résultats obtenus sont très prometteurs.
Certains d'entre eux ont permis d'ébaucher les
premières relations structure-activité. Il est
cependant nécessaire de synthétiser d'autres
analogues nucléosides structuraux et d'effectuer les tests
nécessaires afin d'optimiser les caractéristiques
pharmacologiques nécessaires à l'obtention d'un candidat
médicament valorisable.
BIBLIOGRAPHIE
BIBLIOGRAPHIE
1) fr.wikipedia.org/wiki/Acide tartrique.
2)
www.fauresa.com/pages/02_produits/Acid_Tartrique/Acid_Tartrique.html.
3)
www.viticulture-oenologie-formation.fr/vitioenoformlycee/pdtoenotsvo2-2006-2007/actartrique.htm.
4) http://www.faidherbe.org/site/cours/dupuis/enantio.htm-
Chirality
in Chemistry by V. Prelog.
5) L. Czollner, G. Szilagyi, J. Lango, and J.
Janaky, Arch. Pharm. (Weinheim, Ger.).
1990, 323 (4), 225.
6) M. Jacobson, and L. T. Nguyen, Eur. Pat.
Appl. Ep 338 685; Chem. Abst.1990, 112,
178991t.
7) T. Nakayama, Y. Morisawa, A. Yasuda, and K.
Uchida, Jpn. Kokai Tokkyyo koho, JP 01
26 ,593; Chem. Abst.. 1989, 111,
134696a.
8) X. M. Feng, R. Chen, and Z. Y. Zhang,
Chem. J. Chin. Univ. 1991, 12 (10), 1326.
9)H. Yang, and Z. Y. Zhang, Acta Sinica
Chim.1987, 45 (9), 916.
10) (a)Z. Y. Zhang, Y. Liu, S.
Y. Yang, and M. Q. Chen, Chem. J. Chin. Univ. 1991,
12 (10),
1344 (b) Koomen, G.J. Recueil des Travaux
Chimiques des Pays-Bas-Journal of the Royal
Netherlands Chemical Society.
1993, 112, 65.
11) Anzai, K.; J. Nagatsu & S. Suzuki:
J. Antibiotics, Ser. A .1961,14, 342.
12) Chu, C. K.; Baker, D. C. Nucleosides and
Nucleotides as Antitumor and
Antiviral Agents; Plenum Press: New York.
1993.
13) Montgomery, J. A.Medicinal Research
Reviews. 1982, 2, 308.
14) Mitsuya, H. Anti-HIV Nucleosides: Past,
Present and Future; R. G.Landes:
New York. 1997.
15) Horwitz, J. P.; Chua, J.; Noel, M.
Journal of Organic Chemistry.1964, 29,2078
16) Zhu, X.-F. The Latest Progress in the
Synthesis of Carbocyclic Nucleosides.
Nucleosides, Nucleotides and Nucleic Acids.
2000, 19, 651-690.
17) Simons, C. Nucleoside Mimetics: Their
Chemistry and Biological Properties;
Gordon and Breach: Amsterdam. 2001.
18) Moriconi, W. J.; Slavik, M.; Taylor, S.
Investigational New Drugs. 1986, 4, 84.
19) Momparler, R. L.; Momparler, L. F.
Cancer Chemother. Pharmacol. 1989, 25, 54.
20) E.Declercq, La Recherche.
1992, 23, 295 -hadjbouazaza
21) Field, A. K.; Davie, M. E.; Dewitt, C.;
Perry, H. C.; Liou, R.,Germershausen, J. I.; Karkas, J. D.; Ashton, W. T.;
Johnson, D. B.R.; Tolman, R. C. Proc. Natl. Acad. Sci. (USA).
1983, 80, 4139.
22) Martin, J. C.; Dvorak, C. A; Smee, D. F.;
Mattews T. R.;Verheyden, J. P. H. J. Med. Chem. 1983,
26, 759.
23) Ashton, W. T.; Canning, L. D.; Reynolds, G.
F.; Tolman, R. L.;Karkas, J. D.; Liou, R., Davies, M. -E. M.; De Witt, C. M.;
PerryH. C ; Field, A. K. J. Med. Chem. 1985,
28, 926.
24) Kitahara, M. ; K. Ishii, T. Okazaki, T.
Hidaka & K. Watanabe: J. Antibiotics
1986,39,1290.
25) Amman,C. A. & R. S. Saherman:
Chemother. 1958,8,7.
26) Guarino, A. J. & N. M. Kredich:
Biochim. Biophys. Acta .1963,68,319.
27) Suhadolnik, R. J.; B. M. Chassy & G. R.
Walter: Nucleoside antibiotics III.Biochim.
Biophys. Acta .1969,179,267
28) Yuntsen, H.; H. Yonehara & H. Ui: I.
J. Antibiotics, Ser.A. 1954,7,115.
29) Vavra, J. J.; A. Dietz, B. W. Churdill, P.
Siminof & H. J. Kaepsell: Chemother. 1959,
9,431.
30) Hoeksema, H.; G. Slomp & E.-E. van
Tamelen: Tetrahedron Lett. 1964, 1964, 1795.
31) Cunningham, K. G. ; S. A. Hutchingson, M.
Manson & F. S. Spring: J. Chem. Soc. 1951,1951,
2300.
32) Kaczka, E. A.; E. L. Dulancy, C. O.
Gitterman, H. B. Woodruff & K. Folkers. Biochem. Biophys.Res.
Commun. 1964,14,455.
33) H.Mitsuya; K.J.Weinhold; P.A.Furman; M.St
Clair; S.Nussinoff Lehrman; R.C.Gallo;
D.Bolognesi; D.W.Barry; S.Broder,
Rroc.Natl.Acad.Sci.USA. 1985,82, 7100.
34) H.Mitsuya; S.Broder,
Rroc.Natl.Acad.Sci.USA. 1986, 82, 1915.
35) M.J.Browne; K.H.Mayer; S.B.D.Chafee;
M.N.Dudley; M.R.Posner; S.M.Steinberg; K.K.Graham; S.M.Geletko; S.H.Zinner;
S.L.Denman; L.M.Dunkle; S.Kaul; C.McLaren; G.Skowron; N.M.Kouttab;T.A.Kennedy;
A.B.Weitberg, G.A.Curt, J.Infect.Dis,
1993, 167, 29.
36) Yuan, B. D.; R. T. Wu, I. Sato, T. Okabe, H.
Suzuki, T. Nishimura & N. Tanaka: J. Antibiotics.
1985,38,648.
37) Wu, R. T.; T. Okabe, S. H. Kim, H. Suzuki
& N. Tanaka: J. Antibiotics. 1985,38,1595.
38) Suzuki, H.; S. H. Kim, M. Tahara, K.
Okazaki, T. Okabe, R. T. Wu & N. Tanaka: Cancer Res.
1987,47,717 .
39) Naruto, S.; H. Uno, A. Tanaka, H. Kotani
&Y. Takase: J. Heterocycles.Chem. 1983,20,32
40) Nishimura, S. : Mol. Biol.
1983,28,80.
41) Grunberger, D. & G. Grunberger:
Springer-Verlag, New York, 1979 ,11, 123.
42) Osada, H.; T. Sonada, K. Tsunoda & K.
Isono: J. Antibiotics. 1989, in press 42(1).
43) Nakamura, H. ; G. Koyama, Y. Iitaka, M.
Ohno, N. Yagisawa, S. Kondo, K. Maeda & H. Umezawa: J. Am. Chem.
Soc. 1974,96,4328.
44) Woo, P.W.K.; H. W. Dixon, S.N.L.F. Dahl
& L.J. Durham: J. Heterocycl. Chem.
1974, ll ,643.
45) Omura, S. ; N. Imamura, H. Kuga, H.
Ishikawa, Y. Yamazaki, K. Okano, K. Kimura, Y. Takahashi &H. Tanaka: J.
Antibiotics.1985,38,1015.
46) Omura, S. ; H. Tanaka, H. Kuga & N.
Imamura: J. Antibiotics.1986,39,310.
47) Yokoyama, M.; Toyoshima, H.; Shimizu, M.;
Togo, H. Journal of the Chemical
Society-Perkin
Transaction.1997, 1,33.
48) M.Browne ; L.S.Jeong; H.O.Kim; S.Nampalli;
K.Shanmuganathan; C.K.Chu;
Nucleosides & Nucleotides as Antitumor & Antiviral
agents,Plenum Press : New York, 1993, 243.
49) M. Bobek, R. L. Whistler, A. Bloch, J.
Med. Chem. 1972, 15, 171.
50) H. Nishimura, K. Katagiri, S. Kozaburo, M.
Mayama, N. Shinaoka, J. Antibiot. Ser. A
1956, 9, 62.
51) K. Ohkuma, J. Antibiot. Ser. A
1961, 14, 352.
52) N. Nishizono, N. Koike, Y. Yamagata, S.
Fujii, A. Matsuda, Tetrahedron Lett. 1996,
37, 7572.
53) A.F.Maggio, V.Boyer, A.M.Aubertin, G.Obert,
A.Kirn, J.L.Imbach, Nucleosides &
Nucleotides, 1991,
10,1431.
54) S. Obika, J. Andoh, T. Sugimoto, K.
Miyashita, T. Imanishi, Tetrahedron Lett. 1999,
40, 6468.
55) S. Obika, Y. Hari, K. Morio, T. Imanishi,
Tetrahedron Lett. 2000, 41, 219.
56) Franchetti, P.; Messini, L.; Cappellacci,
L.; Sheikha, G. A.; Grifantini, M. et al.
Nucleosides & Nucleotides
1994, 13, 1755.
57) R.H.Foster ; D.Faulds, Drugs,
1998, 55, 736.
58) De Clercq, Biochemical Pharmacology
1987, 36, 2575.
59) Chiang, P. K.; Miura, G. A. Biological
Methylation and Drug Design; Humana Press:
Clifton, NJ, 1986; 251.
60) (a) Agrofoglio, L.; Suhas,
E.; Farese, A.; Condom, R.; Challand, S.; Earl, R. A.
Tetrahedron,1994, 50,10670;
(b)Borthwick, A. D.; Biggadike, K. Tetrahedron.
1992,48, 571.
61) Daluge, S. M.; Good, S. S.; Faletto, M. B.;
Miller, W. H.; St Clair, M. H.; Boone, L. R.; Tisdale, M.; Parry, N. R.;
Reardon, J. E.;Dornsife, R. E.; Averett, D. R.; Krenitsky, T. A.
Antimicrob. Agents Chemother. 1997, 41, 1082.
62) (a) Watanabe, K. A. In
Chemistry of Nucleosides & Nucleotides;Townsend, l. B., Ed.; Plenum: New
York, 1994; Vol. 3, Chapter 5.Shaban, M. A. E.; Nasr, A. Z. Adv.
Heterocycl. Chem. 1997, 68,223; (b)
Liang, C.; Ma, T.; Cooperwood, J. S.; Du, J.; Chu, C. K.Carbohydr.
Res. 1997, 303, 33.
63) Buchanan, J. G. Fortschr. Chem. Org.
Naturst. 1983, 44, 243.
64) (a) Fuertes, M.;
Garcia-Lopez, T.; Garcia-Munoz, E.; Stud, M. J.Org. Chem.
1976, 41, 4074; (b) Srivastava, P. C.;
Pickering, M.V.; Allen, L. B.; Streeter, D. C.; Campbell, M. T.; Witkowski, J.
T.; Sidwell, R. W.; Robins, R. K. J. Med. Chem.
1977, 20, 256.
65) Buchenal, J. H.; Ciovacco, K.; Kalaher, K.;
O'Toole, T.; Kiefner,R.; Dowing, M. D.; Chu, C. K.; Watanabe, K. A.; Wempen,
I.;Fox, J. J. Cancer Res. 1976, 36, 15.
66) (a) Ko, O. H.; Hong, J.
H. Tetrahedron Lett. 2002, 43, 6399;
(b)Kim, J. W.; Choi, B. G.; Hong, J. H. Bull. Korean
Chem. Soc.2004, 25, 1812.
67) ( a) K. Ono, M. Ogaswara, Y. Iwata, H.
Nakane, T. Fuji, K. Sawai, M. Saneyoshi. Biochem.Biophys. Res. Commun.
1986, 140, 498 ; (b) H. Mitsuya and
S. Broder. Nature.1987, 325, 773 ;
(c) J. Balzarini, B. Masaroni, R. Pauwel, P. Herdewijn,
S. G. Wood, M. J. Robins, E. De Clercq.Mol. Pharmacol.
1988, 33, 243; (d) P. Wigerinck, A.
Van Aerschot, P. Claes, J. Balzarini, E. De Clercq, P. Herdewijn,
J. Heterocyclic Chem. 1989, 26, 1635 .
(e) R. Yarchoan, H. Mitsuya, R. V.
Thomas, J. M. Pluda, N. R. Hartman, C. F. Perno, K. S. Marczyck, J-P.
Allain, D. G. Johns, S. Broder. Science.1989,
245, 412.
(f) A. Matsuda, M. Satoh, T. Ueda, H.
Machida, T. Sasaki. Nucleosides Nucleotides.
1990,9, 587 ; (g) J. A.
Secrist, R. M. Riggs, K. N. Tiwari J. A. Montgomery. J. Med. Chem.
1992 ,35, 533.
68) K.Hirota, T.Tomishi , and Y.Maki , Chem
.Pharm.Bull. 1988, 36. 1298.
69)R Stoalrski.D.Shugar , Z.Kazimiercuzuk , and
P.Lassota , Z.Naturfosch.C. 1988,43; 231.
70) P.Scheiner, A, Geer , A , M, Bucknor ,
H.Gadler, and R.W . Price Nucléosides nucleotides.
1989, 8,1441.
71) H.M.Abrams, L.Ho, S.H.Chu, J. Med.
Chem. 1981, 18, 947.
72) J.Renault, D.Laduree, M.Robba,
Nucleosides Nucleotides. 1994, 13, 891.
73) A.F.Maggio, V.Boyer, A.M.Aubertin, G.Obert,
A.Kirn, J.L.Imbach, Nucleosides
Nucleotides. 1991,
10,1431.
74) (a) C. Perigaud, G. Gosselin, J.-L. Imbach.
Nucleosides Nucleotides 1992,11, 945;
(b) D. M. Huryn and M. Okabe. Chem.
Rev. 1992, 92, 1745; (c) L.
A. Kohlstaed, J. Wang, J. M. Friedman, et al. Science.
1992,256, 1783.
75) (a) F. Seela, G. Becher, H. Rosemeyer, H.
Reuter, G. Kastner, I. A. Mikhailopulo. Helv. Chim. Acta
1999 ,82, 105; (b) N. Ramzaeva, C.
Mittelbach, F. Seela. Helv. Chim. Acta .1999 ,82, 12
; (c) P. Wigerinck, A. Van Aerschot, G. Janssen, P. Claes, J.
Balzarini, E. De Clercq, P. Herdewijn. J. Med. Chem.
1990 ,33, 873; (d) V. Nair and Z. M.
Nuesca. J. Am. Chem. Soc. 1992, 114,
7954; (e) K. Sujino and H. Sugimura. J. Chem. Soc., Chem.
Commun. 1994, 11, 2542 ; (f)
A. Kakefuda, S. Shuto, T. Nagahata, J. Seki, T. Sasaki, A. Matsuda.
Tetrahedron 1994 ,50, 10182; (g) A.
M. Costa, M. Faja, J. Farràs, J. Vilarrasa. Tetrahedron Lett.
1998, 39, 1838; (h) B. Kasnar, V.
Skaric, B. Klaic, M. Zinic. Tetrahedron Lett. 1993,
34, 5000.
76) Mitsuya H., Springer-Verlag,
Heidelberg. 1997,4,198.
77) Y. N. Shi, Y. C. Lu, J. X. Fang, and Y. L.
Hua, Chem. J. Chin. Univ.. 1995, 16, 1710
78) Marquez V., «Advances in Antiviral
Drug Design,» Vol. 2, ed. by De Clercq E., JAI Press, Greenwich.
1996, 89.
79) Agrofoglio L. A., Challand S. R., Klumer
Academis Publishers, Dordrecht. 1998,12,15
80) Santana L., Teijeira M., Uriarte E.,
Balzarini J., De Clercq E., Bioorg. Med. Chem. Lett..
1998 , 8, 1352.
81) Estrada E., Uriarte E., Montero A., Teijeira
M., Santana L., De Clercq E., J. Med. Chem.
let. 2000 , 43, 1985.
82) Ogilvie, K. K.; Cheriyan, U. O.; Radatus, B.
K.; Smith, K. O.;Galloway, K. S.; Kennell,
W. L. Can. J. Chem. 1982,
60, 3005.
83) Ashton, W. T.; Canning, L. D.; Reynolds, G.
F.; Tolman, R. L.;Karkas, J. D.; Liou, R., Davies, M. -E. M.; De Witt, C. M.;
PerryH. C.; Field, A. K. J. Med. Chem. 1985,
28, 926.
84) Lin, T. -S.; Lin, M. -C. Tetrahedron
Lett. 1984, 25, 905.
85) Mac Coss, M.; Chen, A.; Tolman, R. L.
Tetrahedron Lett. 1985,27, 2019.
86) Riley, T. A.; Larson, S. B.; Avery, T. L.;
Finch, R. A.; Robins, R.K. J. Med. Chem. 1990, 33,
576.
87) (a) C. Perigaud, G.
Gosselin, J.-L. Imbach. Nucleosides
Nucleotides1992, 11, 945.
(b) D. M. Huryn and M. Okabe. Chem.
Rev.1992, 92, 1745; (c) L. A.
Kohlstaed, J. Wang, J. M. Friedman, et al. Science
1992,256, 1783.
88) (a) K. Ono, M. Ogaswara, Y.
Iwata, H. Nakane, T. Fuji, K. Sawai, M. Saneyoshi. Biochem.Biophys. Res.
Commun. 1986.140, 498; (b) H. Mitsuya
and S. Broder. Nature 1987,325, 773.
(c) J. Balzarini, B. Masaroni, R. Pauwel, P.
Herdewijn, S. G. Wood, M. J. Robins, E. De Clercq.Mol.
Pharmacol.1988, 33, 243;
(d) P. Wigerinck, A. Van Aerschot, P. Claes, J. Balzarini, E.
De Clercq, P. Herdewijn, J. Heterocyclic Chem.1989,
26, 1635.
(e) R.Yarchoan, H. Mitsuya, R. V. Thomas, J. M.
Pluda, N. R. Hartman, C. F. Perno, K. S. Marczyck, J-P. Allain, D. G. Johns, S.
Broder. Science 1989,245, 412;
(f) A. Matsuda, M. Satoh, T. Ueda,H. Machida, T. Sasaki.
Nucleosides Nucleotides. 1990,9, 587 and
references therein; (g) J. A.Secrist, R. M. Riggs, K. N.
Tiwari J. A. Montgomery. J. Med. Chem. 1992,35, 533
.
89) (a) F. Seela, G. Becher, H.
Rosemeyer, H. Reuter, G. Kastner, I. A. Mikhailopulo. Helv. Chim.
Acta.1999, 82, 105; (b) N.
Ramzaeva, C. Mittelbach, F. Seela. Helv. Chim. Acta
1999,82, 12 (c) P. Wigerinck,
A. Van Aerschot, G. Janssen, P. Claes, J. Balzarini, E. De Clercq,P. Herdewijn.
J. Med. Chem. 1990,33,873;
(d) V. Nair and Z. M. Nuesca. J. Am. Chem.
Soc. 1992,114, 7954; (e) K. Sujino and
H. Sugimura. J. Chem. Soc., Chem. Commun.
1994,11,2542; (f) A. Kakefuda, S. Shuto,
T. Nagahata, J. Seki, T.Sasaki, A. Matsuda. Tetrahedron.
1994,50, 10182; (g) A. M.
Costa, M. Faja, J. Farràs, J. Vilarrasa. Tetrahedron Lett.
1998,39, 1838 ;(h) B. Kasnar,
V. Skaric, B. Klaic, M. Zinic. Tetrahedron
Lett.1993. 34, 5000 .
90) Suhadolnik, R. J.: Nucleoside
Antibiotics. Wiley Interscience, New York,
1970
91) Suhadolnik, R. J. : Nucleosides as
Biological Probes. Wiley Interscience, New York, 1979
92) Suhadolnik, R. J.Progress in Nucleic
Acid Res. & Mol. Biol. 1979, 22, 272.
93) ) Goodchild, J.: The biochemistry of
nucleoside antibiotics. Topics in Antibiotic
Chemistry.1982, 6, 228.
94) Buchanan, J. G. & R. H. Wightman:
The chemistry of nucleoside antibiotics.1982,6,
339.
95) Nakamura, H.; S. Hasegawa, N. Shimada, A.
Fujii, T. Takita & Y. Iitaka: J. Antibiotics.
1986,39,1629.
96) Hoshino, H.; N. Shimizu, N. Shimada, T.
Takita & T. Takeuchi: J. Antibiotics.
1987,40,1078.
97) Yaginuma, S.; N. Muto, M. Tsujino, Y.
Sudate, M. Hayashi & M. Otani: J. Antibiotics.
1981,34,366.
98) Loomis, C. R. & R. M. Bell: J. Biol.
Chem. 1988,263, 1692.
99) Arita, M.; K. Adachi, Y. Ito, H. Sawai &
M. Ohno: J. Am. Chem.Soc. 1983,105,4055.
100) Borchardt, R.; B. T. Keller & U.
Patel-Thomvre: J. Biol. Chem. 1984,259,4358.
101) S .Rihani & T.
Taghi :« mémoire en vue de l'obtention du diplôme
d'ingénieur d'état en chimie
industrielle » 2005.
102) R.EL sayad : Grasas Y Articles .
2006, 57 ,187.
103) Hibert, M.; Haiech, J.
Médecine/Sciences . 2000, 16, 1332.
104) Bozdogan, B.; Appelbaum, P. C.
Int : J. Antimicrob. Agents .2004, 23, 113.
Annexes
| 


