|
UNIVERSITE LIBRE DE BRUXELLES
FACULTE DE MEDECINE
CARACTERISTIQUES DES ATTEINTES CARDIAQUES
AU COURS DE L'IMMUNODEFICIENCE LIEE AU
VIH
EN AFRIQUE CENTRALE : EVOLUTION NATURELLE
LONGO-MBENZA Benjamin
Thèse pour l'obtention du grade
d'Agrégé de l'enseignement supérieur
Option : cardiologie
1996
PREFACE
C'est avec tout le respect dont nous sommes capable que nous
venons nous incliner devant Monsieur le Recteur, le Professeur Jean-Louis
Vanherweghem, Monsieur le Doyen de la Faculté de Médecine, le
Professeur Jean-Paul Degaute, les Membres du Jury, pour présenter cette
dissertation à la prestigieuse Université Libre de Bruxelles.
Nous exprimons toute notre gratitude au Professeur Serge
Degré qui a accepté de diriger ce travail en nous encourageant
à surmonter la frustration d'un pays en dérive. Son
amitié est rayonnante dans notre famille.
Nous tenons à exprimer nos plus vifs remerciements au
Professeur Henri Denolin, le médecin, qui a stimulé notre
goût pour la cardiologie en nous accueillant au Laboratoire des
recherches cardiologiques Prince Alexandre de Bruxelles.
Le goût de l'excellence nous a été
enseigné par tous les maîtres de l'Université Libre de
Bruxelles et particulièrement Marc Englert, Bernard, Polis, Vandermoten,
Kornitzer, Messin, Jean-Luc Vandenbossche, Stoupel, Berkemboom, Jean-Paul Van
Vooren et Philippe Unger. Leurs critiques ont été
déterminantes pour la finalisation de ce travail. Je ne saurai jamais
assez les remercier.
Nous sommes reconnaissant envers le Professeur Jean-Jacques
Cassiman de la K.U.L., Leuven, qui nous a aidé dans l'étude
génétique des cardiomyopathies.
Nous devons signaler que nous avons été sensible
à la générosité du Docteur Victor Seghers qui nous
a offert un échocardiographe.
Nous sommes redevable à la délicate
bienveillance de Madame Lejeune du Service de la coopération de
l'Université Libre de Bruxelles.
Nous avons apprécié à sa juste valeur la
contribution en biostatistique de Madame Dramaix Michèle de l'Ecole de
Santé Publique de l'Université Libre de Bruxelles.
INTRODUCTION
Avant toute chose, nous sollicitons l'indulgence de nos juges
pour avoir utilisé des techniques peut-être surannées pour
un pays développé comme la Belgique, mais fondamentales pour
l'Afrique. En 1985, les professeurs Marcel Kornitzer et Serge Degré
avaient planifié avec rigueur et systémisation l'approche de
l'étude sur les cardiomyopathies du noir zaïrois avec
possibilité des biopsies endomyocardiques. Les perturbations
socio-politiques du Zaïre et la suspension de l'aide au
développement nous ont obligé à changer de sujet et
à nous occuper des complications cardiaques du syndrome
d'immunodéficience acquise (SIDA) du noir africain.
Il nous a été suggéré
d'étudier, sur le terrain à la manière d'un
épidémiologiste non interventionniste, l'évolution
naturelle des cardiopathies associées à l'infection VIH. Il a
été difficile de constituer parfois un groupe témoin dans
certaines observations : toutes les études africaines sur le Sida
manquent de sujets contrôles.
L'acronyme SIDA est la conséquence d'une
dépression immunitaire sévère due à une
déplétion des lymphocytes T helper. La suppression progressive
et irréversible de l'immunité cellulaire prédispose les
patients aux affections opportunistes et à certains cancers (FAUCI A.S.
et al., 1985 ; CHAISSON et al., 1990).
Le virus d'immunodéficience humaine (VIH),
rétrovirus à acide ribonucléique (ARN), détruit
progressivement les lymphocytes CD4. Depuis la révélation du
SIDA (GOTTLIEB M.S. et al., 1981), plusieurs auteurs ont rapporté les
aspects cliniques, diagnostiques et thérapeutiques de ce syndrome
(CLUMECK et al., 1984 ; COULAUD et al., 1985 ; ODIO et al., 1985).
L'expression clinique des affections opportunistes décrites se rapporte
à plusieurs appareils : les poumons, le système nerveux central,
le tube digestif, les reins et la peau (BORIES C. et al., 1985 ; BRUNET P. et
al., 1988 ; BUDKA H. et al., 1987 ; CLUMECK M. et al., 1988 ; DENIS B.J.
et al., 1992 ; COLEBUNDERS R. et al., 1986 ; DORMONT D. et al., 1988 ;
FLOMENBAUM M. et al., 1989 ; GENTILINI M. et DUFLO B., 1988 ; GOEDERT J.J. et
BLATTNER W., 1989 ; HENIN D., HAUW J.J., 1988 ; KAPITA B. et al., 1990 ;
KAWE L.W. et al., 1990 ; LOHOUE P. et al., 1991 ; MAYAUD C. et al., 1986 ;
NEMEL D.B. et al., 1991 ; PIOT P. et al., 1984 ; REITANO J. et al., 1984).
1. PROJECTIONS ET IMPACT DE L'INFECTION VIH SUR LE
MONDE
Le profil épidémiologique de l'infection par le
VIH a profondément changé de contours quinze ans après la
description du SIDA par les Etats-Unis d'Amérique. Si au début
la nouvelle maladie était confinée en Amérique du Nord, en
Europe occidentale et en Afrique noire, force est de constater aujourd'hui
l'expansion du virus VIH à travers tous les continents.
Les données épidémiologiques
rapportées entre 1981 et 1983 ont très rapidement insisté
sur les liens existant entre le SIDA et l'homosexualité. En 1996, la
transmission hétérosexuelle est exclusivement le mode de
propagation du VIH dans les pays en voie de développement en
général et en Afrique centrale en particulier. Le niveau
socio-économique bas de ce Tiers-Monde rend les populations plus
vulnérables vis-à-vis du VIH.
STATISTIQUES
Au 31 décembre 1993, 851.628 cas de SIDA et 14 millions
de séropositifs ont été déclarés à
l'Organisation Mondiale de la Santé (OMS) par 159 pays à travers
le monde. La prévalence cumulative des adultes infectés par le
VIH en Afrique sub-saharienne a été estimée au milieu de
la même année 1993 à plus de 8 millions de sujets, soit 70%
de la prévalence globale de porteurs du VIH dans le monde.
D'ici à l'an 2000, les projections estiment un total
cumulé de 40 millions de sujets infectés par le VIH et 10
millions de cas de SIDA disséminés dans tous les cinq continents
du monde. Et plus de 90% de porteurs du VIH habiteront en ce moment-là
dans les pays en voie de développement (WHO, AIDS, 1993 ; WHO, The
HIV/AIDS, 1993 ; MANN J.M., 1992). Bien évidemment, ces chiffres
minorisent la réalité car de nombreux patients atteints de SIDA
ne font pas l'objet d'une déclaration officielle dans des pays africains
à l'infrastructure médicale défavorisée.
PAYS INDUSTRIALISES
Les groupes à risque de l'infection du VIH ont
été bien précisés comme tels :
- homosexuels ou bisexuels masculins ;
- toxicomanes par voie intraveineuse ;
- transfusés avec du sang contaminé par le VIH
;
- individus ayant des rapports hétérosexuels
avec des sujets porteurs du VIH.
Mais le virus du SIDA touche également des sujets
hétérosexuels ne présentant pas de facteur de risque.
Au 31 décembre 1993, 44 pays européens ont
communiqué leurs recensements à l'OMS en déclarant 111.341
cas de SIDA. Les usagers de drogue intraveineuse en Italie, en Espagne et en
France ont représenté 71% des déclarations de la
Communauté Européenne à la fin de 1993 (EUROPEAN CENTRE,
1993).
Les Etats-Unis d'Amérique (USA) ont
déclaré 249.199 cas de SIDA (adolescents et adultes) au 31
décembre 1992 et le nombre est continuellement en hausse (CDC, 1993).
Une année auparavant (1991), la surveillance sérologique USA
avait noté 1,2 million d'adultes infectés par le VIH dont
130.000 individus étaient de sexe féminin (MANN J.H., 1992) : le
sex-ratio des cas de SIDA est passé de 14 femmes pour 1 homme en 1984
à 7 femmes pour 1 homme en 1991.
La séroprévalence du VIH est très
élevée chez des sujets américains tuberculeux avec des
taux compris entre 0 et 58% (médiane = 6%). Quoique moins nombreux, les
cas de SIDA chez les héroïnomanes ont été
déclarés simultanément avec ceux observés chez les
homosexuels. Ceci s'explique par le fait que 8% des homosexuels masculins sont
également, aux USA, utilisateurs de drogue intraveineuse. Il existe des
foyers de SIDA par homosexualité ou bisexualité (New York et San
Francisco : 10 à 70% de séroprévalence VIH) et par
toxicomanie (New Jersey, Bronx à New York, Atlanta et Chicago : 1
à 53% de séroprévalence VIH) où le partage des
seringues et des aiguilles atteint son paroxysme (CDC, 1987 ; SELIK R.M., 1993
; CDC, 1992 ; HERNANDEZ S.R. et al., 1991 ; HAHN R.A. et al., 1989 ; DES
JARLAIS D.C., 1987 ; WEIBEL W. et al., 1990 ; NATIONAL HIV, 1991 ; ALLEN D.M.
et al., 1992).
ASIE
La situation en Asie du Sud-Est est devenue très
préoccupante en raison d'une cinétique très rapide et d'un
cumul de risques : 1,5 million d'individus infectés par le VIH et 4.000
cas de SIDA rapportés en 1993 (WHO The HIV/AIDS pandemic, 1993)
associent transmission sexuelle par le biais de la prostitution et de la
toxicomanie. Le tourisme sexuel, en Thaïlande, en Malaysie, au sud de la
Chine, au Nord-Est de l'Inde et au Vietnam, constitue un facteur de propagation
du VIH (DES JARLAIS et al., 1992 ; IL P.C.K, 1992 ; WEINGER B.G. et al.,
1991 ; NAIK T.N. et al., 1991).
AMERIQUE LATINE ET CARAÏBES
La propagation du VIH dans cette région a
débuté au même moment qu'aux USA. Déjà en
1993, le recensement a rapporté 250.000 cas de SIDA et un cumul de 1,5
million d'individus infectés par le VIH (WHO, The HIV/AIDS, 1993).
Dans les îles Caraïbes, l'infection à VIH
est une véritable mosaïque de données
épidémiologiques liées aux spécificités
locales. La transmission du VIH par la pratique de l'homosexualité
masculine est prédominante à Trinidad, à Tobago, à
Barbados et à Guyane (BARTHOLOMEW C. et al., 1987). La toxicomanie et
le sexe ont élu domicile à Bahamas, à Bermuda et au Puerto
Rico (LEWIS P. et al., 1989).
Le mythe des Haïtiens avait défrayé la
chronique au début de 1982. Les Haïtiens constituaient
historiquement une entité de sujets à risque de SIDA, en raison
du nombre important des cas de transmission hétérosexuelle (PAPE
J.W., 1988). Cependant, c'est par leur forte appartenance aux drogués
et aux homosexuels qu'ils ont été contaminés et non pas
pour leur localisation géographique.
AFRIQUE SUB-SAHARIENNE
Le Zaïre, le Rwanda et l'Ouganda sont des pays
endémiques du VIH-1. Le VIH-2 a été isolé chez des
patients de l'Afrique de l'Ouest, de l'Angola et du Mozambique (DE COCK K.M.,
1991).
Le contrôle sanitaire est on ne peut pus précaire
dans la région africaine au sud du Sahara. En juin 1993, l'OMS a
estimé à plus de 1,5 million de cas de SIDA en Afrique noire
même si le diagnostic n'est pas toujours porté et les cas non
recensés en totalité (WHO, The HIV/AIDS, 1993). Une maladie
dénommée "SLIM" en Ouganda correspondrait au SIDA africain.
La prévalence de l'infection à VIH dans la
population africaine dépasse les 10% ; elle est de 50 à 80% chez
les femmes prostituées avec des ulcérations génitales
(maladies sexuellement transmissibles = MSD). Le comportement sexuel y joue un
grand rôle chez des jeunes adultes (entre 20 et 40 ans) en intense
activité sexuelle : à Nairobi, capitale du Kenya, 66% des
prostituées provenant d'un milieu économiquement
défavorisé et ayant 963 partenaires par an sont VIH positives et
31% de celles ayant un niveau de vie élevé et un nombre moyen de
partenaires par an de 124 deviennent séropositives pour le VIH
(TEMMERMAN M. et al., 1992).
L'incidence de la séroconversion VIH va de 0,3 à
5% (NKOWANE B.M., 1991). Les hommes et les femmes sont infectés dans
des proportions égales malgré quelques variations
géographiques du sex ratio : 1 homme pour 1,2 femme au Zaïre et en
Ouganda et 2 hommes pour 1 femme en Côte d'Ivoire.
2. PHYSIOPATHOLOGIE ET VIRUS DE L'IMMUNODEFICIENCE
HUMAINE
Les mécanismes par lesquels le VIH induit un
déficit immunitaire sont pratiquement élucidés à
partir de l'identification de ce virus en 1983 (BARRE-SINOUSSI F. et al., 1983
; GALLO R.C. et al., 1984). Le SIDA est la conséquence de ce
déficit immunitaire sévère et dû à une
dépletion des lymphocites T helper. Le VIH manifeste une
affinité pour l'antigène de surface CD4 des lymphocytes T helper,
les envahissant et les détruisant au cours de l'infection à VIH.
La perte progressive de l'immunité cellulaire prédispose les
patients aux affections opportunistes et à des processus
néoplasiques (CHAISSON et al., 1990). Cependant, l'explication de la
lymphopénie CD4 n'est pas univoque.
Pour comprendre ces mécanismes, il est important de
rappeler l'organisation du système immunitaire au cours de l'infection
VIH.
LES VIRUS DE L'IMMUNODEFICIENCE HUMAINE
(VIH)
L'ancien Lymphadenopathy Associated Virus (HTLV-III ou LAV)
est appelé aujourd'hui VIH, rétrovirus humain particulier
découvert en 1983 par l'équipe de Luc Montagnier en France.
Le VIH est un ARN virus de la sous-famille des lentivirus et
de la grande famille de rétroviridae. Alors qu'en général
l'information génétique est codée sous forme de ADN, cet
ADN étant ensuite recopié sous forme d'un ARN messager à
partir duquel la cellule produit des protéines, les rétrovirus
portent un matériel génétique sous forme d'acide
ribonucléique ou ARN qui est rétrotranscrit en ADN proviral
grâce à une enzyme, la transcriptase inverse (reverse). C'est
à ce processus de transcription inverse que ces virus doivent leur
appelation. Cette enzyme "transcriptase inverse" des rétrovirus,
découverte en 1970 par Temin et Baltimore, est une DNA-polymérase
RNA dépendante.
STRUCTURES
Les particules matures sont d'un diamètre de 90
à 120 nm, entourées d'une enveloppe externe lipidique de 100 nm
de diamètre et sortent par bourgeonnement (budding) de la cellule
infectée. Enfermé dans une enveloppe protéique se trouve
un nucléoïde ou corps, formation dense évoquant un noyau.
Le nucléoïde contient deux copies identiques du matériel
génétique (ARN).
ORGANISATION GENOMIQUE
Le génome du VIH, représenté par son ARN,
est composé de deux sous-unités identiques de 9.749
nucléotides (paires de bases, longueur de 10 kilobases) et de
l'extrémité 5' vers l'extrémité 3' des trois
gènes caractéristiques des rétrovirus :
- le gène gag (gène de l'antigène de
groupe) qui code pour les protéines du nucléoïde ;
- le gène pol (polymérase) qui détermine
la synthèse de l'enzyme "transcriptase inverse" ;
- le gène env (enveloppe) qui permet la synthèse
des glycoprotéines de l'enveloppe virale.
Le génome du VIH présente à chacune de
ses extrémités une séquence appelée Long Terminal
Repeat (LTR). Les LTR contiennent les matériaux promoteurs qui
contrôlent l'intensité de l'expression des gènes du virus
et l'intégration aux gènes de la cellule-hôte.
Le VIH renferme, en outre, des gènes
supplémentaires régulateurs :
- le gène vif, localisé entre le
gène pol et le gène env ;
- le gène tat (trans-activateur), augmente
l'expression des gènes viraux en agissant à distance sur le
promoteur contenu dans le LTR ;
- le gène rev (régulateur
sélectif) ;
- le gène vif (virion infecting factor) pour
la réplication virale :
- les gènes vpr et vpu sont
activés au cours de l'infection.
CYCLE VIRAL DU VIH
La particule virale se fixe sur la cible cellulaire par
interaction de la gp 120 (glycoprotéine de 120 KD) et de la
molécule CD4, ce qui découvre la glycoprotéine
transmembranaire gp41 (hydrophobe).
Une des extrémités de la gp41 s'introduit dans
la membrane cellulaire et cet accrochage engendre la fusion entre la membrane
virale et la membrane cellulaire. Une nouvelle protéine CD26 vient
d'être identifiée comme un corécepteur aidant le virus
à pénétrer dans la cellule.
L'enveloppe virale conditionne donc l'infectivité du
VIH puisqu'il s'attache spécifiquement à la cellule qu'il infecte
par l'intermédiaire de ses glycoprotéines d'enveloppe.
Après la liaison spécifique de la gp120 avec la
molécule CD4 à la surface cellulaire, le VIH s'introduit dans la
cellule. Cette liaison est également très efficiente puisque
l'affinité de la gp120 pour la molécule CD4 est plus grande que
l'affinité du complexe majeur d'histocompatibilité Classe II
(MHC) pour CD4 (KLATZMANN D. et al., 1984). Libéré de son
enveloppe, le VIH perd sa capside et assiste à la transcription de l'ARN
génomique en ADN par la transcriptase inverse. Grâce à une
enzymée codée par le VIH (intégrase), une partie de l'ADN
viral est intégrée dans l'ADN cellulaire de la cellule
hôte.
Une latence apparaît alors, caractérisée
par l'inactivité des gènes viraux et l'absence de synthèse
des antigènes viraux. Le VIH intracellulaire, intégré
dans le génome de la cellule hôte infectée sous forme
d'ADN, se met ainsi à l'abri des attaques du système immunitaire.
Cette intégration de la copie d'ADN rend le VIH difficilement
détectable par les techniques sérologiques classiques et
correspond à l'état du porteur séropositif
asymptomatique.
L'exposition à des stimuli exogènes (surtout
herpès virus ou virus d'Epstein-Barr) active le VIH latent pour la
poursuite du cycle de réplication du virus.
LES CIBLES CELLULAIRES DU VIH
Les anomalies induites par l'infection VIH ne sont pas
restreintes à la seule déplétion des lymphocytes CD4.
Elles concernent aussi les monocytes, les macrophages, les lymphocytes B, les
lymphocytes CD8, les cellules dendritiques folliculaires, les cellules
nerveuses, les cellules de Langerhans, les précurseurs
médullaires, les cardiomyocytes, les cellules de la rétine, les
cellules épithéliales rénales, les cellules
trophoblastiques, les cellules du col utérin et les cellules de la
muquese rectale.
LES MECANISMES DE LA LYMPHOPENIE CD4
Les lymphocytes CD4 sont une des cibles cellulaires
privilégiées du VIH. L'atteinte des lymphocytes CD4, une des
causes de l'immunodépression et élément essentiel de
pronostic au cours de l'infection par le VIH, est la conséquence d'une
déplétion multifactorielle.
Les mécanismes évoqués, non mutuellement
exclusifs, sont :
- l'effet cytopathogène du VIH n'est probablement en
cause que pour un faible nombre de cellules ;
- la cytotoxicité cellulaire dépendant des
anticorps ;
- les phénomènes autoimmuns (anticorps ani-CD4,
anti-HLA classe II) ;
- la mort cellulaire programmée ou apoptose (par
interaction moléculaire gp120-CD4 ou action de superantigènes)
;
- la production de cytokines (boucles d'amplification entre le
TNF et le VIH) ;
- l'infection des progéniteurs lymphocytaires ;
- les cofacteurs infectieux (virus, bactéries).
3. MANIFESTATIONS CLINIQUES DE L'INFECTION PAR LE
VIH
Les manifestations cliniques au cours de l'infection par le
VIH sont déterminées par le degré
d'immunodépression des patients.
L'évolution est dichotomique : les individus
infectés par le VIH peuvent évoluer soit vers la stabilisation en
étant porteurs asymptomatiques soit vers l'aggravation de
l'immunodéficience avec émergence d'affections opportunistes.
Les principales affections opportunistes selon le degré
du déficit immunitaire, le sexe, la race, la localisation
géographique, le comportement sexuel et le traitement sont :
- dermite séborrhéique, prurit ;
- sarcome de Kaposi, lymphome malin ;
- tuberculose, zona, candidose buccale ;
- pneumopathies interstitielles ;
- salmonellose, isosporose, toxoplasmose ;
- herpès, cryptosporidiose, cryptococcose ;
- mycobactérioses atypiques, cytomégalovirus.
4. DETECTION DU VIRUS VIH
Pour affirmer l'infection par le VIH le clinicien recourt au
diagnostic indirect (sérologique) et au diagnostic direct
(méthodes compliquées et coûteuses). Les méthodes
directes ne sont pas à la disposition des laboratoires de l'Afrique
subsaharienne.
4.1. DIAGNOSTIC SEROLOGIQUE
Au cours de l'infection VIH, les protéines virales
immunogènes induisent chez le sujet infecté des anticorps pouvant
être détectés par les techniques suivantes :
- Immunofluorescence
L'antiglobuline humaine marquée à
l'isothiocyanate de fluorescéine met en évidence les anticorps
fixés sur les cellules lymphocytaires infectées par le VIH. Un
test positif est basé sur une fluorescence visible à la
périphérie des cellules infectées. Il est difficile de
standardiser cette technique en détection de routine.
- Méthodes immuno-enzymatiques
La technique Enzyme Linked Immuno Sorbent Assay ou ELISA,
simple, sensible, spécifique, est disponible dans tous les centres
africains de référence sanitaire. Elle est rapide à
réaliser sur des grandes séries de sérums (sera). Le
principe repose sur la fixation par absorption physique de l'antigène
viral à une bille de polystyrène de manière indirecte
(sandwich) ou par compétition.
Le principe de l'ELISA en sandwich montre les anticorps
anti-VIH fixés sur les antigènes et conjugués à une
enzyme (E) qui transforme un substrat incolore (S) en produit coloré
analysé au spectrophotomètre ; les autres anticorps
déjà éliminés par lavage forment des anticorps
anti-anticorps humains.
La technique par compétition entre les anticorps du
sérum à tester et du réactif évalue par
colorimétrie l'intensité inversément proportionnelle au
taux d'anticorps du sérum testé.
La méthode "sandwich" est plus sensible mais moins
spécifique que la technique par compétition. Les contaminants
d'origine cellulaire au sein de la préparation antigénique ont
été à la base de nombreux faux positifs (0,1% à
0,4%) retrouvés dans les premières études africaines
(QUINN T.C. et al., 1986).
La commercialisation de bandelettes prêtes à
l'emploi a favorisé l'utilisation de cette technique dans certains
laboratoires africains.
La technique de Western-blot et celle de la RIPA sont
utilisées comme méthodes de référence pour la
confirmation d'une séropositivité VIH.
4.2. DIAGNOSTIC DIRECT
- ELISA antigène
La technique fixe des anticorps anti-VIH au fond des puits.
La liaison des antigènes du VIH présents dans le sérum aux
anticorps est révélée par des anticorps anti-VIH
conjugués à une enzyme. Cette réaction est
colorimétrique.
- Isolement viral
Cette technique se fonde sur la culture des cellules
mononuclées du sang périphérique après stimulation
initiale des cellules par la phytohémagglutinine (PHA). Une fusion
lymphocytaire réflète l'effet cytopathique de la multiplication
du VIH. La détection de l'antigène dans le surnageant de culture
signe la présence du virus VIH.
- Anticorps anti-VIH2
Le principe "sandwich" permet de détecter les anticorps
anti-VIH2 à cause des réactions croisées entre VIH1 et
VIH2.
- Agglutination passive
Les billes de polystyrène mises en présence
d'anticorps anti-VIH produisent un réseau d'agglutination visible
à l'oeil nu.
- Radio-immunoprécipitation (RIPA)
Un virus marqué par un isotope radio-actif comme la
cystéine 35 donne un lysat viral avec des antigènes à
l'état natif pendant qu'il est incubé avec le sérum
à tester. Les billes de protéines A-Sépharose captent les
complexes immuns ainsi formés. La révélation des
anticorps dirigés contre les protéines d'enveloppe est
réalisée par autoradiographie.
- Western-blot
Il s'agit d'un immuno-transfert qui révèle la
présence des anticorps fixés en focntion de leur
spécificité sur les protéines virales par addition d'une
antiglobuline humaine marquée par une enzyme, puis d'un substrat
chromogène.
- Détection de l'ADN et de l'ARN
Les techniques détectent les acides nucléiques
viraux. Les méthodes d'hybridation moléculaire conventionnelle
in situ basées sur la présence du VIH et son niveau d'expression
par la quantification de ses ARN messagers étaient peu sensibles que
l'isolement viral.
Aujourd'hui on utilise la technique "Polymerase Chain Reaction
ou PCR" qui effectue l'amplification de séquence à partir de
l'ADN : rechercher la présence de l'ADN proviral VIH
intégré dans l'ADN cellulaire ou la présence des ARN
génomiques ou messagers grâce à une étape
préalable de transcription inverse qui transforme l'ARN en ADN. Le
résultat de l'amplification est ensuite analysé par
électrophorèse sous forme d'une bande colorée au bromure
d'éthidium.
5. REPONSE SEROLOGIQUE A L'INFECTION VIH ET DEPLETION DES
CELLULES T-CD4
La détection de l'antigène p24 dans le
surnageant des cultures du VIH n'est pas encore reconnue comme une
méthode de référence. L'antigénémie p24
assure le dépistage précoce de l'infection VIH (phase de
primo-invasion de l'adulte ou du nouveau-né de mère
séropositive) et aurait une valeur pronostique : l'antigène p24
disparaît du sérum après la primo-invasion chez 15% de
séropositifs asymptomatiques (8 à 12 semaines) et ne
réapparaît qu'au stade SIDA de l'infection VIH (60% des cas
évoluent en quelques semaines vers la mort) ; les anticorps Ig M et Ig G
(anti-antigènes p24, gp41, gp120) se développent 3 mois
après la contamination (Figure 1).
L'apparition des anticorps anti-p24 coïncide avec une
phase temporaire d'une baisse des antigènes p24 et une formation des
immunocomplexes (GOODSMIT, 1986 ; ALLAIN J.P., 1986 ; SIMMONDS, 1988 ; COOPER,
1988 ; VON SYDOW, 1988).
A la primo-infection, le nombre des CD4 diminue brusquement au
moment de l'hypervirémie (phase aiguë de l'infection VIH,
lymphadénopathie généralisée). Après 3
mois, la virémie devenue nulle coïncide à une
remontée du taux des CD4 vers des valeurs limites inférieures de
la normale (TINDALL B., 1991) ; ici commence une période de latence
clinique qui peut durer 10 ans. Avec la progression de l'infection VIH, la
dépletion des CD4 et l'hypervirémie VIH favorisent entre la
huitième et la onzième année de la durée de
l'infection VIH l'émergence des affections opportunistes et la survenue
du décès des patients (Figure 2).
La surveillance du compte des CD4 reflète le mieux la
progression de l'infection VIH puisque leur taux montre une très forte
corrélation avec la sévérité de
l'immunodépression (CDC, 1993). Un sujet même asymptomatique avec
un nombre de CD4 inférieur à 200/mm3 est actuellement
classé au stade SIDA depuis la révision 1993 du CDC.
6. COEUR ET SIDA
C'est plus tard que les atteintes cardiaques du SIDA
retiendront l'attention des chercheurs américains avec l'invasion
cardiaque par le sarcome de Kaposi (AUTRAN et al., 1983 ; SILVER M.A. et al.,
1984 ; FRIEDMAN K. et al., 1982). Plusieurs travaux apportent la preuve de
l'atteinte de toutes les tuniques cardiaques au cours du SIDA dans les pays
développés et avec un intérêt particulier sur les
cas de cardiomyopathies dilatées (COHEN I.S. et al., 1986 ; CALABRESE
L.H. et al., 1987 ; CORBOY J.R. et al.,
Figure 1
Evolution des marqueurs sérologiques de
l'infection au VIH.
Ag : antigènes. Ac : anticorps anti-
Figure 2
Déplétion des lymphocytes CD4 et virémie
VIH au cours du temps.
00 : virémie VIH, dilution -> 1/512,
·---
· compte des CD4
A : primo-infection. B : latence clinique. C : apparition des
affections opportunistes. D : décès
1987 ; HAKAS J.F. et al., 1991 ; JOSHI V.V. et al., 1988 ;
KAMINSKY H.G. et al., 1988 ; LEIDIG G.A., 1991 ; REILLY G.M. et al.,
1988). Cette riche documentation se fonde sur les descriptions
nécropsiques (FINK L. et al., 1984 ; CAMMAROSANO C. et al., 1985 ; LEVY
W.S. et al., 1989 : STEINHERZ L.J. et al., 1986). Aux Etats-Unis
d'Amérique, 28 à 73% des patients au stade SIDA présentent
un dysfonctionnement cardiaque (CAMMAROSANO et LEWIS, 1985 ; LEWIS W., 1989 ;
VULLIEMIN P. et LEDUC D., 1993 ; MONSUEZ J. et al., 1988 ; MARTIN R.P. et al.,
1980 ; FINK L. et al., 1984).
Le type d'affection qui vient endommager le coeur des patients
souffrant d'infection VIH varie considérablement suivant la
région géographique et la race.
Dans les pays développés d'Amérique et
d'Europe, l'hypertrophie (dilatation) isolée du ventricule droit a
été retrouvée chez 33% des patients sidéens et
régresse chez 47% après 15 mois d'observation (BLANCHARD D.G. et
al., 1991). Elle est la conséquence d'un coeur pulmonaire chronique
(HIMELMAN R.B. et al., 1989 ; EWIG S. et al., 1994). Des cas d'hypertension
artérielle pulmonaire primitive (HTAP) ont aussi été
observés chez des patients atteints de SIDA (MARTOS A. et al., 1993 ;
DUCHESNE N. et al., 1993 ; METTE S.A. et al., 1992 ; GOUELLO J.P. et al., 1992
; COPLAN N.L. et al., 1990). Chez l'animal avec dépression immunitaire,
l'HTAP est caractérisée par un dépôt de
collagène autour des vaisseaux pulmonaires (GILLESPIE M.N. et al.,
1994). Dans l'HTAP primitive associée au SIDA, l'atteinte
plexogénique des artères pulmonaires entraîne un coeur
pulmonaire et une myocardite de surcharge volumique (REISER P. et al.,
1992).
En Afrique noire, le SIDA transmis par voie
hétérosexuelle, présente trois caractéristiques
épidémiologiques (PIOT P. et al., 1993) : sa fréquence
sensiblement égale chez les deux sexes, alors que le rapport de
près de 19 hommes pour 1 femme est observé aux Etats-Unis, son
incidence maximale dans la tranche d'âge de 20 à 39 ans et un pic
de séropositivité dans la même tranche d'âge.
L'infection VIH y est un paradigme épidémiologique puisque le
nombre de sujets contaminés se compte déjà par millions.
Dans un grand hôpital de Kinshasa, plus de 35% des sujets
hospitalisés (enfants et adultes) sont infectés par le VIH (NGALY
B. et al., 1988). Chez les noirs d'Afrique souffrant de SIDA, la
fréquence de morts attribuées à une cause cardiaque varie
de 6 à 10% (BERTRAND Ed., 1992). Malgré la progression
inquiétante du SIDA dans cette partie du continent africain, il n'existe
que quelques données fragmentaires sur les atteintes cardiaques. Il est
fait état des péricardites liquidiennes, des cardiomyopathies
dilatées et rarement des endocardites associées au SIDA (BOGUI F.
et al., 1992 ; BOURAMOUE C., ASOBOA, 1989 ; BOURAMOUE C. et al., 1992 ; KAGAME
A. et al., 1991). Le SIDA est de plus en plus reconnu comme facteur
étiologique des cardiomyopathies dilatées (BERTRAND Ed., 1992 ;
BOURAMOUE C. et al., 1992). Dans la plupart des cas, il s'agit d'atteintes
cardiaques chroniques dont les manifestations cliniques apparaissent avant les
symptômes liés au SIDA.
Dans la région des Caraïbes, il s'agit plus
souvent des populations toxicomanes (84,4%) et d'ethnie hispanique (ALTIERI
P.I. et al., 1994) : l'atteinte cardiaque associée au SIDA est souvent
asymptomatique malgré la fréquence élevée des
myocardites (32%) d'origine infectieuse comme Histoplasma capsulatum,
Toxoplasma gondii, Mycobacterium tuberculosis, Cytomegalovirus, Cryptococcus
neoformans et des mycobactéries atypiques.
L'Europe et les Etats-Unis présentent des patients dont
le SIDA se complique de tuberculose et de cryptococcose. Des 350.000 cas de
SIDA que compteront les Etats-Unis en l'an 2000, 25.000 souffriront d'un
dysfonctionnement ventriculaire gauche : une étude conduite à
l'hôpital Johns Hopkins montre une prévalence de 14,5% et une
incidence de 18% de ce dysfonctionnement ventriculaire gauche au cours du SIDA
(HERSKOWITZ A.H. et al., 1993). En France, la prévalence de
l'altération de la fonction ventriculaire gauche est inférieure
(9,5%) à celle de l'Amérique (LASSAIGNE D. et al., 1991).
Notre modeste contribution, fruit du travail clinique d'une
décennie dans un milieu africain différent des régions
nord-américaine, européenne et des Caraïbes, vise un
dépistage systématique des atteintes cardiaques chez des patients
infectés par le VIH pour mieux :
1. déterminer leurs différents aspects
cliniques, biologiques, électrocardio-graphiques, radiologiques et
échocardiographiques.
2. évaluer leur évolution naturelle par la
compréhension des relations existant entre le VIH et les
différentes variables anthropométriques, biologiques et
échocardiographiques. Ces variables sont liées au pronostic et
à la survie.
3. rechercher une cause immunopathologique possible
liée au complexe d'histocompatibilité (HLA) et tester
l'hypothèse de l'existence d'une base génétique dans ces
atteintes cardiaques associées à l'infection VIH.
CHAPITRE I - METHODES
1.1. PATIENTS
Les patients sont des sujets noirs du Zaïre et
séropositifs pour le VIH nous adressés pour mise au point
cardiovasculaire au Centre de Cardiologie au Coeur de l'Afrique.
Le Centre de Cardiologie au Coeur de l'Afrique, situé
à Lomo Medical de Limete et au centre de la ville de Kinshasa, est le
fruit d'un partenariat afro-américain conçu pour le diagnostic,
le traitement, le follow-up, l'éducation, la recherche et la
prévention des maladies cardiovasculaires.
Nous avons examiné de manière
rétrospective ou prospective un total cumulé de 510 patients (295
hommes et 215 femmes) infectés par le VIH du 1er juillet 1987 au 1er
juillet 1994. De ce registre de 510 séropositifs pour le VIH
(population), certains échantillons aléatoires ont
été constitués par tirage au sort. Lors de la
sélection des patients comme infectés par le VIH (porteur
asymptomatique) ou comme cas de SIDA, nous avons dû impérativement
nous conformer aux critères de définition de la maladie tels
qu'ils sont exposés ci-dessous :
- chaque patient devait être identifié
conformément aux critères cliniques définis par
l'Organisation Mondiale de la Santé lors de l'atelier de Bangui (OMS,
1985) et rapportés par Gentillini (GENTILLINI et al., 1986) ;
Critères majeurs
- amaigrissement > 10%
- diarrhée > 1 mois
- fièvre > 1 mois
Critères mineurs
- toux > 1 mois
- dermatite prurigineuse généralisée
- zona récidivant
- candidose oropharyngée
- herpès virose chronique
- lymphadénopathie
Critères d'exclusion
- cancer
- malnutrition sévère
- autre étiologie
SIDA
- méningite à cryptocoque
- sarcome de Kaposi généralisé
- deux critères majeur + un critère mineur
- la présence d'une sérologie anti-VIH positive
par la méthode d'ELISA et confirmée par le test de Western Blot ;
notre Centre montre une sensibilité de 98,5% (510 vrais positifs, 8 faux
négatifs) et une spécificité de 99,5% (1632 vrais
négatifs et 7 faux positifs) ;
- la classification de l'infection VIH a satisfait aux
critères des Centers for Disease Control (CDC, 1987), du système
de l'Eastern Cooperative Oncology Group (PIOT P. et al., 1993) et à la
révision CDC 1993 (CDC, 1993) ;
Classification de l'infection à VIH (CDC, 1987)
- Groupe I : infection aiguë
Groupe II : infection asymptomatique
A : biologie normale
B : biologie anormale.
- Groupe III : lymphadénopathie
généralisée persistante (PGL)
A : biologie normale
B : biologie anormale
- Groupe IV : autres maladies : A, B, C, D, E
Révision CDC 1993
- Infection VIH
A : asymptomatique, primo-infection PGL
A1 : CD4 500/mm3
A2 : CD4 : 200 - 499/mm3
B : symptomatique
B1 : CD4 500/mm3
B2 : CD4 : 200 - 499/mm3
- SIDA
C, C1 : CD4 500/mm3, C2 : CD4 : 200 -
499/mm3
C3 : CD4 < 200/mm3
Affections opportunistes + cancers.
La relation du VIH avec l'atteinte cardiaque a
été suggérée par l'absence des pathologies à
risque cardiovasculaire suivantes :
- hypercholestérolémie
- hyperuricémie
- accident vasculo-cérébral
- diabète sucré
- insuffisance rénale.
Pour chaque sujet retenu, nous avons réalisé une
anamnèse exhaustive, un examen clinique en rapport avec sa pathologie
cardio-vasculaire, des analyses du sang, un électrocardiogramme, un
cliché radiologique du thorax de face et un échocardiogramme
Doppler.
Le mode de transmission du VIH est hétérosexuel
chez tous les patients. En effet l'enquête anonyme par questionnaire sur
la sexualité retrouve sur 405 répondants (405/510), 302 avec une
moyenne annuelle de 15 partenaires différents, 72 avec des
antécédents de syphilis, de chancre mou, de gonococcie et 41
ayant eu des rapports sexuels avec des prostituées.
1.2. PROTOCOLE EXPERIMENTAL
1.2.1. BIOLOGIE
Au niveau du sang, la vitesse de sédimentation des
érythrocytes, la recherche des anticorps anti-VIH, un test
complémentaire de Western Blot, le typage lymphocytaire et le typage de
l'antigène DRB1 ont été réalisés.
Le liquide d'épanchement péricardique a servi au
dosage des protéines, à la numération des cellules et
à l'étude bactériologique (Ziehl, Gram et encre de Chine).
Le degré du déficit immunitaire a été
évalué par le nombre absolu des CD4 et par l'anergie
tuberculinique (test de Mantoux) au regard des manifestations cliniques de
l'infection à VIH selon l'OMS et les CDC. La recherche de nouveaux
facteurs de pronostic et de nouvelles cibles cellulaires autres que le nombre
des CD4 a été effectuée au niveau du sang complet
(éosinophiles, monocytes, basophiles).
1.2.2. ECHOCARDIOGRAPHIE
1.2.2.1. Techniques de l'Echo-Doppler cardiaque
Les enregistrements échocardiographiques ont
été effectués de manière élémentaire
(HENRI W.L., 1980) à l'aide d'un échocardiographe de marque
Genesis, Biosound, muni d'une sonde de 2,5 MHz et d'un écran donnant des
images en mode bidimensionnel, en mode M et en mode Doppler pulsé et
continu. Un curseur permet de sélectionner à partir de l'image
sectorielle la coupe du mode M. Le déroulement du papier imprimant
s'est réalisé à une vitesse de 50 mm/sec.
Les données du Doppler pulsé ont
été recueillies au niveau de l'anneau mitral et en incidence
apicale 4 cavités en vue d'évaluer le remplissage du ventricule
gauche. Le temps de relaxation isovolumique (IVRT) est obtenu par le Doppler
continu à la pointe du coeur. Les valeurs de tous les paramètres
écho-vélocimétriques sont des moyennes des mesures
enregistrées au cours de 5 cycles cardiaques consécutifs. Trois
enregistrements ont été effectués à intervalle de 5
minutes le même jour de l'examen.
1.2.2.2. Mesures échocardiographiques en mode M
En prenant l'image bidimensionnelle comme guide, il a
été dessiné un tracé échocardiographique
mode M derrière les feuillets mitraux et selon les recommandations de la
Société Américaine d'Echocardiographie (HENRI W.L., 1980).
La masse du ventricule gauche (VG) a été calculée
d'après la formule suivante :
Masse VG = [ VG Dd + VG Eds + VG Edp ]3 x 1,05
où VG Dd = diamètre
télédiastolique du VG, VG Eds = épaisseur diastoliqque du
septum interventriculaire. La masse du VG par surface corporelle (S.C.)
(Index de masse du VG : IMG) normale est égale à 97 + 23
gr/M2.
1.2.2.3. Mesures échocardiographiques - Doppler
Les mesures réalisées à partir des images
bidimensionnelles furent obtenues à l'aide d'un ordinateur
incorporé à partir des repères indiqués par
l'examinateur et en position 1-2 de Feigenbaum (FEIGENBAUM H., 1976), selon les
recommandations de la Société Américaine
d'Echocardiographie (SAHN D.J. et al., 1978).
Nous avons retenu les paramètres suivants : le
diamètre télédiastolique du ventricule gauche (Dd), le
diamètre télésystolique du ventricule gauche (Ds),
l'épaisseur diastolique de la paroi postérieure (Edp), le
diamètre antéro-postérieur de l'oreillette gauche (OG).
La fonction systolique du ventricule gauche a
été évaluée par le pourcentage de raccourcissement
(% R). La formule utilisée est la suivante :
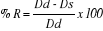
La détermination du temps de relaxation isovolumique
(IVRT) a été rendue possible en incidence apicale 4
cavités et après avoir placé le tir à un endroit de
la chambre de chasse du VG le plus proche de la pointe du feuillet
antérieur de la valve mitrale : l'IVRT débute avec la fermeture
aortique et s'arrête avec l'ouverture mitrale.
Les mesures du flux mitral ont été
réalisées par l'enregistrement en apical 4 cavités en
fixant le tir au-dessus des feuillets de la valve mitrale. En diastole, le
flux entrant dans le ventricule gauche a été analysé par
les pics de vélocités maximales proto-diastolique (VE) et
télé-diastolique (VA) et par le rapport VE/VA au cours de chaque
cycle cardiaque. Le temps de décélération (DT)
représentant la durée nécessaire à VE pour revenir
à la ligne de base O, a été calculé
également. Le demi-temps de décélération (DHT) a
été aussi mesuré.
1.3. ANALYSES STATISTIQUES
La saisie des données et les calculs statistiques ont
été effectués à l'aide d'un micro-ordinateur de
marque Zenith IBM compatible. Le logiciel DBase III Plus a servi à la
saisie des données, le SPSS PC à l'analyse statistique et le 2L
BMDP à l'estimation de Kaplan-Maier et au modèle de COX.
L'analyse descriptive a été
réalisée grâce aux calculs des proportions, des moyennes,
des médianes, l'intervalle de confiance à 95% et des
écart-types. Pour l'analyse inférentielle, le test de T-student
et le test U de Mann-Whitney ont été utilisés pour
comparer les moyennes, le test Chi-carré pour comparer les proportions
et l'analyse des variances pour comparer les données
métriques.
Les mesures tensionnelles et
écho-vélocimétriques effectuées de manière
répétitive ont exigé de corriger les tests de Student par
la méthode de Bonferonni pour comparer les groupes entre eux. Si
l'effectif est inférieur à 20, la correction de Yates a
été appliquée pour utiliser le test Chi-carré
(Chi-Deux).
L'évaluation de la liaison entre variables
métriques s'est faite par le calcul du coefficient de
corrrélation linéaire de BRAVAIS-PEARSON.
Les statistiques de survie ont évalué le
pronostic de l'infection VIH par le calcul des taux de mortalité ou de
survie (probabilité) avec la méthode des estimateurs de
Kaplan-Maier. La régression de Cox a estimé de façon
quantitative l'effet d'un paramètre extérieur (facteur de
pronostic) sur la survie. Pour pouvoir tenir compte de la totalité de
la courbe de survie et des données tronquées (censurées ou
censored) pouvant biaiser les moyennes de survie, les groupes ont
été comparés par le test du logrank (équivalent du
test de Student pour des données censurées). Ce modèle de
régression très général a été
proposé en 1972 par Cox (COX D.R., 1972) à travers les relations
suivantes :
- 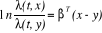
où xT = (x1, x2,
...xp) et yT = (y1, y2, ...
yp)
p facteurs de risques (covariables), ë(t, x) fonction de
survie
- ou bien
F(t ; Z) = [ Fo(t) ]exp (zâ)
F(t ; Z) fonction de survie ; Fo(t) valeur de la
fonction de survie pour une valeur nulle de la variable indépendante
Z.
Les tests statistiques ont porté sur le coefficient
â. Ce modèle est connu sous le nom de "modèle des risques
proportionnels parce qu'il suppose que les variables indépendantes
agissent de façon multiplicative sur la fonction de survie. Le rapport
RR (pour Z=0 du facteur de risque, et Z = 1 du même facteur) est le
risque relatif de mortalité. La méthode "pas-à-pas"
(stepwise) pour le modèle de Cox a été utilisée
pour ne retenir que les variables les plus significatives.
Les seuils de signification ont été
utilisés selon les valeurs de p suivantes :
- p 0,05 : non significatif (NS)
- 0,01 p 0,05 : significatif (*)
- 0,001 p 0,01 : hautement significatif (**)
- p 0,001 : très hautement significatif (***).
CHAPITRE II - FREQUENCE ET ASPECTS CLINIQUES DES
PERICARDITES AU COURS DU SIDA
2.1. ETAT DE LA QUESTION
Dans la littérature, le tableau clinique de l'atteinte
péricardique au cours du SIDA comprend des épanchements
péricardiques asymptomatiques et des péricardites fatales par
tamponnade ou constriction (HERSKOWITZ A.H. et al., 1989). La fréquence
des péricardites associées au SIDA varie de 6 à 32% dans
des séries autopsiques (MARTIN R.P. et al., 1980 ; REILLY J.M. et al.,
1988 ; ANDERSON D.W. et al., 1988 ; CAMMAROSANO C. et LEWIS W., 1985 ;
FINK L. et al., 1984 : MONSUEZ J. et al., 1988 ; LAFONT A. et al., 1988 ; LEWIS
W., 1989) et se situe à 23% dans les études cliniques (MONSUEZ J.
et al., 1988 ; KAUL S. et al., 1991 ; LEVY W.S. et al., 1989 ; BLANCHARD D.G.
et al., 1991 ; CORALLO S. et al., 1983 ; STEFFEN H. et al., 1991 ;
HIMELMAN R.B. et al., 1989 ; KINNEY E.L. et al., 1989). Ces types de
péricardites, non bruyantes et non spécifiques, sont
lymphocytaires, à liquide sérohémorragique et
stérile. Elles sont associées à une myocardite dans 44%
des cas (REILLY J.M. et al., 1988) et rarement à des tumeurs de types
sarcome de Kaposi ou lymphome (CLIFFORD C.D., 1990 ; CAMMAROSANO L., 1985).
2.1.1. PATIENTS DE L'ETUDE RETROSPECTIVE
De janvier 1985 à décembre 1986, nous avons
évalué de manière rétrospective la fréquence
et les aspects cliniques des péricardites dues au virus VIH
auprès de 17 sujets atteints de péricardite liquidienne et
d'âge moyen de 28 ans. Le diagnostic clinique de l'infection à
VIH a été établi selon les critères de
l'Organisation Mondiale de la Santé (OMS) pour l'Afrique et les pays en
voie de développement (GENTILLINI, 1986). La recherche des anticorps
anti-VIH, le test tuberculinique de Mantoux et le compte des CD4 ont
été pratiqués chez tous les patients. Les explorations
cardiovasculaires ont été limitées à
l'électrocardiogramme, au cliché thoracique de face, à
l'échocardiogramme et à la ponction péricardique.
Depuis la découverte du syndrome
d'immunodéficience acquise, il y a une nette recrudescence des
péricardites en Afrique noire en général et au Zaïre
en particulier. En 1988, nous avons noté une prévalence
hospitalière de cas de péricardites six fois supérieures
à celle d'avant 1980, soit 12,4% (34/275 patients admis en
médecine interne). Les principales étiologies rapportées
étaient : l'infection à VIH (50%), la tuberculose (20,6%), le
rhumatisme articulaire aigu (17,7%) et de formes étiologiques non
précisées (MALU K., LONGO-MBENZA B., 1988).
2.1.2. PATIENTS DE L'ETUDE PROSPECTIVE
Pour rechercher une éventuelle relation entre
l'infection à VIH et la fréquence élevée de cas de
péricardite liquidienne, tous les patients suspects d'épanchement
péricardique, consultant au Centre de Cardiologie au Coeur de l'Afrique,
ont été examinés de manière prospective de janvier
1991 à décembre 1994. L'incidence clinique annuelle de
péricardite liquidienne chez les patients avec infection VIH et ceux
avec SIDA a été respectivement évaluée à
1,8% (cumul de 153 VIH positifs/2150 patients) et à 0,4% (cumul de 37
cas de SIDA). Les résultats partiels concernant l'étiologie et
l'évolution clinique de la péricardite liquidienne
associée au VIH ont été publiés récemment
(TONDUANGU K., LONGO-MBENZA B. et al., 1995).
Depuis 15 ans l'Afrique subsaharienne connaît une
recrudescence de la tuberculose pulmonaire et ganglionnaire. En suspectant une
grande association de la tuberculose avec l'immunodépression
déterminée par l'infection du VIH, 32 patients infectés
par le VIH ont été appariés à 32 patients
séronégatifs pour le VIH au sujet de l'histoire naturelle de
leurs péricardites liquidiennes. Seuls ces 64 patients ont
été retenus dans l'étude au regard de critères
ci-dessous.
Critères d'inclusion :
- présence de l'épanchement péricardique
à l'échocardiogramme bidimensionnel ;
- péricardioncenthèse (ponction
péricardique) positive ;
- compte de CD4 ;
- examen hématologique complet ;
- présence d'un tracé
électrocardiographique et d'un cliché radiologique du
thorax ;
- confirmation de l'infection à VIH par le test de
Western Blot.
Critères d'exclusion :
- insuffisance cardiaque congestive ;
- asthme bronchique ;
- bronchopneumopathie chronique obstructive.
2.2. RESULTATS
I. ETUDE RETROSPECTIVE
2.2.1. LES ASPECTS CLINIQUES DE L'INFECTION A VIH ET DES
PERICARDITES
Les principales manifestations cliniques de l'infection
à VIH sont respectivement l'amaigrissement (100%), la fièvre
chronique (88,2%) et la diarrhée chronique (41,1%), la pneumopathie
interstitielle à Pneumocystis carinii (29,4%), la candidose
oro-oesophagienne (29,4%), la méningite à cryptocoque et le
sarcome de Kaposi généralisé.
L'atteinte péricardique est notée chez 76,4% des
patients porteurs d'une infection à VIH de la catégorie B de la
révision CDC 1993. Le tableau électrocardiographique est
dominé par des troubles diffus de la repolarisation. Le bas-voltage
n'est noté que dans 23,5% des tracés. Sur le plan radiologique,
l'index cardiothoracique légèrement modifié ne
dépasse pas 0,60. Chez ces patients, l'image échocardiographique
(tableau 1) montre un espace clair postérieur mince en diastole (2-5 mm)
dans 60% des cas. La dilatation du ventricule gauche (Dd > 5,5 cm, D1
< 4,1 cm) concomittante à l'épanchement
péricardique chez 40% des patients ferait penser à une atteinte
myocardique associée.
Tableau 1 - Aspects échocardiographiques
chez 10 patients
|
Aspects anatomiques
|
Nombre de cas
|
Pourcentage
|
|
- Espace clair postérieur :
en diastole
2-5 mm
6-10 mm
11 mm et plus
- Anomalies des valves
- Dilatation du ventricule gauche
|
6
3
1
1
4
|
60
30
10
10
40
|
2.2.2. LES EXAMENS BIOLOGIQUES
Au plan biologique, l'analyse du liquide péricardique
montre qu'il s'agit d'un exsudat pauvre en lymphocytes (tableau 2). Les
cultures bactérienne et fungique sont stériles. Une anergie
tuberculinique observée chez 17 patients (100%) et une diminution des
lymphocytes CD4 chez 15 patients (88,2%) confirment l'immunodéficience
acquise des patients.
Tableau 2 - Analyse du liquide péricardique chez
12 patients atteints du SIDA
|
Anomalies
|
Nombre de cas
|
Pourcentage
|
|
- Exsudat
- Culture positive
|
12
0
|
100
0
|
II. ETUDE PROSPECTIVE
2.2.3. ASPECTS GENERAUX
Au 31 décembre 1994, le cumul total de cas de
péricardite liquidienne a été estimé à 190
cas parmi les 2.150 patients examinés (prévalence
hospitalière de 8,8%). Ce taux ne montre pas de différence
significative (p = NS) en comparaison avec celui que nous avons observé
dans la partie rétrospective de cette étude (12,4%) ; toutefois
la prévalence des péricardites après
l'épidémie du SIDA demeure quatre fois plus élevée
que celle d'avant 1980. Cet ordre de grandeur observé sur un
échantillon plus large serait proche de la réalité.
L'incidence clinique annuelle (dérivée de la prévalence)
de péricardites liquidiennes chez les patients infectés par le
VIH est de 1,8%.
Seules la présentation clinique et les
caractéristiques biologiques de 64 patients ayant répondu aux
critères de sélection seront discutées dans la suite de ce
travail.
2.2.4. MANIFESTATIONS CLINIQUES DE L'INFECTION A VIH ET
EXPLORATION FONCTIONNELLE DU COEUR
Une cohorte constituée de 32 patients infectés
par le VIH (19 hommes, 13 femmes ; âgés de 20 à 54 ans) et
de 32 patients séronégatifs pour le VIH (20 hommes, 12 femmes ;
âgés de 23 à 60 ans) ont accepté de participer
à une étude prospective étalée sur 3 ans.
Une forte suspicion d'épanchement péricardique
était fondée sur la présence des douleurs thoraciques
atypiques, d'une toux sèche, d'un frottement péricardique, d'une
pression veineuse jugulaire supérieure à 5 cm au-dessus de
l'angle de Louis et d'un pouls paradoxal. Le tableau 3 résume les
caractéristiques cliniques des patients. Le groupe de patients VIH
négatifs a servi de contrôle.
Les deux groupes de patients sont comparables en ce qui
concerne l'âge, le sex ratio, la toux, les douleurs thoraciques
atypiques, l'amaigrissement, le frottement péricardique et l'importance
de l'épanchement péricardique (p = NS). Au cours de l'infection
à VIH associée à une péricardite, les patients
présentent plus de sudations nocturnes (70%), de cas de dilatation du VG
à l'échocardiogramme et de clichés radiologiques de thorax
(43,7%) que les patients VIH négatifs ; la différence a atteint
le seuil de signification statistique (p < 0,05). Par contre les patients
VIH négatifs présentant une péricardite liquidienne
montrent plus d'ascites (50%), de cardiomégalies à la
radiographie du thorax et plus d'altérations de la repolarisation
à l'E.C.G. (81% de bas voltage de QRS, 38% du sus-déclage segment
ST) que ne le font les patients VIH positifs.
La dépression immunitaire est évidente chez les
patients VIH positifs et classée selon les critères de CDC aux
stades d'infection VIH (A1-B1 avec 34,4% patients, A2-B2 avec 56,3% patients)
et de C1-C2 SIDA (9,3% patients).
Tableau 3 - Caractéristiques cliniques des
péricardites
chez les patients VIH positifs versus VIH
négatifs
|
Variables
|
VIH+
n = 32
|
VIH-
n = 32
|
p
|
|
Age (ans)
|
37 + 9,4
|
38 + 9,7
|
NS
|
|
Sex ratio (hommes/femmes)
|
1,5
|
1,7
|
NS
|
|
Plaintes
Toux
Douleurs thoraciques
Sudations nocturnes
Amaigrissement
|
92%
90%
70%
43%
|
82%
82%
40%
45%
|
NS
NS
<0,05
NS
|
|
Clinique
Frottement péricardique
Ascite
Classe Infection VIH/CD4
500/mm3
200-499/mm3, A1-B1
< 200/mm3, SIDA
|
48%
10%
34,4%
56,3%
9,3%
|
25%
50%
96%
4%
0%
|
NS
<0,05
<0,05
<0,05
NS
|
|
Rx Thorax
Coeur normal
Cardiomégalie
|
43,7%
56,3%
|
15,6%
84,4%
|
<0,05
<0,05
|
|
ECG
Bas voltage QRS
Sus-décalage ST
|
19%
0%
|
81%
38%
|
<0,05
<0,05
|
|
Echo-coeur
Epanchement modéré
Epanchement important
Dilatation VG
|
69%
31%
66%
|
63%
37%
22%
|
NS
NS
<0,05
|
|
Test Mantoux +
|
18%
|
25%
|
NS
|
Tableau 4 - Efficacité diagnostique du
cliché radiologique
du thorax pour la péricardite liquidienne
|
Efficacité
diagnostique
|
Péricardite
associée au VIH+
n = 32
|
Péricardite
du VIH-
n = 32
|
p
|
|
Sensibilité
|
56%
|
81%
|
<0,05
|
|
Valeur prédictive
positive
|
51%
|
60%
|
NS
|
|
Spécificité
|
83%
|
83%
|
NS
|
Si l'échocardiogramme apporte le diagnostic de
certitude de la péricardite liquidienne associée à
l'infection VIH, la radiographie du thorax apporte un nombre important de faux
négatifs (p<0,05). L'évaluation de l'efficacité
diagnostique du cliché radiologique du thorax pour la péricardite
- VIH versus la péricardite des sujets séronégatifs a
été réalisée par la sensibilité, la
spécificité et la valeur prédictive pour la
péricardite VIH+ (tableau 4).
Le système hématologique et les
mécanismes immunitaires sont plus altérés chez les
patients VIH positifs que chez les patients VIH négatifs (tableau 5) :
il existe au cours de l'infection à VIH une baisse hautement
significative de l'hémoglobine (8,6 + 1,8 g/dL), de lymphocytes
(3244,5 + 797,5/mm3, nombre absolu), d'éosinophiles
(306,7 + 129,7/mm3), de basophiles (16,4 +
12,2/mm3) et de CD4 (306,8 + 129,8/mm3) au seuil
de signification statistique pour p<0,001. Nous avons recherché la
corrélation entre le taux de CD4 et tous les paramètres
hématologiques par le test de Pearson. La figure 3 montre une
corrélation positive entre le nombre de cellules CD4 et celui des
éosinophiles chez les patients VIH positifs (r = 0,67 ; p <0,05).
Tableau 5 - Caractéristiques hématologiques
des péricardites
avec ou sans infection VIH
|
Variables
|
VIH+
|
VIH-
|
p
|
|
Hémoglobine (g/dL)
|
8,6 + 1,8
|
11,3+ 1,9
|
<0,01
|
|
Globules blancs/mm3
|
5128 + 1564
|
5112,5 + 1492
|
NS
|
|
Plaquettes (x103/mm3)
|
348,5 + 112,5
|
370,8 + 119
|
NS
|
|
Lymphocytes/mm3
|
3244,5 + 797,5
|
3750 + 964
|
<0,05
|
|
Monocytes/mm3
|
403,5 + 97
|
401,7 + 94,7
|
NS
|
|
Neutrophiles/mm3
|
4125,9 + 877,9
|
3818,8 + 1025
|
NS
|
|
Eosinophiles/mm3
|
306,7 + 129,7
|
463 + 99
|
<0,001
|
|
Basophiles/mm3
|
16,4 + 12,2
|
24 + 7,3
|
<0,001
|
|
CD4/mm3
|
306,8 + 129,8
|
1191 + 297
|
<0,001
|
p avec test t par paires
Figure 3
Corrélation positive entre le nombre absolu des
lymphocytes CD4 et le compte des éosinophiles au cours des
péricardites associées à l'infection VIH.
r = 0,68, p < 0,05
2.2.5. ETIOLOGIES DES PERICARDITES
A l'admission, une première ponction
péricardique a ramené un liquide sérohématique chez
les patients VIH positifs et un liquide séro-fibrineux chez les VIH
négatifs. Les résultats des analyses effectuées sur ce
liquide sont rapportés au tableau 6 : 75% (n = 24) de
péricardites liquidiennes sont d'étiologie tuberculeuse chez les
patients VIH négatifs contre 25% (n = 8) chez les VIH positifs
(différence significative avec p < 0,05) ; alors que 65,7% de
péricardites (n = 21) sont probablement déterminées par le
VIH et 9,3% (n = 3) par le sarcome de Kaposi dans le groupe VIH+.
Tableau 6 - Etiologie des péricardites à
l'admission
chez les VIH+ versus VIH-
|
Etiologie
|
VIH+
n = 32
|
VIH-
n = 32
|
p
|
|
Mycobacterium tuberculosis
|
8(25%)
|
24 (75%)
|
<0,05
|
|
Anoeba Hystolitica
|
0
|
1 (3%)
|
|
|
Staphylococcus aureus
|
0
|
4 (12%)
|
|
|
Sarcome de Kaposi
|
3 (9,3%)
|
0
|
|
|
Influenza
|
0
|
3 (9%)
|
|
|
VIH (probable)
|
21 (65,7%)
|
0
|
|
Une deuxième ponction péricardique a
été effectuée pour non assèchement de
l'épanchement péricardique au-delà de 10 semaines
d'évolution de 21 péricardites VIH probables. Le Mycobacterium
tuberculosis a été incriminé comme facteur
étiologique dans 19 cas/21 de péricardites (90,5%) et le sarcome
de Karposi dans 2 cas/21 (9,5%).
2.2.6. EVOLUTION DE L'INFECTION A VIH ET DE LA PERICARDITE
LIQUIDIENNE
L'évolution de l'immunodéficience est
particulière en trois ans : et en fonction de leur taux initial de CD4,
2 patients sur 11 (18%) avec CD4 500/mm3, 11 sur 18 (61%) avec
CD4compris entre 200 et 499/mm3 et 3 sur 3 (100%) avec
CD4<200/mm3 ont connu une progression vers le stade SIDA (Figure
4).
Figure 4
Taux de progression verssw le SIDA en 3 ans d'observation
par référence
au taux initial des CD4
Les manifestations cliniques du SIDA apparaissent dès
la deuxième année d'observation. Il s'agit souvent
d'amaigrissement > 10%, de la diarrhée chronique, de la fièvre
chronique, de la lymphadémopathie généralisée, de
la candidose oesophagienne et de la méningite à cryptocoque. Au
total 16 patients VIH positifs (50%) ont progressé vers le stade SIDA
endéans 3 ans, soit un taux de passage annuel vers le SIDA de 16,6%.
Les figures 5 et 6 présentent la fréquence
cumulée et liée au temps de l'incidence des péricardites
liquidiennes en présence ou non de l'infection à VIH. Au cours
de l'étude, une explosion de cas de péricardite liquidienne a
été notée chez les patients VIH positifs (r = 0,67 ; pente
= 0,50) alors que la fréquence des cas de péricardite liquidienne
VIH amorce une tendance à la baisse (r = 0,37 ; pente = 1,8).
Figure 5
Incidence mensuelle cumulée des péricardites
chez les sujets
séropositifs (HIV+) et séronégatifs
(HIV-) pour le VIH
Figure 6
Droites de régression théoriques
calculées en fonction de l'incidence mensuelle des péricardites
chez les patients VIH séropositifs (HIV+) versus
séronégatifs (HIV-) : impact de la pandémie VIH sur
l'incidence multipliée des péricardites chez le noir
africain.
La durée moyenne d'hospitalisation (10 semaines) est
similaire dans les deux groupes de patients. La mortalité
cumulée est plus élevée chez les VIH positifs (69%, 22/32)
que chez les VIH négatifs (19%, 6/32) avec une différence
statistique significative (p<0,001).
2.2.6. VALEUR PEJORATIVE DES EOSINOPHILES
La diminution du nombre absolu de CD4, signe de l'aggravation
du déficit immunitaire, est accompagnée d'une baisse
significative des éosinophiles (tableau 7) dans la péricardite
liquidienne associée à l'infection VIH. Un chiffre absolu
inférieur à 500 éosinophiles/mm3 est de mauvais
pronostic et un chiffre inférieur à 250/mm3 fait
craindre une immunodépression majeure à 3 ans d'évolution
: les taux de passage au SIDA à 3 ans en fonction du taux initial des
éosinophiles sont respectivement de 71% (10/14) si éosinophiles
< 250/mm3, de 45% (5/11) si éosinophiles entre 250 et
499/mm3
Tableau 7 - Progression vers le SIDA en 3 ans
selon le taux initial de CD4 et des
éosinophiles
|
Variables
|
Entrés
VIH+
1991
n
|
Devenus
SIDA
1994
n (%)
|
|
Eosinophiles/mm3
<250
200-499
>500
|
14
11
7
|
10 (71%)
5 (45%)
1 (14%)
|
|
CD4
500
200-499
<200
|
11
18
3
|
2 (18%)
11 (61%)
3 (100%)
|
et de 14% (1/7) si éosinophiles > 500/mm3
(Figure 7). Pour CD4 < 200/mm3, 100% des patients
évoluent vers le SIDA et pour CD4 200-499/mm3, 61%. Le taux
moyen des éosinophiles chez les patients VIH négatifs avec
péricardites tuberculeuses prédominantes (75%) a relativement
baissé (463/mm3 < 500/mm3). Cependant il
n'existe pas de correlation significative entre le nombre de CD4 et celui des
éosinophiles dans la péricardite des patients VIH négatifs
(r = - 0;,09, pente = - 0,27).
A la fin de l'étude, 50% (16/32) des patients avec
péricardites VIH+ sont passés au stade SIDA, soit un taux de
passage annuel de 16,6%.
Figure 7
Taux de progression vers le SIDA en 3 ans d'observations
par référence
au taux initial des CD4 et des éosinophiles.
2.2.7. EVOLUTION DES PERICARDITES AU COURS DE L'INFECTION
VIH
L'état général des patients VIH positifs
ayant présenté une péricardite liquidienne est
resté stable jusqu'au mois de juin 1994. Après, cinq patients
sur 32 (15%) avec un épanchement péricardique associé aux
lésions de sarcome de Kaposi généralisé sont
décédés dans un tableau de détresse respiratoire
malgré un traitement cytostatique par la Vincristine. Cette
mortalité au cours de l'infection par le VIH n'est pas différente
de celle survenue en cas de péricardites des séronégatifs
(25%, 8/32). Une quadruple association tuberculostatique constituée de
Rifampicine, d'Isoniazide, d'Ethambutol et de Pyrazinamide a été
appliquée chez 19 patients avec péricardite chronique
d'étiologie tuberculeuse prouvée. Les résultats
étaient concluants dans tous les cas. L'allure est plutôt
aiguë dans les péricardites d'étiologie VIH+ probable, mais
chronique en cas de surinfection tuberculeuse (opportuniste) du sujet VIH+
(Figure 8).
Figure 8
Allure évolutive des péricardites
associées à l'infection VIH en fonction de leurs
étiologies.
BK : Mycobacterium tuberculosis.
S. Kaposi : sarcome de Kaposi.
VIH+ : étiologie probable, virus VIH.
Etant donné les moyens diagnostiques limitézs
disponibles, le rôle des autres virus comme le cytomegalovirus ou
Coxsackie n'a pas pu être étudié dan,s la pahse aiguë
des péricardites.
2.3. DISCUSSION
En Afrique subsaharienne, la fréquence
élevée des péricardites liquidiennes associées
à l'infection VIH est de plus en plus rapportée au cours du
temps. Ce type de péricardites survient aux stades précoces de
l'infection VIH dans la majorité des travaux réalisés en
Afrique noire (MALU K. et al., 1988 ; CEGIELSKI J.P. et al., 1990 ;
TAELMAN H. et al., 1990 ; KAGAME et al., 1991). Mais deux études, une
première menée au Congo (BOURAMOUE C. et al., 1992) et une
deuxième au Zaïre (TONDUANGU K. et al., 1995), ont
révélé la survenue des péricardites liquidiennes au
stade SIDA (CDC, 1993) chez le Noir africain.
En étudiant de manière rétrospective les
aspects cliniques et étiologiques des péricardites aiguës
chez 34 patients zaïrois infectés par le VIH admis entre 1985 et
1986, nous avons noté leur prévalence portée à
12,4%, taux six fois plus élevé que celui d'avant
l'épidémie du SIDA à Kinshasa (BEHEYT et al., 1977 ;
MBARAGA N. et al., 1984) et taux tendant au double de celui observé en
1968 (7%) à Abidjan (BERTRAND Ed. et al., 1968).
Au plan étiologique des péricardites, le
Mycobacterium tuberculosis qui dominait le tableau étiologique de ces
affections chez le sujet noir masculin avant l'explosion des cas
infectés par le VIH, a cédé la place au rôle
probable du VIH au stade aigu de la péricardite associée aux
stades précoces de l'infection VIH. Aussi 50% de péricardites
rapportées en 1988 par le Zaïre (MALU K. et al., 1988) et 72% en
1990 par la Tanzanie (CEGIELSKI J..P. et al., 1990) sont étroitement
associées à la présence de l'infection VIH. Cependant, au
fur et à mesure que l'infection VIH progresse en Afrique, l'association
de la tuberculose et de l'infection VIH devient on ne peut plus significative.
Parmi les péricardites tuberculeuses confirmées, il a
été noté 91% de cas chez des sujets rwandais au stade non
défini de l'infection VIH (KAGAME et al., 1991), 72% (60% à
l'état non précisé de l'infection VIH et 12% au stade SIDA
de CDC 1993) chez des patients de Tanzanie (CEGIELSKI J.P. et al., 1990) et
91,3% chez des patients au stade SIDA du Zaïre (TONDUANGU K. et al.,
1995).
Dans le milieu hospitalier du Zaïre, cette forme de
péricardite-VIH semble frapper surtout le sujet du sexe féminin.
Elle passe inaperçue pour un clinicien non averti. L'amaigrissement
dans 100% des cas, la fièvre dans 88,2%, la pneumopathie à
pneumocystis carinii dans 29,4% et la candidose buccopharyngée dans
29,4% constituent le tableau clinique de l'infection à VIH. Les
aspects échocardiographiques de ces péricardites-VIH montrent un
espace clair postérieur ne dépassant pas 5 mm.
Aux Etats-Unis, la péricardite avec ou sans signes de
tamponnade a été la première manifestation cardiaque
rapportée chez les patients atteints de SIDA (HERSKOWITZ A.H. et al.,
1989) comme nous l'avons noté aussi. Le mérite des études
américaines réside dans le fait d'avoir isolé plusieurs
agents étiologiques :
- cancers (CAMMAROSANO C. et al., 1985)
- cyptococcus neoformans (BRIVET F. et al., 1987)
- mycobacterium tuberculosis (D'CRUZ I.A. et al., 1986)
- mycobacterium avium-intracellulare (WOODS G. et al.,
1989)
- herpes simplex (FREEDBERG R.S. et al., 1987)
- nocardia asteroides ou actinomycetales (HOLTZ M.A. et al.,
1985).
Notre étude rapporte la présence des
péricardites au cours de l'infection à VIH. Le mécanisme
d'action du VIH sur le péricarde nous paraît obscur. Deux
hypothèses peuvent être avancées : la présence des
infections opportunistes à affinité cardiaque et l'atteinte
immunologique par complexes immuns des tuniques cardiaques. Aucune
péricardite fungique n'a été constatée dans notre
série contrairement à l'atteinte fungique du péricarde des
séries de la littérature (CAMMAROSANO C. et LEWIS, 1985 ;
OLUWOLE et al., 1985 ; ACIERNO L.J., 1989). Il n'a pas été
possible d'isoler certains virus opportunistes tels que le cytomegalovirus. Le
cytomegalovirus a été incriminé comme agent
étiologique d'une péricardite avec tamponnade au cours du SIDA en
Amérique (NATHAN P.E. et al., 1991). L'invasion néoplasique par
le sarcome de Kaposi généralisé a été
observée chez deux de nos patients. Le liquide péricardique est
stérile chez 100% de nos patients comme l'a rapporté aussi
Auringer (AURINGER S.T. et al., 1993).
Au plan clinique, la douleur thoracique atypique (94%), la
fièvre (88%), l'amaigrissement (100%) et le frottement
péricardique (59%) sont des signes habituellement
présentés par les patients.
L'hypothèse de travail de la partie prospective
menée de 1991 à 1994 était de démontrer que la
recrudescence des péricardites liquidiennes était liée
à l'augmentation de l'incidence de la tuberculose en association avec
l'infection VIH dans les pays en voie de développement en
général et dans les pays africains en particulier (BLASER M.J.,
1986 ; QUINN T.C. et al., 1986) et que la prévalence des cas de
tuberculose extra-pulmonaire était la plus élevée parmi
les sujets infectés par le VIH (CHAISSON R.E. et al., 1987 ; PITCHENIK
A.E. et al., 1984 ; PITCHENICK A.E. et al., 1987 ; NOBLE O., FOWLER, 1991
; DALLI E. et al., 1987 ; TONDUANGU K. et al., 1995). Cette hypothèse
demeure spéculative à l'état actuel de nos connaissances
sur le VIH et surtout de l'infrastrusture sanitaire défavorisée
de l'Afrique noire incapable d'évaluer l'étiologie exacte de ces
péricardites. En relation avec la misère de la population
africaine aggravée par l'infection VIH ne permettant pas à
l'Afrique subsaharienne de poser souvent le diagnotisc indirect
(sérologie VIH par ELISA, Radio-immunoprécipitation ou RIPA,
Western Blot) ou le diagnostic direct (détection des antigènes
VIH par PCR) de l'infection par le VIH et en prenant le nombre de CD4 comme
référence, de nouveaux facteurs pronostiques de la biologie
sanguine de très bon marché ont été
recherchés dans la péricardite associée à
l'infection VIH.
Le tableau clinique des péricardites associées
à l'infection par le VIH diffère de celui des péricardites
survenant chez des sujets séronégatifs : apparition aux stades
précoces de l'infection VIH de sudations nocturnes et d'une dilatation
du ventricule gauche. La radiographie du thorax (peu sensible) et
l'électrocardiogramme (peu sensible) sont superflus dans l'exploration
fonctionnelle d'une péricardite associée à l'infection par
le VIH ; mais ces examens détectent comme d'habitude la
cardiomégalie (radiographie du thorax) et le sus-décalage du
segement ST avec concavité supérieure (ECG) dans la
péricardite survenue chez les séronégatifs pour le VIH.
Les facteurs étiologiques des péricardites
associées au VIH varient selon le temps et le degré du
déficit immunitaire : aux stades pre-SIDA d'infection par le VIH
(IVA-IVB), le VIH (65,7%) et la tuberculose (25%) en sont les principales
causes alors qu'au stade CDC du SIDA la tuberculose (90,5%) en est presque
l'unique cause. Le sarcome de Kaposi détermine la péricardite
associée au VIH dans des proportions similaires dans l'état
d'infection VIH (9,3%) et dans l'état de SIDA (9,5%).
La tuberculose est incriminée dans 75% des
péricardites survenues chez les patients séronégatifs pour
le VIH. La prévalence très élevée (90,5%) de la
tuberculose dans la péricardite associée au SIDA dans la
présente étude confirme par ailleurs certaines études
antérieures menées en Tanzanie, au Rwanda et au Congo (CEGIELSKI
J.P. et al., 1990 ; TAELMAN H. et al., 1990 ; BOURAMOUE C. et al., 1992).
Cette forte prévalence de la tuberculose comme étiologie des
péricardites du Zaïrois avec ou sans SIDA confirme son lien fort
étroit avec l'infection par le VIH comme rapporté aux Etats-Unis
d'Amérique (CDC, 1988 ; HANDWERGER S. et al., 1987) et surtout dans les
pays en voie de développement (BLASER M.J., 1986 ; QUINN T.C. et al.,
1986), tout comme la tuberculose extrapulmonaire est si fréquente chez
les sujets infectés (CHAISSON R.E. et al., 1987 ; PITCHENIK A.E. et al.,
1984 ; PITCHENIK A.E. et al., 1987).
L'ascite a été plus rencontrée (50%) dans
les péricardites tuberculeuses des sujets séronégatifs que
dans celles associées à l'infection par le VIH (10%). Dans ce
contexte l'ascite signe l'apparition de la péricardite constrictive due
à la tuberculose comme souvent rapportée dans les pays en voie de
développement (LORELL B.H., BRAUNWALD E., 1988).
Le fait que 18% des patients infectés par le VIH
développent une anergie tuberculinique, proportion du reste
statistiquement non différente de ceux des patients
séronégatifs pour le VIH (25%) et de la population
générale de l'Afrique noire, suggère que les patients ont
été examinés aux stades précoces de leur
immunodéficience acquise liée au VIH.
Au cours de l'infection par le VIH les péricardites
persistent au-delà d'une moyenne de 10 semaines d'hospitalisation chez
65,7 % de patients infectés au stade de SIDA.
L'évolution des péricardites est stable chez 80%
(17/21 patients) des patients infectés par le VIH et traités par
une quadruple association constituée de Rifampicine, d'Isoniaziole,
d'Ethambutol et de Pyrazinamide pendant deux mois et de la bi-association
Rifampicine et Isoniazide les quatre mois restants.
Il est recommandé de situer le stade de l'infection VIH
en cas de tuberculose afin de rendre efficient le traitement antituberculeux
des patients séropositifs pour le VIH (RUBIN R.H., 1991).
Malheureusement il n'est pas aisé d'obtenir chez tous les patients de
l'Afrique subsaharienne le compte de CD4 qui est étroitement
correlé au degré du déficit immunitaire (STEIN et al.,
1992). Le taux de lymphocytes et le nombre absolu des CD4 restent dans les
limites normales chez les tuberculeurx séronégatifs. Cependant
il est noté une baisse significative des lymphocytes et des CD4 chez les
tuberculeurx infectés par le VIH.
Plusieurs constantes hématologiques sont
altérées d'une manière significative chez les
infectés par le VIH : l'anémie, la diminution des
éosinophiles et des basophiles. Seule la numération des
éosinophiles donne une corrélation positive avec le compte des
CD4 chez les patients avec une infection par le VIH. En Afrique subsaharienne
l'éosinophilie accompagne souvent différentes helminthiases. Les
deux groupes de patients infectés ou non par le VIH sont comparables
devant le risque de l'infestation parasitaire. L'hyperéosinophilie est
plutôt observée dans la tuberculose résistante (YONG A.J.
et al., 1989). La diminution des éosinophiles des patients VIH positifs
serait probablement déterminée par l'infection VIH. Les
éosinophiles seraient probablement de nouvelles cibles du VIH qui in
vitro y subirait une replication (FREEDMAN et al., 1991). En outre, les
cytokines (granulocyte/macrophage colony stimulating factor et interleukin 5 ou
IL-5) jouent un rôle non négligeable dans la physiologie des
éosinophiles (CLUTTERBUCK et al., 1989). L'anomalie de la production de
IL-5 pourrait augmenter le rythme pré-établi de la mort
cellulaire au niveau des éosinophiles de l'homme (STERN M. et al.,
1992). Ainsi, l'infection par le VIH pourrait induire la baisse du nombre des
éosinophiles au niveau du sang périphérique par un
dérèglement de la synthèse des cytokines (CLERICI M.,
1993) ou par une destruction directe des éosinophiles, sinon par les
deux mécanismes. Cette diminution des éosinophiles progresse
avec l'évolution de l'infection à VIH. L'intérêt
des éosinophiles est aussi grand dans l'évaluation du taux de
passage des patients de l'état de séropositif VIH au stade SIDA
en prenant le nombre des CD4 comme référence. La proportion des
patients passés au stade de SIDA selon le taux initial des
éosinophiles (16 patients) est plus importante quand le nombre des
éosinophiles devient inférieur à 250/mm3.
Au cours du temps l'incidence de péricardites
associées à l'infection par le VIH épouse une allure
épidémique alors que celle des péricardites des sujets
séronégatifs tend à décroître. La
mortalité est identique dans les deux types de péricardites.
CHAPITRE III - TABLEAU CLINIQUE DES ATTEINTES
CARDIAQUES AU COURS DU SIDA
3.1. IMPORTANCE DU SUJET
L'invasion du péricarde par le virus VIH décrite
au chapitre II a retenu notre attention sur la place de la pathologie cardiaque
au cours du SIDA.
Dans la littérature, l'atteinte myocardique
associée au SIDA est devenue une réalité aujourd'hui sur
le plan histologique, et retrouvée dans 50% des cas au cours des
séries autopsiques (ANDERSON D.W. et al., 1988 ; REILLY J.M. et al.,
1988 ; BAROLDI G. et al., 1988 ; CAMMAROSANO C., LEWIS W., 1985 ; SILVER M.A.
et al., 1984). Son expression clinique est paucisymptomatique puisque une
dysfonction ventriculaire gauche prouvée n'est notée que dans 10%
des myocardites histologiques (REILLY J.M. et al., 1988 ; LASSAIGNE D. et al.,
1991 ; LAFONT A. et al., 1988). D'autres observations autopsiques ont
montré des lésions chez 28 à 72% des patients
décédés de SIDA, le coeur étant la cause du
décès dans 7% des cas (VULLIEMIN P., LEDUC D., 1993 ; MARTIN R.P.
et al., 1980 ; FINK L. et al., 1984 ; MONSUEZ J. et al., 1988).
Toutefois, les atteintes du coeur sont réelles et
regroupées en quatre rubriques : cardiomyopathies, localisations
cardiaques des cancers, localisations cardiaques des affections opportunistes
et diverses atteintes (péricardites, endocardites marastiques). Dans
l'ensemble, l'impression clinique est à la rareté de ces
complications cardiaques dont les unes sont bruyantes (embolies
périphériques, insuffisance cardiaque, tamponnade, troubles du
rythme ventriculaire) (ANDERSON D.W. et al., 1988 ; BEAUDET B. et al., 1988 ;
COHEN I.S. et al., 1986 ; FINK L. et al., 1984 ; KAMINSKY H.J. et al., 1988 ;
LEVY W.S. et al., 1988) mais les autres asymptomatiques (D'IVERNOIS C. et al.,
1991 ; VULLIEMIN P. et LEDUC D., 1993).
La fréquence des anomalies échocardiographiques
chez des patients infectés par le VIH (sérologie positive) et
présentant des signes cliniques d'immunodéficience peut
s'élever jusqu'à 55% des cas, atteintes dues à des
épanchements péricardiques, des masses intracavitaires, des
végétations ou l'altération de la contractibilité
(CORALLO S. et al., 1988 ; FINK L. et al., 1984 ; LEVY W.S. et al., 1989).
Cependant, il n'est pas facile d'attribuer à une cause cardiaque des
symptômes aussi vagues qu'une fièvre, une tachycardie et une
dyspnée rencontrées chez des patients sidéens aux
atteintes multiviscérales intriquées.
Chez les patients au stade de SIDA aux USA, la
mortalité d'origine exclusivement cardiaque s'élève
à 10% (ANDERSON D.W. et al., 1988 ; WELCH K. et al., 1984).
Ces données cliniques et autopsiques sont
observées dans des régions géographiques
différentes de l'Afrique noire et à différents stades ou
liées à différents modes de transmission du virus VIH.
Elles ne peuvent donc naïvement pas être comparées à
nos données. Il est donc urgent de passer en revue nos connaissances
sur les lésions cardiaques chez le noir infecté par le VIH.
L'absence d'une étude large visant un dépistage
systématique des atteintes cardiaques au cours de l'infection à
VIH chez 83 patients noirs nous a stimulé à décrire leurs
manifestations cardiaques et à déterminer la prévalence,
l'évolution naturelle, les différents aspects cliniques,
électrocardiographiques, échocardiographiques et radiologiques de
ces atteintes cardiaques.
L'hypothèse de travail est que l'excès
d'atteintes cardiaques serait attribué à l'infection par le VIH.
Elle a été testée en comparant les anomalies cardiaques de
166 patients infectés par le VIH à celles de 38 patients
séronégatifs pour le VIH et souffrant de cardiopathies non
athéromateuses (péricardites amibiennes chez 10 patients,
cardiopathies de 10 sicklanémiques et 18 cas de cardiomyopathie
dilatée idiopathique).
3.2. RESULTATS
I. DEPISTAGE DES CARDIOPATHIES ASSOCIEES A L'INFECTION
VIH
3.2.1. CARACTERISTIQUES DEMOGRAPHIQUES
a. Age et sexe
Quatre vingt trois patients (49 hommes et 34 femmes) et
âgés de 15 à 52 ans (33,16 + 8,09 ans) ont
volontairement accepté de faire partie de notre population
d'études. L'âge moyen des hommes (34,46 + 8,02 ans) ne
montre pas de différence significative par rapport à celui des
femmes (31,26 + 7,91 ans) (Figure 9).
Figure 9
Age et sexe des patients infectés par le
VIH
b. Impact matrimonial et économique
Le caractère hétérosexuel de la
transmission du VIH en Afrique est démontré par la
prévalence élevée de célibataires avec plusieurs
partenaires de sexe opposé (54%) et de mariés (42%) (Figure
10).
Figure 10
Etat civil des patients avec infection VIH
La misère est la deuxième condition de ces
patients : 66% des patients proviennent d'un milieu économiquement bas
et 30% d'un niveau socio-économique moyen.
3.2.1. INVESTIGATIONS CLINIQUES
a. Aspects cliniques
L'amaigrissement, l'asthénie et la fièvre ont
été les signes majeurs de l'infection VIH (Tableau 8). Il
s'agit d'une infection par le VIH au stade IV, A du CDC.
Tableau 8 - Les manifestations cliniques extra-cardiaques
de l'infection à VIH
|
Signes cliniques
|
Nombre de cas
|
Pourcentage
|
|
Amaigrissement
Asthénie
Fièvre au long cours
Candidose buccale
Prurigo
Diarrhée chronique
Zona
Tuberculose pulmonaire
Kaposi généralisé
|
81
76
61
32
32
22
15
13
2
|
97,6
91,6
73,5
38,6
38,6
26,5
18,1
15,7
2,4
|
La symptomatologie cardiovasculaire est dominée par la
dyspnée classée entre les stades II et IV de la New York Heart
Association (NYHA). Les douleurs thoraciques atypiques, la toux rebelle et les
palpitations sont fréquemment rapportées. Mais 46% des patients
restent asymptomatiques.
A l'examen du coeur, la tachycardie, l'assourdissement des
bruits cardiaques et la décompensation cardiaque viennent en tête
des signes cardio-vasculaires.
b. Enregistrement électrocardiographique
Quarante patients (48,2%) montrent un ECG normal, par contre
43 (51,8%) présentent un ECG pathologique caractérisé par
une tachycardie sinusale, de troubles diffus de la repolarisation, un bas
voltage des complexes QRS et une hypertrophie ventriculaire gauche. (Tableau
9).
Tableau 9 - Les aspects électrocardiographiques
des péricardites
associées à l'infection VIH
|
Signes cliniques
|
Nombre de cas
|
Pourcentage
|
|
ECG normal
Tachycardie sinusale
Troubles diffus de la repolarisation
Bas volgage QRS
Hypertrophie ventriculaire gauche
Alternance électrique
Hypertrophie auriculaire gauche
Bloc debtranche gauche
Extrasystoles ventriculaires
Lésions de nécrose
Tachycardie ventriculaire
|
40
32
22
18
9
2
1
1
1
1
1
|
48,2
38,6
26,5
21,6
10,8
2,4
1,2
1,2
1,2
|
c. Données échocardiographiques
Quarante quatre patients (53%) présentent un
échocardiogramme normal. 39 patients (47%) présentent un
épanchement péricardique (27,2%), une cardiomyopathie
dilatée (18,1%) et une végétation au niveau de la valve
mitrale (1,2%).
d. Aspects radiologiques
Le volume du coeur est normal chez 46 patients (55,4%). Une
cardiomégalie est notée chez 37 patients (44,6%).
e. Hémocultures
Le diagnostic d'endocardite infectieuse à Salmonella
enteritidis a été confirmé par 4 hémocultures chez
une jeune prostituée de 22 ans (1,2%). Ce diagnostic a
été suggéré par une fièvre prolongée
et par l'échocardiogramme.
3.2.2. PERICARDITE LIQUIDIENNE
La tachycardie sinusale (82,6%), l'altération diffuse
de la repolarisation à l'ECG (65,2%) et la dyspnée (stades II -
IV NYHA) caractérisent la péricardite liquidienne au cours du
SIDA. L'importance de l'épanchement péricardique est de moindre
ampleur dans la majorité des cas (47,8%). L'examen radiologique du
thorax à incidence de face montre une silhouette cardiaque normale chez
2 patients (9%) alors que l'échocardiogramme met en évidence un
épanchement péricardique modéré chez ces deux
patients.
Le liquide d'épanchement péricardique,
hémorragique ou jaune citrin, se révèle un exsudat
stérile.
3.2.3. CARDIOMYOPATHIE DILATEE
Au cours du SIDA, 14 patients (16,9%) ont
présenté une dilatation de toutes les cavités cardiaques.
La dyspnée (100%) fonctionnellement classée entre les stades II
et IV de la NYHA et la tachycardie sinusale (71,4%) sont les faits cliniques
les plus fréquents. Il existe un effondrement de la fraction
d'éjection et du pourcentage de raccourcissement avec une
régurgitation mitrale chez 12 patients (85,7%). Tous les 14 patients
(100%) ont présenté une cardiomégalie à la
radiographie du thorax avec un index cardiothoracique (ICT) compris entre 0,51
et 0,60.
II. INFLUENCE DE L'INFECTION VIH SUR LA FREQUENCE DES
CARDIOPATHIES
3.2.4. DONNEES CLINIQUES ET IMMUNOLOGIQUES
La population d'étude appariée pour l'âge
et le sexe (tableau 10) est constituée de 166 patients infectés
par le VIH et 38 patients séronégatifs pour le VIH. Au plan
immunitaire, 114 (69%) sur 166 sont au stade A de l'infection VIH et 52 (31%)
sur 166 sont au stade C3 SIDA selon les critères du CDC 1993. Les 38
patients séronégatifs et cardiopathes connus du service ont servi
de groupe de contrôle aux sujets VIH positifs (tableau 10).
Tableau 10 - Caractéristiques
générales des patients VIH+ ou VIH-
|
VIH+
n = 166
|
VIH-
n = 38
|
p
|
|
Hommes
|
98
|
20
|
|
|
Femmes
|
64
|
18
|
|
|
Sex ratio (H/F)
|
1,4
|
1,1
|
NS
|
|
Age (15-52 ans)
|
33 + 8
|
31,8 + 7,5
|
NS
|
|
Infection VIH
Stade ACDC
|
114
|
0
|
|
|
SIDA
Stades C3, CDC
|
52
|
0
|
|
Au plan fonctionnel, 67 patients VIH positifs (40,4%) sont
plus dyspnéiques que 5 (13%) sujets de contrôle (p = 0,003) et il
y a plus d'anomalies échocardiographiques chez 47 VIH positifs (28,3%)
que chez 5 (13%) sujets témoins (p = 0,035) ; les différences
sont statistiquement significatives (tableau 11).
Tableau 11 - Exploration fonctionnelle
cardiovasculaire
chez les sujets VIH positifs ou non
|
VIH+
n = 166
|
VIH-
n = 38
|
p
|
|
Pas de plaintes cardiaques
|
52 (31,3%)
|
13 (34,2%)
|
NS
|
|
Dyspnée II - IV NYHA
|
67 (40,4%)
|
5 (13%)
|
0,003
|
|
Anomalies Echo-coeur
|
47 (28,3%)
|
5 (13%)
|
0,035
|
|
Anomalies ECG
|
41 (24,7%)
|
5 (13%)
|
NS
|
A l'échocardiogramme, la dilatation du VG est similaire
chez les patients avec immunodéficit immunitaire (VIH + versus SIDA, p =
NS) mais elle accuse une différence statistiquement significative entre
les séronégatifs pour le VIH et ceux du stade SIDA (p < 0,05)
et entre les séropositifs pour le VIH et les séronégatifs
(p > 0,002) (Figure 11).
Figure 11
Diagramme en boîte avec moustaches de la
distribution des diamètres télédiastoliques du ventricule
gauche (VGDD) selon le stade immunitaire pour le VIH.
Dilatation cavitaire gauche importante chez les patients
séropositifs.
·
·
· : Etendue, premier
quartile, médiane, troisoième quartile, étendue.
La fonction systolique évaluée par le
pourcentage de raccourcissement est normale chez les VIH positifs (%R = 29,2
+ 11,9) et chez les VIH négatifs (%R = 28,9 + 5) sans
aucune différence statistique (p = NS) entre eux, mais elle est
effondrée au stade SIDA avec une différence statistiquement
significative (p < 0,01) par rapport aux deux stades ci-haut cités
(Figure 12).
Figure 12
Moyenne #177; écart-type du pourcentage de
raccourcissement (%R) en fonction de l'état immunitaire pour le VIH des
patients.
Fonction systolique effondrée au stade SIDA.
3.3. DISCUSSION
Toutes les tuniques cardiaques présentent des anomalies
au cours de l'infection par le VIH (BLANC P. et al., 1990 ; D'IVERNOIS C. et
al., 1991 ; FRANCIS C.K., 1990 ; CAMMAROSANO C., 1985 ; FINK et al., 1984
; REITANO et al., 1984 ; COHEN I.S. et al., 1986).
Plusieurs facteurs étiologiques interviennent
isolément ou conjointement dans les myocardites et les cardiomyopathies
au cours de l'infection VIH. Près de 80% de ces atteintes cardiaques
épousent une allure primitive (idiopathique). Au point de vue
étiologique, plusieurs hypothèses peuvent être
envisagées : le virus VIH lui-même (GRODY W.W. et al., 1990 ;
CALABRESE L.H. et al., 1987 ; HO D.D. et al., 1987 ; HERSKOWITZ A. et al.,
1992), des virus opportunistes comme le cytomégalovirus (PARRAVICINI et
al., 1992 ; WI T.C. et al., 1992), des réactions auto-immunes (GRODY
W.W. et al., 1990 ; TURNICKY R.P. et al., 1992), l'effet toxique des
catécholamines, des anthracyclines, de l'interféron alpha
(BAROLDI G. et al., 1988 ; REILLY J.M. et al., 1988 ; DEYTON L.R. et al.,
1989) et des carences vitaminiques ou nutritionnelles par déficit en
sélénium ou en L-carnitine (COTTON P., 1990 ; DE SIMONE C. et
al., 1992 ; DWORKIN B.M. et al., 1989 ; KAVANAUGH-MAC et al., 1989 ;
LAFONT A. et al., 1989), des agents infectieux comme le Mycobacterium
tuberculosis, le Mycobacterium avium intracellulaire (MAIL), le toxoplasme
gondii, le cryptococcus neoformans et l'actinomycète (ANDERSON E.L. et
al., 1989 ; BAROLDI G. et al., 1988 ; BERTRAND Ed., 1992 ; COX J.N. et al.,
1990 ; BAUDET B. et al., 1988 ; HOFFMAN P. et al., 1990 ; KAPILA R., 1985
; LUCAS S. et al., 1992 ; SCHONHEYDER H. et al., 1992). Mais il faut souligner
que dans plusieurs cas, aucune étiologie n'a été
retrouvée (BERTRAND Ed., 1992 ; CORBOY J.R. et al., 1987).
Le rôle du VIH est de plus en plus cité comme
facteur étiologique des myocardites et des cardiomyopathies
dilatées (BERTRAND Ed., 1992 ; BOURAMOUE C. et al., 1992 ;
CALABRESE L.H. et al., 1987 ; CENACCHI G. et al., 1990 ; FLOMENBAUM M. et al.,
1989 ; GRODY W.W. et al., 1990). Le VIH a été isolé dans
le myocarde d'un patient avec cardiomyopathie dilatée (CALABRESE L.H. et
al., 1987).
Nous avons examiné 83 patients infectés par le
VIH dont 49 hommes et 34 femmes. Le sexe ratio est de 1,4 en faveur du sexe
masculin. L'infection VIH touche indistinctement les deux sexes dans notre
étude menée au Zaïre, observation déjà
publiée par d'autres auteurs (COLEBUNDERS R. et al., 1986 ; ODIO W. et
al., 1985 ; PIOT P. et al., 1984). La moyenne d'âge des patients de
notre série est de 33,16 + 8,09 ans (extrêmes 15 et 52
ans). Il n'y a pas de différence statistiquement significative entre
l'âge moyen des hommes (34,46 + 8,024 ans) et celui des femmes
(31,26 + 7,91 ans). La maladie touche l'adulte jeune. Ceci confirme
les constatations antérieurement faites sur le Zaïre (COLEBUNDERS
R. et al., 1986 ; ODIO W. et al., 1985 ; PIOT P. et al., 1984). La même
tranche d'âge (34,6 + 5,4 ans) a été
rapportée aussi en Italie (DE CASTRO S. et al., 1992).
La maladie demeure de transmission
hétérosexuelle dans notre étude (54% des
célibataires, 42% des mariés et 4% des veufs dont les conjoints
sont décédés de l'infection VIH), contrairement aux
milieux occidentaux où les homosexuels et les drogués constituent
des groupes à haut risque (COLEBUNDERS R. et al., 1986 ; GENTILINI M. et
al., 1988 ; ODIO W. et al., 1985 ; PIOT P. et al., 1984 ; DE CASTRO S. et al.,
1992 ; VAN HOEVEN K.H. et al., 1990 ; KAUL S. et al., 1991 ; AKHRAS F. et
al., 1994 ; HECHT S.R. et al., 1989). La fréquence des atteintes
cardiaques au cours de l'infection VIH est difficile à apprécier,
elle varie d'un auteur à l'autre en fonction de la définition
donnée et de la nature des séries qui sont autopsiques ou
échocardiographiques (BERTRAND Ed., 1992 ; D'IVERNOIS C. et al., 1991 ;
FRANCIS C.K., 1990). Selon les séries autopsiques, le coeur est atteint
dans 25 à 72% des cas (ANDERSON D.W. et al., 1988 ; BAROLDI G. et al.,
1988 ; BERTRAND Ed., 1992 ; BLANC P. et al., 1990 ; FRANCIS C.K., 1990 ;
HOFFMAN P. et al., 1990 ; LUCAS S. et al., 1992 ; VULLIEMIN P. et al., 1993 ;
MARTIN R.P. et al., 1980 ; FINK L. et al., 1984 ; MONSUEZ J. et al., 1988).
371 autopsies effectuées chez des noirs ivoiriens
décédés de SIDA montrent 36,6% d'atteintes myocardiques,
28,8% d'atteintes péricardiques, 6,95% d'atteintes néoplasiques
et 2,96% d'atteintes endocardiques (BERTRAND Ed., 1992).
Notre série étudie les aspects cliniques,
électrocardiographiques, radiologiques et échocardiographiques.
Chez 54,2% des patients symptomatiques (45,8% asymptomatiques), la
symptomatologie au plan cardiovasculaire est dominée par la
dyspnée (stades II-IV NYHA) et la tachycardie alors que l'examen
clinique montre seulement 13,3% des cas d'insuffisance cardiaque globale et
rarement un frottement péricardique, un assourdissement des bruits
cardiaques ou une tamponnade. L'électrocardiogramme effectué
chez nos patients dessine un tracé normal chez 40 patients (48,2%) et
des altérations atypiques chez 43 patients (51,8%) avec
prédominance d'une tachycardie sinusale. A l'échocardiogramme,
nous notons 23 cas (27,7%) de péricardite liquidienne, 14 cas (18,1%) de
cardiomyopathie dilatée avec un effondrement de la fonction systolique
chez tous les patients et 1 cas d'endocardite infectieuse (1,2%). Dans
d'autres villes africaines, la fréquence des lésions cardiaques
est plus élevée en tout ou en partie : 61% des cas de
cardiomyopathie dilatée, 35,1% des cas de péricardite liquidienne
et 3,9% des cas d'endocardite infectieuse à Brazzaville (BOURAHOUE C. et
al., 1992) ; 26,6% des cas de cardiomyopathie dilatée et 10% des
cas de péricardite liquidienne à Ouagadougou (BOGUI-FERRONA et
al., 1992) et une fréquence égale de 23% pour les cas de
cardiomyopathie dilatée et de péricardite liquidienne à
Abidjan (BERTAND Ed., 1992). Mais la fréquence des complications
cardiaques dans notre série se rapproche de celle des pays occidentaux
avec 23% des cas de péricardites en général (MARTIN R.P.
et al., 1980 ; REILLY J.M. et al., 1988 ; ANDERSON D.W. et al., 1988 ;
CAMMAROSANO C. et al., 1985 ; FINK L. et al., 1984 ; MONSUEZ J. et al., 1988 ;
KAUL S. et al., 1991 ; LEVY W.S. et al., 1989 ; BLANCHARD D.G. et al., 1991 ;
CORALLO S. et al., 1988 ; STEFFEN H.M. et al., 1991 ; HIMELMAN R.B. et al.,
1989 ; KINNEY E.L. et al., 1989) et 26% des péricardites chez les
homosexuels de New-York (HECHT S.R. et al., 1989). Dans la présente
étude, 19% de nos patients avec péricardite liquidienne patente
à l'échocardiographie présentent une silhouette cardiaque
normale à la radiographie du thorax à incidence de face.
La fonction systolique du ventricule gauche est
effondrée chez tous nos patients avec cardiomyopathie dilatée.
Doit-on considérer le virus VIH responsable des lésions
cardiaques rencontrées ? Des réserves sont permises dans
l'établissement des liens de causalité entre la présence
du VIH et les lésions découvertes in situ. Certains auteurs sont
affirmatifs en attribuant toutes les lésions myocardiques au virus VIH
(GRODY W.W. et al., 1990 ; FLOMENBAUM Metal, 1989 ; CALABRESE L.H. et al.,
1987).
La littérature européenne rapporte aussi comme
nous la rareté des endocardites infectieuses au cours du SIDA, sauf chez
les toxicomanes qui présentent une prévalence très
élevée de l'ordre de 31% (D'IVERNOIS C. et al., 1991 ; VULLIEMIN
P., 1993 ; MINARDI G. et al., 1991). Ces endocardites infectieuses sont
déterminées par l'Aspergillus fumigatus, les Listeria
monocytogenes et par la Salmonella thyphimurium (ACIERNO L.J., 1989 ; BERTRAND
Ed., 1992 ; BOURAMOUE C. et al., 1992).
Le seul cas d'endocardite infectieuse à Salmonella
enteritidis rapporté par notre travail confirme la rareté de la
détermination endocarditique de la Salmonella comme déjà
signalée dans la littérature (PITCHENIK A.E. et al., 1983).
Contrairement aux patients africains ne recevant pas de traitement
antiretroviral ; les batériémies à Salmonelles non
typhiques sont fréquentes chez les américains ou européens
traités par la Zidovudine (SALMON C.D. et al., 1992 ; SMITH P.D. et al.,
1985). A l'autopsie, l'endocardite thrombotique abactérienne
(marastique) est souvent observée chez 5 à 7% des
immunodéprimés VIH (LEWIS W., 1989 ; CAMMAROSOANO C., LEWIS W.,
1985).
Tous nos patients sont au stade A de l'infection par le VIH
selon les critères du CDC (1993), fait confirmé par De Castro S.
et al ailleurs (DE CASTRO S. et al., 1992).
Ce travail a établi le rôle de l'infection VIH
sur l'excès des atteintes cardiaques observées ces dix
dernières années en Afrique subsaharienne. En comparant 166
patients cardiaques infectés par le VIH à 38 cardiopathes VIH
négatifs, nous trouvons 28,3% d'anomalies échocardiographiques
avec dilatation du VG à tous les stades de l'infection par le VIH contre
13% chez les séronégatifs (p = 0,035), proportion identique
à celle de Lipman en milieu londonien (28,3%) mais deux fois
inférieure à celle de Caggese (56%) selon Lanfranchi (LANFRANCHI
J. et al., 1993).
La symptomatologie cardiovasculaire est plus présente
chez les cardiaques infectés par le VIH que chez les cardiaques
séronégatifs : la dyspnée fonctionnellement comprise entre
les classes II et IV de la NYHA est retrouvée chez 40,4% de sujets
infectés par le VIH et chez 13% de non infectés. Sans
préciser la classe fonctionnelle de la dyspnée, Akhras retrouve
comme nous 40% des patients dyspnéiques parmi les sujets homosexuels
infectés par le VIH à Londres (AKHRAS F. et al., 1994).
La prévalence de la dilatation et de
l'altération de la fonction ventriculaire gauche varie avec le stade
définitif de l'infection VIH chez le noir africain. Comme le montre ce
travail, l'augmentation du diamètre télédiastolique est
plus marquée chez les cardiaques infectés par le VIH (VIH+ et
SIDA) que chez les cardiaques indemnes ; la fraction de raccourcissement est
inférieure à 26% chez les cardiaques passés au stade C3
SIDA, mais reste de manière isolée intacte chez les cardiaques
VIH positifs encore au stade A. La diffusion de l'infection VIH en Afrique
explique la prépondérance de la dysfonction ventriculaire gauche
parmi les patients VIH positifs par rapport aux cardiopathes
immunocompétents. Ces complications cardiaques se manifestent sous
l'aspect des cardiomyopathies dilatées liées à l'infection
VIH bien connues aux Etats-Unis et en Europe (LANFRANCH J. et al., 1993 ; COHEN
et al., 1986 ; AKHRAS F. et al., 1994).
CHAPITRE IV - DYSFONCTION DIASTOLIQUE AU COURS DE
L'INFECTION VIH : APPORT DE L'ECHO DOPPLER CARDIAQUE
4.1. PHYSIOPATHOLOGIE DE LA FONCTION
DIASTOLIQUE
a. Rôle de la fonction diastolique
La fonction diastolique du ventricule gauche (VG) est avant
tout le résultat de la relation pression-volume ventriculaire. Le
Doppler échocardiographique facilite le diagnostic des anomalies du
remplissage diastolique du VG en ce qu'il est une méthode de mesure
atraumatique, facilement réalisable, reproductible et sensible, quoique
d'interprétation parfois peu spécifique.
Plusieurs processus pathologiques ainsi que des multiples
déterminants peuvent induire des variations des paramètres
échographiques du remplissage diastolique du VG.
b. Périodes de la diastole (figure 13)
La diastole est répartie en deux périodes : la
relaxation isovolumique et le remplissage diastolique.
Figure 13
Cycle cardiaque
P.C.G. :phonocardiogramme ; E.C.G.
:électrocardiogramme ; Echo :échocardiogramme ;
1 : VE ; 2 : VA ; 3 : temps accélération E ;
4 : DT ; 5 : durée ; 6 : durée totale du remplissage
diastolique ; 7 : accélération E ; 8 :
décélération E.
1. Relaxation isovolumique
Cette phase débute avec la fermeture de la valve
aortique et se termine avec l'ouverture de la valve mitrale. Durant cette
période, la pression du VG diminue sans variation du volume du VG. La
relaxation isovolumique est quantifiée à l'écho Doppler
cardiaque par la mesure du temps de relaxation isovolumique (IVRT).
Si la fonction diastolique est altérée, la
baisse de la pression ventriculaire est allongée et l'IVRT augmente.
Toutefois, la prudence doit être de mise dans l'interprétation de
l'IVRT, index peu spécifique et peu sensible de la relaxation
isovolumique (MYRENG et al., 1990). La diminution de la pression ventriculaire
se réalise parallèlement avec la vitesse de désactivation
myocardique (BAHLER et al., 1985 ; ZILE et al., 1989). La vitesse de
désactivation myocardique est un important déterminant de la
dynamique de remplissage du VG. Des processus pathologiques comme
l'ischémie, l'hypertrophie ou des changements aigus dans les
déterminants physiologiques comme l'accroissement de la postcharge ou
l'asynchronisme pourraient affecter le mécanisme de désactivation
et ralentir la vitesse de relaxation et prolonger la diminution de la pression
ventriculaire (BRUTSAERT et al., 1985 ; STAUFFER et al. 1990).
2. Remplissage diastolique
Le remplissage normal du VG se déroule en trois
phases : le remplissage diastolique rapide précoce (70 à 80%
du volume télédiastolique du VG, VTD), le diastasis et le
remplissage diastolique tardif produit par la contraction auriculaire (15
à 20% du VTD VG).
L'écho-Doppler cardiaque mesure la vitesse du flux
transmitral (m/sec) durant le remplissage diastolique rapide et précoce
(VE) et pendant le remplissage tardif produit par la contraction auriculaire
(VA).
La relation entre la pression du VG et le volume durant la
phase lente du remplissage sert à calculer la compliance et la
rigidité (stiffness) du VG.
3. Facteurs déterminants du remplissage du
VG
Les variations du remplissage diastolique sont
influencées par deux facteurs :
a. Facteurs dynamiques actifs
- vitesse de désactivation du myocarde
- hétérogénéité
fonctionnelle de la contraction-relaxation
- charge ventriculaire
b. Facteurs statiques passifs (rigidité de la
chambre)
- ischémie myocardique
- hypertrophie myocardique
- fibrose myocardique
- contrainte (restriction) péricardique.
4.2. FONCTION DIASTOLIQUE ET SIDA
Plusieurs auteurs ont rapporté que l'atteinte cardiaque
associée à l'infection VIH était le plus souvent latente
avec des signes cliniques observés dans 5 à 16% des cas, signes
qui contrastent avec les constatations échocardiographiques ou
anatomopathologiques notées dans 50 à 70% des cas (BERTRAND Ed.,
1992 ; FINK L. et al., 1984 ; RAFFANTI S.P. et al., 1988 ; HERST J.A. et al.,
1991). Nous avons noté aussi que 45,8% des patients zaïrois et VIH
positifs étaient asymptomatiques en présence d'une
cardiomyopathie dilatée ou d'une péricardite liquidienne.
Les différentes formes d'atteinte cardiaque au cours de
l'infection VIH sont des myocardites et des cardiomyopathies (AUTRAN et al.,
1983 ; SILVER M.A. et al., 1984 ; FRIEDMAN K. et al., 1982 ; COHEN I. S.
et al., 1986 ; CALABRESE L. H. et al., 1987 ; CORBOY J. R. et al., 1987 ; HAKAS
J.F. et al., 1991 ; JOSHI V.V. et al., 1988 ; KAMINSKY H.J. et al., 1988 ;
LEIDIG G.A., 1991 ; REILLY G. M. et al., 1988 ; FINK L. et al., 1984 ;
CAMAROSANO C. et al., 1985 ; LEVY W. S. et al., 1989 ; STEINHERZ L. J. et al.,
1986 ; ALTIERIP I. et al., 1994 ; KERSKOWITZA H. et al., 1993 ; LASSAIGNE D. et
al., 1990 ; ANDERSON D. W. et al., 1988).
En Afrique noire, l'existence du tropisme cardiaque du VIH
vient d'être démontrée par quelques travaux (BOURAMOUE C.,
OBOA A.G., 1989 ; CEGIESLSKI J.P. et al., 1990 ; MALU K. et al., 1988),
confirmant ainsi les données de la littérature (REILLY G.M. et
al., 1988 ; BAROLDI G. et al., 1988). L'atteinte cardiaque semble
évoluer avec le temps et les stades de l'infection VIH.
L'altération de la relaxation et du remplissage diastolique rapide
précoce du VG peut se manifester au moment où la fonction
systolique du VG demeure normale au cours des cardiomyopathies dilatées
(DOUGHERTY A.M. et al., 1984 ; GROSSMAN W. et al., 1979 ; GROSSMAN W., 1991).
A cette fin, nous avons utilisé de manière non-invasive l'effet
Doppler pour étudier l'éventualité d'une différence
des propriétés du remplissage du VG durant la diastole entre les
patients souffrant de l'infection VIH ayant ou non des
antécédents pathologiques cardiaques et des sujets normaux de
même âge.
4.3. PATIENTS
Le groupe étudié au repos consiste en 49
patients sidéens infectés par le VIH (29 hommes et 20 femmes)
avec une moyenne d'âge de 28 ans (extrêmes 20 <-> 50 ans) et
appariés à 28 sujets normaux pour l'âge et le sexe. Le
diagnostic clinique et
sérologique (test VIH positif par enzyme-linked
immunosorbent assay ou ELISA et confirmé par Western blot) a satisfait
aux critères des Centers for Disease Control (CDC, 1987). Tous les
sujets de race noire et originaires du Zaïre ont librement donné
leur accord d'adhésion à la présente étude.
Asymptomatiques au plan cardiaque, les 49 patients atteints de l'infection VIH
ont été répartis en deux sous-groupes : stade C1 SIDA
(Groupe I =19 patients) et stades A-B VIH (Groupe II = 30 patients). Les
sujets normaux ont servi de groupe contrôle (Groupe III = 28 patients)
Critères d'exclusion
- âge < 20 ans et âge > 50 ans
- hypertension artérielle
- péricardite liquidienne
- cardiopathie ischémique
- cardiomyopathie hypertrophique
- cardiomyopathie dilatée
- bronchopneumopathie chronique
- épisodes fébriles
- fréquence cardiaque > 96/min.
4.4. EXAMEN ECHO-DOPPLER PULSE MITRAL
Les méthodes d'enregistrement
échocardiographique par temps-mouvement et onde Doppler ont
été largement décrites au chapitre I.
1. Analyse du flux mitral : les paramètres
échocardiographiques
La courbe de remplissage ventriculaire gauche (courbe des
vitesses mitrales) est biphasique, avec une première onde E de
remplissage protodiastolique précoce et d'une seconde onde A de
remplissage auriculaire télédiastolique tardif (Figure 13).
Morphologiquement, la courbe de vitesses mitrales obtenue par effet Doppler
pulsé ressemble à la courbe de la dérivée (dV/dt)
du temps/volume angiographique (LABOVITZ et al., 1987).
Chez l'adulte, les valeurs normales des paramètres
diastoliques sont (APPELTON C.P. et al., 1988) :
VE : 86 + 16 cm/s
VA : 56 + 13 cm/s
VE/VA : 1,6 + 0,4
DT : 199 + 32 ms
DHT : 
IVRT : 71 + 14 ms
4.5. RESULTATS
La fonction systolique est normale chez tous les sujets
étudiés. L'index de masse du VG est élevé chez les
patients VIH positifs (147 + 28 g/M2).
Les variables de la fonction diastolique du VG
analysées sont résumées dans les tableaux 12 et 13.
Tableau 12 - Données cliniques et Echo-Doppler des
patients
VIH positifs et des sujets normaux
séronégatifs
|
Variables
|
Groupe I
SIDA
n = 19
|
Groupe II
VIH+
n = 30
|
Groupe III
Normaux
n = 28 p
|
U
p
|
ANOVA
F
|
Correction
Bonferonni
p<0,05
|
|
Age (ans)
|
27 + 4
|
28 #177; 4
|
29 #177; 4
|
NS
|
|
|
|
FC/min
|
81,6 + 10,3
|
80,7 #177; 7,9
|
74,9 #177; 11,3
|
NS
|
|
NS
|
|
IMG (g/M2)
|
99 + 26
|
147 #177; 28
|
92 #177; 15
|
+*
++*
+++*
|
|
|
|
VE (m/s)
(I.C. 95%)
|
0,54 #177; 0,1
(0,48 - 0,59)
|
0,44 + 0,1
(0,39 - 0,48)
|
0,64 #177; 0,1
(0,59 - 0,68)
|
|
0,0000
|
+*
++*
+++*
|
|
VA (m/s)
(I.C. 95%)
|
0,63 #177; 0,1
(0,56 - 0,69)
|
0,69 #177;0,2
(0,59 - 0,77)
|
0,51 #177; 0,1
(0,47 - 0,54)
|
|
0,0000
|
+NS
++*
+++NS
|
|
DHT (ms)
(I.C. 95%)
|
89 #177; 12
(83 - 94)
|
106 #177; 20
(96 - 113)
|
80 #177; 12
(76 - 85)
|
|
0,0000
|
+*
++*
+++NS
|
|
VE/VA
|
0,85 #177; 0,2
|
0,64 #177; 0,1
|
1,3 #177; 0,2
|
|
0,0000
|
+*
++*
+++*
|
|
IVRT (ms)
|
87,2 #177; 12,4
|
103,9 #177; 19,3
|
79,4 #177; 12
|
|
0,0000
|
+*
++*
+++NS
|
U: test de Mann-Whitney.
F : test Fisher d'égalité de 3 moyennes.
Correction Bonferonni : comparaison des moyennes 2 à 2
au seuil de 5%
* : significatif p < 0,05
NS : non significatif
+ : SIDA versus VIH+, ++ VIH+versus Normaux, +++SIDA versus
Normaux
Tableau 13 - Variations de l'index de masse du VG
selon le sexe et selon la réponse immunitaire pour
le VIH
|
Femmes
|
Hommes
|
p
|
|
VIH-
IMG
(g/M2)
|
104,9 #177; 9,3
(n = 13)
|
105,1 #177; 8
(n = 15)
|
NS
|
|
VIH+
IMG
(g/M2)
|
128 #177; 2,9
(n = 11)
|
157,9 #177; 54,1
(n = 19)
|
p < 0,001
|
|
SIDA
IMG
(g/M2)
|
58,5 #177; 12,6
(n = 9)
|
122,3 #177; 48
|
p < 0,001
|
Comparés aux sujets normaux, tous les patients avec
infection VIH présentent une diminution significative de VE et de VE/VA,
un accroissement de VA et un allongement de DHT (Figure 14, Figure 15).
Au cours de l'infection à VIH, les paramètres VE
et VE/VA sont significativement diminués au stade précoce de
l'immunodépression (Groupe II = stade A) tandis que les valeurs de VA et
de DHT demeurent très augmentées.
L'index de masse du VG (IMG) présente des variations
selon le sexe et le stade de l'infection VIH (tableau 13) : l'IMG des hommes au
stade A VIH+ (157,9 #177; 54,1 g/M2) est plus élevé
que celui des femmes (A VIH+ : 128,9 #177; 2,91 g/M2 ; SIDA : 58,5
#177; 12,6 g/M2) avec une différence statistique intersexe
hautement significative (p < 0,001).
Figure 14
|
Onde VE des sujets normaux
comparée à celles des patients
avec infection VIH
|
|
Composante auriculaire VA des sujets
normaux comparée à celle
des patients infectés par le VIH
|
|
|
|
Figure 15
|
Comparaison de VE/VA et de DHT
entre sujets normaux et patients
avec infection VIH
|
|
Corrélation entre index de masse
du ventricule gauche et VE/VA et DHT
au cours de l'infection VIH
|
|
|
|
4.6. DISCUSSION
Durant les douze dernières années,
l'intérêt de la prise en charge du dysfonctionnement diastolique a
été très marqué. Brutsaert d'Anvers a
étudié 31 index de la fonction diastolique du VG évaluant
la relaxation diastolique, la rigidité et la compliance (BRUTSAERT et
al., 1985).
L'altération de la composante diastolique du VG est un
substratum physiopathologique important de la symptomatologie de l'insuffisance
cardiaque congestive induite par l'hypertension, de la cardiopathie
ischémique et des cardiomyopathies (INOUYE I. et al., 1984 ; BONOW R.O.
et al., 1981 ; TOPOL E.J. et al., 1985).
Réalisable et non-invasive, l'écho-Doppler
cardiaque est un outil utile dans l'étude de la fonction diastolique
(SPIRITO P. et al., 1986 ; ROCKEY R. et al., 1985 ; IMASE M. et al., 1987).
La fonction systolique du VG pourrait être normale chez
des sujets présentant des signes fonctionnels et physiques d'une
insuffisance cardiaque congestive ayant comme cause une dysfonction diastolique
(DOUGHERTY A.H. et al., 1984 ; SOUFER R. et al., 1985 ; SIMONS M. et al., 1986
; AGUIRRE F.V. et al., 1981 ; AROESTY J.M. et al., 1985).
L'analyse des index de la fonction diastolique est fort
complexe puisque le remplissage du VG dépend de la relaxation
myocardique, de la suction diastolique, des forces visco-élastiques du
myocarde, de la contractilité ventriculaire et auriculaire, de la
restriction péricardique, de l'interaction interventriculaire et de la
fréquence cardiaque (WILBUR Y.W., 1989).
La présente étude a été
réalisée pour comparer les vitesses transmitrales au repos des
patients infectés par le VIH asymptomatiques ou plan cardiovasculaire
à celles des sujets normaux. Par une méthode atraumatique, nous
avons mis en évidence les perturbations de la fonction diastolique chez
des patients à différents stades de l'infection VIH et sans
signes cliniques d'insuffisance cardiaque.
1. SIDA et dysfonctionnement diastolique du VG
La présente étude démontre une diminution
de VE et de VE/VA mais aussi une augmentation des variables VA et DHT plus
marquées au stade A qu'au stade C de l'infection VIH. Chez ces patients
infectés par le VIH, nous notons une corrélation négative
entre VE/VA et l'index de masse du VG, mais une corrélation positive
entre DHT et l'index de masse du VG (Figure 5). L'atteinte du remplissage
précoce du VG a aussi été retrouvée en France
auprès des porteurs VIH positifs asymptomatiques et symptomatiques, la
performance systolique restant globalement intacte (COUDRAY N. et al.,
1995).
L'altération de la relaxation myocardique est
appuyée par l'allongement pathologique du temps de relaxation
isovolumique aux stades précoces de l'infection VIH (IVRT Groupe II =
103,9 #177; 19,3). Au stade SIDA, le temps de relaxation isovolumique (IVRT
Groupe I = 87,2 #177; 12,4) est dans les limites normales mais reste plus long
que celui de sujets séronégatifs (IVRT Groupe III = 79,4 #177;
12,9, p < 0,001) et plus court que celui des patients au stade A de
l'infection VIH sans différence statistique significative (p < NS).
Coudray N. et al. ont aussi observé un allongement du temps de
relaxation isovolumique chez des patients asymptomatiques au stade
précoce de l'infection VIH.
La gradation des troubles de remplissage à partir du
flux transmitral a été décrite en trois stades (APPLETON
et al., 1988) : ces stades traduisent la progression habituelle d'un trouble de
remplissage. C'est le stade I de Appleton qui caractérise chez ces
noirs infectés par le VIH la réduction en protodiastole du
remplissage ventriculaire gauche.
Le dysfonctionnement diastolique noté chez ces patients
noirs avec infection VIH est le témoin de l'étape initiale de
l'atteinte myocardique associée à l'infection VIH. Ce
dysfonctionnement diastolique s'installe progressivement avec les stades de
l'infection VIH : les complications cardiaques observées comprennent
l'incidence d'une cardiomégalie chez 26,6% des patients, une
augmentation de l'index de masse du VG (147 + 28g/M2), un
allongement de la relaxation du VG (DHT 106 + 20 m/s) et une
accentuation de l'atteinte de la phase de remplissage diastolique
précoce (diminution de VE : 0,44 + 0,1 m/s).
2. Etiologies de la dysfonction diastolique du VG au cours
du SIDA
Le mécanisme étiopathogénique de
l'atteinte myocardique associée à l'infection VIH n'est pas
encore élucidé. Cependant, plusieurs études ont
rapporté une fréquence élevée des cas de
myocardites et de cardiomyopathies (AUTRAN et al., 1983 ; SILVER Metal, 1984 ;
FRIEDMAN K. et al., 1982 ; COHEN I.S. et al., 1986 ; CALABRESE L.H. et al.,
1991 ; JOSHI V.V. et al., 1988 ; KAMINSKY H.J. et al., 1988 ; LEIDIG G.A.,
1991 ; REILLY G.M. et al., 1988 ; FINK L. et al., 1984 ; CAMAROSANO C. et
al., 1985 ; LEVY W.S. et al., 1989 ; STEINHERZ L.J. et al., 1986 ; ALTIERI
P.I. et al., 1994 ; KERSKOWITZ A.H., 1993 ; LASSAIGNE D. et al., 1990 ;
ANDERSON D.W. et al., 1988).
Il est bien établi aujourd'hui que la fonction
diastolique du VG est altérée par les cardiopathies
ischémiques, l'hypertension artérielle et la cardiomyopathie
hypertrophique (HARIZI R.C. et al., 1988). Les facteurs physiologiques
influencent aussi les changements de la fonction diastolique du VG (BRUTSAERT
et al., 1985).
Plusieurs étiologies possibles sont à l'origine
de la dysfonction cardiaque associée à l'infection VIH :
l'invasion néoplasique du myocarde, des carences nutritionnelles, la
cardiotoxicité liée aux médicaments ou à la drogue
et des myocardites (REILLY G.M. et al., 1988 ; BAROLDI G. et al., 1988 ; LEWIS
W. et al., 1985 ; CALABRESE L.H. et al., 1987 ; LEWIS W. et al., 1992 ;
HERSKOWITZ A. et al., 1992).
Aucun des patients de la présente étude ne
signale une histoire médicale d'hypertension artérielle, de
péricardite liquidienne, d'insuffisance coronaire, de
bronchopneumopathies chroniques, d'alcoolisme et de traitement anti-retroviral.
Si ces dernières conditions physiopathologiques susceptibles de
perturber la fonction diastolique du VG sont absentes chez ces patients VIH
positifs du Zaïre, il faut signaler la découverte de l'hypertrophie
concentrique du VG, (index de masse du VG 147 + 28g/M2). La
corrélation entre l'index de masse du VG et VE/VA et DHT (Figure 5)
confirme l'action de l'hypertrophie du VG sur le remplissage diastolique : la
diminution du VE/VA et l'allongement du temps de décelération
avec l'augmentation de la masse du VG décrivent un flux mitral de
type I d'Appelton (APPELTON et al., 1988).
L'échographie du coeur a montré l'existence
d'une hypertrophie concentrique prépondérante au stade
précoce ( A VIH + : 22/30 patients) et quelques cas d'hypertrophie
excentrique au stade SIDA (3/19 patients). Il n'existe pas de dilatation du
VG. A la question de savoir s'il y a des liens pathogéniques entre
l'infection VIH et les cardiomyopathies hypertrophiques,
l'épidémiologie des cardiomyopathies idiopathiques en Afrique y
répondrait par l'affirmative. En effet, les cardiomyopathies
hypertrophiques idiopathiques y sont rares. Mais il est aussi possible que
cette association soit fortuite. Le VIH pourrait stimuler les
proto-oncogènes des cellules infectées et augmenter la masse
cardiaque : un accroissement significatif de la masse cardiaque a
été observé au cours d'une étude prospective sur 5
ans chez 46 enfants sur 56 infectés par le virus VIH (LIPCHULTZ S. et
al., 1989). La cardiomyopathie hypertrophique est souvent associée
à une dysfonction du remplissage diastolique : l'onde VE diminue s'il
n'y a pas de régurgitation mitrale surajoutée (TAKENAKA et al.,
1986).
Cette hypertrophie du VG a été plus
retrouvée chez l'homme que chez la femme à tous les stades de
l'infection VIH, la différence statistique étant hautement
significative au seuil de p < 0,001.
Tous les sujets admis dans la présente étude
sont jeunes (VIH+ 28 #177; 4 ans, SIDA 27 #177; 4 ans, contrôles 29 #177;
4 ans) sans différence de plus de 30 ans entre les plus jeunes et les
plus âgés (un seul âgé de 50 ans dans le groupe
témoin), ce qui exclut l'effet de l'âge sur la courbe de
remplissage du VG. En effet la morphologie de la courbe du flux mitral se
modifie avec l'âge du sujet normal : à 20 ans, le rapport VE/VA
est proche de 2 pour chuter à 1,5 à 40 ans et atteindre 1 vers 60
ans. La contribution auriculaire augmente donc avec l'âge. De
même, le temps de décélération (DHT) a tendance
à s'allonger avec l'âge (PEARSON A.C. et al., 1987).
Pour éviter les effets de la tachycardie sur le flux
diastolique, seuls les patients avec une fréquence cardiaque
inférieure à 96/min ont été inclus dans la
présente étude. Concernant la fréquence cardiaque, aucune
différence significative n'est notée entre les patients
infectés par le VIH et les sujets normaux. Les modifications de VE, VA,
DHT et d'IVRT présentées dans ce travail ont été
réalisées chez des sujets en rythme sinusal normal.
Néanmoins au cours de l'évolution de l'infection VIH, 16 patients
sur 19 au stade SIDA (84,2%) et 12 sur 30 séropositifs au stade A (40%)
ont présenté une tachycardie respectivement de l'ordre de 128
#177; 4 battements/min et de 129 #177; 4,1/min (p = NS). Malgré la
tachycardie il n'a pas été montré une corrélation
(r = 0,001) entre la fréquence cardiaque et les paramètres VE,
VA, DHT, IVRT chez ces patients infectés par le virus. Habituellement
la tachycardie raccourcit l'IVRT et détermine la fusion de VE et de VA
suite à la diastasis écourtée. Une cardiomyopathie
(myocardite) avec tachycardie permanente se présente comme une
complication évolutive de l'infection VIH en Afrique tropicale (KAPITA
B., 1989). La tachycardie notée ici serait une stigmate de
l'évolution vers une CMD associée au VIH.
Notre étude montre une relation directe probable entre
l'atteinte de la fonction diastolique et l'infection VIH chez des patients
noirs du Zaïre.
Les insuffisances de cette étude sont dues à
l'absence de l'enregistrement des pressions auriculaires gauches et du temps de
mouvement du VG, à l'impossibilité d'obtenir des biopsies
endomyocardiques et à l'enregistrement des tracés
échocardiographiques par les deux observateurs à des intervalles
du temps fort longs.
L'amplitude de VE dépend de la qualité de la
relaxation du VG, du débit transvalvulaire mitral, des pressions de
remplissage, de la surface valvulaire. En télédiastole, la
systole auriculaire est responsable d'une majoration du gradient oreillette
gauche - VG, ce qui correspond à VA qui disparaît avec la
fibrillation auriculaire. L'amplitude de VA dépend d'une part de la
qualité de la contraction auriculaire mais aussi du niveau des pressions
de remplissage et de la compliance du VG.
Les biopsies endomyocardiques nous auraient apporté la
preuve de l'existence des processus infiltratifs, des nécroses ou des
fibroses du myocarde avec une hypertrophie des segments intacts qui
entraînent une augmentation de la rigidité du myocarde et de la
chambre du VG. L'augmentation de la rigidité entraîne une
diminution dans la vitesse et l'extension du remplissage précoce
diastolique (VE). Le ventricule gauche va compenser ces anomalies en
déplaçant le remplissage vers la diastole tardive, augmentant
ainsi de façon considérable le remplissage dû à la
contraction auriculaire (VA).
Nos résultats suggèrent que l'anomalie de la
relaxation est le signe précoce du dysfonctionnement du VG au cours de
l'infection VIH.
CHAPITRE V - ETUDE DE LA SURVIE DES PATIENTS AVEC
COMPLICATIONS CARDIAQUES ASSOCIEES A L'INFECTION VIH
5.1. INTERET DE L'ETUDE SUR LA MORBIDITE ET LA
MORTALITE CARDIOVASCULAIRES AU COURS DU SIDA
L'Afrique héberge seulement 9% de la population
mondiale, mais paie le plus lourd tribut de la pandémie du SIDA avec
67,7% des cas de SIDA parmi la population globale adulte. Plusieurs millions
d'individus de ce continent ont été déjà
contaminés par le VIH (PIOT P. et al., 1993).
Le tropisme cardiaque du VIH n'est plus à
démontrer au sein de la population noire d'Afrique (BOURAMOUE C., OBOA
A.S., 1989 ; CEGIESLSKI J.P., 1990 ; MALU K. et al., 1988).
Aux Etats-Unis, différentes formes d'atteintes
cardiaques ont été décrites au cours de l'infection VIH
comme des myocardites, des cardiomyopathies, des péricardites
liquidiennes, des arythmies ventriculaires, des infiltrations
néoplasiques et des endocardites thrombotiques non infectieuses (COHEN
I. et al., 1986 ; FINK L. et al., 1984 ; REILLY J.M. et al., 1988 ;
MONSUEZ J.J. et al., 1988 ; CORBOY J.R. et al., 1987 ; CAMMAROSANO C.,
1985 ; ANDERSON D.W. et al., 1988 ; BAROLDI G. et al., 1988 ;
SILVER M.A. et al., 1984 ; RAFFANTI S.P. et al.,...).
Avec une meilleure prise en charge du SIDA, un nombre
important des patients des pays développés vivent plus longtemps
en dépit des complications fatales éventuelles (PETERS B.S. et
al., 1991).
Les atteintes cardiaques associées à l'infection
VIH constituent les principales causes de l'insuffisance cardiaque. Des
études controversées ont noté un pronostic sombre en cas
de cardiomyopathie dilatée (CMD) et dysfonction ventriculaire gauche
avancée, 50% des patients sont décédés
endéans les 6 mois (MONSUEZ J.J. et al., 1988 ; HIMELMAN R. et al., 1989
; FACTOR S.M., 1989). Currie P.F. et al. ont étudié le cours
naturel de l'atteinte myocardique au cours de l'infection VIH en observant une
diminution significative de la survie des patients avec CMD par rapport aux
sujets normaux (CURRIE P.F. et al., 1994).
Il devient difficile d'estimer l'impact des lésions
cardiaques associées au SIDA en Afrique noire où 6 à 16%
des patients infectés par le VIH sont décédés des
complications cardiaques (BERTRAND Ed., 1992).
Au stade SIDA de l'infection VIH, les patients africains avec
toutes affections opportunistes confondues évoluent plus rapidement de
l'infection VIH asymptotique à la mort (survie = 1 an) que ceux
d'Europe ou des Etats-Unis (RYDER R.W., 1988 ; MANN T., NETTER, 1992).
Les buts de notre étude visent à :
1. déterminer dans le cas particulier d'une
lésion cardiaque associée à l'infection VIH du noir
africain la relation entre le tableau clinique de cette anomalie cardiaque et
des variables démographiques, biologiques et échocardiographiques
;
2. comprendre le cours naturel et les répercussions des
complications cardiaques sur la survie des patients noirs présentant une
infection VIH.
5.2. PATIENTS
Le groupe d'étude est constitué d'une cohorte de
87 patients noirs du Zaïre recrutés de manière
aléatoire avec leur consentement libre dans une étude
longitudinale allant de 1987 à 1994.
Le diagnostic de l'infection VIH a satisfait aux
critères du CDC (CDC, 1993). Aucun patient n'a été
reconnu homosexuel, bisexuel, toxicomane ni recevant un traitement
antirétroviral (AZT, etc.). Les données cliniques biologiques et
échocardiographiques obtenues 12 mois avant le passage au stade SIDA ont
été utilisées à l'analyse uni et multivariée
comme facteurs potentiels de pronostic.
Quatre événements étaient attendus tout
au long de l'infection VIH :
- cardiomyopathie dilatée
- péricardite liquidienne
- survie
- décès.
L'observation des événements attendus a
été réalisée au cours de 7 visites à
intervalle de 12 mois. Le follow-up des patients et l'actualisation des
données sont effectuées de manière régulière
et continue.
5.3. ANALYSE DES PARAMETRES ECHO-DOPPLER CARDIAQUES
Les enregistrements échocardiographiques des
paramètres du VG en mode M en position 1-2 de Feigenbaum (FEIGENBAUM H.,
1976) et selon les critères de la Société
Américaine d'Echocardiographie (SAHN D.J. et al., 1978 ; HENRY W.L. et
al., 1980) ont servi à la récolte des variables suivantes :
- le diamètre télédiastolique du VG
(Dd)
- le diamètre télésystolique du VG
(Ds)
- l'épaisseur diastolique de la paroi
postérieure du VG
- le diamètre antéro-postérieur de
l'oreillette gauche (OG)
- le pourcentage de raccourcissement (% R) du VG
L'utilisation du Doppler a servi à analyser les
vitesses du flux mitral et le temps de décélération du
remplissage diastolique précoce :
- VE
- VA
- VE/VA
- DT.
5.4. CALCUL DES COURBES DE SURVIE
La finalité est de recenser la mortalité
cardiovasculaire et la durée de la survie des patients au stade C1 SIDA
de l'infection VIH. Les courbes de survie sont obtenues par l'estimation de
Kaplan-Meier tandis que la régression proportionnelle du hasard de Cox a
comparé les différents facteurs de risque (KAPLAN, MEIER, 1958).
Ce modèle de Cox a étudié l'effet
simultané de toutes les variables avec des données manquantes ou
censurées (patients encore en vie à la fin de l'étude,
1994). Les variables (ou régresseurs) inclues dans le modèle de
Cox sont les suivantes :
1 L'âge au passage de l'état C1 SIDA ;
2 Le sexe masculin ou féminin ;
3 Les complications cardiaques : péricardite ou
cardiomyopathie dilatée ;
4 Le compte des cellules T-CD4 ;
5 Le diamètre télédiastolique du VG
à l'échographie ;
6 L'épaisseur diastolique de la paroi
postérieure du VG à l'échocardiogramme ;
7 Le rapport VE/VA à l'écho-Doppler
cardiaque.
Ces 7 facteurs (régresseurs) potentiels de pronostic
sur la survie ont reçu des valeurs dichotomiques par rapport à
leurs médianes ou moyennes, à la limite supérieure des
valeurs normales et à l'appartenance à l'une ou à l'autre
des deux catégories.
Ne connaissant pas le début de l'infection VIH, il n'a
pas été possible d'inclure l'année de début de
l'invasion du VIH, régresseur qui aurait dépisté un
éventuel effet de cohorte sur le pronostic.
La méthode "pas-à-pas" (stepwise) a servi
à retenir les variables les plus significatives. Nous avons recourru au
programme spécialisé 2L de BMDP (DIXON W.J. et al., 1983).
5.5. RESULTATS
Sur 87 patients VIH positifs passés au stade C1 SIDA,
76 (87,4%) sont décédés et 11 (12,6%) étaient
encore en vie à la fin de la présente étude longitudinale
d'une durée de 7 ans. Les données cliniques et
échocardiographiques de 11 patients restés en vie ont
été censurées (tronquées) dans l'analyse par la
méthode Kaplan-Meier.
Les résultats du calcul actuariel de différentes
fonctions de survie cumulée par rapport au temps sont rappportés
aux tableaux 14 à 18.
Tableau 14 - Calcul actuariel de la fonction de survie
cumulée
de 87 VIH+ au stade C1 SIDA
|
Moyenne (I.C. 95%) ans Survie Médiane (I.C.
95%) ans
|
|
4 (3 - 4)
|
3 ( 3 - 3)
|
|
Temps depuis
SIDA, ans
|
Entrés
vivants
|
Perdusde vue
|
Décédés
|
% survie
cumulée
|
Erreur
standard
|
|
1
|
87
|
0
|
17
|
0,79
|
0,043
|
|
2
|
70
|
0
|
13
|
0,64
|
0,051
|
|
3
|
57
|
0
|
20
|
0,42
|
0,053
|
|
4
|
37
|
0
|
6
|
0,34
|
0,051
|
|
5
|
31
|
0
|
6
|
0,27
|
0,047
|
|
6
|
25
|
0
|
8
|
0,18
|
0,41
|
|
7
|
17
|
N.B.
|
6
|
0,12
|
0,035
|
N.B. 11 patients (12,6%) sont restés en vie
au-delà de 7 ans (données censurées).
% : F(t) fonction de survie cumulée par rapport au
temps.
Tableau 15 - % survie cumulée selon le sexe des
patients
au stade SIDA de l'infection VIH
|
Hommes
|
Femmes
|
|
Temps
SIDA, ans
|
Entrés
vivants
|
Perdus
de vue
|
Décédés
|
% survie
cumulée
|
Entrées vivantes
|
Perdues
de vue
|
Décédées
|
% survie
cumulée
|
|
1
|
52
|
0
|
12
|
0,77
|
35
|
0
|
6
|
0,83
|
|
2
|
40
|
0
|
10
|
0,58
|
29
|
0
|
3
|
0,74
|
|
3
|
30
|
0
|
12
|
0,35
|
26
|
0
|
7
|
0,54
|
|
4
|
18
|
0
|
2
|
0,31
|
19
|
0
|
5
|
0,40
|
|
5
|
16
|
0
|
4
|
0,23
|
14
|
0
|
2
|
0,34
|
|
6
|
12
|
0
|
5
|
0,13
|
12
|
0
|
3
|
0,26
|
|
7
|
7
|
H.
|
1
|
0,11
|
9
|
F
|
4
|
0,14
|
H : 6 hommes restés en vie au-delà de 7 ans.
F : 5 femmes restées en vie au-delà de 7 ans.
Tableau 16 - % survie cumulée en fonction de
l'âge de survenue
du stade SIDA de l'infection VIH
|
Survenue SIDA avant 32 ans
|
Survenue SIDA après 32 ans
|
|
Temps
SIDA, ans
|
Entrés
vivants
|
Perdus
de vue
|
Décédés
|
% survie
cumulée
|
Entrées vivantes
|
Perdues
de vue
|
Décédées
|
% survie
cumulée
|
|
1
|
41
|
0
|
7
|
0,83
|
46
|
0
|
11
|
0,76
|
|
2
|
34
|
0
|
3
|
0,76
|
35
|
0
|
10
|
0,54
|
|
3
|
31
|
0
|
7
|
0,59
|
25
|
0
|
12
|
0,28
|
|
4
|
24
|
0
|
3
|
0,51
|
13
|
0
|
4
|
0,20
|
|
5
|
21
|
0
|
3
|
0,44
|
9
|
0
|
3
|
0,13
|
|
6
|
18
|
0
|
6
|
0,29
|
6
|
0
|
2
|
0,09
|
|
7
|
12
|
A
|
4
|
0,20
|
4
|
B
|
1
|
0,07
|
A : 8 patients sont restés en vie au-delà de 7
ans
B : 3 patients sont restés en vie au-delà de 7
ans.
Tableau 17 - % survie cumulée selon la
complication cardiaque
associée au stade SIDA de l'infection VIH
|
Péricardite
|
Cardiomyopathie dilatée
|
|
Temps
SIDA, ans
|
Entrés
vivants
|
Perdus
de vue
|
Décédés
|
% survie
cumulée
|
Entrées vivantes
|
Perdues
de vue
|
Décédées
|
% survie
cumulée
|
|
1
|
41
|
0
|
11
|
0,73
|
46
|
0
|
7
|
0,85
|
|
2
|
30
|
0
|
9
|
0,51
|
39
|
0
|
4
|
0,76
|
|
3
|
21
|
0
|
7
|
0,34
|
35
|
0
|
12
|
0,50
|
|
4
|
14
|
0
|
3
|
0,27
|
23
|
0
|
4
|
0,41
|
|
5
|
11
|
0
|
3
|
0,20
|
19
|
0
|
3
|
0,35
|
|
6
|
8
|
0
|
4
|
0,10
|
16
|
0
|
4
|
0,26
|
|
7
|
4
|
P
|
1
|
0,07
|
12
|
C
|
4
|
0,17
|
P : 3 cas de péricardite avec infection VIH stade SIDA
encore en vie au-delà de 7 ans.
C : 8 cas de cardiomyopathie dilatée au stade SIDA
encore en vie au-delà de 7 ans.
Tableau 18 - % survie cumulée en fonction du
compte de CD4
avant le passage au stade SIDA de l'infection VIH
|
CD4 < 400/mm3
|
CD4 > 400/mm3
|
|
Temps
SIDA, ans
|
Entrés
vivants
|
Perdus
de vue
|
Décédés
|
% survie
cumulée
|
Entrées vivantes
|
Perdues
de vue
|
Décédées
|
% survie
cumulée
|
|
1
|
40
|
0
|
16
|
0,60
|
47
|
0
|
2
|
0,96
|
|
2
|
24
|
0
|
7
|
0,43
|
45
|
0
|
6
|
0,83
|
|
3
|
17
|
0
|
11
|
0,15
|
39
|
0
|
8
|
0,66
|
|
4
|
6
|
0
|
2
|
0,10
|
31
|
0
|
5
|
0,55
|
|
5
|
4
|
0
|
1
|
0,08
|
26
|
0
|
5
|
0,45
|
|
6
|
3
|
0
|
1
|
0,05
|
21
|
0
|
7
|
0,30
|
|
7
|
2
|
X
|
1
|
0,03
|
14
|
Y
|
4
|
0,21
|
X : 1 patient (2,5%) encore en vie au-delà de 7 ans.
Y : 10 patients (21,28%) restés encore en vie
au-delà de 7 ans.
La survie médiane de l'ensemble de patients
infectés par le VIH au stade C1 SIDA est de 3 ans (36 mois) avec limite
de confiance inférieure (LCI) de 3 ans et limite de confiance
supérieure (LCS) de 3 ans à 95% d'intervalle de confiance (I.C.).
La survie moyenne globale est de 4 ans (I.C. 95%, 3-4).
L'âge médian des patients au moment de passage au
stade SIDA de leur infection VIH est de 32 ans. Un sex ratio de 1,5 homme/1
femme (52 hommes/35 femmes) est noté parmi les patients de la cohorte
étudiée.
L'échocardiographie a révélé 41
cas de péricardite liquidienne et 46 de cardiomyopathie dilatée ;
complications cardiaques caractérisées par une dilatation du VG
importante (VGDD 6 cm) chez 57 patients sur 87 (66%), une diminution de VE/VA
(rapport < 1) chez 65 sur 87 (75%) et une hypertrophie de la paroi
postérieure du VG (EDp > 1,2 cm) chez 22 sur 87 (25%). La
dysfonction diastolique est caractéristique du stade SIDA puisque 75%
ont une diminution du rapport VE/VA.
Concernant la dépletion de CD4, 40 patients sur 87
(46%) ont avant le passage au stade de SIDA un nombre absolu de CD4
inférieur à 400/mm3 et 47 sur 87 (54%) un taux de CD4
supérieur à 400/mm3.
1. Analyse univariée des facteurs potentiels de
pronostic.
Sur 7 régresseurs, le tableau 19 montre 5 facteurs
déterminants de mauvais pronostic de l'infection VIH au stade SIDA :
l'âge, la complication cardiaque, le nombre de CD4, la dilatation et
l'hypertrophie du VG.
Tableau 19 - Analyse univariée des facteurs
potentiels de mauvais pronostic
après passage au stade SIDA
|
Facteurs
potentiels
|
Total
n/catégorie
|
Décédés
n
|
Censurés
n(%)
|
Moyenne
temps
survie
ans
(I.C.95%)
|
Médiane
temps
survie
ans
(I.C.95%)
|
p
(logrande)
|
|
Sexe
Hommes
Femmes NS
|
52
35
|
46
30
|
6 (11,5%)
5 (14,2%)
|
3 (3-4)
4 (3-5)
|
3 (2-4)
4 (3-5)
|
0,21
|
|
Age/passage SIDA
Médiane
< 32 ans
> 32 ans **
|
41
46
|
33
43
|
8 (19,5%)
3 (6,5%)
|
4 (4-5)
3 (2-4)
|
4 (4-5)
3 (2-4)
|
0,003
|
|
Complications
cardiaques
Péricardite
Cardiomyopathie dilatée *
|
41
46
|
38
38
|
3 (7,3%)
8 (17,4%)
|
3 (3-4)
4 (3-5)
|
3 (2-4)
3 (2-4)
|
0,03
|
|
Nombres CD4/mm3
< 400
400 ***
|
40
47
|
39
37
|
1 (2,5%)
10 (21,28%)
|
2 (2-3)
5 (4-5)
|
2 (1-3)
5 (4-6)
|
0,0000
|
|
VGDDcm
< 6
6 *
|
30
57
|
28
48
|
2 (6,7%)
9 (15,8%)
|
3 (2-4)
4 (3-5)
|
2 (1-3)
3 (2-4)
|
0,03
|
|
VE/VA
< 1
1 NS
|
65
22
|
58
18
|
7 (10,8%)
4 (18,2%)
|
3 (3-4)
4 (3-5)
|
3 (2-4)
4 (2-6)
|
0,14
|
|
EDp cm
< 1,2
> 1,2 *
|
65
22
|
55
21
|
10(15,4%)
1(4,6%)
|
4 (3-4)
3 (2-4)
|
3 (2-4)
2 (1-3)
|
0,04
|
La comparaison des durées médianes de survie
(I.C. 95%) entre les hommes et les femmes, entre les patients avec VE/VA < 1
et ceux avec VE/VA > 1 ne montre pas de dfférence statistique
signbificative (p = ns).
Les patients âgés de plus de 32 ans lors du
passage au stade SIDA ont une durée médiane de survie (3 ans, LCI
2 - LCS 4) plus courte que celle de moins de 32 ans (5 ans, LCI 3 - LCS 7), la
différence statistique étant hautement significative (p =
0,003).
A durée médiane de survie égale (3 ans,
LCI 2 - LCS 4), 17,39% de patients avec cardiomyopathie dilatée contre
7,32% avec péricardite liquidienne étaient encore en vie
au-delà de 7 ans depuis leur passage au stade SIDA de l'infection VIH
avec une différence statistiquement significative (p = 0,03). Par effet
d'association avec la cardiomyopathie dilatée surtout, les patients avec
dilatation importante du VG (VGDD 6 cm) présentent une survie plus
longue (médiane 3 ans, LCI 3 - LCS 5) que ceux avec VGDD < 6 cm
(médiane 2 ans, LCI 1 - LCS 3) (p = 0,03).
La durée médiane de survie est 3 fois plus
allongée chez les patients avec CD4 400/mm3 (5 ans, LCI 4 -
LCS 6) que chez ceux avec CD4 < 400/mm3 (2 ans, LCI 1 - LCS 3),
la différence étant très hautement significative (p =
0,0000).
2. Analyse multivariée des facteurs de risque de
décès au cours de l'infection VIH.
Le tableau 20 résume les résultats de l'analyse
multivariée par régression du modèle de Cox dans lequel
nous avons introduit tous les 7 facteurs potentiels de mauvais pronostic de
l'infection VIH au stade SIDA.
Les valeurs de X2 avec celles de p correspondantes
pour évaluer la corrélation entre les covariables (facteurs) et
la survie sont données au premier et au dernier pas de la
régression de Cox. Le premier pas sert comme une analyse
univariée (stratification par intervalle de temps entre le passage au
stade SIDA et le décès), le test de signification statistique
à ce palier étant l'équivalent du Logrank test.
Tableau 20 - Risque relatif et valeur de p de
mortalité par analyse multivariée
de régression pas à pas du modèle de
Cox du diagnostic SIDA au décès
|
Premier pas
|
Dernier pas
|
|
Variables
|
X2
|
p
|
X2
|
p
|
RR (I.C.95%)
(Exp. B coeff.)
|
|
CD4
< 400/ 400***
|
19,63
|
0,0000
|
22,58
|
0,0000
|
3,4 (2,1 - 5,6)
|
|
Complications cardiaques
PERI/CMD**
|
8,15
|
0,0043
|
8,18
|
0,0042
|
2,0 (1,2 - 3,2)
|
|
Sexe (H/F)
|
0,19
|
0,657
|
0,008
|
0,925
|
-
|
|
Age (<32/>32)
|
5,31
|
0,021*
|
2,561
|
0,109
|
-
|
|
VG DD (<6/>6)
|
6,37
|
0,011*
|
0,854
|
0,355
|
-
|
|
VE/VA (<1/>1)
|
2,03
|
0,153
|
2,548
|
0,110
|
-
|
|
EDp (<1,2/>1,2)
|
0,02
|
0,865
|
0,515
|
0,472
|
-
|
PERI : péricardite.
CMD : cardiomyopathie dilatée.
H : hommes
F : femmes
Au dernier pas de la régression de Cox, analyse
multivariée, ont été retenus par ordre décroissant
deux facteurs de risque de décès les plus significatifs :
- le nombre de CD4 < 400/mm3 confère un
risque relatif de décès de 3,4 (I.C. 95%, 2,1 - 5,6) aux patients
passés au stade SIDA par rapport à CD4 400/mm3 ;
la différence statistique étant très hautement
significative (p = 0,0000) ;
- au stade SIDA de l'infection avec atteintes cardiaques, la
péricardite liquidienne renferme un risque relatif de
décès de 2 (I.C. 95%, 1,2 - 3,2) par rapport à la
cardiomyopathie dilatée avec une différence hautement
significative (p = 0,0042).
Pour les autres facteurs (sexe, âge, VGDD, VE/VA, EDp),
il n'existe pas de différence significative.
3. Courbes de survie
La probabilité pour un patient zaïrois au stade
SIDA d'être toujours en vie en fonction du temps et pour les 7 facteurs
potentiels de pronostic est représentée aux figures 16 à
22.
L'effet du compte de CD4 égal ou supérieur
à 400/mm3 et la survenue d'une cardiomyopathie dilatée
au stade SIDA donne la meilleure prédiction de survie.
Figure 16
Fonction de survie globale estimée chez 87 patients
cardiopathes au stade SIDA : survie médiane 3 ans, I.C. 95% (3 ; 3). +
: données censurées de 12,64% patients survivants 7 ans
après le diagnostic du SIDA.
Figure 17
Courbes de survie après passage au SIDA chez les
hommes () et les femmes () du Zaïre. probabilité d'être en
vie comme fonction du temps non influencée par le sexe.
Figure 18
Influence de l'âge au moment du diagnostic du SIDA
sur la fonction de survie. les patients ayant progressé vers le stade
SIDA avant l'âge de 32 ans présentent une probabilité de
survie (médiane : 5 ans) plus élevée que ceux l'ayant fait
après l'âge de 32 ans (médiane : 3 ans) ; la
différence statistique étant hautement significative, p =
0,003.
Figure 19
Après le passage au stade SIDA, la
probabilité d'être en vie est plus grande en cas de dilatation
(DD+) du ventricule gauche (survie médiane : 3 ans) qu'en cas de
cavité normale (DD-) du ventricule gauche (survie : 2 ans), avec
une différence statistique significative, p = 0,03.
Figure 20
Courbes de survie après diagnostic du SIDA en
présence de l'hypertrophie (HVG) de la paroi postérieure du
ventricule gauche (survie médiane : 2 ans) versus épaisseur
normale de la paroi postérieure (Edp=n) du ventricule gauche (survie
médiane : 3 ans). La différence est significative, p =
0,04.
Figure 21
Courbes de survie estimée après progression
vers le stade SIDA en association avec la péricardite liquidienne (PERI)
ou la cardiomyopathie dilatée (CMD). La durée moyenne de la
survie est plus longue en cas de cardiomyopathie dilatée (4 ans) qu'en
cas de péricardite liquidienne (3 ans), la différence
étant significative, p = 0,03.
Figure 22
Courbes de survie en fonction du taux initial
pré-diagnostic du SIDA des lymphocytes CD4 400/mm3 . La
survie médiane est très significativement plus longue avec CD4
400/mm3 (5 ans) qu'avec CD4 < 400/mm3 (5 ans) qu'avec
CD4 < 400/mm3 (2 ans), p = 0,0000.
5.6. DISCUSSION
En passant en revue les publications américaines et
européennes sur les atteintes cardiaques associées au SIDA,
Anderson et Virmani rapportent que 6 à 7% des patients infectés
par le VIH présentent des affections cardiaques patentes faites de
tamponnade, CMD, d'arythmies, d'infiltration néoplasique du coeur, etc.
(ANDERSON D.W., VIRMANI R., 1990). La fréquence de ces anomalies
cardiaques du SIDA est de l'ordre de 28 à 73% (REILLY J.M. et al., 1988
; BAROLDI G. et al., 1988).
L'amélioration du traitement des patients avec
infection VIH prolonge la vie de ces patients (CLIFFORD C.D., 1990). Les
anomalies cardiaques sont les causes de décès de 1,1 à
6,3% des sujets (ANDERSON D.W., VIRMANI R., 1990).
En Europe, l'observation de l'infection VIH a montré un
taux de 40,2% des patients décédés ; le
décès est dû à une complication cardiaque dans 13,7%
des cas (DE CASTRO S. et al., 1992). La même constatation a
été faite en Afrique (BERTRAND Ed., 1992) où 6 à
16% des patients sont décédés de causes cardiaques. La
présence des signes cardiaques assombrit le pronostic du noir africain :
près de 50% des décès en moins de 6 mois (BERTRAND Ed.,
1992).
L'objectif de la présente étude a
été de comprendre le rôle de l' association entre le stade
SIDA de l'infection VIH avec atteinte cardiaque et certaines variables
cliniques, biologiques et échocardiographiques sur la survie. Nous
notons une fréquence masculine plus importante que celle des femmes (sex
ratio 1,5) alors que le sex ratio dans la population globale en Afrique est de
1 (QUINN T.C. et al., 1986).
Certains signes cliniques, biologiques et
échocardiographiques ont été reconnus comme marqueurs de
mauvais pronostic accélérant la progression de l'état VIH
positif vers le stade SIDA (FAHEY J.L. et al., 1990 ; SAAH A.J. et al., 1992 ;
SAAH A.J. et al., 1994 ; CURRIE P.F. et al., 1994). Dans ces dernières
études longitudinales, la diminution du nombre absolu de CD4
associée à d'autres facteurs cliniques est le facteur
déterminant de pronostic d'une progression rapide vers le stade SIDA de
l'infection VIH. Malheureusement il n'a pas été clairement
démontré que ces facteurs étaient autant capables de
prédire le pronostic des patients après leur passage au stade
SIDA.
En Angleterre, la cardiomyopathie dilatée au cours de
l'infection VIH est étroitement associée à une
déplétion de CD4 (< 100/mm3) et à une
très courte survie de l'ordre de 101 jours (I.C. 95%, 42-146 jours) en
comparaison avec les autres atteintes cardiaques ou ceux ayant un coeur normal
(CURRIE P.F. et al., 1994).
Nous avons donc soupçonné 7 facteurs avec valeur
potentielle de pronostic sur l'évolution des atteintes cardiaques et de
l'infection VIH du noir africain après passage au stade SIDA.
Au cours de l'infection VIH, les complications cardiaques de
87 noirs du Zaïre sont accompagnées d'une survie moyenne de 4 ans
(médiane 3 ans) après le diagnostic du stade SIDA,
espérance de vie plus longue que la survie moyenne de 1 an
décrite chez le noir africain sans atteintes cardiaques (RYDER R.W. 1988
; MANN J. et al., 1992). Ce travail montre que le noir du Zaïre, une fois
passé au stade SIDA avec une cardiomyopathie dilatée et moins
avec une péricardite, n'évolue pas rapidement à la mort.
L'explication la plus vraisemblable de ce phénomène est que ces
patients, sans traitement antirétroviral (AZT),
bénéficient d'une qualité de soins pour leurs affections
opportunistes et un suivi cardiologique à Lomo Médical de
Kinshasa comparables à ceux des patients européens ou
américains.
L'âge médian des patients au moment du diagnostic
du stade SIDA est de 32 ans. Cet âge jeune (< 40 ans) noté
également au Congo-Brazzaville (BOURAMOUE C. et al., 1992), en Italie
(DE-CASTRO S. et al., 1992) et en Angleterre (SAAH A.J. et al., 1994) s'est
montré un bon facteur prédictif d'une plus longue survie chez les
patients passés au stade SIDA avant 32 ans que ceux âgés
plus de 32 ans, confirmant ainsi d'autres études menées en Europe
(FRIEDLAND G.H. et al., 1991 ; PEDERSEN C. et al., 1990 ; SAAH A.J. et
al., 1994).
Le sexe et la dysfonction diastolique (VE/VA < 1)
n'exercent aucun effet sur le cours de l'état SIDA de ces patients. La
répartition de la survie médiane hommes-femmes atteint
pratiquement l'unité (3/4 ans) et correspond à une transmission
hétérosexuelle de l'infection VIH en Afrique sub-saharienne. Une
étude réalisée à Kinshasa a montré que
l'âge et le sexe étaient étroitement liés à
la séroprévalence VIH (RYDER, W.R. et al., 1987). Entre 25 et 35
ans autant d'hommes que de femmes sont infectés par le VIH et
après 35 ans ce rapport s'inverse au détriment des hommes, car
à l'âge identique ici les hommes sont deux fois plus
touchés (hommes/femmes = 1,5). On a essayé de spéculer
qu'un index anormal de la fonction diastolique servirait à identifier
tout patient exposé à développer des anomalies systoliques
et donc de la dysfonction ventriculaire gauche. La valeur prédictive
des index anormaux de la fonction diastolique n'est pas encore
explicitée. La majorité de patients (75%) présentent
avant l'installation du stade SIDA une diminution du rapport VE/VA en-dessous
de l'unité (altération du remplissage diastolique) qui n'influe
pas sur l'évolution VIH.
Si globalement les complications cardiaques associées
au SIDA manifestent une survie plus longue que les affections opportunistes du
SIDA des africains en général, la comparaison des
catégories révèle que la péricardite est
entachée d'une surmortalité sur 7 ans (93%) par rapport à
la cardiomyopathie dilatée (83%). La survie médiane des patients
avec cardiomyopathie dilatée (3 ans, 2-4) à Kinshasa est 12
à 6 fois plus longue que celle rapportée aux Etats-Unis et en
Amérique (CURRIE P.F. et al., 1994 ; HIMELMAN R. et al., 1989 ;
FACTOR S.M., 1989). L'explication est que la moyenne du nombre de CD4 chez les
patients de Kinshasa avec cardiomyopathie dilatée est supérieure
à 400/mm3. Certains médicaments administrés
aux patients avec SIDA (anthracycline, pentamidine, etc.) toxiques pour le
myocarde et l'effondrement du taux de CD4 associé aux cardiomyopathies
dilatées en Europe et aux Etats-Unis ont été
rapportés (CURRIE P.F., 1994). L'azothymidine (AZT), traitement
antiretroviral, ne diminue pas la prévalence des cardiomyopathies
dilatées ni la mortalité pour certains (HIMELMAN R. et al.,
1989), mais influe favorablement sur le pronostic du SIDA en retardant le
décès pour d'autres (FISCHL M.A. et al., 1987 ; VOLBERDING P.A.
et al., 1990). Nous avons noté une prévalence de
cardiomyopathies dilatées de 52% en association avec l'infection VIH,
taux supérieur à ceux rapportés par Corallo (41%) et Kau
(30 à 40%) en occident (CORALLO S. et al., 1988 ; KAUL S. et al.,
1991).
En analyse multivariée, le nombre de CD4 est
resté avec la péricardite le meilleur facteur de pronostic de
survie des patients zaïrois au stade de SIDA et maintenant sa
signification statistique très haute. Le risque de
décéder au stade SIDA est 3,4 fois plus élevé chez
les Zaïrois avec CD4 < 400/mm3 que chez celui avec CD4 >
400/mm3 (p = 0,0000). Comparée à la cardiomyopathie
dilatée, la péricardite présente un risque relatif de
décès égale à 2.
Le bénéfice du modèle de
régression de Cox réside dans l'utilisation adéquate de
l'information sur la survie de chaque patient, même les patients
restés en vie et dans la possibilité du calcul simultané
de l'effet de tous les facteurs potentiels de risque tout en contrôlant
la covariance entre les variables.
Plusieurs facteurs pronostiques ont été
retrouvés chez les patients sidéens des pays
industrialisés du Nord. Il s'agit entre autres du nombre absolu de
lymphocytes CD4 inférieur à 400/mm3 comme mauvais
pronostic. Quelques publications ont démontré une
corrélation entre le stade du SIDA et la probabilité de trouver
une atteinte cardiaque (LASSAIGNE D. et al., 1991). Le comptage des CD4 a
servi de paramètre dans l'étude de la survie (DE JONG M.S., 1992
; LEVY W.S. et al., 1989 ; MONSUEZ J. et al., 1988).
CHAPITRE VI - FACTEURS GENETIQUES ET CARDIOMYOPATHIE
DILATEE AU COURS DU SIDA
6.1. FACTEURS GENETIQUES ET CARDIOMYOPATHIE DILATEE
Il existe une histoire familiale chez 5 à 10% des
patients avec dilatation cardiaque, arythmies et mort subite (MICHELS V.V. et
al., 1985). Une forme autosomique dominante a été décrite
chez certains enfants avec trouble de conduction (GRABER H.L. et al., 1986),
alors qu'une hérédité x-linked (liée au sexe) a
été remarquée chez d'autres enfants avec formes
neuromyopathiques.
L'importance des facteurs génétiques est moins
grande dans la cardiomyopathie dilatée par rapport à la
cardiomyopathie hypertrophique quand bien même d'autres chercheurs aient
reconnu l'incidence familiale de la cardiomyopathie dilatée (EMMANUEL R.
et al., 1971) et le caractère récessif de cette cardiomyopathie.
Toutefois aucun travail n'a pu prouver le caractère autosomal dominant
de la cardiomyopathie dilatée.
6.2. HEREDITE ET CARDIOMYOPATHIE DILATEE ASSOCIEE AU
SIDA
Malgré les progrès réalisés dans
tous les domaines de la recherche sur le virus VIH, le SIDA reste encore mal
connu. Des inconnues importantes subsistent sur plusieurs points : facteurs
expliquant la sensibilité individuelle inégale à
l'égard du virus VIH ; facteurs ralentissant ou accélérant
l'évolution de la maladie.
La cardiomyopathie dilatée est reconnue aujourd'hui
comme une complication de l'infection VIH puisqu'elle est présente chez
10 à 20% des patients américains avec SIDA (HIMELMAN R.B. et al.,
1989 ; LEVY W.S. et al., 1989). La fréquence des cas de cardiomyopathie
dilatée a été notée en Afrique noire entre 8, 4 et
19,9% des patients infectés par le VIH (TONDUANGU K. et al., 1994).
L'existence d'une incidence familiale a été notée chez des
patients américains avec cardiomyopathie dilatée idiopathique
(HARVEIT F. et al., 1981). La myocardite évolue souvent vers la
cardiomyopathie dilatée (KAUL S. et al., 1991). Des recherches
histopathologiques ont montré une incidence élevée des cas
de myocardite aussi bien chez des patients avec infection VIH que chez des
patients sans facteurs de risque de SIDA et la présence des
antigènes HLA-A, B, C classe I et HLA-DR classe II chez ces deux groupes
de patients (BISCHORNER W.E. et al., 1990). Le mécanisme
immunopathologique des myocardites de ces deux groupes de patients est une
agression à médiation cellulaire des myocytes.
Certains mécanismes d'auto-immunité ont
été décrits chez les sujets VIH positifs sous forme
d'hypergammaglobulinémie, d'immunocomplexes circulants et d'anticorps
anti-HLA classe II (GOLDING H. et al., 1988 ; PROCACCIA S. et al., 1991).
Cette auto-immunité est aussi à la base de la dépletion
des cellules CD4 (SLOAND E. et al., 1992). Il existe une homologie entre la
molécule gp120 du VIH et les châines â (bêta) du
complexe d'histocompatibilité majeure (MHC) classe II, ligand naturel
des CD4 (PUGLIESE O. et al., 1992). La protéine gp41 partage une
homologie avec certaines régions de la classe II tandis que les
protéines de l'enveloppe du VIH et l'interleukine (IL)-2 le font avec
les protéines du complexe HLA classe I. Les superantigènes (ou
Poke week mitogen "PWM") se lient à diverses molécules du
système HLA en dehors du sillon conventionnel d'anchrage de
l'antigène normal et exigent pour la reconnaissance de la cellule T la
région V (variable) de la chaîne â d'une cellule T
réceptrice d'antigène (Figure 23).
Figure 23
Interactions des antigènes conventionnels et des
superantigènes avec les cellules T CD4.
A. Mode conventionnel : interactions avec toutes les
régions variables des chaînes á et â de la cellule
réceptrice.
B. Interactions des superantigènes avec la
région variable de la chaîne â de la cellule
réceptrice (PANTALEO et al., 1993)
On pense aujourd'hui que le virus VIH encoderait une
protéine qui pourrait agir comme un superantigène. Cette
protéine (superantigène chez l'homme et superantigenlike protein
chez la souris) stimule l'expansion des organites lymphocitaires T
spécifiques pour le transport de Vâ, expansion à l'origine
de l'immunodéficience humaine (AIDS) ou de la souris (MAIDS, virus de la
leucémie de la souris). Il existe également une identité
moléculaire entre les protéines (p. 17 et 24) du core du VIH et
les myocytes cardiaques (GU et al., 1992). Aux Etats-Unis, 0,7 à
7/100.000 sujets VIH négatifs développent une cardiomyopathie
dilatée (ABELMAN, 1985) alors que 6,2% sur 450 VIH positifs
présentent une cardiomyopathie dilatée symptomatique (LEVY,
1989). Il est clair donc que les séropositifs pour le VIH manifestent
une susceptibilité accrue à développer une cardiomyopathie
dilatée avec insuffisance cardiaque congestive (HERSKOWITZ, 1993).
La fréquence élevée de certains groupes
tissulaires (HLA A1-B8-DR3, HLA-DR1, HLA B35, HLA DR5) a été
notée chez des sujets homosexuels ou immunodéprimés par le
VIH (MANN D.L. et al., 1988 ; FRIEDMAN K.A.E., 1982 ; STEEL et al., 1988).
La présente étude a été
conçue pour rechercher une cause immunopathologique possible liée
au complexe majeur d'histocompatibilité (HLA) chez le noir du Zaïre
souffrant de cardiomyopathie dilatée concomitante à une infection
VIH. Et le typage de l'antigène HLA-DRB1 avait comme objectif
spécifique de vérifier si les polymorphismes de HLA classe II
contribuerait à la susceptibilité des patients VIH positifs
à développer une cardiomyopathie dilatée. L'existence
éventuelle d'une base génétique particulière
pourrait influencer la réponse immunitaire dans la cardiomyopathie
dilatée associée à l'agression virale du VIH.
6.2.1. DEFINITION DU COMPLEXE HLA
Le système immunitaire comprend différents types
de cellules et de molécules qui défendent l'organisme contre les
infections et les cellules cancéreuses.
Les molécules de l'antigène leucocytaire humain
de la classe II (HLA) sont codées par des gènes du complexe
humain d'histocompatibilité (MHC) situé dans le bras court du
chromosome 6 (KAPPES et STROMINGER, 1988). Elles se manifestent au niveau du
plasma sous forme des hétérodimères produits d'un groupe
des loci áâ. Les trois loci majeurs de la classe II dits DR, DQ
et DP sont des gènes séparés A et B qui codent les
hétérodimères áâ présentant les
antigènes peptidiques au répertoire récepteur des cellules
T (KAPPES et STROMINGER, 1988).
6.3. METHODES
6.3.1. PATIENTS
Ving-huit patients (16 hommes et 12 femmes ; âge moyen
47 ans, extrêmes 24 <-- >74 ans) souffrant de cardiomyopathie
dilatée et d'infection VIH stade C2 CDC ont été inclus
dans l'étude d'une manière aléatoire, le tirage au sort se
faisant à partir du registre.
Critères d'inclusion :
- dilatation du VG
- insuffisance cardiaque congestive au stade IV de la NYHA
- critères de l'OMS pour le diagnostic de CMD
(WHO/ISFC, 1980)
- diagnostic de l'infection VIH selon les critères du
CDC (CDC, 1993).
Vingt-huit sujets sains et donneurs bénévoles du
sang ont été sélectionnés de manière
aléatoire à la Banque du Sang de l'Hôpital Mama Yemo,
Kinshasa, pour servir de groupe témoin. Ce groupe témoin
était constitué de 18 hommes et de 10 femmes (âge moyen 44
ans, extrêmes 22 <-> 50 ans).
Nous avons donc constitué à partir de ces sujets
noirs originaires du Zaïre qui ont donné leur libre consentement
deux groupes (avec CMD-SIDA et sans CMD-SIDA).
6.3.2. EXTRACTION DE L'ADN GENOMIQUE
Une méthode de désalinisation
antérieurement publiée (MILLER S.A. et al., 1988) a servi
à la préparation de l'ADN génomique à partir de la
lignée cellulaire B (lymphocytes). La lyse et la digestion du sang ont
été obtenues par le traitement nonionique de détergent
protéinase K comme décrit ailleurs (HIGUCHI R., 1989). Une
méthode alternative a aussi été adaptée pour
l'analyse des échantillons sanguins (SCHWARTZ E.I. et al., 1990).
Dix ìl de sang ont été
étalés sur du papier Whatman de 3mm d'épaisseur dont un
petit morceau de 1 à 2 mm3 de volume a été
coupé et ajouté immédiatement à ce mélange
d'amplification.
6.3.3. TYPAGE DE L'ANTIGENE DRB1
Le typage de l'antigène DRB1 a été
réalisé à partir des échantillons de sang
prélevés dans des tubes contenant de l'EDTA. Les
échantillons ont été typés grâce à des
méthodes de sérologie et de polymorphisme de longueur des
fragments de restriction (RFLP). Cette technique RFLP (restriction fragment
length polymorphism) permet de comparer les ADN de différents individus
et de rechercher si des mutations ponctuelles faisant apparaître ou
disparaître des sites de restriction se sont produites. Deux ADN de
séquence identique traités par des enzymes de restriction
donneront des fragments identiques. Les Southern blots obtenus avec ces
fragments d'ADN seront donc identiques. Au contraire si un site de restriction
a disparu, à la suite d'une mutation ponctuelle, les fragments n'auront
plus des tailles identiques, ce qui sera donc visible sur les auroradiogrammes.
Il en est de même si un nouveau site de restriction est apparu à
la suite d'une mutation. La méthode de l'oligotypage nonisotonique
utilisant l'hybridation de dot blot reverse a été
préférée dans l'étude des allèles DRB1 de la
classe II du HLA. Le second exon polymorphe de différents gènes
a été amplifié par la réaction de la chaîne
polymérase (PCR). La PCR permet d'amplifier la quantité d'ADN
dont on dispose initialement. Il s'agit d'une amplification enzymatique in
vitro. Pour chaque gène, l'hybridation de l'ADN amplifié s'est
déroulée dans des conditions pour les oligonucléotides
(SSOs) spécifiques avec séquences liées aux
membranes, alors que la visualisation des signaux positifs a été
rendue possible par la chimioluminescence. Une combinaison de 11, 18, 23 et de
31 SSOs a été conçue pour identifier le locus
des 50/55 DRB1. Pour le locus de DRB1, une PCR spécifique pour le
groupe DRB 04 a été utililsée en vue d'opérer une
discrimination entre les éventuelles allèles DR4 de
différentes combinaisons hétérozygotes.
6.3.4. PRIMERS DE PCR
L'amplification spécifique du locus a été
effectuée pour l'analyse des gènes. La constitution des paires
des primers a servi à amplifier les seconds exons complets et
polymorphes en comparant les séquences restées intactes et qui
confèrent aux régions la diversité.
Une méthode non-radioactive rapide amplifiant le second
exon par PCR a servi à typer les polymorphismes du gène HLA
classe II. Cette méthode a été suivie par la technique
d'hybridation de dot blot reverse comme publié antérieurement
(BUYSSE I. et al., 1993).
Pour amplifier les loci de DRB et DPB1 de la classe II du HLA,
nous avons utilisé :
- le primer DRB - 1(5'-GAT-CCTTCGTGTCCCCACAG - (ACG - 3')
- le primer biotinylé DRB - BR (5' - B - CGCTGCAC -
TGTGAAGCTCTC - 3')
- le primer DPB - 1 (5'CCTCCCCGCAGAGAATTAC - 3')
- le primer biotinylé DPB - BR (5'BGCCGG - CCCAAAG -
CCCTCA - 3').
En fin, 0,5 ìg d'ADN génomique a
été amplifié par 0,2 ìM de chaque primeur dans un
volume de 50 ìl de mélange PCR contenant 50 mM KCl, 10 mM
Tris-HCL pH 8,3, 0,01% gélatine, 1,5 mM MgCL2, 200 ìM
de chaque triphosphate désoxynycléotidique (Pharmacia), 1
unité de Taq ADN polymérase (Gibco BRL). Nous avons
réalisé des conditions d'un cycle thermique par une étape
de dénaturation durant 5 minutes à une température de 94
C, recuire (détremper) durant 1 minute à une température
de 55 C, une élongation de 1 minute à 72 C et une
étape finale d'extension de 10 minutes à 72 C.
6.3.5. ANALYSE STATISTIQUE
La fréquence phénotypique de l'antigène
HLA-DRB1 des patients VIH séropositifs et souffrant de cardiomyopathie
dilatée a été comparée à celle des
témoins.
Nous avons utilisé le Chi-carré (÷) et les
valeurs ajustées de P au nombre d'allèles comme tests
statistiques (SVEYGARD A. et al., 1974).
6.4. RESULTATS
L'échocardiogramme a confirmé le diagnostic de
cardiomyopathie dilatée chez tous les patients VIH positifs (CM) et
l'absence d'atteinte cardiaque dans le groupe témoin (CMN).
La fréquence phénotypique des antigènes
DRB1 du système HLA des patients VIH positifs avec CMD et des
témoins est reportée aux tableaux 21 et 22.
Tableau 21 - Liste du typage de DRB1
1 1107 1500 CM
2 1201 1300 CM
3 1106 1300 CM
4 1500 0806 CM
5 1202 0806 CM
7 0101 1300 CM
8 1500 1600 CM
9 0101 1105 CM
10 0301 0701 CM
11 1500 1500 CM
12 1500 0901 CM
13 1201 1106 CM
14 1202 1500 CM
14 1500 1202 CM
15 1106 1500 CM
16 1106 1500 CM
18 1500 0701 CM
19 1107 0701 CM
20 0101 1300 CM
21 1500 1001 CM
22 0901 0701 CM
23 1106 1300 CM
24 0901 1300 CM
25 1500 1600 CM
26 0901 0406 CM
27 1107 0701 CM
28 1107 0301 CM
29 0301 1001 CM
529 0101 0701 CMN
530 1106 1106 CMN
531 1106 0701 CMN DRB1*1106=DRB1*1101 or DRB1*1104
532 1300 1103 CMN DRB1*1107=DRB1*1102 or DRB1_1104
533 1106 1107 CMN DRB1*1500=DRB1*1501 or DRB1*1502 or
DRB1*1
534 1500 1600 CMN DRB1*1600 = DRB1*1601 or DRB1_1602
535 1300 1600 CMN DRB1*0806 = DRB1*0802 or DRB1*0804
536 1106 1001 CMN DRB1*0807 = DRB1·0801 or DRB1*0805
538 1500 1300 CMN DRB1*1300 = DRB1*1301 or DRB1*1302
540 1106 1400 CMN DRB1*1400 = DRB1*1401 or DRB1*1407
541 0807 1303 CMN
542 1500 1500 CMN
543 1500 0806 CMN
544 1500 0806 CMN
545 1500 0807 CMN
546 1106 0301 CMN
547 0301 0806 CMN
548 0301 1300 CMN
549 1106 1500 CMN
550 1500 1300 CMN
551 0301 0806 CMN
552 0301 0301 CMN
553 1500 0500 CMN
554 0301 0302 CMN
555 1106 1106 CMN
556 1500 1300 CMN
557 0101 1500 CMN CM : cardiomyopathie
558 1106 1500 CMN CMN : sujet normal
Tableau 22 - Comparaison de la fréquence de
différentes allèles des patients VIH+
avec cardiomyopathie (CM) à celle des normaux
(CMN)
0101 0701 0 1 1
0101 1105 1 0 1
0101 1300 2 0 2
0101 1500 0 1 1
0301 0301 0 1 1
0301 0302 0 1 1
0301 0701 1 0 1
0301 0806 0 2 2
0301 1001 1 0 1
0301 1300 0 1 1
0807 1303 0 1 1
0901 0406 1 0 1
0901 0701 1 0 1
0901 1300 1 0 1
1106 0301 0 1 1
1106 0703 0 1 1
1106 1001 0 1 1
1106 1106 0 2 2
1106 1107 0 1 1
1106 1300 2 0 2
1106 1400 0 1 1
1106 1500 2 2 4
1107 0301 1 0 1
1107 0701 2 0 2
1107 1500 1 0 1
1201 1106 1 0 1
1201 1300 1 0 1
1202 0806 1 0 1
1202 1500 1 0 1
1300 1103 0 1 1
1300 1600 0 1 1 DRB1*1106 = DRB1*1101 or DRB1*1104
1500 1701 1 0 1 DRB1_1107 = DRB1*1102 of DRB1*1104
1500 0806 1 3 4 DRB1*1500 = DRB1*1501 or DRB1_1502 or
DRB1*1503
1500 0901 1 0 1 DRB1*1600 = DRB1*1601 or DRB1*1602
1500 1001 1 0 1 DRB1*0806 = DRB1*0802 or DRB1*0804
1500 1202 1 0 1 DRB1*0807 = DRB1*0801 or DRB1*0805
1500 1300 0 3 3 DRB1*1300 = DRB1*1301 or DRB1*1302
1500 1500 1 1 2 DRB1*1400 = DRB1*1401 or DRB1*1407
1500 1500 0 1 1
1500 1600 2 1 3
ALL 28 28 56
6.5. DISCUSSION
Coughlin S.S. et al. ont pensé à l'existence des
facteurs liés à la race et peut-être aux antigènes
de l'histocompatibilité HLA pouvant intervenir dans l'association
habituelle de la race et des cardiomyopathies d'allure primitive (COUGHLIN S.S.
et al., 1990). Un facteur génétique a été
identifié dans certaines familles présentant plusieurs cas de
cardiomyopathie dilatée (GERBEAUX, 1989). La fréquence
élevée du complexe HLA a aussi été notée
chez des patients avec cardiomyopathies idiopathiques dilatées (KOMAJDA
M. et al., 1987). L'association entre les phénotypes B27 et DR4 du
système HLA et la cardiomyopathie dilatée chez des patients de
race blanche a été décrite il y a longtemps (ANDERSON
J.L., et al., 1984). Des études récentes ont montré une
relation entre les anticorps anti-bêta récepteurs et le
phénotype DR4 du complexe HLA chez le blanc avec cardiomyopathie
dilatée (LIMAS C.J. et al., 1990), et une fréquence nettement
élevée des antigènes DR1 et DRW10 du complexe HLA chez des
patients noirs d'Afrique du Sud avec cardiomyopathie dilatée (MAHARA
D., 1990). Les antigènes DP, DQ et DR de la classe II du complexe HLA
sont des glycoprotéines hétérodimériques comprenant
une chaîne alpha (á) et une chaîne (â). Ils sont des
molécules de la surface cellulaire induites par l'interféron
ã (gamma) et s'exprimant principalement au niveau des cellules
présentatrices d'antigènes et des monocytes. Les
antigènes de la classe II jouent un rôle capital vis-à-vis
d'un antigène étranger aux cellules T en vue de déclencher
une réponse immunitaire adéquate (KAPPES D., 1988). Ils
interviennent aussi dans le processus d'auto-reconnaissance immunitaire
spécifique en déterminant le répertoire de la
réception des cellules T transformées en cellules T matures
(SCHWARTZ R.H., 1989). En outre, ils jouent un rôle on ne peut plus
important dans l'immunologie de la transplantation des organes (MORRIS P.J. et
al., 1987 ; TIERCY J.M. et al., 1991) et dans la susceptibilité aux
maladies auto-immunes (THOMSON G., 1988). Les patients souffrant de
cardiomyopathie dilatée présentent des anomalies humorales,
cellulaires et des régulateurs de la réponse immunitaire
adéquate (ANDERSON J.L. et al., 1987 ; ANDERSON J.L. et al., 1985).
Leur signification étiopathogénique n'est pas encore
élucidée surtout en ce qui concerne la spécificité
des anticorps anti-myocardes (KOMAJDA M. et al., 1982).
La majorité des gènes exprimés de la
classe II dans le complexe HLA met en évidence une variabilité
allélique étendue. La sous-région de l'antigène
DRB est unique de telle sorte que l'organisation des gènes DRB n'est pas
identique pour tous les haplotypes (KAPPES D., 1988). Quatre gènes DRB
exprimés comme DRB1, DRB3, DRB4 et DRB5 ont été
définis avec leurs caractéristiques et selon le haplotype, un
maximum de 2 gènes DRB ont été codés (SCHWARTZ
R.H., 1989 ; MORRIS P.J. et al., 1987).
Notre étude a utilisé le test dot blot
nonisotopique reverse (SAIKI R.K. et al., 1989) pour les gènes DRB1 de
la classe II du système HLA. La méthode est fondée sur
l'amplification de la PCR de différents exons seconds suivie d'une
hybridation destinée aux SSOs immobilisés et à
une visualisation nonisotopique des signaux positifs. Les molécules de
la surface cellulaire des antigènes du complexe HLA, intervenant dans le
contrôle de la réponse immunitaire et de
l'alloréactivité, sont hautement polymorphes spécialement
dans les loci de la classe II. 60 allèles au moins ont
été décrits pour le seul locus HLA - DRB1 (BODMER J.G. et
al., 1992).
La présente étude ne montre pas des variations
significatives au niveau des fréquences alléliques puisque
DRB1*1106 (DRB1*1101 ou 1104) est retrouvé simultanément chez 5
hommes VIH positifs avec cardiomyopathie dilatée et chez 9
témoins (8 hommes et 1 femme). Pour démontrer une
éventuelle association protectrice ou négative de cet
antigène avec la cardiomyopathie dilatée au cours du SIDA, le
typage de l'antigène DRB devrait être effectué au sein
d'une population plus large de patients VIH positifs avec cardiomyopathie
dilatée et un échantillon plus important de témoins.
Mais la fréquence allélique de DRB1* 1106
exclusivement masculine tant chez les zaïrois infectés par le VIH
(5 hommes sur 5) que chez les témoins (8 hommes sur 9) ferait penser
à une hérédité liée au sexe où les
hommes seraient hémizygotes et les femmes homozygotes et
hétérozygotes. L'hémophilie se transmet selon ce mode.
Et la prédominance des hommes homosexuels ou hémophiles (95%)
atteints de sarcome de Kaposi, d'affections opportunistes et de cardiomyopathie
dilatée dans la littérature américaine ou
européenne (GROOPMAN J.E., 1982 ; MARX J.L., 1983 ; WATERSON A.P., 1983
; JACOB A.J. et al., 1992) montrant une incidence élevée de
HLA-DR5 pourrait suggérer une hérédite liée au
chromosome X.
L'absence d'une association significative de l'antigène
DRB1 avec la cardiomyopathie dilatée associée à
l'infection VIH chez le noir du Zaïre suggère la notion d'une
affection multifactorielle avec une interaction immunitaire non encore
élucidée. La même conclusion a été
tirée par Beschorner W.E. et al. sur la myocardite associée
à l'infection VIH (BESCHORNER W.E. et al., 1990).
Un environnement particulier du Zaire et la présence du
SIDA pourrait expliquer la discordance qui existe entre nos résultats et
ceux publiés ailleurs avant l'épidémie du SIDA. Il est
donc indiqué de poursuivre cette étude sur des cohortes plus
importantes. En effet, la comparaison des VIH positifs avec CMD versus VIH
négatifs sans CMD, des VIH positifs sans SMD versus VIH négatifs
sans CMD et des VIH négatifs avec CMD versus VIH négatifs sans
CMD aurait peut-être mis en évidence l'association du VIH avec la
CMD.
CHAPITRE VII - EVOLUTION DE LA TENSION ARTERIELLE AU
COURS DE L'INFECTION VIH
7.1. INTRODUCTION
La grande majorité de patients (95% à 100%)
sont normotendus au début et à la fin de leur dépression
immunitaire pour le VIH en dépit d'une perte rapidement progressive de
leur fonction rénale (BOURGOIGNIE J.J. et al., 1988 ; BOURGOIGNIE J.J.,
1989 ; RAO T.K.S., FRIEDMAN, 1989 ; SONI A. et al., 1989). Cette absence
d'hypertension artérielle systémique serait attribuée
à deux facteurs : d'une part l'hypovolémie due à une
diarrhée chronique, et d'autre part une insuffisance
surrénalienne chronique en rapport avec la nécrose
surrénalienne fréquemment retrouvée à l'autopsie
des patients avec SIDA (BOURGOIGNIE J.J., 1990). Cependant, d'autres auteurs
ont noté la présence de l'hypertension artérielle chez des
patients sans signes cliniques manifestes du SIDA (BOURGOIGNIE J.J. et al.,
1988 ; CARBONE et al., 1989). La cyclosporine, médicament
utilisé dans le SIDA, entraîne entre autres effets secondaires
l'hypertension artérielle (ANDRIEU J.M. et al., 1988).
Aux Etats-Unis d'Amérique, la race noire (96% à
100% des patients), la drogue (42% des patients) et l'hypertension
artérielle systolo-diastolique ou diastolique constituent pour la
méningite à cryptocoque et l'atteinte rénale
spécifique de l'infection VIH (HIVAN) des facteurs péjoratifs du
pronostic (PATTY F.H. et al., 1992 ; CARBONE L. et al., 1989).
L'élévation de la tension artérielle diastolique (TAD >
110 mmHg) entraîne une mortalité très marquée et
montre une corrélation positive avec l'hyperpression du liquide
céphalo-rachidien (PATTY F.H. et al., 1992).
Le mécanisme étiopathogénique de
l'élévation de la tension artérielle au cours de
l'infection VIH n'est pas encore élucidé.
L'objectif de la présente étude est
d'évaluer l'action de l'infection VIH sur la tension artérielle
du noir zaïrois.
7.2. PATIENTS
7.2.1. HYPERTENSION ARTERIELLE TRANSITOIRE ET INFECTION VIH
: ETUDE PRELIMINAIRE
Sont inclus dans cette partie d'étude prospective 18
patients noirs du Zaïre dont 9 hommes et 9 femmes, avec une moyenne
d'âge de 40 + 12 ans. Leur observation a courru du 12
décembre 1992 au 1er juillet 1994.
Sont exclus les patients hypertendus connus ayant une
hypertrophie du VG à l'échocardiogramme et une
rétinopathie hypertensive au fond d'oeil.
L'infection VIH est au stade A1 du CDC 1993 chez 14 patients
sur 18 (9 hommes et 5 femmes). 4 patients ont été perdus de
vue.
La vitesse de sédimentation des globules rouges (VS) et
la fréquence cardiaque (Fc) sont les moyennes de 7 mesures
pratiquées au cours de l'observation. Nous avons
considéré les moyennes de 3 mesures de la tension
artérielle prises en position couchée, après 5 minutes de
repos à l'admission et au moment du passage au stade SIDA.
Le passage au stade C3 SIDA (CDC 1993) est intervenu au
quatorzième mois de leur suivi chez tous les 14 patients restants (100
%).
7.2.2. EVOLUTION DE LA TENSION ARTERIELLE ET INFECTION
VIH
Le rôle de l'infection VIH sur l'évolution de la
tension artérielle et l'hypothèse que la tension
artérielle serait un facteur prédictif de mauvais pronostic au
stade SIDA ont été évalués auprès de 170
sujets noirs du Zaïre examinés entre 1987 et 1994.
Il s'est agi de comparer les mesures de la tension
artérielle prises 6 mois avant le passage au stade SIDA et puis 6 mois
après ce passage. Seuls les patients ayant le compte de CD4 ont
été colligés et répartis en deux groupes selon les
cohortes suivantes :
a. Groupe de contrôle
Quatre-vingt trois patients dont 49 hommes et 34 femmes, avec
une moyenne d'âge de 36,1 #177; 12,1, ont présenté une
infection VIH au stade C3 SIDA du CDC 1993. En outre, ils ont
développé un syndrome néphrotique et une insuffisance
rénale chronique (protéinurie massive > 4,8 gr/24 h et
créatininémie > 3,2 mg %) dans le cadre de la maladie
rénale propre à l'infection VIH (HIVAN : HIV-associated
nephropathy) des anglosaxons (RAO T.K.S., 1989). L'évolution et les
variations de la tension artérielle de ces patients seront
comparées à celles des patients du groupe suivant.
b. Groupe cible
Cette cohorte de 87 patients mieux décrite au chapitre
V a fourni le matériel d'étude de l'association infection VIH et
tension artérielle. L'anamnèse n'a pas signalé des
antécédents d'hypertension artérielle.
Outre leur infection VIH au stade C1 SIDA du CDC 1993, les
patients ont présenté des complications cardiaques sous forme de
péricardite liquidienne et de cardiomyopathie dilatée.
L'âge moyen est de 33,3 #177; 9,2 ans.
7.3. RESULTATS
Etude préliminaire
Les valeurs moyennes de la vitesse de sédimentation, de
la fréquence cardiaque, de la tension artérielle et ses
dérivés sont rapportées au tableau 23.
La vitesse de sédimentation (72 + 52,3 mm/H) et
la fréquence cardiaque (108 + 28,7 battements/min) sont
accélérées. La tension artérielle systolique est
élevée chez 4 patients (28,57%) alors que la tension
artérielle diastolique est élevée chez tous les 14
patients (100%). La tension artérielle systolique est montée
à 180 mmHg chez un homme qui est décédé deux ans
après de méningite à cryptocoque.
Tableau 23 - Description des paramètres
mesurés et calculés
chez les noirs zaïrois atteints de SIDA
|
Paramètre
|
Moyenne
|
Minimum
|
Maximum
|
|
VS mm/H
FC/min
TAS*mmHg
TAS**mmHg
TAD*mmHg
TAD**mmHg
ÄTASmmHg
ÄTADmmHg
DiffTAj1
DiffTAj2
|
71,79 + 52,33
108,36 + 28,69
138,86 + 25,20
119,57 + 17,01
119,64 + 19,42
84,00 + 13,10
19,29 + 21,93
35,64 + 6,30
19,50 + 15,26
35,57 + 14,86
|
2
64
100
100
84
60
-20
24
|
134
145
180
150
150
104
55
50
|
TAS* et TAD* : à l'admission. TAS** et TAD** :
à la fin. Ä : variations. DiffTA : tension différentielle.
La tension est la moyenne de 10 mesures aux j1 et j2.
La figure 24 et le tableau 24 montrent l'existence des
corrélations positives et significatives entre la vitesse de
sédimentation et la tension artérielle diastolique moyenne (r =
0,844, p = 0,0001), entre la vitesse de sédimentation et la tension
artérielle différentielle (r = 0,749, p = 0,002), entre la
vitesse de sédimentation et la tension artérielle systolique
moyenne (r = 0,586, p = 0,0276), entre la vitesse de sédimentation et la
tension artérielle diastolique à l'admission (r = 0,859, p =
0,0001).
Tableau 24 - Corrélations entre VS, FC, TAS,
TAD, ÄTAD, TAS-TAD
|
Corrélations,p
|
VS
|
FC
|
TAS
|
TAD
|
ÄTAD
|
TAS-TAD
|
|
VS
TAS
TAD
ÄTAD
TAS-TAD
TAD*
|
0.586
p=0.0276*
0.844
p=0.0001***
0.749
p=0.0002**
0.22
p=0.449NS
0.859
p=0.0001***
|
0.938
p=0.0001***
|
0.758
p=0.0017**
|
0.746
p=0.0022**
0.844
p=0.0001***
|
0.712
p=0.0043**
0.033
p=0.910NS
0.891
p=0.0001***
|
0.512
p=0.06NS
0.189
p=0.518NS
0.16
p=0.585NS
|
TAS, TAD : valeurs moyennes de 210 mesures.
Outre avec la vitesse de sédimentation, la tension
artérielle systolique moyenne (129,2 +18 mmHg) est positivement
correlée avec la tension artérielle diastolique moyenne (101,8
+ 16 mmHg) (r = 0,746, p = 0,0022) et la variation de la tension
artérielle diastolique (r = 0,712, p = 0,0043).
Curieusement, la valeur moyenne de la tension
différentielle n'est pas correlée à la vitesse de
sédimentation.
Un patient a présenté à
répétition plusieurs poussées hypertensives, la tension
artérielle systolique atteignant des valeurs de 180 mmHg. La
sévérité de son déficit immunitaire a
été caractérisée par un effondrement des CD4
(100/mm3), une méningite à cryptocoque neoformans et
une insuffisance rénale aiguë. La fonction rénale de tous
les patients est restée normale au cours de l'observation.
Figure 24
Corrélation de la vitesse de sédimentation
avec la tension systolique et la tension diastolique
Nous notons une tendance à l'hypertension
artérielle à l'admission et une normalisation des chiffres
tensionnels avec élargissement de la tension différentielle
à la fin de l'observation. La tension artérielle systolique est
plus élevée à l'admission qu'à la fin de
l'observation (p = 0,02). La tension artérielle diastolique est aussi
plus élevée à l'admission qu'à la fin de
l'étude (p = 0,0000).
La tension artérielle différentielle
s'élève plus sensiblement au moment du passage au stade SIDA de
l'infection VIH (p = 0,009).
Les autres variables ne montrent pas de différence
significative (NS).
Evolution de la tension artérielle au stade
SIDA
Le tableau 25 résume les caractéristiques
générales des patients jeunes passés au stade SIDA. Le
groupe SIDA avec des complications rénales (SIDA et rein)
présente une survie médiane très écourtée
(12 mois) par rapport à celui ayant des complications cardiaques (SIDA
et coeur) (36 mois, p = 0,0000).
Le dépletion des CD4 est plus marquée chez les
patients avec HIVAN (CD4 250/mm3) que chez les patients avec
cardiopathies associées au SIDA (CD4 400/mm3), la
différence est hautement significative (p = 0,000).
Le décès de tous les patients avec SIDA et rein
à 12 mois de l'observation ne permet pas de vérifier l'effet de
la tension artérielle sur la survie.
Tableau 25 - Caractéristiques
générales des patients au stade SIDA
|
Variables
|
SIDA
et
rein
|
SIDA
et
coeur
|
p
|
|
Age (ans)
|
36,1 #177; 12,1
|
33,3 #177; 9,2
|
NS
|
|
Survie médiane
(mois)
|
12
|
36
|
0,0000***
|
|
TAS2 - TAS1 mmHg
|
36,8 + 25
|
63,7 #177; 23,2
|
0,000**
|
|
TAD2 - TAD1 mmHg
|
37,2 + 24,8
|
29,3 #177; 22,6
|
0,04(B=NS)
|
|
CD4 médiane/mm3
|
250
|
400
|
0,000**
|
TAS1, TAD1 : tension artérielle systolique et
diastolique 6 mois avant le passage au stade SIDA
TAS2, TAD2 : mesures prises 6 mois après le passage au
stade SIDA.
p non significatif après correction de Bonferonni.
La phase post-passage SIDA est marquée par une
élévation transitoire de la tension artérielle ;
après correction de Bonferonni, seules les variations de la tension
artérielle systolique montrent une différence hautement
significative entre les groupes (p = 0,000). C'est le groupe SIDA et coeur
avec une élévation transitoire de la tension artérielle
systolique au moment de passer à l'état de SIDA (TAS2 = 169,2
#177; 27 mmHg) qui présente une meilleure survie et un nombre des CD4
plus élevé que les patients avec HIVAN (TAS2 = 145,9 #177; 20,7
mmHg) ; cette tension artérielle systolique est positivement
correlée au nombre absolu des CD4 (r = 0,67, p < 0,001). Il en est
de même pour la tension artérielle diastolique.
Malgré la sévérité des
lésions rénales associées à leur SIDA, seuls 22
patients sur 83 (26,5%) ont présenté l'hypertension
artérielle transitoire contre 52 sur 87 (59,7%) chez les patients avec
cardiomyopathie dilatée et péricardite associées au SIDA,
la différence étant statistiquement significative (p <
0,05).
En comparant les patients avec cardiomyopathie dilatée
et ceux avec péricardite liquidienne dans le groupe SIDA et coeur, la
tension artérielle systolique, la tension artérielle diastolique
et la tension artérielle différentielle ne montrent pas de
différence significative.
Les valeurs des tensions artérielles systolique,
diastolique et différentielle mesurées 6 mois avant le passage au
stade SIDA n'ont pas de valeur prédictive sur la survie à
l'analyse univariée de Kaplan-Meier.
7.4. DISCUSSION
En Afrique noire, aucun cas d'hypertension artérielle
n'a été publié jusqu'à ce jour chez les patients
positifs, mais l'hypotension artérielle a été
décrite au cours du SIDA à cause de la diarrhée chronique
et de la déshydratation du noir (PIOT P. et al., 1993).
L'hyponatrémie (fuite excessive urinaire du sodium) et d'autres facteurs
peuvent contribuer à l'installation de l'hypotension artérielle
au cours du SIDA (VAZIRI N.D. et al., 1985).
Etude préliminaire
La controverse de la présence ou de l'absence de
l'hypertension artérielle systémique dans les atteintes
rénales du SIDA a plutôt montré un iceberg immergé
dans le vaste océan du puzzle-SIDA décrit par des études
rétrospectives. Ces dernières études évaluent des
patients au stade terminal de l'insuffisance rénale et de l'infection
VIH.
Le mérite de la partie préliminaire est
d'analyser l'évolution tensionnelle de manière dynamique et
pendant longtemps (7 mois d'observation) malgré l'échantillonnage
fort réduit à 14 patients (18 patients recrutés au
départ).
A ce stade, tous les patients ont présenté un
tableau clinique de myopéricardite confirmée par
l'échocardiographie. Une endartérite diffuse a été
aussi suspectée.
La tachycardie (Fc > 100/min) est permanente chez ces
patients comme déjà notée au cours du SIDA du noir
africain (MALU K. et al., 1988 ; KAPITA B., 1989). Cette tachycardie peut
déterminer l'augmentation du débit cardiaque et favoriser
l'élévation tensionnelle. Quoi qu'il en soit, l'hypertension
artérielle apparaît au seuil de l'infection VIH et disparait au
stade clinique avancé et manifeste du SIDA, peut-être à
cause des facteurs hypotenseurs éventuels prouvés dans le
modèle animal (FABER J.E. et al., 1984). Des raisons techniques ne nous
ont pas permis d'évaluer le rôle du système
rénine-angiotensine-aldostérone (SRAA).
L'accélération de la vitesse de sédimentation de nos
patients est liée à l'action de plusieurs facteurs : l'infection
VIH, des processus inflammatoires (myopéricardite, endartérite)
et affections opportunistes (zona intercostal).
C'est précisément cette
accélération de la vitesse de sédimentation qui montre une
corrélation très positive avec la tension artérielle au
début de l'infection VIH. L'infection VIH déclencherait une
réaction systémique post-agressive comprenant la stimulation du
système sympathico-adrénergique et du système
rénine-angiotensine et surtout la dysfonction endothéliale avec
vasoconstriction. La tachycardie et la sudation profuse sont les marques de
l'hypertonie sympathicodrénergique chez nos patients. La
vasocosntriction détermine une augmentation des résistances
périphériques et de la tension artérielle, surtout
l'installation de l'hypertension artérielle diastolique. L'hypertension
artérielle diastolique a été décrite chez le noir
américain au cours du SIDA compliqué de méningite à
cryptocoque (PATTY F.H. et al., 1992). Un patient avec tension systolique de
180 mmHg est décédé deux ans après dans un tableau
de méningite à cryptocoque. La tension artérielle
diastolique à l'admission (Pré-Sida) est positivement
correlée à la vitesse de sédimentation.
Dans la cardiomyopathie dilatée, Treasure et al. ont
montré que les cellules endothéliales étaient les
premières de tout le système cardiovasculaire à
présenter une anomalie de la réactivité vasomotrice
(vasodilatation) liée à l'endothélium (TREASURE C.B. et
al., 1990). Dix de nos 14 patients (71,43%) ont présenté une
cardiomyopathie dialtée au cours de l'évolution de leur SIDA.
L'élargissement de la tension différentielle est
plus marqué à l'apparition des signes cliniques manifestes de
l'infection VIH. Ceci a été noté en dépit de
l'absence apparente d'une corrélation entre la tension artérielle
différentielle et la vitesse de sédimentation (r = 0,22, p =
0,449).
L'hypertension artérielle transitoire pourrait
être liée au conflit immunologique caractéristique du
Pré-SIDA du noir africain et ne nécessite pas un traitement
anti-hypertenseur. D'autre part, l'infection VIH rend l'hypertension
artérielle chronique réfractaire à tout traitement
anti-hypertenseur.
Ne pouvant tirer de conclusions valables sur l'étude de
la tension artérielle auprès d'un petit échantillon (14
patients), une grande cohorte de 170 patients a servi de matériel
d'expérimentation. L'étude préliminaire avait émis
l'hypothèse que la tension artérielle serait un facteur potentiel
de mauvais pronostic de l'infection VIH.
La grande majortié de patients du groupe contrôle
(73,5%) sont restés normotendus en dépit d'une perte rapidement
progressive de leur fonction rénale VIH dépendante ;
confirmant ainsi certaines études menées aux Etats-Unis
d'Amérique (BOURGOIGNIE J.J. et al., 1988 ; BOURGOIGNIE J.J., 1989 ; RAO
T.K.S., FRIEDMAN E.A., 1989).
Dans ce même groupe contrôle
caractérisé par des lésions rénales
associées à l'infection VIH, la proportion de 26,5% de patients
trouvés avec une hypertension artérielle transitoire est moins
importante que celle observée en Amérique (BOURGOIGNIE J.J. et
al., 1988 ; CARBONE et al., 1989). L'hypertension artérielle a
été notée chez 39% des patients au stade SIDA à
Newx York, patients à majorité noire (96% afro-américains)
(CARBONE L. et al., 1989). En dehors du SIDA, la prévalence de
l'hypertension artérielle est estimée à 23% des cas de
glomérulonéphrite primaire chronique (OROFINO L. et al., 1987).
Tous les 83 patients du groupe contrôle ont rapidement
évolué vers l'insuffisance rénale à cause de
l'HIVAN. L'HIVAN est une forme insolite des lésions rénales
caractérisée au cours de l'infection VIH par une
protéinurie massive et une progression rapide vers l'insuffisance
rénale (CARBONE L. et al., 1989). Cette atteinte rénale du noir
africain au stade SIDA confirme la prédisposition raciale du noir
à développer l'HIVAN comme déjà rapporté par
d'autres auteurs (PARDO V. et al., 1987 ; RAO T.K.S. et al., 1987). La
toxicomanie et l'homosexualité, autres facteurs de risques
incriminés dans l'HIVAN, n'ont pas été retrouvées
chez le noir du Zaïre. L'incidence de l'hypertension artérielle
due à la glomérulosclérose et à la
néphropathie associée à l'héroïne est 4
à 5 fois plus élevée chez le noir américain que
chez d'autres races (FRIEDMAN F.A., RAO T.K.S., 1983 ; ROSTAND S.G. et
al., 1982). Le virus VIH et d'autres facteurs de l'environnement auraient
probablement induit des variations génétiques du noir au niveau
rénal.
L'évolution de la tension artérielle a
été suivie de manière régulière pendant plus
de 84 mois chez 87 patients infectés par le VIH avec des complications
cardiaques (cardiomyopathie dilatée et péricardite liquidienne).
Ces 87 patients sont passés au stade SIDA à un âge moyen de
33 ans, âge sans différence significative avec celui du groupe
SIDA et rein (36 ans).
Comparé au groupe SIDA et rein, le groupe SIDA et coeur
présente une survie médiane plus longue, un nombre absolu des CD4
plus élevé et une proportion plus importante de sujets avec
hypertension artérielle transitoire (59,7 %). Cette hypertension
artérielle transitoire contemporaine à la période
post-immédiate du passage au stade SIDA (durée 6 à 8 mois)
est suggestive du rôle direct ou indirect du VIH d'autant plus que la
tension artérielle systolique mesurée 6 mois après le
passage au stade SIDA montre une corrélation positive avec le nombre des
CD4 (r = 0,67) dans le groupe avec cardiopathies - SIDA.
Dans les deux groupes d'étude, malgré la
différence des troubles hormonaux liés à l'infection CVIH
entre les hommes et les femmes (PIOT et al., 1993), il n'a pas
été noté une différence liée au sexe quant
à l'évolution de la tension artérielle et à la
survie. Le sex ratio de deux cohortes est resté proche de
l'unité comme observé dans toutes les études
africaines.
La tension artérielle prise 6 mois avant le virage vers
le stade SIDA n'a pas exercé une influence prédictive à
l'analyse univariée, confirmant ainsi les résultats du chapitre V
ayant seulement reconnu le nombre de CD4 > 400/mm3 et la
présence de la cardiomyopathie dilatée comme meilleurs facteurs
de longue survie au stade SIDA.
Dans la cardiomyopathie dilatée associée
à l'infection VIH, à dilatation égale pour les patients
noirs du Zaïre VIH positifs (avant SIDA) et déjà au stade
SIDA, la dysfonction systolique est présente uniquement chez les
patients au stade SIDA (cf. chapitre III). En analysant les données de
SOLVD (Studies of Left Ventricular Dysfunction), Konstan a
réinsisté sur la réponse neurohormonale devant la
dysfonction systolique (KONSTAN, 1992) : le taux plasmatique de
noradrénaline, indicateur de la stimulation adrénergique,
augmente déjà au stade incipiens de la dysfonction systolique ;
l'activité rénine-plasmatique, reflet de l'action du
système rénine-angiotensine, augmente aussi chez les patients
avec dysfonction systolique. Cette réponse neurohormonale maintiendrait
initialement le patient en phase de compensation, et peut exacerber la
dysfonction ventriculaire. Cette hyper-réactivité
cardiovasculaire est accompagnée d'une élévation
aiguë de la tension artérielle au cours du stress (MANUCK S.B.,
1990 ; PAGE I.H., 1963).
Une fois la phase post-aggressive résolue (passage au
SIDA), la tension artérielle est restée normale chez tous les
survivants.
L'hypertension artérielle permanente aurait dû
apparaître devant la gravité des lésions rénales
observées chez le noir du Zaïre, l'absence de cette hypertension
pourrait être expliquée par l'action possible des facteurs
antihypertenseurs décrits par d'autres auteurs (GROLLMAB A., 1964 ;
GOTHBERG B. et al., 1982 ; CHRISTY I.C. et al., 1992 ; PREWITT R.L. et
al., 1979 ; FABER J.E. et al., 1984).
CONCLUSIONS GENERALES
Le SIDA est aujourd'hui un problème de santé
publique pour le monde entier : 14 millions de sujets ont déjà
été infectés par le virus VIH. Des 350.000 cas de SIDA
que compteront les Etats-Unis en l'an 2000, 25.000 souffriront d'un
dysfonctionnement cardiaque.
L'émergence du syndrome d'immunodéficience
acquise (SIDA) a compliqué davantage l'étiopathogénie, la
clinique, l'évolution et le traitement des cardiomyopathies et des
péricardites souvent idiopathiques dans une Afrique tropicale
confrontée à des maladies transmissibles et à la
malnutrition.
Le but de ce travail a été d'identifier les
complications cardiaques au cours de l'infection VIH, de rechercher les
caractéristiques communes rencontrées chez les africains au sud
du Sahara. Ce qui a permis d'orienter les investigations étiologiques
pour suivre l'histoire naturelle de l'infection VIH.
La définition de l'infection VIH (SIDA) était
clinique et sérologique (OMS, 1985 ; OMS, 1986 ; OMS, 1988 ; GENTILLINI
et al., 1986 ; COLEBUNDERS R.L. et al., 1987). Nous avons mis en
évidence des anticorps spécifiques du virus VIH par la technique
immuno-enzymatique ELISA, une séropositivité VIH étant
confirmée par un test d'immuno-transfert Western-blot.
La classification des stades de l'infection VIH repose sur les
critères révisés du CDC (CDC, 1993).
L'évaluation de la validité de la
définition clinique de l'infection VIH (stade SIDA)
réalisée en 1987 à Kinshasa a montré une
spécificité de 94%, une sensibilité de 62% et une valeur
prédictive positive de 74% (COLEBUNDERS R.L., 1987). Et dans notre
Centre de Cardiologie, la technique d'ELISA s'est avérée
très efficiente avec des taux de 98,5% de sensibilité et de 99,6%
de spécificité en comparaison avec le test de Western-blot et
comme rapporté en Tanzanie ou ailleurs en Afrique noire (VERCAUTEREN G.,
1987 ; URASSA W. et al., 1987).
La propagation de l'infection VIH épouse une allure
exponentielle en Afrique. Les taux de séroprévalence VIH varient
d'un pays africain à l'autre : de 1 à 25%. Si en Europe et en
Amérique du Nord la transmission du VIH est dans 90% de cas homosexuelle
ou bisexuelle, en Afrique elle est encore entièrement
hétérosexuelle. Le rôle de la prostitution et des maladies
sexuellement transmissibles a été souligné dans ce travail
et par d'autres avant nous (PIOT P., CARAEL M., 1988 ; VAN DE PERRE P. et al.,
1985 ; KREISS J.K. et al., 1986).
Les atteintes cardiaques au stade du SIDA sont aujourd'hui
bien décrites aux Etats-Unis, aux Caraïbes et en Europe grâce
aux observations cliniques, aux données échocardiographiques et
aux lésions histopathologiques des biopsies endomyocardiques.
Le type de complications cardiaques associées à
l'infection VIH varie considérablement suivant la région
géographique. En Afrique noire, le SIDA se développe dans un
contexte singulier sans infrastructures sanitaires adéquates. Chez les
noirs d'Afrique souffrant d'infection VIH, la fréquence de morts
attribuées à une cause cardiaque varie de 6 à 16%. La
situation serra plus dramatique à l'avenir, puisque plus de 70% de tous
les infectés par le VIH du monde sont africains au sud du Sahara.
La présente étude porte sur des patients noirs
du Zaïre avec infection VIH et complications cardiaques. Ces
lésions cardiaques se manifestent par des péricardites, des
myocardites, des cardiomyopathies dilatées, des endocardites, de
l'hypertension artérielle et des troubles de conduction. Elles sont
souvent asymptomatiques. La diffusion du SIDA et la prolongation de la survie
des patients viennent compliquer le tableau clinique de ces atteintes
cardiaques. Une susceptibilité génétique a
été recherchée dans cette association VIH-cardiopathies du
noir africain.
1. Les péricardites
Comme aux Etats-Unis d'Amérique, les
péricardites ont été les premières manifestations
cardiaquées rapportées par nous en Afrique en association avec
l'infection VIH.
Evaluée à 12,4% en 1988, leur prévalence
hospitalière s'est stabilisée aujourd'hui à 8,8%, soit 4
à 6 fois plus élevée que la fréquence des
admissions hospitalières pour péricardite avant
l'épidémie du SIDA. Sensiblement plus fréquentes au stade
précoce de l'infection VIH dans la partie rétrospective de cette
étude, en prospective les péricardites liquidiennes sont apparues
tant au stade précoce qu'au stade avancé de
l'immunodéficience acquise. Au cours du temps l'incidence des
péricardites associées à l'infection VIH épouse une
allure épidémique alors que celle des péricardites du
sujet séronégatif tend à décroître.
L'incidence clinique annuelle des péricardites VIH+ est de 1,8%. En 3
ans d'observation, 50% de patients VIH+ avec péricardite ont
progressé vers le stade SIDA, soit un taux de passage au SIDA annuel de
16,6%. La fréquence des péricardites au stade SIDA varie dans
les séries cliniques de la littérature entre 10 et 38%
(HIMMELMAN, 1989 ; BERTRAND Ed., 1992 ; EISENBERG, 1992).
Deux facteurs pronostiques biologiques ont été
retrouvés avec une valeur péjorative de virage vers le stade SIDA
: un chiffre absolu de CD4 inférieur à 500/mm3 et un
compte d'éosinophiles inférieur à 500/mm3.
Plusieurs facteurs pronostiques (non réalisables en Afrique) ont
démontré leur intérêt chez les patients
séropositifs des pays industrialisés : le nombre absolu et le
pourcentage de lymphocytes CD4, la disparition ou la baisse des anticorps anti
p24, le taus de â-2-microglobuline > 5 mg/L, la baisse du rapport
CD4/CD8, l'élévation de la néoptérine sanguine et
uniraire, l'élévation des immunoglobulines sériques et une
sérologie CMV très positive font craindre une
immunodéficience majeure à court terme (MOSS A.R. et al., 1988 ;
WEBER J.N. et al., 1987). Par contre la présence d'anticorps
neutralisants à haut titre renferme une bonne valeur pronostique
(WENDLER L. et al., 1987). A San francisco, une étude sur 288
homosexuels a montré un taux de progression vers le SIDA de 22% en trois
ans (MOSS A.R. et al., 1988). Mais l'une des meilleures études
présentées en 1988 à Stockholm avec la connaissance de la
date de séroconversion à 6 mois près à retrouver
les taux de passage vers le SIDA suivants : 5% à 3 ans, 10% à 4
ans, 15% à 5 ans, 25% à 6 ans, 36% à 7 ans et 48% à
10 ans (HESSOL A. et al., 1988). Ces chiffres sont fondamentalement
différents de celui observé dans les péricardites
associées à l'infection VIH du noir africain.
Le tableau clinique des péricardites au cours de
l'infection VIH varie de la forme asymptomatique au tableau souvent mortel de
tamponnade cardiaque. Les principales manifestations cliniques sont les
sudations nocturnes, les douleurs thoraciques atypiques et une dilatation du
ventricule gauche (myopéricardite). Au stade SIDA, ont
été retrouvés les signes généraux et les
affections opportunistes suivants : amaigrissement, fièvre chronique,
diarrhée chronique, penumopathie interstitielle à Pneumocystis
carinii, candidose oro-oesophagienne, méningite à cryptocoque et
sarcome de Kaposi.
Dans un certain nombre des cas, elles sont associées
aux lésions de cardiomyopathie à VIH (KAUL S. et al., 1991 ;
BOURAMOUE C. et al., 1992).
L'examen radiologique du thorax et
l'électrocardiogramme perdent l'efficacité diagnostique (peu
sensibles) dans les péricardites associées à l'infection
VIH. L'échocardiographie demeure un outil très important dans la
détection de ces péricardites asymptomatiques et
d'épanchement péricardique de quantité minimes tel que
rapportés par Gouello et al. (GOUELLO J.P. et al., 1993).
Les manifestations cliniques, électrocardiographiques,
radiologiques et échocardiographiques des patients zaïrois ne
diffèrent pas de celles des autres africains ou d'ailleurs comme
déjà décrites dans la littérature (CEGIELSKI J.P.
et al., 1990 ; TAELMAN H. et al., 1990 ; BOURAMOUE C. et al., 1992 ; NOBLE O.,
FOWLER, 1991 ; CLIFFORD C.D., 1990), sauf en ce qui concerne la diarrhée
chronique. Une diarrhée chronique inexpliquée est notée
dans 41,1% des cas après assèchement péricardique alors
que sa fréquence est de 80% chez tous les africains au stade SIDA sans
péricardite (JACOBS J.L. et al., 1985 ; OMS, 1985) et au début de
la maladie (COULAUD J.P., 1985). La péricardite constrictive est rare
dans cette forme associée au VIH. L'allure est plutôt aiguë
dans l'évolution des péricardites d'étiologie VIH
probable.
Les facteurs étiologiques des péricardites
varient selon le temps et le degré du déficit immunitaire pour le
VIH : aux stades pré-SIDA, le VIH est incriminé dans 65,7% de cas
(d'autres virus, entérovirus fréquents, en Afrique, sont
suspectés aussi) alors qu'au stade avancé chronique (SIDA) de la
maladie la tuberculose est retenue comme cause déterminante de 90,5% de
péricardites associées à l'infection VIH. Ceci confirme
par ailleurs quelques études menées en Tanzanie, au Rwanda, au
Congo et au Zaïre (CEGIELSKI J.P. et al., 1990 ; KAGAME A., 1991 ;
TONDUANGU K. et al., 1995). Dans 9,5% de péricardites associées
au VIH, le sarcome de Kaposi est survenu comme affection opportuniste. Dans
les pays industrialisés du Nord, une variété d'agents
étiologiques sont retenus comme cause des péricardites
associées à l'infection VIH. Il s'agit de Cryptococcus
neoformans, Mycobacterium tuberculosis, Mycobacterium avium-intracellulare,
Herpes simplex, Actinomycostales (Nocardia astèroïdes),
Staphylococcus aureus et cancers (KAUL S. et al., 1991 ; BERTRAND Ed., 1992 ;
BOURAMOUE C. et al., 1992 ; DALLI E. et al., 1987). Dans un nombre important
des cas, la cause n'a pas été précisée (KAUL s. et
al., 1991 ; BERTRAND Ed., 1992). Le liquide d'épanchement
péricardique est un exsudat stérile riche en lymphocytes.
Le couple tuberculose et infection VIH ne concerne pas
seulement les atteintes pulmponaires mais également les
péricardites, association souvent rapportée aux Etats-Unis
d'Amérique et dans les pays en voie de développement (HANWERGER
S. et al., 1987 ; BLASER M.J., 1986 ; QUINN T.C. et al., 1986). Avec
l'augmentation considérable du nombre de cas infectés par le VIH
dans le monde en général et en Afrique subsaharienne en
particulier, il faudra également s'attendre à une incidence
croissante des cas de péricardites tel que démontré
ici.
Les péricardites peuvent enfin être
comptées comme affections associées de façon significative
à l'infection VIH.
2. Les endocardites
En dépit du nombre élevé d'infections
opportunistes qui représentent la complication essentielle de
l'infection VIH ; leur localisation cardiaque reste rare en Afrique noire. Au
cous de l'infection VIH, 1,2% des patients zaïrois ont
présenté une endocardite infectieuse à Salmonella
enteritidis. La littérature rapporte également la rareté
des endocardites infectieuses au stade SIDA tant en Afrique que dans les pays
industrialisés : 2,96% en Côte d'Ivoire (BERTRAND Ed., 1992), 3,9%
au Congo Brazzaville (BOURAMOUE C. et al., 1992), 5% aux Etats-Unis
d'Amérique (KAUL S. et al., 1991). Les toxicomanes européens et
américains séronégatifs présentent une
prévalence très élevée d'endocardites infectieuses
de l'ordre de 31% ou de 87% (D'IVERNOIS C. et al., 1991 ; VULLIEMIN P., 1993 ;
MINARDI G. et al., 1991 ; KAUL S. et al., 1991). L'immunité cellulaire
n'intervient pas dans la genèse des endocardites sur un terrain
immunodéprimé par le VIH (D'IVERNOIS C. et al., 1991).
A l'autopsie, l'endocardite thrombotique abactérienne
(marastique) est souvent observée chez 5 à 7% d'américains
immunodéprimés par le VIH (LEWIS W., 1989 ; CAMMAROSOANO C.,
1985).
3. Les cardiomyopathies
L'excès d'atteintes cardiaques attribuées
à l'infection VIH ressort de ce travail. Le rôle du VIH est de
plus en plus cité comme facteur étiologique des myocardites et
des cardiomyopathies dilatées en Afrique et ailleurs (BERTRAND Ed.,
1992, BOURAMOUE C. et al., 1992 ; CALABRESES L.H. et al., 1987 ; GRODY W.W. et
al., 1990).
La fréquence d'atteintes cardiaques au cours de
l'infection VIH est difficile à apprécier, elle varie d'un auteur
à l'autre en fonction de la définition donnée et de la
nature des séries qui sont autopsiques ou échocardiographiques
(BERTRAND Ed., 1992 ; FRANCIS C.K., 1990). La présente série
repose sur les aspects cliniques, électrocardiographiques, radiologiques
et échocardiographiques.
Ces atteintes cardiaques se manifestent sous différents
tableuax : 45,8% de patients asymptomatiques et 54,2% de patients
symptomatiques, une suspicion de myocardites aiguës avec ou sans
insuffisance cardiaque, une cardiomyopathie dilatée et quelques rares
cas de cardiomyopathie hypertrophique.
Tous les cas de myocardite et de myo-péricardite ont
évolué vers le stade de cardiomyopathie dilatée. La
tachycardie et l'insuffisance cardiaque globale dominent le tableau clinique de
ce nouveau syndrome cardiovasculaire du SIDA.
Au plan clinique, l'insuffisance cardiaque congestive est
survenue chez 13,3% des malades, fréquence proche de 10%
constatée par Anderson (ANDERSON D.W. et al., 1988).
Dans ce travail, la dilatation et l'altération de la
fonction systolique sont patentes. Elles sont rapportées à une
cardiomyopathie dilatée dont le diagnostic est fondé sur la
cardiomégalie au cliché radiologique du thorax, l'augmentation
des cavités cardiaques gauches et la baisse du pourcentage de
raccourcissement à l'échocardiographie.
La prévalence des cardiomyopathies dilatées
varie avec le stade évolutif de l'infection VIH. De 18,1% des cas au
stade asymptomatique et symptomatique de l'infection VIH (pré-SIDA),
elle est plus importante au stade SIDA avec 52% des cas ; mais la
fréquence de cette entité est plus élevée (61%)
à Brazzaville (BOURAMOUE C. et al., 1992).
La fonction systolique du ventricule gauche est
effondrée dans 100% des cas.
L'anomalie de la relaxation est le signe précoce du
dysfonctionnement diastolique du ventricule gauche caractérisé
par une diminution des indices du remplissage ventriculaire gauche, un
allongement du temps de décélération et une augmentation
de la contribution auriculaire. Cette dysfonction diastolique survient aux
stades précoces du SIDA et chez des patients sans cardiomyopathie
dialtée. C'est plus près de 70% des cas d'hypertrophie
concentrique qui accompagnent le trouble de remplissage diastolique du noir
séropositif. Les cardiomyopathies hypertrophiques sont rares.
4. La survie
De façon générale, le pronostic de
l'atteinte cardiaque est sévère.
Certains signes cliniques, biologiques et
échocardiographiques ont été reconnus comme marqueurs de
mauvais pronostic accélérant la progression des sujets
séropositifs vers le stade SIDA (SAAH A.J. et al., 1994)
Après le diagnostic du stade SIDA, les zaïrois
avec cardiopathies associées à l'infection VIH présentent
une survie médiane de 3 ans (36 mois), espérance de vie plus
longue que celle d'un an décrite chez le noir africain sans atteintes
cardiaques (RYDER R.W., 1988). L'âge avancé écourte la
survie de ces patients comme déjà noté en Europe (SAAH
A.J. et al., 1994).
Le sexe et la dysfonction diastolique n'exercent aucun effet
sur le cours de l'infection VIH passée au stade SIDA.
La péricardite-VIH est entachée d'une
surmortalité sur 7 ans d'observation (93%) en comparaison avec la
cardiomyopathie dilatée (83%). Au stade SIDA, la survie médiane
des patients zaïrois avec cardiomyopathie dilatée (3 ans, 2-4) est
10 fois plus longue que celle rapportée aux Etats-Unis d'Amérique
(CURRIE P.F. et al., 1994).
En analyse multivariée, le nombre absolu des CD4 est
resté le meilleur facteur de pronostic de survie des patients
zaïrois avec SIDA. Le risque relatif de décès au stade SIDA
est 3,4 fois plus élevé avec CD4 < 400/mm3 qu'avec
CD4 > 400/mm3.
Comparée à la cardiomyopathie dilatée, la
péricardite présente un risque relatif de décès
égal à 2.
5. Les facteurs génétiques
Malgré les progrès réalisés dans
tous les domaines de la recherche sur le virus VIH, le SIDA reste encore mal
connu. Des inconnues importantes subsistent sur plusieurs points : facteurs
expliquant la sensibilité individuelle inégale à
l'égard du virus VIH ; facteurs ralentissant ou accélérant
l'évolution du SIDA.
La présente étude a recherché une cause
immunopathologique possible liée au complexe majeur
d'histocompatibilité (HLA) chez le noir du Zaïre souffrant de
cardiomyopathie dilatée concomitante à une infection VIH. Cette
étude ne montre pas des variations significatives au niveau des
fréquences alléliques puisque DRB1*1106 (DRB1*1101 ou 1104) est
retrouvé simultanément chez 5 patients sidéens avec
cardiomyopathie dilatée et chez 9 témoins. L'absence d'une
association significative de l'antigène DRB1 avec la cardiomyopathie
dilatée associée au SIDA chez le noir du Zaïre
suggère la notion d'une affection multifactorielle avec une interaction
immunitaire non encore élucidée.
Un environnement particulier du Zaïre et la
présence du SIDA pourraient expliquer la discordance existant entre nos
résultats et ceux publiés ailleurs avant l'épidémie
du SIDA.
6. L'hypertension artérielle
La grande majorité de patients sont normotendus au
début et à la fin de leur dépression immunitaire pour le
VIH en dépit d'une insuffisance rénale terminale (BOURGOIGNIE
J.J. et al., 1989).
En Afrique noire, aucun cas d'hypertension artérielle
n'a été publié jusqu'à ce jour au cours de
l'infection VIH, mais c'est l'hypotension artérielle qui a
été décrite au cours du SIDA compliqué de
diarrhée chronique et de déshydratation (PIOT P. et al., 1993).
En- fin, à la limite des anomalies cardiaques, Harle et Craddock ont
rapporté des cas d'hypotension artérielle orthostatique
dysautonomique (syncopes) au cours du SIDA (HARLE J.R. et al., 1988 ; CRADDOCK
C. et al., 1987).
L'élévation de la tension artérielle
diastolique entraîne une mortalité très marquée chez
le patient infecté par le VIH avec méningite à cryptocoque
(PATY F.H. et al., 1992). Nous avons évalué l'action de
l'infection VIH sur la tension artérielle du noir zaïrois en deux
étapes.
L'étude préliminaire menée auprès
d'un petit échantillon (14 patients) montre une corrélation
positive entre la tension artérielle et la vitesse de
sédimentation.
Ne pouvant tirer de conclusions valables sur une
éventuelle association entre le VIH et l'hypertension artérielle
transitoire observée dans ce petit échantillon, une grande
cohorte de 170 patients au stade SIDA a servi de matériel d'étude
complémentaire.
L'atteinte rénale typique de l'infection VIH (HIVAN) a
été retrouvée chez 83 zaïrois au stade SIDA. Cette
atteinte rénale du noir africain avec SIDA confirme la
prédisposition du noir à cette complication comme rapporté
chez le noir américain (PARDO V. et al., 1987). Ce groupe a
été comparé à un deuxième constitué
de 87 patients zaïrois au stade SIDA avec atteintes cardiaques.
Il a été noté une fréquence de
59,7% de cas d'hypertension artérielle transitoire dans le groupe avec
complications cardiaques contre 26,5% dans le groupe avec HIVAN.
La survie médiane est plus longue en cas d'atteintes
cardiaques associées au SIDA (36 mois) puisque tous les patients avec
HIVAN sont décédés dans les 12 mois qui ont suivi le
diagnostic du SIDA.
Le nombre absolu des CD4 est plus élevé dans le
groupe SIDA avec cardiopathies (médiane : 400/mm3) que dans
le groupe SIDA avec HIVAN (médiane : 250/mm3). La tension
artérielle systolique post-diagnostic du SIDA est très
élevée par rapport à celle prise en pré-SIDA ;
après correction de Bonferonni, la variation de la tension
artérielle systolique du groupe SIDA avec cardiopathies est plus grande
que celle du groupe SIDA avec HIVAN, la différence statistique
étant hautement significative. Les variations de la tension
artérielle diastolique et de la tension artérielle
différentielle inter- et intra-groupes n'ont pas montré de
différence significative.
L'influence de l'immunodéficience sur la tension
artérielle (systolique et diastolique) a été
retrouvée uniquement dans le groupe SIDA avec cardiopathies : le nombre
absolu des CD4 est positivement correlé à la tension
artérielle de ces patients. Le sexe n'a pas montré d'influence
sur la tension artérielle. L'hypertension artérielle transitoire
est une forme d'hyper-réactivité cardiovasculaire
déclenchée en post-aggression immunologique. Le conflit
immunologique lié à la progression vers le SIDA a
été un grand stress pour ces patients.
La tension artérielle (systolique, diastolique,
différentielle) prise avant le virage vers le stade SIDA n'a pas
exercé une influence prédictive sur la survie à l'analyse
univariée de Kaplan Meier, alors qu'aux Etats-Unis d'Amérique, la
race noire (96 à 100% des patients), la drogue (42% des patients) et
l'hypertension artérielle systolo-diastolique ou diastolique seule
constituent pour la méningite à cryptocoque et l'HIVAN des
facteurs péjoratifs du pronostic (PATTY, 1992 ; CARBONE, 1989).
L'hypertension artérielle permanente aurait dû
apparaître devant la gravité des lésions rénales du
noir africain. Aux Etats-Unis d'Amérique, outre la race noire, la
toxicomanie et l'homosexualité ont été incriminées
comme facteurs de risque d'HIVAN, et l'hypertension artérielle a
été notée chez 39 % des patients avec SIDA de New-York
à majorité noire (96% des patients) (CARBONE L. et al., 1989).
La diarrhée chronique avec hypovolémie et
l'insuffisance surrénalienne chronique (tuberculose
généralisée) fréquentes chez le noir africain
pourraient expliquer l'absence d'hypertension artérielle
systémique. Aux Etats-Unis d'Amérique où l'infection VIH
est associée à une grande prévalence de la tuberculose,
Bourgoignie a attribué l'absence d'hypertension artérielle dans
l'HIVAN à la diarrhée chronique et à la nécrose
surrénalienne retrouvée à l'autopsie (BOURGOIGNIE J.J.,
1990).
La cyclosporine, médicament utilisé dans le
traitement du SIDA aux Etats-Unis d'Amérique, entraîne entre
autres effets secondaires l'hypertension artérielle (ANDRIEU J.M. et
al., 1988).
BIBLIOGRAPHIE
ABELMANN W.H., Incidence of Dilated Cardiomyopathy.
Post-grad. Med. J. 1985 ; 61 : 1123-24.
ACIERNO L.J., Cardiac Complications in Acquired
Immunodeficiency Syndrome (AIDS) : A Review. J. ACC. 1989 ; 13 :
1144-54.
AGUIRRE F.V., LEWEN M.K., PEARSON A.C. et al., Usefulness of
Doppler Echocardiography in the Diagnosis of Congestive Heart Failure. Am. J.
Cardiol. 1989 ; 63 : 1098-102.
AKHRAS F., DUBREY S., GAZZARD N., NOBLE M.I.M., Emerging
Patterns of Heart Disease in HIV Infected Homosexual Subjects with and without
Opportunistic Infections ; A Prospective Colour Flow Doppler
Echocardiographic Study. Eur-Heart J. 1994 ; 15 : 68-75.
ALLAIN J.P., LAURIAN Y. et al. Serological Markers in Early
Stages of Human Immunodeficiency Virus Infection in Hoemophiliacs. Lancet 1986
; 2 : 1233-6.
ALLEN D.M., ONORATO I.M., GREEN T.A. et al. HIV Infection in
Intravenous Drug Users entering Drug treatment. United States, 1988 to 1989.
Am. J. Public Health. 1992 ; 82 : 541-6.
ALTIERI PABLO I., CLIMENT C., LAZALA G., VELEZ R., TORRES
J.V.. Opportunistic Invasion of the Heart in Hispanic Patients with Acquired
Immunodeficiency Syndrome. Am. J. Trop. Med. Hyg. 1994 ; 51 : 56-59.
ANDERSON D.W., VIRMANI R., REILLY J.M., O'LEARY T., CUNNION
R.E., ROBINOWITZ M., MACHER A.M., PUNJA W., VILLAFLOR S.T., PARRILLO J.E.,
Prevalent Myocarditis at Necropsy in the Acquired Immunodeficiency Syndrome.
J. Am. Coll. Cardiol. 1988 ; 11, 4 : 792-99.
ANDERSON J.L., CARLQUIST J.R., LUTZ Jr. et al.. HLA A-B and
DR typing in Idiopathic Dilated Cardiomyopathy : A Search for Immune Response
Factors. Am. J. Cardiol. 1984 ; 53 : 1326-30.
ANDERSON D.W., VIRMANI R.. Emerging Patterns of Heart Disease
in Human Immunodeficiency Virus Infection. Hum. Pathol. 1990 ; 21 : 253-59.
ANDRIEU J.M., EVEN P., VENE T. et al.. Effects of Cyclosporin
on T-cell Subsets in Human Immunodeficiency Virus Disease. Clin. Immunol.
Immunopathol. 1988 ; 47 : 181-98.
APPELTON C.P., HATLE L.K., POPP R.L., Relation of Transmitral
Flow Velocity Patterns to Left Ventricular Diastolic Function : New Insights
from a Combined Hemodynamic and Doppler Echocardiographic Study. J. Am. Coll.
Cardiol. 1988 ; 12 : 426-40.
AROESTY J.M., McKAY R.G., HELLER G. et al.. Simultaneous
Assessment of Left Ventricular Systolic and Diastolic Dysfunction during
Pacing-Induced Ischemia. Circulation 1985 ; 71 : 889-90.
AURINGER S.T., SUMNER J.E., COWAN R.J.. Pediatric
AIDS-Related Myocarditis : Focal Cardiac Gallium Uptake. Clin. Nucl. Med. 1993
; 18 : 999-1000.
AUTRAN B.C., LEIBOWITCH M.. AIDS in a Haitian Woman with
Cardiac Kaposi's Sarcoma and Whipple's Disease. Lancet 1983 ; 3 : 767-68.
BAHLER R.C., MARTIN P., Effects of Loading Conditions and
Inotropic State on Rapid Filling Phase of Left Ventricle. Am. J. Physiol. 1985
; 248 : H523-33.
BAROLDI G., CORALLO S., MORUNI M., REPOSSINI A., MUTINEELI
M.R., LAZZARIN A., CONCETTA M., ANTONACCI, CRISTINA S., NEGRI C.. Focal
Lymphotic Myocarditis in Acquired Immunodeficiency Syndrome (AIDS) : a
Correlative Morphological and Clinical Study in 26 Consecutive Fatal Cases. J.
Am. Coll. Cardiol. 1988 ; 2 : 463-69.
BARRE-SINOUSSI F., CHERMANN J.C., REY F. et al. Isolation of
a T-Lymphotropic Retrovirus from a Patient at Risk for Acquired Immune
Deficiency Syndrome (AIDS). Science 1983 ; 220 : 868-71.
BARRE-SINOUSSI F., CHERMANN J.C., REY F. et al. Isolation of
a T-Lymphotropic Retrovirus from a Patient at Risk for Acquired
Immunodeficiency Syndrome (AIDS). Science. 1983 ; 220 : 868-71.
BARTHOLOMEW C., SAYINGER C., CLARD J. et al. Transmission of
HTLV-1/HIV among Homosexual Men in trinidad. JAMA 1987 ; 257 : 2604-8.
BEAUDET B., SACHS R.N., FISCHBEIN L. et al.. Myocardite
d'évolution subaiguë révélatrice d'un syndrome
d'immunodéficience acquise. Arch. Mal. Coeur 1988 ; 4 : 533-35.
BEHEYT P., JEAN-FRANCOIS G., DUFFRESNE A. Les affections
péricardiques au Zaïre. cardiologie Tropicale 1977 ; 3 :
147-57.
BERTRAND Ed.. Coeur et SIDA. Préliminaires, Cardiol.
Trop. 1992 ; 18 n spécial 1 : 128-29.
BESCHORNER W.E., BAUGHMAN K., TURNICKY R.P. et al..
HIV-associated Myocarditis, Pathology and Immunopathology. Am. J. Pathol. 1990
; 137 : 1365-71.
BLANC P., HOFFMAN P., MICHIELS J.F., BERNARD E., VINTI H.,
MORAND P., LOUBIER R.. L'atteinte cardiaque des patients porteurs du virus de
l'immunosuppression humaine (VIH). A propos de 38 cas. Ann. Cardiol. Angeiol.
1990 ; 39 : 519-25.
BLANCHARD D.G., HAGENHOFF C., CHOWL C., McCANN H.A., DITTRICH
H.C.. Reversibility of Cardiac Abnormalities in Human Immunodeficiency Virus
(HIV) - Infected Individuals : A Serial Echocardiographic Study. J. Am. Coll.
Cardiol. 1991 ; 17 : 1270-76.
BLASER M.J., COHN D.L. Opportunistic Infections in Patients
with AIDS : Clues to the Epidemiology of AIDS and the Relative Virulence of
Pathogens. Rev. Infect Dis. 1986 ; 8 : 21-30.
BODMER J.G., MARSCH S.G.E., ALBERT E. et al.. Nomenclature
for Factors of the HLA System, 1991, Tissue Antigens 1992 ; 39 : 161-73.
BOGUI-FERRON A., MENSAH W., BASSA M., AOUSSI E.B.A., N'DHATZ
M., RENAMBOT J.. Atteinte cardiaque chez les patients infectés par le
VIH. Etude échocardiographique systémique : à propos de
60 cas. Cardiol. Trop. 1992 ; 18 n Spécial 1 : 131.
BONOW R.O., BACHARACH H., GREEN M.W. et al.. Impaired Left
Ventricular Diastolic Filling in Patients with Coronoary Artery Disease :
Assessment with Radionuclide Angiography. Circulation 1981 ; 64 : 315-23.
BORIES C., SALMERON M. et MODIGLIANI R.. Diarrhée et
syndrome d'immunodépression acquise. Gastroentérol. Clin. Biol.
1985 ; 9 : 321-26.
BOURAMOUE C., AS OBOA. Cardiopathies concomitantes avec le
syndrome d'immunodéficience acquise (SIDA), à propos de 20 cas.
Cardiol. Trop. 1989 ; 15 : 7-16.
HIMELMAN R., CHUNG W., CHERNOFF D. SCHILLER N., HOLLANDER H..
Cardiac Manifestations of Human Immunodeficiency Virus Infection : a
Two-Dimensional Echocardiographic Study. J. Am. Coll. Cardiol. 1989 ; 13 :
1030-36.
BOURAMOUE C., EKOBA J., NKOUA J.L., KIMABLLY-KAKY G., MBIZI
R.. Cardiopathies au cours du syndrome d'immunodéficience acquise
(SIDA) : étude de 77 cas cliniques. Cardiol. Trop. 1992 ; 18 :
77-84.
BOURGOIGNIE J.J., MENESES R., ORTIZ C., JAFFE D., PARDO V..
The Clinical Spectrum of Renal Disease associated with Human Immunodeficiency
Virus. Am. J. Kidney Dis. 1988 ; 12 : 131-37.
BOURGOIGNIE J.J.. Renal Complications of Human
Immunodeficiency Virus Type 1. Kidney Int. 1990 ; 37 : 1571-84.
BOURGOIGNIE J.J.. Acquired Immunodeficiency Syndrome (AIDS) -
related Renal Disease. Klin. Wochensch. 1989 ; 67 : 889-94
BRIVET F., LIVARTOWSKI J., HERVE P., RAIN B., DORMONT J..
Pericardial Cryptococcal Disease in Acquired Immune Deficiency Syndrome
(Letter). Am. J. Med. 1987 ; 82 : 1273.
BRUNET P., BOLGERT F., PIERROT D.. L'infection du
système nerveux central par le virus du déficit immunitaire
humain acquis. Rev. Neurol. Paris 1988 ; 144, 5 : 317-26.
BRUTSAERT D.L., RADEMAKERS F.E., SYS S.U. et al.. Ventricular
Relaxation. In : LEVINE H.G., GAASCH W.H. (Eds) : The Ventricle : Basic
and Clinical Aspects. Boston, Martinus-Nijhoff, 1985, p. 123.
BUDKA H., COSTANZY G., CRISTINA S., LECHI A., PARRAVICINI C.,
TRABATTONI R. and VAGO L.. Brain Pathology induced by Infection with the Human
Immunodeficiency Virus (HIV) : a Histlogical, Immunocytochemical, and Electron
Microscopical Study of 100 Autopsy Cases. Acta Neuropathol. 1987, 75 :
185-98.
BUYSE I., DECORTE R., BEANS M.. Rapid DNA Typing of Class II
HLA Antigens using Polymerase Chain Reaction and Reverse Dot Blot
Hybridization. Tissue Antigens 1993 ; 41 : 1-14.
CALABRESE L.H., PROFITT M.R., YEN-LIEBERMAN B., HOBSS R.F.F.,
RATLIFF N.B.. Congestive Cardiomyopathy and Illness Related to the Acquired
Immunodeficiency Syndrome (AIDS) Associated with Isolation of Retrovirus from
Myocardium. Ann. Intern. Med. 1987 ; 107 : 691-692.
CAMMAROSANO C., LEWIS W.. Cardiac Lesions in Acquired Immune
Deficiency Syndrome (AIDS). J. Am. Coll. Cardiol. 1985 ; 5 : 703-6.
CARDBONE L., D'AGATI V., CHENG J.T., SUH J.L., APPEL G..
Cause and Prognosis of Human Immunodeficiency Virus associated Nephropathy.
Am. J. Med. 1989 ; 87 : 389-95.
CEGIELSKI J.P., RAMAIYA K., LALLINGER G.J., MTULIA I.A., MBAGA
I.M.. Pericardial Disease and Human Immunodeficiency Virus in Dar es Salaam,
Tanzania. Lancet 1990 ; 335 : 209-12.
CENACCHI G., RE M.C., FURLINI G., LA PLACA M., BINETTI G.,
RAPEZZI C., ALAMPI G., MAGNANI B.. Human Immunodeficiency Virus Type 1 Antigen
Detection in Endomyocardial Biopsy : an Immunomorphological Study. Micro
biologica 1990 ; 13 : 145-49.
CENTERS FOR DISEASE CONTROL AND PREVENTION. HIV/AIDS
Surveillance Report. February 1993 : 1-23.
CENTERS FOR DISEASE CONTROL AND PREVENTION. Human
Immunodeficiency Virus Infection in the United States : A Review of Current
Knowledge. HMWR 1987 ; 36 (n S 6) : 1S - 48S.
CENTERS FOR DISEASE CONTROL AND PREVENTION (CDC). National
HIV Serosurveillance Summary-Results through 1992. Atlanta, GA : U.S.
Department of Health and Human Services. Public Health Service, 1993,
Publication n HIV/NCID/11-93/036.
CENTERS FOR DISEASE CONTROL. Tuberculosis and acquired
Immunodeficiency Syndrome - New York. JAMA 1988 ; 259 : 338-45.
CENTERS FOR DISEASE CONTROL. Revision of the CDC Case
Surveillance Case Definition for Acquired Immunodeficiency Syndrome. Morbid.
Mortal. Weekly Rep. 1987 ; 36 (suppl. 15) : 15-55.
CHAISSON R.E. and VOLBERDING P.A.. Clinical Manifestations of
HIV Infection. In MANDECH G.L., DOUGLAS R.G. and BENNET J.E. (eds) : principle
and Practice of Infectious Disease, ed. 3, Churchill Livingstone, New York
1990, 1059-60.
CHAISSON R.E., SCHECTER G.F., THEUER C.P. et al.
Tubserculosis in patients with the Acquired Immunodeficiency Syndrome. Am.
Rev. respir. Dis. 1987 ; 136 : 570-74.
CHRISTY I.C., WOODS R.L., DENTON K.M., ANDERSON W.P.. In Vivo
Evidence for the Existence of a Circulating Renal Medullary Hypotensive
Substance in Rabbits and Dogs. J. Hypertens. 1992 ; 10 (suppl. 4) ; 70.
CLERICI M., SHERER G.M. A Th1 -> Th 2 Switch is a critical
Step in the Etiology of HIV Infection. Immunology Today 1993 ; 14 :
107-111.
CLIFFORD C.D.. Pericarditis in AIDS. Cardiology Clinics 1990
; 8 : 697-99.
CLUMECK M., HERMAN. P., WIT S.SD.. Current Problems in the
Management of AIDS Patients. Eur. J. Clin. Microbiol. Infect. Dis. 1988 ; 1 :
2-8.
CLUMECK M., SONNET J., TAELMAN et al.. Acquired
Immunodeficiency Syndrome in African Patients. N. Engl. J. Med. 1984 ; 310 :
492-97.
CLUTTERBUCK E.J., HIRST E.M., SANDERSON C.J. Human
Interleukin-5(IL-5) Regulates the Production of Eosinophils in Human Bone
Marrow Cultures : Comparison and Interaction with IL-1, IL-3, IL*6 and GMCSF.
Blood 1989 ; 73 ; 1504-12.
COHEN I.S., ANDERSON I., VIRMANI R., REEN B.M., MACHER A.M.,
SENNESH J., DILORENZO P., REDFIELD R.. Congestive Cardiomyopathy in
Association with the Acquired Immunodeficiency Syndrome. N. Engl. J. Med. 1986
; 315 : 628-30.
COLEBUNDERS R.L., MANN J.M., FRANCIS H. et al. Evaluation of
a Clinical Case Definition of AIDS in Africa. Lancet 1987 ; I : 492-94.
COLEBUNDERS R., MANN J., FRANCIS H., KAPITA B., NDANGI K.,
LUSAKUMUNU K., LEBUGHE I., PIOT P.. La clinique du SIDA en Afrique.
Méd. et Mal. Inf. 1986 ; 16 : 350-55.
COOPER D.A., TINDALL B. et al. Characterization of T
Lymphocite Responses during Primary Infection with Human Immunodeficiency
Virus. J. Infect Dis. 1988 ; 157 : 889-96.
COPLAN N.L., SHIMONY R.Y., IOACHIM H.L. et al.. Primary
Pulmonary Hypertension Associated with Human Immunodeficiency Viral Infection.
Am. J. Med. 1990 ; 89 : 96-99.
CORALLO S., MUTINELLI M.R., MORONI M. et al. Echocardiography
Detects Myocardial Damage in AIDS : prospective Study in 102 Patients. Eur.
Heart J. 1988 ; 9 : 887-92.
CORBOY J.R., FINK L., MILLER W.T.. Congestive Cardiomyopathy
in Association with AIDS. Radiology 1987 ; 165, 1 : 139-41.
COTTON P.. AIDS giving Rise to cardiac Problems, JAMA 1990 ;
264 : 888-89.
COUDRAY N., DE ZUTTERE D., FORCE G. et al.. Left Ventricular
Diastolic Function in Asymptomatic and Symptomatic Human Immunodeficiency Virus
Carriers : an Echocardiography Study. Eur. Heart J. 1995 ; 16 : 61-67.
COUGHLIN S.S., SZKLO M., BAUGHMAN K. et al.. The Epidemiology
of Idiopathic Dilated Cardiomyopathy in a Biracial Community. Am. J. Epidemiol
1990 ; 131 : 48-56.
COULAUD J.P., GENTILINI M.. Aspects cliniques, diagnostiques
et thérapeutiques du syndrome d'immunodépression acquise (SIDA)
en Afrique noire. Population et santé tropicales (Pfizer) 1985 ; 13 :
2-5.
COX J.N., DIDIO F., PIZZOLATO G.P., LERCH R., POCHON N..
Aspergillus Endocarditis and Myocarditis in a Patient with the Acquired
Immunodeficiency Syndrome (AIDS), A review of literature. Virchows. Arch. A.
Pathol. Anat. Histopathol. 1990 ; 417 : 255-59.
COX D.R. Regression Models and Life Tables. J.R. Stat. Soc.
Scr. B. 1972 ; 34 : 187-220.
CRADDOCK C., PASVOL G., BULL R. et al. Cardiorespiratory
Arrest and Autonomic Neuropathy in AIDS. Lancet 1987 ; 16-18.
CURRIE P.F., JACOB A.J., FORMAN A.R. et al.. Heart Muscle
Disease Related to HIV Infection : Prognostic Implications. BMJ 1994 ; 309 :
1605-7.
D'CRUZ I.A., SENGUPTA E.E., ABRAHAM S.C., REDDY H.K.,
TURLAPATI R.V.. Cardiac Involvement, Including Tuberculous Percicardial
Effusion Complicating Acquired Immunodeficiency Syndrome (AIDS). Am. Heart J.
1986 ; 112 : 100-2.
D'IVERNOIS C., LACUT J.Y., WARIN J.F.. Atteintes cardiaques
au cours du SIDA. La Presse Médicale 1991 ; 20 : 68-70.
DALLI E., QUESADA A., JUAN G. et al. Tuberculous Pericarditis
as the First Manifestation of Acquired Immunodeficiency Syndrome. Am. Heart J.
1987 ; 114 : 905-6.
DE SIMONE C., TZANTZOGLOU S., JIRILLO E., MARZO A., VULLO V.,
ARRIGONI M.E.. L-Carnitine Deficiency in AIDS Patients. AIDS 1992 ; 6 :
203-5.
DE CASTRO S., MIGLIAU G., SILVESTRI A., D'AMATI G.,
GIANNANTONI P., CARTONI D. et al.. Heart Involvement in AIDS : a Prospective
Study during Various Stages of the Disease. Eur-Heart J. 1992 ; 13 :
1452-59.
DE JONG M.D., BORLEFFS J.C.C.. Didanosine and Heart Failure.
Lancet 1992 ; 339 : 806-7.
DE COCK K.M., BRUN-VEZINET F., SORO B. HIV-1 and HIV-2
Infections and Aids in West Africa. AIDS 1991 ; 5 (Suppl. 1) : S21-28.
DENIS B.J., MAYT, BIGARD M.A., CANTON P.. Lésions
anales et périanales au cours des infections symptomatiques par le VIH.
Etude prospective d'une série de 190 patients. Gastroentérol.
Clin. Biol. 1992 ; 16, 2 : 148-54.
DES JARLAIS D.C., FRIEDMAN S.R., CHOOPAN Y.Q.K. et al.
Internationa Epidemiology of HIV and AIDS among Injecting Drug Users. AIDS
1992 ; 6 : 1053-5.
DES JARLAIS D.C., FRIEDMAN S.R., NOVICK D.M. et al. HIV-1
Infection among Intravenous Drug USERS in Manhattan, New York City, from 1977
through 1987. JAMA 1989 ; 261 : 1008-12.
DEYTON L.R., WALKER R.E., KOVACS J.A. et al.. Reversible
Cardiac Dysfunction Associated with Interferon Alpha Therapy in AIDS Patients
with Kaposi's Sarcoma. N. Engl. J. Med. 1989 ; 321 : 1246-49.
DIXON W.J. et al. BMDP Statistical Software. Berkeley :
University of California Press 1983.
DORMONT D., BOUSSIN F., MERROUCHE Y.. Interactions virus VIH
et système nerveux : données récentes et hypothèses
pathogéniques. Nouv. rev. Fr. Hematol. 1988 ; 30 : 21-29.
DOUGHERTY A.M., NACCARELI G.V., GRAY E.L. et al.. Congestive
Heart Failure with Normal Systolic Function. Am. J. cardiol. 1984 ; 54 :
778-82.
DWORKIN B.M., ANTONECCHIA P.P., SMITH F., WEISS L., DAVIDIAN
M., RUBIN D., ROSENTHAL W.S.. Reduced Cardiac Selenium Content in the ACquired
Immunodeficiency Syndrome. J. Parenter Enter. Nutr. 1989 ; 13 : 644-47.
EMMANUEL R., WITHERS R.F.J., O'BRIEN K.. Dominant and
Recessive Modes of Heritance in Idiopathic Cardiomyopathy. Lancet 1971 ; 2 :
1065.
EUROPEAN CENTRE FOR THE EPIDEMIOLOGICAL MONITORING OF AIDS.
AIDS Surveillance in the European Community and Cost Countries. Quarterly
Report, March 1993, Paris.
EWIGS, FEHSKE W., OMRAN H., ROCKSTROH J.K., LUERITZ B..
Cardiac Manifestations in Advanced HIV Infection. Dtsch Med. Wochenschr. 1994
; 119 : 683-89.
FABER J.E., BARRON K.W., BONHAM A.C., LAPPE R., MUIRHEAD E.E.,
BRODY M.J.. Regional Hemodynamic Effects of Antihypertensive Renomedullary
Lipids in Conscious Rats. Hypertension 1984 ; 6 : 494-502.
FACTOR S.M.. Acquired Immune Deficiency Syndrome : the Heart
of the Matter. J. Am. Coll. Cardiol. 1989 ; 13 : 1037-38.
FAHEY J.L., TAYLOR J.M.G., DETELS R. et al., The Prognos Value
of Cellular and Serologic Markers in Infection with Human Immunodeficiency
Virus Type 1. N. Engl. J. Med. 1990 ; 322 : 166-72.
FAUCI A.S., MASAR H., GELMANN L.P., MARKHAM P.D., HAHN B.H.,
LANE H.C.. The Acquired Immune Deficiency Syndrome, AN Update. Ann. Intern.
Med. 1985 ; 102 : 800-13.
FEIGENBAUM H., Echocardiography (2nd Edition), Lea and
Fibiger, Philadelphia 1976.
FINK L. REICHEK N., SUTTON S.J.. Cardiac Abnormalities in
Acquired Immune Deficiency Syndrome. Am. J. Cardiol. 1984 ; 54 : 1161-63.
FISCHL M.A., RICHMAN D.D., GRIECO M.H. et al. The Efficacy of
Azidothymidine (AZT) in the Trends of Patients with AIDS and AIDS-Related
Complex. A Double-Blind, Placebo-Controlled Trial. N. Engl. J. Med. 1987 ;
317 : 185-91.
FRANCIS C.K.. Cardiac Involvement in AIDS. Curr. Probl.
Cardiol. 1990 ; 15, 10 : 569-639.
FREEDBERG R.S., GINDEA A.J., DIETRICH D.T., GREENE J.B..
Herpes Simplex Pericarditis in AIDS. New-York State J. Med. 1987 ; 304-6.
FREEDMAN A.R., GIBSON F.M., FLEMING S.C. et al. Human
Immunoideficiency Virus Infection of Eosinophils in Human Bone Marrow Cultures.
Journal of Experimental Medicine 1991 ; 174 : 1661-64.
FRIEDLAND G.H., SALTZMAN B., VILENO J. et al. Survical
Differences in patients with AIDS. J. Acquir. Immune Defic. Syndr. 1991 ; 4 :
144-53.
FRIEDMAN E.A., RAO T.K.S.. Why does Uremia in Heroin Abusers
occur Predominantly among Blacks ? JAMA 1983 ; 250 : 2965-66.
FRIEDMAN K.A.E.. Disseminated Kaposi's Sarcoma in Homosexual
Men. Ann. Intern. Med. 1982 ; 96 : 693-700.
GALLO R.C., SALAHUDDIN S.Z., POPOVICO M. et al. Frequent
Detection and Isolation of Cytopathic Retroviruses (HTLV-III) from patients
with AIDS and at Risk for AIDS. Science. 1984 ; 224 : 500-3.
GENTILINI M. et DUFLO B.. Le SIDA tropical. In :
Médecine tropicale, Ed. Flamamrion 1986 : 401-14.
GERBAUX. Les cardiomyopathies primitives dilatées.
Encycl. Med. Chir. coeur-vaisseaux, Paris 1989 ; 9 : 9.
GILLESPIE M.N., HARTSFIELD C.L., O'CONNOR W.N., COHEN D.A..
Pulmonary hypertension in a Murine Model of the Acquired Immunodeficiencu
Syndrome. Am. J. respir. Crit. Care Med. 1994 ; 150 : 194-99.
GOEDERT J.J., BLATTNER W.. The epidemiology of AIDS and
related conditions. Journal of AIDS, 1989 ; 4 : 100-5.
GOLDING H., ROBEY F.A., GATES F.T. et al. Identification of
Homologous Regions in Human Immunodeficiency Virus I gp 41 and Human MHC Class
II Beta 1 Domain. I. Monoclonal Antibodies against the gp41-Derived Peptide
and Patients'Sera React with Native HLA Class II Antigens, Suggesting a Role
for Autoimmunity in the Pathogenesis of Acquired Immune Deficiency Syndrome.
J. Exp. Med. 1988 ; 167 : 914-23.
GOODSMIT J., PAUL D.A. et al. Expression of Human
Immunodeficiency Virus Antigen (HIV-Ag) in Serum and Cerebrospinal Fluid during
Acute and Chronic Infection. Lancet 1986 ; 2 : 177-80.
GOTHBERG B., LUNDIN S., FOLKOW B.. Acute Vasodepressor Effect
in Normotensive Rats following Extracorporeal Perfusion of the Declipped
Kindney of Two-Kidney One-clip Hypertensive Rats. Hypertension 1982 ; 4 :
101-5.
GOTTLIEB M.S., SCHROFF R., SCHANKER H.M. et al. Pneumocystis
Carinii Pneumonia and Mucosal Candidiasis in Previous Healthy Homosexual Men.
Evidence of a New Acquired Cellular Immunodeficiency. N. Engl. J. Med. 1981 ;
305 : 1425-31.
GOUELLO J.P., CHENNEBAULT J.M., LOISON J. et al.. Primary
Pulmonary Arterial Hypertension Associated with Acquired Immunodeficiency Virus
Infection (letter). Presse Med. 1992 ; 21 : 632-33.
GRODY W.W., CHENG L., LEWIS W.. Infection of the Heart by the
Human Immunodeficiency Virus. Am. J. Cardiol. 1990 ; 66 : 203-6.
GROLLMAN A.. Antihypertensive and Pressor Agents of Renal
Origin. Can. Med. Assoc. J. 1964 ; 90 : 299-302.
GROOPMAN J.E., GOTTLIEB M.S. Kaposi's Sarcoma : an Oncogenic
Looking Glass. nature 1982 ; 299 : 103-4.
GROSSMAN W., Mc LAURIN L.P., ROLETT E.L.. Alterations in Left
Ventricular Relaxation and Diastolic Compliance in Congestive Cardiomyopathy.
Cardiovasc. Res. 1979 ; 13 : 514-22.
GROSSMAN W.. Diastolic Dysfunction in Congestive Heart
Failure. N. Engl. J. Med. 1991 ; 325 : 1557-64.
GU J., DISCHE R., ANDERSON V. et al. Evidence for an
Autoimmune Mechanism of the Cardiac Pathology in AIDS Patients. Circulation
1992 ; 86 (suppl. I), I-795 (Abstract).
HAHN R.A., ONORATO I.M., JONES T.S. et al. Prevalence of HIV
Infection among Intravenous Drug Users in the United States. JAMA 1989 ; 261 :
2677-84.
HAKAS J.F., GENRALOVICH T.. Spontaneous Regression of
Cardiomyopathy in Patient with the Acquired Immunodeficiency Syndrome. Chest.
1991 ; 99, 3 : 770-72.
HANDWERGER S., MILDVAN D., SENIE R., Mc KINLEY F.W.
Tuberculosis and the acquired Immunodeficiency Syndrome at a New York City
Hospital : 1978-1985. Chest 1987 ; 91 : 176-80.
HARIZI R.C. et al.. Diastolic Function of the Heart in
Clinical Cardiology. Arch. Intern. Med. 1988 ; 148 : 99-108.
HARLE J.R., DISDIER P., CHOUC P.Y., WEILLER P.J. Hypotension
orthostatique dysautonomique au cours d'une infection par le virus de
l'immunodéficience humaine. Régression sous azidovudine. La
Presse Méd. 1988 ; 17 : 917-18.
HARVEIT F., MOEHLE B.O., PIHL T.. A Family with Congestive
Cardiomyopathy. Cardiology 1981 ; 68 : 193-200.
HECHT S.R., BERGER M., VAN TOSH A., CROXSON S.. Unsuspected
cardiac abnormalities in the Acquired Immune Deficiency Syndrome, An
Echocardiographic Study. Chest. 1989 ; 96, 4 : 805-8.
HENIN D., HAUW J.J.. Neuropathologie de l'infection par le
virus de l'immunodéficience humaine type 1. Presse Méd. 1988 ;
17, 40 : 1446-47.
HENRI W.L., DE MARIA A., GRAMIAK R.. Report of the American
Society of Echocardiography Committee on Nomenclature and Standards in
Two-dimensional Echocardiography. Circulation 1980 ; 62 : 212-17.
HERNANDEZ S.R., KELLOGG T.A., WILSON M.J. et al. Prevalence
of HIV-1 among homosexual and bisexual men in the San Francisco Bay Area :
Evidence of Infection among Young Gay Men (Abstract W.C. 3010). In : Abstracts
of the VIIth International Cofnerence on Aids. v.2. Florence, italy, June
16-21, 1991 : 298.
HERSKOWITZ A.H., WILLOUGBY S., WU T.C. et al.
Immunopathogenesis of HIV-1-Associated Cardiomyopathy. Clin. Immunol.
Immunopathol. 1993 ; 68 : 234-41.
HERSKOWITZ A., WILLOUGHBY S.B., BAUGHMAN K.L., SCHULMAN S.P.,
BARTLETT J.D.. Cardiomyopathy Associated with Antiretroviral Therapy in
Patients with HIV Infection : a Report of Six Cases. Ann. Intern. Med. 1992 ;
116 : 311-13.
HERSKOWITZ AHVIE, VLAHOV D., WILLOUGHBY S. et al.. Prevalence
and Incidence of Left Ventricular Dysfunction in Patients with Human
Immunodeficiency Virus Infection. Am. J. Cardiol. 1993 ; 71 : 955-58.
HERST J.A., SHEPHERD F.A., LIU P., BUTANY J.W., HOULE S.,
BURKES R., PAUL K.. Prospective Assessment of Cardiac Function in Patients
with Kaposi's Sarcoma and the Acquired Immune Deficiency Syndrome. Clin-Invest
Med. 1991 ; 14 : 21-27.
HESSOL N.A. et al. The Natural History of HIV Infection in a
Cohort of Homosexual and Bisexual Men : a Decade of Follow-up, 4e
Conférence Internationale sur le SIDA, Stockholm, 1988,
Résumé 4096.
HIGUCHI R.. Simple and Rapid Preparation of Samples for PCR.
In : ERLICVH H.A., ed. PCR Technology. Principles and Applications for DNA
Amplification. Stockton Press, New-York, 1989.
HIMELMAN R.B., DOHRMANN M., GOODMAN P. et al.. Severe
Pulmonary Hypertension and Pulmonale in the Acquired Immunodeficiency
Syndrome. Am. J. cardiol. 1989 ; 64 : 1396-99.
HIMELMAN R., CHUNG W., CHERNOFF D. et al. Cardiac
Manifestations of Human Immunodeficiency Virus Infection : a Two-Dimensional
Echocardiographic Study. J. Am. Coll. Cardiol. 1989 ; 13 : 1030-6.
HIROTA Y.. A Clinical Study of Left Ventricular Relaxation.
Circulation 1980 ; 62 : 756-63.
HO D.D., POMERANZ R.J., KAPLAN J.C.. Pathogenesis of
Infection with Human Immunodeficiency Virus. N. Engl. J. Med. 1987 ; 317 :
278-86.
HOFFMAN P., BERNARD E., MICHIELS J.F., DELLAMONICA P.,
LOUBIERE P.. Myocardite aigüe toxoplasmique. Cause de mort subite au
cours d'un syndrome d'immunodéficience acquise. Arch. Mal. Coeur Vaiss.
1990 ; 83 : 1735-38.
HOLTZ M.A., LAVERY D.P., KAPILA R.. Actinomycetates Infection
in the Acquired Immunodeficiency Syndrome. Ann. Intern. Med. 1985 ; 102 :
203-5.
IL P.C.K., YEOH E.K. Current Epidemiological trends of HIV
Infection in Asia. In : Volberding P., Jacobson M.A., ed. AIDS Clinical
Revision 1992. new York, marcel Dekker Inc. ; 1992 : 1-24.
IMASE M., SOTOBATA I., TAKAGI S. et al.. Effects of Diltiazem
on Left Ventricular Diastolic Behaviour in Patients with Hypertrophic
Cardiomyopathy : Evaluation with Exercise pulsed Doppler Echocardiography. J.
Am. Coll. Cardiol. 1987 ; 9 : 1099-105.
INOUYE I., MASSIE B., LOGE D. et al.. Abnormal Left
Ventricular Filling : An Early Finding in Mild to Moderate Systemic
Hypertension. Am. J. Cardiol. 1984 ; 53 : 120-6.
JACOB A.J., SUTHERLAND G.R., BIRD A.G. et al. Myocardial
Dysfunction in patients Infected with HIV : PREVALENCE AND Risk Factors. Br.
heart J. 1992 ; 68 : 549-53.
JACOBS J.L., GOLD J.M.W., MURRAN H.W. et al. Salmonella
Infections in Patients with the Acquired Immunodeficiency. Ann. Intern. Med.
1985 ; 102 : 186-8.
JOSHI V.V., GADOL C., CONNOR E., OLESKE J.M., MENDELSON J.,
MARIN GARCIA G.. Dilated Cardiomyopathy in Children with Acquired
Immunodeficiency Syndrome : a Pathologic Study of Five Cases. Hum. Pathol.
1988 ; 19, 1 : 69-73.
KAGAME A., TAELMAN. Les péricardites avec
épanchement et infection au VIH à Kigali (Rwanda). L'information
cardiologique 1991 ; vol. XV, n 1 : 57-8.
KAMINSKY H.J., KATZMAN M., WIEST P.M. et al.. Cardiomyopathy
Associated with the Acquired Immune Deficiency Syndrome. J. Acq. Immun. Defic.
Syndrome 1988 ; 1 : 105-11.
KAPILA R.. Actinomycetates Infection in the Acquired
Immunodeficiency Syndrome. Ann. Intren. Med. 1985 ; 102 : 203-5.
KAPITA B., COLEBUNDERS R., LUSAKUMUNU K., HENRY M.C..
Parasitoses opportunistes en Afrique, Clinique et diagnostic. Ann. Parasitol.
Hum. Comp. 1990 ; 65 suppl. 1 : 45-47.
KAPITA B. Aspects cliniques de l'infection à VIH de
l'adulte en zone tropicale. In : Rosenheim M. et Itoua-Ngaporo A. SIDA,
Infection à VIH, aspects en zone tropicale. Ellipses/Aupelf 1989 ;
92-99.
KAPLAN E.L., MEIER P.. Non-Parametric Estimation from
Incomplete Observations. Am. Stat. Assoc. J. 1958 ; 53 : 457-81.
KAPPES D., STROMINGER J.L.. Human Class II Major
Histocompatibility Complex Genes and Proteins. Ann. Rev. Biochem. 1988 ; 57 :
991-1028.
KAUL S., FISHBEIN M.C., SIEGEL R.J.. Cardiac Manifestations
of Acquired Immune Deficiency Syndrome : A 1991 Update. Am. Heart. J. 1991 ;
122 : 535-44.
KAVANAUGH Mac Hugh A., ROWE S., BENJAMIN Y. et al.. Selenium
Deficiency and Cardiomyopathy in Malnourished Pediatric AIDS Patients in :
Conférence Internationale sur le SIDA, Montréal 1989, Ottawa :
Centre de Recherches pour le Développement International, 1989 : 329
(abstr.).
KAWE L.W., RENARD G., LE HOANG P., KAYEMBE L., ODIO W..
Manifestations ophtalmologiques du SIDA en milieu africain. A propos de 45
cas. J. Fr. Ophtalmo. 1990 ; 13, 4 : 199-204.
KINNEY E.L., BRAFMAN D., WRIGHT R.J.I.I.. Echocardiographic
Findings in Patients with Acquired Immunodeficiency Syndrome (AIDS) ans
AIDS-Related Complex (ARC). Catheter Cardiovas Diagr. 1989 ; 16 : 970-76.
KLATZMANN D., CHAMPAGNE E., CHARMARET S. et al. T-Lymphocyte
T4 Molecule Behalves as the Receptor for Human Retrovirus LAV. Nature 1984 ;
312 : 767-8.
KOMAJDA M., RAFFOUX C., SALAME E. et al.. Antigènes
HLA A-B et DR dans les myocardiopathies dilatées. Arch. Mal. Coeur 1987
; 80 : 1233-37.
KONSTAM M.A. The Rationale for Pharmacotherapy in Left
Ventricular Systolic Dysfunction. The XIV Scientific Meeting of the
Internation Society of Hypertension, Toledo, Spain, June 1992.
KREISS J.K., KOECH D., PLUMMER F.A. et al. AIDS Virus
Infection in Nairobi Prostitutes. N. Engl. J. Med. 1986 ; 314 : 414-18.
LABOVITZ A.J., PEARSON A.C.. Evaluation of Left Ventricular
Diastolic Function : Clinical Relevance and Recent Doppler Echocardiographic
Insights. Am. Heart J. 1987 ; 114 : 836-51.
LAFONT A., MARCHE C., WOLFF M. et al.. Myocarditis in AIDS :
Etiology and Prognosis. JACC 1988 ; 11 (suppl. A) : 196A (abstr.).
LAFONT A., ZAZZO J.F., CHAPPUIS P. et al.. Carences en
sélenium et myocardiopathies au cours du SIDA. Arch. Mal. Coeur 1989 ;
82 : 971 (abstr.).
LANFRANCHI J., NAMADE M., SACHS R.N., ROBINEAU M., Les
cardiomyopathies au cours du syndrome d'immunodéficience acquise. Arch.
Mal. Coeur 1993 ; 86 (II) : 21-8.
LASSAIGNE D., GREDER A., HEDOIRE F., GROLLIER G., POTIER J.C.,
BAZIN C.. L'atteinte myocardique au cours du SIDA. Ann. Med. Interne 1991 ;
142 : 205-8.
LEIDIG G.A.. Clinical, Echocardiographic, and
Electrocardiographic Resolution of HIV-Related Cardiomyopathy. Mil. Med. 1991
; 156, 5 : 260-61.
LEVY W.S., VARGHESE J., ANDERSON D.W. et al.. Myocarditis
Diagnosed by Endomyocardial Biopsy in human Immunodeficiency Virus Infection
with Cardiac Dysfunction. Am. J. Cardiol. 1988 ; 62 : 658-59.
LEVY W.S., SIMON G.L., RIOS J.C.. Prevalence of Cardiac
Abnormalities in Human Immunodeficiency Virus Infection. Am. J. Cardiol. 1989
; 63 : 86-89.
LEWIS P., HOSPEDALES J., FRANCIS M; et al. HIV Seroprevalence
among Cocaine Addicts in trinidad. West Ind. Med. J. 1989 ; 4 (Suppl.).
LEWIS W.. AIDS : Cardiac Finding from 115 Autopsies. Prog.
Cardiovasc. Dis. 1989 ; 32 : 207-15.
LIPCHULTZ S., CHANOK S., SANDERS S. et al. cardiovascular
Manifestations of Human Immuno-deficiency Virus Infection in Infants and
Children. Am. J. Cardiol. 1989 ; 63 : 1489-97.
LOHOUE P., NOMO ONGOLO A., SAME E.A.. Candidoses et SIDA
à Yaoundé. Bull. Soc. Pathol. Exot. Filiales 1991 ; 84, 2 :
133-35.
LORELL B.H., BRAUNWALD E., Pericardial Disease. In :
Braunwald E., ed. heart Disease, 3rd ed. Philadelphia : WB Saunders 1988 :
1484-534.
MAHARAJ B., HAMMOND M.G.. HLA A-B, DR and DQ Antigens in
Black Patients with Idiopathic Dilated Cardiomyopathy. Am. J. Cardiol. 1990 ;
65 : 1402-3.
MALU K. et LONGO MBENZA B.. Péricardites aigües :
aspects cliniques et étiologiques (incidence du SIDA). Cardiol. Trop.
1988 ; 14 : 57-60.
MALU K., LONGO MBENZA B., LURHUMA Z., ODIO W..
Péricardite et syndrome d'immunodéficience acquise. Arch. Mal.
Coeur 1988 ; 81, 2 : 207-11.
MANN J.M., TARANTOLA D.M., NETTER T.W., eds. AIDS in the
World. Cambridge, MA ; Harvard University Press ; 1992.
MANN D.L. et al. HLA Antigen Frequencies in HIV-1
Seropositive Disease - Free Individual and Patients with AIDS. Journal of AIDS
1988 ; 1 : 13-17.
MANN J., TARANTOLA D.J.M., NETTER T.W. AIDS in the World. A
Global report. harvard University press 1992 ; 204-209.
MANUCK S.B., KASPROWICZ A.L., MULDOON M.F.,
Behaviorally-evoked Cardiovascular Reactivity and Hypertension : Conceptual
Issues and Potential Associations. Ann. behav. Med. 1990 ; 12 : 17-29.
MARTIN R.P., MALTZER R.S., CHIA B.L. et al.. Clinical Utility
of Two Dimensional Echocardiography in Infective Endocarditis. Am. J. Cardiol.
1980 ; 46 : 379-85.
MARTOS A., CARRATALA J., CABELLOS C., RODRIGUEZ P.. AIDS and
Primary Pulmonary Hypertension. Am. Heart J. 1993 ; 125 : 1819 (letter).
MARX J.L. Health Officials Seek Ways to halt AIDS. Science
1983 ; 219 : 271-72.
MAYAUD C., TOUBOUL J.L., MONTAGNE V. et AKOUN G.. Les
infections respiratoires au cours du SIDA. Rev. Prat. 1986 ; 36, 21 :
1169-76.
MBARAGA N., LONGO-MBENZA B., TSHIANI K.A., Place de
l'hypertension artérielle aux Cliniques Universitaires de Kinshasa.
cardiologie Tropicale 1984 ; 10 : 85-9.
METTE S.A., PALEVSKY H.I., PIETRA G.G. et al.. Primary
Pulmonary Hypertension in Associaiton with Human Immunodeficiency Virus
Infection. A Possible Viral Etiology for Some Forms of Hypertensive Pulmonary
Arteriopathy. Am. Rev. Respir. Dis. 1992 ; 145 : 1196-1200.
MICHELS V.V., DRISCOLL D.J., MILLER F.A.. Familial
Aggregation of Idiopathic Dilated Cardiomyopathy. Am. J. Cardiol. 1985 ; 55 :
1232-3.
MILLER S.A., DYKES D.D., POLESKY H.F.. A Simple Salting Out
Procedure for Extraction of DNA from Human Nucleated Cells. Nucl. Acids Res.
1988 ; 16 : 1215.
MINARDI G., DI SEGNI M., BOCCARDI L., PUCCI E., GIOVANNINI E..
Echocardiographic Evaluation of HIV-Positive Subjects. G. Ital. Cardiol. 1991
; 21 : 272-80.
MONSUEZ J., KINNEY E.L., VITTECOQ D. et al.. Comparison among
Acquired Immune Deficiency Syndrome Patients with and without Clinical Evidence
of Cardiac Disease. Am. J. Cardiol. 1988 ; 62 : 1311-13.
MORRIS P.J., FUGGLE S.V., TING A., WOOD K.J.. HLA and Organ
Transplantation. Br. Med. Bull. 1987 ; 43 : 184-202.
MOSS A.R. et al. Seropositivity for HIV and the Development of
AIDS or AIDS related Condition : Three Year Follow-up of the San francisco
General Hospital Cohort. Br. Med. J. 1988 ; 296 : 745-50.
MYRENG Y., SMISETH O.A.. Assessment of Left Ventricular
Relaxation by DOPPLER Echocardiography. Circulation 1990 ; 81 : 260-6.
N'GALY. Human Immunodeficiency Virus Infection among
Employees in an African Hospital. N. Engl. J. Med. 1988 ; 319 : 1123-27.
NAIK T.N., SARKAR S., SINGH H.L. et al. Intravenous Drug
users - A New Risk Group for HIV Infection in India. AIDS 1991 ; 5 : 117-8.
NATHAN P.E., ARSURA E.L., ZAPPI M.. Pericarditis with
Tamponade Due to Cytomegalovirus in the Acquired Immunodeficiency Syndrome.
Chest. 1991 ; 99, 3 : 765-66.
NATIONAL HIV Serosurveillance Summary. v. 2. Results through
1990. Atlanta. GA. U.S. Department of Health and Human Services, Public
Health Service. 1991 : Publication n HIV/NCID/11-91/011.
NEMEL D.B., DEROGATIS A.J., WILLIAM D.C.. Ga-67 Citrate
Myocardial Uptake in a Patient with AIDS, Toxoplasmosis and Myocarditis. Clin.
Nucl. Med. 1991 ; 16, 5 : 315-17.
NKOWANE B.M. Prevalence and Incidence of HIV Infection in
Africa : A Review of Data published in 1990. AIDS 1991 ; 5 (Suppl. 1) :
S7-15.
NOBLE O., FOWLER. Tuberculous Pericarditis. J. Am. Med.
Assoc. 1991 ; 266 : 99-103.
O.M.S. Deuxième meeting des centres collaborateurs de
l'OMS sur le SIDA. Bull. OMS 1986 ; 64 : 221-31.
O.M.S. Syndrome d'immunodéficience acquise (SIDA).
Révision 1987 de la définition CDC /OMS du cas de SIDA. Rel.
Epidémio. Hebdo 1988 ; 63 : 1-8.
ODIO W., KAPITA B., MBENDI N., KAYEMBE K., MUYEMBE T., MAZEBO
P., IZZIA K., LURHUMA Z., SANSA A., DECLER D., HENRY M.C., MBONGO M., Mc
CORMICK J.B., TAELMAN et PIOT P.. Le syndrome d'immunodéficience
acquise (SIDA) à Kinshasa, Zaïre : observations cliniques et
épidémiologiques. Ann. Soc. Bel. Méd. trop. 1985 ; 65 :
357-61.
OLUWOLE FAJOLU, MORDI V.P.N., OLU George B.. Aspergilius
Pericarditis. Cardiologie Tropicale 1985 ; 11 : 95-6.
OMS. Atelier sur le SIDA en Afrique Centrale (Bangui). Who
CDS/SIDA 1985, 1 Genève.
ORGANISATION MONDIALE DE LA SANTE (OMS). Atelier sur le SIDA
en Afrique centrale ; Bangui Rép. Centrafricaine, 22-24 oct. 1985.
OROFINO L., QUEREDA L., LAMA S., ORTE L., GONZALO A., MAMPASO
F., ORTUNO J.. Hypertension in Primary Chronic Glomerulonephritis : Analysis
of 288 Biopsied Patients. Nephron 1987 ; 45 : 22-26.
PAGE I.H. The Nature of Arterial Hypertension. Arch. Int.
Med. 1963 ; 111 : 103-17.
PANTALEO G., GRAZIOSI C., FAUCI A.S., The Immunopathogenesis
of Human Immunodeficiency Virus Infection. N. Engl. J. Med. 1993 ; 328 :
327-35.
PAPE J.W., JOHNSON W.D. Jr. Epidemiology of Aids in the
Caribbean. On : P., Mann J.M., eds. AIDS and HIV Infection in the Tropics.
Londonc : Baillière. Tindall ; 1988 : 31-42.
PARDO V., MENESES R., OSSA L. et al.. AIDS-related
Glomerulopathy : Occurrence in Specific Risk Groups. Kidney Int. 1987 ; 31 :
1167-73.
PARRAVICINI C., BAROLDI G., GAIERA G., LAZZARIN A.. Phenotype
of Intra Myocardial Leukocytic Infiltrates in Acquired Immunodeficiency
Syndrome (AIDS) : a Post-Mortem Immunohistochemical Study in 34 Consecutive
Cases. Mod. Pathol. 1992 ; 4 : 559-65.
PATTY F.H., YAMAGUCHI E., SMITH S.H., ENG R.-H.K.. Diastolic
Hypertension in AIDS Patients with Cryptococcal Meningitis. Am. J. Med. 1992 ;
93 : 347-48.
PEARSON A.C. et al.. Assessment of Diastolic Function in
Normal and Hypertrophied Hearts : Comparison of Doppler Echocardiography and
M-Mode Echocardiography. Am. Heart J. 1987 ; 113 : 1417-25.
PEDERSEN C., GERSTOFT J., TAURIS P. et al. Trends in Survival
of Danish AIDS Patients from 1981 to 1989. AIDS 1990 ; u : 111-6.
PETERS B.S., BECK E.J., COLEMAN D.G. et al.. Changing Disease
Patterns in Patients with AIDS in a Referral Centre in the United Kingdom : the
Changing Face of AIDS. BMJ 1991 ; 202 : 202-7.
PIOT P., CARAEL M. Epidemiological and Sociological Aspects
of HIV Infection in Developping Countries. Br. Med. Bul. 1988 ; 44 : 68-88.
PIOT P., QUINN T.C., TAELMAN H., FEINSOD F.M., KAPITA B., ODIO
W., MNENDI N., MAZEBO P., NDANGI K., STEVENS W., KAYEMBE K., MITCHELL S.,
BRIDTS C., Mc CORMICK J.B. Acquired Immunodeficiency Syndrome in a
Heterosexual Population in Zaïre. The Lancet 1984 ; 11 : 65-69.
PIOT P., KAPITA B., NGUGI E., MANN J., COLEBUNDERS R.,
WABITSCH R.. Le SIDA en Afrique. Manuel du praticien, OMS, Genève
1993, 24-27.
PITCHENICK A.E., BURR J., SUAREZ M. et al. Human T-Cell
Lymphotropic Virus-III Seropositivity and Related Disease among 71 Consecutive
Patients in whom Tuberculosis was diagnosed. Am. rev. respir. Dis. 1987 ; 135
: 875-79.
PITCHENIK A.E., FISCH M.A., DICKINSON G.M. et al. Opportunic
Infection and Kaposi's Sarcoma among Haitians. Evidence of a New Acquired
Immunodeficiency State. Ann. Int. Med. 1983 ; 98 : 277-84.
PITCHENIK A.E., COLE C., RUSSELL B.W., Tuberculosis, atypical
Mycobacterioses, and the acquired Immunodeficiency Syndrome among Haitian and
non-Haïtian Patients in South Florida. Ann. Intern. Med. 1984 ; 101 :
641-45.
PREWITT R.L., LEACH B.E., BYERS L.W., BROOKS B., LANDS W.E.M.,
MUIRHEAD E.E.. Antihypertensive polar renomedullary lipid, a semisynthetic
vasodilatator. Hypertension 1979 ; 1 : 299-308.
PROCACCIA S., BLASIO R., VILLA P. et al. Rheumatoïd
Factors and Circulating Immune Complexes in HIV-Infected Individuals. AIDS
1991 ; 5 : 1441-46.
PUGLIESE O., VIORA M., CAMPONESCHI B. et al. Agp 120 HIV
Peptide with High Similarity to HLA Class II Beta Chains Enhances PPD-Specific
and Autorsactive T-Cell Activation. Clin. Exp. Immunol. 1992 ; 90 : 170-4.
QUINN T.C., MANN J.M., CURRABN J., PIOT P.. AIDS in Africa :
an Epidemiologic Paradigm. Science 1986 ; 234 : 955-63.
RAFFANTI S.P., CHIARAMIDA A.J.J., SEN P., WRIGHT P., MIDDLETON
J.R. and CHIARAMIDA S.. Assessment of Cardiac Function in Patients with the
Acquired Immunodeficiency Syndrome. CHEST, 1988 ; 93 : 592-94.
RAO T.K.S., FRIEDMANN E.A.. AIDS (HIV)-associated Nephropathy
; does it exist ? An in-depth Review. Am. J. Neprol. 1989 ; 9 : 441-53.
RAO T.K.S., FRIEDMAN E.A., NICASTRI A.D.. The Types of Renal
Disease in the Acquired Immunodeficiency Syndrome. N. Engl. J. Med. 1987 ; 316
: 1062-68.
REISER P., OPRAVIL M., PFALTZ M., SPEICH R., SCHNEIDER J..
Primary Pulmonary Hypertension and Mesangioproliferative Glomerulonephritis in
HIV Infection. Dtsch Med. Wochenschr. 1992 ; 117 : 815-18.
REITANO J., KING J., COHEN H., LE SADR W., RUBLER S.,
STEINBERT J., FISHER V.. Cardiac Fonction in Patients with Acquired
Immune-Deficiency Syndrome (AIDS) or AIDS Prodrome. JACC. 1984 ; 3 : 525
(abstract).
ROCKEY R., KWO L.C., ZOGHBI W.A. et al.. Determination of
Parameters of Left Ventricular Diastolic Filling with Pulsed Doppler
Echocardiography : Comparison with Cineangiography. Circulation 1985 ; 71 :
543-50.
ROSTAND S.G., KIRK K.A., RUTSKY E.A. et al.. Racial
Differences in the Incidence of Treatment for End Stage Renal Disease. N.
Engl. J. Med. 1982 ; 306 : 1276-79.
ROUSSEAU M.F., POULEUR H., DETRY J.M.R., BRASSEUR L.A..
Relationship between Changes in Left Ventricular Isotropic State and Relaxation
in Normal Subjects and Patients with Coronary Artery Disease. Circulation 1981
; 64 : 736-43.
RUBIN R.H. preemptive Therapy in Immuno-Compromised Hosts.
N. Engl. J. Med. 1991 ; 324 : 1057-59.
RYDER R.W., PIOT P. Epidemiology of HIV Infection in Africa.
In : Piot P. et Mann J.M., AIDS and HIV Infection in the Tropics,
Baillière Tyndall 1988 ; 3 : 13-30.
RYDER W.R., BERTRAND W., COLEBUNDERS R.L. et al. Community
Surveillance for HIV-Infection in Zaïre. 3e Conférence
Internationale sur le SIDA, Washington D.C., 1987, Résumé
T.7.6.
SAAH A.J., MONOZ A., KUO V. et al. Predictors of the Risk of
AIDS over 24 Months among HIV-1 Seropositive Gay Men, a Report from the MACS.
Am. J. Epidemiol. 1992 ; 135 : 1147-55.
SAAH A.J., HOOVER D.R., YANHUA H.E. et al., Facotrs
influencing Survival after AIDS : Report from the Multicenter AIDS Cohort Study
(MACS). J. Acquir. Immune Defic. Syndr. 1994 ; 7 : 287-95.
SAHN D.J., DE MARIA A., KISSLO J., WEYMAN A.. Recommandation
Regarding Quantitation in M-mode echocardiography : results of a survey of
echocardiographic measurements. Circulation 1978 ; 58 : 1072-77.
SAIKI R.K., WALSH P.S., LEVENSON C.H., ERLICH H.A.. Genetic
Analysis of Amplified DNA with Immobilized Sequence Specific Digonucleotide
Probes. Proc. Natl. Acad. Sci. USA 1989 ; 86 : 6230-34.
SALMON C.D., DETRUCHIS P., JACCARD A. et al.
Bactériémies à salmonelles non typhiques au cours de
l'infection par le VIH. Données cliniques, évolutives et
thérapeutiques chez 68 malades. Presse Méd. 1992 ; 21 :
847-51.
SCHONHEYDER H., HOFFMANN S., JENSEN H.E., HANSEN B.F.,
FRANZMAN M.B.. Aspergillus Fumigatus Fungemia and Myocarditis in a Patient
with Acquired Immunodeficiency Syndrome. AMMIS. 1992 ; 107 : 605-8.
SCHWARTZ E.I., KALCHITSKY S.E., EISENSMITH R.C., WOO S.L.C..
Polymerase Chain Reaction from Dried Blood Spots on Giuthrie Cards. Lancet
1990 ; 336 : 339-40.
SELIK R.M., CHU S.Y., BUEHLER J.W., Human Immunodeficiency
Virus (HIV) Infection as a Leading Cause of Death among Young Adults in U.S.
Cities and States. JAMA 1993 ; 269 : 2991-4.
SILVER M.A., MACHER A.M., REICHERT C.M. et al.. Cardiac
Involvement by Kaposi's Sarcoma in Acquried Immune Deficiency Syndrome. Am. J.
Cardiol. 1984 ; 53 : 983-5.
SIMMONDS P., LAINSON F.A.L. et al. HIV Antigen and Antibody
Detection : Variable Responses to Infection in the Edinburgh Hoemophiliac
Cohort. Br. Med. J. 1988 ; 296 : 593-8.
SIMONS M., PANDIAN N., Mc INERNEY K. et al.. Diastolic
Filling Dysfunction in Patients with Congestive Heart Failure and Normal
Systolic Function (Abstract). Circulation 1986 ; 74 : 384.
SLOAND E.M., KLEIN H.G., BANKS S.M. et al. Epidemiology of
Thrombocytopenia in HIV Infection. Eur. J. Haematol. 1992 ; 48 : 168-72.
SMITH P.D., MACHER A.M., BOOKMAN A.M. et al. Salmonella
Thypimurium Entiridis and Bacteremia in the Acquired Immunodeficiency Syndrome.
Ann. Int. Med. 1985 ; 102 : 207-8.
SONI A., AGARWAL A., CHANDER P., YOO J., SINGAL D., SALOMON
N., ROBINSON B., TRESER G.. Evidence for an HIV-related Nephropathy : a
Clinico-pathological Study. Clin. Nephrol. 1989 ; 31 : 12-17.
SOUFER R., WOHLGELERNTER D., VITA N.A. et al.. Intact
Systolic Left Ventricular Function in Clinical Congestive Heart Failure. Am.
J. Cardiol. 1985 ; 55 : 1032-6.
SPIRITO P., MARON B.J., NONOW R.O.,. Non-invasive Assessment
of Left Ventricular Diastolic Function : Comparative Analysis of Doppler
Echocardiographic and Radionucle Angiographic Technique. J. Am. Coll. Cardiol.
1986 ; 7 : 518-26.
STAUFFER J.C., GAASCH W.H.. Recognition and Treatment of Left
Ventricular Diastolic dysfunction. Prog. Cardiovasc. Dis. 1990 ; 32 :
319-32.
STEEL C.M. et al. HLA Haplotype A1B8DR3 as a Risk Factor for
HIV-Related Disease. Lancet 1988 ; I : 1185-88.
STEFFEN H.M., MULLER R., SCHRAP P.E., BACHER M. et al..
Prevalence of Echocardiographic Abnormalities in Human Immunodeficiency Virus 1
Infection. Am. J. Noninvasive Cardiol. 1991 ; 5 : 280-84.
STEIN D.S., KORVICK J.A., VERMUND S.H. Cd4 + Lymphocyte Celle
Enumeration for Prediction of Clinical Course of Human Immunodeficiency Virus
Disease : a Review. Journal of Infections Diseases 1992 ; 165 : 352-63.
STEINHERZ L.J., BROCHSTEIN J.A., ROBINS J.. Cardiac
Involvement in Congenital Acquired Immunodeficiency Syndrome. Am. J. Dis.
Child 1986 ; 140 : 1241-44.
STERN M., MEAGHER L., SAVILL J., HASLETT C. Apoptosis in
Human Eosinophils. programmed Cell Death ion the Eosinophils Leads to
Phagocytosis by Macrophages and is modulated by IL-5. Journal of Immunology
1992 ; 148 : 3543-49.
SVEYGARD A., JERSILD C., STAUB-NIELSEN L. et al.. HLA
Antigens and Disease. Statistical and Genetical Considerations. Tissue
Antigens 1974 ; 4 : 95-105.
TAELMAN H., KAGAME A., BAHUNGWANAY J. et al. Pericardial
Effusion and HIV Infection. Lancet 1990 ; 335 : 924.
TAKENAKA K., DABESTANI A., GARDIN J.M. et al., Left
Ventricular Filling in Hypertrophic Cardiomyopathy : A Pulsed Doppler
Echocardiographic Study. J. Am. Coll. Cardiol. 1986 ; 7 : 1263-71.
TEMMERMAN M. MOHAMMED ALI F., NDINYA-ACHOLA J.O. et al. Rapid
Increase of Both Women in Nairobi, Kenya. AIFDS 1992 ; 6 : 1181-5.
THOMSON G.. HLA and Disease Associations : Models for Insulin
Dependent Diabetes Mellitus and the Study of Complex Genetic Disorders. Ann.
Rev. Genet 1988 ; 22 : 31-50.
TIERCY J.M., MOREL C., FREIDEL A.C. et al.. Selection of
Unrelated Donors for Bone Marrow Transplantation is improved by HLA Clan II
Genotyping with Digonucleotide Hybridization. Proc. Natl. Acad. Sci. USA 1991
; 88 : 7121-25.
TINDALL B., COOPER D.A., Primary HIV Infection : Host
Response..., AIDS 1991 ; 5 : 1-14.
TONDUANGU K., LONGO-MBENZA B., LUTETE K. et al.
Péricardites liquidiennes au cours du syndrome d'immunodéficience
acquise (SIDA). A propos de 23 cas à Kinshasa (Zaïre).
médecine d'Afrique Noire 1995 ; 42 : 67-76.
TONDUANGU K., LON?GO-MBENZA B., LUTETE K., KINTOKI V., IZZIA
K., MUYEMBE T., Péricardites liquidiennes au cours du syndrome de 23 cas
à Kinshasa (Zaïre). Médecine d'Afrique Noire 1995 ; 42 :
673-6.
TOPOL E.J., TRAILL T.A., FORTUIN N.J.. Hypertensive
Hypertrophic Cardiomyopathy of the Elderly. N. Engl. J. Med. 1985 ; 312 :
277-83.
TREASURE C.B., VITA J.A., COX D.A. et al..
Endothelium-dependent Dilation of the Coronary Microvasculate is Impaired in
Dilated Cardiomyopathy. Circulation 1990 ; 81 : 772-79.
TURNICKY R.P., GOODIN J., SMIALEK J.E., HERSKOWITZ A.,
BESCHORNER W.E.. Incidental myocarditis with Intravenous Drug Abuse : the
Pathology, Immunopathology and Potential Implications for Human
Immunodeficiency Virus-Associated Myocarditis. Hum. Pathol. 1992 ; 23 :
138-43.
URASSA W., BRAEDBERG RADEN U., MBENA E. et al. Field
Evaluation of 6 HIV-1 Antibody Screening Assays in Dar es Salaam, Tanzania.
Poster 111, presented at IVthe International Conference on AIDS and associated
Cancers in Africa ; oct. 18-20, 1989, Marseille, France.
VAN DE PERRE P., CLUMECK N., CARAEL M. et al. Female
Prostitutes : a Risk Group for Infection with T-Cell Lymphotropic Virus Type
II. Lancet 1985 , II : 524-26.
VAN HOEVEN K.H., SEGAL B., FACTOR S.M.. AIDS Cardiomyopathy :
First Rules out other Myocardial Risk Factors. Int. J. cardiol. 1990 ; 29 :
35-37.
VAZIRI N.D., BARBARI A., LICORISHI K., CASARIO T., GUPTA S..
Spectrum of Renal Abnormalities in Acquired Immunodeficiency Syndrome. J. Nat.
Med. Assoc. 1985 ; 77 : 369-75.
VERCAUTEREN G., VAN DER GROEN G., PIOT P. Comparison of
Enzyme Immunoassays and an Immunofluorescence Test fort Detection of Antibody
to Human Immunideficiencu Virus in African Sera. Eur. J. Clin. Microbiol. 1987
; 6 : 1232-5.
VOLBERDING P.A., LAGAKOS S.W., KOCH M.A. et al. Zidovudine in
Asymptomatic Human - Immunodeficiency Virus Infection. A Controlled Trial in
Persons with Fewer than 500 CD4-Positive Cells per Cubic Millimeter. The AIDS
Clinical Trial Group of the National Institute of Allergy and Infectious
Diseases. N. Engl. J. Med. 1990 ; 322 : 941-9.
VON SYDOW M., GAINES H. et al. Antigen Detection in Primary
HIV Infection. Br. med. J. 1988 ; 296 : 238-40.
VULLIEMIN P. et LEDUC D.. Coeur et SIDA. Méd. et Hyg.
1993 ; 51 : 241-46.
WATERSON A.P. Regular Review : Acquired Immunodeficiency
Syndrome. br. Med. J. 1983 ; 288 : 743-46.
WEBER J.N. et al. Human Immunodeficiency Virus Infection in
Two Cohorts of Homosexual Men : Neutralizing Sera and Association of Anti-gag
Antibody with Prognosis. Lancet 1987 ; I : 119-121.
WEIBEL W., LAMPINEN T., CHENE D. et al. HIV-1 Seroconversion
in a Cohort of Street Intravenous Drug Users in Chicago (Abstract F.C. 556).
In : Final program and Abstractzs of the VIth International Conference on AIDS.
v.2. San francisco. CA. June 20-24, 1990 : 220.
WEINGER B.G., LIMPAKARNJANARAT K., UNGCHUSOK K. et al. The
Epidemiology of HIV Infection and AIDS in Thailand. AIDS 1991 ; 5 (Suppl. 2) :
571-85.
WENDLER L. et al. Neutralizing Antibodies and the Course of
HIV-Induced Disease. AIDS Res. Hum. Retro. 1987 ; 3 : 157-163.
WILBUR Y.W.. Evaluation of Left Ventricular Diastolic
Function. Circulation 1989 ; 79 : 1393-97.
WOODS G., GOLDSMITH J.. Fatal Pericarditis Due to
Mycobacterium AVium-Intracellulare in Acquired Immunodeficiency Syndrome.
Chest. 1989 ; 95 : 1355-57.
WORLD HEALTH ORGANIZATION (WHO). AIDS. The Current Global
Situation of the HIV/AIDS Pandemic. Weekly Epidemial Rec 1993 ; 68 : 193-6.
WORLD HEALTH ORGANIZATION (WHO). The HIV/AIDS Pandemic. 1993
Overview. Geneva : World Health Organization ; 1993.
WORLD HEALTH ORGANIZATION. Interim Proposal for a WHO staging
for HIV Infection and Diseases. Wkly Epidemial Rec. 1990 ; 65 : 221-4.
WU T.C., PIZZORNO M.C., HAYWARD G.S., WILLOGHBY S. et al.. In
Situ Detection of Human Cytomegalovirus Immediate-Early Gene Transcripts within
Cardiac Myocytes of Patients with HIV-associated Cardiomyopathy. AIDS 1992 ; 6
: 777-85.
YONG A.J., GRANGE J.M., TEE R.D. et al. Total and
antimycobacterial IgE Levels in Serum from Patients with Tuberculosis and
Leprosy. Tubercle 1989 ; 70 : 273-79.
ZILE M.R., BLAUSTEIN A.S.. GAASH W.H., The Effect of Acute
Alterations in left Ventricular Aflterload and â-Adrenergic Tone on
Indices of Early Diastolic Filling Rate. Circ. Res. 1989 ; 65 : 406-16.
ANNEXES
TABLE DES MATIERES
PREFACE 1
INTRODUCTION 3
1. PROJECTIONS ET IMPACT DE L'INFECTION VIH
SUR LE MONDE 4
2. PHYSIOPATHOLOGIE ET VIRUS DE L'IMMUNODEFICIENCE HUMAINE
9
3. MANIFESTATIONS CLINIQUES DE L'INFECTION PAR LE VIH 13
4. DETECTION DU VIRUS VIH 14
4.1. DIAGNOSTIC SEROLOGIQUE 14
4.2. DIAGNOSTIC DIRECT 16
5. REPONSE SEROLOGIQUE A L'INFECTION VIH ET DEPLETION DES
CELLULES T-CD4 18
6. COEUR ET SIDA 19
CHAPITRE I - METHODES 24
1.1. PATIENTS 24
1.2. PROTOCOLE EXPERIMENTAL 27
1.2.1. BIOLOGIE 27
1.2.2. ECHOCARDIOGRAPHIE 28
1.2.2.1. Techniques de l'Echo-Doppler cardiaque 28
1.2.2.2. Mesures échocardiographiques en mode M 29
1.2.2.3. Mesures échocardiographiques - Doppler 29
1.3. ANALYSES STATISTIQUES 30
CHAPITRE II - FREQUENCE ET ASPECTS CLINIQUES DES
PERICARDITES AU COURS DU SIDA 33
2.1. ETAT DE LA QUESTION 33
2.1.1. PATIENTS DE L'ETUDE RETROSPECTIVE 33
2.1.2. PATIENTS DE L'ETUDE PROSPECTIVE 34
2.2. RESULTATS 36
I. ETUDE RETROSPECTIVE 36
2.2.1. LES ASPECTS CLINIQUES DE L'INFECTION A VIH ET DES
PERICARDITES 36
2.2.2. LES EXAMENS BIOLOGIQUES 37
II. ETUDE PROSPECTIVE 38
2.2.3. ASPECTS GENERAUX 38
2.2.4. MANIFESTATIONS CLINIQUES DE L'INFECTION A VIH ET
EXPLORATION FONCTIONNELLE DU COEUR 38
2.2.5. ETIOLOGIES DES PERICARDITES 43
2.2.6. VALEUR PEJORATIVE DES EOSINOPHILES 46
2.2.7. EVOLUTION DES PERICARDITES AU COURS DE L'INFECTION VIH
48
2.3. DISCUSSION 50
CHAPITRE III - TABLEAU CLINIQUE DES ATTEINTES
CARDIAQUES AU COURS DU SIDA 57
3.1. IMPORTANCE DU SUJET 57
3.2. RESULTATS 59
I. DEPISTAGE DES CARDIOPATHIES ASSOCIEES A L'INFECTION VIH
59
3.2.1. INVESTIGATIONS CLINIQUES 61
3.2.2. PERICARDITE LIQUIDIENNE 64
3.2.3. CARDIOMYOPATHIE DILATEE 64
II. INFLUENCE DE L'INFECTION VIH SUR LA FREQUENCE DES
CARDIOPATHIES 65
3.2.4. DONNEES CLINIQUES ET IMMUNOLOGIQUES 65
3.3. DISCUSSION 68
CHAPITRE IV - DYSFONCTION DIASTOLIQUE AU COURS DE
L'INFECTION VIH : APPORT DE L'ECHO DOPPLER CARDIAQUE 74
4.1. PHYSIOPATHOLOGIE DE LA FONCTION DIASTOLIQUE 74
4.2. FONCTION DIASTOLIQUE ET SIDA 77
4.3. PATIENTS 78
4.4. EXAMEN ECHO-DOPPLER PULSE MITRAL 79
4.5. RESULTATS 80
4.6. DISCUSSION 85
CHAPITRE V - ETUDE DE LA SURVIE DES PATIENTS AVEC
COMPLICATIONS CARDIAQUES ASSOCIEES A L'INFECTION VIH 92
5.1. INTERET DE L'ETUDE SUR LA MORBIDITE ET LA MORTALITE
CARDIOVASCULAIRES AU COURS DU SIDA 92
5.2. PATIENTS 94
5.3. ANALYSE DES PARAMETRES ECHO-DOPPLER CARDIAQUES 95
5.4. CALCUL DES COURBES DE SURVIE 95
5.5. RESULTATS 96
5.6. DISCUSSION 108
CHAPITRE VI - FACTEURS GENETIQUES ET CARDIOMYOPATHIE
DILATEE AU COURS DU SIDA 113
6.1. FACTEURS GENETIQUES ET CARDIOMYOPATHIE DILATEE 113
6.2. HEREDITE ET CARDIOMYOPATHIE DILATEE ASSOCIEE
AU SIDA 113
6.2.1. DEFINITION DU COMPLEXE HLA 117
6.3. METHODES 117
6.3.1. PATIENTS 117
6.3.2. EXTRACTION DE L'ADN GENOMIQUE 118
6.3.3. TYPAGE DE L'ANTIGENE DRB1 119
6.3.4. PRIMERS DE PCR 120
6.3.5. ANALYSE STATISTIQUE 121
6.4. RESULTATS 121
6.5. DISCUSSION 124
CHAPITRE VII - EVOLUTION DE LA TENSION ARTERIELLE AU
COURS DE L'INFECTION VIH 127
7.1. INTRODUCTION 127
7.2. PATIENTS 128
7.2.1. HYPERTENSION ARTERIELLE TRANSITOIRE ET INFECTION VIH :
ETUDE PRELIMINAIRE 128
7.2.2. EVOLUTION DE LA TENSION ARTERIELLE ET INFECTION VIH
129
7.3. RESULTATS 130
7.4. DISCUSSION 136
CONCLUSIONS GENERALES 142
BIBLIOGRAPHIE 155
ANNEXES 194
| 


