Chapitre VI: HYDROCHIMIE KHELIFI.B
2016
72
VII-3-3-5-1-3-Le Sodium et le Potassium (Na+ + K+) :
Le potassium provient de l'altération des roches
gneissiques et schisteuses, des argiles
potassiques et de la dissolution des engrais chimiques (NPK).
Les teneurs en potassium sont très faibles, l'origine de
potassium des eaux du barrage est les
argiles numidien.
Les teneurs en sodium admises par l'O.M.S. sont de l'ordre de
100 mg/l.Les origines possibles
de sodium sont la dissolution de couches salifères, le
sodium dans les eaux peut provenir :
+ du lessivage des formations riches en NaCl
(argiles- marnes).
+ des eaux usées d'origine industrielle
et domestique.
+ de l'invasion d'eau marine.
VII-3-3-5-2-Les anions :
VII-3-3-5-2-1-Les Bicarbonates (HCO3-) :
Les ions de bicarbonates sont définis par les
hydrogénocarbonates et caractérisent
essentiellement l'alcalinité des eaux naturelles.
La présence des bicarbonates dans l'eau est due à
la dissolution des formations carbonatées
(cipolin, calcaire) Par des eaux chargées en gaz
carbonique (CO2) de la minéralisation de la matière
organique. La réaction de dissolution est donnée
par l'équation suivante :
CaCO3(S) +
H2O(L) + CO2(g)
2HCO3-+Ca2+
La concentration des bicarbonates dans l'eau est fonction des
paramètres suivants :
+ Température de l'eau.
+ Tension du CO2 dissous.
+ Concentration de l'eau en sels et nature lithologique des
terrains traversés.
Tableau N°41 : Variations de la teneur en
Bicarbonates dans les eaux du barrage de la
Cheffia (Période : 2015-2016).
Paramètres
|
Paramètres statistiques du Bicarbonates
(HCO-3)
|
Barrage de
la
Cheffia
Période
2015-2016
|
Max (mg/l)
|
Moy (mg/l)
|
Min (mg/l)
|
Ecart type
|
|
13,95
|
10,5
|
2,34
|
|
|
Chapitre VI: HYDROCHIMIE KHELIFI.B
2016
73
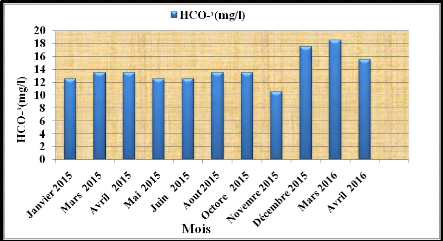
Figure N°37: Histogramme des Variations de la
teneur en Bicarbonates dans les eaux du barrage de la Cheffia (Période :
2015-2016).
Le graphe de l'évolution de la teneur en Bicarbonates
(HCO3-) (Fig. 38), montrent que La valeur maximum des concentrations
d'analyses du bicarbonate des eaux du barrage est de l'ordre de 18,5mg/l
enregistrée au mois d'Mars 2016 et la valeur minimum est de l'ordre de
10,5 mg/l marquée au mois Novembre 2015.
VII-3-3-5-2-2-Les sulfates (SO42-):
La présence des ions de sulfates (SO42-)
dans l'eau est liée à la dissolution des formations gypseuses
d'une part, aux pesticides provenant des eaux d'irrigation d'autre part.
Les sulfates les plus fréquemment rencontrés
sont les sulfates de sodium, les sulfates d'ammonium et le sulfate de
magnésium. Bien que l'ion de sulfate soit l'un des anions les moins
toxiques, une concentration de 250 mg/L peut occasionner des problèmes
gastro-intestinaux chez les enfants et une concentration de 300 mg/l peut
être laxative chez les adultes. L'OMS considère que l'eau est non
potable si la concentration en sulfate dépasse 500 mg/l.Les eaux du
barrage Bounamoussa présentent des teneurs en (SO42-) 39
mg/l.
| 


