2022-2023

|
UNIVERSITE DE NOUAKCHOTT FACULTE DES SCIENCES ET TECHNIQUES
DEPARTEMENT DE LA BIOLOGIE
|
Mémoire
En vue de l'obtention du Diplôme de
MASTER
Option : Biologie Environnementale et Écosystèmes
Sahéliens
Thème
SUIVIE SPATIO-TEMPORELS DE
L'ECHOUAGE DES TORTUES MARINES SUR
LE LITTORAL SUD-MAURITANIE
Présenté par
Sidiahmed Ahmed Sidi Elemin Elmahmoud
Mr.Ahmedou Mohamed Vadel Salihi FST President
Mr.Lemhaba Yarba FST Examinateur
Mr.Mohamed Avoulwatt FST Encadrant

Année Universitaire 2022-2023
2022-2023
Résumé
L'environnement de toute l'humanité est victime de
menaces de toute sorte y compris la Mauritanie. Il existe sept espèces
des tortues marines au monde, rassemblées en deux grandes familles. Le
Parc National du Diawling est géré en partenariat entre le
Ministère de l'environnement et du Développement Durable et le
projet de Partenariat Régional pour la Conservation de la zone
Côtière et Marine en Afrique de l'Ouest qui finance les Missions
des Suivis littoral d'échouage des tortues Marines .
Les échouages des tortues marines constituent la
principale source de données et de matériel biologique pour
l'étude de ces espèces et est un soutien essentiel à la
recherche scientifique et aux politiques publiques de conservation. Les
données et prélèvements collectés permettent en
effet de renforcer les connaissances sur la biologie et l'écologie des
espèces, mais aussi sur les menaces.
Il existe plusieurs raisons d'échouages, mais trois
grandes catégories peuvent être distinguées :
· Les causes naturelles : pathologies, prédation,
compétitions inter ou intra spécifiques, etc.
· Les causes anthropiques : les captures accidentelles
dans les engins de pêche, qui constituent la première cause
d'échouages dans de nombreuses régions du monde, les collisions
avec les navires, la pollution sonore ou chimique, l'ingestion de
matières plastiques,etc.
· Les causes environnementales : le changement
climatique, les tempêtes, les toxines algales, les séismes,
etc.
La majorité des espèces des tortues
échouées dans la zone sont des espèces des tortues vertes
à52%.
Le pic de courbe d'échouage des tortues marines dans
la zone correspondant à la période de nidification.
Mots clés : Mauritanie, tortues
marines, Parc National du Diawling, Missions de Surveillance du Littoral,
échouage de tortues marines, menaces
2022-2023
Abstract
The environment of all humanity is a victim of threats of all
kinds, including Mauritania. There are seven species of marine turtles in the
world, grouped into two large families. The Diawling National Park is managed
in partnership between the Ministry of Environment and Sustainable Development
and the Regional Partnership Project for the Conservation of the Coastal and
Marine Zone in West Africa, which finances the Coastal Monitoring Missions of
marine turtle strandings.
The strandings of marine turtles are the main source of data
and biological material for the study of these species and are essential
support to scientific research and public conservation policies. The data and
samples collected reinforce the knowledge of the species biology and ecology,
as well as the threats.
There are several reasons for strandings, but three main
categories can be distinguished: - Natural causes: pathologies, predation,
inter or intra-specific competitions, etc.
- Anthropogenic causes: accidental capture in fishing gear,
which is the primary cause of strandings in many parts of the world, collisions
with ships, noise or chemical pollution, ingestion of plastic materials,
etc.
- Environmental causes: climate change, storms, algal toxins,
earthquakes, etc.
The majority of turtle species stranded in the area are green
turtles at 52%.
The peak of the stranding curve of marine turtles in the area
corresponds to the nesting period.
Keywords: Mauritania, sea turtles, Diawling
National Park, Coastal Monitoring Missions, sea turtle stranding, threats
2022-2023
Dédicaces
A celui qui a toujours garni mes chemins avec force et
lumière...Mon très cher père. A la plus belle perle du
monde...ma tendre mère. A mes soeurs et chers frères je leur
souhaite tout le succès et tout le bonheur. A toute ma famille pour
l'amour et le respect qu'ils m'ont toujours accordé. A tous mes amis
dont les noms ne sont pas mentionnés mais qui sont présent dans
notre esprit. Pour une sincérité si merveilleuse jamais
oubliable, en leur souhaitant tout le succès ...tout le bonheur. A toute
personne qui m'a aidé à franchir un horizon dans ma vie. A mon
Pays : La Mauritanie.
2022-2023
Remerciements
Je remercie avant tout ALLAH, le tout puissant, de m'avoir
guidé et de m'avoir donné la volonté, la patience et le
courage pour terminer ce travail. Comme toute oeuvre humaine, ce travail n'est
pas le fruit de mes seuls efforts. Pour l'accomplir, il m'a fallu l'apport et
le soutien précieux de plusieurs personnes. C'est le moment pour moi de
leur exprimer mes sincères remerciements. Je pense en première
lieu aux personnes sans lesquelles ce travail n'aurait pas été
possible, qui ont bien encadré et orienté ce travail par leurs
paroles, leurs écrits, leurs conseils et leurs critiques. Aux personnes
qui ont dirigé, malgré leurs préoccupations, ce modeste
travail, qui a été réalisé entre le PK28 et Ndiago.
Mes remerciements vont à mon encadrants : Monsieur Mohamed
Avoulwatt. Ils ont accepté de diriger ce travail tout le long
de sa réalisation. Je leurs exprime ma profonde gratitude. J'adresse un
grand merci à Mr. Lemhaba Yarba , pour le temps qui a consacré
pour examiner ce travail. Ses conseils et remarques ont été un
grand support afin de finaliser mon mémoire. Les agents du Parc National
du Diawling à la direction à Nouakchott, notamment le Directeur
Mr. Daf Sehla Daf, pour l'accord de mon stage, Mr. Zeine El abidine Sidaty, le
conservateur pour l'accueil chaleureux et les informations importantes pendant
le séjour sur le terrain.
Je ne peux pas oublier Mr. Ahmedou Vadel Salihi, pour avoir
accepté présider le jury de soutenance de mon mémoire.
Tous les professeurs du Département de la Biologie notamment Mr.
Khyarhoum Brahim, le coordinateur du master BEES pour les conditions du
déroulement des cours pendant la formation du master.
Mes remerciements vont tout particulièrement à
ma famille qui m'a toujours soutenu dans mes choix. Elle était
présente chaque fois que cela est nécessaire. Que tous ceux qui
ont contribué de près ou de loin à ce travail, même
par un petit signe d'encouragement, trouvent ici mes remerciements les plus
sincères.
2022-2023 6
TABLE DES MATIERES
Introduction 9
PREMIERE PARTIE : ETUDE BIBLIOGRAPHIQUE 11
Chapitre I: BIOLOGIE ET ECOLOGIE DES TORTUES, LE
PROTOCOLE DE NIDIFICATION, LES MENACES
11
II.1. Biologie et écologie des tortues
11
II .1.2 Systématiques des Tortues marines
11
II .1.2 .1 LA FAMILLE DES CHELONIIDAE 12
II .1.2 .2 LA FAMILLE DES DERMOCHELYIDAE 12
II .1.3 Classification Linnéenne des Tortues
marines 13
II .2.1.1 les pontes 15
II .2.1.2 Phase d'incubation
16
II .2.1.2 Nouveau-né 16
II .2.1.3 Stade juvénile 16
II .2.1.5 Stade adulte 17
II .3.Les Menaces des tortues marines 17
II .3.1 Menaces Naturelles 17
II .3.2.1. L'érosion 17
II .3.1.2. La prédation naturelle 17
II .3.1.3. État Sanitaire des Populations de
Tortues Marines 18
II .3.2. Menaces D'origine Anthropique 18
II .3.2.1 Filets de pêche 18
II .3.2.2 La destruction des habitats de ponte et la
perturbation intentionnelle 19
II .3.2.4 La chasse et le braconnage 19
II .3.2.5 La Pollution 19
II .3.2.5.1 La Pollution au plastique 19
II .3.2.5.2 La pollution lumineuse 19
II .3.3.4 L'Echouage des Tortues Marines 20
II .3.3.4.1 Qu'est-ce qu'un
échouage ? 20
II .3.3.4.3 L'importance du suivi des
échouages pour la conservation des espèces 20
II .3.4.Mesures de Conservation pour les Tortues Marines
21
II .3.5 Convention RAMSAR sur la conservation des zones
humides dont le PND 21
Chapitre II. Présentation de la zone de
l'étude 23
I.1.1 zone d'étude 23
2022-2023 7
I.1.2. Les Ecosystèmes du PND et ses zones
périphériques 24
I.1.3. Caractéristiques physiques et ressources
du parc 27
I.1.3.1 Climat 27
I.1.3.2 Hydrologie 27
I.1.3.3 SOL 28
I.1.3.4 Géologie et géomorphologie
28
I .2 Environnement biologique 29
I.2.1. Végétation 29
I.2.2. Faune 30
I.2.2.c L'ichtyofaune 30
I.2.2.d L'herpétofaune 30
I.3. Environnement socio-économiques
31
La pêche Artisanal 31
La cueillette et l'artisanat 31
L'agriculture 31
L'élevage 32
Le commerce 32
CHAPITRE III MATERIELLES ET METHODES 33
CHAPITRE III MATERIELLES ET METHODES 34
I-1-Localisation des sites de suivi littorale
d'échouage des tortues marines 34
1-2-Matériels 35
I-2-1-Matériel de terrain 35
I-2-2-Matériel biologique 35
I-2-3-Matériel technique 35
I-2-4 Entretien avec les acteurs impliqués dans
la gestion du Parc 36
I-4-1-Entretien avec les pêcheurs 36
I-5-Observations et indentification des tortues
37
I-5-1-Identification 37
I-5-2-Traitement des données 38
CHAPITR IV RESULTAT ET DISCUTIONS 40
I-RESULTATS 40
II-Discutions 42
Conclusion 44
Références Bibliographiques 45
LISTE DES FIGURES
Figure 1: Localisation du Parc national du Diawling et sa
zone périphérique 25
Figure 2: Carte de situation des villages situés dans
la zone périphérique au PND 26
Figure 3 : Cumuls pluviométriques annuels source PND
2020 27
Figure 4: Les Especes des tortues marines source
(Éparses, 2015) 14
Figure 5 :Cycle de vie général des tortues
marines (modifié, d'après Lanyon et al., 1989 in FAO,
2009). 15
Figure 6:Localisation des sites d'échouages des
tortues marines entre pk28 et N'Diago 34
Figure 7 :Nombre d'échouages 40
Figure 8 :Répartition des espèces de tortues
échouées 41
Figure 9 :Réparation d'échouage des espaces par
apport aux saisons 41
2022-2023
Introduction
L'environnement mondial, y compris celui de la Mauritanie,
est menacé par diverses menaces. Il est de la responsabilité de
tous de le protéger, en commençant par éduquer les jeunes
et sensibiliser les populations locales. Notre travail porte sur le Suivie
Spatio-Temporels De L'échouage Des Tortues Marines Sur Le Littoral
Sud-Mauritanie, en particulier les espèces faciles à observer et
en grand danger de disparition. Il existe sept espèces de tortues
marines dans le monde, regroupées en deux grandes familles.
Le projet de Partenariat Régional pour la Conservation
de la zone Côtière et Marine en Afrique de l'Ouest (PRCM) finance
les missions de suivi des tortues marines échouées.
L'échouage des tortues marines sur la côte sud, face au Parc
National du Diawling, sont le résultat de plusieurs facteurs, notamment
la destruction des habitats marins et de ponte due à l'installation
aléatoire de camps de pêcheurs le long de la côte, le
changement des courants marins, la morphologie des dunes de nidification
après l'installation du port de N'Diago, la prédation, la
pollution des eaux par les déchets ménagers et chimiques, et la
mortalité accidentelle due à la pêche.
Les objectifs de notre étude étaient de
contribuer à la conservation de ces espèces sur le littoral sud
de la Mauritanie tout en sensibilisant la population locale à la gestion
durable des tortues marines. Nous avons également cherché
à acquérir des données de base sur l'échouage de
ces espèces marines, telles que les espèces
échouées, leur nombre, leur lieu d'échouage et leur
répartition, ainsi qu'à présenter les causes probables
d'échouage sur la côte sud mauritanienne
2022-2023 9
2022-2023 10
PREMIERE PARTIE : ETUDE
BIBLIOGRAPHIQUE
Chapitre I : BIOLOGIE ET ECOLOGIE
DES TORTUES, LE PROTOCOLE DE
NIDIFICATION, LES MENACES
2022-2023 11
PREMIERE PARTIE : ETUDE
BIBLIOGRAPHIQUE
Chapitre I: BIOLOGIE ET ECOLOGIE DES TORTUES, LE
PROTOCOLE DE NIDIFICATION, LES MENACES
II.1. Biologie et écologie des
tortues
Les tortues marines sont des espèces
emblématiques et fascinantes de la Méditerranée,
intégrées dans l'écosystème marin. En tant
qu'indicateurs fiables de la santé globale de l'environnement marin,
leur extinction devrait susciter de sérieuses préoccupations
quant à la santé des océans. Par conséquent, leur
préservation est essentielle pour maintenir la vitalité de
l'écosystème marin. (Orskov & Fraser, 1975)
II .1.2 Systématiques des Tortues
marines
Les chéloniens sont regroupés en grandes deux
familles, la famille de Cheloniidae et celle de
Dermochelyidae. La famille des Cheloniidae regroupe toutes
les tortues à écailles. Tandis que celle des Dermochelyidae
est composée d'une seule espèce, la Tortue luth. C'est
à partir du sous ordre des cryptodires que sont apparues les
tortues marines actuelles. Sept espèces de tortues peuplent les eaux
marines du monde, la Tortue verte (Chelonia mydas), la Tortue
olivâtre (Lepidochelys olivacea), la Tortue caouanne (Caretta
caretta), la Tortue à dos plat (Natator depressue), la
Tortue de kemp (Lepidochelys kempii) et la Tortue imbriquée
(Eretmochelys imbricata) et la Tortue luth (Dermochelys
coriacea).
D'après (Leschi et al. 2007), le groupe des
Chéloniens appartient au :
Règne : Animal
Embranchement : Chorodatas
Sous-embranchement : Vertébrés
Classe : Reptiles
Sous-classe : Anapsides
Ordre : Testudines (Chéloniens)
Sous-ordre : Pleurodires et cryptodires.
A l'exception de la Tortue à dos plat dont l'aire de
répartition se limite dans l'océan (Atlantique, Indien,
Pacifique) et la Tortue de kemp dont l'aire de répartition serait
limitée au
2022-2023 12
Nord de l'Afrique, toutes les autres espèces sont
susceptibles d'être rencontrées sur le littoral congolais.
II .1.2 .1 LA FAMILLE DES CHELONIIDAE
Cette famille est représentée par :
V' tortue verte (Chelonia mydas),
V' la tortue imbriquée (Eretmochelys
imbricata),
V' la tortue olivâtre (Lepidochelys olivacea),
V' la tortue de Kemp (Lepidochelys kempii),
V' la tortue caouanne (Caretta caretta), et
V' la tortue à dos plat (Natator depressa).
Ces six espèces ont une carapace osseuse recouverte
d'écailles cornées à laquelle sont
soudées la colonne vertébrale et les côtes.
Le nombre d'écailles sur la dossière et la tête, qui
diffère selon les espèces, est un critère
d'identification.(Éparses, 2015)
II .1.2 .2 LA FAMILLE DES DERMOCHELYIDAE
Représentée par une seule espèce :
V' le tortu luth (Dermochelys coriacea).
Cette espèce de tortue est largement répartie
jusqu'aux pôles et est considérée comme la plus
pélagique parmi les tortues marines, étant très bien
adaptée au milieu marin. Elle est présente dans la plupart des
océans du monde, y compris dans les eaux froides du Groenland et de
l'Alaska où elle peut supporter des températures d'eau aussi
basses que 5°C grâce à sa graisse et à
l'activité de ses muscles. (DIRECTION DES PARCS NATIONAUX, 2020)
II .1.3 Classification Linnéenne des Tortues
marines
Classification linnéenne des tortues marines (Bowen et
al., 1993 ; Pritchard & Mortimer, 1999)(Éparses, 2015)
? Règne : ANIMAL
? Embranchement : CHORDÉS
? Sous-embranchement : VERTÉBRÉS ? Classe :
REPTILE (SAUROPSIDÉS) ? Ordre : TESTUNIDÉS
Famille : CHELONIIDAE
> Genre Chelonia
- Espèce : Chelonia mydas
Tortue verte, tortue franche (fr), Green Turtle
(en)
> Genre Eretmochelys
- Espèce : Eretmochelys imbricata
Tortue imbriquée (fr), Hawksbill
(en)
> Genre Natator
- Espèce : Natator depressa
Tortue à dos plat (fr), Flatback (en)
> Genre Caretta
- Espèce : Caretta Caretta
Tortue caouanne (fr), Loggerhead (en)
> Genre Lepidochelys
- Espèce : Lepidochelys olivacea
Tortue olivâtre (fr), Olive Ridley
(en)
- Espèce : Lepidochelys kempii
Tortue de Kemp (fr), Kemp's Ridley (en)
Famille : DERMOCHELYIDAE
> Genre Dermochelys
- Espèce : Dermochelys coriacea à
Tortue luth (fr), Leatherback
(en)
2022-2023 13

Tortue verte (Chelonia mydas).
Tortue imbriquée (Eretmochelys imbricata).
Tortue caouanne (Caretta caretta).
Tortue olivâtre (Lepidochelys olivacea).
Tortue luth
(Dermochelys coriacea).
Figure 1: Les Especes des tortues marines source
(Éparses, 2015)
2022-2023 14
2022-2023 15
II .2.1 Cycle de Vie de Tortues Marines
Les tortues marines, comme les humains, connaissent des
moments de vie assez distincts durant leur croissance et leur vieillissement.
Elles vivent en moyenne 80 ans (avec un record de 150 ans pour l'une d'elle).
Au cours de leur vie, elles passent par différents stades, qui
conditionneront leurs comportements et leur façon de vivre(Addict,
2019).
La figure ci-contre illustre le cycle biologique des
tortues marines.
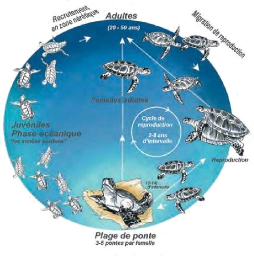
Figure 2 :Cycle de vie général des tortues
marines (modifié, d'après Lanyon et al., 1989
in FAO, 2009).
II .2.1.1 les pontes
Les tortues marines sont parfaitement adaptées
à leur environnement, elles conservent pourtant certaines
caractéristiques de leurs ancêtres terrestres, comme la
respiration pulmonaire.
La tortue femelle siffle de façon inquiétante
sur la plage la nuit .La femelle avancez suffisamment haut sur la plage pour
éviter que le nid ne soit redécouvert l' eau de haute mer
Lorsqu'elle trouve un endroit convenable , elle commence à grandir .en
deux temps :Au départ, elle crée une couche de surface avec ses
quatre membres .Et il se transforme en une cavité corporelle .Puis, avec
l' aide de ses deux membres ,postérieures, qui lui servent de "pelles,"
elle se crée un puits de ponte de 70 cm de profondeur .Elle
déposera 100 à 200 oeufs
2022-2023 16
qu'elle recouvrira de sable avant de repartir à la mer.
Une fois la ponte commencée, plus rien ne pourra arrêter la
tortue. Mais au moment où la tortue monte sur la plage, la
présence de branches mortes, de lumières excessives ou de bruits
anormaux, peuvent lui faire rebrousser chemin. Entre le moment où la
tortue monte sur la plage et le moment où la tortue retourne à la
mer, il peut se passer plus de 4 heures(L'ÉCOLE DES TORTUES MARINES,
2020).
II .2.1.2 Phase d'incubation
L'incubation des oeufs dans les nids de tortues de
mer dure 60 jours, bien que cette période puisse varier en
fonction de divers facteurs tels que la température. C'est à ce
moment-là que les petits sont prêts à quitter le sable et
à rejoindre directement la mer.
L'une des curiosités des tortues de mer est que
le sexe des tortues est déterminé par la
température d'incubation du nid. Si la température est
proche de 29,5 °C, un pourcentage similaire de femelles et de mâles
peut éclore. Si la température dépasse 29,5 °C, il y
aura un pourcentage plus élevé de femelles et si la
température est plus basse, il y aura un pourcentage plus
élevé de mâles(projet ecolo, 2019).
II .2.1.2 Nouveau-né
Après l'éclosion des oeufs, les nouveau -
nés, qui ne mesurent que quelques centimètres, remontent à
la surface de la plage .L' émergence se produit lorsque les gradients de
température du sable s'inversent, généralement en fin de
journée ou la nuit, limitant la prédation. Les nouveaux venus
cherchent l'horizon le plus clair pour les guider vers la mer, aidés par
la pente de la plage et surtout par les reflets de la lune sur l'eau. Les
petites tortues sont extrêmement vulnérables après avoir
quitté le nid et pendant le voyage vers la mer, tout comme les
prédateurs (oiseaux, crabes, chiens, rats, etc.). Lorsqu'ils atteignent
la mer , les survivants entament une période de nage
frénétique de plusieurs jours ( 3 à 6 selon les
espèces ) afin de s'éloigner de la côte et des courants
côtiers .(Éparses, 2015)
II .2.1.3 Stade juvénile
Les premiers jours en mer permettent l'éloignement du
littoral et de ses dangers : les nouveau-nés nagent sans discontinuer
pendant plusieurs jours. Après quoi, pour être moins fragile aux
attaques des prédateurs, elles doivent grandir et donc se concentrer sur
l'alimentation. Pour cela, malines, elles prennent le transport en commun des
océans : les courants. Le stade de tortue juvénile est le moins
documenté par les biologistes, assez mystérieux, ce que l'on sait
c'est qu'elles se cachent et se nourrissent, pour poursuivre leur
croissance(Addict, 2019).
2022-2023 17
II .2.1.5 Stade adulte
Selon les espèces, les tortues marines deviennent
matures sexuellement vers l'âge de 15-20 ans (parfois jusqu'à 30
ans !). Elles entament alors une migration vers les zones de reproduction,
où mâles et femelles se rencontrent près des côtes et
où les femelles entament leur saison de ponte. La femelle monte sur la
plage, creuse un trou et y dépose une centaine d'oeufs en moyenne
à chaque ponte (peut aller jusqu'à 250 oeufs en début de
saison). La zone de ponte sur la plage varie d'une espèce à une
autre : les tortues imbriquées et vertes pondent
préférentiellement sous, ou à proximité de la
végétation haute et arbustive de bord de plage tandis que la
tortue luth pond en milieu de plage dans le sable nu. Elles pondent
principalement la nuit pour éviter la chaleur et les prédateurs
et réalisent plusieurs pontes pendant la saison. Ces longs voyages entre
aire d'alimentation et aire de reproduction rythment la vie de la tortue
marine.(Kap Natirel, 2019)
II .3.Les Menaces des tortues marines
Malheureusement, les espèces tortues marines et leurs
habitats sont de plus en plus menacés dans la région par la
pêche illégale, la perturbation de femelles pondeuses et le
braconnage des oeufs. Les pressions anthropiques ne se limitent pas à la
terre ferme; les filets dérivants et les palangres utilisés par
les flottes artisanales et industrielles provoquent également une forte
mortalité chez les tortues marines parts(GRID-Arendal, 2020).
II .3.1 Menaces Naturelles
II .3.2.1. L'érosion
certaines plages présentent un risque d'érosion
plus élevé que d'autres, en fonction des courants marins
.(Éparses, 2015)
II .3.1.2. La prédation naturelle
Les tortues marines peuvent avoir plus de 150 oeufs par ponte
et plusieurs ponte par saison ; ce qui, en condition normale compense la forte
mortalité qui empêche la plupart des tortues d'atteindre la
maturité. Le subtil équilibre entre les tortues et leurs
prédateurs peut être modifié au détriment de la
survie des tortues lorsque de nouveaux prédateurs sont introduits ou si
des prédateurs naturels deviennent soudain plus nombreux à la
suite d'une intervention humaine(WWF, 2020).
2022-2023 18
II .3.1.3. État Sanitaire des Populations de
Tortues Marines
Différentes maladies parasitaires concernent les
tortues marines. La fibropapillomatose constitue l'une des plus importantes
maladies (voir figure 6).
La fibropapillomatose (FP) des tortues marines est une
affection caractérisée principalement par l'apparition de tumeurs
cutanées sur les parties molles et parfois sur la carapace de ces
tortues. La présence de ces tumeurs serait associée à un
agent viral de type Herpès, quoique son étiologie précise
reste incomplètement élucidée et fait encore l'objet de
nombreuses recherches. Son diagnostic clinique est relativement aisé ;
mais il y a peu de techniques de
laboratoire pour son diagnostic étiologique(Yaghouba
Kane, 2012).

Photo1:Source :
www.terresacree.org
II .3.2. Menaces D'origine Anthropique
II .3.2.1 Filets de pêche
Les Filets de pêche Qu'ils soient utilisés ou
rejetés, ils constituent une menace sérieuse pour les tortues
marines. Elles s'y coincent et n'arrivent plus à remonter à la
surface, et en manquant d'air elles meurent asphyxiées(Mahalo Voyage,
2020).
2022-2023 19
II .3.2.2 La destruction des habitats de ponte et la
perturbation intentionnelle
La destruction due notamment à l'urbanisation. Cela
rend les plages plus difficiles d'accès pour les tortues qui cherchent
à pondre, mais rend également l'accès à la mer plus
difficile pour les bébés qui viennent de naître(Mahalo
Voyage, 2020) .
L'urbanisation du littoral, le tourisme et la
fréquentation des lieux occupés par les tortues sont autant de
menaces pouvant perturber leur cycle de vie.
Le piétinement des plages de ponte par les baigneurs
et les pêcheurs à pieds entraîne un tassement du sable et le
rend plus compact, ce qui peut accroître les difficultés des
bébés tortues pour sortir du nid et remonter à la
surface.(Éparses, 2015)
II .3.2.4 La chasse et le braconnage
La chasse à la tortue marine est majoritairement
interdite, mais on continue de la braconner pour la consommer (viande, gras,
oeufs) et pour la transformer en produits finis : souvenirs empaillés
pour touristes, artisanat de luxe avec l'écaille de sa carapace, boisson
à base de pénis de tortue aux propriétés soi-disant
aphrodisiaques (Espèces en danger, 2020).
II .3.2.5 La Pollution
II .3.2.5.1 La Pollution au plastique
La pollution au plastique tue les tortues marines : elle
confond sacs plastiques et méduses et meurt étouffée. La
pollution chimique des océans (due aux activités maritimes,
agricoles ou industrielles) l'empoisonne et serait à l'origine d'une
maladie qui lui est propre : la fibropapillomatose(Espèces en danger,
2020).
II .3.2.5.2 La pollution lumineuse
La pollution lumineuse des sites de ponte représente
une menace directe pour les nouveau-nés de tortues marines qui
possèdent une sensibilité aiguë à la lumière
et utilisent principalement la lumière et d'autres signaux visuels
(couleur, forme) pour localiser la mer après l'émergence. La
lumière artificielle en bord de plage pourrait donc être source de
perturbation pour les tortues qui ont plus de chance de se faire
prédater. De plus, les femelles préférant en
général des plages non éclairées pour pondre,
peuvent se retrouver plus nombreuses sur ces plages et ainsi détruire
des nids creusés précédemment par manque de place. Elles
peuvent aussi être dérangées par une lumière mobile
au cours de la ponte et s'arrêter et retourner à la mer
(Éparses, 2015).
2022-2023 20
II .3.3.4 L'Echouage des Tortues Marines
II .3.3.4.1 Qu'est-ce qu'un échouage
?
Un tortue marine est dit échoué lorsqu'il se
trouve sur le rivage, mort ou vivant, mais incapable de retourner à son
habitat naturel par ses propres moyens (affaiblissement, blessures,
pathologies, etc.).
On distingue trois types d'échouages :
· L'échouage individuel, qui concerne un individu
isolé ;
· les échouages multiples, qui concernent un grand
nombre d'individus, pouvant appartenir à plusieurs espèces,
retrouvés échoués sur un intervalle de temps court
(quelques jours à quelques semaines) et localisés sur un secteur
géographique restreint ;
· l'échouage en masse, qui est un échouage
simultané de plusieurs cétacés appartenant à la
même espèce. Il concerne principalement les espèces
d'odontocètes grégaires.(CAR-SPAW-RAC, 2021)
II .3.3.4.2Quelles sont les principales causes
d'échouages ?
Il existe plusieurs raisons d' échouages, mais trois
grandes catégories peuvent être distinguées:
· Les causes naturelles : pathologies, prédation,
compétitions inter ou intra spécifiques, etc.
· Les causes anthropiques : les captures accidentelles
dans les engins de pêche, qui constituent la première cause
d'échouages dans de nombreuses régions du monde, les collisions
avec les navires, la pollution sonore ou chimique, l'ingestion de
matières
plastiques, etc.
· Les causes environnementales : le changement
climatique, les tempêtes, les toxines algales, les séismes,
etc.(CAR-SPAW-RAC, 2021)
II .3.3.4.3 L'importance du suivi des
échouages pour la conservation des espèces
Les échouages des tortues marines constituent la
principale source de données et de matériel biologique pour
l'étude de ces espèces et est un soutien essentiel à la
recherche scientifique et aux politiques publiques de conservation. Les
données et prélèvements collectés permettent en
effet de renforcer les connaissances sur la biologie et l'écologie des
espèces, mais aussi sur les menaces. Par exemple, des analyses
génétiques peuvent être réalisées sur les
prélèvements de peau, l'âge peut être
déterminé grâce stries de croissances sure les
différences pièces squelettiques , l'écologie alimentaire
par l'étude des contenus stomacaux, l'état de santé et les
causes de mortalité au travers des marques de captures, des signes de
2022-2023 21
maladies lors de l'examen des organes internes, ou la
présence de contaminants dans les échantillons
prélevés sur les différents organes.(CAR-SPAW-RAC,
2021)
II .3.4.Mesures de Conservation pour les Tortues
Marines
Les tortues marines sont des espèces migratrices, leur
protection nécessite de préserver de multiples habitats et
écosystèmes. Cette protection est donc une responsabilité
partagée de tous les pays côtiers.(Orskov & Fraser, 1975)
Ce qui exige la république islamique de Mauritanie Le
29 mai 1999, a signé le Mémorandum d'accord sur les Mesures de
Conservation pour les tortues marines de la Côte atlantique de l'afrique
de la CMS/Pnue, encore appelé «Mémorandum d'abidjan».
La Mauritanie est impliquée également dans le processus du
Programme régional de Conservation de la zone côtière et
marine en Afrique de l'ouest (PRCM). Le PRCM a préparé en 2002 un
Plan de conservation des tortues marines en Afrique de l'ouest , de la
Mauritanie à la Sierra Leone.(L. M. Hama et al. 2013)
II .3.5 Convention RAMSAR sur la conservation des zones
humides dont le PND
La convention RAMSAR protège les zones humides
d'intérêt mondial qui présentent des
caractéristiques écologiques exceptionnelles. Certains sites
RAMSAR sont des habitats notables pour les tortues marines comme le parc
national du diawling (PND) et le parc national du banc d'Arguin (PNBA).
(Éparses, 2015)
2022-2023 22
CHAPITRE II. PRÉSENTATION DE LA
ZONE DE L'ÉTUDE
2022-2023 23
Chapitre II. Présentation de la zone de
l'étude
I.1.1 zone d'étude
Le Parc National du Diawling est un établissement
public à caractère administratif créé par le
décret n° 91-005 du 14 janvier 1991. Le PND est une réserve
naturelle d'environ 16 000 hectares de superficie protégée,
située en amont et au nord-ouest du barrage de Diama, dans les terres
salées du Bas delta mauritanien, entre l'océan à l'ouest
et les rives du Sénégal à l'est (BARRY Mohamed El Habib,
2004).
Ses limites effectives s'inscrivent dans le
périmètre dont les limites géographiques sont :
V' En latitude : 16° 12' 30» à 16° 30'
N
V' En longitude : 16° 18' à 16° 26' W
Le PND a été créé à la
suite de la construction du barrage de Diama et des endiguements
nécessaires à son fonctionnement(OULD MOHAMEDOU, 1998)
Jusqu'aux années soixante, les zones humides du bas
delta du fleuve Sénégal étaient parmi les plus
étendues et les plus riches de l'Afrique de l'Ouest. Cependant, à
partir des années soixante-dix, les conditions climatiques se sont
détériorées et la construction des barrages de Diama et de
Manantali a considérablement modifié les
écosystèmes. Les populations locales, qui dépendaient de
l'exploitation des ressources naturelles, ont connu une crise. En 1991, le
gouvernement mauritanien a créé le Parc national du Diawling
(PND), un parc naturel de 16 000 hectares qui intègre les populations
locales en tant que partenaires de la gestion des activités. Le parc a
entrepris de restaurer les conditions "avant barrage" dans les
différents bassins en construisant de nouvelles digues et des ouvrages
pour une alimentation artificielle en eau douce à partir du barrage de
Diama. Depuis la création du parc, la végétation
caractéristique du bas delta a été restaurée et les
rendements de pêche ont augmenté dans les différents
bassins, qui sont des zones de reproduction et de frayère pour de
nombreuses espèces de poissons. Le parc est également un lieu de
rassemblement pour les oiseaux d'eau migrateurs et sédentaires, et le
retour d'espèces nidificatrices a été observé.
Administrativement, le PND est situé dans la commune de N'Diago, qui
abrite une trentaine de villages implantés sur les flancs de formations
dunaires en liaison avec les lentilles d'eau douce exploitables, dans la wilaya
du Trarza. Cette zone est appelée le bas delta mauritanien. Source :
UICN/BRAO 2007
2022-2023 24
I.1.2. Les Ecosystèmes du PND et ses zones
périphériques
Selon les travaux de (Soulé, 2010)La subdivision du
PND et de ses zones périphériques en
zones écologiques , basése essentiellement sur
les caractéristiques du milieu et les services
fournis par l'écosystème. Les zones suivantes
ont été retenues :
- les bassins : Diawling/Tichilit, Bell, Gambar et
N'Tiallakh.
- les lacs : N'Tok et N'Ter.
- les dunes : de Ziré, de Birette et les dunes
côtières.
- Aftout Es Saheli.
- lagune : Chat Tboul.
- les îles de M'Boyo et N'Thiong.
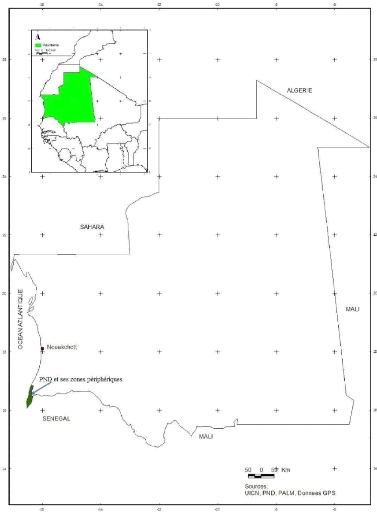
Figure 3: Localisation du Parc national du Diawling et
sa zone périphérique
2022-2023 25
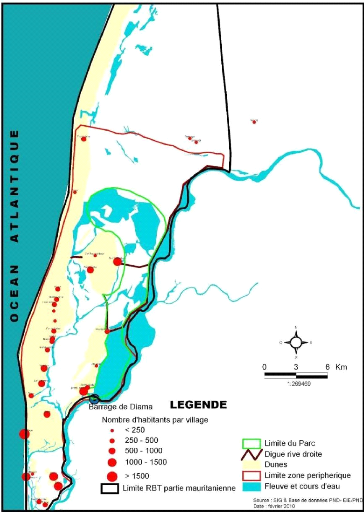
2022-2023 26
Figure 4: Carte de situation des villages situés
dans la zone périphérique au PND
2022-2023 27
I.1.3. Caractéristiques physiques et ressources du
parc
I.1.3.1 Climat
Le Bas-Delta est une région située dans la
ceinture du Sahel, s'étendant le long des bords sud-
ouest du désert du Sahara, de l'océan
Atlantique à la mer Rouge. Le Sahel est une région pastorale
située entre le désert et la zone où l'agriculture sous
des conditions pluvieuses est pratiquée. Cette dernière
nécessite un minimum annuel de 400 millimètres de
précipitations. En effet, le climat sahélo-saharien se
caractérise par trois saisons : la première est la saison des
pluies ou l'hivernage, qui dure de mi-juillet à mi-octobre, la
deuxième est la saison froide et sèche qui s'étend de
mi-octobre à mi-février, et la troisième est la saison
chaude et sèche qui s'étend de mi-février à
mi-juillet. Ainsi, la dynamique des eaux et des sols dans le Bas-Delta est
étroitement liée aux conditions climatiques. (Daniels, 1975;
Hamerlynck & Duvail, 2003)
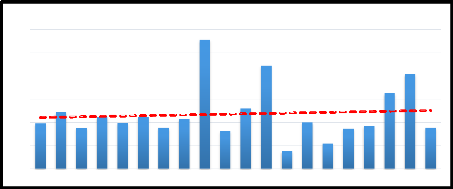
400
600
500
300
200
100
0
194,9
2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014
2015 2016 2017 2018 2019 2020 2021
245,1
222,8196 5223,1 214
175,5 , 176,6
Cumuls pluviometriques annuels au PND
556,1
163
260,5
444,5
76
199,5
172,7184,5
109,3
409,4
325
176,3
Figure 5 : Cumuls pluviométriques annuels source
PND 2020
I.1.3.2 Hydrologie
Plusieurs unités hydrologiques constituées de
bassins selon (FFEM, 2021) séparés par des
seuils naturels ou artificiels peuvent être
délimitées dans le bas delta. Notamment :
· Le Chat Tboul, d'une superficie de 6000 ha, est
alimenté en eau de crue par les mares de Tumbos sud et le marigot de
Hassi Baba.
· Le bassin du Ndiader, d'une superficie de 9000 ha, est
alimenté par l'ouvrage de l'Aftout Es-saheli est une zone
entièrement inondable, dont une partie est habituellement sous l'eau de
façon permanente.
· Le bassin du Diawling, couvre une superficie de 10000
ha dont 8000 appartiennent au Parc du Diawling. Il est alimenté par
l'ouvrage de Cheyal.
·
2022-2023 28
Le bassin du Bell, s'étend sur 4000 ha environ et fait
partie du parc national du Diawling, il est alimenté par l'ouvrage de
Lemer.
· Le bassin de Gambar, couvre 4500 ha et fait partie de
la retenue de Diama, il est en permanence sous l'eau. 5
· Le bassin du Ntiallakh, couvre environ 20000 ha,
l'inondation de ce bassin se fait essentiellement par l'aval à travers
le marigot du Ntiallakh en connexion avec le fleuve.
I.1.3.3 SOL
La zone du parc présente deux types de sols :
Les sols argileux limoneux au sud en bordure de
rivière, qui se répartissent en deux catégories :
V' halomorphes et hydromorphes des
formations fluviodeltaques (delta de rupture, petites levées
subcurrentles à actuels, petites dépressions...),
caractérisés par un régime hydrique humide plus avec une
inondation réduite mais un engorgement plus fréquent et une forte
influence des remontées capillaires dans les sols limoneuse à
limono-argileuse Ces remontées accélèrent la salinisation
des horizons superficiels.
Notamment au voisinage des parties inondées qui
entretiennent une nappe _phréatique élevée durant une
partie de la saison sèche et chaude.
V' Des sols fortement hydromorphes
à Gley et plus ou moins vertiques des zones
dépressionnaires marquées par une inondation prolongée et
par une sédimentation d'argiles gonflantes.
Les sols sablonneux dans la partie nord et sur
le littoral qui constitue la seule zone de pâturage pour le bétail
pendant la période de crue. Ce sont des sols minéraux bruts et
sols peu évolués des dépôts sableux éoliens
actuels (dunes actives), des bancs sableux du lit mineur, des bourrelets de
berge et des terrasses marines(Amadou Diam, 2021).
I.1.3.4 Géologie et
géomorphologie
Le Bas delta Mauritanien est une zone dynamique : entre les
fluctuations du niveau des eaux océaniques, les changements du cours et
de l'embouchure du fleuve, ses crues variables, etc. Situé en rive
droite du fleuve Sénégal, il s'est créé pendant la
dernière grande transgression du Nouakchottien (7000-4000 ans BP), il y
a 5000 ans. Ce bassin dit sénégalo-mauritanien est
constitué de terrains quaternaires récents que sont l'Ogolien
(20000-12000 ans BP), le Tchadien (formations lacustres holocènes :
9500-7000 ans BP), Nouakchottien (7000-4000 ans BP), Tafolien (4000-2000 ans
BP), et des dépôts fluviaux deltaïques. Ces dernières
se
2022-2023 29
sont déposées pendant la dernière
transgression dite dakarienne (à partir de 2000 ans BP) au cours de
laquelle le delta était recouvert de foret de mangroves (Daniels,
1975).
Géo morphologiquement deux paysages dans le bas delta
Eté décrit par Tricart 1961 : les dépôts alluviaux
de texture argileuse et limono-argileuse et les reliefs sablonneux le Parc du
Diawling avec sa zone périphérique est constitué de :
y' 3 massifs dunaires : dune de Ziré, dune de Birette,
cordon dunaire littoral ; y' 8 bassins naturels : Aftout, Chat Boul, N'Diader,
Diawling-Tichilitt, Bell, Gambar, N'Thiallakh et Gueyloubou.(Parc National du
Diawling (PND), 2018)
I .2 Environnement biologique
I.2.1. Végétation
153 espèces végétales ont
été recensées sur le territoire du bas delta du fleuve
Sénégal, dont 128 herbacées et 25 ligneuses. La richesse
floristique s'avère donc relativement importante pour des milieux
sahéliens, et témoigne de la diversité de la mosaïque
écologique conditionnée par la variété des
situations d'hydromorphie. Néanmoins la couverture
végétale a été fortement affectée par les
conditions climatiques, anthropiques et hydrologiques qui ont sévi dans
la zone(Baudu, 2004).
En effet, la diminution des précipitations, la
construction des barrages et l'endiguement qui assèchent (ou inondent
dans le cas du Gambar) en permanence la plaine inondable, ont provoqué
la disparition d'importantes surfaces boisées d'Acacia nilotica, suite
à la diminution des apports en eau douce. De nombreuses espèces
végétales jouent par ailleurs un rôle dans le
développement de l'artisanat et dans l'alimentation du bétail. Il
s'agit notamment de Sporobolus robustus, Sporobolus helvolus, Echinochloa
colona, Acacia nilotica, Acacia raddiana.... On note également la
présence d'espèces végétales envahissantes telles
que Typha australis, Salvinia molesta et Prosopis juliflora. Cette
dernière espèce, bien que très utile pour la fixation des
dunes de sable, envahit de manière sauvage les plaines
d'inondation.(Parc National du Diawling (PND), 2012)
Cette végétation est répartie dans
plusieurs unités physiographiques comprenant des plaines d'inondation,
des dunes continentales et côtières, des îles avec des
mangroves à Avicennia germinans et Rhizophora racemosa, des sebkhas,
etc.... La composition floristique de la zone étant largement
dépendante de la nature du sol et du degré d'inondation, on
distingue schématiquement 2 types de végétation :
2022-2023 30
y' La végétation de la zone inondable y' la
végétation des dunes
I.2.2. Faune
I.2.2.a Mammifères
On rencontre souvent les espèces suivantes : chacals,
phacochères, patas, chats sauvages,
ratels, lièvres et renards. (Ly & Zein, 2009)
I.2.2 .b Avifaune
Plus des 360 espèces ont été
observé, dans le PND en 2022 plus de 170 espèces d'oiseaux ont
été enregistrées dans la zone se répartissant ainsi
: 107 espèces d'oiseaux d'eau migrateurs afro-tropicaux et du
paléarctique occidental, 8 espèces de rapaces et 56
espèces de passereaux. Parmi ces dernières, il y a 20
espèces migratrices du paléarctique(Parc National du Diawling
(PND), 2012)
I.2.2.c L'ichtyofaune
Malgré l'importance économique et
écologique de ces peuplements, peu d'études et de
données sont disponible au niveau du PND.
quatre-vingt-quatorze (94) espèces été récence
réparties en soixante-cinq (65) genres et trente-neuf (39) familles ont
été recensées(Parc National du Diawling (PND), 2012).
La répartition écologique est la suivante :
y' Vingt-huit (28) espèces marines
y' Quarante et une (41) espèces saumâtres y'
Soixante-sept (67) espèces dulçaquicoles
I.2.2.d L'herpétofaune
6 espèces de tortues marines et terrestres
: Tortue verte (Chelonia mydas), Tortue caouanne (Caretta
caretta), Tortue olivâtre (Lepidochelys olivacea), Tortue
luth (Dermochelys coriacea), Tortue sillonnée (Geochelone
sulcata)(« Une biodiversité riche », 2021)
La répartition des nids de Chelonia mydas est
quelque peu différente, se répartissant de Mouily au sud (sur la
frange littorale du Parc national du Diawling) jusqu'à une vingtaine de
kilomètres au nord de Nouakchott (18°16'30.78» N,
16°02'11.94» W).(Marie, 2020)
· 1 population de 120 individus de
crocodile, Crocodylus suchus
· 17 espèces de lézards
· 15 espèces de serpents
· 5 espèces d'amphibiens
2022-2023 31
I.3. Environnement
socio-économiques
La population de la région est historiquement
d'origines géographiques diverses, mais aujourd'hui, trois
communautés linguistiques coexistent dans le delta : les Maures, les
Wolofs et les Peuls. Les maures sont la population majoritaire, dont les
harratines ou maures noirs, en constituent la majeure partie. Les wolofs
représentent le noyau le plus dur de la sédentarisation dans la
zone, peuplant les villages de la dune côtière, les villages de
N'diago, Birette et N'djemer. Traditionnellement, les wolofs sont
essentiellement des pêcheurs. Les peuls sont les communautés les
moins représentées dans le bas-delta car ils sont nomades par
nature. Ils nomadisent au gré du bétail et de ses besoins en eau
et pâturages(Nature Mauritanie, 2020).
La pêche Artisanal
Elle est surtout pratiquée par les Maures des tribus
Taghredient , ainsi que quelques rares Tandgha et Bouhebeyni .Certains Wolofs
pratiquent la pêche dans la réserve de Diama (Nature Mauritanie,
2020) .
La cueillette et l'artisanat
La cueillette a concerné principalement le ramassage du
Bolboschoenus maritimus. Cette plante est récoltée par une
vingtaine de femmes de Bouhajra appartenant aux coopératives
féminines. La période de ramassage se situe au 1er trimestre,
lorsque l'eau est toujours présente dans les bassins. Les femmes
récoltent en moyenne 15 kg par mois. Ce produit, communément
appelé Tare, est très demandé à la fois à
l'intérieur et à l'extérieur du PND. En janvier 2021, le
kg était vendu à 100 MRU(Parc National du Diawling (PND),
2021).
L'agriculture
L'agriculture est une activité qui s'est
amplifiée avec la migration des populations vers la
périphérie du parc et a connu un essor après la
construction du barrage. Pour autant elle a toujours été
présenté sur les bords du fleuve Sénégal et
permettaient l'exportation de grandes quantités de mils. Le
développement de l'agriculture dans les villages de la
périphérie du parc a été nécessaire
après la migration de près d'un tiers des habitants vers les
grands centres urbains. Ceci en raison de la diminution des ressources
halieutiques. La production est en partie pour la consommation interne au
village et une partie est destinée au commerce à Nouakchott et/ou
Rosso.(Daniels, 1975)
2022-2023 32
L'élevage
En l' absence de suivi de l'activité au PND , il est
difficile d' évaluer précisément son importance et ses
conséquences socio - économiques pour les habitants du parc
.Cependant, une enquête menée en juin 2021 a permis de mettre
à jour des données d' élevage datant de 2011. Selon les
ascenseurs du parc, le cheptel comptera 58 500 têtes d' ici 2021 , dont
16 000 bovins, 40 000 petits ruminants (dont 10 000 moutons et 30 000
chèvres), et 2 500 camelins13 .Sur la base de l' évolution du
cheptel entre 2009 et 2021, on peut prévoir que l' ensemble du cheptel
PND sera d' environ 157 000 têtes d' ici 2030(GIZ-UFZ-PND, 2021).
Le commerce
Le commerce est divisé en deux catégories qui
ont évolué au cours du temps, le commerce externe a vu son
importance croître au cours du temps et le commerce interne qui est
resté pratiquement stationnaire reste intéressant pour les
populations mais est très limité par l'enclavement et la
concurrence du marché.(Daniels, 1975)
2022-2023 33
CHAPITRE III
MATERIELLES ET
METHODES
CHAPITRE III MATERIELLES ET METHODES
2022-2023 34
I-1-Localisation des sites de suivi littorale
d'échouage des tortues marines
Dans le littoral du parc national du Diawling (PND) ; le
suivie littorale d'échouage des tortues marines se fait sur 16
transactions ;du PK28 jusqu'à (N'Diago) dans le sud-ouest du pays
à la frontière sénégalo-mauritanienne (figure
:6)
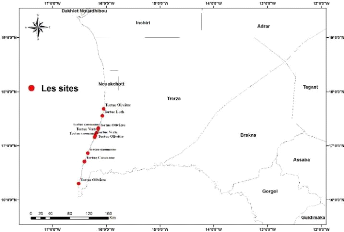
Figure 6:Localisation des sites d'échouages des tortues
marines entre pk28 et N'Diago
2022-2023 35
1-2-Matériels
Pour la réalisation de cette étude nous avons
utilisé trois types de matériel : Le matériel de terrain ;
le matériel biologique et le matériel technique
I-2-1-Matériel de terrain
Le matériel cité ci-dessous a été
utilisé pour la réalisation de cette étude sur le terrain
:
Des gants de latex ; des fiches pour la collecte des
données ; guide d'identification des tortues marines ; des marqueurs
« waterproof » ; Équipement de mesure (mètre ruban 2,5
m, pied à coulisse) et de pesée (balance, dynamomètre) ;
un appareil photo de marque Canon D7000 ; un GPS de marque Canon ; un bloc note
; des fiches d'identification.
I-2-2-Matériel biologique
La collection de tortues du Parc National du Diawling
était principalement constituée des cinq espèces de
tortues que l'on retrouve dans les différentes zones
côtières du parc. Il s'agit du Tortu luth (Dermochelys
coriacea), de la Tortue verte (Chelonia mydas), de la Tortue
olivâtre (Lepidochelys olivacea), de la Tortue caouanne
(Caretta caretta) et de la Tortue imbriquée (Eretmochelys
imbricata).
I-2-3-Matériel technique
Le matériel utilisé pour cette étude sur
les tortues marines comprenait divers éléments tels que des
clés d'identification pour différencier les différentes
espèces de tortues, des mémoires, des publications et des
articles écrits par d'autres chercheurs pour servir de
référence, ainsi que l'utilisation d'Internet et d'un ordinateur
de marque HP. La combinaison de ces différents outils a permis une
recherche approfondie et précise sur les tortues marines, en utilisant
une variété de sources et de méthodes pour obtenir des
informations fiables et pertinentes. L'utilisation de clés
d'identification a été particulièrement utile pour
différencier les cinq espèces de tortues présentes dans la
région d'étude, tandis que l'ordinateur et l'Internet ont permis
un accès rapide à une grande quantité de données et
d'informations à jour sur les tortues marines. Les mémoires,
publications et articles écrits par d'autres chercheurs ont
également été précieux pour élargir les
connaissances sur le sujet et pour comparer les résultats avec les
travaux antérieurs. En somme, cette étude a utilisé une
approche multidisciplinaire pour obtenir des résultats précis et
fiables sur les tortues marines de la région d'étude.
J-2-4 Entretien avec les acteurs impliqués dans la
gestion du Parc
Chaque mois, des enquêtes ont été
menées auprès des principaux acteurs travaillant pour le compte
du Parc National du Diawling (PND), notamment les responsables du parc tels que
les Conservateurs, le responsable du projet PRCM et le responsable de la
communication du PND, ainsi que les agents en charge du suivi littoral. Ces
enquêtes ont été mises en place pour recueillir des
informations sur l'état de santé et la population des tortues
marines dans la région, ainsi que pour évaluer
l'efficacité des mesures de protection et de conservation en place. Les
résultats de ces enquêtes ont été précieux
pour améliorer les stratégies de gestion et de conservation des
tortues marines dans le PND.
I-4-1-Entretien avec les pêcheurs
Les pêcheurs ont été identifiés
comme une source cruciale d'informations pour l'étude des tortues
marines dans la zone d'étude. En effet, ils peuvent fournir des
informations précises sur les tortues accidentellement prises dans les
filets, les tortues échouées sur les plages et les impacts des
hameçons de pêche sur les tortues marines. Pour collecter ces
informations, des entretiens ont été organisés avec les
pêcheurs locaux. Ces entretiens ont eu lieu tôt le matin sur la
plage, lorsque les pêcheurs revenaient de leur sortie en mer. Les
informations recueillies auprès des pêcheurs ont été
complétées par des observations directes et des relevés
sur les plages de ponte des tortues marines. L'ensemble de ces données
ont permis de mieux comprendre les menaces qui pèsent sur les
populations de tortues marines dans la zone d'étude et de proposer des
mesures de conservation adaptées.

Photos2 : Entretien avec les pêcheurs sur la plage
2022-2023 36
I-5-Observations et indentification des tortues
Les tortues marines possèdent des
caractéristiques spécifiques propres à chaque
espèce. Ces différences sont importantes pour les identifier
correctement. Les agents chargés du suivi littoral du parc utilisent les
noms vernaculaires pour identifier chaque espèce de tortue, puis les
clés d'identification pour donner les noms scientifiques. Au cours de
notre étude, nous avons identifié cinq espèces de tortues
sur le littoral du parc. La répartition des tortues
échouées n'est pas uniforme entre les espèces. Nous avons
donc pu nuancer nos observations en fonction de chaque espèce
rencontrée.

Figure3 : Observations et indentification des tortues
I-5-1-Identification
Elle commence par les traces laissées sur le sable par
les tortues et la nature da la carapace. Les traces sont parmi les
critères d'identification les plus importants (si l'échouage est
récent). Les tortues laissent sur le sable des profondes empreintes qui
permettent d'identifier l'espèce. La Tortue luth et la tortue
olivâtre avancent les quatre pattes en même temps, la trace est
dite symétrique ou de type simultané. Les tortues vertes,
imbriquée et caouanne avancent seulement deux pattes en même
temps. La trace est dite asymétrique ou de type alterné.
La nature de la carapace est différente pour chaque
espèce des deux familles des Chéloniens. A partir de ces
familles, on distingue deux types de carapace, la carapace lisse (sans
écailles) chez la tortue luth et la carapace à écailles
présente chez les Chelonidae.
2022-2023 37
I-5-2-Traitement des données
2022-2023 38
Après la collecte des données sur le terrain,
les données sont traitées en utilisant le logiciel Excel. Cette
étape permet d'identifier les espèces de tortues marines
rencontrées chaque mois au cours de 10 mois, de connaître les
transactions potentielles d'échouage des tortues marines, qui se sont
produites entre PK28 Sud de Nouakchott et PK128 (KHANTOUR). Les données
collectées permettent également de déterminer la saison et
le pic d'échouage des tortues marines, ainsi que la répartition
des espèces échouées sur le littoral du parc. Ces
données ont une grande valeur pour la Mauritanie, car elles permettent
de mieux comprendre la situation des tortues marines dans le pays et de prendre
les mesures nécessaires pour les protéger.
2022-2023 39
CHAPITR IV RESULTATS ET
DISCUTIONS
2022-2023 40
CHAPITR IV RESULTAT ET DISCUTIONS
I-RESULTATS
L'échouage des tortues marines est l'une des
principales causes de mortalité pour ces espèces en danger. Les
tortues marines peuvent s'échouer pour diverses raisons, notamment
à cause de la pollution des océans, de la destruction de leur
habitat naturel, des changements climatiques et des captures accidentelles dans
les filets de pêche. Lorsqu'une tortue marine s'échoue, elle est
souvent affaiblie et vulnérable, ce qui la rend susceptible de subir
d'autres blessures ou d'être attaquée par des prédateurs.
De plus, le temps passé sur le rivage peut également aggraver les
blessures ou les maladies préexistantes de la tortue. En raison de ces
facteurs, l'échouage des tortues marines est une menace sérieuse
pour la survie de ces espèces, qui ont besoin de notre protection pour
continuer à prospérer dans les océans du monde.
-10
40
60
50
30
20
10
0
10
26
46
25
Nombre d'échouages
8
3 4
1 2
12 10 10
1
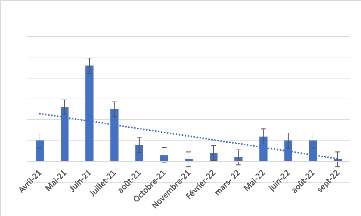
Figure 7 : l'effectif général des
échouages
La figure 7 représente l'effectif général
des échouages de tortues marines observés entre avril 2021 et
septembre 2022, soit la durée de notre étude. Ce graphique nous
montre deux pics importants d'échouages, le premier se situant entre
avril 2021 et août 2021, et le second entre mai 2022 et août
2022.
On peut observer que le premier pic est plus important que le
second, avec des échouages signalés presque tous les mois entre
avril et août 2021. En revanche, en dehors de ces périodes de
pics, les échouages de tortues marines sont beaucoup moins
fréquents.
Cette information est cruciale pour comprendre les saisons
d'échouages des tortues marines dans la zone étudiée et
pour mettre en place des mesures de conservation et de protection
appropriées.
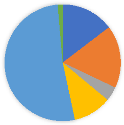
RÉPARTITION DES ESPÈCES DE TORTUES
ECHOUÉES
tortue caouanne
17%
tortue verte
52%
tortue Luth
4%
tortue olivâtre
11%
tortue imbrique
1%
tortue non identifiée
15%
2022-2023 41
Figure 8 : la répartition des cinq
espèces de tortues marines échouées
La figure 8 présente la répartition des cinq
espèces de tortues marines échouées dans la zone
étudiée, qui représentent près de 71% des
espèces de tortues marines dans le monde. Les tortues vertes sont les
plus représentées avec 52% des échouages, suivies par les
tortues caouannes (17%), les tortues non identifiées (15%), les tortues
olivâtres (11%) et les tortues imbriquées (1%). Cette
répartition permet de mieux comprendre la présence de ces
espèces dans la région étudiée et d'orienter les
mesures de conservation en fonction des espèces les plus
vulnérables.
Réparation d'échouage des espaces par
apport
aux saisons
|
100 80 60 40 20 0
|
|
|
HIVER PRINTEMPS ÉTÉ AUTOMNE
|
Figure 9 : la répartition des cinq
espèces de tortues marines échouées par apport
aux
saisons
La Figure 9 illustre le taux d'échouage des tortues
marines en fonction des saisons (Hiver, Printemps, Été, Automne)
au cours de la période d'étude. Nous pouvons observer deux pics
successifs importants, mais inégaux, durant la saison de Printemps et de
l'Été, avec des pourcentages moindres durant les deux autres
saisons (Hiver, Automne).
Cette figure nous permet de mieux comprendre la variation
saisonnière de l'échouage des tortues marines dans la zone
d'étude. Il est intéressant de noter que les saisons où le
taux d'échouage est le plus important correspondent également
à celles où les températures sont plus
élevées. Ces données peuvent être utiles pour la
mise en place de mesures de protection et de conservation de ces espèces
en Mauritanie.
II-Discutions
Plusieurs cadavres de tortues ont été
observés en divers points du littoral du Parc National du Diawling,
notamment vers Chat Boul qui se situe à environ 13,5 km au nord de
Mouily. La majorité de ces spécimens étaient des adultes
ou des juvéniles de Chelonia mydas, ou tortues vertes, qui
peuvent potentiellement être originaires du pont au sud du pays, selon
une étude menée par F. L. Hama en 2018. Les résultats de
notre propre étude montrent également que les tortues vertes
représentent la majorité des tortues échouées sur
le littoral sud de la Mauritanie, comme indiqué dans la Figure 8, avec
une proportion de 52% par rapport aux autres espèces
échouées. Les tortues imbriquées ne représentent
que 1% des cas d'échouage, le tortu luth à 4%, les tortues
caouanes à 17%, et les tortues non identifiées à 15%.

Photo 4 : Changement morphologique des dunes de nidification
des espèces de tortues
marines
2022-2023 42
2022-2023 43
Le risque d'échouage des tortues marines est plus
élevé pendant la période de ponte, qui atteint son maximum
pendant la saison des pluies et de chaleur (mai à octobre) (J. Dossa,
2019). Comme indiqué dans les figures 7 et 9, les pics d'échouage
de tortues marines sont généralement répartis en deux
saisons, le printemps et l'été, qui sont potentiellement des
saisons de nidification, en particulier chez les tortues vertes, ce qui
reflète une mortalité très élevée pour cette
espèce. Selon nos observations, la principale cause d'échouage de
la population de tortues marines dans la zone sud de la Mauritanie est les
changements brusques de la morphologie de la plage due à l'installation
aléatoire du port de N'Diago et le changement des courants d'eau, ce qui
empêche les tortues de retourner à leur lieu de naissance
après la ponte. Les photos 4 montrent ces changements. À partir
de la deuxième quinzaine de novembre, les montées pour la
nidification deviennent très rares et les éclosions commencent,
et le nombre d'échouages diminue.
Conclusion
2022-2023 44
Il est important de noter que la cause principale de
l'échouage des tortues marines dans la zone sud de la Mauritanie est
liée aux changements morphologiques de la plage suite à
l'installation aléatoire du port de N'Diago et au changement de courants
d'eaux, qui empêchent les tortues de revenir à la mer après
la ponte. Ces facteurs sont à l'origine d'une mortalité
importante chez les tortues marines, en particulier chez les espèces de
tortues vertes. Il est donc crucial de mettre en place des mesures de
protection et de conservation de ces espèces pour préserver leur
habitat naturel et minimiser leur taux d'échouage. Ces mesures
pourraient inclure des programmes de sensibilisation des communautés
locales et des pêcheurs, ainsi que des efforts de conservation pour
protéger les plages de nidification des tortues marines.
En conclusion, les résultats de cette étude
mettent en évidence l'importance des efforts de conservation des tortues
marines dans la zone sud de la Mauritanie, en particulier en ce qui concerne la
protection de leurs habitats de nidification et la mise en place de mesures
pour minimiser les impacts des activités humaines sur leur survie.
2022-2023 45
Références Bibliographiques
Addict, C.-R. (2019, juillet 21). Cycle de vie des tortues
marines. Récif et Plongée.
https://recifetplongee.com/cycle-de-vie-des-tortues-marines/
Amadou Diam. (2021). Etude de faisabilité pour la
restauration et la valorisation de la mangrove du bas delta du fleuve
Sénégal, rive droite - Mauritanie.
BARRY Mohamed El Habib. (2004). LE PARC NATIONAL DU DIAWLING
DANS LE PROCESSUS DE DEVELOPPEMENT DURABLE DU BAS DELTA MAURITANIEN DU FLEUVE
SENEGAL: CONFLITS D'USAGES ET D'ACTEURS DANS UN CONTEXTE DE CHANGEMENTS
ENVIRONNEMENTAUX ET SOCIOECONOMIQUES. Université d'Angers UFR
Sciences Département de Géographie.
Baudu, M. M. (2004). Vulnérabilite des eaux et des
sols de la rive droite du fleuve Sénegal en
Mauritanie : Étude en laboratoire du comportement de
deux pesticides. 159. CAR-SPAW-RAC. (2021). Observation d'un animal
échoué.
https://www.car-spaw-
rac.org/?Observation-d-un-animal-echoue-1257
Daniels, L. K. (1975). Rapid in-office and in-vivo
desensitization of an injection phobia
utilizing hypnosis. The American Journal of Clinical
Hypnosis, 18(3), 200?203.
https://doi.org/10.1080/00029157.1976.10403798
DIRECTION DES PARCS NATIONAUX. (2020).
1_protocole_de_suivi_des_tortues_marines-compresse.pdf.
Éparses, Î. (2015). Diagnostic, stratégie
opérationnelle et actions régionales Plan national d'actions en
faveur des tortues marines sur les territoires français du sud-ouest de
l'océan Indien 2015-2020 Mayotte, Réunion, Îles
Éparses. 1, 196.
Espèces en danger. (2020). L'environnement de la
tortue marine est fragilisé en mer comme sur terre--Espèces en
danger.
https://especes-en-danger.com/tortue-marine
2022-2023 46
FFEM. (2021). Guide des Oiseaux du Parc National du Diawling
et de sa Zone Périphérique.
GIZ-UFZ-PND. (2021). Évaluation des Services
Écosystémique du Parc National de Diawling--
Mauritanie.
www.biotope.fr
GRID-Arendal. (2020, juin 28). Suivez des tortues marines
dans leur recherche de pâturages. ArcGIS StoryMaps.
https://storymaps.arcgis.com/stories/8d2a94a1302d40b8b80f8eaa25fc2401
Hama, F. L. (2018). Sea turtle stranding events along the
Mauritanian coast.
Hama, L. M., Fretey, J., & Aksissou, M. (2013). Nouvelles
données sur le statut des Tortues marines en Mauritanie. 17.
Hamerlynck, O., & Duvail, S. (2003). La restauration du
delta du fleuve Sénégal en Mauritanie: Une application de
l'approche écosystémique. IUCN.
J. Dossa. (2019). Etat de conservation des tortues marines en
Afrique de l'Ouest.
Kap Natirel. (2019). Biologie tortues marines. Kap
Natirel.
https://kapnatirel.org/biologie-tortues-marines
L'ÉCOLE DES TORTUES MARINES. (2020). LE CYCLE
BIOLOGIQUE DES TORTUES MARINES.
Ly, O. K., & Zein, S. A. O. M. (2009). ??valuation
??conomique d'une zone humide : Le cas du Diawling, Mauritanie. UICN.
Mahalo Voyage. (2020, février 19). Sauver les tortues
de mer : Menaces et solutions. Mahalo Voyage.
https://www.mahalovoyage.com/sauver-les-tortues/
Marie, B. (2020). Jacques Fretey et Patrick Triplet.
244.
Nature Mauritanie. (2020). Situation des
écosystèmes de mangroves en Mauritanie Etat de la conservation et
de l'exploitation.
2022-2023 47
Orskov, E. R., & Fraser, C. (1975). The effects of processing
of barley-based supplements on rumen pH, rate of digestion of voluntary intake
of dried grass in sheep. The British Journal of Nutrition,
34(3), 493?500.
https://doi.org/10.1017/s0007114575000530
OULD MOHAMEDOU, A. (1998). Contribution a l'etude de
l'environnement du parc national du diawling (mauritanie) : Eaux, sols,
vegetation [These de doctorat, Nice].
https://www.theses.fr/1998NICE5160
Parc National du Diawling (PND). (2012). Plan
d'Aménagement et de Gestion du Parc National du Diawling 2013-2017
Partie I Etat des lieux en 2012.
Parc National du Diawling (PND). (2018). Plan
d'Aménagement et de Gestion du Parc National du Diawling
2018-2022.
Parc National du Diawling (PND). (2021). Rapport
d'activités Annuel-2021-du-PND-MEDD. 46.
projet ecolo. (2019). Reproduction des TORTUES de MER - Type,
Parade nuptiale et Accouplement !
projetecolo.com.
https://www.projetecolo.com/reproduction-des-tortues-de-mer-261.html
Soulé, A. O. (2010). Projet Articulation
Pauvreté et Environnement. 228.
Une biodiversité riche. (2021). Parc National du
Diawling (PND).
http://www.pnd.mr/une-biodiversite-riche/
WWF. (2020). Les tortues marines, des animaux menacés
| WWF France.
https://www.wwf.fr/especes-prioritaires/tortues-marines
Yaghouba Kane. (2012). (PDF) La fibropapillomatose des
tortues marines : Etat des lieux et perspectives.
https://www.researchgate.net/publication/257130417_La_fibropapillomatose_des_tort
ues_marines_Etat_des_lieux_et perspectives
Annex :
2022-2023 48
FICHE D'OBSERVATION D'ÉCHOUAGE DE TORTUES
MARINES




