|
|
ECOLE FONDAMENTALES REPUBLIQUE DU Paix -
Travail UNIVERSITE DE DOCTORALE Unité de Formation Chimie
Laboratoire de BP 24157
-
|
CAMEROUN - Patrie
|
REPUBLIC OF CAMEROON
Peace - Work -
Fatherland
THE UNIVERSITY OF DOUALA
POSTGRADUATE SCHOOL FOR
PURE AND APPLIED
SCIENCES
Postgraduate Training Unit for Chemistry and Biochemistry
---------
Laboratory of Biochemistry
PO Box 24157
Douala
|
|
|
DOUALA
DES SCIENCES ET APPLIQUEES
Doctorale de et Biochimie
Biochimie Douala
|
|
INFLUENCE DES CO-INFECTIONS A Plasmodium
ET
Salmonelles SUR LE PROFIL HEMATOLOGIQUE DES
ENFANTS DE
2-5 ANS A L'HOPITAL LAQUINTINIE DE
DOUALA DE JUIN A AOUT 2021
|
|
Mémoire présenté et soutenu en vue
de l'obtention du Diplôme de Master II en Biochimie
Option Biochimie Clinique
Par :
Axel MASRA
Matricule :
20S51834
Licencié en Biochimie
Sous la Direction de
:
Dr EBELLE ETAME Rebecca Madeleine
(Chargée de
Cours)
|
|
|
ANNEE ACADEMIQUE 2020-2021
|
|
|
DEDICACE

A mes Parents
MASRA DJIMOGIUNA
RUTH NOUBATA
Rédigé et présenté par
: Axel MASRA
ii
Rédigé et présenté par
: Axel MASRA
REMERCIEMENTS
Ce mémoire représente l'accomplissement d'un
travail réalisé avec la volonté du Dieu le Tout Puissant.
Au terme de ce travail, j'aimerais adresser mes sincères remerciements
:
Au Dr EBELLE ETAME Rebecca Madeleine,
Chargé de Cours au Département de Biochimie de
l'Université de Douala pour m'avoir accueilli dans son équipe de
recherche, je vous remercie pour votre confiance et votre aide dans la
recherche. Ce travail fut d'autant plus agréable grâce à
vos conseils, votre disponibilité, votre dévouement et vos
encouragements tout au long de sa réalisation. Je vous prierais de
trouver ici l'expression de ma très haute considération.
Au Pr NGONO NGANE Annie Rosalie, Chef du
Département de Biochimie de l'Université de Douala pour vos
encouragements et la formation que vous m'avez donné tout au long de ce
parcour academique.
Au feu Pr Raymond Simplice MOUOKEU, Maitre de
Conférences à l'Institut des Sciences Halieutiques de Douala pour
vos encouragements et orientation.
Au Dr Beack Sandrine ce travail fut d'autant
plus agréable grâce à vos conseils, votre
disponibilité, votre dévouement et vos encouragements tout au
long de sa réalisation. Je vous prierais de trouver ici l'expression de
ma très haute considération.
Au Pr Noel Emmanuel ASSOMBA Directeur de
l'Hôpital Laquintinie de Douala pour avoir permis que la structure
sanitaire dont il a la charge soit notre cadre d'étude.
Au Dr MEDI SOKE Christiane, Chef de
département de laboratoire de Biologie médicale de
l'Hôpital Laquintinie de Douala d'avoir accepté de superviser ce
travail au sein de son laboratoire
Au Dr EMBOLO ENYEGUE Elisée Libert,
Biologiste de laboratoire de biologie médicale de l'Hôpital
Laquintinie de Douala pour votre disponibilité, votre dévouement
et vos encouragements tout au long de sa réalisation.
Au Dr ABOUDI Elysée et Dr
Fabrice DONGHO pour votre contribution dans l'amélioration de
la qualité de ce travail.
A tous les parents ayant acceptés de
participer et qui ont bien voulu donner le sang de leurs enfants pour la
réalisation de ce travail, je vous remercie pour la confiance que vous
avez accordé à mon égard.
iii
Rédigé et présenté par
: Axel MASRA
A Tout les Enseignants du Département de
Biochimie de l'Université de Douala pour vos enseignements et
vos conseils qui ont été d'un apport scientifique
indéniable tout au long de ma formation universitaire : trouvez ici
l'expression de ma sincère considération.
A tout le personnel du laboratoire de biologie clinique de
l'Hôpital Laquintinie de Douala. Plus précisément ;
Major NGO NLEND, Mme NGAMENI Stéphanie, Mme NKOUEKEKAM Virginie,
Mme KANA, Mme SOPO Thérèse, M. ELOKA Pierre-Jean, Mr YEMELI
Romain, Mme Aichatou, Mme KENGNE Régine M. KOA Paulin, Mme TIMBA, M.
Pierre Jean pour votre formation rigoureuse qui m'a été
d'une aide précieuse.
A mon Oncle feu M. DIGUINA TORBAYE DILNGAR et
ma tante Mme YANKINGEM Célestine, mes frères et
soeurs SOBOUMTA Evelyn DJIDINGAR, MOTANGAR Serge, Tatiana MASRA
DJIMOGIUNA, Ulrich MASRA, NDIGYENOUBA MASRA Germain, pour votre
soutien morale et financier.
A mes ainé(e)s académiques Dr LIENOU, M.
TCHIENTCHEU Raphael, Mme HOPOGAP Laure, M. CIDJEU Cédric, Mme MASSOHE
Charité, pour vos conseils, votre disponibilité et
l'intérêt que vous avez manifesté pour
l'amélioration de ce travail.
A tous mes camarades de promotion : KENNE ZOKO
Géraldine, KEUTNOU KAMGA Lucie Cynthia, KEZEBOU NGUEPJIP Ornella Laurel,
LOTERI Osée, MESSI ALEMBE Séraphine Linda, NGNONBOUOWO Pierre
Loti, PASSAU DJOUK Manuella Elsie, SIMO FOTSO Ulrich Stéphane, TCHANA
Danielle Stéphane, ZANGUE FOMBIT Guyllia Rosta, NJIFENDJOU Mohammed
Moustapha pour les meilleurs moments que nous avons partagés
ensemble. J'espère qu'il en sera toujours ainsi.
A tous les stagiaires du laboratoire de biologie
clinique avec qui nous avons travaillé en équipe et
passé des moments inoubliables tout au long de ce travail. A ceux qui
sont encore au laboratoire, je vous souhaite le meilleur dans la fin de vos
études.
A tous mes ami(es) en particulier TEDEBAYE Eveline,
REOUNODJI Eloge, ALLATAROUM Tevin, AMEMENKEM JOKO Christelle, DJIMHOTOUM
Roland, BANGUE Alex pour le soutient et le réconfort qu'ils ont
toujours su m'apporté ceci en toute circonstance.
Je remercie tous ceux que je n'ai pas pu citer et qui ont
contribué de près ou de loin à l'élaboration de ce
travail.
iv
Rédigé et présenté par
: Axel MASRA
TABLE DE MATIÈRE
DEDICACE ii
REMERCIEMENTS iii
TABLE DE MATIÈRE v
LISTE DES TABLEAUX vii
LISTE DES FIGURES viii
LISTE D'ABREVIATIONS ix
RESUME x
ABSTRACT xi
INTRODUCTION 1
CHAPITRE I : REVUE DE LA LITTERATURE 3
I. GENERALITE SUR LE PALUDISME 4
I.1. Définitions 4
I.2 Epidémiologie 7
I.3. Le cycle biologique du parasite 7
I.4. Clinique : 9
I.5. TRAITEMENT 10
1. Accès au palustre simple 10
2. Accès palustre grave et compliqué 11
II. GENERALITES SUR LA FIEVRE TYPHOIDE 12
II.1. Définition 12
II.2 Situation épidémiologique 14
II.3 Pathogénie des Salmonelles 15
II.4. Clinique 18
II.5. Traitement 19
III. INFLUENCE DES CO-INFECTIONS A PLASMODIUM-SALMONELLES SUR
LES
PARAMETRES BIOCHIMIQUES ET HEMATOLOGIQUES 21
CHAPITRE II : MATERIEL ET METHODES 22
II.1. TYPE ET PERIODE D'ETUDE 23
II.2. CADRE D'ETUDE 23
II.3. CRITERES DE SELECTION 23
II.4. ECHANTILLONNAGE ET TAILLE DE L'ECHANTILLON 24
II.5. MATERIEL 24
II.6. PROCEDURES 25
II.6.1. Procédures administratives 25
II.6.1.1. Considérations éthiques 25
II.6.1.2. Recrutement des patients 25
II.6.1.3. Collecte des données 26
v
II.6.2. PHASE PRE-ANALYTIQUE 26
II.6.2.1. Prélèvement sanguin 26
II.6.2.2. Transport et conservation des échantillons 26
II.6.3. PHASE ANALYTIQUE 26
II.6.3.1 Etude de la prévalence des co-infections
Plasmodium-Salmonelles 26
1. Prévalence des infections à Plasmodium 26
2. Prévalence des infections à Salmonelle
27
II.6.3.2 Evaluation de l'effet des co-infections Plasmodium-Salmonelles
sur les paramètres
hématologiques 28
CHAPITRE III : RESULTATS ET DISCUSSION 30
I. RESULTATS 31
I.1 Caractéristiques de la population d'étude
31
I.2. Influence des statuts infectieux sur les paramètres
hématologiques 33
I.2.1 Influence des infections à Plasmodium sur
le profil hématologique 33
I.2.2. Influence des infections à Salmonelles le
profil hematologique 34
I.2.3. Influence des co-infections à Plasmodium
et Salmonelles sur le profil hématologique 35
II. DISCUSSION 37
CONCLUSION 40
RECOMMANDATIONS 41
PRESPECTIVE 42
REFERENCES 43
ANNEXES 48
Rédigé et présenté par
: Axel MASRA
vi
LISTE DES TABLEAUX
Tableau I : Numération
réalisée sur l'automate Pentra XRL 28
Tableau II: Distribution de la population
d'étude selon les caractéristiques sociodémographiques
31
Tableau III : Fréquence des patients
souffrant des co-infections à Plasmodium et
Salmonelles
par rapport aux patients reçus 32
Tableau IV: Influence de l'infection à
Plasmodium sur le profil hématologique 33
Tableau V: Influence de l'infection à
Salmonelles sur le profil hématologique 34
Tableau VI: Influence des co-infections
à Plasmodium et Salmonellessur le profil
hématologique
35
Rédigé et présenté par
: Axel MASRA
vii
LISTE DES FIGURES
Figure 1: aspect des différentes espèces de
Plasmodium au microscope 5
Figure 2: Anophèle femelle prenant son repas sanguin
6
Figure 3: Plasmodium vu au microscope 6
Figure 4: Cycle du Plasmodium 8
Figure 5 : Mécanisme de contamination des maladies du
péril fécales 13
Figure 6 : Phase d'adhésion et d'invasion des
salmonelles au niveau des cellules épithéliales, et
internalisation dans la membrane 15
Figure 7 : Localisation de la cellule M dans la plaque de
Peyer 16
Figure 8 : Phase de colonisation et d'infection du tissu
lymphoïde 17
Figure 9 : Répartition de la population en fonction des
caractéristiques sociodémographiques 31
Figure 10 : Fréquence des patients co-infectés
à Plasmodium et Salmonelles par rapport aux
patients reçus 32
Figure11: Influence de l'infection à Plasmodium
sur le profil hématologique 34
Figure 12 : Influence de l'infection à Salmonelles
sur le profil hématologique 35
Figure 13: Influence des co-infections à Plasmodium
et Salmonelles sur le profil hématologique,
36
Rédigé et présenté par
: Axel MASRA
viii
LISTE D'ABREVIATIONS
OMS : Organisation Mondiale de la
Santé
MINSANTE : Ministère de la
Santé
TDR : Test de Diagnostic Rapide
NFS : Numération de Formule
Sanguine
CTA : Combinaison Thérapeutique
à base d'Artémisinine
TA : Tension Artérielle
PVP : Pays en Voie de Développement
Ig A : Immunoglobuline A
VS : Vitesse de Sédimentation
G6PD : Glucose-6-Phosphate
Déshydrogénase
VIH : Virus Immunodéficience
Acquise
HLD : Hôpital Laquintinie de Douala
HRP2 : Histidine Rich Protein 2
CBC : Cell Blood Count
Rédigé et présenté par
: Axel MASRA
ix
Rédigé et présenté par
: Axel MASRA
RESUME
Le paludisme est une maladie parasitaire causée par
cinq (5) parasites protozoaires chez l'homme connu sous le nom de
Plasmodium falciparum, Plasmodium vivax, Plasmodium malaria, Plasmodium
ovale, Plasmodium knowlesi. Le Plasmodium est transmis à
l'homme par un moustique femelle « Anophèle ». Quant aux
Salmonelles, ils sont des bactéries à Gram
négatif qui causent la fièvre typhoïde. Les
co-infections peuvent influencer les paramètres hématologiques.
Dans le but de contribuer à une meilleure prise en charge des patients
souffrant du paludisme et de la fièvre typhoïde, nous nous sommes
proposé d'évaluer le taux du Plasmodium, le taux de
Salmonelles et les paramètres hématologiques chez les
patients de 2 à 5 ans venus en consultation à l'Hôpital
Laquintinie de Douala de Juin 2021 à Aout 2021.
Nous avons effectué une étude transversale
à viser analytique d'une durée de 3 mois allant de Juin 2021
à Aout 2021 sur 101 patients de 2 à 5 ans venus en consultation
à l'Hôpital Laquintinie de Douala. Des échantillons de sang
ont été prélevés chez ces patients après
obtention de consentement éclairé de leurs parents. Les
données démographiques ont été collectées
à l'aide des questionnaires. Les examens parasitaires et
sérologiques tels que le TDR, la goutte épaisse, test de
Widal-Felix et la NFS ont été réalisés.
Il ressort de cette étude que 26,7% de co-infections
Plasmodium/Salmonelles, 16,8% des infections à
Plasmodium, 19,8% des infections à Salmonelles et
36,6% des patients sains.
Dans la population des co-infectées on a observé
un grand nombre de personnes ayant un faible taux des plaquettes sanguines
(inferieur à 200), des globules rouges ( inferieur à 3,5), des
lymphocytes ( inferieur à 1,5). Part contre, dans cette meme population
on a noté un taux élevé de globules blancs (superieur
à 13,5) et des monocytes (superieur à 0,80). Par ailleurs, une
association positive et significative (P < 0,05) a été
observée entre les co-infections Plasmodium/Salmonelles et les
plaquettes sanguines, lymphocytes, ainsi que les globules rouges.
Dans les co-infections Plasmodium/Salmonelles
en général et dans notre cas en particulier l'anémie,
la lymphopénie et la thrombopénie ont été
considérablement en baisse par rapport à la valeur normale. Ils
sont les paramètres hématologiques de référence
pour l'orientation thérapeutique.
Mots clés : Co-infections, Salmonelles,
Plasmodium, Paramètres hématologiques.
x
Rédigé et présenté par
: Axel MASRA
ABSTRACT
Malaria is a parasitic disease caused by five (5) protozoan
parasites in humans known as Plasmodium falciparum, Plasmodium
vivax, Plasmodium malaria, Plasmodium ovale,
Plasmodium knowlesi. Plasmodium is transmitted to humans by a female
mosquito "Anopheles". As for Salmonella, they are Gram-negative bacteria that
cause typhoid fever. Co-infections can influence haematological parameters. .In
order to contribute to better management of patients suffering from malaria and
typhoid fever at the Laquintine Hospital in Douala we sought out to evaluate
the rate of Plasmodium/Salmonella co-infections,
Plasmodium Infection, the rate of Salmonella infection and the
impact of these infections on haematological parameters.
This was a cross-sectional analytic study carried out from
June 2021 to August 2021 on 101 patients aged 2 to 5 years who came for
consultation at Laquintinie Hospital in Douala. 3ml of venous blood was
collected from these patients after obtaining informed consent from their
parents. Demographic data was collected using questionnaires. Parasitic and
serological examinations such as RDT, thick blood smear, Widal-Felix test and
CBC were performed.
Results of this study showed 26.7% of co-infections with
Plasmodium and Salmonella, 16.8% of infections with
Plasmodium, 19.8% of infections with Salmonella and 36.6% of
witnesses. In the co-infected population, a large number of people had low
blood platelets (less than
200), red blood cells (less than 3.5), lymphocytes (less than
1.5) and 'others with a high ratewhite blood cells (greater than 13.5) and
monocytes (greater than 0.80). Furthermone, a positive and significant
association (P <0.05) was observed between co-infections with Plasmodium
and Salmonella and blood platelets, lymphocytes, as well as red
blood cells.
In Plasmodium and Salmonella co-infections in
general and in our case in particular anemia, lymphopenia and thrombocytopenia
were considerably reduced from the normal value. They are the reference
hematological parameters for therapeutic orientation.
Keyswords: Co-infections, Salmonella,
Plasmodium, Hematological parameters.
xi
Rédigé et présenté par
: Axel MASRA
INTRODUCTION
Le paludisme est une maladie tropicale, causé par des
parasites intracellulaires obligatoires qui vivent dans les érythrocytes
de l'hôte. Dans le monde selon le Rapport de l'Organisation Mondiale de
la Santé publié en 2020, plus de 229 millions de cas de paludisme
ont été recensé en 2019 donc 215 millions en Afrique, 67%
concernent les enfants de moins de 5 ans (OMS, 2020).
Au Cameroun, le paludisme est la première cause de
mortalité avec une incidence estimée à 24%
(MINSANTE, 2018). C'est la première cause de
mortalité des enfants de moins de cinq ans en Afrique, seule ou en
combinaison avec d'autres affections.
Il existe quatre parasites protozoaires unicellulaires du
genre Plasmodium qui causent le paludisme chez l'homme : Plasmodium
falciparium, P. ovale, P. malariae et P. vivax, P.
Knowlesi. La transmission du paludisme se fait principalement par la
piqûre d'un moustique anophèle femelle infecté se
nourrissant de sang et par la transfusion de sang infecté (Aubry
et al., 2020).
La fièvre typhoïde (fièvre
entérique) est une maladie bactérienne causée par des
bactéries Gram-négatives du genre Salmonella. Il existe
plusieurs espèces de Salmonella qui sont impliquées dans
la fièvre typhoïde chez l'homme : S. typhi, S.paratyphi A, S.
paratyphi B et S. paratyphi C. Ces sous-espèces sont
identifiées par des marqueurs sérologiques sur les
antigènes polysaccharidiques somatiques (O) et protéiques des
flagelles (H) (Sabbagh, 2013)
L'infection à Salmonella est acquise par la
voie orale. L'homme est le seul véritable réservoir de S.
typhi en tant que convalescent ou chronique et les porteurs servent
toujours de source ultime d'infection (Hald et al.,
2003). S. typhi peut survivre pendant plusieurs semaines
dans l'eau douce, dans l'eau salée, dans la glace, dans la
poussière, dans les eaux usées, sur les vêtements et peut
se multiplier dans les produits laitiers (Cook, 1996). Les
mouches et autres insectes peuvent transporter des agents infectieux des
fèces ou d'autres matériaux infectés vers les aliments et
les boissons (Alhassane et al., 2012). L'incidence
actuelle de la fièvre typhoïde au niveau mondial est de 11 à
20 millions de cas par an. L'issue de l'infection est mortelle dans 1 à
4 % des cas, ce qui correspond à 128 000 à 161 000
décès en 2018 (OMS, 2018). En l'absence de
traitement, le taux de mortalité est de 10 à 20 %. Chez l'enfant
de moins de 5 ans ce taux de mortalité est dix fois plus
élevé que chez les enfants de plus de 5 ans.
1
Le paludisme et la fièvre typhoïde sont des
maladies fébriles endémiques dont les signes et les
symptômes se chevauchent, notamment la fièvre, l'état de
confusion, la jaunisse, la diarrhée, les vomissements, les maux de
tête, etc. On a signalé des cas des co-infections par le paludisme
et la fièvre typhoïde (Gopinath et al.,
1995), et certaines souches bactériennes de Salmonella
ont été isolées à partir d'hémocultures
d'enfants atteints de paludisme (Prada et al., 1993).
Une association entre le paludisme et la fièvre typhoïde a
été décrite pour la première fois en 1862 en
Amérique du Nord sous la forme d'une entité appelée
fièvre typho-malaria (Smith, 1982). En Afrique,
Escherichia coli, Pseudomonas aeruginosa et les
espèces de Salmonella ont été impliquées
comme cause de septicémie dans les cas de paludisme compliqué
à falciparum (Bygbjerg et Lang, 1982).
Au vu de ce qui précède nous nous posons la
question de savoir quelle est la fréquence et le profil
hématologique des enfants infectés par le Plasmodium et
les Salmonelles à l'hôpital Laquintinie de Douala? De
cette question découlent des hypothèses selon lesquelles la
fréquence les co-infections à Plasmodium et
Salmonelles à l'Hôpital Laquintinie est plus
élevée chez les enfants, les co-infections à
Plasmodium et Salmonelles modifient les paramètres
hématologiques. Dans le but de contribuer à une meilleure prise
en charge des enfants co-infectés, nous nous sommes proposé
d'évaluer la parasitémie à travers l'examen de la goutte
épaisse, d'évaluer le sérodiagnostic de Widal-Felix et le
profil hématologique par la numération à formule sanguine
chez les enfants amenés en consultation à l'Hôpital
Laquintinie de Douala. Plus spécifiquement, il sera question :
? De déterminer la fréquence des co-infections
à Plasmodium et Salmonelles chez les enfants de 2
à 5 ans à l'Hôpital Laquintinie de Douala durant la
période allant de Juin à Aout 2021.
? De caractériser l'effet des co-infections à
Plasmodium et Salmonelles sur le profil
hématologique.
Rédigé et présenté par
: Axel MASRA
2
CHAPITRE I : REVUE DE LA LITTERATURE
3
Rédigé et présenté par
: Axel MASRA
I. GENERALITE SUR LE PALUDISME
I.1.
Définitions
L'Organisation Mondiale de Santé (OMS)
définie le paludisme comme étant une parasitose due à des
protozoaires du genre Plasmodium transmis par des moustiques femelles
du genre Anophele. Il réalise une maladie fébrile,
hémolysante, qui constitue un fléau mondial.
On recense cinq espèces de Plasmodium
(Stefani, 2011)
- Plasmodium falciparum est le plus
redoutable et le plus intensément implanté. Il est l'agent du
paludisme « des tropiques » celui qui tue. Il sévit toute
l'année dans les pays tropicaux où il subit cependant des
recrudescences saisonnières, mais il ne survient que dans la
période chaude et humide, dans les régions subtropicales. Son
incubation est de 7 à 12 jours. Il est responsable de la fièvre
tierce maligne, de l'accès pernicieux et, indirectement, de la
fièvre bilieuse hémoglobinique. La longévité de cet
hématozoaire est inférieure à un an. Il est rare, en fait,
de voir survenir un accès du à Plasmodium falciparum
plus de deux mois après le départ d'une zone
d'endémie.
- Plasmodium vivax : qui cause une
forme bénigne du paludisme ou « fièvre tierce » car
ayant une périodicité de recrudescence fébriles tous les
deux jours. Il sévit au Sud-Est d'Asie, en Amérique du sud et en
Océanie. Elle peut survenir plus de 5 ans après la contamination.
La parasitémie dépasse rarement les 2%. Les hématies
parasitées sont plus grandes que les hématies non
parasités et elles ont une forme déformée.
- Plasmodium ovale. Il sévit
en Afrique intertropicale et provoque une fièvre tierce bénigne
comme Plasmodium vivax, dont il est très proche avec lequel il
a été longtemps confondu. Son incubation peut être de 15
jours ou très longue, jusqu'à 4 ans. L'évolution du
paludisme due à cette espèce est bénigne, mais les
rechutes tardives (ou les incubations longues) sont possibles (5ans).
Schématiquement, on peut dire que Plasmodium ovale remplace
Plasmodium vivaxlà ou cette dernière espèce
n'existe pas (Afrique noire) et que l'évolution du paludisme due
à cette espèce est encore bénigne.
- Plasmodium malariae: sa
distribution géographique est clairsemée. Son incubation
est
plus longue, environ trois semaines. Il est responsable de la
fièvre quarte et, parfois de complications rénales.
4
Rédigé et présenté par
: Axel MASRA
Sa longévité est étendue : 3 ans au moins
et jusqu'à 20 ans.Même après un très long
délai, il peut réapparaître dans le sang, par exemple
après une splénectomie.
- Plasmodium Knowlesi : est un
parasite de singes, mais depuis quelques années il est
régulièrement responsable de cas humains en Asie. De diagnostic
difficile, il cause un paludisme potentiellement grave (Cox-Singh et
al., 2008)

Figure 1: aspect des différentes
espèces de Plasmodium au microscope
? Mode de transmission
- Agent vecteur : c'est un moustique du genre
Anopheles. Les espèces vectrices sont nombreuses et d'autant plus
redoutable qu'elles ont une affinité pour l'homme (espèces
anthropophiles), se nourrissent et se reposent dans les maisons (espèces
endophiles ou domiciliaires). Parmi ces moustiques, seule la femelle, qui est
hématophage, assure la transmission du paludisme. Elle ne pique que la
nuit et le soir.
La répartition des Anophèles à
travers le monde est beaucoup plus étendue que celle du paludisme. Si
les conditions sont favorables, la transmission s'y établirait de
nouveau.
5
Rédigé et présenté par
: Axel MASRA

Figure 2: Anophèle femelle prenant son
repas sanguin
(Source :
https://www.insectecran.com/maladie/paludisme-malaria/transmission)
D'autres formes de transmissions moins importantes mais
suffisantes pour être signalées existent notamment :
- Par transfusion du sang d'un donneur infesté à
un receveur sain. Les manifestations
cliniques ici surviennent assez rapidement car la phase
hépatique est shuntée !
- La transmission verticale par voie trans-placentaire d'une
mère impaludée vers son enfant. On parlera dans ce cas de
paludisme congénital.
- Les autres formes notamment par accident d'exposition au
sang (AES) ainsi que chez les toxicomanes sont exceptionnelles
(Petithory et Guidon, 2001)
? Morphologie du Plasmodium
Le Plasmodium, découvert par Laveran à
Constantine en 1880, est un protozoaire très petit (1 à 2 u selon
les formes); la coloration au May-Grünwald Giemsa montre qu'il est
constitué d'un cytoplasme bleu pâle entourant une vacuole
nutritive claire, et contenant un noyau rouge et du pigment brun doré ou
noir (hémozoïne).

Figure 3: Plasmodium vu au
microscope
(Timbine , 2009)
6
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
I.2 Epidémiologie
DANS LE MONDE : Le paludisme est un
véritable fléau mondial : les estimations du nombre des personnes
contaminées par an varient entre 229 millions avec un taux de
décès entre 409 000 à 600 000 dont 67% concernent les
enfants (OMS, 2019). C'est la première cause de
mortalité des enfants de moins de cinq ans en Afrique. Les femmes
enceintes dans les zones endémiques, sont aussi particulièrement
touchées par le paludisme car le placenta constitue une cible où
les parasites peuvent s'accumuler. Le paludisme est encore la maladie mondiale
la plus importante (priorité de premier rang pour l'OMS) tant par ses
ravages directs que par ses conséquences socio-économiques : une
improductivité aboutissant à la sous-alimentation et au
sous-développement).
Il est à noter que l'être humain est loin
d'être le seul hôte à subir le paludisme. Par exemple,
nombreux sont les oiseaux, en Europe et à travers le monde, qui sont
porteurs de ces parasites, notamment de Plasmodium relictum.
AU CAMEROUN : Le paludisme est la
première cause de morbidité avec une incidence
estiméeà 24% selon les données statistiques de 2018 du
Ministère de la Santé Publique (MINSANTE, 2018).
Cette maladie existe presque sur tout le territoire camerounais avec pour
gradient d'endémicité décroissant du sud au nord. On y
rencontre quatre espèces plasmodiales (Plasmodium falciparum,
Plasmodium vivax, Plasmodium malariae, Plasmodium ovale). Le
Plasmodium falciparumagent du paludisme pernicieux, est
l'espèce la plus représentée soit 85-95%.
I.3. Le cycle biologique du parasite
? Le cycle chez l'homme
Le cycle des Plasmodium chez l'Homme ou cycle
schizogonique commence par une phase pré-érythrocytaire
d'adaptation, totalement asymptomatique. Les parasites intracellulaires y
effectuent une multiplication végétative intense aboutissant
à des milliers de mérozoïtes. Ceux-ci passent dans la
circulation sanguine. Ils s'accolent à la paroi des hématies
7
Rédigé et présenté par
: Axel MASRA
avant de les pénétrer activement. Ils s'y
développent aux dépens de l'hémoglobine. Chaque
trophozoïte mature évolue vers une rosace qui libère,
après destruction de l'hématie, de 6 à 24 cellules-filles,
ou mérozoïtes, selon les espèces. Ces mérozoïtes
envahissent immédiatement des hématies indemnes, assurant la
continuité de l'infection (figure 4). Ce cycle
intra-érythrocytaire est particulièrement rapide, de 48 à
72 heures selon les espèces. Il est à l'origine de l'accès
palustre et de son signe le plus marquant, une fièvre intense
(Gazin, 2003).
Le cycle chez le moustique
Lors d'un repas sanguin sur un individu infecté,
l'anophèle femelle ingère des gamétocytes à
potentiel sexuel mâle ou femelle. Ceux-ci parviennent dans l'estomac du
moustique et se transforment en gamètes. Le gamète mâle
subit un processus d'ex-flagellation, et donne naissance à 8
gamètes mobiles ayant chacun une longévité de quelques
minutes, pendant lequel les gamètes femelles sont
fécondés. Il en résulte un zygote appelé
ookinète. Celui-ci s'implante sur la paroi stomacale en formant
l'oocyste. Cette brève phase diploïde s'achève par une
division méiotique et est suivie par plusieurs milliers de mitoses qui
conduisent au développement de sporozoïtes. L'éclatement de
l'oocyste libère ces éléments mobiles et haploïdes
dans l'hémolymphe. Il a été prouvé que les oocystes
extraient leurs nutriments de l'hémolymphe (MACK,
1979).
Les sporozoites gagnent préférentiellement les
glandes salivaires du moustique d'où ils pourront être
injectés avec la salive lors d'une piqûre infectante. Chez le
moustique, l'ensemble de ce cycle se déroule entre 10 et 40 jours,
suivant la température extérieure et les espèces en
cause (MERCK, 1899)

Figure 4: Cycle du Plasmodium (MERCK,
1899)
8
Rédigé et présenté par
: Axel MASRA
I.4. Clinique :
? Le paludisme de primo invasion
Il atteint un sujet neuf (enfant entre 4 mois et 4 ans,
européen ou récemment transplanté en zone d'endémie
palustre non soumis àla chimioprophylaxie).
- Incubation, elle dure 7 à 20 jours et elle est
cliniquement muette. - Invasion : elle est marquée par l'apparition
d'une fièvre continue.
Le tableau clinique est celui d'un embarras gastrique
fébrile : anorexie, douleurs abdominales, nausées, parfois
vomissements, diarrhée, associés à des
céphalées et myalgies. A l'examen, le foie surtout chez l'enfant
est parfois augmenté de volume, la rate est normale, les urines sont
rares, foncées et peuvent contenir des protéines.
Ce paludisme de primo invasion peut guérir
spontanément après plusieurs épisodes fébriles. Une
splénomégalie modérée apparaît dans ce cas,
signe tardif au cours de la primo invasion et élément de bon
diagnostic. S'il s'agit d'une invasion à Plasmodium falcifarum,
elle évolue parfois vers l'accès pernicieux secondaire
annoncé par la majorité des céphalées et
l'apparition des signes en céphalitiques. Accès palustre à
fièvre périodique.
Cette période comprend des accès thermiques
à rythme régulier et des signes d'accompagnement.
L'accès palustre n'est typique que dans les infections
à Plasmodium vivax, Plasmodium ovale et Plasmodium
malariae. Il peut faire suite à une primo invasion non
traitée. Mais dans de nombreux cas, il apparaît longtemps
après, alors que l'accès fébrile initial a
été oublié. Ces accès palustres sont
caractérisés par la succession de 3 phases et un rythme
particulier.
Précède de quelques prodromes toujours
identiques pour un même malade, l'accès intermittent frappe un
patient céphalalgique et nauséeux. Il dure une dizaine d'heures
avec successivement. :
Stade de frissons : Agité de violents
frissons, le malade se blottit sous ses couvertures; la température
s'élevé à 39°C ; la rate s'hypertrophie, la tension
artérielle (TA) baisse. Ce stade est de une heure environ ;
Stade de chaleur : La peau est sèche
et brûlante; la température atteint 40 - 41°C ; la rate
diminue de volume. Ce stade persiste 3 à 4 heures ;
9
Stade de sueurs : Le malade émet des
urines foncées. La température s'effondre brusquement, avec une
phase d'hypothermie; la T.A. remonte. Ce stade dure 2 à 4 heures. Il est
souvent suivi d'une période d'euphorie et d'une impression de «
libération », de bien-être.
Le rythme des accès est variable selon l'espèce
plasmodiale.
? Complications :
- Accès
pernicieux :
L'accès pernicieux constitue le grand drame du
paludisme. Il est encore appelé neuro-paludisme (cérébral
malaria des anglo-saxons) et réalise une encéphalite
fébrile aigue. Il est dû au tropisme cérébral de
Plasmodium falciparum (schizogonie dans les capillaires intra
cérébraux). L'accès pernicieux intervient à tout
âge, mais atteint surtout l'enfant de 4 mois à 4 ans.
- Evolution de l'accès pernicieux.
Non traité, l'accès pernicieux est fatal en deux
ou trois jours, correctement traité, la mortalité reste lourde
(20 à 30 %), mais la guérison se fera sans séquelle, sauf
parfois chez l'enfant (troubles neurologiques).
I.5. TRAITEMENT
1. Accès au palustre simple (Puepi ,
2009)
Comme dans la prise en charge des affections
bactériennes, l'association de plusieurs molécules antipaludiques
a été adoptée pour améliorer l'efficacité du
traitement, dans certains cas par synergie potentialisatrice, en rendant
improbable l'émergence de résistances. Ceci est à la base
de la recommandation des CTA par l'OMS pour éviter l'émergence du
paludisme multi résistant. Il s'agit de :
? Artémether 180mg+ Luméfantrine 1080mg
suspension 60ml (Coartem®) ;
|
R
Poids de l'enfant
|
Nombre de millilitres
|
|
1er Jour
|
2eme Jour
|
3eme Jour
|
|
5-9kg(6 à 11mois)
|
10ml
|
10ml
|
10ml
|
|
10-15kg(1 à 3ans)
|
20ml
|
20ml
|
20ml
|
10
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
V' Artésunate + Méfloquine
(Artequin®) ; I
V' Artésunate + Amodiaquine (Arsucam®)
|
Intervalle de poids
(Intervalle
d'âge
approximatif)
|
Présentation
|
1er jour de
traitement
|
2eme jour de
traitement
|
3eme jour de
traitement
|
|
=4,5kg à <9kg (2 à 11mois)
|
25mg/67,5mg Blister de 3cps
|
1 comprimé
|
1 comprimé
|
1 comprimé
|
|
=9kg à <18kg (1 à 5ans)
|
50mg/135mg Blister de 3cps
|
1 comprimé
|
1 comprimé
|
1 comprimé
|
|
=18kg à <36kg (6 à 13ans)
|
100mg/270mg Blister de 3cps
|
1 comprimé
|
1 comprimé
|
1 comprimé
|
|
=36kg (14ans plus)
|
100mg/270mg
Blister de 6cps
|
2 comprimés
|
2 comprimés
|
2 comprimés
|
V' Artésunate + Sulfadoxine-Pyriméthamine
(Artescape®)
2. Accès palustre grave et compliqué
(Sogoba, 2012)
Pour les cas de paludisme grave, le traitement se fait
principalement avec la quinine en
intraveineuse dans les structures
hospitalières sous surveillance stricte de l'agent de santé.
En effet, ce traitement peut entraîner de graves
troubles cardiaques potentiellement fatals. Un traitement à base
d'Artémether en Intra musculaire est envisageable
particulièrement chez l'enfant.
NB :
- B Tout cas de paludisme chez la femme enceinte doit
être considéré comme grave ou compliqué et doit
être traité comme tel.
- Les complications suites au paludisme grave doivent faire
l'objet d'une prise en charge immédiate et fonction de la
complication.
11
Rédigé et présenté par
: Axel MASRA
II. GENERALITES SUR LA FIEVRE
TYPHOIDE
II.1. Définition
Selon le Aubry et al., en 2020
depuis 2004, le genre Salmonella comporte trois espèces : Salmonella
enterica, Salmonella bongoriet Salmonella subterranea.
L'espèce principale est Salmonella enterica, elle-même
divisée en plusieurs dontsérovars :dublin, enteritidis,
infantis, paratyphi, typhi, typhimurium
Les salmonelloses recouvrent deux principaux types
d'infections : d'une part, la fièvre typhoïde et les fièvres
paratyphoïdes et d'autre part les salmonelloses non typhiques ou non
typhoïdiques.
La fièvre typhoïde est due à Salmonella
enteritica, Salmonella sérovar, Salmonella typhi. Elle est devenue
rare dans les pays industrialisés du fait des progrès de
l'hygiène et de l'amélioration des conditions d'approvisionnement
en eau potable. Les fièvres paratyphoïdes sont dues à S.
paratyphi A, B et C.
Les salmonelloses non typhiques, improprement dites mineurs,
sont responsables d'infections sporadiques ou épidémiques, le
plus souvent en raison de la contamination des aliments ou du portage
asymtomatique. Ce sont les bactéries le plus souvent mise en cause dans
les toxi-infections d'origine alimentaire.
Les salmonelles sont des entérobactéries, ce
sont des bacilles droits de 0,6 à 1 um de long sur 0, 3 à 1 um de
large à coloration de Gram négative
? Caractéristiques des
Salmonelles
Les salmonelles sont d'une manière
générale des hôtes pathogènes ou non du tube
digestif. Elles sont mobiles, grâce à la présence de
flagelles péritriches. Ce sont des bactéries non sporulées
qui se développent sur milieux ordinaires en
aéro-anaérobiose. Elles résistent en milieu hydrique et
survivent au froid et à la dessiccation, notamment en présence de
protéines. En revanche, elles ne résistent pas à la
chaleur (au-delà de 47°C) ou aux acides. Elles réduisent les
nitrates en nitrites grâce à la présence d'un nitrate
réductase, utilisent le glucose par voie fermentative, ont une catalase
positive et ont une réaction d'oxydase négative.
12
Rédigé et présenté par
: Axel MASRA
? Mode de contamination
La fièvre typhoïde est liée à la
consommation d'aliments ou d'eau contaminés par Salmonella
Typhi. La contamination se fait donc par voie orale. Il s'agit d'une
maladie strictement humaine, le réservoir est l'homme. Il existe des
porteurs sains qui représentent le plus gros réservoir. En effet,
ils engendrent des infections sans le savoir, puisqu'ils ne présentent
pas de symptômes. Ils sont des porteurs chroniques de la bactérie
et ont une élimination possible du germe dans leurs excréments
pendant plusieurs mois voire même plusieurs années. Toutefois les
malades symptomatiques restent une voie importante de transmission de la
bactérie.
La typhoïde est une maladie du péril fécal
ou oro-fecale. La transmission peut être directement interhumaine, par
contact avec une personne infectée. Les sujets sont infectieux avant
l'apparition des symptômes et jusqu'à une semaine après la
convalescence. Le plus fréquemment, la contamination se produit de
manière indirecte via l'ingestion d'aliments contaminés par
l'agent pathogène. Salmonella typhi contamine les fruits de mer
(coquillages notamment), les viandes de volaille mais surtout les fruits et
légumes crus. Ces aliments sont contaminés s'ils sont
manipulés par un individu porteur du bacille pathogène
(symptomatique ou asymptomatique) ou par contact avec de l'eau souillée.
La contamination est favorisée dans les lieux de repas de
collectivités si la préparation préalable est
réalisée par un porteur sain.
La fièvre typhoïde survient le plus souvent dans
les zones où l'hygiène est précaire. Dans ces
régions où les réseaux d'égouts sont peu ou pas
existants, et où les conditions d'hygiène de vie est
défavorable.

Evacuation des eaux usées
Approvisionnement d'eau
Selles humaines
Mains souillées
Alimentation
Ingestion
Figure 5 : Mécanisme de contamination des maladies
du péril fécales (Photo auteur)
13
Rédigé et présenté par
: Axel MASRA
Les facteurs de risques de la maladie sont l'hygiène
précaire, la pauvreté, et l'altération du p11 gastrique
(hypochlorhydrie gastrique). Le risque d'infection est accru en cas
d'immunodépression de l'individu ou de drépanocytose homozygote.
Ce risque est également augmenté en fonction du terrain
(diabète, âge...) et de la virulence de la souche.
La multiplication de la bactérie est facilitée
par un p11 gastrique élevé. L'infection peut également
être favorisée par une diminution de la motricité
intestinale (cette dernière permet à un inoculum plus faible
normalement non pathogène de devenir pathogène pour l'organisme).
La fièvre typhoïde peut être également due à
d'autres sérovars Paratyphi A, B, C mais elle est qualifiée dans
ce cas de fièvre paratyphoïde (les symptômes seront
similaires mais la fièvre paratyphoïde est moins grave.
II.2 Situation
épidémiologique
L'incidence actuelle de la fièvre
typhoïde au niveau mondial est de 11 à 20 millions de cas par an.
L'issue de l'infection est mortelle dans 1 à 4 % des cas, ce qui
correspond à 128 000 à 161 000 décès par an en 2018
(OMS, 2018).
Dans les pays en développement dont le Cameroun fait
partie, la fièvre typhoïde est toujours, un problème
important de santé publique. Dans ces pays, le taux de mortalité
reste très important car l'accès aux soins et à la
vaccination est difficile. Les enfants sont beaucoup plus touchés par la
typhoïde, préférentiellement entre 5 et 15 ans. L'incidence
annuelle chez les enfants est de 180 à 494 pour 100 000 habitants. Dans
pays d'endémie cependant, l'incidence de la maladie chez les enfants de
moins de 5 ans est supérieure ou égale à l'incidence de la
maladie chez les enfants de plus de 5 ans
Le taux de complications graves est plus important chez les
enfants. Les complications sont présentes dans 10% des cas,
particulièrement en l'absence de traitement ou si l'infection dure
depuis au moins 2 semaines
La mortalité est estimée entre 1 et 4 % chez
l'enfant de plus de 5 ans et chez l'adulte. En l'absence de traitement, le taux
de mortalité est de 10 à 20 %. Chez l'enfant de moins de 4 ans ce
taux de mortalité est dix fois plus élevé que chez les
enfants de plus de 4 ans.
14
II.3 Pathogénie des Salmonelles ?
Pathogénie des salmonelles
Une fois dans l'organisme les salmonelles colonisent le tube
digestif et se multiplient dans le caecum. Au niveau de la muqueuse, il existe
plusieurs mécanismes de défense de l'hôte : les
Immunoglobulines A sécrétoires (IgA), les
sécrétions biliaires, le mucus intestinal ou encore les
défensines (peptides antimicrobiens qui vont perméabiliser les
membranes bactériennes). Ces mécanismes essayent d'empêcher
l'entrée de la bactérie dans les cellules
épithéliales.
Le développement des salmonelles dans l'organisme se
déroule en trois étapes: la phase d'adhésion et
d'invasion, la phase de pénétration et la phase de
colonisation.
? Phase d'adhésion et d'invasion:
Cette phase d'adhésion et d'invasion a lieu dans la
lumière intestinale. Les salmonelles développent au contact de la
face apicale des cellules épithéliales intestinales, des
appendices appelés invasomes. Ces appendices produisent des
protéines provoquant une ondulation des cellules
épithéliales qui correspond à une
dégénérescence de leurs microvillosités et de leur
bordure en brosse. Cette étape se fait en anaérobie et
nécessite beaucoup de nutriments.

2
Sécrétion et pénétration dans la
membrane
3
Internalisation et envahissement de la membrane
Cellule épithéliale
1
Adhésion
Salmonella
Figure 6 : Phase d'adhésion et d'invasion des
salmonelles au niveau des cellules épithéliales, et
internalisation dans la membrane
(CHAPAND, 2015)
La bordure en brosse, précédemment
dégénérée, se reforme avec des remaniements de son
cytosquelette. Les salmonelles se retrouvent à l'intérieur de la
cellule dans de larges
15
Rédigé et présenté par
: Axel MASRA
vacuoles. Les cellules épithéliales deviennent
des cellules phagocytaires. En général, les salmonelles
interagissent plutôt avec les cellules M des plaques de Peyer (follicules
lymphoïdes, principal constituant du tissu lymphoïde digestif). Ces
plaques sont bordées par un épithélium constitué
des cellules M et d'entérocytes. Contrairement aux entérocytes
qui ont une bordure en brosse, les cellules M ont une bordure avec des courts
micro-replis. Ces cellules ont la capacité de capter les
antigènes dans des vésicules contenant des protéases, afin
par la suite de les détruire, pour ainsi assurer la protection de
l'organisme contre les agressions. Ces étapes n'ont pas lieu chez les
salmonelles car elles ne sont pas détruites.

Figure 7 : Localisation de la cellule M dans la plaque de
Peyer (CHAPAND, 2015)
L'entrée des salmonelles dans ces cellules M est
toujours rapidement suivie de la destruction des cellules M
Les salmonelles sont des bactéries capables de
parasiter la cellule-hôte au niveau intracellulaire. Il s'agit d'un
parasitisme facultatif.
? Phase de pénétration:
Après une période de multiplication qui dure
entre 12 et 24h, la plupart des cellules épithéliales contiennent
des salmonelles dans des vacuoles. Ces vacuoles sont dans les phagocytes de la
lamina propria et de la sous muqueuse. Il s'agit de la phase de
pénétration de l'épithélium.
L'organisme lutte contre cette propagation en envoyant des
phagocytes : des polynucléaires neutrophiles, éosinophiles ou des
monocytes/macrophages.
16
Rédigé et présenté par
: Axel MASRA
Cependant, au sein du phagocyte, les bactéries ne sont
pas tuées ni détruites. Elles vont persister et se
développer dans les phagocytes. Elles survivent au sein des macrophages
en réduisant l'acidité des phagosomes et en restant dans les
vacuoles qui les protègent de la phagocytose.
? Phase de colonisation et infection du tissu
lymphoïde:
Les bactéries infectent les tissus lymphoïdes via
la circulation lymphatique et se retrouvent dans les macrophages du foie, de la
moelle osseuse et de la rate en raison d'un tropisme pour ces organes. Les
germes s'y multiplient. Les bactéries se propagent alors dans
l'organisme par la voie sanguine. Cette propagation est responsable d'une
bactériémie (présence anormale de la bactérie dans
le sang) à l'origine des symptômes et qui peut engendrer par la
suite un sepsis (infection générale de l'organisme due à
la propagation de la bactérie par le sang). Les bactéries sont
retrouvées dans les hémocultures même lorsque les
symptômes digestifs ont disparu.

Figure 8 : Phase de colonisation et d'infection du
tissu lymphoïde
(CHAPAND, 2015)
Les bactéries colonisent également le rein, la
vésicule biliaire mais aussi les plaques de Peyer une fois encore en
passant par la bile. Une lyse des bactéries survient ce qui engendre la
libération de l'endotoxine. Cette endotoxine est à l'origine d'un
choc toxique. Ces endotoxines sont responsables de tous les symptômes
connus des salmonelles et plus particulièrement de S. Typhi.
17
Rédigé et présenté par
: Axel MASRA
II.4. Clinique
? Incubation
L'inoculum nécessaire pour provoquer une infection est
de l'ordre de 10 UFC par mL. Toutefois un inoculum faible peut provoquer des
symptômes si l'intestin de l'hôte ne se trouve pas dans des
conditions physiologiques (PH entre 6 et 8). L'incubation de la maladie est de
7 à 21 jours. La durée de l'incubation, la survenue et
l'importance des symptômes dépendent de la quantité
d'inoculum, de l'état de l'hôte (immunodépression ou
système immunitaire affaibli par une infection passée ou encore
présente dans l'organisme) et surtout de la virulence de la souche
entrant en contact avec l'organisme. Lors de l'incubation, chez certaines
personnes, une diarrhée fugace qualifiée d'épisode de
gastro-entérite est constatée 12 à 48h après
l'ingestion du germe.
? Symptômes
La maladie est décrite sous 3 phases «
septénaires », chaque phase dure environ une semaine : il y a la
phase d'invasion, la phase d'état et la phase d'évolution
spontanée (ou sous traitement) ou d'apparition de complications
endotoxiniques.
? Phase d'invasion
La phase d'invasion, ou premier septénaire, est
caractérisée par l'apparition progressive de fièvre. Cette
phase se traduit également par des céphalées intenses au
niveau frontal puis plus diffuses, des vertiges, des insomnies avec des
somnolences dans la journée, des épistaxis, une anorexie et une
constipation.
La fièvre apparait de manière progressive (sans
frisson), avec une augmentation de 0,5°C par jour, sans frisson,
jusqu'à atteindre 40°C à la fin de la phase. Le pouls n'est
pas accéléré, mais il est dissocié. En revanche,
les signes physiques sont moins notables. L'abdomen est sensible et la fosse
iliaque est gargouillant.
Un râle de bronchite au niveau pulmonaire et une
légère splénomégalie est présente, mais
aucun signe de souffrance viscérale n'est retrouvé. Au niveau
biologique, une leucopénie est présente et plus rarement une
thrombopénie. La Vitesse de Sédimentation (VS) et les
transaminases peuvent être élevées. Un tableau un peu moins
typique chez l'enfant peut survenir, avec des vomissements, une
hyperleucocytose et une évolution plus rapide.
18
Rédigé et présenté par
: Axel MASRA
? Phase d'état
La phase d'état, ou deuxième septénaire,
est plus symptomatique et plus facile à diagnostiquer.
Elle est caractérisée par une fièvre en
plateau à 40°C associée à des signes de souffrance
viscérale. L'état général est altéré
et le pouls reste non accéléré mais dissocié. Les
signes digestifs sont importants. Une diarrhée ocre, avec une odeur
fétide, et en « jus de melon » peut survenir. Cette
diarrhée est inconstante et peut être remplacée par une
constipation.
Un signe neurologique important et caractéristique de
cette phase est retrouvé : le tuphos. Il s'agit d'une obnubilation
diurne en alternance avec des phases de délire et d'insomnie nocturne.
Cette atteinte est caractérisée par une asthénie, une
prostration, une somnolence, et parfois un coma vigile (coma de stade 1, le
malade n'est pas totalement inconscient).
Des symptômes cutanéo-muqueux se traduisent par
des lèvres sèches et fuligineuses (recouvertes d'une sorte
d'enduit de couleur noire), et des tâches lenticulaires (macules de 2
à 4 mm de diamètre) non prurigineuses, fugaces, sur la partie
supérieure de l'abdomen, la base du thorax et le haut des cuisses. Plus
rarement, il est noté une « angine » de Duguet qui est une
ulcération superficielle, unilatérale et indolore du pilier
antérieur du voile du palais au niveau de l'amygdale.
Comme lors de la première phase, le pouls est
dissocié, l'abdomen est météorisé et sensible, la
fosse iliaque est toujours gargouillant. Une splénomégalie
franche est constatée et la rate est palpable. Parfois, une
hépatomégalie est également retrouvée.
? Phase d'évolution spontanée
L'évolution de la maladie, avec ou sans traitement,
peut-être différente.
II.5. Traitement
En France les fluoroquinolones sont utilisés en
première intention à la dose de 20 mg par
kilogramme et par jour pendant 7 à 14 jours et en
deuxième intention, les céphalosporines de
3ème génération sont utilisées, et plus
particulièrement la ceftriaxone à une dose de 60 mg par
kilogramme et par jour pendant 7 à 10 jours. Dans certains pays,
19
Rédigé et présenté par
: Axel MASRA
comme le Népal et le Vietnam, des antibiotiques
inconnus en France sont utilisés comme les gatifloxacines,
présentant de bons résultats pour traiter la fièvre
typhoïde.
Aux Etats-Unis, l'association de ceftriaxone et de
ciprofloxacine est souvent utilisée, notamment lorsqu'il s'agit d'une
souche résistante.
En Inde, la furazolidone, un nitrofurane, est également
utilisée, moins chère que la ciprofloxacine et beaucoup moins
chère que la ceftriaxone. Efficace dans 74% des cas
étudiés, ce médicament présent beaucoup d'effets
indésirables.
Dans les pays en voie de développement, le
chloramphénicol est toujours utilisé car il s'agit d'un
traitement ayant un prix réduit, et facilement disponible. La
guérison a lieu dans 90% des cas, mais un risque de rechute de 10%
existe. Cet antibiotique est utilisé à une dose de 2 à 3 g
par jour en 4 prises. Il ne permet toutefois pas d'éviter le portage
chronique, ce qui est un inconvénient majeur. Une surveillance
hématologique pendant la durée du traitement est
nécessaire car ce médicament présente un risque important
d'anémie nécessitant l'arrêt du traitement et plus rarement
d'aplasie médullaire éventuellement mortelle.
En cas d'inefficacité, l'ampicilline ou le
co-trimoxazole sont utilisées si les souches n'y sont pas
résistantes. Le traitement dure 7 à 10 jours après la
disparition de la fièvre. Les effets indésirables
hématologiques et cutanés sont fréquents et
représentent une raison de leur faible utilisation.
Le co-trimoxazole est contre-indiqué en cas d'allergies
aux sulfamides, de déficit en G6-PD ou chez la femme enceinte et le
nourrisson.
Chez l'enfant, sont utilisées en première
intention les céphalosporines de 3ème génération
car les fluoroquinololes sont contre-indiquées chez les patients de
moins de 15 ans. Elles peuvent avoir un effet sur le cartilage de
croissance.
Rédigé et présenté par
: Axel MASRA
20
III. INFLUENCE DES CO-INFECTIONS A
PLASMODIUM-SALMONELLES
SUR LES PARAMETRES BIOCHIMIQUES ET
HEMATOLOGIQUES
Le paludisme et la fièvre typhoïde sont les deux
principales maladies fébriles affectant les humains, en particulier en
Afrique subsaharienne (Simon-Oke et al., 2020). Elles
restent les maladies d'importance majeure pour la santé publique et la
cause de morbidité et de mortalité. Une association entre le
paludisme et la typhoïde a été décrite pour la
première fois en 1862 en Amérique Nord comme une entité
appelée fièvre typho-paludique (Smith, 1982).
Les deux maladies sont courantes dans de nombreux pays du monde
où existent de mauvaises habitudes sanitaires, la pauvreté et
l'ignorance. Les premières manifestations non spécifiques
comprennent de la fièvre, des maux de tête, des douleurs
abdominales et des vomissements. Malgré l'importance du paludisme et de
la fièvre typhoïde concomitants sous les tropiques, les
défis associés au diagnostic et implications pour la santé
publique n'ont pas été examinés de manière
exhaustive. Les critères de l'Organisation mondiale de la santé
(OMS) reconnaissent que certaines caractéristiques biochimiques et
hématologiques devraient augmenter la gravité du paludisme
(OMS, 2000).
Les coinfections à Plasmodium et
Salmonelle entrainent des altérations des paramètres
biochimiques comme l'augmentation du taux de créatinine, urée et
bilirubine totale et une diminution du taux d'albumine, glucose et
protéines totale(Kayode et al., 2011).
Les coinfections à Plasmodium et
Salmonelles ont des effets évidents sur les paramètres
hématologiques comme augmentation du nombre de leucocytes, lymphocytes
et des globules rouges (Simon-Oke et al., 2020).
Les données de la littérature suggèrent
que le paludisme grave peut favoriser les coinfections bactériennes qui
elles même compliquent le paludisme grave. Néanmoins le poids
respectif en termes de mortalité, de l'infection par P. falciparum
et des coinfections bactériennes est mal connu.
Rédigé et présenté par
: Axel MASRA
21
CHAPITRE II : MATERIEL ET METHODES
22
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
II.1. TYPE ET PERIODE D'ETUDE
Cette étude est faite selon deux approches :
quantitative et qualitative. Dans l'approche qualitative, les personnes
incluses dans l'étude répondront à un questionnaire nous
permettant de connaitre leurs statuts sociodémographiques, et leurs
expositions à certains facteurs de risques. Chaque participant avait
environ 15 minutes pour l'information, le consentement et le questionnaire, et
les consentants ont 5 à 10 minutes pour les
prélèvements.
Par contre dans l'approche quantitative les paramètres
sérologiques et hématologiques seront dosés et l'analyse
de ces données par des méthodes statistiques sera
réalisée.
Cette étude est de type prospectif à
visée analytique d'une durée de trois mois allant de Juin 2021
à Aout 2021
II.2. CADRE D'ETUDE
Le recrutement des patients a été
effectué respectivement dans les services de laboratoire central de
biologie clinique, dans les services de pédiatrie et de vaccination de
l'Hôpital Laquintinie de Douala. L'analyse biologique quant à elle
s'est effectuée dans le grand laboratoire de Biologie Clinique de
l'Hôpital Laquintinie de Douala. L'Hôpital est localisé au
Cameroun, dans la région du Littorale en plein coeur du quartier AKWA.
Il représente à ce jour un hôpital de
référence de deuxième catégorie dans la
sous-région Afrique Centrale et notamment dans la prise en charge
médicale. Il dispose d'une salle d'Hospitalisation bien
équipée lui permettant d'assurer à un patient une prise en
charge complète allant du diagnostic jusqu'à la
guérison.
II.3. CRITERES DE SELECTION
? Critères d'inclusion
Seuls les enfants de 2-5 ans, sans distinction de sexe
présentant les symptômes ou non du paludisme et de la
fièvre typhoïde venus en consultation ou pour les vaccinations
à l'Hôpital Laquintinie de Douala ont été inclus
dans cette étude.
? Critères de non exclusion
Les enfants atteints de VIH, les enfants
drépanocytaires, les enfants de plus de 5 ans et les enfants dont leurs
parents refusent de signer la fiche de consentement ne sont pas inclus dans
notre étude.
23
Rédigé et présenté par
: Axel MASRA
? Critère d'exclusion
Dans cette étude, les participants respectant les
critères d'inclusion mais n'ayant pas rempli correctement la fiche
d'enquête, dont le sérum était hémolysé, et
ceux dont les résultats d'analyse seraient incomplets ont
été exclus.
II.4. ECHANTILLONNAGE ET TAILLE DE
L'ECHANTILLON
Un échantillonnage aléatoire simple
c'est-à-dire que chaque membre de la population cible avait une chance
égale d'être inclus dans l'échantillon a été
effectué. L'échantillon a été constitué d'un
groupe des enfants atteints du paludisme, d'un groupe des enfants atteints de
la fièvre typhoïde, d'un groupe des enfants atteints du paludisme
et fièvre typhoïde et d'un groupe des enfants « sains »
présent au moment de l'étude. Le groupe des enfants « sains
» a servi de témoin pour l'étude.
Dans le cadre de ce travail, la taille de l'échantillon
a été définie par convenance. Ainsi un total de 101
enfants a été recruté.
II.5. MATERIEL
Fiche d'enquête
Une fiche d'enquête (Annexe III) a
été utilisée pour recueillir les données
sociodémographiques, des habitudes d'hygiène,
caractéristiques du logement du ménage ainsi que l'identification
des enfants du ménage et leur vaccination.
a. Matériel biologique
Du sang prélevé dans les tubes sec et EDTA.
b. Matériel de
prélèvement
Tubes secs et EDTA et portoirs pour tubes,
coton sec, alcool à 70°C et eau de javel, gants stériles,
garrot, aiguilles et corps vacutainer, compresses stériles, plateau
stérile, sac d'élimination des objets mous et boite de
sécurité pour des objets piquants tranchants.
c. Matériel d'analyse
Spectrophotomètre, centrifugeuse, tubes d'aliquotage.
Automate Pentra XRL (Annexe VIII), mélangeur,
microscope (Annexe VII), pipettes
24
Rédigé et présenté par
: Axel MASRA
d. Matériel de Conservation des
Réactifs
Réfrigérateur
e. Matériel de Protection et de
Décontamination des Consommables Souillés
Eau de javel, eau du robinet, gants en latex, blouse blanche
longues manches en coton, bac à embouts, papier hygiénique de
nettoyage.
II.6. PROCEDURES
II.6.1. Procédures administratives
II.6.1.1.
Considérations éthiques
Le protocole d'étude a été soumis et
approuvé par le comité d'éthique. Une autorisation
administrative a été délivrée conformément
à la loi en vigueur sous N° 2734CEI-UDo/05/2021/M (Annexe
V). Cette autorisation a par la suite été
présentée à la direction de l'hôpital Laquintinie
pour le recrutement des patients ou une autorisation de la recherche a
été accordée par le Directeur de l'hôpital
(Annexe IV).
La notice d'information (Annexe I) et le
consentement éclairé (Annexe II) ont
été élaborés conformément aux exigences du
comité d'éthique institutionnel de l'Université de Douala
et présentés à toutes les participantes avant leur
inclusion dans l'étude. Les participantes ont été
rassurées sur le strict respect de la confidentialité des
données recueillies et de la possibilité de retirer leur
consentement à tout moment sans que cela nuise à leur prise en
charge.
II.6.1.2. Recrutement des patients
Les participants été recrutés à
l'HLD de Juin 2021 à Aout 2021. Le recrutement s'est
déroulé en respectant les règles d'éthique
liées à la recherche sur l'Homme en vigueur au Cameroun.
A cet effet, pour le recrutement des patients souffrant du
paludisme, fièvre typhoïde et co-infections paludisme-fièvre
typhoïde s'est fait dans le laboratoire central ainsi que dans les
services de pédiatrie. Quant aux témoins, le recrutement s'est
fait dans les services des vaccinations de l'HLD. Un entretien de 10 à
15 minutes nous a permis d'informer les parents des enfants de l'objectif, la
méthodologie et les contraintes liés à l'étude
avant la prise du sang de leur enfant.
25
Rédigé et présenté par
: Axel MASRA
II.6.1.3. Collecte des données
Avant le prélèvement sanguin, les données
anthropométriques (poids, âge, taille), hygiéniques
(fréquence de lavage de mains, condition de vie) et cliniques
(symptômes, sous médication ou non) ont été
collectées à partir de la fiche
d'enquête.
II.6.2. PHASE PRE-ANALYTIQUE
II.6.2.1. Prélèvement sanguin
Avant le prélèvement les tubes ont
été préalablement étiquetés. Les
informations portées sur l'étiquette ont concerné le
numéro d'identification du patient et la date du jour de
prélèvement. Trois millilitres de sang ont été
prélevés par ponction veineuse dans des tubes secs pour l'examen
de Widal-Felix, dans des tubes EDTA pour la NFS et les flacons stériles
ont été remis aux parents des patients pour les selles pour la
coproculture.
Après prélèvement, les tubes ont
été retournés délicatement de façon à
éviter l'hémolyse et la formation des bulles d'air. Tous les
prélèvements ont été réalisés dans
les conditions d'asepsie.
II.6.2.2. Transport et conservation des
échantillons
Les tubes prélevés ont ensuite été
transportés au laboratoire à l'aide d'un bac
réservé à cet effet. Ils ont par la suite subit une
centrifugation à l'aide d'une centrifugeuse de marque VanGuard V6000
(Annexe VI).
II.6.3. PHASE ANALYTIQUE
II.6.3.1 Etude de la prévalence des
co-infections Plasmodium-Salmonelles
1. Prévalence des infections à Plasmodium
? Examen de TDR
Il est utilisé pour une détection qualitative
rapide de la HRP2 (protéine riche en histidine 2) du Plasmodium
falciparum dans le sang humain en tant qu'aide au diagnostic d'infection
du paludisme.
Principe : Le TDR utilisé est le
CareStartTM Malaria Pf (HRP2) Ag RDT qui
contient une membrane pré-revêtue d'un anticorps monoclonal en
ligne complète tout au long de la
bande de test. L'anticorps monoclonal est spécifique
à l'HRP2 du P. falciparum. Le tampon conjugué est
distribué avec des anticorps adsorbés dans des particules
d'or.
26
Rédigé et présenté par
: Axel MASRA
Procédure : Nettoyer la zone du doigt
avec un tampon d'alcool avant de piquer. A l'aide d'une lancette, percer la
zone du doigt nettoyée, essuyer la première goutte de sang avec
du coton et recueillir l'échantillon de sang (5ul) en utilisant un
dispositif de transfert */fourni dans le kit. Ajouter les 5ul sang
prélevés dans le puits « S », ensuite ajouter 2 gouttes
(60ul) de solution tampon dans le puits « A ». Attendre 20 minutes et
lire les résultats.
? Examen de la goutte épaisse
La goutte épaisse a été choisie comme
technique de référence pour la recherche de Plasmodium.
On utilise à cet effet la coloration de Giemsa qui est utilisée
entre autres, pour la coloration de protozoaires. Elle fait partie avec le
frottis sanguin des techniques de références pour diagnostiquer
le paludisme, c'est-à-dire mettre en évidence le Plasmodium
responsable du paludisme.
Principe : Lors de l'addition d'eau, les sels
(l'éosinate de méthylène et l'azur de
méthylène) se précipitent et se fixent
sélectivement sur les constituants cellulaires. Les noyaux étant
colorés de bleu à violet-noir et les hématies en
beige-rose.
Procédure : Après avoir
étiqueté une lame porte objet, une goutte de sang sera
déposée et étalée sur une lame préalablement
étiquetée. Puis la goutte de sang sera étalée
à l'aide d'un bouchon d'aiguille pour seringue par un mouvement en
spirale ou rotatoire. La lame sera enfin séchée à l'abri
de la poussière, des mouches et de la chaleur, puis recouverte de Giemsa
diluée au 1/10ème et examinée au microscope à
l'objectif 100X après 15 minutes (POIMT., 2008).
2. Prévalence des infections à
Salmonelle
? Sérodiagnostic Widal-Felix
Le sérodiagnostic de WIDAL et FELIX permet de
détecter la présence dans le sang d'anticorps dirigés
contre les constituants de Salmonella: Les anticorps anti-O
apparaissent vers le 7-8e jour, atteignent leur maximum vers le 14e jour,
restent ensuite en plateau jusqu'à la 4e semaine puis disparaissent
rapidement. Les anticorps anti-H apparaissent vers le 10e jour, montent
rapidement pour atteindre un maximum de 1/800e à 1/1600e vers le 14e
jour, restent en plateau jusqu'à la 4e semaine et diminuent ensuite.
Mais à l'inverse des anticorps
27
Rédigé et présenté par
: Axel MASRA
anti O, ils ne disparaissent pas complètement. Ils
persistent toute la vie à un taux de l'ordre de 1/200e.
II.6.3.2 Evaluation de l'effet des co-infections
Plasmodium-Salmonelles sur
les paramètres
hématologiques
? Numération de Formule Sanguine
Cet examen de sang permet de renseigner les personnes sur leur
état de santé. Les renseignements obtenus concernent les volumes
de cellules érythrocytes et des lymphocytes.
? Valeurs normales de l'hémogramme chez les
enfants Tableau I : Numération réalisée sur
l'automate Pentra XRL
|
Paramètres
|
Valeurs
|
|
Globules rouges
|
3,50 - 5,50
|
|
Hémoglobines
|
12,00 - 14,00
|
|
Hématocrite
|
36 - 44
|
|
Volume Globulaire Moyen
|
73 - 89
|
|
Teneur Globulaire Moyenne en Hémoglobine
|
24 - 30
|
|
Concentration Corpusculaire Moyenneen Hémoglobine
|
32 - 36
|
|
Plaquettes sanguines
|
200 - 400
|
|
Globules blancs
|
4,50 - 13,50
|
|
Neutrophiles
|
1,80 - 8,00
|
|
Lymphocytes
|
1,50 - 6,50
|
|
Monocytes
|
0,00 - 0,80
|
|
Eosinophile
|
0,00 - 0,65
|
|
Basophile
|
0,00 - 0,20
|
? Procédure
Le comptage et l'analyse des échantillons sanguins sont
effectués rapidement après la collecte à l'aide de
l'hématimètre Pentra XRL (Annexe VIII).
Après avoir enregistré les données du
28
patient, secouez doucement le tube EDTA pour bien
homogénéisé l'échantillon de sang, puis
présentez le tube d'échantillon à la sonde (gardez la
sonde au fond du tube). Appuyez sur la touche Run. Les résultats seront
disponibles après l'analyse. Les résultats des tests et les
histogrammes de WBC, de RBC et de PLT seront affichés à l'analyse
des cellules sanguines après comptage et analyse.
? Analyses statistiques
Les résultats issus des fiches d'enquêtes et
analyses de laboratoire ont été saisis dans le logiciel Excel
2016 et traités avec le logiciel SPSS version 22. Pour évaluer
l'effet des co-infections Plasmodium-Salmonelles sur les
paramètres hématologiques, nous avons
procédé à l'analyse des variances (ANOVA). Les
différences entre les moyennes des différents paramètres
hématologiques dans les quatre groupes de la population d'étude
ont été calculées et nous les avons comparés
à l'aide du test de Pearson Square (test de chi 2) au seuil de
signification 0,05.
Rédigé et présenté par
: Axel MASRA
29
CHAPITRE III : RESULTATS ET DISCUSSION
30
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
I. RESULTATS
I.1 Caractéristiques de la population
d'étude
Cette étude a porté sur une population
constituée de 101 patients volontaires des deux sexes. Cette population
a été subdivisée en quatre groupes : patients
infectés au Plasmodium, les patients infectés de
Salmonelles, les patients co-infectés de Plasmodium et
Salmonelles et les patients témoins.
I.1.1 Répartition de la population d'étude
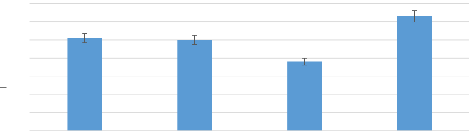
en fonction des caractéristiques sociodémographiques
L'analyse des données montre une fréquence de
(50,5%) chez les enfants de sexe feminin contre (49,5%) chez les enfants de
sexe masculin.De plus on observe une forte fréquence de (62,4%) chez les
enfants vivant dans les zones urbaines que les enfants vivant dans les zones
rurales (37,6%).
Tableau II: Distribution de la population
d'étude selon les caractéristiques sociodémographiques
|
Variables
|
Groupes
|
Fréquence
|
Pourcentage
|
|
Féminin
|
51
|
50,5%
|
|
Sexe
|
|
|
|
|
Masculin
|
50
|
49,5%
|
|
Rurale
|
38
|
37,6%
|
|
Zone
|
|
|
|
|
Urbaine
|
63
|
62,4%
|
Feminin Masculin Rurale Urbaine
Caractères sociodémographiques
70
60
50
Frequence
40
30
20
10
0
63
50
38
51
Figure 9 : Répartition de la population
en fonction des caractéristiques sociodémographiques
31
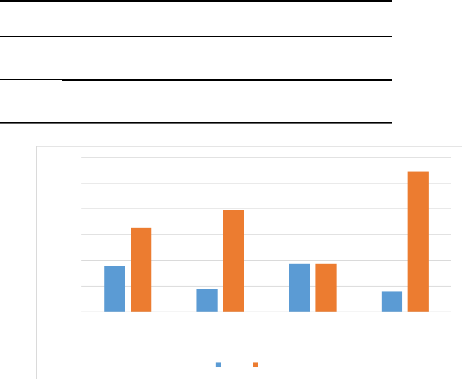
I.1..3 Fréquence des co-infectés par
rapport aux patients reçus
Nous remarquons dans le tableau III que le sexe le plus
touché est le sexe féminin avec 18 patients soit une
prévalence de 17,82% alors que chez le sexe masculin nous avons un
effectif de 9 patients avec une prévalence de 8,91%. L'effectif total de
patients sains est de 77 soit 76,23% reparti comme suit, 33 (32,67%) chez les
filles et 40 (39,60%) chez les garçons. La zone la plus touchée
est la rurale avec 19 soit une prévalence de 18,81 contre 8 patients
soit une prévalence de 7,92% dans la zone urbaine. La prévalence
des co-infections à Plasmodium et Salmonelles dans
notre population d'étude est de 26,73%. Les deux groupes étaient
statistiquement comparables (p-value < 0,05).
Tableau III : Fréquence des patients
souffrant des co-infections à Plasmodium et Salmonelles
par rapport aux patients reçus
|
Variable
|
|
Positif (%)
|
Négatif (%)
|
X2
|
P Valeur
|
|
Féminin
|
18(17,82%)
|
33(32,67%)
|
|
|
|
Sexe
|
|
|
|
3,633
|
0,0567
|
|
Masculin
|
9(8,91%)
|
40(39,60%)
|
|
|
|
Rurale
|
19(18,81%)
|
19(18,81%)
|
|
|
|
Zone
|
|
|
|
16.84
|
< 0.0001***
|
|
Urbaine
|
8(7,92%)
|
55(54,45%)
|
|
|
Feminin Masculin Rurale Urbaine
Groupes
Positif Negatif
60
50
40
Fréquence(%)
30
20
10
0
18,81
18,81
7,92
54,45
17,82
32,67
39,6
8,91
Figure 10 : Fréquence des patients
co-infectés à Plasmodium et Salmonelles par
rapport aux
patients reçus
32
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
I.2. Influence des statuts infectieux sur les
paramètres hématologiques
I.2.1 Influence des infections à Plasmodium
sur le profil hématologique
Nous remarquons dans cette partie que le taux de globules rouges,
d'hémoglobines et d'hématocrites ont considérablement
diminuée avec une prévalence de 82,35%
Tableau IV: Influence de l'infection à
Plasmodium sur le profil hématologique
|
Paramètres
|
Inferieur de la
|
Normale
|
Supérieur de la
|
|
hématologiques
|
normale
|
|
normale
|
|
GR
|
14 (82,35%)
|
3(17,64%)
|
0(0%)
|
|
HGB
|
14(82,35%)
|
3(17,64%)
|
0(0%)
|
|
HT
|
14(82,35%)
|
3(17,64%)
|
0(0%)
|
|
VGM
|
4(23,52%)
|
13(76,47%)
|
0(0%)
|
|
TGMH
|
3(17,64%)
|
14(82,35%)
|
0(0%)
|
|
CCMH
|
2(11,76%)
|
15(88,23%)
|
0(0%)
|
|
PLA
|
2(11,76%)
|
10(58,82%)
|
4(23,52%)
|
|
GB
|
0(0%)
|
13(76,47%)
|
4(23,52%)
|
|
NEU
|
1(5,88%)
|
15(88,23%)
|
1(5,88%)
|
|
LYM
|
3(17,64%)
|
13(76,47%)
|
1(5,88%)
|
|
MON
|
0(0%)
|
10(58,82%)
|
7(41,17%)
|
|
EOS
|
0(0%)
|
13(76,47%)
|
4(23,52%)
|
|
BAS
|
0(0%)
|
17(100%)
|
0(0%)
|
33
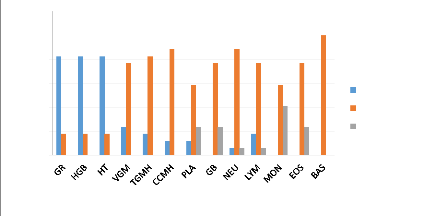
Frequence(%)
120
100
40
80
60
20
0
Paramètres hématologiques
Inf. Normale Normale
Sup. Normale
Figure 11: Influence de l'infection à
Plasmodium sur le profil hématologique
I.2.2.
Influence des infections à Salmonelles le profil
hematologique
Nous remarquons dans cette partie une diminution du taux de
globules rouges (61,90%), d'hémoglobines (66,66%) et
d'hématocrites (71,42%).
Tableau V: Influence de l'infection à
Salmonelles sur le profil hématologique
Rédigé et présenté par
: Axel MASRA
|
Paramètres
|
Inferieur de la
|
Normale
|
Supérieur de la
|
|
hématologiques
|
normale
|
|
normale
|
|
GR
|
13(61,90%)
|
7(33,33%)
|
1(4,76%)
|
|
HGB
|
14(66,66%)
|
7(33,33%)
|
0(0%)
|
|
HT
|
15(71,42%)
|
6(28,57%)
|
0(0%)
|
|
VGM
|
5(23,80%)
|
11(52,38%)
|
5(23,80%)
|
|
TGMH
|
4(19,04%)
|
14(66,66%)
|
3(14,28%)
|
|
CCMH
|
7(33,33%)
|
14(66,66%)
|
0(0%)
|
|
PLA
|
3(14,28%)
|
15(71,42%)
|
3(14,28%)
|
|
GB
|
0(0%)
|
13(61,90%)
|
8(38,09%)
|
|
NEU
|
0(0%)
|
14(66,66%)
|
7(33,33%)
|
|
LYM
|
1(4,76%)
|
16(76,19%)
|
4(19,04%)
|
|
MON
|
0(0%)
|
11(52,38%)
|
10(47,61%)
|
|
EOS
|
0(0%)
|
20(95,23%)
|
1(4,76%)
|
|
BAS
|
0(0%)
|
20(95,23%)
|
1(4,76%)
|
34
|
100 90 80 70 60 50 40 30 20 10
0
|
|
|
|
|
Frequence(%)
|
|
Inf. Normale Normale
Sup. Normale
|
Paramètres hématologiques
Rédigé et présenté par
: Axel MASRA
Figure 12 : Influence de l'infection à
Salmonelles sur le profil hématologique
I.2.3. Influence des co-infections à
Plasmodium et Salmonelles sur le profil
hématologique
Nous remarquons dans cette partie une diminution du taux de
globules rouges (85,18%), d'hémoglobines (74,07%) et
d'hématocrites (70,37%), de plaquettes sanguines (55,55%). Ainsi qu'une
augmentation du taux de monocytes (59,25%).
Tableau VI: Influence des co-infections à
Plasmodium et Salmonellessur le profil
hématologique
|
Paramètres
|
Inferieur de la
|
Normale
|
Supérieur de la
|
|
hématologiques
|
normale
|
|
normale
|
|
GR
|
23(85,18%)
|
4(14,81%)
|
0(0%)
|
|
HGB
|
20(74,07%)
|
7(25,92%)
|
0(0%)
|
|
HT
|
19(70,37%)
|
8(29,62%)
|
0(0%)
|
|
VGM
|
5(18,51%)
|
19(70,37%)
|
3(11,11%)
|
|
TGMH
|
5(18,51%)
|
18(66,66%)
|
4(14,81%)
|
|
CCMH
|
5(18,51%)
|
22(81,48%)
|
0(0%)
|
|
PLA
|
15(55,55%)
|
7(25,92%)
|
5(18,51%)
|
|
GB
|
7(25,92%)
|
7(25,92%)
|
13(48,14%)
|
|
NEU
|
8(29,62%)
|
17(62,96%)
|
2(7,40%)
|
|
LYM
|
13(48,14%)
|
7(25,92%)
|
7(25,92%)
|
|
MON
|
0(0%)
|
11(40,74%)
|
16(59,25%)
|
|
EOS
|
0(0%)
|
24(88,88%)
|
3(11,11%)
|
|
BAS
|
0(0%)
|
23(85,18%)
|
4(14,81%)
|
35
|
100,00 90,00 80,00 70,00 60,00 50,00 40,00 30,00 20,00 10,00
0,00
|
|
|
|
|
Frequence(%)
|
|
Inf. Normal Normal
Sup. Normal
|
|
|
|
|
Paramètres hématologiques
Figure 13: Influence des co-infections à
Plasmodium et Salmonelles sur le profil
hématologique,
Rédigé et présenté par
: Axel MASRA
36
Rédigé et présenté par
: Axel MASRA
II. DISCUSSION
Les co-infections à Plasmodium et
Salmonelles sont des maladies qui provoquent la mortalité chez
les enfants, et engendrent de forts coûts médicaux. Au cours de
ces dernières décennies les co-infections à Plasmodium
et Salmonelles représentent un problème majeur de
santé publique (Simon-Ok et al., 2020). Au
Cameroun, la prévalence de cette maladie est en nette augmentation dans
les populations urbaines et rurales à cause de la pauvreté, de la
malnutrition, d'un mauvais état sanitaire, d'une mauvaise hygiène
personnelle, et d'un faible niveau d'éducation (Udeze et
al., 2013). Notre étude à l'Hôpital
Laquintinie de Douala effectuée sur 101 patients de 2 à 5 ans a
permis d'axer nos résultats sur deux grands points : une determination
de la prevalence des coinfections à Plasmodium et
Salmonelles, ensuite une comparaison entre les paramètres
hématologiques des patients co-infectés par rapport aux patients
sans.
Les cas des co-infections à Plasmodium et
Salmonelles, sont présents dans tous les quartiers de
provenance de nos patients qui consultent ce centre hospitalier, bien que cette
structure couvre une aire de santé bien limité dans la ville de
Douala, les patients viennent de presque partout dans la ville de Douala et en
dehors (urbaine et rurale). La prévalence des coinfections à
Plasmodium et Salmonelles est de 26,73%. Les
mécanismes expliquant l'association entre le paludisme et la
co-infection typhoïde sont inconnus, bien qu'il ait été
montré que l'hémolyse, qui se produit dans le paludisme, peut
prédisposer à la fièvre typhoïde (Ukaegbu et
al ., 2014). Il a été constaté que les
deux sexes sont concernés par ces pathologies, avec une forte
prédominance chez le sexe féminin, soit 17,81% pour l'association
Plasmodium/Salmonelles contre 8,91% pour le sexe masculin avec une
différence non significative pour (p<0,05). Il a été
constaté également que les patients vivant dans les quartiers
périphériques de la ville de Douala sont plus exposés aux
co-infections à Plasmodium et Salmonelles (18,81%) que
les patients vivants dans le centre-ville (7,92%) avec une différence
significative pour (p<0,05). la prévalence élevée
enregistrée dans les zones périphériques (rurales)
pourrait être due à leurs différentes habitudes
(hygiène des mains, qualité d'eau, préparation des
aliments) (Maskalyk, 2003) leurs niveaux d'exposition aux
piqûres de moustiques. Ceci corrobore avec les résultats de
Morde et al., 2013.
Des altérations des paramètres
hématologiques ont été étudiées et
signalées dans les infections à Plasmodium et
Salmonelles (Dangana et al., 2010 ; Erhard et
al., 2004 ; Kayode et al., 2011 ). Il est
nécessaire d'inclure des investigations hématologiques dans le
diagnostic de l'infection à Plasmodium et Salmonelles
afin de détecter les complications
37
Rédigé et présenté par
: Axel MASRA
précoces associées à des infections
aiguës. Cela aide à soigner le patient de manière intensive
et à prévenir la mort pouvant résulter de telles
complications (Mishra et Mohanty, 2003). Le résultat de
notre étude montre que les co-infections à Plasmodium et
Salmonelles concomitante entraînent des altérations de
certains paramètres hématologiques.
Les données présentées dans cette
étude montrent que les globules rouges étaient significativement
en baisse (p<0,05) chez les patients atteints à l'infection à
Plasmodium, Salmonelles et les co-infectés que chez le
témoin. Dans notre série nous comptons 85,18% des cas (soit
23/27) dont 74,07% soit (20/27) ayant un taux d'hémoglobine inferieur
à 12g/100ml, 3/27 soit 11,11% qui ont un taux d'hémoglobine
compris entre 12-14g/100ml. La diminution concomitante du nombre des globules
rouges est principalement due à une inflammation, hémorragie
voire même hémolyse entrainant une anémie
périphérique. Ces résultats corroborent avec les travaux
de TRAORE et al ., 1991 qui ont obtenus une
diminution considérable des globules rouges. Un faible taux de globules
rouges a également été signalé dans des maladies et
des infections telles que l'hépatite, les maladies de la moelle osseuse,
les maladies auto-immunes, maladies génétiques, maladies
héréditaires et aussi à un manque de l'acide folique.
Cette étude rapporte une thrombopénie, nous
comptons 55,55% des cas (soit 15/27) ayant un taux de plaquettes sanguines
inférieur à 200 000mm3 chez les patients
co-infectés à Plasmodium et Salmonelles qui
peut être attribuée à une hypersensibilité des
plaquettes à l'ADP, augmentant les facultés d'hémostase
primaire. Cette observation corrobore avec les travaux de Ramde
Réma (1998), Saissy et al., (1991), qui ont
signalé une diminution du nombre de plaquettes sanguines lors des
co-infections.
Cette étude nous montre que 48,14% soit (13/27)
personnes co-infectées avaient un nombre plus élevé de
globules blancs que les personnes normales. Cela peut être dû
à l'effort du corps pour résister à l'infection par le
Plasmodium et Salmonelles, entraînant une production
continue de leucocytes. Ce qui est en accord avec les travaux de
Odikamnoro et al. 2018 menés au Nigeria ou ils
obtiennent un nombre considérable de leucocyte.
Nos résultats montrent que les patients
co-infectés ont un nombre de lymphocyte plus bas que les patients sains,
48,14% soit 13/27. Ceci peut être médicalement significatif car
les effets combinés de la comorbidité du paludisme et de la
fièvre typhoïde peuvent entraîner des anomalies des
lymphocytes et du coup sa diminution. Ces résultats corroborent à
ceux de Asma et al., 2019 au Pakistan.
38
Notre étude nous montre que 59,25% soit 16/27 des
patients co-infectés avaient un taux élevé de monocyte que
les patients normaux. Ceci s'explique en partie que le Plasmodium
présent chez les patients co-infectés provoque une
inflammation, les monocytes vont se multiplier de façon
considérable pour combattre cette inflammation. Ce résultat
corrobore avec les résultats de Muhammad et al., 2017
en Pakistan
Rédigé et présenté par
: Axel MASRA
39
CONCLUSION
Dans le but de contribuer à une meilleure prise en
charge des patients atteints des co-infections à Plasmodium et
Salmonelles, nous nous sommes proposés d'évaluer la
parasitémie par la gouttes épaisse, le sérodiagnostic de
Widal-Felix et faire une numération de formule sanguine pour
évaluer les paramètres hématologiques des enfants de 2
à 5ansco-infectés.
Il ressort des principaux résultats obtenus une
fréquence plus élevée des co-infections à
Plasmodium et Salmonelles chez les patients féminins
(50,5% avec un taux de coinfections de 17,8%) comparées aux patients
masculins (49,5% avec un taux de co-infections de 8,9%) dans la population
générale. De même, une association positive et
significative (p = 0,000) a été observée entre les
co-infections à Plasmodium et Salmonelles et la zone
de résidence. La fréquence des co-infections à
Plasmodium et Salmonelles était de (26,7%).
Les patients souffrant des co-infections présentent un faible taux
de globules rouges, plaquettes sanguines et lymphocytes comparés
à ceux des non co-infectés. Ces observations suggèrent des
risques élevés d'anémie, thrombopénie ainsi que la
lymphopénie. L'ensemble des données obtenues démontre la
nécessité de la prise en compte de l'équilibre
hématologique, non seulement dans le diagnostic mais également de
la prise en charge des patients co-infectés à Plasmodium
et Salmonelles. Ces résultats constituent une contribution
originale dans la surveillance et la prise en charge des patients souffrant des
co-infections à Plasmodium et Salmonelles.
Rédigé et présenté par
: Axel MASRA
40
RECOMMANDATIONS
Compte tenu de l'effet des co-infections à Plasmodium
et Salmonelles sur les
paramètres hématologiques chez les participants de
l'étude nous recommandons vivement :
? Aux autorités sanitaires
? Multiplier sur l'ensemble du territoire national la
sensibilisation sur les règles
d'hygiène.
? Distribuer gratuitement de moustiquaires
imprégnées pour lutter efficacement contre
le paludisme.
? Aux cliniciens et aux biologistes
? Inclure dans le bilan de diagnostic des suspicions d'infection
à Salmonelles le bilan
systématique pour le diagnostic du paludisme
? Assurer la formation continue du personnel socio-sanitaire dans
la prise en charge des
infections bactérienne et du paludisme
? Aux chercheurs
Promouvoir des études de recherche sur les co-infections
à Plasmodium et Salmonelles
Rédigé et présenté par
: Axel MASRA
41
PRESPECTIVE
Les investigations effectuées dans le cadre de ce
mémoire de Master ne représentent que l'initiation d'un vaste
champ de recherche que nous voulons entreprendre dans le cadre d'une
collaboration avec les différents acteurs de la santé en vue
d'améliorer la prise en charge des patients souffrant des co-infections
à Plasmodium et Salmonelles afin de réduire la
morbidité et la mortalité dues à cette maladie. Ainsi,
nous envisagerons dans un futur proche : - D'étendre l'étude dans
plusieurs structures hospitalières à travers plusieurs
régions du Cameroun.
- Associer les examens déjà effectués
à d'autres examens comme le frottis sanguin et la coproculture pour
rendre les résultats plus crédibles.
- D'augmenter la taille de notre échantillon et la
durée de l'étude.
Rédigé et présenté par
: Axel MASRA
42
Rédigé et présenté par
: Axel MASRA
REFERENCES
1. Achonduh-Atijegbe, O.A., Mfuh, K.O., Mbange, A.H.,
Chedjou, J.P., Taylor, D.W., Nerurkar, V.R., Mbacham, W.F., Leke, R. (2016).
Prevalence of malaria, typhoid, toxoplasmosis and rubella among febrile
children in Cameroon. BMC infectious diseases, v. 16, p. 658,
2. Akinyemi KO, Bamiro BS, Coker AO. (2007). Salmonellosis in
Lagos, Nigeria: incidence of Plasmodium falciparum-associated
co-infection, patterns of antimicrobial resistance, and emergence of reduced
susceptibility to fluoroquinolones. J Health Popul. Nutr., 25:
351-358.
3. Alhassan Hussaini Mohammed. (2012). Co-infection profile
of Salmonella typhi and Malaria parasite in Sokoto-Nigeria. Global Journal
of Science, Engineering and Technology., 201: 13-20
4. ALKASSANE A. I. (2011). Co infection paludisme et infections
bactériennes invasives dans le service de Pédiatrie du CHU GT de
Janvier 2007 à Décembre 2008. Thèse Med. FMOS/Bko2011 ;
n°105.
5. Al-Omar IA, Eligail AM, Al-Ashban RM, Shah AH. (2010).
Effect of falciparum malaria infection on blood cholesterol and platelets.
Journal of Saudi Chemical Society. 14(1) : 83-89.
6. Ammah A., Nkuo-Akenji T., Ndip R, Deas JE. (2013). An
update on concurrent malaria and typhoid fever and in Cameroon. Trans R Soc
Trop Med Hyg., 93: 127-129.
7. Asma Waheed Qureshi, Zaib-Ullah Khan., Luqman Khan., Abu
Mansoor., Rashid Minhas. (2019). Prevalence of malaria, typhoid and
co-infection in district DIR (Lower) Pakistan., Bioscience Journal 35:
317-325.
8. Balédent F., Vergé V. (2010).
Découverte fortuite d'une infection à Plasmodium falciparum.
Immuno-analyse et Biologie Spécialisée. 25(1) : 62-5.
9. Bashyam H. (2007). Surviving malaria, dying of typhoid:
JEM 204(12)
10. Bruneel F., Tubach F., Corne P., Megarbane B., Mira JP.,
Peytel E. (2010). Severe Imported Falciparum Malaria: A Cohort Study in 400
Critically Ill Adults. Plosone.,8;5(10):e13236
11. Chapand Margaud. (2015). La fièvre typhoïde,
le point en 2015. Thèse pharm. FMPOS/Lyon 2015, n°118 ; 129p
12. COOK, G. (1996). Manson's Tropical Diseases. 20th
edition, WB Saunders, London.
43
13.
Rédigé et présenté par
: Axel MASRA
Cox-Singh J., Davis TME., Kim-Sung L., Sunita SGS., Matusop
A., Ratnam S., Rahman HA., Conway DJ et Singh B. (2008). Plasmodium knowlesi
malaria in humans is widely distributed and potentially life threatening.
Clincal Infectious Diseases: An Official Publication of the Infectious
Diseases Society of America., 46(2):165-171
14. Cunha BA. (2004). Osler on typhoid fever: differentiation
of typhoid from typhus and malaria Infect Dis. Clin. North Am., 18 :
111-26.
15. Cunha BA. (2005). Malaria vs. typhoid fever: a diagnostic
dilemma? Am.J. Med., 118: 1442-1443.
16. Dangana A., Ajobiewe J and Nuhu A. (2010). Hematological
changes associated with Salmonella typhi and Salmonella paratyphi in
humain. Int. J. Biomed. Health Sci., 6 : 219-222
17. Edet O. (2002). Another opinion on the Widal test.
Africa Health. 24:2.
18. Eholié SP., Ehui E., Adou-Bryn K., Kouamé
KE., Tanon A., Kakou A. (2004). Paludisme grave de l'adulte autochtone à
Abidjan (Côte d'Ivoire). Bull Soc PatholExot., 97 :340 - 344.
19. Erhart LM., Yingyuen K., Chuanak N., Buathong N.,
Laoboochai A et al. (2004). Hematologic and clinical indices of
malaria in a semi-immune population of western Thailand. Am J Trop Med
Hyg., 70(1): 8-14.
20. Fallab Stubi C.L., Landry P.R., Pétignat C., Bille
J., Genton B. (2006). Compliance to Live Oral Ty21a Typhoid Vaccine, and its
Effect on Viability. Journ Of Trav Med., 7(3):133-7.
21. Gopinath R., Keystone JS., Kain KC. (1995). Concurrent
falciparum malaria and Salmonella bacteremia in travellers: report of two
cases. Clin Infect Dis., n°20: 706-708
22. Hald T., Wingstrand A., Swanenburg M., von Altrock A.,
Thorberg BM. (2003). The occurrence and epidemilogy of Salmonella in
European pig slaughterhouses. Epidemiol Infect., 131 :1187-1203
23. Hamadou SAÏDOU. (17 janvier 2018). Pauvreté,
paludisme et réformes des systèmes de santé en Afrique :
trois études appliquées au Cameroun. Thèse Doctorale.
PSLRU. Paris 2018, n°543 ; 226p
24. Jonston V., Stockley JM., Dockrell D., Warrell D., Bailey
R. (2009). Fever in returned travelers presenting in the United Kingdom:
recommendations for investigation and initial management. J. Infect.,
59(1): 1-18.
44
25.
Rédigé et présenté par
: Axel MASRA
Kanjilal SD., Dutta A., Mondal RK., Chakravorti S. (2006).
Uncomplicated falciparum malaria complicated by salmonella septicaemia: cause
not coincidence. J. Indian Med. Assoc., 104 : 646-648.
26. Khovid hunkit W., Kim MS., Memon RA., Shigenaga JK.,
Moser AH (2004). Effects of infection and inflammation on lipid and lipoprotein
metabolism: mechanisms and consequences to the host. J. lipid Res.,
45(7): 1169-1196.
27. KOCHAR, D., DAS., A., KOCHAR, A., MIDDHA, S., ACHARYA,
J., TANWAR, G., PAKALAPATI, D., SUBUDHI, A., BOOPATHI, P., GARG, S. (2014). A
prospective study on adult patients of severe malaria caused by Plasmodium
falciparum, Plasmodium vivax and mixed infection from Bikaner, northwest
India. Journal of Vector Borne Diseases., v. 51, p. 200
28. Lateef AO., Aprileona LK. (2000). Widal agglutination
test- 100 years later: still plagued by controversy; Post grad. Med.
J., 76 : 80-84.
29. Laurent V., Hilly J., Bedel J., Planquette B., Legriel S.
(2014). Paludisme grave d'importation de l'adulte. Journal Européen
des Urgences et de réanimation., 26(2) : 97-104.
30. Mbah CE., Agu B. (2014). Prevalence of malaria and
typhoid co-infection among patients in some hospitals in Samaru, Zaria. Ann
Bioanthropol., 2: 43-48.
31. Muhammad Sajid, Muhammad Zahid, Riaz Ahmad, Muhammad
Rasool, Mudassar Shah, et al. (2017). Co-infection of malaria and typhoid in
district Dir (Lower) Khyber Pakhtunkhwa, Pakistan. Journal of Entomology
and Zoology Studie., 5: 912-914.
32. Morde RM., Borke ME. (2013). The prevalence of malaria in
Edo State, Nigeria. Nigeria Journal of Parasitology., 34: 4146.
33. Nsutebu E., and P. Ndumbe. (2001). The Widal test for
typhoid fever: It is useful? Africa Health., 23: 18-19.
34. Obimakinde ET., Simon-Oke IA. (2017). The prevalence of
malaria infection among patients attending the Health Cenrtre of the Federal
University of Technology Akure, Nigeria. International Journal of Tropical
Disease & Health., 27: 1-7.
35. ODIKAMNORO O., IKEH I., OKOH F., EBIRIEKWE S., NNADOZIE
I., NKWUDA J., ASOBIE G. (2018). Incidence of malaria/typhoid co-infection
among adult population in Unwana community, Afikpo North local Government area,
Ebonyi state, Southeastern Nigeria. African journal of infectious
diseases., v. 12, n°33.
36. OMS. (2019). Le Rapport sur le paludisme dans le monde en
un clin d'oeil. 4 decembre 2019
45
37.
Rédigé et présenté par
: Axel MASRA
OMS. (2020). Le Rapport sur le paludisme dans le monde.
Messages generaux. 30 Novembre 2020
38. OT Kayode., AAA Kayode et OO Awonuga. (2011). Statut de
certains paramètres hématologiques et biochimiques dans le
paludisme et la co-infection paludisme-typhoïde. Journal des sciences
biologiques., 11: 367-373
39. Pr Pierre Aubry et al.,(2020). Paludisme.
Medecine Tropicale., 30 : 1-18
40. Programme national de lutte contre le paludisme -
Cameroun. Plan stratégique national de lutte contre le paludisme au
Cameroun, Cameroun 2011-2015. Yaoundé: MINSANTE.; 2011.
41. Programme national de lutte contre le paludisme -
Cameroun. Rapport annuel 2018. Yaoundé: MINSANTE.; 2018.
42. Programme national de lutte contre le paludisme -
Cameroun. Rapport annuel 2008. Yaoundé: MINSANTE.; 2008.
43. Puepi Alvine. (2009). Etude bibliographique des
thèses réalisées sur le paludisme à la FMPOS, de
janvier 2007 à décembre 2008. Thèse Pharm. FMPOS. Bamako
2009 ; 118p
44. QURESHI A.W et al., (2019). PREVALENCE OF
MALARIA, TYPHOID AND CO-INFECTION IN DISTRICT DIR(LOWER), PAKISTAN. Biosci.
J., v.35, n°1, 317-325
45. RAFIQUE N., IMRAN A., KHAN L. (2016). Identification of
Plasmodium falciparum in anemic patients with special reference to
pregnancy. Journal of Biodiversity and Environmental Sciences (JBES).,
v. 9, n°2, p. 113-121.
46. RAMDE REMA. (1998). Etude des perturbations hematologiques
observees au cours de la crise algue de paludisme chez l'enfant au service de
pediatrie du centre hospitalier national yalgado ouedraogo. Thèse Pharm.
FSS/Bkso 1998 ; n°34.
47. Rapp C., Andriamanantena D., Ficko C., Ba PS., Pelletier
C., Barruet R. (2008). Pertinence de l'ictère dans le paludisme grave
d'importation de l'adulte. Med Mal infect., 38 : 140-141.
48. Sagbo GG., Alao MJ., D'Almeida M., Lalya F et Ayivi B.
(2011). Infection Bactérienne au cours du Paludisme Grave Chez le
Nourrisson de moins de six mois au Centre National Hospitalier et Universitaire
(CNHU) de Cotonou, Bénin. Clinics in Mother and Child Health.,
8 : 1-4.
49. SAISSY J.M., KEMPF J., DEMAZIERE J. et coll. (1991).
Neuro-paludisme chez les sujets non immuns. Aspects actuels en-zone
d'endémie africaine. La Presse Afédicale., 20 :
836-840
46
50.
Rédigé et présenté par
: Axel MASRA
SANSONETIl P.J., SPINOSI L., DUPONT B. et coll. (1986).
Accès palustres à Plasmodium falciparum à
parasitémie faible ou nulle au retour de régions d'endémie
de résistance aux amino-4 quinoléines. La Presse
Afédicale., 15 :1264-1266
51. Sébastin Sabbagh. (2013). Identification et
caractérisation de gène chez Salmonella enterica serovar
typhi impliqués dans l'interaction avec les macrophages.
Thèse doctorale, université Montréal, 362p
52. Seth M., Mdetele D., Phillips ST., Buza J. (2015).
Challenges in diagnosis of febrile illnesses in Tanzania in the era of
declining malaria epidemiology. Am J Res Commun., 3(5):88-110
53. Simon-Oke IA and Akinbote MO. (2020). Prevalence of
Malaria and Typhoid Coinfection in Relation to Haematological Profile of
University Students in Akure, Nigeria. J. Infect. Dis. Epidemiol.,
6:166.
54. Smith DC. (1982). The rise and fall of typhomalarial
fever. I: origins. J Hist Med Allied Sci 37: 182-220.
55. SOGOBA F L. (2012). Etude de la prise en charge des cas
de paludisme dans le district sanitaire de Douentza de janvier 2008 à
décembre 2009., Thèse Med FMOS/Bko; n°311
56. Soumaré M., Seydi M., Diop SA., Diop BM et Sow PS.
(2008). Neuro-paludisme de l'adulte à la clinique des maladies
infectieuses du CHU de Fann, Dakar, Sénégal. Bull Soc
PathExot.,101 : 20-21.
57. Stefani Aurélia. (2011). Epidémiologie du
paludisme et environnement : étude de deux populations
amérindiennes de l'est et de l'ouest guyanais. Thèse doctorale,
université des Antilles et de la Guyane. n°2011AGUY0448 ; 369p
58. Udeze AO, Nwokocha EJ, Okerentugba PO, Anibijuwon II,
Okonko IO. (2013). Asymptomatic Plasmodium Parasitaemia in Ilorin, North
Central Nigeria. Nature and Science 11: 26-27.
59. Ukaegbu CO, Nnachi AU, Mawak JD, Igwe CC (2014) Incidence
of concurrent malaria and typhoid fever infections in febrile patients in Jos,
Plateau State Nigeria. International Journal of Scientific and Technology
Research 3: 157-161.
60. Uneke CJ. (2008). Concurrent malaria and typhoid fever in
the tropics: the diagnostic challenge sand public health implications. J
Vector Borne Dis., 45(2):133-142. Medline
47
ANNEXES
48
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
ANNEXE I
NOTE D'INFORMATION
Moi, AXEL MASRA, étudiant en Master II de Biochimie
Clinique à la Faculté des Sciences de l'Université de
Douala, procède à une étude sur le thème :
Influence des co-infections à Plasmodium et
Salmonelles sur le profil hématologique des enfants de 2-5ans
à l'hôpital Laquintinie de Douala.
But : Cette étude permettra de savoir
si les co-infections ont une influence sur les globules rouges, globules
blancs, les plaquettes sanguines, les lymphocytes de votre enfant. Elle
permettra aussi de mettre sur pied une bonne prise en charge efficiente des
personnes infectées par ces microbes afin de réduire les risques
de complications et de décès.
BENEFICE(S) ATTENDUS
La participation de votre enfant aidera à fournir des
données qui contribueront à son suivi, puis améliorer
l'impact des coinfections à Plasmodium et Salmonelles
au Cameroun et plus précisément dans la ville de Douala. La
participation à cette étude ne vous coûtera aucune
dépense financière, vos résultats d'analyse vous seront
remis gracieusement.
RISQUES POTENTIELS
Votre enfant ressentira une sensation de piqure a l'aiguille
au début du prélèvement et à la fin de celui-ci il
(elle) ne ressentira plus de douleurs.
PARTICIPATION
Votre participation est volontaire. Vous êtes libre
d'accepter ou de refuser de participer à l'étude. Si vous refuser
de participer, aucun service offert ne vous sera refusé à cause
de votre choix. Si vous accepter de participer nous allons vous poser des
questions générales, sur votre mode de vie, les différents
antécédents de santé liés aux examens que nous
allons vous effectuer.
J'autorise les investigateurs à publier les
résultats de cette étude.
DEPENSES
La participation à l'étude est gratuite.
49
Rédigé et présenté par
: Axel MASRA
ANNEXE II
FICHE DE CONSENTEMENT ECLAIRE
Je, soussignée,
Mrs/Mme.... déclare, accepte, librement, de façon
éclairé que mon enfant participe comme sujet à
l'étude intitulée « Influence des coïnfections à
Plasmodium et Salmonelles sur le profil hématologique dans enfants de 2
à 5 ans à l'Hôpital Laquintinie de Douala».
Les objectifs et modalités de l'étude m'ont
été clairement expliqués par M. Axel MASRA j'ai lu et
compris la fiche d'information qui m'a été remise.
J'accepte que les documents de dossier médical de mon
enfant qui se rapportent à l'étude puissent être
accessibles aux responsables de l'étude et éventuellement aux
autorités de santé. A l'exception de ses personnes, qui
traiteront les informations dans le plus strict respect du secret
médical, anonymat de mon enfant sera préservé.
J'accepte que les données nominatives concernant mon
enfant recueillies à l'occasion de cette étude puissent faire
l'objet d'un traitement automatisé par les organisateurs de la
recherche. Je pourrai exercer mon droit d'accès et de rectification
auprès de M. Axel MASRA.
Je suis libre d'accepter ou de refuser de participer, et je
suis libre d'arrêter à tout moment ma participation en cours
d'étude. Cela n'influencera pas la qualité des soins qui seront
prodigués
à mon enfant.
Mon consentement ne décharge pas les organisateurs de
cette étude de leurs responsabilités. Je conserve tous mes droits
garantis par la loi
Fait à Douala le....../..../2021
Signature de l'investigateur Signature du sujet
50
ANNEXE III
FICHE D'ENQUETE INDIVIDUELLE
Date : ___/___/___
IDENTIFICATION
|
Type de prélèvement
|
|
|
|
|
Numéro de téléphone :
|
|
|
Numéro d'anonymat :
|
|
|
A. PARAMETRES GENERAUX
|
|
Taille (m) :
|
|
Poids (kg) :
|
|
QUESTIONNAIRE
B. CARACTERISTIQUES SOCIO-DEMOGRAPHIQUES
|
|
Sexe : 1= Masculin LI ; 2 = Féminin LI .
|
|
|
Age : _____ans
|
|
|
|
|
|
|
|
Patient : 1 = Hospitalisé LI ; 2 = en ambulatoire LI Bon
état de santé général : LI AutresLI
|
|
|
|
Médication : 1 = oui LI ; 2 = nonLI.
|
|
|
Médication en cours : 1 = oui LI ; 2 = non
1=Antipaludéens LI ; 2 = Antibiotiques LI 3=Autres LI
.....
|
|
|
Quels sont les symptômes présentez-vous ?
Céphalée|_| Vomissements|_|. Nausées|_|
Fièvre|_|. Maux de ventre|_| manque d'appétit |_|.
Fatigue |_|. Autres
|
|
Diarrhée|_|
|
|
|
|
Quels sont les aliments couramment consommés ?
|
|
|
|
|
|
Comment lavez-vous vos aliments ? Eau de robinet |_|. Eau du
marigot |_|. Eau du puits |_|
|
|
51
Rédigé et présenté par
: Axel MASRA
|
D. HABITUDES D'HYGIENE
|
|
Fréquence de lavage de mains : 1 = Jamais LI ; 2 = 1 fois
/jour LI ; 3 = 2 fois /jour LI ;
4 = 3fois/jour LI .
|
|
|
Matériel de lavage : 1 = lavage avec de l'eau simple LI 2
= lavage avec de l'eau et du savon LI ; 3= lavage avec de l'eau et autre
produit chimique LI ;.
|
|
Dort-il sous une moustiquaire imprégnée ? : 1 = oui
LI ; 2 = non LI
|
|
Moment du lavage: 1 = matin LI ; 2 = soir LI ; 3 = matin+soirLI ;
4 = après les selles LI ;
5 = A tout moment LI ;
|
|
E. CARACTERISTIQUES DU LOGEMENT DU MENAGE
|
|
Citer les maladies que vous abordé le plus dans votre
ménage A- FIEVRE/PALUDISME |_|LIB- INFECTION
RESPIRATOIRE |_| C- SIDA |_| D- FIEVRE TYPHOÏDE|_|LIE- AUTRE
MALADIE (A PRECISER)
|
|
Qu'elle est la principale source d'eau que boivent les habitants
de votre ménage ?
Eau du robinet dans le logement |_|. Robinet public/borne
fontaine|_|
Eau du robinet dans la cour|_|. Eau du puits
protégée |_|
Puits non protégée|_|
|
|
Habituellement quel type de toilettes les membres de votre
ménage utilisent-ils ? Pas de toilettes ou brousse ou
champ|_|. Chasse d'eau |_| Latrines |_|. Sauts |_| Autres
|
|
Votre ménage possède-t-il un moyen d'information et
de communication ? Télévision |_| Radio|_|
Téléphone |_|. Autres |_|
|
|
Un membre de votre ménage possède-t-il un moyen de
transport ? Oui |_|. Non |_|
|
|
F.IDENTIFICATION DES ENFANTS DU MENAGE ET LEUR
VACCINATION
|
|
Avez-vous déjà vacciné (nom) ? 1=Oui
2=Non
|
|
A quels moments avez-vous souvent vacciné (nom) ? LI1=A la
naissance |_| 2=Selon le rendez-vous |_|.
3=Quand il est malade et je l'amène à
l'hôpital |_|. Autre
|
|
|
Quels sont les vaccins/vitamine que (nom) a déjà
faits ? BCG |_|. DTC-HepB+Hib3 |_| VPO |_| LIVAA |_|
VAT |_|. Vit A |_|
|
52
Rédigé et présenté par
: Axel MASRA
Rédigé et présenté par
: Axel MASRA
ANNEXE IV
AUTORISATION DE LA RECHERCHE

53
ANNEXE V

54
Rédigé et présenté par
: Axel MASRA
ANNEXE VI
Centrifugeuse (VanGuard V6000)

Rédigé et présenté par
: Axel MASRA
55
ANNEXE VII
Microscope optique
Rédigé et présenté par
: Axel MASRA
56
ANNEXE VIII
Automate pour la NFS ( Pentra XRL)

Rédigé et présenté par : Axel
MASRA
57



