|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE
L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE
DES SCIENCES ET DE LA TECHNOLOGIE HOUARI BOUMEDIENNE

FACULTE DES SCIENCES BIOLOGIQUES
Mémoire de projet de fin d'études en vue de
l'obtention du Diplôme de Master
Domaine : Sciences
de la Nature et de la Vie
Spécialité : Biotechnologie et
Pathologies Moléculaires
THEME
Etude de l'effet immuno-modulateur de
la
membrane lamellaire d'Echinococcus
granulosus
sur la production du NO au cours des MICI
|
Présenté par : Melle BENAZZOUZ
Sara et
Soutenu le 08 / 06 / 2015 devant le jury composé
de :
|
Melle BOUHARA
|
Lynda
|
|
Présidente :
|
Dr
|
AMRI M.
|
MCA
|
(FSB/USTHB)
|
|
Promotrice :
|
Pr
|
TOUIL-BOUKOFFA C.
|
Professeur
|
(FSB/USTHB)
|
|
Co-Promotrice :
|
Melle
|
SOUFLI I.
|
Doctorante
|
(FSB/USTHB)
|
|
Examinatrice :
|
Dr
|
RAFA H.
|
MAA
|
(FSB/USTHB)
|
|
Membre invitée :
|
Melle
|
TOUMI R.
|
MAB
|
(FSB/USTHB)
|
Promotion : 2014 - 2015
Remerciements :
es remerciements vont tout d'abord au corps professoral et
administratif
de la Faculté des Sciences Biologiques de
l'Université des Sciences et de la Technologie Houari Boumedienne.
Nous tenons à exprimer notre profond respect et nos
plus vifs remerciements à Madame TOUIL-BOUKOFFA. C., Professeur à
la Faculté des Sciences Biologiques (FSB) et directrice de
l'équipe Cytokines et NO synthase : Immunité et
Pathogénie, de nous avoir accueillies Lynda et moi au sein de son
laboratoire pour notre stage de fin d'étude, ainsi que pour la
qualité de son enseignement. Madame TOUIL-BOUKOFFA nous a donné
goût à la science, à l'immunologie en particulier, ainsi
qu'à la recherche scientifique.
À Madame AMRI. M., pour l'honneur
qu'elle nous a fait en acceptant de présider ce jury, ainsi que pour sa
pédagogie et sa grande amabilité.
À Madame RAFA. H., membre de
l'équipe `Cytokines et NO synthase : Immunité et
Pathogénie, pour avoir accepté d'examiner ce travail, et de
l'enrichir par ses propositions ainsi que pour son enseignement de
qualité et sa gentillesse.
À Mesdemoiselles SOUFLI I. et TOUMI
R., de nous avoir inculqué les règles de bonne pratique, de leur
disponibilité ainsi que de leurs qualités humaines et
pédagogiques. Merci de nous avoir consacré votre temps et votre
énergie pour le bon déroulement de notre stage, pour vos conseils
et la confiance que vous nous avez accordé quotidiennement. Merci encore
à Mademoiselle SOUFLI pour son engagement et son soutien ainsi que pour
la pertinence de ses remarques et de ses feed-back.
Sara
Dédicace :
e dédie ce mémoire aux nombreuses personnes qui
m'ont apporté leur aide et leur soutien.
À Lynda, mon binôme, mon amie surtout. Merci
d'exister, d'être toi, si gentille et douce. Voilà maintenant 3ans
qu'on est amie, j'espère que la vie ne nous séparera pas et
même si elle nous sépare un jour, sache que je ne t'oublierai
jamais.
À Chahinez, Mhamed, Narimene, Shéraz et Rania.
Merci pour les bons moments passés ensemble au cours de notre stage,
restez comme vous êtes.
À mes chers BPM, nous avons partagé tellement
d'examens, d'exposés ainsi qu'une sortie inoubliable qui nous a
soudé tous ensemble. Vous êtes les meilleurs, je vous souhaite le
meilleur dans votre vie et tout ce que vous pouvez rêver. Je vous aime
tous sans aucune distinction.
À Malik, merci pour ton soutien sans faille et tes
encouragements tout au long de mon cursus universitaire.
À tous mes amis et plus spécialement
Chérifa, ainsi qu'à tous les Bosaristes qui me sont chers.
our finir, je le dédie aux plus importants, ma famille.
Je dédicace ce travail à mes parents sans
lesquelles je ne ferai pas partie de ce monde, merci d'être les meilleurs
parents qui puissent exister.
À mon frère ainsi qu'à mes Tantes, mes
oncles, mes grands-parents et mes cousins.
B. Lynda
Je dédie ce travail à
Ma mère qui représente mon tout, trouve en ce
travail le fruit de tes sacrifices, de tes prières, de tes
encouragements, mon éternele reconnaissance et mon
amour infini.
Mon père merci pour ta confiance ta complicité
et l'amour que tu me porte.
Lyes pour ton soutien constant et pour le sourire que tu
dessines sur mon visage.
Aux personnes qui en cru en moi qui m'ont encouragé
à aler de l'avant.
A Sara, la promo BPM2014 /2015, l'équipe
MICI.
« C'est dans l'effort que l'on trouve satisfaction et
non dans la réussite. Un plein d'efforts est une pleine victoire
».
Mahatma Gandhi
SOMMAIRE
Liste des figures Liste des tableaux Liste des
abréviations
Introduction 1
Chapitre I : Généraliés
I. Côlon et système immunitaire muqueux
2
1. Anatomie du côlon 2
2. Histologie du côlon 2
3. Système immunitaire muqueux . 3
II. Les maladies inflammatoires chroniques intestinales
... 6
1. Les maladies inflammatoires chroniques intestinales
... 6
2. Définitions et diagnostic 6
3. Epidémiologie et distribution
géographique 7
4. Etiologie 8
5. Physiopathologie .. 10
6. MICI et Monoxyde d'azote 13
7. Traitements 14
III. les modèles expérimentaux des MICI
16
1. Modèle de colite chimio-induite par le DSS
16
IV. Helminthes et maladies inflammatoires chroniques
intestinales 18
1. Introduction 18
2. Effets des helminthes sur la réponse
immunitaires de l'hôte 18
3. La membrane lamellaire hydatique 19
4. Effet immunomodulateur des helminthes chez l'homme
et l'animal 21
Chapitre II : Matériel et méthodes
I. Matériel 22
1. Matériel biologique 22
2. Matériel non-biologique 23
II. Méthodes 23
|
1.
|
Préparation de l'extrait de la membrane lamellaire
|
23
|
|
2.
|
Induction d'une colite aigue par le DSS chez des souris
BALB/c
|
24
|
|
3.
|
Prélèvements sanguins
|
25
|
|
4.
|
Préparation des macrophages
péritonéaux
|
25
|
|
5.
|
Dosage du monoxyde d'azote
|
25
|
|
6.
|
Récupération et étude histologique
du côlon
|
26
|
|
7.
|
Etude histologique
|
27
|
|
8.
|
Isolement et culture des cellules mononuclées du
sang périphérique des patients
|
|
|
atteints de MICI : Etude de l'effet immunomodulateur de
la ML
|
28
|
|
9.
|
Etude statistique
|
29
|
Chapitre III : Résultats
Partie I : Etude sur modèle animal 30
I. Effet de la ML au cours de la colite induite par le
DSS 30
1. Paramètres cliniques 30
2. Effet de la ML sur les altérations
morphologiques et histologiques du côlon induites
par le DSS 31
3. Effet de la ML sur la production de NO in vivo
et in vitro 33
II. Effet de l'IL-4 sur la production in vitro
du monoxyde d'azote au niveau des
surnageants de culture des macrophages
péritonéaux 34
Partie II : Etude chez des patients atteints de MICI
35
I. Effet de l'extrait brut de la ML sur la production du NO
ex vivo au cours des
MICI 35
1. Patients atteints de la MC 35
2. Patients atteints de la RCH 36
Chapitre IV : Discussion générale
Discussion générale 37
Conclusion 41
Références bibliographiques
Liste des figures et des tableaux
Figure 1:Anatomie intestinale et organes
digestifs annexes 2
Figure 2:histologie intestinale 3
Figure 3:Anatomie de l'épithélium
intestinal et du système immunitaire de la muqueuse 5
Figure 4:Caractéristiques histologiques
des MICI (Xavier & Podolsky ; 2007). 6
Figure 5:Système immunitaire
intestinal(Baumgart & Carding ; 2007) 12
Figure 6:Les réponses immunitaires de
l'hôte dirigées contre la membrane lamellaire du
kyste hydatique (Diaz et al., 2011). 20
Figure 7:Schéma expérimental 24
Figure 8: courbe étalon de dosage du NO
selon la méthode de Griess modifiée. 26
Figure 9: Effet de la ML sur les
paramètres cliniques de la colite induite par le DSS 30
Figure 10:Longueur des différents colons
issus des trois groupes expérimentaux 31
Figure 11: Structure histologique du Côlon
des souris des groupes 32
Figure 12: Effet de la ML sur la production in
vivo du monoxyde d'azote (NO). 33
Figure 13: Effet de la ML et/ou du DSS sur la
production in vitro des nitrites résiduels par
les macrophages péritonéaux. 34
Figure
14: Effet de l'Il-4 et/ou du DSS sur la production in vitro des
nitrites résiduels par les
macrophages péritonéaux 34
Figure
15: Concentrations des nitrites résiduels ex vivo au niveau des
PBMC de
patients atteints de la maladie de Crohn 35
Figure 16: effet de la ML sur la production ex
vivo du NO par les PBMC de patients atteints
de la rectocolite hémorragique en phase active et sous
corticothérapie. 36
Figure 17: Schéma proposé pour
illustrer les altérations induites par le DSS et l'effet protecteur
probable de la membrane lamellaire.
Tableau 1: Testes utilisés pour le diagnostic des MICI
(Hendrickson et al., 2002). 7
Tableau 2 : Nouvelles approches thérapeutiques pour le
traitement des MICI. 15
Tableau 3 : Randomisation des souris par groupes. 22
Tableau 4 : Données clinique des Patients. 22
Tableau 5 : Paramètres de calcule du DAI. 24
Chapitre I: Généralités
Chapitre II: Matériel &
Méthodes
Chapitre III: Résultats
Chapitre VI:
Discussion générale
Conclusion
Références
bibliographiques
Liste des abréviations
ATG16L1: Autophagy-related protein 16L1
Breg: Lymphocyte B régulateur
CARD: Caspase recruitment domain containing
protein
CHU: Centre Hospitalier Universitaire
CMH: Complexe majeur
d'histocompatibilité
CPA: Cellule présentatrice
d'antigènes
DAI: Disease Activity Index
DC: Cellule Dendritique
DSS: Dextran Sulfate Sodium
DMEM: Dulbecco modified Eagle's minimal
essential medium
DO: Densité Optique
EDTA: Éthylène Diamine
Tétra-Acétique
eNOS: endothelial NO synthase
EPH: Etablisement Public Hospitalier
FLI : follicules Lymphoides isolés
GALT : Gut Associated Lymphoïd Tissu
ICAM: intracellular adhesion molecule
IEC: Intestinal Epithelial cell
IEL : Intra-Epithelial Lymphocyte
Ig: Immunoglobuline
IL: Interleukine
LPS: Lipopolysaccharide
LT: Lymphocyte T
LPS: Lipopolysaccharide
MALT : associated lymphoid tissu
MICI: Maladies Inflammatoires Chroniques de
l'Intestin
ML: Membrane Lamellaire
MMP: Métallo-protéases
matricielles
MU: Mucine 2
ng: Nanogramme
NLRs: NOD-like receptors
NK: Natural Killer cells
MG: Membrane Germinative
MLN: mesentric lymph node
MyD88: Myeloid differenciation primary
response protein 88
NF-?B: Nuclear Factor ?B
NKT: Natural Killer T cells
nNOS: neuronal NO synthase
NO : Monoxyde d'azote
NOS2: Nitric Oxide Synthase-2
O2- : L'anion superoxyde
OONO- : L'ion
péroxynitrite
PBMC: Cellules mononuclées du sang
périphérique
PBS: Phosphate Buffer Saline
pg: Picogramme
PRR: Pattern Recognition Receptor
RCH: Rectocolite Hémorragique
RPMI: Roswell Park Memorial Instit
STAT: Singal transducer activator of
SVF: Sérum de Veau Foetal
TNF: Tumor Necrosis Factor
TLR: Toll Like Receptor
TNBS: Trinitrobenzenesulfonic acid
TNF-á: Tumor Necrosis Factor-alpha
Treg: Lymphocyte T regulateur
tolDC: Cellule Dendritique
tolérogèn
pig: Microgramme
piM: Micromolaire
NOD: NLR Nucleotide oligomirization
domain-like receptor
PARS: poly-ADP ribosyl synthetase
pM? : Peritonial Macrophage
sIgA: secretory Immunoglobulin A
TNBS: trinitobenzen sulfonic acid
1
Introduction
Introduction :
Les maladies inflammatoires chroniques de l'intestin (MICI)
sont des affections qui résultent d'une inflammation chronique de la
paroi intestinale et sont associées à des désordres
immunitaires graves caractérisés par un
déséquilibre des voies de régulation immunitaires.
Les données épidémiologiques indiquent
une corrélation inverse entre l'incidence des MICI et la
prévalence des helminthiases. En effet, la forte prévalence des
MICI dans les pays développés a été associée
à un faible taux d'exposition aux helminthes. Ces données
appuient l'hypothèse hygiéniste selon laquelle une moindre
exposition aux entéro-pathogènes tels que les helminthes dans
l'enfance conduirait à une maturation inadéquate du
système immunitaire. Il en résulte le développement de
maladies auto-immunes et inflammatoires (Fiasse et al., 2009).
La pathogenèse de ces maladies reste complexe et
implique une large variété de molécules dont les
cytokines, plusieurs études ont rapporté une surexpression des
cytokines pro inflammatoires au cours des MICI, à l'origine d'une
production accrue de métabolites réactifs d'oxygène et de
nitrogène, dont le monoxyde d'azote (NO) (Touil-Boukoffa et al.,
1998 ; Rafa et al., 2010).
Le monoxyde d'azote est un médiateur inflammatoire
important produit principalement par la NO synthase inductible (NOS2), il a
été associé aux lésions les plus
sévères au cours des MICI et des colites expérimentales
(Kolios et al., 2004; Rafa et al., 2010 ; Abdelouhab et
al., 2012 ; Toumi et al., 2013), sa production est
régulée positivement par les cytokines de la voie Th1 (Rafa
et al., 2010).
De plus une étude récente de notre équipe
a démontré une corrélation positive entre la production du
NO in vivo et des cytokines de la voie Th17 (Rafa et al.,
2013).
À travers ces données et à travers les
travaux mettant en exergue le rôle inhibiteur de la membrane lamellaire
hydatique (ML) sur la production du NO in vivo chez la souris et
ex vivo chez des patients atteints d'hydatidose (Steers et al.,
2001 ; Amri & Touil-Boukoffa, 2011 ; 2014), nous nous sommes
penchés sur l'évaluation de l'effet de la membrane lamellaire au
cours des MICI.
La première partie de notre travail a pour but
d'étudier l'effet curatif de la ML extraite à partir du cestode
Echinoccocus granulosus au cours d'un modèle
expérimental de colite induite par le Dextran Sulfate Sodium (DSS), nous
avons examiné son effet sur les paramètres cliniques, ainsi que
les altérations morphologiques et histologiques induites par le DSS. De
plus, nous avons évalué son impact sur la régulation de la
NOS2 à travers la production du NO, in vivo et in vitro
dans notre modèle d'étude.
La deuxième partie de notre travail a ciblé
l'étude de l'effet immunomodulateur de la ML sur la NOS2 et ce, à
travers l'évaluation de la production du NO ex vivo par les
cellules mononuclées du sang périphérique (PBMC) de
patients atteints de rectocolite hémorragique et de maladie de Crohn.
Chapitre I : Généralités
I- Côlon et système immunitaire muqueux
:
1. Anatomie du côlon :
Le gros intestin entoure l'intestin grêle sur trois
côtés et s'étend de la valve iléo-caecale
jusqu'à l'anus en formant la dernière partie du tube digestif. Sa
fonction principale consiste en l'absorption d'eau et d'électrolytes
provenant des résidus alimentaires indigestibles et leur
évacuation de l'organisme sous forme de fèces semi-solides
(Schaffler & Menche ; 2004).
- Le côlon est divisé en quatre parties :
Le côlon ascendant, le côlon transverse, le colon
descendant et le colon sigmoïde (Schaffler & Menche ; 2004).
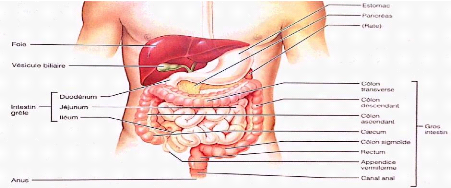
Figure 1 : Anatomie intestinale et organes
digestifs annexes.
2. Histologie du côlon :
Comme celle du tractus digestif, la paroi du côlon est
composée principalement de quatre couches.
De l'intérieur vers l'extérieur :
- La muqueuse : Au niveau de la muqueuse colique on ne trouve
plus de villosités sur la paroi, mais exclusivement des cryptes.
L'épithélium pavimenteux des cryptes est composé
majoritairement de cellules muqueuses caliciformes et de cellules
épithéliales.
- La sous-muqueuse : une mince couche de tissu conjonctif
entre la muqueuse et la couche musculaire.
- La musculeuse : on trouve des fibres musculaires lisses qui
sont mises en action de manière involontaire, elles sont aussi bien
circulaires que longitudinales.
2
- La séreuse (ou adventice) (Schaffler & Menche ;
2004).
3
Chapitre I : Généralités
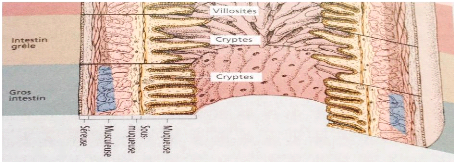
Figure 2 : Histologie intestinale.
3. Système immunitaire de la muqueuse intestinale
:
Les muqueuses de manière générale sont
dotées d'un système immunitaire lymphoïde associé aux
muqueuses, appelé le MALT. Le GALT ou le tissu lymphoïde
associé à la muqueuse intestinal est la partie la plus large et
la plus complexe du système immunitaire. Non seulement, il
reconnaît plus d'antigènes que toute autre partie du corps, mais
il doit aussi faire clairement la distinction entre les organismes invasifs et
les antigènes inoffensifs, tels que les protéines alimentaires et
les bactéries commensales. La réponse habituelle à des
antigènes inoffensifs intestinaux est l'induction de la tolérance
immunologique locale et systémique.
Le GALT peut être subdivisé en sites inducteurs
et en sites effecteurs reliés entre eux par le système
lymphatique. Le site inducteur est formé par des tissus organisés
sous forme de ganglions lymphatiques mésentériques (MLN), de
plaques de Peyer et de follicules lymphoïdes isolés (FLI). En
revanche, le site effecteur est représenté par
l'épithélium intestinal abritant des lymphocytes
intra-épithéliaux (IEL) et d'un chorion fait de tissus conjonctif
et très riche en cellules immunitaires, notamment les plasmocytes
sécréteurs d'IgA. (Abreu, 2010). Les plaques de Peyer contiennent
plusieurs types cellulaires incluant les macrophages, les cellules
dendritiques, les lymphocytes B et les lymphocytes T : TCD8+, TCD4+, TCD3+ et
Tãä (Jung et al., 2010).
Les réponses immunes sont initiées par la
reconnaissance de motifs moléculaires conservés au sein des
espèces microbiennes (PAMPs, pathogens-associated molecular patterns)
par des récepteurs de l'immunité innée appelés PRR
(pattern recognition receptor). Les quatre familles de PRR identifiées
à ce jour comprennent des protéines transmembranaires comme les
récepteurs de type Toll (TLR, Toll-Like Receptor) et les lectines de
type C ainsi que des récepteurs cytoplasmiques tels que les
récepteurs NOD (NLR, Nucleotide oligomerization domain -like receptor).
Ces récepteurs sont exprimés par les cellules
épithéliales et par les cellules présentatrices
d'antigènes comme les cellules dendritiques (DC) et les macrophages.
4
Chapitre I : Généralités
Par ailleurs, les cellules épithéliales de
l'intestin remplissent une fonction de cellules présentatrices
d'antigènes grâce à l'expression des molécules du
CMH I et II à leurs surfaces. Elles jouent un rôle dans les
réponses immunitaires innées et adaptatives au niveau de la
muqueuse intestinale en exprimant à leur surface des récepteurs
de nombreuses chémokines et cytokines. Elles produisent donc de nombreux
signaux immuno-régulateurs, limitant l'inflammation à un
état stable.
Des IEC spécialisées, appelées cellules
Microfold (cellules M) jouent un rôle important dans
l'échantillonnage des agents microbiens présents dans la
lumière intestinale. En effet, elles ont pour rôle la capture
d'antigènes luminaux de micro-organismes à partir de la
lumière intestinale grâce à leur transport
vésiculaire actif (activité d'endocytose) pour la
présentation au système immunitaire de la muqueuse sous-jacente.
Ces cellules M sont concentrées dans les plaques de Peyer et les
follicules lymphoïdes isolées (Neutra et al., 2001 ;
Peterson & Artis ; 2014).
Les cellules de Paneth quant à elles, peuplent la base
des cryptes de Lieberkühn dans l'intestin grêle de la plupart des
mammifères. Elles jouent un rôle important dans la réponse
immunitaire innée via la production de peptides antimicrobiens. Elles
expriment à leur surface des PRR tels que les TLRs et des
récepteurs intra-cytoplasmique tels que le NOD2. Ces récepteurs
reconnaissent des motifs bactériens déclenchant une cascade de
signalisation qui aboutit à l'activation du NF-êB (Ouellette,
2010).
Un autre élément important de la barrière
intestinale implique les immunoglobulines A sécrétoires (sIgA).
Les sIgA favorisent la clairance des antigènes et des micro-organismes
pathogènes de la lumière intestinale en empêchant leur
contact avec les récepteurs des cellules épithéliales,
conduisant ainsi à leur neutralisation dans le mucus et leur
élimination ultérieure par les activités
péristaltiques et mucociliaires (McCole, 2014).
Les cellules dendritiques (DC) présentent les
antigènes à des cellules T CD4 + naïves, selon le
microenvironnement cytokinique, ces cellules T auxiliaires se
différencient vers Th1, Th2, Th9, Th17, Th22. Elles sont alors
activées et circulent ensuite à la lamina propria intestinale,
où elles exercent des fonctions effectrices. À l'état
physiologique et en absence d'agents pathogènes invasifs, les cellules
dendritiques induisent la différentiation des LT vers un profil T
régulateur (Treg). De plus, elles stimulent la sécrétion
d'IgA par les lymphocytes B. Une balance homéostatique est maintenue
entre les cellules Treg et les cellules T effectrices. Les DC jouent aussi un
rôle majeur dans l'échantillonnage des antigènes de la
lumière intestinale, grâce à leur capacité à
exprimer des protéines des jonctions serrés qui leurs permettent
la formation de dendrites trans-épithéliales qui
pénètrent le lumen intestinal et entrent en contact
d'antigènes exogènes (Wells et al., 2011 ; Peterson
& Artis ; 2014).
Les macrophages au niveau de la muqueuse intestinale sont
situés directement sous la couche épithéliale, ils jouent
ainsi un rôle important dans l'échantillonnage des
antigènes de la lumière intestinale (MacDonald et al.,
2011; Bar-On et al., 2011).
5
Chapitre I : Généralités
En réponse à divers stimuli, les macrophages
peuvent subir une activation classique M1 (stimulée par les ligands des
TLR ou IFN-ã) ou alternative polarisation M2 (stimulée par l'axe
l'IL-4 / IL-13). Les macrophages M2, contrairement aux M1, ont une faible
expression de l'IL-12, une forte expression de l'IL-10, du TGF-â, et de
l'arginase-1, et présentent des fonctions anti-inflammatoires et de
réparation tissulaire (Gordon, 2003).
L'épithélium intestinal est l'une des surfaces
muqueuse les plus larges, elle recouvre plus de 400m2,
représenté en une monocouche organisée en cryptes et en
villosités. Il est composé de quatre lignées cellulaires :
Les entérocytes qui ont pour fonction l'absorption, constituent les
cellules épithéliales intestinales (IEC) les plus abondantes. Les
cellules caliciformes productrices de mucus, des cellules
entéro-endocrines hormones productrices et les cellules de Paneth, qui
produisent des peptides antimicrobiens (Figure 3).
L'épithélium intestinal est constitué
d'une couche de cellules épithéliales fortement liées par
des jonctions serrées, formant ainsi une barrière physique
imperméable contre l'invasion des pathogènes. Il sépare
les antigènes de la lumière intestinale des cellules du
système immunitaire muqueux. De plus, il est recouvert d'une fine couche
de mucus qui limite, d'une part, le contact avec les antigènes
bactériens et favorise, d'autre part, la rétention des
molécules antibactériennes produites par les cellules de Paneth
(McCole, 2014).
Les cellules stromales, les lymphocytes B (en particulier les
plasmocytes productrices d'IgA), les lymphocytes T, les macrophages et les
cellules dendritiques de la lamina propria se trouvent directement en dessous
de l'épithélium intestinal. En outre, des sous-ensembles de
cellules T, les lymphocytes intra-épithéliaux (IELs) comprennent
les cellules T conventionnelles, ainsi que les cellules T ãä et les
cellules NKT. Les IELs et certaines cellules dendritiques se positionnent entre
les IECs (Figure3) (Abreu, 2010).
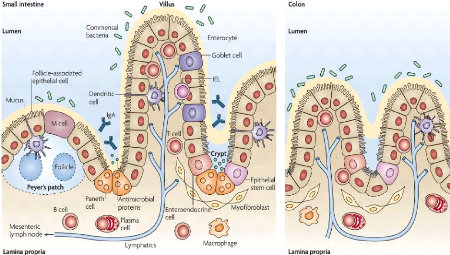
Figure 3 : Anatomie de
l'épithélium intestinal et du système immunitaire de la
muqueuse.
6
Chapitre I : Généralités
II. Les maladies inflammatoires chroniques intestinales
:
1. Les maladies inflammatoires chroniques intestinales
(MICI) :
Les maladies inflammatoires chroniques intestinales (MICI)
regroupent la maladie de Crohn (MC) et la rectocolite hémorragique
(RCH). Ce sont des maladies complexes caractérisées par une
inflammation d'une partie de la paroi du tractus gastro-intestinal. Elles sont
le plus souvent diagnostiquées chez le sujet jeune de 20 à 30 ans
et évoluent par poussées inflammatoires alternant avec des phases
de rémission. Il est actuellement admis que les MICI résultent de
la perte de tolérance du système immunitaire muqueux
vis-à-vis des antigènes de la flore commensale intestinale chez
des sujets génétiquement prédisposés. (Molodecky
& Kaplan ; 2010)
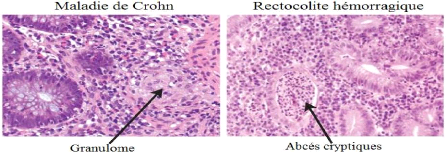
Figure 4 : Caractéristiques
histologiques des MICI (Xavier & Podolsky ; 2007).
2. Définitions et Diagnostic des MICI : 2.1 La
rectocolite hémorragique (RCH) :
La rectocolite hémorragique est une maladie
inflammatoire chronique du côlon, le rectum est touché chez 95%
des patients, avec un degré variable d'atteinte proximale. Sur le plan
histologique, l'inflammation se limite à la muqueuse et consistes-en des
ulcérations, des oedèmes, des abcès cryptiques, une
distorsion des glandes muqueuses, une déplétion des cellules
caliciformes et des hémorragies sur toute la longueur du côlon.
Ces lésions sont accompagnées d'une infiltration par les
leucocytes polymorphonucléaires et les cellules mononuclées. La
RCH évolue par poussées et se manifeste chez le patient par des
diarrhées et des rectorragies (Hendrickson et al., 2002).
2.2 La maladie de Crohn (MC) :
Contrairement à la rectocolite hémorragique, la
MC peut atteindre n'importe quelle partie du tractus gastro-intestinal, de
l'oropharynx à la région anal. Les segments atteints sont
fréquemment séparés par des intervalles de muqueuse
saine.
7
Chapitre I : Généralités
Du point de vue histologique, l'inflammation peut être
trans-murale et peut s'étendre à travers la séreuse,
résultant en la formation de fistules. Il apparait des
ulcérations superficielles au niveau des Plaques de Peyer et des foyers
inflammatoires chroniques s'étendant à la sous-muqueuse, parfois
accompagnés de granulomes. La localisation la plus commune est la
région iléo-caecale (Hendrickson et al., 2002).
2.3 Diagnostic :
Avant de pouvoir confirmer le diagnostic des MICI, il est
important d'exclure l'éventualité d'une infection par des
pathogènes entériques qui pourrait les mimer tels que
Salmonella, Shigella, Campylobacter, Aeromonas, Plesiomonas, Yersinia,
Eschericha coli O157:H7, Clostridium difficile, Giardia lamblia, Histoplasma,
Mycobacterium tuberculosis, et Entamoeba histolytica. (Tableau
I)
Une fois ces infections exclues, d'autres analyses plus
approfondies de diagnostic des MICI sont effectuées. (TabIeau I)
(Hendrickson et al., 2002).
Tableau I : Testes utilisés pour le diagnostic des
MICI (Hendrickson et al., 2002).
|
Tests
|
Résultats
|
|
Tests sérologiques spéciaux
|
pANCA, ASCA
|
|
Analyse des selles
|
Exclusion des bactéries
pathogènes, oeufs et parasites,
sang dans les selles et
leucocytes fécaux
|
|
Evaluation endoscopique
|
OEsophagogastroduodénoscopie avec biopsies, colonoscopie
avec biopsies.
|
|
Evaluation radiologique
|
Tractus gastro-intestinal
supérieur avec l'intestin grêle, entéroclise,
lavement
|
3. Epidémiologie et distribution
géographique des maladies inflammatoires chroniques intestinales
:
Initialement décrites aux États-Unis et en
Europe du Nord, les MICI touchent désormais de nombreuses régions
du globe que l'on pensait jusqu'ici épargnées. Les études
épidémiologiques font ainsi état d'une augmentation de
l'incidence des MICI dans les pays en voie de développement,
parallèlement à leur niveau d'industrialisation (Lotfus &
Edward ; 2004).
En effêt, les MICI ont été principalement
caractérisée comme maladies des pays industrialisés, avec
une prévalence accrue dans le monde développé. Les taux
d'incidence et de prévalence varient selon un gradient nord/sud au sein
des zones géographiques étudiées.
La prévalence de la MC en Amérique du Nord varie
de 44 à 201/100 000 habitants, et celle de la RCH à partir de
37,5 à 238 / 100,000 habitants; en Europe, la prévalence de la MC
varie de
8
Chapitre I : Généralités
8 à 214 /100.000 habitants et celle de la RCH de 21
à 294/100.000 habitants (Cosnes et al., 2011). Bien que les
pays en développement ont traditionnellement rapporté une plus
faible prévalence des MICI, leur incidence est en hausse (par exemple,
Inde et Chine) (Lotfus & Edward ; 2004 ; Molodecky & Kaplan ; 2010).
En Europe du Sud, et au Maghreb, l'incidence paraît
croître encore dans certaines régions.
En Algérie, le taux d'incidence annuel moyen des MICI
connaît une recrudescence. En effet, une étude
réalisée par Boucekkine entre 1981-1985 a montré un taux
d'incidence de 2,17/100.000 habitants par an au niveau de la région du
grand Alger. Une étude récente réalisée au niveau
de la ville de Constantine a rapporté un taux d'incidence de 9,8/100 000
habitants par an, situant notre pays dans la zone d'incidence
intermédiaire (Hammada et al., 2011).
4. EtioIogie:
L'étiologie des MICI a été largement
étudiée au cours des dernières décennies ;
cependant, les facteurs étiologiques de la pathogenèse de ces
maladies ne sont pas encore pleinement compris (Molodecky & Kaplan ;
2010).
4.1. Les facteurs génétiques:
Il existe des variations génétiques dans plus de
100 à 160 gènes distincts qui augmenterait le risque d'apparition
de la MC et de la RCH (Korzenik & Podolsky ; 2006).
Le Caspase recruitment domain family, member 15 (NOD2/CARD15)
a été le premier gène identifié et
spécifiquement associé à la MC (IBD1). Les mutations de
CARD15 associées à la MC ont été impliquées
dans le défaut de clairance des bactéries intracellulaires au
niveau de l'épithélium intestinal humain et également
à la réponse immunitaire altérée aux composants
bactériens, mais aussi au défaut d'activation du facteur
nucléaire -kB (NF-kB) ( Kozernik & Podolsky ; 2006).
De plus l'identification d'une variation au niveau du
gène codant pour la protéine reliée à l'autophagie
ATG16L1 chez les patients atteints de MC confirme l'implication d'un
défaut de clairance des bactéries. En effet, ces variations
induisent des aItérations immunoIogiques, dont les principales sont un
défaut dans la dégradation par autophagie, l'altération de
la présentation des antigènes bactériens aux Lymphocytes T
et une déficience dans la formation de granules dans les cellules de
Paneth au cours de la MC (Gianchecchi et al., 2014).
Des variations au niveau des gènes codant pour des
protéines impliquées dans le maintien de l'integrité de la
barrière éphitéliale ont été égalment
décrites. Le CDH1 est associé à la RCH et à la MC.
Il code pour les protéines d'adhésion A-cadherin, ces
dernières jouent un rôle essentiel dans l'adhésion
cellule-cellule et sont également nécessaires pour la formation
des jonctions serrées.
Le gène codant pour MUC3 a été
associé à la MC et la RCH. Des allèles rares dans MUC3
pourraient coder pour des protéines de mucine avec des
altérations conformationnelles.
9
Chapitre I : Généralités
Étant donné que les O-glycosylation et la
N-glycosylation dépendent de la structure de la protéine de type
mucine, une modification conformationnelle de la protéine pourrait
entraîner une diminution de la glycosylation. Cela pourrait conduire
à une sensibilité accrue aux protéases intestinales
bactériennes et à la dégradation de la mucine, contribuant
ainsi à la rupture de la fonction de barrière (McCole, 2014). Ces
données suggèrent l'implication de l'altération de la
barrière épithéliale dans la pathogenèse des
MICI.
Plusieurs gènes impliqués dans la voie de
signalisation de l'IL-23, spécifiquement IL-23R, JAK2, STAT3, IL-12B
(encodage p40) ont été associés aux MICI, ces
données soulignent la forte implication de l'axe IL-23/IL-17 dans la
pathognie des MICI (Anderson et al., 2011).
4.2. Les facteurs environnementaux:
Les données épidémiologiques et
génétiques ont souligné le rôle probable des
facteurs environnementaux dans la genèse des MICI (Baron et
al., 2005 ; Economou & Pappas ; 2008 ; Guo et al., 2014).
En effet, l'incidence des MICI a tendance à être
plus élevés dans les latitudes nordiques. Plusieurs groupes ont
examiné la variation géographique de l'incidence des MICI dans un
même pays et ont suggéré un gradient nord/sud. De plus, une
étude réalisée au niveau de la ville de Constantine a
montré que la distribution des malades vivants en milieu urbain
était de 88 contre 12 % en milieu rural, soit un ratio de 7,30 (Hammada
et al., 2011).
Les études génétiques ont
démontré que la concordance entre les jumeaux homozygotes varie
de 20 à 62 % pour la MC et de 6 à 19% pour la RCH (Halfvarson
et al., 2007). De plus, les variations du gène NOD2 par exemple
sont retrouvées chez seulement 10 à 50% des patients atteints de
la MC (Lesage et al., 2002).
L'interaction entre les facteurs génétiques et
environnementaux dans la genèse des MICI est souvent expliquée
par l'hypothèse de l'hygiène. Cette hypothèse expliquerait
la prévalence quasiment nulle ou faible des MICI dans les régions
avec une forte prévalence des helminthiases (Ponder, 2013).
L'hypothèse de l'hygiène des maladies
inflammatoires chroniques de l'intestin a été proposée
dans les années 1990 par Weinstock et al, celle-ci stipule que
l'éducation des enfants dans un environnement extrêmement propre
et une exposition réduite aux parasites intestinaux (helminthes en
particulier), affecte négativement le développement du
système immunitaire, ce qui les prédispose à l'âge
adulte aux MICI (Ben-Ami Shor et al., 2013).
D'autre part, la barrière intestinale joue un
rôle clé dans le maintien de l'homéostasie intestinale. Par
conséquent, l'altération de la flore commensale suivant
l'utilisation d'antibiotiques ou la perturbation de la barrière
intestinale par des agents tels que les médicaments anti-inflammatoires
non stéroïdiens (AINS) peut augmenter le risque de contracter la
maladie (Ananthakrishnan ; 2013).
10
Chapitre I : Généralités
De plus, plusieurs facteurs de risque environnementaux, ont
été étudiés dont les plus important sont le
tabagisme et l'apendisectomie (Frolkis et al., 2013 ;
Molodecky & Kaplan ; 2010). Il a été montré
que le tabagisme est un facteur protecteur de la RCH, mais de risque pour la
MC.
L'effet «opposé» du tabagisme sur ces deux
conditions inflammatoires offre la possibilité de définir des
mécanismes impliqués dans les deux maladies. Différents
mécanismes peuvent ainsi être influencés par le tabagisme
dans les deux maladies.
Il a été suggéré, dans la maladie
de Crohn que des changements dans la micro-vascularisation induisent des
lésions ischémiques, le tabagisme aurait un effet négatif
sur ce processus ; des changements comparables dans la circulation
micro-vasculaire n'ont pas été décrits dans la RCH. Le
tabac semble exercer un rôle sur la motilité intestinale ou sur le
mucus au cours de la RCH, mais ce ne sont que quelques-unes des
différentes possibilités (Thomas et al., 2000).
En ce qui concerne l'appendicectomie, elle a aussi des effets
divergents sur la MC et la RCH. L'appendicectomie précoce (avant
l'âge de 20 ans) est associée à une réduction du
risque de la RCH ; Toutefois, elle ne modifie pas le risque de MC et peut
même être associée à une augmentation initiale du
risque.
Des études ont démontrés une association
variable entre les principaux facteurs de stress, l'anxiété ou la
dépression et le risque de développer les MICI (Ananthakrishnan ;
2015).
5. Physiopathologie des MICI :
L'hypothèse la plus répandue suggère que
des réponses immunitaires excessives à l'encontre d'un
sous-ensemble de bactéries entériques commensales, se
développent chez des hôtes génétiquement
susceptibles, les facteurs environnementaux influencent l'apparition ou la
réactivation de la maladie (Sartor, 2006).
Les macrophages et les cellules dendritiques dans la lamina
propria augmentent en nombre et ont un phénotype activé dans les
deux formes des MICI. La production de cytokines pro-inflammatoires et de
chémokines, telles que : l'IL-1f3, TNF-á, IL-6, IL-8, IL-12,
IL-18, IL-23, IL-27 est augmentée dans les MICI (Sartor, 2006).
Les cellules épithéliales intestinales expriment
normalement de faibles niveaux de TLR, ce qui leur permet de résider
dans l'iléon distal et le côlon malgré la concentration
bactérienne élevée. De plus, les TLRs sont exprimés
sur la surface de diverses cellules de la réponse immunitaire
innée. Bien que chaque type de TLR lie un motif bactérien
spécifique, ces signaux convergent par l'intermédiaire du MyD88,
à l'activation de plusieurs voies dont celle du NF-?B. L'activation du
NF-?B stimule l'expression de nombreuses molécules contribuant à
la pathogenèse des MICI. Celles-ci comprennent des molécules
impliquées dans la réponse inflammatoire, telles que : les
cytokines (l'IL-1f3, TNF-á, IL-6), les chémokines, les
molécules d'adhésion (ICAM-1), ainsi que les molécules de
co-stimulation (CD40, CD80, CD86).
11
Chapitre I : Généralités
L'expression de chacun de ces médiateurs
pro-inflammatoires est augmentée en phase active des MICI (Sartor,
2006).
Contrairement à la réponse immunitaire
innée, qui est activée de façon similaire dans les deux
formes des MICI, les profils de cellules T sont disparates dans la MC et la
RCH. En effet, un profil cytokinique Th1 caractérisé par la
production de l'IFN-ã et de l'IL-12 a été associé
à la MC (Neurath, 2014).
Une étude récente de notre équipe a
démontré que l'axe IL-12/IFN-ã est déterminant dans
l'induction de la NOS2 chez des patients atteints de MC en phase active (Rafa
et al., 2010).
À l'inverse, la prédominance d'un profil Th2 a
été rapportée au cours de la RCH caractérisé
par la sécrétion de l'IL-5, l'IL-4 et l'IL-13 (Neurath, 2014). Il
a été démontré dans un modèle de colite Th2
induite par l'oxazolone que l'IL-13 produite en forte quantité par des
cellules NKT atypiques serait impliquée dans l'altération de la
barrière intestinale et ce, via l'induction de l'apoptose des cellules
épithéliales et l'altération des protéines de
jonctions (Baumgart & Carding ; 2007).
De plus, une forte expression de l'IL-23 a été
également rapportée chez les patients atteints de MICI. L'axe
IL-23/IL-17 joue un rôle particulièrement important dans le
développement de l'inflammation intestinale. L'IL-23 est une cytokine
pro-inflammatoire qui joue un rôle important dans le maintien et
l'amplification de la réponse Th17 et l'inhibition de la réponse
Treg (Sarra et al., 2010 ; Powrie, 2012). Une forte expression des
cytokines IL-6, IL-1? a été observée au niveau de la
muqueuse colique de patients atteints de MICI (Neuman, 2007). Ces cytokines
favorisent la différenciation des lymphocytes T naïfs vers un
profil Th17.
Dans la lamina propria, les cellules Treg jouent un rôle
majeur dans le maintien de l'homéostasie intestinale et suppriment les
réponses immunitaires aux microbes commensaux résidents et ce,
à travers la production des cytokines immuno-régulatrices telles
que: l'IL-10, le TGF-â et l'IL-35. Les Treg pourraient avoir un
rôle critique dans la modulation du spectre clinique de la maladie. Ces
cellules seraient réduites en nombre ou absentes dans la lamina propria
des patients atteints de MICI conduisant à une régulation
insuffisante de la réponse immunitaire (MacDonald et al.,
2011). En plus des cellules T, il a été
démontré que les cellules Breg ont également un rôle
régulateur de l'inflammation intestinale. Contrairement aux cellules
Treg, ces cellules ne sont vus que dans les états l'inflammatoires et
suppriment la progression plutôt que l'initiation de la colite murine
(Xavier & Podolsky ; 2007).
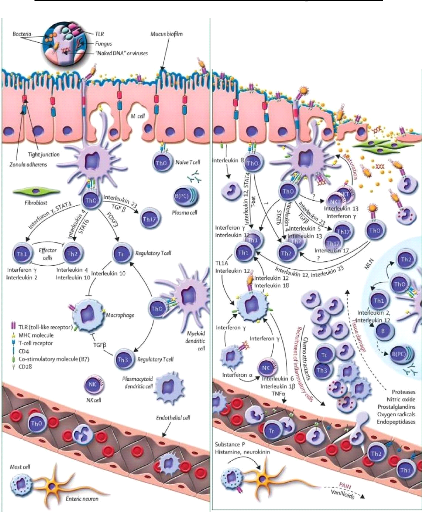
12
Chapitre I : Généralités
|
Figure 5 : Système immunitaire
intestinal. Etat physiologique (à gauche), Durant les MICI (à
droite) (Baumgart
& Carding ; 2007). M-cell=microfold cell
(a specialised epithelial cell). Th=T helper cells. Th0=naive T cell. Th, Th1,
Th2, Th17=effector T cells. Tr, Th3=regulatory T cells. B=B cell. MLN=mesentric
lymph node. B(PC)=plasma cell. NK=natural killer cell. NKT=natural killer T
cells.
|
13
Chapitre I : Généralités
6. MICI et monoxyde d'azote (NO) :
Le monoxyde d'azote (NO) est un radical libre avec une
réactivité modérée en comparaison avec d'autres
espèces, ce qui donne lieu à une multitude de fonctions de
régulation spécifiques d'organe. Cette molécule fortement
diffusible est synthétisé à partir de la L-arginine par la
NO synthase (NOS). Trois isoformes ont été identifiés :
deux sont constitutivement présentes, la nNOS neuronale et la eNOS
endothéliale. La troisième isoforme appelé NOS inductible
(NOS2) est exprimée après stimulation par le lipopolysaccharide
(LPS) et / ou des cytokines pro-inflammatoires IFN-X, le TNF-á, l'IL-1,
et l'IL 6 (Touil-Boukoffa et al., 1998).
Le NO est produit tout au long du tractus gastro-intestinal.
Il est jugé important dans les deux événements
physiologiques et physio-pathologiques en fonction de la quantité de NO
produit. La Production et la sécrétion de haute concentration de
NO par les cellules infiltrantes peut conduire à la perpétuation
de la lésion tissulaire locale. Certaines données indiquent que
les cytokines pro-inflammatoires induisent l'expression de la NOS2 et sont
activation dans les cellules épithéliales du côlon.
Il a été rapporté que le NO
excédentaire produit par la NOS2 peut aggraver les
caractéristiques clinico-pathologiques des MICI et des colites
expérimentales par cytotoxicité directe, par l'activation des
neutrophiles, la vasodilatation, une diminution du tonus des muscles lisses,
une augmentation de la production de nitrosamines, et l'interaction avec
l'anion superoxyde pour former le peroxynitrite. Ce dernier est
considéré comme un oxydant puissant qui réagit avec les
protéines, les lipides et est un puissant initiateur de dommages
à l'ADN. Le peroxynitrite est un stimulus obligatoire pour l'activation
de l'enzyme nucléaire poly-ADP ribosyle synthetase (PARS), ce qui peut
conduire à une augmentation de la perméabilité des
cellules épithéliales. La voie peroxynitrite-PARS peut contribuer
à des lésions cellulaires dans un certain nombre de situations
physiopathologiques et a été impliquée dans la survenue de
l'inflammation intestinale et ce, en induisant l'apoptose des cellules
épithéliales (Kolios et al., 2004).
14
Chapitre I : Généralités
7. Traitements conventionnels et biologiques
(biothérapies) :
7.1 : Traitements conventionnels :
Jusqu'à récemment, les techniques
médicales de traitement des MICI étaient relativement
limitées comprenant essentiellement les composants de l'acide
5-Aminosalicyllique (5-ASA), Corticostéroïdes et l'azathioprine
6-mercaptopurine. A ces dernières, viennent s'ajouter le
Méthotrexate, des inhibiteurs de Calcineurine tels que la cyclosporine,
les thiopurines, et l'infliximab (Remicade ; Centocor) un anticorps monoclonal
chimérique dirigé contre le tumor-necrosis factor-á
(TNF-á) (Bernstein, 2015 ; Kozernik & Podolsky ; 2006).
Bien-que nombre de patients répondent et maintiennent
un état de rémission grâce à ces thérapies
conventionnelles, elles restent néanmoins inadaptée pour une
certaine catégorie de patients atteints de MICI, de ce fait, de
nombreuses nouvelles approches thérapeutiques ciblant des
molécules précises au niveau des différentes voies de
signalisation impliquées dans le processus physiopathologique des MICI
(Kozernik & Podolsky ; 2006).
8.2 : Traitements biologiques (biothérapies) :
De nombreuses thérapies biologiques ont
été développées et ont pour but de bloquer une
variété de cytokines impliquées dans l'activation des
cellules T ainsi que de nouvelles approches qui interviennent dans d'autres
étapes du processus physiopathologique (Tableau II) (Kozernik &
Podolsky ; 2006). Les différentes approches sont résumées
dans le tableau II.
15
Chapitre I : Généralités
Tableau II : Nouvelles approches thérapeutiques
pour le traitement des MICI.
|
Approches
thérapeutiques
|
Agents
|
Cible
|
Classe
thérapeutique
|
Maladie
|
Phase
|
|
Différenciation des
cellules T
|
ABT-974
|
IL-12
|
mAb
|
MC
|
III
|
|
Atlizumab/
MRA
|
IL-6
|
Récepteur mAb
|
MC
|
I/II
|
|
Daclizumab/
basiliximab
|
CD25
|
mAb
|
RCH
|
II
|
|
Visilizumab
|
CD3
|
mAb
|
RCH
|
I/II
|
|
Cytokines pro-
inflammatoires/ voix
de signalisation
|
Certolizumab
(CDP-870)
|
TNFá
|
Fragment
PEG-Ab
|
MC
|
III
|
|
Adalizumab
|
TNFá
|
Petite molécule
|
MC
|
III
|
|
Fontolizumab
|
IFNã
|
Peptide
|
MC
|
II
|
|
Molécules
d'adhésions
sélectives
|
Alicaforsen
|
ICAM1
|
Anti-sens
|
RCH
|
II
|
|
Natalizumab
|
á4
|
mAb
|
MC
|
III
|
|
MLN02
|
á4â7
|
mAb
|
RCH
|
III
|
|
Réparation
intestinale
|
EGF
|
Inconnue
|
Peptide
|
RCH
|
III
|
|
Hormone de
croissance
|
Inconnue
|
Peptide
|
MC
|
II
|
|
Autres
|
Ovule de
Trichuris suis
|
Inconnue
|
Helminthe
|
MC/RCH
|
I et II
|
|
Probiotiques/
prébiotiques
|
Equilibre de la
flore intestinale
|
N/A
|
MC/RCH
|
II/III
|
|
Greffe
autologue de
moelle osseuse
|
Lymphocytes T
|
N/A
|
MC
|
I
|
Légendes du Tableau II : Ab, Anticorps ; MC, Maladie de
Crohn ; EGF, epidermal growth factor ; ICAM ; intercellular adhesion molecule;
IL, interleukin; IFN, interferon; mAb, anticorps monoclonal; N/A, Pas
disponible ; PEG, polyethylene glycol ; PPAR, peroxisome proliferator-activated
receptor; TNF, tumour-necrosis factor; RCH, rectocolite hémorragique,
Phase : Phase des essais clinique en cours.
16
Chapitre I : Généralités
III. Les modèles expérimentaux des MICI :
Il existe à l'heure actuelle plusieurs modèles
animaux des MICI. Bien qu'aucun des modèles animaux actuels ne
reproduise les MICI humaines entièrement, des modèles animaux
d'inflammation intestinale ont fourni des indications utiles sur la
pathogenèse de la réponse inflammatoire intestinale. Les
modèles animaux des MICI sont soit des modèles qui se
développent spontanément ou qui sont induits. Pour les
modèles animaux qui se développent spontanément, il existe
deux souches de souris, les C3H/HeJBir et les SAMP1/Yit. En ce qui concerne les
modèles induits, ils incluent les animaux qui ont été
traités avec des agents qui favorisent l'inflammation intestinale comme
par exemple le Trinitrobenzene sulfonic acid (TNBS) ou le Dextran sulfate
sodium (DSS) (Wirtz & Neurath ; 2007).
Les rongeurs qui ont été
génétiquement manipulées par un ciblage génique ou
par transgénèse, ceux-ci incluent les souris chez les quelles on
a altéré une fonction cytokinique comme les souris IL-10
knockout, les souris IL-2 knockout, les souris TNF-á et les souris
STAT-4 transgéniques. D'autre part, ils existent des rongeurs chez
lesquels on a induit une altération des fonctions des cellules T, par
exemple les souris knockout pour le récepteur á ou â des LT
et des rats transgéniques pour le HLA-B27 (Wirtz & Neurath ;
2007).
Enfin, des animaux immuno-déficients chez lesquelles
des populations de cellules qui interviennent dans l'inflammation intestinale
ont été transférés, nous citerons le transfert
adoptif de Cellules T CD4+ exprimant des niveaux élevés de CD45RB
(CD45RBhi) dans des souris SCID ou Rag -/- qui sont
déficientes en lymphocytes B et T, ce qui a pour résultat une
inflammation intestinale accompagnée de diarrhée et de perte de
poids (Hendrickson et al., 2002).
1. Modèle de colite chimio-induite par le DSS :
Le Dextran est un polymère de glucose complexe avec un
haut poids moléculaire il est synthétisé par certaines
bactéries à partir du glucose, comme Leuconostoc spp
et Streptococcus spp. Le Dextran sulfate sodium (DSS) est un
dérivé polyanionique du Dextran, produit par une
estérification avec l'acide chlorosulphonique. C'est donc un
polysaccharide héparine-like contenant plus de 3 groupements sulfate par
molécule de glucose.
Le modèle de colite induite par le Dextran Sulfate
Sodium (DSS) a été largement validé. Le modèle de
colite expérimentale reproduit les caractéristiques clinique et
anatomopathologique des MICI notamment la RCH selon sa concentration et sa
durée.
La colite est généralement induite par addition
de DSS à l'eau de boisson. Selon la concentration, la durée et la
fréquence d'administration de DSS, les animaux peuvent développer
une colite aiguë ou chronique. La colite survient chez des souris BALB/c
après l'administration du DSS dissout dans l'eau de boisson pendant 7
jours. Cette durée est considérée comme un cycle (Okayasu
et al., 1990). L'alternance de trois cycles de DSS
séparés par un intervalle d'une semaine sans DSS provoque une
colite chronique. La colite aiguë est induite quant à elle en
utilisant des concentrations relativement élevées de DSS (entre 3
et 10%) administrés en continu pendant de courtes périodes,
généralement de 4 à 14 jours.
17
Chapitre I : Généralités
Durant la semaine d'administration, la
sévérité de la colite est évalué en
utilisant le Disease Activity Index (DAI), qui se base sur l'observation de
plusieurs manifestations comme la perte de poids, la consistance des selles
(selles molles, diarrhées liquides) Présence de sang (au niveau
de l'anus, dans les selles) (Cooper et al., 1993).
L'inflammation est généralement limitée
au côlon; les caractéristiques macroscopiques comprennent un
raccourcissement du côlon qui devient oedémateux avec des zones
d'hémorragies et d'ulcérations. Histologiquement, l'inflammation
est superficielle, affectant principalement la muqueuse, mais peut
s'étendre à la sous-muqueuse et à la musculeuse-muqueuse.
Elle est caractérisée par des ulcères superficiels, un
oedème muqueux, la perte des cellules caliciformes, une distorsion des
cryptes et des abcès cryptiques ; il y a une infiltration de cellules
inflammatoires dans la muqueuse et la sous-muqueuse, ces cellules
inflammatoires comprennent des neutrophiles, macrophages, cellules plasmatiques
et quelques lymphocytes.
Bien que l'inflammation dans la colite aiguë induite par
le DSS est continue, sa gravité varie, affectant plus le côlon
ascendant et le caecum chez le cochon de Guinée et le hamster, tandis
qu'elle est plus sévère dans le côlon descendant chez les
souris BALB / c.
Le mécanisme exact à travers lequel le DSS
pourrait induire une colite est inconnu. Il existe plusieurs hypothèses,
la plus plausible serait l'augmentation de la perméabilité de
l'intestin causée par la réduction des protéines de
jonction tel que zona occludens-1 directement par le DSS.
Il a été démontré que les
groupements sulfate avait un rôle potentiel dans l'induction de la colite
par le DSS. En effet, les dérivés soufré serait capable de
provoquer une inflammation colique après transformation du H2S en
HS- (Roediger et al., 1996).
Par ailleurs, des bactéries sulfato-réductrices
ont été mises en évidence au niveau de la muqueuse
colique. Ces bactéries exercent un effet délétère
sur la muqueuse en transformant les groupements sulfates en sulfides
d'hydrogène très toxiques pour les colonocytes. La
présence de ces bactéries est par ailleurs requise pour
l'apparition de la colite expérimentale après traitements des
animaux avec du DSS (Solomon et al., 2010).
18
Chapitre I : Généralités
IV. Helminthes et maladies inflammatoires chroniques
intestinales :
1. Introduction :
Parmi les parasites pouvant infecter l'homme, on distingue
les protozoaires, organismes unicellulaires et les helminthes, ou vers, qui
sont des métazoaires d'organisation plus complexe. Les helminthes
regroupent les némathelminthes (vers ronds), par exemple, les
trichocéphales (Trichuris trichiura (T. trichiura),
Trichuris suis (T. suis) et Trichuris vulpis (T.
vulpis)), et les plathelminthes (vers plats) représentés par
les trématodes non segmentés (douves et schistosomes) et les
cestodes segmentés (ténia, Echinoccocus sp) (Laclotte
et al., 2008).
Les données épidémiologiques rapportent
une forte prévalence des helminthiases dans les pays
sous-développés, contrairement aux pays développés
où l'hygiène est de rigueur.
Il est intéressant de noter que les helminthes ont
co-évolué avec leur hôte depuis des millénaires, ils
induisent un état de tolérance afin de survivre dans l'organisme
de leur hôte aussi longtemps que possible. Pour cela, les helminthes sont
capables, grâce à divers mécanismes, de moduler finement le
système immunitaire de l'hôte à fin d'échapper
à celui-ci (Versini et al., 2015).
L'hypothèse de l'hygiène des MICI propose
qu'une modification du niveau d'exposition aux agents pathogènes et plus
spécialement aux helminthes, affecte négativement le
développement et l'entretien des circuits de régulation
immunitaires qui normalement permettent une protection contre ces maladies. Les
helminthiases sont d'extrêmement puissants inducteurs des circuits de
régulation immunitaires. Ainsi, la perte de ces infections chez les
enfants et les adultes, une conséquence de l'hygiène et des
fortes mesures de santé publique, peut être un facteur important
dans l'étiologie des MICI. Plusieurs études cliniques et
épidémiologiques soutiennent ce concept. Les recherches portant
sur l'utilisation des helminthes pour traiter la maladie de Crohn et la
rectocolite hémorragique suggèrent que l'utilisation des
helminthes représente une approche intéressante au cours des MICI
à la fois pour le traitement et la prévention (Elliott &
Weinstock ; 2012).
2. Effets des helminthes sur la réponse
immunitaires au cours des MICI :
Les mécanismes d'évasion immunitaire des
parasites dépendent eux-mêmes d'une forme de dialogue
moléculaire entre l'agent pathogène et l'hôte et, à
leur tour, de nombreux parasites dépendent de signaux
moléculaires de l'hôte pour leur développement.
2.1 Interaction hôte-Echinoccocus granulosus :
L'hydatidose, est une helminthiase chronique endémique
causée par une infection par le stade larvaire du Cestode
Echinococcus granulosus. C'est l'une des maladies zoonotiques les plus
répandues chez l'homme dans le monde (Siracusano et al.,
2012).
L'hydatidose est répandue dans les pays des zones
tempérées, y compris l'Amérique du Sud, l'ensemble de la
région méditerranéenne, plus spécialement l'Afrique
du nord, mais aussi la Russie, l'Asie centrale, la Chine et l'Australie
(Siracusano et al., 2012).
19
Chapitre I : Généralités
Au cours de l'hydatidose, les antigènes
d'Echinoccocus granulosus modulent la polarisation des lymphocytes T
vers la voie Th2. Ceci est confirmé par les niveaux d'IgG4, d'IgE et
l'éosinophilie, retrouvée au cours de cette infection (Shambesh
et al., 1997).
Les données immunologiques montrant une forte
production in vitro d'IL-4, IL-5, IL-6, IL-10 et IFN-ã par les patients
atteints d'hydatidose, ont confirmé que la réponse immunitaire
humaine à l'infection par E. granulosus est principalement
régulée par l'activation des cellules Th2, mais aussi par les
cellules Th1 (Siracusano et al., 2012). Des résultats
récents suggèrent que l'IL-4 et l'IL-10 entravent la
réponse Th1 protectrice de l'hôte contre le parasite et permettent
à ce dernier de survivre chez les patients hydatiques (Amri et
al., 2009).
Par ailleurs, Il a été démontré
que la ML exerce d'une part, un effet anti-inflammatoire et
immuno-régulateur qui se traduit par la diminution de l'expression de la
NOS2, des cytokines pro-inflammatoires majeures (axe IL-1??IL-17A) et d'autre
part, par l'augmentation de la cytokine immuno-régulatrice : IL-10 au
cours d'un modèle de colite expérimentale induite par le DSS
(Soufli et al., 2015).
2.1.1 La membrane lamellaire (ML) et l'immunité de
l'hôte :
Une fois que le kyste hydatique est complètement
formé, la deuxième phase de l'infection par E.granulosus
à lieu. Elle se caractérise par une réponse de type
Th2, en corrélation avec la sensibilité à la maladie,
impliquant l'élévation de l'IL-4, IL-5, et de l'IL-10 et une
diminution de l'IFN? et du TNF-á. Cela suggère que la
membrane lamellaire joue un rôle important dans l'orientation de la
réponse immunitaire de l'hôte (Diaz et al ., 2011).
Le parasite élabore deux mécanismes
d'échappement, le premier passif par l'enkystement et le deuxième
actif par l'immuno-modulation de la réponse immunitaire de l'hôte,
la ML est la seule structure du parasite qui soit en contact avec les cellules
de l'hôte, et semble être l'un des facteurs clés de la
stratégie de survie du parasite par la modulation de la réponse
immunitaire de l'hôte (Diaz et al ., 2011).
Des travaux antérieurs ont montré que la ML
d'Echinococcus granulosus augmente la production de l'IL-4, IL-10 et
TGF-â par les leucocytes de l'hôte infecté. Cela
améliore la survie du parasite par l'inhibition des réponses
effectrices notamment la Th1 protectrice de l'hôte. La ML d'E.
granulosus n'active le complément que très peu,
contrairement au liquide hydatique du kyste et aux protoscolexes. C'est en
grande partie la conséquence de l'activité du facteur H de
l'hôte, inhibiteur du complément, qui est présent dans les
fluides extracellulaires, et se concentre dans la ML (Diaz et al.,
2011). De plus, il a été rapporté que la ML
d'Echinoccocus granulosus induirait la production de l'IL-10 et des
cytokines de la voie Th2 telles que l'IL-4 et l'IL-13 et induirait une
activation alternative des macrophages M2 (Amri, 2012).
3. La membrane lamellaire hydatique :
E. granulosus se développe habituellement en
un grand kyste uniloculaire turgescent, qui se développe à
travers une augmentation du diamètre. La membrane germinative (MG) se
trouve vers l'extérieur de la membrane plasmique apicale (de son
tégument syncytial) qui porte des
20
Chapitre I : Généralités
microtriches. La MG est séparée des cellules de
l'hôte et / ou de sa matrice extracellulaire par la membrane lamellaire
(ML).
La membrane lamellaire est considérée comme
l'élément crucial de la relation hôte-parasite, c'est une
gaine acellulaire, riche en glucides, sécrétée par la MG.
La ML atteint jusqu'à environ 3 mm chez E. granulosus. La ML
est liée au glycocalyx cellulaire. Toutefois, seule la couche la plus
interne de cette structure massive est susceptible d'être ancré de
manière covalente à la membrane tégumentaire de la MG.
Ainsi, la ML est décrite à juste titre comme une matrice
extracellulaire spécialisée, trouvé seulement dans le
genre Echinococcus, évolutivement conçu pour
préserver l'intégrité physique des métacestodes et
pour protéger les cellules de la MG de l'immunité de l'hôte
(Diaz et al., 2011).
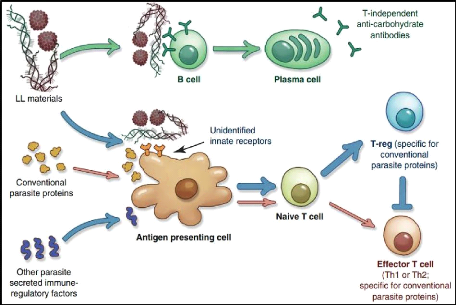
Figure 6 : Les réponses immunitaires
de l'hôte dirigées contre la membrane lamellaire du kyste
hydatique (Diaz et al., 2011).
3.1 Structure de la membrane lamellaire hydatique :
3.1.1 Ultrastructure :
La ML est une structure macroscopique cohérente et
élastique, un maillage tridimensionnel de fibrilles hydrophiles
hautement hydratés. Sous le microscope électronique à
transmission, ces fibrilles sont irrégulièrement disposées
et d'environ 10 nm de diamètre. La ML d'E. granulosus se
compose, en plus du maillage fibrillaire, de granules naturellement denses aux
électrons, se disposant individuellement ou en amas. La ML doit son nom
aux lamelles concentriques qu'on observe sous le microscope optique (Diaz
et al., 2011).
21
Chapitre I : Généralités
3.1.2 Structure moléculaire :
Les hydrates de carbone abondants qui caractérisent la
ML se trouvent dans le maillage fibrillaire. Ce dernier est formé par un
type majeur de glycoprotéines fortement glycosylées, les mucines,
portant essentiellement que des O-glycanes. La composition en monosaccharides
de la ML, est formée seulement de galactose (Gal),
N-acétylgalactosamine (GalNAc) et N-acétylglucosamine
(GlcNAc).
Par ailleurs, il a été démontré
que la paroi du kyste d'E. granulosus contenait de grandes
quantités de myo-inositol hexakiphosphate (InsP6).
4. Effet immunomodulateur des helminthes chez l'homme et
l'animal : 4.1 Données chez l'homme :
Deux rapports rapportant l'utilisation des helminthes pour le
traitement des MICI chez l'homme, Suggèrent que l'exposition aux
helminthes a un effet bénéfique sur la MC et la RCH. Dans ces
études, les patients RCH et MC ont été traités
directement avec les oeufs de Trichuris suis (TSO), résultant
en une amélioration clinique significative chez près de 80% des
patients MC et des effets plus modestes chez les patients RCH (Summers et
al., 2005).
4.2 Données chez l'animal :
Une variété de modèles animaux de colite
ont été développés. Ces modèles reproduisent
un grand nombre des particularités et caractéristiques des MICI
humaines.
Même si aucun des modèles ne représente
complètement les MICI chez l'homme, ils ont néanmoins
été extrêmement utiles dans la compréhension de leur
pathogenèse. La première publication sur la modulation par les
helminthes d'une colite murine a montré que les aspects de la colite
expérimentale induite par le DSS étaient améliorés
chez les animaux infectés par le ténia Hymenolepis
diminuta (Reardon et al., 2001).
Plus récemment, une étude menée au sein
de notre équipe a mis en évidence l'effet protecteur de la
membrane lamellaire d'Echinoccocus granulosus au cours d'un
modèle de colite induite par le DSS (Soufli et al., 2015).
D'autres travaux sur un modèle de colite induite par le
dinitrobenzène acide sulfonique (DNBS) ont montré que l'infection
de souris par le nématode parasite, Trichinella spiralis, avait
un effet protecteur. De plus, une étude a utilisé les
protéines solubles de S. mansoni au cours d'un modèle de
colite induite par le TNBS (Hunter & McKay ; 2004).
En outre, plusieurs études ont rapporté
l'utilisation des helminthes et de leurs dérivés pour le
traitement au cours de modèles expérimentaux d'autres maladies de
nature inflammatoire, tel que la polyarthrite rhumatoïde, la
sclérose en plaque et le diabète de type 1 (Bashi et
al., 2015).
|
Souris BALB/c
|
|
|
|
Eau de boisson
|
|
|
Témoin (n=4)
DSS (n=4)
DSS+ML (n=4)
DSS a 3% dans l'eau de boisson

Extrait soluble de la ML
Injection IP de l'extrait soluble de la ML.

j0 j1 j 2 j3 j4 j5 j6 j7 j8 j9 Jours
Euthanasie des animaux à J9
Récupération des
macrophages
péritonéaux
Lavage péritonéale avec PBS stérile pH=7
Ponction cardiaque
Récupération du sang sur
tube à EDTA
Récupération du côlon
Mesure de la longueur du
côlon
Récupération du plasma
Centrifugation 4000rpm à10min
Récupération des surnageants de culture
Mise en culture dans du DMEM 20 à 22h à 37°C,
5%CO2
Adhésion 1h30

Dosage du NO par la méthode de Griess modifiée

Etude histologique Coloration H&E
Centrifugation 3000rpm à 10min
Fragments du côlon distal

Kyste hydatique
Extraction
Membrane lamellaire
Sonication (ML) Broyage
Décontamination Décontamination

Extrait brut Extrait soluble
|
Patients atteints de MICI
|
|
|
Isolement PBMC sur gradient de Ficoll
Prélèvements sanguins
Mise en culture pendant 20h avec du RPMI 1640 à 37°C,
5% CO2
Maladie de Crohn (n=13)
Rectocolite hémorragique (n=4)

Prélèvements sanguins
Isolement PBMC sur gradient de Ficoll
Mise en culture pendant 20h avec
du RPMI 1640 à
37°C, 5% CO2
+/-

Concentrations croissantes de l'extrait brut [ML]=10/25/50/60
ug/ml
Surnageants de culture
+/ +/-

Concentrations
croissantes
[IL-4]=1/10/100 ng/ml
Concentrations
croissantes de
l'extrait
brut
[ML]=10/25/50/60
ug/ml
|
Dosage du NO par la
méthode de Griess
modifiée
|
Surnageants de culture
|
22
Chapitre II : Matériel & Méthodes
I. Matériel:
1. Matériel biologique : 1.1 Animaux :
Notre étude a été réalisée
sur des souris BALB/c femelles fournies par l'institut pasteur de Kouba ;
Alger. Les souris ont ensuite été placées au niveau de
l'animalerie de la faculté des sciences biologiques, ayant accès
libre au pain comme unique aliment et à l'eau courante (ad libitum) sous
des conditions climatique stable avec un cycle de lumière de 12h. Les
souris BALB/c femelles, âgées de 6 à 8 semaines et pesant
entre 20 et 24g, ont été réparties en 3 lots de 4
souris.
Tableau III : Randomisation des souris par
groupes.
|
Paramètres
Groupes
|
Traitement
|
|
Groupe 1 Témoins
|
Aucun traitement
|
|
Groupe 2 DSS
|
DSS à 3% (m/v) dans l'eau de boisson pendant 5jours
|
|
Groupe 3 DSS + ML
|
DSS à 3% (m/v) dans l'eau de boisson pendant 5jours et
injection IP de la ML à partir de J2 après l'induction de la
colite et pendant 7jours.
|
1.2 Echantillons sanguins :
Le sang a été prélevé dans des
tubes citrate chez des patients consentant atteints de MICI. Ses derniers ont
été fournis par: CHU Mustapha bacha, EPH de Ain taya et EPH de
Rouiba. Les prélèvements vont servir à l'isolement des
cellules mononuclées du sang périphérique (Tableau IV).
Tableau IV : Données clinique des
Patients.
|
Patients
Paramètres
|
MC
|
RCH
|
|
Nombre (n)
|
13
|
4
|
|
Age (années)
|
34#177;12
|
34#177;12
|
|
Sexe
|
4F-9H
|
1F-3H
|
|
Thérapies
|
Immunosuppresseurs/
Anti-inflammatoires
|
Corticoïdes
|
F : femme ; H : homme
1.3 La membrane lamellaire hydatique :
La membrane lamellaire a été
récupérée à partir de kystes hydatiques pulmonaires
humains (n=2) prélevés sur des patients atteints d'hydatidose au
niveau du service de chirurgie thoracique, CHU Mustapha bacha Alger.
23
Chapitre II : Matériel & Méthodes
1.4 Les cytokines :
La cytokine recombinante humaine IL-4(Cell signaling) a
été utilisée pour l'induction des cultures de PBMC.
2. Matériel non biologique :
- Dextran sulfate sodium (DSS) (Consultancy AB, Sweden), est
un polymère de polysaccharide sulfatés, de poids
moléculaire varient entre 36 000 Da - 50 000Da.
- Milieux de culture :
? Dulbecco's Modified Eagle's Medium (Sigma) enrichi par
l'addition de 10% de SVF, 1% d'antibiotique er de L-Glutamine à 1mg/ml
préalablement décomplémenté à +56°C,
pendant 30min.
? RPMI (Roswell Park Memorial Institute medium/Sigma Aldrich)
enrichi avec 5% de sérum de veau foetal (SVF) préalablement
« décomplémenté » à +56°C, pendant
30 min.
- Antibiotiques : pénicillines10000 UI-streptomycine
10mg/ml (Sigma).
- Griess A (a-naphtylamine) et Griess B (acide sulfanilique).
- EDTA (Ethylène Diamine Tétraacétique).
- PBS: KH2PO4, NaCl, KCl, Na2HPO4.
- Ficoll 1077 SIGMA Histopaque®-1077 sterile-filtered,
density: 1.077 g/mL
-Pierce High Capacity Endotoxin Removal kit (Life
Technologies)
- Hematoxylin (Sigma Aldrich)
- Eosin (Sigma Aldrich)
- Eukitt® (Fluka analytical, Sigma Aldrich)
II. Méthodes :
1. Préparation de l'extrait de la membrane
lamellaire :
L'extrait brut de la membrane lamellaire hydatique est
préparé selon le protocole décrit par (Amri et al.,
2012). Le liquide hydatique est aspiré à l'aide d'une
seringue, la membrane du kyste est ensuite lavée plusieurs fois au PBS
stérile contenant 300UI de pénicilline et 0.3 mg/ml de
streptomycine et congelée pendant une nuit.
La membrane lamellaire est ensuite séparée de la
membrane germinative dans un environnement stérile ; elle est
lavée plusieurs fois avec un tampon PBS stérile (pH : 7.4)
contenant 4% d'antibiotiques. Elle subit par la suite plusieurs cycles de
sonication de 10s pendant 10min dans du tampon PBS contenant un cocktail
d'anti-protéases jusqu'à l'obtention d'une solution
homogène. Par la suite cette solution est laissé à
décanter à 4°C, le surnageant qui en résulte
représente l'extrait brut de la membrane lamellaire, il est ensuite
récupéré et conservé à -20°C et servira
à l'induction des cultures des PBMC.
24
Chapitre II : Matériel & Méthodes
Pour son utilisation in vivo dans un modèle de
colite induite par le DSS, l'extrait soluble de la ML est préparé
après broyage mécanique dans un tampon PBS stérile (pH :
7.4) contenant des anti-protéases.
Afin d'éliminer toute contamination pouvant
interférer avec l'effet de la ML nous avons procédé
à la décontamination des extraits brut et soluble par un kit
d'élimination d'endotoxines, Endotoxin Removal kit (Life technologies).
Cela a été réalisé selon les instructions du
fabricant.
2. Induction d'une colite aigue par le Dextran Sulfate
Sodium (DSS) chez des souris BALB/c :
La colite expérimentale est induite après
administration de 3% de DSS ad libitum dans l'eau de boisson à
des souris BALB/c pendant 5 jours. Les souris ont été
randomisé en 3 groupes de 4souris chacun (Figure 7).
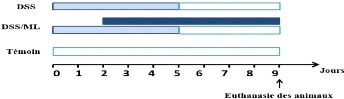
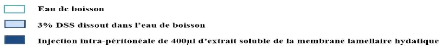
Figure 7: Schéma
expérimental.
La solution de DSS à 3% est préparée
fraichement chaque jour, les souris sont pesées chaque jour et les
paramètres cliniques de la colite le poids, saignements rectaux,
consistance des selles ont été contrôlés
quotidiennement chez toutes les souris, durant la période
expérimentale afin d'évaluer la sévérité de
l'inflammation tout au long de l'expérimentation. Chacun de ces
paramètres est évalué sur une échelle de 0 à
4 afin de calculer le «Disease Activity Index» (DAI), le DAI est
établis tous les jours comme suit (Cooper et al, 1993) :
Tableau V : Paramètres de calcule du
DAI.
|
Paramètres
Scores
|
selles
|
sang
|
Perte de poids
|
|
0
|
normales
|
Pas de sang
|
Pas de perte de poids
|
|
1
|
Normales/molles
|
Pas de sang
|
1 à 3% de perte de poids
|
|
2
|
molles
|
Visible dans les selles
|
3 à 6% de perte de poids
|
|
3
|
Diarrhée liquide
|
selles et intérieur de l'anus
|
6 à 9% de perte de poids
|
|
4
|
Liquide et queue marron
|
Sang au niveau de l'anus et la queue
|
> 9% de perte de poids
|
25
Chapitre II : Matériel & Méthodes
3. Prélèvements sanguins :
Après avoir sacrifié les souris le sang a
été récupéré par ponction cardiaque dans des
Eppendorf contenant de l'EDTA à 2.6%. Il a été ensuite
centrifugé pendant 10min à 3000 rpm, et les plasma ont
été récupérés et conservés à
-20°C pour un dosage ultérieur du NO.
4. Préparation des macrophages
péritonéaux : 4.1 Récupération des macrophages
:
Pour récupérer les macrophages
péritonéaux il est nécessaire d'effectuer un lavage
péritonéal, pour ce faire un volume de 5ml de PBS stérile
est injecté dans la cavité péritonéale de la
souris. Celle-ci est secouée quelque secondes afin de
récupérer un maximum de cellules. Le liquide
péritonéal prélevé est ensuite centrifugé a
2800 rpm pendant 10min. le culot obtenu est remis en suspension dans un volume
déterminé de DMEM après deux lavages avec du PBS
stérile.
4.2 Test de viabilité :
Un test de viabilité et un comptage des macrophages
sont d'abord effectués sur une cellule Malassez. La viabilité
cellulaire est évaluée en utilisant un colorant vital (Bleu de
trypan) ce dernier nous permettra de différencier entre les cellules
vivantes qui apparaissent réfringentes des cellules mortes de couleur
bleu.
La densité cellulaire (4.105 cellules/ml) est
déterminée par la formule suivante :
Le nombre de cellules= M x d x 105 x V
M : moyenne des macrophages vivants observés dans 3 champs
de la lame de Malassez.
D : facteur de dilution
105 : volume pris par la rigole de la lame de
Malassez.
V : volume de la suspension cellulaire.
4.3 Culture des macrophages péritonéaux :
Les macrophages ont été mis en culture à
raison de 4*105 cellules/puits. Chaque puits est
réalisé en duplicate. Les cellules sont d'abord mises à
adhérer sur microplaque à fond plat pendant 1h30 à
37°C sous atmosphère humide en présence de 5% de CO2.
Ensuite trois lavages au PBS stérile sont effectués afin
d'éliminer les cellules non adhérentes. Puis elles sont à
nouveau mises en culture dans les mêmes conditions pendant 20h à
37°C.
Après 20h d'incubation les surnageant de culture sont
récupérés et centrifugés pendant 5min a 4000 rpm,
ils sont ensuite conservés à -20°C pour le dosage
ultérieur du NO.
26
Chapitre II : Matériel & Méthodes
5. Dosage du monoxyde d'azote (NO) :
L'évaluation des taux de monoxydes d'azote a
été réalisée par le dosage de ses
métabolites physiologiquement stables, les nitrites résiduels
(NO2-). Le dosage du NO a été réalisé au
niveau des plasma et des surnageants de culture cellulaire, par la
méthode de Griess modifiée.
5.1 Principe :
C'est une technique colorimétrique qui permet la
quantification des nitrites (métabolites stables du NO). Ce dosage est
réalisé au spectrophotomètre à une longueur d'onde
de ë=543nm.
5.2 Mode opératoire :
Une courbe étalon des nitrites s'étalant de 0
à 128uM est réalisée antérieurement à partir
d'une solution mère de NaNO2. L'échantillon à doser est
mélangé à 25ìl de Griess B, 25 ul de Griess A et
400 ul d'eau distillée respectivement. La solution obtenue est alors
incubée pendant 15min à l'obscurité puis
centrifugée à 10000rpm pendant 5 minutes. Une lecture de la DO
est réalisée au spectrophotomètre à une longueur
d'onde de ë=543nm.
Nous avons obtenu la courbe suivante :
-0.1
0.6
0.5
0.4
0.3
0.2
0.1
0
20 40 60 80 100 120 140
do
y = 0.0043x - 0.01 R2 = 0.9866
do
Linear (do)
Figure 8: courbe étalon de dosage du NO
selon la méthode de Griess modifiée.
Les échantillons de plasma et de surnageant de culture
ont été préparés selon la méthode de Griess
modifiée. Puis la lecture des DO a été
réalisée a une longueur d'onde de ë=543nm. Les
concentrations des nitrites résiduels sont déterminées
après extrapolation de la valeur de D0 sur la courbe étalon
DO=É [NaNO2] préalablement établie (Touil-Boukoffa et
al.,1998).
27
Chapitre II : Matériel & Méthodes
6. Etude histologique du côlon:
Après avoir sacrifié les souris, le colon est
délicatement séparé de l'intestin grêle à la
limite iléo-caecale. Sa taille est mesurée sur un plan
gradué (caecum replié), puis un fragment de 1cm correspondant au
rectum est coupé à l'extrémité anale. Ensuite, un
fragment de 0.5 à 1 cm est découpé à partir de la
région distale (en amont du rectum), il est lavé au PBS et
conservé dans du formol tamponné à 10% pour l'étude
histologique.
7. Etude histologique :
L'étude histologie se déroule en plusieurs
étapes :
? La déshydratation : la
déshydratation du colon se fait sous agitation par un passage du tissu
dans des bains d'éthanol à des concentrations croissantes.
Deux bains d'alcool 70° de 5 à 10 min chacun Deux
bains d'alcool 90° de 5 à 10 min chacun Trois bains d'alcool
100° de 5 à 10 min chacun
? L'éclaircissement: les fragments
sont ensuite plongés dans trois bains de toluène pendant 10min
chacun.
? L'inclusion dans la paraffine: Les
fragments tissulaires sont plongés dans deux bains de paraffine de 2h
puis 24h dans une étuve thermostatée à 60°c, ensuite
des blocs sont confectionnés grâce à des cassettes et
seront ultérieurement coupés au microtome.
? La réalisation des coupes: les blocs
de paraffine sont coupés à l'aide d'un microtome pour
réaliser des coupes histologique d'une épaisseur de 4um, les
rubans obtenus sont placés au fur et à mesure dans un bain marie
à 37°C et étalés ainsi sur des lames recouvertes
d'eau gélatinée à 0.4%. les lames sont ensuite
placées dans une étuve thermostatée à 37°c
pendant 24h afin de les sécher.
? Le déparaffinage et la réhydratation
des coupes:
Cette étape vient avant l'étape de la coloration
des coupes. Pour cela les lames sont placées pendant quelques secondes
sur une plaque chauffante puis plongées dans un bain de toluène
pendant 3 à 5 min. Lorsque la paraffine est fondue, les coupes sont
réhydratées en les plongeant dans des bains d'alcool
décroissants :
Un bain d'alcool de 100° pendant 2 à 3 min. Un bain
d'alcool de 90° pendant 2 à 3 min. Un bain d'alcool de 70°
pendant 2 à 3 min. Puis on réalise un bain final d'eau
distillée.
28
Chapitre II : Matériel & Méthodes
? La coloration des coupes :
L'étape de la coloration est primordiale à fin
de réaliser notre étude histologique, une coloration à
base d'hématoxyline et d'éosine qui nous permettra d'observer les
différentes couches du côlon distal a été
utilisée. Pour cela les lames sont plongées dans de
l'hématoxyline pendant 2 minutes puis lavées à l'eau de
robinet. Elles sont ensuite plongées dans de l'éosine pendant
quelques secondes puis rincées à l'eau distillée pendant 1
minute.
Enfin, les coupes sont déshydratées par passage
dans des bains d'alcool croissants (70°, 90°, 100°) pendant
quelques minutes, suivis de deux bains de xylène.
? Montage des lames :
La dernière étape consiste à recouvrir
les lames par des lamelles en verre et pour cela une goutte de résine de
montage Eukitt® est déposée sur la lamelle
imprégnée de xylène, celle-ci est fixée sur la lame
délicatement en évitant la formation de bulles d'air.
8. Isolement et culture des cellules mononuclées
du sang périphérique (PBMC) des patients atteints des MICI :
Etude de l'effet immunomodulateur de la ML
Dans le second volet de notre étude nous avons voulu
exploré l'effet de la ML sur la production ex vivo du NO. A cet
effet, Les PBMC sont préparées à partir du sang total par
gradient de densité de Ficoll «Histopaque» (1.077 mg/ml, Sigma
Aldrich). Les cellules sont ensuite récupérées et
re-suspendues dans du PBS stérile. Trois lavages sont effectués
avant de procéder au test de viabilité. Ce dernier
réalisé, les cellules sont mises en culture à raison de
106 cellules/ml dans le milieu de culture RPMI-1640 en
présence et en absence de concentrations croissantes d'extrait brut de
la ML (10, 25, 50 et 60ug/ml) et ou de la cytokine recombinante IL-4 (1ng, 10ng
et 100ng).
8.1 Culture des PBMC humaines :
Les PBMC sont mises en culture dans une microplaque de 96
puits à raison de 106cellules/puits et cela en rajoutant le
volume nécessaire de RPMI-1640 contenant 30 mM de L-glutamine et enrichi
par 5% de sérum de veau foetal, 100UI de pénicilline et 0.1 mg/ml
de streptomycine, en présence et en absence de concentrations
croissantes d'extrait brut de ML (10, 25, 50 et 60ug/ml) et ou de cytokine IL-4
(1ng, 10ng et 100ng) pour un volume final de 200ìl. La microplaque est
alors incubée pendant 20h dans une étuve humidifiée,
réglée à 37°C et 5% de CO2.
Après 20h d'incubation les surnageants de culture sont
récupérés et centrifugés pendant 5min à 4000
rpm. Ils sont ensuite conservés à -20°C pour le dosage
ultérieur du NO.
29
Chapitre II : Matériel & Méthodes
9. Etude statistique :
RM One way ANOVA et le test non-paramétrique de
Friedman ont été utilisés pour mesurer l'effet de la ML
sur la modulation de la production du NO ex vivo. Les
différences sont considérées comme statistiquement
significatives pour p < 0,05 dans l'ensemble des analyses statistiques.
30
Chapitre III : Résultats
PARTIE I : Etude sur modèle animal :
I. Effet de la membrane lamellaire hydatique au cours de la
colite induite par le Dextran sulfate sodium (DSS) :
1. Paramètres Cliniques :
L'administration de 3% (m/v) de DSS pendant 5jours a
provoqué chez les souris du groupe DSS une détérioration
importante de l'état général. Les premiers signes
cliniques sont apparus à partir de J2 : fatigue, perte de poids et
diarrhées hémorragiques.
À l'inverse, nous avons remarqué un retardement
de l'apparition de ces signes cliniques chez le groupe DSS+ML, seulement 25%
des souris ont montré un état de morbidité à partir
de J8 pour le groupe DSS+ML alors que toutes les souris appartenant au groupe
DSS étaient en état de morbidité avec plus de 20% de perte
de poids à la fin de la période expérimentale.
A J7 il y'a eu 25% de mortalité dans le groupe DSS
contre 0% dans le groupe DSS+ML, à J9 jour du sacrifice nous avons a
retrouvé 50% de souris mortes dans le groupe DSS contre 25% des souris
pour le groupe DSS+ML.
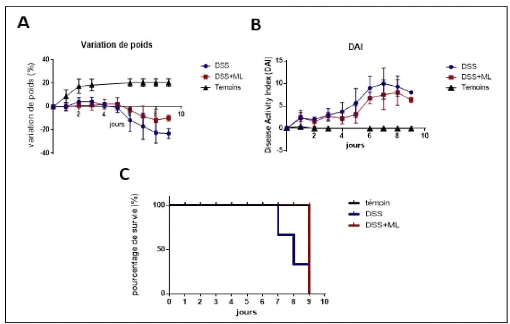
Figure 9: Effet de la ML sur les paramètres
cliniques de la colite induite par le DSS. A. Variation du poids
corporel des souris exprimée en %. B. Disease Activity Index : Perte de
poids, consistance et présence de sang dans les selles. C. Taux de
survie des souris exprimé en % durant la période
expérimentale.
31
Chapitre III : Résultats
Ainsi, l'administration par voie
intra-péritonéale de la ML à but curatif a induit une
légère amélioration des signes cliniques se traduisant par
une diminution du score clinique, le DAI. De plus, une restauration du poids
corporel, a été remarquée dans le groupe DSS+ML en
comparaison avec le groupe DSS (Figure 9).
2. Effet de la ML sur les altérations morphologiques
et histologiques du côlon induites par le DSS :
Sur le plan morphologique, l'administration du DSS 3% à
des souris BALB/c à induit un raccourcissement important du côlon
d'environ 55% en comparaison avec les souris non traitées. Le traitement
des souris par la ML atténue légèrement le
raccourcissement de la longueur du côlon. En effet, nous avons
remarqué qu'il y a une amélioration d'environ 10% au niveau de la
longueur du côlon du groupe DSS+ML en comparaison avec le groupe DSS
(Figure 10).
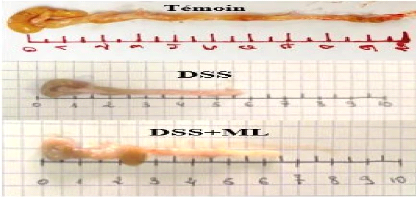
Figure 10 : Longueur du côlon des souris issues
des trois groupes expérimentaux (DSS : Dextran Sulfate Sodium ;
ML : Membrane Lamellaire).
L'analyse histologique du côlon qui s'est basée
sur des critères bien définis tels que l'organisation structurale
de la muqueuse colique, la présence d'abcès cryptique,
l'apparition d'oedèmes, la présence d'infiltrat inflammatoire au
niveau de la muqueuse colique ainsi qu'une déplétion des cellules
caliciformes. L'examen histologique du côlon des souris traitées
avec du DSS a montré des lésions intestinales
sévères. Un infiltrat intense de cellules inflammatoires,
destruction totale des cryptes et des zones oedémateuses ont
été observés au niveau de la muqueuse et de la sous
muqueuse (Figure 11C, 11D).
Cette analyse chez le groupe DSS+ML a montré la
conservation de quelques cryptes dans la muqueuse colique. En outre, nous avons
remarqué une diminution légère de l'infiltrat
inflammatoire au niveau de la muqueuse colique en comparaison avec le groupe
DSS (Figure 11E, 11F). Nous avons suggéré que cette
amélioration serait dûe à une diminution du taux de
monoxyde d'azote.
32
Chapitre III : Résultats
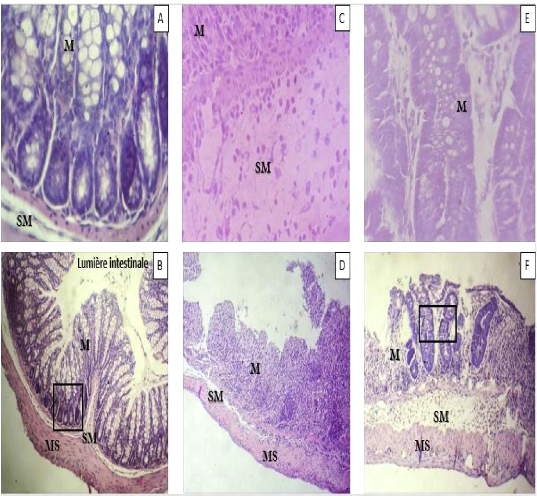
Figure 11: Structure histologique du Côlon des
souris des groupes : (coloration H&E) Témoin (A, B), DSS
(C, D), DSS/ML (E, F). (A, B) x100, x400: Groupe témoin montrant un
aspect stratifié normal; muqueuse (M), sous muqueuse (SM), musculeuse
(MS). (C, D) x100, x400: Groupe DSS montrant une destruction des cryptes et une
déplétion des cellules caliciformes, une érosion de la
muqueuse et la présence d'infiltrat cellulaire au niveau de la muqueuse
(M) et de la sous muqueuse (SM). (E, F) x100, x400: Groupe DSS/ML montrant une
amélioration dans l'organisation architecturale du côlon, une
destruction partielle des cryptes une déplétion non totale des
cellules caliciformes, on remarque aussi la présence d'un important
infiltrat inflammatoire au niveau de la sous muqueuse (SM) et une diminution de
l'infiltrat inflammatoire au niveau de la muqueuse (M).
33
Chapitre III : Résultats
3. Effet de la ML sur la production du NO in vivo
et in vitro :
Nous avons ainsi été amenés à
explorer l'effet de la ML sur la modulation de la production du NO dans notre
modèle d'étude. Le NO étant un médiateur
proinflammatoire produit principalement par les macrophages activés
à travers la NOS2, il a été associé à
l'apparition des dommages tissulaires au cours des MICI (Kolios et al.,
2004).
3.1. Effet de la ML sur la production in vivo du monoxyde
d'azote (NO) :
Le dosage du NO au niveau du plasma a été
réalisé grâce au dosage des nitrites résiduels
[NO2-]. Nous avons remarqué qu'après administration de
3% de DSS à des souris BALB/c, le taux de NO a fortement augmenté
en comparaison avec le groupe témoin (11.3#177;3.81uM vs
5.1#177;0.42uM).
Par contre, le groupe DSS+ML a montré une diminution de
la production in vivo du NO en comparaison avec les souris du groupe
DSS (7.46#177;4.80uM vs 11.3#177;3.81uM) (Figure 12).
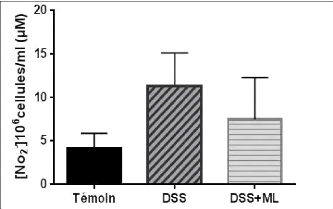
Figure 12 : Effet de la ML sur la production in
vivo du monoxyde d'azote (NO).
3.2. Effet de la ML sur la production in vitro du monoxyde
d'azote (NO) au niveau des surnageants de culture des macrophages
péritonéaux :
L'étude de la production de NO au niveau des
surnageants de culture des macrophages péritonéaux a
révélé une forte augmentation chez le groupe DSS en
comparaison avec le groupe Témoin (39.75#177;8.08uM vs
16.80#177;1.21uM). À l'inverse, nous avons observé une forte
diminution de la production du NO par les pMØ des souris du groupe
DSS+ML en comparaison avec le groupe DSS (22.82#177;2.52uM vs
39.75#177;8.08uM) (Figure 13).
34
Chapitre III : Résultats
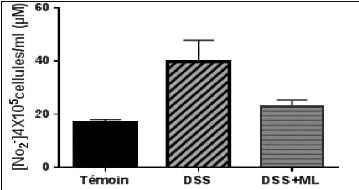
Figure 13: Effet de la ML et/ou du DSS sur la
production in vitro des nitrites résiduels par les macrophages
péritonéaux.
II. Effet de l'IL-4 sur la production in vitro du monoxyde
d'azote (NO) au niveau des surnageants de culture des macrophages
péritonéaux :
Le traitement des macrophages péritonéaux des
souris du groupe DSS par l'IL-4 a induit une diminution du taux de NO en
comparaison avec le groupe DSS (39.75#177;8.08uM vs 25.5#177;6.64uM).
Nous avons noté avec intérêt que l'effet de la ML sur la
production du NO au niveau des surnageants de culture des pMØ du groupe
DSS était comparable à l'effet de l'IL-4 (Figure 14).
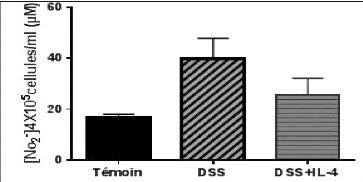
Figure 14: Effet de l'Il-4 et/ou du DSS sur la
production in vitro des nitrites résiduels par les macrophages
péritonéaux des souris du groupe.
Chapitre III : Résultats
PARTIE II : Etude chez des patients atteints de
MICI
I. Etude de l'effet de l'extrait brut de la ML sur la
production du monoxyde d'azote ex vivo au cours des maladies inflammatoires
chroniques de l'intestin :
Dans la seconde partie de notre étude, nous nous sommes
intéressés à l'évaluation de l'effet de l'extrait
brut de la membrane lamellaire hydatique sur la production ex vivo du
NO par les cellules mononuclées du sang périphérique
(PBMC) des patients atteints de MICI.
La production du monoxyde d'azote a été
déterminée dans les surnageants de culture en présence et
en absence de concentrations croissantes de la ML et/ou de la cytokine
recombinante exogène : l'IL-4.
1. Patients atteints de la maladie de Crohn :
1.1. Effet de la ML sur la production ex vivo
du NO au niveau des cultures des cellules mononuclées du sang
périphérique chez les patients traités par des
anti-inflammatoires :
Les taux de nitrites dans les surnageants de culture des PBMC
ont montré une diminution significative * P<0.05 dans les teneurs en
NO après l'addition de concentrations croissantes d'extrait brut de la
ML 25, 50 et 60 ug/ml par rapport au témoin négatif (PBMC non
traités avec la ML) et ce, quelque soit la concentration en
protéines de l'extrait brut de la ML (Figure 15A).
1.2. Effet de la ML sur la production ex vivo
du NO au niveau des cultures des cellules mononuclées du sang
périphérique (PBMC) chez les patients sous immunosuppresseurs
:
Les taux de nitrites dans les surnageants de culture des PBMC
ont montré une diminution significative (* P<0.05) dans les teneurs
en NO après traitement par les concentrations 10 et 50 ug/ml de
l'extrait brut de la ML par rapport au témoin négatif de culture
(PBMC non traités avec la ML) (Figure 15B).
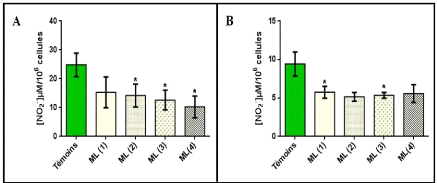
35
Figure 15: effet de la ML sur la production ex
vivo du NO par les PBMC de patients atteints de la maladie de Crohn.
A : patients traités par des anti-inflammatoires. B : patients
traités par des immunosuppresseurs. [ML]= 10, 25, 50, 60 ug/ml d'extrait
brut de la ML, * : p<0.05.
36
Chapitre III : Résultats
2. Patients atteints de la rectocolite hémorragique
:
2.1 Effet de la ML sur la production ex vivo du NO au
niveau des cultures des cellules mononuclées du sang
périphérique (PBMC):
La comparaison entre les taux de nitrites dans les surnageants
de culture des PBMC de patients atteints de rectocolite hémorragique en
phase active et sous corticothérapie a montré une diminution
importante dans les teneurs en NO après l'addition de concentrations
croissantes d'extrait brut de la ML par rapport au témoin négatif
de culture (PBMC non traités avec la ML). Quelque soit la concentration
de l'extrait brut utilisée, la diminution du taux du NO n'est pas
statistiquement significative, à l'exception de la concentration de
50ug/ml de la ML. Cette dernière a induit une diminution significative
de la production du NO par les PBMC en comparaison avec le témoin de
culture (Figure 16.A).
2.2 Effet de L'IL-4 sur la production ex vivo du NO au
niveau des cultures des cellules mononuclées du sang
périphérique :
Afin de confirmer l'effet inhibiteur de la ML sur la
production du NO, nous avons voulu comparer son effet avec l'effet de l'IL-4.
Pour rappel, l'IL-4 est une cytokine anti-inflammatoire, capable d'inhiber
l'expression de la NOS-2 au niveau des monocytes. Le traitement des PBMC de
patients atteints de RCH en phase active et sous corticothérapie avec 1
et 10 ng/ml d'IL-4 a induit une diminution significative du taux du NO en
comparaison avec le témoin de culture (3.7#177;1.53uM, 4.03#177;2.07uM
vs 7.51#177;0.37uM p<0.05 respectivement) (Figure 16.B).
Ainsi, nous avons noté avec intérêt que
l'effet de la ML sur la production du NO par les PBMC de patients atteints de
RCH en phase active est semblable à celui de l'IL-4.
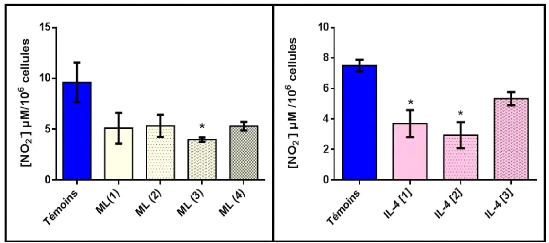
A
B
Figure 16: effet de la ML sur la production ex
vivo du NO par les PBMC de patients atteints de la rectocolite
hémorragique en phase active et sous corticothérapie. A
: Avec ou sans [10, 25, 50, 60 ug/ml] d'extrait brut de la ML. B : Avec ou sans
[1, 10, 100 ng/ml] d'IL-4 humaine recombinante. * : p<0.05.
37
Discussion générale
Discussion générale
Le modèle de colite induite par le DSS est un
modèle établie, son principal intérêt est de
comprendre l'impact de la rupture de la barrière intestinale dans la
pathogenèse des MICI. Il présente des similarités avec les
MICI humaines du point de vue étiologique et physiopathologique
(Solomon et al., 2010).
Le DSS par son action cytotoxique sur les cellules
épithéliales, induit la rupture de la fonction de la
barrière épithéliale (Cooper et al., 1993). Cette
destruction mettrait en contact la flore commensale et le système
immunitaire muqueux, ce qui est à l'origine de l'activation excessive du
système immunitaire muqueux et la perturbation de l'homéostasie
intestinale comme il a été décrit au cours des MICI
humaines (Nancey et al., 2008; Neuman, 2007).
De ce fait, nous avons utilisé ce modèle afin
d'évaluer l'effet curatif de la ML et ce, selon différents
paramètres : cliniques, morphologiques et histologiques. Nous avons
également évalué l'impact de son effet sur la modulation
de la NOS2 au cours de notre modèle d'étude.
Ce modèle est caractérisé sur le plan
clinique par une importante perte de poids, en conséquence d'une
diminution de la consommation alimentaire, un changement de la consistance des
selles allant jusqu'à la diarrhée, accompagné de
saignements rectaux. Sur le plan histologique, il a été
décrit que l'inflammation induite par le DSS est limitée au
côlon distal chez les souris BALB/c. Il induit des lésions
sévères au niveau de la muqueuse colique associées
à une importante infiltration des cellules inflammatoires (Cooper et
al., 1993).
Dans notre étude, l'administration de 3% de DSS dissout
dans l'eau de boisson à des souris BALB/c pendant 5 jours, a induit une
détérioration de l'état général des souris
se traduisant par une augmentation du DAI. En effet, l'apparition des
différents signes cliniques nous a permis de suivre l'évolution
de l'inflammation. Les premières selles molles sont apparues à
J1, les diarrhées hémorragiques sont apparues à partir de
J3. À partir de J7 jusqu'à J9 les souris de ce groupe
étaient toutes dans un état de morbidité associé
à plus de 20% de perte de poids, nous avons également
enregistré 50% de mortalité dans ce groupe. Au cours de notre
modèle, l'administration du DSS à 3% pendant 5jours a induit un
raccourcissement de la longueur du côlon de l'ordre de 55%, ce qui
reflète la sévérité de l'inflammation colique.
Nos résultats sont en accord avec les résultats
obtenus par les études précédentes (Okayasu et
al., 1990 ; Cooper et al., 1993 ; Abdelouhab et al.,
2012 ; Soufli et al., 2015). En effet, il est bien établi que
les souris présentent des symptômes cliniques de colite à
partir de J2 reflétant l'installation du processus inflammatoire et des
lésions histologiques. Nous avons donc évalué l'effet de
l'extrait soluble de la ML en tant que traitement curatif et ce, à
travers son administration par voie intra-péritonéale 3 jours
après l'induction de la colite.
L'administration de l'extrait soluble de la ML à but
curatif, a induit un retardement de l'apparition des signes cliniques, ce qui a
conduit à l'amélioration de l'état générale
des souris et la diminution des altérations morphologiques. En effet,
nous avons relevé une augmentation de la longueur du côlon chez le
groupe DSS+ML en comparaison avec le groupe DSS.
38
Discussion générale
Nos résultats sont en accord avec ceux rapportés
par Reardon et al, qui ont démontré que l'infection des souris
avec le teania Hymenolepis améliore la colite induite par le
DSS. Khan et al ont aussi démontré que l'infection avec
Trichinella spiralis, protège les souris de la colite induite
par le (DNBS). Plus récemment, une étude menée au sein de
notre équipe a mis en évidence l'effet protecteur de la membrane
lamellaire d'Echinoccocus granulosus au cours d'un modèle de
colite induite par le DSS (Reardon et al., 2001 ; khan et
al., 2002 ; Soufli et al., 2015). Il a été
démontré que la ML exerce un effet protecteur au cours de la
colite induite par le DSS à travers la régulation négative
de l'expression de la NOS2 et des cytokines proinflammtoires IFN-ã et
TNF-á (Soufli et al., 2015).
L'analyse histologique nous a permis de localiser et d'estimer
le degré d'atteinte tissulaire au niveau du côlon distal. Nous
avons observé chez les souris du groupe DSS la présence
d'importantes altérations au niveau de l'organisation architecturale du
côlon qui se traduisent par une destruction de la muqueuse colique, la
destruction de l'épithélium, la déplétion des
cryptes et des cellules caliciformes ainsi qu'une importante infiltration
muqueuse et sous muqueuse. En ce qui concerne le groupe DSS+ML, nous avons
remarqué une légère amélioration dans
l'organisation structurale de la muqueuse en comparaison avec le groupe DSS. En
effet, nous avons observé la présence de quelques cryptes ainsi
qu'une diminution de l'infiltration au niveau de la muqueuse.
Dans notre étude, l'analyse histologique a
révélé la présence d'un important infiltrat
inflammatoire hétérogène. Ces cellules seraient à
l'origine de la production des cytokines proinflammatoires et de monoxyde
d'azote.
Nous avons mesuré le taux de nitrites résiduels
représentatifs des taux de NO au niveau systémique (taux
plasmatique) in vivo et in vitro au niveau des surnageants de
cultures des macrophages péritonéaux. L'administration
du DSS à 3% a induit une forte augmentation de la production du NO
in vivo et in vitro en comparaison avec les souris du groupe
témoin. À l'inverse, nous avons noté une diminution
importante du taux de NO in vivo et in vitro après
traitement des souris par l'extrait soluble de la ML en comparaison avec les
souris traitées par le DSS seul.
Plusieurs études ont démontré une
surexpression de la NOS2 au niveau de la muqueuse intestinale des patients
atteints de MICI (Rafa et al., 2013) ainsi qu'au cours des colites
expérimentales (Toumi et al., 2014 ; Soufli et al.,
2015 ).
L'expression de la NOS2 est induite après activation du
facteur de transcription NF-êB et libère de fortes concentrations
de monoxyde d'azote. Elle est induite par différents stimuli qui
agissent en synergie : l'IFN--y/TNF--a, LPS/IFN- ã, IL-1â/LPS. Le
NO est un radical libre impliqué dans l'apparition des lésions
tissulaires au cours des MICI (Kimura et al., 1997 ; Pacher et
al., 2007 ; Rafa et al., 2010 ; 2013).
39
Discussion générale
Il interagit avec l'anion superoxyde pour donner le
péroxynitrite qui est connu pour ses effets
délétères sur la muqueuse intestinale (Rachmilewitz et
al., 1995 ; Kolios et al., 2004).
Des travaux ont suggéré que l'induction des
macrophages de type M2 serait à l'origine de l'atténuation de
l'inflammation colique par les helminthes au cours des modèles
expérimentaux de MICI (Heylen et al., 2014). De plus, une
étude récente de notre équipe a démontré que
la ML inhibe l'expression de la NOS2 et augmente l'expression de l'arginase,
marqueur des macrophages M2, au niveau des macrophages
péritonéaux murins (Amri & Touil-Boukoffa ; 2015 in
press).
Les résultats obtenus à travers notre
étude, sont en accord avec ces données. En effet, nous avons
noté que la ML a induit une diminution importante de la production du NO
par les macrophages péritonéaux en comparaison avec le groupe
DSS. Cette diminution est comparable à celle observée au niveau
des surnageants de culture des pMø issus du groupe DSS et traités
par de l'IL-4 exogène, suggérant que la ML aurait un effet
similaire à l'IL-4.
Il a été démontré qu'au cours de
la phase chronique de l'hydatidose, la ML induirait des cytokines de type Th2
et Treg principalement l'IL-4 et l'IL-10 (Amri et al., 2009). Nos
résultats montrent que l'effet de la ML était semblable à
celui de l'IL-4 ce qui suggèrent que la ML agirait probablement en
induisant la production de l'IL-4 et de l'IL-10.
Nos résultats suggèrent qu'en plus de
l'amélioration au niveau histologique et clinique, l'extrait soluble de
la ML exerce un rôle immunomodulateur sur la production du NO au cours de
notre modèle d'étude.
Cependant, nous avons utilisé un nombre de souris
faible dans notre étude ce qui limite nos résultats à des
observations. L'augmentation du nombre des souris ainsi que l'utilisation de
l'extrait brut de la ML au lieu de l'extrait soluble pourraient
démontrer un effet supérieur. En effet, il a été
démontré de façon intéressante que l'extrait brut
de la ML induit une réduction plus importante de la production de NO en
comparaison avec l'extrait soluble au niveau des cultures de macrophages in
vitro (Steers et al., 2001). De ce fait, l'utilisation de
l'extrait brut pourrait probablement donner un effet supérieur au cours
de notre modèle d'étude.
Dans la seconde partie de notre étude, nous nous sommes
intéressés à l'évaluation de l'effet ex vivo
de l'extrait brut de la ML sur la production du NO chez des patients
atteints de la maladie de Crohn et de la rectocolite hémorragique. En ce
qui concerne les patients atteints de la MC nous avons été
amenés à les classer selon deux catégories, les patients
traités par des anti-inflammatoires et les patients traités par
des immunosuppresseurs. Nous avons noté un taux de NO réduit au
niveau des surnageants de culture des patients traités par
immunosuppresseurs et en comparaison avec les patients traités par
anti-inflammatoire. En effet, les corticoïdes et les immunosuppresseurs
sont connus pour réguler négativement la production du NO et
l'induction de la synthèse des cytokines pro-inflammatoires, ce qui
explique les taux faibles de NO retrouvés chez ces patients.
40
Discussion générale
Nous avons remarqué que la ML a induit une diminution
importante de la production du NO quelque soit la concentration
protéique de l'extrait, et ceci chez les deux catégories de
patients atteints de la MC. Néanmoins, nous avons remarqué que
les concentrations de 25ug/ml,
50ìg/ml et 60ug/ml étaient
légèrement plus efficaces chez les patients atteints de la MC
sous anti-inflammatoires. Alors que pour les patients sous immunosuppresseurs
elle connait une diminution statistiquement significative pour des
concentrations de ML de 10ìg/ml et 50ìg/ml. Nous pouvons
expliquer ces résultats par le fait que la ML exercerait son effet
inhibiteur à travers l'induction de l'expression des cytokines
anti-inflammatoires telles que l'IL-4 et l'IL-10 (Amri, 2012). Ces cytokines
sont capables d'inhiber l'expression des cytokines pro inflammatoires
régulatrices positives de l'expression de la NOS2 (Bogdan & Nathan,
1993).
En ce qui concerne les patients atteints de la RCH en phase
active sous corticoïdes, l'évaluation de la production du NO dans
les surnageants de culture de leurs PBMC a permis d'observer une diminution non
significative de la production du NO après traitement avec
différentes concentrations de la ML. A l'exception de la concentration
de 50ìg/ml ou nous avons observé une diminution statistiquement
significative (p<0.05).
De plus, nous avons noté avec intérêt que
l'effet de la ML était comparable à l'effet de l'IL4. En effet,
le traitement des PBMC par différentes concentrations de l'IL-4 a induit
une diminution non significative du taux de NO à l'exception des
concentrations de 1ng/ml et 10ng/ml (p<0.05). Néanmoins, il est
impératif de signaler l'effectif réduit de notre
échantillonnage pour cette catégorie de patients (n=4),
l'augmentation de la taille de notre échantillon nous permettrait
probablement de démontrer un effet supérieur.
Nos résultats suggèrent que l'inhibition de
l'expression de la NOS2 par la ML passerait probablement par l'effet de l'IL-4.
Pour rappel, l'IL-4 est une cytokine anti-inflammatoire produite
essentiellement par les lymphocytes Th2, cette cytokines a la capacité
d'inhiber la libération des cytokines pro-inflammatoires telles que :
l'IL-1â et le TNF-á par les monocytes/macrophages et ainsi inhiber
indirectement l'expression de la NOS2 (Bogdan et Nathan, 1993).
41
Conclusion
Conclusion
Au regard global de notre étude, nous suggérons
l'instauration d'un effet curatif exercé par l'extrait soluble de la
membrane lamellaire hydatique dans le modèle de colite
expérimentale induite par le DSS. En effet, il apparait que la ML exerce
un effet immunomodulateur sur l'expression de la NOS2 qui se traduit par la
diminution de la production du NO in vivo et in vitro au
niveau des surnageants de culture des macrophages péritonéaux.
D'autre part nous avons noté un effet bénéfique probable
sur la protection de l'intégrité de la muqueuse colique. Nous
avons dans cette optique, mis en évidence, le rôle
immunomodulateur de cet extrait sur la production du NO ex vivo chez
des patients atteints de MICI. En effet, les résultats obtenus à
travers notre étude, sont en faveur de l'hypothèse
hygiéniste et suggèrent un effet thérapeutique potentiel
de la ML dans les MICI.
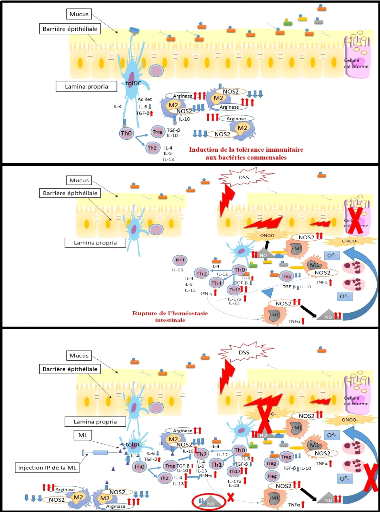
IL-10
1 Arginase
i
1-1-1-1-1-1
1-1
N O52-444
t
O5
Barrière épithéliale
Lamina propria
IL-4
Treg I TGF-j3 44
IL-10
Induction de la tolérance immunitaire aux bactéries
commensales
IL-4
IL-5 IL-13
el le
li 'forrre
0
pn
i
Barrière épithéliale
ONOO-
Lamina propria
IL-13
TNFa
TGF-R1IL-1G
IL-4
IL-5 L-13
IFN-y
`IL-17e 1L-23
O2-
Rupture de l'homéostasie intestinale
TN Fat
Lamina propria
NOSJI
ONOO-
(y,
Injection IP de la ML
i
-- 00
- 1-
lme
Barrière épithéliale
tIArginase
1 NOS2 M211,
114
L IL-4 L-6 1
· TGF-lit IL-4
G F-13 1 IL-5 IL-101 IL-13
IL-4 "1.4IFN-y
IL-131
1
Argi na se 11t
TGF-131 I L-10
IL-23
X
MI.
TNFaI
Treg
NOS2
NOS2
TNFa
IL-17a
Figure 17 : Schéma proposé pour illustrer
les altérations induites par le DSS et l'effet
protecteur probable de
la membrane lamellaire.
Références bibliographiques
Références bibliographiques :
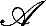
Abdelouhab, K., Rafa, H., Toumi, R., Bouaziz, S., Medjeber,
O., & Touil-Boukoffa, C. (2012). Mucosal intestinal alteration in
experimental colitis correlates with nitric oxide production by peritoneal
macrophages: effect of probiotics and prebiotics. Immunopharmacol
Immunotoxicol, 34(4), 590-597. doi: 10.3109/08923973.2011.641971
Abreu, M. T. (2010). Toll-like receptor signalling in the
intestinal epithelium: how bacterial recognition shapes intestinal function.
Nat Rev Immunol, 10(2), 131-144. doi: 10.1038/nri2707
Amri, M., Mezioug, D., & Touil-Boukoffa, C. (2009).
Involvement of IL-10 and IL-4 in evasion strategies of Echinococcus granulosus
to host immune response. Eur Cytokine Netw, 20(2), 6368. doi:
10.1684/ecn.2009.0154
Amri, M. & Touil-Boukoffa, C., 2011. PS2-092.
Down-regulation of Th1/Th17 protective immune responses during human
echinococcosis. Cytokine, 56(1), 88-89. Available at:
http://dx.doi.org/10.1016/j.cyto.2011.07.256.
Amri, M. (2012). Etude du rôle des effecteurs
cytokiniques, antigéniques et du monoxyde d'azote dans le rapport
immunité/échappement parasitaire au cours de
l'échinococcose (Doctoral dissertation)
Amri, M., & Touil-Boukoffa, C. (2014). Induction of Treg
and alternatively activated macrophages by the helminth Echinococcus
granulosus: implication in the promotion or control of allergic disease
Clinical and Translational Allergy, 4(Suppl 2), P61. doi:
10.1186/2045-70224-s2-p61
Ananthakrishnan, A. N. (2013). Environmental Risk Factors for
Inflammatory Bowel Disease Gastroenterology & Hepatology 9(6).
Ananthakrishnan, A. N. (2015). Environmental risk factors for
inflammatory bowel diseases: a review. Dig Dis Sci, 60(2), 290-298. doi:
10.1007/s10620-014-3350-9
Anderson, C. A., Boucher, G., Lees, C. W., Franke, A.,
D'Amato, M., Taylor, K. D., . . . Rioux, J. D. (2011). Meta-analysis identifies
29 additional ulcerative colitis risk loci, increasing the number of confirmed
associations to 47. Nat Genet, 43(3), 246-252. doi: 10.1038/ng.764

Bar-On, L., Zigmond, E. & Jung, S., 2011. Management of
gut inflammation through the manipulation of intestinal dendritic cells and
macrophages Seminars in Immunology, 23(1), 58-64. Available at :
http://dx.doi.org/10.1016/j.smim.2011.01.002.
Références bibliographiques
Baron, S., Turck, D., Leplat, C., Merle, V., Gower-Rousseau,
C., Marti, R., Colombel, J. F. (2005). Environmental risk factors in paediatric
inflammatory bowel diseases: a population based case control study. Gut, 54(3),
357-363. doi: 10.1136/gut.2004.054353
Bashi, T., Bizzaro, G., Ben-Ami Shor, D., Blank, M., &
Shoenfeld, Y. (2015). The mechanisms behind helminth's immunomodulation in
autoimmunity. Autoimmun Rev, 14(2), 98-104. doi:
10.1016/j.autrev.2014.10.004
Baumgart, D. C., Carding, S. R. (2007) Inflammatory bowel
disease: cause and immunobiology. Lancet ; 369: 1627-1640.
doi:10.1016/S0140-6736(07)60750-8.
Ben-Ami Shor, D., Harel, M., Eliakim, R., & Shoenfeld, Y.
(2013). The hygiene theory harnessing helminths and their ova to treat
autoimmunity. [Review]. Clin Rev Allergy Immunol, 45(2), 211-216. doi:
10.1007/s12016-012-8352-9
Bernstein, C. N. (2015). Treatment of IBD: Where We Are and
Where We Are Going. [Review]. Am J Gastroenterol, 110(1), 114-126. doi:
10.1038/ajg.2014.357
Bogdan, C. & Nathan, C., 1993. Modulation of Macrophage
Function by Transforming Growth Factor p, Interleukin-4, and
Interleukin-lo». Annals New York Academy of Sciences, 685, 713- 739.
Brandtzaeg, P. (2009). Mucosal immunity: induction,
dissemination, and effector functions. Scand J Immunol, 70(6), 505-515. doi:
10.1111/j.1365-3083.2009.02319.x
D
Diaz, A., Casaravilla, C., Allen, J. E., Sim, R. B., &
Ferreira, A. M. (2011). Understanding the laminated layer of larval
Echinococcus II : immunology. Trends Parasitol, 27(6), 264-273. doi:
10.1016/j.pt.2011.01.008
Diaz, A., Casaravilla, C., Irigoin, F., Lin, G., Previato, J. O.,
& Ferreira, F. (2011). Understanding the laminated layer of larval
Echinococcus I : structure. [Review]. Trends Parasitol, 27(5), 204-213. doi:
10.1016/j.pt.2010.12.012
Dieleman, LA., Ridwan, BU., Tennyson, GS., Beagley, KW., Bucy,
RP., Elson, CO. (1994) Dextran sulfate sodium-induced colitis occurs in severe
combined immunodeficient mice. Gastroenterol; 107:1643-1652.
w
Economou, M., & Pappas, G. (2008). New global map of
Crohn's disease: Genetic, environmental, and socioeconomic correlations.
[Review]. Inflamm Bowel Dis, 14(5), 709-720. doi: 10.1002/ibd.20352
Références bibliographiques
Elliott, D. E., & Weinstock, J. V. (2012). Helminth-host
immunological interactions : prevention and control of immune-mediated
diseases. Ann N Y Acad Sci, 1247, 83-96. doi:
10.1111/j.1749-6632.2011.06292.
F
Fiasse, R., Dewit, O. & Latinne, D., 2009. Is endemic
helminthiasis in sub-Saharan Africa the sole reason for the low prevalence of
inflammatory bowel disease Impacts on public health. Journal Africain
d'Hépato-Gastroentérologie, 3(2), 58-66.
Frolkis, A., Dieleman, L. A., Barkema, H. W., Panaccione, R.,
Ghosh, S., Fedorak, R. N., Kaplan, G. G. (2013). Environment and the
inflammatory bowel diseases Can J gastroenterol 27(3), 18-24.
G
Gianchecchi, E., Delfino, D. V., & Fierabracci, A. (2014).
Recent insights on the putative role of autophagy in autoimmune diseases.
Autoimmun Rev, 13(3), 231-241. doi: 10.1016/j.autrev.2013.10.007
Gordon, S., 2003. Alternative activation of macrophages. Nature
reviews. Immunology, 3(1), 23-35.
Guo, A. Y., Stevens, B. W., Wilson, R. G., Russell, C. N., Cohen,
M. A., Sturgeon, H. C., Ananthakrishnan, A. N. (2014). Early life environment
and natural history of inflammatory bowel diseases. BMC Gastroenterol, 14(1),
216. doi: 10.1186/s12876-014-0216-8
H
Hammada, T., Lemdaoui, M. C., Boutra, F., Zoughailech, D.,
& Asselah, H. (2011). Aspects épidémiologiques des maladies
inflammatoires chroniques de l'intestin dans une population algérienne.
Journal Africain d'Hépato-Gastroentérologie, 5(4), 293-302. doi:
10.1007/s12157011-0327-6
Halfvarson, J. et al., 2007. Longitudinal concordance for
clinical characteristics in a Swedish-Danish twin population with inflammatory
bowel disease. Inflammatory Bowel Diseases, 13(12), 1536-1544.
Hendrickson, B. A., Gokhale, R., & Cho, J. H. (2002).
Clinical Aspects and Pathophysiology of Inflammatory Bowel Disease. Clinical
Microbiology Reviews, 15(1), 79-94. doi: 10.1128/cmr.15.1.79-94.2002
Références bibliographiques
Heylen, M. et al., 2014. Of worms, mice and man: An overview
of experimental and clinical helminth-based therapy for inflammatory bowel
disease. Pharmacology and Therapeutics, 143(2), 153-167. Available at:
http://dx.doi.org/10.1016/j.pharmthera.2014.02.011.
Hunter, M. M., & McKay, D. M. (2004). Helminths as
therapeutic agents for inflammatory bowel disease. Alimentary Pharmacology and
Therapeutics, 19(2), 167-177. doi: 10.1111/j.0269-2813.2004.01803.
J
Jung, C., Hugot, JP., Barreau, F. (2010) Peyer's Patches: The
Immune Sensors of the Intestine. International Journal of Inflammation; 12
K
Khan, W.I. et al., 2002. Intestinal nematode infection
ameliorates experimental colitis in mice. Infection and Immunity,
70(11), 5931 -5937.
Kimura, H. et al., 1997. Increased nitric oxide production and
inducible nitric oxide synthase activity in colonic mucosa of patients with
active ulcerative colitis and Crohn's disease. Digestive diseases and
sciences, 42(5), 1047-1054.
Kolios, G., Valatas, V., & Ward, S. G. (2004). Nitric oxide
in inflammatory bowel disease: a universal messenger in an unsolved puzzle.
[Review]. Immunology, 113(4), 427-437. doi: 10.1111/j.1365-2567.2004.01984.
Korzenik, J. R., & Podolsky, D. K. (2006). Evolving knowledge
and therapy of inflammatory bowel disease. [Review]. Nat Rev Drug Discov, 5(3),
197-209. doi: 10.1038/nrd1986
L
Laclotte, C., Oussalah, A., Rey, P., Bensenane, M., Pluvinage,
N., Chevaux, J. B., Peyrin-Biroulet, L. (2008). [Helminths and inflammatory
bowel diseases]. Gastroenterol Clin Biol, 32(12), 1064-1074. doi:
10.1016/j.gcb.2008.04.030
Lesage, S. et al., 2002. CARD15/NOD2 mutational analysis and
genotype-phenotype correlation in 612 patients with inflammatory bowel disease.
American journal of human genetics, 70(4), 845-857.
Loftus., & Edward. (2004). Clinical epidemiology of
inflammatory bowel disease: incidence, prevalence, and environmental
influences. Gastroenterology, 126(6), 1504-1517. doi:
10.1053/j.gastro.2004.01.063
Références bibliographiques
M
McCole, D. F. (2014). IBD candidate genes and intestinal barrier
regulation. [Research Support, N.I.H., Extramural]. Inflamm Bowel Dis, 20(10),
1829-1849. doi: 10.1097/MIB.0000000000000090
MacDonald, T.T. et al., 2011. Regulation of homeostasis and
inflammation in the intestine.
Gastroenterology, 140(6), 1768-1775. Available at:
http://dx.doi.org/10.1053/j.gastro.2011.02.047.
Molodecky., N. A., & Kaplan., G. G. ( 2010). Environmental
Risk Factors for Inflammatory Bowel Disease. Gastroenterology & Hepatology
6(5).
N
Nancey, S. et al., 2008. Apport des modèles animaux dans
les maladies inflammatoires chroniques de l'intestin. , 15, .33-41.
Neuman, M.G., 2007. Immune dysfunction in inflammatory bowel
disease. Translational Research, 149(4), 173-186.
Neurath, M. F. (2014) Cytokines in inflammatory bowel disease.
Nature Reviews Immunology 14, 329-342.
doi:10.1038/nri3661
Neutra, M. R., Mantis, N., & Kraehenbuhl, J. (2001)
Collaboration of epithelial cells with organized mucosal lymphoid tissues
Nature Immunology 2, 1004 - 1009. doi:10.1038/ni1101-1004
O
Ouellette, A. J. (2010). Paneth cells and innate mucosal
immunity. [Research Support, N.I.H., Extramural Review]. Curr Opin
Gastroenterol, 26(6), 547-553. doi: 10.1097/MOG.0b013e32833dccde
P
Pacher, P. et al., 2007. Nitric Oxide and Peroxynitrite in
Health and Disease. Physiological reviews, 75(1), pp.315-424.
Peterson, L. W., & Artis, D. (2014). Intestinal epithelial
cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol,
14(3), 141-153. doi: 10.1038/nri3608
Références bibliographiques
Ponder, A., 2013. A clinical review of recent findings in the
epidemiology of inflammatory bowel disease. , pp.237-247.
Powrie, F., 2012. Gut reactions: Immune pathways in the
intestine in health and disease. EMBO Molecular Medicine, 4(2),
71-74.

Rachmilewitz D, Stamler JS, Bachwich D, Karmeli F, Ackerman Z,
Podolsky DK. (1995) Enhanced colonic nitric oxide generation and nitric oxide
synthase activity in ulcerative colitis and Crohn's disease. Gut ;36 :
718-23
Rafa, H., Amri, M., Saoula, H., Belkhelfa, M., Medjeber, O.,
Boutaleb, A., Touil-Boukoffa, C. (2010). Involvement of interferon-gamma in
bowel disease pathogenesis by nitric oxide pathway: a study in Algerian
patients. J Interferon Cytokine Res, 30(9), 691-697. doi:
10.1089/jir.2010.0012
Rafa, H., Saoula, H., Belkhelfa, M., Medjeber, O., Soufli, I.,
Toumi, R.,Touil-Boukoffa, C. (2013). IL-23/IL-17A axis correlates with the
nitric oxide pathway in inflammatory bowel disease: immunomodulatory effect of
retinoic acid. J Interferon Cytokine Res, 33(7), 355-368. doi:
10.1089/jir.2012.0063
Roediger, W. E. W., Babidge, W., Millard, S. (1996) Methionine
derivatives diminish sulphide damage to colonocytes - implications for
ulcerative colitis Gut ; 39: 77-81.

Sarra, M. et al., 2010. IL-23/IL-17 axis in IBD.
Inflammatory Bowel Diseases, 16(10), 1808- 1813.
Sartor, R. B. (2006). Mechanisms of disease: pathogenesis of
Crohn's disease and ulcerative colitis. [Research Support, N.I.H., Extramural
Review]. Nat Clin Pract Gastroenterol Hepatol, 3(7), 390-407. doi:
10.1038/ncpgasthep0528
Schaffler, A., Menche, N. (2004).
Anatomie-Physiologie-Biologie. 2e éd. Paris : Maloine, 454 p.
(Collection Diplômes Et Études Infirmiers).
Shambesh, M. K., Craig, P. S., Wen, H., Rogan, M. T.,
Paolillo, E. (1997) «IgG1 and IgG4 serum antibody responses in
asymptomatic and clinically expressed cystic echinococcosis patients,»
Acta Tropica, vol. 64, no. 1-2, 53-63.
Siracusano, A., Delunardo, F., Teggi, A., & Ortona, E.
(2012). Host-parasite relationship in cystic echinococcosis: an evolving story.
[Review]. Clin Dev Immunol, 2012, 639362. doi: 10.1155/2012/639362
Références bibliographiques
Solomon, L., Mansor, S., Mallon, P., Donnelly, E., Hoper, M.,
Loughrey, M., Gardiner, K. (2010). The dextran sulphate sodium (DSS) model of
colitis: an overview. Comparative Clinical Pathology, 19(3), 235-239. doi:
10.1007/s00580-010-0979-4
Soufli, I., Toumi, R., Rafa, H., Amri, M., Labsi, M., Khelifi,
L., Nicoletti, F & Touil-Boukoffa, C. (2015). Crude extract of hydatid
laminated layer from Echinococcus granulosus cyst attenuates mucosal intestinal
damage and inflammatory responses in Dextran Sulfate Sodium induced colitis in
mice. J Inflamm (Lond), 12, 19. doi: 10.1186/s12950-015-0063-6
Steers, N.J.R., Rogan, M.T. & Heath, S., 2001. In-vitro
susceptibility of hydatid cysts of Echinococcus granulosus to nitric oxide and
the effect of the laminated layer on nitric oxide production. Parasite
Immunology, 23(8), 411 -417.
Summers RW, Elliott DE, Urban JF Jr, Thompson R, Weinstock JV
(2005) Trichuris suis therapy in Crohn's disease. Gut 54:87-90 11.
Summers RW, Elliott DE, Urban JF Jr, Thompson RA, Weinstock JV
(2005) Trichuris suis therapy for active ulcerative colitis : a randomized
controlled trial. Gastroenterology 128: 825- 832 12.

Thomas, G. A. O., Rhodes, J., Green, J. T., & Richardson,
C. (2000). Role of smoking in inflammator y bowel disease: implications for
therapy. Postg rad Med 76:273-279.
Touil-Boukoffa, C., Bauvois, B., Sancéau, J., Hamrioui,
B., & Wietzerbin, J. (1998). Production of nitric oxide (NO) in human
hydatidosis: Relationship between nitrite production and interferon-y levels.
Biochimie, 80, 739-744.
Toumi, R., et al., 2013. Beneficial role of the probiotic
mixture Ultrabiotique on maintaining the integrity of intestinal mucosal
barrier in DSS-induced experimental colitis. Immunopharmacology and
Immunotoxicology, 35, 403-409.
Toumi, R., Soufli, I., Rafa, H., Belkhelfa, M., Biad, A.,
& Touil-Boukoffa, C. (2014). Probiotic bacteria Lactobacillus and
bifidobacterium attenuate inflammation in dextran sulfate sodium-induced
experimental colitis in mice. Int. J. Immunopathol. Pharmacol. 27, no. 4,
0-0.
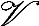
Versini, M. et al., 2015. Unraveling the Hygiene Hypothesis of
helminthes and autoimmunity: origins, pathophysiology, and clinical
applications. BMC Medicine, 13(1), 1 -16.
Références bibliographiques
W
Weinstock KG, Mastrangelo MF, Burkett TJ, Garfinkel DJ, Strathern
JN. (1990) Multimeric arrays of the yeast retrotransposon Ty. Mol Cell Biol
10(6):2882-92
Wells, JM., Rossia, O., Meijerinka, M.,b, van Baarlena, P. (2011)
Epithelial crosstalk at the microbiota-mucosal interface. PNAS ; 108 :
4607-4614.
Wirtz, S. & Neurath, M.F., 2007. Mouse models of inflammatory
bowel disease. Advanced Drug Delivery Reviews, 59(11), 1073-1083.
X
Xavier, R. J., & Podolsky, D. K. (2007). Unravelling the
pathogenesis of inflammatory bowel disease. Nature, 448(7152), 427-434. doi:
10.1038/nature06005
| 


