I.3.2. Principe de fonctionnement
Lorsqu'une batterie au plomb fournit de l'énergie
électrique à un appareil extérieur, plusieurs
réactions chimiques se produisent en même temps. Une
réaction réductrice se produit aux électrodes positives
(cathode) lorsque le peroxyde de plomb (PbO2) se transforme en sulfate de plomb
(PbSO4). Par ailleurs, sur les plaques négatives (anode), une
réaction oxydante se produit et le plomb métallique se transforme
en sulfate de plomb. L'électrolyte, de l'acide sulfurique (H2SO4),
fournit les ions de sulfate pour les deux demi-réactions et agit comme
un pont chimique entre elles. Pour chaque électron
11 Ce type ne concerne que les électrodes
positives. La plaque se présente alors sous forme d'un tube
constitué par une épine en alliage de Pb entourée de
matière active ;
12 Polychlorure de vinyle ou chlorure de polyvinyle,
un polymère thermoplastique ;
13 Acrylonitrile Butadiène Stirène, un
polymère thermoplastique
P a g e 10
BEMBA René Darnel Master II /Energie Renouvelable
et Efficacité Energétique/ Promotion 2021-2022
Proposition d'un Système de Recyclage des
Déchets d'Electrification par le Solaire au Bénin
produit à l'anode, un électron est
consommé à la cathode[8]. Les réactions mises en jeu sont
les suivantes :
L'équation proposée résume très
sommairement les réactions chimiques qui dans la réalité
sont bien complexes et encore aujourd'hui pas toutes comprises et
maîtrisées[5] .
- Anode
Pb + SO42- ? PbSO4 + 2e- (1.1)
- Cathode
PbO2 + SO42- + 4H+ ? PbSO4 + 2H2O (1.2)
- Réaction complète
Pb + Pb02 + 2H2S04 ?
2PbS04 + 2H20 (1.3)
I.3.2.1. Etat de décharge et de charge d'une
batterie
· Etat de décharge
Lorsque la batterie est en état de décharge,
les matériaux actifs de l'électrode positive, le dioxyde de
plomb, sont transformés en sulfate de plomb. De la même
manière, l'électrode négative, qui est composée de
plomb, sera également transformée en sulfate de plomb.
L'électrolyte, l'acide sulfurique, sera consommé en
réagissant avec les matériaux actifs. Les équations de
réaction de l'électrode positive et de l'électrode
négative en état de décharge se présente comme
suit[8] :
- Cathode
PbO2 + 4H+ + 2e- ? Pb2+
+ 2H2O (1.4)
- Anode
Pb ? Pb2+ + 2e-
(1.5)
· Etat de charge d'une batterie
Lorsque la batterie est à l'état de charge, le
sulfate de plomb est transformé en matériaux actifs. Ainsi les
équations se produisant à cet effet sont démontrées
ci-dessous :
- Cathode
PbSO4 + 2H2O ? PbO2 + HSO4- + 3H+
+ 2e- (1.6)
- Anode
PbSO4 + H + ? Pb + HSO4- (1.7)
La figure 1.7 ci-dessous présente le principe de
décharge et décharge d'une batterie :
P a g e 11
BEMBA René Darnel Master II /Energie
Renouvelable et Efficacité Energétique/ Promotion
2021-2022
Proposition d'un Système de Recyclage des
Déchets d'Electrification par le Solaire au Bénin
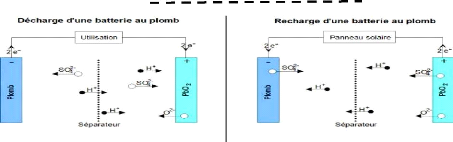
Figure 1.7 : Principe de décharge et de charge d'une
batterie [35]
| 


