|
République de Côte d'Ivoire Année
Universitaire : 2018-2019
~~~~~~~~~~~~~
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
UFR des Sciences de la Terre et
Université Félix Houphouët Boigny de
des Ressources Minières
Cocody
N° d'ordre :
Département des Sciences du Sol
|
|
MÉMOIRE
Pour l'obtention du Diplôme de Master en Sciences
de la Terre
Option : PÉDOLOGIE
THÈME
|
|
EFFICIENCE DES ISOLATS BACTÉRIENS SUR LA
SOLUBILISATION DES AMENDEMENTS PHOSPHATÉS (AP) EN SOLS ACIDES : CAS
D'UNE PARCELLE RIZICOLE DU PLATEAU DE MAN (OUEST DE LA CÔTE
D'IVOIRE).
|
|
|
Présenté par :
KPAN WONDOUET HIPPOLYTE
Date de soutenance 09/12/2019
Directeur de mémoire: Dr BONGOUA AFFI JEANNE Epse
DEVISME
Superviseur Scientifique: Dr KOUADIO
KONAN-KAN
HIPPOLYTE
|
Composition du jury
Dr YAO KOFFI BLAISE Président
Dr BONGOUA AFFI JEANNE EPSE DEVISME Directeur de
mémoire
Dr KOUADIO KONAN-KAN HIPPOLYTE Superviseur
Scientifique
Dr AKOTTO ODI FAUSTIN Examinateur
|
|
|
République de Côte d'Ivoire
~~~~~~~~~~~~~
Ministère de l'Enseignement Supérieur et
de la
Recherche Scientifique
|
Année Universitaire : 2018-2019
|
|
UFR des Sciences de la Terre et
des Ressources
Minières
du Sol
|
|
Université Félix Houphouët Boigny
de
Cocody
N° d'ordre :
Département des Sciences
|
|
MÉMOIRE
Pour l'obtention du Diplôme de Master en Sciences
de la Terre
Option : PÉDOLOGIE
THÈME
EFFICIENCE D'UN ISOLAT BACTÉRIEN SUR LA
SOLUBILISATION DES AMENDEMENTS PHOSPHATÉS (AP) EN SOLS ACIDES : CAS
D'UNE PARCELLE RIZICOLE DU PLATEAU DE MAN (OUEST DE LA CÔTE
D'IVOIRE).
|
|
Présenté par :
KPAN WONDOUET HIPPOLYTE
Date de soutenance 09/12/2019
Directeur de mémoire: Dr BONGOUA AFFI JEANNE Epse
DEVISME
Superviseur Scientifique: Dr KOUADIO
KONAN-KAN
HIPPOLYTE
|
Composition du jury
Dr YAO KOFFI BLAISE Président
Dr BONGOUA AFFI JEANNE EPSE DEVISME Directeur de
mémoire
Dr KOUADIO KONAN-KAN HIPPOLYTE Superviseur
Scientifique
Dr AKOTTO ODI FAUSTIN Examinateur
|
|

Dédicace
Au Seigneur Jésus-Christ, Dieu de grâce et de
paix qui, du haut des cieux, a jeté son dévolu sur moi pour faire
de moi ce que je suis. Que la gloire lui soit rendue.
II
TABLE DES MATIÈRES
Remerciements IV
LISTE DES FIGURES VII
LISTE DES TABLEAUX VIII
LISTE DES SIGLES ET ABRÉVIATIONS IX
LISTE DES ANNEXES XI
RÉSUMÉ XII
ABSTRACT XIII
INTRODUCTION GÉNÉRALE 1
PARTIE I : GÉNÉRALITÉS 4
CHAPITRE I : GÉNÉRALITÉS SUR LES
PHOSPHATES 4
Introduction 4
I.1 Phosphates 4
I.1.1 Origine des phosphates 4
I.1.2 Dynamique du phosphore dans les sols 5
I.1.3 Engrais phosphatés et roche phosphaté
(RP) 7
I.2 Bactéries solubilisatrices du phosphate
(BSP) 8
I.2.1 Solubilisation des roches phosphatées par
les microorganismes du sol 8
I.2.2 Contribution des microorganismes solubilisateurs du
phosphate (MSP) à la
croissance des plantes 8
I.3 Phospho-compost 10
I.3.1 Solubilisation des RP par les résidus
organiques 10
I.3.2 Efficacité agronomique des
phospho-composts 10
Conclusion partielle 11
CHAPITRE II : PRÉSENTATION DE LA ZONE
D'ÉTUDE 12
Introduction 12
II.1 Localisation de la zone d'étude
12
II.1 Climat 12
II.2 Végétation 13
II.3 Relief 13
II.4 Contexte hydrographique 13
II.5 Contexte géologique de la
région 13
II.6 Caractère pédologique 15
II.7 Population et Activités 16
III
Conclusion partielle 16
PARTIE II : MATÉRIEL ET MÉTHODES
16
CHAPITRE III : MATÉRIEL 17
Introduction 17
III.1 Matériel de terrain 17
III.2 Matériel de laboratoire 17
III.3 Substrat de culture 18
III.4 Matériel biologique 19
Conclusion partielle 19
CHAPITRE IV : MÉTHODES D'ÉTUDE
20
Introduction 20
IV.1 Mise en place du dispositif
expérimental 20
IV.1.1 Echantillonnage 20
IV.1.2 Conditions expérimentales 21
IV.1.3 Préparation des milieux de culture
21
IV.1.4 Recherche, isolement et sélection des
bactéries solubilisatrices de phosphate 22
IV.1.4.1 Préparation de l'inoculum, ensemencement
des microplaques et des boites
de pétri 22
IV.1.4.2 Isolement de souches bactériennes
solubilisatrices de phosphate sur les
boites de pétri 23
IV.2 Test d'aptitude des isolats bactériens
à solubiliser le phosphate en microcosme 24
IV.3 Mise en place de l'expérimentation en
Batch 25
IV.3.1 Incubation des pots en "Batch" 25
IV.3.2 Dispositif expérimental 26
IV.4 Méthodes d'analyse 27
IV.4.1. Caractérisation physico-chimique et
microbiologique du sol 27
IV.4.2 Détermination des paramètres des
milieux de culture 29
IV.4 Analyses statistiques des données
31
PARTIE III : RÉSULTATS ET DISCUSSION
30
CHAPITRE V : RÉSULTATS 32
Introduction 32
V.1 Caractéristiques physico-chimique et
microbiologique de l'échantillon de sol 32
V.1.1 Analyse granulométrique et chimique du
sol 32
V.1.2 Caractéristique microbiologique du
sol 33
V.2 Caractéristique de la paille de riz
33
V.3 Caractéristiques chimique de la roche
phosphatée 34
IV
V.4 Caractéristiques macroscopiques des souches
bactériennes solubilisant le
phosphate isolé du sol de plateau. 34
V.5 Evolution des paramètres du milieu de culture
des études réalisées en Batch 35
V.6 Effet des amendements phosphatés (AP) sur le pH,
la teneur en P, le nombre de
bactérie et le COD 37
V.6.1 Effet des AP sur le pH et la teneur en P du
milieu 37
V.6.2 Effet des AP sur le nombre de BPS et la teneur en
COD du milieu 40
V.7. Effet de l'inoculation sur le pH, la teneur en P, le
nombre de bactérie et le COD 44
Conclusion partielle 45
CHAPITRE VI : DISCUSSION 47
Introduction 47
VI.1 Capacité solubilisatrice des souches
bactériennes isolées 47
VI.2 Effet de la paille de riz sur le pH, le P
solubilisé, le nombre de bactérie et le
COD 48
VI.3 Effet des amendements phosphatés sur les
paramètres du milieu 48
VI.4 Effet de l'inoculation sur l'efficience des
traitements 49
Conclusion partielle 50
CONCLUSION GÉNÉRALE ET PERSPECTIVES
51
RÉFÉRENCES BIBLIOGRAPHIQUES 52
ANNEXES XIV
Remerciements
Ce travail a été financé par une
allocation de recherche de l'OCP dans le cadre du projet ASORPRI. Merci d'avoir
rendu possible la réalisation de ce travail.
Je voudrais commencer à exprimer mes remerciements aux
différents responsables et enseignants de l'UFR des Sciences de la Terre
et des Ressources Minières (STRM). Je dis donc merci au :
Professeur Soro Nagnin, Doyen de l'UFR des
Sciences de la Terre et des Ressources Minières, pour son engagement
dans la lutte pour la réussite des étudiants ;
Dr Kouakou Kouadio Emmanuel, Vice-Doyen
chargé de la pédagogie à l'UFR STRM pour avoir
accepté mon inscription en Master ;
Professeur Coulibaly Aoua Sougo, Vice-Doyen
chargé de la recherche à l'UFR STRM pour sa contribution à
la réussite des étudiants de ladite UFR ;
V
Professeur Digbéhi Zéli Bruno,
responsable du 3ème cycle pour avoir facilité
mon inscription en Master ;
Professeur Yao-Kouamé Albert,
Directeur du département des Sciences du sol et
Président de la Commission Scientifique de l'UFR STRM dont
l'expérience et l'expertise dans le domaine nous servent de boussole
;
Je remercie par la suite :
mon Directeur de mémoire : Dr Bongoua Affi
Jeanne Epse DEVISME qui n'a cessé de me soutenir et de croire
en moi jusqu'au bout. Elle fut toujours présente, en particulier lorsque
je me suis confronté au doute. Je lui suis donc reconnaissant, pour ses
multiples et précieux conseils scientifiques, professionnels et tout
simplement humains. Puisse donc le Très-Haut, du haut de son
Trône, se souvenir d'elle afin de lui accorder grâces sur
grâces ;
mon Superviseur Scientifique : Dr Kouadio Konan-Kan
Hippolyte à qui je voudrais exprimer ma gratitude pour ses
critiques pertinentes, ses conseils avisés, ses remarques et directives
sans lesquelles je n'y serai pas arrivé. Que l'Eternel vous
bénisse abondamment ;
Dr Akoto Odi Faustin, Chercheur au
Laboratoire des Sciences du Sol, de qui j'ai reçu continuellement des
instructions constructives depuis la Licence 3. Vous m'avez inspiré dans
mon choix de Labo ;
Dr Ettien Djétchi Jean Baptiste, pour
ses encouragements lors de mes manipulations en laboratoire ;
Dr Bolou Bi Bolou Emile, pour avoir mis
à notre disposition son matériel sans lequel une part du travail
n'aurait pu être fait et aussi pour ses instructions constructives lors
de ses passages en laboratoire. Que Dieu fasse déborder votre
coupe ;
Dr Bahan Frank Michael Lemonou,
Attaché de Recherche au programme riz du Centre National de
Recherche Agronomique (CNRA) de Man pour ses conseils et mises au point qui ont
indéniablement été incontournables pour la
rédaction de ce document ;
mes chers collègues Boueunan Wongbé
Béralex et Diomandé Moussa, que le
Seigneur Jésus-Christ vous ouvre les portes du succès pour votre
aide inestimable ;
mes jeunes collègues Koffi Tanoh Jean-Noël
et Kouakou N'Guessan Hermann, je dis merci pour votre
disponibilité sans faille ;
mes devanciers et particulièrement les doctorantes
Koffi Affoué Larissa et Kouakou Sainte Adélaïde
que je ne saurai oublier pour leurs aimables conseils et directives
qui ont été des boussoles dans le déroulement de mes
travaux.
J'adresse également des remerciements à tous les
responsables et enseignants de l'UFR des Sciences de la Terre et des Ressources
Minières (STRM), qui ont, par leur travail et
VI
leur soutien, largement contribué d'une certaine
manière, à la réalisation de ce document et à mon
évolution au sein de ladite UFR.
Je remercie également les membres du jury qui ont bien
voulu juger de ce travail malgré les lourdes tâches qui leur
incombent.
Je ne saurais terminer sans dire merci à vous les
âmes les plus chères de ma vie, mes très chers parents,
vous avez fait plus que votre devoir, je voudrais que vous sachiez que je vous
aime, et que je rends louange à Dieu de m'avoir donné ce
privilège d'être votre fils ; puisse la divine main de l'Eternel
être constamment votre bouclier afin de prolonger vos jours pour que du
fruit de votre labeur (ma réussite), vous jouissiez pleinement.
Que soient ici, chaleureusement remerciées, toutes les
personnes qui ont, par leurs conseils et critiques, contribué à
la réalisation de ce travail.
VII
LISTE DES FIGURES
Figure 1 : Réserves mondiales en roches phosphates en Mt.
5
Figure 2 : Dynamique du phosphore dans le système
engrais-sol-plante. 6
Figure 3 : Mécanismes d'amélioration de la
croissance des plantes par des bactéries solubilisant
le phosphate. 9
Figure 4 : Carte du département de Man. 12
Figure 5 : Carte géologique de la zone d'étude.
15
Figure 6 : Matériels de terrain. 17
Figure 7 : Matériels de laboratoire. 18
Figure 8 : Substrats de culture utilisés pour la mise en
place de l'expérimentation. 18
Figure 9 : Souche bactérienne isolée du sol de
plateau de Man provenant des sols de plateau. . 19
Figure 10 : Prélèvement des échantillons de
sol. 20
Figure 11 : Remplissage des boîtes de petri. 22
Figure 12 : Milieu PVK liquide (A) et Milieu PVK solide (B).
22
Figure 13 : Microplaque ensemencée présentant un
halo de solubilisation autour d'une colonie.
24
Figure 14 : Microplaque témoin non-ensemencée 24
Figure 15 : Dispositif expérimental. 26
Figure 16 : Courbe étalon du phosphore 29
Figure 17 : Courbe étalon de l'isolat (souche 1) retenue
pour l'expérimentation en pot. 30
Figure 18 : Triangle textural de l'Aisne couplé à
l'échantillon de sol observé. 32
Figure 19 : Evolution des paramètres du milieu au cours du
temps en présence et en absence de
la paille de riz. 36
Figure 20 : Évolution du pH au cours du temps d'incubation
sous différents traitements. 38
Figure 21 : Évolution de la quantité de P dissous
au cours du temps d'incubation sous les
différents traitements 39
Figure 22 : Évolution
du nombre de bactéries au cours du temps d'incubation sous les
différents
traitements. 42
VIII
LISTE DES TABLEAUX
Tableau I : Contenu des différents traitements
apportés 27
Tableau II : Composition granulométrique du sol
utilisé 32
Tableau III : Caractéristiques chimiques du sol 33
Tableau IV : Dénombrement de la microflore (unité
formant des colonies (UFC)). 105/g de sol
sec sur les différents milieux de culture. 33
Tableau V : Concentrations de N, P, K, Ca, Mg et C dans la paille
de riz 34
Tableau VI : Composition chimique de la roche phosphate du Maroc
34
Tableau VII : Caractéristiques macroscopiques des souches
bactériennes solubilisatrices de
phosphate rencontrées sur le sol de plateau. 35
Tableau
VIII : Test statistique de l'évolution des paramètres du milieu
avec ou sans la paille de
riz 37
Tableau IX : Carbone organique dissous au bout de 60 jours
d'incubation 40
Tableau X : Effet des amendements phosphatés sur les
paramètres du milieu après 60 jours
d'incubation 43
Tableau XI : Effet de l'inoculation sur les paramètres du
milieu 44
Tableau XII : Effet de l'inoculation sur les différents
traitements 45
Tableau XIII : Tableau des absorbances des solutions tampons de P
XVI
IX
LISTE DES SIGLES ET ABRÉVIATIONS
Al : Aluminium
AP : Amendement Phosphaté
BSP : Bactérie Solubilisatrice du Phosphore
Ca : Calcium
CEC : Capacité d'Echange Cationique
CIRAD : Centre de coopération internationale en
recherche agronomique pour le développement
COD : Carbone Organique Dissous
CNRA : Centre National de Recherche Agronomique
CPCS : Commission de Pédologie et de Cartographie des
Sols
EP : Efficacité Agronomique
FAO : Food and Agriculture Organization (Organisation des
Nations Unis pour l'Alimentation
et l'Agriculture)
Fe : Fer
GPS : Global Positioning System (Système de
Localisation (de mobiles) par Satellite)
I : Inoculum
IS : Indice de Solubilisation
ISSS : International Society of Soil Sciences
(Société Internationale des Sciences du Sol)
M : Molaire
MO : Matière Organique
MSP : Microorganisme Solubilisateur du Phosphate
Mt : Milliard de tonnes
MT : Microflore Totale
N : Azote
NB : Nutrient Broth (Bouillon Nutritif)
OCP : Office Chérifien des Phosphates
OFEFP : Office Fédéral de l'Environnement, des
Forêts et du Paysage
P : Phosphore
PN : Phosphate Naturel
PRICI : Projet de Renaissance des Infrastructures et de
Gestion Urbaine en Côte d'Ivoire
PVK : Pikovskaya's
RPCP : Rhizobactéries Promotrices de la Croissance des
Plantes
RGPH : Recensement Général de la Population et
de l'Habitat
X
RP : Roche phosphatée
TSP : Triple Super Phosphate
WRB : World Reference Base (Base Mondiale de
Référence (BMR)) YR : Yellow Red (rouge jaunâtre)
XI
LISTE DES ANNEXES
Annexe I XIV
Annexe II XVI
Annexe III XVII
Annexe IV XVII
RÉSUMÉ
A cause de sa faible disponibilité sous forme
directement assimilable par les plantes, le phosphate est un facteur limitant
dans les sols. Ainsi, pour atteindre de meilleurs rendements agronomiques il
faudrait mettre en place des techniques visant à augmenter sa
disponibilité pour les plantes. La présente étude portant
sur l'évaluation de l'efficience des BSP sur la minéralisation de
différents types d'amendements phosphatées révèle
la dominance d'une souche S1 dans la solubilisation des AP. Elle a donc servi
à des tests en laboratoire sur différentes proportions
d'amendements phosphatés dont les résultats montrent qu'elle a un
effet très hautement significatif sur les paramètres du milieu de
culture. Plus le nombre de BSP augmente dans le milieu, plus le taux de P
dissous et le COD augmentent tandis que le pH décroit au cours du temps.
De même, l'apport de paille a contribué à augmenter le P
dissous et le COD mais a fait baisser le pH à 4,8. Cependant, les
traitements ont augmenté le pH. Le taux de COD était plus
élevé avec l'inoculation (1,96 mg.kg-1). Le taux de P
minéralisé était maximal sur le traitement T8 (0%RP +
100%TSP) (49,5 mg.kg-1) mais le traitement T5 (60% RP + 40% TSP)
serait le mieux approprié pour des essais au champ; car c'est ce
traitement qui, comparé au premier jour a donné en moyenne le
plus fort taux en ce qui concerne le P libéré (138,47%). La
combinaison de BSP-AP-paille de riz serait prometteuse comme alternative pour
accroitre l'efficacité des AP singulièrement en ce qui concerne
l'utilisation de RP.
XII
Mots clés : Roche phosphatée, BSP,
inoculation, sol acide, Côte d'Ivoire.
ABSTRACT
Because of its low availability in directly assimilable form
by plants, phosphate is a limiting factor in soils. To achieve better agronomic
yields, techniques should be put in place to increase phosphate's availability
for plants. This study, on the evaluation of efficiency of PSBs on the
mineralization of different types of phosphate amendments, reveals the
dominance of an S1 strain in PAs solubilization. It has therefore been used for
laboratory tests on different proportions of phosphate amendments whose results
showed that it has a very highly significant effect on the parameters of the
culture medium. As the number of PSB increases in the medium, the rate of
dissolved P and DOC increases, but the pH decreases over time. Besides, putting
rice straw in the medium contributed to increase dissolved P and DOC but
lowered the pH to 4.8. However, the treatments have increased the pH. DOC was
higher with inoculation (1.96 mg.kg-1). The mineralized P level was maximal on
the treatment T8 (0% PR + 100% TSP) (49.5 mg.kg-1) but the treatment T5 (60% PR
+ 40% TSP) would be the most appropriate for tests at the field; because it is
this treatment which compared to the first day, gave on average the highest
rate with regard to the increase of the released P (138.47%). The combination
of PSB-PA-rice straw would be a promising alternative to increase the
efficiency of PA particulary with regard to the use of PR.
XIII
Keywords : Phosphate rock, PSB, inoculation,
acide soil, Côte d'Ivoire.
1
INTRODUCTION GÉNÉRALE
À l'instar du potassium (K) et de l'azote (N), le
phosphore (P) est l'un des trois éléments nutritifs majeurs
impliqués dans la croissance des végétaux, mais il est
considéré comme facteur limitant dans les sols, surtout ceux
à la fois altéré et vieux des régions tropicales
(Vitousek et al., 2010). Selon Vance et al., (2000), 40% des
sols de la planète sont déficitaires en P, spécialement,
ceux des zones tropicales et subtropicales. Cette carence en P entraine une
baisse du rendement et de la production des plantes en général et
du riz en particulier (Kotchi et al., 2010). Les 20 premiers
centimètre du profil d'un sol agricole contiennent une à trois
tonnes de phosphore par hectare. Malgré cette forte quantité de P
total, le P disponible ne dépasse pas 10 mg.kg-1 avec
l'extraction Olsen (Rabeharisoa, 2004). Le meilleur pourcentage de phosphore
disponible pour la plante, dans la solution du sol se situe entre 2 et 5%. Ce
déficit de P directement assimilable par la plante, va limiter
l'activité des microorganismes spécialisés dans la
minéralisation de la matière organique du sol, dont la teneur est
par ailleurs, particulièrement faible (Randriamanantsoa et al.,
2013 ; Rabeharisoa, 2004). Pour pallier ce problème, des engrais
chimiques solubles, à des coûts prohibitifs pour les petits
paysans, sont appliqués aux sols pour atteindre des rendements
appréciables. Toutefois, mal appliqués, les fertilisants
phosphatés peuvent réduire la fertilité du sol par la
mobilisation des colloïdes organiques (Siemens et al., 2004 ; Ilg
et al., 2005) et une utilisation excessive d'engrais minéraux
conduit à une diminution de l'efficacité d'utilisation des
nutriments, surtout le phosphore et l'azote, avec des effets néfastes
sur l'atmosphère (Aulakh et Adhya, 2005). Aussi, selon Abbasi et
al., (2015), seulement 1 % des engrais phosphatés appliqués
est utilisé par la plante. Pour Khan et al., (2007) et Servin,
(2014), la majorité (70 à 90 %) des engrais phosphatés
utilisés en agriculture précipitent après leur application
(Mehta et al., 2014). Ils forment des complexes métalliques
limitant ainsi leur efficacité qui dépend des conditions
édaphiques du sol tels que la CEC, le type de cations, le pH, les
substances humiques et le complexe organométallique (Li et Stanforth,
2000 ; Riggle et Von Wandruszka, 2005 ; Servin, 2014). Ainsi, du fait du prix
élevé des engrais phosphatés, l'une des alternatives peu
coûteuses est l'utilisation des roches phosphatées (RP) qui est
une véritable source de phosphore (Kotchi et al., 2010). Mais
l'un des principaux obstacles de l'application directe des roches
phosphatées aux sols est la libération insuffisante de P pour
supporter la nutrition des plantes à cause de leur faible
solubilité dans le sol dépendant des caractéristiques du
sol (Smalberger et al., 2010 ; Servin, 2014). Les BSP
améliorent la quantité de P solubilisée dans le sol et
à partir des amendements phosphatés (AP) afin de les mettre
à la disposition des plantes (Khan et al., 2007). Aussi, le P
organique contenu dans la matière organique ne peut être
disponible pour les plantes qu'après décomposition et
2
minéralisation par les microorganismes (Smith et
al., 2003 ; Pereda Campos, 2008). Pour augmenter l'efficacité
agronomique des roches phosphatées (RP), plusieurs techniques ont
été déjà testées :
- le compostage de résidus organiques avec des RP (Saleem
et al., 2013) ;
- l'acidulation partielle des RP (Kpomblekou et Tabatabai, 2003)
;
- le mélange des phosphates naturels avec des engrais
phosphatés hydrosolubles (Mashori et al., 2013) ;
- la solubilisation des roches phosphatées par des
microorganismes (Servin, 2010 ; Abbasi et al., 2015).
Mais, les méthodes de fertilisation phosphatée
doivent être, non seulement, selon les besoins des végétaux
en cet élément, mais également, en fonction des
mécanismes de sa mise à la disponibilité et de son
utilisation par ces végétaux afin d'accroitre les rendements.
C'est dans ce contexte que l'Office Chérifien des
Phosphates (OCP) a décidé de mettre en place des amendements
phosphatés (AP), composés de différentes proportions de RP
et TSP, afin de freiner la chute du pH des sols et d'améliorer la
nutrition phosphatée des plantes. Dès lors, on se demande quel
serait l'impact des BSP sur l'efficacité de ces amendements
phosphatés.
Notre étude, intitulée « efficience des
bactéries solubilisant le phosphate (BSP) sur la minéralisation
des amendements phosphatés (AP) en sols acides : cas d'une parcelle
rizicole du plateau de Man (Ouest de la Côte d'Ivoire) » s'inscrit
dans ce même cadre. Elle vise à évaluer l'efficience des
BSP sur la minéralisation de différents types d'amendements
phosphatés. Spécifiquement, il s'agit de :
- déterminer l'effet des amendements organique (apport de
paille de riz) et phosphaté sur les paramètres physico-chimiques
du milieu ;
- évaluer l'efficience des bactéries
solubilisatrices de phosphate (BSP) sur les différents traitements.
Pour atteindre ces objectifs, nous allons vérifier les
hypothèses ci-après :
- l'apport de paille de riz et d'amendements phosphatés au
sol modifierait ses paramètres ;
- les BSP influenceraient la minéralisation des
amendements phosphatés (AP) et le pH des sols acides.
Le présent mémoire qui rend compte de notre
travail s'articulera autour de trois grandes parties. La première partie
concernera les généralités qui permettront de mettre en
exergue les connaissances sur les AP et les BSP, puis viendra la
présentation de notre zone d'étude. La deuxième partie
rend compte du matériel et des méthodes utilisées. Pour ce
qui est de la troisième partie, elle sera consacrée à
la
3
présentation, l'interprétation et à la
discussion des résultats axée sur les hypothèses.
L'étude s'achèvera par une conclusion assortie de perspectives
pour d'éventuelles recherches visant des objectifs similaires. Des
annexes complètent le document.
PARTIE I : GÉNÉRALITÉS ET ZONE
D'ÉTUDE
CHAPITRE I : GÉNÉRALITÉS
CHAPITRE II : PRÉSENTATION DE
LA ZONE D'ÉTUDE
4
CHAPITRE I : GÉNÉRALITÉS SUR LES
PHOSPHATES
Introduction
Dans ce chapitre, nous nous évertuerons à
présenter, en nous basant sur les connaissances et principes
préalablement établis par les travaux antérieurs, les
amendements phosphatés et BSP. C'est donc une synthèse de ces
dits travaux.
I.1 Phosphates
I.1.1 Origine des phosphates
L'association des ions métalliques et des ions
phosphates (PO4)3- donne lieu aux roches phosphatées (RP). Le
terme de « roche phosphatée » désigne les assemblages
minéraux naturels contenant des minéraux phosphatés tant
en quantité élevée qu'en faible proportion. Ils
proviennent de dépôt géologiques d'origines
différentes (FAO, 2004). Environ 80 à 90% de la production
mondiale est issue des gisements sédimentaires localisés dans des
formations d'âges géologiques très différents. Ces
gisements montrent une gamme très large de compositions chimiques et de
formes physiques, se trouvant souvent en couches épaisses relativement
horizontales, et pouvant être à la base de terrains de
recouvrement peu profonds. Les gisements qui représentent la majeure
partie de la production mondiale de RP sont au Maroc (Figure 1) et dans
d'autres pays africains, aux Etats-Unis, au Proche Orient et en Chine. La
plupart des gisements sédimentaires contiennent de la fluoroapatite
carbonatée appelée francolite (McConnell, 1938). Les francolites
ayant une importante substitution avec les carbonates de phosphate, ils
s'avèrent fortement réactifs et sont les plus appropriés
pour l'application directe comme engrais ou amendement.
La RP est une ressource naturelle finie et non renouvelable.
Le phosphate de calcium est un autre type de RP qui se trouve dans des roches
magmatiques et dans des roches sédimentaires de différents
âges. Ces roches peuvent avoir été plus ou moins
métamorphisées ou remaniées, altérées ou
lessivées. Plus de 80% des besoins mondiaux en P, exprimés en
millions de tonnes (Mt) de minerais en place, est fournie par la Chine, le
Maroc, la Russie et les Etats Unis d'Amérique (Ouchiha et Oulebsir,
2013).

5
Figure 1 : Réserves mondiales en roches
phosphates en Mt.
Source : US Geological Survey (2010)
I.1.2 Dynamique du phosphore dans les sols
La quantité de phosphore présent dans le sol,
plus précisément dans les tous premiers centimètres est
considérable. Cette teneur varie entre 600 et 1000 mg P.kg
sol-1, malgré ce fait, la partie disponible pour les plantes
se trouvant dans la solution du sol sous forme d'orthophosphate ne
représente que quelques milligrammes par kilogramme de sol (Berne,
2004). Les ions orthophosphates (P inorganique) sont en grande partie
présents sous la forme de divers phosphates de Ca (notamment des
apatites) dans les sols neutres à alcalins. Dans les sols acides et
très altérés abondamment présents en zone
tropicale, ils sont largement liés aux minéraux d'Aluminium, de
Fer et argileux de type 1-1 (Jones and Oburger, 2011). Ainsi, quoi qu'en
général les sols, y compris les sols ferrallitiques de Côte
d'Ivoire, renferment du P en quantité importante (Rabeharisoa, 2004), la
quantité directement disponible pour les plantes n'excède pas 2%
(Richardson et al., 2009a), les 98% restant précipitent et sont
transportés par diffusion. Les principaux mécanismes
régissant la disponibilité du P dans les sols sont :
? dissolution et précipitation de P avec le carbonate
de Calcium et les formes amorphes du Fer et de l'Aluminium ;
? adsorption et désorption de P sur les sites
d'adsorption des argiles (Rao et al., 2004) ;
? capacité des MSP du sol à fixer et
minéraliser le P organique ;
? complexation et chélation des oxyhydroxydes de Al et
Fe par les exsudats racinaires.
Les phénomènes de désorption et de
solubilisation du P inorganique et la minéralisation du P organiques
dans les sols conditionnent la disponibilité du P directement
assimilables par les plantes
6
(Figure 2) (Richardson et al., 2009a). Le P organique
est le P présent dans l'humus et la matière organique
fraîche à un taux de 25 à 30 % du phosphore total des sols
cultivés de longue date, et un taux de 75 et 80% dans les sols des
forêts et prairies (zones à couverture végétale
permanente naturelle (Fardeau et Conesa, 1994). Dans les sols, il est
majoritairement sous la forme d'inositolphosphates. Ces derniers, et
particulièrement l'acide inositolhexaphosphorique (phytate), constituent
presque 50% du P totale dans les sols (Turner et al., 2002) ; ils
représentent donc des réserves considérables de phosphore
dans les sols pouvant être utilisés comme engrais direct pour
améliorer la nutrition des plantes. Dans certains cas, pour pallier
cette carence, les plantes font appel aux processus physico-chimique comme
l'acidification de la rhizosphère (Hinsinger, 2001 ; Rengel, 2008 ;
Sánchez Chávez et al., 2009), qui modifie le taux de P
inorganique disponible par action sur la cinétique
d'adsorption-désorption du P (Richardson et al., 2009a). Par
ailleurs, l'activité de la phytase est inhibée par l'acide
humique en présence de Fe (Pospisil et Hrubcová 1975) ou d'Al (He
et al., 2006) entraînant l'accumulation de phytate dans le sol.
Pour augmenter la teneur en phytate sorbé en goethite, les plantes
produisent des anions organiques (Giles et al., 2012). La
décomposition et la minéralisation du P organique de la
matière organique (MO), dépend non seulement de la composition de
la MO elle-même mais aussi de l'humidité du sol, de la
concentration en oxygène dans le sol et du pH (Stroia, 2007 ;
Andrianambinina, 2013), nécessite l'intervention de microorganismes
(Smith et al., 2003 ; Pereda Campos, 2008).

Figure 2 : Dynamique du phosphore dans le système
engrais-sol-plante. Schéma adapté d'après De Brouwer
et al. (2003) et Richardson et al. (2009)
7
Bien qu'il ait été considéré
pendant de nombreuses années comme étant immobile car lié
aux particules de sol (Haygarth et Jarvis, 1999), des études ont
montré que le phosphore inorganique (Pi), à l'instar des autres
éléments chimiques du sol peut être perdu sous forme de
Phosphore transféré de façon accidentelle (PTA) ou de
phosphore transféré sous forme dissoute (PTD) ou encore de
phosphore transféré associé à des solides (PTS),
suite aux processus de lixiviation, de lessivage, de ruissellement,
d'écoulement de subsurface et d'érosion (Berne, 2004).
Des travaux de recherche menées conjointement par
Kassin et al., en 2012 sur le territoire ivoirien, ont permis de
savoir que 81% des sols ivoiriens sont déficitaires en P. La Côte
d'Ivoire se révèle donc être un pays exportateur
d'amendements phosphatés afin d'accroitre ses productions.
I.1.3 Engrais phosphatés et roche phosphaté
(RP)
Une étude menée par Khan et al., (2007)
a rapporté que 76 à 90% des engrais phosphatés
apportés aux sols précipitent pour former des complexes de
cations métalliques. L'amendement des sols avec la RP seul plutôt
qu'avec le triple super phosphate (TSP) s'avère bien plus efficace dans
la mise à disposition du phosphore assimilable par les plantes
(Smalberger et al., 2010). L'application des engrais phosphatés
solubles libère rapidement du phosphore pour les plantes tandis que
l'application de RP libère lentement le phosphore mais son effet
s'étend sur plusieurs années (FAO, 2004; Smalberger et
al., 2010). L'apport de RP aux sols s'avère plus efficace dans les
sols acides (Begum et al., 2004; FAO, 2004) comparativement aux sols
neutres ou alcalins où son efficacité est quasi
négligeable (Begum et al., 2004). En effet, FAO (2004) rapporte
que sur les sols neutres voir alcalin, les ions hydroxyle libérés
dans le milieu sont neutralisés ; ce qui ne favorise pas la poursuite du
processus de dissolution des RP. De plus, du fait de son coût accessible
à tous, il se présente comme un excellent substituant des engrais
phosphatés solubles. Cependant, les paramètres du sol telles que
l'acidité, la CEC, la concentration en phosphore de la solution du sol
et la capacité de rétention du phosphore, les conditions
climatiques, la matière organique du sol) conditionnent son
efficacité agronomique relative (EP) et sa réactivité
(FAO, 2004; Smalberger et al., 2010). La quantité de P
disponible pour les plantes dans le sol est faible soit du fait de la
sécheresse soit du fait de l'incapacité des racines à
l'absorber car souvent sous forme insoluble (Koné et al.,
2010). Ainsi, plusieurs alternatives pour augmenter la
réactivité des RP ont été essayées ; en
occurrence, l'incorporation d'additifs, acidulation partielle (Kpomblekou-A et
Tabatabai, 2003), fabrication de compost avec les RP et des engrais
phosphatés solubles dans l'eau (Kpomblekou-A et Tabatabai 2003), et
l'utilisation de microorganismes solubilisant les phosphates (MSP) (Vassileva
et al., 1997).
8
I.2 Bactéries solubilisatrices du phosphate
(BSP)
I.2.1 Solubilisation des roches phosphatées par les
microorganismes du sol
De nombreuses études, sur la possibilité de
développer des biofertilisants à partir des microorganismes
capables de solubiliser le P en général mais ceux se trouvant
dans les sols en particulier, sont menées depuis des années afin
d'améliorer l'alimentation minérale de la plante en phosphore
(Gyaneshwar et al., 2002). Les microorganismes du sol se sont
généralement révélés efficaces pour rendre
le P disponible aux plantes, qu'il s'agisse de sources inorganiques ou
organiques, en solubilisant et en minéralisant les composés P
complexes (Khan et al., 2014). Les souches telles que rhizobia
et bradyrhizobia ont de nombreuses propriétés
propres aux rhizobactéries promotrices de la croissance des plantes
(RPCP), plus précisément des attributs visant à
solubiliser les phosphates et à stimuler la croissance des plantes
(Alikhani et al., 2006).
Il existe une multitude d'autres micro-organismes et
champignons qui ayant des facultés remarquables de solubilisation des
phosphates, favorisent la croissance des plantes, soit par chélation
(excrétion d'acides organiques ou production de sidérophores) et
/ ou acidification (par ionisation d'acides organiques ou libération de
protons), soit par accompagnement de la respiration ou assimilation de
NH4+) (Reyes et al., 2001; Song et al., 2008).
Ainsi, en agriculture durable l'application direct des RP se
présente comme rentable comparativement aux engrais phosphatés
(Reddy et al., 2002). Toutefois, pour augmenter leur efficacité
en agronomie, les RP doivent être alliées aux MSP du sol
impliqué dans la translocation du P soluble (Smith et Read, 1997).
I.2.2 Contribution des microorganismes solubilisateurs du
phosphate (MSP) à la croissance des plantes
L'aptitude des MSP à augmenter la production a
été démontrée après de nombreuses
expérimentations menées en laboratoire et aux champs. Ils
influent sur l'augmentation de la productivité et l'amélioration
de la croissance et du rendement de plusieurs cultures (Khan et al.,
2009). Tel que résumé sur la Figure 3, ces microorganismes
pourraient également contribuer au développement des plantes en
sécrétant des nutriments essentiels, en augmentant
l'incorporation symbiotique ou non symbiotique de l'azote moléculaire et
la production des sidérophores, des antibiotiques et d'acide
cyanhydrique (HCN) (Khan et al., 2009). Les mécanismes telles
que (i) le développement accrue des rhizomes par une extension des
systèmes racinaires déjà présents ou par
stimulation hormonale de la
9
croissance des racines, ramification ou développement
de poils radiculaires (Richardson et al., 2009a; Hayat et al.,
2010), (ii) la modification des équilibres de sorption pouvant
entraîner une augmentation du transfert d'ions orthophosphate dans une
solution du sol ou faciliter la mobilité du P organique, directement ou
indirectement par le renouvellement microbien (Seeling et Zasoski, 1993) et
(iii) l'induction de processus métaboliques qui sont efficaces pour
solubiliser et minéraliser directement le P avec modération en
des formes disponibles de P inorganique et organique du sol (Richardson et
al., 2009a) ; sont utilisés par les microorganismes afin
d'accroitre les capacités des plantes à acquérir le P.
Suite à plusieurs travaux de recherche menées sur le sujet, les
microorganismes dissolvant le phosphore et améliorant la croissance des
plantes sont classés en deux groupes. Le premier groupe se compose de
ceux qui vivent à l'état libre non loin des racines et souvent
même sur la racine sans y être liés ; et le deuxième
groupe est constitué de ceux qui vivent en symbiose avec les plantes
(Leggett et al., 2001). Le deuxième groupe a fait l'objet de
plusieurs études dans le but d'accroitre la production de plusieurs
cultures (Frey-Klett et al., 1999). En 1989, le rendement du
blé et l'absorption du phosphate par ce dernier s'est accru de
façon considérable après inoculation avec Penicillium
bilaji (Kucey et Leggett, 1989). De même, du maïs
inoculé avec des isolats d'Enterobacter et Pseudomonas ont donné,
après 60 jours de croissance, des augmentations significatives (7
à 9%) de l'élongation des plants de maïs (Chabot, 1996a).
D'autres expérimentations menées en serre par Domey et Lippman
(1989) sur le blé inoculé montre une augmentation de 8% pour ce
qui est du rendement de la partie aérienne et de 17 à 57%
concernant l'assimilation du phosphore.
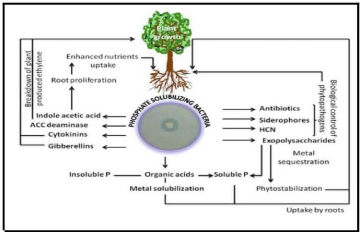
Figure 3 : Mécanismes d'amélioration de la
croissance des plantes par des bactéries solubilisant le phosphate.
Source: Khan et al. (2009)
10
I.3 Phospho-compost
La fabrication de compost est un processus naturel de
décomposition de la matière organique par les micro-organismes
dans des conditions bien définies. Les matières premières
organiques, telles que les résidus de culture, les déchets
animaux, les restes alimentaires, certains déchets urbains et les
déchets industriels appropriés, peuvent être
appliquées aux sols en tant que fertilisant, une fois le processus de
compostage terminé. Plusieurs travaux de recherche visant à la
fabrication de composts à partir de paille de riz et enrichis avec les
roches phosphatées ont été menés (Lompo et al.,
2009 ; Chaibou, 2013 ; Aziable et al., 2014). Le traitement des
phosphates naturels avec des matériaux organiques et leur compostage est
une technique prometteuse pour augmenter la solubilité des roches
phosphatées du Maroc et augmenter la disponibilité du phosphore
(P) pour les plantes. Le compost a un effet positif sur la biologie et les
caractéristiques physico-chimiques du sol car la matière
organique qu'il contient est un élément essentiel pour la faune
du sol. Elle constitue une source d'énergie et un réservoir
d'azote pour la synthèse des tissus des microorganismes.
I.3.1 Solubilisation des RP par les résidus
organiques
L'augmentation du taux de phosphore libéré par
les roches phosphatées résulte de l'acidification de la roche
phosphate par les acides organiques libérés lors de la
décomposition des résidus organiques, de la complexation des
cations métalliques Al3+, Fe2+ et Ca2+
par les substances humiques (issus de la décomposition des
résidus organiques) et surtout de la capacité de chélation
de ces acides sur le calcium (Ca), le fer (Fe) et l'aluminium (Al) (Chaibou,
2013 ; Aziable et al., 2014). L'acide fulvique est la plus
réactive des substances humiques car elle adsorbe des quantités
significatives de Ca2+ et en libère des ions H+,
augmentant de ce fait la dissolution de la roche phosphatée. L'acide
humique peut former des complexes avec le phosphore et le calcium, et
entraîner une augmentation de la dissolution de la roche
phosphatée (Singh et Amberger, 1990 ; Chaibou, 2013). De ce fait,
l'application de résidus organiques au sol augmente le phosphore
libéré et le met à la disposition des plantes (Aziable
et al., 2014).
I.3.2 Efficacité agronomique des
phospho-composts
En raison de sa forte teneur en phosphore soluble dans l'acide
citrique, l'efficacité agronomique des roches phosphatés dans les
phospho-composts est à prévoir comparé aux engrais
phosphatés directement appliqués. Les fractions solubles de
phosphore stimulent la croissance racinaire et facilitent une plus grande
exploitation du sol enrichi en phosphore par les plantes (llabib et al.,
1999 ; Chaibou,
11
2013). Des études antérieures ont montré
que le phospho-compost préparé en mélangeant des
résidus d'exploitation agricole, des déjections de bétail
et du sol est aussi efficace que le superphosphate simple (Zanguina, 2011) ;
même lorsqu'il est appliqué sur un sol tropical où la
dissolution directe des roches phosphatées est quasi impossible car
ayant un pli supérieur à 7,5 (Mishra et al., 1996). Un
avantage additionnel de l'application de phospho-compost est le mouvement du
phosphore dissous à une plus grande profondeur dans le sol, ce qui
permet l'exploration d'un plus grand volume de sol pour l'absorption de
phosphore par les plantes (Chaibou, 2013).
Conclusion partielle
Retenons que l'application de roche phosphatée avec un
MSP efficace pourrait améliorer le rendement des cultures et
l'absorption de P par les plantes de manière durable, car leurs effets
durent plus longtemps. Toutefois, il serait encore plus avantageux de les
associer à d'autres intrants tels que les phospho-composts et les
engrais phosphatés solubles dont l'effet est plus rapide dans le temps.
Cette technique peut être effectivement adoptée par les
communautés d'agriculteurs car elle est simple, économique et
peut aider à améliorer l'efficacité et la
disponibilité du phosphore dans les sols.
CHAPITRE II : PRÉSENTATION DE LA ZONE
D'ÉTUDE
Introduction
Dans ce chapitre, nous situerons notre zone d'étude
dans la localité de Man. Ensuite nous donnerons un aperçu de son
climat, sa végétation, son relief, de son contexte
hydrographique, géologique, pédologique, sa démographique
et les activités qui y sont pratiquées.
II.1 Localisation de la zone d'étude
Notre zone d'étude se situe à 585 km d'Abidjan
à la station du Centre National de Recherche Agronomique (CNRA) de Man.
Elle se situe entre 07°18' et 07°36' latitude Nord et 07°27' et
7°47' longitude Ouest à 500m au-dessus du niveau de la mer (Figure
4).
Man est le chef-lieu de la région du Tonkpi et la
capitale du District des Montagnes dans l'Ouest de la Côte d'Ivoire. On
la surnomme également la «cité des 18 Montagnes»
à cause des nombreuses chaînes de montagnes qui la ceinturent.
C'est une ville de 4140,7 km2. Le Département de Man englobe
onze Sous-préfectures : Man, Bogouiné, Fagnampleu,
Gbangbégouiné Yati, Logoualé, Podiagouiné,
Sandougou-Soba, Sangouiné, Yapleu, Zagoué et Ziogouiné. Il
est limité :
- au Sud par le Département de Bangolo ;
- au Nord par le Département de Biankouma ;
- à l'Ouest par le Département de Danané
;
- à l'Est par le Département de Kouibly.

Figure 4 : Carte du département de Man.
12
13
II.1 Climat
Le climat de Man et par ricochet de notre site d'étude
est un climat de montagne où la température diminue avec
l'altitude (jusqu'à 8° en janvier) et les précipitations
vont jusqu'à 1770 mm (PRICI, 2016). Il est caractérisé par
deux saisons dont une saison des pluies qui s'étend sur huit mois et une
saison sèche bien tranchée qui part de Novembre à janvier
avec un mois et demi d'harmattan (décembre à mi-janvier). Les
précipitations moyennes atteignent 1348 mm/an. Les températures
moyennes se situent entre 24 et 30°C (Figure 5) (Kaman, 2013). Septembre
est le mois le plus arrosé. Le régime pluviométrique est
unimodal avec des cumuls de 2 260 mm en 1999, 1 771 mm en 2000 (Koné
et al., 2010).
II.2 Végétation
La végétation du Département de Man et de
la Région du Tonkpi est constituée à 80% de forêt
tropicale humide dont une partie est transformée en jachères
à Chromolaena odorata (Sékou touré) tandis qu'une
autre partie est exploitée sous forme de plantations agro-industrielles
de café, de cacao ou d'hévéa sans oublier les culture
vivrières (manioc, riz, igname) (PRICI, 2016).
II.3 Relief
Le relief du Département de Man, comme dans toute la
zone Ouest du pays est constitué d'une série de bas-plateaux qui
s'enchaînent par endroits avec des zones très accidentées
aux contours variant entre des pentes moyennes et des altitudes
dépassant parfois les 1 000 m à l'image du Mont Nimba (1 752m) et
du mont Tonkpi (1293 m d'altitude). Ce relief dont l'aspect montagneux est
accentué par les mont Dan et Toura, est constitué d'une
succession de dômes et de collines séparés par des
vallées profondes. Il est accidenté sur 1/3 de sa superficie
(PRICI, 2016).
II.4 Contexte hydrographique
L'Ouest de la Côte d'Ivoire où se situe la zone
d'étude a un réseau hydrographique très dense qui draine
toute la région. Le fleuve Cavally fait office de frontière
naturelle entre le Libéria et la Côte d'Ivoire avec une longueur
de 600 km et un débit moyen de 600 m3/s. La superficie de son
bassin versant est de 30 000 km2 (Kaman, 2013). Les eaux de
ruissellement sont drainées vers le fleuve Sassandra par le biais du
Bafing au Nord, du Kouen à l'Est, du N'Zo grossi du N'Kô au Sud
(SODEXAM, 2005).
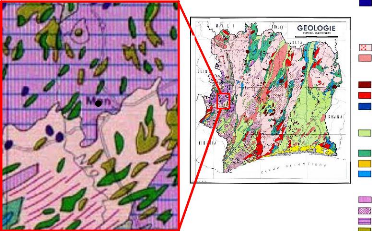
II.5 Contexte géologique de la région
Les formations géologiques rencontrées dans la
région de Man sont constituées essentiellement de roches
métamorphiques et de roches plutoniques (Figure 5).
- Les roches métamorphiques regroupées sous
l'appellation de métamorphites sont constituées de
14
gneiss, d'amphibolo-pyroxénites, des quartzites
ferrugineuses (à magnétites), des micaschistes et aussi
de migmatites, (Bessoles, 1997).
- Les roches plutoniques aussi appelées plutonites sont
constituées par un ensemble, de Granites,
de granodiorites, etc.
A ceux-ci, il faut ajouter le complexe charnockitique de Man
caractérisé par l'ensemble des
roches granitiques et gabbroïques toutes à
hypersthène, (Bessoles, 1997).
La tectonique de cette région présente, deux (02)
zones mylonitiques dues aux deux (2) accidents
majeurs de la région (la faille du Sassandra et la faille
de Danané). Les formations ont généralement les
directions suivantes :
- NE-SE dans le centre de la région,
- N-S au niveau de la faille du Sassandra,
- E-S dans la partie Nord-ouest de la région, (Bessoles,
1997).
La région de Man est dominée par deux accidents
majeurs :
- Un décrochement ductile qui est la faille de Sassandra
d'orientation N-S (Figure 5);
- Une faille plus ou moins parallèle à
l'orientation NNE-SSW qui est la faille de Danané.
On y rencontre des plis isoclinaux dont l'axe a une direction
NNO-SSE, (Bessoles, 1997).
QUATERNAIRE : Sédiments côtiers
TERTIAIRE et SECONDAIRE : Sédiments
sableux, argileux... PERMIEN et plus ancien (280-2400 M.a.) :
Dolérites, ?Kimberlites
8°
6°
4°
PROTEROZOÏQUE MOYEN et INFERIEUR
(Mégacycle éburnéen, 1500-2300 M.a.) Complexe
granitoïque baoulé
0 100 200 km
10°
10°
Granitoïdes à biotite homogènes et
hétérogènes Granitoïdes subalcalins à deux
micas
Complexe plutonique abronien
Granitoïdes discordants : Granodiorites, monzonites...
Granitoïdes concordants : Granodiorites, granites... Plutonites basiques
et ultrabasiques : Gabbros...
8°
8°
Man
Birrimien
6°
6°
Supergroupes de comblement : Conglomérats, grès,
schistes Supergroupes volcano-sédimentaires :
Métasédiments : Schistes, quartzites, roches
à manganèse... Métavulcanites quartziques :
Rhyolites...
Métavulcanites non quartziques : Basaltes,
andésites...
8° 6°
4°
15
Archéen ou Antébirrimien (Mégacycle
libérien, supérieur à 2300 M.a)
Granitoïdes
Migmatites, granites migmatiques Anorthosites, norites,
charnockites Itabirites, quartzites à magnétite Amphibolites,
pyroxénites
Gneiss divers
Roches à hypersthène
Figure 5 : Carte géologique de la zone
d'étude. Accidents, failles, mylonites
Echelle : 1/4 000 000
Réalisée à la SODEMI en 1972
G. BERTHOUMIEUX, Directeur
général
Rédaction et interprétation
B. TAGINI, Directeur des recherches
Travaux graphiques et Impression
M. GOBERT, Cartographe
Participation de R. CASANOVA,
Faculté des sciences de l'Université d'Abidjan
II.6 Caractère pédologique
Le sol de notre site d'étude est
considéré comme profond (>1m) et peu gravillonnaire car
contenant moins de 30 % de graviers et de couleur rouge (5YR à 2,5YR).
Il a été classé parmi les sols ferrallitiques fortement
désaturés en bases selon CPCS (1967) et serait selon ses
caractéristiques, un hyperdystric ferralsol selon l'International
Society of Soil Sciences (ISSS), International Soil Reference and Information
Centre (ISRIC) et l'Organisation des Nations Unies pour l'Alimentation et
l'Agriculture (FAO, 1998; Koné et al., 2010). Toutefois, il
existe dans le département de Man des sols hydromorphes (bas-fonds) et
des sols minéraux (montagnes) (PRICI, 2016).
16
II.7 Population et Activités
Selon le recensement général de la population et
de l'habitat (RGPH) de 2014, la population de Man est estimée à
188 704 habitants et se compose de Yacouba et Toura qui sont les ethnies
autochtones et de peuples venus des autres régions du pays et des pays
avoisinants (Libériens, Maliens, Burkinabés, Guinéens,
etc.). C'est une ville attrayante compte tenue de ses atouts touristiques
telles que ses cascades, la forêt des singes, la «dent de Man»,
le pont de liane. Les principales activités de la population sont
l'agriculture ; tant industrielle (Café, Cacao, hévéa) que
vivrière (riz, manioc, maïs, ...) et le commerce.
Quoiqu'étant très peu développées, les
activités telles que la pêche et l'élevage sont
pratiquées par la population.
Conclusion partielle
Notre zone d'étude se situe dans le département
de Man, à l'Ouest de la Côte d'Ivoire où la
végétation est constituée à 80% de forêt
tropicale humide. Le climat est constitué de d'une saison des pluies et
d'une saison sèche. Les précipitations annuelles atteignent 2400
mm et le relief est très accidenté au 1/3 de sa superficie. Le
sol de la zone d'étude fortement désaturé fait partie des
Ferralsols. Les principales formations rencontrées sont de type
métamorphiques et plutoniques.
PARTIE II : MATÉRIEL ET MÉTHODES
CHAPITRE III : MATÉRIEL
CHAPITRE IV : MÉTHODES
17
CHAPITRE III : MATÉRIEL
Introduction
L'étude a nécessité l'utilisation de
plusieurs matériels sur le terrain et au laboratoire pour mener à
bien les différentes activités. Ce chapitre s'attèlera
à la description de ce matériel.
III.1 Matériel de terrain
Comme matériel de terrain (Figure 6), nous avons
utilisé une massette (A) et un tube cylindrique (B) pour les
prélèvements de sols; un GPS de type GARMIN (C) pour la
localisation, un appareil photo pour les photographies, une balance
électronique pour la pesée des échantillons.
|
|
|
Figure 6 : Matériels de terrain.
|
III.2 Matériel de laboratoire
Au laboratoire, le matériel (Figure 7) s'est
composé d'un spectromètre (D) pour les lectures de DO, d'une
hotte aspirante équipée de lampe à rayons UV (E) pour les
manipulations en condition stérile, d'une étuve (F) pour le
conditionnement des boîtes de pétri et microplaques
ensemencés, d'un congélateur pour la conservation des
échantillons, d'un pITmètre (G), d'une balance de
précision (0,001g), d'une centrifugeuse, d'un distillateur (IT), d'une
autoclave (I) et d'un agitateur.


Figure 7 : Matériels de laboratoire.
III.3 Substrat de culture
Le substrat de culture (Figure 8) se constitue de sol de
plateau de la station du CNRA de Man (J), de roche phosphaté du Maroc
(K) et de triple super phosphate (L) fournis par l'office chérifien du
phosphate (OCP), et de paille de riz (M).

18
Figure 8 : Substrats de culture utilisés pour la
mise en place de l'expérimentation.
19
III.4 Matériel biologique
Une souche bactérienne solubilisant la roche
phosphatée (RP) isolé des sols de plateau de Man est le seul
matériel biologique de ce travail (Figure 9).
Figure 9 : Souche bactérienne isolée du
sol de plateau de Man provenant des sols de plateau.
Conclusion partielle
Le choix de tout ce matériel qui nous aura
été très utile dans la réalisation de nos travaux,
s'est fait sur la bases des objectifs que nous nous sommes fixés pour la
vérification de nos hypothèses.
CHAPITRE IV : MÉTHODES D'ÉTUDE
Introduction
Les différentes méthodes usitées pour
l'obtention des résultats à venir ont été
décrites et expliquées dans ce chapitre afin de faciliter leur
compréhension et leur éventuelle reproduction.
IV.1 Mise en place du dispositif
expérimental
IV.1.1 Echantillonnage
Sur la parcelle rizicole de plateau, les
prélèvements de sol (Figure 10) ont été
effectués selon les diagonales de la parcelle, de manière
à la couvrir totalement. L'échantillonnage s'est fait à
l'aide d'un tube cylindrique et d'une massette en 9 différents points
à une profondeur de 0-20 cm et mélangés pour obtenir un
échantillon composite, représentatif du site d'étude.
L'échantillon composite a été
divisé en deux parties. La première partie a été
conservée au congélateur pour la culture et la numération
des microorganismes puis pour l'isolement des souches bactériennes
solubilsatrices de phosphate. La seconde partie séchée à
l'air libre a servi à la mise en place de l'expérimentation et
à la caractérisation physico-chimique de la parcelle avant la
mise en place de l'expérimentation.

Figure 10 : Prélèvement des
échantillons de sol.
20
21
IV.1.2 Conditions expérimentales
La stérilisation de tous les milieux de culture,
(milieu gélosé, milieu physiologique, milieu nutriment Broth
(NB), milieu Pikovskaya's (PVK), eau distillée) et substrats de culture,
utilisés dans cette étude, a été faite à
l'autoclave pendant 30 minutes à 115°C, afin d'éliminer
toute trace de contamination. Les différents matériels de
laboratoires (pots et verres gradués, tubes à essai, les
cônes, les billes ; etc.), ont également été
soigneusement nettoyés puis stérilisés dans les
mêmes conditions. Pour le dénombrement bactérien, les
milieux de cultures préalablement stérilisés ont
été incubés à 28 °C, à
l'obscurité pendant 3 jours sur NB et 7 jours sur le milieu PVK avec des
boites de microplaque.
Pour l'expérimentation en pot, une partie de
l'échantillon de sol a été stérilisée
à l'autoclave sous une température de 120°C pendant 15
minutes à trois (03) reprises à intervalle d'un (01) jour.
IV.1.3 Préparation des milieux de culture
Le milieu gélosé utilisé pour la culture
des souches bactériennes sur milieu solide, a été
préparé à partir de 8 g d'Agar stérile dissous dans
1L d'eau distillée. La solution ainsi obtenue a été
ensuite homogénéisée et stérilisée à
l'autoclave à 115°C pendant 30min. Après refroidissement, la
solution gélosée a été transvasée dans les
boîtes de Pétri (Figure 11 et Figure 12) et laissée
à l'air libre jusqu'à solidification.
Le milieu NB, constitué de 8 g Nutrient Broth (NB)
Difco TM et de1000 ml d'eau ultra pure, additionné de nystatine, est
utilisé pour la culture des souches bactériennes et la
détermination de la microflore totale aérobie.
Le milieu Pikovskaya's (PVK) liquide (Figure 12) est
utilisé pour le dénombrement des microorganismes solubilisateurs
de phosphate (MSP), est constitué de 10g de glucose ; 0.01g de sulfate
d'ammonium hydraté; 0.2g chlorure de potassium; 0.2g de Chlorure de
sodium; 0.1g de sulfate de magnésium heptahydraté ; 0.002g de
sulfate de manganèse monohydraté ; 0.002g de sulfate de fer
heptahydraté; 0.5 g d'extrait de levure ; 5g de Tricalcium de phosphate.
Le pH du milieu PVK obtenu est maintenu entre (7-7,2) puis autoclavé
à 115 °C pendant 30min. Pour le dénombrement des
bactéries solubilisatrices de phosphate, le milieu PVK stérile
est additionné de nystatine pour éliminer toute trace de
fongiques.
Le milieu Pikovskaya's (PVK) solide (Figure 12) de composition
identique au milieu PVK liquide mais additionné d'agar (15g), de
nystatine (2 gouttes) et de bleu de Bromophénol (0,025 g) est
utilisé pour l'isolement et la sélection des bactéries
solubilisatrices de phosphate (BSP).
22
Figure 11 : Remplissage des boîtes de petri.
|
Figure 12 : Milieu PVK liquide (A) et Milieu PVK solide
(B).
|

IV.1.4 Recherche, isolement et sélection des
bactéries solubilisatrices de phosphate
La recherche de la microflore totale aérobie et la
microflore solubilisatrice du phosphate a été
réalisée en microplaque sur les milieux respectifs, NB et PVK
liquide à partir de 1g des sols de de plateau, dans 10 ml d'une solution
physiologique (NaCl).
IV.1.4.1 Préparation de l'inoculum,
ensemencement des microplaques et des boites de pétri
Les inoculas bactériens sont obtenus à partir de
la suspension initiale de sol dans un rapport sol/solution (1/10 g/ml). Des
dilutions successives de sol de 10-1 à 10-6 sont
réalisées pour ensemencer soit les microplaques à l'aide
d'une micropipette soit les boîtes de pétri à des billes
stériles. Chaque boîte de pétri ou microplaques contenant
les milieux de culture stériles reçoit 100 ìl de
suspension-dilution de sol avec 3 répétitions par dilution, et un
témoin non inoculé pour chaque ensemencement (Figure 13). Les
boîtes de pétri ou microplaques ainsi ensemencées sont
emballées avec du papier aluminium et mises à l'étuve
à une température de 30°C, à l'obscurité,
pendant 3 jours pour le milieu NB et 7 jours pour le milieu PVK. Après
incubation, un dénombrement des colonies et une numération des
types morphologiques observés sont effectués. La distinction
morphologique des colonies est basée sur des critères
macroscopiques de taille, forme, surface, contour, couleur de colonie,
formation de spores (forme et couleur), couleur de l'envers de la culture.
23
IV.1.4.2 Isolement de souches bactériennes
solubilisatrices de phosphate sur les boites de pétri
L'isolement s'est fait en trois étapes : une
pré-culture, une sélection et une purification des souches
bactériennes sur le milieu PVK.
· Pré-culture : 100 ul de la suspension
de chaque dilution (10-1 à 10-6) de sol sont
utilisés pour ensemencer les microplaques contenant le milieu PVK
liquide pendant 7 jours d'incubation. Après l'incubation, un lecteur de
microplaque est utilisé pour déterminer au
spectrophotomètre les DO à 620 nm le nombre de puits positifs,
correspondant à l'apparition d'un trouble bactérien. Les
résultats sont traités par un programme statistique
déterminant le Nombre le Plus Probable (NPP) de bactéries
présente dans l'échantillon qui est exprimé en UFC (nombre
d'Unités Formant Colonies) / g de sol sec.
· Sélection : après 7 jours
d'incubation à 30°C sur le milieu PVK liquide, les puits positifs
des plus faibles dilutions sont prélevés pour réensemencer
les boites de pétri contenant le milieu PVK solide contenat du bleu de
Bromophenol. Après 7 jours d'incubation, les souches sont
sélectionnées et isolées selon leur diversité
morphologique. La distinction morphologique des colonies s'est basée sur
des critères décrit par Sharna et al (2011). Il s'agit
de la forme, la couleur de la colonie, l'aspect, le diamètre de colonies
et des halos de solubilisation, puis l'indice de solubilisation (Figure13).
En effet, l'apparition d'un halo (zone claire) transparent autour
des colonies en croissance détermine la solubilisation du phosphate
(Figure13 et Figure 14), due à la présence d'acides produits par
les BSP. Ainsi, le diamètre de la colonie et du halo qui l'entoure sont
mesurés, puis l'indice de solubilisation (IS) est calculé par la
formule suivante :
IS =
Diamètre de la colonie + Diamètre de
Halo
Diamètre de la colonie
|
Halo de dissolution Colonie bactérienne
|
24
Figure 13 : Microplaque ensemencée
présentant un halo de solubilisation autour d'une colonie.
Figure 14 : Microplaque témoin non-ensemencée
? Purification : Les isolats ayant un IS >2 sont
sélectionnés puis réutilisés pour
réensemencer à nouveau des boites de pétri contenant le
milieu PVK solide (Figure 14). Cette procédure est
répétée cinq (05) fois jusqu'à l'obtention de
souche bactériennes pures. La souche ayant l'indice de solubilisation le
plus élevé a été utilisée pour la mise en
place de notre expérimentation.
IV.2 Test d'aptitude des isolats bactériens
à solubiliser le phosphate en microcosme
La capacité des isolats bactériens à
solubiliser le phosphate a été testée en microcosme dans
les tubes à centrifugeuses stériles en polypropylène de
50ml avec du tricalcium phosphate (Ca3PO4-) ou la roche
phosphatée du Maroc (RP), préalablement stérilisé
à l'UV, comme source de phosphore. Ainsi, 40
25
ml du milieu PVK stérile sont placés dans les
tubes contenant soit 2g du tricalcium phosphate (Ca3PO4-) soit 3g de
la roche phosphatée du Maroc (pour avoir 1g.l-1 de P dans le
milieu) et également 0,4 g de glucose (pour avoir 10 g.l-1 de
glucose dans le milieu) a été ajouté dans le milieu PVK
comme la source de carbone. Les tubes contenant les différents milieux
de culture de PVK sont ensemencés par 1 ml d'inoculum bactérien
isolé (108 bactéries.ml-1 de suspension).
Les tubes sont agités, emballés dans du papier aluminium puis mis
en incubation à l'obscurité pendant dix (10) jours.
Après 10 jours d'incubation, 5 ml des
différentes solutions sont prélevés dans chaque tubes,
centrifugées à 4000 tours pendant 15 minutes, puis le surnageant
obtenu est utilisé pour la détermination des paramètres
(pH, P et nombre de bactéries) du milieu de culture.
Le phosphore est dosé par colorimétrie au
spectrophotomètre à 790nm. Le nombre de bactéries a
été mesuré au spectrophotomètre par la
densité optique à 620nm.
IV.3 Mise en place de l'expérimentation en
Batch
IV.3.1 Incubation des pots en "Batch"
Pour compléter l'étude sur la capacité de
la souche bactérienne sélectionnée à solubiliser
efficacement le phosphate, une expérimentation en pots
a été menée au laboratoire.
30g de sol de plateau stérile ou non stérile ont
été introduits dans chaque pot de 400 cm2 de
superficie. Ensuite 0,6g de paille de riz comme source de carbone, pour avoir
0,15 tonne de paille à l'hectare, puis 1,2g des amendements
phosphatés composés de différentes proportions de roche
phosphatée (RP) et/ou le triple super phosphate (TSP) pour avoir 0,144g
P /pot et enfin 300 ml d'eau distillée stérilisée pour
avoir un taux d'humidité de 80 % ont été ajoutés,
puis homogénéisés. Les traitements inoculés,
reçoivent 250ul de l'isolat bactérien correspondant à
108 bactéries apportées par pot.
Les pots sont agités et mis en incubation pendant
soixante jours (60) jours.
Après 0 ; 10 ; 20 ; 30 ; 40 ; 50 et 60 jours
d'incubation, 5 ml des différentes solutions sont
prélevées dans chaque pot, centrifugées à 4000
tours pendant 15 minutes, puis le surnageant obtenu est utilisé pour la
détermination de l'évolution des paramètres (pH, P, le
carbone organique dissous et le nombre de bactéries) du milieu de
culture.
Le phosphore est dosé par colorimétrie au
spectrophotomètre à 790nm. Le nombre de bactéries a
été mesuré au spectrophotomètre par la
densité optique à 620nm.
26
IV.3.2 Dispositif expérimental
Le dispositif expérimental (Figure 15) est
composé de 9 blocs complétement randomisés de type
factoriel à 3 facteurs que sont le :
- Facteur « traitement » à 09 niveaux : T0, T1,
T2, T3, T4, T5, T6, T7, T8
- Facteur « Inoculation » à 02 niveaux : avec
inoculum (+I) et sans inoculum (-I)
- Facteur « Sol » à 02 niveaux : sol
stérile (Ster) et sol non-stérile (N. Ster).
Neuf (09) traitements ont été appliqués
dans cette étude (Tableau 1). Les intrants ont été
appliqués en raison de 90 kg.ha-1 de P2O5 par traitement soit
300 kg.ha-1 de RP hormis le témoin (T0) et le traitement
T1.

Figure 15 : Dispositif expérimental.
27
Tableau I : Contenu des différents
traitements apportés
|
Traitements
|
Intrants (%)
|
Quantité
RP
apportée
(kg.ha-1)
|
Quantité de paille apportée
(t.ha-1)
|
Inoculum
(I)
|
|
RP
|
TSP
|
|
T0
|
0
|
0
|
0
|
0
|
-I
|
|
T1
|
0
|
0
|
0
|
0,15
|
+I / -I
|
|
T2
|
100
|
0
|
300
|
0,15
|
+I / -I
|
|
T3
|
90
|
10
|
270
|
0,15
|
+I / -I
|
|
T4
|
80
|
20
|
240
|
0,15
|
+I / -I
|
|
T5
|
60
|
40
|
180
|
0,15
|
+I / -I
|
|
T6
|
40
|
60
|
120
|
0,15
|
+I / -I
|
|
T7
|
20
|
80
|
60
|
0,15
|
+I / -I
|
|
T8
|
0
|
100
|
0
|
0,15
|
+I / -I
|
|
IV.4 Méthodes d'analyse
|
|
|
|
|
|
IV.4.1. Caractérisation physico-chimique et
microbiologique du sol
La caractérisation physico-chimique concerne les
paramètres physiques (granulométrie) et chimiques (pH, C, N, P,
K, Ca, Mg, CEC) du sol de plateau de la station du Centre de Recherche
Agronomique (CNRA) de Man. Les analyses ont été
réalisées au laboratoire des sols et des végétaux
de l'Institut National Polytechnique Félix Houphouët Boigny
(INP-HB) de Yamoussoukro.
IV.4.1.1 Granulométrie
L'analyse granulométrique a été
réalisée par la méthode à la pipette de
Robinson-Köln qui consiste tout d'abord à détruire la
matière organique à l'eau oxygénée (H2O2) et
à disperser l'argile par l'hexamétaphosphate de sodium. Ainsi,
les fractions fines de 0 à 0,002 mm (argile) et de 0,002 à 0,02
mm (limon fin) sont déterminées à partir de
prélèvements effectués à l'aide de la pipette de
Robinson,
28
après un temps de sédimentation, suivant la loi
de Stokes. Les fractions grossières de 0,02 à 0,05 mm (limon
grossier) et les sables sont déterminés par tamisage à
sec, après siphonage.
IV.4.1.2 Détermination du pHeau et pHKCl dans
les échantillons de sol
Les mesures du pHeau (acidité effective) et du
pHKCl (acidité de réserve) de l'échantillon de
sol ont été obtenues par la méthode
électrométrique au pH-mètre avec une électrode en
verre (appareil 744 pHmetermetrohm). La détermination des
différents pH a été réalisée sur des prises
différentes, dans un rapport sol/solution 1/2,5 et en triplicats. Le
protocole adopté est le suivant : dans un bécher, 10g de sol sec
(< 2mm) sont ajoutés à 25 ml soit d'eau ultra pure, soit de
KCl (1N), puis agités pendant une heure et centrifugés à
7500 tr/min pendant 20min à 20°C ; après avoir laissé
reposer pendant 2h, la mesure des pH est effectuée dans le
surnageant.
IV.4.1.3 Dosage du carbone organique total et de
l'azote total
Le carbone organique total a été
déterminé selon la méthode de Walkley-Black utilisant
l'oxydation dans un mélange de bichromate de potassium et d'acide
sulfurique. Ainsi, on admet que la quantité d'oxygène
consommée est proportionnelle à celle du carbone que l'on veut
doser. La teneur en matière organique a été
calculée en multipliant la valeur du carbone obtenue par 1,72. L'azote
total (N-total) a été déterminé selon la
méthode de Kjeldahl, en oxydant les substances organiques après
traitement de l'échantillon de sol avec l'acide sulfurique
concentré. Le carbone et l'hydrogène se dégagent à
l'état CO2 et H2O. L'azote transformé en ammoniac, est
fixé par l'acide sulfurique, à l'état de sulfate
d'ammoniaque. Enfin, l'ammoniac formé est déplacé de ses
combinaisons par la soude caustique, distillée et recueillie dans une
solution d'acide sulfurique (1N), puis dosée par une solution
d'hydroxyde de sodium NaOH (1N).
IV.4.1.4 Cations échangeables et Capacité
d'Echange Cationique(CEC)
Les cations échangeables et la CEC ont
été mesurés selon la méthode de Metson qui comporte
trois étapes. Après la saturation de l'échantillon en ions
ammonium (NH4+) par percolations successives
d'une solution d'acétate d'ammonium (CH3CO2NH4)
à 1 mol.l-1, pour extraire les bases échangeables,
l'excès des ions ammonium est éliminé par percolations
d'alcool éthylique, on procède ensuite à leur
échange par une solution de chlorure de sodium à
1 mol.l-1. Les ions ammonium déplacés et les bases
29
échangeables sont dosés par la méthode
Kjeldahl, sur la solution de NaCl, une fois filtrée, pour
déterminer la CEC.
IV.4.2 Détermination des paramètres des
milieux de culture
IV.4.2.1 Détermination de la teneur en
phosphore
Le phosphore en solution a été
déterminé par spectrophotométrie grâce au kit
Spectroquant phosphate qui est une méthode basée sur le dosage
des ions orthophosphates. En effet, dans une solution sulfurique, les ions
orthophosphates forment avec les ions molybdates, l'acide phosphomolybdique.
Celui-ci est réduit par l'acide ascorbique en bleu de
phosphomolybdène (BPM), qui est dosé par photométrie.
L'absorbance a été mesurée à 790nm
et convertie en mg.kg-1 à l'aide de la gamme étalon
établie (Figure16).



1,2
1
y = 7,5116x - 0,0249
R2 =
0,9971
0,6
0,4
0,2
0
Concentration en (mgP/L) Ions
Phosphate
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16
DO (nm)
Figure 16 : Courbe étalon du phosphore
Y = Taux de phosphore;
X = Densité Optique ou Absorbance de l'échantillon
; R2 = Coefficient de determination
30
IV.4.2.2 Détermination du pH
La mesure du pH des milieux de culture a été
obtenue par la méthode électrométrique au pH-mètre
avec une électrode en verre (appareil 744 pHmetermetrohm) et s'est faite
dans le surnageant des solutions prélevées dans les pots
après incubation.
IV.4.2.3 Détermination du nombre de
bactéries
La densité optique du milieu de culture a
été déterminée par photométrie à 620
nm et le nombre de bactérie a été déterminé
à l'aide de la courbe étalon établie (Figure 16) à
partir de la mesure de la densité optique des dilutions de culture
bactérienne (100 à 108). En effet,
après la culture des souches dans le milieu NB pendant 24h, des
dilutions successives ont été réalisées
(100 à 108), puis la DO des différentes
dilutions a été mesurée à 620 nm. Le nombre de
bactérie de la plus faible dilution est déterminé
grâce à la cellule thomas. Ensuite, les données obtenues
ont permis de tracer une courbe d'étalonnage de croissance
bactérienne en fonction des DO (Figure 17), d'où la droite, y =
ax + b (avec y = nombre de bactérie ; et x = DO).
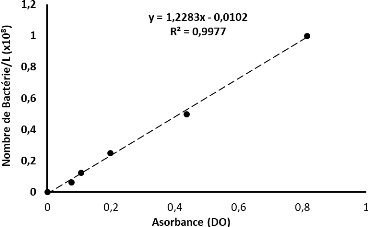
Figure 17 : Courbe étalon de l'isolat (souche 1)
retenue pour l'expérimentation en pot.
Y = Nombre de bactéries ;
X = Densité Optique ou Absorbance de l'échantillon
; R2 = Coefficient de détermination ;
31
IV.4 Analyses statistiques des données
Les données collectées lors de cette
étude ont été numérisées afin de les
traiter. Le logiciel SAS 9.0 a été utilisé pour comparer
les traitements entre eux et effectuer des analyses de variance (ANOVA) au test
de Student-Newman-Keuls (SNK) avec un seuil de 5 %. Le logociel XLStat de
Microsoft Excel 2016 a aussi été utilisé pour les tests de
corrélation.
PARTIE III : RÉSULTATS ET DISCUSSION
CHAPITRE V : RÉSULTATS
CHAPITRE VI : DISCUSSION
32
CHAPITRE V : RÉSULTATS
Introduction
Les résultats obtenus suites aux différentes
méthodes utilisées feront l'objet de description dans ce
chapitre. Il sera question des caractéristiques du sol et de
l'évolution des paramètres du milieu de culture.
V.1 Caractéristiques physico-chimique et
microbiologique de l'échantillon de sol
V.1.1 Analyse granulométrique et chimique du sol
La composition granulométrique du sol de plateau
prélevé sur la parcelle rizicole est résumée dans
le tableau II. D'après le triangle des textures de la Chambre
d'Agriculture de l'Aisne, ce sol à une texture Sablo-Argilo-Limoneux
(Tableau II, figure18).
Tableau II : Composition granulométrique
du sol utilisé
Argile (%) Limon (%) Sable (%) Texture
Sol de plateau 28,65 16,35 55 Sablo-Argilo-Limoneux
Figure 18 : Triangle textural de l'Aisne couplé
à l'échantillon de sol observé.
33
Dans l'ensemble, le sol est moyennement acide avec un pHeau de
5,2 et un pHkcl = 3,6 (Tableau III). La variation de pH (?pH= pHeau - pHkcl)
est ?pH>1. Le sol contient une faible quantité d'azote (moins de 100
mg.kg-1) et ses teneurs en carbone et en phosphore sont
respectivement 143 mg.kg-1 et 5 mg.kg-1. Cependant, bien
que sa teneur en matière organique soit élevée (246
mg.kg-1), on observe une faible décomposition de la
matière organique se traduisant par un rapport C/N élevé
(C/N>10) (Tableau III). La CEC est faible (1,54
cmol+.kg-1), et le taux de saturation (18,23%) montre que
le sol est désaturé en cations échangeables tels que le
calcium, magnésium, potassium et sodium dont les valeurs respectives
sont 1,00 cmol+.kg-1 ; 0,32
cmol+.kg-1; 0,11 cmol+.kg-1 ; 0,11
cmol+.kg-1 (Tableau III).
Tableau III : Caractéristiques chimiques
du sol
|
Passi
Site pH (mg.kg-1)
|
Matières organiques (M.O)
(mg.kg-1)
|
Éléments échangeables
(cmol+.kg-1)
|
S/T
(%)
|
pHeau pHKCl C N MO C/N K+ Na+
Ca++ Mg++ CEC
Plateau
5,2 3,6 5 143 13 246 11 0,11 0,11 1,00 0,32 1,54 18,23
V.1.2 Caractéristique microbiologique du sol
De façon général, la microflore totale
(MT) cultivable, dénombrée sur le milieu NB (219.105
UFC/g de sol sec) est très hautement significative à P < 0.001
plus importante que celle solubilisatrice du phosphore (MSP) avec
2,9.105 UFC/g de sol sec (Tableau IV).
Tableau IV : Dénombrement de la
microflore (unité formant des colonies (UFC)). 105/g de sol
sec sur les différents milieux de culture.
|
Substrat MT (x105 UFC/g de sol
sec)
|
MSP (x105 UFC/g de sol
sec)
|
Pr
|
Plateau 219 #177; 54a 2,9 #177;
0,9b Pr* <0,001
* Très hautement Significatif à P < 0,001
V.2 Caractéristique de la paille de riz
L'analyse chimique de la paille de riz montre qu'elle contient
des oligo-éléments et est composé majoritairement du
potassium (26,2 g.kg-1), suivi du phosphore (1,6 g.kg-1)
et de l'azote (140 g.kg-1). La paille de riz présente de plus
faible teneur en magnésium (2,8 g.kg-1) (Tableau V).
34
Tableau V : Concentrations de N, P, K, Ca, Mg et
C dans la paille de riz
Nutriments (g.kg-1) Valeurs
N 140
P 1,6
K 26,2
Ca 1,7
Mg 2,8
C 448,2
V.3 Caractéristiques chimique de la roche
phosphatée
La roche phosphatée du Maroc utilisée est
constituée majoritairement de CaO (49,54%) et P2O5 (30%). Sa teneur en
eau (H2O) ne représente que 2,03%. Le SiO2 total représente
6,64%. Les taux de Fe2O3 et Al2O3 se situent en dessous de 1% (respectivement
0,2% et 0,41%). Les éléments tels que CO2, SO3,
MgO et F représentent respectivement 6,44%, 1,29%, 1,16% et 2,21%
(Tableau VI).
Tableau VI : Composition chimique de la roche
phosphate du Maroc
|
Eléments
chimique
|
P2O5 CO2 SO3 SiO2 CaO MgO Fe2O3 Al2O3 F H2O
|
Teneur 30 6,44 1,29 6,64 49,54 1,16 0,20 0,41
2,21 2,13
(%)
V.4 Caractéristiques macroscopiques des souches
bactériennes solubilisant le phosphate isolé du sol de
plateau.
Dans l'ensemble, quatre (04) souches bactériennes ont
été identifiées sur milieu PVK solide à partir de
l'échantillon du sol de Plateau (Tableau VII). L'étude
macroscopique des souches bactériennes, montre que le sol de plateau
contient quatre souches solubilisatrices de phosphate (S1 à S4) dont les
diamètres de la zone halo varient de (0,2 à 1cm) et les indices
de solubilisation (IS) (de 0,6 à 3,6 cm) (Tableau VII). La couleur des
souches identifiées sur les sols de plateau est vert-jaune (S1), marron
(S2), Brun-vert (S3) et vert (S4) et elles ont une forme arrondie (S3 et S4) et
subangulaire (S1 et S2) mais elles ont toutes un aspect cotonneux (Tableau
VII). De plus, seule la souche S1 a obtenu un indice de solubilisation IS>2,
qui est égale à 3,6 (Tableau VII).
35
Tableau VII : Caractéristiques
macroscopiques des souches bactériennes solubilisatrices de phosphate
rencontrées sur le sol de plateau.
Diamètre halo
Site Isolats Caractères morphologiques
IS
(cm)
|
Plateau
|
Aspect coton, de couleur verte-jaune
S1 1,03#177;0.15 3,6#177;1,2
et une forme
subangulaire
Aspect coton, de couleur marron, et
S2 0,2#177;0,01 0,6#177;0,04
une forme
subangulaire
Aspect coton, de couleur brun-verte,
S3 0,7 #177; 0,02 1,2 #177;0,3
et une forme
arrondie
Aspect coton, de couleur verte, et
S4 0,4 #177;0,03 1,5 #177;0,5
une forme
arrondie
|
Indice de solubilisation= IS
V.5 Evolution des paramètres du milieu de
culture des études réalisées en Batch
L'évolution des paramètres du milieu durant
l'expérimentation en batch montre qu'en absence de la paille de riz, le
pH du milieu augmente progressivement et passe de 5,7 à 6,2 sur le sol
stérile et non-stérile (Figure 19). Par contre, en
présence de la paille de riz, le pH baisse de de 6,57 à 4,8 sur
le sol stérile et non stérile (Figure 19). Mais on assiste
à une augmentation de la quantité de phosphore dans le milieu
(variant de 13,7 à 17,2 mg.kg-1) en présence de la
paille sur le sol stérile et non stérile (Figure 19). Sur le sol
stérile, la prolifération des bactéries est lente et leur
nombre de bactérie passe de 105 à 107
bactéries/g de sol en présence de la paille et de 105
à 106 bactéries/g de sol en absence de paille (Figure
19). Par contre, sur le sol non stérile, la prolifération des
bactéries est rapide et leur nombre passe de 105 à
3,9.108 bactéries/g de sol en présence de la paille et
de 105 à 3,6.108 bactéries/g de sol en
absence de la paille de riz (Figure 19).
Le test statistique réalisé sur le pH, la teneur
de phosphore, le nombre de bactéries et le carbone organique dissous
indique une baisse du pH des sols (4,81 et 4,86) très hautement
significative à P=0,0001 après 60 jours d'incubation en
présence de la paille et une augmentation du pH (5,74-6,13) très
hautement significative à P=0,0001 après 60 jours d'incubation en
absence de la paille (Tableau VIII) quel que soit le type de sol
(stérile ou non stérile). On observe une augmentation de la
teneur en phosphore et du COD très significative à P<0,05
après 60 jours d'incubation en présence de la paille
comparativement au traitement sans paille (Tableau VIII) sur le sol
stérile et non stérile. Le nombre de bactéries est
significativement à P<0,05 plus important en présence de la
paille qu'en son absence sur le
sol stérile. Mais sur le sol non stérile la
prolifération des bactéries sous le traitement avec paille n'est
pas significativement différente de celle sans paille (Tableau VIII).
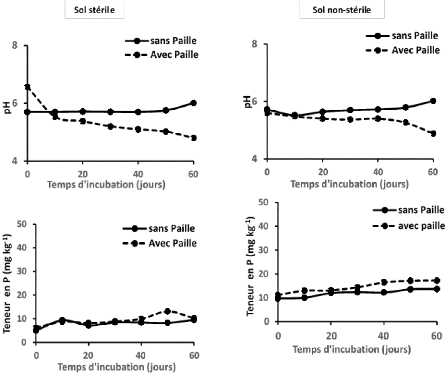

36
Figure 19 : Evolution des paramètres du milieu au
cours du temps en présence et en absence de la paille de riz.
37
Tableau VIII : Test statistique de
l'évolution des paramètres du milieu avec ou sans la paille de
riz
|
|
Non stérile
|
|
|
|
Stérile
|
|
|
Traitements
|
pH
|
P
(mg.kg-1)
|
BSP
|
COD
(mg.kg-1)
|
pH
|
P
(mg.kg-1)
|
BSP
|
COD
(mg.kg-1)
|
|
Avec paille
|
4,8b
|
17,40a
|
16.108a
|
1,39a
|
4,86b
|
13,80b
|
4,3.105a
|
1,14a
|
|
Sans paille
|
6,13a
|
9,72b
|
15.108b
|
<0,3b
|
5,74a
|
9,58a
|
3,7.105a
|
<0,3b
|
|
CV (%)
|
3,43
|
7,87
|
42,92
|
19,79
|
3,768
|
12,204
|
11,45
|
8,95
|
|
Pr>F
|
0,001*
|
0,0009**
|
0,01*
|
0,0002**
|
0,006**
|
0,022*
|
0,17ns
|
<0,0001***
|
Les valeurs du tableau sont les moyennes des
paramètres mesurés pendant le suivi de l'expérimentation
Les données dans la même colonne, suivies de la même lettre
ne sont pas significativement différentes selon le test de Newman-Keuls
p<0,05. (0,3 est le seuil de détection du COD) *** très
hautement significatif au seuil de p<0,05; ** très significatif au
seuil de p<0,05 ; * significatif au seuil de p<0,05 ;
V.6 Effet des amendements phosphatés (AP) sur le
pH, la teneur en P, le nombre de bactérie et le
COD
V.6.1 Effet des AP sur le pH et la teneur en P du
milieu
De façon générale, nous constatons une
baisse du pH (5,6 à 6,9) et augmentation de la teneur en phosphore (0
à 35 mg.kg-1) du milieu au cours d'incubation après
l'apport d'amendement phosphaté (AP) dans le milieu quel que soit le
type de sol comparativement au traitement sans AP (Figure 20 et 21). Toutefois,
en présence d'amendement phosphaté (AP), l'évolution du pH
et la quantité de phosphore solubilisé varie selon la proportion
de roche phosphatée (RP) ou de triple-super-phosphate (TSP)
présente dans le milieu. Nos résultats indiquent que lorsque
l'amendement phosphaté est riche en RP (100 à 60 % RP), on
assiste au départ (0 jour d'incubation) à une augmentation plus
rapide du pH du milieu (5,6 à 6,9) quel que soit le type de sol. Par
contre, lorsque la proportion de RP dans l'amendement phosphaté est
faible (0 à 40 % RP) et celle de TSP est élevée, on
assiste plutôt à une augmentation lente de pH (5,6 à 5,8)
à 0 jour d'incubation (Figure 20).
Pour la teneur en phosphore du milieu, on constate que lorsque
l'amendement est riche en RP (100 à 60 % RP), on assiste une
augmentation de la quantité en phosphore (0 à 30
mg.kg-1) dans le milieu quel que soit le type de sol à partir
du 30ième jour d'incubation (Figure 21). Par contre, lorsque
la proportion de RP est faible dans l'amendement (0 à 40 % RP), on
assiste à une augmentation de la quantité en phosphore (0
à 35 mg.kg-1) dans le milieu dès les 10 premiers
jours, que le sol soit stérile ou non (Figure 21).

pH
4
8
6
Ster - I N.Ster - I
pH
4
8
6
38
0 10 20 30 40 50 60 0 10 20 30 40 50 60
Temps d'incubation (jours) Temps d'incubation
(jours)

pH
6
8
Ster + I N.Ster + I
4
8
4
6
pH
0 10 20 30 40 50 60 0 10 20 30 40 50 60
Temps d'incubation (jours) Temps d'incubation
(jours)
Figure 20 : Évolution du pH au cours du temps
d'incubation sous différents traitements.
Teneur en P (mg.kg-1)

50
50
0
0
Ster - I
N.Ster - I
40
30
20
10
Teneur en P (mg.kg-1)
40
30
20
10
39
0 10 20 30 40 50 60 0 10 20 30 40 50 60
Temps d'incubation (jours) Temps d'incubation
(jours)
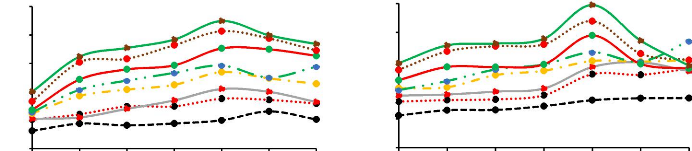
Teneur en P (mg.kg-1)
40
50
30
20
10
0
N.Ster + I
Ster + I
Teneur en P (mg.kg-1)
40
50
30
20
10
0
0 10 20 30 40 50 60
|
Temps d'incubation (jours)
|
0 10 20 30 40 50 60
Temps d'incubation (jours)
|
Figure 21 : Évolution de la quantité de P
dissous au cours du temps d'incubation sous les différents
traitements
40
V.6.2 Effet des AP sur le nombre de BPS et la teneur en COD
du milieu
L'évolution du nombre de bactéries au cours du
temps d'incubation montre une plus importante prolifération des
bactéries après ajout de AP (4,8.105 à
5,6.105 bactéries /g sol sec) dans le milieu comparativement
au traitement sans AP (3,1.105 à 3,6.105
bactéries /g sol sec) sur le sol stérile (Figure 22). Par contre,
sur le sol non stérile, on a une croissance des bactéries sous
les traitements avec ou sans AP (3,1.108 à 4.108
bactéries /g sol sec). Nos résultats indiquent que quel que soit
le type de sol, cette croissance des BSP est indépendante de la nature
du phosphate dans l'amendement phosphaté (Figure 22).
La quantité de carbone organique dissous après
60 jours d'incubation montre que dans le traitement sans apport d'amendement
phosphaté, la quantité de COD varie de 1,3 à 1,4
mg.kg-1 sur le sol stérile et de 1,21 à 1,24
mg.kg-1 sur le sol non stérile (Tableau IX). Dans les
traitements avec apports de AP, la quantité de COD varie de 0,42
à 0,83 mg.kg-1 sur le sol stérile non inoculé,
de 1,52 à 1,96 mg.kg-1 sur le sol stérile
inoculé (Tableau IX). Sur le sol non stérile, la quantité
de COD varie de 0,54 à 1,09 mg.kg-1 pour les traitements non
inoculés et de 1,24 à 1,79 mg.kg-1 pour les
traitements inoculés (Tableau IX).
Tableau IX : Carbone organique dissous au bout
de 60 jours d'incubation
|
Traitements
|
Sol stér - I
COD
(mg.kg-1)
|
Sol N.stér - I
COD
(mg.kg-1)
|
Sol stér + I
COD
(mg.kg-1)
|
Sol N.stér + I
COD
(mg.kg-1)
|
|
Sans AP + Paille
|
<0,3
|
|
<0,3
|
|
<0,3
|
|
<0,3
|
|
|
100% RP+Paille
|
1,39
|
#177; 0,03
|
1,21
|
#177; 0,04
|
1,39
|
#177; 0,02
|
1,21
|
#177; 0,04
|
|
90% RP+ Paille
|
0,42
|
#177; 0,06
|
1,09
|
#177; 0,08
|
1,67
|
#177; 0,05
|
1,33
|
#177; 0,05
|
|
80% RP+ Paille
|
0,53
|
#177; 0,06
|
0,91
|
#177; 0,09
|
1,81
|
#177; 0,09
|
1,60
|
#177; 0,15
|
|
60% RP+ Paille
|
0,83
|
#177; 0,07
|
0,84
|
#177; 0,04
|
1,92
|
#177; 0,07
|
1,73
|
#177; 0,08
|
|
40% RP+ Paille
|
0,43
|
#177; 0,06
|
0,78
|
#177; 0,09
|
1,96
|
#177; 0,15
|
1,70
|
#177; 0,2
|
|
20% RP+ Paille
|
0,56
|
#177; 0,06
|
0,54
|
#177; 0,04
|
1,68
|
#177; 0,12
|
1,76
|
#177; 0,2
|
|
0% RP+ Paille
|
0,38
|
#177; 0,06
|
0,63
|
#177; 0,17
|
1,96
|
#177; 0,04
|
1,79
|
#177; 0,09
|
0,3 = Seuil de détection du COD dans un milieu
Les tests statistiques réalisés entre les
différents traitements sur les paramètres du milieu montrent que
lorsque l'amendement phosphaté est riche en roche phosphatée (RP)
c'est-à-dire 60 à 100 % RP, le pH augmente significativement
à P<0,05, selon le test de Newman-keuls, comparativement aux
41
traitements sans AP (Tableau X) quel que soit le type de sol.
Par contre, lorsque l'AP est pauvre en RP (0 à 40 % RP), il n'y a pas de
différence significative entre le pH déterminé sous le
traitement sans AP et celui sous AP avec une faible proportion de RP (0
à 40 % RP).
Pour la quantité de phosphore solubilisé, nos
résultats montrent que quel que soit le type de sol, l'apport de
l'amendement phosphaté augmente très significativement à
P=0,001 la teneur en P du milieu comparativement aux traitements sans AP, mais
cette teneur en P est plus élevée lorsque AP contient 0% RP et
100% triple-super-phosphate (TSP) c'est-à-dire lorsque la proportion de
RP dans l'amendement phosphatée est faible (0 à 40% RP). Sur le
sol stérile non inoculé, la quantité de COD est
significativement à P<0,05 plus importante en absence d'AP (1,39
mg.kg-1) qu'en présence de AP (0,42 à 0,83
mg.kg-1). Par contre, sur le sol stérile inoculé, la
quantité de COD est significativement à P<0,05 plus importante
en présence d'AP (1,7 à 1,96 mg.kg-1) avec une plus
forte quantité sous les traitements avec 40 à 80% RP qu'en
absence d'AP (1,43 mg.kg-1). Sur le sol non stérile non
inoculé, à l'exception du traitement avec 100% RP, l'apport de AP
diminue significativement à P<0,05 la quantité de COD dans le
milieu comparativement au traitement sans AP (Tableau X). Sur le sol non
stérile inoculé, à l'exception du traitement avec 100% RP,
l'apport de AP augmente significativement à P<0,05 la quantité
de COD dans le milieu comparativement au traitement sans AP (Tableau X). Nos
résultats ont montré également que sur le sol
stérile inoculé, l'apport d'amendement phosphaté augmente
significativement à P<0,05 le nombre de bactéries dans le
milieu comparativement au traitement sans AP. Par contre, sur le sol non
stérile inoculé ou non, l'apport d'amendement phosphaté ne
modifie pas significativement à P<0,05 la prolifération des
bactéries comparativement aux traitements sans AP (Tableau X).
Ster - I
0 10 20 30 40 50 60
|
6,0
4,0
2,0
|
|
|
|
Nombre de bactéries*108/ g sol
sec
|
|
N.Ster - I
|
|
|
0 10 20 30 40 50 60
|
3,0
2,0
1,0
Nombre de bactéries*105/ g sol
sec
0,0
Temps d'incubation (jours) Temps d'incubation
(jours)
Ster + I
ec
Nombre de bactéries*108/ g sol
sec
3,0
Nombre de bactéries*108/ g sol
se

6,0
N.Ster + I
4,0
2,0
0 10 20 30 40 50 60
0 10 20 30 40 50 60
42
Temps d'incubation (jours) Temps d'incubation
(jours)
Figure 22 : Évolution du nombre de
bactéries au cours du temps d'incubation sous les différents
traitements.
43
Tableau X : Effet des amendements
phosphatés sur les paramètres du milieu après 60 jours
d'incubation
|
|
|
|
|
|
|
|
Type de sol
|
|
|
|
|
|
|
|
|
Stérile - I
|
|
|
Stérile + I
|
|
|
Non-stérile - I
|
|
|
Non-stérile + I
|
|
|
Traitements
|
pH
|
BSP
(x108)
|
mg.kg-1
|
pH
|
BSP
(x108)
|
mg.kg-1
|
pH
|
BSP (x108)
|
mg.kg-1
|
pH
|
BSP
(x108)
|
mg.kg-1
|
|
P
|
COD
|
P
|
COD
|
P
|
COD
|
P
|
COD
|
|
Sans AP
|
5,03b
|
0,005b
|
10,27g
|
1,39a
|
5,03b
|
0,005b
|
10,27f
|
1,43d
|
4,9b
|
3,65a
|
17,22e
|
1,19a
|
4,9b
|
3,65a
|
17,22g
|
1,25b
|
|
100%RP
|
6,39a
|
0,001b
|
12,85f
|
0,43de
|
6,25a
|
1,7a
|
15,9e
|
1,7bc
|
6,15a
|
3,6a
|
27,45d
|
1,14a
|
6,36a
|
4,87a
|
27,79f
|
1,33b
|
|
90%RP
|
6,37a
|
0,001b
|
18,9e
|
0,59c
|
6,16a
|
1,9a
|
16,4e
|
1,8ab
|
6,14a
|
3,65a
|
26,57d
|
0,91b
|
6,13a
|
4,93a
|
31,5e
|
1,60a
|
|
80%RP
|
6,09a
|
0,001b
|
24,27c
|
0,83b
|
6,14a
|
2,01a
|
22,8d
|
1,92a
|
6,1a
|
3,63a
|
31,34b
|
0,84b
|
6,08a
|
3,90a
|
33,7d
|
1,75a
|
|
60%RP
|
6,3a
|
0,001b
|
21,59d
|
0,44de
|
6,01a
|
1,84a
|
28,8c
|
1,87a
|
6,12a
|
3,6a
|
36,92a
|
0,64c
|
5,24b
|
4,91a
|
32,18e
|
1,50ab
|
|
40%RP
|
5,23b
|
0,002b
|
30,61b
|
0,36e
|
5,4ab
|
1,85a
|
32,6b
|
1,96a
|
5,32b
|
3,64a
|
26,46d
|
0,64c
|
5,19b
|
4,96a
|
34,74c
|
1,79a
|
|
20%RP
|
5,24b
|
0,009a
|
35,66a
|
0,42de
|
5,21b
|
1,85a
|
33,5b
|
1,6dc
|
5,26b
|
3,62a
|
30,4b
|
0,63c
|
5,15b
|
4,93a
|
36,05b
|
1,79a
|
|
0%RP
|
5,13b
|
0,002b
|
36,17a
|
0,56cd
|
5,01b
|
1,51a
|
36,8a
|
1,7bc
|
5,21b
|
3,62a
|
28,47c
|
0,54c
|
5,10b
|
4,94a
|
40,63a
|
1,76a
|
|
CV (%)
|
5,22
|
46,91
|
2,65
|
10,42
|
6,05
|
24,14
|
3,09
|
5,15
|
5,41
|
18,18
|
2,04
|
10,12
|
5,53
|
16,53
|
1,77
|
8,04
|
|
Pr>F
|
<,0001
***
|
<,0001
***
|
<,0001
***
|
<,0001
***
|
0,0005 **
|
0,0002 **
|
<,0001
***
|
<,0001
***
|
0,0001 **
|
1,00 ns
|
<,0001
***
|
<,0001
***
|
<,0001
***
|
0,25 ns
|
<,0001
***
|
0,0002 **
|
Les données dans la même colonne, suivies de la
même lettre ne sont pas significativement différentes selon le
test de Student-Newman-Keuls p<0,05. * très hautement significatif au
seuil de p<0,05; ** très significatif au seuil de <0,05; ns : Non
Significatif
44
V.7. Effet de l'inoculation sur le pH, la teneur en P,
le nombre de bactérie et le COD
Excepté le pH qui baisse avec l'inoculation quel que
soit le type de sol, la quantité de P solubilisé, de COD et le
nombre de BSP augmentent avec l'inoculation (Tableau XI et Tableau XII).
L'effet de l'inoculation est très hautement significatif (P=0,0001) sur
le COD et le nombre de BSP quel que soit le type de sol. L'inoculation a aussi
un effet significatif sur la quantité de P solubilisé sur sol
non-stérile (p<0,043) comparativement aux traitements non
inoculé. Par contre, sur le sol non stérile, l'inoculation
diminue significativement la quantité de P dans le milieu (Tableau XI et
Tableau XII).
Tableau XI : Effet de l'inoculation sur les
paramètres du milieu
|
|
Sol stérile
|
|
|
Sol non-stérile
|
|
|
Traitements
|
pH
|
P
mg.kg-1
|
BSP
(x108)
|
COD
mg.kg-1
|
pH
|
P
mg.kg-1
|
BSP
(x108)
|
COD
mg.kg-1
|
|
Inoculé
Non Inoculé
|
5,65a
5,72a
|
24,65a
23,79a
|
1,59a
0,003b
|
1,74a
0,63b
|
5,52a
5,65a
|
28,10b
31,72a
|
4,63a
3,63b
|
1,6a
0,82b
|
|
CV (%) Pr>F
|
10,78
0,70ns
|
38,62
0,75ns
|
62,61
<0,0001*
|
22,82
<0,0001*
|
10,49
0,44ns
|
20,17
0,043**
|
16,89
<0,0001*
|
19,88
<0,0001*
|
Les données dans la même colonne, suivies de la
même lettre ne sont pas significativement différentes selon le
test de Student-Newman-Keuls p<0,05. * très hautement significatif au
seuil de <0,05;
** significatif au seuil de <0,05 ;
ns : non significatif
45
Tableau XII : Effet de l'inoculation sur les
différents traitements
|
|
Paramètres
|
|
|
Traitements
|
pH
|
BSP
(x108)
|
P
mg.kg-1
|
COD
mg.kg-1
|
|
100%RP +I
|
6,25a
|
1,70a
|
15,86i
|
1,67bc
|
|
90%RP +I
|
6,16ab
|
1,91a
|
16,39i
|
1,81ab
|
|
80%RP +I
|
6,14ab
|
2,01a
|
22,81f
|
1,92a
|
|
60%RP +I
|
6,01ab
|
1,84a
|
28,85d
|
1,88a
|
|
40%RP +I
|
5,42bc
|
1,85a
|
32,63b
|
1,96a
|
|
20%RP +I
|
5,21c
|
1,85a
|
33,50a
|
1,55dc
|
|
0%RP +I
|
5,01c
|
1,51a
|
36,84a
|
1,69bc
|
|
100%RP -I
|
6,39a
|
0,001b
|
12,85j
|
0,43hg
|
|
90%RP -I
|
6,37a
|
0,001b
|
18,9h
|
0,59g
|
|
80%RP -I
|
6,09ab
|
0,001b
|
24,27e
|
0,83f
|
|
60%RP -I
|
6,30a
|
0,001b
|
21,59g
|
0,44hg
|
|
40%RP -I
|
5,23c
|
0,002b
|
30,61c
|
0,36h
|
|
20%RP -I
|
5,24c
|
0,009b
|
35,66a
|
0,42hg
|
|
0%RP -I
|
5,13c
|
0,002b
|
36,17a
|
0,56g
|
|
CV (%)
|
5,65
|
34,06
|
2,88
|
6,63
|
|
Pr>F
|
<0,0001***
|
<0,0001***
|
<0,0001***
|
<0,0001***
|
Les données dans la même colonne, suivies de la
même lettre ne sont pas significativement différentes selon le
test de Student-Newman-Keuls p<0,05.
*** Très hautement significatif au seuil de P<.05
Conclusion partielle
Les résultats révèlent qu'il y a
corrélation entre tous les paramètres (pH, P dissous, COD et
nombre de bactérie) du milieu. L'apport de paille de riz augmente la
quantité de COD, de P solubilisé, le nombre de bactérie
mais diminue le pH du milieu.
L'apport d'AP augmente le pH du milieu comparativement aux
traitements sans AP quel que soit le type de sol. Par contre, lorsque l'AP est
pauvre en RP (0 à 40 % RP), il n'y a pas de différence
significative entre le pH déterminé sous le traitement sans AP et
celui sous AP avec une faible proportion de RP (0 à 40 % RP).
46
Pour la quantité de phosphore solubilisé, quel
que soit le type de sol, l'apport de l'amendement phosphaté augmente
très significativement à P=0,001 la teneur en P du milieu
comparativement au traitement sans AP, mais cette teneur en P est plus
élevée lorsque la proportion de RP dans l'amendement
phosphatée est faible (0 à 40% RP).
Sur le sol stérile non inoculé, la
quantité de COD est significativement plus importante en absence de AP
qu'en présence de AP. Par contre, sur le sol stérile
inoculé, la quantité de COD est significativement plus importante
en présence de l'AP qu'en absence de l'AP. Sur le sol non stérile
non inoculé, à l'exception du traitement avec 100% RP, l'apport
d'AP diminue significativement la quantité de COD dans le milieu alors
que sur le sol non stérile inoculé, à l'exception du
traitement avec 100% RP, l'apport de AP augmente significativement à
P<0,05 la quantité de COD dans le milieu comparativement aux
traitements sans AP. Nos résultats ont montré également
que sur le sol stérile inoculé, l'apport d'amendement
phosphaté augmente significativement le nombre de bactéries dans
le milieu comparativement aux traitements sans AP. Par contre, sur le sol non
stérile inoculé ou non, l'apport d'amendement phosphaté ne
modifie pas significativement la prolifération des bactéries
comparativement aux traitements sans AP.
En condition naturel (c'est-à-dire sur le sol non
stérile), les plus importantes quantités de P solubilisé
ont été observées sous les traitements avec 0 % RP (sur
sol non stérile non inoculé) et avec 60% RP et 40% TSP (sur sol
non stérile inoculé).
47
CHAPITRE VI : DISCUSSION
Introduction
Ce chapitre se consacre à la discussion des
résultats obtenus suite aux expérimentations. Il sera donc
question d'expliciter ces résultats par des interprétations puis
de les confronter aux résultats de d'autres chercheurs.
VI.1 Capacité solubilisatrice des souches
bactériennes isolées
L'étude réalisée sur les sols de
rizières des parcelles rizicoles de plateau de la station de recherche
de Man a révélé la présence d'un nombre
élevé de microorganismes (219.105 bactéries /g
sol) qui est significativement plus important que le nombre de microorganismes
solubilisateurs de phosphate (2,9.105 bactéries /g sol).
Cette étude a révélé que c'est seulement 1% de la
microflore bactérienne totale des sols qui est capable de solubiliser le
phosphate.
Par ailleurs, l'évaluation de la solubilisation des
isolats bactériens par la présence d'un halo ou zone claire sur
un milieu solide contenant le phosphate tricalcique comme seule source du
phosphate a révélé une différence entre les quatre
(04) souches bactériennes isolées. Sur l'ensemble des quatre (04)
souches bactériennes isolées, seule la souche S1 a un indice de
solubilisation (IS) le plus élevé (3,6) et supérieur
à 2. Ce qui traduit son fort pouvoir de solubilisation de phosphate
comme l'ont montré les travaux de Hassimi et al., (2017) et
Haile et al., (2016). Cette méthode de choix basé sur
l'IS de la souche concorde avec celle appliquée par Plassard et al.,
(2015) qui affirment que la capacité à dissoudre des
minéraux phosphatés insolubles fournis dans un milieu de culture
solide est un trait fonctionnel utilisé pour sélectionner des
microorganismes dits « solubilisateurs de phosphate ». Ainsi, la
capacité constante à dissoudre le phosphore est un critère
à prendre en compte dans la sélection des souches (Pereira et
Castro, 2014), puisqu'une souche présentant une baisse de sa
capacité de solubilisation sur PVK solide au cours du temps, pourrait se
révéler inefficace en condition au champ (Servín, 2014).
De plus, les études menées par Mehta et Nautiyal (2001) avec
plusieurs souches de BSP sur milieu PVK solide avec le phosphate tricalcique
comme source de phosphate ont montré qu'une souche est capable de
solubiliser le phosphate lorsqu'elle crée autour d'elle un halo de
dissolution.
48
VI.2 Effet de la paille de riz sur le pH, le P
solubilisé, le nombre de bactérie et le COD
Les résidus organiques, comme la paille de riz,
apportés au sol sous forme de litières, de composts constituent
une source d'éléments nutritifs pour les organismes vivants du
sol, animaux ou végétaux et permettent d'améliorer le
rendement des cultures et certaines caractéristiques physico-chimiques
du sol (Lompo et al., 2009).
L'apport de la paille de riz dans le sol a montré une
baisse du pH du milieu après son incorporation au sol comparativement au
traitement sans paille. La baisse du pH s'expliquerait par le processus de
décomposition et de minéralisation de la paille de riz, à
travers la libération du carbone organique dissous (COD), comme le
montre cette étude, et anions d'acides organiques dans le milieu
(Chaibou, 2013). En effet, la dégradation de la paille de riz dont la
teneur en phosphore (1,6 mg/kg) va favoriser la minéralisation du
phosphore du sol et par conséquent va augmenter la teneur en P soluble
du milieu (Koulibaly et al., 2010). Pour Plassard et al.,
(2015), l'apport de matière organique (paille de riz) comme source
de carbone dans le milieu a stimulé la minéralisation de P du sol
et de de la paille.
Par ailleurs, en présence de la paille de riz, nos
résultats indiquent une augmentation du phosphore soluble du sol qui
s'accompagne de la production du carbone organique dissous dans le milieu, de
la prolifération des microorganismes solubilisateurs de phosphate (MSP)
et de l'acidification du milieu. Ce changement des paramètres (COD, P,
pH, MSP) du milieu serait probablement dû à la dégradation
des résidus organiques (paille de riz) par les microorganismes du sol et
à la libération d'acides organiques tels que les acides
oxaliques, citriques et tartriques lors de la décomposition de la paille
de riz, modifiant ainsi le pH du milieu. Ces résultats sont en accord
avec ceux de Bongoua-devisme et al., 2012, qui ont observé une
baisse du pH du sol et une augmentation du nombre de bactéries
après apport d'amendement organique dans les sols de rizières de
la Thaïlande, affecté par les problèmes de salinité,
dû probablement aux activités Ferri réductrices des
bactéries.
VI.3 Effet des amendements phosphatés sur les
paramètres du milieu
L'étude de l'efficience des amendements
phosphatés (AP) composés de différentes proportions de
roche phosphatée (RP) et de triple-super-phosphate (TSP) sur les
paramètres d'un sol a montré qu'au cours de l'incubation,
l'apport de l'AP augmente le pH du milieu comparativement au traitement sans
apport de AP. Cependant, nos résultats indiquent que la proportion de
roche phosphatée (RP) contenue dans l'amendement phosphaté
influence la variation du pH. En effet, lorsque l'AP contient une faible
proportion de RP (0 à 40%RP), le pH croît lentement et ce qui fait
que nous n'observons pas de différence significative entre le pH
déterminé sous ces traitements et le traitement sans AP. Par
contre, sous les
49
traitements riches en RP (60 à 100% RP) le pH
croît rapidement et se traduit par une différence significative
comparativement aux traitements sans AP. Pour Dabre et al., (2017),
cette augmentation rapide du pH serait liée au calcium contenu dans ce
phosphate naturel du Maroc (49 % Ca) qui, en se liant au complexe
argilo-humique permettrait de baisser la concentration des ions H+
dans la solution du sol et par conséquent augmenter le pH du milieu. Nos
résultats ont montré que plus les proportions de RP sont
élevées dans les traitements, plus le pH augmente, ce
résultat corrobore à ceux obtenu par Abbasi et al.,
(2015) qui ont montré que les traitements avec RP ont donné des
pH plus élevés que ceux avec des traitements avec un engrais
soluble (Simple Super Phosphate).
Nos travaux ont également révélé
que l'apport de l'amendement phosphaté augmente très
significativement à P=0,001 la teneur en P du milieu comparativement aux
traitements sans AP, mais cette teneur en P est plus élevée
lorsque la proportion de RP dans l'amendement phosphatée est faible (0
à 40% RP). Cela peut être lié au caractère des deux
types d'amendement. En effet, des études ont révélé
que les roches phosphatées naturelles sont peu solubles dans l'eau alors
que le triple super phosphate (TSP) est un engrais minéral facilement
soluble. Smalberger et al., (2010) ont abordé dans le
même sens en montrant que l'application d'engrais phosphatés
solubles libère rapidement du phosphore pour les plantes tandis que
l'application de RP seul libère lentement le phosphore mais son effet
s'étend sur plusieurs années (FAO, 2004; Smalberger et
al., 2010).
Toutefois, il ressort de cette étude, qu'en condition
naturel (c'est-à-dire sur le sol non stérile), la plus importante
quantité de P solubilisé ont été observé
sous les traitements avec 0 % RP et 100% TSP (sur sol non stérile non
inoculé) et avec 60% RP et 40% TSP (sur sol non stérile
inoculé). Ce qui traduit que le traitement 60% RP et 40% TSP
associé aux microorganismes pourra être proposée pour des
essais au champ afin de réduire le coût élevé des
intrants chimiques.
VI.4 Effet de l'inoculation sur l'efficience des
traitements
L'étude de l'effet de l'inoculation sur l'efficience
des différents traitements appliqués a indiqué que dans
l'ensemble l'apport de microorganismes solubilisateurs de phosphate (MSP) dans
le milieu baisse significativement le pH, augmente très hautement
significatif (P=0,0001) la quantité de carbone organique dissous COD, le
nombre de BSP. L'inoculation augmente également significatif la
quantité de P solubilisé excepté sur le sol non
stérile. Cette baisse progressive du pH du milieu sous les traitements
inoculés pendant l'expérience pourrait provenir de
l'activité des microorganismes du sol et particulièrement des MSP
qui en décomposant la matière organique (la paille de riz) ou en
minéralisant les amendements phosphatés pour leur croissance vont
secréter des acides organiques dans le milieu qui
50
vont affecter le pH (Salma, 2015 ; Yu et al., 2011).
Des résultats similaires ont été obtenus par Abbasi et
al., (2015) qui ont observé une baisse du pH baisse avec apport
d'inoculum au cours de la minéralisation du P. Par ailleurs, cette
minéralisation de la paille et des amendements phosphatés s'est
accompagnée d'une plus forte production de COD et une solubilisation de
P plus importante après inoculation comme déjà
signalé dans les travaux de Bongoua-Devisme et al., (2012).
Il ressort de cette étude que quel que soit le type de
sol, à l'exception du traitement avec 0%RP, l'apport de l'inoculum dans
chaque traitement augmente très hautement significatif à
p<0,0001 la quantité de P solubilisé dans le milieu
comparativement aux traitements sans inoculum, surtout quand l'AP est pauvre en
RP (20% à 40%RP). De même, l'inoculation affecte significativement
à p<0,0001 le pH du milieu surtout sous les traitements avec 90 % RP
et 60% RP et COD sous tous les traitements inoculés comparativement aux
non inoculés. Cette augmentation est plus marquée sous les
traitements contenant 40 à 80% RP. Ces résultats suggèrent
une combinaison des bactéries solubilisant le phosphate BSP aux roches
phosphatées pour améliorer la réactivité des RP. De
plus, les plus fortes solubilisations observées lorsque la roche
phosphatée est associée aux engrais solubles (TSP), confirment
les travaux de Begum et al., (2004) qui a constaté une
amélioration substantielle du P disponible en associant RP avec du SSP
(Simple superphosphate) et du MAP (phosphate monoammonique). Notre étude
a également révélé que les BSP sont aussi efficace
pour augmenter l'efficacité du triple super phosphate (TSP).
Il ressort de cette étude que la combinaison BSP / RP /
engrais phosphatés solubles pourrait augmenter l'efficacité de
ces derniers afin d'accroitre le P disponible pour les plantes.
Conclusion partielle
La baisse du pH tout comme la hausse du P solubilisé et
du nombre de bactéries sont l'effet soit cumulé soit individuel
de l'apport de paille de riz dans le milieu et/ou des traitements
appliqués et/ou de l'inoculation. Les taux de carbone organique dissous
(COD) sont aussi influencés par l'inoculation, l'apport de la paille de
riz et les traitements appliqués. L'ensemble de nos résultats
sont en conformité avec ceux des études menées
antérieurement.
51
CONCLUSION GÉNÉRALE ET PERSPECTIVES
A la fin de cette étude dont l'objectif
générale était d'évaluer l'efficience d'une BSP sur
la minéralisation de différents types d'amendements
phosphatés, les résultats de nos essais de sélection et de
purification montrent que les BSP sont en faibles proportions dans l'horizon
échantillonné. Les traitements appliqués influent à
la fois sur le pH du milieu, sur le P minéralisé et sur le COD.
La décomposition de la paille de riz acidifie le milieu mais favorise
l'augmentation du taux de P minéralisé. Le taux de BSP croissant
favorise la solubilisation des AP présents dans le milieu de culture. La
RP appliquée seule augmente le pH de la solution du milieu tandis que
l'engrais chimiques phosphaté utilisé, à savoir le TSP,
acidifiait le milieu mais libérait plus de P lorsqu'il était
appliqué seul (T8). Sur sols non inoculés, son effet est
similaire à celui de RP, c'est-à-dire que le taux de P
libéré s'accroit jusqu'à la fin de l'expérience (60
jours). Cependant en présence de la souche solubilisant le P, son effet
décroit à partir du 40ème jour et passe de 44,
9 mg.kg-1 (sol stérile +I) et 49,5 mg.kg-1 (sol
non-stérile +I) à 33,13 mg.kg-1 (sol stérile
+I) et 25,87 mg.kg-1 (sol non-stérile +I) soit 26,21% et
47,74% de régression respectivement sur sol stérile +I et sol
non-stérile +I tandis que sur ces mêmes sols le traitement T2
(100% RP) connait une hausse de son P dissous de 158,5% et 106,64%.
L'inoculation a eu un effet très hautement significatif sur les
paramètres du milieu de culture, il en a été de même
pour la paille de riz et les traitements appliqués. Quoique les
traitements avec TSP donnent les plus forts taux de P solubilisé, le
traitement T5 (60% RP + 40% TSP) serait approprié pour des cultures en
milieu réel. En effet, c'est le traitement qui comparé au premier
jour a donné en moyenne le plus fort taux de «croissance».
La combinaison des BSP avec les AP est donc très
prometteuse comme alternative pour accroitre leur efficacité
singulièrement en ce qui concerne l'utilisation de RP. Cependant, des
expérimentations au champ seraient nécessaire pour confirmer la
rentabilité tant sur le plan agronomique qu'économique de
l'application de cette combinaison puisque la Côte d'Ivoire ne produit
pas les intrants utilisés. Aussi, serait-il judicieux d'identifier les
souches isolées du sol prélevé par le biais
d'études plus poussées telles que la biologie
moléculaire.
52
RÉFÉRENCES BIBLIOGRAPHIQUES
Abbasi, M. K., Musa N., Manzoor M., 2015. Mineralization of
soluble P fertilizers and insoluble rock phosphate in response to
phosphate-solubilizing bacteria and poultry manure and their effect on the
growth and P utilization efficiency of chilli (Capsicum annuum L.).
Biogeosciences, 12(15), pp. 4607-4619.
https://doi.org/10.5194/bg-12-4607-2015
Alikhani, H.A., Saleh-Rastin, N., Antoun, H., 2006. Phosphate
solubilization activity of rhizobia native to Iranian soils. Plant and Soil
287: pp.35-41.
Andrianambinina Fano Vatosoa, 2013. « Dynamique et
disponibilité de l'azote et du phosphore sous association riz-haricot
soumise à différentes doses croissantes de fertilisation
minérale azotée et phosphatée ». Essai en pot sous
serre sur sol ferrallitique de Tanety de Lazaina
Aulakh M.S., Adhya T.K., 2005. Impact of agricultural
activities on emission of greenhouse gases - Indian perspective. In
`International Conference on Soil, Water and Environmental Quality - Issues and
Strategies. pp. 319-335 (Indian Society of Soil Science: New Delhi).
Aziable E., Tchegueni S., Bodjona B. M., Djahini K., Kili A.
K., Tchangbedji G., Baba G., 2014. Etude de la disponibilité du
phosphore assimilable des composts de déchets urbains dans deux sols
différents.
Begum, M., Narayanasamy, G., and Biswas, D. R., 2004:
Phosphorus supplying capacity of phosphate rocks as influenced by compaction
with water-soluble P fertilizers, Nutr. Cycl. Agroecosys., 68, 73- 84
Berne OFEFP, 2004. Le cahier de l'environnement N°368. Le
phosphore dans les sols : Etat de la situatuin en Suisse. pp 129-145.
Bessoles B., 1997, Géologie de l'Afrique, le craton Ouest
africain. Mémoire BRGM n°88.
Bongoua, J., Mustin, C., Berthelin, J. 2012. Salinity,
rhizosphere and organic amendment impact on iron reducing bacterial activity in
paddy rice field (Thailand). Biology Fertility of Soil Journal. submitted.
Chabot, R., Antoun, H., Cescas, M.P. 1996a.Growth promotion of
maize and lettuce by phosphate-solubilizing Rhizobium leguminosarum biovar,
phaseoli. Plant and Soil 184: pp. 311-321.
Chaibou Zeioabou. 2012. Effet du phospho-compost sur la
production de mil (Pennisetum glaucum : cas de la commune urbaine de Niamey.
p28.
CPCS-Commission de pédologie et de cartographie des
sols. 1967. Classification des sols. Tableaux des classes, sous-classes,
groupes et sous-groupes des sols. Service de classification des sols. INRA,
France. 96 p.
53
Dabre A., Hien E., Der Some et Drevon JJ : 2017. Effets
d'amendements organiques et phosphatés sous zaï sur les
propriétés chimiques et biologiques du sol et la qualité
de la matière organique en zone soudano-sahélienne du Burkina
Faso. International Journal of Biological and Chemical Sciences, 11(1), pp
473-487.
De Brouwer J., Gandah M., Bouma J., Hiernaux, P., Van
Duivenbooden, N. 2003. Strategies to optimize allocation of limited nutrients
to sandy soils of the Sahel : a case study form Niger, West Africa.
Agriculture, Ecosystems and Environment, 94, 311-390.
Djigal D., Brauman A., Diop T.A., Chotte J.L., Villenave C.,
2004a. Influence of bacterial-feeding nematodes (Cephalobidae) on soil
microbial communities during maize growth. Soil Biology and Biochemistry 36,
323-331.
Djigal D., Sy M., Brauman A., Diop T.A., Mountport D., Chotte
J.L., Villenave C., 2004b. Interactions between Zeldia Punctata (Cephalobidae)
and bacteria in the presence or absence of maize plants. Plant and Soil 262,
33-44.
Domey S., Lippmann G., 1989. Stimulation of plant growth by
phosphate solubilizing bacteria. Dans Interrelashionships between
microorganisms and plants in soil. Éditeurs : V. Vancura et F. Kunc.
Dev. Soil. Sci. 18 : pp. 457 - 461.
FAO, 2004. Utilisation des phosphates naturels pour une
agriculture durable.
http://www.fao.org/3/y5053f/y5053f00.htm#Contents,
consulté en ligne le 11 Août 2019.
Fardeau JC et Conesa AP, 1994. Le phosphore. in: Bonneau et
Souchier, Pédologie, 2.Constituants et propriétés du sol.
Masson, 557-568 pp.
Frey-Klett P., Churin J., Pierrat J., Garbaye J., 1999. Dose
effect in the dual inoculation of ectomycorrhizal fungus and mycorrhiza helper
bacterium in two forest nurseries. Soil Biol. Biochem. 31: pp. 1555 - 1562.
Giles C.D., Richardson A.E., Druschel G.K., Hill J.A., 2012.
Organic anion-driven solubilization of precipitated and sorbed phytate improves
hydrolysis by phytases and bioavailability to Nicotiana tabacum. Soil Science
177(10): pp. 591-598.
Gyaneshwar P., Kumar G. N., Parekh L. J. and Poole P. S.,
2002. Role of soil microorganisms in improving P nutrition of plants. Plant and
Soil 245, pp. 83-93.
Haile D., Mekbib F., Assefa F., 2016. Isolation of Phosphate
Solubilizing Bacteria from White Lupin (Lupinus albus L.) Rhizosphere Soils
Collected from Gojam, Ethiopia. J Fertil Pestic 7: 172.
doi:10.4172/2471-2728.1000172
Hassimi M. S., Boukeskass, A., Adamou, I., 2017.
Caractérisation des microorganismes thermotrophes impliqués dans
la solubilisation du Phosphate Naturel Marocain au cours de la
biotransformation anaérobie du gazon Characterization of thermophilic
phosphate solubilizing microorganisms during grassland an. 11(December), pp.
2764-2777.
54
Hayat R., Ali S., Amara U., Khalid R., Ahmed I., 2010. Soil
beneficial bacteria and their role in plant growth promotion: a review. Annals
Microbiol 60: pp. 579-598
Haygarth P. M., Jarvis,S.C. 1999. Transfer of phosphorus from
agricultural soils. Advances in agronomy 66, 195-249.
He Z., Ohno T., Cade-Menun, B.J, Erich, M.S., Honeycutt, C.W.
2006. Spectral and chemical characterization of phosphates associated with
humic substances. Soil Science Society of America Journal 70:1741- 1751.
Hinsinger P., 2001. Bioavailability of soil inorganic P in the
rhizosphere as affected by root induced chemical changes: a review. Plant and
soil. 237: pp. 173-195.
Ilg K., Siemens J. and M. Kaupenjohann. 2005. Colloidal and
Dissolved Phosphorus in Sandy Soils as Influenced by Phosphorus saturation. J.
Environ. Qual. 34 : pp. 926 - 935
ISSS, ISRIC et FAO. 1998. World reference base for soil
resources. World soil resources reports, 84, FAO, Rome. 88 p. In Koné,
B., Saidou, A., Camara, M., 2010. Effet de différentes sources de
phosphate. 22(1), pp. 55-63.
Jones D.L., Oburger E., 2011. Solubilization of phosphorus by
soil microorganisms. In: E.K. Bünemann A. Oberson , E. Frossard (eds),
Phosphorus in action. Biological Processes in Soil Phosphorus, 169198.
Springer-Verlag, Berlin, Heidelberg.
Kaman Paul, 2013. Analyse des vulnérabilités aux
catastrophes et des capacités de réponse en Côte d'Ivoire.
pp5-6
Kassin E., Snoeck D., Nguessan, J.-C., Yao-Kouamé A.,
Camara M., 2012. Projet De Cartographie Des Sols Rapport Final., pp. 1-17.
Khan M.R., Khan M.S., 2002. Effect of root-dip treatment with
certain phosphate solubilizing microorganisms on the fusarial wilt of tomato.
Bioresource technology, 35: 213-215
Khan Z. R., Midega C. A. O., Wadhams, L. J., Pickett, J. A.,
Mumuni, A., 2007. Evaluation of Napier grass (Pennisetum purpureum)
varieties for use as trap plants for the management of African stemborer
(Busseola fusca) in a push-pull strategy. Entomol. Exp. Applic., 124
(2): 201-211
Khan A. A., Jilani G., Akhter M. S., Naqvi, S. M. S., and
Rasheed, M., 2009. Phosphorous solubilizing Bacteria; occurrence, Mechanisms
and their role in crop production, J. Agric. Biol. Sci., 1, pp. 48- 58.
Khan M. and Sharif, M., 2012: Solubility enhancement of
phosphorus from rock phosphate through composting with poultry litter, Sarhad
J. Agric., 28, pp. 415-420.
Khan M. S., Zaidi A. and Ahmad E., 2014. Mechanism of phos-
phate solubilization and physiological functions of phosphate- solubilizing
microorganisms, In: Phosphate Solubilizing Mi- croorganisms: Principles and
application of microphos technology, edited by: Khan, M. S., Zaidi, A., and
Musarrat, J., Springer International Publishing Switzerland, Switzerland, pp.
31- 62, doi:10.1007/978-3-319-08216-5_2.
55
Koné B., Saidou, A., et Camara M., 2010. Effet de
différentes sources de phosphate. 22(1), pp. 55-63.
Koné B., Yao-Kouamé A., Sorho F., Diatta, S.,
Sié, M., et Ogunbayo, A., 2011. Long-term effect of Mali phosphate rock
on the grain yield of interspecifics and saltiva rice cultivars on acid soil in
a humid forest zone of Côte d'Ivoire. International Journal of Biological
and Chemical Sciences, 4(3)., pp. 563-570.
https://doi.org/10.4314/ijbcs.v4i3.60451
Kotchi V., Yao-Kouamé A., et Diatta S., 2010.
Réponse de cinq variétés de riz à l'apport de
phosphate naturel de Tilemsi (Mali) sur les sols acides de la région
forestière humide de Man (Côte d ' Ivoire). pp. 1895-1905.
Koulibaly B., Traoré O., Dakuo D., Zombré P.N.,
Bondé, D., 2010. Effets de la gestion des résidus de
récolte sur les rendements et les bilans culturaux d'une rotation
cotonniermaïs-sorgho au Burkina Faso. Tropicultura 28 (3), 184-189
Kpomblekou-A. K. and Tabatabai M.A., 2003. Effect of
low-molecular weight organic acids on phosphorus release and phytoavailability
of phosphorus in phosphate rocks added to soils, Agri. Ecosyst. Environ., 100,
pp. 275-284.
Kucey R.M.N. and Leggett, M.E. (1989) Increased yields and
phosphorus uptake by Westar canola (Brassica napus L.) inoculated with a
phosphate-solubilizing isolate of Penicillium bilaji. Canadian Journal of Soil
Science, 69, 425-432.
http://dx.doi.org/10.4141/cjss89-042
Labib K., Diffley J.F., Kearsey S. E., 1999. G1-phase and
B-type cyclins exclude the DNA-replication factor Mcm4 from the nucleus.
Nat Cell Biol 1(7):415-22
Li L., Li S.M., Sun J.H., Zhou L.L., Bao X.G., Zhang H.G.,
Zhang F.S., 2007. Diversity enhances agricultural productivity via rhizosphere
phosphorus facilitation on phosphorus deficient soils. Proceedings of the
National Academy of Sciences of the United States
Li L., et Stanforth R. R., 2000. Distinguishing Adsorption and
Surface Precipitation of Phosphate on Goethite (??-FeOOH). DOI:
10.1006/jcis.2000.7072
Lompo F., Segda Z., Gnankambary Z., Ouandaogo N., 2009. Influence
des phosphates naturels sur la qualité et la biodégradation d'un
compost de pailles de maïs.
Masho, N. M., Memon M., Memon K. S., and Kakr H. 2013: Maize
dry matter yield and P uptake as influenced by rock phosphate and single super
phosphate treated with farm manure, Soil Environm., 32, 130-134.
McConnell D., 1938. A structural investigation of the
isomorphism of the apatite group. Am. Min., 54: pp. 1379-1391
Mehta P., Walia A., Kulshrestha S., Chauhan, A., and Shirkot,
C.K.2014. Efficiency of plant growth-promoting P-solubilizing Bacillus
circulans CB7 for enhancement of tomato growth under net house conditions, J.
Basic Microb., 53, pp. 1-12
56
Mehta S., and Nautiyal, C. S., 2001. An efficient method for
qualitative screening of phosphate-solubilizing bacteria. Current microbiology,
43: pp. 51-56.
Mishra I. N., Sandhya Jha., 1996. Nutritive profile of some
grasses of Darbhanga. Environment and Ecology, 14 (1): 93-95
Ouchiha O., Oulebsir F.., 2013. Elimination Du Cuivre Par
Adsorption (Djebel Onk). pp. 2012-2013.
Pereda Campos Marline Veronica, 2008. Contribution à
l'étude des transporteurs de phosphate de la famille PHT1 chez le
Peuplier (Populus trichocarpa Torr. & Gray) et le champignon
ectomycorhizien Laccaria bicolor (Maire) P. D. Orton
Pereira T. N. A., Castro R. M. C., 2014. A new species of
Utiaritichthys Miranda Ribeiro (Characiformes : Serrasamidae) from the Serra
dos Parecis, Tapajos drainage. Neotropical Ichthyology. 12(2) : 397-402
Pospisil F., Hrubcová, M., 1975. The influence of humic
acids on phytase activity isolated from wheat seeds. Biologia Plantarum 17(6):
pp. 468-474.
Plassard L., Ballot, R., Halska, J., Lambert, E., Meynard, J. M.,
Minette, S., Reau, R., 2015. Innovations Agronomiques 43 (2015), 177-186.
Innovations Agronomiques, 43(January), 177-186.
PRICI, 2016. Financement additionnel au projet d'urgence de
renaissance des infrastructures/Financement : Don IDA n° H 79 000 - CI/
cadre de gestion environnementale et sociale (CGES) rapport final Avril 2016.
pp 65-66
Rabeharisoa L., 2004. Gestion de la fertilité et de la
fertilisation phosphatée des sols ferrallitiques des Hautes Terres de
Madagascar. Thèse de Doctorat d'Etat ès-Sciences Naturelles.
Université
d?Antananarivo, Faculté des Sciences, Département
de Biologie et Ecologie Végétales. 199 p.
Raghothama K. G., 1999. Phosphate acquisition. Annual Review
of Plant Physiology and Plant Molecular Biology 50: pp. 665-693.
Rao I.M., Barrios E., Amézquita E., Friesen D.K.,
Thomas R., Oberson A., Singh B.R., 2004. Soil Phosphorus Dynamics, Acquisition
and Cycling in Crop-Pasture-Fallow Systems in Low Fertility Tropical Soils: a
Review from Latin America. ACIAR proceedings 114 p.
Randriamanantsoa L., Morel C., Rabeharisoa L., Douzet J.M.,
Jansa J., Frossard E., 2013. Can the isotopic exchange kinetic method be used
in soils with a very low water extractable phosphate content and a high sorbing
capacity for phosphate ions? Geoderma.
http://dx.doi.org/10.1016/j.geoderma.2013.01.019.
Razafimahatratra H. M., 2003. Optimisation des facteurs
interactifs de productivité du riz et impacts sur la maîtrise de
l'eau, cas du SRI sur les hautes terres malgaches, 102 p.
Rengel Z., 2008. Bioavailability of Phosphorus and
Micronutrients in the Soil-Plant-Microbe Continuum. Keynote papers. Fifth
International Symposium ISMOM 2008-November 24th - 28th, 2008 - Pucón,
Chile.8 p.
57
Reyes, I., Baziramakenga, R., Bernier, L., Antoun, H. 2001.
Solubilization of phosphate rocks and minerals by a wild-type strain and two
UV-induced mutants of Penicillium rugulosum. Soil Biology and Biochemistry 33:
pp. 1741-1747.
Richardson A.E., Barea J.M., McNeill A.M., Prigent-Combaret
C., 2009a. Acquisition of phosphorus and nitrogen in the rhizosphere and plant
growth promotion by microorganisms. Plant and Soil 321, pp. 305- 339.
Riggle, J., von Wandruszka, R., 2005. Binding of inorganic
phosphate to dissolved metal humates. Talanta 66(2): pp. 372-375.
Reddy, M.S., Kumar, S., Babita, K., Reddy, M.S., 2002.
Biosolubilization of poorly soluble rock phosphates by Aspergillus tubingensis
and Aspergillus niger. Bioresource Technology 84, pp. 187189.
Saidou, A., Kossou, D., Acakpo, C., Richards, P., &
Kuyper, T., 2012. Effects of farmers' practices of fertilizer application and
land use types on subsequent maize yield and nutrient uptake in central Benin.
International Journal of Biological and Chemical Sciences, 6(1), pp. 365-378.
https://doi.org/10.4314/ijbcs.v6i1.32
Saleem A. B., A. Ayaz, K.J. Jeffery, K.D. Harris, M., 2013.
Integration of visual motion and locomotion in mouse visual cortex Nat.
Neurosci., pp. 1864-1869
Salma Taktek, 2015. Dissolution biologique des phosphates :
Interaction bactéries - mycorhizes, pp 120.
Sánchez Chávez E., Muñoz E., Anchondo
Á., Ruiz J.M., Romero L., 2009. Nitrogen impact on nutritional status of
phosphorus and its main bioindicator: response in the roots and leaves of green
bean plants. Revista Chapingo, Serie horticultura 15 (2): pp. 177-182.
Seeling B, Zasoski R.J., 1993. Microbial effects in
maintaining organic and inorganic solution phosphorus concentrations in a
grassland topsoil. Plant Soil 148: pp. 277-284
Servín, P. M., 2014. Development of an Inoculant of
Phosphate Rock-Solubilizing Bacteria To Improve Maize, pp 1-10.
Siemens J., Ilg K., Lang F. and M. Kaupenjohann, 2004.
Adsorption controls mobilization of colloids and leaching of dissolved
phosphorus. European Journal of Soil Science 55: pp. 254 - 263.
Smalberger S.A., Chien S.H., Singh U., Henao, J., 2010.
Relative agronomic effectiveness of phosphate rock compared with triple
superphosphate for initial canola, wheat, or ryegrass, and residual wheat in
two acid soils. Soil Science. 175(1): pp. 36-43.
Smith F.W., Mudge S.R., Rae A.L., Glassop D., 2003. Phosphate
transport in plants. Kluwer Academic Publishers. Plant and Soil 248: pp.
71-83
Smith S.E., Read, D.J., 1997. Mycorrhizal symbiosis. Academic
Press, San Diego CA.
58
Song O., Lee S., Lee Y., Lee S., Kim K., Choi Y., 2008.
Solubilization of insoluble inorganic phosphate by Burkholderia cepacia DA23
isolated from cultivated soil. Brazilian Journal of Microbiology 39: pp.
151-156.
Souhaïl Mâalem, 2011. Etude de l'impact des
interactions entre le phosphore et le Chlorure de Sodium sur trois
espèces végétales halophytes du genre Atriplex Option
Physiologie (A. halimus, végétale A. et canescens applications et
A. nummularia). Consulté en ligne le 02 Septembre 2019 sur
https://docplayer.fr/85409444-Wzr@-lt%60lym-l%60ly-w-lbhth-l%60lmy.html
Souleymane S., Maméri C., Michel Z., J, K. Z., Francis
M., et Aïdara, S., 2010. Effets de la fertilisation minérale sur
des variétés améliorées de riz en condition
irriguée à Gagnoa, Côte d ' Ivoire. pp. 2235- 2243.
Stroia C., 2007. Etude de fonctionnement de
l'écosystème prairial en conditions de nutrition N et P
sublimitantes. Application au diagnostic de nutrition. Thèse de
Doctorat. Institut National Polytechnique de Toulouse, Université de
Sciences Agricoles et Médecine Vétérinaire de Banat
Timiþoara, Spécialité: Fonctionnement des
Ecosystèmes et Agrosystèmes. 256 p.
Toor G. S., 2009. Enhancing phosphorus availability in
low-phosphorus soils by using poultry manure and commercial fertilizer, Soil
Sci., 174, pp. 358-364
Turner B. L.; Paphazy, M. J.; Haygarth, P. M. & Mckelvie,
I. D. 2002a). Inositol phosphates in the environment. Phil.Trans.R.Soc. London
35. pp. 449-469.
Vance CP, Graham PH, Allan D. L., 2000. Biological nitrogen
fixation: phosphorus Ba critical future need? In F.O. Pederosa, M. Hungria,
M.G. Yates, W.E. Newton (Eds), Nitrogen Fixation from molecules to crop
productivity. Kluwer Academic publishers, Dordrecht, The Netherlands, pp 509
-518.
Vassilev N., Vassileva M., Azcon, R. 1997. Solubilization of
rock phosphate by immobilized Aspergillus niger. Bioresource Technology 59(1):
pp. 1-4.
Vassilev N., Vassileva M., Azcon R., Fenice M., Federici F.,
Barea J.M. 1998. Fertilizing effect of microbially treated olive mill
wastewater on Trifolium plants. Bioresource Technology 66(2): pp. 133-137.
Vitousek P.M., Porder M., Houlton B.J., Chadwick O.A., 2010.
Terrestrial phosphorus limitation: mechanisms, implications, and
nitrogen-phosphorus interactions. Ecological Applications 20: pp. 5-15.
Sodexam, 2005. Section météorologie, Côte
d'Ivoire - Bull. Annuel, 16 p.
Yu X, Liu X, Zhu TH, Liu G.H, Mao C., 2011. Isolation and
characterization of phosphate-solubilizing bacteria from walnut and their
effect on growth and phosphorus mobilization. Biol Fertil Soils 47: pp.
437-446
59
Zanguina A., 2011. Contribution à la
caractérisation physicochimique et à la mise en valeur
agronomique du phosphate naturel de Tahoua (Niger) : essais de fabrication de
phospho-compostage. Thèse de doctorat, Université de Niamey.
XIV
ANNEXES
ANNEXE I
Caractérisation et isolement des bactéries
solubilisatrices de phosphate.
1- Préparer le milieu PVK liquide contenant 10g de
glucose ; 0.01g d'Ammonium sulfate hydraté; 0.2g chlorure de potassium ;
0.2g de Chlorure de sodium ; 0.1g de sulfate de magnésium ; 0.002g de
sulfate de manganèse ; 0.002g de sulfate de fer septahydraté; 0.5
g d'extrait de levure ; 5g de Tricalcium de phosphate, maintenez le pH à
7 et autoclavez à 121 °C pendant 15min.
2- Préparer le milieu PVK de bleu de
Bromophénol solide contenant 10g de glucose ; 0.5 0.01g d'Ammonium
sulfate hydraté; 0.2g chlorure de potassium ; 0.2g de Chlorure de sodium
; 0.1g de sulfate de magnésium ; 0.002g de sulfate de manganèse ;
0.002g de sulfate de fer septahydraté; 0.5 g d'extrait de levure ; 15 g
Agar ; 0,25g de Bromophénol ; 5g de Tricalcium de phosphate, maintenez
le pH à 7 -7.2 et autoclavez à 121 °C pendant 15min.
3- Prélever 1g de chaque échantillon de sol et
ajouter dans les tubes à centrifugeuse contenant 10 ml d'eau
physiologique (NaCl 9%o) stérile
4- Agiter pendant 1h
5- Une heure après agitation, Un ml (1 ml) de la
dilution 10-1 est prélevée aseptiquement et mis dans 9
ml d'eau physiologique stérile donnant ainsi la dilution 10-2
qui est agitée avant de prélever 1ml que l'on ajoute à 9
ml d'eau physiologique stérile et ainsi de suite jusqu'à la
dilution 10-7.
6- 100 ul de chaque dilution sera prélevée et
étalé sur les boites de Pétri contenant le milieu PVK
gélosé. Trois boites seront été
préparées pour chaque dilution. Elles seront incubées
à 30° C pendant 7jours dès leur ensemencement.
7- De même, 20 ul de chaque dilution sera
prélevée et inoculée les microplaques contenant 200 ul de
milieu PVK liquide. Elles seront incubées à 30° C pendant
7jours dès leur ensemencement.
8- 7 jours après incubation, le nombre de
bactéries solubilisatrices de phosphate est déterminé au
spectromètre à DO 620 nm sur milieu liquide en microplaque.
9- Sur le milieu solide PVK, l'activité de
solubilisation de phosphate des BSP est évaluée par la
détermination de halos (zone claires) autour des colonies en croissance.
Ainsi, le diamètre de la colonie et de l'halo qui l'entoure seront
mesurés. L'indice de solubilisation sera calculé de
solubilisation.
L'indice de solubilisation sera calculé par la formule
suivante :
IS =
Diamètre de la colonie + Diamètre de
l'halo
Diamètre de la colonie
10- Les isolats ayant un IS >2 seront
sélectionnés puis réutilisés pour
réensemencer à nouveau des
microplaques contenant PVK. Cette procédure sera
répétée 3fois pour une purification des
XV
différents isolats de BSP. Les caractéristiques
morphologiques comme décrit par Sharna et al., (2011) de chaque
isolat seront mentionnées.
ANNEXE II
Préparation des solutions tampons de
phosphate
? Dissoudre 0,439g de phosphate monopotassique dans 500 mL
d'eau distillée. Acidifier la solution par 01 mL d'acide sulfurique
à 20% et ajuster le volume à 01 L avec de l'eau distillée.
Ensuite bien agiter pour homogénéiser la solution. On obtient une
solution mère S0 de concentration C0 = 323.10-5 mol/L, soit
une concentration massique de 0,1g/L (100mg/L) de P.
? Diluer au 01/10ème : Prélever 10 mL
de la solution-stock (S0) à 100 mg/L et la mettre dans une fiole de
100mL et compléter jusqu'au trait de jauge. On obtient une solution S1
de concentration massique C1 = 0,01g/L de P (10mg/L).
? Recommencer l'opération de dilution
précédente pour avoir la solution fille S2 de concentration
massique C2 = 1mg/L de P.
? A partir de la solution S2 de concentration 1mg/L de P,
préparer des solutions filles S3, S4, S5, S6, S7, S8 de concentration
C3, C4, C5, C6, C7, C8 selon le procédé résumé dans
le tableau suivant :
Tableau XIII : Tableau des absorbances des
solutions tampons de P
|
Solution
|
S0
|
S1
|
S2
|
S3
|
S4
|
S5
|
S6
|
S7
|
S8
|
|
C (mg P/L)
|
100
|
10
|
1
|
0,5
|
0,4
|
0,3
|
0,2
|
0,1
|
0,05
|
|
Vo (mL)
|
1
|
1
|
1
|
2,5
|
2
|
1,5
|
1
|
0,5
|
0,25
|
|
Veau
|
9
|
9
|
9
|
2,5
|
3
|
3,5
|
4
|
4,5
|
4,75
|
|
Absorbance
|
13,216
|
1,340
|
0,135
|
0,068
|
0,06
|
0,045
|
0,03
|
0,019
|
0,009
|
Les différentes solutions ont permis de construire la
courbe d'étalonnage du P Pour le dosage des ions orthophosphates, suivre
le protocole du kit à disposition.
Courbe étalon du Phosphore
|
Concentration en Ions Phosphate (mgP/L)
|
1,2
|
|
y = 7,5116x - 0,0249
R2 =
0,9971
|
|
0,8
0,4
0
|
|
|
XVI
0 0,04 0,08 0,12 0,16
Absorbance (DO)
ANNEXE III
Evolution générale de la couleur des
surnageants en fonction des traitements quel que soit le type de sol
:

T0 T1 T2 T3 T4 T5 T6 T7 T8
ANNEXE IV
Aspect général de la surface des
surnageants dans les traitements

A B
XVII
Traitements témoins (limpide et clair)
A B
A : Sol stérile
B : Sol non-stérile

Traitement contenant l'AP et la paille de riz (Présence
d'un film translucide semblable à celui causé par une
toxicité ferrique)



