0. Introduction générale
0.1. Problématique
0.1.1. Etat des lieux
Le paludisme demeure encore aujourd'hui l'un des principaux
problèmes sanitaires mondiaux. Il sévit partout, plus
particulièrement dans les zones tropicales ou subtropicales, par exemple
en Afrique, en Asie du Sud ou en Amérique latine. Il touche la
population humaine mondiale depuis des milliers d'années et continue de
sévir de nos jours, causant selon les estimations 216 millions de
cas cliniques et 655 000 décès en 2010, environ
90 % des décès et 80 % des cas cliniques surviennent en
Afrique, au sud du Sahara (OMS, 2011).
Sa transmission se produit dans 90 pays et territoires
situés entre les latitudes 45° Nord et 40° Sud. Ces
pays ont des zones tropicales ou subtropicales offrant des conditions
climatiques optimales pour favoriser le développement des
anophèles et des parasites du paludisme (OMS, 2014).
Sur le plan clinique, on distingue le paludisme simple ou
accès palustre et le paludisme grave qui peuvent être
causés par les cinq espèces de plasmodium. Le retard dans le
traitement ou le diagnostic du paludisme simple peut conduire au paludisme
grave lequel peut être mortel ou laisser des séquelles graves,
notamment chez les enfants de moins de cinq ans (Sagbo et al, 2008).
En effet, le paludisme grave ou cérébral chez
ces enfants non immunes a pour conséquence l'insuffisance
pondérale à la naissance, l'anémie, l'épilepsie et
les difficultés d'apprentissage en cas de survie de ces enfants (RBM,
2001). En outre, les infections paludéennes
répétées rendent les jeunes enfants plus sensibles aux
autres maladies courantes de l'enfance telles que la diarrhée et les
infections respiratoires, favorisant indirectement la mortalité (OMS,
2003).
Chaque année, le paludisme provoque entre 300 et 500
millions de cas de maladie et entraîne les décès de plus
d'un million d'enfants. Les enfants de moins de cinq ans vivant en Afrique
subsaharienne payent le plus lourd tribut à la maladie : près de
3 000 d'entre eux en meurent chaque jour. En Afrique, le paludisme est à
l'origine d'environ 20 % de tous les décès d'enfants. Certains
enfants sont victimes d'une attaque aiguë de paludisme
cérébral qui entraîne rapidement le coma et la mort ;
d'autres succombent à une grave anémie suite aux infections
à répétition ou aux conséquences d'un poids
insuffisant à la naissance qui s'explique lui-même par une
infection paludique utérine. Mais les enfants qui échappent
à la mort ne sont pas indemnes pour autant. Le paludisme entravera leur
développement. En Afrique subsaharienne, c'est le paludisme qui est
à l'origine de 30 à 50 % des visites de patients dans les
cliniques et de plus de 50 % des admissions à l'hôpital (UNICEF,
2004).
Géographiquement, l'infection à paludisme varie
d'une région à une autre sur le continent. Dans les zones de
forte endémie, pendant la période où la transmission
atteint son paroxysme, près de 70% d'enfants de moins de 5 ans ont le
paludisme dans leur sang faisant ainsi 1,6 à 5,4 accès palustre
chaque année (RBM, 2001).
Avec six à neuf mois de pluviométrie, l'Afrique
tropicale notamment la République Démocratique du Congo (RDC) se
caractérise par une forte prévalence du paludisme essentiellement
à plasmodium falciparum presque toute l'année.
Des solutions et des stratégies en vue d'éradiquer cette
épidémie en Afrique sont envisagées depuis l'époque
coloniale notamment la première conférence panafricaine du
paludisme de Kampala (1950) et la 8ème conférence
mondiale de la santé de Mexico (1955) qui suggéraient
déjà l'éradication du paludisme dans certaines
régions de l'Afrique. Face à la persistance de la
prévalence du paludisme, des nouvelles conférences furent
organisées pour redynamiser la lutte, notamment la conférence
d'Alma-Ata en 1978 qui défendait l'idée de développement
de soins de santé primaire (SSP) dans les pays
sous-développés et avait aussi penché sur les questions
liées au paludisme (Mosley, 1985).
Pays frappé de plein fouet par le paludisme, la RDC a
participé activement à toutes ces rencontres en tant que membre ;
d'autant plus que les autorités congolaises avaient mis en place
dès 1998 le Programme National de Lutte contre le Paludisme (PNLP) en
vue de coordonner les actions de lutte contre le paludisme en partenariat avec
les organismes internationaux intervenant sur la problématique du
paludisme. C'est à ce titre, que la RDC est engagée dans le
projet du Round 5 avec l'appui du PNUD et qu'il a soumis son composant
paludisme au Fond Mondial. Parmi les actions palpables issues de ces
décisions politiques, la promotion des moustiquaires
imprégnées à efficacité durable en prophylaxie et
l'utilisation de combinaison thérapeutique à base
d'artémisinine (ACT) en chimiothérapie constituent actuellement
les deux principaux axes de lutte contre le paludisme selon les recommandations
de l'OMS. Ces nouvelles options de lutte viennent pallier les limites du
dichloro-diphényl-trichlorétane (D.D.T) dont l'association avec
les antipaludéens de synthèse a fortement amélioré,
en son temps, la lutte contre le paludisme; et pour surmonter la
chimiorésistance du plasmodium ou les échecs
thérapeutiques mais aussi pour maîtriser le problème
lié aux mutations génétiques observées chez les
moustiques vecteurs du parasite.
Malgré, ces initiatives dans la lutte contre le
paludisme, leurs impacts restent limités notamment en RDC. De
même, la thérapie par les ACT reste assez faible dans la
population. Des obstacles de plusieurs ordres sur le terrain comme ailleurs en
Afrique, expliqueraient cette situation notamment : le manque de volonté
politique et de ressources financières et humaines, le manque de
formation du personnel médical, la faible reconnaissance des
bénéfices des ACT pour les communautés, la pénurie
des ACT d'une qualité garantie, le fait que les travailleurs de la
santé n'aient pas accès à des tests de diagnostics rapide
enfin, le faible accès aux soins en général (MSF, 2006).
Ces différentes approches mettent ainsi en
évidence la problématique de l'offre et de la demande des
services de santé lesquelles permettent de comprendre le comportement
des parents sur le mode de prise en charge médicale des enfants
souffrant du paludisme. En effet, des comportements médicaux
déplorables de la part des personnels soignants et les parents tels que
le non-respect de posologie, le recours aux formations de santé
après des jours et les décès intra-hospitalier non
déclarés sont constatés dans les pays africains
impaludés. A ce propos le Directeur du PNLP en RDC confirme que les
statistiques sur l'état du paludisme ne représentent que la
partie visible de l'iceberg, car elles proviennent des structures sanitaires
publiques ; certains décès survenus au niveau des structures
sanitaires ne sont pas notifiés et le taux de complétude des
rapports ne dépasse pas les 10% des cas réels sur l'ensemble du
territoire national (Antimi, 2006) ; alors même que l'OMS recommande
qu'en présence de tout syndrome fébrile chez un enfant de moins
de cinq ans, dans les régions sub-sahariennes où le paludisme est
endémique d'administrer un antipaludique approprié en
première intention et de recourir le plus tôt possible à
une formation sanitaire (Talani et al, 1995).
Plus de 85 % des cas et 90 % des décès dus au
paludisme surviennent en Afrique, au sud du Sahara, où ils concernent,
dans l'immense majorité, de jeunes enfants. Dans toute la
sous-région du Sahel, on observe la morbidité et la
mortalité dues au paludisme chez l'enfant avant tout pendant la saison
des pluies. On a montré que l'administration régulière
d'un traitement antipaludique efficace au cours de cette période
prévenait la morbidité et la mortalité dues au paludisme
chez l'enfant. Les interventions essentielles recommandées actuellement
par l'OMS pour lutter contre le paludisme sont l'utilisation de moustiquaire
imprégnées d'insecticide (MII) et/ou les pulvérisations
intra-domiciliaires d'insecticides à effet rémanent (IRS) pour la
lutte anti-vectorielle, ainsi que l'accès rapide aux épreuves de
diagnostic en cas de suspicion du paludisme et le traitement des cas
confirmés. Les interventions supplémentaires recommandées
dans les zones de forte transmission pour certains groupes à haut risque
sont le traitement préventif intermittent pendant la grossesse(TPIg) et
le traitement préventif intermittent du nourrisson(TPIn) (OMS, 2012).
Malgré tous ces efforts, le problème de la
mortalité infantile dû au paludisme se pose toujours avec
acuité dans le monde en général et en Afrique en
particulier. En République Démocratique du Congo(RDC), le
paludisme fait des nombreuses victimes. Cette endémie touche
particulièrement les enfants de moins de 5 ans. Bien plus qu'un
problème de santé publique, le paludisme constitue un fardeau
socio-économique important dans une grande partie de la population qui
est démunie.
En 2016, plus de 920 000 cas de paludisme ont
été traités en RDC, selon l'ONG
Médecins sans frontières
(Avril, 2017),
à l'occasion de la journée mondiale de lutte
contre le paludisme célébrée le 25 avril de cette
même année. Il indique cependant que beaucoup d'enfants de moins
de cinq ans meurent.
Selon le PNLP (2016), la province de Kwango a
enregistrée 33948 cas de paludisme simple et 27080 cas de paludisme
grave, dont une grande majorité d'enfants. En ce qui concerne la zone de
santé de Mwela-Lembwa, au cours de la période 2015-2016, le
nombre de personnes atteintes du paludisme s'élevait à 8.252 cas
dont 5.163 cas concernaient les enfants de moins de 5 ans et 115 cas de
décès ont été enregistrés à
l'Hôpital Général de Référence de Mwela, et
en 2016, un total de 10.252 cas de paludisme sur 18.625 malades qui ont
fréquenté cette structure sanitaire dont 6.237 cas de paludisme
parmi lesquels les enfants de moins de 5 ans. Un total de 139
décès chez les moins de 5ans a été notifié
pendant cette année à l'Hôpital Général de
Référence de Mwela.
0.1.2. Enoncé du problème
L'HGR de Mwela-Lembwa comme toute autre structure rurale de la
RDC, connait autant de difficultés : les ruptures
répétées en médicaments, l'insuffisance de
formation du personnel en matière de prise en charge du paludisme et le
non-respect du protocole national en matière de prise en charge du
paludisme... Ces nombreuses difficultés entrainent des
conséquences néfastes sur la qualité de soins chez les
enfants de 0-59 mois atteint de paludisme. Ceci a constitué pour nous
une préoccupation pour mener cette étude.
0.2. Questions de recherche
0.2.1. Question principale de recherche
Quelle est la qualité de la prise en charge du
paludisme grave chez les enfants de 0-59 mois à l'Hôpital
Général de Référence de Mwela-Lembwa ?
0.2.2. Questions spécifiques de recherche
· Le personnel de l'HGR de Mwela-Lembwa respecte-t-il le
protocole national en matière de prise en charge du paludisme grave chez
les enfants de 0-59 mois ?
· L'HGR de Mwela-Lembwa dispose-t-il de façon
permanente les intrants nécessaires pour la prise en charge du paludisme
grave ?
· Quel est l'issue des enfants traités pour
paludisme grave à l'Hôpital Général de
Référence de Mwela-Lembwa?
0.3. Hypothèses du travail
· Le protocole national en matière de prise en
charge du paludisme grave n'est pas respecté.
· Les médicaments et autres intrants
nécessaires pour la prise en charge des patients ne sont pas disponibles
de façon permanente.
· L'évolution finale des enfants traités
pour paludisme grave est hasardeuse
0.4. Objectifs de recherche
0.4.1. Objectif général
Notre objectif général est d'évaluer la
qualité de la prise en charge des enfants 0-59 mois traités pour
paludisme grave à l'Hôpital Général de
Référence de Mwela-Lembwa.
0.4.2. Objectifs spécifiques
· Evaluer le respect de l'application du protocole
national en matière de prise en charge du paludisme grave chez les
enfants de 0-59 mois à l'HGR de Mwela-Lembwa,
· Inventorier la disponibilité des
médicaments et des autres intrants nécessaires pour la prise en
charge du paludisme,
· Dresser un bilan sur l'évolution des enfants
traités pour paludisme grave.
0.5. Justification et intérêt du sujet
Le choix de réaliser une telle étude sur la
prise en charge du paludisme repose sur le fait que le paludisme figure parmi
les problèmes de santé publique qui menacent la vie des enfants
de 0-59 mois avec une mortalité importante.
L'application du protocole national en matière de prise
en charge du paludisme pose des sérieux problèmes par le
personnel.
L'indisponibilité des médicaments et des autres
intrants nécessaires pour la prise en charge pose des sérieux
problèmes en milieu rural et met en danger des milliers des vies des
enfants et affecte même le pronostic vital.
Ainsi, les résultats de cette étude pourront
servir de repère aux gestionnaires du système de santé
afin de mettre en place une politique efficace capable de relever les failles
constaté tant du côté prise en charge que dans
l'approvisionnement en intrant. Ceci peut contribuer à augmenter le
confort du patient.
0.6. Délimitation spatio-temporelle
Notre étude se déroule à l'Hôpital
Général de Référence de Mwela-Lembwa, plus
précisément aux services du triage et pédiatrie, dans la
Zone de Santé de Mwela, province du Kwango en République
Démocratique du Congo. Cette étude couvrira la période du
25 Avril au 25 juin 2018.
0.7. Subdivision du travail
Outre l'introduction générale bouclée par
une conclusion, notre travail comporte quatre chapitres :
- Le premier chapitre traite la revue de la
littérature ;
- Le deuxième chapitre se penche sur la
méthodologie ;
- Le troisième chapitre aborde la présentation
des résultats
- Le quatrième chapitre est consacré à
discuter les résultats.
CHAPITRE PREMIER : REVUE DE LA LITTERATURE
Ce chapitre présente quelques littératures
scientifiques en lien avec le paludisme.
1.1. Définitions des concepts
· Prise
en charge : c'est l'action de prendre en charge ou de s'occuper de
quelqu'un.
· Paludisme grave : selon le PNLP, c'est tout cas de
fièvre accompagné d'un signe de danger comme vomissement
répété, léthargie, convulsion, incapable de boire
ou téter...
1.2. Généralités sur le
Paludisme
Selon OMS (2017), le paludisme est une maladie potentiellement
mortelle dû à des parasites du genre plasmodium, transmis à
l'homme par des piqûres de moustiques Anophèles femelles
infectés, appelés vecteurs du paludisme. Le paludisme est une
maladie parasitaire transmissible causée par les protozoaires du genre
Plasmodium qui est transmise par les moustiques, caractérisé par
des symptômes récurrents : frissons, fièvre et douleurs
corporelles généralisées l'OMS (2014).
1.2.1. Etiologie
Le paludisme est une maladie parasitaire transmissible,
causée par les protozoaires du genre Plasmodium dont il existe plusieurs
variétés. Chacune de ces variétés occasionne des
accès de fièvres qui reviennent à l'intervalle
régulier, mais différemment espacés suivant le type de
parasite en cause (Nathan, 18850).
L'homme ne peut être parasité que par cinq
espèces spécifiquement humaines, dont les caractéristiques
morphologiques se différent entre elles.Les protozoaires en cause
appartiennent au genre plasmodium dont on connait cinq
représentants : Plasmodium falciparum, P. vivax, P. malariae, P.
ovale, P. falciparum et le parasite du paludisme du singe, P.Knowlesi (OMS,
2014).
1.2.2. Modalités de transmission
Selon Anofel (2014), l'homme est le seul réservoir du
parasite. La maladie se transmet d'une personne à une autre par trois
principaux modes de transmission:
Dans la plupart des cas, le paludisme est transmis par
l'intermédiaire de la piqûre d'un moustique, l'anophèle
femelle infesté (principal mode de transmission) à la recherche
de son repas sanguin pour nourrir ses oeufs. Lorsqu'ils piquent, les
moustiques, injectent leur salive qui la serve à rendre la peau
insensible à la piqure.
C'est ainsi, qu'ils inoculent également les plasmodiums
dans leur forme de sporozoïte. Toutes les espèces importantes de
vecteur du paludisme piquent entre le crépuscule et l'aube.
L'intensité de la transmission dépend de facteurs liés au
parasite, au vecteur, à l'hôte humain et à
l'environnement.
Il existe plus de 400 espèces de moustiques
Anophèles dans le monde, mais seuls 60 sont des vecteurs du paludisme
dans des conditions naturelles, dont 30 sont des vecteurs d'importance
majeure. La plupart des zones comptent plusieurs espèces
d'Anophèles, et différentes espèces sont présentes
dans différentes parties du monde. Les espèces vectrices les plus
virulentes, qui prédominent en Afrique, sont A. gambiae,
A. arabiensis et A. funestus. Les autres vecteurs courants en Asie
sont A. stephensi, A. minimus et A. dirus.
La transmission par transfusion sanguine non testé,
piqûre d'aiguille accidentelle(greffe d'organe) du sang contaminé
chez les personnels de santé manipulant le matériel d'injection
souillé ou partage de seringues conduisant à la transmission de
stades asexués du parasite. Ici la période d'incubation de la
maladie est par conséquent nettement plus courte qu'elle ne l'est
après transmission des sporozoites par la piqûre de moustique.
La transmission congénitale de la mère à
l'enfant (materno-foetale) pendant la grossesse ou l'accouchement. La
transmission du paludisme de la mère au foetus à travers le
placenta est diagnostiquée lorsqu'une parasitémie est
constatée chez le nouveau-né dans les sept jours après sa
naissance, ou plus tard en l'absence d'autre possibilité de transmission
au nouveau-né (par le sang ou par piqûre de moustique).
Malgré la forte prévalence de l'infection placentaire, la
transmission congénitale du paludisme est rare.
1.2.3. Epidémiologie
Selon Thellier (2012), l'épidémiologie du
paludisme dans le monde a beaucoup évolué depuis 2006, qu'il
s'agisse du paludisme sévissant en zone tropicale ou du paludisme
d'importation en France. On constate enfin une diminution importante du nombre
de cas et de décès, alors qu'il s'agit toujours de la maladie
parasitaire la plus meurtrière, et que l'endémie était
restée désespérément stable jusqu'au début
des années 2000. Néanmoins, la vigilance reste de mise, car
l'émergence chez l'homme d'une cinquième espèce du genre
Plasmodium infectant le singe et, surtout, l'apparition récente d'une
tolérance de l'espèce P. falciparum aux dérivés de
l'artémisinine, sont inquiétantes.
Le paludisme continue à tuer, surtout des enfants
(plusieurs centaines de milliers par an), en zone d'endémie, ainsi que
des voyageurs dans les pays développés (entre 100 et 200 par an,
dont 5 à 10 en France métropolitaine). La lecture des derniers
rapports de l'OMS sur le paludisme dans le monde, très complets depuis
2008 et du rapport 2011 du partenariat «Faire reculer le paludisme»
(Roll Back Malaria Partnership), donne une vision enfin rassurante de
l'efficacité de la lutte contre cette maladie. Ainsi, en 2010, l'OMS
estime que 216 millions d'épisodes de paludisme sont survenus (247
millions en 2006), dont 81 % observés en Afrique, avec cependant un
large intervalle d'incertitude, de 149 à 274 millions de cas.
Le nombre de décès en 2010 est estimé par
l'OMS à 655 000 (881 000 en 2006) ; ils seraient observés
en Afrique dans 91 % des cas et chez des enfants de moins de 5 ans dans 86 %
des cas. L'incidence du paludisme aurait diminué de 17 % depuis 2000, et
le taux de mortalité spécifique, de 26 %. Cette diminution
globale cache cependant des disparités suivant les pays, puisque si une
diminution du nombre de cas de plus de 50 % a été
enregistrée entre 2000 et 2010 dans 43 pays, la diminution est nettement
moins marquée dans plus de la moitié des 106 pays où la
transmission persiste.
Par ailleurs, ces estimations ne prennent pas en compte le
rôle du paludisme comme cofacteur de mortalité et sont nettement
inférieures à celles souhaitées par les organisations
internationales (Objectifs du millénaire pour le développement),
qui projetaient une diminution globale de 50 % en 2010. Cette
amélioration de la situation du paludisme dans le monde est le
résultat d'une reprise plus efficace du plaidoyer pour la lutte et de la
mobilisation des acteurs, de la formation et de la sensibilisation de la
population des pays concernés, mais, surtout, d'une augmentation
considérable des fonds consacrés au contrôle du paludisme
(de 0,3 à 1,7 milliards de dollars par an entre 2003 et 2009 et 2
milliards en 2011).
Le rapport sur le paludisme dans le monde (OMS, 2017) souligne
également qu'il y a eu, 216 millions de cas de paludisme en 2016,
contre 211 millions en 2015. On estime à 445 000 le nombre de
décès dus au paludisme en 2016, un chiffre similaire à
celui de l'année précédente (446 000).La Région OMS
de l'Afrique supporte une part disproportionnée de la charge mondiale du
paludisme. En 2016, 90% des cas de paludisme et 91% des décès dus
à cette maladie sont survenus dans cette région. 80% de la charge
de morbidité due au paludisme pesaient sur une quinzaine de pays tous
situés en Afrique subsaharienne, sauf l'Inde.Dans les régions
où la transmission du paludisme est intense, les enfants de moins de 5
ans risquent tout particulièrement de contracter l'infection, de tomber
malades et de mourir; plus des deux tiers (70%) des décès dus au
paludisme surviennent dans cette tranche d'âge.Le nombre de
décès enregistrés chez les enfants de moins de 5 ans est
passé de 440 000 en 2010 à 285 000 en 2016. Toutefois, le
paludisme demeure toujours un facteur majeur de mortalité chez les
enfants de moins de cinq ans et un enfant en meurt toutes les deux minutes.
1.2.4. Symptomatologie
Ce n'est que plusieurs jours, et parfois deux semaines
seulement après la piqure de moustique, qu'apparaissent les
symptômes. Leurs caractères, et en particulier la fréquence
des accès de fièvre, dépendent de la variété
du parasite. Certaines de ces variétés demandent quarante-huit
heures pour évoluer et les accès apparaissent tous les trois
jours, d'autres évoluent en septante deux heures et les accès ont
lieu tous les quatre jours.
1.2.4.1. Cas de paludisme simple
Le signe le plus important du paludisme c'est la
fièvre (ou un épisode fébrile dans deux à trois
derniers jours dans un pays endémique). Au début, la
fièvre peut-être soit continue, soit irrégulière
mais elle s'installe rapidement avec des crises tous les deux à trois
derniers jours. Chaque crise peut durer plusieurs heures et commence souvent
par des frissons, la fièvre apparait ensuite puis des sueurs abondantes.
Pendant la crise, le malade se plaint de : céphalée,
sensation de froid, courbatures, tremblements, fatigue, frisson, transpiration,
nausée sans signes de gravité, vomissement, asthénie
physique, anorexie, diarrhée, myalgie, etc. (Courtejoie et Rotsart.,
1986).
1.2.4.2. Cas de paludismegrave
Les enfants fortement atteints développent
fréquemment une hyperparasitémie caractérisée par
un ou plusieurs des symptômes suivants : difficulté de
parler, de s'assoir, de se tenir debout ou de marcher (fatigue intense),
incapacité de téter, de boire ou de manger,
antécédents de convulsion ou convulsion actuelle, saignement au
niveau des gencives, du nez ou de la peau, élimination d'urines en
petite quantité et de couleur café ou coca-cola, troubles de
comportement (agitation, logorrhée, la confusion, mutisme,
agressivité, euphorie...), perte de conscience ou le coma, jaunisse
et/ou pâleur palmaire, respiration anormale ou inhabituelle,
extrémité froides, vomissement à répétition,
déshydratation sévère (peau flasque, yeux enfoncés,
plis cutanés persistants, soit intense, sécheresse de la muqueuse
buccale...) (PNLP, 2012).
1.2.5. Diagnostic
I.2.5.1. Diagnostic clinique
L'élément majeur du diagnostic clinique de
paludisme est une forte présomption en secteur d'endémie :
« fièvre = paludisme ». La
géo-répartition du paludisme n'étant pas uniforme,
même dans les pays où il sévit, il importe de s'appuyer sur
les arguments géographiques et sur la notion de voyage. On ne
négligera pas non plus l'éventualité d'un paludisme
transfusionnelle, congénitale ou transmis par une aiguille
contaminée (H.M.GILLES, 1990). De toute façon, les signes et les
symptômes du paludisme ne sont pas propres à cette maladie, ceci
signifie que de nombreuses autres infections peuvent provoquer des signes et
des symptômes identiques à ceux du paludisme. Le diagnostic
clinique du paludisme simple ne se justifie que lorsqu'un test de diagnostic
n'est pas disponible. Les présentes recommandations de l'OMS dans ces
situations sont :
? Dans un contexte caractérisé par un faible
risque palustre, le diagnostic clinique d'un cas de paludisme simple doit
être basé sur la possibilité d'exposition à
l'infection et sur un antécédent de fièvre au cours des
trois jours précédents, en l'absence de signes d'autres maladies
graves;
? Dans un contexte caractérisé par un risque
palustre élevé, le diagnostic clinique doit être
basé sur un antécédent de fièvre au cours des
dernières 24 heures et/ou sur la présence d'une
anémie, pour laquelle une pâleur palmaire semble être le
signe le plus fiable chez le jeune enfant, en l'absence des signes d'autres
maladies graves (Lagarde, 2016).
I.2.5.2. Diagnostic parasitologique
Toute suspicion de paludisme basée sur des signes
cliniques doit être confirmée par un diagnostic parasitologique.
Celui-ci est recommandé dans tous les cas de suspicion de paludisme quel
que soit le contexte de transmission. Le diagnostic parasitologique
présente les avantages suivants :
a) il permet une meilleure prise en charge des malades dont le
diagnostic parasitologique est positif, car il renforce la certitude que la
cause de la maladie est le paludisme ;
b) il permet d'identifier les sujets n'ayant pas le paludisme,
pour lesquels un autre diagnostic doit être posé ;
c) il évite l'administration inutile d'antipaludiques,
ce qui réduit la fréquence des effets indésirables et des
interactions médicamenteuses ;
d) il permet de confirmer les échecs
thérapeutiques ;
e) il améliore le dépistage et la notification
des cas. (Aubry, at. al, 2017). Le diagnostic parasitologique doit pouvoir
être réalisé rapidement (moins de 2 heures)
après l'examen clinique du malade. Si ce n'est pas possible, le patient
doit être traité sur la base du diagnostic clinique.
Les deux principales méthodes de diagnostic
parasitologique sont l'examen au microscope optique et les tests de diagnostic
rapide (TDR).
1. Examen microscopique
a) Diagnostic direct
Les techniques microscopiques conventionnelles, frottis mince
et goutte épaisse demeurent la référence. Elles
nécessitent une méthodologie simple, mais précise et
rigoureuse et un long apprentissage (OMS, 2012).
ü Le frottis mince : La
sensibilité est corrélée au temps d'observation (lecture
d'au moins 100 champs, en pratique 20 minutes).
Le frottis mince permet l'étude morphologique des
hématozoaires, le diagnostic différentiel entre les
espèces plasmodiales (il reste toujours un défi même pour
un lecteur averti).
ü La goutte épaisse : Examen
de référence de l'OMS, est largement utilisée pour le
diagnostic de routine. Sa sensibilité (seuil de détection
d'hématies parasitées/uL) est de 20 hématies
parasitées/uL, 10 fois plus élevée que celle du frottis
mince.
2. Les tests de diagnostic rapide(TDR)
Permettent de déceler les antigènes
spécifiques issus des stades sanguins des parasites du paludisme. La
présence de l'antigène est indiquée par une ligne de
résultat sur une bande de nitrocellulose.
Selon Lagarde (2016), les TDR constituent un support utile
pour un diagnostic clinique du paludisme et une solution de remplacement
valable à l'examen microscopique pour le diagnostic clinique du
paludisme simple, en particulier en l'absence de services de microscopie de
qualité. La sensibilité et la spécificité des TDR
pour détecter le paludisme à falciparum et vivax sont comparables
à celles de la microscopie de champ. Les TDR se présentent sous
différentes formes : bandelettes, cartes et cassettes, les
dernières étant les plus utilisées en raison de leur
facilité d'emploi. Pour les tests, on utilise du sang total,
généralement prélevé par ponction digitale (Rapp,
2017).
Les TDR sont des épreuves de détection
d'antigène immuno-chromatographiques à flux latéral,
reposant sur la capture d'anticorps marqués avec un colorant afin de
produire une bande visible sur un film de nitrocellulose. Dans le cas des TDR
du paludisme, l'anticorps marqué se lie à l'antigène du
parasite et le complexe résultant est capturé sur un film par une
bande d'anticorps lié qui formera une ligne visible par
précipitation. Une ligne de contrôle donne des informations sur
l'intégrité du conjugué d'anticorps marqué par un
colorant, mais ne confirme pas que le TDR puisse détecter
l'antigène parasitaire. Certains TDR ne mettent en évidence
qu'une seule espèce, P. falciparum. D'autres détectent cette
espèce en combinaison avec une ou plusieurs des trois autres
espèces qui parasitent l'homme (P. vivax, P. ovale et
P. malariae), d'autres encore détectent toutes ces espèces.
Les TDR disponibles dans le commerce ciblent la protéine-2 riche en
histidine (HRP2) de Plasmodium falciparum, le lactate
déshydrogénase de plasmodium (pLDH) et/ou l'aldolase (commun
à toutes les espèces de paludisme). Différentes variantes
de pLDH peuvent être présentes dans les TDR disponibles dans le
commerce : pLDH-Pan (commun à toutes les espèces de paludisme),
pLDH-Pf (présent uniquement dans P. falciparum), pLDH-Pv
(présent uniquement dans P. vivax) et pLDH-Pvom (présent
dans toutes les espèces sauf P. falciparum). Le TDR
spécifique au P. falciparum est un test de capture
d'antigènes à l'aide d'un anticorps monoclonal contre la HRP2 du
P. falciparum. Il sert à confirmer le paludisme à falciparum
et aussi à l'exclure en cas de fièvre inexpliquée,
indiquant ainsi la nécessité de rechercher d'autres causes
possibles. Un résultat de test positif n'indique donc pas toujours la
présence d'une infection active, mais il appuie le diagnostic du
P. falciparum simple si le malade n'a pas reçu de traitement
antipaludique dans les semaines qui précèdent.
Si le malade a déjà reçu un traitement
avec un antipaludique, l'examen microscopique d'une goutte épaisse est
recommandé pour l'analyse d'un possible échec
thérapeutique (Paris et Danis, 2016).
1.3. Traitement curatif
1.3.1. Prise en charge du paludisme simple chez
l'enfant
Selon OMS (2010), L'objectif du traitement du paludisme simple
est de guérir l'infection, c'est-à-dire éliminer de
l'organisme les parasites qui ont provoqué la maladie. Cela permet de
prévenir la progression vers une forme grave de la maladie et
d'éviter un surcroît de morbidité résultant d'un
échec thérapeutique. En termes de santé publique, le
traitement a pour but de réduire la transmission à d'autres
personnes, c'est-à-dire de réduire le réservoir infectieux
et d'éviter l'apparition et la propagation d'une résistance aux
antipaludiques. Pour améliorer le résultat du traitement et
éviter qu'une résistance aux monothérapies se
développe, l'OMS recommande une combinaison d'antipaludiques pour le
traitement du paludisme à falciparum. Ces combinaisons
thérapeutiques consistent à administrer simultanément au
moins deux schizontocides sanguins ayant des mécanismes d'action
différents, c'est-à-dire agissant sur des cibles
indépendantes dans le parasite. Elles reposent sur un double principe :
? Une combinaison médicamenteuse est souvent plus
efficace qu'une mono-thérapie;
? Dans les cas rares où un hématozoaire mutant
résistant à l'un des médicaments apparaîtrait
spontanément au cours de l'infection, il serait éliminé
par l'autre médicament, ce qui empêche ou retarde
l'émergence d'une résistance. Les combinaisons
thérapeutiques à base d'artémisinine (CTA) sont de
combinaisons dans lesquelles l'un des médicaments est
l'artémisinine ou l'un de ses dérivés (Artésunate,
Artémether, dihydroartémi-sinine...). Les artémisinines
entraînent une clairance parasitaire rapide et la prompte disparition des
symptômes. Les artémisinines ont des effets gamétocytocides
sur P. falciparum, ce qui peut contribuer à réduire la
transmission. Ils existent sous forme de formulations à dose fixes ou de
thérapies co-administrées.
En RDC, les combinaisons thérapeutiques à base
de CTA suivantes sont recommandées comme médicaments de
première ligne pour le traitement du paludisme simple chez les enfants
dans les secteurs tant public que privé (PNLP, 2012).
ü Artésunate +
Amodiaquine (AS-AQ) : Ces produits sont actuellement
disponibles en formulation fixe sous la forme de comprimés contenant
respectivement 25/67,5mg (nourrisson : 2-11 mois); 50/135mg
d'Artésunate et d'Amodiaquine (petit enfant : 1-5 ans). Le
schéma posologique est basé sur le nombre de comprimés par
dose administrés selon des tranches d'âge
prédéterminées : nourrisson (2-11 mois) :
1comprimé, petit enfant (1-5 ans) :1 comprimé une fois par
jour (prise unique) pendant 3 jours. La dose cible est de 4 mg/kg/jour
d'Artésunate et de 10 mg/kg/jour d'Amodiaquine une fois par jour
pendant 3 jours, avec une marge thérapeutique de
2-10 mg/kg/jour pour l'Artésunate et de 7,5-15 mg/kg/jour pour
l'Amodiaquine.
N.B. : il est recommandé d'administrer l'AS-AQ aux
enfants après un repas et y ajouter une boisson sucrée ou un jus
de fruit sucré, tout en se rassurant que le traitement complet est pris
une fois chaque jour pendant 3 jours (Fandeur, et al, 2010).
ü Artémether +
Luméfantrine (AL): Ces produits sont
actuellement disponibles en formulation fixe sous la forme de comprimés
dispersibles ou ordinaires contenant 20 mg d'Artémether et
120 mg de Luméfantrine. Le traitement recommandé consiste
à administrer 6 doses sur 3 jours. Le schéma
posologique est basé sur le nombre de comprimés par dose
calculé selon des tranches de poids prédéterminées
(5-14 kg : 1 comprimé ; 15-24 kg :
2 comprimés) deux fois par jour pendant 3 jours. Par rapport
au poids corporel, cette posologie correspond respectivement à 1,7 et
12 mg/kg d'Artémether et de Luméfantrine par dose,
administrés deux fois par jour pendant 3 jours, la marge
thérapeutique étant de 1,4-4 mg/kg pour l'Artémether
et de10-16 mg/kg pour la Luméfantrine.
N.B. : il est recommandé
d'administrer l'AL aux enfants après avec un aliment ou une boisson
contenant une forte teneur en graisse (par exemple du lait). On administre la
première dose immédiatement et la deuxième dose huit
heures après. Puis une dose le matin et une dose le soir pendant le
deuxième et le troisième jour jusqu'à ce que l'emballage
soit vide, tout en se rassurant que le traitement complet est pris deux fois
par jour pendant 3 jours et aux heures recommandées.
ü Artésunate +
méfloquine : Cette formulation est actuellement
disponible sous forme de comprimés sécables
séparés, présentés dans des blisters, contenant les
uns 50 mg d'Artésunate et les autres 250 mg de
méfloquinebase. La dose cible est de 4 mg/kg d'Artésunate
administrée une fois par jour pendant 3 jours et de 25 mg de
méfloquine fractionnés sur 2 jours à raison de
15 mg/kg et de 10 mg/kg ou sur 3 jours à raison de
8,3 mg/kg/jour. La marge thérapeutique est de 2-10
mg/kg/dose/jour pour l'Artésunate et de 7-11 mg/kg/dose/jour pour
la méfloquine. L'administration de méfloquine est associée
à une incidence accrue des nausées, des vomissements, des
vertiges, de la dysphorie et des troubles du sommeil, mais ces effets sont
rarement débilitants.
ü
Artésunate+Sulfadoxine-Pyriméthamine :
Cette formulation est actuellement disponible sous forme de comprimés
sécables séparés contenant les uns 50 mg
d'Artésunate et les autres 500 mg de Sulfadoxine et 25 mg de
Pyriméthamine. La dose cible est de 4 mg/kg/jour
d'Artésunate administrée une fois par jour pendant 3 jours
avec une prise unique de Sulfadoxine-Pyriméthamine
(25 mg/1,25 mg) le premier jour, la marge thérapeutique
étant de 2-10 mg/kg/jour pour l'Artésunate et de
25-70/1,25-3,5 mg/kg pour la Sulfadoxine-Pyriméthamine.
ü Dihydroartémisinine plus
pipéraquine : Ces produits sontactuellement disponibles en
formulation fixe sous la forme de comprimés contenant 40 mg de
dihydroartémisinine et 320 mg de pipéraquine. La dose cible
est de 4 mg/kg/jour de dihydroartémisinine et de 18 mg/kg/jour
de pipéraquine administrée une fois par jour pendant
3 jours, avec une marge thérapeutique de 2-10 mg/kg/jour pour
la dihydroartémisinine et de 16-26 mg/kg/jour pour la
pipéraquine.
N.B. : la quinine reste la seule
molécule pour la prise en charge de cas de paludisme chez
l'enfant de moins de 2 mois.
1.3.2.Prise en chargespécifique du paludisme
grave chez l'enfant
Le paludisme grave est une urgence médicale.
Après un rapide bilan clinique et la confirmation du diagnostic, il faut
administrer sans délai au patient atteint de paludisme grave un
traitement antipaludique approprié, correct et complet par voie
parentérale.
Voici les recommandations de l'OMS pour le traitement du
paludisme grave chez l'enfant :
1.3.2.1. Artésunateinjectable
Conformémentaux nouvelles directives, administrer
préférentiellement l'Artésunate injectable plutôt
que la quinine injectable pour le traitement du paludisme grave chez l'enfant.
L'Artémether ou la quinine sont des options acceptables si l'on ne
dispose pas d'Artésunate parentérale (OMS, 2014).
Posologie d'Artésunate : 2,4 mg/kg
administré en IV ou en IM dès l'admission (temps zéro)
puis après 12 et 24 heures, en suite une fois par jour
jusqu'à ce que le patient puisse avaler. Il est disponible en ampoules,
contenant 60 mg d'acide artésunique anhydre, avec une ampoule
séparée de solution de bicarbonate de sodium à 5 %.
Reconstitution : le flacon de poudre d'Artésunate doit
être mélangé avec 1 ml de solution de bicarbonate de
sodium à 5 % (fournie) et le tout doit être agité
pendant 2-3 minutes afin de favoriser la dissolution. Il faut
préparer une nouvelle dose de solution à chaque administration et
ne pas la stocker.
Pour l'administration en intraveineuse (IV) : ajouter
5 ml de glucose à 5 % ou de solution saline isotonique afin de
parvenir à une concentration d'Artésunate de 10 mg/ml et
administrer en perfusion lente.
Pour l'administration en intramusculaire (IM) : ajouter
2 ml de glucose à 5 % ou de solution saline isotonique afin de
parvenir à une concentration d'Artésunate de 20 mg/ml.
1.3.2.2. Artémether
Si l'Artésunate n'est pas disponible, administrer de
l'Artémether de la manière suivante : Artémether :
3,2 mg/kg de poids corporel en IM (dose d'attaque), suivis de
1,6 mg/kg chaque jour jusqu'à ce que le patient puisse avaler.
1.3.2.3. Quinine
S'il n'est possible d'administrer ni de l'Artésunate ni
de l'Artémether, donner de la quinine selon la posologie suivante :
Quinine : 20 mg de sels de dichlorhydrate de quinine/kg (dose d'attaque)
dilués dans 10 ml de solution saline isotonique/kg en perfusion IV
pendant 4 heures ; puis administrer une dose d'entretien de sels de
quinine, à raison de 10 mg/kg sur 4 heures. Il faut
répéter cette dose d'entretien toutes les 8 heures, en
calculant le temps à partir du début de la perfusion
précédente, jusqu'à ce que le patient puisse avaler
(Meksi, 2012).
Si, pour une raison ou pour une autre, la quinine ne peut pas
être passée en perfusion IV, le dichlorhydrate de quinine peut
être donné à la même posologie en injection IM dans
la face antérieure de la cuisse (pas dans les fesses). La dose de
quinine sera injectée pour moitié dans la cuisse droite, et pour
moitié dans la cuisse gauche. Pour une utilisation en IM, il faut si
possible diluer la quinine dans de la solution saline pour obtenir une
concentration de 60-100 mg sels de quinine/ml.
Dans le traitement du paludisme grave, les antipaludiques
parentéraux doivent être administrés pendant au moins
24 heures une fois que le traitement est commencé (que le patient
retrouve ou non sa capacité à absorber des médicaments par
voie orale avant la fin de cette période de 24 heures). Si le
patient peut ensuite avaler, il convient de compléter le traitement en
lui donnant un traitement complet de l'une des thérapies suivantes :
traitement complet de la CTA recommandée en première intention
(Artésunate) ou la quinine, conformément aux posologies
indiquées pour le cas de paludisme simple comme traitement de relais.
Chez les enfants qui nécessitent plus de 48 heures
de quinine par voie parentérale, diminuer d'un tiers à une demie
la dose d'entretien (5-7 mg de sels/kg toutes les 8 heures). Les
doses totales quotidiennes de quinine intraveineuse pur l'enfant sont les
suivantes : Premier jour du traitement : 20-25 mg de sels/kg;
Deuxième jour du traitement : 20 mg de sels/kg ; Troisième
jour du traitement et jours suivants : 10 mg de sels/kg (MSF, 1993).
N.B. : les Traitements ci-dessous sont
contre-indiqués en cas de paludisme grave chez l'enfant:
corticostéroïdes, autres anti-inflammatoires, autres agents
donnés pour l'oedème cérébral (urée, sucre
inverti), dextran de bas poids moléculaire, épinéphrine
(adrénaline), héparine, pentoxifylline (oxpentifylline),
oxygène hyperbare, cyclosporine (cyclosporine A).
1.4. Pronostic
Le pronostic est favorable, si le traitement est
instauré à temps sinon, et surtout en cas de paludisme tropical,
la maladie peut être fatale. Parfois aussi, surtout chez les jeunes
enfants, s'installe le paludisme chronique, mieux appelé
« paludisme viscéral » qui peut donner lieu à
un nanisme malarien. Il est la suite de réinfection,
nécessairement subie en pays endémique et il ne s'observe
généralement que dans les régions
d'endémicité permanente où le P. falciparum est chronique,
non corrigé par l'immunisation, auquel participe tous les organes et il
en résulte que ces malades sont exposés à la fièvre
bilieuse hémoglobinurique, ou s'enfoncent vers la cachexie (Carmen,
1995).
I.5. Model théorique de l'étude
Fièvre/Suspicion paludisme ?
251627008251638272
251628032
TDR/Frottis/GE
251629056
251630080251631104
Négatif
251633152
Positif
251632128
251634176251624960
Signes de gravités
251635200
Pas de paludisme
251636224251660800
251658752251662848
Chercher d'autres signes
251661824
Non
251639296
Oui
251637248
251642368251640320
Paludisme simple
251643392
Paludisme grave
251641344
251644416251653632
251649536
Vomissement ?
251647488
Antipaludique injectable conformément au protocole
national:
- Artésunateen IV, ou
- Artémetheren IV, ou
- Quinine en IV.
251654656
251648512
Oui
251650560
Non
251651584
251652608
Antipaludique Oral avec CTA :
AS-AQ, ou AL,...
251645440251646464
251655680
251656704
Contrôle et suivi avec Frottis/Goutte-
épaisse/ TDR au Jour 3, Jour 7 et Jour
28.
251659776
251657728
Figure 1 : Prise en charge du paludisme
chez les enfants de 0-59 mois.
Source (PNLP, 2012).
CHAPITRE DEUXIEME : METHODOLOGIE DE RECHERCHE
2.1. Introduction
Ce chapitre aborde essentiellement les méthodes et
techniques utilisées au cours de cette étude. Toutes les
démarches entreprises ont été expliquées dans le
présent chapitre sous six (6) points : Le 1èr
point présente la brève introduction dans laquelle nous avons le
type et la période d'étude ainsi que le plan
méthodologique ; le 2ème point décrit le
milieu d'étude comportant la dénomination, la situation
géographique, les données socioéconomiques, les services
organisés à l'HGR, le déroulement des services à
l'HGR, le circuit fonctionnel et relation entre les services, la
capacité d'accueil, les structures organiques, l'organigramme
structurel, l'organigramme fonctionnel ainsi que l'effectif et qualification
des personnels ; le 3ème point décrit
l'échantillonnage avec comme sous titres : la population cible de
l'étude, les techniques d'échantillonnage, la
détermination de la taille de l'échantillon et les
critères de sélection ; le 4ème point
parle des techniques de collecte des données comportant les techniques,
l'outils, les variables de l'étude ainsi que la sélection et
formation des enquêteurs ; le 5ème point parler de
l'analyse et de traitements des données et enfin le
6ème point parle de la considération d'ordre
éthique.
2.2. Type et période d'étude
Il s'agissait d'une étude transversale à
visée analytique et descriptive portant sur l'évaluation de la
qualité de la prise en charge du paludisme grave chez les enfants de
0-59 mois, particulièrement à l'HGR de Mwela-Lembwa.
Cette étude s'est déroulée du 25 Avril
au 25 Juin 2018 soit 2 mois, couvrant la saison pluvieuse et le début de
la saison sèche reconnue comme étant celle de la recrudescence et
de la transmission maximale du paludisme dans ce milieu.
2.3. Plan méthodologique
Pour cette investigation, la technique d'enquête
à l'aide d'une grille d'évaluation utilisée dans sa
version statistique et systémique a été retenue
principalement. L'étude utilise aussi les données quantitatives
et qualitatives issues des observations directes participatives et de
l'interview aux personnels soignants.
2.4. Milieu de l'étude
2.4.1. Dénomination
Notre milieu d'étude est dénommé
Hôpital Général de Référence de Mwela-Lembwa,
en sigle « HGR-ML ».Par sa signification, il est un
établissement étatique à caractère médical
et social, dont son objectif consiste à assurer à tous les
individus les soins de qualité d'une façon préventive,
promotionnelle et curative, envie de restaurer et maintenir l'équilibre
sanitaire.
2.4.2.Situation géographique
L'Hôpital Général de
Référence de Mwela-Lembwa est localisé dans le groupement
Kambundi ganga, dans le secteur de Ganaketi, territoire de Feshi, Province du
Kwango, République Démocratique du Congo, au sein de la Zone de
Santé de Mwela-Lembwa.
Allant de sa situation géographique, il est
limité :
- Au Nord, par le ruisseau Lembwa,
- Au Sud, par la grande route menant vers Kinshasa,
- A l'Est, par le camp de docteur et le camp secteur,
- A l'Ouest, par le camp fore ami.
2.4.3.Données socio-économiques
L'Hôpital Général de
Référence de Mwela-Lembwa est l'un des points captivants de la
contrée, c'est-à-dire de la Zone de Santé de Mwela-Lembwa,
qui connait un climat tropical à deux saisons dont, la saison de pluie
qui va du 1èr septembre au 15 mai et la saison sèche qui
commence à partir de mi-mai au mois d'août de chaque
année.
Son relief est constitué d'une savane herboboiseuse,
avec un sol sablonneux.
Sa végétation est dominée par la
brousse, traversée par deux grandes rivières, dont INZIA et
BAKALI, constituant son bassin hydrographique. Il se trouve au coeur du secteur
de Ganaketi, dont la population environnante vit de l'agriculture et de
l'élevage artisanal (85 %). La nature du sol étant sablonneuse et
pauvre, la population est soumise à une faible production qui entraine
la malnutrition. Les cultures les plus rencontrées sont : le
manioc, les arachides, le mais, l'haricot, les tarots, les
niébés, les légumes (...).La seule voie d'accès
principal reste routière et le réseau téléphonique
reste le seul moyen de communication.
2.4.4. Services organisés à l'HGR
L'Hôpital Général de
Référence de Mwela-Lembwa organise les services
ci-après : les services médicaux, administratifs,
médico-techniques et les services généraux.
a) Les services médicaux :
Chirurgie (Homme et Femme), Maternité, Pédiatrie, Triage,
Médecine Interne (Homme et Femme), Banque du Sang, Echographie.
b) les services administratifs:
secrétariat,mouvement et statistique, Budget et contrôle,
réception et caisse, Comptabilité,
c) Les services
médico-techniques : laboratoire, pharmacie, consultation
ambulatoire (Triage).
d) Les services généraux :
entretien, logistique, et maintenance.
2.4.5. Déroulement des services
A l'Hôpital Général de
Référence de Mwela-Lembwa le service commence de 7 heures 30'
jusqu'à 15 heures 30' et fonctionne 24 heures sur 24 heures sans
interruption, composé de deux équipes à deux
vocations :
-La première équipe est composée de
service matinal et va de 7 heures 30' à 15 heures 30 minutes, avec une
pause de 30 minutes, de 12 heure 30' à 13 heure 00'.
-La seconde commence de 15 heure 30' jusqu'à 7 heure
30' du jour suivant, composée de quatre infirmiers de garde,
secondé par les stagiaires.
Avant le début des activités
journalières, les infirmiers de garde présentent leurs rapports
à toute l'équipe qui commencera bientôt et les stagiaires
tiennent directement la propreté avant de commencer le travail.
Pour terminer ce point, notons que le service de garde est
supervisé par le médecin de garde et le service journalier par le
Directeur de Nursing et le Médecin Traitant. Notamment, c'est le
Directeur de Nursing qui a le pouvoir de répartir les tâches
à l'HGR. Toutefois, le chef de service s'en charge aussi dans le cas
d'empêchement.
2.4.6.Circuit fonctionnel et relation entre les
services
Dès l'arrivée du patient à l'HGR, il lui
est exigé de passer avant tout à la réception et à
partir de là, celui-ci sera orienté à la réception
pour l'achat de la fiche, en suite au triage pour l'anamnèse avant de
lui prescrire les médicaments selon le cas. Le malade sera traité
directement au triage ou en hospitalisation. S'il guérit, il prend son
billet de sortie, mais sinon, il obtient un transfert. Parlant de la relation
entre les services, chaque service a son responsable mais tous les services
à l'Hôpital sont chapeautés par le Médecin Directeur
secondé par le Directeur de Nursing.
2.4.7. Capacité d'accueil
L'Hôpital Général de
Référence de Mwela-Lembwa dispose essentiellement en son sein
quatre bâtiments en matériaux durable, avec une capacité
d'accueil de quatre-vingts cinq lits montés, repartis de la
manière suivant (Dans un tableau) :
- Chirurgie Homme : 9 lits
- Chirurgie Femme : 8 lits
- Médecine Interne Homme : 10 lits
- Médecine Interne Femme : 9 lits
- Pédiatrie : 22 lits
- Maternité : 15 lits
- Gynécologie : 12 lits
2.4.8. Structure organique
Parlant de la structure organique, on a ce qui suit : le
Comité Directeur, l'Administrateur Gestionnaire, le staff
médical, la Direction de Nursing.
a) Le Comité Directeur : est
composé de Médecin Directeur, l'Administrateur Gestionnaire,
le Directeur de Nursing, le Staff médical (Médecin Traitant,
Infirmiers responsables, pharmacien).
Il a pour rôle :
- Exécuter les décisions de l'Equipe Cadre de la
Zone de Santé et de Comité de Gestion,
- Assurer la gestion quotidienne de l'Hôpital,
- Dresser les comptes d'exploitations mensuelles et
annuelles,
- Proposer et élaborer les états de paies,
- Convoquer les réunions du staff médical et
élaborer la liste standard des médicaments à utiliser,
- Représenter l'Hôpital devant l'état,
- Collaborer avec la direction administrative de
l'Hôpital pour ressortir les besoins de l'institution,
- Signer le bon de sortis et d'entré de la caisse avec
l'administrateur.
b) Les administrateurs gestionnaires, ont
pour rôle :
- Dresser les bilans et les comptes d'exploitations mensuelles
et annuelles,
- Assurer la liquidation, l'engagement et ordonner les
dépenses,
- Désigner après avis du Médecin
Directeur, l'agent responsable pour la tenue des documents financiers et
comptables de l'Hôpital,
- Assurer la libération et la décision de la
gestion administrative du personnel, des statistiques et des mouvements des
malades,
- Contrôle quotidiennement les entrées et les
sorties des fonds,
- Elaborer les préventions budgétaires,
- Préparer les états des paies du personnel.
c)Le staff médical, a pour rôle
:
- Eclairer tout problème des soins et aider le
personnel à le résoudre,
- Organiser les unités de soins de manière
à assurer aux malades les soins adéquats à leurs besoins
fondamentaux,
- Participer à la planification de leçons
théoriques pour la formation continue des infirmiers et les
stagiaires,
- Participer à réunions matinales
secondées par les Médecins Directeur et le Directeur de
Nursing,
- Assurer l'encadrement du personnel au niveau des
pavillons
d) La direction de nursing : est
assurée par un infirmier du niveau A1 tellement
expérimenté et a pour rôle :
- Organiser, planifier, coordonner, faire le suivi et
superviser tous les soins infirmiers,
- Contrôler régulièrement les infirmiers
et approuver tout changement du personnel infirmier,
- Assurer la formation continue du personnel soignant,
- Assurer l'encadrement des stagiaires,
- Compiler, analyser et faire signer tous les rapports au
Médecin Directeur,
- Elaborer la planification et l'horaire de service de
personnels soignants,
- Superviser tous les services médico-techniques,
- Participer à toutes les réunions et à
toutes les décisions de l'Hôpital et de la Zone de
Santé.
2.4.9.Organigramme structurel de l'HGR
L'organigramme structurel de l'Hôpital de Mwela-Lembwa
se présente comme suit :
COMITE DIRECTEUR
251663872
251664896
SECRETARIAT
251665920
251672064
251673088251674112251666944
SERVICES ADMINISTRATIF ET FINANCIERS
251667968
SERVICES MEDICO-TECHNIQUES
251668992
251676160251675136
251682304251681280251680256251679232251678208251677184251689472251691520251692544251693568251694592251695616251696640251670016251671040
PHARMA CIE
251702784
CO MPTABILITE
251701760
PERSONNEL
251699712
STATISTIQUE
251697664
MATERIEL
251698688
FINANCE
251700736
ECHOGRAPHIE
251684352
MEDECINE INTERNE
251686400
PEDIA
TRIE
251683328
GYNECOOBSTETRIQUE.
251688448
TRI A GE
251690496
LABORATOIRE
251687424
CHIRUR
GIE
251685376
Source : secrétariat/ HGR, (2018).
Figure 2 :Organigramme de l'HGR de
Mwela-Lembwa.
2.4.10.Effectifs et qualification des personnels
L'Hôpital Général de
Référence de Mwela-Lembwa compte un effectif de 46 agents
jusqu'au 25 Juin 2018, comme représenté par le tableau
ci-dessous :
Tableau1 :Personnel de l'HGR de Mwela-Lembwa et
leur qualifications jusqu'au 25 juin 2018.
|
N°
|
Catégorie
|
Qualification
|
Nombre
|
|
01
|
Médecins généralistes
|
Docteur en médecine
|
3
|
|
02
|
Administrateurs Gestionnaire
|
G3
|
4
|
|
03
|
Infirmiers
|
A1
|
10
|
|
A2
|
11
|
|
A3
|
4
|
|
04
|
Technicien de labo
|
A1
|
1
|
|
05
|
Secrétaire
|
D6
|
1
|
|
06
|
Réceptionniste
|
D6
|
1
|
|
07
|
Caissière
|
D6
|
1
|
|
08
|
Sage-femme
|
PP5
|
3
|
|
09
|
Sentinelle
|
-
|
1
|
|
10
|
Travailleurs Ordinaires
|
-
|
6
|
|
TOTAL
|
46
|
Source : liste actualisée des agents de l'HGR
deuxième trimestre 2018.
2.5. Echantillonnage
2.5.1. Population d'étude
Pour notre étude, la population d'étude est
constituée de tous les enfants de 0 à 59 mois qui ont
été reçus et traités à l'Hôpital
Général de Référence de Mwela-Lembwa du 25 avril
au 25 juin 2018 ainsi que leurs gardiennes (mères).
Toutefois, les personnels soignants de services de triage et
de pédiatrie ont constitué notre source d'information et ont
été utiles pour l'obtention des données portant sur la
qualité de la prise en charge du paludisme chez les enfants de 0-59
mois.
2.5.2. Technique d'échantillonnage
Il s'agit d'un échantillonnage exhaustif de tous les
enfants de 0-59 mois chez qui le diagnostic de paludisme grave a
été confirmé.
2.5.3.Détermination de la taille de
l'échantillon
L'Hôpital Général de
Référence de Mwela-Lembwa a enregistré 268 enfants de 0-59
mois pour toutes causes confondues dont 218 cas de paludisme grave.
Nous avons par convenance considéré la
totalité de 218 enfants reçus pour paludisme grave.
2.6.Critères de sélection
a) Critères d'inclusion
Pour faire partie de l'échantillon, les sujets à
enquêter devront répondre aux critères ci-après:
- Etre enfantde 0-59 mois,
- Avoir été soigné pour paludisme grave
durant la période de l'étude.
b) Critères d'exclusion
Est exclu de l'étude, tout sujet ne répondant
pas aux critères d'inclusion ci-haut énumérés.
2.7. Méthodes et techniques de collecte des
données
2.7.1. Technique
Pour cette étude, nous avons recouru à la
technique d'enquête et les techniques d'analyse documentaire et
d'observations pour collecter les données pour les enfants de 0-59 mois.
Quelques interviews face à face ont été effectuées
par les enquêteurs grâce à l'administration d'un
questionnaire standardisé aux personnels soignants (triage et
pédiatrie). Cette technique nous a aidé à soumettre
quelques questions aux enquêtés pour pouvoir recueillir de
réponses écrites dont nous aurions besoin dans la recherche.
2.7.2. Outils
Pour collecter les données et les renseignements dont
nous avions besoin pour cette étude, nous avons élaboré
deux types d'instruments :
- une grille d'observation a été
utilisée.
- Un guide d'entretien adressé aux parents des enfants
de 0-59 mois ayant consultés l'HGR pour le cas de paludisme grave. Ces
outils ont permis de récolter les données quantitatives et
qualitatives.
2.8. Sélection et
formation des enquêteurs
a) Sélection des
enquêteurs
Pour atteindre la population cible de cette étude,
nous utiliserons la sélection de quatre (4) enquêteurs qui seront
choisis parmi les élèves stagiaires finalistes A2, et nous allons
jouer le rôle de superviseur et cela après analyse à l'aide
des critères préétablis :
- Avoir une connaissance de la langue locale et une
expérience dans la collecte des données sur terrain ;
- Avoir une connaissance acceptable sur le paludisme ;
- Être courageux et humble ;
- Avoir la volonté de travailler avec les gardiens des
enfants de 0-59 mois et les personnels soignants de services de triage et
pédiatrie.
b) Formation des
enquêteurs
La formation se déroulera pendant 2 jours, basée
sur :
- L'objectif de l'enquête,
-La garantie de l'anonymat et la confidentialité des
renseignements qu'ils nous fourniraient,
- La conduite à adopter sur terrain vis-à-vis
des gardiens des enfants de 0-59 mois et des personnels soignants de services
de triage et pédiatrie de l'HGR,
- La lisibilité et la cohérence des
données collectées pour une bonne compréhension.
2.9.Pré-enquête
Avant de descendre à l'HGR/Mwela-Lembwa pour la
collecte des données auprès des gardiens des enfants de 0-59 mois
et les personnels soignants, nous organisions une mini enquête au Centre
de Santé de Référence de Matari qui se situe à 3 Km
de l'HGR, car ce Centre a le même Paquet Complémentaire
d'Activité que celui-ci.
Les enquêteurs auront à mesurer l'outil qui sera
le questionnaire d'enquête pour se rendre compte des réactions des
enquêtés face au questionnaire et bien d'autres aspects (la
durée d'une interview, le degré de compréhension de
questions, les difficultés en rapport avec le consentement
éclairé), surtout aussi évaluer la fiabilité de ce
questionnaire envie de détecter les ambiguïtés et les
problèmes éventuels que recélerait son contenu.
Ce pré-test devait se dérouler au moins une
semaine avant la collecte des données proprement dites.
2.10. Déroulement de
l'enquêteproprement dite
La lettre de recherche délivrée par la section
santé communautaire de l'ISTM/Kenge, a permis d'entrer en contact
d'abord avec les autorités de l'HGR de Mwela-Lembwa et les chefs de
services de triage et pédiatrie ensuite, pour réalisation de
l'enquête.
Un entretien de face à face avec les gardiens des
enfants de 0-59 mois et des personnels soignants de triage et pédiatrie
était ensuite réalisé, soutenu par des explications
claires et approfondies. Chaque interview prendra à peu près 30
à 40 minutes pour éviter de fatiguer l'enquêté.
2.11. Techniques d'analyse et traitement des
données
Les données ont été saisies et
analysées à base du logiciel SPSS 17.0 qui a permis le calcul
des différents indicateurs et la construction des différents
tableaux. C'est-à-dire les fréquences des indicateurs de
l'étude ont été calculées. Nous avons
également utilisé le logiciel Sphinx plus 2 pour les analyses
descriptives et la construction des graphiques.
Les analyses ont été essentiellement
descriptives et inférentielles. Les analyses descriptives basées
sur le calcul des fréquences et sur les inférences statistiques.
Les analyses descriptives ont consisté à décrire les
effectifs de l'échantillon selon l'âge, le sexe, les signes
cliniques, l'évolution et le résultat final de contrôle
à la sortie...
Les tendances ont été décelées sur
base de la formule suivante :
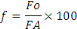
Où,
f = Fréquence relative
FO = Fréquence observée
FA = Fréquence attendue
Le test du chi-carré (Khi2) a été
utilisé pour vérifier les liens entre la qualité de la
prise en charge et les facteurs démographiques, cliniques,
parasitologiques et thérapeutiques associés à
l'utilisation de ces services.
La statistique de chi-carré (Khi2) a été
testée au seuil de signification de 5% (p =0,05) à l'aide des
logiciels informatiques.
2.12. Considérations d'ordre éthique
Un formulaire de consentement éclairé de
personnes interviewées est rédigé pour garantir le respect
de la personnalité humaine, les principes de bienfaisance et de justice
requis pour toute étude. Il a été lu à chacun
d'eux. Ce formulaire explique les objectifs poursuivis par l'étude et
les bénéfices à tirer à tous les niveaux, le type
d'investigation proposée, le risque encouru et les précautions
prises pour le minimiser.
CHAPITRE TROISIEME : PRESENTATION ET ANALYSE
DES DONNEES
Dans ce présent chapitre, nous allons présenter
les résultats issus de notre enquête selon les principales
caractéristiques se rapportant aux sections reprises sur notre outil des
collectes des données, conformément aux objectifs que nous nous
sommes assignés au départ par rapport à
l'évaluation de la qualité de la prise en charge de cas de
paludisme chez les enfants de 0-59 mois à l'Hôpital
Général de Référence de Mwela-Lembwa.
3.1. Description de l'échantillon
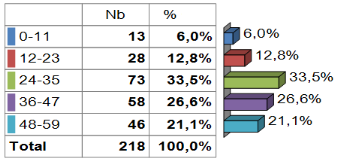
Tableau 2 : Répartition par âge des
enfants atteints du paludisme grave.
251610624
Source : Auteur, (2018).
Parmi les enfants atteints de paludisme, la répartition
par âge montre que 73 (soit 33,5 %) avaient l'âge compris entre
24-35 mois ; 58 enfants (soit 26,6 %) avait l'âge compris entre 36
à 47 mois ; 46 enfants (soit 21,1 %) se situait entre 48 et 59
mois ; pour 28 enfants (soit 12,8 %) l'âge variait entre 12 et 23
mois, et enfin ; l'âge de 13 enfants soit 6,0 % se situait entre 0
et 11 mois.
Tableau 3 : Répartition des enfants
atteints du paludisme grave selon le sexe.

251704832
Tableau 3: Répartition des enfants atteints du
paludisme grave selon le sexe.
Source : Auteur, (2018).
Les résultats montrent que 117 enfants (soit 53,7%)
étaient de sexe masculin contre 101 enfants (soit 46, 3%) de sexe
féminin.
Tableau 4 : Répartition des enfants
atteints du paludisme grave selon le lieu de provenance.

Tableau 4: Répartition des
enfants atteints du paludisme grave selon le lieu de provenance.
Source : Auteur, (2018).
Par rapport au lieu de résidence, 48 (soit 22,0 %) de ces enfants proviennent de Mwela-Lembwa ;
36 enfants, (soit 16,5 %) proviennent de Makaya; 29 enfants, (soit 13,3
%), sont de Matari ; 22 enfants (soit 10,1 %) sont de Kiamfu ; 19
enfants soit (soit 8,7 %) proviennent de NkusuTsay. Pour Mavunda ils sont
17 enfants (soit 7,8%) ; pour Kulonda ils sont 13 enfants soit
(6,0%) ; 11 enfants (soit 5,0 %) proviennent de Mwanabasila; 10 enfants,
(soit 4,6 %) proviennent de Mulasa-Mwela ; pour le reste des villages
(Kimfusa, Ngima, Mulasa-Tingi, Lumbala et Bumba) sont représentés
par 8 enfants (soit 3,7 %) et, enfin 5 enfants, (soit 2,3 %) proviennent de
Kifilu.

251613696Tableau 5:
Répartition des malades selon le temps écoulé
entre le début des symptômes et la consultation.
Source : Auteur, (2018).
Les parents d'enfants malades prenaient la décision
après en moyenne 2,84 jours, c'est-à-dire, après en
moyenne 2 jours 20 heures et 10 minutes, avec une variabilité de 14
heures et 24 minutes (0,60 jour). La majorité des parents
c'est-à-dire le mode (160 parents, soit 73,4 %), amenait leurs enfants
à l'hôpital 2 à 6 jours après le
déclenchement de la maladie, 33 parents soit 15,1 % avaient amené
leurs enfants après 2 à 3 jours, suivi de 16 parents soit 7,3 %
qui avaient amené leurs enfants après plus de 7 jours ;
enfin 9 enfants soit 4,1 % ont été amenés à
l'Hôpital après 1jour du début de l'épisode.
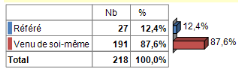
Tableau 6: Répartition des
patients selon le mode d'arrivé à l'Hôpital
Général de Mwela-Lembwa.
251620864
Source : Auteur, (2018).
Les résultats de ce tableau montre que 27 (soit 12,4%)
des patients ont été référés par les
structures et 191 soit (87,6%) ont directement consulté à
l'hôpital.
Graphique 1 : Répartition
des patients selon les motifs de référence à
l'Hôpital Général de Mwela-Lembwa.

Source : Auteur, (2018).
Parmi les 27 patients référés par les
structures, on note que 11 (soit 40%) ont été
référé pour anémie sévère ; 7
(soit 25,93%) pour vomissement répété ; 5 soit 18,52%
pour convulsion répétée ; 3 soit 11,11% pour coma et
enfin 1 soit 3,70% pour autres complications.
Tableau 7: Répartition des
malades selon les motifs de consultation.

Source : Auteur, (2018).
Les plaintes les plus récurrentes relevées par
les parents des enfants malades sont : la fièvre avec 204 enfants
représentant 93,6 % des cas, suivi de la pâleur de l'enfant dont
146 cas, soit 67,0 %, ensuite les vomissements (98 cas, dont 45,0 %), les
convulsions (63 cas, dont 28,9 %), l'anorexie (55 cas, dont 25,2 %), les
douleurs abdominales (44 cas, dont 20,2 %) ; et d'autres cas peu
fréquents comme des pleurs incessants (33 cas, dont 15,1 %), le regard
plafonné (19 cas, dont 8,7 %), le coma (12 cas, dont 5,5 %) et autres
signes non mentionnés ici (11 cas, dont 5,0 %).
Tableau 8: Répartition des
patients atteints du paludisme grave selon les complications cliniques
observées.

251614720
Source : Auteur, (2018).
Sur les 218 enfants de 0 à 59 mois ayant
présenté des complications on observe que la détresse
respiratoire était notée chez 54 patients (24,8 %), suivi de
l'hypoglycémie avec 51 cas (23,4 %), le neuropaludisme avec 46 des
patients (21,1 %), puis de l'anémie sévère avec 22 cas
(10,1 %), 11 cas soit 5,0 % pour la convulsion à
répétition. La fièvre bilieuse hémoglobinurique
n'était notée que chez 8 malades soit 3,7 %.
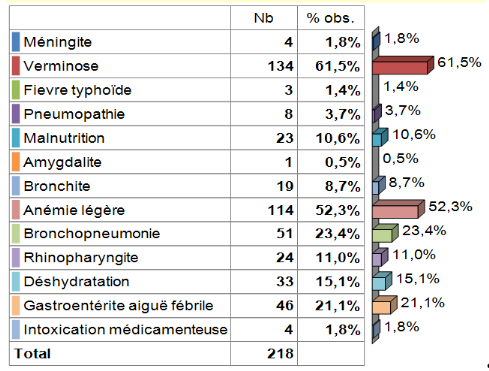
Tableau 9: Répartition des malades selon les
diagnostics associésau paludisme
Source : Auteur, (2018).
Sur les 13 cas cités, la verminose vient en tête
avec 134 cas (soit 61,5 %), suivi d'anémie légère (114 cas
dont 52,3 %), ensuite la bronchopneumonie (51 cas dont 23,4 %), la
gastroentérite (46 cas dont 21,1 %), la déshydratation (33 cas
dont 15,1 %), la rhinopharyngite(24 cas dont 11,0 %), la malnutrition (23 cas
dont 10,6 %), la bronchite(19 cas, soit 8,7 %), la pneumopathie(8 cas dont 3,7
%), l'intoxication médicamenteuse et la méningite (4 cas chacune,
soit 1,8 %), la fièvre typhoïde, avec 3 cas, soit 1,4 % et un seul
cas d'amygdalite (0,5 %).

Tableau 10: Répartition des
malades selon le mode de diagnostic utilisé.
Source : Auteur, (2018).
En ce qui concerne le mode de diagnostic, pour 88,1%, le
diagnostic était clinique et biologie ; et pour une minorité
soit 11,9% il n'était que clinique.
Tableau 11: Répartition des
malades selon les types d'examens effectués.

Source : Auteur, (2018).
La goutte épaisse était de plus en plus
effectuée (sur 168 patients, soit 77,1 %), et très peu
réalisé le Test de Diagnostic Rapide (TDR) (sur 26 patients, soit
11,9 %). Notons, par ailleurs que l'examen de frottis mince n'avait
été effectué sur aucun cas.
Tableau 12 : Répartition
des malades selon les résultats de la Goutte Epaisse.
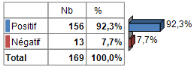
Source : Auteur, (2018).
Sur un total de 169 examens de Goutte Épaisse
réalisés, 156 cas (soit 92,3 %) se sont avérés
positifs contre 13 cas négatifs (7,7 %).
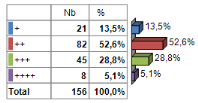
Tableau 13: Répartition des
malades selon la parasitémie de la GE.
Source : Nos investigations (Auteur, 2018).
La majorité des cas (le mode) ont tombé sur une
parasitémie « ++ », 82 cas sur le total des 156
examens de la Goutte Épaisse effectués, (soit 52,6 %) ; 45
cas « +++ » soit (28,8 %) ; 21 cas avaient
« + » (soit 13,5 %) et 8 cas avaient
« ++++ » (soit 5,1 %).
Tableau 14: Répartition des
malades selon les résultats du Test de diagnostic Rapide
(TDR).
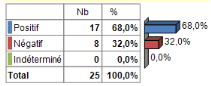
Source : Auteur, (2018).
Sur 25 cas soumis à l'examen de TDR, 17 cas (soit 68,0
%) ont été positifs et 8 cas (soit 32,0 %) ont été
négatifs.
Graphique 2 : Répartition
des malades selon le taux d'hémoglobine.
 Source : Auteur, (2018).
Source : Auteur, (2018).
A la lumière de ce graphique, 72 soit 33,03% n'avait
pas été dosé pour l'hémoglobine ; 80 patients
(36,70 %) avaient une hémoglobinémie supérieure à
5g/dl, suivi de 43 patients (19,72 %) avec une hémoglobinémie
égale à 5g/dl. L'hémoglobinémie inférieure
à 5 g/dl n'était retrouvée que chez 23 patients(10,55
%).
Graphique 3: Répartition des
malades selon les types de traitement reçu avant
l'hospitalisation.

Source : Auteur, (2018).
Sur 218 patients hospitalisé ayant
bénéficié d'un traitement à domicile, 96 patients
(soit 44,0 %) avaient reçu un traitement de type moderne, 68 patients
(31,2 %) avaient reçu un traitement traditionnel ; 31 soit 14,2%
n'avaient reçu aucun traitement et 23 patients soit (10,6 %) avaient
mélangé un traitement moderne à un traitement traditionnel
Tableau 15: Répartition des
malades en fonction de la molécule antipaludéen reçue en
hospitalisation.

Source : Auteur, (2018).
Il est remarquable sur ce tableau que 114 (soit 52,3 %) des
malades avaient récu la quinine injectable associée à
l'ACT ou quinine comprimé ; 93 patients (soit 42,7 %) avaient
récu l'artésunate injectable associée à l'ACT ou
quinine comprimé alors que seulement 11 enfants (soit 5,0 %) avaient
recu l'artémether injectable
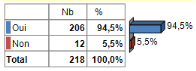
Tableau 16: Répartition des
malades en fonction du respect de traitement instauré.
Source : Auteur, (2018)
Le traitement a été respecté dans 94,5 %
(206 cas) contre 5,5 % (12 cas) où le suivi avait posé
problème.
Tableau 17: Répartition des
malades selon l'évolution finale

251623936
Source : Auteur, (2018)
L'évolution des patients s'est présentée
comme suite : la guérison était observée sur 201
enfants (soit 92,2 %) ; 9 enfants (soit 4,1 %) étaient perdus de
vue ; 5 (soit 2,3 %) étaient décédés et 3
enfants (soit 1,4 %) étaient transférés.
Tableau 18 : Répartition des intrants
(GE/Frottis/TDR) en fonction de la disponibilité pour les examens
para-cliniques à l'HGR de Mwela-Lembwa.
|
Disponibilité des intrants
|
Nb.
|
%
|
|
Oui
|
192
|
88,1 %
|
|
Non
|
26
|
11,9 %
|
|
Total
|
218
|
100 %
|
Source : Auteur, (2018)
Le résultat de ce tableau montre que 192 soit 88,1 %
des patients hospitalisés pour le cas de paludisme grave ont eu
accès aux examens para-cliniques contrairement aux 26 soit 11,9 %
patients où les examens para-cliniques n'ont pas été
réalisés suite à la rupture des intrants.
La rupture des intrants pour les examens para-cliniques
pourait compromettre la bonne prise en charge chez les enfants atteints du
paludisme grave.
Tableau 19: Répartition des
médicaments antipaludéen prescrits en fonctionde la
disponibilité à l'HGR
|
Disponibilité des médicaments
prescrits
|
Nb.
|
%
|
|
Oui
|
176
|
81 %
|
|
Non
|
42
|
19 %
|
|
Total
|
218
|
100 %
|
Source : Auteur, (2018)
Sur un total de 218 patients hospitalisés à
l'HGR de Mwela pour paludisme grave, 176 (81 %) de ces patients étaient
servis en médicaments antipaludéen tandis que 42 (19 %) autre
s'étaient retrouvés avec les ordonnances en main suite à
la rupture des médicaments antipaludéen.
3.2. Analyse relationnelle
Tableau 20 : Relation entre âge et
évolution finale des patients atteints de paludisme.
|
Quelle est la tranche d'âge de l'enfant? (en mois)
|
Quelle est l'évolution finale de l'enfant à
l'hôpital
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
TOTAL
|
|
0-11
|
12
|
1
|
0
|
0
|
13
|
9,35
|
1
|
0,673
|
|
12-23
|
27
|
1
|
0
|
0
|
28
|
|
24-35
|
68
|
1
|
3
|
1
|
73
|
|
36-47
|
53
|
4
|
1
|
0
|
58
|
|
48-59
|
41
|
2
|
1
|
2
|
46
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
Source : Auteur, (2018).
La dépendance n'est pas significative entre l'âge
et l'évolution finale du malade. Kh²=9,35; ddl= 1 ;
Pv=0,673
Tableau 21: Relation entre Sexe et
évolution finale des patients.
|
Quel est le sexe de l'enfant?
|
Quelle est l'évolution finale de l'enfant à
l'hôpital
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
0,59
|
3
|
0,102
|
|
Masculin
|
108
|
5
|
2
|
2
|
117
|
|
Féminin
|
93
|
4
|
3
|
1
|
101
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
Source : Auteur, (2018).
La dépendance n'est pas significative entre le sexe et
l'évolution finale des patients. Kh²=0,59; ddl=3 ; Pv=0,102
Tableau 22: Relation entre mode d'arrivée
à l'hôpital et l'évolution finale.
|
Est-ce que le malade a-t-il été
référé ou il est venu de soi-même?
|
Quelle est l'évolution finale de l'enfant à
l'hôpital ?
|
Kh2
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
38,98
|
3
|
0,001
|
|
Référé
|
19
|
2
|
5
|
1
|
27
|
|
Venu de soi-même
|
182
|
7
|
0
|
2
|
191
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
La relation est très significative entre le mode
d'arrivée etl'évolution finale de l'enfant à
l'hôpital. Chi2=38,98; ddl=3 ;Pv=0,001
Tableau 23 : Relation entre types de
Complications et l'évolution finalede l'enfant à
l'hôpital
|
L'enfant a-t-il présenté de complications ?
si oui, lesquelles ?
|
Quelle est l'évolution finale de l'enfant à
l'hôpital
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Non réponse
|
26
|
0
|
0
|
0
|
26
|
38,14
|
2
|
0,004
|
|
Anémie sévère
|
15
|
2
|
3
|
2
|
22
|
|
Neuropaludisme
|
40
|
3
|
2
|
1
|
46
|
|
Fièvre bilieuse hémoglobinurique
|
7
|
1
|
0
|
0
|
8
|
|
Détresse respiratoire
|
52
|
2
|
0
|
0
|
54
|
|
Hypoglycémie
|
51
|
0
|
0
|
0
|
51
|
|
Convulsions à répétition
|
10
|
1
|
0
|
0
|
11
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
La relation est très significativeentre les types de
complications et l'évolution finale de l'enfant à
l'hôpital. chi2 = 38,14 ; ddl = 2 ;Pv=0,004
Tableau 24 : relation entre la parasitémie
et l'évolution finale des patients
|
Si l'examen de la goutte épaisse a été
positif, quelle a été sa parasitémie
|
Quelle est l'évolution finale de l'enfant à
l'hôpital ?
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Non réponse
|
58
|
4
|
0
|
0
|
62
|
11,33
|
12
|
0,501
|
|
+
|
19
|
1
|
1
|
0
|
21
|
|
++
|
72
|
4
|
3
|
3
|
82
|
|
+++
|
44
|
0
|
1
|
0
|
45
|
|
++++
|
8
|
0
|
0
|
0
|
8
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
La dépendance n'est pas significative entre la
parasitémie et l'évolution finale de l'enfant. chi2 =
11,33 ;ddl = 12 ;Pv = 0,501
Tableau 25 : relation entre pathologies
associées et l'évolution finale de l'enfant.
|
L'enfant a-t-il eu des pathologies associées ? Si
oui, laquelle ou lesquelles?
|
Quelle est l'évolution finale de l'enfant ?
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Non réponse
|
32
|
3
|
0
|
0
|
35
|
42,61
|
4
|
0,314
|
|
Méningite
|
4
|
0
|
0
|
0
|
4
|
|
Verminose
|
127
|
3
|
3
|
1
|
134
|
|
Fièvre typhoïde
|
3
|
0
|
0
|
0
|
3
|
|
Pneumopathie
|
7
|
0
|
0
|
1
|
8
|
|
Malnutrition
|
21
|
0
|
1
|
1
|
23
|
|
Amygdalite
|
1
|
0
|
0
|
0
|
1
|
|
Bronchite
|
18
|
0
|
1
|
0
|
19
|
|
Anémie légère
|
110
|
3
|
1
|
0
|
114
|
|
Bronchopneumonie
|
48
|
2
|
0
|
1
|
51
|
|
Rhinopharyngite
|
22
|
2
|
0
|
0
|
24
|
|
Déshydratation
|
30
|
1
|
2
|
0
|
33
|
|
Gastroentériteaiguë fébrile
|
4
|
2
|
2
|
0
|
46
|
|
Intoxication médicamenteuse
|
3
|
1
|
0
|
0
|
4
|
La dépendance n'est pas significative entre les
pathologies associées et l'évolution finale des patients. chi2 =
42,61 ;ddl=4 ;Pv=0,314.
Tableau 26: relation entre
les signes présentés avant l'hospitalisation et
l'évolution finale du patient.
|
Quels sont les signes qu'a présentés l'enfant
avant d'être amené à l'hôpital?
|
Quelle est l'évolution finale de l'enfant de
l'hôpital?
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Fièvre
|
189
|
8
|
4
|
3
|
204
|
42,22
|
27
|
0,031
|
|
Pâleur
|
133
|
8
|
4
|
1
|
146
|
|
Convulsions
|
53
|
3
|
4
|
3
|
63
|
|
Vomissements
|
89
|
6
|
2
|
1
|
98
|
|
Anorexie
|
52
|
2
|
0
|
1
|
55
|
|
Douleurs abdominales
|
43
|
1
|
0
|
0
|
44
|
|
Regard plafonné
|
16
|
0
|
1
|
2
|
19
|
|
Pleurs incessants
|
32
|
0
|
1
|
0
|
33
|
|
Coma
|
8
|
2
|
2
|
0
|
12
|
|
Autres
|
10
|
1
|
0
|
0
|
11
|
La dépendance est significative entre les signes
présentés à l'arrivée et l'évolution finale
chi2 = 42,22 ;ddl = 27 ;Pv = 0,031.
Tableau 27: relation entre mode de diagnostic
utilisé et l'évolution finale de l'enfant.
|
Quel est le mode de diagnostic utilisé pour le cas de
paludisme grave?
|
Quelle est l'évolution finale de l'enfant
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Clinique
|
23
|
3
|
0
|
0
|
26
|
5
|
3
|
0,832
|
|
Clinique + biologique
|
178
|
6
|
5
|
3
|
192
|
|
Total
|
201
|
9
|
5
|
3
|
218
|
La dépendance n'est pas significative entre le mode de
diagnostic et l'évolution finale de l'enfant à l'hôpital.
chi2=5 ;ddl=3 ;Pv=0,832.
Tableau 28: relation entre taux
d'hémoglobine et évolution finale de l'enfant.
|
Quel est le taux d'hémoglobine de l'enfant? (en g/dl)
|
Quelle est l'évolution finale de l'enfant à
l'hôpital ?
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Non réponse
|
69
|
2
|
0
|
1
|
72
|
2,918
|
9
|
0,001
|
|
< 5 g/dl
|
16
|
2
|
3
|
2
|
23
|
|
=5 g/dl
|
40
|
3
|
0
|
0
|
43
|
|
> 5 g/dl
|
76
|
2
|
2
|
0
|
80
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
La dépendance est très significative entre le
taux d'hémoglobine et l'évolution finale du patient. chi2 =
2,918 ; ddl = 9, Pv = 0,001.
Tableau 29: relation entre le traitement
antipaludique reçu et l'évolution des patients pendant
l'hospitalisation.
|
L'enfant a-t-il reçu un antipaludique ? Si oui, le
quel ?
|
Quelle est l'évolution finale de l'enfant à
l'hôpital ?
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Artésunateinjectable+ACT (ou Quinine Ce)
|
82
|
7
|
2
|
2
|
93
|
2,540
|
6
|
0,001
|
|
Quinine injectable +ACT (ou Quinine Ce)
|
111
|
2
|
1
|
0
|
114
|
|
Artémether injectable
|
8
|
0
|
2
|
1
|
11
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
La dépendance est très significative entre le
traitement reçu et l'évolution finale des patients. chi2 =
2,540 ; ddl = 6 ;Pv= 0,001
Tableau 30: relation entre respect du traitement
et évolution des patients en hospitalisation.
|
Est-ce que la durée du traitement a été
respectée?
|
Quelle est l'évolution finale de l'enfant à
l'hôpital ?
|
Kh²
|
ddl
|
Pv
|
|
Guéri
|
Perdu de vue
|
Décédé
|
Transféré
|
Total
|
|
Oui
|
194
|
4
|
5
|
3
|
206
|
45,39
|
3
|
0,001
|
|
Non
|
7
|
5
|
0
|
0
|
12
|
|
TOTAL
|
201
|
9
|
5
|
3
|
218
|
La dépendance est très significative entre la
durée du traitement et l'évolution finale de l'enfant à
l'hôpital. chi2 = 45,39 ; ddl = 3 ;
Pv=0,001.
CHAPITRE QUATRIEME : DISCUSSION DES RESULTATS
4.1. Données sociodémographiques
Les résultats d'âge dans cette étude ont
montré que soit 33,5 % avaient l'âge compris entre 24-35
mois ; soit 26,6 % avait l'âge compris entre 36 à 47
mois ; 21,1 % se situait entre 48 et 59 mois ; pour 12,8 %,
l'âge variait entre 12-23 mois, et enfin ; l'âge de 13 enfants
soit 6,0 % se situait entre 0 et 11 mois. Les analyses n'ont pas montré
de dépendance significative entre l'âge et l'issue finale des
enfants à l'hôpital. Kh²=93,5; ddl= 1 ; Pv=0,673
Généralement dès les premiers mois de la
vie, les enfants particulièrement de 0-59 mois bénéficient
encore de la protection des anticorps maternels transmis pendant la vie
intra-utérine. C'est ce qui explique le faible taux des enfants de 0-11
mois. Toutefois, tous les enfants de moins de 59 mois sont très
vulnérables au paludisme. Comme les résultats l'ont
prouvé, l'issue finale ne dépend pas de l'âge.
L'étude menée par Traore (2009) au mali sur
l'évaluation de la qualité de prise en charge du paludisme chez
les enfants de moins de 5 ans dans le CS Réf de Kati a également
trouvé que les enfants de moins de 12 mois étaient minoritaires
de l'échantillon.
Bien que menée chez les enfants de plus de 0-15 ans,
l'étude d'Ouattara (2007) confirmeégalement que la tranche
d'âge n'influence pas le devenir (Khi2 = 4,82 P =0,43)
Malgré une réduction considérable des
taux de morbidité et de mortalité du paludisme depuis 2000, plus
de300.000 enfants de moins de 5 ans sont morts du paludisme en 2015, la
majorité de ces décès survenant enAfrique subsaharienne
(CDC et al. 2016).
A propos du sexe, les résultats ont
révélé un taux de 53,7% pour le sexe masculin contre 46,
3% de sexe féminin. Comme remarqué sur l'âge, les
résultats sur le sexe ont aussi montré que ladépendance
n'est pas significative entre le sexe et l'évolution finale des
patients. Kh²=0,590; ddl=3 ; Pv=0,102.
Traoré (2009) a également trouvé que le
sexe masculin est autant touché de paludisme que le sexeféminin
avec un ratio H/F de 1.005. Les études de Samou et al.(cité par
Traoré, 2009) au Burkina Faso à Ouagadougouont trouvé un
ratio H/F de 1.11 et Keita trouve 1.14 tous en faveur du sexemasculin.
Les résultats sur le temps écoulé entre
le début des symptômes et la décision de consulter montrent
que les parents d'enfants malades prenaient la décision après en
moyenne 2,84 jours, c'est-à-dire, après en moyenne 2 jours 20
heures et 10 minutes, avec une variabilité de 14 heures et 24 minutes
(Ecart-type 0,60 jour). La majorité des parents c'est-à-dire 73,4
%, (soit 160 parents,) amenait leurs enfants à l'hôpital 2
à 6 jours après le déclenchement de la maladie, 33 parents
soit 15,1 % avaient amené leurs enfants après 2 à 3
jours, suivi de 16 parents soit 7,3 % qui avaient amené leurs enfants
après plus de 7 jours ; enfin 9 enfants soit 4,1 % ont
été amenés à l'Hôpital après 1jour du
début de l'épisode.
Ceci est typique pour nos milieux ruraux où la
population consulte toujours en retard après avoir tenté
plusieurs fois ailleurs.
Médecins Sans Frontières (2018) indique que
beaucoup d'enfants de moins de cinq ans meurent chaque jour en RDC du fait
qu'ilsne sont pas soignés à temps.
Selon ONG, un enfant malade de paludisme simple peut
être diagnostiqué en 15 minutes. Cet enfant mettra en moyenne
trois jours à guérir avec du repos et des médicaments
antipaludéens.A l'inverse, prévient l'organisation, renoncer aux
soins peut entraîner des complications du paludisme en particulier chez
les jeunes enfants, qui peuvent être exposés à
l'anémie, à des soucis neurologiques, à
l'hypoglycémie voire à la mort.MSF relève aussi
l'existence des nombreux obstacles pour accéder au traitement en RDC,
notamment l'insécurité.
OMS (2017) insiste aussisur le fait que le diagnostic et le
traitement précoces du paludisme réduisent l'intensité de
la maladie et permettent d'éviter le décès. Ils
contribuent aussi à réduire la transmission du paludisme.
Le paludisme est une maladie de la pauvreté. Lorsque
les services antipaludiques ne sont pas gratuits, la pauvreté constitue
un obstacle important à la prévention et à la prise en
charge. La maladie peut aussi entretenir la pauvreté si le coût
des soins est inégalement réparti entre les communautés et
les ménages. Dans certains cas, le paludisme touche de manière
disproportionnée les migrants, les réfugiés, les
populations autochtones, les prisonniers, les personnes vivant dans des zones
isolées ou reculées, ou encore celles travaillant dans des
régions à risques élevés. Cette
inégalité est d'autant plus marquée chez les personnes qui
ne bénéficient d'aucune information sanitaire du fait de
barrières linguistiques ou culturelles. (Fond Mondial, 2017).
4.2.Données cliniques
S'agissant des modes d'arrivée à
l'hôpital, 27 (soit 12,4%) des patients ont été
référés par les structures et 191 soit (87,6%) ont
directement consulté d'eux-mêmes. La relation est très
significative entre le mode d'arrivée et l'évolution finale de
l'enfant à l'hôpital (Chi2 = 3,898, ddl = 3, Pv= 0,001).
L'étude de Diarra (cité par Traoré) a
trouvé un taux de référence de 12,71% des patients
référé, chiffre très proche à notre
étude (12,4%).
Le faible taux de référence dans les structures
trouve plusieurs explications : beaucoup d'enfants
référés disparaissent en cours de route sans arriver au
lieu de référence. Certains meurent compte tenu de la distance,
d'autres n'ont pas de moyens pour se déplacer et atteindre les
structures de référence et ne se contentent qu'à se faire
soigner traditionnellement,soit ils recourent aux charlatans.
Selon Cameroon Coalition Against Malaria (2010), le principal
obstacle à la lutte contre le paludisme est la faible
accessibilité aux services de soins par les populations
vulnérables ; et même quand ces services sont disponibles,
l'accès est parfois limité à cause des informations
inadéquates.
Parmi les patients référés par les
structures, on note que 40% ont été référé
pour anémie sévère ; 25,93% pour vomissement
répété ; 18,52% pour convulsion
répétée ; 11,11% pour coma et enfin 3,70% pour autres
complications.
UNICEF (2017) souligne que le paludisme est également
un facteur important d'anémie chez les enfants affectant gravement la
croissance et le développement. Une infection paludéenne
entraîne une anémie grave chez la femme enceinte et d'autres
maladies chez la mère ; c'est en outre un facteur d'insuffisance
pondérale à la naissance, une des causes majeures de
mortalité chez le nourrisson, ainsi que d'une croissance et d'un
développement insuffisants.
Les plaintes les plus récurrentes relevées par
les parents des enfants malades sont : la fièvre avec 204 enfants
représentant 93,6 % des cas, suivi de la pâleur de l'enfant dont
146 cas, soit 67,0 %, ensuite les vomissements (98 cas, dont 45,0 %), les
convulsions (63 cas, dont 28,9 %), l'anorexie (55 cas, dont 25,2 %), les
douleurs abdominales (44 cas, dont 20,2 %) ; et d'autres cas peu
fréquents comme des pleurs incessants (33 cas, dont 15,1 %), le regard
plafonné (19 cas, dont 8,7 %), le coma (12 cas, dont 5,5 %) et autres
signes non mentionnés ici (11 cas, dont 5,0 %). La dépendance
est significative entre les signes présentés à
l'arrivée et l'évolution finale chi2 = 4,222, ddl = 3, Pv =
0,031.
OMS (2017) note que Le paludisme est une affection
fébrile aiguë. Chez un sujet non immunisé, les
symptômes apparaissent généralement au bout de 10 à
15 jours après la piqûre de moustique infectante. Les premiers
symptômes : fièvre, maux de tête et des frissons
peuvent être modérés et difficiles à attribuer au
paludisme. S'il n'est pas traité dans les 24 heures, le paludisme
à Plasmodium falciparum peut évoluer vers une
affection sévère souvent mortelle.Les enfants fortement atteints
développent fréquemment un ou plusieurs des symptômes
suivants: anémie sévère, détresse respiratoire
consécutive à une acidose métabolique ou paludisme
cérébral. Sur les 218 enfants de 0 à 59 mois ayant
présenté des complications on observe que la détresse
respiratoire était notée chez 54 patients (24,8 %), suivi de
l'hypoglycémie avec 51 cas (23,4 %), le neuropaludisme avec 46 des
patients (21,1 %), puis de l'anémie sévère avec 22 cas
(10,1 %), 11 cas soit 5,0 % pour la convulsion à
répétition. La fièvre bilieuse hémoglobinurique
n'était notée que chez 8 malades soit 3,7 %.
La relation est très significative entre les types de
complications et l'évolution finale de l'enfant à
l'hôpital. chi2 = 3,814 ; ddl = 2, Pv = 0,004.
A propos des pathologies associées, 61,5 % avaient la
verminose ; anémie légère était
observée chez 52,3 % ; la bronchopneumonie chez 23,4% ; 21,1 %
avaient la gastroentérite ; la déshydratation était
observée chez 15,1% ; pour la rhinopharyngiteil y a eu 11,0
% ; la malnutrition chez 10,6 % ; la bronchite8,7 % ; la
pneumopathie. Il y avait également l'intoxication médicamenteuse
et la méningite avec 1,8 % pour chacun. La fièvre typhoïde
était observée chez 1,4 % et un seul cas d'amygdalite soit 0,5
%.
La dépendance n'est pas significative entre les
pathologies associées et l'évolution finale des patients. chi2 =
0,426, ddl = 4, Pv = 0,314.
OMS (2013) note que le paludisme grave peut reproduire le
tableau de nombreuses autres maladies, également courantes dans les pays
d'endémie, dont les plus importantes sont les infections du
système nerveux central, la septicémie, la pneumonie
sévère et la fièvretyphoïde.
Il faut également penser à d'autres diagnostics
différentiels : grippe, dengue et autres arboviroses, hépatites,
leptospiroses, fièvresrécurrentes,
fièvreshémorragiques, infections a rickettsies,
gastroentérites et, en Afrique, les trypanosomes humaines.
4.3. Données biologiques
En ce qui concerne le mode de diagnostic, pour 88,1%, le
diagnostic était clinique et biologique ; et pour une
minorité soit 11,9% il n'était que clinique.
La dépendance n'est pas significative entre le mode de
diagnostic et l'évolution finale de l'enfant à l'hôpital.
chi2 = 5, ddl = 3, Pv = 0,832.
Pour poser le diagnostic du paludisme grave, l'OMS (2013)
recommande de recourir à plusieurs paramètres parmi lesquelsles
paramètres cliniques et biologiques. Elle recommande de faire une
évaluation clinique rapide, en s'intéressant en particulier
à l'étatgénéral, l'état de conscience, la
tension artérielle, la fréquence et la profondeur de la
respiration, ainsi que la pâleur. Rechercher la présence d'une
raideur de la nuque et d'une éruptioncutanée pour exclure des
diagnostics différentiels. Si la confirmation parasitologique du
paludisme ne peut pas être obtenue facilement, faire une goutte
épaisse ou un frottis et démarrer le traitement de paludisme
grave sur la base du tableau clinique.
Le Programme Mondial de lutte contre le Paludisme de OMS
(2012) recommande à ce que dans toutes les circonstances, il soit
procédé à une confirmation parasitologique du paludisme au
moyen d'un test de diagnostic de qualité garantie avant de commencer le
traitement. C'est uniquement si l'on n'a pas la possibilité de poser un
diagnostic parasitologique dans les deux heures suivant l'arrivée d'un
malade qu'on devra envisager untraitement sur la seule suspicion clinique d'une
infestation palustre.
La goutte épaisse était de plus en plus
effectuée chez 77,1 %, et le Test de Diagnostic Rapide chez 11,9 %.
Notons, par ailleurs que l'examen de frottis mince n'avait été
effectué sur aucun cas.
Sur un total de 169 examens de Goutte Épaisse
réalisés, 156 cas (soit 92,3 %) se sont avérés
positifs contre 13 cas négatifs (7,7 %). Sur 25 cas soumis à
l'examen de TDR, 17 cas (soit 68,0 %) ont été positifs et 8 cas
(soit 32,0 %) ont été négatifs.
OMS (2013) note que l'examen au microscope est la
méthode de référence et l'option
préférée pour le diagnostic du paludisme. Dans
pratiquement tous les cas, l'examen de la goutte épaisse et du frottis
sanguin met en évidence des plasmodies. La goutte épaisse est
plus sensible que le frottis pour repérer une parasitémie faible.
Nauet al. (2011) soulignent également que le
diagnostic parasitologique du paludisme est une urgence, les résultats
devant être rendus dans un délai maximum de deux heures. L'examen
de référence, bien qu'opérateur-dépendant, reste
l'analyse microscopique du frottis sanguin et de la goutte épaisse. Cet
examen permet d'affirmer la présence de parasites, d'identifier
l'espèce et de quantifier la parasitémie.
Il existe d'autres techniques, qui permettent de supprimer le
facteur humain, et de faire un diagnostic rapide du paludisme.
OMS (2012) estime qu'il est possible de confirmer rapidement
un paludisme par un examen microscopique de qualité ou un test de
diagnostic rapide de qualité, capables de détecter une
infestation à Plasmodium falciparum (Pf) et/ou à Plasmodium vivax
(Pv). Dans la plupart des pays, les deux méthodes sont
nécessaires car l'examen microscopique et les TDR ont souvent un
rôle différent à jouer en fonction de la situation clinique
ou du lieu de soins.
S'agissant du dosage de l'hémoglobine 72 soit 33,03%
n'avait pas été dosé pour l'hémoglobine ; 80
patients (36,70 %) avaient une hémoglobinémie supérieure
à 5g/dl, suivi de 43 patients (19,72 %) avec une
hémoglobinémie égale à 5g/dl.
L'hémoglobinémie inférieure à 5 g/dl n'était
retrouvée que chez 23 patients(10,55 %).
La dépendance est très significative entre le
taux d'hémoglobine et l'évolution finale du patient. chi2 =
0,292 ; ddl = 9, Pv = 99,94%.
4.4.Qualité de la prise en charge et
évolution finale
Parmi les patients hospitalisé ayant
bénéficié d'un traitement à domicile, soit 44,0 %
avaient reçu un traitement de type moderne ;31,2 % avaient
reçu un traitement traditionnel ; 14,2% n'avaient reçu aucun
traitement et 10,6 % avaient mélangé un traitement moderne
à un traitement traditionnel.
Dans un contexte de pauvreté accentuée,
l'accès aux soins reste difficile pour les populations. Certains
Congolais recourent à l'automédication, d'autres à la
médecine traditionnelle à base de plantes (citronnelle, feuilles
de papayer, « Kongo bololo ») ou d'une noix communément
appelé «Ngadiadia »... Avec la prolifération des
églises de réveil, d'autres encore cherchent leur guérison
dans la prière. Outre ces couches défavorisées, il existe
des populations déplacées ou réfugiées qui vivent
dans une telle précarité qu'elles sont d'autant plus
vulnérables à toute maladie dont le paludisme. (Munsala et
Engulu, 2018)
Les schémas thérapeutiques administrés
font remarquer que 114 (soit 52,3 %) des malades avaient récu la
quinine injectable associée à l'ACT ou quinine
comprimé ; 93 patients (soit 42,7 %) avaient récu
l'artésunate injectable associée à l'ACT ou quinine
comprimé alors que seulement 11 enfants (soit 5,0 %) avaient recu
l'artémether injectable.
Les analyses montrent une dépendance très
significative entre le traitement reçu et l'évolution finale des
patients. chi2 = 25,40 ;
ddl = 6 ;Pv = 0,001.
OMS (2013) recommande à ce que pour le paludisme grave,
administrer les agents antipaludiques par voie parentérale au minimum
pendant 24 heures, même sientre-temps le patient parvient
àtolérer des médicamentsPeros. Ensuite, prescrire
une cure complète d'une association médicamenteusea base
d'artémisinine (ACT) efficace là oul'infection a
étécontractée. Le PNLP recommande la même ligne de
conduite.
Plusieurs essais ont testé chez l'enfant africain
l'Artémether pendant 5 jours versus quinine avec dose de charge. Tous
ont montré une excellente tolérance et une efficacité
équivalente à celle de la quinine, avec cependant une tendance au
réveil de coma plus tardif malgré une clairance parasitaire plus
rapide. Une revue générale récente confirme les
résultats cliniques comparables à tout âge des
dérivés de l'artémisinine et de la quinine (28). Leur
utilisation en monothérapie expose cependant à des rechutes
précoces du fait d'une demi-vie courte, d'où la prescription en
relais d'un autre antipaludique, notamment la méfloquine synergique
in vitro avec l'artémisinine. Imbert et Gendrel (2002).
L'étude de Nsimba et al. (2018) sur la comparaison de
l'efficacité de la quinine à l'Artésunate injectable dans
la prise en charge du paludisme grave chez les enfants de 0-59 mois à
l'HGR de Kenge a confirmé que la réponse thérapeutique de
l'Artésunate s'avère plus efficace que celle la quinine à
99% de seuil de confiance (Khi²= 17,11, ddl =1, p=0,00).
Quant au respect du traitement, 94,5 % ont respecté
leur traitement contre 5,5 % où le suivi avait posé
problème. La dépendance est très significative entre la
durée du traitement et l'évolution finale de l'enfant à
l'hôpital. chi2 = 4,539, ddl = 3, Pv = 0,001
L'évolution des
patients a été caractérisée par la guérison
pour 92,2 %; 4,1 % étaient perdus de vue ; 2,3 % étaient
décédés et 3 enfants (soit 1,4 %) étaient
transférés.
L'étude de Ouattara (2007) a
révélé une baisse de létalité
hospitalière à 15,52% contre un taux de guérison
à82,27% des cas et sans séquelle. Les 2,22% des cas sont des cas
d'abandon.
4.5. Disponibilité des intrants
Le résultat de ce tableau montre que 192 soit 88,1 %
des patients hospitalisés pour paludisme grave ont eu accès aux
examens para-cliniques contrairement aux 26 soit 11,9 % patients dont les
examens para-cliniques n'ont pas été réalisés suite
à la rupture des intrants.
Sur un total de 218 patients hospitalisés à
l'HGR de Mwela pour paludisme grave, 176 (81 %) de ces patients étaient
servis en médicaments antipaludéen tandis que 42 (19 %) autre
s'étaient retrouvés avec les ordonnances en main suite à
la rupture des médicaments antipaludéen.
Aubry et Gaüzère (2017) relayent que les produits
utilisés dans la lutte anti-palustre ont continué d'être
fournis en 2016 aux pays d'endémie palustre : moustiquaires
imprégnées d'insecticides (MII), tests de diagnostic rapide
(TDR), traitements par combinaison thérapeutique à base
d'artémisinine (ACT). L'Afrique subsaharienne a reçu la grande
majorité de ces produits. Cinq cent cinq millions de MII ont
été livrés en Afrique sur les 582 millions livrés
dans le monde entre 2014 et 2016. Deux cent soixante -neuf millions de TDR ont
été distribués en 2016 en Afrique sur un total de 312 dans
le monde. Le nombre de traitements par ACT distribués par les Programmes
nationaux de lutte contre le paludisme (PNLP) au secteur public a
augmenté de 192 millions en 2013 à 198 millions en 2016. Presque
tous (99%) les ACT distribué l'ont été dans
larégion Afrique. Toutefois, l'accès au système de
santé publique reste limité, en particulier en Afrique où
seulement un tiers (34%) des enfants ayant de la fièvre a
sollicité des soins dans le secteur de lasanté publique.
Conclusion
Le paludisme grave constitue une urgence thérapeutique,
étant donné sa grande évolutivité et son pronostic
redoutable chez l'enfant. La quinine reste jusqu'à ce jour le traitement
de référence. Les dérivés de l'artémisinine
sont de plus en plus utilisés en raison de leur facilité
d'emploi, au risque de voir émerger des résistances en l'absence
d'association. Malgré cela, les ruptures de stock fréquent
rendent ces dérivés de l'artémisinine rare sur le
marché.
La prise en charge du paludisme chez les enfants de 0-59 mois
à l'HGR Mwela-Lembwa a révélé que 53,7%
étaient de sexe masculin contre 46, 3% de sexe féminin. La
majorité des parents (73,4 %), amenait leurs enfants à
l'hôpital 2 à 6 jours après le déclenchement de la
maladie.
Les plaintes les plus récurrentes relevées par
les parents des enfants malades sont : la fièvre avec 204 enfants
représentant 93,6 % des cas, suivi de la pâleur de l'enfant dont
146 cas, soit 67,0 %,
En ce qui concerne le mode de diagnostic, pour 88,1%, le
diagnostic était clinique et biologique ; et pour une
minorité soit 11,9% il n'était que clinique.
Les schémas thérapeutiques administrés
font remarquer que 52,3 % des malades avaient récu la quinine
injectable associée à l'ACT ou quinine comprimé ;
soit 42,7 % avaient récu l'artésunate injectable associée
à l'ACT ou quinine comprimé alors que seulement 11 enfants soit
5,0 % avaient recu l'artémether injectable
L'évolution des patients a été
caractérisée par la guérison pour 92,2 %; 4,1 %
étaient perdus de vue ; 2,3 % étaient
décédés et 3 enfants (soit 1,4 %) étaient
transférés.
S'aggissant de la disponibilité des intrants, 88,1 %
des patients hospitalisés pour paludisme grave ont eu accès aux
examens para-cliniques parcontre 11,9 % des patients n'ont
réalisés ces examens suite à la rupture des intrants
et ; 81 % de ces patients étaient servis en médicaments
antipaludéen par contre19 %n'ont pas pu en bénéficier
suite à des ruptures de stock et étaient forcés de
chercher des médicaments dans des pharmacies.
Les analyses réalisés ont établi une
dépendance très significative entre le mode d'arrivée,
types de complications, la durée du traitement, le taux
d'hémoglobine, le traitement reçu et l'évolution finale de
l'enfant à l'hôpital.
La dépendance a également été
significative entre les signes présentés à
l'arrivée et l'évolution finale de l'enfant à
l'hôpital.
Aucune dépendance significative n'a été
observée entre les pathologies associées, le mode de diagnostic,
la parasitémie, l'âge et le sexe et l'évolution finale de
l'enfant à l'hôpital.
Au regard de ces résultats, nous rejetons notre
première hypothèse car le protocole national est respecté
sur les critères de diagnostic et de prise en charge du paludisme
grave ; nous confirmons partiellement notre deuxième
hypothèse au regard de la minorité des patients qui n'ont pas
reçu les traitements suite aux ruptures et enfin nous rejetons notre
troisième hypothèse car l'évolution des patients est bonne
avec 92,2% du taux de guérison.
Suggestions et recommandations
v Aux responsables de l'hôpital
- D'assurer une bonne gestion des stocks des intrants
nécessaires pour le paludisme afin d'être rassuré de la
qualité des soins
v Aux parents de l'enfant
- D'amener toujours les enfants à temps pour une bonne
prise en charge, ce qui va leur épargner des complications
- D'éviter de donner des traitements indigènes
qui n'ont pas toujours prouvés leur efficacité sur le
paludisme
Références bibliographiques
Antimi&Idoundou, J.S. (2006). Le paludisme au Gabon,
in Perspectif Nouvelle, N°03, 32 p.
Aubry, P. &Gaüzère, B.A. (2017). Paludisme,
Actualités 2017. Centre René La busquière, Institut de
Médecine Tropicale, Université de Bordeaux, 33076 Bordeaux
(France)
Bastin, R. (1998), maladies infectieuses
médico-chirurgicales, paris VIe, France.
Bernard et Geneviève P. (1989). Dictionnaire
médical pour les régions tropicales. BERPS, KanguMayumbe, RDC
Cameroon Coalition Against Malaria (2010). Guide pratique de
lutte contre le paludisme. L'Harmattan
Carnevale P. et al (2012), Les cinq piliers de la protection
familiale et personnelle de l'homme contre les moustiques vecteurs d'agents
pathogènes. Med. Santé. Trop., 22, 13-21 p.
Carnevale P.et al. (2009). Les anophèles Biologie,
transmission du Plasmodium et lutte anti-vectorielle, IRD Edition, 402p.
Cot A., Deloron P. Paludisme associé à la
grossesse : conséquences et perspectives d'intervention. Med. Trop.,
2003, 63, 369-380.
Courtejoie J. et Rotsart (1986), L'enfant, ses maladies, sa
santé. Pédiatrie pratique. BERPS, KanguMayumbe, RDC
Dakuyo, P.Z,(1992).« Paludisme et médecine
traditionnelle», in Vie et Santé, une revue du
réseau de recherche en santé de la reproduction en Afrique,
n°10, 17-19 pp.
Fandeur T. et Abani M. (2010), Associations à base
d'artémisinine subventionnées pour l'Afrique. Méd. Mal.
Inf., 40, 611-616 pp.
Faucher J.F.et al (2006),Traitement du paludisme de l'enfant
en Afrique : les ACT en question, Med Trop N°66, 292-294p.
Finken, R. (1979), ABC de pédiatrie au poste de
santé, BERPS, Kangu-Mayombe
Hance P., Garnotel E., De Pina J.L., Vedy S., Ragot C., Chadli
M., Morillon M. (2005). Tests immuno- chromatographiques rapide de
détection du paludisme. Principes et stratégies d'utilisation.
Med. Trop., 2005,65, 389-393.
Imbert, P. &Gendrel, D. (2002). Traitement du paludisme
chez l'enfant. Med Trop 2002; 62 : 657-664
Kiniffo, I.R et al, (2000), Les mères des enfants de
moins de cinq ans et le paludisme dans la vallée de Dangbo au Sud-Est du
Bénin, Médecine d'Afrique Noire, p47.
Lagarde, M. (2016). Paludisme de l'enfant :
recommandation et actualité pédiatrique, urgences
pédiatriques CHU bordeaux, France.
Le Bras M., Malvy, D. (2004). Le paludisme à l'heure du
« Roll Back Malaria ». Med. Trop., 2004, 64, 576- 578.
Le Fonds Mondial (2017). Paludisme, genre et droits de
l'Homme. Note d'information technique, Genève, Suisse.
Le Hesran. J. Y. (2000), Les Particularités du
Paludisme chez l'Enfant : Médecine Tropicale, Revue
française de pathologie et de sante publique tropical, volume 60,
N° 1, 92-98 pp.
Legros F. (2008). Paludisme d'importation en France :
modalités de surveillance et principales caractéristiques
épidémiologiques. La Lettre de l'Infectiologue, 23, 100-107
pp.
Lemardeley, P et al.(1996). Prescripteurs et prise en charge
des fièvres de l'enfant : premiers résultats des enquêtes
du réseau paludisme OCEAC (Yaoundé, Brazzaville, Malabo et
Libreville), in Bull liaison doc OCEAC 1997 ; 30(3), p21.
Malvy D. et al (2000), Plasmodies : traitement,
prévention. Encycl. Méd. Chir., Maladies Infectieuses,
8-507-A-25, 17 p.
Malvy D., et al. (2000), Malaria. Formes cliniques,
diagnostic. Encycl. Med. Chir., Maladies Infectieuses, 8-507-A-20, 16 p.
Millet P. (2011). Le traitement du paludisme en Afrique
subsaharienne : des progrès notables, mais des mesures pas toujours
applicables. Méd. Trop., 5-6, 71 p.
Mosley, H. (1985). Les soins de santé primaires
peuvent-ils réduire la mortalité infantile ? Bilan critique de
quelques programmes africains et asiatiques ; In Luttecontre la
mort, INED, 101-136 p.
Mouchet J. et al. (1993), Typologie du paludisme en Afrique,
Cahier santé, n°3, 220-238 pp.
MSF (1993). Médicament essentiels : Guide pratique
pour l'emploi des médicaments. Kinshasa, RDC
MSF (2017). RDC: 920 000 cas de paludisme traités en
2016. Kinshasa, RDC
Nau, A., Cordier, P.Y., Pouliquen, G., Puidupin, A., Peyte, E.
(2011). L'accès palustre : Diagnostic - Critères de
gravité - Prise en charge initiale. SAMU, Urgences, France.
Ngassam-Ngoueni, A. (1995), Prise en charge du paludisme
grave chez les enfants de moins de 5ans à Bafoussam (Cameroun-1995),
in bull liais doc OCEAC 1998 ; 31(3), pp30-34.
NsimbaMayamba, P., KafumbiKatsiatsia, J., NgonzoLuwesi, C.,
KisakaNgimbi, J.J, LunduYenamawu, G. (2018). Efficacité de
l'Artésunate injectable versus quinine dans le traitement du paludisme
grave chez les enfants de 0-59 mois à Kenge, RDC.
Health-EnvironmentSustainability Journal, Edition spéciale
Française, Année 2018 Mois : Avril-Juin Vol. 7 Numéro 1
pp. 161-173.
Oliver M., Simon F., de Monbrison F. et coll. Le nouvel
âge de la primaquine contre le paludisme. Médecine et maladies
infectieuses, 2008, 38, 169-179.
OMS (1990). Accès aux médicaments et financement
: analyse économique et financière de base. Genève,
Organisation Mondiale de la Santé.
OMS (1992). Paludisme : lutte anti-vectorielle et protection
individuelle, Série de rapports techniques, rapport d'un groupe
d'étude de l'OMS, N° 936.
OMS (1997). Le paludisme, manuel de l'agent de santé
communautaire. Genève, Organisation Mondiale de la Santé.
OMS (2014). Prise en charge du paludisme : guide du
participant. Genève : Organisation Mondiale de la Santé.
OMS (2010). Prévention et traitement du paludisme
à Plasmodium falciparum résistant à l'artémisinine:
Mise à jour à l'intention des voyageurs internationaux. REH, 85,
195-196 p.
OMS (2011). Directives pour le traitement du paludisme,
deuxième édition. Genève : Organisation Mondiale de
la Santé
OMS (2012). Chimio-prévention du paludisme saisonnier
pour lutter contre le paludisme à Plasmodium falciparum en zone de forte
transmission saisonnière dans la sous- région du Sahel en
Afrique. Genève, Organisation Mondiale de la Santé
OMS (2017). Paludisme. Aide-mémoire N°94, Novembre
2017. Genève, Organisation Mondiale de la Santé.
OMS (2017). Prise en charge du paludisme grave. Genève,
Organisation Mondiale de la Santé.
Organisation Mondiale de la Santé (2003). Nouvelles
recommandations pour lutter contre le paludisme, Africa Malaria report,
Santé & prévention.
Ouattara, B.(2007). Prise en charge des cas de neuropaludisme
chez les enfants de 0-15 ans à l'hôpital NianankoroFomba de Segou
(HNF/S). Thèse Présentée et soutenue publiquement pour
obtenir le Grade de Docteur en Médecine. Faculté de
médecine, de pharmacie et d'odontostomatologie, Université de
Bamako, Mali.
Pichard E., Richard-Lenoble D. coordonnateurs. Palutrop. Prise
en charge du paludisme en Afrique. Manuel de prescription. Impact malaria. IME,
25112 Baume-les-Dames imprimeur, septembre 2005, 40 p.
Pradines B., Dormoi J., Briolant S., Bogreau H., Rogier C.
(2010). La résistance aux antipaludiques. Revue Francophone des
Laboratoires, 2010, 422, 51-62. Centre René Labusquière, Institut
de Médecine Tropicale, Université de Bordeaux, 33076 Bordeaux
(France)
Receveur M.C., Roussin C., Vatan R., de MonteiraA., Sissoko
D., Malvy D. Bilan du paludisme à Mayotte. Epidémiologie,
diagnostic, prévention et traitement. Bull. Soc. Path. Exot., 2004, 97,
265- 267.
Rogier C.et al (2001). Diagnostic des accès palustres
en zone d'endémie : bases théoriques et implications pratiques.
Med. Trop., 61, 27-46 p.
Rogier, C. (2003). Paludisme de l'enfant en zone
d'endémie : épidémiologie, acquisitions d'une
immunité et stratégies de lutte. Med. Trop., 2003, 63,
449-464.
Rogier, C. (2004). Comment diagnostiquer les accès
palustres. Med. Trop., 2004, 64, 319-320.
Saissy J.M., Rouvin R., Koulmann P. (2003). Le paludisme grave
en réanimation en 2003. Med. Trop., 2003, 63, 258-266.
Soula, G et al. (1998). Evaluation de la prise en charge
du paludisme au Cameroun. 1ère partie : connaissances et
comportement professionnel des prescripteurs, in Bull doc OCEAC
2000 ; 33(3), p15-27.
Talani, P et al (1995). Prise en charge des
fièvres de l'enfant à domicile dans le district rural de Bioko
(Congo Brazzaville) in Santé publique, 2003, vol 15
n°4, 485-490 p.
Tchen J., Ouledi A., Lepère J.F., Fernandiz D., Yvin
J.L. Epidémiologie et prévention du paludisme dans les îles
du sud-ouest de l'Océan indien. Med. Trop., 2006, 66, 295-301.
Thellier, M., E. Kendjo, Houzé, S.,Le Bras, J., Danis,
M. (2012). Épidémiologie du paludisme dans le monde : un
véritable espoir de contrôle de la maladie, mais de nouvelles
inquiétudes. La Lettre de l'Infectiologue. Tome XXVII-n°
6-novembre-décembre 2012, Pp. 216-221
Traore, S.A (2009). Evaluation de la qualité de prise
en charge du paludisme chez les enfants de moins de 5 ans dans le CSRéf
de Kati. Thèse Présentée et soutenue publiquement pour
obtenir le Grade de Docteur en Médecine. Faculté de
médecine, de pharmacie et d'odontostomatologie, Université de
Bamako, Mali.
Valance, D., Vandroux, D., Antok, E., Winer, A.,
Gaüzère, B-A. (2011). Caractéristiques cliniques du
paludisme sévère d'importation de l'adulte à la
Réunion de 2000 à 2011. AnesthReanim. 2015 ; 1 : 305-312.
ANNEXE
QUESTIONNAIRE D'ENQUETE
Thème : Evaluation de la qualité
de la prise en charge de cas de paludisme grave chez les enfants de 0-59 mois
à l'Hôpital Général de Référence de
Mwela-Lembwa.
Exposé de motif
Bonjour !
Je suis Carlos Ntungidi, étudiant en deuxième
licence en santé communautaire à l'ISTM Marie Reine de la Paix de
Kenge.
Je fais mon mémoire de fin de cycle sur
l'évaluation de la qualité de prise en charge des enfants de 0-59
mois atteints de paludisme grave. C'est pour cette raison que je désire
vous rencontrer pour un petit entretien de 15-20 minutes.
Merci d'avance pour le temps que vous acceptez de m'accorder.
Date de l'enquête......................... N° de la
fiche..........................
Lieu de l'enquête...................Début de
l'interview : /_ /_ h__/__ ''
I. DONNEES SOCIODEMOGRAPHIQUES
Q1. Quelle est la tranche d'âge de l'enfant (en
mois) ?
1 = 0 - 11/___/ 2 = 12 - 23/___/ 3 = 24 - 35/___/
4 = 36 - 47 /___/ 5 = 48 - 59/___/
Q2. Quel est le sexe de l'enfant ?
1 = masculin /___/ 2 = féminin /___/
Q3. Quel est votre adresse (Village)
1= Mwela-Lembwa /___/ 2= Matari /___/ 3= Makaya /___/
4= Kiamfu /___/5= Mavunda/___/ 6= Kulonda /___/
7= Mulasa Mwela /___/ 8= NkusuTsay /___/
9= Kifilu/___/ 10= Mwanabasila /___/ 11= Autres
/___/
II. DONNEES CLINIQUES
Q4. Combien d'enfants de 0-59 mois atteints du paludisme
grave hospitalisés du 25 avril au 25 juin 2018 ?
1 = Avril /___/ 2 = Mai /___/ 3 = Juin /___/
Q5. Combien de jours se sont écoulés avant
que l'enfant soit conduit à l'Hôpital ?
1 = 1 jour /___/ 2 = 2-3 jours /___/ 3 = 4-6 jours /___/
4= 7 jours et plus /___/
Q6. Quels sont les signes qu'a présentés
l'enfant avant de venir à l'hôpital ?
1. fièvre 1 = oui /___/ 2 = non /___/
2. pâleur 1 = oui /___/ 2 = non /___/
3. convulsion 1 = oui /___/ 2 = non /___/
4. vomissement 1 = oui /___/ 2 = non /___/
5. anorexie 1 = oui /___/ 2 = non /___/
6. douleur abdominale 1 = oui /___/ 2 = non /___/
7. regard plafonné 1 = oui /___/2 = non /___/
8. pleures incessantes 1 = oui /___/2 = non /___/
9. coma 1 = oui /___/2 = non /___/
10. autres 1 = oui /___/2 = non /___/
Q7. L'enfant a-t-il présenté des
complications ?
1 = oui /___/2 = non /___/
Si oui laquelle (lesquelles) ?
1 = anémie sévère 1 = oui /___/ 2 = non
/___/
2 = neuropaludisme 1 = oui /___/ 2 = non /___/
3 = fièvre bilieuse hémoglobinurique 1 = oui /__/
2 = non /___/
4 = détresse respiratoire 1 = oui /___/ 2 = non
/___/
5 = hypoglycémie 1 = oui /___/ 2 = non /___/
6 = convulsion à répétition 1 = oui /___/
2 = non /___/
Q8.En dehors du paludisme, y-a-t- il eu d'autres
pathologies (diagnostics) associées ?
1= oui /___/ 2 = non /___/
Si oui laquelle (lesquelles) ?
1. méningite 1 = oui /___/ 2 = non /___/
2. verminose 1= oui /___/ 2 = non /___/
3. fièvre typhoïde 1= oui /__/ 2 = non /__/
4. pneumopathie 1= oui /__/ 2 = non /__/
5. malnutrition 1= oui /__/ 2 = non /__/
6. amygdalite 1= oui /__/ 2 = non /__/
7. bronchite 1= oui /___/ 2 = non /___/
8. anémie légère 1= oui /__/ 2 =
non /__/
9. bronchopneumonie 1= oui /__/ 2 = non /__/
10. Rhinopharyngite 1= oui /__/ 2 = non /__/
11. déshydratation 1= oui /__/ 2 = non /__/
12. gastroentérite aigué fébrile /___/
2 = non /___/
13. intoxication médicamenteuse /___/ 2 = non
/___/
III. DONNEES BIOLOGIQUES ET IMMUNOLOGIQUES
a) Données biologiques
Q9. Quel est le mode de diagnostic utilisé pour
les cas de paludisme grave ?
1 = clinique /___/ 2 = clinique + biologie /___/
Q10. L'enfant a-t-il présenté les examens
biologiques ?
1 = oui /____/ 2 = non /____/
Si oui lesquels ?
1 .Goutte épaisse : 1 = oui /_____/ 2 = non /_____/
Si oui résultat goutte épaisse : 1
= positive /__/ 2 = négative /_/
Si goutte épaisse positive:
Parasitémie: 1 = + /__/ 2 = ++/___ /
3 = +++ /_____/ 4 = ++++/_____/
2 .Frottis mince: 1 = oui /___/ 2 = non /___/
Si oui résultat Frottis mince: 1 =
positif /___/ 2 = négatif /___/
3 .Test de diagnostic rapide (TDR): 1 = oui /____/ 2 = non
/____/
Si oui résultat TDR : 1 = positif
/__/ 2 = négatif /__/
3= indéterminé /____/
b) Données immunologiques
Q11. Quel est le taux d'hémoglobine de l'enfant
(en g/dl) ?
1 = < 5g/dl /____/ 2 = 5 g/dl /____/3 = > 5 g/dl
/____/
IV. DONNEES THERAPEUTIQUES ET EVOLUTIVES
a) Données thérapeutiques
Q12. L'enfant a-t-il reçu un traitement avant de
l'amener à l'hôpital ?
1 = oui /____/2 = non /____/3 = inconnu /____/
Si oui, quel (s) types des médicaments ?
1. moderne : 1 = oui/___/ 2 = non/___/
2. Traditionnels : 1 = oui/___/ 2 = non/___/
3. mixte: 1 = oui/___/ 2 = non /___/4. Aucun : 1 =
oui/___/
Q13. L'enfant a-t-il reçu les traitements
antipaludiques en hospitalisation?
1 = oui /___/ 2 = non /___/
Si oui lesquels ?
1. Artésunate injectable + ACT (ou quinine
co) : 1 = oui /___/
2 = non /___/
2. Quinine injectable + ACT (ou quinine co) : 1 = oui
/___/
2 = non /___/
3. Artémether injectable : 1 = oui /___/ 2 = non
/___/
4. Autres (à spécifier)
/___/..........................................................
Q14. Est-ce que la durée du traitement a-t-elle
été respectée ?
1= oui /____/ 2 = non /____/
Si non, pourquoi ?
1. Manque d'argent /___/ 2.Intolérance de
médicament par l'enfant /___/ 3. Evasion de l'enfant /___/
4. Autres (à spécifier) /___/...........
Q15. Est-ce que les enfants avec anémie
sévère ont bénéficié de la
transfusion ?
1 = oui /____/ 2 = non /____/
Q16. Est-ce que le malade a été
référé ou venu de soi-même?
1 = référé /____/2 = venu de soi-même
/____/
Si référé quel est le motif de
référence pour l'hôpital ?
1 = anémie sévère /____/ 2 = coma
/____/3 = dyspnée /____/
4 = convulsion répétée /____/ 5=
vomissement répété /____/
6= autres (à spécifier)
/____/........................................................
b) Evolution
Q17. Quel est l'évolution et mode de sortie de
l'enfant de l'Hôpital ?
1= guéri /__/2= perdu de vue /__/3=
décédé /__/
4= transféré /____/
V. DISPONIBILITE DES INTRANTS
Q18.Les intrants pour les examens para-cliniques
(TDR/GE/Frottis sanguin) étaient-ils toujours disponibles ?
1. Oui /____/ 2. Non /____/
Q19.Les médicaments antipaludéens
prescrits pour l'enfant étaient-ils toujours disponibles ? 1. Oui
/____/ 2. Non /____/
MERCI !



