|
En Afrique, l'infection est la première cause de
morbidité et de mortalité néonatale. Au cours de la
période périnatale qui va de la 28e SA à 7
jours
1
0. INTRODUCTION
0.1. PROBLEMATIQUE
L'infection néonatale (INN) est un syndrome clinique de
bactériémie caractérisé par des signes et
symptômes cliniques survenant chez un nouveau-né de 0 à un
mois de vie, pouvant s'étendre jusqu'à 3 mois
(1,2).
Le retard diagnostic, les consultations tardives et le bas
niveau socio-économique limitent sa prise en charge rapide et efficace,
contribuant ainsi à augmenter la mortalité due aux infections, en
particulier dans les pays en voie de développement
(3).
Dans le monde, L'infection néonatale demeure une
pathologie préoccupante par sa fréquence et sa gravité.
Elle reste l'une des causes les plus fréquentes de la mortalité
néonatale. Sa fréquence est estimée à 2 à 3
% des naissances vivantes [4]. Sa gravité est liée à
l'immuno-incompétence du nouveau-né et au risque de
mortalité qui est de l'ordre de 10 à 30 % selon les séries
[4,5].
L'Organisation Mondiale de la Santé (OMS) estime la
survenue globale de décès néonatal à 2,8 millions
en 2013, ce qui représente 44% du taux de mortalité infantile ;
75,8% de ces décès surviennent pendant la période
néonatale précoce et 47,6% sont dues à l'INN
(4)
Ce drame est un problème mondial puisque les pays
développés ne sont pas épargnés.
Une méta-analyse retrouve une incidence de 9.8%
d'infection bactérienne néonatale possible en 2012 dans les pays
d'Afrique sub-saharien, au Sud de l'Asie et en Amérique latine
(6).
En Europe, en France, l'incidence des INN certaines en 2002
était de 1 à 4 pour mille naissances vivantes (2)
et le taux de mortalité néonatale lié aux INN en
2001 était estimé à 9,3 pour mille admissions dont 11
infections materno-foetales et 17 infections nosocomiales
(7).
En 2015 en Inde, l'incidence des INN était
estimée à 18 pour mille. Sur 440 nouveau- nées admis en un
an, 82 étaient retenues comme INN précoce
(8).
2
de vie, les infections bactériennes sont
fréquentes et graves (9). Diverses études faites
en Afrique montrent une incidence élevée des infections
néonatales.
Elle était de l'ordre de 16,6% en 1998 à Abidjan
(10) et de 73,9 % en 2002 à Ouagadougou
(11).
Au Maroc, l'infection néonatale serait à
l'origine de plus de 16% de la mortalité périnatale
(12).
Au Cameroun, à Douala en 2015, le taux de
mortalité lié à l'INN était de 54,93%
(13)
La RD Congo avec sa mortalité néonatale
élevée estimée à 42% naissances vivantes a
été classée en 7ème position parmi les
pays ayant une mortalité élevée. Certains auteurs (MAVINGA
et al) ont observé une incidence d'infection néonatale de 81% en
2006 et une mortalité néonatale de 57,7% entre 2001 et 2004 aux
Cliniques Universitaires de Kinshasa (CUK). Tandis que KIETA en 2002 a
trouvé une incidence de 17,4% chez les nouveau - nés provenant
des CUK (14).
Il est connu qu'en Afrique, certains problèmes
contribuent à rendre difficile le diagnostic et la prise en charge de
cette pathologie ; il s'agit des problèmes liés aux faibles
revenus financiers, d'équipement et des ressources humaines
qualifiées auxquelles, il faut ajouter les conditions
défectueuses d'hygiène.
L'infection néonatale est un problème majeur de
santé publique de par sa forte incidence et mortalité. C'est
ainsi que sa prévention et prise en charge restent des
éléments clefs pour relever le défi de la réduction
de la mortalité périnatale.
Le but de notre travail est de dresser un profil
épidémiologique, clinique et paraclinique des infections prises
en charge dans le service de néonatologie de la Clinique NGALIEMA
3
0.2. JUSTIFICATION
L'infection néonatale est la première cause de
morbidité et de mortalité périnatale.
Plusieurs études ont été menées afin
d'objectiver la place importante qu'occupent les infections dans la
mortalité néonatale. En 2015, l'OMS estimait à 47,6% les
décès liés à l'infection néonatale.
En RDC on a observé une incidence d'infection néonatale
de 81% en 2006 et une mortalité néonatale de 57,7% entre 2001 et
2004.
Au vu de ces études, il apparait que la
mortalité néonatale dans notre contexte reste très
élevée et que l'infection néonatale représente une
cause importante de cette mortalité. La prise en charge adéquate
de ces infections passe par la meilleure connaissance épidemioclinique
et paraclinique.
Peu d'études à notre connaissance ont
été faites à la Clinique NGALIEMA concernant les INN et
par ce travail, nous voulons décrire le profil
épidémioclinique et paraclinique des infections
néonatales.
Ceci dans l'optique d'améliorer la prise en charge des
infections néonatales et donc réduire la mortalité
liée à ces dernières dans cet hôpital en particulier
et à Kinshasa de manière générale.
0.3. OBJECTIFS
a. Objectif général
La présente étude vise à contribuer
à l'amélioration de la prise en charge de l'infection au service
de néonatologie de la Clinique NGALIEMA
b. Objectif spécifique
Pour atteindre cet objectif principal, nous nous sommes
fixés les objectifs spécifiques ci-après :
? Identifier les nouveau-nés admis pour infection
néonatale
? Déterminer la fréquence hospitalière de
l'infection néonatale ;
? Décrire le profil sociodémographique des
nouveau-nés avec infections
néonatales ;
? Décrire les différentes causes de l'INN ;
4
? Décrire les caractéristiques cliniques et
paracliniques des nouveau-nés avec infections néonatales ;
? Décrire la prise en charge des nouveau-nés avec
infections néonatales.
5
CHAPITRE I. GENERALITES SUR LES INFECTIONS
NEONATALES
1.1. Définition des concepts
1. Infection : C'est la pénétration et le
développement d'un agent pathogène dans l'organisme.
2. Infection néonatale : C'est l'infection qui
survient de 0-28 jours de la naissance.
3. Période néonatale : Elle s'étend de
la naissance au 28è jour.
4. Période post néonatale : Elle s'étend
de 29 à 90 jours.
5. Infection néonatale précoce : Elle
s'étend sur toute la première semaine de vie.
6. Infection néonatale tardive : Elle s'étend
du 8è jour au 90è jour de vie.
7. Mortalité néonatale : Infection des
nouveau-nés avant 30 jours de vie (15).
8. Prématurité : Naissance avant 37 semaines
d'aménorrhée (16).
L'infection néonatale précoce est celle qui
intéresse le nouveau-né au cours des trois premiers jours de vie
post natale (34).
Durant cette période, l'origine de ces infections reste
le plus souvent materno-transmise mettant en évidence les
bactéries opportunistes issus de la flore maternelle vaginale ou
urinaire (34,35).
I.2. Moment et Mode de contamination
Le nouveau-né peut s'infecter à trois moments :
1. Pendant la grossesse : Infection prénatale
2. Moment de l'accouchement : Infection périnatale
3. Apres l'accouchement : Infection post natale.
? Infections prénatales : sont transmises par voie
transplacentaire lors de
bacteriemies ou septicémies maternelles, soit par voie
transmembranaire, à membres intactes ou rompues, le liquide amniotique
(Amniotite) contaminant le foetus lors de sa déglution.
? Les infections périnatales : sont acquises lors du
passage dans la filière
génitale.
? Les infections post-natales : sont de transmission manu
portées ou
secondaires à la contamination.
6
1. La contamination anté et
périnatale
La transmission materno-foetale survient à
différentes périodes de la vie intra-utérine. Elle peut
être précoce ou tardive.
· Lorsqu'elle est précoce, elle peut
entraîner un avortement ou bien un accouchement prématuré
d'un enfant sain ou infecté. Elle peut entraîner une embryopathie
et/ou une foetopathie ;
· Lorsqu'elle tardive, elle peut survenir après
l'accouchement. A ce moment, le foetus est atteint, soit par voie
hématogène, transplacentaire, soit par voie ascendant par
contigüité.
Dans ce cas, le tableau clinique est celui d'une
septicémie précoce.
1. La contamination peut survenir aussi au cours de
l'accouchement. Elle est descendante ou survient lors du passage dans la
filière génitale. Par contre, la contamination est ascendante,
lorsque le germe va infecter le liquide et le foetus finira par avaler, soit
par l'inhalation, soit aussi par la voie cutanée
(17).
2. La contamination post-natale
Le nouveau-né est contaminé par les germes qui
proviennent de la mère, de l'entourage ou du milieu hospitalier. C'est
également à partir du matériel utilisé, les mains
souillées des visiteurs, etc. D'où viennent les infections qui
peuvent attaquer le nouveau-né et lui provoquer un danger.
(15)
1.3. Aspects Cliniques
En raison du mode de contamination, on distingue
schématiquement deux circonstances cliniques :
1. Lorsque les manifestations cliniques surviennent au cours
de trois premiers jours, très souvent, la contamination est antée
ou périnatale. Ici c'est l'anamnèse qui joue un rôle majeur
pour le dépistage. Certains arguments sont très importants, car
ils vont conduire à une antibiothérapie des principes :
· Fièvre maternelle (T 38 C) au moment de
l'accouchement, il faut éliminer la fièvre liée au
paludisme ;
· Infection maternelle récente, certaine
même si elle est sous traitement ;
· Liquide amniotique teinté au cours d'un
accouchement prématuré ;
· Liquide amniotique teinté d'emblée et
l'odeur nauséabonde.
D'autres arguments sont évocateurs et doivent conduire
à une enquête acharnée :
7
· Ouverture prolongée de la poche des eaux
au-delà de 18 à 24 heures ;
· Rupture prématurée des membranes au
début du travail ;
· Signe de souffrance foetale ;
· Liquide amniotique teinté non expliqué par
l'accouchement dystocique.
1.4. Arguments biologiques
a) Arguments hématologiques en faveur d'une
infection néonatale : - GB 5000/mm3 ou GB
25000/mm3 (une leucopénie hyperleucocytose franche) ;
- Le polynucléaire neutrophile 1500 à 2000/mm3
la proportion de forme germe 10 % ;
- Plaquette 100.000/mm3 ;
- Anémie inexpliquée ;
- Fibrinogène 3,5 g/litre avant la 48è heure.
b) Arguments
bactériologiques
Les prélèvements doivent être
effectués sur le nouveau-né, le placenta et la mère.
1. Chez le nouveau-né, on doit prélever le
sang, le L.C.R., les urines. Dans les premières heures de naissance du
nouveau-né, on peut prélaver le suc gastrique ainsi que le
méconium ;
2. Mère : on peut prélever la
sécrétion vaginale ;
3. Placenta : écouvillon ou bien au niveau des
lésions suspectes.
1. Autres examens paracliniques
Parmi les autres examens paracliniques, on peut citer :
· Ionogramme, bilirubine, albumine, glycémie, pH
;
· Rx du thorax, de l'abdomen, ect.
(17).
1.5. Traitement
Il intervient à deux niveaux, au niveau préventif
et au niveau curatif.
1.5.1. Traitement préventif
1. a) Prévention des infections bactériennes
néonatales précoces impliquées :
8
- Traitement des épisodes infectieux maternels pendant
la grossesse : amoxycilline en cas de syndrome fébrile évocateur
de listénose, antibiothérapie adaptée des infections
cervicovaginales et des voies urinaires ;
- Dépistage des portages génitaux de SBHB
pendant la grossesse ; - Dépistage et traitement du SbHB urinaire
pendant la grossesse ;
- Antibiothérapie per-partum intraveineuse des femmes
fébriles 38° C ou porteuses de SbHB : cette attitude diminue le
nombre des formes précoces graves d'infections materno-foetales
(septicémie, méningite) mais interfère sur les
résultats bactériologiques des nouveau-nés.
(18).
1. b) Prévention des infections bactériennes
néonatales secondaires :
Elle repose sur le respect strict d'hygiène et
d'asepsie : lavage des mains avec des antiseptiques efficaces, isolement des
enfants, infectés, utilisation de matériels à usage
unique, limitation des prothèses de soin.
1.5.2. Traitement curatif
1. a) Règles d'antibiothérapie du
nouveau-né
L'antibiothérapie doit être administrée
par voie intraveineuse, avoir un spectre élargi initialement, puis une
adaptation spécifique secondaire, être bactéricide
vis-à-vis des germes responsables, avec une vitesse de
bactéricide maximale, utiliser des associations d'antibiotiques
synergiques, diffuser dans les méninges, être de toxicité
réduite et de durée suffisante adaptée à la nature
de l'infection. (18).
1. b) Nature : spectre et posologie des antibiotiques
utilisés dans les infections bactériennes
néonatales
Le traitement des infections bactériennes
néonatales fait principalement appel aux a-lactamines associées
le plus souvent à un aminoside.
Parmi les a-lactamines, l'amoxycilline est sur SbHB, la
listeria et sur seulement 50 % des E-colis. Les Céfotaxine est actif sur
le SbHB et sur E-coli, mais pas sur listéria.
L'association Amoxycilline-Acide clavulanique est sur le SbHB,
la listéria et 75 % d'E-coli.
En cas de méningite, les a-lactamines sont
administrées à la dose de 200 mg/kg/j en 2 injections. Elle est
utilisée pour des infections pulmonaires ou septicémiques
staphylococciques sur prothèses.
9
Les doses d'antibiotiques néphrotoxiques (aminosides,
vancomycine) doivent etre adaptées à la fonction rénale et
modifiées selon leur taux sanguin (pic et taux résiduels).
1.5.3. Durée du traitement antibiotique
Elle dépend de la nature de l'infection : 10 jours pour
une infection simple ; 10 à 15 jours une septicémie, une
entérocolite, une pyélonéphrite, 21 jours pour une
méningite et 3 mois pour une ostéomyélite.
La durée d'utilisation des aminosides est aussi fonction
du type d'infection, mais tend à se raccourcir.
(18).
10
CHAPITRE II : MATERIEL ET METHODES
II.1. Matériel II.1.1. Patients
Nos patients étaient essentiellement des
nouveau-nés à terme ou prématurés admis au Service
de Néonatologie.
II.1.1.1. Critère d'inclusion
Etaient inclus dans notre étude, tous les
nouveau-nés admis au Service de Néonatologie chez qui il a
été diagnostiqué ou suspecté une infection
néonatale pendant notre période d'étude.
II.1.1.2. Critères de non inclusion
Tout nouveau-né ne répondant pas aux
critères d'inclusion ou ceux dont les dossiers médicaux
étaient incomplets.
II.1.1.3. Matériel non humains.
Les matériels ayant servi pour la réalisation de
cette étude :
- Le registre d'admission au Service de
Néonatologie/Pédiatrie ;
- Les dossiers médicaux des patients ;
- Les documents sur les critères morphologiques selon
FINNSTROM ;
- Une courbe de croissance de Lubchenco ;
- Un pèse bébé ;
- Un ruban métrique ;
- Les fiches de collecte des données.
II.2. Méthodes.
III.2.1. Nature, cadre et période
d'étude.
III.2.1.1. Nature.
Il s'agit d'une étude documentaire et descriptive
basée uniquement sur les dossiers médicaux des patients
11
II.2.1.2. Cadre.
Notre étude s'est déroulée au Service de
Néonatologie de la Clinique NGALIEMA.
II.2.1.3. Période d'étude.
Notre étude a couvert la période allant du
1er Mars 2019 au 31 Mars 2020, soit une période d'une
année.
II.3. Les variables d'intérêt.
a. Paramètres néonatals
> Variables sociodémographiques
- Âge maturatif (clinique) en semaine ;
- Sexe ;
- Mode d'accouchement.
> Variables cliniques
- Poids de naissance ;
- Age gestationnel ;
- Examen à l'admission : les signes
généraux, les signes respiratoires, l'examen
cardiovasculaire, l'examen neurologique dans les 3composantes,
l'examen du
système digestif ainsi que l'examen des organes
génitaux externes
> Variables paracliniques (biologiques et radiologiques)
- Hématologie ;
- CRP ;
- Ponction lombaire ;
- ECBU ;
- Hémoculture ;
- Rx Thorax.
> Traitement antibiotique
- Type d'antibiotique.
> Evolution
b. Paramètres maternels
> Identité gynécologique ;
> Antécédents médicaux ;
> Fièvre en per partum ;
> Rupture prématurée des membranes ;
> Aucune informations sur les CPN ou insuffisamment suivies
;
12
? Suivi de la grossesse ;...
II.4. Analyses statistiques.
Les données analysées dans ce travail ont
été saisies à l'aide du logiciel Excel 2010 et les
données ont été analysées sur le logiciel SPSS 21.0
pour aboutir à des données exprimées en terme de
fréquence et pourcentage dans les tableaux.
II.5. Considérations éthiques.
De la collecte jusqu'à la transcription des
données, notre étude a été réalisée
selon les règles éthiques exigées en matière de
publication médicale, à savoir le respect du principe de
confidentialité ainsi que l'anonymat des patients.
13
CHAPITRE III. RESULTATS
III.1. Fréquence hospitalière des
infections néonatales
Durant la période de notre étude, nous avons
colligé 587 admissions au Service de Néonatologie, parmi lesquels
253 chez qui le diagnostic d'infection néonatale a été
posé, soit 43,1%

56,9%
43,1%
Infections néonatales Autres pathologies
Figure 1. Fréquence des infections
néonatales
14
III.2. Paramètres
sociodémographiques
III.2.1. Caractéristiques
sociodémographique des nouveau-nés
III.2.1.1. Age maturatif et sexe
Tableau I : Répartition des nouveau-nés
selon l'âge clinique et le sexe
Sexe
|
Age (en semaine)
|
Masculin
|
féminin
|
|
Total
|
|
? 32
|
7
|
(2,7%)
|
10 (3,9%)
|
17
|
(6,7%)
|
|
32
|
- 36
|
21
|
(8,3%)
|
24 (9,4%)
|
45
|
(17,7%)
|
|
37
|
- 42
|
106
|
(41,9%)
|
85 (33,5%)
|
191
|
(75,5%)
|
|
>42
|
0
|
(0%)
|
0
|
(0%)
|
0
|
(0%)
|
|
Total
|
134
|
(53%)
|
119
|
(47%)
|
253
|
(100%)
|
La majorité de nos patients étaient de sexe
masculin (53% des cas) et nés à terme (75% des cas)
15
III.2.1.2. Mode d'accouchement
Dans notre série, la majorité des patients
était nés par voie basse

40
60
50
30
20
10
0
Voie basse Césarienne
55%
45%
Figure 2. Mode d'accouchement
16
III.2.2. Caractéristiques
sociodémographiques des mères III.2.2.1. Age et
parité.
Tableau II. Répartition selon l'âge des
mères et parité.
|
Age et Parité
|
n
|
%
|
|
Parité
|
|
|
|
Primipares
|
88
|
34,7
|
|
Multipares
|
83
|
32,4
|
|
Paucipares
|
73
|
29
|
|
Grandes multipares
|
10
|
4
|
|
Total
|
253
|
100
|
|
Ages des mères (en année)
|
|
|
|
? 18
|
8
|
3
|
|
18-35
|
202
|
80
|
|
>35
|
43
|
17
|
|
Total
|
253
|
100
|
La plupart des mères était primipares et
âgées de 18 à 35 ans avec une moyenne de 28 #177; 2ans
17
III.3. Paramètres cliniques III.3.1.
Paramètres maternels III.3.1.1. Suivi des CPN
|
Le tableau III représente le suivi des CPN par les
mères. Tableau III. Répartition des mères en
fonction du suivi des CPN
|
|
|
|
CPN
|
n
|
%
|
|
Non ou irrégulièrement suivies ou sans
renseignement
|
68
|
26,8
|
|
Régulièrement suivies
|
175
|
69,1
|
|
Non précisées
|
10
|
4
|
|
TOTAL
|
253
|
100
|
|
La majorité (69,1%) des mères a suivi
régulièrement les CPN
|
|
|
18
III.3.1.2. Facteurs de risques maternels liés
à l'infection néonatale
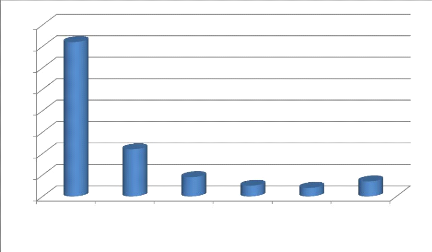
Infection
uro-génitale
RPM Travail
prolongé
LA fétide Fièvre Aucun
facteur de risque
72%
22%
7%
5% 4%
9%
80
70
60
50
40
30
20
10
0
Figure 4. Facteurs de risque maternels liés
à l'infection néonatale
En ce qui concerne les facteurs de risques maternels, l'infection
uro-génitale était en tête avec 72% et les ruptures
prématurées des membranes venaient en seconde position avec
22%
73,5% nouveau-nés de la population
étudiés sont eutrophiques, 17,5% sont hypotrophiques et 9% sont
macrosomes.
19
III.3.2. Paramètres néonatals III.3.2.1.
Poids de naissance
TableauI V : répartition des nouveau-nés
selon leur poids de naissance
|
Poids de naissance (en gramme)
|
n
|
%
|
|
? 1000
|
5
|
2
|
|
1000 - 1499
|
13
|
5
|
|
1500 - 1999
|
20
|
8
|
|
2000 - 2499
|
33
|
13
|
|
2500 - 4000
|
177
|
70
|
|
>4000
|
5
|
2
|
|
TOTAL
|
253
|
100
|
La majorité des nouveau-nés (70%) avaient un
poids de naissance compris entre 2500 et 4000 grammes

18%
9%
73%
Eutrophique
Hypotrophique
Macrosome
Figure 5 : Répartition selon la
troficité
20
|
III.3.2.2. Symptômes (plaintes) des nouveau-nés
à l'admission
Tableau V : Répartition selon les plaintes des
nouveau-nés
|
|
|
|
Plaintes / Symptômes
|
n
|
%
|
|
Fièvre
|
37
|
14,6
|
|
Polypnée
|
6
|
2,4
|
|
Enchiffrenement
|
14
|
5,5
|
|
Refus de tétée
|
23
|
9,1
|
|
Convultions
|
3
|
1,2
|
|
Pleurs incessants
|
10
|
4
|
|
Cyanose
|
9
|
3,5
|
|
Ictère
|
18
|
7
|
|
Vomissement
|
16
|
6,3
|
Il ressort de ce tableau que la fièvre était le
premier symptôme (37%) suivi du refus de tétée (23%).
21
III.3.2.3. Examen physique des nouveau-nés
Tableau VI : Répartition selon les signes
cliniques
|
Clinique
|
n
|
%
|
|
Signes respiratoires
|
|
|
|
Détresse respiratoire
|
33
|
13
|
|
Cyanose
|
16
|
6,3
|
|
Apnée
|
13
|
5,2
|
|
Signes neurologiques
|
|
|
|
Comportement perturbé
|
26
|
10,3
|
|
Tonus perturbé
|
52
|
20,5
|
|
Reflexes perturbé
|
42
|
16,6
|
|
Signes cutanées
|
|
|
|
Ictère
|
28
|
11
|
|
Teint gris
|
4
|
1,6
|
|
Paleur cutanéo-muquese
|
3
|
1,2
|
Il ressort de ce tableau que l'examen neurologique
était le plus perturbé suivi du trouble du système
respiratoire.
22
III.4. Bilan paraclinique
III.4.1. Hémogramme
|
Tableau VII: Répartition selon les
résultats de l'hémogramme.
|
|
|
|
Eléments
|
n
|
%
|
|
Globules Blancs
|
|
|
|
Hyperleucocytose (>11.000/mm3)
|
47
|
18,5
|
|
Normale (4.000 - 11.000/mm3)
|
182
|
71,9
|
|
Leucopénie (? 4.000/mm3)
|
24
|
9,5
|
|
Plaquettes
|
|
|
|
Hyperplaquettose (>450.000/mm3)
|
2
|
0,8
|
|
Normal (150-450.000/mm3)
|
221
|
87,3
|
|
Thrombopénie (?150.000/mm3)
|
30
|
12
|
|
Hémoglobine
|
|
|
|
Normal (15 - 19g%)
|
227
|
89,7
|
|
Anémie (? 14g%)
|
25
|
9,8
|
Il ressort de ce tableau que l' hyperleucocytose a
été retrouvée dans 18,5% des cas, la thrombopénie
et l'anémie respectivement chez 12 et 9,8 % des nouveau-nés.
23
III.4.2. Protéine C - Réactive
|
Tableau VIII: Répartition selon les
résultats de la CRP
|
|
|
|
Eléments
|
n
|
%
|
|
Dosage de la CRP
|
|
|
|
Négative
|
67
|
26,5
|
|
Positive
|
164
|
65
|
|
Non réalisée
|
22
|
8,5
|
|
TOTAL
|
253
|
100
|
Le dosage de la CRP a été pratiqué chez
231 malades, soit 91,5% de la population étudiée, il a
été positive chez 164 cas, soit 65% des malades
bénéficiant de cet examen.
24
III.4.3. Hémoculture
Tableau IX : Répartition selon le germe
isolé sur hémoculture
|
Germes
|
n
|
%
|
|
Enterobacter sp
|
3
|
33,3
|
|
E. Coli
|
2
|
22,2
|
|
Klebsiella
|
1
|
11,1
|
|
Proteus mirabilis
|
1
|
11,1
|
|
Serrata liquefaciens
|
1
|
11,1
|
|
Staphylocoque aureus
|
1
|
11,1
|
|
TOTAL
|
9
|
100
|
Il ressort de ce tableau que parmi les germes isolés sur
hemocultures, l' Enterobacter Sp était isolé chez 3
patients ( soit 33,3%) et l' E. Coli chez 2 patients (soit 22,2%).
25
III.5. Traitement antibiotique
Tableau X : Répartition selon le traitement
administré.
|
Traitement (molécules
utilisées)
|
n
|
%
|
|
Céfotaxime + Amikacine
|
228
|
90,1
|
|
Cefotaxime + Amikacine + Métronidazole
|
11
|
4,3
|
|
Céfotaxime + metronidazole + Ciprofloxacine
|
6
|
2,3
|
|
Céfuroxime + Amoxycilline + Amikacine
|
5
|
2
|
|
Amoxycilline/Ac. Clavulanique + Cefotaxime + Amikacine
|
1
|
0,4
|
|
Piperacilline/TaZobactam + Amikacine
|
2
|
0,8
|
|
TOTAL
|
253
|
100
|
La majorité des nouveau-nés (90,1%) qui
étaient admis pour infection néonatale a reçu une
antibiothérapie probabiliste faite d'une association Cefotaxime -
Amikacine.
26
III.6. Evolution clinique à court
terme.
|
Tableau XI. Répartition selon l'évolution
clinique.
|
|
|
|
Evolution Clinique
|
n
|
%
|
|
Guérison
|
199
|
78,7
|
|
Sorties contre avis médical
|
10
|
4
|
|
Décès
|
44
|
17,3
|
|
TOTAL
|
253
|
100
|
Sur l'ensemble de nos 253 nouveau-nés, la majorité
(soit 78,7%) était guérie.
27
CHAPITRE IV. DISCUSSION
Notre étude avait comme objectif de décrire le
profil épidémioclinique des infections néonatales à
la Clinique Ngaliema. Notre étude a porté sur 253
nouveau-nés admis au service de néonatologie pour infection
néonatale.
IV.1. Fréquence hospitalière
Notre étude a révélé une
fréquence hospitalière de 43,1%. Notre fréquence
hospitalière est différente de celle de Danielle Christiane et
al, au Cameroun en 2016 (19) et de Bafunyembaka Gabriel et al,
aux CUK/RDC en 2017 (20) qui ont enregistré
respectivement 62% et 67%. Nous osons croire que différence avec ces
deux équipes serait lié à la fréquentation qui est
fonction de chaque structure hospitalière.
IV.2. Paramètres maternels
La majorité des mères avaient un âge
compris entre 18 - 35 ans avec une moyenne de 28 #177;2 ans. Ce résultat
corroborait celui de Matumona et al, en RDC (25), qui en 2010
a trouvé une prédominance dans la tranche d'âge de 20
à 29ans. Ce résultat était également similaire
à celui de Danielle Christiane et al, au Cameroun (19)
qui a trouvé que plus de la moitié des mères
avaient un âge compris entre 25 et 35ans.
Notre étude a trouvé que seulement 34,7% des
mères étaient primipares. Ces résultats sont similaires
à ceux de Bafunyembaka Gabriel et al, aux CUK/RDC(20).
Par contre, ils étaient différents Andriamady et al, (26)
au Madagascar qui a trouvé plus de la moitié des
mères primipares (50,7%). A notre avis, Cette différence serait
liée probablement à la population chez nous en majorité
jeune et en âge de procréer.
Plus de 60% des mères avaient bien suivi les CPN. Nos
résultats corroboreraient ceux de :
? Bafunyembaka Gabriel et al, (20) aux
CUK/RDC en 2017 qui a observé 63,7%. ? M. Taleuan abdelouahid et al,
(27) au Maroc ainsi que ceux de Matumona et
al, en RDC en 2010 qui ont trouvé que la moitié
des mères avaient
régulièrement suivi les CPN.
28
L'examen des critères anamnestiques de l'infection
néonatale mis en évidence les facteurs de risque maternels
liés à l'infection néonatale. Dans l'ordre
décroissant, nous avons : l'infection uro-génitale, la rupture
prématurée des membranes, le travail prolongé, le liquide
amniotique fétide et la fièvre.
· Abdellatif Harkani et al, (31) au
Maroc en 2010 ont trouvé l'infection urogénitale, la rupture
prématurée des membranes, le travail prolongé
· Kemeze et al, (30) ont trouvé
la prématurité inexpliquée ainsi que la rupture
prématurée des membranes comme facteurs de risque ;
· Chiabi et al, en 2011 (29) ont
rapporté ; la rupture prématurée des membranes et la
fièvre perpartale comme facteurs de risque maternels associés
à l'infection néonatale ;
· Andriamady et al, (26) au Madagascar,
ont trouvé comme facteurs de risque maternels l'infection
urogénitale et la fièvre maternelle pendant le travail
d'accouchement.
· M.A. Folqueta et al, (28) en
Côte d'Ivoire ont trouvé le liquide amniotique fétide ou
teinté ainsi que la fièvre avant ou en début de travail
d'accouchement comme facteurs de risque maternels.
IV.3. Paramètres néonatales
IV.3.1 Caractéristiques sociodémographiques
Notre étude a trouvé une prédominance
masculine dans l'apparition de l'infection néonatale. Nos données
étaient en phase avec ceux de Bafunyembaka Gabriel et al, aux CUK/RDC en
2017 ainsi que Matumona et al, en RDC en 2010. Cette répartition selon
le sexe confirme les données de la littérature selon lesquelles
les infections néonatales sont prédominantes chez les
garçons que chez les filles (21).
Plusieurs auteurs ont fait le même constat dans leurs
études :Vinay Bs et al, puis Assudani et all en Inde et Raha Bk et all
au Bengladesh. (22, 23, 24)
Les raisons qui expliqueraient cette prédominance
masculine ne sont pas encore élucidées.
Notre étude a trouvé que la majorité des
nouveau-nés était à terme soit 75,5%. Les
prématurés représentaient 24,4% dont 6,7% des grands
prématurés. Ces résultats sont proches de ceux de :
· M.A. Folqueta et al, (28) en Côte
d'Ivoire qui ont repris 77%
29
? Bafunyembaka Gabriel et al, (20) aux CUK/RDC
en 2017 qui ont trouvé 79% ? Ogundane et al, (32) qui
ont trouvé 68%
? Bastard et al, (33) qui ont trouvé
85%.
Plus de la moitié de la moitié de nos patients
(55%) étaient nés par voie basse. Nos résultats
corroboraient ceux de :
? Bafunyembaka Gabriel et al, aux CUK/RDC en 2017 qui ont
trouvé 56,7% (20) ? M.A. Folqueta et al, en Côte
d'Ivoire qui ont repris 77% (28)
IV.3.2. Tableau clinique des nouveaux nés
Notre étude a montré que 73% des
nouveau-nés étaient eutrophiques. Les faibles poids
représentaient 18% et les macrosomes 9%. Les résultats de notre
étude sont proches de ceux de Bafunyembaka Gabriel et al, qui ont
trouvé 79%. (20)
Le Tableau clinique de l'infection néonatale reste
polymorphe et aucun signe n'est spécifique. Dans notre étude, Le
symptome le plus rencontré était la fièvre et l'examen
neurologique perturbé (en particulier le tonus) était le signe le
plus retrouvé suivi des signes respiratoires (en particulier la
détresse respiratoire).
Nos résultats corroboraient ceux de Matumona et al,
(11) ainsi que Bafunyembaka Gabriel et al (20)
qui ont trouvé la perturbation du système nerveux suivi
du système respiratoire
Par contre M.A. Folqueta et al ont révélé
en tête la détresse respiratoire suivi de la fièvre et la
perturbation de l'examen neurologique. (28)
IV.4. Données paracliniques
L'hyperleucocytose était la perturbation de
l'hémogramme la plus représentée avec 18,5% suivi de la
thrombopénie (12%)
La CRP était revenu positive dans plus de 65% des cas.
Nos résultats corroboraient ceux d'Abdellatif Harkani
et al, au Maroc en 2010 avec une hyperleucocytose est retrouvée chez 20%
des malades et la thrombopénie chez 10%. (31)
30
Sur un total de 69 hemocultures réalisées, 9
sont revenues positifs (soit 13%) et les germes les plus fréquents
étaient l'Enterobacter Sp (33,3%) et l'Escherichia Coli
(22,2%).
Nos résultats rejoignent ceux de Bafunyembaka Gabriel
et al, (20) aux CUK/RDC en 2017 qui ont revélé
la présence préponderente de l'Enterobacter Sp (38,8%)
et l'Escherichia Coli (16,6%)
IV.5. Traitement et évolution à court
terme.
La Quasi-totalité des nouveau-nés admis pour
infection néonatale avait reçu une antibiothérapie
probaliste faite d'une association Céfotaxime - Amikacine.
La littérature actuelle et la plupart d'études
françaises consultées ne préconisent plus la triple
association d'antibiotique en première intention au motif qu'il serait
judicieux de protéger certaines molécules pour éviter
l'émergence des souches multiresistantes et pour cela ils recommandent
une bithérapie en première intention selon l'écologie
bactérienne du milieu en attendant les résultats de
l'antibiogramme.
Sur l'ensemble de nos 253 patients, 78,7% étaient
guéris, 17,3% décédés et 4% sortis contre avis
médical. Nos résultats se rapprochent de ceux de :
? Matumona et al, qui ont révélé 79,1% de
guérison et 21% de décès (11)
? M.A. Folqueta et al, qui ont trouvé un taux de
guérison de 81,5%, un taux de mortalité de 11,6% et 7,1% de
nouveau-nés sorti contre avis médical. (28)
31
Limite et Force du travail.
1. Limite
Ce travail étant documentaire, les informations
rapportées sont celles trouvées dans les fiches de consultation,
le manque de certaines données utiles constitue une limite majeure.
2. Force
Malgré cette limite, notre travail dispose d'une force
d'être la première étude réalisée à la
clinique Ngaliema sur le sujet et sur une longue période relativement
longue à savoir 12mois.
32
CONCLUSION
Au terme de notre étude qui avait pour objectif
principal de décrire un profil épidémioclinique infections
néonatales à la Clinique NGALIEMA, nous avons aboutis aux
observations suivantes :
? La fréquence hospitalière de l'infection
néonatale était de 43,1% avec une prédominance
masculine.
? L'infection uro-génitale des mères était
le facteur de risque le plus important. ? La fièvre était le
symptôme le plus fréquent et la perturbation de l'examen
neurologique a dominé à l'examen physique
? L'association cefotaxime-amikacine était
l'association antibiotique la plus utilisée.
? L'évolution était favorable dans la
majorité des cas.
33
RECOMMENDATIONS
Aux autorités sanitaires :
· Promouvoir la formation continue et adaptée des
prestataires des équipes soignantes ;
· Doter les établissements sanitaires des
matériels adéquats.
Aux personnels sanitaires :
· De renforcer l'information, l'éducation et la
communication sur l'importance des consultations prénatales et leurs
composantes pour un dépistage précoce des grossesses à
risque et leur suivi adéquat ;
· D'installer une clinique spécialisée
avec personnel permanent pour le suivi et la prise en charge des grossesses
à risque, et des urgences néonatales ;
· Améliorer la tenue et la conservation des
dossiers en vue des faciliter les prochaines recherches dans ce domaines.
Aux gestantes :
· Fréquenter les établissements de
santé maternels et infantile de proximité ;
· Suivre régulièrement les CPN en vue de
prévenir et traiter dans le temps les facteurs de risques liés
à la survenue d'une infection néonatale.
34
REFERENCES BIBLIOGRAPHIQUES
1. Jain N, Jain V, Maheshwari S. Clinical
profile of néonatale sepsis. Kathmandu Univ Med J. Nepal;
2003;117-20.
2. Vergnano S, Sharland M, Kazembe P, Mwansambo C, Heath
P. Neonatal sepsie: an international perspective. Arch Dis child Fetal
Neonatal. 90. 2005;220-4.
3. Chiabi A, Fokam P, Aly T, Nguele M, Sihom P, Tetang
M. les infections neonatales bacteriennes en milieu rural au Cameroun.
Clin Mother Child Health. 2005;2(1):22934.
4. Shefali O, Joy E, Daniel R, Colin M, Simon
N. Neonatale cause of death estimates for the early an late neonatale
periods for 194 contries. Bull World Health Organ. 2015;19- 28.
5. Aboussad A, Chafai S, Benomar S, Bennis M, Squalli
M, Belbachir M. Infection néonatale au Maroc ; Etude
rétrospective à propos de 100 cas. Méd Mal Infect 1996 ;
26 ; 332-6.
6. Seale AC, Blencowe H, Manu AA, Nair H, Bahl R,
Qazi SA, et al. Estimates of possible severe bacterial infection in
neonates in sub-Saharan Africa, south Asia, and Latin America for 2012: a
systematic review and meta-analysis. Lancet Infect Dis. 2014
Aug;14(8):731-41.
7. Saizou C, Farnoux C, Rajguru M, Bingen E, Aujard
Y. Infections bactériennes graves du nouveau-né. Arch
Pediatr. 8. 2001;721-5.
8. Manta J, Kapil K, Garg L, Vikas M, Mittal
S. To study the incidence and risk factors of early onset neonatal
sepsis in an out born neonatale intensive unit care of Indian. J Clin Neonatal.
2015 May 11;154-72. 174-225.
9. Kago I, Tchokoteu P-F, Tenanye E, Doumbe P,
N'Koulou H, Ndayo W. Les septicémies néonatales à
Yaoundé: aspects épidémiologiques, cliniques et
pronostiques. Rev Int Pédiatrie. 1990;(201):19-23.
10. Akaffou E, Amon-Tanoh D, Lasme E, Ehua-Amangoua
E, Kangah D. Les infections bacteriennes neonatales en milieu
hospitalier à Abidjan. Med Afr Noire. 45. 1998;4551.
11. Koueta F, Yé D, Dao L, Neboua D, Sawadogo
A. Neonatal morbidity and mortality in 2002-2006 at the Charles de
Gaulle pediatric hospital in Ouagadougou. Cah Etude Rech Francoph.
2007;17(4):187-91
35
12. Abourmane E.H. Etude
rétrospective de la mortalité périnatale au niveau de la
maternité de l'hôpital « Essalama » d'El kélaa
des Sraghnaa, Maroc. Institut national d'administration sanitaire (INAS),
Ministère de la santé. Juillet 2006.
13. Koum D, Essomba N, Ngaha G, Sintat S, Ndombo P,
Coppieters Y. Morbidity and risk factors for neonatal mortality in
Douala referral Hospital. Pan Afr Med J. 2015 Mar 17;20:258.
14. Kabasubabo F, Profil anatomoclinique sur
les infections bacteriennes materno
foetales à l'hopital provincial général de
référence de Kinshasa,Université de
Kinshasa
15. Ngondo, Pitsha Ndende, Mortalité et
morbidité infantile et juvénile dans les grandes villes du
Zaïre, in Afrique 1996-1997
16. Boskabadi H, Maamouri G, Mafinejad S.,
Neonatal complications related with pronged rupture of membranes. Maced J
Med
17. Mulongo P. et coll. Fréquence et
facteurs de risques des infections néonatales à l'hôpital
général. de référence d'Uvira en technique d
élaboration volume 9, n=37, 2016
18. Cisse CT, Mbengue -diop R, Moubarek M, Ndiay O,
Dotou CR, Cotou CS et al. Infections néonatales
bactériennes au CHU de Dakar. GynécolObstétFertil 2001 ;
29 : 433-9
19. SolangeOdile Yougbaré Ouéddraogo,
Désiré Méda, Lassina Dao ; Fla Koueta, Kam Ludovic, Ramada
Ouedraogo Taoré, Diarra yé. Facteurs associés au
décès des nouveaux nées suspects d'infection bacteriennes
au Centre Hospitalier universitaire Pédiatrique Charles de Gaule de
Ouagadougou, Bourkina Faso, Pan African médical Journal. 2016 ; 23
:97
20. Gabriel BAFUNYEMBAKA et al, Infection
néonatale précoce aux Cliniques Universitaires de Kinshasa :
Profil bacteriologique, M »moire de fin de spécialisation,
Décembre 2017
21. Nejla Aissa, Eliette Jeanmaire : Bonne
pratiques des prélevements des hemocultures - Laboratoire de
bacteriologie et service des maladies infectieuses et tropicales,
16ème JNI Nancy et Interregional, EST 2015
22. hitesh J Assudani, Jigar K Gussani, Sanjay J
Mehta, Harihar K Agravat, Krupali Kothari : bacteriological profils of
septicaemia in neonat and tertiary care hospital, journal of Reseach in Medical
and dental science / Vol.3/Issue 2/ April-June 2015
23. Vinay BS, Kruthi BN, Girish GN Appolo
Bgs Hospital, Adichnchanagiri Road, Kuvempunagar, Mysone 570023, Karnataka,
India A study of Bacteriological profile
36
ans their sensitivity pattern in neonatal sepsis at tertary care
hospital in Mysore, southern India, scholars Journal of Applied Médical
Science.
24. Raha BK, Baki MA, Begum T, Nahar N, Begum
Clinical nacteriological Profil and Out come of neonatal sepsis in tertiary
care hospital 2014 volume 26 number 01, medicine today
25. Matumona S et all. Prise en charge des
infections materno-foetale (type sepsis) aux cliniques universitaires de
Kinshasa, mémoire de fin de spécialisation, Décembre
2010
26. Andriamady RCL, Rasamoelisoa JM, Razanabolona,
Ranjalahy RJ. Les infections becteriennes néonatales precoces :
un problème de santé publique à la maternité de
Befelatanana (1997 - 1998), Arch Inst Pasteur Madagascar 1999 ; 65 (2) :
86-89
27. Kari A.Simonsen, a Ann L. Anderson - Beery, B
Shierley F. Delair, a H. Dele DaviesEarly - Onset Neonatal Sepsis.
Clinical Microbiology Review p.21-47. Divisions of Infections Diseases and
Neonatology, b Département of Pédiatrics, University of Nebraska
Medical center, Omaha, Nebraska, USA, 2014
28. M.A Folqueta, M.-E. Dainguya, D. diomandea, b,C.
Kouakoua, M. Kamenana, V.C. Mbengue Gbondonc, E. Kouadioa, G.C.Y. Kouadioa, M.
Gro Bia, A. Djivohessouna, A.D. Angen Goli. Actualisation du profil
des infections bacteriennes du nouveau-né au CHU de Coccody à
Abidjan, Journal de Pédiatrie et de puériculture, (2016),
29,8.
29. Chiabi A, Djumpomb M, Mah E, Nguefack S, Mbuagbaw
L, Zafack J et al. The Clinical and bacteriological spectum of
neonatal sepsis in a tertiary hospital in Yahounde cameroon. Iran J Pediatr.
2011 dec ; 21 (4) : 441-8.
30. Sandrine Kemeze, Béatrice Moudze, Andreas
Chiabi, et charlotte Eposse, Alexi kaya, Madeleine Mbague, Odette Guifo,
Innocent Kago. Porfil clinique et bacteriologique des infections
néonatales bacteriennes à l'hopital Lanquinitinie de Douala,
Cameroun, Pan African Medical Journal, 2016
31. Abdellatif HARKANI et al. L'infection
néonatale : Expériance du CHU Mohamed VI de Marrakesh,
Université Cadi Ayyad, Faculté de Médecine et Pharmacie,
Thèse 59, 2010
32. Ogundare ezra Olatunde, Akintayo Akinyemi
Akinsoji, Dedeke Iyabode Olabisi Florence, Okeniyi John Akintunde, Adeyemi
Lateef Ademola, Ogunlesi Tinuade Adetutu and Oyelami Oyeku Akibu.
Néonatal Septicaemia in Rural Nigerian Hospital : Aetiology,
Presentation and Antibiotic sensitivity Pattern. British Journal of Medecine en
Medical Research 12 (7) : 1-11, 2016.
37
33. Lucie Bastard. Evaluation de la prise en
charge diagnostique et thérapeutique des nouveaux nés suspects
d'infection néonatale précoce, étude prospective et
multicentrique dans trois maternités des pays de la Loire,
Mémoire inedit, Université de Nantes, UFR de
médecine-Ecole des sages-femmes, 2011
34. Haute autorité de santé, « Diagnostic
et traitement curatif de l'infection bactérienne précoce du
nouveau-né. Recommandations pour la pratique clinique » 2012.
35. S. Schrag, R. Gorwitz, K. Fultz-Bults et A.
Schuchat. Prévention of perinatal group B streptococcal
disease. Revised guidelines from CDC », MMWR Recomm Rep, Vol. 51, no
RR-11, p. 1-22, Août 2002.
38
ANNEXES
39
PROFIL EPIDEMIO - CLINIQUES DES INFECTIONS NEONATALES A
LA CLINIQUE
NGALIEMA.
Dossier
FICHE DE COLLECTE DES DONNEES
Âge : 0-7j El 7-15j El 15-29j El
[CODE : ]
Sexe : FEl M [CODE : ]
Commune / District de provenance :
[CODE : ]
Eléments maternels:
- ATCD médicaux :
El HTA El Diabète sucré El Cardiopathie El
Asthme
El Drépanocytose El Chirurgie El Autres :
[CODE : ]
- Parité : El Primipare El Multipare [CODE :
]
- CPN : El Non El Oui Si Oui, El Mal suivi El Bien suivi
El Infection urogénitale El Autres [CODE :
]
- Accouchement :
El Leucorrhée Elfièvre ElRPM >12h ElLA
fétide Eltravail prolongé
El Autres : [CODE : ]
- Mode : El VB El Césarienne ( si oui, indication : )
[CODE : ]
Eléments du Nouveau-né :
- Age gestationnel (maturatif) [CODE : ]
- Poids de naissance : El Hypotrophie El Eutrophie El Macrosomie
[CODE : ]
- Terme : El Prématuré El à Terme El Post
Terme [CODE : ]
Examen à l'admission :
-Signes généraux :
El Fièvre El Hypothermie El Convulsion El Pâleur El
Vomissement [CODE : ]
- Signes respiratoires
El Détresse Respiratoire El cyanose El polypnée El
Apnée [CODE : ]
- Signes cutanés
El Ictère El coloration grisâtre El coloration
marbré [CODE : ]
- Signes neurologiques
El Comportement perturbé El tonus perturbé El
Reflexe perturbé [CODE : ]
40
Autres signes [CODE ..]
Malformation : ci Non ci Oui (si Oui, Type : )
Autres : [CODE .........]
Paraclinique : - NFS :
ci Leucopénie ci GB NL ci hyperleucocytose ci
thrombopénie
ciAnémie [CODE .........]
- CRP : ci Négative ci Positive [CODE
.........]
-Bilan hémostatique réalisé : ci Non ci
Oui (si Oui, ci NL ci pathologique) [CODE .........]
-PL : ci Négative ci Positive ci Présence de
germes : ci*non ci *oui ci type [CODE .........]
-ECBU : ci Négatif ci Positif ci Germe : ci*non ci *oui
ci type [CODE .........]
-Hémoculture : ci Non faite ci Faite. Si oui :
ci*négative ci *positive ci Germe [CODE .........]
-Analyse du suc gastrique : ci Non fait ci Fait :
ci*négatif ci*positif ci Germe [CODE .........]
- Radio thorax : ci Non faite ci faite: ci*NL ci *pathologique
; ci Type
ci Antibiogramme ci Autres : [CODE
.........]
Traitement antibiotique :
-démarré à : ci 0-24h ci >24h
[CODE .........]
-Type d'ATB : amoxicilline + Amikacin ci C3G+Amikacin ci
Autres : [CODE .........]
Evolution :
-favorable : séjour à l'hôpital : ci 0-3j
ci >3j [CODE .........]
- Séquelles : ci Non ci Oui ci Type [CODE
.........]
-mortalité : ci Précoce (0-24h) ci Tardive ci
circonstances : [CODE .........]
| 


