IV.3.1.4. Analyse cinétique
Plusieurs modèles sont utilisés pour la
description de la cinétique de réaction du système
époxy amine. La vitesse de réaction est donnée en
général par les équations suivantes :
r =
dt
(3)
da =kf(a)=Aexp(-E
RT)f(a)
Où r : Vitesse de réaction,
á : Taux de conversion,
t : Temps,
k : Constante d'Arrhenius k = A exp
(-E/RT)
A : Facteur pré-exponentiel,
E : l'Energie d'activation,
R : Constante des gaz,
T : Température absolue.
Chapitre IV Résultats et discussion
Les modèles les plus fréquemment utilisés
sont les modèles cinétiques d'ordre n et la combinaison
des modèles autocatalytique est d'ordre n sont décrit
par les équations suivantes :
da
r= = k ( 1 - )n
a
d
(Modèle d'ordre n) (3)
t
Page 68
|
da
r = =
dt
|
( m )( )n
k k
1 + 2 1 -
a a
|
(Modèle autocatalytique) (4)
|
Où k, k1 et k2
sont des constantes,
m et n : Ordre de réaction.
Le taux de conversion et la vitesse de réaction sont
déterminés directement à partir des thermogrammes de DSC
par les relations suivantes :
da 1 dDH t dt D H dt
Tot
|
(6)
|
Où MHt : l'enthalpie isotherme au
temps t
MHTot : l'enthalpie totale de réticulation
obtenue par le test subséquent en dynamique.
Les figures (IV.12), (IV.13) et (IV.14) montrent la variation
de la vitesse de réaction obtenues à partir des courbes DSC et
des équations précédentes.
Nous remarquons pour les différentes formulations que
la vitesse réactionnelle (dá/dt) augmente en
général avec la température. Pour toutes les formulations
étudiées, nous constatons que le temps au maximum du pic
(tp) diminue avec l'augmentation de la température,
alors que la conversion augmente en fonction de la température et du
temps.
Chapitre IV Résultats et discussion

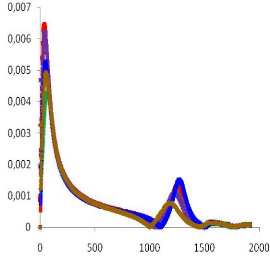
d /dt (1/°C)
Temps (s)
Figure IV.12 : Vitesse de réaction
en fonction du temps pour la RTM6 à 100°C

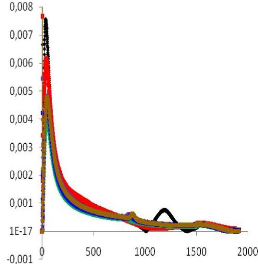
d /dt (1/°C)
Temps (s)
Page 69
Figure IV.13 : Vitesse de réaction
en fonction du temps pour la RTM6 à 135°C
Chapitre IV Résultats et
discussion

d /dt (1/°C)
Temps (s)
Page 70
Figure IV.14 : Vitesse de réaction
en fonction du temps pour la RTM6 à 150°C
Les courbes de la vitesse de réaction en fonction du
temps sont ajustées à l'aide de l'équation
cinétique (4). Cette équation est modifiée pour tenir
compte de l'effet de la diffusion, qui apparaît lorsque la résine
passe de l'état caoutchoutique à l'état vitreux.
Dans cette équation modifiée ámax,
le maximum de conversion obtenue à chaque température
remplace le nombre 1 dans le membre de droite de l'équation. D'autre
part ámax est calculée à partir des enthalpies
de réaction et des enthalpies résiduelles obtenues par DSC. Les
variations observées en DSC sont ajustées à l'aide de
l'équation de Karkanas et Partridge.
da
dt
|
k 1 ( 1 - )
1 +
n k m
2 ( 1 ) 2
n
a a - a
|
(7)
|
Le tableau (IV.5), résume les paramètres
obtenues par ajustement des données expérimentales à
l'aide des équations (4) et (7). Les valeurs des facteurs
pré-exponentiels et l'énergie d'activation sont calculées
à partir de la température de chauffage qui dépend des
constantes k1 et k2 en utilisant
l'équation d'Arrhenius.
La constante k1, correspond aux
réactions entre la fonction époxy et les groupements amines,
catalysées par des impuretés. Quant à
k2, elle correspond aux réactions entre la fonction
époxy et les groupements amines, catalysées par les groupements
hydroxyles initialement présents et formés durant la
réaction de cuisson.
Les valeurs de E1 et E2
pour des cuissons des échantillons conventionnellement sont
obtenue par Karkanas et Partridge.
L'évaluation des paramètres cinétiques
est faite par une méthode analytique de régression des moindres
carrés non-linéaire.
Chapitre IV Résultats et discussion
Page 71
Température
de
chauffage
(°C)
|
Equation (4)
100°C 135°C 150°C
Equation (7)
100°C 135°C 150°C
|
k1 (10-5
s-1)
|
k2 (10-3
s-1)
|
m
|
n
|
n1
|
n2
|
|
da = k
(
|
m )( )n
k a 1 - a
+ 2 (4)
|
|
1
dt
|
|
2,21
|
0,53
|
0,95
|
0,59
|
-
|
-
|
|
3,52
|
0,92
|
1,09
|
0,66
|
-
|
-
|
|
4,30
|
1,35
|
1,11
|
0,79
|
-
|
-
|
|
da n
n k m
= k1 (1 - ) 1
a + a - a
2 ( 1 ) 2 (7)
dt
|
|
2,15
|
0,51
|
0,95
|
-
|
0,52
|
0,66
|
|
3,43
|
0,89
|
1,07
|
-
|
0,58
|
0,73
|
|
4,11
|
1,28
|
1,05
|
-
|
0,71
|
0,86
|
Tableau IV.5 : Estimation des
paramètres cinétiques à partir des modèles
cinétiques déterminés par DSC Equation (4) :
A1 = 22420 s-1 E1 =
71,l kJ.mol-1 A2 = 10256 s-1
E2 = 55,65 kJ.mol-1
Equation (7) : A1 = 25820
s-1 E1 = 73,6 kJ.mol-1
A2 = 25460 s-1 E2 = 61,84
kJ.mol-1
Dans cette partie, nous avons étudié la
résine RTM6 pure par la DSC, méthode qui nous a permis de
déduire le taux de réticulation de la résine pure et de
procéder à l'analyse cinétique.
L'étude calorimétrique détaillée
de la RTM6 à pour but d'étudier la cinétique de cuisson du
système époxy-amine. Plusieurs modèles cinétiques
sont utilisés dont le but de décrire le processus de cuisson par
DSC. Le taux de réaction des groupes époxydes avec les amines
sont déterminés et fités par le modèle
cinétique autocatalytique. L'amélioration de ce modèle
permet et pour des limitations du phénomène de diffusion entre
les valeurs expérimentales et la prédiction du taux de
réaction.
En comparant entre les données expérimentaux et
le modèle prédit pour le mode dynamique à
différentes vitesses de chauffes allant de 1 à
30°C.min-1 (Figures 2 et 3) et en accord aux premiers stages de
réactions mais la divergence apparaît vers la fin de la cuisson.
Le modèle initial est modifié en utilisant deux ordres de
réactions différents n pour les deux schémas de
réactions précédemment mentionnés
| 


