Partie pratique
Chapitre deuxième : DESCRIPTION DU CADRE DE
RECHERCHE
II.1. Cadre de recherche
II.2. Situation géographique
II.3. Délimitation
II.4. Historique du CSR Tegra ONGD
II.5. Organisation du CSR Tegra ONGD
II.6. Organigramme
Chapitre troisième : METHODE DU TRAVAIL
II.1. Population ou échantillon : taille, critères
d'inclusion et d'exclusion
II.2. Type d'étude
II.3. Technique de collecte des données
II.4. Variables utilisées
II.5. Procédés d'analyse des données
II.6. Considérations éthiques
Chapitre quatrième : RESULTATS ET DISCUSSION
CONCLUSION ET SUGESSIONS
REFERENCES BIBLIOGRAPHIQUES
1
INTRODUCTION
1. Etat de la question
Le paludisme est une maladie parasitaire causée par un
protozoaire du genre plasmodium transmis par l'homme par piqûres des
moustiques femelles infectés du genre anophèles ; il constitue la
maladie parasitaire la plus importante des êtres humains. Cette maladie
à potentiellement mortelle est due à plusieurs espèces des
parasites appartenant au genre plasmodium (plasmodium falciparum, plasmodium
vivax ; plasmodium ovale et le plasmodium malariae). Parmi ces quatre genres
des plasmodiums ; le plasmodium falciparum reste le plus dangereux, causant le
paludisme. Car il entraine le taux de mortalité le plus
élevé ; en outre il présente 80% des toutes les infections
malariques humaines et 90 % des décès (OMS, 2002)
Les manifestations cliniques du paludisme sont très
diverses ; le paludisme débute par une fièvre qui peut
s'accompagner par les maux de tête, les frissons, les douleurs
musculaires qui apparaissent une dizaine de jours après la piqûre
de moustique. (Aubry P., et col. 2010)
Au niveau mondial en 2019, on estime à 229 millions le
nombre de cas de paludisme dans le monde ; le nombre estimé de
décès imputable au paludisme s'élevé à 409
000 en 2019 dans 87 pays. (OMS, 2019)
Les enfants âgés de moins de cinq ans constituent
le groupe le plus vulnérable touché par le paludisme ; en 2019
ils ont représenté 67 % des décès imputables au
paludisme dans le monde (soit 274 000). La part de la charge mondiale de
morbidité palustre supportée par la région Africaine de
l'OMS est disproportionnée. En 2019, 94% de cas de paludisme et des
décès imputables à cette maladie se sont produits dans
cette région (OMS, 2020)
Le nombre de cas de paludisme est estimé à 288
millions en 2018 contre 251 millions en 2010 et 231 millions en 2017, la
plupart des cas (213 millions ou 93%)ont été enregistrés
en 2018 dans la région Afrique de l'OMS. Loin devant la région
d'Asie du sud-est (3,4 %) et la région méditerranéenne
orientale (2.1%). Dix-neuf pays d'Afrique subsaharienne et l'inde ont
concentré quasiment 85 % du nombre total de cas de paludisme dans le
monde (OMS. 2019)
En Afrique, La région Africaine de l'OMS a
supporté 94% de l'ensemble de cas de paludisme et des
décès dus à la maladie dans le monde en 2019. Environ 3%
des cas de paludisme en 2019 ont été signalés. (OMS,
2020)
2
Le paludisme existe en Afrique du nord, où l'on
rencontre les espèces P. vivax et P. malariae. Il est largement
répandu dans toute l'Afrique intertropicale où existent P. ovale
et, pour une moindre part, P. malariae. (MOUCHET J. et col., 2000).
La région Afrique de l'OMS représente 94 % (215
M) des cas estimés dans le monde en 2019 et dans cette région,
l'incidence du paludisme est passée de 363 à 225 sur la
période 2000-2019. Sur la même période, le nombre de
décès a diminué de 44% (680 000 en 2000, 384 000 en 2019)
et la mortalité a baissé de 67%, chutant de 121 à 40.
(OMS, 2020).
Le Cap-Vert n'a signalé aucun cas de paludisme
autochtone pour la première fois depuis 2000. Les Comores ont
signalé plus de cas en 2019 qu'en 2018, avec 1 986 cas
supplémentaires en 2019. (OMS.,2020).
En République Démocratique du Congo, le
paludisme demeure la première cause de morbidité et de
mortalité. Le pays est le 2e contributeur en Afrique, derrière le
Nigéria, en termes de cas (10 %) et de décès (11 %).
Fortement prévalent, le paludisme continue à représenter
plus de 40 % des causes de mortalité infantile au niveau national. En
2017, le taux de positivité a été respectivement de 73 %
au Test de Dépistage Rapide (TDR) et 65 % à la goutte
épaisse (GE). (PNDS, 2019-2022).
En 2018, la RDC comptabilisait le deuxième nombre le
plus important de cas de paludisme et de décès de cette maladie
dans le monde (12% des cas et 11% des décès) et 54,6% des cas en
Afrique centrale. (OMS, 2020)
En 2018, le paludisme faisait partie des principales causes de
morbidité et de mortalité en RDC, représentant 44 % de
l'ensemble des consultations en ambulatoire et 22 % des décès.
Environ 97 % de la population vit dans les zones où la transmission du
paludisme est stable pendant 8 à 12 mois par an. (OMS, 2020).
La prise en charge du paludisme est dictée sur les
recommandations de l'OMS. A l'origine, elle s'appuyait essentiellement sur un
diagnostic basé avant tout sur les symptômes cliniques, notamment
la fièvre même si la confirmation au laboratoire restait à
souhaiter. Mais cette stratégie étale ses limites avec
l'apparition des antipaludéens dans la plupart des pays où
sévit le plasmodium falciparum, dont la République
Démocratique du Congo. Dans ces directives 2006 et 2010, l'OMS
recommande la confirmation de la parasitologie rapide de tout cas clinique
avant la mise sous traitement sauf là où cela n'est pas possible
(PNLP, 2010).
Le TDR est une manière simple et rapide pour les agents
de santé de rechercher des parasites du paludisme dans le sang d'un
patient. Il est plus précis que le diagnostic présomptif et
3
Cette confirmation au laboratoire devient une exigence alors
même que la difficulté à rendre disponible une microscopie
de qualité. En effet, cette microscopie de qualité est
relativement contraignante ; ce qui limite l'accès comme par exemple en
RDC où plus de la moitié des cas déclarés ne sont
pas confirmés au laboratoire et on note une forte tendance des
populations à l'automédication. Par ailleurs, des études
faites par Durrheim et Al (1997) ont montré que quand même les
laboratoires sont correctement équipés et les techniciens bien
formés les résultats des examens microscopiques diffèrent
de façon significative (Durrheim et col., 1997).
Ainsi avec le développement des tests de diagnostic
rapide(TDR) au début des années 2000, l'OMS recommande dans
certaines circonstances, leur usage comme alternative crédible à
la microscopie classique (OMS,2004 ; OMS,2006). L'OMS recommande
également de diagnostiquer le paludisme au moyen d'un test de diagnostic
rapide chez tous les patients dont on suppose qu'ils sont atteints de
paludisme, avant d'administrer le traitement. Les TDR du paludisme peuvent
améliorer considérablement la qualité de la prise en
charge des infections palustres. Notamment dans les zones reculées ayant
un accès limité à des services d'examens microscopiques de
bonne qualité (Valérie A., et coll. 2011).
Le TDR est d'exécution et d'interprétation
faciles ; il fournit des résultats rapidement. Il nécessite une
formation limitée et permet la pose d'un diagnostic de paludisme au
niveau communautaire (Sylvie Z., et col. 2013). Un investissement accru dans la
recherche et l'innovation a conduit au développement de nouveaux outils,
qui restent les principales interventions aujourd'hui, notamment les
moustiquaires imprégnées d'insecticide (MII), les tests de
diagnostic rapide (TDR) et les thérapies combinées à base
d'artémisinine (ACT). (OMS,2020).
Pour un diagnostic efficace et plus rapide, l'Organisation
Mondiale de la Santé (OMS) et le Programme National de Lutte contre le
Paludisme (PNLP), exigent la pratique du test de diagnostic rapide. Le
principal avantage du TDR est sa rapidité d'utilisation, la
facilité d'interprétation des résultats, son faible
coût et le fait que son usage ne requiert ni équipement
électrique, ni aménagement de laboratoire ; il permet la prise en
charge rapide des patients fébriles, soit en posant un diagnostic
définitif de paludisme (afin de pouvoir administrer un traitement
antipaludéen à temps et de sauver de vie) si le résultat
est positif, soit en contribuant à la mise en place rapide d'un
diagnostic alternatif et d'une prise en charge de la fièvre si le
résultat est négatif. (PNLP, 2010).
4
peut être utilisé à proximité du
domicile du patient. Le TDR aide à identifier les patients qui n'ont pas
le paludisme, de sorte que ces patients puissent recevoir le traitement
approprié. (Durrheim et col., 1997).
Il s'avère nécessaire de dire aux lecteurs que
nous ne sommes pas les premiers à pouvoir traiter sur ce sujet, par
ailleurs, certains chercheurs l'ont déjà abordé sous
plusieurs aspects :
Dans son étude intitulée l'intérêt
de l'utilisation des tests de diagnostic rapide du paludisme sur le coût
et l'efficacité de la prise en charge des patients fébriles au
Cameroun à Yaoundé. Elle avait comme objectif d'apprécier
le rôle d'un TDR du paludisme dans la prise en charge des patients
fébriles à Yaoundé. Djeutchouang S. a
montré que l'utilisation des TDR du paludisme permet de rationnaliser la
prise en charge des patients fébriles dans des centres de santé.
Cet outil entrainait l'amélioration du taux de guérison 7 jours
après le traitement chez les enfants de moins de 5 ans. Il permet de
ralentir la pression médicamenteuse sur le plasmodium falciparum. C'est
une solution en attendant une situation idéale où tous les
centres de santé seraient équipés de microscope et de
réactif de qualité (Djeutchouang S.,2010).
Dans son travail traité sur l'étude comparative
d'un test de diagnostic rapide du paludisme avec la goutte épaisse et
dont l'objectif principal était de comparer les performances du test de
diagnostic rapide du paludisme par rapport à la goutte épaisse
réalisée dans les conditions standards. Norbert
T. a montré qu'une sensibilité ?95% est
exigé pour juger qu'un test de diagnostic rapide est satisfaisant.
(Norbert T., 2012)
Dans son travail portant sur les rôles et les limites de
test de diagnostic rapide du paludisme. Dont le but était de
développer un nouveau test de diagnostic rapide du paludisme très
sensible, en mesure de détecter les antigènes les plus pertinents
de plasmodium vivax et plasmodium falciparum, les espèces responsables
de la majorité de décès. L'autre objectif final
était d'améliorer la sensibilité et la
spécificité d'espèce à la détection de
plasmodium vivax et le plasmodium falciparum par rapport aux TDR jusqu'à
une détection submicroscopique. (Anne-Claire
L.,2014).
A l'issue de son travail, Anne-Claire L. a
conclu que les grandes avancées dans la lutte contre le paludisme ont pu
être effectuées grâce aux test de diagnostic rapide. Leur
principal avantage est d'être facile et rapide à utiliser, de
faibles coût, avec une interprétation simple des résultats,
sans lourde formation préalable des manipulateurs. Ils constituent donc
un outil idéal de diagnostic de terrain permettant de prendre en charge
rapidement un grand nombre de patients en
5
zone d'endémie, atout indispensable à la
poursuite des objectifs d'éradication. (Anne-Claire
L.,2014).
2. Problématique
L'Afrique en général et particulièrement
la République Démocratique du Congo connait des sérieux
problèmes de santé et parfois persistants notamment les maladies
tropicales endémiques. L'environnement caractérisé par des
crises économiques à répétitions qui ne peuvent
permettre un assainissement planifié et conséquent n'a fait que
favoriser la survie des vecteurs comme les moustiques. (Luboya O. et coll.,
2016).
Le paludisme considéré maintenant comme une
endémie, frappe régulièrement la population de la ville de
Lubumbashi surtout dans ses zones périphériques et ceci
malgré de nombreuses campagnes. Il est responsable d'une forte
létalité qui varie bien entendu d'une zone à l'autre.
Compte tenu de la multiplication de nombre de cas de paludisme dans nos
structures sanitaires, due à des mauvaises conditions de vie, au
non-respect de l'hygiène et de l'assainissement de milieux de vie. Le
test de diagnostic rapide reste l'outil important pour détecter le
paludisme. (Luboya O. et coll., 2016).
En 2018, la République de Démocratique du Congo
occupait la deuxième place en terme de nombre de cas du paludisme et de
décès associés dans le monde (12 % des cas et 11 % des
décès), et représentait à elle seule 54.6 % des cas
en Afrique centrale (Oscar L., 2016). Le paludisme est la principale cause de
morbidité et de mortalité dans notre pays, et présentait
plus de 40 % de toutes les consultations ambulatoires. (PNLP,2019).
Le paludisme, en Afrique est avant tout un problème
d'enfance, avec la plus grande mortalité avant l'âge de 5 ans. En
République démocratique du Congo, c'est le plasmodium falciparum
qui est responsable de plus de 95 % des infections paludéennes et la
mortalité parmi les enfants hospitalisés pour le paludisme est de
15 à 30 % (PNLP,2019).
Les TDR sont des tests biologiques qui permettent de
détecter rapidement (1015 minutes) l'antigène des parasites du
paludisme à partir d'une microgoutte de sang prélevée sur
le bout du doigt et étalée sur une bandelette. D'utilisation
simple, ils ne nécessitent pas d'équipement spécial ou de
laboratoire. Ils sont une opportunité pour les zones qui ne disposent
pas d'équipement ou de personnel qualifié pour réaliser
les examens microscopiques (Abba et col, 2011 ; OMS, 2004).
6
Le TDR est un nouvel outil de diagnostic du paludisme dans les
centres de santé primaires a fait l'objet de plusieurs travaux qui
apparaissent pour l'essentiel comme des évaluations de son utilisation
par les soignants, et de ses effets sur leurs pratiques de prescriptions des
antipaludéens. Bien que considérés comme une étape
importante vers l'accès à des soins appropriés et un moyen
pour déterminer l'étiologie des cas de paludisme, permettant
ainsi d'améliorer les capacités diagnostiques et la
qualité des indications thérapeutiques, l'utilisation des TDR par
les soignants reste problématique pour certains aspects, notamment pour
la gestion des résultats. (Sylvie Z. et col., 2013).
Devant ces problèmes très préoccupants,
des nombreuses questions se posent comme celles de savoir : la
prévalence du paludisme au CSR TEGRA ; la proportion des patients
testés au TDR au Centre de Santé de Référence TEGRA
(CSR) ; la qualité des résultats des TDR réalisés
aux patients ; le CSR TEGRA prend-t-il en charge ses patients selon le
protocole tel que recommandé par l'OMS ?
3. Choix et intérêt du sujet
? Choix du sujet
La pluralité des cas de paludisme dans notre ville de
Lubumbashi, le non recours au test de diagnostic rapide pour poser le
diagnostic de paludisme dans certaines de nos structures sanitaires ont
motivé notre choix sur ce sujet
? Intérêt du sujet
Notre sujet présente un triple intérêt
à savoir : personnel, scientifique et communautaire
- Sur le plan personnel, il nous permet
d'approfondir nos connaissances le paludisme et le test de diagnostic rapide de
paludisme.
- Sur le plan scientifique, notre
étude rend disponible un outil de référence scientifique
à tout chercheur qui mènera une étude sur la pratique du
test de diagnostic rapide de paludisme dans la ville de Lubumbashi.
- Sur le plan communautaire, il permettra aux
autorités sanitaires de prendre des mesures adéquates pour que
nos structures sanitaires recourent au TDR pour que le patient atteint du
paludisme puisse recevoir les soins appropriés.
7
4. Objectifs
Notre étude comporte deux types d'objectifs : l'objectif
général et les objectifs spécifiques. a. Objectif
général
Promouvoir une meilleure prise en charge du paludisme par le test
de diagnostic rapide au centre de santé de référence TEGRA
de KILOBELOBE.
b. Objectifs spécifiques :
- Déterminer la proportion des patients
testés aux TDR au CSR TEGRA ; - Déterminer les
résultats du test ;
- Déterminer la prévalence du
paludisme au CSR TEGRA ;
- Evaluer la prise en charge adaptée.
5. Délimitation du sujet
Notre étude a été menée dans au
centre de santé TEGRA ONGD de Kilobelobe, du 01 Janvier au 30 Septembre
2021.
5. Subdivision du travail
Ce présent travail comporte deux grandes parties en
plus de l'introduction et la conclusion, qui sont : la partie théorique
qui a un seul chapitre consacré aux généralités sur
le paludisme et la partie pratique qui comporte trois chapitres : le
deuxième chapitre traite de la description du cadre de recherche, le
troisième lui parle de la méthodologie du travail, enfin le
quatrième chapitre parle des résultats et discussion.
Un patient est une personne physique recevant une attention
médicale ou à qui est prodigué un soin. (GREENWOOD B.,
2009)
8
Chapitre premier : GENERALITES SUR LE PALUDISME ET
TEST
DIAGNOSTIC RAPIDE
I.1. DEFINITION DES CONCEPTS DE BASE
a. Test
Un test est une épreuve qui permet de tester les
aptitudes physiques ou les caractéristiques psychologiques d'un
sujet.
Est une épreuve biologique ou chimique utilisée
pour établir un diagnostic ; un questionnaire servant à juger
quelque chose ou quelqu'un
Un test médical, est une procédure de
diagnostic réalisée pour des motifs de santé. Par exemple
: pour diagnostiquer des maladies ; pour mesurer la progression, la
régression ou la guérison des maladies ; pour confirmer chez
quelqu'un l'absence de maladie. (GENTILLINI M., 2009)
b. Diagnostic
- Temps de l'acte médical permettant
d'identifier la nature et la cause de l'affection dont un patient est
atteint.
- Identification d'une maladie à partir de ses
symptômes ; l'analyse des causes d'une situation. (BRICAIRE F.,2009)
c. Test de diagnostic rapide
C'est un test de détection rapide des
antigènes, qui n'ont besoin qu'une goutte de sang, et qui ne
nécessite pas beaucoup de formation. Ce test peut être
présenté sous forme de bandelette réactive. (OMS, 2018)
d. Prise en charge
C'est l'action de prodiguer des soins à une personne
présentant des symptômes dus à une maladie ou accident.
(Dictionnaire médical)
e. Patient
9
f. Le paludisme
D'après la prophylaxie des maladies transmissibles
à l'homme, le paludisme (palus=marais) ou malaria (= mauvais air) est
une érythrocytopathie due à un moustique, l'anophèle
femelle.
Est une maladie infectieuse potentiellement mortelle due
à plusieurs espèces de parasites appartenant au genre
plasmodium.
Selon le dictionnaire médical pour les régions
tropicales, le paludisme est un malaise général accompagné
de fièvre apparaissant pendant les quelques jours qui
précèdent les accès paludéens aigu chez un sujet
non prémuni. (Lozano F. et Col., 1983)
Est dû à un parasite, le plasmodium, transmis par
les moustiques femelles qui en sont porteurs. Chez l'humain, ces parasites se
multiplient dans le foie puis s'attaquent aux globules rouges. Le paludisme se
manifeste par de la fièvre, des maux de tête et des vomissements.
(Lozano F. et Col., 1983)
I.2. DESCRIPTION DU PALUDISME I.2.1. HISTORIQUE DU
PALUDISME
Le paludisme est présent dans l'histoire de
l'humanité et affecte tous les continents. Il a en outre
été la cause d'une mortalité excessive.
Le paludisme (malaria) est une des plus vieilles maladies de
l'homme dont les manifestations cliniques sont décrites par les
premières civilisation : les médecins de l'Inde védique
distinguent des fièvres intermittents caractéristiques. Ainsi que
Hippocrate décrivait longtemps des fièvres tierce et quatre ; il
a réalisé ses premières descriptions cliniques
précises de fièvres palustres avec la triade classiques «
frissons-sueurs-fièvre » selon les séquences
quotidiennes.
Les principaux événements ayant marqué
l'évolution du paludisme sont : 1820 : découverte de la quinine
par Pelletier et Caventou
1880 : Découverte du parasite par Alphonse Laveran ;
1885-90 : découverte de trois premières
espèces qui parasitent l'homme (P. vivax, P. malariae, P. falciparum)
par Marchiafava et Celli ;
1897 : découverte du rôle des moustiques dans la
transmission du paludisme par Ross ;
10
1922 : découverte du P. ovale par Stephens ;
1940 : découverte des antis malariques de synthèse
(Nivaquine)
1957 : l'OMS entreprit à l'éradication du
paludisme. (ODEKA M., 2011) I.2.2. CAUSES DU PALUDISME
Le paludisme peut être contracté par une
piqûre de moustique anophèle infecté ou par transfusion
sanguine d'une personne infectée. Les plasmodiums, résistants
à une température de 4°C pendant plusieurs jours, sont
susceptibles d'être transmis par transfusion sanguine de sang
conservé et a fortiori de sang frais.
Le paludisme peut aussi être transmis de la mère
au foetus pendant la grossesse, c'est le paludisme congénital.
(GENTILLINI M., et coll. 2000)
Les moustiques qui transmettent le parasite plasmodium
l'obtiennent en piquant une personne ou un animal infecté. Le parasite
subit ensuite diverses transformations qui lui permettent d'infecter la
prochaine créature piquée par le moustique. Lorsqu'il a
été introduit dans l'organisme, il se multiplie dans le foie et
se transforme de nouveau, prêt à infecter le prochain moustique
qui vous piquera. Il pénètre ensuite dans la circulation sanguine
et envahit les globules rouges. Les globules rouges infectés finissent
par éclater, ce qui a pour effet d'envoyer les parasites partout dans
l'organisme et de déclencher les symptômes du paludisme. (SENE I.,
2010)
I.2.3. EPIDEMIOLOGIE
Plus de deux milliards de personnes vivent en zone à
risque de paludisme. Chaque année, il y a environ 400 à 500
millions de malades, dont 1,5 à 2,5 millions décèdent, une
grande majorité de ces décès surviennent chez les enfants
moins de 5 ans résidant en Afrique Subsaharienne. Les autres groupes
à haut risque sont les femmes enceintes, les voyageurs non
immunisés, les réfugiés, et les ouvriers agricoles
arrivant dans des zones d'endémie. Plus de 90 % de tous les cas de
paludisme surviennent en Afrique Subsaharienne.
Avec l'apparition et la rapide extension des
chimiorésistances et de l'accoutumance des moustiques aux insecticides,
le paludisme est actuellement en progression.
L'assemblée mondiale de la santé a adopté
en mai 2015 une nouvelle stratégie mondiale, comprenant des objectifs
ambitieux pour réduire davantage le nombre de cas de paludisme et de
décès dus à la maladie. (OMS, 2016)
La région Afrique de l'OMS représente 94 % des
cas estimés dans le monde en 2019 et dans cette région,
l'incidence du paludisme est passée de 363 à 225 sur la
période 2000-2019. Sur
11
La stratégie technique mondiale de lutte contre le
paludisme 2016-2030 (GTS) a identifié quatre cibles à atteindre
d'ici 2030 dans le monde entier, ainsi que des objectifs intermédiaires
pour suivre les progrès réalisés. Les cibles pour 2030
sont les suivantes :
- Réduire d'au moins 90 % d'incidence des
cas de paludisme ;
- Réduire d'au moins 90 % les taux de
mortalité dus au paludisme ;
- Eliminer le paludisme dans au moins 35 pays ;
et
- Prévenir une résurgence du
paludisme dans tous les pays qui en sont exempts. (Rapport
2020 sur le paludisme dans le monde)
I.2.3.1. EVOLUTION DU NOMBRE DE CAS ET DE
DECES
Le paludisme est toujours le grand fléau de
l'hémisphère sud et particulièrement des pays pauvres ou
en développement et touche souvent les plus faibles catégories de
population : femmes enceintes et enfants.
En fait la principale zone à risque est l'Afrique et
plus précisément l'Afrique subsaharienne. En dehors du
sous-continent le paludisme est en recul dans toutes les autres zones
d'endémie : Asie, Amérique centrale et du sud.
Au niveau mondial en 2019, le nombre de cas de paludisme est
estimé à 229 millions dans 87 pays d'endémie palustre et
celui des décès à 409 000 dont 67 % concernant les enfants
de moins de 5 ans.
L'incidence du paludisme (nombre de cas pour 1000 habitants
exposés de paludisme) a reculé au niveau mondial, passant de 80
en 2000 à 57 en 2019. Mais entre 2015 (incidence de 58) et 2019, on note
un net ralentissement de ce recul. La tendance est la même pour la
mortalité associée au paludisme (nombre de décès
pour 100 000 habitants exposés de paludisme) qui est passée de 25
en 2000 à 12 en 2015, puis 10 en 2019. (BAUDON D. et Coll., 2000)
En 2019, 29 pays ont concentré 95 % du nombre total des
cas de paludisme et le Nigéria (27%), la RDC (12 %), Ouganda (5%), le
Mozambique (4%) et le Niger (3%). (OMS. 2020)
Dans notre continent, le paludisme existe en Afrique du nord,
où l'on rencontre les espèces P. vivax et P. malariae. Il est
largement répandu dans toute l'Afrique intertropicale où existent
P. ovale et, pour une moindre part, P. malariae.
12
la même période, le nombre de décès
a diminué de 44% (680 000 en 2000, 384 000 en 2019) et la
mortalité a baissé de 67%, chutant de 121 à 40. (OMS,
2020)
Le Cap-Vert n'a signalé aucun cas de paludisme
autochtone pour la première fois depuis 2000. Les Comores ont
signalé plus de cas en 2019 qu'en 2018, avec 1 986 cas
supplémentaires en 2019. (OMS. 2020)
La région Asie du sud-est de l'OMS représente 3%
des cas de paludisme dans le monde. Le nombre de cas a chuté de 73% (23
M en 2000, 6.3 M en 2019). L'incidence du paludisme dans cette région a
diminué de 78% (18 en 2000, contre 4 en 2019). Le nombre de
décès a diminué de 74%.
L'Inde a enregistré la baisse la plus prononcée,
avec près de 20M de cas en 2000, contre 5,6 M en 2019 ; mais concentre
près de 86% des décès de la région. (MARC. G.
2000)
Dans la région Amériques de l'OMS, le nombre de
cas de paludisme a diminué de 40 % entre 2000 et 2019 (1,5 M contre 0,9
M) et l'incidence du paludisme de 57 % (de 14 à 6). Le nombre de
décès a diminué de 39 % (909 contre 551) et la
mortalité de 50 %.
Les progrès réalisés dans cette
région ces dernières années ont souffert de la forte
hausse du paludisme au Venezuela, qui avait recensé près de 35
500 cas de 2000 contre plus de 467 000 en 2019. Le Brésil, la Colombie
et le Venezuela concentrent plus de 86 % des cas dans cette région. Le
Costa Rica, l'Equateur ont signalé plus de cas en 2019 qu'en 2018, avec
respectivement 25 150 et 66 cas supplémentaires en 2019. Plus de 70 %
des décès en 2019 dans cette région ont été
enregistrés au Venezuela. (MARC. G. 2000)
L'épidémiologie du paludisme est
extrêmement variable d'une zone géographique à une autre.
Cette hétérogénéité (différence) est
sous la dépendance de nombreux facteurs ; le rôle de la
distribution des anophèles et leur capacité vectorielle ont
été déjà évoqués, ainsi que les
caractéristiques biologiques des parasites. (MARC. G. 2000)
Un autre facteur extrêmement important est le rôle
de l'immunité. Même si le paludisme entraine la mort d'un
très grand nombre des personnes chaque année dans le monde. La
mortalité est fiable au moins 1% par rapport au nombre
présumé d'accès palustres survenant sur une même
période. La réponse clinique à l'infection est
extrêmement variable, allant de l'infection asymptomatique à la
survenue d'un accès grave pouvant entrainer la mort du patient.
13
I.2.3.2. AGENTS PATHOGENES a. Classification
Sur 140 espèces du genre de plasmodium
répertoriées, seules quatre sont spécifiquement humain :
le P. vivax, P. ovale, P. malariae et P. falciparum qui l'espèce la plus
pathogène, responsable de tous les cas de paludisme. (CHARMOT G. Coll.,
2002)
L'agent pathogène du paludisme appartient :
- Phylum des Apicomplexa
- Classe des sporozae
- Sous classe des Coccidia
- Ordre des Eucoccidiidae
- Sous ordre des Haemosporima
- Famille des plasmodiidae
- Genre plasmodium
Quatre espèces sont parasites pour l'homme, celles-ci sont
regroupées en deux sous-groupe : Sous-genre plasmodium : P. vivax, P.
Ovale, P. malariae,
Sous-genre Laverania : P. falciparum
P. vivax et P. falciparum sont les plus rencontrés.
L'infection à P. falciparum est la plus sévère et peut
entrainer la mort du patient. (Danis M, et coll. 2016)
b. Morphologie et cycle évolutif
La morphologie change sans cesse dans son aspect et sa
taille, au cours du cycle biologique. Les plasmodies sont des parasites
intercellulaires dont la multiplication nécessite un hôte
intermédiaire vertébré (homme) où se déroule
le cycle asexué ou schizogonie, et un hôte définitif
invertébré (anophèle) chez qui se déroule la
multiplication sexuée ou sporogonie.
c. Chez l'homme
Au cours d'une piqûre chez l'homme, l'anophèle
femelle infectée injecte avec sa salive dans un vaisseau sanguin, des
sporozotes (éléments fusiformes de 8 à 12
micromètres de diamètre) localisés dans ses glandes
salivaires. Ces sporozoîtes se répartissent rapidement dans
l'organisme, pénètrent activement et indifféremment dans
différents types cellulaires. Seuls les sporozoîtes ayant
gagné le foie et franchi une dernière barrière
constituée par les cellules de Kupffer,
14
poursuivent leur cycle : c'est la schizogonie tissulaire ou
cycle exo-érythrocytaire. Le sporozoîte pénètre dans
l'hépatocyte et se transforme en trophozoîte, puis en schizonte.
(GENTILLINI M., 1993)
A maturité le schizonte hépatique encore
appelé corps bleu, éclate, libérant des
mérozoîtes : formes uni nucléés qui initieront la
phase érythrocytaire. Le mérozoite de provenance tissulaire
pénètre dans l'hématie par endocytose et s'y transforme en
trophozoîte jeune. Aux dépens de l'hémoglobine dont il se
nourrit, le trophozoîte élabore des grains de pigment noir :
l'hémozoine, résidu voisin de l'hématine. Parvenu à
maturité il se forme un schizonte composé d'un certain nombre de
mérozoites qui se disposent à une forme régulière
appelée « corps en rosace », avec le pigment rassemblé
au centre du schizonte. Le corps en rosace se dilate puis éclate,
libère le pigment et les mérozoites qui vont parasiter les
hématies vierges. Il semble que c'est l'éclatement quasi
simultané des corps en rosace appartenant à la même
génération qui provoque l'accès fébrile
observé au cours du paludisme. Cet accès fébrile est de
type :
Tierce : toutes les 48 heures, pour P. falciparum, P. vivax, P.
ovale.
Quatre : toutes les 72 heures, P. malariae. Amorce du cycle
sporogonique dans le sang
Plus ou moins tôt après évasion du sang,
certains trophozoites installés dans les hématies vont subir une
évolution particulière. Leur développement va aboutir non
à la formation des schizontes, mais à la formation de
gémétocytes mâles et femelles. Ces gamétocytes
dépourvus de tout pouvoir pathogène ne peuvent plus
évoluer chez l'homme, ils sont les seuls éléments aptes
à contaminer l'anophèle femelle. (Gentilini M., 1993)
d. Chez l'anophèle femelle
En prenant un repas de sang sur un sujet infecté,
l'anophèle femelle absorbe les différents stades du parasite. Les
éléments asexués : trophozoites et schizontes sont
digérés. Seuls les gamétocytes poursuivent leur
développement.
Le gamétocyte mâle, parvenu dans l'estomac du
moustique, libère 4 o 8 éléments minces, allongés,
flexueux, mobiles : c'est le phénomène de l'ex flagellation. Ces
éléments sont appelés microgamètes. Quant au
gamétocytes femelles, ils subissent une maturation et deviennent des
gamètes femelles ou macrogamètes. L'un des microgamètes
pénètre dans le macrogamète ; les deux noyaux fusionnent,
il y a fécondation et formation d'un oeuf mobile appelé
ookinète. Cet ookinète, grâce à sa mobilité
va s'enfoncer dans la paroi de l'estomac du moustique pour
15
finalement s'immobiliser entre l'épithélium et
la couche musculaire. Il devient un oocyste qui va grossir pour atteindre et
même dépasser 60 micromètres de diagramme. Le noyau de
l'oocyste se divise plusieurs fois, les divisions fusiformes, allongés :
les sporozoites. (CDC, 1998)
Parvenu à maturité, l'oocyste éclate et
libère les sporozoites qui vont envahir les glandes salivaires du
moustique. L'anophèle devenu infectante contaminera un nouvel individu
en lui inoculant lors d'un repas de sang, des sporozoites. La durée du
cycle sporogonique est en moyenne de 10 à 40 jours, en fonction de la
température, l'humidité de l'air, de l'espèce plasmodiale
hébergée par l'anophèle.
D'une façon générale P. falciparum et P.
vivax évoluent plus rapidement que P. ovale et P. malariae surtout.
(Hernandez et Coll., 2002)
I.2.4. TRANSMISSION
1. Les vecteurs
Les vecteurs du paludisme humain appartiennent tous du genre
anophèles. Les anophèles appartiennent au phylum des arthropodes,
à la classe des insectes, à l'ordre des diptères, au
sous-groupe des nématocères, à la famille des culcidae et
à la sous-famille des anophelinae et au genre anophèles.
On compte environ 400 espèces anthropophiles et
zoophiles d'anophèles dans le monde. Mais seules 60 d'entre elles sont
des vecteurs du paludisme dans les conditions naturelles. Les mâles se
nourrissent uniquement de jus sucré, ils ne piquent pas. Les femelles
ont besoin de protéines pour assurer le développement de leurs
ovaires, elles le puisent dans le sang des vertébrés dont
l'homme. Seules les femelles sont donc capables de transmettre le paludisme.
(Gentilini M., 2009)
En Afrique tropicale les vecteurs majeurs sont :
anophèles gambiae qui est un complexe d'espèces :
· Anophèles arabiensis,
· Anophèles melas,
· Anophèles gambiae (SS)
· Anophèles funestus,
· Anophèles moucheti,
· Anophèles nili.
Le cycle sporogonique nécessite une température
de 15° C pour P. vivax et P. malariae et 22° C pour P. falciparum. La
température optimale se situe autour de 27° C pour P. ovale.
16
Au Sénégal, 20 espèces d'anophèles
sont actuellement connues. Mais les principaux vecteurs du paludisme sont
anophèles gambiae et anophèles funestus.
2. Réservoir de parasites
L'homme infecté et l'anophèle constituent les
réservoirs de parasites pour les principales espèces. Cependant,
P. malariae peut être retrouvé chez le singe.
3. Mode de contamination
Ils sont de trois ordres :
3.1.Transmission par piqûre d'anophèle
femelle infestée :
Elle est assurée par des anophèles femelles
anthropophiles âgés, porteurs de sporozoites dans leurs glandes
salivaires. Lors d'un repas sanguin chez un sujet infesté,
l'anophèle ingère en même temps les formes plasmodiales
infectantes. Ces plasmodies sont inoculées à un sujet sain lors
d'une nouvelle piqûre. Ce mode de transmission est le plus habituel.
(BRICAIRE F., et coll. 2009)
3.2.Transmission par transfusion sanguine ou
accident
Elle résulte de la transfusion de sang parasité
provenant de donneurs plus ou moins anciennement infestés apparemment
sains : c'est le « paludisme de seringue », rencontré chez les
malades transfusés, les toxicomanes.
3.3.Transmission congénitale
C'est la transmission de la mère à l'enfant par
le sang placentaire ; c'est e paludisme congénital. (BRICAIRE F., et
coll. 2009.)
4. Hôtes réceptifs
Tous les hommes sont réceptifs mais on observe une
résistance innée chez les sujets présentant des
antigènes DUFFY sur leurs hématies et chez les sujets
présentant une hémoglobinopathie de types S. (BRICAIRE F., et
col. 2009.)
5. Les facteurs favorisant la transmission 5.1.La
température
Le type classique est celui décrit dans la
physiopathologie du paludisme simple avec la triade successive :
frissons-chaleur-sueur accompagnés de fièvres
périodiques.
17
5.2.L'eau et humidité
Les eaux stagnantes constituent les gîtes larvaires. Les
pluies, en entretenant ces eaux, participent à la multiplication des
vecteurs et à l'endémie palustre. L'humidité influe
positivement sur la longévité du vecteur. (TRAPE J.F., et col.,
2000)
5.3.Les facteurs anthropiques
Des modifications du réseau hydrographique (barrage et
irrigations) entraînent la prolifération des vecteurs. Les
modifications des couverts végétaux, la déforestation,
favorisent la multiplication des espèces dans les mares
ensoleillées.
Le développement des transports, favorisant les mouvements
de population, entraîne une dissémination des vecteurs. Les
conditions socio-économiques défavorables, (promiscuité),
peuvent favoriser la transmission.
5.4.Les facteurs individuels
La grossesse : la diminution de
l'immunité au cours de la grossesse expose la femme enceinte à un
paludisme grave.
L'Age : les enfants de 0 à 5 ans sont
plus exposés du fait de leur immunité encore imparfaite.
La profession : toute profession exposant
l'homme à la maladie : médecins, infirmiers, sages-femmes,
techniciens de laboratoire.
I.2.5. MANIFESTATIONS CLINIQUES
Les manifestations cliniques du paludisme sont diverses dans leur
expression et de leur gravité. Elles dépendent d'une part de
l'espèce plasmodiale et de l'intensité de l'infection, d'autre
part de l'hôte et de sa prémunition. (DENIAU M., 2008)
1. Accès simple
Primo invasion : elle touche les sujets neufs non immuns et les
enfants vivant en zone d'endémie. L'incubation est silencieuse, dure 7
à 21 jours, mais elle peut atteindre 6 à 9 mois pour certaines
souches.
18
Dans la pratique, le paludisme simple ne manifeste pas
toujours de façon classique. Ses principaux signes en plus de la
fièvre sont :
? Frissons : myalgies
? Céphalées : douleurs abdominales
particulières chez l'enfant ? Courbatures : troubles digestifs
? Arthralgies.
2. Accès grave
Le neuropaludisme, fait partie des formes graves du paludisme,
il est dû essentiellement à P. falciparum. Il s'agit d'une urgence
médicale majeure pouvant mettre enjeu le pronostic vital surtout chez
l'enfant. On note une fièvre très élevée atteignant
40° C ou plus ; des troubles neurologiques réalisent typiquement le
tableau d'un coma fébrile d'intensité variable mais le plus
souvent calme. Des convulsions peuvent survenir
généralisées ou localisées à des troubles du
tonus, des manifestations psychiatriques peuvent être associées.
(GAYE O. et col., 2000)
L'OMS a défini des critères de gravité du
paludisme. La présence d'un seul de ces critères, clinique ou
biologique, associé à la présence de plasmodium falciparum
dans le sang, fait porter le diagnostic d'accès palustre grave.
Ces critères sont les suivants :
- Troubles de la conscience
- Convulsions répétées
- Détresse respiratoire
- Ictère (jaunisse)
- Hémoglobinurie macroscopique (urines
colorées en rouge)
- Défaillance cardiocirculatoire avec
collapsus circulatoire (baisse brutale et profonde de la
circulation avec risque d'arrêt cardiaque)
- OEdème pulmonaire (présence de
liquide dans le poumon)
- Anémie grave
- Hypoglycémie
- Acidose métabolique ou
hyperlactasémie
- Hyperparasitémie
-
Insuffisance rénale.
19
1. Cas particuliers
1.1.Paludisme de l'enfant
Le paludisme est la première cause de mortalité
infantile mondiale, la première cause des convulsions fébriles en
Afrique noire. Les accès sont fréquents jusqu'à
l'adolescence om les survivants prémunis. Le paludisme est toujours
potentiellement grave chez l'enfant. Le diagnostic, parfois difficile, doit
être envisagé devant tout syndrome fébrile. Le traitement
doit être urgent pour éviter l'évolution vers les
symptômes neurologiques graves pourvoyeurs de séquelles, et qui
peuvent évaluer vers la mort.
1.2.Paludisme de la femme enceinte
En zone d'endémie, le paludisme est le risque important
pour la femme enceinte, qui est susceptible surtout dans le dernier trimestre
de la grossesse. Les anémies maternelles sont fréquentes, mais
aussi la prématurité, le petit poids de naissance, les
avortements, la rétention d'oeuf mort, les hémorragies du post
partum et la transmission de l'enfant : c'est le paludisme congénital.
(PNLP, 2004)
I.2.6. DIAGNOSTIC BIOLOGIQUE
Le diagnostic de certitude du paludisme est apporté par
la mise en évidence du parasite dans le sang. (DENIAU M., 2008)
1. Diagnostic direct
Il se réalise par l'examen direct au microscope
optimale de prélèvement sanguins effectués de
préférence avant tout traitement antipaludique ; au moment des
pics fébriles. Les techniques les plus utilisées sont la goutte
épaisse et le frottis sanguins.
1.1.La goutte épaisse
Elle constitue l'examen de référence, c'est une
technique de concentration des parasites. L'examen se fait au microscope
optique à l'objectif 100 en utilisant de l'huile à immersion. La
numération se fait en comptant les parasites rapportés au nombre
de Leucocytes. L'examen peut mettre en évidence de faibles taux de
parasitémie. (DAVIS R., et Coll. 2002)
1.2.Le frottis sanguin
C'est l'étalement mince d'une goutte de sang
prélevée au doigt sur une lame de verre. L'examen se fait
après fixation à l'alcool et coloration au Giemsa. Il permet un
diagnostic
20
d'espèce plus précis mais ne permet pas de
dépister des parasitémies faibles. (DAVIS R., et Coll. 2002)
1.3.Quantitative Buffy Coat (QBC)
Cette méthode associe l'isolement des hématies
parasitées à une coloration par un fluorochrome (l'acridine
orange) à partir d'un prélèvement sur tube capillaire.
Elle a une sensibilité élevée mais ne permet pas une
identification précise des espèces plasmodiales ni une
numération parasitaire.
1.4.L'utilisation de la sonde à ADN
Elle permet de reconnaître dans un
prélèvement de sang, après marquage préalable par
un radioscope ou une enzyme, les fragments du génome du parasite.
(CHARMOT G., et col. 1993)
Ces méthodes permettent de faire un diagnostic rapide.
2. Diagnostic indirect
Ce sont des méthodes immunologiques. La présence
de plasmodium dans le sang provoque la formation d'anticorps dirigés
contre les antigènes du parasite. On peut ainsi titrer le complexe
antigène anticorps.
Ces différentes techniques sont : l'immunofluorescence
indirectes, l'hémagglutination indirecte, le test Elisa,
l'immunochromatographie. (DURARDIN, 2013)
2.1.Test Elisa (Enzyme Linked Immuno Sorbent
Assy)
Ce test utilise des anti globulines conjuguées pour
mettre en évidence la présence d'anticorps spécifiques
antiparasitaires.
2.2.Les tests rapides de diagnostic
Le test de détection de l'Histidim Rich Protein2
(HRP-2). Un test rapide manuel et spécifique de P. falciparum. Il est
basé sur la détection de l'Histidim Rich Protein2 (HRP-2) qui est
une glycoprotéine spécifique de P. falciparum. Il s'agit d'un
antigène soluble dont la sécrétion est constante tout au
long du cycle érythrocytaire du parasite.
21
I.2.7. TRAITEMENT
1. Pour le paludisme simple
Les combinaisons thérapeutiques à base
d'Artémisinine (CTA) comme médicaments de première
intention : Artésunate+Amodiaquine (AS-AQ) ou
Artéméther+Luméfantrine (AL). La quinine en
comprimé associée à la Clindamycine ou la Doxycycline est
réservée aux cas de contre-indication ou de l'indisposition des
CTA. Il est nécessaire de tenir compte des contre-indications à
la Doxycycline et à la Clindamycine. (PNLP, 2018)
2. Si échec thérapeutique
À une de deux CTA recommandées par le PNLP :
administrer l'autre CTA non prescrit ou si contre-indication des CTA ou
indisponibilité, prescrire la Quinine associée à la
Clindamycine (excepté chez les enfants de moins de 1 mois). (PNLP,
2018)
3. Pour le paludisme grave
Artésunate injectable en IV de
préférence ; IM si IV impossible. Si contre-indication de
l'Artésunate, prescrire l'Artéméther IM ou la Quinine en
perfusion. (PNLP, 2018)
4. Pour le traitement de
pré-référence :
S'il est probable que le temps devant s'écouler entre
la décision de transférer le patient et le traitement
définitif soit ?6h, administrer l'un des médicaments suivants
:
? Artésunate par voie rectale (10 mg/kg) chez les enfants
de moins de six ans,
? Artésunate IM, 2,4 mg/kg si impossibilité de la
voie rectale et chez les enfants de plus de six ans.
? Artéméther IM, 3,2 mg/kg ; puis
transférer immédiatement le patient vers l'établissement
qui convient pour poursuivre le traitement.
5. Traitement de relais du paludisme grave :
Si le patient est capable de boire sans vomir, alors passer
à la voie orale :
Pour les patients soignés par Artésunate par
voie IV ou IM, le relais se fait avec une CTA (AS-AQ ou AL) aux doses
recommandées pendant 3 jours ;
? Pour les patients ayant reçu la Quinine en perfusion,
le relais se fait avec la Quinine per os associée à la
Clindamycine Chlorhydrate (excepté chez les enfants de moins de 1 mois)
pour atteindre 7 jours ou avec une CTA (AS-AQ ou AL) aux doses
recommandés pendant 3 jours. (OMS, 2015)
22
6. Pour le paludisme chez la femme enceinte :
La femme enceinte fébrile doit être
considérée comme une urgence et un cas particulier : sa prise en
charge doit se faire au niveau d'un Centre de Santé-Maternité,
d'un Centre de Santé de Référence ou d'un Hôpital
(à tous les niveaux).
Il faut vérifier l'existence des contractions
utérines et donner si nécessaire un tocolytique selon l'âge
de la grossesse (1er trimestre : papavérine, diazépam.
2ème et 3ème trimestre : Phloroglucinol, salbutamol ou
diazépam). Il faut baisser la fièvre avec le
paracétamol.
> Au premier trimestre de la grossesse : devant l'absence
d'une autre alternative (les CTA étant contre-indiquées), on
prescrit la Quinine en comprimé + Clindamycine dans la forme sans
complications et Quinine en perfusion dans la forme compliquée
> Au 2e et 3e trimestre : CTA pour le Paludisme non
compliqué et Artésunate injectable en cas de paludisme
compliqué. La Quinine en perfusion sera prescrite en cas de
contre-indication ou indisponibilité de l'Artésunate. (PNLP,
2015)
I.2.8. PROPHYLAXIE
Le but de la prophylaxie antipaludique est de prévenir
le paludisme chez un sujet sain, donc l'idéal est d'éviter
l'infestation par le paludisme en se protégeant au maximum contre les
piqures de moustique et/ou en prenant une chimioprophylaxie adéquate.
(COULAUD J.P.,2007)
1. Protection contre les moustiques
a. Réduction de la densité de
moustiques
Une lutte anti larvaire est bénéfique quand les
gîtes sont limités en nombre, facilement identifiables et faciles
d'accès. Les méthodes utilisées dans la lutte antilarvaire
se classent en quatre catégories
:
> L'aménagement de l'environnement : travaux de
drainage et l'hygiène péri domestique ; > La lutte chimique :
la plus utilisée, traitement des gîtes larvaires avec des
insecticides chimiques ;
> La lutte biologique : utilisation de prédateurs ou
de bactéries entomopathogènes exemple Bacillus thuringiensis
(Bti).
> La lutte génétique : réduction de la
densité des populations de moustiques par modification de leur
patrimoine génétique ou par leur autodestruction. Elle concerne
essentiellement le lâcher de mâles stériles dans certaines
régions bien délimitées. (COULAUD J.P.,2007)
23
b. Réduction du contact Homme-vecteur 2.
Moustiquaires imprégnées d'insecticides
Bien que les moustiquaires non traitées soient depuis
longtemps utilisées pour se protéger des piqûres de
moustiques, l'avènement de moustiquaires imprégnées
d'insecticides a considérablement augmenté leur
efficacité, ajoutant à l'effet de barrière physique, un
effet répulsif et létal vis-à-vis des moustiques. En
effet, l'effet répulsif des pyréthrinoïdes empêche le
moustique de se gorger au travers de la moustiquaire et d'y
pénétrer lorsque celles-ci sont trouées après un
certain temps d'utilisation. L'effet létal sur les moustiques est
important mais variable selon l'insecticide choisi et l'espèce cible.
L'utilisation de rideaux imprégnés peut également
constituer une méthode complémentaire aux moustiquaires
imprégnées.
2.Répulsifs cutanés : Ce sont
des produits qui éloignent les moustiques sans toutefois les tuer, la
durée d'efficacité est au moins six heures s'ils sont
utilisés à des concentrations suffisantes. Actuellement,
l'Afssaps (Agence française de sécurité sanitaire des
produits de santé) a donné un avis favorable uniquement pour des
produits utilisant comme principe actif un des quatre répulsifs de
synthèse suivants :
· Diéthyltoluamide, ou DEET,
· P-Menthane-3,8 diol, ou citriodiol,
· Icaridine, ou KBR 3023,
· Ethyl-butyl-acetyl-amino-propionate, ou JR 3535. Les
critères de choix doivent se faire selon la substance active, son
dosage, l'âge des utilisateurs et selon l'état physiologique
(grossesse, allaitement). (LOZANO F. et Col., 1983)
I.3. TEST DE DIAGNOSTIC RAPIDE DU PALUDISME
(TDR)
En raison des résistances du plasmodium aux
antipaludéens, l'OMS recommande désormais l'usage de combinaisons
thérapeutiques à base d'artémisinine (ACT). Cette prise en
charge médicamenteuse doit être fondée sur la mise en
évidence préalable de l'agent pathogène par un diagnostic
biologique (OMS, 2011). Ainsi, les tests en routine chez tous les patients
suspectés de paludisme dans les zones endémiques sont
recommandés par l'OMS (Abba et col, 2011). Le diagnostic biologique est
basé sur la détection du parasite par la goutte épaisse.
Cependant, compte tenu de la relative disponibilité des microscopes et
du personnel qualifié dans les formations sanitaires de base, l'OMS
recommande depuis 2004, l'utilisation des tests de diagnostic rapide (TDR)
24
par détection d'antigène ; ceci en vue de
remplacer le diagnostic présomptif par le diagnostic biologique et de
parvenir ainsi à améliorer la qualité des soins. (Abba et
col, 2011).
I.3.1. Matériels et réactif de
laboratoire
1. Sachets de test de diagnostic rapide (TDR) ;
2. Gants jetables ;
3. Tampons imbibés d'alcool : ils sont souvent compris
dans chaque boîte de TDR. Si on ne dispose de tampons imbibés
d'alcool, il est également possible d'utiliser du coton hydrophile des
flacons d'alcool ou de tout autre désinfectant approprié, mais
les tampons préemballés sont plus faciles à manier et sont
plus pratiques.
4. Lancettes stériles jetables : elles sont souvent
comprises dans chaque boîte de TDR, ou bien elles peuvent être
obtenues séparément ;
5. Solution tampon : elle est fournie avec le TDR par le
fabriquant ;
6. Conteneur à aiguilles ;
7. Simple poubelle : une poubelle est nécessaire pour
se débarrasser des gants, des cassettes des tests, des emballages, des
tampons et de déchets non piquants/non coupants ;
8. Chaises et tables ;
9. Planches en couleur et Quiz sur le TDR : la planche en
couleur illustrant les résultats des TDR, de Quiz sur les TDR et des
fiches d'instructions relatives aux TDR. (OMS, 2010)
I.3.2. Principes
Les TDR sont un moyen de déterminer si une personne
présentant les symptômes du paludisme a effectivement la maladie.
Le paludisme est provoqué par un parasite qui infecte les cellules
sanguines. C'est le parasite qui provoque la fièvre et d'autres
symptômes habituels du paludisme. Les parasites du paludisme produisent
des substances chimiques (protéines) appelées antigènes.
Les TDR détectent ces antigènes du paludisme dans le sang d'une
personne. Si les antigènes du paludisme sont présents, le test de
la personne sera positif ; si les antigènes du paludisme ne sont pas
présents, le test de la personne sera négatif. Différents
types de TDR détectent différent antigènes. Certains
antigènes sont produits par une seule espèce du parasite
responsable du paludisme (par exemple : plasmodium falciparum), certains sont
produits par toutes les espèces de parasite responsable du paludisme
(notamment P. vivax, P. ovale et P. malariae), s'ils sont présents, les
antigènes font des particules microscopiques et se collent à
une
- Port d'une paire de gants : pour
protéger les agents de santé et les patients contre une infection
éventuelle par des maladies propagées par le sang, notamment le
VIH/SIDA ;
25
bande sur le TDR, formant par la suite une ligne
colorée visible dans la fenêtre « test ». (OMS, 2010)
I.3.3. Limites du TDR
Le TDR est très efficace pour diagnostiquer le
paludisme mais il y a certaines choses qu'il ne peut pas faire :
· Le TDR ne peut pas déterminer la
quantité de parasites du paludisme présents dans le sang. Il ne
peut que déterminer la présence ou l'absence de parasites dans le
sang.
· Le TDR ne détecte pas les parasites proprement
dits. Il détecte les antigènes des parasites. Certains
antigènes de parasites (par ex. le protéine-2 riche en histance,
ou HRP2) peuvent rester dans le sang pendant encore deux semaines au moins
après l'élimination des parasites par les médicaments. Le
TDR qui détecte la HRP2 ne peut être utilisé pour
vérifier l'efficacité du traitement car une personne ayant eu un
médicament antipaludique au cours des deux semaines
précédentes aura un résultat positif ou test, même
si cette personne n'est plus porteuse de parasites. (OMS, 2010)
I.3.4. Avantages du test de diagnostic
rapide
· Le test de diagnostic rapide permet d'administrer un
traitement spécifique dans un court délai. Ceci est surtout
important pour les maladies rapidement fatales.
· Le TDR peut être utilisé de façon
séquentielle au lit du malade. Ceci permet de diminuer le nombre et,
ainsi, le coût des investigations.
· Il est utile de » connaître la
probabilité prétest pour une utilisation rationnelle du TDR
· Le clinicien doit connaître les performances des
tests pour inclure ou exclure une maladie. (J. Maslin et coll., 2009)
I.3.5. Mode opératoire
Regrouper toutes les fournitures dont on voir besoin : un
nouveau sachet de test, non ouvert, un nouveau tampon imbibé d'alcool
(non ouvert), une nouvelle lancette stérile non ouverte, de la solution
tampon, une nouvelle paire de gants d'examen jetables, une montre ou une
pendule qui servira à minuter, une boîte pour évacuer les
déchets : tranchants/pointus, une poubelle pour les déchets non
pointus/tranchants.
26
- Ouvrir le sachet du test et sortir le
contenu : l'instrument de prélèvement (tube capillaire, pipette,
anse de prélèvement, auto piqueur ; sont utilisés pour
prélever le sang et pour déposer le sang dans la cassette du
test.
- L'alvéole carré
marquée de la lettre A est celle dans laquelle on ajoute le sang ;
- L'alvéole circulaire marquée
de la lettre B est celle dans laquelle on ajoute la solution tampon.
- L'alvéole rectangulaire
séparé en deux parties est la fenêtre de lecture des
résultats du test. La partie la plus grande portant la lettre « T
» est l'endroit où on détermine le diagnostic. La partie la
plus petite portant la lettre « C ». Permet de vérifier que le
test fonctionne correctement ; une ligne rouge doit apparaître dans cette
alvéole pour que le test soit valable. Si aucune ligne n'apparait pas
dans cette alvéole, le test ne fonctionne pas correctement et les
résultats sont invalides ;
- Ecrire le nom du patient sur la cassette
pour ne pas confondre les résultats d'une personne avec ceux d'une autre
;
- Ouvrir le tampon imbibé d'alcool et
nettoyer le 4ème doigt du patient : on préfère
le 4ème doigt car, chez la plupart des gens, c'est le doigt qui est le
moins utilisé. Le 4ème doigt de la main gauche pour un
droitier et le 4ème doigt de la main droite pour gaucher.
Après avoir désinfecté le doigt avec le tampon
imbibé d'alcool, on le laisse sécher à l'air libre et ;
- Une fois que le doigt du patient est sec,
on ouvre le sachet de la lancette : piquer le doigt du patient, de
préférence vers le coté de la pulpe du doigt. S'assurer
que la piqûre donnera suffisamment le sang, jeter ensuite la lancette
dans la boîte à aiguilles après utilisation. (OMS, 2010)
Instrument de prélèvement du
sang
- Tube capillaire : s'assurer qu'il y a une
goutte conséquente sur le doigt avant de procéder à
l'aspiration. Aspirer jusqu'à la marque, ne jamais soulever
l'extrémité du tube pour éviter l'introduction de bulles
d'air.
- Anse de prélèvement : presser
le bout du doigt jusqu'à ce qu'une goutte de sang se forme, utiliser
l'anse pour prélever la bonne quantité de sang.
27
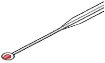
- Pipette : prélever le sang sur le
doigt, la main étant tournée paume vers le haut. Il ne doit
y avoir qu'une mince épaisseur de sang sur l'ouverture
de la pipette. Ne jamais soulever l'extrémité de la pipette pour
éviter l'introduction de bulles d'air.
- Auto piqueur : prélever le sang
jusqu'à la première marque.

- Utiliser l'instrument de
prélèvement pour placer la goutte de sang dans l'alvéole
destinée à recevoir la goutte de sang (alvéole
carrée marquée par la lettre A) : le sang doit être en
contact avec la solution tampon au fond de l'alvéole et qu'il doit
être absorbé par la solution tampon.
Introduire le sang dans l'alvéole
- Le tube capillaire doit toucher le fond et
y rester jusqu'à ce que le sang soit sorti du tube. -
La pipette : transférer le sang dans la cassette de test, en
mettant bien l'extrémité de la pipette au contact du
spécimen.
- L'anse de prélèvement : un
moyen très simple de déposer le sang au bon endroit consiste
à enfoncer l'anse bien verticalement dans l'alvéole
jusqu'à ce que son extrémité touche le tampon, puis,
enfoncer délicatement pour faire ployer l'extrémité de
l'anse pour que la plus grande part de sa surface puisse toucher le fond.
- Auto piqueur : transférer le sang
dans la cassette de test en plaçant bien son embout au contact du
spécimen et en pressant doucement la partie renflée.
- Ajouter la solution tampon dans la cassette
(alvéole ronde marquée par la lettre B) : compter les gouttes qui
tombent dans la cassette (quatre gouttes), attendre 15 minutes après
l'ajout de la solution tampon avant de lire les résultats.
- Enlever et jeter les gants à ce
stade.

28
I.3.6. Lecture des résultats des tests
Résultat positif : une ligne rouge
dans la fenêtre de Contrôle (C) et une ligne rouge
dans la fenêtre de Test (T) ; si des lignes rouges
apparaissent dans les deux fenêtres, le résultat est positif
même si la ligne de Test est très fine.
Résultat négatif : une ligne rouge
dans la fenêtre de Contrôle (C) et pas de ligne
dans la fenêtre de Test (T).
Test valides : Apparition d'un trait rouge
à la zone de contrôle (C)
Test invalide : pas de ligne dans la
fenêtre de Contrôle (C) et pas de ligne dans la
fenêtre de Test (T) ou une ligne dans la fenêtre
(T). En cas de résultat invalide ;
répéter le test en utilisant un nouveau TDR.

La sensibilité et la spécificité
du test : la sensibilité et la spécificité de
tous les TDR sont telles qu'ils peuvent remplacer les services de diagnostic ou
élargir la couverture diagnostique dans le paludisme à P.
falciparum non compliqué. Les tests utilisant l'anticorps anti-HRP-2
pourraient être plus sensibles mais sont moins spécifiques que les
tests utilisant l'anticorps anti-LDHp, sachant toutefois que les
différences sont minimes après un traitement efficace et ne peut
donc pas être utilisé pour détecter les échecs du
traitement.
? Sensibilité : les tests basés
sur la HRP-2 tendent à être plus sensible. Ils identifient le cas
réel de paludisme. PfHRP2 (95%) ? PfLDH (93%). (S.
Larréché, 2012)
? Spécificité : ils rendent de
résultats faussement positifs. Les tests basés sur la LDHp.
PfHRP2 (95%) ? PfLDH (98%). (S. Larréché, 2012).
29
Chapitre deuxième : PRESENTATION DU MILIEU
D'ETUDE
II.1. CADRE DE RECHERCHE
Notre étude a été réalisé au
centre de santé de référence TEGRA de Kilobelobe
II.2. SITUATION GEOGRAPHIQUE
Le Centre de santé de référence TEGRA
ONGD est situé en République Démocratique du Congo, dans
la province du Haut-Katanga, la ville de Lubumbashi, commune Annexe, dans le
quartier Naviundu, sur l'avenue de l'espérance N°01. Dans la zone
de santé Kampemba, dans l'aire de santé Kilobelobe.
II.3. DELIMITATION
Le centre de santé de référence TEGRA ONGD
est limité :
- Au nord par l'aire de santé saint Abraham - Au sud par
l'aire de santé Kamasaka - A l'Est par le centre de santé La
Charitable - A l'Ouest par la rivière Naviundu
II.4. HISTORIQUE
TEGRA ONGD du temps de grâce est une organisation
née de la cohésion d'idées de huit associés d'une
camaraderie de longue date, issus de deux principales cellules pionniers : la
famille (Sainteté) qui avait pour devise : Tous pour un et un pour tous
» et les Jeunes Elites du Renouveau, JELIR en sigle, Solidarité
dans le travail et persévérance dans la lutte (pour le
développement).
II.5. ORGANISATION DU CSR TEGRA
TEGRA ONGD est une organisation non gouvernementale de
Développement, une Association sans but lucratif, agrée,
d'utilité publique, apolitique et non confessionnelle au service de
l'humanité depuis 2009, engagé dans la lutte contre les facteurs
du sous-développement et a pour objectif le bien être en
général :
- La santé humaine - L'éducation
- L agropastoral
30
TEGRA ONGD est composée de trois organes :
1) L'Assemblée générale qui est l'organe
décisionnaire suprême
2) Le comité de gestion qui est chargé de
l'administration
3) Le comité de contrôle qui assure le suivi et
l'évaluation des activités et la gestion de conflits
Membres Fondateurs
1) DANIEL NGOY : Président
2) KAYANDA NGOMBE : Vice-président
3) SERGES NGOY : Sec. Exécutif
4) PANDA RUTH : Sec. Exécutif adjointe
5) NGOIE Angelani : Trésorière
6) KABONDO MUKANYA : Chargé de suivi
7) MUTEBA ANTOINE : Chargé de suivi
8) MUFINDO ALPHONSE : Chargé de suivi
31
II.6. ORGANIGRAMME DU CENTRE DE SANTE DE REFERENCE
TEGRA
CHEF DU PROJET
MEDECIN DIRECTEUR
IT

CHIRURGIE
PHARMACIE
LABORATOIRE
PEDIATRIE
MEDECINE
INTERNE
ECHO et
RADIO
GYNECHOLOGIE
MATERNITE
|
CPN, CPON, CPS, PTME et
PF
|
FEMMES
MENAGERES
32
Chapitre troisième : METHODE DU
TRAVAIL
III.1. Population et échantillon
La population d'étude était constituée
des personnes consultées pour le paludisme et qui étaient soumis
aux tests de diagnostic rapide du paludisme au centre de santé de
référence Tegra ONGD de Kilobelobe en 2020 ; au total, nous avons
trouvé 826 personnes (malades) consultées pour l'année
2020.
Notre population source était constituée de tous
les habitants de la zone de santé Kampemba et de ses environs, dans
laquelle un échantillon a été tiré
aléatoirement.
Notre taille d'échantillon était de 100
personnes malades, consultés au centre de santé de
référence Tegra ONGD durant l'année d'étude et qui
ont été sélectionnées suivant les critères
de sélection. Comme technique, nous avons procédé par la
numérotation de chaque fiche des patients et nous sommes passés
au pas de sondage à 8, pour obtenir le nombre des fiches des malades qui
ont été dretenus pour notre étude.
? Critères d'inclusions : Ont
été inclus dans notre étude, tous les patients se
présentant au service de consultation pour le problème de
paludisme au CSR Tegra ONGD durant l'année 2020, et qui ont
répondu aux critères d'éligibilité, surtout ceux
qui ont subi au départ le TDR.
? Critères d'exclusions : Ont
été exclus dans notre étude, tous les patients ayant
fréquentés le CSR Tegra ONGD pour d'autres motifs que le
paludisme, et ceux qui n'ont pas répondu à nos critères
d'éligibilité surtout ceux n'ayant pas subi le TDR.
III.2. Type d'étude
Pour ce travail, nous avons recouru à la méthode
d'observation descriptive transversale allant du 01 janvier au 30 septembre
2021, au centre de santé de référence Tegra ONGD de
Kilobelobe.
III.3. Technique de collecte des
données
Dans le cadre de notre étude nous avons recouru
à la technique d'observation documentaire, par celle-ci nous avions
dû recourir aux registres de consultation curative, aux fiches de
consultation et aux registres du laboratoire.
33
III.4. Variables utilisées
Les variables recherchées lors de cette collecte des
données sont les suivantes :
Variables liées aux caractéristiques
socio démographiques : sexe, âge, Etat matrimonial,
profession, commune de résidence.
Variables liées à l'offre des soins
: motif de consultation, complications du paludisme (simple, grave ou
de la femme enceinte), manifestations cliniques si paludisme simple,
manifestations cliniques si paludisme grave, examen réalisé,
résultat obtenu au TDR, prise en charge pour le paludisme simple et
grave et enfin l'issu du malade.
III.5. Procédés d'analyse des
données
Les données récoltées ont
été encodées, traitées et analysées avec le
logiciel Excel version 10, il nous a aidé dans la présentation
des tableaux et des figures et le logiciel Epi-Info version 7.2. nous a
aidé dans le calcul de tranche d'âge.
Ainsi, les résultats ont été
présentés sous la forme de tableau et de figure. III.6.
Considérations éthiques
Pour réaliser la présente étude, nous
avons aussi au préalable sollicité et obtenu le consentement
éclairé de l'infirmier titulaire et les techniciens de
laboratoire qui, d'ailleurs étaient libre de participer à
l'étude, nous avons aussi taché de respecter le principe de la
bienfaisance. L'anonymat et la confidentialité des informations
recueillies leur a été garanties.
34
Chapitre quatrième : RESULTATS
Tableau I : Répartition des patients selon le
sexe
|
Sexe
|
|
Fréquence Pourcentage
|
|
Féminin
|
58
|
58%
|
|
Masculin
|
42
|
42%
|
|
Total général
|
100
|
100%
|
Ce tableau indique que 58 % des patients étaient de sexe
féminin contre 42 % de sexe masculin. Tableau II :
Répartition des patients selon les tranches d'âge
|
Tranche d'âge
|
Fréquence
|
Pourcentage
|
|
?1-5 ans
|
10
|
10%
|
|
?6-10 ans
|
18
|
18%
|
|
?11-15 ans
|
10
|
10%
|
|
?16-20 ans
|
11
|
11%
|
|
?21-25 ans
|
8
|
8%
|
|
?26-30 ans
|
17
|
17%
|
|
?31-35 ans
|
12
|
12%
|
|
?36-40 ans
|
3
|
3%
|
|
?41+
|
11
|
11%
|
|
Total général
|
100
|
100%
|
Au regard de ce tableau ci-dessus, notre étude montre
que la tranche d'âge la plus représentée était de
6-10 ans avec 18 patients soit 18% des cas. Contrairement à celle de
36-40 ans qui n'avait que 3 % des cas.
35
Tableau III : Répartition des patients selon
l'Etat civil
|
Statut matrimonial
|
|
Fréquence
|
Pourcentage
|
|
Célibataire
|
52
|
52%
|
|
|
Marié (e)
|
46
|
46%
|
|
|
Veuf (ve)
|
2
|
2%
|
|
|
Divorcé (e)
|
0
|
|
0%
|
|
Total général
|
100
|
100%
|
|
Ce tableau nous renseigne que 52 % des patients étaient
célibataires, 46 % des patients étaient des mariés, 2 %
étaient veufs et nous n'avons enregistré aucun cas de divorce.
Tableau IV : Répartition des patients selon la
profession
|
profession
|
|
Fréquence Pourcentage
|
|
Chômeur
|
2
|
2%
|
|
Apprenant
|
37
|
37%
|
|
Libéral
|
13
|
13%
|
|
Ménagère
|
11
|
11%
|
|
Travailleur
|
33
|
33%
|
|
Autres
|
4
|
4%
|
|
Total général
|
100
|
100%
|
Le tableau ci-haut nous montre que sur 100 patients, 37 %
d'entre eux étaient des apprenants, 33 % des travailleurs, 13 %
étaient dans le libéral et 2 % seulement des chômeurs.
36
La figure ci-dessous nous montre que la majorité des
patients provenaient de la commune de Kampemba au taux de 54 % des cas.

22%
54%
24%
ANNEXE KAMPEMBA LUBUMBASHI
Figure 1 : Répartition des patients selon la
commune de résidence.
Tableau V. Répartition des patients selon le motif
de consultation.
|
motif de consultation
|
|
Fréquence Pourcentage
|
|
Céphalée
|
19
|
19%
|
|
Convulsion
|
5
|
5%
|
|
courbatures
|
21
|
21%
|
|
Fièvre associée
|
43
|
43%
|
|
Fièvre
|
12
|
12%
|
|
Total général
|
100
|
100%
|
Ce tableau indique que la majorité des patients avaient
été consultés pour la fièvre associée au
taux de 43 %, 21 % des douleurs articulatoire ou musculaire et des courbatures
et 5% seulement de convulsion.
37
Tableau VI : Répartition des patients selon la
complication lors de la consultation
Complications lors de la consultation Fréquence
Pourcentage
Paludisme de la Femme enceinte 16 16%
Paludisme grave 7 7%
Paludisme simple 77 77%
Total général 100 100%
Au vu de ce tableau nous voyons que, 77 % des malades avaient
une forme simple du paludisme et 7 % seulement avaient présenté
une forme grave.
La figure ci-dessous nous indique que 75 % des patients
avaient subi le TDR, et 1 % n'a subi aucun
test.
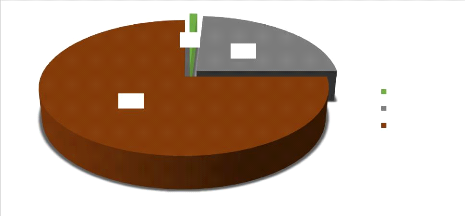
75%
1%
24%
SYMPTOMATIQUE GE
TDR
Figure 2 : Répartition des patients selon les
examens réalisés.
38
Tableau VII : Répartition des patients selon les
résultats de TDR
Résultat au TDR Fréquence Pourcentage
Invalide 1 1,33%
Négatif 11 14,67%
Positif 63 84%
Total général 75 100%
Il ressort de ce tableau que 84 % des malades avaient un TDR
positif et 1,33% des cas avaient un test invalide.
La figure ci-dessous montre que 92 % des cas étaient
positifs à la GE et 8 % étaient négatifs.

92%
8%
NEGATIF POSITIF
Figure 3 : Répartition des patients soumis
à la GE selon leurs résultats.

2%
95%
3%
DECES GUERIS
PERDU DE VIE
Figure 4 : Répartition des patients selon
l'issu.
39
Tableau VIII : Répartition des patients selon la
prise en charge médicamenteuse
|
Prise en charge
|
Fréquence
|
Pourcentage
|
|
Artemether
|
26
|
26%
|
|
Artemether + cefatax
|
6
|
6%
|
|
Artemether + luméfantrine
|
7
|
7%
|
|
Artesunate
|
3
|
3%
|
|
Artesunate+amodiaquine
|
10
|
10%
|
|
Artesunate + luméfantrine
|
33
|
33%
|
|
Dimarteme
|
3
|
3%
|
|
Mefloquine
|
3
|
3%
|
|
Quinine en perfusion
|
2
|
2%
|
|
Quinine+ cefatax
|
1
|
1%
|
|
Quinine + clindamycine
|
5
|
5%
|
|
Quinine + vitamine Bc
|
1
|
1%
|
|
Total général
|
100
|
100%
|
Ce tableau nous renseigne que la majorité des patients a
été traité à l'artesunate + luméfantrine au
taux de 33 %, et 1 % à la quinine associée au cefatax ou à
la vitamine B complexe.
La figure ci-dessous nous montre un taux de guérison
à 95 %, et 2% seulement de décès.
40
DISCUSSIONS
Dans notre étude nous avons trouvé qu'une grande
proportion des patients était de sexe féminin avec un taux de 58
% et 42 % des hommes, soit un sex-ratio (F/M) de 1,4 ; nos résultats
sont presque les mêmes avec ceux trouvés par Norbert TANKE au
Cameroun en 2012, qui a trouvé 56 % des sujets de sexe féminin
contre 44 % de sexe masculin, soit un sex-ratio de 1,3 ; ceci pourrait
s'expliquer par le fait que les femmes sont les cibles majeures du
paludisme.
Les patients dont l'âge variait entre 6-10 ans
étaient plus touchés par le paludisme (18 %). Cette tranche
d'âge est suivie par celle comprise entre 26-30 ans avec 17 %. Cette
représentativité de la tranche pédiatrique dans cette
étude pourrait s'expliquer par le fait que les parents seraient plus
enclins à les amener à la consultation dès l'apparition
des symptômes, par contre, ils préfèrent se tourner vers
d'autres solutions (automédication) pour les plus grands et
eux-mêmes. Ce résultat est presque similaire à celui de
Davos SANGBA à Lubumbashi en 2010, qui dans son étude avait
trouvé que la tranche d'âge comprise entre 13-25 ans était
prédominante avec un taux de 22%.
Quant à l'Etat civil, Dans cette étude nous
avons trouvé 52 % des patients célibataires, 46% des
mariés. Contrairement à une étude similaire faite par Amos
au Mali en 2006, où les patients en union représentaient 57% dans
sa population d'étude.
Dans l'ensemble des cas observés de paludisme, seule la
commune de Kampemba a une fréquence élevée de 54% soit 54
sur 100 cas. Ceci s'explique par le fait que le milieu de recherche est
situé dans la commune même de Kampemba. Mais pour WULA J. (UNILU)
lui a spécifié que seule la commune de Lubumbashi avait 55 cas
sur 150 (2014) à l'hôpital général de
référence SENDWE, chez les enfants dans la ville de
Lubumbashi.
Par rapport à la profession, nos résultats
montrent que 33 % des patients étaient encore aux bacs de
l'école, de même que Faye A. au Sénégal (2015) avait
trouvé 39 % des apprenants, 2 % des chômeurs. Ces résultats
viennent confirmer l'idée selon laquelle, le taux de chômage en
RDC est de 3,7% et à l'Equateur 1,4% (PNUD 2009). Et l'EDS 2013-2014 a
montré que la province du Haut-Katanga dans son ancienne configuration
(Province du Katanga) avait un taux de chômage de l'ordre de 4% pour les
femmes et de 6,2% pour les hommes et dans le pays 4,6% pour les femmes et 7,9%
pour les hommes (Minisanté RDC et Miniplan, 2014). Mais ces
résultats sont contraires avec ceux trouvés par Djeutchouang S.
au Cameroun (2010) qui avait trouvé 21 % des chômeurs.
41
Concernant le motif de consultation, la fièvre
associée à d'autres signes (céphalée, courbature,
douleur abdominale) a été trouvée comme signe
prédominant du paludisme avec un taux de 29 %, une étude
similaire à celle réalisée par WULA Joseph à
Lubumbashi (2018) qui avait trouvé 32 % de la fièvre
associée, alors que Norbert TANKE au Cameroun (2012) lui avait
trouvé plus de la moitié des patients (56 %) présentaient
la fièvre seule. Ceci se justifie du fait que la fièvre a
toujours été considérée comme signe majeur du
paludisme.
Pour ce qui concerne la complication lors de la consultation,
nous avons constaté une forte représentativité du
paludisme simple de 77 %, quoi que plus proche de nos résultats, une
étude de Bahati MBUKEYI à Bukavu (2019) rapporte une proportion
de 70 % de forme simple du paludisme, des résultats quasi contraires
à ceux rapportés par Liliane T. à Kinshasa (2015) qui
avait parlé du paludisme chez la femme enceinte, l'auteur avait
trouvé 78% de paludisme de forme grave, cela peut trouver une
explication du fait que les femmes enceintes sont les cibles du paludisme.
Par rapport au test utilisé, l'étude montre que
le TDR a été beaucoup plus utilisé que la GE, 75% contre
24% pour la GE. Cette observation rejoint le constat fait dans l'étude
de Norbert TANKE au Cameroun (2012) qui trouva 66 % d'utilisation du TDR. Ces
proportions d'utilisation du TDR peuvent s'expliquer par le fait que le test de
diagnostic rapide est relativement facile à exécuter, à
interpréter des résultats et a un faible coût. Dans notre
étude, 84 % des patients testés au TDR ont donné un
résultat positif ; Kiniffo et coll. en 2011au Bénin a noté
aussi que le TDR était utilisé à 88 %. Une étude de
KROEGER au Sénégal (2006) rapporte une proportion de la GE
à 74,8%, tandis que dans notre étude, nous avons trouvé
92% des cas avaient un test positif à la GE.
Concernant la prise en charge des patients, l'étude
montre que la majorité des patients étaient traités
à l'artesunate + luméfantrine représentant une proportion
de 33% ; cette observation corrobore avec celle de Liliane T. à Kinshasa
(2015) qui avait trouvé une proportion de 37% des patients
traités à l'artesunate + luméfantrine. Mais l'étude
de Bahati MBUKEYI à Bukavu (2019) montre 50% de prise en charge des
patients à la Quinine. A ce qui concerne l'issu de traitement dans notre
étude, 95 % des patients sont sortis guéris et 3% seulement de
décès, ces résultats se rapprochent à ceux
rapportés par WULA Joseph à Lubumbashi (2018) 87,3% des
guéris et 12,6 des décès ; par contre l'étude
présentée à LOME a montré 31,7% d'enfants
étaient morts au cours de la première année et 7,2 % des
décès dus au paludisme grave.
42
CONCLUSION ET SUGGESTIONS
1. CONCLUSION
Cette étude a porté sur le test de diagnostic
rapide du paludisme, les résultats et prise en charge des patients au
centre de santé de référence Tegra ONGD de Kilobelobe.
L'objectif principal était de promouvoir une meilleure prise en charge
du paludisme par le test de diagnostic rapide. Et d'une manière
particulière de déterminer la proportion des patients
testés aux TDR ; de déterminer les résultats du test ;
évaluer la prise en charge adaptée. Pour atteindre ces objectifs,
une étude d'observation descriptive transversale a été
menée, allant du 01 janvier au 30 septembre 2021, au centre de
santé de référence Tegra ONGD de Kilobelobe. Dont les
renseignements ont été recueillis dans les registres de
consultation curative, sur les fiches des malades et aussi sur les fiches de
laboratoire. Après analyse, nous avons obtenu les résultats
suivants :
? 77% des patients souffraient du paludisme simple, 16% du
paludisme de la femme enceinte et 7% de forme grave ;
? Sur 100 patients retenus dans notre étude, 75 d'entre
eux ont été examinés au test de diagnostic rapide, dont
84% des patients avaient des tests positifs ; 24 à la goutte
épaisse dont 92% des patients avaient des tests positifs à la
GE.
? 33% des patients ont été traités
à l'artesunate et à luméfantrine, ce qui nous permet de
dire que la structure respecte le protocole national de prise en charge du
paludisme ; pour confirmer cela, 95% des patients étaient guéris
et seulement 3% décès.
Ainsi donc, nous pouvons nous permettre de dire que le test de
diagnostic rapide doit être considéré comme un moyen pour
la bonne prise en charge du paludisme au centre de santé de
référence Tegra ONGD et la goutte épaisse est prise comme
un examen de référence.
43
2. SUGGESTIONS
En se référant aux résultats obtenus et dans
le but de réduire la prévalence du paludisme, les mesures
suivantes pourraient être suggérées :
a. Aux autorités politico-administratives :
· Améliorer les conditions de vie de la population
;
· Permettre à toute la population l'accès aux
MII ;
· Participer massivement dans la lutte contre le paludisme
?
b. Aux autorités médicales :
· Disponibilité les tests de diagnostic rapide dans
les structures sanitaires ainsi que les intrants antipaludiques ;
· Sensibiliser la population sur le paludisme, son impact
sur la population et les moyens de lutte ou de diminuer sa propagation ;
· Améliorer la prise en charge du paludisme afin
d'éviter son évolution vers la forme grave.
c. Aux prestataires des soins :
· Utiliser le schéma thérapeutique
recommandé par le programme national de lutte contre le paludisme pour
une meilleure prise en charge du paludisme.
d. A la population :
· Participer individuellement et collectivement à
la lutte contre l'insalubrité du milieu par le désherbage, la
destruction des gites larvaires et flaques d'eaux ;
· Utiliser des MII ;
· Eviter l'automédication qui serait à la
base des complications suite à une pharmaco résistance.
44
REFERENCES BIBLIOGRAPHIQUES
1. OMS. « Diagnostic et prise en charge du paludisme
grave à P. falciparum ». Département du contrôle de la
prévention et l'éradication groupe des maladies transmissibles,
Juin 2002.
2. Aubry P., et col. (2010). Le paludisme. Diplôme
de médecine tropicale des pays de l'Océanie indien.
Université de bordeaux, France, p6
3. Document du programme national de lutte contre le
paludisme(RDC). 2018
4. OMS, 30 décembre2020. Paludisme.
5. OMS. Le Rapport sur le paludisme dans le monde 2019 en
un clin d'oeil.
6. OMS 2004, 2006.cité par Norbert TANKE
DONGMO.2012.
7. Valérie A., et coll. (2011) tests de
diagnostics rapides : la panacée pour le praticien. Rev. Med suisse.
Volume7.984-990
8. Sylvie Z., et col. (2013) ; Les tests de diagnostic
rapide (TDR) du paludisme : entre directives officielles et
réalités d'utilisation au Burkina Faso.
9. Escalante et col, 1994 ; Cox-Sigh et al,
2008).
10. Organisation mondiale de de la santé(OMS) 2019.
Rapport mondial du paludisme 2019.
11. Anne-Claire LANGLOIS, rôles et limites du test
de diagnostic rapide du paludisme. 2014.
12. Oscar L., 2016, Problématique de l'utilisation
des MILD chez les enfants de moins de 5 ans en RDC.
13. OMS, 2020. Rapport 2020 sur le paludisme dans le
monde. Novembre 2020.
14. Mrabet M.,(2017), les différentes
études en épidémiologie
15. Moussaoui H.,2015, les approches
méthodologiques en santé
16. LOZANO F. et Col. (1983), paludisme à
plasmodium falciparum et à plasmodium malariae compliqué part un
oedème pulmonaire.
17. ODEKA, M., 2011, paludisme : maladie parasitaire eu
très lourd passé militaire.
18. SENE I., 2010. Le paludisme : aspects
épidémiologiques, cliniques et parasitologiques.2010.
19. Danis M, et col. 2016 : Paludisme ; cycle et biologie
des plasmodiums-universités Francophones, P26-P87.
20. GENTILLINI M., 2009, le paludisme : une situation
critique. Médecine-science, Flammarion, P839.
21. BRICAIRE F., et col. 2009. Paludisme et grossesse,
P289
22. TRAPE J.F et GREENWOOD B., approches nouvelles en
épidémiologie du paludisme, annales de l'institut
Pasteur/actualités, 2000. P259
45
23. DENIAU M., Paludisme : épidémiologie,
étiologie, physiopathologie, diagnostic, évolution, pronostic et
traitement. 1995
24. GAYE O. et col., Epidémiologie des
endémies parasitaires dans la zone du barrage anti sel. 2000,
P139-144
25. DENIAU M., Paludisme : épidémiologie,
étiologie, physiopathologie, diagnostic, évolution, pronostic et
traitement. 1995.
26. CHARMOT G., et col. : Paludisme, cahier santé.
1993
27. PNLP, Directives pour la prise en charge du paludisme,
2015.
28. COULAUD J.P., la prophylaxie du paludisme, cahier
santé, 2007. P315
29. Comment utiliser les tests diagnostiques rapides (TDR) :
Un guide pour la formation au niveau du village et du district.
30. VAN DER STUYF P. et de MUYICK A., le paludisme de
l'enfant à Kinshasa (Zaïre)influence des saisons, de l'âge,
de l'environnement et du standing familial. Med. Trop., 1990, p53-64.
31. Wandji S., Kimbi K., Eyong J., Tendonfor N. and
Ndamukong J. (2008). Performance and usefulness of hexagon rapid
diagnostic test in children with asymptomatic malaria living in the Mounth
Cameroon Region. Malaria Journal, 7:89
46
Table des matières
EPIGRAPHE I
DEDICACE II
REMERCIEMENTS III
LISTE DES ABREVIATIONS IV
LISTE DES TABLEAUX ET FIGURES V
LISTE DES FIGURES VI
PLAN DU TRAVAIL VII
INTRODUCTION 1
1. Etat de la question 1
2. Problématique 5
3. Choix et intérêt du sujet 6
4. Objectifs 7
a. Objectif général 7
b. Objectifs spécifiques : 7
5. Délimitation du sujet 7
5. Subdivision du travail 7
Chapitre premier : GENERALITES SUR LE PALUDISME ET TEST
DIAGNOSTIC RAPIDE 8
I.1. DEFINITION DES CONCEPTS DE BASE 8
I.2. DESCRIPTION DU PALUDISME 9
I.2.1. HISTORIQUE DU PALUDISME 9
I.2.2. CAUSES DU PALUDISME 10
I.2.3. EPIDEMIOLOGIE 10
I.2.3.1. EVOLUTION DU NOMBRE DE CAS ET DE DECES 11
I.2.3.2. AGENTS PATHOGENES 13
I.2.4. TRANSMISSION 15
I.2.5. MANIFESTATIONS CLINIQUES 17
1. Accès simple 17
2. Accès grave 18
I.2.6. DIAGNOSTIC BIOLOGIQUE 19
1. Diagnostic direct 19
2. Diagnostic indirect 20
I.2.7. TRAITEMENT 21
1. Pour le paludisme simple 21
I.2.8. PROPHYLAXIE 22
47
1. Protection contre les moustiques 22
2. Moustiquaires imprégnées d'insecticides 23
I.3. TEST DE DIAGNOSTIC RAPIDE DU PALUDISME (TDR) 23
I.3.1. Matériels et réactif de laboratoire 24
I.3.2. Principes 24
I.3.3. Limites du TDR 25
I.3.4. Avantages du test de diagnostic rapide 25
I.3.5. Mode opératoire 25
I.3.6. Lecture des résultats des tests 28
Chapitre deuxième : PRESENTATION DU MILIEU D'ETUDE 29
II.1. CADRE DE RECHERCHE 29
II.2. SITUATION GEOGRAPHIQUE 29
II.3. DELIMITATION 29
II.4. HISTORIQUE 29
II.5. ORGANISATION DU CSR TEGRA 29
II.6. ORGANIGRAMME DU CENTRE DE SANTE DE REFERENCE TEGRA 31
Chapitre troisième : METHODE DU TRAVAIL 32
III.1. Population et échantillon 32
III.2. Type d'étude 32
III.3. Technique de collecte des données 32
III.4. Variables utilisées 33
III.5. Procédés d'analyse des données 33
III.6. Considérations éthiques 33
Chapitre quatrième : RESULTATS 34
DISCUSSIONS 40
CONCLUSION ET SUGGESTIONS 42
1. CONCLUSION 42
2. SUGGESTIONS 43
REFERENCES BIBLIOGRAPHIQUES 44
Table des matières 46
| 

