|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE
L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
UNIVERSITE
ABDELHAMID BEN BADIS MOSTAGANEM

Faculté des Sciences de la Nature et de la Vie
DEPARTEMENT DE BIOLOGIE
MéMOIRE DE FIN D'éTUDES
Présenté par
NAIB Laila
MIMOUNI Nassima
Pour l'obtention du diplôme de
Master en biologie
Spécialité : Biodiversité
et environnement
Thème

espèces d'Atriplex : Atriplex halimus L.
et Atriplex canacsens (Pursh)
Synthèse sur l'effet du plomb sur le comportement
biochimique de deux
Date de soutenance: ../../2020
Devant le jury composé de :
|
Nom et prénom
|
Grade
|
Qualité
|
Appartenance administrative
|
|
Mme. SAKKAL.FZ
|
MAB
|
Président
|
Université de Mostaganem
|
|
M. TAHRI. M
|
MAA
|
Examinateur
|
Université de Mostaganem
|
|
M. REGUIEG YASSAAD H.A
|
Prof
|
Encadreur
|
Université de Mostaganem
|
|
Mme. HAMAD. H
|
Doctorante
|
Co-encadreur
|
Université de Mostaganem
|
Année universitaire : 2019/2020

Remerciements
Nous remercions Dieu, le tout puissant de nous
avoir
accordé la santé et le courage pour
accomplir ce travail.
Nous remercions respectueusement notre promoteur
Mr
Reguieg Yssaad Houcine Abdelhakim, pour le temps
et
L'attention qu'elle a bien voulu consacrer au bon
déroulement
de notre travail.
Nos remerciements s'adressent à notre
co-encadreur Mme
Hammed Hanane pour sa compréhension, sa
grande
contribution, sa disponibilité et ses
précieux conseils et

Nos remerciements sont également exprimés aux
membres de
jury : Mme. SANNAL.F Z présidente, et M. TAHRI
Miloud
examinateur d'avoir accepté de juger notre
travail.
Enfin, Dans le souci de n'oublier personne,
tout ceux qui
nous ont soutenu, encouragé, conseillé et
aidé de près ou de loin,
trouvent dans ces lignes l`expression de notre
reconnaissance et
gratitude.
orientations.

Dédicace
Tout d'aBord, Dieu
Merci qui m'a aidée à réaliser ce
modeste travail
ft maman chérie
ft mon père a qui je souhaite une longe vie
ft mes frères et mes soeurs
ft Beldjilali, ftziz, Zahia et la petite Rahmouna
ft toute ma famille
ft mon Binôme Nassima
ft ma chère copine Houda
ft Tous mes proches, mes amis et camarades de
promotion.
Laila

Dédicaces
Avant tout c'est grâce à Allah je suis
arrivé à ce Stade
Je dédie ce modeste travail à : Mes très
chers parents
À mon unique frère : Abd Elbasset et mes
très chères
soeurs. À tout le reste de la famille :
Grand-mère,oncles,
À Laila, mon binôme pour toute sa
patience,
sa compréhension et sa bonne humeur.
À toute mes amies (es) dont: Hayet, Khadra et
Narimene
, et tous ceux qui m'ont aidé durant le
parcours de mes
études.
Nassima
Liste des abréviations
|
Cd:
|
cadmium
|
|
CEC
|
Capacité d'échange cationique
|
|
Chl
|
chlorophylle
|
|
Cl
|
calcium
|
|
cm
|
centimètre
|
|
Cr
|
chrome
|
|
Cu
|
cuivre
|
|
EDDS
|
Ethylène diamine dissuccinate
|
|
EDTA
|
Ethylène diamine tétra-acétate
|
|
ERO
|
Espèce réactive d'oxygène
|
|
ETM
|
éléments traces métalliques
|
|
Fe
|
fer
|
|
g
|
gramme
|
|
Hg
|
mercure
|
|
Kg
|
kilogramme
|
|
Ni
|
nickel
|
|
OH
|
-radical hydroxyle
|
|
O-2
|
anion superoxyde
|
|
Pb
|
plomb
|
|
Zn
|
zinc
|
Liste des figures
Fig. 1: Coupe transversale de racine, avec le
passage des ions selon les voie
symplastiques et apoplastiques 10
Fig.2:Techniques de phytoremédiation
. 17
Fig. 3:Processus de phytoextraction 18
Fig.4:Schéma représentant une
phytoextraction continue 19
Fig. 5 : Schéma représentant
une phytoextraction induite par des chélateurs .. 19
Fig.6: Atriplex halimusL. 28
Fig.7 : Atriplex canescens (Pursh)
Nutt 29
Liste des tableaux
|
Tableau 1 : Classification périodique des
éléments
|
05
|
|
Tableau 2 : propriétés
physico-chimiques de plomb
|
06
|
|
Tableau 3 : Caractéristiques de
différents procédés utilisés en
phytoremédiation.....
|
21
|
|
Tableau 4 : Avantages et limites de la
phytoremédiation
|
....22
|
|
Tableau 5 : Répartition des
espèces d'Atriplex dans le monde
|
25
|
|
Tableau 6 : Doses des métaux lourds
appliquées .
|
32
|
Tableau 7 : Teneur en chl a, b et totale des
feuilles des deux espèces d'Atriplex : halimus et canescens
sous l'effet de plomb .....33
Tableau 8 : Teneurs en
sucres solubles dans les feuilles et les racines de l'A. halimus et
A.
canescens 34
Tableau 9 : Teneurs
en proline enregistrées chez les deux espèces d'Atriplex
en absence et en
présence de plomb 35
Tableau 10 :
Teneur en sodium dans les feuilles et racines de l'Atriplex
canescens et Atriplex
halimus 36
Tableau 11 :Teneur
en potassium dans les feuilles et racines de l'Atriplex canescens
et
Atriplex halimus 36
Tableau 12 :
Teneur en plomb dans les feuilles et racines de l'Atriplexc
anescens et Atriplex
halimus 37
Résumé
L'Atriplex canescens (Pursh) Nutt., et Atriplex
halimus L. sont bien adaptés à des conditions
environnementales extrêmes et présentes des
propriétés accumulatrices de métaux lourds. Notre
étude consiste à faire une synthèse sous forme d'une
comparaison du comportement biochimique de deux espèces d'Atriplex
: Atriplex canescens et Atriplex halimus L sous l'effet
de trois doses (0, 5000 et 10000 ppm) de plomb , à travers l'analyse de
la chlorophylle, la proline et les sucres solubles qui sont admis comme
étant des biomarqueurs de la résistance aux stress abiotiques,
ainsi le dosage de plomb et des éléments minéraux (sodium
et potassium) dans les feuilles et racines des plantes d'Atriplex.
Les résultats obtenus par Babou., (2014), Khedim (2019)
et Ouini (2012) montrent que la présence du plomb dans le sol affecte
directement l'Atriplex, en se traduisant par une diminution de la
teneur en chlorophylle (chl a, chl b et chl t) chez les deux espèces
d'Atriplex exposées à différentes concentrations
en plomb (5000 et 10000 ppm) par rapport aux témoins où la
diminution est plus importante chez l'Atriplex halimus , ainsi une
augmentation de la synthèse des sucres solubles au niveau des feuilles
par rapport aux racines chez l'Atriplex canescens et le contraire chez
l'Atriplex halimus. Sous stress, les deux espèces
d'Atriplex s'accumulent plus de proline et des éléments
minéraux (sodium et potassium) dans les feuilles que dans les racines.
De plus, Les teneurs en Pb enregistrées dans les parties
aériennes reflètent les concentrations moins importantes par
rapport aux racines des plantes d'Atriplex, dont l'accumulation de ce
métal est plus importante chez l'Atriplex canescens par rapport
à l'Atriplex halimus.
Mots-clés : Atriplex canescens,
Atriplex halimus L, plomb, stress métallique,
paramètres biochimiques, Phytoremédiation.
summary
Atriplex canescens (Pursh) Nutt., And Atriplex
halimus L. are well adapted to extreme environmental conditions and
exhibit heavy metal accumulating properties. Our study consists in making a
synthesis in the form of a comparison of the biochemical behavior of two
species of Atriplex: Atriplex canescens and Atriplex
halimus L. under the effect of three doses (0, 5000 and 10000 ppm) of
lead, through analysis of chlorophyll, proline and soluble sugars which are
accepted as biomarkers of resistance to abiotic stresses, as well as the
determination of lead and mineral elements (sodium and potassium) in the leaves
and roots of Atriplex plants.
The results obtained by Babou., (2014), Khedim (2019) and
Ouini (2012) Show that the presence of lead in the soil directly affects
Atriplex, resulting in a decrease in the chlorophyll content (chl a ,
chl b and chl t) in the two Atriplex species exposed to different lead
concentrations (5000 and 10000 ppm) compared to the controls where the decrease
is more significant in Atriplex halimus, thus an increase in the
synthesis of sugars soluble in the leaves compared to the roots in Atriplex
canescens and the opposite in Atriplex halimus. Under stress,
both Atriplex species accumulate more proline and mineral elements
(sodium and potassium) in the leaves than in the roots. In addition, the Pb
contents recorded in the aerial parts reflect the lower concentrations compared
to the roots of Atriplex plants, whose accumulation of this metal is
greater in Atriplex canescens compared to Atriplex
halimus.
Keywords: Atriplex canescens,
Atriplex halimus L, lead, metallic stress, biochemical parameters,
Phytoremediation.
ÕÎáã
áËãÊÊ
.ÉáíÞËáÇ
äÏÇÚãáÇ
ãßÇÑÊ ÕÆÇÕÎ
ÑåÙÊæ
ÉíÓÇÞáÇ
ÉíÆíÈáÇ
æÑÙáÇ Úã ÏíÌ
áßÔÈ ØÞáÇ
ÊÇÈä íßÊí
5000 0( ÊÇÚÑÌ
ËáÇË ÑíËÊ
ÊÍÊ ØÞáÇ äã
äíÚæäá
íÆÇíãíßæíÈáÇ
ßæáÓáá
ÉäÑÇÞã áßÔ í
íáÊ áãÚ í
ÇäÊÓÇÑÏ
íÊá Çæ
äÇÈæÐáá
ÉáÈÇÞáÇ
ÊÇíÑßÓáÇ
äíáæÑÈáÇ
áíæÑæáßáÇ
áíáÍÊ ááÇÎ
äã ÕÇÕÑáÇ äã
)äæíáãáÇ í
ÁÒÌ 10000 æ
ãæíÏæÕáÇ(
äÏÇÚãáÇæ
ÕÇÕÑáÇ
Éíãß ÑíÏÞÊ
ÞíÑØ äÚ
ßáÐßæ Éí
æíÍáÇáÇ
ØæÛÖáÇ
ÉãæÇÞãá
ÉíæíÍ
ÊÇÑÔÄãß
ÑÈÊÚÊ
.ØÞáÇ
ÊÇÊÇÈä
ÑæÐÌæ ÞÇÑæ í
ÉÏÌÇæÊãáÇ
)ãæíÓÇÊæÈáÇæ
ÕÇÕÑáÇ
ÏæÌæ ä ) 2012(
íäíææ )2019(
ãíÏÎæ ) 2014( æÈÇÈ
äã ãß ÇåíáÚ
áÕÍ íÊáÇ
ÌÆÇÊäáÇ
ÊÑåÙ í(chl a, chl b, chl t)
áíæÑæáßáÇ
ìæÊÍã ÖÇÎäÇ
ìáÅ íÏÄí Çãã
ØÞáÇ ÊÇÈä
ìáÚ ÑÔÇÈã
áßÔÈ ÑËÄí
ÉÈÑÊáÇ í
ÊÇÊÇÈäáÇÈ
ÉäÑÇÞã
)äæíáãáÇ í
ÁÒÌ 10000 æ
5000(ÕÇÕÑáÇ äã
ÉáÊÎã
ÊÇÒíßÑÊá
äíÖÑÚãáÇ
ØÞáÇ ÊÇÈä
íÚæä
ÉáÈÇÞáÇ
ÊÇíÑßÓáÇ
ÈíßÑÊ í
ÉÏÇíÒ ßáÐßæ
halimus Úæä äã
ØÞáÇ ÊÇÈä
ÏäÚ ÑÈß
ÖÇÎäáÇÇ
äæßí ËíÍ
ÉÏåÇÔáÇ
|
íäÇËá
|
Ç ÚæäáÇ
ÏäÚ ÓßÚáÇæ
|
canescens Úæä äã
ØÞáÇ ÊÇÈä
ÏäÚ ÑæÐÌáÇÈ
ÉäÑÇÞã
ÞÇÑæáÇ
ìæÊÓã ìáÚ
äÇÈæÐáá
|
í
)ãæíÓÇÊæÈáÇæ
ãæíÏæÕáÇ(
ÉíäÏÚãáÇ
ÑÕÇäÚáÇæ
äíáæÑÈáÇ äã
ÑÈß Éíãß
äÇãßÇÑí
äíÚæäáÇ áÇß
ØÛÖáÇ ÊÍÊ . halimus
ÉÖÎä ã
ÒíßÇÑÊ
ÉíÆÇæåáÇ
ÁÇÒÌáÇ í
ÉáÌÓãáÇ
ÕÇÕÑáÇ
Éíãß ÓßÚÊ
ßáÐ ìáÅ
ÉÇÖáÅÇÈ
.ÑæÐÌáÇ äã
ÑËß ÞÇÑæáÇ
ÑÈß canescens Úæä äã
ØÞáÇ ÊÇÈä
áÈÞ äã
ÉãßÇÑÊãáÇ
äÏÚãáÇ ÇÐå
Éíãß äæßÊ
ËíÍ
ØÞáÇÊÇÊÇÈä
ÑæÐÌÈ
ÉäÑÇÞã .halimus
Úæä äã
ØÞáÇÈ
ÉäÑÇÞã
ÉíÍÇÊãáÇ
ÊÇãáßáÇ
.ÉíÊÇÈäáÇ
ÉÌáÇÚãáÇ
ÉíÆÇíãíßæíÈáÇ
ÕÆÇÕÎáÇ,íäÏÚãáÇ
ÏÇåÌáÇÇ
ÕÇÕÑáÇ Atriplex canescens,
Atriplex halimus L
Table de matière
Remerciements
Dédicace
Liste des
abréviations
Liste des figures
Liste des
tableaux
Résumé
ÕÎáã
Abstract
Introduction .1
Premier I : Synthèse bibliographique
Chapitre
I : métaux lourds
I.1. Généralité sur les métaux
lourds 4
I.2. Définition des métaux lourds . ...4
I.3. Classification des métaux lourds 4
I.4. Pollution par le plomb . 5
I.4.1. Généralité sur le plomb .6
I.4.2. Propriétés physico-chimiques du plomb .
6
I.4.3. Plomb dans le sol .6
I.4.4. Origine de la contamination des sols par le plomb .7
I.4.5. Comportement du plomb dans le sol . 7
I.4.5.1. Mobilités et spéciation du plomb .
8
I.4.5.2. Influence des paramètres physico-chimiques sur la
spéciation du
plomb 8
|
I.4.6. Plomb dans la plante .
|
....9
|
|
I.4.6.1. Phytodisponibilité du plomb . .
|
.9
|
|
I.4.6.2. Absorption du plomb par la plante .
|
10
|
|
I.4.6.3. Translocations du plomb des racines vers les parties
aériennes
|
11
|
|
I.4.6.4. Bioaccumulation et effet du plomb sur les
végétaux
|
.12
|
|
I.4.6.4.1. Effet du plomb sur la germination
|
12
|
|
I.4.6.4.3. Effet sur la photosynthèse
|
12
|
|
I.4.6.4.2. Effet du plomb sur croissance des plantes .
|
13
|
|
I.4.6.4.4. Effet sur les antioxydants
|
13
|
|
I.4.6.4.7. Effets sur le stress hydrique .
|
13
|
|
I.4.6.4.5. Effets sur la nutrition minérale .
|
14
|
|
I.4.6.4.6. Effets sur les activités enzymatiques .
|
14
|
|
I.4.7. Mécanismes de tolérance des plantes au plomb
|
15
|
Chapitre II : Phytoremédiation
II.1. Dépollution du sol
|
..16
|
II.2. Définition de la phytoremédiation
|
.16
|
II.3. Histoire de la phytoremédiation
|
..16
|
II.4. Techniques de la phytoremédiation
|
|
16
|
|
|
II.4.1. Phytoextraction ou phytoaccumulation
|
17
|
|
II.4.2. Rhizofiltration
|
..20
|
|
II.4.3. Phytostabilisation
|
.20
|
|
II.4.4. Phytodégradation .
|
20
|
|
II.4. 5.Rhizodégradation (phytostimulation)
|
20
|
|
II.4.6. Phyto-volatilisation
|
..20
|
|
II.5. Les avantages et les limites de la phytoremédiation
|
22
|
Chapitre III : L'Atriplex
|
III.1. Généralités sur les Atriplex
|
.....23
|
|
III. 2. Caractéristiques morphologiques
|
...23
|
|
III. 3. Répartition géographique des Atriplex
|
....24
|
|
III.3.1.Dans le monde
|
.24
|
|
III.3.2.En Algérie .
|
.24
|
|
III. 4. Intérêts de l'Atriplex
|
....26
|
|
III.4.1. Intérêt fourrager
|
.....26
|
|
III.4. 2. Intérêts économique et agronomique
|
26
|
|
III.4. 3. Intérêt thérapeutique
|
.26
|
|
III.5. Atriplex halimus L
|
27
|
|
III.5.1. Origine
|
...27
|
|
III.5.2. Systématique
|
. 28
|
|
III.6. Atriplex canescens (Pursh) Nutt .
|
28
|
|
III.6.1. Origine
|
. .29
|
|
III.6.2. Systématique de l'espèce
|
29
|
|
III.7. L'utilisation des atriplex en
phytoremédiation
|
29
|
Partie II : Etude comparative de la réponse de
l'A. halimus et A. canescens
vis-à-vis au stress
métallique
Chapitre I : Résultats
II.1.Réponse biochimique de l'Atriplex
halimusL. et d'Atriplex
canescens
(Pursh) Nutt. au stress métallique de plomb . 32
II.2.1. Teneur en chlorophylle a, b et totale des feuilles de
l'Atriplex halimus et
Atriplex canescens stressée au plomb .
32
II.2. Teneur en sucres solubles de l'Atriplex canescens et
Atriplex halimus
stressée par le plomb . ..33
II.3. Teneur en proline de l'Atriplex canescens et
Atriplex halimus stressée au
plomb 34
II.4. Teneur en Eléments minéraux de l'A.
canescens et A. halimus stressée au
plomb 35
II.4.1. Teneur en sodium de l'Atriplex
canescens et Atriplex halimus stressée au
plomb .35
II.4.2. Teneur en potassium de l'A. canescens et A.
halimus stressée au
plomb 36
II.5. Teneur en plomb dans les feuilles et racines de
l'Atriplex canescens et
|
|
halimus stressée par le plomb
|
37
|
|
Chapitre II : Discussion
|
|
|
III.1. Effet du plomb sur paramètres biochimiques de
l'Atriplex
|
39
|
|
III.1.1. Effet de plomb sur la teneur en chlorophylle de
l'Atriplex
|
39
|
|
III.1.2. Effet de plomb sur la teneur en sucres solubles de
l'Atriplex
|
40
|
|
III.1.3. Effet de plomb sur la teneur en proline de
l'Atriplex
|
40
|
|
Effet de plomb sur la teneur en éléments
minéraux de l'Atriplex
|
41
|
|
III.1.4. Effet de plomb sur la teneur en sodium de l'Atriplex
|
41
|
|
III.1.5. Effet de plomb sur la teneur en potassium l'Atriplex
|
....41
|
|
III.1.6. Teneur totale en plomb l'Atriplex .
|
.....42
|
|
Conclusion
|
44
|
|
Référence bibliographie
|
47
|

troduction
Introductiongnnnr

1
Introduction générale
La pollution de l'environnement est devenue en quelques
décennies un des problèmes majeurs qui conditionne l'avenir de
notre planète. Parmi les principaux polluants, il y a les métaux
lourds, persistants qui s'accumulent dans le sol en contaminant
l'environnement. De plus ils sont continuellement rajoutés dans les sols
par diverses activités : en agriculture par l'application de pesticide
ou dans l'industrie métallurgique ou par ruissellement. Tous les
éléments traces métalliques sont potentiellement toxiques
pour les végétaux en fonction de leur concentration dans un
milieu et de leur caractère essentiel ou non pour la plante (Lotmani et
Mesnoua, 2011).
Le plomb est l'un des contaminants les plus répandus
dans l'environnement toxique, même à faible concentration pour de
nombreux organismes vivants (Jarup, 2003 ; Hernández-Ochoa et al,
2005). Leur accumulation dans l'environnement peut se répercuter
sur la santé des êtres humains et des animaux (Wang et al.,
2003). La contamination de l'environnement a été très
peu considérée la majorité concernant des plantes
cultivées en raison des risques de contamination de la chaine trophique
et de baisse de rendements observée sur les parcelles par le plomb
(Seregin et Ivanoc, 2001 ; Patra et al., 2004 ; Sharma et
Dubey,2005).
Afin de pallier les limites environnementales, des
méthodes biologiques, qui sont actuellement employées pour le
traitement des sols pollués telles que la phytoremédiation,
c'est-à-dire l'utilisation des plantes pour éliminer ou
dégrader les métaux lourds dans les sols contaminées
(Sutherzan, 2001).Cette technique de remédiation des sols pollués
est basée sur la capacité de certaines plantes à
prélever des métaux du sol, et à les transporter et
concentrer dans leurs parties aériennes, qui seront ensuite
récoltées et traitées (Raskin, 1996 ; Blaylocket
al., 1997). La phytoremédiation est de plus en plus
utilisées de nos jours puisqu'elle contribue au maintien de la structure
des sols étant donné qu'elle ne nécessite aucune
excavation (EPA., 2012). En plus d'être reconnue comme un choix
économique comparativement aux techniques de décontamination
conventionnelles, de plus elle est largement acceptée par le grand
public puisque peu d'impact y sont associés (Forget., 2004 ;Ghosh et
Singh., 2005).
L'Atriplex est une espèce
réputée par sa grande rusticité, amplitude
écologique, polymorphisme et à sa reproduction allogame dominante
(Haddioui et Baaziz, 2001). Elle attire l'attention de nombreux chercheurs et
constitue le matériel de choix pour plusieurs investigations.

2
Introduction générale
Les espèces d'Atriplex sont souvent
utilisées dans la réhabilitation de sites difficiles. Elles
possèdent par ailleurs, un système racinaire très
développé, fixant les couches supérieures du sol et
peuvent être utilisées comme moyen de lutte contre la
désertification (Belkhodja et Bidai., 2004).
Le présent travail vise à réaliser une
synthèse sur l'effet du plomb sur le comportement biochimique de deux
espèces d'Atriplex : Atriplex halimus L et Atriplex
canescens. Ainsi, la détermination du pouvoir
phytoremédiateur de ces deux espèces, et ce par la
détermination de la capacité d'accumulation et de translocation
du plomb vers leurs parties aériennes. A cet effet ce travail est
subdivisé en deux parties :
? Première partie une synthèse bibliographique
qui apporte les principales informations sur les métaux lourds et la
pollution par le plomb ainsi que son transfert dans le système sol
plante et ses effets sur les végétaux et donne aussi un
aperçu général sur la phytoremédiation et des
généralités sur l'espèce étudiée.
Deuxième partie c'est une étude comparative des
mécanismes biochimiques de tolérance de
métallique (plomb) et comporte aussi une conclusion
générale.
deux espèces d'Atriplex : Atriplex halimus
L. et Atriplex canescens (purch)
nutt. au stress

Partie I
Synthèse bibliographique
I.1. Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds

4
Généralité sur les métaux
lourds
Les éléments traces, appelés abusivement
métaux lourds, comprennent non seulement les métaux
présents à l'état de trace (cadmium, cuivre, mercure,
plomb...etc), mais aussi des éléments non-métalliques,
comme l'arsenic, le fluor...etc. La plupart d'entre eux sont des
oligo-éléments nécessaires à la vie en faible dose.
Ils peuvent cependant se révéler très nocifs en
quantités importantes, comme le fer (Fe), le cuivre (Cu), le zinc (Zn),
le nickel (Ni), le chrome (Cr)...etc. D'autres n'ont aucune fonction biologique
ou physiologique et sont considérés toxiques même à
très faible concentration, comme le plomb (Pb), le cadmium(Cd), le
mercure (Hg)...etc. (Kurlaze, 2007 ; Liu, 2008).
I.2. Définition des métaux
lourds
Un métal est une matière, issue du minerai,
dotée d'un éclat particulier, bon conducteur de chaleur et
d'électricité, ayant des caractéristiques de dureté
et de malléabilité, caractérisés par une masse
volumique élevée, supérieure à 5g/cm3
(Bendada et Boulakradech, 2011). Les métaux lourds sont présents
dans tous les compartiments de l'environnement mais en général en
quantité très faible (traces) (Adriano, 2001).
I.3. Classification des métaux lourds
La classification en métaux lourds est souvent
discutée car certains métaux toxiques ne sont pas
particulièrement « lourds » et certains éléments
ne sont pas des métaux mais des métalloïdes (Miquel,
2001).
D'un point de vue chimique, les éléments de la
classification périodique formant des cations en solution sont des
métaux (Huynh, 2009).
D'un point de vue physique, le terme «
métaux lourds » désigne les éléments
métalliques naturels, métaux ou dans certains cas
métalloïdes (environ 65 éléments),
caractérisés par une forte masse volumique supérieure
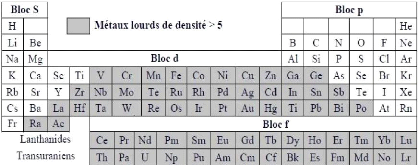
à 5 g.cm-3 (Adriano, 2001). Voir tableau 01.
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds

5
Tableau 01: Classification périodique
des éléments (Kabata-Pendias et Pendias, 2001).
D'un autre point de vue biologique, on distingue deux types en
fonction de leurs effets physiologiques et toxiques : métaux essentiels
et métaux toxiques (Huynh, 2009).
? Métaux essentiels : Ce sont des
éléments indispensables pour de nombreux processus cellulaires et
qui se trouvent en proportion très faible dans les tissus biologiques
(Loué, 1993). Certains peuvent devenir toxiques lorsque la concentration
dépasse un certain seuil. C'est le cas du cuivre (Cu), du nickel (Ni),
du zinc (Zn), du fer (Fe), etc... (Loué, 1993).
? Métaux non essentiel (toxiques) :
n'ont aucun effet bénéfique connu pour la cellule mais
présentent un caractère polluant avec des effets toxiques pour
les organismes vivants même à faible concentration c'est le cas du
plomb (Pb), du Mercure (Hg) et du Cadmium (Cd) (Chiffoleau, 1992).
I.4. Pollution par le plomb
Le développement industriel et l'essor de l'automobile
ont eu pour conséquence une augmentation considérable de la
production de plomb et de l'emploi de ce métal et de ses
dérivés. Il en a résulté une dispersion importante
de cet élément dans l'environnement et une augmentation des
risques d'exposition (Maizi, 2013). Le plomb, considéré comme
élément peu mobilisable mais également très toxique
lorsqu'il est assimilé par les végétaux (Jopony et Young,
1994). Toutes les formes de plomb biodisponible sont responsables d'effets
toxiques vis-à-vis des organismes vivants (Maizi, 2013).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds

6
I.4.1. Généralité sur le plomb
Le plomb, du latin (plumbum) est un métal mou,
gris, habituellement trouvé en petite quantité dans la
croûte terrestre à une concentration d'environ 15 mg/kg. Il
appartient au groupe IVb de la classification périodique des
éléments (Huynh, 2009). Constitue des gisements primaires dans
les roches éruptives et métamorphiques, il existe sous forme de
sulfure et peut être associé à d'autres
éléments tels que le Zn, l'arsenic, le cuivre et l'argent (Huynh,
2009). Dans l'eau de mer il existe sous trois formes : dissous, colloïdal
et le plomb particulaire. Cet élément est très peu
hydrosoluble et de faible mobilité géochimique (Casas, 2005).
I.4.2. Propriétés physico-chimiques du
plomb
L'essentiel de caractéristiques physico-chimiques du
plomb est mentionné dans le tableau suivant :
Tableau 02 : propriétés
physico-chimiques de plomb (Miquel, 2001).
|
Symbole chimique
|
Pb
|
|
Numéro atomique
|
82
|
|
Masse atomique
|
207.2 (g/mol)
|
|
Masse volumique
|
11.34 (g/cm3)
|
|
Température de fusion
|
327°C
|
|
Température d'ébullition
|
1740°C
|
|
Minerai d'origine
|
Galène (PbS)
|
I.4.3. Plomb dans le sol
On peut trouver le plomb dans le sol sous forme ionique,
dissoute, ou liée aux particules. Leur accumulation provenant des
retombées atmosphériques, ou de déchets
déposés sur le sol, se fait dans les horizons de surface
(Sterckeman et al., 2000). Les teneurs en plomb diminuent, ensuite,
plus en profondeur (Abreu et al., 1998), ceci s'explique par le fait
que le Pb est peu mobile (Brunet et al., 2008).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
I.4.4. Origine de la contamination des sols par le
plomb

7
? Origines naturelles
Le plomb est naturellement présent en moyenne à
0,002% dans la croûte terrestre. Les sols non contaminés
contiendraient de 10 à 30 mg.kg-1 (Nriagu, 1978 ; Baize,
2002). A l'état naturel, le plomb se retrouve dans l'environnement sous
forme de galène (sulfure de Pb), de cérusite (carbonate de Pb),
et d'anglésite (sulfate de Pb) (Brunet et al, 2008). Dans
l'air, les émissions du plomb provenant de poussières volcaniques
véhiculées par le vent sont reconnues d'une importance mineure.
D'autres processus naturels, comme la dégradation et l'érosion
des roches mères (Gadd, 2000) et les feux de forêt, contribuent de
façon significative à la libération du plomb. Mais
généralement, ces processus naturels ne conduisent que rarement
à des concentrations élevées du plomb dans l'environnement
(Garnier, 2004).
? Origines anthropiques
A ce jour, les principales sources de contaminations en plomb
sont les rejets anthropiques. Ils proviennent des industries qui extraient et
purifient le plomb naturel et qui recyclent les composants contenant du plomb
comme les batteries et leurs retombées atmosphériques contaminent
les sols (Pichard, 2002). Les retombées de particules riches en
métaux peuvent entraîner une contamination des sols (Donisa et
al., 2000), des eaux de surface (Sanyal et al., sous presse) et
des végétaux (Uzu et al., 2009 ; 2010). A ceci s'ajoute
les déchets industriels et la détérioration des peintures
extérieures à base de plomb. Des rejets provenant des industries
sidérurgiques ainsi que les réseaux de canalisations de
distribution d'eau anciennes (Pichard, 2002). Le plomb est principalement
utilisé dans les batteries électriques, comme additif dans les
essences, dans la sidérurgie des industries de décapage et de
traitement des métaux, l'incinération des déchets, la
combustion du bois, les cimenteries et les industries de fabrication des
accumulateurs (Sabouraud et al.,2009).
I.4.5. Comportement du plomb dans le sol
Le comportement du plomb dans un sol dépend de
différents facteurs comme sa dynamique propre mais également des
caractéristiques pédologiques et physico-chimiques du sol. Il
peut être soit sous forme liée aux particules de terre soit dans
la phase aqueuse (Baize, 1997). Notons toutefois que la mobilité du
plomb va être particulièrement conditionnée par la teneur
en phases absorbantes du sol (matière organique, argile, oxydes...). En
effet, ce métal possède une forte affinité pour ces
constituants du sol (Ross, 1994).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
I.4.5.1. Mobilités et spéciation du plomb

8
Le plomb étant en général
considéré comme un élément peu mobile dans les
milieux naturels, il a donc tendance à s'accumuler dans les horizons
superficiels des sols. Les travaux de (Sterckeman, 2000), démontrent que
dans des profils de sol au voisinage des fonderies, le plomb est
essentiellement concentré dans les 30 premiers centimètres. La
mobilité du plomb est principalement contrôlée par sa
spéciation en phase aqueuse et par des processus
d'adsorption/désorption ainsi que de dissolution/précipitation.
Et par le rôle de certains paramètres tels que le pH, le potentiel
redox, la composition minéralogique (matière organique, argile,
oxydes...) du sol ou du sédiment (Sterckeman, 2000).
I.4.5.2. Influence des paramètres
physico-chimiques sur la spéciation du plomb ? Influence du
pH
C'est le facteur le plus qui a une influence sur la
mobilité et la biodisponibilité du plomb (Swaine, 1986). Les
risques de mobilité sont plus grands dans les milieux acides, alors que
la solubilité diminue avec l'élévation de pH. A pH 5, le
plomb semble majoritairement adsorbé aux oxydes et aux matières
organiques, et une augmentation du pH a pour effet de rendre le plomb moins
biodisponible (Alloway, 1995).
? Influence du potentiel redox
Le potentiel d'oxydoréduction (Eh) exprime le flux
d'électrons des agents réducteurs vers les agents oxydants. Il
est contrôlé par l'activité des électrons en
solution (Sposito et al., 1983). Evans (1989) montre qu'une diminution
de la teneur en eau ou en matière organique favorise une augmentation du
potentiel redox. Ces réactions d'oxydoréduction influencent
fortement le devenir des ETM en solution. Chuang et al., (1996)
observent une augmentation de la solubilité du plomb lorsque le
potentiel redox diminue.
? La teneur en argile
Les argiles, de par leurs propriétés
physico-chimiques, jouent un rôle très important dans la
disponibilité des métaux lourds (Li and Li, 2000). Des
études ont montré que les métaux lourds peuvent être
absorbés et immobilisés par les minéraux argileux ou
également être complexés par la matière organique du
sol en formant alors un complexe organométallique (Lamy, 2002).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
? Influence de la composition minéralogique du
sol

9
Dans la mesure ou la mobilité du plomb est
majoritairement contrôlée par des phénomènes
d'adsorption ou de précipitation/dissolution, elle va être
dépendante de la composition minéralogique du sol, notamment de
la teneur en phases absorbante (matière organique, argile, oxydes...).
La teneur en carbonates va également affecter la mobilité du
plomb. En effet, dans les sols riches en carbonates, le plomb va pouvoir
être piégé par simple adsorption à la surface de la
calcite ou par précipitation minérale due aux pH
élevés de ce type de sol (Marie, 2008).
I.4.6. Plomb dans la plante
Les plantes peuvent absorber du plomb à partir des
racines, mais également à partir des organes aériens, ou
bien par l'intermédiaire des deux. Les quantités de métal
absorbées par les racines dépendent de la concentration et de la
spéciation du métal dans la solution du sol, mais
également de ses capacités de migration du sol vers la surface
des racines. Ensuite, la quantité de plomb présente dans les
divers organes d'une plante dépend du transport de l'extérieur
des racines vers l'intérieur, puis de sa translocation des racines vers
les feuilles (Patraet al., 2004).
I.4.6.1. Phytodisponibilité du plomb
La phytodisponibilité des ETM est fortement
corrélée à la concentration d'espèces ioniques dans
la solution du sol (Kabata-Pendias et Pendias, 1992). Elle est également
largement dépendante des propriétés du sol, de
l'espèce végétale considérée et de
l'élément métallique.
La phytodisponibilité va donc dépendre des
différents paramètres permettant le transfert de la phase solide
du sol vers le végétal (Hinsingeret al., 2005) :
La disponibilité ou mobilité chimique.
L'accessibilité ou mobilité physique. L'assimilation ou
mobilité biologique.
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
I.4.6.2. Absorption du plomb par la plante

10
? Absorption racinaire du plomb
Au départ, le Pb+2 présent dans la
solution du sol se lie aux groupements carboxyle de l'acide uronique composant
le mucilage autour des racines (Sharma et Dubey, 2005). Ce mucilage permet donc
de restreindre le passage du plomb à l'intérieur des cellules
racinaires, et constitue ainsi une protection du système racinaire. Le
passage du plomb dans les racines se fait par deux voies : apoplastique et
symplastique (Figure 1).

Fig.1 : Coupe transversale de racine, avec le
passage des ions selon les voie symplastiques et
apoplastiques (Gobatet
al., 1998).
? Voie apoplastique
Ce phénomène s'arrête le plus souvent au
niveau de l'endoderme, du fait de la présence de cadres de
subérines, ou bandes de Caspary, qui bloquent le passage des
molécules et des ions. A ce moment-là, l'eau et les
molécules sont obligées de traverser les membranes plasmiques des
cellules de l'endoderme, afin de pouvoir parvenir dans le cylindre central
contenant les vaisseaux du xylème. Après avoir traversé la
membrane plasmique de la face interne de l'endoderme, les ions peuvent à
nouveau reprendre le chemin apoplastique. Il reste néanmoins possible
qu'une faible partie de l'absorption des ions se fasse par l'apoplasme
complètement par les cellules de transferts (Cellules non
subérifiées de l'endoderme) (Cecchi, 2008), le plomb peut migrer
relativement vite (Wierzbicka,1987).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds

11
? Voie symplastique
La pénétration du plomb dans les racines par
cette voie se fait grâce à un transport actif interne par le
symplaste (cytoplasmes des cellules reliés entre eux par les
plasmodesmes). Après avoir traversé la paroi cellulaire, les ions
métalliques atteignent la surface de la membrane plasmique, puis
pénètrent dans le symplaste. Ensuite, ces ions métalliques
peuvent passer d'une cellule à l'autre en empruntant les plasmodesmes,
qui relient les cellules. La quantité de ce métal passant par
cette voie est marginale par rapport à la voie apoplastique, et peu
d'études en ont fait état. Cependant, elle a une importance
capitale dans la toxicité du plomb car c'est cette fraction, passant par
le symplaste, qui cause la majorité des effets
délétères observés. Les mécanismes de
pénétration dans le symplaste ne sont pas clairement
identifiés. Pourtant, à des doses non létales, le plomb
pénètre uniquement dans le symplaste dans les zones de divisions
cellulaires actives, comme la zone apicale (Tung et Temple, 1996) ou le
protoderme (Wierzbicka, 1998).
? Absorption foliaire du plomb
Bien qu'elle ait été peu étudiée
par rapport à l'absorption racinaire, l'assimilation du plomb par les
feuilles peut représenter une part importante dans le taux de
contamination de la plante. Le plomb peut être apporté sur les
feuilles par des retombées atmosphériques, mais également
dans les champs par des apports en engrais et pesticides (plomb sous forme
d'impuretés). La majorité de ce plomb est lessivée, mais
une partie va s'adsorber aux lipides épicuticulaires et être
absorbée par les feuilles (Prasad et Hagemeyer, 1999 ; Hovmanet al
; 2009). La capacité des plantes à absorber le plomb
disponible via leurs feuilles dépend à la fois de l'âge de
celles-ci, mais également de leurs morphologies (Dalenberg et Van Driel,
1990).
I.4.6.3. Translocations du plomb des racines vers les
parties aériennes
Après l'absorption par les racines, la translocation
correspond au transfert des ETMs vers les parties aériennes. Elle peut
varier considérablement en fonction du métal, mais
également de l'espèce végétale. Pour être
conduits vers les parties aériennes, les éléments
prélevés dans le sol par les racines doivent être
transportés dans le cortex puis déversés dans les
vaisseaux du xylème. La majorité du plomb absorbé par les
plantes réside dans les racines, et seulement une faible proportion est
transloquée vers les parties aériennes. Ce transport
limité des racines vers les feuilles peut être expliqué par
la barrière formée par l'endoderme des racines (Briat et Lebrun,
1999)
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
I.4.6.4. Bioaccumulation et effet du plomb sur les
végétaux

12
La toxicité du plomb dépend de sa concentration,
de sa spéciation, des propriétés du sol, et de
l'espèce végétale concernée (Cecchi, 2008). Les
plantes mettent en place diverses barrières physiques pour se
protéger, quand le plomb a réussi à passer à
travers ces barrières de protection (Cecchi, 2008). Il peut induire des
troubles physiologiques et biochimiques diminuant la photosynthèse et la
transpiration induisant ainsi un retard de croissance (Alloway, 1995).
I.4.6.4.1. Effet du plomb sur la germination
A l'échelle macroscopique, le plomb entraine des effets
néfastes sur la germination des certaines plantes. Chez plusieurs
espèces, le tégument assure une très haute protection
contre les stress abiotiques, et les fortes variations interspécifiques
des morphologies de ces téguments peuvent affecter leur
perméabilité aux métaux (Moise et al., 2005).
Même à faibles doses, le plomb inhibe la germination des grains
qui ont les enveloppes perméables comme le petit pois Pisum sativum
(Seregin et Ivanov, 2001) .Par contre, les fortes doses conduit à
une inhibition totale de la germination chez l'haricot (Phaseolus
vulgaris), dont le tégument de la graine ne limite pas assez la
pénétration de ces ions (Wixrzbicka et Obidzinska, 1998).
I.4.6.4.3. Effet sur la photosynthèse
L'inhibition de la photosynthèse est un des effets bien
connus du plomb sur la plante (Islam et al., 2008). Parmi les causes
de l'altération de la photosynthèse, on peut citer une
augmentation de l'activité de la chlorophyllase et une
dégradation des pigments chlorophylliens, en particulier, de
lachlorophylle b qui est plus sensible que la chlorophylle a (Liu et
al., 2009). Il a été aussi montré qu'il existait une
inhibition de la synthèse des pigments chlorophylliens (Cenkci et
al., 2010). L'affinité du plomb pour les protéines de la
membrane entraîne, à des concentrations en plomb
élevées, une déformation et une destruction de l'ultra
structure des chloroplastes (Islam et al., 2008), de plus,
l'inhibition des enzymes du cycle de Calvin par le Pb (Liu et al.,
2008) ainsi que le remplacement par le Pb d'ions essentiels comme le Mn et
le Fe (Chatterjee et al., 2004 ; Cecchi, 2008).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
I.4.6.4.2. Effet du plomb sur croissance des plantes

13
Globalement, le plomb affecte la croissance et la
morphogénèse des plantes, en perturbant de très nombreux
mécanismes physiologiques, Le plomb réduit également
fortement le développement des plantules et des radicelles (Mishra et
Choudhuri, 1998), en entraînant de formation de plantes de taille
réduite (Mishra et Chouduri, 1998). Un traitement à de faibles
concentrations en plomb inhibe la croissance des racines et des parties
aériennes (Makowski et al., 2002 ; An, 2006). Cette inhibition
est plus importante pour la racine (Obroucheva et al., 1998).
L'inhibition de la division et de l'élongation cellulaire sont les
phénomènes les plus souvent reportés pour expliquer ces
effets du plomb sur les racines et les tiges (Seregin et Ivanov, 2001 ;
Malkwoski et al., 2002 ; Patra et al., 2004 ; Kopittke et
al., 2007 ; Cecchi,2008). Les traitements au plomb, même à
des doses non-létales, peuvent conduire à l'apparition de
nécroses au niveau des apex racinaires et des feuilles, ainsi que des
chloroses foliaires (Liu et al., 2000).
I.4.6.4.4. Effet sur les antioxydants
Un des effets très importants provoqué par le
plomb dans les cellules est la génération de stress oxydant, qui
est définie comme un déséquilibre entre les
systèmes prooxydants et antioxydants, en faveur des premiers (Sies,
1991). Les espèces réactives de l'oxygène (ERO),
normalement produites dans les cellules se retrouvent en excès, ces
espèces réactives de l'oxygène incluent l'anion superoxyde
(O-2), le radical hydroxyle (OH-) ou encore le peroxyde
d'hydrogène. Le stress oxydant entraîne un ralentissement de la
croissance végétale, mais également des dommages
moléculaires en interagissant avec des substrats biologiques
(dénaturation de protéines, inactivation d'enzymes, des cassures
au niveau de l'ADN (Sies, 1991).
I.4.6.4.7. Effets sur le stress hydrique
Le plomb peut également affecter l'état hydrique
de la plante, en provoquant un stress hydrique, notamment par la fermeture des
stomates. Cette fermeture des stomates a un impact sur divers processus dans la
cellule, tel que la photosynthèse, en induisant une déficience en
CO2 (Parys et al., 1998).
Le stress hydrique s'exprime également par une
réduction de la surface foliaire, ainsi que globalement de tous les
organes sièges de la transpiration, afin de limiter les pertes en
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds

14
eau. Le plomb provoque une perte globale de turgescence et de
plasticité, et enfin une réduction globale du contenu en eau de
la plante (Weryszko-Chmielewska et Chwil, 2005).
I.4.6.4.5. Effets sur la nutrition minérale
Le plomb affecte la nutrition minérale, en perturbant
le prélèvement et le transport des nutriments par la plante, tels
que Ca, Fe, Mg, Mn, P et Zn en bloquant leur entrée ou en se liant
à eux, les rendant indisponibles pour les plantes (Xiong, 2006). Il a
été montré, chez plusieurs plantes exposées au Pb,
une diminution dans les feuilles de la concentration en cations divalents comme
le Zn2+, le Mn2+et le Fe2+ (Seregin et
al., 2001 ; Chatterjee., 2004 ; Kopiitke et al., 2007 ; Cecchi,
2008). Cette diminution pourrait être due à une compétition
entre le plomb et certains ions de taille équivalente au niveau des
transporteurs membranaires. En effet, le plomb, qui a quasiment le même
rayon que le K+, pourrait emprunter les canaux potassiques pour
entrer dans la cellule (Sharma et Dubey, 2005). Le plomb affecte aussi le
métabolisme azoté en diminuant le prélèvement de
nitrate et en perturbant le fonctionnement de la nitrate réductase
(Seregin et Ivanov, 2001 ; Cecchi, 2008).
I.4.6.4.6. Effets sur les activités enzymatiques
Le plomb peut inhiber l'action de certaines enzymes, notamment
celles qui possèdent un groupement -SH, ce dernier présentant une
forte affinité pour le plomb. Dans la plupart des cas, l'inhibition se
fait par interaction du plomb avec ce groupement qui est indispensable pour
l'activité et le bon fonctionnement des enzymes. Le plomb affecte donc
la conformation de nombreuses enzymes, les empêchant de fonctionner
convenablement (Seregin et Ivanov, 2001). Parmi les enzymes fondamentales qui
peuvent être inhibées par le plomb, se trouvent des enzymes
impliquées dans la biosynthèse de la chlorophylle ou bien la
RUBISCO qui permet la fixation du CO2 (Seregin et Ivanov, 2001 ; Patra et
al., 2004). L'inhibition de ce type d'enzyme entraîne une forte
perturbation de la photosynthèse. Ceci entraîne une
réduction de la teneur en chlorophylle ainsi que celle de tous les
pigments photosynthétiques, et également une croissance
réduite des feuilles (Kupper et al., 1996).
Partie I : Synthèse
bibliographique Chapitre I : Métaux lourds
I.4.7. Mécanismes de tolérance des plantes au
plomb

15
Seules les plantes qui ont développé des
mécanismes de tolérance peuvent survivre à un
environnement contaminé. Elles développent en
général deux grands types de stratégies. Le
mécanisme le plus répandu est l'évitement du stress
métallique par exclusion, qui se fait par fixation du métal sur
la paroi cellulaire ou bien par sécrétion de chélates.
Ceci a pour but de limiter au maximum le prélèvement par les
racines, mais également de limiter un éventuel transport des
racines vers les parties aériennes (Seregin et Ivanov, 2001). Une
deuxième stratégie est donc mise en place par les plantes, qui
consiste à détoxiquer le plomb qui a
pénétré. La tolérance au stress métallique
dépendra donc de l'efficacité des mécanismes internes
qu'elles mettent en place. Ces mécanismes peuvent être (Patra
et al., 2004) :
La séquestration des métaux grâce à
des composés organiques spécialement
synthétisés.
La compartimentation dans certains compartiments cellulaires
(tels que les vacuoles). La détoxication grâce à des
chélates.
Les mécanismes de tolérance internes ne sont pas
encore parfaitement connus, mais la chélation du plomb dans le
cytoplasme et la séquestration dans les vacuoles seraient des
mécanismes prépondérants (Saadi et boutchich., 2017). La
vacuole est en effet considérée comme le lieu principal de
stockage du plomb (Tong et al., 2004). Selon Wierzbicka (1993), ces
vacuoles peuvent en effet contenir plus de 96% du métal. Ceci permet de
diminuer considérablement la quantité de métal dans le
cytoplasme, compartiment cellulaire à forte activité
métabolique.
II.1. Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

16
Dépollution du sol
La dépollution naturelle consiste en
l'élimination naturelle des polluants présents dans les
différents compartiments (sol, eaux ...) par voie biologique. Cette
élimination est assurée par les organismes vivants
(microorganismes et/ou plantes). Il existe deux méthodes la
bioremédiation et/ou la phytoremédiation (Annane et Haynouss,
2015).
II.2. Définition de la
phytoremédiation
Le terme phytoremédiation vient du préfixe grec
« phyto » (plante) et du mot latin remedium (pour corriger
ou éliminer un mal) (Ghosh et sing, 2005).
La phytoremédiation est une technologie
émergeante qui utilise les plantes ou les microorganismes de la
rhizosphère pour extraire, transformer ou stocker les polluants contenus
dans les sols, les sédiments, les eaux souterraines ou de surface et
même l'atmosphère (Susarla et al., 2002). A l'heure
actuelle, la phytoremédiation est utilisée pour le traitement de
plusieurs classes de polluants tels que les hydrocarbures, les solvants
chlorés, les pesticides, les composés explosifs ou encore les ETM
(Vassilevet al., 2007).
II.3. Histoire de la phytoremédiation
Au 16ème siècle, un botaniste de
Florence, Andréa Cesalpino découvre une plante poussant sur des
roches naturellement riches en métaux (du nickel notamment). En 1885,
Baumann a identifié pour la première fois deux espèces
végétales, Thlaspi caerulescen set Viola
calaminaria, comme étant capables d'accumuler de fortes
quantités de zinc dans leurs feuilles. Ensuite, en 1935, Byers
étudia l'accumulation du sélénium chez Astragalus
spp. Dix ans plus tard, Minguzzi et Vergnano (1948) identifièrent
des plantes capables d'accumuler jusqu'à 1 % de (m/m) de Ni dans leurs
parties aériennes. Aujourd'hui plus de 400 plantes sont connues pour
leur capacité d'accumulation des métaux (Baker et al.,
2000).
II.4. Techniques de la
phytoremédiation
Plusieurs mécanismes permettent aux plantes
l'élimination des polluants par phytoremédiation (Schröder
et Collins, 2002).
L'action des plantes sur le polluant intervient à
différents niveaux. Les polluants peuvent être stabilisés
ou dégradés dans la rhizosphère, séquestrés
ou dégradés ou encore rendus volatiles et éliminés
dans l'air environnant. Divers mécanismes sont mis en oeuvre en
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

17
fonction de la nature du polluant et de ses
caractéristiques physico-chimiques (Mc Cutcheon et Schnoor, 2003 ;
Pilon-Smits, 2005).
La phytoremédiation regroupe cinq méthodes qui
sont appliquée selon la contamination et les objectifs de
remédiation (Brooks, 1998 ; Bert et al., 2000) :
Phyto-extraction, Rhizofiltration, phytotransformation, rhizdégradation,
phytostabilisation et phytovolatilisation (Pulford et Watson, 2003 ; Vavasseur
et al., 2003) (Figure 2).

Fig.2 : Techniques de phytoremédiation
(Pilon-Smits, 2005). II.4.1. Phytoextraction ou
phytoaccumulation
La phytoextraction est une technologie in situ
liée aux plantes qui sont capables d'absorber les métaux
lourds (Pb, Cd, Cu, Zn ...) par leurs racines et de les transporter ensuite
vers les parties aériennes (Zheng et al., 2011).
Pour le traitement de la biomasse produite, les auteurs
évoquent souvent l'incinération et la valorisation
énergétique, les cendres, ou le biominerai, seraient
stockées en centre d'enfouissement technique ou recyclées en
métallurgie. En effet, pour certains métaux présentant un
intérêt économique, comme le nickel, le thallium et les
métaux précieux, le biominerai pourrait être purifié
et les métaux recyclés (Ademe, 2010).
L'avantage du procédé est la réduction du
volume de polluants à traiter par concentration dans les cendres.
Celles-ci peuvent ensuite être mises en décharge ou
recyclées en métallurgie. Il faut néanmoins noter que la
phytoextraction est une technique de traitement en développement
(Amrouche, 2015) (Figure 3).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

18
Les plantes utilisées sont des espèces
végétales sauvages hypertolérantes et/ou
hyperaccumulatrices capables deprélever des métaux toxiques dans
les horizons de surface des sols (profondeur < 80cm) et de lesaccumuler dans
leurs parties aériennes (Amrouche, 2015).
Les plantes utilisées pour la phytoextraction doivent
avoir les caractéristiques suivantes (Ann-Peer et al., 2003)
:
? Tolérance à un niveau élevé de
métal ;
? Accumulation raisonnable du métal dans les parties
aériennes ;
? Croissance rapide ;
? Production importante de biomasse au terrain ;
? Avoir un système racinaire dense et capable de coloniser
le sol/ sédiment en
profondeur.

Fig.3 : Processus de phytoextraction (ITRC,
2001).
Deux stratégies sont proposées pour une
phytoextraction réussite des sols contaminés par les
métaux lourds et autres polluants : phytoextraction continue et
laphytoextraction induite ou assistée par des chélateurs
? Phytoextraction naturelle
Pour qu'une plante soit adéquate pour la
phytoextraction d'un polluant donné, elle doit être capable durant
toute sa vie de résister à la toxicité du polluant et de
l'accumuler dans ses parties aériennes. En effet, la phytoextraction
naturelle utilise des plantes hyperaccumulatrices
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

19
qui peuvent extraire de teneurs importantes de métaux
présent sur des sols pollués sans présenter de signes de
phytotoxicité (Quartacciet al.,2006 ; Zheng et al.,
2011) (Figure 4).

Fig.4 : Schéma représentant une
phytoextractioncontinue(Salt et al., 1998).
? Phytoextraction induite ou assistée par des
chélateurs
Elle est basée sur l'utilisation de chélateurs
permettant à des plantes non hyperaccumulatrices mais de biomasse
importante d'absorber des teneurs élevées en métaux
à partir d'un site pollué. La solubilité des métaux
est accrue par des chélateurs telsque l'acide citrique, l'EDTA et
l'EDDS. Ils sont appliqués soit directement sur le sol ou encondition
hydroponiques (Saifullahet al., 2009 ; Shahid et al., 2011 ;
Zheng et al., 2011) soit en pulvérisation foliaire (Meers et
Tack., 2004). C'est ainsi que l'EDTA a permis d'améliorer la
mobilisation et le transport subséquent du Cd, Cr, Cu, Ni, Pb et Zn par
la moutarde indienne et le tournesol (Ann-Peer et al., 2003).
Cependant, la haute solubilité dans l'eau de certains complexes
chélateurs-toxique peut résulter dans leur déplacement
vers les couches plus profondes du sol et ceci consiste un risque potentiel
important décontamination de l'eau souterraines (Ann-Peer et
al., 2003) (Figure 5).

Fig.5 : Schéma représentant une
phytoextraction induite par des chélateurs (Salt et al.
1998).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation
II.4.2. Rhizofiltration

20
La rhizo-filtration est une technique qui met en jeu les
systèmes racinaires de certaines espèces terrestres ou aquatiques
qui absorbent, concentrent et stockent les contaminants des eaux
polluées (Ghosh et Singh, 2005 ; Pilon-Smits, 2005). Cette technique est
généralement utilisée afin de traiter les sites
contaminés aux métaux et radionucléides comme le plomb, le
cuivre, le zinc, le nickel, l'uranium, le césium et le strontium (EPA,
2000).
II.4.3. Phytostabilisation
C'est l'utilisation des plantes pour réduire la
biodisponibilité des polluants par les écoulements ou immobiliser
les composés polluants en les liants chimiquement par
précipitation, stabilisation, absorption ou piégeage de ceux-ci
par la plante, par un stockage dans le système racinaire ou
l'insolubilisassions dans la rhizosphère. Cette technique permet
d'éviter la dispersion des polluants dans les eaux de surface et
souterraines (Cunningham et al., 1995), ainsi de limite
l'érosion et le lessivage du sol (Pilon-Smits, 2005 ; Remon, 2006).
II.4.4. Phytodégradation
La phytodégradation (ou phytotransformation) consiste
à convertir des polluants organiques en composés moins toxiques
voire même être totalement minéralisés. Cette
décomposition est réalisée grâce à des
enzymes variées sécrétées par la plante (Chaudhry
et al., 1998).
II.4.5 .Rhizodégradation (phytostimulation)
Dans la Rhizo-dégradation, la décontamination
est effectuée dans la rhizosphère par les micro-organismes dont
la croissance et l'activité sont stimulées par les plantes
(Pilon-Smits, 2005).
II.4.6. Phyto-volatilisation
Cette technique utilise les plantes pour extraire les
métaux lourds puis les éliminer par évapotranspiration via
les stomates des feuilles ou les tiges. Parmi les métaux lourds, seuls
le mercure et le sélénium sont adapté à cette
technique. La phytovolatilisation présente également l'avantage
de ne pas nécessiter de récolte de la biomasse puisque les
contaminants sont dispersés dans l'atmosphère (Pilon-Smits, 2005
; Dechamp et Meerts, 2003 ; Bert et Deram, 1999).

21
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation
Tableau 03 : Caractéristiques de
différents procédés utilisés en
phytoremédiation
|
Procédés de
la
phytoremédiation
|
Rhizofiltration
|
Phytostabilisation
|
Phyt-extraction
|
Phytovolatilisation
|
Phytodégradation
|
|
Mécanismes
|
Accumulation, adsorption précipitation
|
Complexation,
adsorption, précipitation
|
Accumulation et
Hyperaccumulation
|
Volatilisation
|
Dégradation
rhizosphérique
|
|
Type de polluant
|
Inorganique
|
Inorganique
|
Inorganique
|
Organiques
/inorganiques
(As, Hg, Se)
|
Organiques (solvants
chlorés, herbicides)
|
|
Substrats traités
|
Milieux aqueux
|
Sols, sédiments,
boues
|
Sols, sédiments,
boues
|
Sols, sédiments,
boues
|
Eaux, sols,
sédiments, boues
|
|
Plantes utilisées
|
H. annuus, B. juncea, N.
Tabacum, Zeamays
|
Plantes exclusives
(Agrostis tenuis)
|
Hyperaccumulatrices
ou accumulatrices à
forte
biomasse
|
Plantes modifiées génétiquement
|
Tout type de plante
hébergeant
des
rhizobactéries
|
|
Avantages
|
Utilisation in situ et ex
situ
|
Limite le risque de
lixiviation et
d'érosion
Solution rapide
|
Utilisation in situ
Adaptée aux
pollutions
diffuse
|
Dilution de la pollution dans l'air
Pas de traitement des
déchets
végétaux
|
Pas de traitement des
déchets
végétaux
|
|
Inconvénients
|
Dépend du système racinaire
|
s Dépend du système racinaire
s Nécessite une surveillance s
N'élimine pas le polluant du sol
|
s Dépend du système racinaire
s Retraitement des déchets produits
|
s Risque d'exposition atmosphérique
s n'a pas été quantifié
Utilisation d'OGM
|
s Limité à des polluants s
Facilement dégradables
s Dépend des rhizobactéries
associées
|
|
Références
|
(Dushenkov et al., 1995)
|
(Cunningham et Berti, 2000)
|
(Garbisu et Alkorta,
2001 ;Mc Grath et
Zhao, 2003)
|
(Chaney et al., 1997)
|
(Black, 1995)
|
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

22
II.5. Les avantages et les limites de la
phytoremédiation
La phytoremédiation présente comme toute technique
de dépollution des sols de nombreux intérêts, notamment
d'ordre environnemental et économique et des limites.
Tableau 04 : Avantages et limites de la
phytoremédiation (Cunningham et al., 1995 ; Henry, 2000).
|
Avantages
|
|
|
Utilisé pour une grande diversité de polluants
organiques/inorganiques.
|
|
|
Application in situ/ex situ.
|
|
|
Diminution des perturbations pour le sol par rapport aux
conventionnelles.
|
techniques
|
|
Réduit la quantité de déchets à
stocker jusqu'à 95%.
|
|
|
Diminution de la dispersion dans l'eau (lixiviation) et l'air.
|
|
|
Méthode peu coûteuse en moyen humain et
matériel.
|
|
|
Facile à mettre en oeuvre.
|
|
|
Ecologiquement adaptée et esthétique.
|
|
|
Limite l'érosion, maintien ou améliore la structure
des sols.
|
|
|
Impact positif sur la fertilité et la biodiversité
des sols.
|
|
|
Limites
|
|
|
?
|
Restreint à des sites pollués peu profonds
limités à 1 m dans les sols.
|
|
|
?
|
Durée de remédiation longue.
|
|
|
?
|
Restreint aux sites de faible contamination.
|
|
|
?
|
Traitement des déchets potentiellement dangereux.
|
|
|
?
|
Dépend des conditions climatiques.
|
|
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

23
III.1. Généralités sur les
Atriplex
Les Atriplex sont des plantes arbustes vivaces
appartenant à la famille des chénopodiacées. Ces arbustes
sont considérés comme des plantes fourragères
(Mâalem et al., 2011). Les Atriplex comprennent environ
417 espèces, dont 48 dans le bassin méditerranéen (Le
Houérou., 1992).
D'après Le Houérou et Pontanier (1988), les
espèces d'Atriplex qui ont suscité un
intérêtparticulier sont :Atriplex glauca; Atriplex malvana;
Atriplex repanda; Atriplex atacamensis;Atriplex mollis; Atriplex sembiccata;
Atriplex halimus; Atriplex canescens; Atriplex vesicaria.
Selon ces auteurs, cinq espèces seulement
présentent un réel intérêt pratique dans un avenir
immédiat :
? Atriplexnummularia: en raison de sa
productivité élevée et sa bonne appétibilité
; ? Atriplexhalimus: en raison de sa grande
rusticité et de sa facilité d'implantation ;
? Atriplexcanescens: en raison de sa
haute productivité et son adaptation aux
solssableux ;
? Atriplexglauca: en raison de sa
facilité d'implantation par semis direct et de son rôle
antiérosif ;
? Atriplex mollis : en raison de son
adaptation aux sols hydromorphes salés et de sa bonne
appétibilité.
III. 2. Caractéristiques morphologiques
Les Atriplex ce sont des arbustes qui poussent
extrêmement bien dans le bassin méditerranéen, sur les
sables maritimes du littoral ou à l'intérieur du pays sur les
étendues salées autour des Sebkhas (Edmond, 1963).
Ces plantes en forme des touffes de 0.5 à 3 m de
diamètre et de 0.5 à 3 m de hauteur et dont les fruits sont des
akènes regroupés en glomérules (Benrebiha, 1987) qui
peuvent fournir entre 310g et 1720g/100 pieds selon l'espèce. Leur
composition chimique varie selon l'espèce, la saison et les conditions
pédoclimatiques (Berri, 2009).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

24
III. 3. Répartition géographique des
Atriplex III.3.1. Dans le monde
Les espèces d'Atriplex sont dominantes dans de
nombreuses régions arides et semi-arides du monde, en particulier dans
des habitats qui combinent relativement la salinité élevée
des sols avec l'aridité (Osmond et al., 1980 ; Mc Arthur et
Sanderson, 1984) (Tableau5 ).
Les Atriplex se rencontrent dans toutes les parties
du monde de l'Alaska à la Patagonie, de la Bretagne à la
Sibérie et de la Norvège à l'Afrique du sud (Franclet et
Le Houérou, 1971). L'espèce Atriplex halimus L. est
spontanée à l'intérieur d'une aire relativement vaste
englobant les pays du nord de l'Afrique et de proche et Moyen-Orient depuis les
îles Canaries jusqu'à l'Iran. Vers le sud, l'espèce atteint
le massif de l'Ahagar. En Europe, l'espèce est présente en plus
de zone méditerranéenne en Bulgaire (Le Floch, 1989).
III.3.2. En Algérie
Les espèces d'Atriplex a été
introduite en Afrique du Nord à partir des Etats-Unis "Nouveau Mexique,
Arizona", et à partir de la Tunisie vers l'Algérie pour
être utilisée dans les projets de fixation des dunes dans ces
régions (Franclet et Le Houérou, 1971).
En Afrique du Nord, le genre Atriplex comprend 15
espèces spontanées et 2 espèces naturalisées, soit
07 espèces vivaces, 01 biannuelle et 09 annuelles (Franclet et Le
Houérou, 1971) (Tableau 5).
Par ailleurs, Maire (1962) a identifié une dizaine
d'espèces en Algérie dont les plus répandues sont :
Atriplex halimus et Atriplex portucoides.
L'Atriplex est spontané dans les étages
bioclimatiques semi-arides et arides, les plus grandes superficies
correspondent aux zones dites steppiques (Batna, Biskra, Boussaâda,
Djelfa, Saida, Tebessa et Tiaret) (Pouget, 1980). Le genre Atriplex se
rencontre aussi sur le littoral et même au Sahara,
particulièrement dans la région de Béchar où les
nappes longent les dépressions d'Oued (Benrebiha., 1987).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation
Tableau 05 : Répartition des
espèces d'Atriplex dans le monde (Le Houérou, 1992).
|
Pays ou régions d'espèces
|
|
nombre d'espèces/sous espèces
|
|
pays ou régions nombres
|
|
|
|
|
Etats-Unis
|
110
|
Baja Californie(Mexique)
|
25
|
|
Australie
|
78
|
Afrique du nord
|
22
|
|
Bassin
méditerranéen
|
50
|
Texas
|
20
|
|
Europe
|
40
|
Afrique du sud
|
20
|
|
Ex. URSS
|
36
|
Iran
|
20
|
|
Proche-Orient
|
36
|
Syrie
|
18
|
|
Mexique
|
35
|
Palestine & Jordanie
|
17
|
|
Argentine
|
35
|
Algérie &Tunisie
|
17
|
|
Californie
|
32
|
Bolivie & Pérou
|
16
|
|
Chili
|
30
|
|
|
III. 4. Intérêts de l'Atriplex
III.4.1. Intérêt fourrager
C'est une source de minéraux, vitamines et
protéines pour le bétail (El-Shatnawi et Mohawesh, 2000) ce qui
permet de les utiliser comme une réserve fourragère en
été et en automne, comblant la carence de fourrage qui se
manifeste avant la croissance printanière des espèces
fourragères herbacées (Kessler, 1990).

25
Différentes observations expérimentales ont
démontré que, grâce à cet arbuste, le bétail
peut supporter de longues périodes de carence alimentaire dues à
la sécheresse (Le Houérou, 1980). En effet une bonne formation
d'Atriplex halimus peut produire jusqu'à cinq tonnes par
hectare de matière sèche et par an sur des sols
dégradés ou salins inutilisables pour d'autres cultures (Dutuit
et al., 1991).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation
III.4. 2. Intérêts économique et
agronomique

26
? Mise en valeur des sols salés
Concernant la salinité, les Atriplex
présentent une bonne tolérance aux conditions
défavorables du milieu (Glenn et al, 1995) : en milieu
synthétique liquide l'Atriplex halimus supporte des
concentrations de chlorure de sodium voisines à celles de l'eau de mer
(Glenn et al ,1995). Ils réduisent la salinité des sols
(Anderson, 1993) en exportant d'importantes quantités de sel qui peuvent
égaliser les 1100 Kg de NaCl en une année de culture par un
hectare (Franclet et Le Houérou, 1971).
? Mise en valeur des sols pauvres
Les Atriplex sont les arbustes les mieux
adaptées aux régions arides et aux sols pauvres. D'autre part, la
couverture d'Atriplex accroit considérablement la
perméabilité des sols et l'augmentation de drainage dans les
horizons superficiels. Elle permet la reconstitution d'un tapis
végétal herbacé (Benrebiha, 1987).
Les Atriplex permettent également de remettre
en état de nombreux pâturages à flore et sols
dégradés (Benrebiha, 1987). En Algérie les essais
réalisés dans les régions de Djelfa et Boussaâda
avec plusieurs espèces d'Atriplex dans le cadre du «
barrage vert » ont donné des résultats satisfaisants
(Benrebiha, 1987).
? Fixation des dunes
Ils sont utilisés avec efficacité pour la
fixation des dunes, grâce à leur forme en touffe puisqu'ils
peuvent atteindre les 3 m de diamètre et 3m de hauteur à cela
s'ajoute leur pérennité (Edmond, 1963).
III.4. 3. Intérêt thérapeutique
Certaines espèces d'Atriplex, sont connues
pour leur intérêt médicinal traditionnel, à savoir
dans le traitement digestif, respiratoire, uro-génital, vasculaire, et
possèdent des propriétés antihypercholes
térolémiante, antipyrétique, antirhumatismale (DeFeo et
Senatore, 1993) et antihyperglycémiante (De Feo et Senatore, 1993 ;
kambouche et al., 2011).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

27
III.5. Atriplex halimus L.
Arbuste à développement estival, peut atteindre
1 à 3 mètres, de diamètre de hauteur, port variable
dressé ou étalé (Cherfaoui, 1987). Les feuilles sont
alternées, nettement pétiolées, plus ou moins charnues,
couvertes de poils vésiculeux blanchâtres, ovales et
entières. Fleurs monoïques, inflorescences en panicules
d'épis, valves fructifères cannées à la base, de
0.3 à 0.4 cm sur 0.4 à 0.5 cm, réniformes ou plus ou moins
deltoïdes. Floraison Mai-Décembre. Les graines sont
entourées de 2 valves à bords denticulés (3 dents) de
dimensions variant entre 5 et 7 mm. (Cherfaoui, 1987). (Figure 6).
III.5.1. Origine
L'origine de cette espèce n'est pas bien connue,
certains auteurs présument qu'elle est native d'Afrique du Nord
où elle est très abondante (Kinetet al., 1998), selon
ces mêmes auteurs, il parait qu'elle tolère bien les conditions
climatiques et pédologiques des régions arides et semi-arides
comme la sécheresse et la salinité (Kinet et al., 1998). D'autres
estime qu'elle est d'origine de l'Austauralie, et s'étend aux parties
arides et semi-arides du monde (Osman et Ghassalie., 1997). C'est une
espèce spontanée qui croit en bord de la mer sur le littoral de
la Méditerranée, à l'intérieur de l'Algérie
et de la Tunisie dans les sols un peu salés (Ozenda., 1977).
Dans l'Algérie, certaines espèces sont
menacées de disparaitre (Chamard., 1993), d'autre manifestent des
mécanismes d'adaptation (Batanouny., 1993), c'est le cas des
atriplex dans ces régions (Benabadji et Ghazlaoui., 2007). En
Algérie, des essais ont été réalisés sur le
cordon dunaire dans la région de Djelfa et Boussaâda avec
plusieurs espèces d'atriplex semblent donné des
résultats satisfaisants dans la fixation des dunes (Benrebiha.,
1987).
Espèce originaire du nord-ouest Américain, on la
trouve au Colorado, Utah, Wyoning, Nevada, New Mexico, Ouest du Texas et le
Nord du Mexique (Maalem., 2002). Elle s'est largement propagée en
Afrique du Nord et au Moyen-Orient. Elle est cultivée dans les
étages humides et subhumides, semi arides et arides (H.C.D.S., 1996).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

28
III.5.2. Systématique

D'après Linné Carl (1753), l'Atriplex halimus
appartient à :
Règne végétal
Embranchement : Spermaphytes
Sous embranchement : Angiospermes
Classe : Dicotylédones
Sous classe :
préastéridées
Ordre : Caryophyllades
Sous Ordre : chénopodiales
Famille : Amaranthacées
Genre : Atriplex.
Espèce : Atriplexhalimus L.
Fig.6: Atriplex halimusL.
Atriplex
halimus est divisé en deux sous espèces (Franclet et Le
Houérou, 1971) :
Atriplex halimus Subp
halimus: généralement plus
feuillée se rencontre sur les zones du littoral semi-aride à
humide.
Atriplex halimus Sub
pschweifurthi : rameaux florifères
dépourvus de feuilles ; c'est une espèce des zones arides et
désertiques.
III.6. Atriplex canescens (Pursh) Nutt
C'est un arbuste buissonneux de 1 à 3 m de hauteur
forme une touffe, peut atteindre 3 m de diamètre avec proportion
importante de biomasse lignifiée, les feuilles de couleur vert
grisâtre, entières alternées, et courtement
pétiolées de 3 à 5 m de long et de 0,3 à 0,5 cm de
large, les inflorescences sont dioïques, les valves fructifères ont
4 ailes à bord denticulés de 10 à 20 mm dimension
(Franclet et Le Houérou, 1971).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation
III.6.1. Origine

29
L'air d'origine d'Atriplex canescens s'étend
du Mexique central au Canada (Amérique du nord). Espèce
originaire du nord et Ouest américain, on la trouve au Colorado, Utah,
Wyoming, Nevada, New Mexico, Ouest du Texas et le Nord du Mexique. Elle est
introduite en Afrique du nord à partir des états unis (Nouveau
Mexique, Arizona), et à partir de la Tunisie vers l'Algérie pour
être utilisée dans les projets de fixation des dunes (Gougue,
2005) (Figure 7).
III.6.2. Systématique de l'espèce

D'après LinnéCarl (1753), l'Atriplex canescens
appartient à :
Règne végétal
Sous règne Tracheobionta
Embranchement
Spermaphytes
Sous-embranchement Angiospermes
Classe Dicotylédones
Sous- classe Apétales
Série Hermaphrodites
Ordre Centrospermales Fig.7 :
Atriplex canescens (Pursh) Nutt.
Famille Chénopodiacées
(Amaranthaceae)
Genre et espèce Atriplex canescens
(Pursh) Nutt.
III.7. L'utilisation des atriplex en
phytoremédiation
Plusieurs Atriplex sp. ont des
caractéristiques excellentes qui contribuent beaucoup à la
réduction de l'érosion éolienne et hydrique du sol par la
structure de son système racinaire (Grantzet al., 1998), et par
leur port rampant et marcottant naturellement (Dutuit., 1999). Certains
estiment qu'elle pourrait contribuer à la désalinisation des
sols, dans les régions arides (Dassarma et Arora., 2001).
Partie I : Synthèse
bibliographique Chapitre II : Phytoremédiation

30
De même, les espèces d'Atriplex
annuelles sont connues pour contenir de fortes teneurs en fer, en
manganèse, en aluminium et en molybdène (Voorhees et al.,
1991), ainsi que le sélénium en grandes quantités,
dans ce dernier cas, la plante pourrait être capable d'en assurer la
volatilisation (Vickerman et al., 2002).

Partie II
Etude comparative de la réponse
d'Atriplex halimus et Atriplex canescens
vis-à-vis au stress métallique

32
Partie II: Etude comparative de la
réponse de l'A.halimus et A.canescens vis-à-vis
au stress métallique
II.1. Réponse biochimique de l'Atriplex
halimusL.
et d'Atriplex canescens (Pursh) Nutt. au
stress métallique de plomb
Dans ce chapitre, on fait une comparaison de la réponse
de deux espèces d'Atriplex : Atriplex halimus L. et
Atriplex canescens (Pursh) Nutt, sous l'effet de trois doses de plomb
(0, 5000 et 10000 ppm), à travers l'analyse des composés
biochimiques et leurs variations au niveau des parties aériennes et
souterraines de ces deux espèces. Voir tableau 06.
Tableau 06 : Doses des métaux lourds
appliquées.
|
Espèce
|
Doses du plomb
|
Paramètres étudiés
|
|
Atriplex halimus L.
|
0 ppm
5000 ppm
10000 ppm
|
chlorophylle
|
|
sucres solubles
|
|
proline
|
|
Atriplex canescens (Pursh) Nutt.
|
Eléments minéraux
|
K+
|
|
Na+
|
|
Dosage de Pb
|
II.2.1. Teneur en chlorophylle a, b et totale des
feuilles de l'Atriplex halimus et Atriplex canescens
stressée par le plomb
Les résultats obtenus (tableau 7) montrent une
diminution de la teneur en chlorophylle a, b et totale dans les feuilles des
plantes de l'Atriplex canescens et halimus au fur et à
mesure que les doses du plomb appliquées augmentes, dont les teneurs les
plus élevés sont enregistrées chez les deux espèces
en absence de plomb. Tandis que les teneurs de la chlorophylle a, b et totale
les plus basses sont notées en présence du plomb et chez les
plantes de l'atriplex halimus comparativement à l'Atriplex
canescens.
La teneur en chlorophylle b de l'Atriplex canescens
est largement supérieure que la chlorophylle a, où on a
remarqué une augmentation de 50% de teneur en chlb par rapport à
la chl a, Alors que chez les plantes de l'atriplex halimus la valeur
de la chl b est légèrement supérieur à la teneur en
chl a. Les valeurs de la teneur en chl totale de l'atriplex canescens
sont plus élevées que les valeurs enregistrées chez
l'atriplex halimus.
L'analyse statistique montre que l'effet du plomb sur la
chlorophylle a et totale dans les feuilles de l'atriplex canecsens est
significatif, Alors que la chlorophylle b chez l'atriplex

33
Partie II: Etude comparative de la
réponse de l'A.halimus et A.canescens vis-à-vis
au stress métallique
canecsens et la chl a, b et totale au niveau des
feuilles de l'atriplex halimus sont non significatif.
Tableau 07 : Teneur en chl a, b et totale des
feuilles des deux espèces d'Atriplex : halimus et canescens
sous l'effet de plomb
|
Espèces Doses
de Pb
|
Atriplex canescens
|
Atriplex halimus L
|
|
Chl a
|
Chl b
|
Chl t
|
Chl a
|
Chl b
|
Chl t
|
|
0 ppm
|
1.39
|
2.51
|
3.91
|
0,128
|
0,207
|
0,335
|
|
5000 ppm
|
1.26 *
|
2.39 NS
|
3.65 NS
|
0,126 NS
|
0,195 NS
|
0,321 NS
|
|
10000 ppm
|
1.16 NS
|
2.21 NS
|
3.38 NS
|
0,105 NS
|
0,17 NS
|
0,275 NS
|
|
Plomb
|
|
|
|
|
|
|
II.2. Teneur en sucres solubles de l'Atriplex
canescens et Atriplex halimus stressée au
plomb
Les résultats trouvés (tableau 8) pour les
plantes stressées au plomb à différentes concentrations
révèlent une augmentation de sucres solubles dans les feuilles et
les racines chez les deux espèces d'atriplex.
Les valeurs de sucres solubles les plus élevées
sont enregistrées dans les feuilles et les racines d'Atriplex
halimus en présence et en absence de plomb comparativement aux
celles enregistrées chez l'Atriplex
canescens.
Les teneurs obtenus en sucres solubles sont plus
élevées dans les feuilles de la plante de l'Atriplex
canescens que chez les racines, bien que les teneurs en sucres dans les
racines de l'atriplex halimus restent plus élevés, mais
ne semblent pas trop varier pour toutes les plantes sous tous les
traitements.
L'analyse statistique des teneurs en sucres solubles
enregistrées dans les feuilles et racines de l'Atriplex canescens
sont hautement significatives, Alors que les valeurs des sucres solubles
chez l'Atriplex halimus sont significatives au niveau des feuilles et
des racines sous l'effet de tous les traitements au plomb.

34
Partie II: Etude comparative de la
réponse de l'A.halimus et A.canescens vis-à-vis
au stress métallique
Talbleau 08 : Teneurs en sucres solubles dans
les feuilles et les racines de
l'A. halimus et A. canescens
|
Espèces Doses de Pb
|
Atriplex canescens
|
Atriplex halimus L
|
|
Feuilles
|
Racines
|
Feuilles
|
Racines
|
|
0 ppm
|
8.04
|
3.99
|
107
|
201
|
|
5000 ppm
|
17.28**
|
5.46 **
|
159.16 *
|
212 *
|
|
10000 ppm
|
20.77**
|
8.10 **
|
165.91 *
|
242 *
|
|
Plomb
|
|
|
|
|
** hautement significatif *
significatif
II.3. Teneur en proline de l'Atriplex canescens et Atriplex
halimus stressée au plomb
Les résultats enregistrés (tableau 9) montrent
que le taux de la proline dans les feuilles et racines chez les deux
espèces d'Atiplex augmente progressivement avec les doses
croissantes du plomb appliquées dont chez les deux espèces et en
présence de plomb, les valeurs de proline enregistrées au niveau
de racines sont inférieures aux celles enregistrées dans les
feuilles.
Pour les deux espèces et dans les feuilles des plantes
stressées à 10000 ppm de Pb, la teneur en proline est d'environ
deux fois plus que celle enregistrée dans les feuilles des plantes
témoins.
L'analyse statistique montre que le plomb a un effet
significatif sur l'accumulation de la proline dans les feuilles et les racines
chez les deux espèces d'Atriplex canescens et l'atriplex
halimus.

35
Partie II:Etude comparative de la réponse
de l'A.halimuset A.canescens vis-à-vis au stress
métallique
Tableau 09 : Teneurs en proline
enregistrées chez les deux espèces d'Atriplex en absence
et en présence de plomb
|
Espèces
Doses de Pb
|
Atriplex canescens
|
Atriplex halimus L
|
|
Feuilles
|
Racines
|
Feuilles
|
Racines
|
|
0 ppm
|
7.4
|
7.9
|
7.1
|
5.90
|
|
5000 ppm
|
10.4*
|
8.0
|
11.0*
|
8.40 *
|
|
10000 ppm
|
13.6*
|
11.14*
|
15.0 *
|
9.75 *
|
|
Plomb
|
|
|
|
|
|
II.4. Teneur en Eléments minéraux de
l'Atriplex canescens et Atriplex halimus stressée au
plomb
II.4.1. Teneur en sodium de l'A. canescens et A. halimus
stressée au plomb
Les résultats obtenus (Tableau 10) montrent une
diminution de la teneur en sodium dans les feuilles et racines de
l'atriplex canescens au fur et à mesure que les doses de plomb
appliquées augmentent comparativement aux teneurs en sodium
enregistrées dans les feuilles et racines d'Atriplex halimus
où ils ont augmenté en présence de plomb. Chez les
deux espèces, Les teneurs en sodium dans les racines des plantes sont
inférieures par apport aux celles enregistrées dans les
feuilles.
Les teneurs en sodium les plus élevées sont
enregistrées dans les feuilles d'Atriplex halimus
strésseés par le plomb dont la valeur la plus
élevée est remarqué à 5000 ppm comparativement aux
celles enregistrées au niveau des feuilles l'atriplex canescens
où la valeur la plus basse est notée à 10000 ppm.
L'analyse statistique des résultats montre que le plomb
a un effet significatif sur l'accumulation de sodium dans les feuilles de
l'atriplex canescens alors que ce métal n'a aucun effet
significatif sur les racines de cette espèce. Tandis que les
résultats de l'accumulation de sodium dans de l'atriplex halimus
révèle un effet significatif du plomb sur la présence
de cet élément minéral dans les deux organes
végétatifs de l'atriplex halimus.

36
Partie II:Etude comparative de la réponse
de l'A.halimuset A.canescens vis-à-vis au stress
métallique
Tableau 10 : Teneur en sodium dans les
feuilles et racines de l'Atriplex canescens et Atriplex
halimus
|
Espèces Doses de Pb
|
Atriplex canescens
|
Atriplex halimus L
|
|
Feuilles
|
Racines
|
Feuilles
|
Racines
|
|
0 ppm
|
46.74
|
12.32
|
56.18
|
9.84
|
|
5000 ppm
|
23.50*
|
7.50
|
70.67*
|
9.84
|
|
10000 ppm
|
17.40*
|
10.17
|
53.25
|
18.32*
|
|
Plomb
|
|
|
|
|
II.4.2. Teneur en potassium de l'Atriplex canescens et
Atriplex halimus stressée au plomb
Les résultats enregistrés (tableau 11) montrent
que l'accumulation de potassium dans les feuilles et racines des plantes de
l'Atriplex canescens et atriplex halimus augmente proportionnellement
avec la concentration du plomb appliquée. Chez les deux espèces
et en présence de plomb, le potassium s'accumule beaucoup plus dans les
feuilles contrairement aux racines, ce qui dépasse le double de sa
valeur. De plus, sous l'effet du stress métallique, On a
enregistré une augmentation plus élevée des teneurs en
potassium au niveau des feuilles et racines de la plante Atriplex canescens
comparativement à l'Atriplex halimus.
L'analyse statistique indique un effet significatif du plomb
sur l'accumulation du potassium dans les feuilles et racines chez les deux
espèces : l'atriplex canecsens et l'atriplex
halimus.
Tableau 11 : Teneur en potassium dans les
feuilles et racines de l'Atriplex canescens et Atriplex
halimus
|
Espèces Doses de Pb
|
Atriplex canescens
|
Atriplex halimus L
|
|
Feuilles
|
Racines
|
Feuilles
|
Racines
|
|
0 ppm
|
116.20
|
35.60
|
65.92
|
25.06
|
|
5000 ppm
|
125.77*
|
54.00*
|
73.96*
|
36.66*
|
|
10000 ppm
|
132.40*
|
52.50*
|
81.99*
|
30.42*
|
|
Plomb
|
|
|
|
|

37
Partie II:Etude comparative de la réponse
de l'A.halimuset A.canescens vis-à-vis au stress
métallique
II.5. Teneur en plomb dans les feuilles et racines de
l'Atriplex canescens et Atriplex halimuss tressée par le
plomb
Les résultats obtenus (tableau 12) montrent une
augmentation de la teneur en plomb dans les deux organes
végétatifs (feuilles et racines) chez les deux espèces au
fur et à mesure que les doses du plomb appliquées augmentent.
On remarque chez les deux espèces,
l'accumulation du plomb dans les parties racinaires des plantes
stressées au plomb est largement supérieure à celle des
parties aériennes. De plus, on remarque que la plante l'atriplex
canecsens a une capacité d'accumulation plus élevée
comparativement à l'atriplex halimus.
Les analyses statistiques indiquent que l'accumulation de
Plomb est significative dans les feuilles et racines de l'Atriplex
canescens et l'Atriplex halimus.
Tableau 12 : Teneur en plomb dans les
feuilles et racines de l'Atriplex canescens et Atriplex halimus
|
Espèces Doses de Pb
|
Atriplex canescens
|
Atriplex halimus L
|
|
Feuilles
|
Racines
|
Feuilles
|
Racines
|
|
0 ppm
|
0
|
0
|
0
|
0
|
|
5000 ppm
|
0.69
|
1.56
|
0,522
|
1,097
|
|
10000 ppm
|
0.807
|
2.225
|
0,941
|
1,635
|
|
Plomb
|
|
|
|
|

Partie II
Chapitre II : Discussion générale
Partie II Chapitre II: Discussion
générale

39
II.1. Effet du plomb sur paramètres biochimiques de
l'Atriplex
L'Atriplex, qui constitue une espèce
clé dans les zones de pâturages, doit sa survie à ses
aptitudes endogènes grâce auxquelles elle s'établit et se
fixe dans ces mêmes zones à fortes contraintes environnementales
(Zidane et al., 2010 ; Benaradj et al., 2014).
II.1.1. Effet de plomb sur la teneur en chlorophylle de
l'Atriplex
La teneur en pigments chlorophylliens est souvent
utilisée pour évaluer l'impact de nombreux stress
environnementaux. Selon les résultats obtenus de Babou., (2014) et
Khedim (2019) la présence du plomb provoque une diminution de la teneur
en chlorophylle (chl a, chl b et chl t) chez les deux espèces :
Atriplex canescens et Atriplex halimus exposées
à différentes concentrations en plomb (5000 et 10000 ppm) par
rapport aux témoins. Les mêmes résultats ont
été obtenus chez le radis (Raphanus sativus L.)
cultivés dans des sols pollués par le plomb (Gopal et Rizvi, 2008
; Biteur et al., 2011) le maïs, Chlorella vulgaris et
Pfaffia glomerata (Ghani et al., 2010 ;
Bajguz, 2011 ; Gupta et al., 2011).
L'exposition au Pb conduit à une forte inhibition de la
photosynthèse, du rendement photosynthétique, et à une
limitation du taux d'assimilation de CO2. Cette inhibition s'explique par la
diminution des teneurs en chlorophylles et en caroténoïdes
généralement constatée (Kosobrukhov et al., 2004.
Irfan Qureshi et al., 2005 ; Gopal et Rizvi,
2008).
Au niveau physiologique une exposition au plomb entraîne
de nombreuses perturbations dans les parties aériennes, en particulier
l'appareil photosynthétique (Seregin et Ivanov, 2001 ; Sharma et Dubey,
2005). Plusieurs travaux montrent que le plomb a une influence sur la
réduction de la teneur en pigments chlorophylliens. Ceci pourrait
être attribué d'une part, au stress oxydatif qui provoque
l'inhibition de l'acide aminolévuliniquedéshydratase (ALAD), une
enzyme importante dans la biosynthèse de la chlorophylle (Pereira et
al., 2006) et d'autre part, le plomb peut agir directement sur le
transport des électrons et des enzymes du cycle de Calvin (en
particulier la Rubisco) et indirectement induit une diminution de la teneur en
chlorophylle (Chatterjee et Chatterjee, 2000).
Le plomb, en induisant une fermeture des stomates, limite
considérablement les flux gazeux entre les feuilles et le milieu
extérieur. Cette limitation du flux de CO2 entrant est
considérée comme la cause principale de la forte réduction
de la fixation du CO2 (Bazzaz et al., 1975 ; Parys et al.,
1998). Les ions du plomb peuvent aussi être la cause principale de la
détérioration de la structure et de la composition des
thylakoïdes et des chloroplastes, ce qui a pour effet d'altérer les
photosystèmes (Yruela, 2005).
Partie II Chapitre II: Discussion
générale

40
II.1.2. Effet de plomb sur la teneur en sucres solubles de
l'Atriplex
Les résultats obtenus de Babou., (2014) et Khedim
(2019) montrent que la présence du plomb dans le sol affecte directement
l'Atriplex (canescens et halimus) en se traduisant par une
augmentation de la synthèse des sucres solubles au niveau de leurs
feuilles et racines par rapport aux plantes témoins dont cette
augmentation est plus importante dans les feuilles comparativement aux racines
chez l'Atriplex canescens et le contraire chez l'Atriplex halimus.
Ceci s'accorde avec les travaux de belarbi (2018) et Bennabi (2005) qui
rapportent une augmentation des sucres solubles chez l'atriplex halimus
stressée par le plomb.
L'accumulation des sucres solubles est parmi les
phénomènes les plus observés dans la réponse de
stress, Costa et Spitz (1997) puis Dubey et Singh (1999) suggèrent que
cette accumulation de glucide soluble a été rapportée en
réponse à différents stresses environnementaux et
particulièrement les métaux, stratégie adoptée par
les plantes afin de résister aux contraintes du milieu Bajji et al
(1998), El Midaoui et al (2007).
II.1.3. Effet de plomb sur la teneur en proline de
l'Atriplex
Les résultats obtenus (Babou , 2014) montrent que la
teneur en proline dans les feuilles et racines chez les plantes
stressées par le plomb (A.canescens et A.
halimus)augmente proportionnellement avec les doses de plomb
appliquées dont cette augmentation est plus élevée dans
les feuilles que dans les racines chez les deux espèces. Ces
résultats sontcorroborés avec ceux de Flagella et al.
(2006), qui rapporte que l'apport d'acétate de plomb induit une
augmentation importante en proline chez le radis (Raphanus sativus).
Ainsi que L'accumulation de la proline est signalée chez Artichoke
(Cynarascolymus L.) (Karimi et al., 2012), Une telle
augmentation de la proline a également été observée
sous l'effet d'autres métaux tels que le Zn, le Pb, le Cd et le Cu chez
le tournesol (Kastori et al., 1992), le Cd et le Pb chez
Lemnapolyrrhiza L. (John et al., 2008), le Cd chez
Atriplex halimuss (Bouzid, 2009) et chez Brassicajuncea
(Irfan et al., 2014).
L'accumulation de la proline est un résultat de
l'inhibition de son oxydation (Flagellaet al., 2006), l'augmentation
du catabolisme des protéines et/ou une synthèse de nouveau de cet
acide aminé (Ben khaled et al., 2003 ; Djeddi, 2006). Selon
Hassani et al. (2008),
Partie II Chapitre II: Discussion
générale

41
cette accumulation permet la protection de la membrane cellulaire
et participe à l'ajustement osmotique, chélation et
détoxification des métaux, protection des enzymes,
régulation de l'acidité cytosolique, stabilisation de la
machinerie de la synthèse protéique et piégeage des
espèces réactives de l'oxygène (Sharmila et Pardha
Saradhi, 2002).
Effet de plomb sur la teneur en éléments
minéraux de l'Atriplex II.1.4. Effet de plomb sur la teneur en
sodium de l'Atriplex
Les résultats trouvés (Babou, 2014) montrent une
augmentation du taux du sodium chez l'Atriplex halimus comparativement
l'Atriplex canescens à en fonction des doses de plomb
appliquées dont l'accumulation de sodium est plus importante dans les
feuilles que dans les racines chez les deux espèces d'Atriplex
stréssées par le plomb.
Ces résultatssont en accord avec Azzouz (2011) qui a
enregistré une accumulation desodium sous le nitrate de plomb pour les
feuilles et les racines de l'Atriplex halimus et dans les feuilles de
la fève. Ainsi que Maneva et al. (2013) trouvent aussi une
augmentation de l'accumulation de sodium sous le nitrate de plomb chez la
tomate (Lycopersicon esculentum Mill.). Une accumulation importante de
sodium est signalée chez l'Atriplex halimus au niveau foliaire
sous une combinaison du sel et du plomb, alors que le contraire est
enregistré pour les racines (Ghellai., 2013). Pour l'Atriplex
canescens, notre résultat montre une diminution du Na+
dans les feuilles et les racines alors qu'Azzouz (2011) rapporte cette
réduction du cation seulement dans les racines de la fève
(Vicia faba L.) sous l'effet de plomb. Les mêmes observations
sont rapportées, chez le blé (Khizar et al., 2013 ;
Lamhamdi et al., 2013), l'épinard (Lamhamdi et al.,
2013), et chez l'Atriplex canescens sous l'action combinée du
sel et du plomb (Ghellai., 2013).
II.1.5. Effet de plomb sur la teneur en potassium
l'Atriplex
Les résultats obtenus (Babou, 2014) enregistrent une
augmentation en potassium dans les feuilles et racines des plantes
d'Atriplex sous l'effet de plomb, dont l'accumulation du potassium est
plus importante dans les feuilles que dans les racines chez les deux
éspèces d'Atriplex. Ces résultats sont
confirmés d'ailleurs par les résultats d'Azza et Mazher (2006)
chez Leuceana leucocephala et chezla tomate (Lycopersicon
esculentum Mill.) par Maneva et al., 2013. Kibria et al.
(2009) rapportent les mêmes observations chez les feuilles et les racines
d'Amaranthus oleracea L. et les racines d'Amaranthus gangeticus
L.
Partie II Chapitre II: Discussion
générale

42
II.1.6. Teneur totale en plomb l'Atriplex
Les résultats obtenus par Ouini (2012) montrent une
augmentation de la teneur de plomb accumulée par les plantes d'triplex
stressées au fur et à mesure que les doses de plomb
appliquées augmentent, dont l'accumulation de ce métal est plus
importante au niveau des racines que des feuilles chez d'Atriplex canescens
par rapport à l'Atriplex halimus.
Les teneurs en Pb enregistrées dans les parties
aériennes reflètent les concentrations moins importantes par
rapport aux racines des plantes d'Atriplex. La majorité du Pb
absorbé par les plantes persiste dans les racines et seulement une
faible proportion est transloquée vers les parties aériennes de
la plante (Huang et Cunningham, 1996 ; Huang et al., 1997), soulignant
une faible mobilité du plomb des racines vers les parties
aériennes et donc une immobilisation dans les racines (Yoon et al.,
2006). Ceci peut être due à son affinité pour les
structures végétales de la surface racinaire et/ou à une
accumulation du plomb dans l'apoplasme jusqu'au blocage par la bande
casparienne (Seregin et Ivaniov, 1997 ; Verma et Dubey, 2003).
Des études ont montré que la présence de
ligands organiques dans le milieu de culture augmente le
prélèvement du plomb et que les complexes qu'ils forment avec le
plomb sont mobiles dans les plantes, permettant la translocation vers les
parties aériennes (Vassil et al., 1998 ; Hammer et Keller, 2002
; Ruley et al., 2006 ; Cui et al., 2007).

Conclusion générale

43

44
Le présent travail, a permis d'étudier les
variations de quelques paramètres biochimiques comme les teneurs en
chlorophylles, en sucres solubles, en proline, en sodium, en potassium ainsi le
dosage de plomb dans les feuilles et racines des plantes de deux espèces
d'Atriplex : Atriplex canescens et Atriplex halimus
cultivées dans des substrats sableux enrichis par le plomb.
La réponse biochmique des plantes d'atriplex
vis-à-vis au stresses due au plomb par des doses croissantes, aboutit
aux résultats suivants :
? Une diminution de la teneur en pigments chlorophylliens chez
les deux espèces d'Atriplex avec l'augmentation de la
concentration de plomb appliquée, dont la diminution est plus importante
chez l'Atriplex halimus comparativement à l'Atriplex
canescens. Toutes ces modifications remarquées pourraient
être prises comme marqueurs biochimiques de toxicité de plomb sur
les plantes.
? Les sucres solubles semblent également s'accumuler
dans les tissus des plantes d'atriplex sous l'effet stressant du
plomb. La présente étude a montré que chez les plantes
d'Atriplex canescens traitées par plomb, les sucres
s'accumulent davantage et à des concentrations élevées, au
niveau des feuilles que des racines comparativement au l'Atriplex halimus
dont l'accumulation des sucres est plus importante dans les racines que
dans les feuilles.
? L'augmentation de la concentration de plomb induit une
augmentation de la teneur en proline et en potassium dans les feuilles par
rapport aux racines des plantes d'Atriplex (les deux espèces).
L'accumulation de la proline est très importante chez l'Atriplex
halimus stressée comparativement à l'Atriplex
canescens, alors que cette dernière accumule plus de potassium dans
ces organes végétatifs comparativement à l'Atriplex
halimus.
? L'application de stress métallique (plomb) sur
l'Atriplex canescens entraîne une accumulation moins importante
du sodium dans les racines que dans les feuilles de cette espèce, alors
que chez l'Atriplex halimus, elle induise une augmentation de cet
élément minéral dans les feuilles plus que racines.

45
? Les plantes d'Atriplex canescensont la
capacité d'accumulation des concentrations élevées de
plomb dans leurs racines par rapport aux plantes d'Atriplex halimus.
Alors que les deux espèces d'Atriplex ont montré
leur faible capacité de translocation de ce métal des racines
vers les feuilles.
En conclusion, Les résultats trouvés
suggèrent que les deux espèces d'Atriplex méritent
d'être exploitées en vue de l'utiliser pour la dépollution
des sols pollués par le plomb par les approches de la
phytoremédiation, car elles possèdent des
propriétés particulières de résistance naturelle
à de nombreuses contraintes abiotique.
En perspective : Suite aux résultats que nous venons de
décrire, nous pouvons proposer quelques orientations afin d'apporter de
nouvelles informations sur les réponses des plantes d'Atriplex
aux stress métalliques.
? Une expérimentation directe de l'atriplex
sur des sols pollués par le plomb en Algérie dans des
conditions naturelles permettrait d'étudier les capacités
d'Atriplex à extraire le plomb présent dans le sol et
les proposer comme une plante phytoremédiatrice afin de dépolluer
et réhabiliter des sites pollués dans notre pays.
? Il serait indispensable de faire une étude
génétique pour l'identification des gènes responsables de
la tolérance au stress métallique dû au plomb.
? Une étude histologique ou anatomique au niveau
racinaire et des tiges sera très intéressante pour savoir les
lieux de stockage du plomb par la plante.
? Généralement les sols sont pollués par
plusieurs métaux dans ce contexte, il serait souhaitable de faire
d'autres études sur ces espèces sous diverses contraintes
métalliques.

Références bibliographiques
·
A
.
Références
bibliographiques

47
Abreu, C.A., de Abreu, M.F., Andrade, J.C. (1998).
Distribution of lead in the soil profil evaluated by DTPA and
Mehlich-3 solution. Bragantia 57, 185-882.
· ADEME. 2010. Agence de
l'Environnement et de la Maitrise de l'Energie ;
http://www2. ademe.fr/servi
et/KB ase Show ? Sort = 1 & ci d=96& m=3 & cati d=10157.
· Adriano, D.C. (2001). Trace elements
in terrestrial environments: Biochemistry, bioavailability and risks of metals.
Springer-Verlag, New York.
· Alloway B.J., 1995. Heavy metals in
soils. Blackie Academic & Professional, London, 2ndEdition, 368
p.
· Amrouche,,. O , 2015. Contribution
à l'étude du stress métallique sur le Colza (Brassica
napus) soumis à differentes doses de plomb : Approche
expérimentale. Master 2 Protection de l'environnement. Université
MOULOURD MAMMERI de Tizi Ouzou.
· Anderson JA, Churchill GA, Autrique JE,
Tanksley SD, Sorrells ME. 1993. Optimizing parental selection for
genetic linkage maps. Genome. 36 (1), 181-186.
· AneelaK., 2013 - Effect of Heavy
Metal Lead (Pb) Stress of Different Concentration on Wheat (Triticum
aestivum L.). Middle-East Journal of Scientific Research 14 (2):
148-154.
· Annane, H et Haynoussi, L.
2015. La dépollution naturelle. Master 2
Géomatériaux et Environnement. Université Paris-Est
Marne-La-Valée. Ann-Peer W., Baxter I.R., Richards E.L., Freeman
J.L et Murphy A.S., 2003. Phytoremediation and hyperaccumalator
plants. Int J Phytorem.5: 89-103
· AnY J
(2006)."Assessmentofcomparativetoxicitiesofleadandcopperusingplantassay."
Chemosphere 62 : 1359-1365.
· Azza A et Mazher M., 2006 - Reponse
of Leuceana leucocephala Seedling Grown underlead pollution in sandy Soil.
World journal of agricultural sciences 2(2): 217222.
·

Références
bibliographiques
Azzouz F., 2011 - Effet de l'interaction
plomb-salinité sur les réponses physiologiques etbiochimiques
d'une halophyte (Atriplex halimus L.) et d'une glycophyte (Vicia
fabaL.). Mémoire de magistère. P 65.
B .
· Babou FZ., 2014. L'action du plomb
sur les marqueurs de résistance d'Atriplex halimus L. et
d'Atriplex canescens (Pursh) Nutt.. Université Abdelhamid Ibn
Badis de Mostaganem. P 30.
· Bajji, M.,Kinet.J.M et Lutts 1998.
Salt stress effets on roots and leaves of Atriplex halimus .L
.and their corresponding callus cultures plants science
Vol.137,n°2pp.131-142.
· Bajguz A (2011). Suppression of
Chlorella vulgaris growth by cadmium, lead, andcopper stress and its
restoration by endogenous brassinolide. Arch Environ Contam Toxico.60:
406-416.
· Baize D (1997). "Teneurs totales en
éléments traces métalliques dans les sols (France). "INRA
Editions, Paris, 408 pp.
· Baize, D, 2002. Les
éléments traces métalliques dans les sols. INRA
éditions.
· Baker AJM, McGrath SP, Reeves RD, Smith JAC
(2000) Metal hyper-accumulator plants: areview of the ecology and
physiology of a biological resource for phytoremediation of metal-polluted
soils. In N Terry, G Banuelos, eds, Phytoremediation of contaminated
soil and water. Lewis Publishers CRC, Boca Raton, pp 85-107
· Batanouny K H., 1993. Eco physiology
of halophytes and their traditional use in theArab world. Advanced Course on
halophyte utilization in Agriculture, 12 Sept., Agadir, Marocco.
· Baumann A 1885. Das Verhalten von
Zinksalzen gegen Pflanzen und in Böden.Landwirt. Vers. Stn. 31, 1-53.
· Bazzaz FA, Carlson RW, Rolfe GL (1975).
"Inhibition of Corn and Sunflower Photosynthesis by Lead." Physiologia
Plantarum 34: 326-329.
·

48
Belarbi A, 2018. Physiological and
phytochemical study of tolerance to heavy metals Pb, Cr (III) and Cr (II) by
Atriplex halimus L. Mostaganem University, Algeria 179189.
·

Références
bibliographiques

49
Belkhodja, M., Bidai, Y., 2004.
Réponse des graines d'Atriplex halimus Là la
salinité au stade de la germination, Sécheresse 15 : 331-335.
· Benabadji N et Ghazlaoui B., 2007 -
Contribution à l'étude phytoécologique des atriplexaies au
nord de Tlemcen (Oranie-Ouest. Algérie). Laboratoire de gestion
desécosystèmes, Département de Biologie, Faculté de
science, Université Abou Bekr Belkaid, Tlemcen- Algérie.
· Benaradj A., Mederbal K., Boucherit H.,
Lotmani. Aibout F. & Baghdadi D., 2014. Les aires de mises en
défends, mesures biologiques pour la lutte contre
ladésertification dans la steppe sud- oranaise de Naama.3ième
forum Nat. Agro-Vétérinaire, Tiaret, 13-15 Mai2014,
Algérie.
· Bendada, K. et Boulakradeche, M. W. (2011).
Optimisation des conditions de dosage par spectroscopie d'absorption
atomique (SAAF et SAAET) : Application à la détermination de la
pollution et de la bioaccumulation des métaux lourds. Mémoire :
Université Houari Boumediene, 73 p.
· Ben Khaled L., Morte Gõmez A.,
Ouarraqel M et Oihabi A., 2003 - Réponses physiologiques et
biochimiques du trèfle (Trifolium alexandrinum L.) à la
double association Mycorhizes-Rhizobium sous une contrainte saline. INRA, EDP
Sciences. Agronomie. 23 : 571-580.
· Bennabi F. 2005. Métabolisme
glucidique et azote chez une halophyte (Atriplex halimus L.)
stressée à la salinité. Mémoire de magistère
en physiologie végétale, Université Es-Senia, Oran, P
136.
· Benrebiha FZ. 1987. Contribution
à l'étude de la germination de quelques espèces
d'Atriplex locales et introduites. Thèse de Magister.
Univiversité d'Annaba, Algerie. P 119.
· Berri R. 2009. Contribution à
la détermination de la biomasse consommable d'une halophyte
Atriplex. Mémoire de Master. Université KASDI
MERBAH-Ouargla-. P 16.
· Bert v., deram A. (1999). Guide des
phytotechnologies : utilisation des plantes.
· Bert, V., Macnair, M.R., de Laguérie,
P., Saumitou-Laprade, P. et Petit, D., 2000. Zinc tolerance and
accumulation in metallicolous and non metallicolous populations of Arabidopsis
halleri (Brassicaceae). New Phytol., Vol. 146: 225- 233.
·

Références
bibliographiques
Biteur N, Aoues A, Kharoubi A et Slimani N (2011).
?Oxidative stress induction by lead inleaves of Radish (Raphanus
sativus) seedlings?. Not Sci Biol 3:
93-99.
· Black H. 1995. Absorbing possibilities:
Phytoremediation. Environ. Health Perspect.
103,1106-1108.
· Blaylock MJ, Salt DE, Dushenkov S, Zakharova O,
Gussman C. 1997. Enhanced accumulation of Pb in Indian mustard by
soil-applied chelating agents; Environmental Science and Technology. 31,
860-65.
· Bouzid Nedjimia, Youcef D.2009. Cadmium
accumulationin Atriplex halimus subsp. Schwein furthii and
its influence on growth, proline, root hydraulic conductivity and nutrient
uptake. Flora., 204,316-324.
· Briat JF., Lebrun M., 1999. Plant
responses to metal toxicity. Plant Biology and Pathology, Académie des
Sciences, Elsevier, Paris, 322: 43-54.
· Brooks, R.R., 1998. Plants that
hyperaccumulate Heavy Metals. (ed.) CAB International, Wallingford, UK, 380
p.
· Brunet J, Reppelin A, Varralult G, Terryn N et
Zuily-Fodil Y. (2008). ?Lead accumulationin the roots of grass pea
(Lathyrus sativus L.) ?. C.R. Biologies 331:
859864.
· Byers HG (1935) Selenium occurrence in
certain soils in the United States, with a discussion of the related topics.
U.S. Department of Agriculture Technical Bulletin 482: 147.
C .
· Casas S., 2005. Modélisation
de la bioaccumulation de métaux traces (Hg, Cd, Pb, Cu et Zn) chez la
moule, Mytilus galloprovincialis, en milieu
méditerranéen. Thèse de doctorat :
Océanologie biologique, Environnement marin. Université du sud
Toulon Var, 363 p.
· Cecchi M. (2008). Devenir du plomb
dans le système sol- plante. Cas d'un sol contaminé par une usine
de recyclage du plomb et de deux plantes potagères (Fève et
Tomate). Thèse de doctorat, Institut National Polytechnique de Toulouse.
215 : 12-35.
·

50
Cecchi M (2008). "Devenir du plomb dans le
système Sol-Plante : Cas d'un sol contaminé par une usine de
recyclage du plomb et de deux plantes potagères (Fève et
Tomate)." Thèse de doctorat. Institut National Polytechnique de
Toulouse.226P.
·

Références
bibliographiques

51

52
Cenkci, S, HakkiCigerci I, Yildiz, M Özay C,
Bozdag A, and Terzi H., (2010). Lead contamination reduces chlorophyll
biosynthesis and genomic template stability in Brassicarapa L. Environ. Exp.
Bot. 67, 467-473
· Chatterjee J et Chatterjee C (2003).
Management of phytotoxicity of cobalt in tomato by chemical measures.
Plant Science 64: 793-801.
· Cunningham SD, 1995. Phytoremediation
of contaminated soils. Trends Biotechnol. 13 : 393-397.
· Cunningham S.D., Berti W.R., Huang J.W.
(1995) Phytoremediation of contaminated soils. Trends in
Biotechnology 13: 393-397
· Cunningham SD, Berti WR. 2000.
Phytoextraction and phytostabilization: technical, economic, and
regulatory considerations of the soil-lead issue. In: N Terry, G
Bañuelos (eds.) Phytoremediation of Contaminated Soils and Waters. CRC
Press LLC, Boca Raton, FL, USA, 359-375.
· Chamard P., 1993 - Environnement et
développement. Références particulières aux
étatssahéliens membres du CCILS. Rev. Sécheresse, 4, p.
· Chaney RL, Malik M, Brown SL, Brewer EP, Angle
JS, Baker AJM. 1997. Phytoremediation of soil metals. Current
Opinion in Biotechnology. 8, 279-284.
· Chatterjee, C., Dube, B. K., Sinha, P. &
Srivastava, P., (2004). Detrimental effects of lead phytotoxicity on
growth, yeld and metabolism of rice. Soil Scienceand Plant Analysis, 35,
255-265.
· Chaudhry T.M., Hayes W.J., Khan A.G et Khoo
C.S. (1998). Phytoremediation focusing on accumulator plants that
remediate metal-contaminated soils. Aust J Ecotoxico. 4: 37-51.
· Cherfaoui, A. EL., 1987.Contribution
à l'étude comparative de lagermination des semences de
quelque Atriplex de provenance Djalfa, thèse de
magistère. P 65.
· Chuang MC., Shu GY., Liu JC.,
1996.Solubility of heavy metal in a contaminated soil : effects of
redox potential and pH. Water, Air and Soil Pollution 34: 543-556.
· Costa G et Spitz E., 1997.Influence
of cadmium on soluble carbohydrate, free aminoacids, protein content of in
vitro cultured Lupinus albus. Plant Sci. 128: 131140.
· Cui S, Zhou QX, Wei SH, Zhang W, Cao L, Ren
LP. 2007. Effects of exogenous chelators on phytoavailability and
toxicity of Pb in Zinnia elegans Jacq. Journal of Hazardous Materials. 146,
341-346.
·

D
.
Références
bibliographiques
Dalenberg JW et Van Driel W
(1990)."Contribution of atmospheric deposition to heavy metal
concentrations in field crops." Netherlands journal of agricultural science
38: 369-379.
· Das sarma S et Arora P., 2001 -
Halophyls. Encyclopedia of life science. 1- 9.
· Dechamp c., meerts P. (2003),«La
phytoremediation : Panacee pour l'environnementou menace pour la
biodiversité », Les Naturalistes belges, n°82, pp.
135-148.Delacroix 2006a l'idée de peindre un tableau sur ce thème
qu'il. 364-369 ; EdinaBernard, Pierre Cabanne, Janic Durand et Gérard
Legrand, Histoire de l'Art du MoyenÂge à nos jours, Paris,
Larousse, 947 p.
· De Feo V, Senatore F. 1993. Medicinal
plants and phytotherapy in the Amalfitan Coast, Salerno Province, Campania,
Southern Italy. Journal of Ethnopharmacology,
39: 39-51.
· Djeddi H., 2006 - Utilisation des
eaux d'une station d'épuration pour l'irrigation desessences
forestières urbaines. Mémoire de Magistère. Laboratoire
d'Ecologie végétale. Université Mentouri Constantine. P
92.
· Donisa C., Mocanu R., Steinnes E., Vasu E.
(2000). Heavy Metal Pollution by Atmospheric Transport in Natural
Soils from the Northern Part of Eastern Carpathians. Water, Air & Soil
Pollution, n° 120(3-4), p. 347-358.
· Dubey et Singh 1999.Salinity induces
accumulation of soluble sugars and alters the activityof sugar
métabolizing enzymes in rice plants. Biol Plant 42.233-232.
· Dushenkov V, Kumar PBAN, Motto H, Raskin I.
1995. Rhizofiltration: The use of plants to remove heavy metals from
aqueous streams. Environmental Science Technology. 29,
1239-45.
· Dutuit P, Pourrat Y, Dodeman VL. 1991.
Stratégie d'implantation d'un système d'espèces
adaptées aux conditions d'aridité du pourtour
méditerranéen. In : L'amélioration des plantes pour
l'adaptation aux milieux arides. John Libbey Eurotext. P 491.
· Dutuit P., 1999 - Etude de la
diversité biologique d'Atriplex halimus pour le repérage
in vitro et in vitro d'individus résistants à des conditions
extrêmes du milieu. Université de Paris-Sud published by.CTA.
·

E
.
Références
bibliographiques
Edmand. 1963. Effects of treading perennial
ryegrass (Tolium perenne L.) and white clover (Trifolium
repens L.) pasture in whiter and summer at two soil moisture levels. New
Zealand Journal of Agricultural Research. 6, 265-276.
· El Midaoui M., Benbella M., Ait Houssa A.,
IbuzM., TalouizteA (2007) : Contribution à l'étude de
quelques mécanismes d'adaptation à la salinité chez le
tournesol cultivé. Revue HTE n° 136, pp.29-34.
· El-Shatnawi MJ, Mohawesh Y. 2000.
Seasonal chemical composition of saltbush in semi-arid grassland of
Jordan. Journal of Range Management. 53, 211-214.
· EPA 2000. Introduction to
phytoremediation. W ashington: U.S. Environmental Protection Agency.
EPA/600/R-99/107.
· Etats-Unis. United States Environmental
Protection Agency (EPA) (2012). A Citizen's to Phytoremediation. 2p
(EPA 542-F-12-016).
· Evans LJ., 1989. Chemistry of metal
retension by soils. Environmental Science and technology 23: 1046-1056.
F .
· Forget D. (2004).
Réhabilitation des sols. In ETS. Ecole de technologie
supérieure (ETS).
https://cours.
Etsmtl.ca/ctn626/innov_fiche_cemrs_200409_fr.pdf (page consultée
le 20 février 2013).
· Franclet A, Le houerou HN. 1971. Les
Atriplex en Tunisie et en Afrique du Nord. Doc.F.A.O. Rome. P 189.
G .
· Flagella Z, Trono D, Pompa M, Di Fonzo N,
Pastore D. 2006. Seawater stress applied at germination affects
mitochondrial function in durum wheat (Triticum durum) early
seedlings. Funct. Plant Biol ogy. 33, 357 - 366.
·

53
Gadd J.M (2000). Phytoremediation of toxic
metals: using plants to clean up the environnement. Raskin. I and Ensley.B.D.,
John Wiley & Sons, New York, P 304.
·

Références
bibliographiques

Références
bibliographiques
Garbisu C, Alkorta I.2001. Phytoextraction: A
cost effective plant-based technology for theremoval of metals from the
environment. Bioresource Technology.77(3), 229236.
· Garnier R (2004). Toxicité du
plomb et de ses dérivés [En ligne]. 2005, 2,67-88.Disponible
à l'adresse :
http://infoterre.brgm.fr/rapports/RP-54417-FR.pdf
[Consulté le 04-04-2014].
· Ghani A, Shah AU et Akhtar U (2010).
Effect of lead toxicity on growth,chlorophyll and lead (Pb+2) contents
of two varieties of maize (Zea mays L.). Pak J Nutr. 9(9): 887-891.
· Ghosh M. et Singh S.P., 2005: A
review on phytoremediation of heavy metals and utilizationof its byproducts.
Appl. Ecol. Environ. Res. 3: 1-18.
· GLENN E.P., HICKS N., RIPLEY J., SWINGLE S.,
1995. Sea water irrigation of halophytes for animal feed. In:
Choukr-Allah R, Malcolm CV, Hamdi A., eds. halophytes and biosaline
agriculture. New York, Basel, Hong Kong, p.221-236.
· Gobat J. M., Aragno M. et Matthey W., 1998.
Le sol vivant. Bases de pédologie, biologie des sols, Presses
polytechniques et universitaires romandes, vol 14, coll. gérer
l'environement, 592pp.
· Gopal R et Rizvi AH (2008). Excess
lead alters growth, metabolism andtranslocation of certain nutrients in radish.
Chemosphere. 70 : 1539-1544.
· Gougue - A, 2005- Impact de la
salinité sur la germination et la croissance des halophytes,
mémoire de d'ingénieur en agronomie pastorale. Ed
université de Djelfa, 75 p.
· Grantz D A., Vaughn D L., Farber R J., Kim B
et Ashbaug H., 1998 - Transplanting native plants to revegetate
abandoned farmland in the western Mojave Desert. J. Environm. Qual. 27,
960-967.
· Gupta DK, Nicoloso FT, Schetinger MR, Rossato
LV, Huang HG, Srivastava SetYang XE (2011). Lead induced responses of
Pfaffia glomerata, an economically importantBrazilian medicinal plant, under in
vitro culture conditions. Bull Environ Contam Toxico. 86 :272-277.
H .
·

54
Haddioui, A., et Baaziz, M., 2001.
Genetic diversity of natural population of Atriplex halimus
L. in morocco: An isoenzyme-based oreview. Euphytica.121:99-106.
· Hammer D, Keller C. 2002.
Changes in the rhizosphere of the heavy metal accumulating plants as evidenced
by chemical extr actants. Journal Environmental Qua lity. 31, 1561 -
1569.
· Hassani A., Dellal A., Belkhodja M et Kaid-
Harche M., 2008 - Effet de la Salinitésur l'eau et
certains osmolytes chez l'orge (Hordeum vulgare L.). European Journalof
scientific Research Vol. 23n°.1. PP. 61-69.
· Hernández-Ochoa I,
García-Vargas G, López-Carrillo L, et al (2005)
Low lead environmental exposure alters semen quality and
sperm chromatin condensation in northern Mexico. Reprod Toxicol 20:221-228.
doi: 10.1016/j.reprotox.2005.01.007.
· Henry J.R. (2000) An
overview of the phytoremediation of lead and mercury. US-EPA, 51p.
· H.C.D.S. 1996. Notice
bibliographique sur quelques plantes fourragères et pastorales.
Haut-commissariat du développement de la steppe. P 15.
· Hinsinger P., Schneider A., Dufey J.E.,
2005.Le sol : ressource en nutriments et
biodisponibilité. In « Sols et Environnement », Dunod (ed),
Paris, 285-305.
· Hovman MF, Nielsen SP et Johensen I (2009).
Root uptake of lead by norway spruce grown on Pb spiked
soils. Environ Poll 157: 404-409.
· Huang JW, Cunningham SD.
1996. Lead phytoextraction: species variation in lead uptake
and translocation. New Phytologist. 134, 75-84.
· Huang J., Chen J, Berti WR et al 1997.
Phytoremédiation of lead-contaminated soils: Role of
synthetic chelates in lead phytoextraction. Environ Sci Technol; 31:800-
5.
· Huynh, T. (2009). Impact
des métaux lourds sur l'interaction plantes/ver de terre/microflore
tellurique. Thèse de Doctorat. Université de Paris Est.
151p.
I .
· Interstate Technology et Regulatory Cooperation
Work Group (ITRC)., (2001). Emerging technologies for the remediation
of metals in soils. Washington, D, C., ITRC and phytotechnologies Teams,
124p.PHYTO-2.
· Irfan Qureshi M, M Israr, MZ Abdin and M Iqbal
(2005). "Responses of Artemisia annua L. to leadand
salt-induced oxidative stress." Environmental and

55
Experimental Botany53(2): 185-193.
·

Références
bibliographiques
Irfan M, Aqil A, Shamsul H . 2014. Effect of
cadmium on the growth and antioxidant enzymes in two varieties of Brassica
juncea. Saudi Journal of Biological Sciences. 21, 125- 131.
· Islam E, D Liu, T Li, X Yang, X Jin, Q Mahmood, S
Tian et J Li. (2008). "Effect of Pb toxicity on leaf growth,
physiology and ultrastructure in the two ecotypes of Elsholtziaargyi." Journal
of Hazardous Materials In Press, Corrected Proof.
J .
· Jarup L (2003) Hazards of heavy metal
contamination. Br Med Bull 68:167-182. doi: 10.1093/bmb/ldg032.
· John R, Ahmad P, Gadgil K, Sharma S. 2008.
Effect of cadmium and lead on growth, biochemical parameters and
uptake in Lemna polyrrhiza L. Plant Soil Environ ment. 54 (6), 262 - 270.
· Jopony M and SD Young (1994). "The solid
solution equilibria of lead and cadmium in polluted soils." European Journal of
Soil Science 45(1): 59-70.
K .
· Kabata-Pendias A., Pendias H.,
1992.Trace elements in soils and plants. CRC Press, Boca Raton,
Florida, 2nd Edition, 209 p.
· Kabata-Pendias A, Pendias K. 2001.Trace
elements in soils and plants. Third Edition.CRC Press. Boca Raton, USA.
· Kambouche N, Merah B, Derdour A, Bellahouel S,
Younos C, Soulimani R. 2011. Activité
antihyperglycémiante d'un stérol â-sitoglucoside
isolé de la plante Anabasis articulata (Forssk) Moq
Phytothérapie. 9, 2-6.
· Karimi N., Khanahmadi M et Moradi B., 2012
- Accumulation and Phytotoxicity ofLead in Cynara scolymus. Indian
Journal of Science and Technology. Vol: 5 (11).
· Kastori R, Petrovic M, Petrovic N. 1992.
Effect of excess lead, cadmium, copper and zinc on water relations in
sunflower. Journal of Plant Nutr ition.15,
2427 -2439.
· 
56
Kessler JJ. 1990.Atriplex forage as a
dry season supplémentation feed for sheep in the Montané Plains
of the Yemen Arab Republic. Journal of Arid Environments. 19,
225234.
·

Références
bibliographiques
Khedim I., 2019. Phytoremédiation par
l'Atriplex planté dans des sols enrichis en cuivre, zinc, plomb et
cadmium. Université Abdelhamid Ibn Badis de Mostaganem. P 60.
· Khizar H B., Sehrish A., Khalid N., Khalid H.,
Ejaz H S., Raja U S., Aqsa T et Ghellai M., 2013 - Action
combinée de la salinité et du plomb sur les réponses
physiologiques des atriplex. Mémoire de Magistère. Labo
d'écophysiologie végétale. Université
Es-sénia. Oran.
· Kibria M G., Islam M et Osman K T., 2009
- Effects of lead on growth and mineralnutrition of Amaranthus
gangeticus L. et Amaranthus oleracea L. University ofChittagong, Bangladesh.
Soil & Environ. 28(1): 1-6.
· Kinet J M., Benrebiha E., Bouzid S., Laihacar S et
Dutuit P., 1998 - Le réseau atriplexou comment allier biotechnologies et
écologie pour une sécurité alimentaire accrue
enrégions semi arides et arides. Cahiers d'Ariculture. 7 (6):
505-509.
· KopittkePM., Colin JA., Kopittke RA., Menzies
NW., (2007). Toxic effects of Pb2+ on growth of cowpea
(Vigna unguiculata). Environmental Pollution, in press.
· Kosobrukhov A, I Knyazeva and V Mudrik (2004).
"Plantago major plants responses to increasecontent of lead in soil:
Growth and photosynthesis." Plant Growth Regulation 42: 145 151.
· Kupper H., Kupper F., Spiller M., 1996.
Environmental relevance of heavy metal substituted chlorophylls using
the example of water plants. Journal of Experimental Botany 47: 259-266.
· Kurlaze, G.V. (2007). Environnemental
Microbiology Research Trends. Nov. Scien. Publ. Inc. pp: 239-245.
L .
· Lamhamdi M., El Galiou O., Bakrim A.,
Nóvoa-Muñoz J C., Arias-Estévezb M et Aaraba A., 2013
- Effect of lead stress on mineral content and growth of wheat
(Triticum aestivum L.) and spinach (Spinacia oleracea L.) seedlings. Rene
Lafont Saudi Journal of Biological Sciences 20, 29-36.
·

57
Lamy, I. (2002). Réactivité des
matières organiques des sols vis-à-vis des métaux.
Journées nationales de l'étude des sols. p 22.
·

Références
bibliographiques

58
Le Floch E. 1989. Plantation d'arbustes
fourragers. Bilan préliminaire de 30 mars de pastoralisme. RAB/ 84/025.
F.A.O. p 240.
· Le Houérou H. N. 1980.
Background and justification. In: H.N. Le Houérou (ed.). «Browse in
Africa. The current state of knowledge». International Livestock Center
for Africa, Addis Abeba (Ethiopia): p 491.
· Le Houerou HN. 1992. The rôle
of saltbusches (Atriplex sp.) in arid land réhabilitation in
the Mediterranean Basin: a review. Agroforestry Systems. 18, 107148.
· Le Houérou H.N et Pontanier. (1988).
Les plantations sylvopastorales dans la zone aride de tunisie .Rev :
Pastoralisme et développement ,Montpellier .PP :16-23 .
· LeHouérou H.N. (1992). The
role of salt bushe (Atriplex spp.) in arid lanrehabilitation in the:
OsmondC.B.,Bjorkman O.,et Andarson D.J ,(1980)physiological process in plant
ecology.Toward a semi-arid lands . Ed. Academic press .INC, NewYourk. (U.S.A) P
:601-642
· Li LY., Li RS., 2000. The role of
clay minerals and the effects of H+ ions on removal of Heavy metals (Pb2+) from
contaminated soils. Canadian Journal of Geotechnology 37 (2): 296-307.
· Linné Carl (1753), " Atriplex «,
espèces Plantarum, 2, Lars Salvius / biodiversité du patrimoine
Bibliothèque, pp. 1052-1054.
· Liu D, Jiang W, Liu C,Xin C, HouW
(2000)."Uptakeand accumulation of lead by roots, hypocotyls and shoots
of Indian mustard[Brassica juncea (L.)]."Bioresource Technology71: 273-277.
· Liu D, Zou J, Meng Q, Zou J et Jiang W (2009).
Uptake and accumulation andoxidative stress in garlic (Allium sativum
L.) under lead phytotoxicity. Ecotoxico. 18:134143.
· Lotmani B, Mesnoua M. 2011. Effects
of copper stress on antioxidative enzymes, chlorophyll and protein content in
Atriplex halimus. African Journal of Biotechnology.
10(50), 10143-10148.
· Seregin I.V., Ivanov V.B., (2001).
Physiological aspects of cadmium and lead toxic effects on higher
plants. Russ. J. Plant Physiol., 48, 523-544.
· Loué A., (1993).
Oligo-éléments en agriculture.2. Paris Nathan.
·
M
.
Références
bibliographiques

59

Références
bibliographiques
Maalem S., 2002. Etude
écophysiologique de trois espèces halophytes du genre atriple
x(A. canescens, A. halimus et A. nummularia) soumises
à l'engraissement phosphaté.Mémoire de Magistère en
Physiologie Végétale et Applications Biotechnologiques.
Université Baji Mokhtar, Annaba, Algérie, 76p.
· Mâalem, S., (2011).Étude
de l'impact des interactions entre le phosphore et le chlorure de sodium sur
trois espèces végétal halophytes du genre Atriplex
(A. HalimusA. Nummularia A. canescence). Thèse
Doctorat. Univérsité Baji Mokhtar, Annaba. P :100.
· Maire R. 1962. Flore de l'Afrique du
Nord. Vol VI I. Ed Paul Le Chevalier. Paris, p 81.
· Maizi N., 2013.caractérisation
de la pollution plombique à l'aide des bio indicateurs
végétaux : un lichen (Ramalinafarinacea), une mousse
(Funariahygrométrica) et quelques espèces phanerogamiques dans la
region d'Annaba (ALGERIE), thèse de doctorat, université Badji
Mokhtar Annaba, Algérie, 2013.
· Makowski E, Kita A, Galas W, Karcz W,Kuperberg
JM (2002)."Lead distribution in corn seedlings (Zea maysL.) and its
effect on growth and the concentrations of potassium and calcium." Plant Growth
Regulation 37: 69-76.
· Maneva S., Vatchev T et Miteva E., 2013
- Effect of lead excess in soil on the accumulation of P, K and Na in
infected by Fusarium oxysporum f. sp. Radicis-lycopersici in tomato
Lycopersicon esculentum MILL.) plants. Bulgarian Journal of
AgriculturalScience, 19 (No 5), 972-980.
· Marie C,2008. DEVENIR DU PLOMB DANS
LE SYSTEME SOL-PLANTE cas d'un sol contaminé par une usine de recyclage
du plomb et de deux plantes potagères (Fève et Tomate). P :
30.
· McArthur ED, Sanderson C. 1984.
Distribution, systematics and evolution of Chenopodiaceae: an overview. In:
Tiedemann, A.r.; McArthur, E.D.; Stutz, H.C.; Stevens, R.; Johnson, K.L.,
comps. Proceedings Symposium on the biology of Atriplex and related
chenopods; 1983 May 2-6; Provo, UT. Gen. Tech. Rep. INT-172. Odgen, UT: U.S.
Department of Agriculture, Forest Service, Intermountain Forest and Range
Experiment Station: 14-24.
· McCutcheon SC and Schnoor JL (2003)
Overview of phytotransformation and control of wastes. In:
Phytoremediation - Transformation and control of contaminants, McCutcheon SC
and Schnoor JL, eds (Hoboken,New Jersey: John Wiley & Sons) pp. 3-58
· Mc Grath SP, Zhao FJ. 2003.
Phytoextraction of metals and metalloids from contaminated soils.
Current Opinion in Biotechnology.14, 277-282.
· Meers E et Tack F. (2004). The
potential of foliiar treatments for enhanced phytoextraction of heavy metals
contaminated soil. Remed J. 14: 111-123.
· Minguzzi C, Vergnano O (1948) Il
contento di nichel nelli ceneri di Alyssum bertlonii Desv.Atti della Societa
Toscana di Science Naturali 55 : 49-77
· Miquel G., 2001. Les effets des
métaux lourds sur l'environnement et la santé. Rapport Office
Parlementaire d'évaluation des choix scientifiques et technologiques.
Rapport Sénat n°261 : 360.
· Mishra A et Choudhuri MA
(1998)."Amelioration of lead and mercury effects on germination and
rice seedling growth by antioxidants." Biologia Plantarum41 : 469473.
· Moise, J.A., Han, S., Gudynaite-Savitch, L.,
Johnson, D.A. & Miki, B.L.A. (2005). Seed coats: structure,
development, composition, and biotechnology. In Vitro Cell. Dev. Biol. Plant,
41: 620-644.
N .
· Nriagu JO., 1978. The biogeochemistry
of lead in the environment. Ed JO Nriagu, Elsevier Biomedical Press,
Amsterdam.
O .
· Obroucheva NV, Bystrova EI, Ivanov VB,
Antipova OV, Seregin IV (1998). "Rootgrowth responses to lead in young
maize seedlings." Plant and Soil200: 55-61.
·

60
Osman A E et Ghassali F., 1997 - Effect of
storage conditions and presence of fruitingbracts on the germination of
Atriplex halimus and Salsola vermiculeta. Expl. Agric.
33:149-156.
·

Références
bibliographiques

Références
bibliographiques
Osmond CD, Bjorkmann O, Anderson DJ. 1980.
Physiological processes in plant ecology: Towards a synthesis with
Atriplex. Berlin, Heidelberg, New york: Springler-verlag, p 463.
· OUAINI A., 2012.Effet des métaux
lourds dans les sols amendés en bentonite (Plomb) sur les
caractéristiques biométriques et biochimiques chez quelques
espèces d'Atriplex. Université Abdelhamid Ibn Badis de
Mostaganem.P 47.
· Ozenda P. 1977. Flore du Sahara. 8eme
Ed. CNRS Paris. p 622.
P .
· Parys E, Romanowska E, Siedlecka M et Poskuta
J (1998)."The effect of lead on photosynthesis and respiration in
detached leaves and in mesophyll protoplasts of "Pisum sativum."Acta
Physiologiae Plantarum 20: 313-322.
· Patra M., Bhowmick N., Bandopadhyay B., Sharma
A., 2004. Comparison of mercury, lead and arsenic with respect to
genotoxic effects on plant systems and the development of genetic tolerance.
Environmental and Experimental Botany, 52: 199223.
· Pereira LB, Tabaldi LA, Goncalves JF, Jukoski
JO et Pauletto MM (2006). Effect of aluminium on inolevulinic acid
dehydratase (ALAD) and the development of cucumber (Cucumis sativus).
Environ Exp Bot 57 : 106-115.
· Pichard A (2002). Plomb et ses
dérivés. Institut national de l'environnement. 90p.
· Pilon-Smits, E. 2005.
Phytoremediation. Annual Review of Plant Biology, 56,
15-39.
· Pouget M. 1980. Les relations
sol-Végétations dans les Steppes sud-Algéroises Travaux et
document de L'O.R.S.T.O.M. 116, 555p. Paris.
· Pulford, I.D. et Watson, C., 2003.
Phytoremédiation of heavy metal contaminated land by trees. A
review. Environment International, Vol. 29 : 529-540.
· Prasad MNV et Hagemeyer F (1999).
Heavy Metal Stress in Plants: From Molecules to Ecosystems. Berlin,
Springer-Verlag.
Q .
· Quartacci M.F., Argilla A., Baker A.J.M et
Navari-Izzo F. (2006). Phytoextraction of metals from a multiply
contaminated soil by indian mustard. Chem. 63 : 918- 925.

61
R .
· Raskin I. 1996. Plant genetic
engineering may help with environmental clean-up.Proceedings of the National
Academy of Sciences. 93, 3164-3166.
· Remon E, 2006. Tolérance et
accumulation des métaux lourds par la vegetation spontanée des
friches métallurgiques : vers de nouvelles methods de
bio-dépollution, these de Doctorat, Université Jean Monnet,
Faculté des Sciences Techniques, France.
· Ross SM (1994). "Retention,
transformation and mobility of toxic metals in soils. " In: Toxic metals in
soil-plant systems. S. M. R. editor: 63-152.
· Ruley A T, Sharma N C, Sahi S V, Singh SR,
Sajwan K S. 2006. Effects of lead and chelators on growth,
photosynthetic activity and Pb uptake in Sesbania drummonda grown in
soil. Environmental Pollution (Soil and sediment Remediation). 144, 11
- 18.
S .
· Saadi et Boutchiche S (2017).
"RECHERCHE DU POUVOIR PHYTOREMEDIATEUR DE LA PLANTE CORIANDRUM SATIVUM
L. AU PLOMB ET L'IMPACT DE L'EXTRAIT DE PLANTE SUR DES RATS INTOXIQUES AU PLOMB
" Mémoire master. UNIVERSITE Oran 1, 30 p.
· SabouraudS., Coppereb. (2009).
Intoxication environnemental des métaux par le plomb lié
à la conservation de boissondans une artisanal en céramique
vernissée [En
:
ligne]. 2009,30,1038-1043. Disponible sur
http://www.researchgate.net/profile/Sabine_Sabouraud/publication/5269825_Environ
mental_lead_poisoning_from_leadglazed_earthenware_used_for_storing_drinks/file/d
912f502801d6366 fb.pdf [Consulté le 12-04-2014].
· Saifullah E., Meers Qadir M., Caritat P., Tack
F.M.G., Du Laing G. et Zia M.H. (2009). EDTA- assisted Pb
phytoextraction. Chemosphere. 74 : 1279-1291.
· Salt, D.E. Smith, R.D. and Raskin, I. (1998).
Phytoremediation Annual Revie of PlantPhysiology and Plant
Molecular Biology, vol. 49, p. 643-668.
· Schröder P, Collins C (2002).
Conjugating Enzymes Involved in Xenobiotic Metabolism of Organic Xenobiotics in
Plants. Int. J. Phytorem. 4, 247-265.
·

62
Seregin IV, Ivaniov VB. 1997. Histochemical
investigation of cadmium and lead distributionin plants. Fiziol. Rast. 44,
915-921.
·

Références
bibliographiques
Seregin IV et Ivanov VB (2001). "Physiological
Aspects of Cadmium and Lead Toxic Effects on Higher Plants." Russian Journal of
Plant Physiology 48: 523-544.
· Seregin IV et Ivaniov VB., (2001).
Physiological aspects of cadmium and lead toxic effects on higher
plants. Russian Journal of Plant Physiology 48: 606-630.
· Shahid M., Pinelli E., Pourrut B., Silvestre J.
et Dumat C. (2011). Lead-induced genotoxicity to vicia faba L.
roots in relation with metal cell uptake and initial speciation Ecotoxico
Environ Safety. 74(1): 78-84.
· Sharma P., Dubey RS., 2005. Lead
toxicity in plants. Brazilian Journal of Plant Physiology 17
(1): 35-52.
· Sharmila P et Pardha Saradhi P (2002) .
Proline accumulation in heavy metalstressed plants: An adaptative
strategy. In Physiology and biochemistry of metal toxicity and tolerance in
plants. Prasad MNV et Strzalka K (Eds). 179-199.
· Sies H., 1991. Oxidative stress:
introduction. In: Sies H. (ed), Oxidative stress, Oxidants and Antioxidants.
Academic Press, San Diego, I-XV, 650 p.
· Sposito G., Prost R., Gaultier JP., 1983.
Infrared spectroscopic study of adsorbed water on reduced-charge Na/Li
montmorillonites. Clays and clay minerals 31 : 9-16.
· Sterckeman T, Douay F, Proix N et Fourrier H
(2000). Vertical distribution of Cd, Pb, and Zn in soils near smelters
in the North of France. Environmental Pollution 107 : 377-389.
· Susarla S., Victor F. Medina V. F, McCutcheon
S.C. (2002). Phytoremediation: an ecological solution to organic
chemical contamination. Ecological Engineering 18: 647-658.
· Sutherzan S.2001. Natural and Enhanced
Remediation Systems. CRC Press, 6 août 2001 - p440.
· Swaine DJ., 1986. Lead. In DC Adriano
(éd), Trace elements in the terrstrial environment. Springer Verlag, New
York.
T .
· 
63
Tung G et Temple PJ
(1996)."Histochemical detection of lead in plant tissues."
Environmental Toxicology and Chemistry 15 : 906-914.
·

Références
bibliographiques
Tung G, Temple PJ., 1996. Uptake and
localization of lead in corn (Zea mays L.) seedlings, a study by histochemical
and electron microscopy. The Science of the Total Environment 188 : 71-85.
· Tong YP., Kneer R., Zhu YG., 2004.
Vacuolar compartmentalization: a second-generation approach to
engineering plants for phytoremédiation. Trends in Plant Science : 9
:7-9.
U .
· Uzu G., Sobanska S., Aliouane Y. et al. (2009).
Study of lead phytoavailability for atmospheric industrial micronic
and submicronic particles in relation with lead speciation. Environmental
Pollution, n° 157(4), p. 1178-1185.
· Uzu G., Sobanska S., Sarret G. et al. (2010).
Foliar lead uptake by lettuce exposed to atmospheric fallouts.
Environmental Science & technology, n° 44(3), p. 1036-1062.
V .
· Vassil AD, Kapulnik Y, Raskin I, Salt DE.
1998. The role of EDTA in Pb transport and accumulation by Indian
mustard. Plant Physiology. 117, 447-453.
· Vassilev A., Schwitzguébel J.P., Thewys
T., van der Lelie D., Vangronsveld J. (2007). The use of plants for
remediation of metal-contaminated soils. The Scientific World Journal
4: 9-34.
· Vavasseur, A., Peltier, G. et Bourguignon, J.,
2003. Biodépollution, Bioremediation. Des plantes pour nettoyer
les sols et les eaux. CLEFS CEA., Vol. 48: 85-88.
· Verma S, Dubey R S. 2003. Lead toxicity
induces lipid peroxidation and alters the activities of antioxidant enzymes in
growing rice plants. Plant Science.164, 645-655.
· Vickerman D B., Shannon M C., Banuelos G S.,
Grieve C M et Trumble J T., 2002 - Evaluation of atriplex lines for
selenium accumulation, salt tolerance and suitability for a key agricultural
insect pest. Environmental Pollution 120, 463- 473.
· 
64
Voorhees M E., Uresk D W et Trlica M J., 1991 -
Substrate relations for rillscale (Atriplex suckleyi) on
bentonite mine spoil. Journal of Range Management 44, 34-38.
·
V
.
Références
bibliographiques
Wang, Q. R., Cui, Y. S., Liu, X. M., Dong, Y. T.,
Christie, P. (2003). Soil contamination and plant uptake of heavy
metals at polluted sites in China. J. Environ. Sci. Health Part A-Toxic/Hazard.
Subst. Environ. Eng. 38, 823-838.
· Weryszko-Chmielewska E et Chwi lM
(2005)."Lead-Induced Histological and Ultrastructural Changes in the
Leaves of Soybean (Glycine max (L.) Merr.)." Soil Science and Plant
Nutrition 51: 203-212.
· Wierzbicka M (1987). "Lead
translocation and localization in Allium cepa roots." Canadian Journal of
Botany 65: 1851-1860.
· Wierzbicka M et Obidzinska J
(1998)."The effect of lead on seed imbibition and germination in
different plant species." Plant Science 137: 155-171.
· Wixzbicka M, Obidzinska J. 1998. The
effect of lead on seed imbibitions and germination in different plant species,
Plant Science 2, 155-171.
· Wierzbicka M.1993. Lead in the
apoplast of Allium cepa L. root tips--ultrastructural studies. Plant
Sci 1998; 133: 105-119.
X .
· Xiong Z, Zhao F et Li M (2006)."Lead
toxicity in Brassicapekinensis Rupr: Effec tonnitrate assimilation and growth."
Environmental Toxicology 21: 147-153.
Y .
· Yruela I (2005). Copper in plants:
acquisition, transport and interactions. Braz. J. Plant Physiol 17:
145-156.
·

65
Yoon J., Cao X., Zhou Q., Ma LQ., 2006.
Accumulation of Pb, Cu and Zn in native plants growing on a contaminated
Florida site. The Science of the Total Environment 368 : 456-464.

Z
.
Références
bibliographiques

66
? Zheng LJ, Liu XM, Lütz-Meindl U et Peer T
(2011).Effects of lead and EDTA assisted lead on biomass, lead uptake
and mineral nutrients in Les pedezachinensis and Lespedezadavidii. Water Air
SoilPoll. 220 (1-4): 57-68.
? Zidane Ouiza D., Belkhodja M., Bissati S. &
HadjajS., 2010. Effet du stress salin sur l'accumulation deproline
chez deux espèces d'Atriplex halimus L. et Atriplex
canescens (Pursh) Nutt. European Journal ofScience. 41 (2), 101-105.
| 


