
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE UNIVERSITE SAAD DAHLEB -BLIDA 1-
FACULTE DES SCIENCES DE LA NATURE ET DE LA
VIE
DEPARTEMENT DE BIOLOGIE ET PHYSIOLOGIE
CELLULAIRE
Mémoire de fin d'études en vue de
l'obtention du diplôme :
Master en biologie.
Domaine : Sciences de la nature et de la
vie.
Filière :
Biologie.
Spécialité : Génie
biologique.
Thème :
Investigation des propriétés
antimicrobienne (in vitro),
anti-inflammatoire et antispasmodique
(in vivo) de l'essence
de Romarin (Rosmarinus officinalis
L.) de la région de Bouira.
Présenté par :
Melle : Bella Imène. Melle : El
fertas Khadidja.
Soutenu le : 30/06/2016.
Devant la commission d'examen formée de :
Mr : Boukhatem .M.N. MCB à
l'université de Blida -1- Président
Mme : Saidi .F. Professeur à
l'université de Blida -1- Examinatrice
Mme : Chelghoum .H. MAA à
l'université de Blida -1- Promotrice
Mme : Negab .I. Chef de laboratoire de
Toxicologie à Saidal,
Médéa
Co-promotrice
Année universitaire
2015/2016.
Remerciements
Nous remercions tout d'abord Allah, le tout puissant de nous
avoir accordé
la force et les moyens afin de pouvoir réaliser ce
travail.
On remercie notre promotrice de son grand aide durant la
réalisation de notre travail, qui nous a orienté vers le
succès avec ses connaissances et aussi son encouragement tout on long de
notre épreuve, comme elle a été présente à
tout moment quand on avait besoin d'elle : Mme Chelghoum.
H.
Nos vifs remerciements vont également aux membres du
jury, le président : Dr.
Boukhatem .M.N. et l'examinatrice
: Pr. Saidi .F. pour l'intérêt qu'ils ont
porté
à notre projet de fin d'études
en acceptant d'examiner notre travail et de
l'enrichir par leurs
propositions.
Nos remerciements s'adressent également
à tous nos professeurs pour
leurs
générosités et la grande patience dont
ils ont su faire preuve tout au long de
notre cursus.
Une partie de notre travail a été
réalisé au niveau du complexe SAIDAL - Filiale ANTIBIOTICAL- de
Médéa :
Nous remercions tous les membres de
l'équipe de ces laboratoires pour leur accueil, leur
sympathie ainsi que leurs idées constructives.
Enfin, tous ceux qui ont pratiqué de près ou de
loin par la réalisation de ce mémoire.

Dédicaces
Je dédie ce modeste travail à:
Mes parents
:
Ma mère, qui a oeuvré pour ma
réussite, le par son amour, son soutien,
tous les sacrifices
consentis et ses précieux conseils, pour toute son
assistance et sa
présence dans ma vie, reçois à travers ce travail
aussi
modeste soit-il, l'expression de mes sentiments et de mon
éternelle
gratitude.
Mon père, qui peut être fier de trouver ici le
résultat de longues années de sacrifices et de privations pour
m'aider à avancer dans la vie. Puisse Dieu faire en sorte que ce travail
porte son fruit. Merci pour les valeurs nobles, l'éducation et le
soutient permanent venu de toi.
Mes frères, qui n'ont cessé d'être pour
moi des exemples de persévérance, le courage et le
générosité, ainsi que ma louce soeurette Soumia et ma
belle-soeur Zahra.
A toi, ma chère binôme, Khadidja.
Toute ma
famille & mes chères amies,
À tous ceux qui m'aiment &
ceux que j'aime.
À tous ceux qui m'ont apporté leur savoir
& contribué à ma
formation, je vous dis merci.
-Bela Imène -

m
I~ICACES
Au nom de Dieu clément et
miséricordieux
Je dédie ce modeste travail à
:
Mes chers parents, Mohamed et Ayouna Zohra, ainsi
que ma grand-
mère :Aouaouech, pour leurs
soutiens, patiences et leurs sacrifices
durant nos études et durant
ce projet.
A tous nos enseignants, pour leurs bienveillances et
pour leurs contributions à notre solide formation.
A mes frères : Abd Elkarim, Mohamed, Salim
et Mustapha, mes
soeurs :Nadia, Samia et Maria, mes neveux, ma famille, mes
amis, et ma
chère binôme Imène, pour leurs conseils et
leurs encouragements.
A mes adorables Adam et Abd illah, mon
fiancé Nadjm eddine, sa
famille, et a tous ce qui ont
contribué de près ou loin à la réalisation de
ce
travail, qu'ils trouvent ici la traduction de notre gratitude et de
notre
reconnaissance.
-EL FERTAS KHADIDJA-
Liste des abréviations :
ATCC : American type culture collection.
CDC : Control disease center (Centre pour le
contrôle et la prévention des maladies).
CMB : Concentration minimale
bactéricide.
CMI : concentration minimale inhibitrice.
CML : concentration minimale
létale.
DMSO : Diméthylsulfoxyde.
DZI : Diamètre de la zone
d'inhibition.
G.T.S : Gélose Trypticase Soja.
H.E : Huile essentielle.
O.N.A.B : Office national des aliments du
bétail.
PGE2 : Prostaglandine E2.
ROEO : Rosmarinus officinalis L.
essential oil.
Liste des figures :
Figure 1 : Provenance des huiles essentielles en fonction des
différents organes des plantes
(Bellakhdar, 1997). 2
Figure 2: Aspects morphologiques de Romarin (Köhler et
Pabst, 1883). 5
Figure 3 : Principales localisations des sites d'action des
constituants des HE (Goetz et
Ghedira, 2012). 8
Figure 4 : Structures de la membrane et de
la paroi de peptidoglycane chez les bactéries
Gram+ : (A) et Gram- : (B) (Bisognano, 2000). 9
Figure 5 :
Analyse de l'activité antimicrobienne par diffusion sur milieu
gélosé solide :
Aromatogramme (Zaika, 1988). 18
Figure 6 : Analyse de l'activité antimicrobienne par
micro-atmosphère(Zaika, 1988). 18
Figure 7: Analyse comparative de l'action antimicrobienne de l'HE
de Romarin en phase
liquide et celle en phase vapeur. 28
Liste des tableaux :
Tableau I: Situation botanique de l'espèce
Rosmarinus officinalis L.(Porcher, 2007). 5
Tableau II : Caractères microbiologiques et pouvoirs
pathogènes des souches microbiennes. 10
Tableau III: Matériel animal. 16
Tableau IV : Les différents micro-organismes
utilisés. 16
Tableau V:répartition des lots de souris
utilisés pour réaliser l'activité anti-inflammatoire.
22
Tableau VI: Répartition des lots utilisés dans
l'activité antispasmodique. 25
Tableau VII : Résultats du screening antimicrobien de
l'HE de Romarin. 26
Tableau VIII: Activité anti-inflammatoire in vivo
de l'HE de Romarin. 30
Tableau IX : Effet de l'HE de Romarin sur le nombre de crampes
abdominales induites par
l'acide acétique et son pourcentage de protection.
32
Résumé
L'espèce Rosmarinus officinalis L. est
largement utilisée dans le traitement de nombreuses affections comme les
douleurs gastro-intestinales et les maladies inflammatoires. L'étude de
l'activité antimicrobienne de l'HE a été accomplie par
deux méthodes différentes (aromatogramme et
micro-atmosphère) à différentes doses .En aromatogramme,
l'inhibition de la croissance microbienne s'est révélée
plus importante sur les bactéries à Gram+, avec des
diamètres des zones d'inhibition (DZI) variant entre 33 et 36 mm pour
une dose de 60 uL, cependant, à cette dose ,la méthode de
micro-atmosphère s'est avérée plus efficace avec des DZI
variant entre 39 et 56 mm. L'activité anti-inflammatoire a
été évaluée sur un modèle d'oedème
induit par la carraghénine sur la patte de souris N.M.R.I ;
l'administration orale de 3.5% de l'HE a présenté un pourcentage
d'inhibition à 55.22% qui n'est pas significativement différent
de celui de Diclofénac (50mg/kg). L'activité analgésique a
été, quant à elle, évaluée sur un
modèle de douleur à l'acide acétique sur la souris,
où l'HE a exhibé un pourcentage de réduction de spasmes
à 51% après administration de 1% de l'HE. Pour toutes ces
activités, l'effet dose-dépendant de l'HE a été mis
en évidence. Ces résultats montrent que cette plante est
douée de nombreux pouvoirs thérapeutiques.
Mots clés : Rosmarinus officinalis
L.; huile essentielle ; activité antimicrobienne ; activité
anti-inflammatoire ; activité analgésique.
Abstract
The species Rosmarinus officinalis L. is widely used
in the treatment of many diseases such as abdominal pain and inflammatory
diseases. The study of the antimicrobial activity of ROEO was accomplished by
two different methods (agar disc diffusion and vapour diffusion) at different
doses. By disc diffusion method, the inhibition of microbial growth was greater
on Gram + bacteria, with the inhibition zone diameter (IZD) ranging between 33
and 36 mm for a dose of 60 uL of ROEO, however, at this dose, vapour diffusion
method proved to be more effective with IZD varying between 39 and 56 mm. The
anti-inflammatory activity was evaluated using carrageenan-induced paw edema
model, where white mice of the strain N.M.R.I were used; oral administration of
3.5% of ROEO presented 55.22% inhibition of swelling, which is not
significantly different from diclofenac (50mg / kg). Furthermore, the analgesic
activity was evaluated using acetic acid induced pain model on N.M.R.I mice,
where the administration of 1% of ROEO exhibited 51% of spasms reduction. For
all these activities, the dose-dependent effect of ROEO was highlighted. These
results show that this plant is endowed with many therapeutic capabilities.
Keywords: Rosmarinus officinalis L.;
essential oil; antimicrobial activity; anti-inflammatory activity; analgesic
activity.
ÕÎáãáÇ

äßÓãáÇ
ØÇÔäáÇ
ÈÇåÊááÇá
ÏÇÖãáÇ
ØÇÔäáÇ
íÈæÑßíãáÇ
æãäáÇ ØíÈËÊ
ÉíÑØÚáÇ
ÊæíÒáÇ
áÈÌáÇ áíáßÅ
? ÉíÍÇÊãáÇ
ÊÇãáßáÇ
.ãááá
Table des matières
Introduction 1
I- Généralités 2
I-1- Généralités sur les huiles
essentielles 2
I-1-1- Définition 2
I-1-2- Localisation des huiles essentielles dans les
différents organes des plantes 2
I-1-3- Propriétés physico-chimiques 3
I-1-4- Composition chimique générale 3
I-2- Présentation de l'espèce
étudiée 5
I-2-1- Description botanique 5
I-2-2- Distribution géographique 6
I-2-3- Étymologie 6
I-2-4- Dénominations internationales 6
I-2-5- Constituants chimiques de la plante étudiée
6
I-3- Activités biologiques étudiées 7
I-3-1- Activité antibactérienne 7
I-3-2- Activité antifongique 9
I-3-3- Activité anti-inflammatoire 12
I-3-4- Activité antispasmodique 12
II- Matériel et méthodes 15
II-1- Matériel 15
II-1-1- Matériel biologique 15
II-1-2- Matériel non biologique 17
II-2- Méthodes 17
II-2-1- Étude du pouvoir antimicrobien de l'huile
essentielle in vitro 17
II-2-2- Évaluation de l'activité anti-inflammatoire
in vivo 20
II-2-3- Évaluation de l'activité antispasmodique
in vivo 23
III- Résultats et discussion 26
III-1- Résultats de l'activité antimicrobienne
26
III-2- Résultats de l'activité anti-inflammatoire
29
III-3- Résultats de l'activité antispasmodique
32
Conclusion 33
1
Introduction
L'histoire des plantes aromatiques et médicinales est
associée à l'évolution des civilisations. Dans toutes les
régions du monde, l'histoire des peuples montre que ces plantes ont
toujours occupé une place importante en médecine. De par sa
situation géographique particulière, l'Algérie
bénéficie d'une gamme très variée de climats
favorisant le développement d'une flore riche et diversifiée. La
médecine moderne a presque toutes les réponses aux
problèmes de santé mais elle n'est pas toujours accessible et
elle est souvent trop chère. De nombreux médicaments modernes
sont fabriqués à partir de produits naturels, souvent impossibles
à créer chimiquement. A cet effet, les métabolites
secondaires font l'objet de nombreuses recherches qui amène à
l'identification des principaux éléments actifs de la plante.
Les plantes médicinales sont importantes pour la
recherche pharmacologique et l'élaboration des médicaments, non
seulement lorsque les constituants des plantes sont utilisés directement
comme agents thérapeutiques, mais aussi comme matières
premières pour la synthèse de médicaments ou comme
modèles pour les composés pharmacologiquement actifs
(AMEENAH, 2006).
La plante aromatique, Rosmarinus officinalis L. est
parmi les plus populaires plantes aromatiques utilisées dans le monde
entier. Elle est très utilisée par nos populations dans la
médecine traditionnelle comme un traitement symptomatique de troubles de
l'appareil digestif, ainsi que l'industrie agroalimentaire qui a
récemment découvert les puissantes propriétés
anti-oxydantes du Romarin, à cet effet, elle représente
récemment un sujet de recherche scientifique intéressant.
Ce présent travail vise à étudier
l'activité antimicrobienne, anti-inflammatoire et antispasmodique de
l'essence de la plante aromatique, Rosmarinus officinalis L., qui
appartient à la famille des lamiacées. Cette famille est connue
depuis longtemps à cause des propriétés
médicinales, aromatiques des plantes qu'elle renferme.
Outre l'introduction et la conclusion, le présent travail
se subdivise en trois grandes parties :
? Le premier chapitre est consacré aux
généralités sur les huiles essentielles ainsi que la
présentation de l'espèce étudiée
(Romarin) et les activités biologiques étudiées.
? Le deuxième chapitre est réservé aux
matériels et méthodes utilisés pour conduire
l'étude.
? Enfin, le troisième chapitre présente les
résultats obtenus et traite leur discussion.
Chapitre I : Rappel
bibliographique
2
I- Généralités
I-1- Généralités sur les huiles
essentielles
I-1-1- Définition
Selon la 6ème édition de la
pharmacopée européenne (2008), une huile essentielle est un
produit odorant, généralement de composition complexe, obtenu
à partir d'une matière première végétale
botaniquement définie, soit par différents procédés
d'extraction. Elle est le plus souvent séparée de la phase
aqueuse par un procédé physique n'entraînant pas un
changement significatif de sa composition.
Du point de vue physico-chimique : une huile essentielle est
un mélange complexe d'éléments chimiques qui sont
nécessairement volatils ,de poids moléculaire souvent inferieur
à trois cent Daltons et hydrophobes mais pas totalement car il y a
évaporation avec de l'eau (Benazzouz, 2011).
I-1-2- Localisation des huiles essentielles dans les
différents organes des plantes
La composition d'une H.E varie en fonction de l'espèce
productrice. La composition et le rendement d'une H.E varient selon la partie
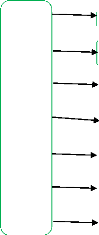
de la plante (figure 1) à partir de laquelle est
extraite (Roulier, 2000).
Fleurs : romarin, oranger,
rose, lavande.
Feuilles : eucalyptus, menthe, thym, laurier,
sauge.
Fruits : fenouil, anis, épicarpes des
Citrus.
Tiges : citronnelles.
Rhysomes et racines : gingembre, vétiver,
iris.
Graines : noix de muscade, coriandre.
Bois et écorces : cannelle, santal, bois
de rose.
Huiles essentielles
Figure 1 : Provenance des huiles essentielles en fonction
des différents organes des plantes (Bellakhdar, 1997).
3
I-1-3- Propriétés physico-chimiques
+ Les huiles essentielles sont volatiles à la
température ambiante, inflammable, et très odorante.
+ Elles sont liquides dans la plus part des cas sauf pour
quelques-unes qui sont solide à la température ordinaire, exemple
: l'huile essentielle d'Anis et de la Menthe du japon.
+ Elles sont généralement incolores et peuvent peu
à peu prendre une coloration jaune plus ou moins foncée, avec
quelques exceptions : L'essence de Cannelle avec la couleur rougeâtre,
l'essence d'Absinthe avec la couleur verte, l'essence de camomille avec la
couleur bleue.
+ Elles sont solubles dans les alcools, l'éther et les
huiles fixes, et sont insolubles dans l'eau.
+ La densité des huiles essentielles est inférieure
à celle de l'eau allant de 0.85 à 0.95, et il y a présence
de trois essences dites lourdes dont la densité est supérieure
à celle de l'eau : l'huile de cannelle, de sassafras et de girofle.
+ D'autres propriétés physiques importantes
caractérisent les huiles essentielles comme : la déviation
polarimétrique, elles dévient la trajectoire d'un faisceau
lumineux monochromatique polarisé, soit à gauche ou à
droite. Le point d'ébullition varie de 160°C jusqu'à
240°C(Djeddi, 2012).
I-1-4- Composition chimique générale
La structure des composés des huiles essentielles est
constituée d'un squelette hydrocarboné, constituant une
chaîne plus ou moins longue. Sur ce squelette de base est souvent
présent un ou plusieurs sites fonctionnels semblables ou
différents.
La majorité des sites fonctionnels sont des sites
oxygénés avec un ou plusieurs atomes d'oxygène, pour
quelques groupes fonctionnels azotés ou soufrés (Guenter,
1975).
Il est généralement admis que les constituants des
huiles essentielles sont répartis en trois groupes provenant de trois
voies de biosynthèse :
- le groupe des terpénoïdes ;
- le groupe des phénylpropanoïdes ;
- le groupe des lipides, issus de la dégradation d'acides
gras et de terpènes(Kaloustian et Hadji-Minaglou,
2013).
4
Selon (Bruneton, 2009), cette structure varie en
fonction :
? Du nombre d'atomes de carbone qui les constitue :
o Les monoterpènes.
o Les sesquiterpènes.
o Rarement les diterpènes.
? Du caractère saturé ou insaturé des
liaisons.
? De leur agencement : linéaire ou cyclique.
? De la configuration spatiale (forme de chaise, de bateau, de
trièdre...).
? De la nature des groupes fonctionnels à savoir :
o Terpènes: RI-HC=CH-R2.
o Alcools terpéniques : R-OH.
o Cétones: RI-CO-R2.
o Phénols: C6H6-OH.
o Aldéhydes: R-CHO.
o Esters: RI-COO-R2.
o Ethers : Rl-O-R2.
5
I-2- Présentation de l'espèce
étudiée
I-2-1- Description botanique
Rosmarinus officinalis L. qui appartient à
l'importante famille des Lamiacea (Tableau I), est un
arbrisseau qui se reconnaît de loin à son odeur.
Cette plante peut atteindre 2m de hauteur. La racine est
profonde et pivotante. La tige est tortueuse, anguleuse et fragile. Les
feuilles coriaces sont sessiles, opposées, rigides, brillantes, à
bords repliés, verdâtres en-dessus, plus ou moins hispides,
blanchâtres en dessous. Les fleurs bleues s'épanouissant tout au
long de l'année attirent de nombreux Insectes. Le fruit est une baie
ovale, sèche et lisse (figure 4) (Damerdji, 2015).

Figure 2: Aspects morphologiques de Romarin (Köhler
et Pabst, 1883).
Tableau I: Situation botanique de l'espèce
Rosmarinus officinalis L.(Porcher, 2007).
|
Règne
|
Plantae
|
|
Sous-règne
|
Tracheobionta
|
|
Embranchement
|
Magnoliophyta
|
|
Sous-embranchement
|
Magnoliophytina
|
|
Classe
|
Magnoliopsida
|
|
Sous-classe
|
Asteridae
|
|
Ordre
|
Lamiales
|
|
Famille
|
Lamiaceae
|
|
Genre
|
Rosmarinus
|
|
Espèce
|
Rosmarinus officinalis L.
|
6
I-2-2- Distribution géographique
Originaire des régions méditerranéennes,
En Algérie, Rosmarinus officinalis L.est une espèce des
régions du nord essentiellement dans l'ouest de l'Oranie. Cette plante
participe d'une façon dominante à des groupements s'organisant le
plus souvent dans les zones sèches avec très peu de
pluviométrie, elle domine largement l'étage semi-aride voir
même aride. Elle apprécie les climats chauds,
modérément secs ; les branches récoltées pendant
l'été sont séchées à l'air et à
l'abri de la lumière (Heinrich et al., 2006).
I-2-3- Étymologie
Le nom latin Rosmarinus est habituellement
interprété, comme dérivé "ros" de la rosée
et "marinus" d'appartenir à la mer, bien qu'elle se développe
habituellement loin de la mer. On a affirmé que cette
interprétation est un produit d'étymologie traditionnelle, mais
probablement le nom original est dérivé du grec '"rhops" arbuste
et "myron" baume(Heinrich et al., 2006).
I-2-4- Dénominations internationales
Français : encensier, herbe aux couronnes, romarin,
romarin officinal.
Anglais : rosemary.
Allemand : Rosmarin.
Espagnol : romani, romero, rome, romero comun, rosmario.
Italien : osmarino, ramerino, rosmarino, usmarino.
Arabe :
eklil,áíáßÇ(Porcher,
2007).
I-2-5- Constituants chimiques de la plante
étudiée
L'huile essentielle est un mélange complexe de
molécules odorantes. C'est un liquide homogène, bien que
constitué d'un assemblage hétérogène sur le plan
chimique par la diversité des structures présentes.
La composition chimique des huiles essentielles est parfois
différente selon l'origine et la biodiversité de la plante
(nature du sol, climat et pratiques culturelles) et selon les méthodes
d'extraction utilisées.
La composition chimique de la plante Rosmarinus officinalis
L. est présentée dans l'annexe 1.
7
I-3- Activités biologiques étudiées
I-3-1- Activité antibactérienne
Bien que les propriétés antimicrobiennes des huiles
essentielles et de leurs composants aient été largement
étudiées, le mécanisme d'action n'a pas été
élucidé entièrement (Burt, 2004; Davidson, 2005;
Dorman et Deans, 2000).
Durant les dernières années, un
intérêt accru s'est focalisé sur les substances
biologiquement actives isolées des plantes, notamment en vue de
l'élimination des micro-organismes pathogènes en raison de la
résistance de ces derniers vis-à-vis des antibiotiques
(Essawi et Srour, 2000) ou bien parce qu'il s'agit de
composés écologiquement sains(Lee et al., 2005).
On distingue deux sortes d'effets des H.E. sur les microorganismes: une
activité létale (bactéricide et fongicide) (Hammer
et al., 1999)et une inhibition de la croissance
(bactériostatique) (Freeman et Carel, 2006).
I-3-1-1- Classification
Selon le pouvoir spécifique sur les germes microbiens,
et grâce à l'indice aromatique obtenu par des aromatogrammes, les
huiles essentielles sont classées en groupes :
? Les huiles majeures : Appelées aussi
"essence de germe", agissent sur les bacilles G+ et G-, leur action est
constante et forte, et sont toujours efficaces.
? Les huiles médiums : Moyennement
antiseptiques, elles se placent entre les huiles majeures et celles
spécifiques pour chaque germe.
? Les huiles terrains : Des huiles qui n'ont
aucune action (Chakou et Bassou, 2007).
I-3-1-2- Sites d'action des huiles essentielles
La structure chimique des constituants des HE conditionne leur
mode précis d'action antibactérienne(Dorman et Deans,
2000).
Compte tenu du nombre de différents groupes de
composés chimiques présents dans les HE, il est probable que leur
activité antibactérienne ne soit pas attribuée à un
mécanisme spécifique mais qu'il y ait plusieurs cibles dans la
cellule(Carson et al., 2002; Skandamis et Nychas, 2001).
Les principales localisations des sites d'action des constituants
des huiles essentielles sont indiquées dans la figure
3.

8
Figure 3 : Principales localisations des sites d'action
des constituants des HE (Goetz et
Ghedira, 2012).
Les principaux mécanismes et sites d'action des
différents constituants des HE sont :
- l'altération de la paroi cellulaire
- la dégradation de la membrane cytoplasmique
- l'altération des protéines membranaires
- la fuite du contenu cellulaire
- la coagulation du cytoplasme
- l'épuisement de la force de mouvement des protons
I-3-1-3- Les bactéries à Gram positif et
négatif
La paroi est une structure rigide et résistante qui
protège la bactérie et lui donne sa forme. Sa nature variable est
à l'origine de la coloration de Gram qui permet de distinguer deux
grands groupes bactériens, les bactéries à Gram positif et
les bactéries à Gram négatif.
Malgré ces différences structurales, la paroi
des Eubactéries est constituée d'un polymère complexe
constant, le peptidoglycane ou muréine. Il est formé d'oses
aminés (glucosamine et acide muramique, reliés par des liaisons
(â1-4) et d'acides aminés constituant des ponts peptidiques entre
les chaînes glucidiques.
Il représente le principal constituant de la paroi des
bactéries à Gram positif. Cette paroi présente une
structure homogène et une épaisseur variant de 10 à 80 nm
(figure 4 : A).Elle renferme des acides téichoiques et
lipotéchoiques (LTA).
Les bactéries à Gram négatif
possèdent une paroi de 10 nm d'épaisseur, constituée d'une
fine
9
couche de peptidoglycane recouverte d'une membrane externe ou
pariétale, renfermant des phospholipides, des lipopolysaccharides (LPS)
et des protéines(figure 4 :B),(Richard et al.,
2010).
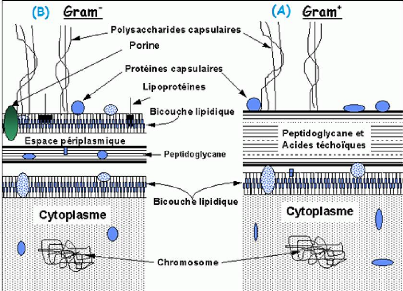
Figure 4 : Structures de la membrane et de la paroi de
peptidoglycane chez les bactéries Gram+ : (A) et Gram- : (B) (Bisognano,
2000).
I-3-2- Activité antifongique
Selon (Larrondo et Calvo, 1991), l'effet
fongicide d'une huile essentielle réside dans les inhibitions du
métabolisme et de la croissance des fungi, souvent en relation avec la
destruction de membranes lipidiques. Ceci entraîne une plus grande
perméabilité et une rupture des structures du champignon.
? Dans le tableau II, on a cité quelques
souches microbiennes en citant leurs caractères microbiologiques ainsi
que leurs pouvoirs pathogènes. Leurs photomicrographies sont
présentées dans l'annexe 2.
Tableau II : Caractères microbiologiques et
pouvoirs pathogènes des souches microbiennes.

Gram+
Staphylococcus aureus.
Bacillus subtilis.
-Les souches de B. subtilis sont constituées
de bacilles Gram positif de 1,4 um habituellement observés en paires ou
en chaînettes courtes (Ozhak-Baysan et al., 2012).
-B. subtilis est anaérobie facultatif, mobile
et capable de former des endospores, et ses colonies blanches d'aspect
granuleux font entre 2 et 7 mm de diamètre.
-Une croissance est observée à des
températures se situant entre 10-20 °C et 35-45 °C, la
température optimale étant d'environ 37 °C (Logan et
Rodrigez-Diaz, 2006).
- Le bacille peut produire six types de toxines, à
savoir cinq entérotoxines et une toxine émétique, qui
peuvent être thermostables ou thermolabiles, selon les souches
(Logan et Rodrigez-Diaz, 2006).
- Une coccobactérie Gram positif, catalase positive
appartenant à la famille des
Staphylococcaceae
(Garcia, 2010).
- Il a un diamètre d'environ 0,5 à 1,5 um,
est immobile, asporulé et
facultativement
anaérobique (sauf
S. aureus anaerobius); il est
habituellement
disposé en grappes.
-De nombreuses souches produisent des entérotoxines
staphylococciques, la toxine superantigénique du syndrome de choc
toxique (TSST-1) et des toxines exfoliatives.
- Il fait partie de la flore humaine et est surtout
présent dans le nez et sur la peau (Kluytmans et al.,
1997).
Caractères microbiologiques
-Un pathogène opportuniste qui peut causer diverses
maladies mortelles chez les humains telle que la nécrose et il est
responsable de 75 % des cas de syndrome de choc toxique (SCT) (Garcia,
2010).
-B. cereus est responsable d'intoxications
alimentaires spontanément résolutives (24-48 heures) de deux
types (syndrome diarrhéique et syndrome émétique) ainsi
que d'infections opportunistes(Logan et Rodrigez-Diaz,
2006).
-B. cereus peut aussi être
responsable d'infections des plaies, de bactériémies, de
septicémies, de méningites, de pneumonies, d'infections du
système nerveux central, d'endocardites, de péricardites,
d'infections respiratoires et d'infections périphériques
(Logan et Rodrigez-Diaz, 2006).
-Une bactérie responsable d'affections cutanées
et de toxi-infections alimentaire (Le Loir et al., 2003).
Pouvoirs pathogènes
10

Sarcina
lutea.
Gram-
Escheriia coli.
levure
Candida albicans.
11
-Les espèces du genre Micrococcus sont des
coques Gram positif, oxydase-positifs et aérobies stricts de la famille
des Micrococcaceae (Kloos et al,. 2006).
-Elles se retrouvent habituellement en grappes
irrégulières, en tétrades ou en paires, où les
cellules individuelles mesurent de 1 à 1,8 um de diamètre
(Bannerman et al., 2006)et sont habituellement non mobiles et
non sporulées (Kloos et al,. 2006).
-Entérobactéries.
Appelée"colibacille".
- Bacille à Gram-,
mobile le plus souvent -oxydase-,catalase+.
-Nonsporulé.Aéro-anaérobies
facultatifs.
-Culture facile sur milieux ordinaires,
lactosés. Sur milieux solides après 1824h les colonies sont
arrondies, lisses, à bords réguliers, de 2 à 3 mm de
diamètre. -E. coli fait partie de la flore digestive de l'homme et des
animaux. C'est l'espèce prédominante de la flore fécale
humaine aéro-anaérobie.
-Sa présence dans l'eau est un indice de contamination
fécale (CHU Minjoz et Besançon, 2007)
|
-Elles sont des saprophytes inoffensifs qui habitent ou
contaminent la peau, les muqueuses et possiblement l'oropharynx.
- agent responsable dans des cas d'abcès
intracrâniens, de pneumonie, d'arthrite septique, d'endocardite et de
méningite (Bannerman et al., 2006).
|
|
-Les colibacilles, hôtes normaux de l'intestin, ne
provoquent normalement pas de maladie. Cependant ils possèdent un
potentiel pathogène qu'ils expriment dans certaines circonstances
(pathogènes opportunistes).
|
-Un champignon diploïde et encapsulé
(Hazen et al., 2006) classé parmi les polymorphes car
il peut prendre l'aspect de levures ou l'aspect de pseudo-hyphes selon la
température, le pH et les nutriments du milieu(Ryan, 2004) .
-Les colonies apparaissent de 48 à 72 heures après la
mise en culture à 37 °C sur un milieu d'isolement des
champignons(Hazen et al., 2006).
|
-C. albicans est un microorganisme commensal qui fait
partie des flores microbiennes endogènes gastro-intestinale,
oropharyngée et génitale féminine (Ryan,
2004).Cependant, il s'agit aussi chez l'humain d'un pathogène
opportuniste (Odds, 2010) pouvant causer des affections
potentiellement mortelles chez les sujets
immunodéprimés
comme
immunocompétents(Schell et al., 2006).
|
12
I-3-3- Activité anti-inflammatoire
En fonction de la composition chimique des huiles, elles
peuvent agir comme des anti-inflammatoires qui affecte le métabolisme de
l'acide arachidonique ou de la production des cytokines, ou la modulation de
l'expression génétique des agents pro-inflammatoires.
L'activité anti-inflammatoire est attribuée aussi aux
propriétés anti-oxydantes des huiles, puisqu'au cours du
phénomène inflammatoire, une grande quantité de radicaux
libres est produite (Miguel, 2010).
A titre d'exemple, il a été constaté que
l'acide rosmarinique de Rosmarinus officinalis L. peut augmenter la
production de PGE2 et ainsi réduire la production de leucotriènes
B4 dans les leucocytes polynucléaires humains et aussi inhiber le
système du complément (CA, 1999).
I-3-4- Activité antispasmodique
De nombreuses huiles essentielles ont un effet antalgique.
Leur action peut permettre de contrôler ou de diminuer la douleur, en
outre, leur mécanisme d'action n'a pas été bien
élucidé.
Quelques-unes, comme la Menthe, qui a été
utilisée pour soulager les troubles gastro-intestinaux, où son
effet analgésique est dû à l'activité de menthol,
qui agit comme un antagoniste des canaux calciques (Taylor et al.,
1985) ;ainsi que la Lavande, où le linalol agit par action
post-synaptique médiée par l'AMP-cyclique, ou en inhibant la
libération d'acétylcholine et en réduisant le temps
d'ouverture des canaux ioniques de la jonction neuro-musculaire (blocage des
canaux Na+ et/ou Ca++ ) (Lis- Balchin et Hart,
1999).
14
Chapitre II : Matériel
et méthodes
15
II- Matériel et méthodes
L'objectif de notre travail est d'étudier
l'activité antimicrobienne, anti-inflammatoire ainsi que
l'activité spasmolytique de l'huile essentielle de Romarin.
Notre travail a été réalisé au
sein des laboratoires de pharmaco-toxicologie et microbiologie au niveau du
complexe SAIDAL -Filiale ANTIBIOTICAL- de Médéa pendant une
période de deux mois (mars et avril).
II-1- Matériel
II-1-1- Matériel biologique
II-1-1-1- Matériel végétal
Des flacons contenant 10 mL d'huile essentielle de Romarin ont
été achetés au niveau d'un
point de vente de la société ZIPHEE BIO
de « Naturaform institut® »,
basée à Bouira, qui est un producteur d'huiles
essentielles à partir de diverses essences végétales.
L'HE est certifiée « 100 % naturelle » car
n'ayant été additionnée ou mélangée à
aucun solvant organique durant la phase de production. Elle est aussi
certifiée « Biologique » puisqu'elle provient d'une culture de
Romarin où aucuns engrais ou pesticides chimiques n'ont
été appliqués durant la phase de culture. Durant toute la
durée de notre travail, l'HE a été conservée dans
des flacons, à 4 °C et à l'abri de l'air et de la
lumière, afin d'éviter les phénomènes d'oxydation
ou de contamination.
On a choisi le Romarin car cette plante dispose de nombreuses
propriétés thérapeutiques.
II-1-1-2- Matériel animal
Le matériel animal et les conditions opératoires
sont représentés dans le tableau III.
16
Tableau III: Matériel animal.
|
Race des souris
|
Albinos.
|
|
Nom scientifique
|
Mus musculus.
|
|
Souche
|
N.M.R.I (Naval Medical Research Institute).
|
|
Lignée
|
Swiss.
|
|
Lieu d'élevage
|
Complexe ANTIBIOTICAL de Médéa.
|
|
Effectif
|
10 lots de 5 souris.
|
|
Poids (g)
|
22 #177; 2.
|
|
Sexe
|
Mâles et femelles.
|
|
Nourriture
|
granulés fournis par l'O.N.A.B.
|
|
Boisson
|
Eau de robinet (eau potable).
|
|
Température ambiante
|
20 à 24 °C.
|
|
Taux d'humidité
|
50%.
|
|
Eclairage
|
10h/j.
|
II-1-1-3- Souches microbiennes
Notre choix a été porté sur 4 souches
bactériennes et une levure puisqu'elles font l'objet des
expérimentations pratiques.
Les souches utilisées (tableau IV) ont
été produites et développées à l'Institut
PASTEUR et ont été fournies par le laboratoire de microbiologie
du complexe SAIDAL.
Tableau IV : Les différents micro-organismes
utilisés.
|
Souche et référence
|
Type du micro-organisme
|
Milieu de culture
|
|
Staphylococcus aureus (ATCC : 6533)
|
Gram positif
|
G.T.S
|
|
Bacillus subtilis (ATCC : 6633)
|
Gram positif
|
G.T.S
|
|
Sarcina lutea (ATCC : 5345)
|
Gram positif
|
G.T.S
|
|
Escherichia coli (ATCC : 11105)
|
Gram négatif
|
G.T.S
|
|
Candida albicans (ATCC : 10231)
|
Levure
|
Sabouraud agar
|
17
II-1-2- Matériel non biologique
L'appareillage, verrerie de laboratoire et les réactifs
chimiques utilisés sont présentés dans l'annexe 3
et 4.
II-2- Méthodes
II-2-1- Étude du pouvoir antimicrobien de
l'huile essentielle in vitro
Les H.E ont un spectre d'action très large puisqu'elles
inhibent aussi bien la croissance des bactéries que celles des
moisissures et des levures, donc elles peuvent servir d'alternatives naturelles
aux antibiotiques. Leur activité antimicrobienne dépend de leur
composition chimique, et en particulier de la nature de leurs composés
volatils majeurs.
? But :
On a réalisé cette étude microbiologique
pour confirmer et évaluer, in vitro, l'effet de l'H.E de
Romarin sur certains micro-organismes.
II-2-1-1- Techniques d'étude de l'activité
antimicrobienne des huiles essentielle
La technique de détermination du pouvoir antimicrobien
des H.E a une grande influence sur les résultats. L'origine des
difficultés pratiques vient de l'insolubilité des constituants
des H.E. dans l'eau ainsi que leur caractère volatile (Bousbia,
2004). Pour réaliser ce screening antimicrobien, trois
techniques ont été mise en oeuvre.
II-2-1-1-1 - Aromatogramme
Les médecins utilisent l'antibiogramme pour analyser
l'impact d'un médicament antibiotique sur des microbes ; l'aromatogramme
(figure 5) fait recours au même principe où les
H.E remplacent les antibiotiques(Festy, 2009).
L'utilisation de cette technique est réservée
à la recherche d'huiles essentielles actives in vitro contre un microbe
infectieux donné.
Il s'agit d'une méthode en milieu gélosé
à l'agar réalisée dans une boîte de Pétri .Le
contact se fait par l'intermédiaire d'un disque de papier sur lequel on
dispose une quantité donnée d' H.E.

18
Figure 5 : Analyse de l'activité antimicrobienne
par diffusion sur milieu gélosé solide :
Aromatogramme (Zaika,
1988).
II-2-1-1-2 - Micro-atmosphère
Contrairement à la première technique, basée
sur le contact direct de l'H.E dans sa globalité avec les
micro-organismes (Laghchimi et al., 2014), dans cette
méthode(figure 6), le disque imprégné
d'H.E est déposé au centre du couvercle de la boite
renversée après fixation de l'H.E sur le disque, donc elle
s'évapore dans l'atmosphère de la boite, donc cette technique a
été réalisée dans le but d'apprécier les
propriétés bactéricide de la phase volatile de
l'essence.
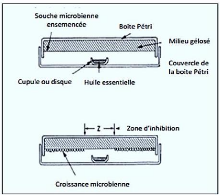
Figure 6 : Analyse de l'activité antimicrobienne
par micro-atmosphère(Zaika, 1988).
19
II-2-1-2- Mode opératoire
a- Préparation de l'inoculum
On prépare à partir des cultures jeunes
(culture de 18-24h pour les bactéries et 48h pour les levures) sur
gélose nutritive, une suspension en solution saline d'eau physiologique
stérile (0.9% NaCl) à une concentration de 107 à 108
germes/ml, par prélèvement de 3 à 5 colonies
isolées et identiques à l'aide d'une anse stérile dans 5
ml d'eau physiologique, on agite au Vortex pendant quelques secondes ; on
procède ainsi pour toutes les suspensions bactériennes et la
suspension fongique (annexe 6).
b- L'ensemencement
On trempe un écouvillon stérile dans la
suspension du micro-organisme, puis on étale en stries sur une boite de
Pétrie stérile de 100 mm de diamètre (annexe
6), coulée précédemment par le milieu de culture
approprié (annexe 5) en la tournant horizontalement
pour couvrir toute la surface.
c- Dépôt des disques et les gouttes
d'H.E
A l'aide d'une pince stérile, on prend un disque en
papier absorbant (papier buvard de 9mm de diamètre) et on le
dépose sur la surface du milieu ensemencée par les
micro-organismes à tester, on met 3 disques dans chaque boite pour
réaliser l'aromatogramme.
A l'aide d'une micropipette on dépose les volumes
croissants suivants : 20uL ,40uL ,60uL d'H.E pure sur les disques afin
d'apprécier l'effet « dose-dépendant »
de l'HE sur l'inhibition de la croissance des germes bactériens.
Pour la technique de micro-atmosphère,
on fait la même chose mais pour chaque boite on utilise un
disque qu'on le dépose au centre du couvercle ; pour chaque volume on
utilise des disques de papier filtre de diamètre croissants afin d'avoir
un bon étalement de l'huile donc une bonne évaporation ; leurs
diamètres sont : 2cm, 4cm, 6cm qui correspondent aux volumes : 20uL
,40uL ,60uL d'H.E pure chargée à l'aide d'une micropipette .On a
recouvert les bords de chaque boite de Pétri à l'aide de para
film pour ne pas avoir une évaporation de l'huile en dehors de la
boite.
En ce qui concerne la technique de dilution,
on réalise une série de dilutions : 1/2 ,1/4, 1/8
,1/16 de l'huile dans le D.M.S.O ; on dépose 4
disques pour chaque boite ensemencée précédemment par le
microbe à tester. Puis, on utilise une micropipette pour déposer
une goutte de 10 ul pour chaque concentration d'H.E diluée.
20
? Il faut noter que la préparation de l'inoculum,
l'ensemencement, l'incubation et la lecture des résultats ont
été menés de la même manière pour toutes les
méthodes réalisées.
Des antibiotiques standards (Ampicilline 10 ug/disque et
Myconasol 10 mg/ml) ont été utilisés afin de
contrôler la sensibilité des micro-organismes à tester en
les appliquant dans les mêmes conditions.
d- Lecture des résultats
Après incubation (24h pour les souches
bactériennes et 48h pour la levure) l'absence de la croissance
bactérienne se traduit par un halo translucide autour du disque pour la
méthode de l'aromatogramme et celle de la dilution, pour la technique de
micro-atmosphère elle se traduit par une zone claire sur la
gélose, de contour à tendance circulaire. On mesure avec
précision les DZI à l'aide d'une règle. La
sensibilité des souches aux différents agents antimicrobiens a
été classifiée par le diamètre de la zone
d'inhibition comme suit (Djeddi et al., 2007) :
1. Souche résistante : (-, D<8mm).
2. Souche sensible : (+, 9mm=D=14mm).
3. Souche très sensible : (++,
15mm=D19mm).
4. Souche extrêmement sensible : (+++,
D=20mm).
II-2-2- Évaluation de l'activité
anti-inflammatoire in vivo
La méthode utilisée pour réaliser cet
essai, est celle de (Halpern et Briot, 1950), intitulé
: « The carrageenan-induced paw edema».
? But :
Le but est de vérifier et mettre en évidence la
propriété « anti-inflammatoire » de l'H.E du
Romarin.
? Principe :
L'inflammation chimique a été provoquée
par l'injection de 0.1ml de carraghénine à 1% sous
l'aponévrose plantaire de la patte postérieure gauche de la
souris.
Cette inflammation est la conséquence de l'augmentation
de la perméabilité vasculaire ce qui permet la diffusion
liquidienne dans les tissus voisins. Celle-ci peut être limitée
par des substances censées être douées d'une
activité anti-inflammatoire ; administrées préalablement
(H.E de la plante étudiée).
21
II-2-2-1- Choix du modèle animal
La méthode mise en évidence recommande
l'utilisation des souris puisqu'elles sont facilement maniables et elles
requièrent des quantités minimes du matériel
utilisé.
II-2-2-2- Choix des doses
Les doses de l'H.E diluée sont 0.01%, 1%, 2.5%, 3.5%.
II-2-2-3- Protocole expérimental
? Étape préliminaire :
· Préparation de six lots, chacun est
composé de cinq souris mâles et femelles, souche N.M.R.I de poids
22#177;2 g, qui reçoivent de l'eau et de la nourriture à
volonté.
· Dilution de l'H.E dans l'eau physiologique afin de
préparer quatre doses.
· Préparation de la carraghénine à
1% en diluant 20mg de cette dernière dans 2mll'eau physiologique.
· Préparation de Diclofénac de sodium
(50mg/kg) utilisé comme anti-inflammatoire officinal, sa dose efficace
pour arrêter l'inflammation est 150mg (dans 3ml) pour un homme de
70kg.Pour une souris d'un poids approximatif de 20mg, la dose suffisante est de
0.04 mg, donc on a dissout un comprimé dans 1250ml d'eau
physiologique.
? Mode opératoire :
La répartition des lots est présentée
dans le tableau V et les étapes de cette
expérience sont présentées dans l'annexe
7.
· A To :
- Gavage de 0.5 ml de l'eau physiologique pour le lot
témoin (1).
- Gavage de 0.5 ml de la solution de Diclofénac de sodium
(50mg/kg) pour le lot référence (2).
- Gavage de 0.5 ml de l'H.E diluée avec l'eau
physiologique en quatre doses : 0.01% et 1% ,2.5%,3.5% pour les lots
d'expérience (3) et (4), (5) et (6) respectivement.
· Après 30 min :
- Injection à toutes les souris 0.025ml de
carraghénine à 1%, sous l'aponévrose plantaire de la patte
postérieure gauche.
- Injection à toutes les souris 0.1 ml de l'eau
physiologique sous l'aponévrose plantaire de la patte postérieure
droite.
22
? Après 4 h :
- Pour l'évaluation du degré de
tuméfaction, les animaux ont été sacrifiés par
écrasement du cou. Pour chaque souris, les pattes postérieures
ont été amputées
au niveau de l'articulation du jarret et ont été
pesées séparément.
Tableau V:répartition des lots de souris
utilisés pour réaliser l'activité
anti-inflammatoire.
Témoins
Essais des doses de l'H.E.
N° lot
|
Essais
|
Voies
d'administration
|
1
|
Eau physiologique
|
Voie orale
|
|
PPG
|
Injection en sous
plantaire
|
|
PPD
|
|
Diclofénac (50mg/kg)
|
Voie orale
|
|
PPG
|
Injection en sous
plantaire
|
|
PPD
|
|
H.E à 0.01%
|
Voie orale
|
|
PPG
|
Injection en sous
plantaire
|
|
PPD
|
|
H.E à 1%
|
Voie orale
|
|
PPG
|
Injection en sous
plantaire
|
|
PPD
|
|
H.E à 2.5%
|
Voie orale
|
|
PPG
|
Injection en sous
plantaire
|
|
PPD
|
|
H.E à 3.5%
|
Voie orale
|
|
PPG
|
Injection en sous
plantaire
|
|
PPD
|
|
PPG : patte postérieur droite .PPD : patte
postérieure gauche. II-2-2-4- Calcul du pourcentage de réduction
d'oedème
L'importance de l'oedème a été
appréciée par la détermination du pourcentage
d'oedème .Le calcule a était effectué comme suit :
23
PG - PD
% d'oedème = PD x
100
Où : PD est le poids des pattes postérieurs
droites et PG est le poids des pattes postérieurs gauches.
Ensuite, l'activité anti-inflammatoire a
été évaluée grâce au calcul du pourcentage
d'inhibition ou de réduction de l'oedème (%INH) selon la formule
suivante :
% de l'oedème témoin - %
de l'oedème essai
% de réduction d'oedème
=
% de l'oedème
témoin
II-2-2-5- Analyse statistique
La comparaison des pourcentages moyens d'augmentation et
d'inhibition a été faite en utilisant le logiciel STATISTICA
VERSION 10, en effectuant le test d'ANOVA à sens unique ou «
one way », suivi par le test de Tukey « post hoc
». Une différence significative est représentée
par un p < 0,05 ; n = 4, représente le nombre d'expériences
par groupe.
II-2-3- Évaluation de l'activité
antispasmodique in vivo II-2-3-1- Modèles d'étude de
l'activité antalgique
Il existe de nombreuses méthodes pour étudier
l'activité antalgique d'une substance supposée
analgésique, Dans l'expérience réalisée, le test
suivant a été mis en exergue.
? Writhing test:
L'injection intra-péritonéale d'une solution de
phénylbenzoquinone ou d'acide acétique à 1% chez la souris
ou le rat provoque un syndrome douloureux qui se manifeste par des contorsions
caractéristiques de type de mouvement d'étirement des pattes
postérieures et du muscle dorso-ventral (spasmes) qui peuvent être
réduites par un produit analgésique.
? But :
Afin d'évaluer et confirmer l'effet spasmolytique de
l'H.E de Romarin sur les souris.
24
? Principe :
La vérification de l'action inhibitrice de l'H.E sur
la douleur induite chez les souris par injection intra-péritoniale d'une
solution diluée d'acide acétique à raison de 0.1/10 g de
poids corporel de l'animal.
II-2-3-2- Choix du modèle animal
La méthode mise en évidence recommande
l'utilisation des souris de souche N.M.R.I pour des raisons de
commodité.
II-2-3-3- Choix des doses
Les doses de l'H.E diluée sont 0.01%, 1%.
II-2-3-4- Protocole expérimental
? Étape préliminaire :
? Préparation de quatre lots, chacun est
composé de cinq souris mâles et femelles, souche N.M.R.I de poids
22#177;2 g, qui ont été maintenues à jeun pendant 18 h
avant le début de l'expérience.
? Dilution de l'H.E dans l'eau physiologique afin de
préparer deux doses (tableau VI).
? Préparation de l'acide acétique à 1%
dilué avec l'eau physiologique.
? Préparation de Phloroglucinol (80mg/kg)
utilisé comme anti-spasmodique officinal, qui porte le nom commercial :
Spasfon; sa dose efficace pour arrêter l'inflammation est 160mg (dans
3ml) pour un homme de 70kg. Pour une souris d'un poids approximatif de 20mg, la
dose suffisante est de 0.09 mg/ml, donc on a dissout deux comprimés dans
800ml d'eau physiologique.
? Mode opératoire :
La répartition des lots est présentée
dans le tableau VI et les étapes de cette
expérience sont présentées dans l'annexe
8.
? A To :
- Gavage de 0.5 ml de l'eau physiologique pour le lot
témoin (1).
- Gavage de 0.5 ml de la solution de Phloroglucinol (80mg/kg)
pour le lot référence (2).
25
- Gavage de 0.5 ml de l'H.E diluée avec l'eau
physiologique en deux doses : 0.01% et 1% pour les lots d'expérience (3)
et (4) respectivement.
· Après 30 min :
- Toutes les souris reçoivent 0.2 ml de la solution
d'acide acétique à 1% par voie I.P.
· Après 5 min :
- Comptage du nombre de spasmes observé chez les souris
pendant 10 min (Vogel et Vogel, 1997).
Tableau VI: Répartition des lots utilisés
dans l'activité antispasmodique.
|
|
|
N° lot
|
Essais
|
Objectifs
|
|
Témoins
|
|
|
1
|
Eau physiologique puis l'acide acétique à 1%.
|
Mise en évidence de
l'activité spasmodique de
l'acide acétique.
|
|
2
|
Solution de Phloroglucinol
(80mg/kg) puis l'acide
acétique à 1%.
|
Vérification de l'effet
spasmolytique du
médicament.
|
|
Essais des
l'H.E.
|
doses
|
de
|
3
|
H.E à 0.01% puis l'acide
acétique à 1%.
|
Mise en évidence de
l'activité analgésique de
l'H.E et la relation
dose/effet.
|
|
4
|
H.E à 1% puis l'acide acétique à 1%.
|
II-2-3-5- Calcul du pourcentage de réduction des
spasmes
Le pourcentage de réduction des spasmes (pourcentage de
protection), est calculé selon la formule suivante (Rouibi et
al., 2013):
Moyenne des spasmes du lot témoin-Moyenne des
spasmes du lot essai
x100 protection = x100
Moyenne des spasmes du lot témoin
26
Chapitre III :
Résultats et
discussion
26
III- Résultats et discussion
III-1- Résultats de l'activité
antimicrobienne
L'évaluation qualitative de l'activité
antimicrobienne de l'HE de Rosmarinus officinalis L. a
été faite en mettant en évidence deux méthodes :
aromatogramme, micro-atmosphère et pour l'évaluation quantitative
: la méthode de dilution. Les résultats de celles-ci sont
présentés ci-dessous, où le pouvoir antimicrobien de l'HE
est obtenu par la mesure des diamètres des zones d'inhibition en
millimètre, ainsi que la sensibilité des souches à l'huile
par des signes :-,+,++,+++ .
Tableau VII : Résultats du screening antimicrobien
de l'HE de Romarin.
|
Techniques micro-
biologiques
Souches bactériennes
|
Aromatogramme
|
Micro-atmosphère
|
|
Volume de l'HE (uL/disque)
|
Volume de l'HE
(uL/disque)
|
Disques
d'ATB
|
|
20
|
40
|
60
|
20
|
40
|
60
|
|
Diamètres des zones d'inhibition
(cm)
|
Gram+
|
Staphylococcus aureus
|
16
|
+
|
26
|
+
|
33
|
+
|
|
|
|
Am*=24
|
|
|
+
|
|
+
|
|
+
|
14
|
38
|
39
|
|
|
|
|
|
+
|
|
+
|
|
|
|
|
|
Sarcina lutea
|
18
|
+
|
22
|
+
|
35
|
+
|
|
|
|
NT**
|
|
|
+
|
|
+
|
|
+
|
13
|
31
|
41
|
|
|
|
|
|
+
|
|
+
|
|
|
|
|
|
Bacillus subtilis
|
23
|
+
|
29
|
+
|
36
|
+
|
|
|
|
Am=25
|
|
|
+
|
|
+
|
|
+
|
15
|
37
|
56
|
|
|
|
+
|
|
+
|
|
+
|
|
|
|
|
|
Gram-
|
Escherichia Coli
|
15
|
+
|
20
|
+
|
22
|
+
|
|
|
|
Am=11
|
|
|
+
|
|
+
|
|
+
|
12
|
28
|
35
|
|
|
|
|
|
+
|
|
+
|
|
|
|
|
|
Levure
|
|
19
|
+
|
24
|
+
|
35
|
+
|
|
|
|
M*=24
|
|
Candida albicans
|
|
+
|
|
+
|
|
+
|
13
|
36
|
49
|
|
|
|
|
|
+
|
|
+
|
|
|
|
|
*Disques d'antibiotiques : Ampicilline (10ug/disque) et
l'antifongique : Myconasol 10 mg/mL. **NT : non testée.
27
? Il faut savoir que le diamètre du disque (9 mm) a
été inclus dans la mesure de la zone d'inhibition.
? En phase liquide (tableau VII) ,l'essence
de Romarin a présenté une activité antibactérienne
importante (annexe 9), particulièrement sur les
bactéries à Gram+ où les DZI varient entre 16 et 23 mm,
pour celle à Gram- : 15mm et la levure : 19mm pour les disques
chargés avec 20 uL ; Gram+ entre 26 et 29 mm et Gram- :20mm et la levure
:24mm pour les disques chargés avec 40 uL ;Gram+ entre 33 et 36mm ,
Gram- : 22mm et la levure à 35mm pour les disques chargés avec 60
uL d'HE.
Concernant les disques d'antibiotiques qui ont servi de
contrôle positif, les DZI varient selon les germes étudiés.
L'activité bactériostatique de l'HE, à la dose de 40 uL,
semble être supérieure à celle des ATB (B. subtilis
= 29 mm et Ampicilline (Am, 10ug)= 25 mm ; E.coli=26mm et
Ampicilline (Am, 10ug)= 11mm ; S.aureus = 26 mm et Ampicilline (Am,
10ug)= 24 mm).
L'action anticandidosique parait, plus ou moins, bonne, à
une dose de 40u, on a enregistré un DZI=24mm qui est le même avec
celui de l'antimycosique (Myconazol), mais plus supérieure (35mm)
à un volume de 60 uL d'HE. Selon les travaux antérieurs,
l'activité antifongique de Romarin est moins marquée et s'exerce
notamment vis-à-vis de Fusarium graminearum (Angioni et
al., 2004) et elle est particulièrement
inférieure sur l'espèce C.albicans en comparaison avec
l'HE d'autres plantes comme : Thymus vulgaris et Clinopodium
acinos L. (Panizzi et al., 1993).
B. subtilis semble être l'espèce la plus
sensible avec des DZI de 23, 29 et 36 mm pour les trois doses croissantes
utilisées de l'HE, ainsi, S. aureus et S. lutea
présentent une sensibilité supérieure par rapport
à celle de E. coli ,ce qui nous a menées à
remarquer qu'il existe une certaine dissimilitude de sensibilité entre
les bactéries à Gram+ et à Gram- vis-à-vis l'HE, ce
qui est en accord avec des recherches antérieurs (Boukhatem et
al., 2014b; Smith-Palmer et al., 1998) qui confirment que les Gram+
sont plus sensibles à l'action antimicrobienne de l'HE que les Gram-.
Ceci est dû au fait que les produits agressifs (les antibiotiques
naturelles et synthétiques) sont incapables de traverser la membrane
externe des bactéries à Gram- qu'elles stockent dans leur
périplasme un arsenal d'enzymes de dégradation de
molécules complexes.
? En phase vapeur (tableau VII), l'HE de
Romarin présente une efficacité remarquable sur les
bactéries à Gram+ avec des DZI allant de 13 à 15mm pour
les disques chargés avec 20 uL,
28
entre 31 et 38mm pour les disques chargés avec 40 uL,
entre 39 et 56mm pour les disques chargés avec 60 uL (annexe
10). La bactérie à Gram- a été
légèrement inhibée par rapport aux Gram+ avec des DZI :
12mm, 28mm, 35mm pour les trois doses d'HE. Il faut se rappeler que l'effet
antimicrobien étudié est « dose-dépendant
».
Tout comme l'aromatogramme, B. subtilis est la souche
la plus sensible. Ainsi, l'action anticandidosique parait plus efficace en
micro-atmosphère qu'en diffusion sur milieu solide avec des DZI
croissants allant de 13 à 49mm.
? Vue la divergence remarquable entre les résultats de
l'aromatogramme et ceux de micro-atmosphère, il a été tout
à fait envisageable de faire une comparaison entre ces derniers,
à la plus grande dose : 60uL (figure 7), où on a
une différence d'inhibition plus ou moins importante en phase gazeuse
qu'en phase liquide, plus particulièrement de: B. subtilis,
S. aureus et C. albicans.

C.albicans
B.subtilis
S.aureus
S.lutea
E.coli
0 10 20 30 40 50 60
Diamètre des zones d'inhibition (mm) pour un
volume de 60uL
Microatmosphère Aromatogramme
22
33
35
35
35
36
39
41
49
56
Figure 7: Analyse comparative de l'action
antimicrobienne de l'HE de Romarin en
phase liquide et celle en phase
vapeur.
Il existe un nombre restreint de publications scientifiques
qui mettent en évidence l'effet inhibiteur des essences en
micro-atmosphère, cependant, (Boukhatem et al., 2014a;
Nedorostova et al., 2008) suggèrent que les HE sont hautement
plus efficaces en phase vapeur qu'en phase liquide.
29
Ceci peut être dû au fait que les molécules
actives de l'HE, non miscible, diffuse mal en milieu solide, d'autre part, en
micro-atmosphère, ses composants biocides seront plus en contact avec le
micro-organisme à tester.
Il est à noter que les HE contenant: alcools,
cétones, esters, oxydes et les hydrocarbures, l'inhibition est
supérieure en micro-atmosphère, par ailleurs, elle est
supérieure en diffusion sur milieu gélosé pour les
essences qui contiennent des quantités supérieurs
d'aldéhydes (Inouye et al., 2006).
Dans cette méthode, la zone d'inhibition qui en
résulte n'est pas seulement une mesure d'activité, mais aussi la
vitesse d'évaporation des composés actifs de l'HE, qui
dépend aussi de la température.
Néanmoins, il n'y a pas une cohérence
générale pour laquelle on sait précisément quelle
HE en phase vapeur sera efficace sur un type de germe bien
déterminé, donc, le spectre d'activité de chaque essence
doit être identifié expérimentalement.
? Pour tous les germes utilisés, les résultats
de la méthode de l'aromatogramme avec dilution (annexe
11) ont révélé une inefficacité de l'HE de
Romarin avec des DZI inférieurs à 8mm, à des
concentrations de : 25%, 12,5%,6.25%, mais, à une concentration de 50%,
les zones d'inhibition ont été inférieurs à 14mm,
ce qui voudrait dire que les CMI sont à 50%, ainsi, en diluant l'HE, son
effet diminue, donc, l'activité est proportionnelle à la
concentration.
III-2- Résultats de l'activité
anti-inflammatoire
L'essai primordial le plus largement utilisé pour
évaluer l'activité d'un nouvel agent anti-inflammatoire est sa
capacité de réduire l'oedème local induit dans la patte
postérieur de la souris par l'injection d'un agent irritant :
carraghénine à 1%.
Les résultats de l'effet de l'huile essentielle de
Rosmarinus officinalis L. sur la tuméfaction des pattes induite
par la carraghénine sont portés dans le tableau
VIIIprovainsi que l'annexe 12.
30
Tableau VIII: Activité anti-inflammatoire in
vivo de l'HE de Romarin.
|
Lots
|
% d'oedème, moyenne #177;SEM*
|
Inhibition (%)
|
|
Témoin
|
35,05 #177; 3,05 a
|
--
|
|
Diclofénac
|
11,67 #177; 1,20 c
|
66,70
|
|
0.01% HE
|
33,69 #177; 2,20 a
|
3,86
|
|
1% HE
|
28,89 #177; 5,25 a,b
|
17,56
|
|
2,5% HE
|
25,11 #177; 2,26 a,b
|
28,34
|
|
3,5% HE
|
15,69 #177; 2,13 b,c
|
55,22
|
*SEM: Standard Error of Means.
N.B : Les moyennes dans la même colonne suivit
par les mêmes petites lettres ne sont pas significativement
différents (P>0,05) selon les résultats d'analyse de la
variance simple ou « One way ANOVA » suivi par le test de
« hoc post » Tukey de comparaison multiple.
L'effet anti-inflammatoire de l'HE a été
évalué en 4 doses : 0.01%,1%,2.5%, 3,5%.
On a calculé le pourcentage d'oedème pour chaque
souris, puis la moyenne de ces derniers pour chaque lot, ensuite, leurs
pourcentages d'inhibition d'oedème.
Les résultats (tableau VIII) indiquent
que les pourcentages d'inhibition à 0.01% et 1% ,2.5% sont croissants :
3.68% et 17.56%, 28.34%, respectivement. Ces derniers sont significativement
différents du pourcentage d'inhibition du médicament
référence.
En outre, à une dose de 3.5% de l'HE, où le
pourcentage d'inhibition d'oedème est de : 55,22%, qui n'est pas
significativement différent de celui de diclofénac (50mg/kg)
à 66.70%, ce qui indique que l'administration orale de l'HE de Romarin
produit un effet anti-inflammatoire significatif face à une inflammation
induite par un agent phlogogène : la carraghénine.
Il existe une relation inversement proportionnelle entre le
pourcentage d'oedème et celui d'inhibition, ainsi, un effet «
dose-dépendant » de l'HE pour réduire l'oedème et
donc une augmentation du pouvoir anti-inflammatoire.
On peut expliquer ce phénomène comme suit :
31
Le développement de l'oedème de la patte
après injection de la carraghénine est décrit comme un
évènement biphasé (Vinegar et al., 1969),
une phase initiale observée durant la première heure, qui est
attribuée à la libération de l'histamine et de la
sérotonine (Crunkhorn et Meacock, 1971) et une
deuxième phase de gonflement qui est due à la libération
des substances prostaglandin- like ;celle-ci est sensible aux agents
anti-inflammatoires stéroïdiens et non stéroïdiens
(Di Rosa et Willoughby, 1971; Vinegar et al., 1969).
Les souris prétraitées par le Diclofénac,
administré par voie orale, marquent une réduction significative
de l'oedème des pattes gauches postérieures. Cette diminution du
pouvoir inflammatoire de la carraghénine est attribuée au pouvoir
anti-inflammatoire du Diclofenac, un médicament anti inflammatoire non
stéroïdien (AINS) qui inhibe la cyclo- oxygénase 2(COX2)
inductible, intervenant au sommet d'une cascade de réactions aboutissant
à la formation de prostaglandines de l'inflammation.
Selon (D'Acquisto et al., 2002; Landino et al.,
1996), les radicaux libres (également appelés
dérivés réactifs de l'oxygène) jouent un rôle
principal dans la physiopathologie d'un processus inflammatoire
Des travaux antérieurs suggèrent que la
concentration élevée d'acides phénoliques dans l'extrait
de R.officinalis L. est liée à son pouvoir antioxydant
(Erkan et al., 2008; Moreno et al., 2006) et
anti-inflammatoire (Peng et al., 2007).
Une étude récente (Rocha et al., 2015)
,a identifié le potentiel anti-inflammatoire de l'acide
rosmarinique, un composé phénolique, qui est le constituant
principal de Rosmarinus officinalis. Après l'administration de
l'acide rosmarinique et d'un extrait méthanolique de R.officinalis
L.., les résultats indiquent que ces derniers ont la
capacité de réduire 60% d'oedème de la patte du rat en
comparaison avec le témoin, vu que tous les deux ont la même
ampleur du pouvoir anti-inflammatoire, cela suggère que c'est l'acide
rosmarinique qui a principalement contribué à cet effet, en
réduisant les radicaux libres.
32
III-3- Résultats de l'activité
antispasmodique
Les résultats de l'activité antalgique ont
été enregistrés en observant le nombre moyen des spasmes
des souris par lot.
Ceux-ci sont présentés dans le tableau IX
.
Tableau IX : Effet de l'HE de Romarin sur le nombre de
crampes abdominales induites par l'acide acétique et son pourcentage de
protection.
|
N° de lot
|
Nombre de spasmes moyen
|
Pourcentage de réduction
|
|
1 : Témoin
|
72
|
0
|
|
2 : Contrôle
|
15
|
79
|
|
3 : Dose 0.01% d'H.E
|
50
|
31
|
|
4 : Dose 1% d'H.E
|
35
|
51
|
On constate que l'essence de Romarin a l'aptitude de diminuer
les spasmes à une dose minime de 0.01% de 72 à 50 crampes, avec
un pourcentage d'inhibition de contractions de 31%. A 1%, le nombre de crampes
moyen passe de 72 à 35, le pourcentage de protection, quant à
lui, augmente de 31% à 51%.
L'acide acétique met en jeu les mécanismes
périphériques de la douleur. Il induit la libération de
nombreux médiateurs chimiques impliqués dans la douleur tels que
l'histamine, les prostaglandines (PGE2 et PGEá), la sérotonine
(Amresh et al., 2007).
Quant au Phloroglucinol (médicament
référence) il agit en inhibant la pénétration du
calcium dans la cellule (Allain, 2000).
Ces résultats indiquent que l'HE de Rosmarinus
officinalis L. présente un effet analgésique significatif et
qu'il pourrait avoir un effet inhibiteur sur la libération des
médiateurs impliqués dans la douleur périphérique.
De plus, il y a une relation inversement proportionnelle entre la concentration
et le nombre de spasmes : la plus grande concentration donne le plus faible
nombre de spasmes.
33
Conclusion
Actuellement, les plantes aromatiques possèdent un
atout considérable grâce à la découverte progressive
des applications de leurs essences dans les soins de santé. L'ensemble
de nos travaux a permis de souligner le pouvoir antimicrobien de l'huile
essentielle de Romarin en phase liquide et vapeur ainsi que son effet
anti-inflammatoire et analgésique.
Pour les trois tests, on a utilisé des doses
différentes de l'huile essentielle ; les résultats indiquent que
l'effet de l'essence est « dose-dépendant » et directement
proportionnelle à la concentration de ce dernier.
Les résultats du screening antimicrobien ont
montré que les bactéries à Gram + sont plus sensibles que
les Gram- à l'action inhibitrice de l'huile essentielle de Romarin et
que l'effet de ce dernier en phase vapeur est plus apprécié qu'en
phase liquide, même pour son effet antifongique qui parait
supérieur à celui de l'ATB utilisé comme
référence.
Par voie orale et à une dose de 3.5%, le pouvoir
anti-inflammatoire de l'HE n'était pas significativement
différent à celui de Diclofénac.
Ainsi, l'administration par voie orale de l'HE de Romarin a
exhibé une réduction remarquable des spasmes à une dose de
1% par rapport à celle de Phloroglucinol.
Donc, l'essence de Romarin possède des pouvoirs
anti-infectieux ainsi que curatifs.
On sait qu'une HE est un mélange de nombreux
composés chimiques et qu'il est difficile d'attribuer des
activités biologiques à un ou à quelques constituants
majeurs de celle-ci, néanmoins, l'étude d'une HE ne se conduit
pas seulement sur ses caractéristiques chimiques mais aussi sur la
possibilité de faire le lien entre les constituants chimiques avec des
propriétés fonctionnelles spécifiques. De cet effet, des
recherches plus poussées sont nécessaires afin d'accentuer non
seulement les pouvoirs de l'HE de Romarin, mais ainsi ses constituants
majeurs.
1
Références
bibliographiques
2
Allain, P. (2000). Les
médicaments (CdM Ed. 3 ed.). Bouchemaine ,France.
Amresh, G., Reddy, G., Rao, C. V., Singh, P.
(2007). Evaluation of anti-inflammatory activity of Cissampelos
pareira root in rats. Journal of ethnopharmacology, 110(3),
526-531.
Angioni, A., Barra, A., Cereti, E., Barile, D.,
Coïsson, J. D., Arlorio, M., et al. (2004). Chemical composition,
plant genetic differences, antimicrobial and antifungal activity investigation
of the essential oil of Rosmarinus officinalis L. Journal of agricultural
and food chemistry, 52(11), 3530-3535.
Bannerman, T. L., Peacock, S., Murray, P., Baron, E.,
Jorgensen, J., Landry, M., et al. (2006). Staphylococcus, Micrococcus,
and other catalase-positive cocci. Manual of clinical microbiology: Volume
1(Ed. 9), 390-411.
Bellakhdar, J. (1997). La pharmacopée
marocaine traditionnelle. I. PRESS (Ed.), (pp. 764). Paris.
Benazzouz, M. (2011). Les huiles
essentielles, importance et potentialités : Mise à jour
bibliographique des dernieres recherche sur leurs, emplois et toxicité
et analyse de la composition des huiles essentielles de quinze plantes des plus
consommés au Maroc. (Doctorat), Mohamed V, Maroc.
Bisognano, C. (2000). Impact de la
résistance antibiotique et des fluoroquinolones sur l'adhérence
à la fibronectine de Staphylococcus aureus : étude fonctionnelle
et mécanismes moléculaires. (Doctorat en sciences
biologiques), Université de Genève, Genève, Suisse.
Boukhatem, M. N., Ferhat, M. A., Kameli, A., Saidi, F.,
Mekarnia, M. (2014a). Liquid and vapour phase antibacterial activity
of Eucalyptus globulus essential oil= susceptibility of selected respiratory
tract pathogens
American Journal of Infectious Diseases, 10(03), 105.
Boukhatem, M. N., Ferhat, M. A., Kameli, A., Saidi, F.,
Taibi, H., Djamel, T. (2014b). Valorisation de l'essence aromatique du
Thym (Thymus vulgaris L.) en aromathérapie anti-infectieuse [Potential
application of Thyme (Thymus vulgaris L.) essential oil as
3
antibacterial drug in aromatherapy]. International Journal of
Innovation and Applied Studies, 8(4), 1418.
Bousbia, N. (2004). Extraction et
identification de quelques huiles e ssentielles (nigelle,coriandre, origan,
thym, romarin), étude de leurs activités antimicrobiennes.
(Thèse de Magistère, option Sciences Alimentaires), Alger
(Algérie).
Bruneton, J. (2009). Pharmacognosie: phytochimie
plantes médicinales (4e ed.). Lavoisier (Ed.), (pp. 567-571-573-574).
Burt, S. (2004). Essential oils: their
antibacterial properties and potential applications in foods--a
review. International journal of food microbiology, 94(3), 223-253.
CA, R. (1999). Pharmacology of rosemary
(Rosmarinus officinalis Linn.) and its therapeutic potentials. Indian
journal of experimental biology, 37, 124-131.
Carson, C. F., Mee, B. J., Riley, T. V. (2002).
Mechanism of action of Melaleuca alternifolia (tea tree) oil on Staphylococcus
aureus determined by time-kill, lysis, leakage, and salt tolerance assays and
electron microscopy. Antimicrobial agents and chemotherapy, 46(6),
1914-1920.
Chakou, M., Bassou, K. (2007).
Efficacité antibactériennes et antifongiques des huiles
essentielles obtenues par extraction de la menthe verte Mentha Spicata L. de la
région de Ouargla sur quelques germes pathogènes:
E.coli,Pseudomonasaeroginosa,Staphylococcus aureus,Bacillus subtiluis et
Candida albican.
CHU Minjoz, J., Besançon, F. d. M.-P. d.
(2007). BACTERIO-WEB. from
http://bacterioweb.univ-fcomte.fr/
Crunkhorn, P., Meacock, S. (1971). Mediators of
the inflammation induced in the rat paw by carrageenin. British Journal of
Pharmacology, 42(3), 392-402.
D'Acquisto, F., May, M. J., Ghosh, S. (2002).
Inhibition of nuclear factor kappa B (NF-B). Molecular interventions,
2(1), 22.
4
Damerdji, A. (2015). Les
Orthoptéroïdes sur différentes plantes dans la région
de Tlemcen (Algérie). Afrique Science: Revue Internationale des
Sciences et Technologie, 8(3), 82-92.
Davidson, P. (2005). Food antimicrobials:
Back to nature. Paper presented at the I International Symposium on
Natural Preservatives in Food Systems 709.
Di Rosa, M., Willoughby, D. A. (1971). Screens
for anti-inflammatory drugs. J Pharm Pharmacol, 23(4), 297-298.
Djeddi, S. (2012). Les huiles essentielles "Des
mystérieux métabolites secondaires" P. a. francophone (Ed.), (pp.
31-32-33-42-43-44).
Djeddi, S., Bouchenah, N., Settar, I., Skaltsa, H. D.
(2007). Composition and antimicrobial activity of the essential oil of
Rosmarinus officinalis from Algeria. Chemistry of Natural Compounds,
43(4), 487-490. doi: 10.1007/s10600-007-0172-4
Dorman, H., Deans, S. (2000). Antimicrobial
agents from plants: antibacterial activity of plant volatile oils. Journal
of applied microbiology, 88(2), 308-316.
Erkan, N., Ayranci, G., Ayranci, E. (2008).
Antioxidant activities of rosemary (Rosmarinus Officinalis L.) extract,
blackseed (Nigella sativa L.) essential oil, carnosic acid, rosmarinic acid and
sesamol. Food Chemistry, 110(1), 76-82.
Essawi, T., Srour, M. (2000). Screening of some
Palestinian medicinal plants for antibacterial activity. Journal of
ethnopharmacology, 70(3), 343-349.
Festy, D. (2009). Les huiles essentielles,
ça marche !: Tous les bons gestes pour se soigner autrement:
Leduc.s éditions.
Freeman, L., Carel, Y. (2006).
Aromathérapie. NUTRA NEWS Science. Nutrition, Prévention et
Santé.
5
Garcia, L. S. (2010). Clinical microbiology
procedures handbook: American Society for Microbiology Press.
Goetz, P., Ghedira, K. (2012).
Phytothérapie anti-infectieuse (Vol. Rosmarinus officinalis (Lamiaceae):
Romarin, pp. 11-193-194-340-341-342).
Guenter, E. (1975). The essential oils
(Vol. II, III, IV, V, VI). New York USA.
Halpern, B. N., Briot, M. (1950). [Pathogenic
and therapeutic study of an edema syndrome caused by ovalbumin in the rat].
Arch Int Pharmacodyn Ther, 82(3), 247-296.
Hammer, K. A., Carson, C., Riley, T. (1999).
Antimicrobial activity of essential oils and other plant extracts. Journal
of applied microbiology, 86(6), 985-990.
Hazen, K., Howell, S., Murray, P., Baron, E., Jorgensen,
J., Landry, M., et al. (2006). Candida, Cryptococcus, and other yeasts
of medical importance. Manual of clinical microbiology: Volume 2(Ed.
9), 1762-1788.
Heinrich, M., Kufer, J., Leonti, M., Pardo-de-Santayana,
M. (2006). Ethnobotany and ethnopharmacology--Interdisciplinary links
with the historical sciences. Journal of ethnopharmacology, 107(2),
157-160.
Inouye, S., Uchida, K., Maruyama, N., Yamaguchi, H., Abe,
S. (2006). A novel method to estimate the contribution of the vapor
activity of essential oils in agar diffusion assay. Nihon Ishinkin Gakkai
Zasshi, 47(2), 91-98.
Kaloustian, J., Hadji-Minaglou, F. (2013). La
connaissance des huiles essentielles :
qualitologie et aromathérapie. S. S. B. Media (Ed.), (pp.
13-20): Springer, Paris.
Kluytmans, J., Van Belkum, A., Verbrugh, H.
(1997). Nasal carriage of Staphylococcus aureus: epidemiology,
underlying mechanisms, and associated risks. Clinical microbiology reviews,
10(3), 505-520.
6
Köhler, F. E., Pabst, G. (1883).
Köhler's Medizinal-Pflanzen in Naturgetreuen Abbildungen Mit Kurz
Erläuterndem Texte: Atlas Zur Pharmacopoea Germanica, Austriaca, Belgica,
Danica, Helvetica, Hungarica, Rossica, Suecica, Neerlandica, British
Pharmacopoeia, Zum Codex Medicamentarius, Sowi: Friedrich von
Zezschwitz.
Laghchimi, A., Znini, M., Majidi, L., Renucci, F., El
Harrak, A., Costa, J. (2014). Composition chimique eteffet des phases
liquide et vapeur de l'huile essentielle de Lavandula multifida sur la
croissance mycélienne des moisissures responsables de la pourriture de
la pomme (Chemical composition and effect of liquid and vapor phaseof Lavandula
multifida essential oil onmycelial growth of fungi responsible for the rot of
apple).
Landino, L. M., Crews, B. C., Timmons, M. D., Morrow, J.
D., Marnett, L. J. (1996). Peroxynitrite, the coupling product of
nitric oxide and superoxide, activates prostaglandin biosynthesis.
Proceedings of the National Academy of Sciences, 93(26),
15069-15074.
Larrondo, J., Calvo, M. (1991). Effect of
essential oils on Candida albicans: a scanning electron microscope study.
Biomedical letters, 46(184), 269-272.
Le Loir, Y., Baron, F., Gautier, M. (2003).
Staphylococcus aureus and food poisoning. Genet Mol Res, 2(1),
63-76.
Lee, H. C., Cheng, S. S., Chang, S. T. (2005).
Antifungal property of the essential oils and their constituents from
Cinnamomum osmophloeum leaf against tree pathogenic fungi. Journal of the
Science of Food and Agriculture, 85(12), 2047-2053.
Lis-Balchin, M., Hart, S. (1999). Studies on the
mode of action of the essential oil of LavenderLavandula angustifolia P.
Miller). Phytotherapy Research, 13(6), 540-542.
Logan, N. A., Rodrigez-Diaz, M. (2006). Bacillus
spp. and related genera. Principles and Practice of Clinical Bacteriology,
2, 139-158.
7
Miguel, M. G. (2010). Antioxidant and
anti-inflammatory activities of essential oils: a short review. Molecules,
15(12), 9252-9287.
Moreno, S., Scheyer, T., Romano, C. S., Vojnov, A. A.
(2006). Antioxidant and antimicrobial activities of rosemary extracts
linked to their polyphenol composition. Free radical research, 40(2),
223-231.
Nedorostova, L., Kloucek, P., Kokoska, L., Stolcova, M.
(2008). Comparison of antimicrobial properties of essential oils in
vapour and liquid phase against foodborne pathogens. Planta Med,
74(09), PI6. doi: 10.1055/s-0028-1084914
Odds, F. C. (2010). Molecular phylogenetics and
epidemiology of Candida albicans. Future Microbiology, 5(1), 67-79.
Ozhak-Baysan, B., Ogunc, D., Colak, D., Ongut, G.,
Donmez, L., Vural, T., et al. (2012). Distribution and antifungal
susceptibility of Candida species causing nosocomial candiduria. Medical
mycology, 50(5), 529-532.
Panizzi, L., Flamini, G., Cioni, P. L., Morelli, I.
(1993). Composition and antimicrobial properties of essential oils of
four Mediterranean Lamiaceae. J Ethnopharmacol, 39(3), 167-170.
Peng, C.-H., Su, J.-D., Chyau, C.-C., Sung, T.-Y., Ho,
S.-S., Peng, C.-C., et al. (2007). Supercritical fluid extracts of
rosemary leaves exhibit potent anti-inflammation and anti-tumor effects.
Bioscience, biotechnology, and biochemistry, 71(9), 2223-2232.
Porcher, M. H. (2007). M.M.P.N.D. Sorting
Rosmarinus names. from
http://www.plantnames.unimelb.edu.au/Sorting/Rosmarinus.html
8
Richard, D., Chevalet, P., Fournel, S., Giraud, N., Gros,
F., Laurenti, P., et al. (2010).
Biologie -Tout le cours en fiches: 300 fiches de cours, 270
QCM et bonus web: Dunod.
Rocha, J., Eduardo-Figueira, M., Barateiro, A.,
Fernandes, A., Brites, D., Bronze, R., et al. (2015).
Anti-inflammatory Effect of Rosmarinic Acid and an Extract of Rosmarinus
officinalis in Rat Models of Local and Systemic Inflammation. Basic &
Clinical Pharmacology & Toxicology, 116(5), 398-413. doi:
10.1111/bcpt.12335
Rouibi, A., Chabane, D., Saidi, F., Azine, K.
(2013). Étude comparative de l'activité antispasmodique
de l'extrait aqueux d'Ajuga iva L. et de l'ibuprofène chez les souris.
Afrique Science: Revue Internationale des Sciences et Technologie,
8(2).
Roulier, G. (2000). Les huiles essentielles pour
votre santé. Dangles (Ed.), (pp. 336).
Ryan, K. (2004). Candida, Aspergillus, and Other
Opportunistic Fungi. Sherris Medical Microbiology, 659-668.
Schell, W. A., Fleming, D., Hunt, D. (2006).
Mycotic agents of human disease. Biological safety: principles and
practices(Ed. 4), 163-178.
Skandamis, P., Nychas, G. J. (2001). Effect of
oregano essential oil on microbiological and physico- chemical attributes of
minced meat stored in air and modified atmospheres. Journal of applied
microbiology, 91(6), 1011-1022.
Smith-Palmer, A., Stewart, J., Fyfe, L. (1998).
Antimicrobial properties of plant essential oils and essences against five
important food-borne pathogens. Lett Appl Microbiol, 26(2),
118-122.
Taylor, B., Duthie, H., Luscombe, D. (1985).
Calcium-antagonist activity of menthol on gastrointestinal
smooth-muscle. British Journal of Clinical Pharmacology, 20(3),
P293-P294.
Vinegar, R., Schreiber, W., Hugo, R. (1969).
Biphasic development of carrageenin edema in rats. Journal of pharmacology
and experimental therapeutics, 166(1), 96-103.
9
Vogel, H., Vogel, W. (1997). Drug Discovery
and Evaluation, Pharmacological Assays. : Springer-Verlag, Berlin
Heidelberg.
Zaika, L. L. (1988). Spices and herbs: their
antimicrobial activity and its determination1. Journal of Food Safety,
9(2), 97-118.
I
nnexes
II
Annexe 1 : Constituants chimiques de Rosmarinus
officinalis L. (Goetz et Ghedira, 2012).
|
Familles de constituants
|
Constituants
|
|
Huile essentielle (1 à 2,5 %)
|
Camphre (1 à 38%), 1,8-cinéole,
á-pinène (7 à 80%), bornéol (4 à 19%),
verbénone (1 à 37%), l'eucalyptol (1 à 35%),
acétate de bornyle(jusqu'à 10%), camphène,
á-terpinéol,f3-pinène, f3-caryophillène,
myrcène...
|
|
Diterpènes phénoliques tricycliques
|
Diterpènes phénoliques tricycliques Acide
carnosolique, carnosol, rosmanol, rosmadial...
|
|
Flavonoïdes
|
- Hétérosides de la lutéoline, de la
diosmétine
- Flavones méthoxylées : genkwanine et
dérivés,
cirsimaritine, scutellaréine
|
|
Acides phénols (3,5 %) = « tanins des
Labiatées »
|
Acides caféique, chlorogénique, rosmarinique
|
|
Triterpènes, stéroïdes
|
Acide oléanolique (10 %), dérivés de
l'acide ursolique et a- et B-amyrine (5 %)
|
|
Lipides (cuticule cireuse des jeunes feuilles)
|
n-alcanes, isoalcanes, alcènes
|
|
Constituants divers
|
Polysaccharides acides (6 %), traces de salicylate
|
III
Annexe 2 : photomicrographies des souches
microbiennes.
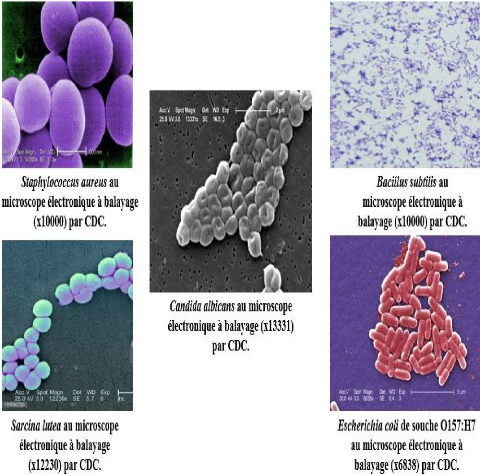
Annexe 3 : Matériel non biologique
Activité Antimicrobienne
Activité antispasmodique
et
anti-inflammatoire
|
Matériels de laboratoire
|
|
Réactifs
|
|
Solvants
|
|
Milieux de culture
|
|
-Agitateur, Autoclave et étuve pour stérilisation,
Bain Marie à 45°C, Bec bunsen, Etuve d'incubation (32.5 #177;
2.5°C).
-Boite de Pétri de 100 mm de diamètre, disques
stériles (9mm), disques d'antibiotiques ( Ampicilline 10 ug/disque et
Myconasol 10 mg/ml ) Ecouvillons stériles, pipettes Pasteur, pipettes
graduées de 1 ml et 10 ml stériles, micropipette (20
à200uL) pince de laboratoire ,portoir, papier filtre, poire ,seringue de
5 cc à 10 cc ,tubes à essai stériles, para film.
|
|
-Huile du romarin.
|
|
-Eau physiologique. -Eau distillé.
-Myristate d'isopropyle (DMSO).
|
|
-Soja agar : Agar
bactériologique (15g), Chlorure de soduim (5g),
Caséine (15g), Peptone de soja (5g).
-Milieu Sabouraud : paptone de viade de
caséine(10g), glucose monohydrate, (40g), gelose(15g), Eau
purifiée (1000 ml).
|
-Agitateur Baro Magnétique. -Balance pour petits
animaux.
IV
-Cages de stabulation des souris.
-lots de souris de laboratoire. -Seringue stériles en
verre de 1
ml.
-Fioles.
|
-Acide acétique à 1%.
-Comprimés
Phloroglucinoldihydrate 80mg.
-Comprimés Votrex 50mg (pour l'activité
anti-inflammatoire).
-Carraghénine à 1% (pour l'activité
anti-inflammatoire).
-Huile du romarin.
|
|
-Eau physiologique. -Eau distillé.
|
|
-
|
Annexe 4: Appareillage de laboratoire.


Balance pour petits animaux
Balance électronique de laboratoire
Agitateur Baro Magnétique
Agitateur Vortex
V
Autoclave
|
Etuve de stérilisation
|
Etuve
d'incubation
|
Bain marie
|
VI
Annexe 5: Etapes de la préparation des
milieux de culture.

VII
Annexe 6 : Etapes de la réalisation de
l'activité antimicrobienne.

VIII
Annexe 7: Etapes de la réalisation de
l'activité anti-inflammatoire de Romarin.
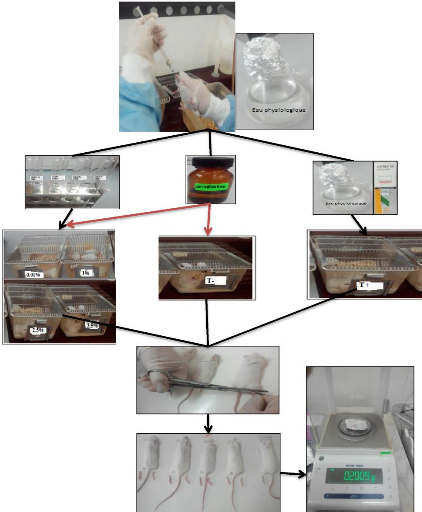
IX
Annexe 8: Etapes de la réalisation de
l'activité antispasmodique de Romarin.

X
Annexe 9: Résultats de la méthode
d'aromatogramme.

Annexe 10: Résultats de la méthode
de micro-atmosphère.

XI
XII
Annexe 11 : Résultats de la
méthode de dilution.

XIII
Annexe 12 : Résultats de l'activité
anti-inflammatoire
Tableau : Poids des pattes postérieurs gauches et droites
et leurs pourcentages d'oedème.
|
PPD
|
PPG
|
% d'oedème
|
|
Témoin
|
0,1533
|
0,2046
|
33,4637965
|
|
0,1558
|
0,2091
|
34,2105263
|
|
0,1776
|
0,2291
|
28,9977477
|
|
0,145
|
0,2081
|
43,5172414
|
|
Diclofénac
|
0,1179
|
0,1278
|
8,39694656
|
|
0,1521
|
0,172
|
13,0834977
|
|
0,1448
|
0,1648
|
13,8121547
|
|
0,1396
|
0,1555
|
11,3896848
|
|
0.01%
|
0,1439
|
0,1929
|
34,0514246
|
|
0,1414
|
0,1835
|
29,7736917
|
|
0,1544
|
0,2026
|
31,2176166
|
|
0,1432
|
0,2001
|
39,7346369
|
|
1%
|
0,1311
|
0,1697
|
29,4431732
|
|
0,1778
|
0,2053
|
15,4668166
|
|
0,1752
|
0,2269
|
29,5091324
|
|
0,1553
|
0,2192
|
41,1461687
|
|
2.5%
|
0,143
|
0,1744
|
21,958042
|
|
0,1128
|
0,1475
|
30,7624113
|
|
0,1355
|
0,164
|
21,0332103
|
|
0,1378
|
0,1746
|
26,7053701
|
|
3.5%
|
0,1537
|
0,1769
|
15,0943396
|
|
0,1336
|
0,1628
|
21,8562874
|
|
0,1371
|
0,1539
|
12,2538293
|
|
0,1356
|
0,154
|
13,5693215
|
PPG : pattes postérieurs gauches.
PPD : pattes postérieurs droites.
Résultats des statistiques descriptives par STATISTICA 10
:
|
Mean
|
Standard Deviation
|
SE of Mean
|
|
T
|
35,04733
|
6,09767
|
3,04883
|
|
DIC
|
11,67057
|
2,40681
|
1,20341
|
|
0,01% HE
|
33,69434
|
4,40145
|
2,20073
|
|
1% HE
|
28,89132
|
10,50531
|
5,25266
|
|
2,5% HE
|
25,11476
|
4,51109
|
2,25555
|
|
3,5% HE
|
15,69344
|
4,26936
|
2,13468
|
XIV
Test de Tukey HSD par STATISTICA 10 :
|
Tukey HSD test; variable %Oedème (Spreadsheet2) Homogenous
Groups, alpha = ,05000 Error: Between MS = 35,214, df = 18,000
|
|
Lots
|
%Oedème
|
1
|
2
|
3
|
|
DIC
|
11,67057
|
|
|
****
|
|
0,035
|
15,69344
|
|
****
|
****
|
|
0,025
|
25,11476
|
****
|
****
|
|
|
0,01
|
28,89132
|
****
|
****
|
|
|
0,0001
|
33,69434
|
****
|
|
|
|
T
|
35,04733
|
****
|
|
|



