EPIGRAPHE
Si je dis aux autres enfants [que je suis malade], ils vont me
négliger. Si un camarade me demande quelque chose et que je lui donne,
l'autre va dire : « Non ! Il ne faut t'approcher de cette fille-là,
elle a le sida ! » [...] C'est ma maman qui m'a dit cela. Elle m'a dit de
ne pas dire que je prends les médicaments, mais moi j'ai su que
c'était le sida. J'ai vu ça sur un bout de papier ! (anonyme,
sept ans et demi) Fabienne HEJOAKA, Burkinafaso, 2012.
DEDICACE
A toi Dieu tout puissant tout honneur et toute gloire pour
les merveilles que tu ne cesses d'accomplir dans ma vie ; toi qui as
donné un sens à mon existence même lorsque tout espoir
s'envolait.
A toi mon cher papa KITOKO ABELI Barnabé et toi ma
chère maman NGUMBI AZIZA Joséphine ; toute votre richesse c'est
vos enfants que nous sommes. En nous vous avez bâti des édifices
immuables. Trouvez à travers ce travail une consolation pour toutes les
peines que vous avez ressenties ; qu'il soit pour vous une source de
joie.
A vous grands frères Gaston KILINDE Feruzi,
Dieudonné SWEDI et Martin AMISI pour tant de conseils que nous avons
reçu de vous, vous qui n'avez pas hésité un seul instant
à nous secourir et nous prêter main forte moralement,
spirituellement et financièrement ; recevez la joie de notre fruit
qu'est ce travail.
A vous mes frères et soeurs, les KITOKO :
Antoinette NGUMBI, Joseph RAMAZANI, Hubert KAFEKE, Kitabel KITOKO, Jean-
Claude KAMANA, Daniel MBARUKU et à vous mes oncles, tantes, cousins,
cousines, neveux et nièces trouvez dans ce travail mon affection pour
vous et un chemin d'exemple tracé devant vous.
A vous enfants séropositifs, pour qu'un jour le soleil
se lève et que vous ne soyez plus infectés par ce virus, nous
ferons de notre mieux. Tant qu'il y a la vie, il y a toujours de l''espoir.
A tous je dédie ce travail
Hermann TAMUBANGO
AVANT-PROPOS
Des élections s'organisent maintenant en
République Démocratique du Congo, la révolution de la
modernité prônée par le chef de l'Etat se vit ; ici on
construit des routes, là on réhabilite des écoles et
là encore on installe des cabines électriques. Le
développement de la RDC compte sur l'effort tant collectif
qu'individuel. Il s'avère sans doute qu'en dépit de l'union
matérielle, sentimentale et morale, ce développement repose
particulièrement sur la capacité de réflexion des
congolais eux-mêmes.
A la fin du deuxième cycle de Médecine le
programme académique prévoit que tout étudiant doit
présenter une monographie de fin d'études. C'est un exercice qui
approuve sa maturité scientifique et son esprit critique face la
réalité du vécu afin de le lancer dans le domaine de la
recherche. Pour ce faire en élaborant ce travail nous pensons avoir
répondu à ce devoir. Le présent travail est les
résultats de notre endurance depuis l'enfance, mais surtout à la
fin de ce cycle. En tant que chercheur débutant, l'élaboration de
ce travail ne nous a pas été facile. Nous tenons donc à
remercier tous ceux qui, de près ou de loin, nous ont assisté
pour sa réalisation et sans le concours desquels il n'aurait vu
jour.
Nous remercions tout particulièrement le Chef Travaux
docteur YABA Antoniki à qui revient à juste titre le
mérite de ce travail ; d'un bout à l'autre vous avez
accepté d'assurer la direction de ce travail malgré vos
occupations multiples. Vous nous avez toujours accueillis avec grande sympathie
et bienséance tout le long de ce travail. Votre disponibilité et
modestie, vos conseils et votre rigueur méthodologique ont
été précieux et déterminants pour la
réalisation de ce travail. Veuillez trouver à travers cette page
le témoignage de notre profonde gratitude. A vous nous réservons
une mention particulière.
Nos remerciements s'adressent également à tout
le corps professoral de la faculté de Médecine. Nous sommes des
nains que vous avez juchés sur vos épaules, vous géants de
la Médecine qui avez vécu et appris cet art avant nous.
Aujourd'hui vous nous l'avez appris à votre tour, nous pouvons soigner
les malades non parce que nos connaissances soient plus aigües mais tout
simplement parce que vous avez accepté de nous élever de toute
votre hauteur gigantesque. Merci pour l'art que vous nous avez appris ;
nous l'enseignerons aussi à vos fils.
Nous exprimons les mêmes sentiments à nos
parents. Vous êtes allés au-delà de vos ressources pour
qu'un jour je sois couronné médecin. Merci pour ce sacrifice et
que cet honneur soit le votre.
Nos remerciements à la famille Amisi, la famille
Kilolo, la famille Sanga, la famille Muganza et à maman Manda Albertine.
Pour votre soutien au moment le plus crucial de notre parcours universitaires.
Nous sommes arrivés à ces résultats grâce à
l'amour paternel que vous avez manifesté à notre égard.
Nous remercions également le professeur Mwembo Tambwe
Albert, pour ses conseils et son soutien financier tout le long de notre
parcours et surtout en cette fin de cycle.
Notre sympathie à nos amis et compagnons de lutte avec
qui, nuit et jour, à n'importe quelle circonstance de peine ou de joie,
avons toujours été ensemble. Nous citons : Etienne Muganza,
Rosie Pombo, Josué Katoy, Jacques Mundeke, Lilie Samusong, Christian
Pfiti, Linda Tartibu, Francis Tshibala, Bolis Paluku, Léonard
Pakama, Wanga Matthieu Franc Kahozi, Noel Kabamba, Bushiri Kasala, Marleine
Kalunga, Lysette Nyembo, Muyumba Albert. La liste n'est pas exhaustive.
A tous nous exprimons notre profonde gratitude
Hermann TAMUBANGO
TABLE DES MATIERES
EPIGRAPHE
I
DEDICACE
II
AVANT-PROPOS
III
TABLE DES MATIERES
V
LISTE DE FIGURES ET TABLEAU
VIII
LISTE DES ABREVIATIONS
IX
RESUME
X
INTRODUCTION
1
CHAPITRE I : CONCEPTS DU SUJET
5
I.1. ENFANT
5
I.2. INFECTION A VIH
5
I.3 SIDA
5
CHAPITRE II : GENERALITES SUR LE VIH/SIDA
CHEZ L'ENFANT
7
II.1 EPIDEMIOLOGIE DU VIH INFANTILE DANS LE MONDE
ET EN RDC
7
II.2 AGENT CAUSAL
8
a) Diversité du VIH
8
b) Cycle de réplication virale
9
II.3 MODES DE TRANSMISSION
10
a) Transmission par voie sexuelle
10
b) Transmission par voie sanguine
10
c) Transmission mère-enfant
11
II.4 FACTEURS DE RISQUE DE TRANSMISSION
MATERNOINFANTILE DU VIH
11
a) Facteurs liés à la mère
11
b) Facteurs obstétricaux
12
c) Facteurs lies a l'enfant
12
d) Facteurs liés au virus
12
II.5 PHYSIOPATHOLOGIE
13
II.6 CLINIQUE
14
a) Classification en stades cliniques
proposés par l'OMS
14
b) Classification CDC Atlanta 1994
15
c) Critères cliniques de BANGUI
15
II.7 PARAMETRES BIOLOGIQUES DU VIH CHEZ
L'ENFANT
16
II.8 EVOLUTION ET PRONOSTIC
16
a) La forme rapide, précoce et
sévère
17
b) La forme lentement évolutive
17
c) Progression de la maladie à VIH chez les
enfants en Afrique
18
II.9 COMPLICATIONS
18
II.10. PARACLINIQUE
19
a) Dépistage
19
b) Confirmation
20
II.11. TRAITEMENT ET CRITERE DE MISE
20
II.12 MOYENS DE PREVENTION
23
CHAPITRE III : OBSERVANCE ET ADHERENCE AU
TRAITEMENT
24
III.1 OBSERVANCE
24
a) Education
24
b) Préparation
24
c) Evaluation
24
d) appui soutenu
25
III. 2 L' ADHERENCE
25
CHAPITRE IV : METHODOLOGIE
26
IV.1 PRESENTATION DU LIEU D'ETUDE
26
IV.2 PERIODE ET TYPE D'ETUDE
28
IV. 3 POPULATION D'ETUDE
28
IV. 4 ECHANTILLONNAGE
28
VI.5 MATERIEL ET ANALYSE STATISTIQUE
28
IV.6 DIFFICULTES LIEES A L'ETUDE
29
CHAPITRE V : PRESENTATION DES RESULTATS
30
I. ASPECT EPIDEMIOLOGIQUE
30
II. ASPECTS CLINIQUES
38
III. ASPECT BIOLOGIQUE
45
IV. ASPECT THERAPEUTIQUE
46
V. ASPECT EVOLUTIF
49
IV. DISCUSSION
55
IV.1 CARACTERISTIQUES SOCIODEMOGRAPHIQUES
55
a) Fréquence
55
b) Sexe
55
c) Age
56
d) Provenance
56
IV.2 ASPECT CLINIQUE
57
a) Le motif de consultation
57
b) Age de diagnostic
57
c) Le Z- score poids pour âge
57
d) Stade clinique
58
e) Les infections opportunistes
58
IV. 3 ASPECT BIOLOGIQUE
59
IV.4 ASPECT THERAPEUTIQUE
59
IV.5. ASPECT EVOLUTIF
60
CONCLUSION
62
RECOMMANDATIONS
64
Aux autorités politico administratives
64
Au niveau du PNLS
64
Au personnel soignant
64
Au parents
64
REFERENCES BIBLIOGRAPHIQUES
65
LISTE DE FIGURES ET TABLEAU
LISTE DES TABLEAUX
Tableau I : Distribution des enfants
séropositifs en fonction de l'adresse
Tableau II : Distribution des enfants
séropositifs en fonction du motif de consultation
Tableau IV : Distribution des enfants
séropositifs en fonction du stade clinique (selon l'OMS)
Tableau V : Distribution des enfants
séropositifs en fonction des infections opportunistes
Tableau VI : Distribution des enfants
séropositifs en fonction du sexe et de décès
Tableau VII : Distribution des cas en fonction de
l'observance et de l'issue
Tableau VIII : Distribution des cas en fonction
du stade clinique selon l'OMS et le sexe
Tableau IX : Le risque de développer les
infections opportunistes lorsqu'on est sous ARV
LISTE DES FIGURES
Figure 1 : La fréquence des enfants
séropositifs au centre d'excellence - Unilu
Figure 2 : Distribution des enfants
séropositifs en fonction du sexe
Figure 3 : Distribution des enfants
séropositifs en fonction de la tranche d'âge
Figure 4: Distribution des enfants séropositifs
en fonction du niveau scolaire
Figure 5: Distribution des enfants en fonction de
l'issue des parents
Figure 6: Distribution des enfants séropositifs en
fonction de la connaissance du statut sérologique des parents
Figure 7: Distribution des enfants séropositifs en
fonction du statut sérologique des parents.
Figure 8: Distribution des enfants séropositifs en
fonction de l'âge de diagnostic du VIH/SIDA.
Figure 9: Distribution des enfants séropositifs
en fonction de l'état général.
Figure 10: Distribution des cas en fonction de
l'âge de diagnostique
Figure11: Distribution des enfants séropositifs
en fonction du Z-score poids pour Age
Figure 12: Distribution des enfants
séropositifs en fonction de l'état immunologique
Figure 13: Distribution des enfants
séropositifs en fonction de la prise en charge PTME
Figure 14: Distribution des enfants
séropositifs en fonction de la mise sous ARV
Figure 15: Distribution des enfants
séropositifs en fonction de l'observance du traitement.
Figure 16: Distribution des enfants
séropositifs en fonction d'hospitalisation
Figure 17: Répartition des cas en fonction de
l'issue
LISTE DES ABREVIATIONS
Ac : anticorps
ADN : acide
désoxyribonucléique
ARN : acide ribonucléique
ARV : antirétroviraux
AZT : azidothymidine (zidovudine)
CD4 : classe de différenciation
4
CDC : center of deseases control
(Centre de surveillance des maladies)
CMV : cytomégalovirus
CV : charge virale
ELISA : Enzyme linked immuno assay
Gp : glycoprotéines
HAART : highly active antirétroviral
therapy (traitement ARV hautement actif)
IF : inhibiteur de fusion
INNTI : inhibiteur non nucléotidique de
la transcriptase inverse
INTI : inhibiteurs nucléotidique ou
nucléotidique de la transcriptase inverse
IP : inhibiteur de protéase
OMS : organisation mondiale de la sante
ONU/SIDA : Programme commun des Nations Unies
sur le VIH/SIDA
PCR : Polymérase Chain réaction
PNLS: programme national de lutte contre le
SIDA
PNMLS : Programme National Multisectoriel de
Lutte contre le SIDA
PTME : Prévention de la transmission
mère-enfant
PVVIH : personnes vivant avec le VIH/SIDA
RIPA : radioimmunoprecipitation assay
SIDA/AIDS : syndrome d'immunodéficience
acquise
TME : Transmission mère enfant
VIH/HIV : virus de l'immunodéficience
humaine
RESUME
Nous avons mené une étude sur le profil
épidémiologique des enfants avec VIH suivi au centre d'excellence
- Unilu.
L'objectif de cette étude était de
dégager la fréquence ; dégager le profil
épidémio - clinique des enfants avec VIH au centre d'excellence
- Unilu et de déterminer le faciès biologique ainsi que
l'évolution et la prise en charge de ces enfants.
C'était une étude d'une approche descriptive
transversale par analyse retrospective des données basée sur la
revue documentaire pour une période allant du 1ier janvier
2010 au 31 Décembre 2013 soit 4 ans. Notre échantillon
était exhaustif et seuls les enfants de 18 mois à 15ans ont
été inclus. Les statistiques usuelles ont été
utilisées pour l'analyse des données.
Sur 1500 PVV, 250 pour l'infection à VIH
pédiatrique soit une fréquence de 17 % ; le sex ratio
homme- femme était 0,7 ; l'âge médian est de 84 mois (avec
les extrêmes 18 mois et 180 mois) ; le niveau scolaire était non
défini dans 49,2% ; dans 29 % sont des orphelins d'où moins un parent ; l'âge
médian de diagnostique était de 72 mois ; dans 46% des cas
les enfants pour la toux 63% des patients font une malnutrition aigüe de
type insuffisance pondérale ; dont 14% sous la forme
sévère 36,4% sous la forme modérée et 12,8%
sous la forme légère. Dans 44% des cas sont au stade III(OMS);
dans 20,15% des cas font la tuberculose comme infection opportuniste ; dans
46, 90% des cas le taux de CD4 est au - delà de 499 /mm3 ; dans 9%
des cas pour le suivi en PTME ; la prophylaxie dans 100% ; dans
65 % des cas étaient sous ARV ; dans 87% des cas observaient le
traitement et dans 7% des cas étaient
décédés.
L'infection à VIH/SIDA pédiatrique reste encore
un problème majeur de santé dans notre milieu d'où la
collaboration personnel médical et les partenaires de santé
serait un outil efficace de lutte.
Mots - clés : Enfant, VIH/SIDA, Centre
d'Excellence- Unilu.
INTRODUCTION
L'enfant est un être en pleine croissance. Cette
croissance intéresse tous les systèmes de l'organisme
notamment : le système cardio- respiratoire, le système
digestif, le système uro- génitale, le système
immunitaire, etc. Le système immunitaire constitue le système
protecteur de l'organisme ; une atteinte de ce système entravera
cette bonne croissance. (Assumani, 2011).
Par ailleurs, on trouve des agents pathogènes qui
s'attaquent directement à ce système, nous citons ici le virus de
l'immunodéficience humaine VIH en sigle qui se traduit par l'infection
à VIH.
Aujourd'hui, l'infection à VIH défie les
sciences médicales et même au - delà, l'humanité
dans toutes ses modalités d'adaptation sociales et d'organisation, et
cela surtout avec le SIDA, syndrome d'immunodéficience acquise qui est
la conséquence la plus sévère et la plus retentissante de
cette infection. L'infection à VIH réalise actuellement un
problème de santé publique. Cette pandémie décrite
au début des années 80, frappe tous les pays du globe et en tout
presque 40 millions de personnes sont atteintes (Dabis et al, 2002)
En effet, une augmentation régulière de la
prévalence est observée dans la région d'Afrique avec des
disparités dont les causes sont multifactorielles alors que dans le
reste du monde la pandémie semble régresser, si non
stabilisée. Les raisons sont multiples et varient d'un pays à
l'autre : le tourisme sexuel, l'absence d'information de la population sur
les facteurs de protection tels que le préservatif, le refus de
l'abstinence ou de relations hors mariage, manque de moyen ou de volonté
pour faire de la prévention une priorité et informer les
populations, voire le refus d'admettre les faits (Dabis et al, 2002)
Les pays pauvres sont les plus touchés à cause
des insuffisances d'information et d'éducation sur la maladie et surtout
la pratique de sexe reste un moyen de satisfaire les besoins vitaux en raison
de quoi les estimations de l'ONUSIDA ont révélé une
prévalence plus élevée chez les professionnelles de sexe
dans la population en générale. (Giraudan et al, 1999)
Dès lors, des grands efforts ont été
déployés à travers toute la communauté
internationale pour aboutir à la mise au point depuis 1985 de
dépistage de plus en plus performants, à une meilleure
détermination des facteurs de risque de contamination et de propagation
du virus mais aussi à des très nombreux essais
thérapeutiques (essais vaccinaux ; amélioration des
traitements antiviraux).
Toutefois la médiocrité des résultats
traduite par expansion inexorable du virus dans les coins les plus
reculés du monde et l'ascension fulgurante de la prévalence
contraste bien avec l'ampleur des efforts tant humains que financiers.
La prévention constitue de loin la meilleure option,
car il n'existe pas actuellement un vaccin permettant de se protéger du
virus, et les traitements antirétroviraux disponibles actuellement ne
permettent aucune guérison. Bien qu'ayant une certaine
efficacité, ils ne peuvent que retarder la progression vers le stade
Sida en ralentissant la prolifération du VIH au sein de l'organisme. De
plus ces thérapeutiques, coûteuses, ne sont facilement
accessibles que dans les pays développés qui peuvent en assurer
la charge financière, alors que dans les pays en développement
comme la République Démocratique du Congo plus de 90% des
patients ne bénéficient aujourd'hui d'aucun traitement efficace.
C'est pour cette raison que l'ONU à travers son programme ONUSIDA a
fait de la lutte contre le Sida une de ses priorités, lutte axée
primordialement sur la prévention. (ONUSIDA, 2007)
En République Démocratique Congo, à peu
près 1 034 000 des personnes infectées, l'OMS
déclare 250 personnes s'infectent chaque jour, 10 personnes s'infectent
toutes les heures et une personne s'infecte toutes les 5 minutes et cela
n'épargne pas les enfants.
L'infection à VIH pédiatrique reste un
problème majeur de santé publique, du fait de l'augmentation de
cas d'infection chez les femmes en âge de procréer et l'Onusida
l'estime à 15,5 millions dont 12 millions en Afrique soit 77% (Onusida,
2007).
Les nourrissons acquièrent l'infection à VIH de
leurs mères soit au cours du travail, de l'accouchement ou après
la naissance par allaitement. Le risque absolu de transmission est de 5
à 10 % au cours de la grossesse, 10 à 20 % au cours du travail et
de l'accouchement et 10 à 20 % au cours de l'allaitement.
La transmission par voie sexuelle représente environ 5%
des modes de contamination pédiatrique. Les circonstances de cette
contamination peuvent être les viols, ou l'entrée des enfants dans
vie sexuelle précoce les exposant à ce virus.
La transmission par voie sanguine ou par la transfusion est
estimée à environ 5% des modes de contamination
pédiatrique. Les principales circonstances de contaminations par cette
voie sont : la transfusion de sang souillée, l'utilisation de
seringues et objets souillés contaminés par du sang
infecté et les scarifications. (Lebela et al, 2009)
Dans le monde, le nombre des personnes vivants avec le VIH est
passé de 1,5 million (1,3 million- 1,9 million) en 2001 à 2,5
millions (2,2 millions - 2,6 millions) en 2007. Le nombre estimé de
nouvelles infections chez les enfants a toutefois diminué, passant de
460 000 (420 000- 510 000) en 2001 à 420 000
(390 000- 470 000) en 2007. Les décès attribuables au
Sida parmi les enfants avaient augmenté, de 330 000 (380 000-
560 000) en 2001 à 360 000 (350 000 - 540 000) en
2005, mais ont commencé à diminuer, l'estimation pour 2007
étant donné 330 000 (310 000- 380 000).
Près de 90 % de l'ensemble des enfants séropositifs vivent en
Afrique subsaharienne.
Au Cameroun en fin 2005, il a été estimé
qu'il existe 43000 enfants sur 500 029 enfants personnes vivants avec le
VIH soit 8,6%. ( Lebela et al, 2009)
En République Démocratique du Congo à
une population totale estimée à 60 millions dont 50 % sont des
enfants de moins de 15 ans. On estime alors le nombre d'enfant de moins 15 ans
infectés par le VIH/ SIDA à 110.000 (42.000 à 280.000)
d'où sa cinquième place au monde pour cette prévalence des
enfants vivants avec le VIH (PNLS, 2010).
La prévalence du VIH parmi les femmes en consultation
prénatale est restée relativement stable dans la capitale,
Kinshasa (entre 3,8% en 1995 et 4,2 en 2005) mais elle a augmenté dans
la deuxième ville du Pays, Lubumbashi (de 4,7 % à 6,6 entre 1997
et 2005), ainsi qu'à Mikalayi (de 0,6 % à 2,2 % entre 1999 et
2005) (Kayembe et al. 2007). La prévalence est également
élevée dans les villes de Matadi, Kisangani et Mbandaka
(où 6% des femmes fréquemment les services prénatales
étaient séropositives au VIH en 2005) ainsi qu'à Tshikapa
(où la prévalence était de 8%) (PNLS, 2005).
Ceci poussa Madame Ann M. Veneman, directrice
générale de l'UNICEF, à déclarer ce qui suit :
« les enfants restent la face cachée de la pandémie du
Sida ». (OMS, ONUSIDA, UNICEF, 2007)
La plupart des études antérieures n'ont
cherchées à révéler l'ampleur de l'infection
à VIH/ Sida que sous d'autres aspects tel est le cas de Ngwej Tshikwej
qui a ressorti le profil clinique et biologique de l'infection à VIH
chez l'enfant aux cliniques universitaires de Lubumbashi (Ngwej. T, 2005). Nous
pensons compléter cette étude en présentant
« enfants vivants avec VIH suivis au centre d'excellence-
Unilu : Etude épidémio - clinique et
biologique ».
La problématique reste à savoir quelle est la
fréquence des enfants vivants avec VIH au centre d'excellence - UNILU
et quel est le profil épidémio- clinique retenir.
L'objectif général de cette étude est
dégager le profil épidémio - clinique et biologique des
enfants vivants avec VIH au centre d'excellence - UNILU.
Les objectifs spécifiques :
· Déterminer la fréquence des enfants avec
VIH consultant le centre d'excellence - UNILU.
· Déterminer le faciès clinique, biologique
ainsi l'évolution et la prise en charge de ces enfants.
Deux parties subdivisent essentiellement ce travail ; la
première théorique, qui rassemble une revue de la
littérature sur le VIH/SIDA et la perte de la prise en charge et la
seconde, pratique, qui présent les résultats de la recherche.
CHAPITRE I : CONCEPTS DU
SUJET
I.1. ENFANT
Le mot enfant désigne aussi bien un individu de sexe
masculin ou féminin de bas âge. Il s'agit d'un être humain
dans sa période de développement située entre la naissance
et la puberté. Ce qui inclut le nouveau-né, le nourrisson, le
petit enfant, le grand enfant et l'adolescent.
Nouveau-né : de la première heure de vie
jusqu'à 28 jours ;
Nourrisson : de 28 jours à 2 ans ;
Le petit enfant : de 3 à 5 ans ;
Le grand enfant : de 6 à 12 ans ;
L'adolescent : de 13 à 17 ans.
En fonction de l'âge gestationnel, les
nouveau-nés sont repartis en trois groupes : les
prématurés, les nouveau-nés à terme et les enfants
post matures.
Un prématuré est un enfant né avant 37
semaines d'aménorrhée mais au moins 22 SA.
Un enfant né à terme est celui qui nait entre
37 et 42 semaines d'aménorrhée.
Un enfant post terme (post mature) est celui qui nait
après 42 semaines de gestation.
En fonction du poids de naissance, les nouveau-nés sont
repartis en trois groupes : les hypotrophiques, les eutrophiques et les
hypertrophiques.
Un hypotrophique est tout nouveau-né avec un poids de
naissance inférieur à 2500 grammes.
Un eutrophique est tout nouveau- né avec un poids de
naissance entre 2500 et 3500 grammes.
Un hypertrophique est tout nouveau-né avec un poids de
naissance supérieur à 3500 gramme.
I.2. INFECTION A VIH
L'infection est la contamination d'un organisme par un agent
pathogène. Le virus de l'immunodéficience humaine VIH, est le
virus responsable du sida chez l'être humain. Il appartient à la
famille des rétrovirus. Comme d'autres virus, le VIH ne peut survivre de
façon indépendante. L'être humain qu'il infecte lui sert
d'hôte (Seydou Sogoba, 2008). Donc l'infection à
VIH est à définir comme étant la pénétration
du virus de l'immunodéficience humaine dans l'organisme humain à
la suite d'un contact contagieux.
I.3 SIDA
Bien que tout le monde parle du sida, le définir est
une chose relativement compliquée. Cette difficulté à
définir simplement cette maladie reflète bien sa
complexité.
Tout d'abord quelles sont les significations des
différentes abréviations :
S : pour syndrome : ensemble de signes, de
symptômes qui appartiennent à une entité clinique mais dont
les causes peuvent être diverses
ID : pour immunodéficience est une insuffisance
fonctionnelle du système immunitaire.
A : pour acquise signifie que le sida n'est pas une
maladie héréditaire mais due à un agent mis
accidentellement au contact du malade.
Le sida, syndrome d'immunodéficience acquise
causé par le VIH est un ensemble des manifestations cliniques traduisant
un déficit profond de l'immunité à médiation
cellulaire. (Seydou Sogoba , 2008)
CHAPITRE II : GENERALITES
SUR LE VIH/SIDA CHEZ L'ENFANT
II.1 EPIDEMIOLOGIE DU VIH
INFANTILE DANS LE MONDE ET EN RDC
ONUSIDA, OMS et UNICEF estiment que chaque jour, près de
1200 enfants de moins de 15 ans contractent l'infection a VIH et que
près de 2 millions vivent avec le VIH, dont 91% en Afrique (Kitetele F
et coll, 2007).
Le nombre d'enfants recevant les ARV jusqu'à la fin du
mois de décembre 2009 était de 275.700 sur 730.000 enfants
infectés éligibles, soit une couverture en ARV de 38 %. Cette
couverture n'était que de 35% en Afrique subsaharienne, avec 224.900
enfants sous ARV sur 640.000 enfants éligibles.
L'Afrique subsaharienne supporte toujours la plus grande
partie du fardeau de l'épidémie mondiale avec 2/3 de tous les
enfants vivant avec le VIH dans le monde et près de 3/4 de tous les
décès infantiles dus au Sida.
La République Démocratique du Congo a une
population totale estimée à 60 millions dont environ 50 % sont
des enfants de moins de 15 ans. (Kitetele F et coll, 2007)
La séroprévalence nationale du VIH/SIDA chez les
femmes enceintes est estimée à 4,3 % avec des variations selon
les milieux. (Kitetele F et coll, 2007)
On estime le nombre d'enfants de moins de 15 ans
infectés par le VIH/SIDA à 110.000 [42.000 à 280.000],
dont 90 % l'ont été par la transmission verticale. La RDC a un
taux de mortalité infanto - juvénile de 148 pour mille (Rapport
EDS2007). De ce fait, elle fait partie de 6 pays au monde et de 3 pays en
Afrique, responsables de 50 % de mortalité infanto juvénile.
Notre pays est également le 5eme pays au monde
où la prévalence des enfants infectés est la plus
élevée (Kitetele F et coll, 2007). On estime à 430.000 le
nombre d'orphelins dus au VIH/SIDA soit 45 % de l'ensemble des orphelins.
Quant aux besoins pédiatriques en ARV, sur 38.950
enfants qui en ont besoin (PNLS 2009), seuls 5315 enfants en
bénéficient, soit 15 % des besoins pédiatriques en ARV
réellement couverts en RDC.
En 2013, le nombre d'enfants de moins de 15ans
infectés par le VIH/ SIDA est de 110.000 à 166.275. (PNLS
2013)
Le syndrome d'immunodéficience acquise plus connu sous
son acronyme SIDA ou sida est un ensemble de signes et symptômes
consécutifs à la destruction de plusieurs cellules du
système immunitaire par un virus. Le sida est la phase ultime de
l'infection par ce virus et finit par la mort de l'organisme de suite des
maladies opportunistes.
II.2 AGENT CAUSAL
Le sida est une affection due à un virus à ARN
appelé VIH. Il appartient au sous- groupe des lentivirus de la famille
des rétrovirus, famille caractérisée par la
possibilité paradoxale, quand le virus infecte une cellule, de
transcrire sa molécule d'ARN (génome du virus) en une
molécule d'ADN virale à partir de l'ADN de la cellule
infectée grâce à une enzyme, la reverse transcriptase.
a) Diversité du VIH
Deux types de virus sont responsables de l'infection à
VIH/SIDA : le VIH-1 qui est le plus répandu dans le monde entier et
le VIH-2 essentiellement localisé en Afrique. Il existe des cas de co-
infection à VIH-1 et VIH-2 limités à l'Afrique
subsaharienne. Pour une prise en charge spécifique, un diagnostic de
différenciation entre les deux types de virus est indispensable.
Le VIH-1est divisé en trois groupes : M (Majeur),
N (New) et O (Outlier). Le groupe M est responsable de la pandémie
actuelle, les autres groupes étant rares. Le groupe majeur est
subdivisé en sous types (A, B, C, D, F, G, H, J, K) et souches
recombinantes (Roquebert, F et coll, 2009) Pour le VIH2, plusieurs sous types
ont été décrits : seuls les sous types A (Cap vert,
Guinée Bissau, Guinée Conakry, Sénégal) et B (Cote
d'ivoire, Mali et Burkina-Faso) ont une diffusion épidémique.
Dans sa structure, le VIH est un virus sphérique de 80
à 100 nm de diamètre. Il s'agit d'un virus possédant un
génome sous forme d'ARN contenu dans une capside protéique,
elle-même entourée par une enveloppe formée d'une membrane
lipidique. Le génome est constitué de deux molécules d'ARN
identiques de 9200 à 10000 nucléotides contenant l'information
génétique nécessaire à la synthèse des
protéines virales.
Il comprend deux types de gènes : trois
gènes classiques qui représentent la majeure partie de la
molécule d'ARN et sont communs à tous les virus de la famille des
rétrovirus et qui codent pour les différentes protéines
virales. Il s'agit de Gag (group antigen) qui code pour les protéines
des structures internes : p50 et p40 qui se cliveront en p27 MA pour la
matrice, p24 CA pour la capside. Le gène Pol (polymérase) qui
code pour les enzymes virales nécessaires à sa
réplication : transcriptase inverse, intégrase et
protéase. Le gène Env (enveloppe) qui code pour les
glycoprotéines de surface gp160 précurseur, gp120 SU responsable
de l'interaction avec la membrane de la cellule cible au niveau du
récepteur CD4 permettant ainsi la pénétration du virus et
gp41 TM transmembranaire avec un pouvoir de fusion cellulaire (syncytium) qui
est l'un des éléments cytopathogènes du VIH. Les
gènes gag, pol et env sont régulés par des
séquences terminales répétitives Long Terminal Repeat
(LTR) qui sont créées lorsque la transcriptase reverse
synthétise l'ADN proviral.
Contrairement aux autres rétrovirus, le VIH
possède en plus d'autres gènes ayant une fonction de
régulation. Il s'agit de : Tat (transactivator of transcription) un
puissant activateur de la transcription en ARNm et ARN viral, Rev ( Regulator
of expression viral protéines) qui favorise l'exportation des ARNm
codant les protéines de structure et des enzymes virales, Nef (negative
factor) rôle mal connu, il favoriserait la réplication
virale ; Vif (virion infectivity factor) augmente l'infectivité des
nouveaux virions sortants de la cellule, Vpr (viral protein r) activateur de la
transcription, Vpu (viral protein u) et Vpx (viral protein x pour VIH2).
Les gènes tat et rev codent pour les protéines
virales régulatrices qui sont essentielles à la
réplication virale. Par contre les gènes nef, vif,vpr et vpu
codent pour des protéines accessoires puisque leur expression n'est
généralement pas essentielle à la réplication du
VIH1 in vitro mais qui demeurent requises pour la réplication virale et
la pathogénèse in vivo ; notons que le VIH2 ne
possède pas de gène Vpu mais le gène Vpx.
Cette complexité qui lui est caractéristique
explique probablement son haut pouvoir pathogène.
b) Cycle de réplication
virale
Il y a dans un premier temps pénétration du
virus dans la cellule. La gp120 se fixe d'abord au récepteur de membrane
CD4 et s'attache aux corécepteurs CCR5 et CxCR4. Il y a ensuite ancrage
du peptide de fusion par un changement de conformation de la gp41 entrainant la
fusion des membranes (membrane cellulaire et enveloppe virale). Le contenu du
virus pénètre alors dans la cellule (ACT.UP, 2010).
Il y a ensuite décapsidation progressive du virus pendant que
l'ARN viral est transcrit en ADN grâce à l'action de la
transcriptase inverse (vivactus 2008) L'ADN alors
obtenu pénètre dans le noyau et est ensuite
intégré dans le génome cellulaire grâce à
l'intégrase, on parle alors d'ADN proviral et le virus est dans sa forme
de latence qui peut perdurer.
La reprise du cycle réplicatif se fera notamment si la
cellule passe à un état d'activité. L'ADN
polymérase cellulaire permet la transcription de l'ADN proviral en ARN
génomiques et en ARN messagers (ACT.UP, 2010). Les ARN
messagers sont alors épissés dans le noyau puis
transportés dans le cytoplasme ou sont synthétisées les
protéines virales.
Enfin ces protéines sont assemblées après
action de la protéase virale et de la protéase cellulaire,
permettant ainsi la formation des nouvelles particules virales
libérées dans le secteur extracellulaire et prêtes à
infecter d'autres cellules (ACT.UP, 2010).
II.3 MODES DE TRANSMISSION
La transmission du VIH résulte d'un contact entre une
porte de sortie du virus chez la personne atteinte et une porte d'entrée
chez la personne saine. Les portes de sortie du virus sont dans l'ensemble les
liquides de l'organisme. Le virus est présent dans le sang, les
sécrétions génitales, les sécrétions
rectales, le lait, la salive, la sueur. Les portes d'entrée du virus
sont les plaies et les muqueuses. ( Encyclopédie médicale
pratique, 1999)
Depuis le début de la pandémie, trois modes
principaux de transmission ont été observés, chacun ayant
ses particularités. Ces voies font toujours intervenir l'exposition aux
liquides organiques d'une personne infectée.
a) Transmission par voie
sexuelle
Le virus étant présent dans les
sécrétions génitales, et peut donc être transmis
lors d'un rapport sexuel. A l'échelon mondial 75 à 90% des
infections par le VIH ont été acquises à l'occasion des
rapports sexuels. Plus de 70% de ces cas sont imputables à une
transmission hétérosexuelle et les 5 à 10% restants
à la transmission homosexuelle entre hommes.
La transmission sexuelle de l'infection à VIH se fait
par l'intermédiaire des muqueuses buccales, vaginales ou rectales
lorsqu'elles sont en contact avec des sécrétions sexuelles ou du
sang contenant du virus. En effet, la muqueuse présente une certaine
perméabilité vis à sis du virus. Certaines maladies
sexuellement transmissibles (syphilis, gonococcie, chlamydiase, herpès
virus, papillomatose et trichomonase) par les ulcérations et
l'inflammation qu'elles entrainent localement favoriseraient cette
transmission. Aussi et surtout la multiplication des partenaires sans
protection lors des rapports sexuels augmente le risque. Signalons
également que les rapports réceptifs sont plus à risque
que les rapports insertifs et les rapports anaux réceptifs sont ceux qui
comportent le risque de contamination le plus élevé.
La probabilité de transmission est estimée
à 0,3% pour chaque acte sexuel (OMS 2010)
b) Transmission par voie
sanguine
Le virus étant présent dans le sang, il peut
être transmis sous trois modalités :
Don de sang ou dérivés sanguins
contaminés ;
Piqure accidentelle avec aiguille souillée ou blessure
avec instruments chirurgicaux souillés de sang contaminé ;
La toxicomanie par voie intraveineuse avec partage des seringues.
La probabilité de transmission par cette voie est de
0,65% (OMS 2010). Toutefois, le dépistage
systématique lors des dons de sang, la notion d'asepsie pour l'usage des
seringues et instruments médicaux, la lutte contre la toxicomanie ont
permis de réduire sensiblement le risque de transmission par cette
voie.
c) Transmission
mère-enfant
La possibilité d'infection in utéro est connue
de longue date par la mise en évidence dès la naissance d'une
virémie VIH voire des signes cliniques chez certains
enfants (DUNN. DT, 2000). Beaucoup d'arguments convergent en faveur d'une
transmission tardive en fin de grossesse, voire l'accouchement ou l'allaitement
en période postnatale. En effet, le virus est capable de traverser la
barrière hémato placentaire et ainsi de contaminer le foetus. Le
cas le plus fréquent semble cependant être lors de l'accouchement
(2/3 des cas). De plus le virus se retrouve dans le lait maternel, d'où
la possibilité d'une contamination lors de l'allaitement (cas le plus
fréquent en Afrique). Toutefois l'utilisation des médicaments
antirétroviraux et la modification des pratiques obstétricales
ont permis de diminuer le taux de transmission materno- infantile de 20
à 5% (DUNN. DT, 2000). Sans traitement le VIH-1 se
transmet de 15 à 20 % de la mère à l'enfant (30% si
allaitement). Le VIH-2 ne se transmet, lui, qu'à 2%. Avec traitement
préventif le taux de transmission de VIH-1 baisse à moins de 8%
(Mandelbrot, 2004).
II.4 FACTEURS DE RISQUE DE
TRANSMISSION MATERNOINFANTILE DU VIH
Les déterminants de la transmission du VIH de la
mère à l'enfant incluent des caractéristiques cliniques,
virologiques et immunologiques. Il est difficile d'évaluer avec
certitude le poids relatif de chaque facteur sur le risque de contamination
tant qu'on ne sait pas avec précision les moments où survient
cette transmission. Plusieurs caractéristiques d'une mère
infectée peuvent être reliées à la transmission mais
leur examen n'a pas donné de consensus (Komme HC, 2004).
a) Facteurs liés à
la mère
Le principal élément pronostique de la
transmission mère-enfant est l'état immunovirologique de la
mère. Sans traitement le taux de transmission mère enfant est
deux fois plus important en cas des symptômes cliniques liés au
VIH, de CD4 inférieur à 200/ml ou si la charge virale (CV) est
supérieure à 10.000 copies/ml (Girard Pierre,
2007).
Tableau I : récapitulatif des facteurs
maternels qui peuvent accroitre le risque de transmission mère enfant du
VIH (Geni, 2006)
|
Pendant la grossesse
|
Pendant l'accouchement
|
Pendant l'allaitement
|
|
charge virale maternelle élevée (infection
récente ou phase avancée de la maladie)
infection bactérienne, virale ou parasitaire de
l'oeuf (rôle des maladies infectieuses)
infections sexuellement transmissibles
malnutrition maternelle (rôle indirect)
|
charge virale maternelle élevée (infection
récente ou phase avancée de la maladie)
rupture des membranes de plus de quatre heures
utilisation des méthodes invasives qui accroissent le
contact avec le sang ou les liquides biologiques infectés de la
mère. (Ex épisiotomie, surveillance par des électrodes)
premier enfant d'une naissance multiple
chorioamniotite due à une infection sexuellement
transmissible ou à une infection non traitée
|
charge virale maternelle élevée (infection
récente ou phase avancée de la maladie)
durée de l'allaitement maternel
alimentation mixte précoce
abcès du sein, fissure du mamelon, mastite
.mauvais statut nutritionnel maternel
maladies buccales chez le bébé (muguet ou
plaie)
|
b) Facteurs
obstétricaux
Gestes obstétricaux invasifs :
amniocentèse, cordocentèse, amnioscopie, cerclage, version par
manoeuvres externes (Mandelbrot. L, 2004);
rupture prématurée des membranes
(Mandelbrot. L, 2004); Chorioamniotite
(Laroy, 1998) ;mode d'accouchement : l'accouchement par voie basse
semble augmenter le risque de transmission mère enfant du VIH par
rapport à l'accouchement par voie ascendante (20% pour la voie basse
contre 14% par césarienne). (Guide national de traitement de l'infection
à VIH, 2005) ; épisiotomie ; accouchement avec
déchirure.
c) Facteurs lies a l'enfant
La prématurité (International
périnatal HIV, 2001) ; affection buccale : muguet, stomatite,
ulcérations ; monitorage invasif du foetus au
cours de l'accouchement ; ordre de naissance en cas
d'accouchement multiple (Goerdert J, 1991).
d) Facteurs liés au
virus
C'est essentiellement le VIH-1 notamment le sous type C qui,
par sa réplication rapide, augmente le risque de transmission. Le taux
de transmission du VIH-2 en dehors de toute intervention thérapeutique
est de 1 à 4% contre 20 à 25% pour le VIH-1 [42].
II.5 PHYSIOPATHOLOGIE
Après transmission, une fois en circulation le VIH
reconnaît toutes les cellules porteuses à leur surface de la
molécule CD4 ayant une haute affinité avec la
glycoprotéine d'enveloppe du virus, la gp120. On retrouve parmi ces
cellules les lymphocytes T CD4, les cellules du système
réticuloendothélial (monocytes macrophages), les cellules
folliculaires dendritiques, les cellules cutanées de Langerhans et les
cellules microgliales cérébrales (Revillard,
JP,
2001)
. Le VIH a cependant un tropisme plus
marqué pour les lymphocytes CD4 et les monocytes macrophages. (Burgard
M. et Rouzioux C,.1999),
Le tout premier effet du VIH sur le corps humain est la
destruction graduelle des cellules immunitaires clés en particulier les
lymphocytes T CD4 qui jouent un rôle primordial dans le
déclenchement et la coordination des réponses immunitaires. Le
VIH désorganise le système immunitaire en l'affectant,
après fixation au récepteur CD4 et pénétration dans
les cellules immunitaires. La mort de ces cellules infectées est
consécutive au détournement de la machinerie bioenzymatique des
lymphocytes qui ne peuvent plus fabriquer leurs propres molécules ainsi
qu'à la destruction de l'intégrité membranaire au moment
de la sortie des virus néoformés. Par ailleurs les cellules
infectées exposent à leur surface membranaire des
protéines virales (complexes env). Ces protéines sont reconnues
par les cellules immunitaires saines qui s'accolent alors aux lymphocytes
infectés. Il s'ensuit un phénomène de « baiser
de mort » ou « kiss of death » par lequel la cellule
saine est détruite par activation de la voie d'apoptose. Un des
médiateurs de cette apoptose est l'existence d'un stress oxydatif
caractérisé par une prévalence des radicaux libres
(molécules oxydantes) sur les défenses anti oxydantes de
l'organisme.
Quant à l'organisme, une fois qu'il détecte la
présence du VIH, il élabore des Ac anti VIH. Le virus est alors
détectable sous la forme d'acide nucléique (ARN) dès le
10e -12e jour et sous sa forme d'antigène p24 vers
le 12e -14e jour (Planter JC, 2002). Cette réponse
immunitaire induite par l'infection à VIH peut contrôler
transitoirement l'infection en réduisant considérablement les
antigènes VIH. Il s'agit en particulier de l'immunité
spécifique, la réponse cellulaire se traduisant par l'apparition
des lymphocytes T cytotoxiques CD8 qui reconnaissent les lymphocytes CD4
infectés et les détruisent avant que ceux-ci n'aient
fabriqué des nouvelles particules virales. Mais comme les lymphocytes
CD4 sont indispensables à l'activation des lymphocytes T cytotoxiques,
leur destruction affaiblit progressivement l'efficacité de la
réponse immunitaire. La réponse humorale quant à elle, se
traduit par l'apparition d'Ac anti VIH qui empêchent la fixation des
particules virales aux cellules cibles. A un stade avancé, l'infection
à VIH détermine à terme une immunodéficience
définissant le sida ; elle est due à la destruction des
lymphocytes CD4 et d'autres cellules porteuses des récepteurs CD4,
notamment les monocytes macrophages et se traduit par un affaiblissement
graduel du système immunitaire permettant ainsi aux agents infectieux de
se propager et d'engendrer des maladies dites infections opportunistes.
II.6 CLINIQUE
a) Classification en stades
cliniques proposés par l'OMS
Stade 1 :
· Patient asymptomatique
· Adénopathies persistantes
généralisées
Stade 2 :
· Perte de poids inférieur à 10% de poids
corporel
· Manifestations cutanéo muqueuses mineures
(dermite séborrhéique, ulcérations buccales
récurrentes, prurigo, onyxis mycosique, chéilite angulaire)
· Zona au cours des cinq dernières
années
· Infections récidivantes des voies
respiratoires
Stade 3 :
· Perte de poids supérieure à 10% du poids
corporel
· Diarrhée chronique inexpliquée pendant
plus de 1 mois
· Fièvre prolongée inexpliquée
pendant plus de 1 mois
· Candidose buccale
· Leucoplasie chevelue buccale
· Tuberculose pulmonaire dans l'année
précédente
· Infections bactériennes sévères
Stade 4 :
· Syndrome cachectisant du au VIH
· Pneumocystose pulmonaire
· Toxoplasmose cérébrale
· Maladie de Kaposi
· Lymphome malin
· Mycobactériose atypique
généralisée
Plus généralement toute affection grave
apparaissant chez un patient infecté par le VIH, ayant une baisse
importante de son immunité (taux des CD4 inférieur à 200/
mm3)
b) Classification CDC Atlanta
1994
Elle permet de classer les enfants infectés en l'une
des quatre catégories cliniques suivantes:
· Catégorie N: Asymptomatiques;
· Catégorie A : symptômes mineurs;
· Catégorie B: symptômes
modérés;
· Catégorie C: symptômes
sévères.
c) Critères cliniques de
BANGUI
La définition clinique du sida de l'enfant est
basée sur les critères définis à Bangui par l'OMS
en 1994 :
Critères majeurs :
· Amaigrissement supérieur à 10%
· Diarrhée au-delà de 1 mois
· Fièvre prolongée (continue ou
intermittente)
Critères mineurs :
· Toux persistante au-delà de 1 mois
· Dermite prurigineuse
généralisée
· Candidose oropharyngée
· Infections banales récidivantes
· Infection à VIH confirmée chez la
mère
· Lymphadénopathie
généralisée
La présence d'au moins 1 critère majeur et 2
critères mineurs permet de poser le diagnostic clinique du sida
pédiatrique.
II.7 PARAMETRES BIOLOGIQUES DU
VIH CHEZ L'ENFANT
La classification immunologique est basée sur la
numération des lymphocytes CD4 en fonction de l'âge et de
l'état du système immunitaire.
Les taux de CD4 sont élevées chez les jeunes
enfants en bonne santé, le thymus étant encore fonctionnel, et
diminuent pour atteindre les taux d'adultes vers l'âge de 6ans.
Chez les enfants de moins de 6 ans, on prendra de
préférence le pourcentage des CD4 au lieu du chiffre absolu
à cause des variations physiologiques.
Tableau II: classification des enfants en fonction de
l'immunodépression (PNLS 2010)
|
Immunodépression
(degré)
|
Age spécifiques et valeurs de CD4
|
|
< ou = 11 mois (% CD4)
|
12 - 35 mois
(% CD4)
|
36 - 59 mois
(% CD4)
|
Sup ou = 5ans
(absolu et % CD4)
|
|
Absence
|
>35
|
>30
|
>25
|
>500
|
|
Légère
|
30- 35
|
25-30
|
20-25
|
350- 499
|
|
Modéré
|
25- 29
|
20-24
|
15-19
|
200-349
|
|
Sévère (CD4 %)
|
<25%
|
<20%
|
<15%
|
<200 ou <15%
|
|
Sévère( CD4 absolu)
|
1500/mm3
|
750/mm3
|
350/mm3
|
200/mm3
|
|
Sévère(lymphocyte tot)
|
<4000cell/mm3
|
3000cell/mm3
|
2500cell/mm3
|
2000cell/mm3
|
II.8 EVOLUTION ET PRONOSTIC
La durée entre la contamination et le début des
signes de sida varie de 6 mois à plus de 15 ans. Elle dépend de
plusieurs facteurs. Le sida est un stade grave et tardif de l'infection par le
VIH ; celle-ci évolue naturellement en plusieurs
étapes :
1. Le contage ou contamination : c'est l'entrée en
contact avec le VIH.
2. Le point d''infection ou primo-infection :
caractérisé parfois par un syndrome grippal pouvant survenir dans
la semaine qui suit la contamination.
3. La période fenêtre (muette ou aveugle) :
temps d'incubation qui va du contage à la séroconversion. La
durée de cette période dépend du mode de contamination.
L'individu reste contagieux mais sans Ac positifs.
4. La séroconversion : 3 à 12 semaines
environ après la primo infection. Elle est caractérisée
par l'apparition des Ac anti VIH dans le sang et le test de détection
devient positif.
5. Le stade asymptomatique : longue période de 10
à 15 ans de séropositivité sans signes cliniques
caractérisée par une élévation du taux des virus
néoformés. Le sujet est séropositif (porteur sain).
6. Le stade symptomatique ou présida :
caractérisé par une lymphadénopathie résistante et
d'autres signes persistants liés à l'attaque facilitée
d'autres infections dues à l'altération du système
immunitaire.
7. Le stade sida : l'altération du système
immunitaire atteint son paroxysme, les maladies apparaissent et la mort est
inévitable.
Concernant l'histoire naturelle l'infection à VIH/SIDA,
il existe des différences importantes entre l'évolution de la
maladie de l'enfant et de l'adulte. Chez l'enfant le système immunitaire
est encore immature mais en cours de développement. Ainsi, l'infection
à VIH/SIDA va entrainer un affaiblissement du système immunitaire
avec un évolution rapide de la maladie et une durée plus courte
de chaque stade clinique.
En fonction du moment de la contamination, on distingue 2
modes évolutifs.
a) La forme rapide, précoce
et sévère
Elle est spécifique à l'enfant, la contamination
est précoce et probablement en début de la grossesse. Et il y a
interaction avec le développement du système immunitaire
d'où constitution rapide d'un déficit immunitaire
sévère.
Les premiers symptômes apparaissent entre 1et 3 mois, il
s'agit notamment de la cachexie, hépatosplénoméglie, poly
adénopathie, infections opportunistes fréquentes (pneumocystoses,
candidose bucco-oesophgienne...), encéphalite avec hypertonie, etc.
Le délai d'apparition du sida se situe entre 3 et 15
mois, le pronostic est sombre, l'enfant décède souvent avant
4-5ans. La survie moyenne à 5 est inférieure à 10 % .
b) La forme lentement
évolutive
La contamination est tardive, probablement en
périnatale (enfant l'accouchement ou durant l'allaitement).
L'immunité cellulaire est probablement mature, les perturbations
immunitaires surviennent après des années (parfois
supérieur à 10 ans).
Les premiers signes apparaissent vers l'âge de 6 mois
puis une accalmie avec une reprise des signes vers l'âge de 8- 10 ans.
Cliniquement on note : les adénopathies, infections
bactériennes à répétition, les pneumopathies,
parotidite chronique, retard staturo- pondérale et pubertaire.
L'évolution est proche d celui de l'adulte. Le délai d'apparition
du stade sida : 2- 10 ans, avec risque d'évolution de 3% à 4% par
an. La survie moyenne à 5 ans est supérieure à 90%.
c)
Progression de la maladie à VIH chez les enfants en Afrique
· Catégorie 1(25- 30%)
La progression est rapide ; les bébés meurent en
1 année. Maladie acquise précocement pendant la grossesse ( in
utero)
· Catégorie 2 (50- 60 %)
Les enfants qui développent les symptômes
tôt au cours de leur vie, l'état se
détérioré rapidement et ils meurent vers l'âge de 3
à 5 ans.
· Catégorie 3 (5- 25) : ces enfants
survivent au- delà de l'âge de 8 ans.
Tableau III : classification selon la progression
|
Présentation clinique des progresseurs rapides
|
Présentation clinique des progresseurs lents
|
· Petit poids de naissance
· Retard de croissance précoce
· Retard de développement psychomoteur
· Candidose orale persistante
· Diarrhée récurrente/ persistante
· Infection bactérienne/ mycosique
récurrentes
· hépato splénomégalie
· Encéphalopathie sévère avant 18 mois
· Charge virale élevée à la naissance
· Diminution rapide du taux de CD4
|
· Infections opportunistes après 2- 10 ans
· Retard de croissance fréquent
· Pneumonie interstitielle lymphoïde (LIP)
· Parotidite
· Infection bactérienne et mycosiques
récurrentes
· Problèmes de peau
· Cancers associés au sida
· Charge virale bas à la naissance, taux de CD4
stable durant 2- 10 ans, puis déclin lent.
|
II.9 COMPLICATIONS
Le système immunitaire des personnes atteintes du VIH
n'est plus en mesure de défendre l'organisme qui devient alors la cible
d'infections opportunistes de toutes natures (bactériennes, virales,
fongiques ou parasitaires). Ces infections facilement jugulées par un
système immunitaire en forme expriment leur gravité lorsque
celui-ci est déficient.
Il existe plusieurs infections opportunistes ; les
principales sont :
· Le Zona du au virus herpès zoster
· La candidose due essentiellement à candida
albicans
· La pneumonie à pneumocystis carinii
(joroveji)
· La cryptococcose due au cryptococcus
néoformans
· Infections à herpès simplex de type I et
de type II
· Infections à mycobacterium avium
· Le sarcome de Kaposi
Cependant les plus redoutables de ces infections
restent : la toxoplasmose cérébrale, la pneumonie à
pneumocystis carinii, la méningite à cryptococcus, la
rétinite à CMV, la candidose et la tuberculose pulmonaire.
II.10. PARACLINIQUE
Le diagnostic de l'infection à VIH fait appel à
la détection dans le sang des patients des Ac dirigés contre le
VIH.
a) Dépistage
De très nombreux tests de dépistage sont
disponibles, tous basés sur la détection d'Ac anti VIH dans le
sérum par méthode immunoenzymatique (ELISA). Les tests de
dépistage sont de plus en plus perfectionnés. Ils sont dits de
première ou deuxième génération selon le produit
utilisé. Dans les tests de première génération
l'antigène fixé à la phase solide consiste en des
particules virales purifiées et lysées tandis que dans ceux de la
deuxième génération, le support solide est
sensibilisé avec des protéines virales (protéine interne
p25 et /ou protéine de surface gp120 ou gp41) obtenues par génie
génétique ou encore des peptides de synthèse. Ces tests
doivent répondre à des critères définis de
sensibilité et de spécificité pour être valables. Le
critère le plus important pour un test étant la
sensibilité, celle-ci doit être de 100% sur un panel de
sérum comprenant des échantillons difficiles en particulier ceux
provenant des sujets au début de séroconversion.
La législation actuelle exige l'utilisation de deux
tests sérologiques différents lors du test de dépistage,
car le test ELISA s'il doit présenter une sensibilité de 99,9%
c'est-à-dire qu'il ne doit pas passer à coté d'une
personne infectée, il peut donner des résultats faussement
positifs, en particulier lors des grossesses multiples, des maladies grippales,
chez les porteurs du facteur rhumatoïde etc. Deux tests différents
sont réalisés issus de deux laboratoires différents. Ces
tests sont des tests à limite c'est-à-dire que la
séropositivité est déclarée si le taux d'Ac
dépasse une certaine valeur fixée par le fabricant du test.
b) Confirmation
Afin d'éliminer des résultats faussement
positifs, la séropositivité au VIH sera confirmée par un
second prélèvement pour confirmation. Les tests de confirmation
font suite aux tests de dépistage et utilisent surtout le western blot
(ou immuno blot) en pratique courante tandis que les autres techniques comme la
RIPA n'est utile que dans le laboratoire de recherche.
Les critères de positivité du western blot (WB)
ont fait l'objet d'un consensus à l'OMS : pour qu'un WB soit
considéré comme positif il faut qu'il présente au minimum
des Ac dirigés contre deux glycoprotéines d'enveloppe (gp160,
gp120 pour le VIH1 ; gp300, gp40, gp125, gp80 ou gp36 pour le VIH2)
associés ou non à des Ac dirigés contre les
protéines internes codées par les gènes gag et pol.
Des nouveaux tests de dépistage permettent d'identifier
des patients porteurs d'antigène p24. En effet, en cas de
prélèvement trop précoce, l'organisme n'a pas encore
fabriqué d'Ac en quantité détectable, et la recherche
d'antigène p24 ou la mesure de l'ARN- VIH plasmatique par des
méthodes directes permettent un diagnostic plus précoce mais qui
doit toujours être confirmé par un second
prélèvement.
Une autre méthode extrêmement
sophistiquée, la PCR (Polymérase Chain Reaction) permet de
révéler la présence du virus même lorsque le nombre
de cellules envahies est minime ; technique très utile chez les
nouveau nés.
Il est également à noter que les tests de
séropositivité dans les pays en voie de développement se
réduisent le plus souvent à un seul test ELISA effectué
et les enfants à partir de 18 mois qui constituent les populations les
plus faciles à dépister à l'hôpital.
II.11. TRAITEMENT ET CRITERE DE
MISE
La maladie est en plein développement et nous ne sommes
même pas surs qu'elle soit un jour éradicable ni même surs
d'aboutir à un vaccin a estimé le professeur Philippe KOURILSKY,
directeur de l'institut pasteur de paris.
Le sida reste à ce jour une infection incurable. Le
traitement curatif n'est pas encore au point. Il existe cependant des
traitements antiVIH efficaces qui bloquent la multiplication du virus et
freinent ainsi très nettement le cours de la maladie. Ces traitements
sont fondés sur trois axes thérapeutiques :
Le premier consiste à restaurer
l'immunité ;
Le deuxième consiste à lutter contre les
manifestations de la maladie en traitant avec efficacité la plupart des
infections opportunistes ;
Le troisième consiste à lutter contre le virus
lui-même. C'est le plus logique mais aussi le plus difficile.
Il existe actuellement quatre familles
d'antirétroviraux. Ils inhibent la réplication virale à
différentes étapes du cycle du VIH. Ils sont virostatiques, ne
permettant donc pas l'éradication du virus mais plutôt
ralentissent la progression vers le stade sida. Ils doivent être
utilisés en association pour obtenir un niveau suffisant
d'efficacité et réduire le risque d'émergence des mutants
résistants. Cette efficacité est cependant obtenue au prix
d'effets secondaires et des contraintes de prise rendant l'observance du
traitement difficile.
Les quatre familles sont :
· Les inhibiteurs nucléosidiques de la
transcriptase inverse (INTI) :
· Les inhibiteurs non nucléosidiques de
transcriptase inverse (INNTI)
· Les inhibiteurs de la protéase (IP)
· Les inhibiteurs de la fusion (IF)
Le traitement antirétroviral doit cependant respecter
quelques principes que voici :
· Les décisions thérapeutiques doivent
s'appuyer sur des paramètres individuels du fait que l'évolution
de la maladie est très variable d'une personne à une
autre ;
· Un traitement antirétroviral énergique
limite le risque potentiel de sélection des virus
résistants ;
· Un traitement d'attaque combinant les
médicaments existants permet d'espérer une suppression
persistante du virus ;
· Chacune des substances utilisées doit toujours
être prise aux doses et posologies optimales
recommandées ;
· Les substances antirétrovirales actuellement
à disposition sont limitées en nombre, il peut exister des
limitations thérapeutiques en fonction des résistances
croisées connues ;
· Les femmes doivent recevoir le meilleur traitement
antirétroviral même pendant la grossesse ;
· Les personnes présentant une infection à
VIH aigue doivent être traitées par une association d'ARV pour
maintenir la réplication virale en dessous du seuil de
détection et même lorsque la virémie se trouve en
dessous du seuil de détection, les personnes VIH positives sont toujours
considérées comme potentiellement contagieuses et méritent
donc un traitement antirétroviral.
Ces principes de traitement sont valables pour les adultes
comme pour les enfants tenant compte des paramètres pharmacologiques,
virologiques et immunologiques spécifiques aux enfants.
Critères de mise sous traitement ARV selon le Pnls RDC
2013
Le TARV sera instauré :
· Chez toute personne âgée de plus de 5 ans
séropositive pour le VIH ayant un taux de CD4= 500/mm3 quel que soit le
stade clinique ;
· Chez tous les parents séropositifs pour le VIH
présentant une maladie clinique de stade 3 ou 4 de l'OMS quel que soit
le nombre de CD4.
· Chez toute femme enceinte ou allaitante
séropositive ; indépendamment du taux de CD4 ou du stade
clinique.
· Chez tout enfant âgé de 0 à 5 ans
avec certitude de l'infection à VIH (PCR ou sérologie) quel que
soit le taux de CD4 ou le stade clinique.
· Chez toute personne vivant avec VIH et
présentant une coïnfection VIH- TUB ou VIH- VHB.
· Chez tout partenaire séropositif d'un couple
discordant.
Les protocoles thérapeutiques actuels s'articulent sur
la trithérapie antivirale qui constitue le seul traitement de
référence de l'infection par VIH. Celles de première
intention comportant soit 2 INTI+ 1 INNTI, soit 2 INTI + 1 IP/r ont une
efficacité comparable. Néanmoins, dans les pays en
développement, notamment en RDC, une préférence est
accordée à la combinaison de 2 INTI+ 1 INNTI en raison de
facilité d'utilisation.
Tableau IV : Schéma thérapeutique
recommandé en RDC (Pnls, 2013)
|
Age
|
1ière ligne
|
2ième ligne
|
|
LPV/r base du schéma thérapeutique
|
< 3ans
|
ABC+ 3 TC+ LPV/r
|
Pas de changement
|
|
AZT+ 3 TC+ LPV/r
|
|
3 ans et plus
|
ABC+ 3 TC+ LPV/r
|
AZT+ 3 TC+ LPV/r
|
|
AZT+ 3 TC+ LPV/r
|
ABC(ou TDF) + 3 TC+ EFV
|
|
INNTI base du schéma thérapeutique
|
Tout âge
|
ABC+ 3 TC+ EFV (NVP)
|
AZT+ 3 TC+ LPV/r
|
|
TDF + 3 TC(ou FTC)+ EFV
|
|
TDF + 3 TC(ou FTC)+ NVP
|
|
AZT+ 3 TC+ EFV (ou NVP)
|
ABC(ou TDF) + 3 TC+ LPV/r
|
|
Adultes et Ados
|
Si AZT utilisée en 1ière ligne
|
TDF + 3 TC(ou FTC)+ LPV/r
|
|
Si TDF utilisée en 1ière ligne
|
AZT + 3 TC(ou FTC)+ LPV/r
|
II.12 MOYENS DE PREVENTION
Bien qu'ayant une certaine efficacité les traitements
antirétroviraux ne peuvent que retarder la progression vers le stade
sida en ralentissant la prolifération du virus au sein de l'organisme.
La prévention constitue de loin la meilleure option. Elle
nécessite la connaissance des différentes voies de transmission
du VIH.
a) Prévention de la transmission par voie
sexuelle
Il faut mettre un barrage entre la porte d'entrée et
la porte de sortie. Il faut donc tenir trois attitudes :
Abstinence de tout rapport sexuel ;
Fidélité mutuelle à un partenaire sexuel
qui n'est pas porteur ;
Utilisation des préservatifs avec tout partenaire et
à tout rapport sexuel.
Il ne faut jamais oublier que la multiplicité des
partenaires sexuels augmente considérablement le risque alors que
diminuer le nombre de ses partenaires ne fait que diminuer statistiquement le
risque mais ne le ramène pas à 0.
b) Prévention de la transmission par voie
sanguine
Les toxicomanes par voie intraveineuse ne doivent pas
échanger de seringues ;
Les professionnels qui manipulent du sang doivent respecter
les règles générales d'hygiène
professionnelle ;
Les personnes présentant des plaies cutanées
doivent éviter d'entrer en contact avec tout sang ;
Le dépistage systématique du sang ou ses
dérivés avant toute transfusion s'impose.
c) Prévention de la transmission materno-
infantile
Il existe plusieurs stratégies possibles agissant
à des niveaux différents :
Interrompre la grossesse ;
Réduire la charge virale maternelle plasmatique et
génitale : utilisation des médicaments
antirétroviraux pendant la grossesse ;
Diminuer l'exposition en fin de grossesse et pendant
l'accouchement : modification des pratiques obstétricales
(césarienne programmée et interdiction de certains
gestes) ;
Réaliser une prophylaxie post expositionnelle :
choix d'un traitement offrant un bon passage transplacentaire et traitement
chez lé nouveau-né ;
Supprimer l'exposition post natale : interruption de
l'allaitement maternel.
CHAPITRE III : OBSERVANCE ET
ADHERENCE AU TRAITEMENT
III.1 L'OBSERVANCE
Comportement selon lequel la personne prend son traitement
médicamenteux avec assiduité et régularité
optimales, selon les conditions prescrites et expliquées par le
médecin : suivi exact des modalités de prises
médicamenteuses en terme de dose, de forme, de voie d'administration, de
quantité par prise et par jour, respect des intervalle entre les prises
et des conditions spécifiques d'alimentation, de jeûn, de boissons
ou substances pouvant modifier la cinétique du traitement.
L'observance des enfants aux médicaments est souvent
difficile pour eux et pour leurs responsables (gardiens). Elle demande à
la fois l'engagement et la disponiblité d'un adulte responsable et la
participation de l'enfant malade. Les enfants sont souvent sous la
responsabilité de p$lusieurs gardiens, ce qui complique à la
fois l'administration et l'évaluation de l'observance, et qui provoque
des problèmes de confidentialité (divulgation).
On note une approche à 4 phases à l'observance
chez les enfants :
a)
Education
Les soins pédiatriques est un partenariat entre les
cliniciens, le gardiens et les enfants. Cette collaboration détermine
le succès du TARV et doit se baser sur le développement d'un
climat de confiance et d'une communication honnête.
L'évaluation de base permettra de
réfléchir à la personne à éduquer.
Idéalement tous les gardiens devront être éduqués,
et si le niveau de maturité de l'enfant le permettait, il peut lui-
même être éduqué sur l'observance.
b)
Préparation
Le TARV n'est jamais une urgence. Avant de prescrire les ARV
il faut prendre le temps de préparer les patients et es familles.
Les gardiens doivent être capables de répondre
aux questions suivantes : qui ? quand ? comment ? et
lesquels des ARV à administrer ?, et quoi faire en cas de
difficultés ?
c)
Evaluation
Elle doit être formelle et systématique. Elle
doit êre faite par une équipe pluridisciplinaire. C'est le
meilleur moyen d'évaluer l'observance. Lors des visites, poser des
questions sur les doses manquées, tolérance aux ARV et faire le
décompte des comprimés en établissant un
parallélisme avec les dires de la famille.
En grandissant les enfants pourront participer aux discussions
sur l'observance et apprendre ainsi à participer à leurs soins et
à prendre des responsabilités.
d)
appui soutenu
Le soutien à l'observance concerne tous les patients
tout au long du traitement.
III. 2 L'ADHERENCE
Adhésion à un parti, à une organisation,
...) : engagement réfléchi et volontaire pour adapter un
comportement conforme à des objectifs acceptés.
L'adhérence au traitement ARV chez l'enfant est
complexe, car non seulement il faut que l'enfant accepte de prendre les
produits, mais il faut aussi q'un adulte (gardien) les lui donne et en
surveille son administration afin de minimiser l'effet du traitement ARV et
empêcher la survenue d'éventuelles résistances. Cela
implique nécessairement l'engagement du responsable mais surtout la
préparation et la participation de l'enfant.
Les facteurs ci- après représentent un
véritable défis quant à l'adhérence aux ARV chez
l'enfant :
· Manque de certaines formulations
pédiatriques ;
· Goût amer de certains ARV ;
· Nombre élévé de comprimés
à prendre ;
· Réajustement fréquent des doses en
fonction de la croissance ;
· Les besoins et la compréhension de l'enfant
évoluent avec l'âge et le stade de
développement ;
· La sévérité de la maladie peut
affecter la capacité de l'enfant à prendre les
médicaments ;
· Les effets indésirables (secondaires)
· Si l'enfant est assez grand, l'intéresser,
l'impliquer et le responsabiliser à la prise correcte de son traitement,
sous le contrôle de son responsable. (Pnls,2010).
CHAPITRE IV : METHODOLOGIE
IV.1 PRESENTATION DU LIEU
D'ETUDE
a)Bref aperçu historique
Le Centre d'Excellence a vu le jour par le canal du Recteur
Professeur Kaumba Lufunda le 22 décembre 2006.Le Professeur Wembonyama
alors médecin Directeur de l'Hôpital provincial de
référence Jason Sendwe en a assuré la mise en oeuvre avec
la collaboration efficace du Docteur Kabongo Joe
Le 29 décembre 2008, le Recteur Ciabu Mumba, conscient
de la pertinence et de l'efficacité des activités de lutte contre
le VIH/SIDA menées par le CE-UNILU et du leadership de
l'Université, créa officiellement le CE-UNILU par décision
rectorale N° 212/2008 du 28 décembre 2008.
Toutes les activités évoluent dans le cadre
formel et s'inscrivent dans la politique de lutte contre le VIH/SIDA de
l'Université de Lubumbashi et du plan stratégique du CE-UNILU, et
dans le respect des directives du PNLS.
Il est maintenant reconnu que cette initiative a largement
permis aux différents protagonistes dans la lutte contre le VIH/Sida et
aux autorités sanitaires de prendre de vérifier la
faisabilité des soins au sein de l'hôpital et de se défaire
de leur scepticisme face à approche holistique de la prise en charge du
Sida.
a) La coordination
générale :
1. Rôles : organisation technique
et management
2. Activités:
· Coordonner et programmer toutes les activités de
lutte contre le VIH/SIDA au sein de l'Université ;
· Assurer les soins de santé de qualité et
fournir les médicaments et les réactifs de laboratoire dans les
services concernés.
· Entreprendre des recherches en vue d'améliorer
la prévention et la prise en charge des malades ;
· Développer les activités de services et
améliorer les équipements.
· Vulgariser et intensifier les principes de
prévention à l'hôpital et en dehors de l'hôpital.
· Veiller à la valorisation de l'hospitalisation
des malades gravement atteints.
· Protéger le personnel, les malades et même
les visiteurs des pratiques actes dangereux.
· Créer un service social (social worker) pour le
counselling et le soutien psychologique des personnes avant et après
dépistage volontaire.
· Monter un centre de dépistage et de conseil
(CDV), et distribution des préservatifs à moindre frais ;
· Evaluer l'atténuation de l'impact du
VIH/SIDA ;
· Garantir la prévention par la
sécurité transfusionnelle ;
· Définir et organiser les programmes de formation
des professionnels de la santé et des intervenants.
· Sensibiliser et vulgariser les mesures de lutte contre
le VIH/SIDA.
· Fournir l'expertise en matière d'hygiène
hospitalière et de la prévention des contaminations.
· Mener des recherches pour contrôler
l'épidémie, procéder à la décontamination ou
stérilisation des matériels, promouvoir l'utilisation des
matériels à usage unique.
· Procéder au suivi et à
l'évaluation : à travers le monitoring des indicateurs de
façon trimestrielle.
3. Personnel :
· Personnel médical et paramédical :
médecins, infirmiers, laborantins, pharmaciens, nutritionnistes
· Administratifs : secrétaires, coursiers.
· Technique : logisticiens, psychologues,
statisticiens, épidémiologistes, experts en hygiène
hospitalière.
· Social : assistantes sociales, psychologues.
· Ouvrier : techniciens de surface (femmes de
ménage), et d'assainissement.
IV.2 PERIODE ET TYPE D'ETUDE
C'est une étude descriptive transversale par analyse
retrospective des données basée sur la revue documentaire qui
s'est étalée sur la période allant du 1ier
janvier 2010 au 31 Décembre 2013.
IV. 3 POPULATION D'ETUDE
Tous les enfants VIH positif vus lors des consultations au
centre d'excellence - UNILU.
IV. 4 ECHANTILLONNAGE
Nous avons réalisé un échantillon exhaustif.
A partir des dossiers, nous avons sélectionné tous les
dossiers des enfants VIH positifs pour la période d'étude. Pour
chaque enfant, une fiche de collecte des données a servi au recueil des
informations. Cette fiche sera remplie à partir des dossiers.
a) critère d'inclusion
Tout enfant séropositif de plus de 18 mois
jusqu'à 15 ans (sérologie VIH positive à Elisa ou Western
blot) pour la période allant du 1ier janvier 2010 à
décembre 2013.
b) critère d'exclusion
Ont été exclus ;
Tous les enfants âgés de moins de 18 mois et
supérieur à 15 ans.
VI.5 MATERIEL ET ANALYSE
STATISTIQUE
Pour la saisie et mise en forme, nous nous sommes servi de
l'office Word. Pour l'analyse de des données et pour
générer les figures, nous avons fait recours à l'office
Excel et aux logiciels Epi info 3.3.2, et ENA of smart pour le calcul du
Z-score. L'intervalle de confiance dans le calcul du Khi- carré, la
moyenne et la médiane étaient de 95% ou un p value ou seuil de
signification < 0,05.
les variables étudiées étaient :
a) Identité de l'enfant
· Sexe ;
· Age (en mois) ;
· Poids (kg) ;
· Taille (cm) ;
· Taille du ménage ;
· Scolarité (scolarisé, non
scolarisé) ;
· Scolarisé (primaire, secondaire) ;
· Quotient intellectuel;
· Z- score
· IMC
· Adresse
· Prise en charge PTME
b) Identité des parents
· Etat civil
· Niveau d'étude
· Profession
· Niveau socio- économique
· Statut sérologique
· Vivant ou décédé
c) paramètres sur le VIH chez
l'enfant
· Age de diagnostic
· Etat général
· Stade clinique
· Stade biologique
· Suivi PTME
· Sous ARV (oui ou non)
· Observance du traitement (oui ou non)
· Infection opportuniste
· Nombre d'hospitalisation
· Vivant ou décédé
IV.6 DIFFICULTES LIEES A
L'ETUDE
De nombreuses difficultés ont été
rencontrées au cours de cette étude de type rétrospective.
Les limites de l'étude ont résidé dans :
· Déterminer la voie de transmission
· De convertir le CD4 en pourcentage et la charge virale
non réalisée
· Les manques de donner sur le paramètres
anthropométriques en dehors du poids
· Difficultés de ressortir le niveau socio-
économiques des parents.
CHAPITRE V : PRESENTATION DES RESULTATS
I.
ASPECT EPIDEMIOLOGIQUE
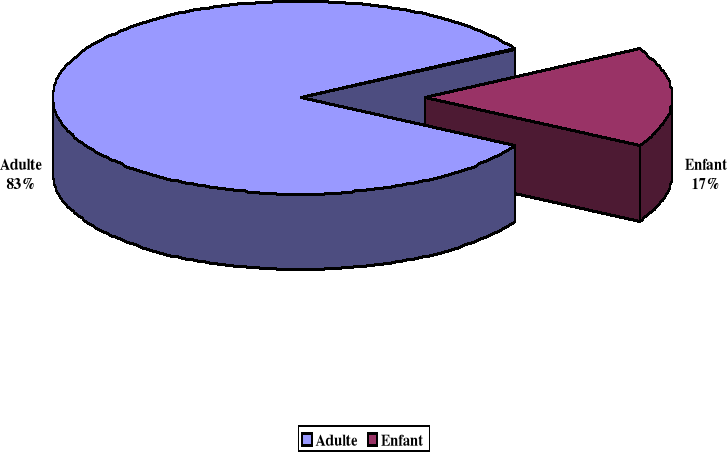
Figure 1 : La
fréquence des enfants séropositifs au centre d'excellence -
Unilu
Il ressort de la figure ci- dessus que parmi les PVV
consultant le Centre d'Excellence -Unilu ; les enfants représentent
17 % (250) par contre les adultes représentent 83 % (1350)
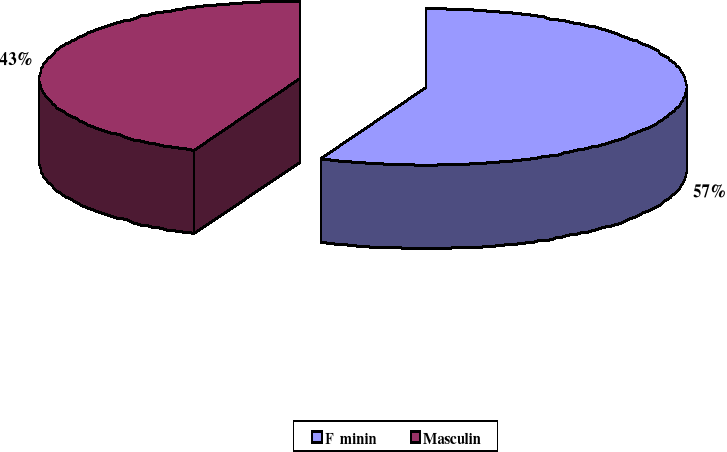
Figure 2 :
Distribution des enfants séropositifs en fonction du sexe
Il ressort de cette figure que 57% d'enfants
représentent les enfants séropositifs du sexe féminin
par contre 43 % représentent les enfants séropositifs du sexe
masculin.

Figure 3 :
Distribution des enfants séropositifs en fonction de la tranche
d'âge
La figure ci- dessus nous montre que 101 enfants
séropositifs (soit 40,40%) se trouvent dans la tranche d'âge
allant de 18 à de 59 mois par contre nous avons 49 enfants
séropositifs (soit 19,06%) dans la tranche allant de 120 à de 180
mois. L'âge médian est de 84 mois (avec les extrêmes 18 mois
et 180 mois).
Tableau I :
Distribution des enfants séropositifs en fonction de l'adresse
|
Adresse
|
Fréquence
|
Pourcentage
|
|
Annexe
|
13
|
5,20%
|
|
Ailleurs
|
17
|
6,80%
|
|
Kamalondo
|
21
|
8,40%
|
|
Kampemba
|
90
|
36,00%
|
|
Katuba
|
22
|
8,80%
|
|
Kenya
|
23
|
9,20%
|
|
Lubumbashi
|
46
|
18,40%
|
|
Ruashi
|
18
|
7,20%
|
|
Total
|
250
|
100,00%
|
Il ressort de ce tableau que 90 enfants séropositifs
(soit 36%) sont venus de la commune de Kampemba par contre 13 enfants
séropositifs (soit 5,02 %) sont venus de la commune Annexe.
.

Figure 4 : Distribution
des enfants séropositifs en fonction du niveau scolaire
Il ressort de la figure ci- dessus que 49,2% des
enfants séropositifs ont un niveau scolaire non définie alors que
5,6 % sont à l'école secondaire
. 
Figure 5 :
Distribution des enfants en fonction de l'issue des parents
La figure ci- dessus montre que 29 % d'enfants
séropositifs sont orphelin d'où moins un parent contre 71 % qui
les ne sont pas
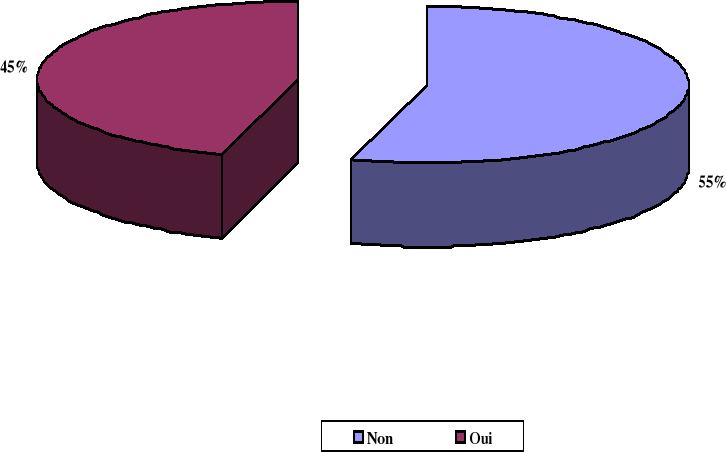
Figure 6 : Distribution des enfants
séropositifs en fonction de la connaissance du statut sérologique
des parents
Il découle de cette figure que 55% des enfants
séropositifs avaient des parents qui ne connaissaient pas leur statut
sérologique par contre 45 % des enfants avaient des parents
connaissent leur statut sérologique.

Figure 7 : Distribution des enfants
séropositifs en fonction du statut sérologique des
parents.
Il ressort de la figure ci- dessous que 77 % enfants
séropositifs avaient des parents séropositifs par contre 23%
enfants séropositifs avaient des parents
séronégatifs.
II.
ASPECTS CLINIQUES

Figure 8: Distribution des enfants
séropositifs en fonction de l'âge de diagnostic du
VIH/SIDA.
Il ressort de la figure ci- dessous que dans 48,60 % le
diagnostic dans la tranche allant de 18 à 59 mois par contre que dans
12,60 % des cas le diagnostic est posé dans la tranche d'âge
allant de 120 à 180 mois. L'âge médian étant 72
mois avec comme extrêmes 18 mois et 150 mois.
Tableau II :
Distribution des enfants séropositifs en fonction du motif de
consultation
|
Motif de consultation
|
Fréquence
|
Pourcentage
|
|
Fièvre
|
61
|
24,40%
|
|
Douleurs abdominales
|
22
|
8,80%
|
|
Toux
|
115
|
46,00%
|
|
Paleur
|
17
|
6%
|
|
Otalgies
|
5
|
0,01%
|
|
Éruptions cutanées
|
41
|
16,40%
|
|
Diarrhées
|
21
|
8,40%
|
|
Dénutrition
|
21
|
8,40%
|
|
Maux de tête
|
10
|
4,00%
|
Le tableau ci- haut montre que dans 46% des cas les enfants
ont consulté pour la toux alors que dans 0,01% ils ont consulté
pour les otalgies.

Figure 9 :
Distribution des enfants séropositifs en fonction de l'état
général.
Il ressort de la figure ci- dessus que dans 55%
l'état général des enfants était conservé
par contre 45% de ces enfants avaient un état général
altéré.
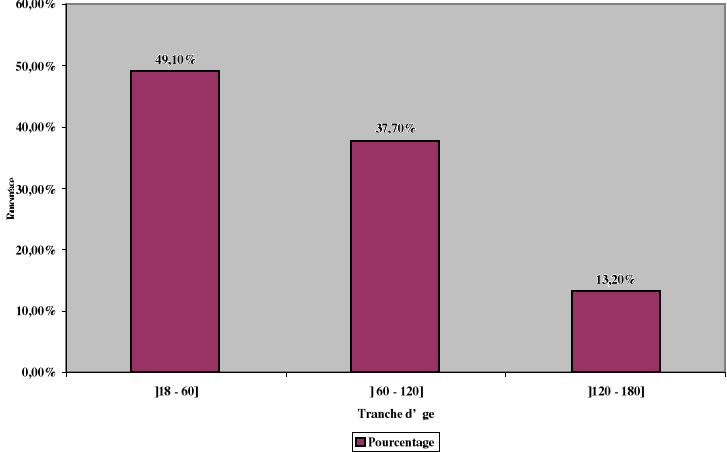
Figure 10 : Distribution des cas en fonction de
l'âge de diagnostique
Il ressort de cette figure que la tranche d'âge
allant de 18 à 60 mois est la plus représentée avec
49,10% contre la 13, 20% pour la tranche allant 120 exlu à 180 mois.
Notons que l'âge médian est de 72 mois.Tableau II :
Distribution des cas en fonction du Z-score poids pour âge
|
Z- score
|
Fréquence
|
Pourcentage
|
|
=-3
|
35
|
14,00%
|
|
]-3 à -2]
|
91
|
36,4%
|
|
]-2 à -1]
|
32
|
12,8 %
|
|
]-1 à + 1
|
85
|
34,00%
|
|
>+1
|
7
|
2,80%
|
|
Total
|
250
|
100,00%
|
Il ressort de ce tableau que 63% des patients
présentent une malnutrition aigüe de type insuffisance
pondérale ; dont 14% sous la forme sévère 36,4% sous
la forme modérée et 12,8% sous la forme
légère.

Figure11 :
Distribution des enfants séropositifs en fonction du Z-score poids pour
Age
Il ressort de la figure ci-dessus que la courbe est
dévié du côté gauche ce qui traduit une
malnutrition globale avec une médiane à -1,42. Dans 36,4% des
cas, les enfants ont un écart type à <- 2 et dans 14,0%
des cas, ils ont un écart type < - 3.
Tableau IV :
Distribution des enfants séropositifs en fonction du stade clinique
(selon l'OMS)
|
Stade clinique
|
Fréquence
|
Pourcentage
|
|
I
|
23
|
9,30%
|
|
II
|
101
|
40,70%
|
|
III
|
109
|
44,00%
|
|
IV
|
17
|
6,00%
|
|
Total
|
250
|
100,00%
|
Il ressort de tableau que 109 enfants séropositifs
(soit 44%) ont consulté au stade III de la maladie par contre 17
enfants séropositifs (soit 6%) ont consulté au stade IV de la
maladie.
Tableau V :
Distribution des enfants séropositifs en fonction des infections
opportunistes
|
Infections opportunistes
|
Fréquence
|
Pourcentage
|
|
Bronchopneumonie
|
2
|
1,55
|
|
Candidose
|
18
|
13,95
|
|
Dermatose
|
21
|
16,27
|
|
Entérite chronique
|
2
|
1,55
|
|
FUO
|
2
|
1,55
|
|
Herpes Zoster
|
1
|
0,77
|
|
MPC
|
12
|
9,30
|
|
pneumopathie reccurente
|
19
|
14,72
|
|
Anémie
|
4
|
3,10
|
|
Sarcome de Kaposi
|
1
|
0,77
|
|
Tuberculose
|
26
|
20,15
|
|
zona
|
6
|
4,65
|
Il ressort de ce tableau que 20,15% des patients ont
développé la tuberculose par contre 0,77% des patients ont
développé le sacome de Kaposi et l'herpès Zoster.
III.
ASPECT BIOLOGIQUE

Figure 12 :
Distribution des enfants séropositifs en fonction de l'état
immunologique
Il découle de la figure ci- dessus que 46, 90% des
patients ont un taux de CD4 qui au - delà de 499 /mm3 contre 23,70% des
patients ont un taux CD4 inférieur à 200/mm3.
IV.
ASPECT THERAPEUTIQUE

Figure 13 :
Distribution des enfants séropositifs en fonction de la prise en charge
PTME
Il ressort de la figure ci- dessous que 91% des
patients n'ont pas bénéficiés d'un suivi PTME contre 9%
qui en ont bénéficié.

Figure 14 :
Distribution des enfants séropositifs en fonction de la mise sous
ARV.
La figure ci- dessous nous montre que 65 % d'enfants
séropositifs étaient sous ARV contre 35 % d'enfants
séropositifs qui ne l'étaient pas.
NB : Tous nos patients ont
bénéficié à 100% de la prophylaxie au
cotrimoxazole

Figure 15 : Distribution des enfants
séropositifs en fonction de l'observance du traitement.
Il ressort de la figure ci- dessus que 87% des enfants
séropositifs observent correctement leur traitement par contre 13% des
enfants séropositifs n'observent pas le traitement.
V. ASPECT EVOLUTIF

Figure 16: Distribution des enfants
séropositifs en fonction d'hospitalisation
La figure ci- dessus nous montre que 60% d'enfants
séropositifs n'ont jamais été hospitalisés par
contre 40 % des enfants séropositifs l'ont déjà
été.

Figure 17: Répartition des cas en fonction de
l'issue
Il ressort de cette figure que 93 % des patients sont envie
contre 7% de décédés
Tableau VI : Distribution des enfants
séropositifs en fonction du sexe et de décès
|
Issue
|
|
Sexe
|
oui
|
Non
|
TOTAL
|
|
Féminin
|
14
|
126
|
140
|
|
Masculin
|
4
|
102
|
106
|
|
Total
|
18
|
228
|
246
|
Il ressort de ce tableau que il y a dépendance ente la
variable sexe et le décés P etant 0,050742991 et avec 10% des
décès pour le sexe féminin et 3,8 % de décès
pour le sexe masculin.
Tableau VII : Distribution des cas en fonction de
l'observance et de l'issue
|
Issue
|
|
Observance
|
non
|
oui
|
Total
|
|
non
|
5
|
16
|
21
|
|
oui
|
9
|
139
|
148
|
|
Total
|
14
|
155
|
169
|
Il ressort de ce tableau qu'il y a dépendance entre
l'observance du traitement et l'issue des patients, le Khi- carré
calculé étant de 7,6076 avec P = 0,00581336. Dans 23,8 % des cas
les décédés n'ont pas observés le traitement par
contre 6,1% des décédés ont observés le
traitement.
Tableau VIII : Distribution des cas en fonction
du stade clinique selon l'OMS et le sexe
|
Stade clinique
|
Féminin
|
Masculin
|
Total
|
|
I
|
13
|
10
|
23
|
|
II
|
63
|
38
|
101
|
|
III
|
59
|
50
|
109
|
|
IV
|
6
|
9
|
15
|
|
Total
|
141
|
107
|
248
|
Ce tableau nous montre qu'il y a indépendance entre la
variable stade clinique et la variable sexe, le khi-
carré étant 3,3237 avec un p de 0,3444.
Tableau IX : Le
risque de développer les infections opportunistes lorsqu'on est sous
ARV.
|
Infection opportuniste
|
|
ARV
|
non
|
Oui
|
Total
|
|
non
|
63
|
18
|
81
|
|
oui
|
54
|
106
|
160
|
|
Total
|
117
|
124
|
241
|
Ce tableau nous montre qu'il n'y a pas indépendance
entre la mise sous ARV et la variable la survenue des infections
opportunistes, le khi- carré étant 41,7319 avec un p de
0,0000.
IV. DISCUSSION
IV.1 CARACTERISTIQUES
SOCIODEMOGRAPHIQUES
a) Fréquence
Notre étude s'est étendue sur une période
allant du 1er janvier 2010 au 31 décembre 2013 soit 4 ans. Au cours
de ladite période, le nombre total des PVV admis était1500 parmi
lesquels 250 cas d'infection à VIH de l'enfant soit une
prévalence de 17 % (figure 1). Cette fréquence est largement
supérieure à celle d'Almeida M. et al ; au centre
hospitalier et universitaire de Cotonou pour une période allant de
Janvier 2002 à Juillet 2010 qui était de 317 enfants
infectés. Ngwej, dans son étude aux cliniques universitaires de
Lubumbashi en 2005, avait de 4,7%. Kakou et al, en côte d'ivoire dans
une étude rétrospective, la fréquence de l'infection
pédiatrique s'élevait à 1,03%.
Nous osons croire que dans notre série, la
fréquence est élevée de l'infection à VIH peut-
être due au fait que notre centre est une structure destinée
seulement à la prise en charge de l'infection à VIH ainsi on
pourra dire que bon nombre des patients émet leur choix sur ce centre
pour des raisons d'accès facile aux soins et surtout pour une bonne
prise en charge mais aussi dire qu'il y a une recrudescence liée
à la non observance des mesures préventives
particulièrement la PTME.
b) Sexe
Le sexe féminin était plus dominant avec un sex
ratio à 0,7. (figure 1). Ce résultat est similaire celui
trouvé dans d'autres études antérieures notamment celles
de Almeida et Coll sur « profil des enfants infectes par le VIH
suivis au centre national hospitalier et universitaire (CNHU) de Cotonou de
2002 à 2010 » qui était de 0,9 . Et celle
de Gona P et col aux Etats Unis en 2006 et celle de Puthanakit et coll en
Thailande en 2007 qui étaient respectivement de 0,92 et 0,96
Par ailleurs, Shilpa et al. dans le département de
pédiatrie de deux hôpitaux de Mumbai en Inde en 2004 et celle de
Biobele et al effectuée au département de pédiatrie de
University College Hôpital à Ibadan au Nigeria en 2011 qui ont
trouvé une légère prédominance du sexe masculin
avec des sex ratio respectivement trouvé à 1,6 et 1,22.
Ngwej quant à lui, aux cliniques universitaires de
Lubumbashi a trouvé une égalité parfaite entre les deux
sexes (sex ratio 1).
Eu égard, ces résultats, la prédominance
d'un sexe sur un autre ou l'égalité entre le sexe n'a pas une
explication scientifique prouvée. Pour notre part cet aspect
relève d'une étude virologique très avancée ceci
parce que le virus mute d'une division à autre et cela d'un organisme
à un autre. Par rapport à notre milieu, avec la recrudescence
des abus et des moeurs notamment la sexualité précoce, les viols
fréquemment rencontrés augmenteraient ce taux dans le sexe
féminin.
c) Age
La médiane de l'âge pour cette étude
était 84 mois soit 7 ans. Ce résultat ne s'éloigne pas de
celui de Ngwej qui était de 7, 5 ans en 2005 lors d'une étude
sur le profil clinique et biologique aux cliniques Universitaires de Lubumbashi
et celui d'Almeida et Coll dans le service de pédiatrie de CNHU de
Cotonou où l'âge moyen était de 89,1 mois. L'étude
sur l'infection à VIH de Bugaje dans le département de
pédiatrie à l'hôpital universitaire de Ahmadu Bello en 2006
au Nigeria trouve que l'âge moyen était de 2 #177; 1,8 ans ( entre
2 et 144 mois). L'on constatera dans la figure 3 que la tranche d'âge
allant de 18 à 59 mois présente un pourcentage (40,40%)
légèrement supérieur à celui de la tranche allant
de 60 à 120 mois (40%), ce résultat pourrait pour une part
remettre en question notre prise en charge PTME, selon la PNLS 2010 les enfants
ayant attrapé le VIH in utero atteignent rarement un âge
supérieur à 5 ans alors que le VIH au-delà de 5 ans serait
le non-respect de la PTME .D'autre part, cet aspect pourrait lier à une
bonne politique de prise en charge pour les patients dont le diagnostic aurait
posé le plus tôt et qui avaient bénéficiés de
la TAR.
d) Provenance
Presque le tiers de nos patients (soit 36%) provenait de la
commune de Kampemba (TableauI). Elle est suivie par la commune de Lubumbashi
qui a fourni 17,30% des patients. Nous pensons d'une part que la
proximité géographique jouerait son rôle et d'autre part
l'on se rendra compte que la commune Kampemba n'a jamais
bénéficié d'un centre de prise en charge VIH.
e) L'issue de l'un de parent
Dans cette étude 29 % d'enfants ont au moins un parent,
cet état de chose se rapproche d'Almeida et Coll dans le service de
pédiatrie de CNHU de Cotonou qui autour de 31 % mais ce
résultat reste inférieur a ceux observés au Brazzaville
en 2003 par M'pemba Loufoua-Lemay AB et Nzingoula sur le SIDA au CHU de
Brazzaville : expérience du service de pédiatrie , au Togo en
2007 par Atakouma DY, et al sur le traitement antiretroviral des enfants
infectes , qui était respectivement de 39% et 80%. Ceci poussa Almeida
et Coll à confirmer que « le sida est une maladie pourvoyeuse
d'orphelins infectés ou affectés. Ces enfants sont par
conséquent à la charge d'autres membres de leur famille avec le
risque de stigmatisation et d'irrégularité du suivi entravant une
prise en charge correcte ». Ce qui pourrait réduire par
ricochet l'espérance de vie ces enfants ainsi augmenter le taux de
mortalité.
IV.2 ASPECT CLINIQUE
a) Le motif de consultation
La toux, la fièvre, l'éruption cutanée et
la diarrhée ont été les plaintes de nos patients qui
représentaient respectivement 46,00%, 24,40%, 16,40%, 8,40%( tableau
II). Une étude similaire réalisée au Nigeria en 2006 par
Bugaje et Coll dans le département de pédiatrie à
l'hôpital universitaire d'Ahmadu Bello montre que la fièvre et la
toux ont été formulées dans 82,8 % des cas.
Selon l'étude menée par Almeida et Coll, la
plupart des enfants avaient présenté plusieurs manifestations
cliniques à l'admission. Les symptômes les plus fréquents
étaient la toux et les difficultés respiratoires, la
dénutrition, la fièvre, la diarrhée. Baleng Maah
Bernadette, son étude au Mali en 2005, la toux et la diarrhée
chronique sont les motifs les plus représentés avec
respectivement 45, 7% et 38, 7%. Par ailleurs, Dicko et Koffi en côte
d'Ivoire ; la fièvre, la toux et la diarrhée étaient
le plus représentés.
Quel que soit la place qu'occupe l'une ou l'autre plainte dans
différentes études, on se rendra compte que les mêmes
motifs de consultation reviennent et dont la plupart font parti des signes
majeurs de l'infection à VIH pédiatrique selon PNLS 2010 de la
république démocratique du Congo. Les symptômes
présentés sont très évocateurs de l'infection
à VIH et certains témoignent d'une maladie déjà
avancée.
b) Age de diagnostic
Dans 49,10 % des cas, le diagnostic a été
posé avant 60 mois avec un âge médian de 72 mois
L'infection à VIH pédiatrique
diagnostiquée au- delà 5ans nous renvoie au moment de la
contamination telle que décrit le PNLS 2010 en parlant sur les formes
évolutives, il souligne que la forme tardive est souvent liée
à une contamination périnatale( pendant le travail,
l'accouchement ou durant l'allaitement.).
c) Le Z- score poids pour
âge
Le courbe Z- score de nos patients est dévié
à gauche (figure 10) signe d'une malnutrition globale avec une
médiane à -1,42. Dans 36,4% des cas, les enfants ont un
écart type à <- 2 (malnutrition modérée ) et
dans 14,0% des cas, ils ont un écart type < - 3 (malnutrition
sévère). Selon l'étude d'Almeida et Coll dans le service
de pédiatrie de CNHU de Cotonou ; la malnutrition avait
été objectivée chez 193 enfants (60,9%) dont 55 cas
(28,5%) étaient sévères.
Ces résultats rejoignent la littérature dans le
guide de prise en charge de l'infection à VIH pédiatrique PNLS
2010 (RDC) et EDS 2007, il souligne que La nutrition est un volet faisant
partie intégrante des soins et du soutien des personnes vivant avec le
VIH, quelle que soit leur âge et leur condition. Déjà en
dehors du VIH, les répercussions de la malnutrition sur le
système immunitaire sont bien connues et la suppression des
réponses immunitaires causée par la malnutrition ressemble,
à maints égards, aux conséquences de l'infection à
VIH. Or, la malnutrition et l'insécurité alimentaire ont pris des
proportions inquiétantes dans le pays. En effet, d' après EDS
2007, 36 % d'enfants congolais de moins de 5 ans souffrent d'une malnutrition
aigue, 11 % d'une malnutrition chronique et 24 % d'une insuffisance
pondérale.
Selon Manuel sur le SIDA pédiatrique en Afrique
2006 : les affections bucco-dentaires rencontrées le plus souvent
chez les enfants infectés par le VIH, serait aussi à la base la
malnutrition. Au vu de tous ces arguments, le suivi staturo- pondérale
de l'enfant avec infection à VIH reste important.
d) Stade clinique
Concernant le stade clinique (tableau III) : 109 enfants
séropositifs (soit 44%) ont consulté au stade III de la maladie
et 101 enfants séropositifs (soit 40%) au stade II de la maladie ;
Selon l'étude d'Almeida et Coll dans le service de
pédiatrie de CNHU de Cotonou, 52% étaient un stade clinique 3 ou
4
Selon l'étude d'Aregay Gebremedhin et coll portant sur
la prédiction de la mortalité attribuable aux VIH chez les
enfants sous ARV à l'hôpital Mikele au Ethiopie 2013
(édition anglaise) 70% des patients étaient au stade 3.
Selon l'étude de Ngwej (2005) aux cliniques
universitaires de Lubumbashi, 54% des enfants sépositifs étaient
au stade 4 de la maladie.
Au vue de toutes ces études, seule notre étude
montre au moins 40 % des patients qui ont été admis au stade 2.
Nous pensons que cela est dû au paquet minimum d'activités du
centre d'excellence- Unilu qui s'investit seulement dans la prise en charge
de l'infection à VIH où l'on retrouve la nouvelle approche
conseil et dépistage à l'initiative du prestataire en sigle DCIP
qui permet ainsi de diagnostiquer l'infection à VIH
précocement.
e) Les infections opportunistes
Le tableau IV de cette étude montre que la
tuberculose, la dermatose, les pneumopathies à répétition,
les candidoses, les MPC, l'amaigrissement, zona, l'entérite chronique
et le FUO sont les infections opportunistes observées respectivement
avec 20,15 %, 16,27%, 14,72, 13,95%, 4,65%, 1,55%.
Par ailleurs, l'étude d'Almeida et Coll rapporte que
les infections opportunistes diagnostiquées étaient
dominées par les candidoses buccales (71,9%). En 2007, Ojukwu et al. au
Nigeria avaient identifié la candidose buccale comme facteur de risque
majeur associé a l'infection à VIH au- delà de six
semaines de vie. Les candidoses buccales sont susceptibles de réduire la
consommation d'aliments constituant des facteurs déclenchent ou
aggravant de l'etat de malnutrition. Les infections respiratoires
étaient essentiellement les pneumonies récurrentes (51 %), la
tuberculose pulmonaire (15,1 %), la pneumocystose (2,6 %).
L'étude de Bugaje et Coll a montré que les
candidoses orales, les pneumonies et la tuberculose avec pour incidence
respective de 60%, 45,7% et 31,4 %.
Ngwej (2005), dans sa série, a trouvé une
fréquence de 46% pour les pneumopathies interstitielles et une
fréquence de 8,4% pour la tuberculose, de 14% de MPC.
D'une manière générale, les infections
opportunistes sont plus observés dans le tractus respiratoires cela
serait lié au fait que les voies respiratoires possèdent un
nombre assez élévé des germes opportunistes notamment le
Mycobactérium tuberculosis, le Streptococcus pneumoniae,le
Mycobactérium avium complex , le Pneumocystis carinii.
Madhi SA et al. ajoute que dans les infections respiratoires
chez les enfants infectes par le VIH, les bacteries sont plus fréquentes
que les virus et parmi les bacteries, le pneumocoque est le plus
rencontré.
IV. 3 ASPECT BIOLOGIQUE
L'état immunologique de la plupart de nos patients est
dans 49,06 % au-delà au délà de 500CD4/mm3, avec un taux
moyen de 450 CD4/mm 3. Par contre de de Bejaje et col le taux de CD4
varié entre 533 et 2336/mm3 avec une moyenne de 1280#177; 604 /mm3.
Almeida et Coll signale quant à lui que plus de la
moitie des enfants (56%) ayant un comptage des lymphocytes T CD4 disponible
(n=255) avaient un déficit immunitaire important ou
sévère.
Cette divergence entre les différents taux serait
liés au fait que le profil immunologique d'un individu dépend
de plusieurs facteurs d' où pour la prise en charge, on rendra compte
sur base des recommandations générales de l'OMS chaque pays essai
de les adaptés aux réalités de la société
d'où la Politique Nationale de Lutte contre le Sida (PNLS).
IV.4 ASPECT THERAPEUTIQUE
Les figures 13, 14, 15 de notre étude montre
respectivement que seulement 9% des patients ont bénéficié
d'une prise en charge PTME, 65 % de patients étaient sous ARV, 81 % des
patients observées fidèlement le traitement. Signalons que 100%
de nos patients ont bénéficié d'une prise en charge
prophylactique au cotrimoxazole l'âge médian début de mise
sous ARV de 72 mois ces résultats réjoignent l'étude
d'Almeida M et coll qui montre que 9,5% des enfants avaient reçu une
prophylaxie antiretrovirale dans le cadre de la PTME. 99% des enfants avaient
reçu la prophylaxie au cotrimoxazole. La TARV était
initiée chez 168 enfants (53%). La moyenne d'age des enfants au
début du TARV était de 57,9 mois.
Selon D.-Y. Atakouma et coll dans son étude
à Lomé en 2006 sur les aspects cliniques, biologiques et
évolutifs de ces enfants sous ARV où la mise des enfants
sous ARV avait débuté à un âge moyen de 5 ans
4 mois (.64 mois) au bout d'une durée minimale de 6 mois de
traitement: 66,7% des enfants étaient devenus asymptomatiques (stade I)
et 20,8% étaient au stade II. Les autres traitements associés aux
ARV étaient essentiellement le cotrimoxazole dans tous les cas et les
vitamines (77,8%).
Eu égard aux différents résultats ci-
haut étalés , dans notre série l'age de mise sous AVR est
légèrement avancée mais sans trop s'éloigner des
autres nous pensons que la plupart des enfants auraient l'infection à
VIH en périnatale avec une évolution lente les signes ne sont
apparu qu'autour de 60 mois. La prévention au cotrimoxazole a
été de 100% dans notre série par contre elle est plus
basse dans la série de Atakouma (77,8%) ceci nous laisse croire que ces
enfants n'étaient pas suivis dans un centre de prise en charge à
l'infection VIH où une fois le diagnostic est posé
l'accès au produit est gratuit.
IV.5. ASPECT EVOLUTIF
Dans notre étude, nous avons observé le
décès dans 7% des cas. L'analyse bivariée sexe et issue
montre 10% dans le sexe féminin et 3,8 dans le sexe masculin
(p<0,05). L'âge médian de décès était de
60 mois ou 5 ans. Les autres études donnent des issues très
variés c'est notamment :Almeida M et coll dans son étude,
18% était décédée Bejaje et col 25 % des
dédès et Aregay Gebremedhin et col quant à lui 1,6%
était décédés
D'une façon générale, le taux
élevé de décès reste encore un problème
dans le pays à ressource limités.
Les difficultés d'accès aux soins pour des
raisons économiques, le décès maternel surtout et
l'absence d'information du substitut parental pourraient expliquer le nombre
important de décès à domicile (Diack Mbaye A, 2005). Le
décès d'un membre du couple parental est en effet cause de
dislocation et de précarité familiale, nécessitant un
soutien psychosocial permanent. En France tout enfant
infecté dont les parents sont affiliés a la
sécurité sociale bénéficie d'une prise en charge
complète (Dolfus C 2006 ).
Ce qui n'est pas le cas dans les pays à ressources
limitées. A défaut de prise en charge, des auteurs
préconisent pour ces pays, un ensemble de soins répondant aux
besoins de prévention, de traitement et de soutien psychosocial de
l'enfant infecte et de sa famille, de façon intégrée aux
dispositifs existants avec une équipe multidisciplinaire (Vaz P,
2005).
CONCLUSION
Au terme de notre étude « Enfants vivants
avec VIH suivis au centre d'excellence- Unilu : étude
épidémio - clinique et biologique» pour une période
allant du 1ier janvier 2010 au 31 Décembre 2013 soit 4 ans.
C'était une étude d'une approche descriptive transversale par
analyse retrospective des données basée sur la revue documentaire
dont les objectifs étaient de déterminer la fréquence des
enfants avec infection à VIH consultant le centre d'excellence - Unilu;
dégager le profil épidémio - clinique des enfants avec
VIH au centre d'excellence - Unilu et de déterminer le faciès
biologique ainsi l'évolution et la prise en charge de ces enfants.
Cette étude a gravité autour de deux grandes
parties, l'une théorique et l'autre pratique.
La partie théorique s'est étalée sur 3
chapitres dont le premier a concerné les concepts du sujets, le
deuxième les généralités sur l'infection
pédiatrique à du VIH et enfin le troisième sur
l'observance et l'adhérence du traitement.
La partie pratique s'est étalée sur 3 chapitres
dont le premier a présenté la méthodologie, au
deuxième nous avons présenté les données et
interprété les résultats obtenus et enfin au
troisième nous nous avons discuté sur ces résultats.
En analysant les données nous avons constaté ce
qui suit :
· Sur 1500 PVV, 250 pour l'infection à VIH
pédiatrique soit une prévalence de 17 % ;
· Les enfants séropositifs du sexe féminin
ont représenté 57% par contre 43 % représentent les
enfants séropositifs du sexe masculin ;
· L'âge médian est de 84 mois (avec les
extrêmes 18 mois et 180 mois) avec 40,40% dans la tranche allant de 18
à 59 mois ;
· La commune de Kampemba était la plus
représentative dans 36% des cas ;
· Le niveau scolaire était non défini
dans 49,2% ;
· Dans 29 % des cas, les enfants étaient
orphelins d'où moins un parent ;
· L'âge médian de diagnostique
était de 72 mois
· Dans 46% des cas les enfants ont consulté
pour la toux alors que dans 0,01% des cas, ils ont consulté pour les
otalgies ;
· la courbe Z- score était dévié
du coté gauche avec une médiane à -1,42. Dans 36,4% des
cas, les enfants ont un écart type à <- 2 et dans 14,0%
des cas, ils ont un écart type < - 3 ;
· Dans 44% des cas , les enfants étaient au
stade III selon la classification clinique de l'OMS ;
· Dans 20,15% des cas, les enfants ont
développé la tuberculose
· Dans 46, 90%, les enfants ont un taux de CD4 qui au -
delà de 499 /mm3 ;
· Dans 9% des cas, les enfants ont
bénéficié d'une prise en charge en PTME ;
· Dans 65 % des cas, les enfants séropositifs
étaient sous ARV
· Dans 100% des cas nos patients ont
bénéficié d'une prophylaxie ;
· Dans 87% des cas, les enfants séropositifs
observaient correctement leur traitement
· Dans 7% des cas étaient
décédés.
RECOMMANDATIONS
Au vu de ces résultats, le VIH pédiatrique
demeure un problème majeur de santé publique et nous formulons
les recommandations suivantes :
Aux autorités
politico administratives
· Intensifier l'Information Education Communication
permanente destinée au grand public sur le VIH/SIDA ;
· Prévenir l'infection à VIH chez la femme
surtout en activité génitale par une information adéquate
et une sensibilisation adaptée à son environnement
socio-économique et culturel ;
· Equiper les laboratoires publics en matériels
nécessaires et réactifs pour la réalisation de PCR/VIH,
le comptage des CD4, la sérologie VIH de manière permanente ;
· Assurer la disponibilité permanente des
substituts au lait maternel pour les enfants nés de mères
séropositives au niveau de tous les sites de PTME/VIH ;
Au niveau du
PNLS
· D'organiser une meilleure coordination des soins et un
suivi des activités par une meilleure communication entre les
différents acteurs dans la prise en charge du VIH chez l'enfant ;
· D'étendre le dépistage
systématique jusque dans les zones les plus reculées du pays et
de renforcer le rôle des ONG dans la sensibilisation face au VIH/SIDA
pour la prise en charge de l'infection à VIH pédiatrique
;
· Initier un traitement de soutien psychosocial de
l'enfant infecté et de sa famille, de façon
intégrée aux dispositifs existants avec une équipe
multidisciplinaire
Au personnel
soignant
· Proposer de façon appropriée et
systématique le test de dépistage du VIH dans le bilan
prénatal ;
· Réaliser les examens pré- transfusionnels
avant toute transfusion
· Assurer un suivi adéquat et clinique
régulier des enfants nés de mères
séropositives ;
Au parent
· D'utiliser correctement des ARV mis à leur
disposition tout en évitant toute stimatisation ;
· Accepter la méthode alternative d'alimentation
des enfants nés de mères séropositives
REFERENCES BIBLIOGRAPHIQUES
ACT.UP Paris Sida, des bases pour comprendre, 2ieme
édition de la collection information -pouvoir, Paris de la
découverte 2010, 199p.
Aregay Gebremedhin, Predictors of mortality among HIV infected
children on anti-retroviral therapy in Mekelle Hospital, Northern Ethiopia: BMC
Public Health 2013, 13:1047
Assumani N., module de croissance et
dévéloppement deuxième doctorat, faculté de
Médecine Unilu, inédit, 2011.
Atakouma DY, Tsolenyanu E, Gbadoe A, Gbetoglo V, Lawson-Evi K,
Agbere AR et al. Le traitement antiretroviral des enfants infectes par le
VIH/SIDA a Lome (Togo): Premiers resultats. Arch Pediatr 2007; 14: 1178-82.
Biobele et al., Présentation du profil clinique au
cours de l`infection à VIH chez l'enfant in journal of the international
association of physician in AIDS care, Collège de médecine,
Université d'Ibadan au Nigeria,2011
Burgard M. et Rouzioux C., virus HIV : diagnostic et
suivi de l'infection : le praticien face au Sida, Paris 1999, 512- 13p
Collège des universitaires des maladies infectieuses et
tropicales infections à VIH et Sida in E Pilly 2010, Paris vivactus
2008, 468- 487p Collège des universitaires des maladies infectieuses et
tropicales infections à VIH et Sida in E Pilly 2010, Paris vivactus
2008, 468- 487p
D'Almeida M et coll , Profile of hiv- infected
children at the university hospital cnhu of cotonou, Mali Medical , article
original
Dabis, Bequelt, Who- I.E, Leroy. V, prévention de la
transmission mère- enfant du VIH. Dans les pays en
développement : avancées récentes et respectives,
Mai 2002, n° spéciale 8 , 9- 16p
DUNN. DT, Simonds RY, Bulray M et all : interventions to
prevent vertical transmission of HIV- 1, effects on viral detection rate in
early infant samples AIDS 2000, 8p.
Extrait de l'encyclopédie médicale pratique
copyright C: 1996, 1997,1998, 1999; the learning company inc.TLC.
Girard Pierre Marie, Katlama Christine, Dialoux Gilles :
VIH septième édition rueil malamaison Doin 2007, 727p
Giraudan I, Leroy V., évaluation du coût de la
prise en charge des enfants infectés par le VIH :cahier
d'études et de la recherche francophone 1999, 277- 281p.
Goerdert J., Duliege. AM., Amos.C; an international registry
of HIV exposed turns, high risk of HIV- 1 infection for first born turn, the
lancet 1991,338, 1471- 1475p.
Gona P, Van Dyke RB, Williams PL, Dankner WM, Chernoff MC,
Nachman SA et al. Incidence of opportunistic and other infections in
HIVinfected children in the HAART era. JAMA 2006;296 (3):330-1.
Guide national de traitement de l'infection à VIH par
les ARV, PNLS, RDC, Janvier 2005.
http/www.aidssida. org/clinique/index html.
Hejoaka_2012._L_enfant_gardien_du_secret._Vivre_et_grandir_avec_le_sida_et_ses_traitements_au_Burkina_Faso.
International périnatal HIV group duration of ruptured
membranes and vertical transmission of HIV -1, A metanalysis fro 15
perspectives cohort.studies 2001, 357- 68p.
Jacqueline LEBELA, Croissance staturo-pondérale des
enfants infectes par le virus de l'immunodeficience humaine à
Yaounde, Cameroun Université de Yaoundé
I - thèse en Pédiatrie 2009.
Kayembe PK et al. (2007). Evolution de la prévalence du
VIH en République démocratique du Congo (1985-2005):
évidence de plusieurs épidémies à
différentes vitesses. Sous presse.
Kitetele F, Lusiama J, Akele C, Mbotama C Evaluation des
enfants nés des mères VIH+, sous protocole PTME à la
névirapine, suivis à l'hôpital pédiatrique de
Kalembelembe. Kin 2007.
Komme HC : évaluation de la
séroprévalence du VIH dans le service de pédiatrie de CHU
Gabriel Toure de 1999 à 2002 , thèse médecine Bamako 2004,
109p.
Laroy, Nuvell. ML, Dabris. S et al, international
multicenterpooled analysis of late post- natal mother to child transmission of
HIV- 1 infection lanct 1998, 597- 600p.
M.A. Bugaje and H.A. Aikhionbare; paediatric HIV/AIDS seen at
Ahmadu Bello University Teaching Hospital Zaria, Nigéria, annals of
African Medicine , Vol.5 , N°2; 2006: 73- 77
M'pemba Loufoua-Lemay AB, Nzingoula S. Le SIDA au CHU de
Brazzaville : experience du service de pediatrie "Grands enfants". Bull Soc
Pathol Exot 2003; 96(4): 291-4.
Mandelbrot. L, Mayane. NJ, Bougain. A et al : obstetric
factors and mother to child transmission of HIV type I
Ngwej D., Profil clinique et biologique de l'infection
à VIH chez l'enfant cas : mémoire de spécialisation, UNILU
2005.
Ojukwu J U, Ogbu N C. HIV infection in hospitalized children
with endemic diseases in Abakaliki, Nigeria: the role of clinically directed
selective screening in diagnosis. AIDS Care 2007; 19(3):330-36 ;
OMS 2010 : rapport sur l'épidémie mondiale
du sida : traitement et prise en charge : http/www.unaids.org.
OMS/ONUSIDA/UNICEF Communiqué commun 17 AVRIL 2007
ONUSIDA (2005). Evidence for HIV decline in Zimbabwe: a
comprehensive review of the epidemiological data. Novembre. Genève.
ONUSIDA (2007). Comparing adult antenatal-clinic based HIV
prevalence with prevalence from national population based
Organisation Mondiale de la Sante. Traitement antiretroviral
de l'infection à VIH chez le nourrisson et l'enfant : vers un acces
universel. Recommandations pour une approche de sante publique. Mise a jour.
Geneve : OMS; 2010.
Planter JC, Simond F;diagnostic sérologique des
infections à VIH 2002, développement et santé n° 162.
Geni
Presentation/2007/survey_anc_2007_en.pdf.
Programme national de Lutte contre le sida (PNLS) (2010).
Guide de prise en charge de l'infection à VIH chez l'enfant en RDC.
Août. Kinshasa, Ministère de la Santé de la
République Démocratique du Congo.
Programme national de Lutte contre le sida (PNLS) (2013).
Guide nationale de prise en charge de l'infection à VIH en RDC.
Juillet. Kinshasa, Ministère de la Santé de la République
Démocratique du Congo.
Puthanakit T, Aurpibul L, Oberdorfer P, Akarathum N,
Kanjananit S, Wannarit P et al. Hospitalization and mortality among HIV
infected children after receiving highly active antiretroviral therapy. Clin
Infect Dis 2007; 44(4): 599-604
Rapport du groupe d'expert sous la direction du professeur
Geni, prise en charge médicale des personnes infectées par le
VIH, édition Flammarion, médecines- sciences, Paris ,2006.
Revillard, JP, association des enseignants d'immunologie des
universités de langue française Assim, 2001 : immunologie,
édition 4, De Boeck, université ISAM, 600p.
Seydou Sogoba , prise en charge de l'infecion à VIH/
sida sur grossesse dans le service de gynécologie de l'hôpital
Nianankoro Fomba de segou , 2007- 2008, thèse de médecine,15-
17p.
Shilpa et al., Profil clinique de l'infection au VlH
pédiatrique de l'Inde in Archives of Medical Research, Mumbai, 2005.
surveys in sub-Saharan Africa. Présentation de
l'ONUSIDA. Consulté le 17 novembre sur
http://data.unaids.org/pub/;
ANNEXE : FICHE DE RECOLTE
a) Identité de l'enfant
· Sexe ;
· Age (en mois) ;
· Poids (kg) ;
· Taille (cm) ;
· Taille du ménage ;
· Scolarité (scolarisé, non
scolarisé) ;
· Scolarisé (primaire, secondaire) ;
· Quotient intellectuel;
· Z- score
· IMC
· Adresse
· Prise en charge PTME
b) Identité des parents
· Etat civil
· Niveau d'étude
· Profession
· Niveau socio- économique
· Statut sérologique
· Vivant ou décédé
c) paramètres sur le VIH chez
l'enfant
· Age de diagnostic
· Etat général
· Stade clinique
· Stade biologique
· Suivi PTME(oui ou non
· Sous ARV (oui ou non) si oui la ligne
· Observance du traitement (oui ou non)
· Infection opportuniste
· Hospitalisation (oui ou non) et Vivant ou
décédé



