|

République du Cameroun
Ministere de l'Enseignement
Superieur
..................
Université de Yaoundé I
..................
Faculté de Médecine et des
Sciences
Biomédicales
Republic of Cameroon
..................
Ministry of Higher Education
.....................
the University of Yaounde I
.....................
Faculty of Medicine and
Biomedical
Sciences
PORTAGE VAGINAL ET PROFIL DE SENSIBILITE
AUX ANTIBIOTIQUES DU STREPTOCOQUE B
CHEZ LA FEMME ENCEINTE A L'HOPITAL
GYNECO-OBSTETRIQUE ET PEDIATRIQUE DE
YAOUNDE

..................
Mémoire Présenté et
soutenu
le 15 DECEMBRE 2008
EN VUE DE L'OBTENTION DU
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
DIPLOME DE MASTER EN SCIENCES BIOMEDICALES
Spécialité: MICROBIOLOGIE
MEDICALE
Par :
ADAWAYE CHATTE IDEKHIM
Matricule : 060057
cadawaye@yahoo.fr
Sous la supervision de:
jury :
PR. KOULLA SINATA SHIRo Pr. NGASSA c. PIUS
(président)
Sous la Direction de : DR. NKOA THERESE
(rapporteur)
Dr. TOUKAM MICHEL DR. ADIOGO DIEUDONNE (membre)
Dr.
NKOA THERESE
Année académique 2007-2008
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Table de matières
PRELIMINAIRES i
1. SOMMAIRE .ii
2. LISTE DU PERSONNEL ADMINISTRATIF ET ENSEIGNANTS DE LA
FMSB . v
3. DEDICACES xiii
4. REMERCIEMENTS .xv
5. LISTE DES SIGLES ET ABREVIATIONS .xix
6. LISTE DES TABLEAUX .xx
7. LISTE DES FIGURES ..xx
RESUME ..xxi
SUMMARY xxiii
INTRODUCTION 1
CHAPITRE I : QUESTION DE RECHERCHE, HYPOTHESES ET
OBJECTIFS 3
1.1 Question de recherche 4
1.2 But de l'étude 4
1.3 Hypothèses de recherche ...4
1.4 Objectif général . .5
1.5 Objectifs spécifiques ..5
1.6 Définitions des termes ..5
CHAPITRE II REVUE DE LA LITTERATURE 6
2.1 Définition du Streptococcus agalactiae 7
2.2 Habitat naturel ..7
2.3 Historique et travaux antérieurs 8
2.4 Epidémiologie .11
2.4.1 Taux de portage maternel .11
2.4.2 colonisation asymptomatique 12
2.4.3 Transmission au nouveau né 12
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
2.4.4 Infection chez le nouveau né 14
2.4.5 Infection chez la femme enceinte 15
2.4.6 Infection chez l'adulte 16
2. 4.7 Physiopathologie .16
2.5 Facteurs de risque .18
2.6 Caractères bactériologiques 19
2.7. Caractères antigéniques 20
2.8 Caractères Biochimiques 21
2.9 Diagnostic Bactériologique 22
2.9.1 Prélèvement 22
2.9.4 Examen direct .22
2.9.5 Mise en culture 24
2.9.6 Identification 25
2.9.7 Antibiogramme 27
2.10 Stratégie de prévention 28
2.10.1 Recommandations de l'APP .30
2.10.2 Recommandations de l'ACOG .30
2.10.3 Recommandations de la SOGC 30
2.10.4 Recommandations de la CDC 31
CHAPITRE III MATERIEL ET METHODES ..34
III.1 METHODES .35
3.1.1 Site d'étude 35
3.1.2 Description de la localité . 35
3.1.3 Type d'étude .35
3.1.4 Durée d'étude 35
3.1.5 Taille de l'échantillon .36
3.1.6 Méthode d'échantillonnage 36
3.1.7 Critères d'inclusion 36
3.1.8 Critères d'exclusion 36
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
3.1.9 Procédure de recueil des données
|
36
|
|
3.1.10 Procédure de collecte d'échantillon
|
37
|
|
3.1.11 Procédure d'analyse de l'échantillon
|
.37
|
|
3.1.11.1 Examen macroscopique
|
37
|
|
3.1.11.2 Examen microscopique
|
..37
|
|
3.1.11.3 Mise en culture
|
38
|
|
3.1.11.4 Identification
|
...38
|
|
3.1.11.5. Antibiogramme
|
42
|
|
3.1.12 Conservation des souches
|
.43
|
|
3.1.13 Analyse des données
|
. 43
|
|
III.2 MATERIEL
|
...44
|
|
3.2.1 Matériel de collecte des données
|
. 44
|
|
3.2.2 Matériel de prélèvement
|
44
|
|
3.2.3 Matériel d'analyse et de conservation
|
..44
|
|
3.2.4 Matériel d'analyse des données .
|
44
|
|
CHAPITRE IV- RESULTATS
|
47
|
|
CHAPITRE V- DISCUSSIONS
|
55
|
|
CONCLUSION ET RECOMMENDATIONS
|
.60
|
|
REFERENCES BIBLIOGRAPHIQUES
|
.63
|
ANNEXES
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
2. LISTE DU PERSONNEL ADMINISTRATIF ET ENSEIGNANT DE LA
FACULTE DE MEDECINE ET DES SCIENCES BIOMEDICALES
1- PERSONNEL ADMINISTRATIF
|
Pr. TETANYE EKOE
|
Doyen
|
|
Pr. BENGONO TOURE Geneviève
|
Vice Doyen chargé de la programmation et du suivi des
activités académiques
|
|
Pr. MBANYA Jean-Claude
|
Vice Doyen chargé de la scolarité et du suivi
des étudiants
|
|
Pr. ABENA OBAMA Marie Thérèse
|
Vice Doyen chargé de la recherché et de la
coopération
|
|
Pr. KUABAN Christopher
|
Coordonnateur Général du cycle de
spécialisation
|
|
Mr. ZOAH Michel
|
Directeur des affaires Administratives et
Financières
|
|
Mr. MODO ASSE
|
Chef de service des Programmes
d'Enseignements et de Recherches
|
|
Mr. BEYENE Fernand Dieudonné
|
Chef de service Financier
|
|
Mr. ABESSOLO Dieudonné
|
Chef de service d'Administration générale et du
Personnel
|
|
Mr ENYEGUE ABANDA Julien Justin
|
Chef de service de la statistique et de la scolarité
|
|
Mr. AKOLATOU MENYE Augustine
|
Chef de service du Matériel et de la
Maintenance
|
|
Mrs. ANDONG Elisabeth
|
Bibliothécaire en chef
|
|
Mrs. NADIA MBARGA née ENDANDE Marie F
|
Comptable Matière
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
2 - PERSONNEL ENSEIGNANT a) Professeurs
1.
|
ANGWAFO III FRU
|
Chirurgie - Urologie
|
2.
|
ASONGANYI TAZOACHA
|
Immunologie - Biochimie
|
3.
|
BENGONO TOURE Geneviève
|
Oto-Rhino-Laryngologie
|
4.
|
DOH Anderson SAMA
|
Gynécologie / Obstétrique
|
5.
|
ESSAME OYONO
|
Anatomie / Pathologie
|
6.
|
GONSU FOTSIN Joseph
|
Radiologie- Imagerie Médicale
|
7.
|
JUIMO Alain Georges
|
Radiologie- Imagerie Médicale
|
8.
|
KOUEKE Paul
|
Dermatologie - Vénérologie
|
9.
|
KUABAN Christopher
|
Médecine Interne Pneumologie
|
10.
|
LEKE Robert John Ivo
|
Gynécologie / Obstétrique
|
11.
|
LEKE Rose
|
Parasitologie - Immunologie
|
12.
|
LOHOUE Julienne
|
Parasitologie - Mycologie
|
13.
|
MBANYA Jean Claude
|
Médecine Interne -Endocrinologie
|
14.
|
MOYOU SOMO Roger
|
Parasitologie
|
15.
|
MUNA WALINJOM
|
Médecine Interne - Cardiologie
|
16.
|
NDUMBE Peter Martins
|
Microbiologie - Immunologie
|
17.
|
NGADJUI TCHALEU Bonaventure
|
Chimie des Sciences Naturelles
|
18.
|
NGOGANG Jeanne
|
Biochimie
|
19.
|
NJITOYAP NDAM Elie Claude
|
Médecine/Gastro - Entérologie
|
20.
|
NKO'O AMVENE Samuel
|
Radiologie- Imagerie Médicale
|
21.
|
SAME EKOBO Albert
|
Parasitologie
|
22.
|
SOSSO Maurice Aurélien
|
Chirurgie Générale
|
23.
|
|
TETANYE EKOE
|
Pédiatrie
|
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
b) Maîtres de Conférences
1.
|
ABENA OBAMA Marie Thérèse
|
Pédiatrie
|
2.
|
ABOLO MBENTI Louis
|
Chirurgie Générale
|
3.
|
AFANE ELA Anatole
|
Anesthésie- Réanimation
|
4.
|
AFANE ZE Emmanuel
|
Médecine Interne Pneumologie
|
5.
|
ATCHOU Guillaume
|
Physiologie Humaine
|
6.
|
BAHEBECK Jean
|
Chirurgie Orthopédique
|
7.
|
BELLA HIAG Assumpta
|
Ophtalmologie
|
8.
|
BINAM Fidèle
|
Anesthésie- Réanimation
|
9.
|
BIWOLE SIDA Magloire
|
Médecine Interne Gastro - Entérologie
|
10.
|
BOB' OYONO Jean-Marie
|
Anatomie/chirurgie pédiatrique
|
11.
|
DOUMBE Pierre
|
Pédiatrie
|
12.
|
EBANA MVOGO Côme
|
Ophtalmologie
|
13.
|
ESSOMBA Arthur
|
Chirurgie Générale
|
14.
|
FOMULU Joseph
|
Gynécologie / Obstétrique-
|
15.
|
KAGO Innocent
|
Pédiatrie
|
16.
|
KASIA Jean Marie
|
Gynécologie / Obstétrique-
|
17.
|
KINGUE Samuel
|
Médecine Interne - Cardiologie
|
18.
|
KOUAM Luc
|
Gynécologie / Obstétrique
|
19.
|
KOULLA Sinata Shiro
|
Microbiologie-Maladies Infectieuses
|
20.
|
MASSO MISSE Pierre
|
Chirurgie Générale
|
21.
|
MBANYA Dora
|
Hématologie
|
22.
|
MBONDA Elie
|
Pédiatrie
|
23.
|
MOUELLE SONE Albert
|
Radiothérapie
|
24.
|
MOUSSALA Michel
|
Ophtalmologie
|
25.
|
NDJOLO Alexis
|
Oto-Rhino-Laryngologie
|
26.
|
NDOBO Pierre
|
Médecine Interne - Cardiologie
|
27.
|
NGASSA CHANCHU Pius
|
Gynécologie / Obstétrique
|
28.
|
NJAMNSHI KONGNYU Alfred
|
Neurologie
|
29.
|
NJOYA Oudou
|
Médecine Interne Gastro-Entérologie
|
30.
|
NKAM Maurice
|
Pharmacologie - Thérapeutique
|
31.
|
NOUEDOUI Christophe
|
Médecine Interne - Endocrinologie
|
32.
|
ONDOBO ANDZE Gervais
|
Chirurgie Pédiatrique
|
33.
|
OYONO ENGUELE Samuel
|
Physiologie Humaine
|
34.
|
SIMO MOYO Justin
|
Anesthésie - Réanimation
|
35.
|
SOW Mamadou
|
Chirurgie - Urologie
|
36.
|
TAKONGMO Samuel
|
Chirurgie Générale
|
37.
|
TAKOUGANG Innocent
|
Santé Publique
|
38.
|
TCHOKOTEU Pierre Fernand
|
Pédiatrie
|
39.
|
TIETCHE Félix
|
Pédiatrie
|
40.
|
|
YOMI Jean
|
Radiologie / Radiothérapie
|
|
c) Chargés de Cours
1.
|
ADIOGO Dieudonné
|
Microbiologie
|
2.
|
|
ASONGALEM Emmanuel ACHA
|
Pharmacologie
|
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
3.
|
ATANGANA René
|
Anesthésie - Réanimation
|
4.
|
BELLEY PRISO Eugène
|
Gynécologie / Obstétrique
|
5.
|
BENGONDO MESSANGA Charles
|
Stomatologie
|
6.
|
BEYIHA Gérard
|
Anesthésie / Réanimation
|
7.
|
BISSECK Anne Cécile
|
Dermatologie - Vénérologie
|
8.
|
DJIENTCHEU Vincent de Paul
|
Neurochirurgie
|
9.
|
DONG A ZOCK Faustin
|
Médecine Nucléaire
|
10.
|
ELLONG Augustin
|
Ophtalmologie
|
11.
|
ELOUNDOU NGAH Joseph
|
Neurochirurgie
|
12.
|
ESIENE Agnes
|
Anesthésie / Réanimation
|
13.
|
EYENGA Jean Claude
|
Neurochirurgie
|
14.
|
FARIKOU Ibrahima
|
Chirurgie-Orthopédique
|
15.
|
FEWOU Amadou
|
Pathologie
|
16.
|
FOUDA Pierre
|
Chirurgie - Urologie
|
17.
|
KOBELA née MBOLLO Marie
|
Pédiatrie
|
18.
|
KOLLO Basile
|
Santé Publique
|
19.
|
LUMA Henry NAMME
|
Bactériologie / Virologie
|
20.
|
MBASSA MENICK DANIEL
|
Psychiatrie
|
21.
|
MBOPI KEOU François-Xavier
|
Bactériologie - Virologie
|
22.
|
MBOUDOU Emile Télesphore
|
Gynécologie / Obstétrique
|
23.
|
MBU ENOW Robinson
|
Gynécologie / Obstétrique
|
24.
|
MBUAGBAW Joséphine
|
Médecine Interne / Dermatologie
|
25.
|
MELI Jean
|
Santé Publique
|
26.
|
MOAMPEA MBIO Marie Claire
|
Anatomie / Pathologie
|
27.
|
MONEBENIMP Francisca
|
Pédiatrie
|
28.
|
MONNY LOBE Marcel
|
Hématologie
|
29.
|
MOUKOURI Ernest
|
Ophtalmologie
|
30.
|
NANA Philip NJOTANG
|
Gynécologie / Obstétrique
|
31.
|
NDOM Paul
|
Oncologie Médicale
|
32.
|
NDIKUM Valentine
|
Pharmacologie
|
33.
|
NGABA Olive Nicole
|
Oto-Rhino-Laryngologie
|
34.
|
NGO NONGHA Bernadette
|
Chirurgie Générale
|
35.
|
NGOUNOU NOUBISSIE N. S. épse DOUALLA.
|
Médecine Interne- Rhumatologique
|
36.
|
|
NGOWE NGOWE Marcellin
|
Anatomie - Chirurgie Générale
|
|
|
37
|
NJOCK Richard Fiarce
|
Oto-Rhino-Laryngologie
|
38.
|
NKOA Thérèse
|
Sciences Physiologiques
|
39.
|
NSANGOU Inoussa
|
Pédiatrie
|
40.
|
NTONE ENYIME Félicien
|
Psychiatrie
|
41.
|
OKOMO ASSOUMOU Marie-Claire
|
Bactériologie - Virologie
|
42.
|
OMOLOKO Cécile
|
Nutrition
|
43.
|
ONDOA MEKONGO Martin
|
Pédiatrie
|
44.
|
ONGOLO ZOGO Pierre
|
Radiologie et Imagerie Médicale
|
45.
|
PISOH Christopher
|
Chirurgie Orthopédique
|
46.
|
SENDE Charlotte
|
Radiologie et Imagerie Médicale
|
47.
|
SINGWE Madeleine épse NGANDEU
|
Médecine Interne- Rhumatologique
|
48.
|
TANYA née NGUTI KIEN Agatha
|
Nutrition
|
49.
|
|
TOUKAM Michel
|
Microbiologie Médicale
|
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
50.
|
WANKAH Christian
|
Santé Publique
|
51.
|
|
ZE MINKANDE Jacqueline
|
Anesthésie - Réanimation
|
|
d) Assistants
1.
|
AHANDA ASSIGA
|
Chirurgie Générale
|
2.
|
ASHUTANTANG Gloria
|
Médecine Interne - Néphrologie
|
3.
|
ANKOUANE Andoulou
|
Gastro-entérologie
|
4.
|
AZABDJI Kenfack Marcel
|
Physiologie
|
5.
|
CHELO David
|
Pédiatrie
|
6.
|
CHETCHA Chremegni Bernard
|
Hématologie
|
7.
|
CHIABI Andreas
|
Pédiatrie
|
8.
|
DJOUMOU Francois
|
ORL
|
9.
|
ESSI Josée
|
Santé Publique
|
10.
|
ETOM EMPIME
|
Neurochirurgie
|
11.
|
|
ETOUNDI MBALLA Georges -Alain
|
Médecine Interne Pneumologie
|
|
|
12
|
FOUMANE Pascal
|
Gynéco-obstétrique
|
13.
|
Frederick AGEM KECHIA
|
Mycologie
|
14.
|
GONSU née KAMGA Hortense
|
Bactériologie
|
15.
|
GUIFFO Marc
|
Chirurgie générale
|
16.
|
KABEYENE OKONO Angèle
|
Histo-embryologie
|
17.
|
KAZE FOLEFACK François
|
Néphrologie
|
18.
|
KINGE NJIE Thompson
|
Maladies Infectieuses
|
19.
|
KUATE TEGUEU Calixte
|
Neurologie
|
20.
|
LOBE Emmanuel
|
Médecine Interne - Néphrologie
|
21.
|
MENENGA Alain Patrick
|
Cardiologie
|
22.
|
MENDIMI NKODO joseph
|
Histo-embryologie
|
23.
|
NANA Oumarou Djam Blondel
|
Chirurgie
|
24.
|
NANG ZOUYE Alain
|
Psychiatrie
|
25.
|
NDIKUM Valentine
|
Pharmacologie
|
26.
|
NDONGO Embolo Epse TOMORIMO Judith
|
Biologie Moleculaire
|
27.
|
NDOUMBE Aurelien
|
Neurochirurgie
|
28.
|
NGAMENI Barthelemy
|
Phytochimie
|
29.
|
NGO NONGA
|
Chirurgie Générale
|
30.
|
NGUEFACK Seraphin
|
Pédiatrie
|
31.
|
NGUEFACK TSAGUE
|
Biostatistique/Informatique
|
32.
|
NDJOUMENI Zachariou
|
Economie et gestion sanitaire
|
33.
|
NKWABONG Elie
|
Gynéco-Obstetrique
|
34.
|
|
OWONO Didier
|
Ophthalmologie
|
|
|
35
|
OWONO Etoundi Paul
|
Anesthesie-Réanimation
|
36.
|
SOBNGWI Eugene
|
Endocrinologie
|
37.
|
TABI OMGBA Yves
|
Parasitologie
|
38.
|
TEUBEU Pierre Marie
|
Gynéco-Obstétrique
|
39.
|
|
WONKAM Ambroise
|
Génétique
|
|
|
40
|
ZE Odile Fernande
|
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
e) Cycle d'Etudes Supérieures en Soins Infirmiers
(CESSI)
1.
|
Dr. OMOLOKO Cécile
|
Coordonnateur du CESSI
|
2.
|
|
KAMTA Charles
|
Coordinateur TSSI
|
|
f) Cycle des Etudes Biomédicales et
Médico-sanitaires
|
1
|
Pr LOHOUE Julienne
|
Coordonnatrice du Cycle
|
|
2
|
Dr TANYA Agatha
|
Coordonnatrice Adjointe
|
|
3
|
Pr AFANE ELA Anatole, Dr ESIENE Agnès
|
Coordonnateurs Anesthésie-Réanimation
|
|
4
|
Dr Dieudonné ADIOGO
Dr Hortense GONSU KAMGA
|
Coordonnateurs Biologie Clinique
|
|
5
|
Pr NDUMBE Peter, Dr Marie claire OKOMO ASSOUMOU
|
Coordonnateurs Immunologie
|
|
6
|
Pr NDUMBE Peter,
Dr MBOPI KEOU François Xavier
|
Coordonnateurs Maladies Infectieuses
|
|
7
|
Pr KOULLA Sinata SHIRO / Dr TOUKAM Michel
|
Coordonnateurs Microbiologie Médicale
|
|
8
|
Pr EBANA Mvogo C. Dr OWONO Didier
|
Coordonnateurs Ophtalmologie
|
|
9
|
Pr NDJOLO Alexis, Dr NGABA O.Nicole
|
Coordonnateurs ORL
|
|
10
|
Pr GONSU FOTSIN Joseph, Dr GUEGANG E.
|
Coordonnateurs Radiologie et Imagerie
Médicale
|
|
11
|
Dr TANYA Agatha
|
Coordonnatrice Santé Publique
|
|
12
|
Pr PNDUMBE Peter
Dr MBOPI KEOU François Xavier
|
Coordonnateurs Virologie
|
g) Coordonnateurs des niveaux (Etudes
Médicales)
|
EM1
|
Dr ONGOLO Zogo Pierre, Dr DJENTCHEU Vincent de Paul
|
|
EM2
|
Pr MBANYA Dora , Dr BENGONDO Charles
|
|
EM3
|
Pr NJOYA Oudou
|
|
EM4
|
Pr Kago Innoncent, Dr BISSECK Anne Cecile
|
|
EM5
|
Pr ESSOMBA Arthur
|
|
EM6
|
Dr MBU ENOW Robinson, Dr NSANGOU INOUSSA
|
H) Coordonnateurs des cycles de
spécialisations
|
Coordonnateur General
|
Pr LEKE IVO Robert, Pr KUABAN Christopher
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
|
1
|
Anatomie pathologieque
|
Dr MOAMPEA Marie Claire
|
|
2
|
Anesthésie-Réanimation
|
Pr BINAM Fidele
|
|
3
|
Biologie Clinique
|
Pr KOULLA S.Shiro
|
|
4
|
Chirurgie Générale
|
Pr ESSOMBA Arthur
|
|
5
|
Gyneco-obstétrique
|
Pr NGASSA Pius
|
|
6
|
Médecine interne
|
Pr NJOYA Oudou
|
|
7
|
Pédiatrie
|
Pr ABENA OBAMA Marie Therese
|
|
8
|
Radiologie et Imagerie Médicale
|
Pr NKO'O AMVENE Samuel
|
|
9
|
Santé Publique
|
Dr WANKAH Christion
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
3. DEDICACES
Ce travail est dédié à :
s' Mon Père CHATTE Idekhim.
Papa, c'est l'occasion pour moi de te remercier pour tous les
sacrifices que tu as déployé à l'égard de tes fils.
Toi qui as su orienter chacun dans une discipline en allant de
l'électromécanique à la comptabilité en passant par
la Psychologie, l'informatique, la santé et le marketing. Voici venu le
moment de profiter du fruit de ce travail qui à été
possible grâce à tes prières. Qu'ALLAH te bénisse et
t'accorde une longue vie ;
s' Ma mère Djimié Abdelkerim,
toi qui m'a donné la vie, toi qui m'allaitas,
toi qui gouvernas me premiers pas, O toi ma mère, je
pense à toi. Qu'Allah te bénisse maman et te prête longue
vie. Pour tous les sacrifices consentis à mon égard, trouve ici
l'occasion de réjouissance maman.
s' Mon Grand Frère Abderahmane
Chaté, toi qui a été pour tes frères un
père et un exemple à suivre. C'est l'occasion pour moi de
t'exprimer toute ma reconnaissance d'avoir financé mes études
dès ma première année d'uni-versité. Merci pour les
encouragements et la valeur qui tu m'accorde à chaque instant. Que ce
travail fasse ta fierté.
s' Mes frères et soeurs :
Abdelkerim, Abdelsalam, Abdelaziz, Allamine, Ab-delsamat, Mahmout,
Nouracham, Yaman et khadidja ; vous qui avez fait toujours de ma
réussite votre première occupation, c'est l'occasion pour moi de
vous exprimer ma profonde gratitude pour les sacrifices que vous avez toujours
consentis à mon éducation. Merci encore pour vos encouragements,
vos conseils et votre soutien.
s' Feue ma tante Adjiti et feue ma
petite soeur Adjiti ; vous qui nous avez quitté très
tôt sans goutter le fruit de votre soutien et encouragement. Qu'Al-lah
vous accorde le paradis.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
y' A tous mes oncles,
tantes, cousins, cousines, neveux et nièces. Ce travail est
aussi le fruit de votre soutien tout au long de ma formation. Ne vous laisser
pas surprendre par le temps, sachez que la clé de la réussite
passe par la patience, la volonté et le travail.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
4. REMERCIEMENTS
Je tiens à remercier tout d'abord
ALLAH, le Tout Miséricordieux et le Très
Miséricordieux de ses bienfaits. IL a été pour moi
l'auteur de mes réussites dans toutes mes entreprises.
Au Gouvernement camerounais qui m'a permis
d'étudier dans ce beau pays ;
Au Cameroun notre seconde Patrie et au
peuple camerounais. Je garde pour ce beau pays et pour ce
peuple hospitalier un souvenir indélébile de la solidarité
fraternelle et amicale. L'intégration sous régionale à eu
sa définition stricto sensu au Cameroun, vous m'avez toujours
accepté parmi vous et j'en suis vraiment reconnaissant.
Au Gouvernement tchadien d'avoir
accepté et facilité cette formation
Au Pr KOULLA SINATA SHIRO, vous avez
accepté de superviser ce travail malgré vos multiples
occupations. Il n'aurait pu être réalisé sans vous. Votre
nom sur ce travail lui donne toute sa crédibilité et sa valeur
scientifique. Votre rigueur au travail, votre dynamisme et vos conseils
éclairés m'inspirent une profonde reconnaissance à votre
égard.
Au Dr TOUKAM Michel, vous avez
été pour moi non seulement un encadreur mais aussi un père
durant tout mon séjour au Cameroun. Recevez ici tous mes remerciements
pour les conseils, l'encadrement et la disponibilité que vous avez
consentis à mon égard. Je vous exprime aussi ma profonde
gratitude pour le goût de l'effort et le sens du travail bien fait que
vous avez cessé de m'insuffler.
Au Dr NKOA Thérèse, votre
encouragement, vos conseils et votre encadrement tout au long de ce travail
sont louables. Je vous remercie n'ont seulement d'avoir accepté de
diriger ce travail mais aussi d'avoir mis à ma disposition toutes les
ressources nécessaires pour la réalisation de ce travail.
Au Pr DOH Anderson, Directeur
Général de HGOPY, je vous remercie beaucoup d'avoir
accepté la réalisation de ce travail dans votre institution.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Au Pr TETANYE EKOE, Doyen de la
Faculté de Médecine et des Sciences Biomédicales et toute
l'équipe enseignante et administrative ; merci de m'avoir permis de
suivre cette formation de qualité dans votre admirable institution. Mon
pays vous sera très reconnaissant et je vous assure que j'en ferai bon
usage de cette formation.
Au Pr LOHOUE Julienne, Coordonatrice du cycle
Médico-sanitaire et biomédical, vous qui n'avez
ménagé aucun effort pour la réussite de ce cycle. Je vous
adresse tous mes remerciements pour vos conseils et votre disponibilité.
Au Dr MAHMOUD Youssouf Khayal, Directeur Général
de l'Institut Universitaire des Sciences et Technique d'Abéché
(IUSTA). Merci d'avoir accepté de financer cette formation. Trouvez ici,
l'expression de ma très profonde reconnaissance.
Au Dr Abdelsalam Adoum Doutoum, chef de
département des Sciences Biomédicales et Pharmaceutiques à
l'IUSTA.
A tous les professeurs et personnel de
l'IUSTA
Au Pr Peter NDUMBE, vos conseils et
encouragements m'ont servi de guide durant cette formation ; Je vous exprime ma
profonde reconnaissance.
Au Dr Abdelsalam Tidjani, vous qui n'avez
ménagé aucun effort pour mon inscription à la FMSB, je
vous suis très reconnaissant.
Au Dr NGUEFACK Tsague, PhD Biostaticien FMSB
pour votre assistance lors des analyses statistiques.
Au Dr FOUMANE Pascal,
Gynécologue-obstétricien à HGOPY pour vos conseils et
orientations. Merci d'avoir accepté de lire et d'apporter des
corrections a ce travail. Merci aussi pur les documents que vous m'avez fourni
pour la revue de littérature,
Au Docteur FOKOUA et Dr NKELE pour vos conseils
et orientations
Au Dr ADIOGO Dieudonné pour vos
conseils et orientations qui m'ont permis d'améliorer la qualité
scientifique de ce travail.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
A Mr Awadalkerim Moussa Chahad et sa femme Kawkab
Allamine, Hamit Mht Alio, Ali Biremé, Zakaria Beyine, Amir Moungache
Adoum Djoni, Younous Abdoulaye pour votre hospitalité, vos
conseils et vos encouragements qui me sont très louables. Je me rappelle
encore du bon moment passé ensemble au Cameroun.
Au Dr AMA Vicky et Dr Christian Siaka pour
vos conseils et encouragements. Vous qui avez toujours été
à mes cotés toutes les fois que j'ai un problème
sanitaire. Merci pour votre assistance
A tout le personnel de L'Hôpital
Gynéco-Obstétrique et Pédiatrique de Yaoundé. Je
pense plus particulièrement au personnel de laboratoire de
bactériologie : Mr Paul (major du labo), Mme
GHOYAP Madeleine (chef de paillasse de bactériologie),
Mme BELLA Sylvie, Mme TCHUENTE Jeanne,
Mme Noah et Mme Ndzana (responsable de la salle de
préparation des milieux de culture). Votre contribution de tout genre
à ce travail est remarquable. Ma profonde gratitude à vous pour
l'effort consenti par tous et chacun.
A Mme Marie Thérèse NGAH,
secrétaire du laboratoire, pour votre assistance et
disponibilité
A mon ami Abdelkerim Youssouf Ramadan, nous
avons beaucoup de choses en commun et je t'admire pour ta simplicité ;
merci pour ton soutien et tes conseils.
A tous mes camarades de promotion et plus
particulièrement à Tagnoukam Paul Alain, Kamga Sidze
Larissa, Mapa Tassou Clarisse, Assam Assam Jean Paul, Meli Josiane, Eyoh
Agnès, Lyonga Emilia, Arafa Abdelmouti, Kafando Alexis, Luc Christian,
Fokam Joseph, Chia julios ,Victor Oyono ,Tekue Emmenuel, Djikwe Ingrid, Ndassi
Vicky. Nous avons passé des moments agréables dans un
esprit de fraternité et de solidarité. Je garderai toujours les
beaux souvenirs de ce beau pays.
A mes compatriotes de Bastos, de Bonas et de l'école de
poste. Je pense particulièrement à Talha Djibrine, Ahmat
Diab, Mahamat Adoum, Youssouf
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Khamis, Bahraddine Abakar, Hadjé zara Brahim,
Maryam Achène et tous ceux que je n'ai pas cité ici.
Nous avons passé des moments de joie et de tristesse ensemble. Je vous
remercie pour le climat de solidarité, de fraternité et d'amour
qui a régné entre nous. Trouvez ici, l'expression de ma
très fonde reconnaissance.
A tous ceux que je n'ai pas cités ici et qui ont
apporté leur aide dans toute dimension, recevez ici, tous mes
remerciements.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
5. LISTE DES SIGLES ET ABREVIATIONS
l'AAP: American Academy of Pediatrics
l'ACOG : American College of Obstetricians and
Gynecologists
ADH : Arginine Dihydrolase
ANAES: Agence Nationale d'Accréditation et d'Evaluation
en Santé
API: Antibioprophylactie intra partum
ATCC : American Type Culture Collection
CAMP: Christie, Atkins, Munch et Petreson
CA-SFM : Comité de l'Antibiogramme de la
Société Française de
Microbiologie
CDC: Center for Diseases Control and Prevention
CNRS: Centre National de Recherché en Santé
CO2 : Dioxyde de carbone
CRP : Protéine C Réactive
EMB : Eosine Méthylène Blue
FCSB: Fondation Canadienne de Streptocoque B
GAPDH : Glycéraldéhyde-3 phosphate
déshydrogénase
GBS : Group B Streptococcus
GN : Gélose nutritive
HCY : Hôpital Central de Yaoundé
HGOPY : Hôpital Gynéco Obstétrique et
Pédiatrique de Yaoundé
HGY : Hôpital Général de Yaoundé
INH : Institut National d'Hygiène
IV : Intraveineuse
LCR : Liquide Cephalo Rachidien
Mg : Milligramme
MM : Millimètre
OXOID : Marque deposée
Pastorex BIO-RAD : Marque deposé
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
PCV : Prélèvement Cervico-vaginal
SGB : Streptocoque du Groupe B
SOGC : Société des Obstétriciens et
Gynécologues du Canada VP : Voges Proskaeur
6. LISTE DES TABLEAUX
|
Tableau
|
intitulé
|
Page
|
|
Tableau 1
|
Caractéristiques des infections néonatales à
SGB
|
15
|
|
Tableau 2
|
Traitements recommandés pour l'antibioprophylaxie
intrapartum
|
33
|
|
Tableau 3
|
Antibiotiques utilisés et diamètres critiques
|
43
|
|
Tableau 4
|
Profil de sensibilité des souches des SGB aux
antibiotiques
|
54
|
6. LISTES DES FIGURES
|
Figure
|
intitulé
|
Pages
|
|
Figure 1
|
Approche basée sur un dépistage à 35-37
semaines de gestation
|
32
|
|
Figure 2
|
Approche basée sur les facteurs de risque
|
32
|
|
Figure 3
|
Distribution des cultures selon leur nature
|
48
|
|
Figure 4
|
Fréquence des germes rencontrés en culture mono
microbienne
|
49
|
|
Figure 5
|
Fréquences des germes rencontrés en culture poly
microbienne
|
50
|
|
Figure 6
|
Prévalence du Streptocoque du groupe B
|
51
|
|
Figure 7
|
Distribution du SGB par âge gestationnel
|
52
|
|
Figure 8
|
Distribution des SGB par tranches d'âge
|
53
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
8. RESUME
Dans le but d'évaluer le portage vaginal du
Streptococcus agalactiae en vue de juger de l'opportunité d'une
systématisation du PCV chez la femme enceinte afin de prévenir
les infections néonatales et puerpérales dues à ce germe,
nous avons évalué de manière descriptive, transversale et
prospective le portage vaginal et le profil de sensibilité du SGB aux
antibiotiques.
Objectif : Evaluer la prévalence du
portage vaginal et le profil de sensibilité du SGB aux antibiotiques
chez la femme enceinte.
Méthodologie : Un
prélèvement cervico vaginal à été
réalisé chez toutes les femmes enceintes admises à HGOPY
à cet effet pendant la période allant du 1er Mars au 30
Août 2008.
Deux écouvillons ont été utilisés
à cet effet. L'examen macroscopique réalisé a
décrit d'abord l'état de la paroi et du col et ensuite
l'abondance des leucorrhées, leur aspect, leur couleur et leur odeur. Un
examen microscopique a recherché à l'état frais des
parasites, des cellules épithéliales et des leucocytes. La
coloration de Gram a permis de distinguer les bactéries en Gram positif
(coloration violette) et Gram négatif (coloration rose), leur
morphologie et leur regroupement. Les cultures sur milieux
gélosé(OXOID) ont permis d'isoler des colonies suspectes qui ont
été ensuite purifiées et soumises à des tests
bactériologiques et biochimiques. Le groupage par le test au latex
(Pastorex Strep BIO-RAD) et le CAMP test ont été utilisés
pour l'identification des SGB. L'antibiogramme a été
réalisé sur gélose Müeller Hinton
supplémentée de 5% de sang de mouton defibriné ; Neuf (9)
antibiotiques ont été testés sur chaque souche. Une souche
de Staphylococcus aureus ATCC 25923 a été
utilisée comme référence.
Résultats : Parmi les 142 femmes
enceintes ayant fait l'objet de notre étude, onze (11) étaient
porteuses du SGB soit 7,7%. Le taux de portage du SGB est de 3,8% au premier
trimestre, 7 % au second trimestre et 11,1% au troisième trimestre. Le
germe le plus rencontré dans notre série est Candida
albicans
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
comme on pouvait toujours s'y attendre et représente
pour lui seul 45,16% des germes rencontrés en culture mono microbienne;
le Streptococcus agalactiae occupe la quatrième place avec
8,60% et Escherichia coli la cinquième place avec 4,30%.
Le CAMP test s'est révélé négatif
avec toutes les souches testées.
Quant à la sensibilité aux antibiotiques, toutes
les souches des SGB étaient sensibles à 100% à la
Pénicilline G, à l'Ampicilline, à l'Amoxicilline, à
la Cefotaxime, à la Pristinamycine, à l'Erythromycine et à
la Clindamycine. Par contre les souches étaient sensibles à la
Cefuroxime qu'à 81,81%. Une résistance de 100% des souches
vis-à-vis de la Gentamycine a été observée.
Conclusion et recommandations:
Au terme notre d'étude, il en ressort que le SGB a
été isolé dans les voies génitales chez les femmes
enceintes à HGOPY avec un taux de 7,7%. Le SGB reste encore sensible aux
Pénicillines et aux Macrolides. La réduction du coût du PCV
et le dépistage systématique au dernier trimestre de la grossesse
chez toutes les femmes enceintes semble être la meilleure
stratégie pour prévenir les infections néonatales et
puerpérales dues à ce germe.
9. SUMMARY
In the aim of evaluating a vaginal colonization of
Streptococcus agalactiae, so as to judge the possibility of the
routine vaginal smear (VS) in pregnant women to prevent neonatal and puerperal
infections dues to this micro organism, we carry out a descriptive, cross
sectional and prospective study to evaluate vaginal colonization and the
antibiotics sensitivity profile of Group B Streptococci (GBS)
Objective: Evaluate the prevalence of vaginal
colonization and the antibiotics sensitivity profile of GBS in pregnant
women.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Methodology: From pregnant women coming for
VS at the HGOPY, we collected a cervical-vagina smear during the period
spanning from the 1st of March to the 30th of august
2008. Two swabs were collected from each patient. Macroscopic examination gave
us a description of the cell wall, the cervix and the abundance of discharge,
their color, odor, consistency. Microscopic examination of the specimen was
used to detect directly the presence of parasites, epithelial cells and
leucocytes. Gram stains enable us to distinguish gram positive (violet
coloration) and Gram negative (pink coloration), the morphology and colonies.
Bacteria colonies on agar medium (OXOID) were purified and identified by
bacteriological and biochemical tests. GBS were identified by latex grouping
test (PASTOREX STREP BIO-RAD) and CAMP test. The antibiotic sensitivity test
was done on Müeller Hinton agar medium enriched with 5% of defebriled
sheep blood, each strain was tested with 9 antibiotics. The strain of
Staphylococcus aureus ATCC 25923 was used as reference.
Results: Among 142 pregnant women recruited
for this study, 11 had GBS that is 7.7%. The frequency of GBS was 3.8% within
the first trimester, 7% in the second trimester and 11.1% in the third
trimester. The most encounted germ was Candida albicans as we had
always expected and made up 45.16% of germ isolated from mono microbial
culture. Streptococcus agalactiae was fourth with 8.60% and
Escherichia coli fifth with 4.3%.
CAMP test was negative with all the strains tested.
For antibiotics sensitivity of GBS strains, all were sensitive
with 100% to Penicilline G, to Amoxicilline, to Ampicilline, to Cefotaxime, to
Pristinamycine, to Erythromycine, and to Clindamycine, where as Cefuroxime had
a sensitivity of 81.81%. All the strains were resistant to Gentamycine.
Conclusion and recommendations: From our
results, the various conclusion could be drawn: GBS is present in the vagina to
pregnant women consulting at
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
the HGOPY with a prevalence of 7.7%. Penicillines and
macrolides are still the first choice antibiotic for a GBS infection. Reducing
the cost of VS and doing routine diagnosis during the last trimester of
gestation seems to be the best strategy against neonatal and puerperal
infections due to this germ
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
INTRODUCTION
Le Streptocoque du groupe B (SGB) ou Streptococcus
agalactiae est une bactérie que l'on retrouve chez environ une
femme enceinte sur quatre [Scuchat A et al.;1994]. Bien qu'il
soit un commensal des voies génitales, il pourrait entrainer des
pathologies non seulement chez la mère mais certains bébés
qui sont exposés durant la grossesse, à la naissance ou
après l'accouchement sont victimes de septicémie, pneumonie et de
méningite avec un taux de mortalité pouvant atteindre
20%[Eloy C et al.;1985] . La colonisation vaginale de la
mère par le SGB est associée à l'endométrite, au
chorio-amniotite et à l'infection de plaie et est responsable de 15
à 25 % des états fébriles du post partum [Krohn MA
et al.;1999].
Les premiers cas d'infection néonatale à
Streptocoque du groupe B ont été décrits par Eickhoff et
al. en 1964 [EIckhoff TC et al. 1964]. Et depuis son
émergence en pathologie infectieuse néonatale dans les
années 1970, le SGB est devenu la première cause d'infection
bactérienne sévère du nouveau-né
[Baker
CJ et al.;1973; MacCraken GH et al.;1973].
Malgré les progrès
thérapeutiques, ces infections
néonatales restent associées à une mortalité et une
morbidité importantes de l'ordre de 10 à 20% et plus de 30 % des
enfants atteints de méningite gardent des séquelles neurologiques
importantes (cécité, surdité, retard mental)
[Faxelius G et al. 1988].
En France, selon le communiqué de presse du CNRS du 1er
février 2007, on dénombre chaque année 800 cas
d'infections invasives à SGB chez les nouveaux nés,
majoritairement dues à une transmission de la mère à
l'enfant. La mortalité liée à ces infections reste
élevée (50 à 100 décès par an) et
malgré l'antibiothérapie, 25 à 50% des enfants qui
survivent gardent des séquelles neurologiques [CNRS;
2007].
Au Cameroun, l'implication du SGB dans les infections
néonatales a été démontrée par plusieurs
études. Bernard Bonnin et Tetanye Ekoé notèrent que
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
de 1982 à 1983, le SGB constituait le troisième
groupe de germes après le Pneumocoque et l'Hoemophilus dans
l'unité de pédiatrie de l'HCY et qu'en période
néonatale, il occupait la deuxième place [Bernard B et
al.; 1985]. Kago I. et al. ont souligné que de 1985 à
1988, le SGB était responsable de 26.66% des méningites du
nourrisson de 0 à 2 mois et en 1990 il représente 31,25% des cas
de méningites en période néonatale à l'HCY
. Foumane, dans une étude rétrospective et
descriptive faite à l'HGY de juin 2001 au 31 Mai 2002 montre que le SGB
est bien présent dans nos milieux avec un taux de portage vaginal de
6,70%; sur 194 femmes enceintes [Foumane;2003].
Il ressort de toutes ces observations que le SGB reste l'une
des principales causes des infections néonatales graves et pourtant le
PCV bien que faisant parti du paquet minimum des examens de la femme enceinte
à HGOPY n'est pas prescrit de façon systématique. Pour
prévenir une éventuelle infection du nouveau-né et
réduire ainsi le taux des infections néonatales et
puerpérales dues à ce germe, le statut de la mère pendant
la grossesse et à la naissance doit être connu d'où
l'intérêt de notre étude.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CHAPrTRE r :
QUESTrON DE
RECHERCHE ET
OBJECTrFS
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
I.1 Question de recherche
Streptococcus agalactiae est toujours connu dans son
implication dans les infections néonatales. A notre connaissance, Au
Cameroun une seule étude d'évaluation de la prévalence a
été faite en 2003 par Foumane à l'HGY
[35]. Cette étude a montré un taux de portage
vaginal du SGB de 6,70% chez les femmes enceintes. Une recommandation a
été formulée selon laquelle le PCV ne doit pas être
prescrit de façon systématique compte tenu du coût de
l'examen et de la faible prévalence trouvée.
Depuis lors, aucune autre étude n'a été
faite qui pourrait permettre de recommander ou non le PCV chez la femme
enceinte pour prévenir cette infection gravissime chez le nouveau
né et la mère. Pourtant, le PCV bien que faisant parti du paquet
minimum des examens de la femme enceinte n'est pas prescrit de façon
systématique. C'est ainsi donc que nous nous sommes posé la
question de savoir, faut-il continuer à garder cette attitude sinon quel
est alors le taux de portage vaginal du SGB et son profil de sensibilité
aux antibiotiques chez les femmes enceintes à HGOPY ?
I.2 But de l'étude
Evaluer le portage vaginal du SGB en vue de juger de
l'opportunité d'une systématisation du PCV chez la femme enceinte
pour prévenir les infections néonatales et puerpérales
dues à ce germe.
I.3 Objectif général
Evaluer la prévalence du portage vaginal et le profil
de sensibilité du SGB aux antibiotiques chez la femme enceinte à
HGOPY.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
I.4 Objectifs spécifiques
V' Déterminer la
fréquence du SGB parmi les autres germes rencontrés dans le PCV
chez la femme enceinte;
V' Déterminer la
prévalence globale du portage vaginal du SGB chez les femmes enceintes
;
V' Déterminer la
prévalence de colonisation du SGB selon l'âge gestationnel
V' Etudier le profil de
sensibilité du SGB aux antibiotiques
I.5 Définitions des termes
Antibiotique : substance naturelle ou
synthétique ayant une activité bactéricide ou
bactériostatique
Resistance bactérienne : Croissance
bactérienne en présence d'une concentration d'antibiotique
supérieure à celle qui inhibe la majorité des souches de
la même espèce.
Période néonatale : Période
de la vie extra-utérine allant de la naissance au 28ème jour de
vie.
Période néonatale précoce :
correspond aux sept premiers jours de la vie extra-utérine.
Période néonatale tardive :
S'étant du 8ème au 28ème jour de la vie
extra-utérine
Période post-natale : succède
à la période pernatale et définie la phase de la vie
extra-utérine.
Prématurité : Naissance avant 37
semaines révolues de grossesse
Post terme : Naissance au-delà de 42
semaines de grossesse
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CHAPITRE II :
REVUE DE LA
LITTERATURE
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.1 Définition du Streptococcus agalactiae
Les Streptocoques appartiennent au genre
Streptococcus, de la famille des Streptococcaceae.
Streptococcus agalactiae est l'espèce désignant le
streptocoque ß hémolytique appartenant au groupe B de Lancefield
[Lancefield et al.;1935]. Les Streptocoques du groupe B (SGB)
sont des coques gram positifs de forme ronde et parfois ovoïdes de l'ordre
de 0,6 à 1,2 um de diamètre formant des longues chaînettes
(plus des 10 cellules) ou des courtes chaînettes (moins de 10
cellules).Ils produisent une capsule polysaccharidique[Kasper DL et
al.;1979]. La variété antigénique des
polysaccharides capsulaires constitue la base d'un système de
sérotypage.
Ils sont aéro-anaérobies (anaérobies
facultatifs aéro-tolérants), immobiles, non sporulés,
dépourvus de catalase et d'oxydase. La fermentation des sucres est
homofermentative c'est à dire l'acide lactique dextrogyre est le
principal produit final, sans formation de gaz. Ils poussent sur milieux usuels
enrichis de sang de mouton, sérum et/ou ascite ; le contenu G+C % de
l'ADN est compris entre 33 et 42%. Ils ne résistent pas à un
chauffage de 30 minutes à 60°C [Lancefield et
al.;1935].
II.2 Habitat naturel
Les SGB sont des commensaux du tractus gastro-intestinal et
des voies génitales des femmes chez lesquelles la colonisation est le
plus souvent asymptomatique. Les taux de colonisation peuvent varier selon les
groupes ethniques, les localisations géographiques et l'âge
[Lancefield et al.;1935]. Par ailleurs, le streptocoque B est
également un problème vétérinaire : il est
considéré en Amérique du Nord comme une des principales
causes d'infections mammaires chez les bovins d'où son nom agalactiae
qui signifie absence de lait [Regan et al.;1991].
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.3 Historique et travaux antérieurs
Le nom de Streptococcus (streptus = flexible ; coccus
= grain) fut pour la première fois attribué par Bilroth et
Ehrlich (1877) à des coques formant des chaînettes
observées des blessures infectées. Fehleisen (1883)
décrivit un coque similaire comme agent de l'érysipèle.
En 1879, PASTEUR décrit dans le pus d'un abcès
chaud des microorganismes en grains de chapelet. ROSENBACH leur donne, en 1884,
le nom des Streptocoques [Kago I et al.;1990].
Le Streptocoque bêta-hémolytique du groupe B
(SGB) a été identifié pour la première fois en 1887
par NOCARD et MOLLEREAU dans le lait des vache atteinte de mammite en tant que
germe responsable de la mastite et de l'infection puerpérale bovine,
puis baptisé Streptococcus agalactiae (agalactiae=absence de
lait) par LEHMANN et NEWMANN en 1896 [Gotoff PS et
al.;1978].
En 1933, REBECCA LANCEFIELD classe les différents types
de Streptocoques hémolytiques [Thomas D et al.;1984]
En 1935, LANCEFIELD et HARE ont isolé chez des femmes
enceintes les premières souches appartenant au groupe B
[Lancefield et al.;1935].
En 1938, LANCEFIELD, WILKINSON et EAGON en découvrent
les sous groupes. Toujours en 1938, FRY [Thomas D et al.;1984]
isole le Streptocoque du vagin des femmes asymptomatiques ou
symptomatiques et lui impute certaines infections périnatales
mortelles.
En 1961, HOOD a réalisé la première
investigation épidémiologique de l'infection néonatale
à streptocoque du groupe B [Hood M et al.;1961]
En 1964, EICKHOFF et al. [Francioli et al.;
1983], ont décrit la première série de
septicémies néonatales à SGB, dont les deux formes
cliniques prédominantes, syndrome de détresse respiratoire et
méningite, ne seront toutes fois vraiment reconnues qu'en 1974.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
En 1973, la prévalence de colonisation vaginale et
rectale de la femme enceinte varie de 10 à 15 % en Europe du
Nord et de 20 à 30 % en Amérique du Nord
[Franciosi RA et al.1973].
SOW A. et Denis F [Siegel JD et al.;1982]
avaient fait remarquer en 1979 que le SGB était responsable de
1,8% de l'ensemble des méningites purulentes dans les travaux
publiés en Afrique. Dans leur étude menée en 1987 au
«Gondor College of Medical Séances
(Ethiopie)», Schmidt et al. [Schmidt J et
al.;1989] avaient trouvé un taux de colonisation maternelle par
le SGB de 9% tandis que le taux de colonisation de leur nouveau né
était de 5%.
En France, une enquête multicentrique
effectuée en Île-de-France en 1986 rapporte que le taux de portage
vaginal à S. agalactiae durant la grossesse varie de 8,6
à 13,2 % en fonction des maternités [Lejeune C et al.
1994]
A Brazzaville, Moyen G. et al rapportant les
cas de méningites bactériennes néonatales notèrent
qu'entre 1984 et 1987, le SGB était à l'origine de 19.7% des cas
[Moyen G et al.1990].
Au Cameroun, Bernard Bonnin et Tetanye
Ekoé dans une étude faite de 1982 à 1983 ont montré
que le SGB constituait le troisième groupe de germes après le
Pneumocoque et l'Hoemophilus dans l'unité de pédiatrie de
l'Hôpital Central de Yaoundé (HCY) et qu'en période
néonatale, il occupait la deuxième place [Bernard B et
al.;1985].Travaillant dans le même service de 1985 à
1988, Kago I. et al. ont noté une prédominance des cocci Gram
positif dont 26.66% de SGB, comme cause de méningite du nourrisson de 0
à 2 mois. Ces mêmes auteurs notèrent en 1990 que le SGB
était à l'origine de 31,25% des cas de méningites en
période néonatale [Kago I et al.;1990].
Au Cameroun toujours, Foumane, dans une étude
rétrospective et descriptive faite à l'HGY de juin 2001 au 31 Mai
2002 trouve un taux de portage vaginal de 6,70% sur 194 femmes enceintes.
En Abidjan, dans une étude faite de
1982 à 1988 sur les distributions des Streptocoques dans les produits
biologiques ; le SGB occupe une place non
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
négligeable dans les infections materno-foetales avec
7,3% dans 72,65 % des isolats qui sont d'origine génitale [Kakou
A et al.;1991]
L'OMS note en 1991 que sur plus de 150 millions des femmes qui
sont dans le pays en développement, près de 500 000 d'entres
elles meurent de causes liées à la grossesse avec 10% de cause
attribuée au SGB et 50 millions souffrent d'une complication grave de la
grossesse [OMS;1991].
En Belgique, 150 à 300
nouveau-nés présentent chaque année une infection grave
à SGB et plus de 10 % en meurent ; La prévalence de colonisation
vaginale par SGB a été rapportée à 12 % et vaginale
+ anorectale de 16 % . De 1983 à 1996, ces infections
représentent 36 % des septicémies et méningites
néonatales (0-28 jours) déclarées par un réseau de
laboratoires vigies belges. Comparativement E. coli, S.
epidermidis et S. aureus sont respectivement responsables de 18,
11 et 10 % des septicémies et méningites néonatales
[Dugroffre G;1998]
Au Canada, une étude publiée en
1998 à révélée un taux global de colonisation
à 11% [Seaward PG et al.; 1998] tandis qu'une autre
étude portant sur des populations différentes indiquait un taux
de colonisation de 19,5% [Spaetgens et al.;2002].
En France on dénombre chaque
année 800 cas d'infections invasives chez les nouveaux nés,
majoritairement dus à une transmission de la mère à l'
enfant.la mortalité liée
à ces infections reste élevée (50 à 100
décès par an) et malgré l'antibiothérapie, 25
à 50% des enfants qui survivent gardent des séquelles
neurologiques [CNRS;2007]. Le taux de portage vaginal
était de 10% en 2001 selon l'ANAES [4] et 9,6% en 2003
[Loulergue J et al.2003]
En Tunisie, Une recherche de SGB a
été réalisée en 2006 chez 300 femmes enceintes par
un prélèvement génito-anal et des renseignements
concernant l'étude des facteurs de risques ont été
consignées sur une fiche. Le taux de portage global est de 13% avec 0%
au premier trimestre, 10.2% au second trimestre et 17% au troisième
trimestre [Feriani A et al.;2006].
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.4 Epidémiologie
L'infection au SGB est la plus grande cause d'infections
meningées (infection des fluides et de la membrane du cerveau) et de
septicémie (infection du sang) chez le nouveau-né. Elle est aussi
une cause importante de pneumonie. Elle est d'ailleurs plus répandue
partout dans le monde que plusieurs autres maladies bien connues tel que la
rubéole, la syphilis congénitale et le spina bifida
[FCSB;2005].
II.4.1 Taux de portage maternel
Les chiffres varient considérablement d'un auteur
à un autre pour plusieurs raisons :
En fonction du site de prélèvement le tube
digestif serait le réservoir de germes ; on l'isole plus
fréquemment du rectum. Puis viennent par ordre de fréquence le
méat urétral, la portion inférieure du vagin, la portion
supérieure du vagin et le col. En fonction du nombre de
prélèvement réalisés en cours de grossesse. On
décèle un taux de portage plus élevé en multipliant
les prélèvements. Pour Anthony cités par Thomas D. et
Bolle J., il existe trois catégories des femmes colonisées :
- Les porteuses chroniques (36%)
- Les porteuses intermittentes (15%)
- Et les porteuses transitoires (20%)
La fréquence du portage vaginal varie selon les
populations étudiées et est généralement plus
élevée dans les milieux économiquement
défavorisés [Regan et al.;1991].
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.4.2 Colonisation asymptomatique
Les SGB sont des commensaux occasionnels du tractus
gastro-intestinal et des voies génitales de la femme, 10 % à 30 %
des femmes en sont colonisées [Schuchat A et al. 1994].
Les taux de colonisation peuvent varier selon les groupes ethniques, les
localisations géographiques et l'âge.
En 1973, la prévalence de colonisation vaginale et
rectale de la femme enceinte varie de 10 à 15 % en Europe du Nord et de
20 à 30 % en Amérique du Nord [Francisi RA et
al.;1973].
Ces variations dans les prévalences publiées
sont en partie attribuables à des différences
méthodologiques de culture [Baker CJ et al.;1977] mais
sont surtout associées aux caractères des populations
étudiées. Cette colonisation est dynamique : elle peut être
transitoire, intermittente ou continue. La colonisation est en
général asymptomatique. Seuls des examens bactériologiques
peuvent reconnaître les porteurs de SGB.
II.4.3 Transmission au nouveau né
La transmission au nouveau né se fait de deux
manières : transmission verticale et transmission horizontale.
- Transmission Verticale
Presque la moitié des enfants nés d'une
mère colonisée vont acquérir le SGB dans la période
périnatale mais tous ne font pas la maladie en même temps. Le
nouveau-né peut être colonisé ou infecté par trois
voies différentes [Ancona RJ et al. ;1980/Ferrieri A et
al.;1977] :
y' La voie la plus importante est la
colonisation directe in utero par voie ascendante, le plus souvent après
rupture de la poche des eaux. Cette voix est responsable des formes à
début précoce qui se révèlent au cours des 72
premières heures de vie extra utérine [Duois M et
al.1980] :
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
* soit de type hématogène, directe ou par
placentite choriale responsable d'un tableau de
septicémie.
* Soit de type amniotite transmembranaire ascendante donnant
un tableau d'infection pulmonaire, digestif, méningé mais aussi
septicémie.
'7 Mais le nouveau-né peut aussi acquérir le SGB
par contact ou inhalation lors du passage par la filière
génitale. Cette voix est moins fréquente que la
précédente et serait à l'origine des formes à
début retardé (date de survenue supérieure à 72
heures de vie).l'invasion bactérienne se fait par traversée des
téguments, des muqueuses ou des conjonctives. le risque de transmission
à l'enfant semble lié à l'importance de la colonisation
vaginale [Aber RC et al.;1976].
V' Le dernier mode d'acquisition est la voie sanguine.
- Transmission Horizontale
Le nouveau né peut acquérir le SGB après
la naissance, par contact avec une personne colonisée ou transitoirement
contaminée si les conditions d'hygiène sont mauvaises (lavage des
mains insuffisant) [Aber RC et al.;1976, Paredes et
al.;1977].
La contamination post natale du nouveau né
[75Siegel JD et al. 1982] se fait en maternité ou en
milieu familial. Elle est due à une contamination par la mère
infectée ou colonisée, par un autre nouveau-né porteur, ou
par le personnel soignant (infection manu portée). Ce qui s'explique par
le pourcentage du portage du SGB dans les voies respiratoires
supérieures : 5 à 10% des adultes seraient porteurs au niveau de
leur rhinopharynx [Duois M et al.;1980]. Dans l'enquête
de Yow, le pourcentage d'infirmières porteuses du Streptocoque B montait
jusqu'à 30% ; de plus, pendant le séjour dans le service
d'hospitalisation du Professeur SATGE (Institut de puériculture de
Paris), le pourcentage des
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
porteuses des Streptocoques passait chez les mères de
4,6% à 29% et chez les nouveau-nés de 1,2% à 37%
[Duois M et al.;1980].
II.4.4 Infection chez le nouveau né
Une mère diagnostiquée positive (SGB positive)
et non traitée à 1 risque sur 2 de coloniser son
nouveau-né. En effet, la littérature internationale rapporte une
incidence de l'infection néonatale par le SGB de 1 à 5,4
nouveau-nés pour 1000 naissances vivantes [Clay LS et al.;1996,
Maniatis AN et al.;1996]. Suite à cette colonisation environ
20% développeront une infection au SGB. Cette infection précoce
compte pour environ 75% des cas d'infections néonatales
[61]. En moyenne, 50 % des nouveau-nés issus de
mères porteuses sont colonisés à la naissance
[Maniatis AN et al.;1996].
L'infection chez le nouveau-né présente deux
formes cliniques différentes (cf tableau 1).
Infection précoce ("early onset GBS
disease")
Elle se déclare pendant les cinq premiers jours de vie,
presque immédiatement à la naissance avec une moyenne d'âge
de 1 à 10 heures de vie [70]. Elle se produit
typiquement après la colonisation de l'utérus et/ou du placenta
suite à l'ascension du SGB vaginal [Eickhoff TC et
al.1964]. Elle est caractérisée par le
développement rapide d'une détresse respiratoire
sévère, d'une septicémie avec état de choc, d'une
coagulation intra vasculaire disséminée et d'une
défaillance des organes vitaux. Ce tableau clinique est
éventuellement accompagné d'une méningite
[Faxelius et al.;1988].
En dépit d'une antibiothérapie adéquate,
la mortalité est encore de 5 à 20 % et plus de 30 % des enfants
atteints de méningite gardent des séquelles neurologiques
importantes (cécité, surdité, retard mental)
[Faxelius et al.;1988].
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Infection tardive ("late onset GBS disease")
L'infection tardive se produit dans les premiers mois de vie
au-delà de la première semaine avec une moyenne d'âge d'un
mois, et avec une incidence de 0,5 à 1 cas pour 1000 nouveau-nés
[Schuchat A et al.;11994]. Elle résulte en
général d'une transmission horizontale et affecte le plus souvent
des enfants en bonne santé. Contrairement au sepsis rencontré
dans l'infection précoce, l'infection tardive est
caractérisée par de la fièvre, une
bactériémie et le plus souvent une méningite. L'arthrite
septique, l'ostéomyélite et la cellulite sont d'autres
manifestations de cette forme. Le sérotype III est isolé dans
plus de 90 % des cas. La mortalité est moins élevée que
dans l'infection précoce, mais les séquelles sont beaucoup plus
importantes, en raison de la fréquence des méningites.
Tableau I : Caractéristiques des
infections néonatales à SGB[Melin P et
al.;1999].
|
INFECTION PRECOCE
|
|
INFECTION TARDIVE
|
|
Incidence
|
0,5 à 4 pour 1000
|
|
0,5 à 1 pour 1000
|
|
Début
|
< à 5 jours (moyenne: 1
heures)
|
-10
|
> à 5 jours (moyenne:1 mois)
|
|
Acquisition
|
Transmission verticale
Intrapartum
|
|
Transmission horizontale
A l'accouchement ? Nosocomiale?
Dans la communauté ?
|
|
Caractéristiques cliniques
|
Détresse respiratoire
pneumonie Sepsis
(Méningite : 5-15%)
|
avec
|
Fièvre Bactériémie Méningite
(Ostéomyélite)
|
|
Mortalité
|
5 à 20 %
|
|
10%
|
|
Sérotypes
|
Tous
(surtout III, Ia et II)
|
|
Le III principalement
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.4.5 Infection chez la femme enceinte
Les SGB ont été associés à des
issues indésirables de la grossesse [Regan JA et
al.;1991]. La présence d'une forte colonisation par des SGB a
été associée au travail préterme et à la
rupture prématurée des membranes [Feikin DR et
al.;2001]. La bactériurie à streptocoques du groupe B
survient dans le cadre de 2 % à 4 % des grossesses et est
associée à l'infection urinaire chez la mère, ainsi
qu'à un risque accru de maladie néonatale [Tomas D et
al.;1984]. La colonisation de la mère par le SGB est
associée à l'endométrite, au chorio-amniotite et à
l'infection de plaie et est responsable de 15 à 25 % des états
fébriles du post partum [Krohn MA et al.;1999].
II.4.6 Infection chez l'adulte
Les infections invasives à SGB rencontrées chez
l'adulte sont le plus souvent des infections de la peau et des tissus mous, des
bactériémies sans foyer connu, des bactériémies
à point de départ urinaire, des endocardites, des pneumonies et
des méningites. Le taux de mortalité est élevé et
varie de 20 à plus de 50 % [Schuchat et al.;1994]
II.4.7 Physiopathologie
L'adhésion de bactéries aux cellules de
l'hôte est une étape essentielle qui précède la
plupart des infections bactériennes. Elle permet la colonisation d'une
surface muqueuse ou épithéliale ainsi que l'accroissement de
l'inoculum nécessaire au développement d'une infection.
L'adhésion de Streptococcus agalactiae aux cellules
épithéliales permet la colonisation du rectum puis du vagin de la
femme enceinte (ou non) et constitue la première étape de
l'invasion des cellules de l'épithélium pulmonaire du
nouveau-né [Tamura GS et al.;1994].
Il a été récemment montré qu'une
souche virulente appartenant au sérotype III était capable
d'adhérer spécifiquement à des lignées cellulaires
d'épithéliums humains issus de différents types d'organes
(poumon, cerveau, intestin) [Tamura GS et al.;1994]. Enfin, un
mutant non capsulé adhère plus
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
efficacement que la souche virulente parentale, ce qui
suggère que la capsule, par encombrement stérique ou par
répulsion électrostatique, pourrait gêner l'interaction
d'une « adhésine » bactérienne avec son ligand
[Tamura GS et al.1995].
L'invasion de cellules épithéliales pulmonaires
par une souche virulente de type III et d'un mutant isogénique non
capsulé a été étudiée in vitro sur des
cellules humaines [Hulse ML et al.;1993]et in vivo chez des
nouveau-nés de Macaca nemestrina après inoculation
intra-amniotique de femelles gestantes. Les résultats obtenus ont
montré que le SGB était capable d'envahir les cellules
alvéolaires de l'épithélium pulmonaire et que la capsule
n'était pas impliquée dans ce processus. Ils suggèrent que
cette bactérie pourrait induire son endocytose par des phagocytes non
professionnels (cellules de l'épithélium alvéolaire,
fibroblastes...) et utiliser cette propriété pour transloquer au
travers de la barrière épithéliale pulmonaire, ce qui
permet la dissémination de l'infection par voie systémique. Les
facteurs de virulence impliqués au niveau de cette étape ne sont
pas caractérisés [Rubens CE et al.;1991].
Par ailleurs, un travail récent suggère que le
niveau de production d'hémolysine pourrait contribuer au processus
invasif. En effet, des clichés de microscopie électronique
montrent que l'hyperproduction d'hémolysine entraînerait des
modifications architecturales de l'épithélium pulmonaire :
disparition des microvillosités, désorganisation des membranes
cytoplasmiques et nucléaires, modification de la structure des
organelles, ballonnement du cytoplasme [Nizet V et al.;1996].
Le processus invasif des streptocoques du groupe B pourrait donc impliquer le
franchissement de différentes barrières
épithéliales, pulmonaire et hémato-méningée,
soit par transcytose soit par désorganisation des structures cellulaires
correspondantes [Nizet V et al.;1997]. Certaines souches de
type II et III résistent à la phagocytose puisqu'elles ne sont
pas opsonisées par des antisera correspondants. Cette résistance
à l'opsonisation
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
semble être due à une grande richesse en acide
sialique de la paroi bactérienne [Menget A et
al.;1998].
Le rôle majeur du SGB est lié en
général aux affections des nouveau-nés ; 90 % des cas
présentent une septicémie, 40 % une atteinte pulmonaire et 30 %
une atteinte méningée; la maladie d'apparition précoce
contractée dans l'utérus ou au cours du passage dans le vagin
peut avoir un taux de létalité de 50 %. La maladie d'apparition
tardive, survenant d'une semaine à 3 mois après la naissance,
comporte un taux de létalité de 20 % et prend probablement sa
source dans l'environnement; les sujets qui survivent à la
méningite peuvent être atteints de surdité, de
cécité, de paralysie cérébrale,
d'arriération mentale ou d'épilepsie [[Ferieri Pet al.
1997].
Il ya plusieurs facteurs différents qui peuvent
entrainer un accouchement prématuré, un mort né ou un
avortement spontané (fausse couche) ; mais certains experts de la SOGC
affirment que le SGB peut entrainer un accouchement prématuré
(avant 37 semaine de grossesse), un bébé mort né ou
même causer la perte des eaux. Les infections de l'adulte comprennent la
pneumonie, les infections des voies urinaires; la péritonite, la
méningite, l'endocardite, l'ostéomyélite et rarement la
pharyngite [FCSB;2005]
II.5 Facteurs de risque
Le principal facteur de risque est la colonisation vaginale
maternelle. Le taux d'infection augmente aussi avec le degré de
colonisation : 85 % des enfants développant une infection précoce
sont nés de mères très colonisées
[Tuppurainem et al.;1989].
L'antibioprophylaxie per-partum de l'infection à
SGB est recommandée :
~ en cas de diagnostic de portage de SGB au cours de la
grossesse, à distance ou non de l'accouchement ;
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
~ en cas de bactériurie à SGB au cours de la
grossesse en cours reflétant une faible réponse immunitaire
anti-SGB ;
~ en cas d'antécédent d'infection
néonatale à SGB [Faxelius et al.;1988] ;
~ en l'absence de prélèvement vaginal de
dépistage du SGB, si l'un des facteurs de risque suivants est
présent :
'7 l'accouchement survient avant 37 semaine
d'aménorrhée (SA) (la prématurité) augmente aussi
la vulnérabilité des nouveau-nés à l'infection
à SGB. Le facteur spécifique contribuant est le taux peu
élevé d'anticorps (IgG) dirigés contre les
antigènes capsulaires de type en relation avec un faible transfert
transplacentaire des IgG maternelles à ce stade de la grossesse
[Schuchat et al.; 1994]
'7 la durée de rupture des membranes est
supérieure ou égale à 18 heures [Soper DE et
al.;1989]
'7 ou la température maternelle dépasse
38 °C au cours du travail [Baker CJ;1977]
Il est intéressant de remarquer que le diabète
au cours de la grossesse est associé à des taux accrus de
colonisation par des SGB [Ramos E et al.1997]. Une
étude récente a laissé entendre que le monitorage
intra-utérin constituait un facteur de risque indépendant de
l'infection néonatale à SGB [Adair et
al.;2003].
II.6 Caractères Bactériologiques
Caractères morphologiques
Les bactéries appartenant au genre Streptocoques dont
le Streptocoque agalactiae ou streptocoque du groupe B (SGB) sont des
coques gram positifs ronds parfois ovoïdes de l'ordre de 0,6 à 1,2
um de diamètre formant des longues chaînettes ( plus des 10
cellules) ou des courtes chaînettes ( moins de 10 cellules)
Caractères culturaux
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Streptocoque agalactiae est le Streptocoque du groupe
B qui présente une hémolyse ß sur gélose au sang de
mouton (gélose Columbia supplémentée de 5% de sang de
mouton). Une ß hémolyse est une zone claire, assez large de 3-4mm
autour des colonies mais la zone d'hémolyse est souvent étroite.
Il pousse aussi bien sur milieu chocolat. La température optimale de
croissance est de 35 à 37°C en atmosphère enrichie de 5-10%
de CO2. Le SGB est à croissance aisée sur les milieux de culture
habituels. Les colonies sont bombées, opaques, de 1 à 2 mm de
diamètre.
II.7 Caractères antigéniques
Outre les caractères du genre Streptococcus, la
principale caractéristique de Streptococcus agalactiae est de
posséder l'antigène du groupe B de Lancefield. La paroi de SGB
est constituée d'un peptidoglycane associé à des acides
lipotéchoïques, du polysaccharide du groupe B, de protéines
et du polyoside capsulaire [Kasper DL et al.1979].
Les travaux de Lancefield qui avaient permis, en 1934, de
caractériser l'antigène polysaccharidique de groupe avaient
également mis en évidence trois antigènes capsulaires
alors dénommés de type I, II et III. Depuis, la division du type
I en 3 sous-types (Ia, Ib et Ic) et la caractérisation de trois nouveaux
types (IV, V et VI) ont porté à 8 le nombre de sérotypes
capsulaires. Les sérotypes capsulaires I (Ia et Ib), II, et III ont une
répartition sensiblement équivalente dans les souches
responsables des septicémies néonatales précoces et dans
celles isolées au cours du portage maternel. Il est par contre
remarquable que le sérotype III corresponde à 75 % des souches
responsables d'infections néonatales avec atteinte
méningée et à 80 % des souches responsables d'infections
néonatales tardives [Yaguspsky et al.;1991].
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Parmi les groupes antigéniques désignés
par Rebecca Lancefield par des lettres (de A à H, et de K à V),
les groupes A, B, C ou G caractérisent les espèces de
streptocoques ß-hémolytiques les plus pathogènes. Les
streptocoques alpha-hémolytiques ou non hémolytiques
appartiennent à d'autres groupes et/ou sont non-groupables, et sont
habituellement commensaux [Colman G et al.;1988].
II.8 Caractères biochimiques
Il élabore un certain nombre de produits parmi lesquels
le facteur CAMP (initiales du nom des auteurs qui ont décrit le test en
1944 : Christie, Atkins et
Munch-Peterson) qui est une protéine
diffusible qui, agissant en synergie avec l'hémolysine ß du
Staphylococcus aureus, provoque l'hémolyse des hématies de
mouton [B.carbonnelle et al.;1987], il est variable selon les
Souches [Euzey JP et al.1999].
Un caractère positif est noté pour les tests
suivants : hydrolyse de l'hippurate, ADH, VP, phosphatase alcaline,
acidification du glucose, du glycérol (uniquement en aérobiose),
du maltose, du ribose (réaction parfois faible et lentement positive) et
du saccharose. Un caractère négatif est obtenu
avec les tests de sensibilité à l'optochine, l'hydrolyse de
l'esculine, hydrolyse de la gélatine, hydrolyse de l'amidon,
pyrrolidonyl arylamidase (pyr), acidification de l'arabinose, de l'inuline, du
mannitol, du raffinose, du sorbitol et de la xylose[Euzey JP et
al.1999].
Une réponse variable est observée pour le test
de CAMP et pour les tests hyaluronidase, DNase, bêta-galactosidase,
bêta-glucuronidase, acidification du lactose, de la salicine et du
tréhalose [Euzey JP et al.1999].
La majorité des souches est capable de croître en
présence de 40% de bile mais incapable de cultiver à 45 °C
ou à pH 9,6. Aucune souche ne cultive à 10°C ou en
présence de 6,5% de NaCl.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.9 Diagnostic bactériologique
Le diagnostic bactériologique du Streptocoque du groupe
B est facile et repose sur la mise en évidence de l'antigène du
groupe B de Lancefield.
III.9.1 Prélèvement
Le Prélèvement cervico-vaginal ou PCV doit
être fait dans les conditions rigoureuses d'asepsies indiquées
telles qu'on évite au maximum les contaminations et en ramenant la plus
grande quantité possible des secrétions.
Le prélèvement cervico-vaginal nécessite
que la patiente soit mise en confiance et on doit lui expliquer les conditions
et la simplicité de l'examen et de son utilité.
Mise en place du spéculum
On maintien les petites lèvres écartées
avec deux doigts de la main gauche en évitant la zone sous
urétrale sensible et le clitoris, le spéculum est introduit en
appuyant sur la fourchette, soit perpendiculairement à l'axe de la vulve
directement dans le plan de la cavité vaginale, soit
parallèlement à l'axe de la vulve en tournant de 90° tout en
l'enfonçant pour le ramener dans le plan de la cavité
vaginale.
Après introduction sur 5 à 6 cm, l'ouverture
légère du spéculum permet un control visuel de sa
progression vers le col, selon un axe de 45° par rapport au plan de la
table. Lorsque le spéculum est bien en place, il convient de bien
éclairer le col pour faire les prélèvements convenables.
Une lampe électrique a été utilisée pour
l'éclairage.
II.9.2 Examen macroscopique
On décrit d'abord l'aspect du col et de la paroi
vaginale. La macroscopie des leucorrhées permet d'apprécier leur
abondance leur aspect, leur couleur et leur odeur.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
II.9.3 Examen microscopique
Il est basé sur la morphologie des bactéries,
leur regroupement, leur abondance, leur mobilité, la présence
éventuelle d'un parasite (Trichomonas) à l'aide d'un microscope.
Il constitue l'examen direct qui intègre l'état frais et la
coloration de gram.
II.9.4 Examen direct
L'examen direct intègre l'état frais et la
coloration de Gram
Etat frais
Sur une lame propre, une goutte de sécrétion
vaginale est mélangée avec une goutte de solution saline (eau
physiologique) et recouverte d'une lamelle. La préparation s'observe
à l'objectif à sec (10X ou 40X). Cet examen met en
évidence les cellules vaginales, les leucocytes, les levures et la
mobilité des Trichomonas. On peut aussi apprécier la morphologie
bactérienne et la mobilité de certaines bactéries.
Coloration de Gram
C'est la coloration la plus importante dans le laboratoire de
bactériologie
On précisera la cytologie, la présence des
leucocytes, des levures et des Trichomonas ainsi que l'aspect de la flore
bactérienne vaginale (Flore de Doderleïn composée de
bactéries du genre Lactobacillus) qui est rattachée
à l'un des 4 types décrits ci-dessous :
Type I : présence exclusive de bacilles
de Doderleïn.
Type II : Prédominance nette de bacilles
de Doderleïn.
Type III : présence de bacilles de
Doderleïn, mais prédominance d'autres bactéries (Gram+ et
Gram-)
Type IV : Absence de bacilles de
Doderleïn et présence d'une flore mono ou polybactérienne
(Gram+ ou Gram-).
Les Streptocoques apparaissent sous formes de coques de
couleur violette en petites chainettes ou longues chainettes.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Etapes de la coloration de Gram
V' Fixer le frottis à la flamme
ou à l'alcool
V' Recouvrir le frottis de la
solution du cristal Violet ou violet de gentiane, laisser agir 45 seconde
à 1 minute ;
V' Sans rincer, rejeter le colorant
avec la préparation de lugol, laisser agir une minute ;
V' Rejeter le lugol, sans rincer ;
V' Décolorer à
l'alcool à 95°C ou au mélange
alcool-acetone.la durée de
la décoloration doit être adaptée à
l'épaisseur du frottis. Plus il est épais, plus il a fixé
le colorant au cours des deux premières étapes. L'action de
l'alcool devra être plus longue dans cette éventualité que
lorsqu'on traite un frottis fin. La méthode qui consiste à
laisser couler l'alcool sur le frottis tenu verticalement ou du moins en
position très inclinée, jusqu'à ce que l'alcool
s'écoule non teinté, s'avère à l'usage être
la plus pratique.
V' Rincer à l'eau courante et
recouvrir la lame de la solution de fuchsine diluée ou de safranine,
laisser agir quelques secondes.
V' Rejeter la fuchsine ou la
safranine. Laver abondamment, égoutter, sécher entre deux
feuilles de papier buvard très propres.
V' La lecture se fait à
l'objectif 100X à immersion.
II.9.5 Mise en Culture
Pour un isolement adéquat des streptocoques B, celles-ci
sont cultivées dans une gélose au sang de mouton et une
gélose chocolat.
Les prélèvements (gorge, anus, vagin, liquide
d'aspiration gastrique et prélèvements orificiels chez le
nouveau-né), hémoculture et LCR sont ensemencés en milieux
liquides (bouillon Todd-Hewitt) ou gélosés (Columbia enrichis
avec 5 % de sang). Ces deux types de milieux seront rendus sélectifs
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
par l'addition d'acide nalidixique ou de colistine pour
faciliter l'isolement des Streptocoques du groupe B des
prélèvements polymicrobiens.
Technique d'ensemencement
A partir d'un écouvillon chargé des
sérosités génitales :
1. Faire un ensemencement épais avec
l'écouvillon sur une moitié de l boite de pétri en
imprimant un mouvement de rotation à l'écouvillon. Les stries
d'ensemencement réalisées doivent être serrées et se
recouvrir de telle sorte que toute la demi-surface se trouve
ensemencée.
2. A l'aide de la pointe boutonnée d'une pipette
pasteur ou à l'aide de l'oëse d'une anse de platine,
réétaler un quadrant de la boite en chargeant la pointe sur la
surface ensemencée avec l'écouvillon.
3. Terminer en faisant une strie d'isolement sur le dernier
quadrant sans recharger la pointe de la pipette pasteur.
II.9.6 Identification
Les différentes espèces du genre Streptococcus
peuvent être identifiées grâce à l'utilisation de
quelques épreuves biochimiques et à l'observation de quelques
caractères morphologiques et culturaux. L'interprétation au
laboratoire des résultats des cultures réalisées à
partir des prélèvements cervico-vaginaux doit se faire dans un
sens restrictif, car il importe à tenir compte des renseignements
cliniques trop souvent vagues et de l'examen direct.
En pratique, la présence d'une flore de Doderleïn
abondante est un signe de normalité de l'écologie
bactérienne du vagin et rend inutile l'identification des autres
colonies bactériennes.
a) L'hémolyse autour des colonies
L'identification des streptocoques repose principalement sur
la nature de l'hémolyse autour des colonies isolées sur
gélose au sang.
Le SGB produit une hémolyse de type béta
appréciée sur gélose au sang. Elle apparaît comme
une zone claire, assez large (3-4mm) autour des colonies.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Parfois cette hémolyse est plus distraite et
apparaît plus nettement là où l'anse est enfoncée
dans la gélose en fin d'étalement.
B) Examen direct après culture
Il inclut l'état frais et la coloration de Gram
après culture. Le principe est le même que celui
réalisé avant culture et décrit un peu haut. Il permet de
voir la morphologie des bactéries, leurs mobilités et leur mode
de groupement. Les SGB sont de formes sphériques, immobiles et
regroupés en courtes ou longues chainettes.
C) Le test à la catalase
La catalase est une enzyme qui décompose l'eau
oxygénée ou peroxyde d'hydrogène (toxique pour certaines
bactéries) en eau et en oxygène gazeux. La méthode
consiste à prélever une colonie du germe à étudier
sur l'extrémité d'une pipette pasteur ou aëse de l'anse de
platine que l'on plonge ensuite dans une goutte d'eau oxygénée
à 3%. Le dégagement des bulles gazeuses signent la
présence de l'enzyme. Cette épreuve ne peut être
réalisée sur des colonies qui ont poussées sur
gélose au sang car la moindre trace d'hémoglobine entraine un
dégagement gazeux susceptible de fausser la réaction. Les
Streptocoques sont catalase négative alors que les Staphylocoques sont
catalase positive.
D) Groupage par le test au latex
L'identification définitive d'un streptocoque
â-hémolytique du groupe B repose sur la détection du
polysaccharide de groupe B par différentes méthodes :
précipitation (contre-immuno-électrophorèse, ring-test),
ELISA, immunofluorescence indirecte, coagulation ou agglutination de particules
de latex sensibilisées. L'examen du LCR, du sérum et des urines
pour rechercher le polysaccharide de groupe représente, en cas de
réponse positive, un moyen indirect de faire le diagnostic d'une
infection à streptocoque du groupe B.
E) Le CAMP test
En 1994, Christie,
Atkins, Munch et Petreson mettent en
évidence le comportement hémolytique particulier des SGB.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Staphylococcus aureus producteur d'une
hémolysine (bétalysine) augmente le pouvoir hémolytique du
SGB en présence du CAMP factor élaboré par ce dernier.
L'épreuve se réalise sur une gélose Columbia enrichie de
5% d'érythrocytes de mouton. La souche de Staphylocoque est
ensemencée sous forme d'une strie qui traverse la boite en allant par le
centre. La souche du Streptocoque est ensemencée selon une strie
perpendiculaire à l'ensemencement du staphylocoque et qui s'arrête
à 0.5 cm de celle-ci.
Après une incubation en atmosphère normale et
à 37°C pendant 24h, les souches qui donnent le
phénomène présentent au niveau de l'intersection des zones
hémolytiques :
> Une augmentation de la surface d'hémolyse qui
prend grossièrement une forme trapézoïdale.
Une augmentation de l'intensité de
l'hémolyse.
II.9.7 Antibiogramme
L'antibiogramme des SGB se réalise sur gélose
Müeller Hinton supplémentée de 5% de sang de mouton
defibriné.
Après ensemencement et dépôt des disques
imprégnés à la surface de gélose, les boites sont
incubées à 37°C en atmosphère enrichi de 5 à
10% de CO2 pendant 18 à 24h.
Un gradient de concentration s'établit dans la
gélose, et après 18 à 24h d'incubation, l'inhibition de la
croissance de la bactérie dessine des halos autour des disques
d'antibiotiques. L'arrêt de la croissance à distance du disque se
produit en présence de la concentration minimale inhibitrice de
l'antibiotique. Interprétation des résultats :
trois catégories cliniques ont été retenues pour
l'interprétation des tests de sensibilité in vitro :
y' Les souches dites Sensibles ou S sont celles
pour lesquelles la probabilité de succès thérapeutique est
acceptable dans les cas d'un
traitement par voie systémique avec la posologie
recommandée.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
y' Les souches dites
Résistantes ou R sont celles pour lesquelles il existe
une forte probabilité d'échec thérapeutique quelque soit
le type de traitement.
y' Les souches dites
Intermédiaires ou I sont celles pour lesquelles le
succès thérapeutique est imprévisible.
II.10 Stratégie de prévention
La prévention des infections néonatales à
streptocoques du groupe B n'a pas encore, à ce jour, trouvé de
solutions simples et efficaces. Cependant toutes les stratégies
proposées par des centres de recherche à travers le monde
s'accentuent autours des deux approches théoriques que sont la
vaccination et l'antibioprophylaxie.
1. La vaccination
Des chercheurs ont montré que La vaccination des jeunes
filles ou des femmes enceintes pendant le premier trimestre de la grossesse
préviendrait au plus 85 % des infections néonatales
précoces et tardives. Cette approche rencontre deux principaux
obstacles [Backer CJ et al.;1985]. D'une part, les anticorps
maternels ne traversent pas le placenta avant 32 semaines de gestation : les
grands prématurés, particulièrement sensibles à
cette infection, ne seraient donc pas protégés par cette
stratégie. D'autre part, différentes préparations
vaccinales à base d'antigènes capsulaires polysaccharidiques (peu
immunogènes) des principaux sérotypes (Ia, Ib, II, III et V) sont
toujours en développement et en cours d'évaluation [Baker
CJ et al.1990].
Des nombreux autres travaux sont en cours pour la mise en
place d'un vaccin contre le SGB, la plus récente est l'étude
menée par le laboratoire de Paula Ferreira, de l'Institut des Sciences
Biomédicales Abel Salazar à Porto, en collaboration avec Patrick
Trieu-Cuot, chef de l'unité des pathogènes à gram-positif
à l'institut Pasteur (Unité de génétique et
Biochimie des
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
microorganismes, associés au CNRS)
[CNRS;2007]. Ces chercheurs ont montré que certaines
protéines produites par le SGB sont capable d'interférer avec le
système immunitaire de l'hôte pour faciliter la colonisation
microbienne. Une protéine secrétée par le SGB
nommée GAPDH était capable d'augmenter le taux d'un messager du
système immunitaire, une cytokine IL-10 (Interleukine 10). Son
augmentation a pour effet de diminuer les défenses immunitaires :
l'infection bactérienne invasive est alors facilitée. Des
chercheurs ont montrés que des souris déficientes en IL-10
étaient beaucoup plus résistantes à l'infection par le
SGB. Ces chercheurs ont conclu donc que la GAPDH pourrait être
utilisée dans des approches immunoprotecteurs contre le SGB
[CNRS;2007].
2. L'Antibioprophylaxie
Jusqu'à nos jours, seule l'antibiothérapie
prophylactique per partum a montré son intérêt dans la
diminution de l'incidence de cette pathologie. Cependant chaque centre de
recherche notamment AAP, ACOG, SOGC et CDC recommande sa stratégie. La
plus utilisés actuellement est celle proposée par le CDC.
II.10.1 Recommandations de l'AAP [AAP;1992]
L'approche de l'AAP suggérait un dépistage
recto-vaginal de colonisation à SGB à la fin du deuxième
trimestre de grossesse. Si les mères étaient identifiées
comme colonisées et avaient au moins un autre facteur de risque, l'AAP
recommandait une administration intrapartum d'antibiotique.
II.10.2 Recommandations de l'ACOG [ACOG;1992]
En 1992, l'ACOG a publié des recommandations assez
différentes pour l'identification et le traitement des mères des
enfants à risque de développer une infection précoce.
L'ACOG recommandait de ne pas faire de dépistage prénatal de
colonisation et de traiter toutes les mères présentant des
facteurs de risque de
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
transmission materno-foetale (accouchement
prématuré, rupture prolongée des membranes, fièvre,
signes de chorio-amniotite, grossesse multiple, antécédents
d'infections à streptocoques du groupe B).
II.10.3 Recommandations de la SOGC [JOGC;2004]
La SOGC quand à elle recommandait un dépistage
de l'infection à streptocoques du groupe B entre la 35e et la 37e
semaine de gestation, au moyen d'une mise en culture effectuée à
partir d'un écouvillonnage de la région vaginale, en premier
lieu, et de la région rectale par la suite.
Ensuite une API est administrée à toutes les
femmes diagnostiquées positives au SGB ou ayant un des facteurs de
risque suivant : accouchement prématuré, rupture prolongée
des membranes, fièvre, signes de chorio-amniotite, grossesse multiple,
antécédents d'infections à streptocoques du groupe B
L'efficacité de toutes ces stratégies a
été évaluée et leurs discordances d'attitude ont
conduit à une certaine confusion. En 1996, le CDC publiait des
recommandations reflétant un compromis raisonnable entre ces
différents types de stratégies [CDC;1996].
II.10.4 Recommandations de la CDC [Baker CJ;1990]
A l'issu donc des multiples confrontations dans les choix de
stratégies, le CDC recommande ceci :
Les obstétriciens, en collaboration avec les
laboratoires et les maternités, doivent adopter une stratégie de
prévention de l'infection néonatale précoce à
SGB.
Quelle que soit la stratégie suivie,
1) les femmes enceintes présentant une
bactériurie à SGB, symptomatique ou non, doivent être
traitées au moment du diagnostic et recevoir une
antibioprophylaxie intrapartum;
2) toutes les femmes ayant déjà eu un
nouveau-né infecté par un SGB et
3) toutes les femmes accouchant avant 37 semaines de gestation
devraient aussi
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
recevoir une antibioprophylaxie intrapartum. Pour ces
patientes, les cultures de dépistage sont inutiles.
Ensuite, une des deux alternatives suivantes est proposée
: y' Approche basée sur le dépistage (premier
choix)
Un dépistage ano-vaginal est réalisé chez
toutes les femmes entre les 35-37èmes semaines. Si la culture est
positive, on administre des antibiotiques pendant le travail. Si le statut de
colonisation est inconnu, une antibioprophylaxie intrapartum s'impose en
présence d'un état fébrile (> à 38°C) ou
d'une rupture de la poche des eaux de plus de 18 heures.

Figure i: Approche basée sur un
dépistage à 35-37 semaines de gestation
? Approche basée sur les facteurs de risque
(alternative acceptable)
En plus des trois situations décrites
précédemment, une antibioprophylaxie est aussi indiquée
chez toutes les parturientes qui présentent au moins un des facteurs de
risque suivants : rupture de la poche des eaux de plus de 18 heures ou
température > à 38°C.

Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Figure ii: Approche basée sur les
facteurs de risque
Les propositions d'antibioprophylaxie intra partum
(tableau 2)
Les recommandations du CDC pour l'API sont les suivantes: soit
la pénicilline G en iv, 5 millions U initialement en début de
travail et puis 2,5 millions U toutes les 4 heures jusqu'à
l'accouchement, soit l'ampicilline iv (2 g initialement suivis de 1 g toutes
les 4 heures). La préférence est donnée à la
pénicilline pour son spectre d'activité plus étroit et
à moindre risque de
sélectionner des résistances.
Pour les patientes allergiques à la pénicilline,
la clindamycine (900 mg iv toutes les 8 heures) ou l'érythromycine (500
mg en iv toutes les 6 heures) peuvent être utilisées. Les femmes
recevant déjà des antibiotiques actifs sur le SGB pour le
traitement d'une chorio-amniotite par exemple, ne doivent plus recevoir un
traitement complémentaire par la pénicilline.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Tableau 2: Traitements recommandés pour
l'antibioprophylaxie intrapartum
|
Recommandé
|
|
|
Pénicilline G, 5 mU en IV initialement et puis 2,5 mU
en IV toutes les 4 heures jusqu'à l'accouchement
|
|
Alternative
|
|
|
Ampicilline, 2 g en IV initialement, et puis 1 g en IV toutes
les 4 heures jusqu'à l'accouchement
|
|
Si allergie
pénicilline
|
à
|
la
|
|
|
Recommandé
|
|
|
Clindamycine, 900 mg en IV toutes les 8 heures jusqu'à
l'accouchement
|
|
Alternative
|
|
|
Erythromycine, 500 mg en IV toutes les 6 heures jusqu'à
l'accouchement
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CHAPITRE III :
MATERIEL ET
METHODES
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
III.1 METHODES
3.1.1 Site d'étude
Laboratoire de bactériologie de l'Hôpital
Gynéco Obstétrique et Pédiatrique de Yaoundé
(HGOPY).
3.1.2 Description du site
Situé au Quartier Ngousso à Yaoundé,
l'Hôpital Gynéco-Obstétrique et Pédiatrique de
Yaoundé (HGOPY) est crée le 24 septembre 2001 et inauguré
le 28 Mars 2002. C'est un hôpital public administratif, médical et
technique doté de la personnalité juridique et de l'autonomie
financière. La mission première de cette institution est
d'améliorer la qualité des soins de santé en faveur de la
femme, la mère et l'enfant au Cameroun.
Toute fois, les hommes aussi y sont reçus pour toutes
sortes des consultations mais en externe.
Il offre des possibilités d'hospitalisations avec une
capacité d'accueil de 300 lits repartis entre la pédiatrie,
gynécologie, maternité, les urgences, pédiatrie,
réanimation et la chirurgie. A part les services cités, l'HGOPY
comporte
d'autres spécialités : cardiologie, physiologie,
acupuncture,
l'anatomopathologie, la diététique et nutrition et
la dermatovénérologie.
Le laboratoire d'analyse médicale est centralisé
avec un Ingénieur Biologiste
comme major de toutes les unités et un médecin
biologiste, chef de service du
laboratoire.
3.1.3 Type d'étude
Nous avons utilisé une étude descriptive,
transversale et prospective.
3.1.4 Durée d'étude
La collecte et l'analyse des échantillons se sont
déroulé à l'HGOPY pendant
une période de 6 mois (du 1er Mars au 30 Août
2008).
3.1.5 Taille de l'échantillon
Selon la littérature, la prévalence de la
colonisation vaginale est estimée à
10%. Nous avons utilisé la formule de LORENTZ :
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
n=Z21-á [p (1-p)/i2]
Avec P : prévalence relative empruntée dans la
littérature 10%= 0.1
á = 5%
i : précision 5%= 0.05
1-á : intervalle de confiance 95%
Z est la déviation standard et Z1-á=1.96
On aura donc n =138,2976~139
La taille de notre échantillon est estimée
à 139 femmes enceintes ; nous en
avons recruté 142.
3.1.6 Méthode d'échantillonnage
Nous avons utilisé un échantillonnage
consécutif non exhaustif et non
probabiliste. Toute femme enceinte admise à HGOPY pour un
PCV pendant la
période allant du 1er Mars 2008 au 30 Août 2008 et
répondant à nos critères est
incluse dans notre échantillon.
3.1.7 Critères d'inclusion
Toute femme enceinte admise à l'HGOPY pour un PCV quelque
soit l'âge de
la grossesse.
3.1.8 Critères d'exclusion
~ Femme enceinte sous antibiotique
~ Femme enceinte qui refuse volontairement de participer
à
l'étude
3.1.9 Procédure de recueil des données
Les données sont recueillies sur fiches
standardisées préétablies dont un
exemplaire est accroché en annexe. Les patientes sont
recrutées sur base des
critères d'inclusion ; les différentes
étapes sont :
y Informations de la cliente sur le but
et les objectifs de l'étude
y Identification et interrogation de la
patiente
y Signature de la fiche de
consentement éclairé une fois le
questionnaire rempli
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
3.1.10 Procédure des collectes des
échantillons
Une fois que la patiente fini de remplir le questionnaire nous
avons procédé au prélèvement.
Prélèvement : Deux
écouvillons stériles ont été utilisés
à cet effet ; un pratiqué sur la paroi vaginal incluant le
balayage des parois de la moitié inferieure du vagin jusqu'au vestibule
et la vulve (recommandations de l'ANAES) pour charger au maximum
l'écouvillon avec les secrétions vaginales. Un second
écouvillon pour l'exocol et le cul de sac postérieur.
L'échantillon recueilli est soumis rapidement aux
analyses
3.1.11 Procédure d'analyse des
échantillons
3.1.11.1 Examen macroscopique
Nous avons d'abord décrit l'aspect du col et de la paroi
vaginale et ensuite apprécié l'abondance des leucorrhées,
leur aspect, leur couleur et leur odeur. 3.1.11.2 Examen
microscopique
Examen direct avant culture
Il intègre l'état frais et la coloration de Gram
a) Etat frais
Il est réalisé entre lame et lamelle sur des
leucorrhées à partir du spéculum de
prélèvement. Nous avons apprécié la morphologie des
bactéries, leur mobilité, la présence éventuelle
d'un parasite (Trichomonas), des levures et des cellules
épithéliales.
b) Coloration de Gram
La coloration de Gram à été
réalisée pour départager les bactéries en gram
positif (coloration violette) et gram négatif (coloration rose),
apprécier leur morphologie (cocci ou bacille ou levure)
Cet examen nous a aussi parmi de voir des cellules
épithéliales colonisées par des coccobacilles qui prennent
mal la coloration de Gram « clue cells ». La
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
présence des clue cells oriente vers Gardnerella
vaginalis qui sera ensuite confirmé par le test à la
potasse
Remarque : La coloration de Gram a
été faite après l'ensemencement pour éviter la
contamination de notre produit d'analyse.
3.1.11.3 Mise en Culture
Les deux écouvillons qui contiennent
l'échantillon sont ensemencés sur une gélose au sang de
mouton, EMB, Sabouraud Chloramphenicol, Gélose nutritive (GN) et une
gélose chocolat(OXOID).
Les boites de GN, EMB et Sabouraud Chloramphenicol sont
incubées à l'étuve à 37°C pendant 18 à
48h. La gélose au sang et la gélose chocolat sont d'abord mises
dans une jarre en atmosphère enrichi de 5 à 10% de CO2 et ensuite
incubées à l'étuve à 37°C pendant 18 à
48h.
3.1.11.4 Identification
L'identification repose sur l'aspect des colonies sur la
gélose et l'hémolyse autour des colonies sur gélose au
sang pour les Streptocoques Béta-hémolytiques.
Examen direct après culture
Celui-ci inclus toujours l'état frais et la coloration
de Gram. Il a été réalisé pour apprécier la
mobilité et la morphologie des bactéries. La coloration de Gram
après culture est faite pour voir la disposition des bactéries
(en amas, en chainette, isolé ou en double) et leur coloration :
violette (Gram positif) et rose (Gram négatif).
A- Pour les cocci : Bactéries à
Gram positif apparaissant en chainette (courte ou longue) ou en amas.
Le test à la catalase sur lame est
réalisé pour départager les Staphylocoques (catalase
positive) et les Streptocoques (Catalase négative)
Le test à la catalase
C'est une enzyme qui décompose l'eau
oxygénée ou peroxyde d'hydrogène (toxique pour certaines
bactéries) en eau et en oxygène gazeux.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
-Technique : Nous avons déposé
une goutte d'eau oxygénée à 3% sur une lame propre et
ensuite prélevé une colonie que nous avons déposée
sur la goutte d'eau oxygénée. La lecture est immédiate. La
présence des bulles d'air visible à l'oeil nu signe la
présence de l'enzyme. Les Streptocoques sont catalase négative
alors que les Staphylocoques sont catalase positive.
Remarque : Nous avons utilisés les
bactéries qui ont poussées sur autre géloses que la
gélose au sang à cause de l'action catalasique
de l'hémoglobine donnant un résultat faussement positif.
1. Les Streptocoques :
Les cocci catalase négative sont repiqués dans
une gélose chocolat et une gélose au sang pendant 18 à 24h
pour la suite de l'analyse (groupage par le test au latex, le Camp test et
l'antibiogramme s'il s'agit des SGB)
a) Le groupage par le test au latex :
Nous avons utilisé le PASTOREX STREP kit de BIO-RAD
pour identifier les différents groupes des Streptocoques
beta-hémolytiques groupables selon Lancefield : A, B, C, F, G et D.
- Préparation des extraits
~ 5 à 10 colonies des SGB ont été
prélevées et mises dans un tube
à hémolyse
contenant 300 ul de solution d'extraction enzymatique ;
~ Le mélange est incubé à 37°C
pendant 15 minutes en l'agitant
toutes les 5 minutes.
- Identification
~ chaque flacon est agité pour remettre en suspension
les
particules de latex ;
~ une goutte de chaque latex est déposée dans les
cercles de la
carte d'agglutination.
~ A l'aide d'une pipette, une goutte d'extrait a
été déposée
dans chacun de ces cercles ;
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
~ le contenu de chaque cercle est
homogénéisé à l'aide d'un
bâtonnet que nous avons changé pour chaque
réaction ;
~ la carte est agitée selon un mouvement orbital pendant
une
minute maximum et le résultat est observé à l'oeil
nu.
Résultat : La formation des
agglutinats rouge sur fond vert au niveau de l'un des cercles signe un
résultat positif. L'absence d'agglutination avec l'un des
réactifs déposé dans les cercles est noté
Streptocoque non groupable.
Les souches ayant agglutinées avec le réactif B
sont soumis à une épreuve de CAMP test.
b) Le CAMP test
Nous avons réalisé l'épreuve d'abord sur
une gélose Columbia enrichie de 5% d'érythrocytes de mouton,
ensuite sur une gélose au sang avec comme base le Blood Agar Base et
enfin sur une gélose nutritive supplémentée de 5% de sang
de mouton.
La souche de Staphylococcus aureus est
ensemencée sous forme d'une strie qui traverse la boite en allant par le
centre. La souche du Streptocoque B à tester est
ensemencée selon une strie perpendiculaire à l'ensemencement du
Staphylococcus aureus et qui s'arrête à 0.2 cm de
celle-ci. Nous avons utilisé d'abord une souche de Staphylococcus
aureus ATCC 25923 et ensuite une souche de Staphylococcus aureus
isolée au laboratoire.
Les boites sont d'abord incubées en atmosphère
normale à 37°C pendant 18 à 24h, puis en atmosphère
enrichie de 5 à 10% de CO2 pendant 24h,
2. Les Staphylocoques :
Les colonies des Staphylocoques sont des cocci en amas,
catalase positive. Le diagnostic d'espèce est réalisé
à l'aide des certains test biochimiques : Ensemencement sur milieu
Chapman (fermentation du mannitol), Coagulase, Oxydase et DNase.
B. Pour les Entérobactéries
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Nous avons utilisés d'abord l'identification basée
sur les caractères commun
des entérobactéries (bactéries à
Gram négatif, mobilité peritriche ou immobiles, catalase positif,
oxydase négative), la recherche de l'Oxydase a été faite
par la méthode des disques. Ensuite, Les caractères biochimiques
ont été déterminés par ensemencement de la galerie
Api 20E (Biomérieux )
C. Pour les levures :
Pour identifier le genre Candida albicans, Nous avons
utilisés la technique de filamentation dans le sérum.
Technique :
Quelques colonies ont été
prélevées et mises dans un tube contenant 0.5 ml de sérum
humain. Le mélange est incubé à 37°C pendant 3
heures. La lecture a été faite entre lame et lamelle à
l'objectif 40X.
Résultat : La présence d'un
tube germinatif ou filamentation indique la présence de C. albicans
et l'absence de filamentation signe la présence de Candida
spp.
3.1.11.5 ANTIBIOGRAMME DES SOUCHES DES SGB ISOLEES
Nous avons réalisé l'antibiogramme sur
gélose Müeller Hinton supplémentée de 5% de sang de
mouton defibriné (Plasmatec). La méthode de diffusion en
gélose a été utilisée.
Préparation de l'inoculum
Quelques colonies sont prélevées et
émulsionner dans un tube en verre contenant 5 ml de l'eau physiologique.
L'opacité de l'inoculum est ajusté à l'échelle 0,5
Mac Farland (environ 108 UFC/ml). Une autre dilution de l'inoculum au 1/10
à été réalisée conformément aux
recommandations du CA-SFM
Technique d'ensemencement
Nous avons utilisé la méthode de Kirby-Bauer ou
ensemencement par écouvillonnage sur des boites de pétri de 90 mm
de diamètre. Deux boites de pétri ont été
utilisées pour chaque souche. 5 disques imprégnés
d'antibiotique
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
sont déposés dans la première boite et 4
autres disques dans la seconde boite. La distance entre les disques
était de 2 cm.
Incubation
Les boites ensemencées sont mises dans une jarre et
incubées dans une étuve bactériologique à 37°C
en atmosphère enrichi de 5 à 10% de CO2 pendant 18 à
24h.
Le tableau 3 indique les disques d'antibiotiques
utilisés avec leurs concentrations et leurs valeurs critiques ainsi que
les diamètres critiques du Staphylococcus aureus ATCC 25923,
souche utilisée comme référence pour le contrôle de
nos disques et milieux.
Les disques sont choisis selon les recommandations du
Comité de l'Antibiogramme de la Société Française
de Microbiologie (CA-SFM édition de janvier 2008)
Tableau III : Antibiotiques utilisés et
diamètres critiques
|
ANTIBIOTIQUE
|
SYMBOLE (Oxoid)
|
CONCENTRATION
|
DIAMETRE CRITIQUE en mm
|
Staph aureus ATCC 25923
|
|
S
=
|
R
<
|
|
PENICILLINE G
|
P
|
10U (6tg)
|
29
|
8
|
31-38,5
|
|
AMOXICILLINE
|
AML
|
25 tg
|
21
|
14
|
|
|
AMPICILLINE
|
AMP
|
10 tg
|
19
|
14
|
27-35
|
|
CEFOTAXIME
|
CTX
|
30 tg
|
26
|
23
|
25-31
|
|
CLINDAMYCINE
|
Da
|
2 tg
|
15
|
15
|
24-30
|
|
ERYTHROMYCINE
|
E
|
15 tg
|
22
|
17
|
26,5-31,5
|
|
PRISTINAMYCINE
|
PT
|
15 tg
|
22
|
19
|
26,5-32,0
|
|
CEFUROXIME
|
CXM
|
30 tg
|
25
|
22
|
|
|
GENTAMYCINE
|
CN
|
10 tg
|
18
|
16
|
19-27
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Tous les disques utilisés sont de marque OXOID sauf la
Pristinamycine qui est de marque BIO-RAD.
3.1.12 Conservation des souches
Les souches des SGB isolées sont conservées dans un
milieu liquide lactosé ( conservation longue durée) et dans une
gélose chocolat coulée en tube (pour une conservation courte
durée) puis gardées dans un congélateur à
-80°C. 3.1.13 Analyse des données
V' Les données collectées ont fait l'objet
d'une analyse avec le logiciel Microsoft Word et Excel 2007.
V' Les résultats sont présentés
sous formes des chiffres, tableaux et figures.
III.2 MATERIEL
Le matériel utilisé est divisé en quatre (4)
groupes :
3.2.1 Matériel de collecte des données
V' Fiches techniques de recherche
V' Stylo à bille
3.2.2 Matériel de prélèvement
V' Table gynécologique
V' Lampe électrique à bras flexible pour
éclairer les voies génitales
V' Plateau
V' Gants de soins
V' Ecouvillons stériles
V' Spéculum stériles
V' Alèse en papier à usage unique
V' Marqueur et stylo à bille
V' Portoir
V' Eau physiologique
ü
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Poubelle
ü Eau de javel
3.2.3 Matériel d'analyse et de conservation
Matériel pour préparation des milieux de culture
ü Autoclave
ü Balance
ü Réfrigérateur à 4°C
ü Spatule
ü Fiole jaugée
ü Bec bunsen
Matériel pour examen direct :
ü eau physiologique
ü lames et lamelles
ü Microscope binoculaire
ü huile à immersion
ü violet de gentiane
ü lugol
ü fuchsine
ü Alcool à 95°C Matériel pour la
mise culture
ü Anse de platine
ü Boite de pétri de 90mm
ü Milieux de culture en poudre (Gélose columbia,
Blood Agar Base, Müeller Hinton, Gélose nutritive, EMB, Chapman,
Sabouraud chloramphenicole
ü portoir
ü Marqueur
ü bec bunsen
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
V' Etuve à 37°C
Matériel pour identification et
antibiogramme
V' Pastorex Strep kit (BIO-RAD).
V' tube à essai
V' Pipettes pasteur
V' Micropipette
V' pissette
V' Bouteille à gaz
V' eau de javel
V' disque d'antibiotiques
V' Registres et fiche de pointage
V' Pince.
Matériel de conservation des souches
V' Milieu liquide lacotsé
V' Cryotubes
V' Congélateur
V' Gélose chocolat coulée en tube
3.2.4 Matériel d'analyse des données
V' Ordinateur
V' imprimante
V' Fiches de collecte des données
V' Logiciels ( Microsoft Windows et Excel 2007)
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CHAPITRE IV :
RESULTATS
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Du 1er Mars au 30 Août 2008, 142 femmes enceintes ont
été prélevées pour un PCV à l'HGOPY. Ces
femmes ont été recrutées sur base des critères
d'inclusion et d'exclusion par un échantillonnage consécutif non
exhaustif et non probabiliste.
La moyenne d'âge de nos patientes est de 27,03#177;5,53
ans avec 17ans pour la plus jeune et 41 ans pour la plus âgée.
P N Nombre des
PCV
Fréquence des germes rencontrés
:
Culture mono microbienne
Culture poly microbienne
Absence des germes Pathogènes
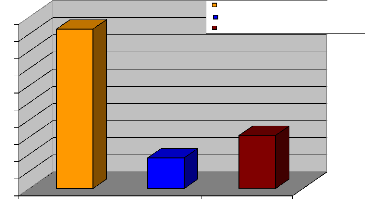
100
40
20
90
80
70
60
50
30
10
0
93
18
Absence des germes pathogènes
Culture monomicrobienne
Culture polymicrobienne
31
Nature des cultures
Figure iii : Distribution des cultures selon
leur nature
On note que 31 femmes, soit 21,8% n'ont aucun germe
pathogène, 18 femmes, soit 12,7% sont porteuses d'au moins deux germes
et 93 femmes soit 65,5% sont porteuses d'au plus un germe.
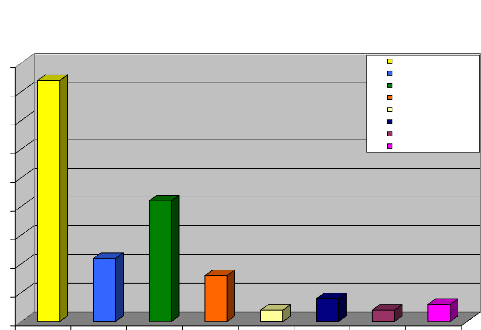
Nombr e des PCV
45
40
35
30
25
20
15
10
5
0
45,16%
11,82%
22,58%
8,60%
2,15%
4,30% 3,22%
2,15%
Candida albicans Candida spp Gardnerella vaginalis
Streptocoque B Autres Streptocoques E.coli
S.aureus
Autres Entérobactéries
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Candida Candida spp Gardnerella Streptocoque B Autres
E.coli S.aureus Autres
albicans vaginalis Streptocoques
Entérobactéries
Germes rencontrés
Figure iv: Fréquence des germes
rencontrés en culture mono microbienne
Le germe le plus rencontré dans le PCV est Candida
albicans et représente pour lui seul 45,16% ; vient ensuite
Gardnerella vaginalis avec 22,58%, Candida spp occupe la
troisième place avec 11,82% le SGB occupe la quatrième place avec
8,60% et Escherichia coli occupe la cinquième place avec un
taux de 4,30%.
Le autres Streptocoques sont constitués d'une souche de
Streptocoque du groupe A et une souche de Streptocoque non
groupable. Les autres Entérobactéries sont constitués
d'une souche de klebsiella pneumoniae, une souche de Citrobacter
koseri et une souche de Pantaea spp
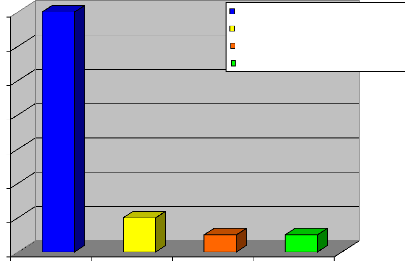
14
12
10
4
8
6
2
0
77,79%
11,11%
5,55% 5,55%
SGB et C. albicans
SGB et E.cloacae
C. albicans, G. vaginalis et S.aureus
C. albicans et G. vaginalis
C. albicans et G. vaginalis
|
SGB et
C. albicans
Germes
|
SGB
et E.cloacae
rencontrés
|
C. albicans, G. vaginalis et S.aureus
|
Nombre des PCV
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Figure v: Fréquences des germes
rencontrés en culture poly microbienne
Candida albicans et Gardnerella vaginalis
occupent la première place avec 77,79%. Deux souches de SGB sont
retrouvées avec Candida albicans et représentent 11,11%
; une autre souche de SGB a été retrouvée avec
Enterobacter cloacae (5,55%) et enfin une souche de Staphylococcus
aureus a été retrouvée avec Candida albicans
et Gardnerella vaginalis.
2. Portage vaginal et profil de sensibilité
du Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Prévalence globale du portage vaginal du
SGB
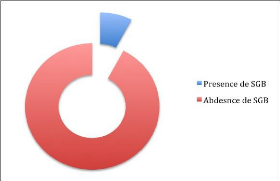
131
11
Figure vi: Prévalence du Streptocoque du
groupe B
Des 142 femmes enceintes, 11 soit 7,7% sont porteuses du SGB.
131 autres portent ou non autres germes que le SGB.
3.
p i at
a
obmN
No
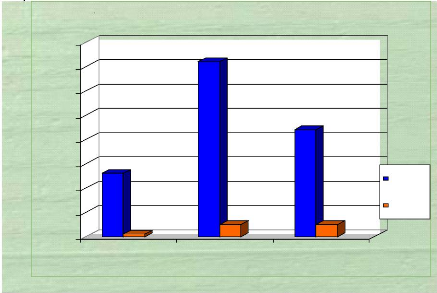
ent es
bre de s
Fréquence du SGB par âge
gestationnel
80 70 60 50 40 30
20
7%
11, 1%
Absence du SGB
10
Presence du SGB
3, 8%
0
Trimestre 1 Trimestre 2 Trimestre 3
Trimestre de grossesse
Figure vii: Distribution du SGB selon
l'âge gestationnel
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Le taux de portage du SGB est élevé au
troisième trimestre de grossesse (5 patientes sur 45 soit 11,1%) par
rapport aux deux premiers trimestres. Au second trimestre, 5 sur 71 soit 7% des
patientes étaient porteuses et une seule sur 26 soit 3,8% était
porteuse au premier trimestre.
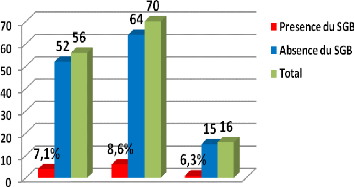

Figure viii: Distribution des SGB par tranches
d'âge
Nous remarquons que le portage du SGB par tranches d'âge
est fonction de la taille des échantillons constituant les tranches.
Plus il ya d'individus, plus le portage est important ([25-33]) et moins il ya
des individus, moins le portage est important ([34-42])
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
RESULTAT DU CAMP TEST
Avec toutes les souches testées, nous n'avons
remarqué aucune augmentation de l'hémolyse au niveau de la zone
d'intersection de la souche à tester du SGB et celle du
Staphylococcus aureus ; ce qui signe un résultat négatif.
L'aspect du CAMP test réalisé avec toutes nos
souches de SGB isolées dans notre étude est accroché en
annexe.
ANTIBIOGRAMME
Tableau 4: Profil de sensibilité des
souches des SGB aux antibiotiques
|
ANTIBIOTIQUES
|
Concentration du disque
|
Nombre des souches
|
|
Sensibles
|
Intermédiaire s
|
Résistantes
|
|
PENICILLINE G
|
10U (6ug)
|
11(100%)
|
00(00%)
|
00(00%)
|
|
AMOXICILLINE
|
25 ug
|
11(100%)
|
00(00%)
|
00(00%)
|
|
AMPICILLINE
|
10 ug
|
11(100%)
|
00(00%)
|
00(00%)
|
|
CEFOTAXIME
|
30 ug
|
11(100%)
|
00(00%)
|
00(00%)
|
|
CLINDAMYCINE
|
2 ug
|
11(100%)
|
00(00%)
|
00(00%)
|
|
ERYTHROMYCINE
|
15 ug
|
11(100%)
|
00(00%)
|
00(00%)
|
|
PRISTINAMYCINE
|
15 ug
|
11(100%)
|
00(00%)
|
00(00%)
|
|
CEFUROXIME
|
30 ug
|
09(81,81%)
|
02(18,18%)
|
00(00%)
|
|
GENTAMYCINE
|
10 ug
|
00(00%)
|
00(00%)
|
11(100%)
|
Toutes les souches étaient sensibles à 100% aux
Macrolides représentés par la Lincomycine, la Clindamycine et
l'Erythromycine. Elles étaient aussi sensibles à 100% aux
Béta-lactamines représentés par la Pénicilline G,
l'Amoxicilline, l'Ampicilline. La Cefuroxime s'est révélée
efficace qu'à 81,81% : deux souches étaient à
sensibilité intermédiaire.
Par contre toutes les souches étaient
résistantes aux Aminosides représentés par la Gentamycine
avec un taux de 100%.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CHAPITRE V
DISCUSSION
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
1. Fréquence des germes rencontrés dans
les PCV
Le germe le plus rencontré dans notre série est
Candida albicans comme on pouvait toujours s'y attendre et
représente pour lui seul 45,16% des germes rencontrés en culture
mono microbienne et 77,79% avec Gardnerella vaginalis en culture poly
microbienne. Fari A et al. affirment que ce germe est en effet
celui qui est le plus souvent rencontré dans les vaginites même en
dehors de la grossesse.
Cette fréquence de Candida albicans
trouvée dans notre étude est légèrement
inferieure à celle trouvée par Maniatis AN. et al.
qui est de 54.1% chez 6226 femmes enceintes. Par contre elle avoisine
celle rapportée par Foumane à l'HGY (48,45% des patientes sur 192
femmes enceintes). B. Balaka et al. au Togo trouvent un taux
de 33,3% qui est inferieur au notre.
Les autres germes rencontrés en culture mono
microbienne chez les femmes enceintes sont : Gardnerella vaginalis qui
représente 22,58%. Ce taux avoisine celui de Maniatis AN. et al.
qui est de 27.2% ; le SGB occupe la troisième place avec 8,60%
et Escherichia coli occupe la 4ième place avec 4,30%. En
culture poly microbienne le SGB et Candida albicans occupe la
deuxième place avec 11, 11% et 5,55 % avec Enterobacter
cloacoe.
Le taux élevé de Candida albicans,
Gardnerella vaginalis et la présence des autres germes peut
être expliqué par les conditions de vie difficiles rendant
beaucoup des femmes sujettes à des conditions d'hygiènes
dérisoires, créant ainsi des vaginites facilitées par
l'usage intempestif d'antiseptiques qui baisse le PH du vagin, ce qui
entrainera la montée des germes vers le haut appareil d'emblé
stérile. Soit par une mauvaise hygiène ; soit par l'utilisation
abusive des antibiotiques à large spectre.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
2. Taux du portage vaginal du SGB
Au terme de notre étude, un taux de portage vaginal du
SGB de 7,7% a été retrouvé chez les femmes enceintes. Ce
taux est moins important que celui retrouvé au Canada par
Seaward PG et al. en 1998 qui est de 11%; Il est de 12 % en Belgique
pour SCHUCHAT A. et al. en 2000; Ce chiffre est aussi moins
important que celui retrouvé en France par l'ANAES en 2001 qui est de
10% [ANAES;2001] alors qu'en 2003, le taux est rapporté
à 9,6% par Joelle Loulergue et al. Par contre,
Feriani A. et al. ont trouvé quant à eux un taux
de 13% en Tunisie en 2006. La plus part des auteurs donnent un
taux de portage vaginal variant entre 10 et 40% [Bevilacqua et
al.;1999; Clay LS et al.;1996; Horvath B et al.;1998; Maniatis AN et
al.;1996], d'autres par contre donne un taux de prévalence qui
oscillent entre 12 et 15 % [Rosa F et al. 1999 ; Gil EG et al.; 1999 ;
Claeys G et al.;2001; Cueto M et al.;1995].
Par contre le taux trouvé dans notre série
avoisine celui de 6,70% [35] trouvé par Foumane
à l'Hôpital Général de Yaoundé ; il est par
conséquent cohérent avec la prévalence obtenue en Abidjan
par A. Kacou et al. qui est de 7.3% et est aussi proche de
celle de Schmidt et al. en Ethiopie qui est 9% ;
Bagnani A et al. ont trouvé aussi un taux de
prévalence avoisinant le notre qui est de 8,18%. En France, dans une
étude multicentrique (23 centres) ayant fait une étude de
prévalence et d'antibiogramme sur le SGB en 2003, Joelle
Loulergue et al. rapportent que la prévalence varie selon les
centres et se situe entre [5,1 à 22,5%], les centres N° 6, 7 et 8
ont trouvé des taux de prévalence semblables au notre avec
respectivement 7% (sur 127 femmes enceintes) , 7,6% (sur 52 femmes enceintes)
et 7,7% sur 195 femmes enceintes.
Dans la mesure où les différentes études
n'ont pas suivi un même protocole au sens strict pour l'identification du
SGB, l'utilisation des différentes méthodes pourrait bien
expliquer les variations des prévalences constatées. Ainsi, si un
élément technique explique ces variations, il faut probablement
le chercher dans
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
la qualité du prélèvement, de la mise en
culture et des techniques d'identifications.
3. Distribution du SGB selon l'âge
gestationnel
Nous avons évalué le taux de portage vaginal par
trimestre de grossesse ; il est élevé au troisième
trimestre avec 11,1% tandis qu'au deuxième et premier trimestre il
représente respectivement 7% et 3,8%. Ces taux trouvés dans notre
série concordent avec ceux de FERIANI A et al. en 2006
sur leurs 300 femmes enceintes en Tunisie qui ont trouvé un taux de 0%
au premier trimestre, 10,2% au second trimestre et 17% au troisième
trimestre.
La variation des taux de portage vaginal par trimestre de
grossesse pourrait être due aux modifications hormonales survenant au
cours de la grossesse.
4. Profil de sensibilité des souches des SGB
isolées aux antibiotiques
Neuf (9) disques d'antibiotique ont été
testés sur chacune des 11 souches des SGB isolées. Ces disques
sont choisis selon les recommandations de la CA-SFM (janvier 2008).
Toutes les souches isolées se sont
révélées sensibles à 100% aux
béta-lactamines représentés par la Pénicilline G,
l'Amoxicilline, l'Ampicilline, la Cefotaxime. Par contre, les souches etaient
sensibles à la Cefuroxime à 81,81%, deux souches étaient
intermédiaires (18,18%). Les Macrolides proposés en cas
d'allergie comme alternative aux béta-lactamines dans
l'antibioprophylaxie per-partum de l'infection à SGB et
représentés dans notre étude par la Pristinamycine, la
Clindamycine et l'Erythromycine se sont révélés efficaces,
toutes les souches étaient sensibles à 100%.
Notre situation est comparable à celle de
Joelle Loulerge et al., de Touppurainem N et al.
et d'O.Sahnoun et al. qui ont trouvé une
sensibilité de
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
100% des souches de SGB à la Pénicilline G,
l'Amoxicilline, la Cefotaxime et la Pristinamycine. Quand à la
Clindamycine et l'Erythromycine, Joelle Loulerge et al. et
Touppurainem N et al. ont trouvé un taux de
sensibilité respectif de 86,9% et 83,2%. La résistance à
l'Erythromycine est de 38,5% pour O. Sahnoun et al.
Elle est aussi comparable à celle de Schuchat
A. et al. et Franciosi
RA. et al.
; ces auteurs affirment qu'en Belgique comme en Amérique du
Nord, presque toutes les souches étaient sensibles à la
pénicilline G, mais moins de 5 % des souches sont résistantes
à l'Erythromycine et à la Clindamycine [Schuchat A et
al.;2000, Franciosi RA et al.;1973].
Toutes les souches étaient résistantes à
100% aux Aminosides représentés par la Gentamycine. O.
Sahnoun et al. ont observé une résistance de haut niveau
de 0,6% pour la Gentamicine. Ceci pourrait s'expliquer par le fait que la
Gentamicine utilisés dans notre série est chargée à
une faible concentration (10 ug) et du fait aussi de la résistance
naturelle de bas niveau des Streptocoques aux Aminosides.
5. Le CAMP test
Le CAMP test a été utilisé pour une
seconde identification des nos souches des SGB isolées, aucune souche
n'a donné un résultat positif ; ceci pourra s'expliquer par le
fait que nos souches isolées sont soit déficientes ou soit ne
produisent pas le CAMP factor, facteur qui, en synergie avec la
bétalysine du Staphylococcus aureus est à l'origine de
l'augmentation de l'hémolyse.
Le portage vaginal du Streptocoque du groupe B chez
la femme enceinte étant transitoire, dynamique ou continue, le
traitement à distance de l'accouchement des femmes enceintes porteuses
asymptomatiques ne diminue pas le taux de portage à l'accouchement. Seul
un dépistage systématique au dernier trimestre de grossesse et la
notion basée sur les facteurs de risque paraissent efficaces.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CONCLUSION ET
RECOMMANDATIONS
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
CONCLUSION
Au terme de notre étude, nous retenons que :
- le taux de portage vaginal du Streptocoque du groupe B
chez la femme enceinte à HGOPY est de 7,7%. Il est de 3,8% au
premier trimestre, 7% au second et 11,1% au troisième trimestre.
- Le germe le plus rencontré dans le PCV chez la femme
enceinte est Candida albicans en culture mono microbienne.
Gardnerella vaginalis occupe la deuxième place. Candida spp
occupe la troisième place. Le SGB occupe la quatrième et
Escherichia coli la cinquième place
- Les souches de SGB isolées sont toutes sensibles
à la Pénicilline G, l'Amoxicilline, la Cefotaxime, l'Ampicilline,
la Pristinamycine, l'Erythromycine et la Clindamycine. Par contre, 81,81% des
souches étaient sensibles à la Cefuroxime . Néanmoins,
toutes les souches étaient résistantes à la
Gentamycine.
- Toutes les souches isolées ont donné un
résultat négatif à l'épreuve du CAMP test.
PERSPECTIVES
V' Nous prétendons faire une
étude comparée du portage vaginale incluant les variables
socio-économiques et démographiques dans les grands
hôpitaux du Cameroun et du Tchad.
V' Faire le sérotypage des
souches isolées dans les deux pays
V' Etudier des manières
approfondies les comportements des souches isolées vis-à-vis du
CAMP test.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
RECOMMANDATIONS
Au terme de notre étude, nous formulons les
recommandations suivantes :
AUX CHERCHEURS
V' Qu'une étude prospective de grande envergure
sur le portage
vaginal du SGB incluant les variables socio-économiques et
démographiques
soit menée dans tous les hôpitaux et centres
hospitaliers dans l'optique
d'apprécier l'ampleur de l'infection à SGB au
CAMEROUN.
Au Ministère de la santé
publique:
V' Réduire le coût du PCV pour les femmes
enceintes.
V' Mobiliser des ressources pour la sensibilisation des
femmes enceintes
au risque d'infections néonatales dues au SGB
Aux médecins prescripteurs ;
V' Faire un dépistage vaginal systématique
du SGB chez toutes les
femmes enceintes entre 34 et 37 semaines de grossesses.
V' De mentionner sur le dossier de la future mère
son statut de
colonisation durant la grossesse;
Aux femmes enceintes :
V' Eviter l'automédication
V' Eviter l'usage abusif des antiseptiques locaux et
autres mauvaises
pratiques d'hygiène pour la toilette intime.
Aux Biologistes :
V' Le CAMP test ne doit pas être utilisé
pour le diagnostic de routine
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
REFERENCES BIBLIOGRAPHIQUES
A.Kacou, H.Faye-Kette Achi, F.D. Sylla koko, C. Akoua-Koffi,
A.L. Khonte, Y.B. Acho, K.E. Bango, M.Dosso ; Distribution des Streptocoques
dans les produits biologiques analyses à Abidjan de 1982 a 1988.
Aber RC, Allen N, Howell JT, et al.-- Nosocomial transmission
of group B streptococci. Pediatrics, 1976, 58, 346-53.
Adair C, Kowalsky L, Quon H, Ma D, Stoffman J, McGeer A et
coll.« Risk factors for early-onset group B streptococcal disease in
neonates: a population-based case-control study », CMAJ, vol.
169, n° 3,2003, p. 198-203.
Agence Nationale d'Accréditation et d'Evaluation en
Santé. Prévention anténatale du risque infectieux
bactérien néonatal précoce. Recommandations pour la
pratique clinique septembre 2001 (
www.anaes.fr)
American Academy of Pediatrics.-- Committee on Infectious
Diseases and Committee on Fetus and Newborn. Guidelines for prevention of group
B streptococcal (GBS) infection by chemoprophylaxis. Pediatrics, 1992, 90,
775-8.
American College of Obstetricians and Gynecologists.-- Group B
streptococcal Infections in pregnancy. American College of Obstetricians and
Gynecologists, Washington DC, 1992. (ACOG technical bulletin n° 170).
Ancona RJ, Ferrieri P, Williams PP.-- Maternal factors that
enhance the acquisition of group B streptococci by newborn infants. J Med
Microbiol, 1980, 13, 273-80.
Anthony BF, Okada DM, Hobel CJ.-- Epidemiology of group B
streptococcus: longitudinal observation during pregnancy. J Infect Dis, 1978,
137, 524-30.
B.Balaka A.Dagnra, S.Baeta, K. Kessieand, K. Assimadi, portage
génital bactérien au dernier trimestre de la grossesse et
infectons néonatales précoces. CHU de lomé Togo,Mai
2003.
B.Carbonnelle, F. Denis ;A. Marmonier ; G.Pinon ; R.Vargues ;
(1987) Bactériologie Médicale : Techniques usuelles. Ed.SIMEP12,
Rue de l'Epéron 75006 Paris. P.9, 10, 15, 17, 22, 85, 86, 87
Bagnani A. Battisti E, Battisti A, Beneetti C, Burnelli I,
Cavagna G, Cirillo A, Dani C, De Feo F, et all prevalence of group B
beta-hemolytic streptococcus
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
colonisation in the sample of 23,312 pregnant women and
newborn infants. Pediatr Med Chir 1995 jul-Aug.17 (4); 295-7.
Baker CJ, Barrett FF, Gordon RC, et al.-- Suppurative
meningitis due to streptococci of Lancefield group B : a study of 33 infants. J
Pediatr, 1973, 82, 724-9.
Baker CJ, Goroff DK, Alpert S, et al. -- Vaginal colonization
with group B streptococcus: a study of college women. J Infect Dis, 1977, 135,
392-7.
Baker CJ, Kasper DL.-- Correlation of maternal antibody
deficiency with susceptibility to neonatal group B streptococcal infection.
NEJM, 1976, 294, 753-756.
Baker CJ, Kasper DL.-- Group B streptococcal vaccines. Rev
Infect Dis, 1985, 7, 458-67.
Baker CJ.-- Immunization to prevent group B streptococcal
disease : victories and vexations. J Infect Dis, 1990, 161, 917-21.
Ben Hassen A.; Ben Radjeb S.; Kechrid A.; Enneifar M.; Boujnah
A.; Infections à Streptocoque du groupe B. Tunisie Méd.; 1986,64
;89, 693-697.
Bernard Bonnin A.C. et Tetanye Ekoé (1985). Les
méningites purulentes de l'enfant à Yaoundé : Aspects
épidémiologiques et pronostiques. Ann.Soc.Belge Méd.
65,59-68.
Bevilacqua G.Prevenion of perinatal infectio caused by group B
â-hemolytic streptococcus.Acta Biomed Ateneo Parmense,1999;
70(5-6):87-94
Blumberg HM, Stephens DS, et al.-- Invasive group B streptococcal
disease : the emergence of serotype V. J Infect Dis, 1996, 173, 365-73.
CDC.-- Prevention of perinatal group B streptococcal disease : a
public health perspective. MMWR, 1996, 45 (n° RR-7).
Claeys G, Verschraegen G, Temmerman M. Modified Granada agar
medium for the detection of group B streptococcus carriage in pregnant
women. Clin Microbiol Infect 2001 ; 7 : 22-4.
Clay LS. Group B streptococcus in perinatal period. A revew.J
Nurse Midwifery 1996 Sep-Oct; 41(5):355-63
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Colman G.-- Typing of Streptococcus agalactiae (Lancefield
Group B). Eur J Clin Microbiol Infect Dis, 1988, 7, 226-31.
Cueto M, Sanchez MJ, Molto L, et al. Efficacy of a
universal screening program for the prevention of neonatal group B
streptococcal disease. Eur J Clin Infect Dis 1995 ; 14 : 810-2
Ducoffre G.-- Surveillance des maladies infectieuses par un
réseau de laboratoire de microbiologie 1997 + Tendances
épidémiologiques 1983 - 1996, 1998; Septicémies et
méningites néonatales. 1-2.
DUOIS M.; les infections à Streptocoque B dans la
période neonatal. Rev. Pediatr.1980, 23,4,161-167.
Eickhoff TC, Klein JO, Daly AK, et al.-- Neonatal sepsis and
other infections due to Group B beta-hemolytic streptococci. N Engl J Med,1964,
271, 1221-8. Eloy C. et Flandrois J.P. : Aspects cliniques et biologiques des
infections
humaines à streptocoque du groupe B(Streptocoque
agalactiae)
Sci.,Vét.Med.Comp., 1985,87,3-18.
Fari A. Infections génitales: bactériologie et
épidémiologie. In : Gynécologie. Paris : Aupelf/Uref
Ellipses 1998 : 207-31
Faxelius G, Bremme K, Kvist-Christensen K, et al. -- Neonatal
septicemia due to group B streptococci-perinatal risk factors and outcome of
subsequent pregnancies. J Perinat Med, 1988, 16, 423-30.
Feikin DR,Thorsen P, Zywicki S, Arpi M,Westergaard JG,
Schuchat A. «Association between colonization with group B streptococci
during pregnancy and preterm delivery among Danish women », Am J
Obstet Gynecol, vol. 184, n° 3, 2001, p. 427-33.
Feriani A., Ben Abdallah H. Ben Saida N. Gozzi C. Boukadida
J., portage vaginal de Streptocoque agalactiae chez la femme enceinte en
Tunisie;2006. vol.99, n°2, pp 99-102.
Ferrieri P et al. -- Epidemiology of group B streptococcal
carriage in pegnant women and newborn infants. J Med Microbiol, 1977, 10,
103-14
Fondation Canadienne de Streptocoque B; A toutes les futures
mamans, mars 2005.
http://www.meningitis.ca/fr/what_is_meningitis/groupbstrep.shtml
Foumane Streptocoque Beta hémolytique du groupe B et
conséquences materno-foetales observées à l'Hôpital
Général de Yaoundé : Faut il systématiser le
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
prélèvement cervico-vaginal au cours de la
grossesse. Mémoire de spécialisation en
Gynécologie/Obstétrique, FMSB, UY1, 2003
Francioli P. Vaudaux B. , Glauser M.P. ; Septicémie
à streptocoque du groupe B. Analyse de18 épisodes chez l'adulte
et 10 cas chez le nouveau-né. Schweiz.med. Wschr ; 1983,113,2,38-41
Franciosi RA, Knostman JD, Zimmerman RA.-- Group B streptococcal
neonatal and infant infections. J Pediatr, 1973, 82, 707-18.
Gil EG, Rodriguez MC, Bartolome R, Berjano B, Cabero L, Andreu
A. Evaluation of the Granada agar plate for detection of vaginal and rectal
group B streptococci in pregnant women. J Clin Microbiol 1999 ; 37 :
2648-51.
Gotoff P.S. (1978) : Streptocoque du groupe B : agent
pathogène majeur en néonatologie. tempo méd., 3,189-197
Hood M, Janneya. Beta-Hemolytic Streptococcus group Bassociated
with problem of perinatal period. Am J Obstet Gynecol 1961, 82: 809.
Horvath B, Grassely M, Lakatos F, Kneffel P. Intrapatum
administration of antibiotics in the prevention of neonatal streptococcus B
infections. Orv Helit 1998 Nov 29; 139 (48):2899-901
Hulse M.L., Smith S., Chi E.Y., Pham A., Rubens C.E. 1993. Effect
of type III group B streptococcal capsular polysaccharide on invasion of
respiratory epithelial cells. Infect Immun 61 : 4835-4841.
J.P.Euzey Caractères bactériologiques permettant
de distinguer les streptocoques bêta-hémolytiques ou pouvant
être bêta-hémolytiques, Dictionnaire de Bactériologie
vétérinaire, Février 1999
Joelle Loulergue, Cecile Couche, Claude Gramick, Parice
Laudat, Roland quentin ; Sensibilité aux antibiotiques des souches de
streptocoque du groupe B de portage vaginal isolées en France, 2003,
p.69-70 ; BEH N°18/2004
Journal des Obstetriciens et Gynecologues du Canada, Birectives
cliniques de la SOGC, Prevention de l'infection neonatale à SGB à
debut précoce, 2004.N°149
Kago I. ; Tetanye Ekoé ; Doumbé P. ; N'koulou H.
et Wouafo Ndayo M.(1990) : les méningites purulentes du nourrisson de 0
à 2 mois :aspects épidémiologiques ,cliniques et
pronostiques à propos de 71 cas étudiés à l'HCY.
Rev. Pédiatrie 26, 6, 266-270.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Kago I. ; Tetanye Ekoé ; Doumbé P. ; N'koulou H.
et Wouafo Ndayo M.(1990) : les méningites purulentes néonatales
à Yaoundé :Aspects épidémiologiques, cliniques et
pronostiques. Med.Mal,infect.,20,507-511.
Kasper DL, Baker CJ.-- Electron microscopic definition of surface
antigens of group B streptococcus. J Infect Dis, 1979, 139, 147-51.
Krohn MA, Hillier SL, Baker CJ. « Maternal peripartum
complications associated with vaginal group B streptococcal colonization
», J Infect Dis, vol. 179, 1999, p. 1410-5.
LANCEFIELD RC, HARE R. The serological differentiation of
pathogenic and non pathogenic strains of hemolytic streptococci from parturient
women. J Exp Med 1935, 61: 3351.
Lancefield RC, Hare R.-- The serological differentiation of
pathogenic and non pathogenic strains of hemolytic streptococci from parturient
women. J Exp Med, 1935, 61, 335-49.
Lejeune C. 1994. Épidémiologie des infections
périnatales à streptocoques du groupe B. Les Cahiers de
l'AP-HP 1 : 71-79.
Maniatis AN, Palermos J, Kantzanou M, Maniatis NA, Christodoulou
C, Legakis NJ.
Streptococcus agalactiae: a vaginal pathogen?
J
Med Microbiol. 1996 Mar;44(3):199-202.
Mc Kenna DS Iams JD. Group B streptococcus
infections.Semin Perinatal 1998 Aug; 22(4) 267-76
McCracken GH.-- Group B streptococci: the new challenge in
neonatal infections. J Pediatr, 1973, 82, 703-6.
MENGET A et all , la méningite neonatale à
Streptocoque B. A propos de 108 nouveaux-nés traités en
réanimation, réflexions sur une présentation. Med.
Infant.,1988, 95,3,231-247.
Moyen G. ; Nzingoula S. Yala F. ; Ondze B. ; Tembe-Ngane
(1990). Méningites bactériennes néonatales à
Brazzaville. A propos de 133 cas .Rev. Pediatrie, 26, 6, 279-285.
Nizet V., Gibson R.L., Chi E.Y., Framson P.E., Hulse M.,
Rubens C.E. 1996. Group B streptococcal beta-hemolysin expression is associated
with injury of lung epithelial cells. Infect Immun 64 : 3818-3826.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Nizet V., Kim K.S., Stins M., Jonas M., Chi E.Y., Nguyen D.,
Rubens C.E. 1997. Invasion of brain microvascular endothelial cells by group B
streptococci. Infect Immun 65 : 5074-5081.
O. Sahnoun, H. Ben Abdallah , S. Noomen, A. Ben Elhadj
Khélifa, M. Mastouri, Sensibilité aux antibiotiques des souches
de Streptococcus agalactiae à
Monastir ; 2007. Med.Mal,infect.
Vol 37, num 11,
734-737.
Organisation Mondiale de la Santé ; Eléments
essentiels des soins obstétricaux au premier niveau du recours.
Genève, OMS 1991.
P. MELIN , M. SCHMITZ , P. DE MOL , JM. FOIDART et J. RIGO,
Centre de Références de Streptocoques du groupe B, Le
Streptocoque du groupe B, première cause d'infections néonatales
graves. Epidémiologie et stratégies de prévention,
février 1999
Paredes A, Wong P, et al.-- Nosocomial transmission of group B
streptococci in a newborn nursery. Pediatrics, 1977, 59, 679-82.
Ramos E, Gaudier FL, Hearing LR, Del Valle GO, Jenkins S,
Briones D. « Group B streptococcus colonization in pregnant diabetic women
»,Obstet Gynecol, vol. 89, 1997, p. 257-60.
Reagan J.A., Klebanoff M.A., Nugent R.P. 1991. The
epidemiology of group B streptococcal colonization in pregnancy. Obstet
Gynecol 77 : 604-610.
Regan JA, Klebanoff MA, Nugent RP.-- The epidemiology of group
B streptococcal colonization in pregnancy. Vaginal infections and prematurity
Study group. Obstet Gynecol, 1991, 77, 604-10.
Rosa-Fraile M, Rodriguez-Granger J, Cueto-Lopez M, et al.
Use of Granada medium to detect Group B streptococcal colonisation in
pregnant women. J Clin Microbiol 1999 ; 37 : 2674-7.
Rubens C.E., Raff H.V., Jackson J.C., Chi E.Y., Bielitzki
J.T., Hillier S.L. 1991. Pathophysiology and histopathology of group B
streptococcal sepsis in Macaca nemestrina primates induced after
intraamniotic inoculation : evidence for bacterial cellular invasion. J
Infect Dis 164 : 320-329.
Sani S,Agostianini R, Rosseti R, Onorari M, Cantini F,
Innocenti C, Tesi E, Massari M, Cinque N. Epidemiology of béta-hemolytic
streptococcus group B colonisation in perinatology.Methodology considerations
and personnal data. Minerva Pediatr 1989 jul;41(7):353-8
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Schmidt J. Halle E., Halle H. Mohammed T. Gunther E.;
Colonisation of pregnant women and their newborn infants with Group B
streptococci in the Gondor College of medical Sciences.
Ethiop-Med-J,1989,27,3,115-119.
Schuchat A, Oxtoby M, Cochi S, et al. -- Population-based risk
factors for neonatal group B streptococcal disease: results of a cohort study
in metropolitan Atlanta. J Infect Dis, 1990, 162, 672-7.
Schuchat A,Wenger JD. « Epidemiology of group B
streptococcal disease: risk factors, prevention strategies, and vaccine
development », Epidemiol Rev, 1994,16 : 374-402
SCHUCHAT A. Epidemiology of group B streptococcal disease in
the United States : shifting paradigms. Clin Microbiol ,2000,11,105 :
6-21
Seaward PG, Hannah ME, Myhr TL, Farine D, Ohlsson A, Wang EE,
«International multicenter term PROM study: evaluation of productors of
neonatal infection in infant born to patients with premature rupture of
membranes at term»; Am J Obstet Gynecol, vol 179 n°3 (partie I),
1998, P.635-9
SIEGEL J.D et al-Single dose penicillin prophylaxis of nenatal
Group B streptoccacal disease. Conclusion of 41 month cotrolled trial. Lancet,
1982,1,8287, 1426-1430;
Soper DE, Mayhall CG, Dalton HP.-- Risk factors for
intra-amniotic infection: a prospective epidemiologic study. Am J Obstet
Gynecol, 1989, 161, 562-8.
Spaetgens R, De Bella K, Ma D, Robertson S, Mucenski M, Davies
HD« Perinatal antibiotic usage and changes in colonization and resistance
rates of group B streptococcus and other pathogens », Obstet
Gynecol,vol. 100, n° 3, 2002, p. 525-33
Streptococcus agalactiae GAPDH is a virulence-associated
immunomodulatory protein. CNRS Journal of immunology Paris, 1er
février 2007
Tamura G.S., Kuyppers J.M., Smith S., Raff H., Rubens C.E.
1994. Adherence of group B streptococci to cultured epithelial cells : role of
environment factors and bacterial surface components. Infect Immun 62
: 2450-2458.
Tamura G.S., Rubens C.E. 1995. Group B streptococci adhere to
variant of fibronectin attached to a solid phase. Mol Microbiol 15 :
581-589.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
THOMAS D., BOLLE J. ; Infection néonatale par le
Streptocoque beta-hémolytique du groupe B : bilan. J. Gynecol.
Obstet.Biol. reprod. , 1984, 13, 2, 109-116
Tuppurainem N, Hallman M.-- Prevention of neonatal group B
streptococcal disease : intrapartum detection and chemoprophylaxis of heavily
colonized parturients. Obstet Gynecol, 1989, 73, 583-7.
Wood EG, Dillon HC Jr.-- A prospective study of group B
streptococcal bacteriuria in pregnancy. Am J Obstet Gynecol, 1981, 140,
515-20.31.
Yagupsky P., Menegus M.A., Powell K.R. 1991. The changing
spectrum of group B streptococcal disease in infants : an eleven-year
experience in a tertiary care hospital. Pediatr Infect Dis J 10 :
801-808.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 1 : Autorisations de recherche
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 2 : FICHE TECHNIQUE DE RECHERCHE
Date
IDENTIFICATION DE LA PATIENTE Fiche N°
N° ordre ou N° de la facture
Nom et Prénoms
Age
non
Patiente Interne Patiente externe
Quartier
INFORMATIONS REQUISES
Etes vous enceintes? Oui
Si oui, de combien de mois?
Nombre de grossesses quelques soient les issues Grossesses
à termes
Nombre des prématurés Nombre des avortements
Nombre des enfants en vie ....
Parité
non
Êtes-vous sous Antibiotique? Oui
Pourquoi faites-vous le
PCV ?...
Motifs : 1
2
Partie réservée au chercheur
Examen Macroscopique :
Abondance des leucorrhées
Couleur
Aspect
Odeur
Examen Microscopique :
Examen direct : V' Etat
frais
Trichomonas
Levures
Leucocytes
Cellules épithéliales
V'
Gram
Flore de Doderleïn type
Bacilles Gram+ Bacilles Gram -
Cocci Gram+ Cocci Gram -
Germes isolés : 1
2
CAMP Test
ANTIBIOGRAMME :
|
SENSIBLES
|
INTERMEDIAIRES
|
RESISTANTS
|
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXES 3: FICHE DE CONSENTEMENT ECLAIRE
Je soussignée, Mme, Mlle
atteste avoir reçu des explications claires et
précises sur le but de cette recherche dont le thème est
« Portage vaginal et profil de sensibilité aux
antibiotiques du Streptocoque B chez la femme enceinte à l'Hôpital
Gynéco-obstétrique et Pédiatrique de Yaoundé
HGOPY» ainsi que son importance et sa bienfaisance.
Par ailleurs, j'accepte donc de faire partie de cette
étude sans conditions préalables.
En foi de quoi, le présent engagement peut servir et
valoir ce que de droit.
Le chercheur La participante
ADAWAYE CHATTE
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXES 4 : CONDITIONS ETHIQUES
Notre étude a été menée en respectant
certains principes généraux et
fondamentaux de l'éthique et le respect de certaines
règles :
> L'obtention de l'accord du Superviseur de thèse ;
> L'obtention d'une autorisation de recherche du Doyen de la
FMSB
> L'obtention d'une autorisation de collecte des
données par la direction de
l'HGOPY
> Explication à la patiente des objectifs de
l'étude ;
> L'obtention de l'accord de la cliente incluse dans
l'étude (principe du
consentement éclairé);
> Mesures garantissant la protection de vie privée,
l'anonymat et la confi-
dentialité des données
> La garantie d'une large diffusion des conclusions (principe
de bienfai-
sance)
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 5 : Mode Opératoire
du PASTOREX STREP ( BIO-RAD) Préparation des
échantillons
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Le Test PASTOREX STREP s'applique aux colonies de
Streptocoques béta-hémolytiques isolées sur gélose
au sang ou gélose columbia +ANC (colonies de cocci à Gram
positif, catalase négative).
Préparation des extraits
~ Placer 0,3 ml ou 300ul de solution d'extraction
enzymatique
dans un tube à hémolyse pour chaque souche
isolée ;
~ Placer 5 à 10 colonies d'une culture fraiche de
streptocoques et
les dissocier dans l'enzyme. Lorsque les colonies sont de
taille inferieure à 0,5 mm, augmenter l'inoculum jusqu'à
l'obtention d'un trouble visible à l'oeil nu.
~ Incuber soit à 15 à 45°C à
température ambiante (18-30°C)
Identification du
groupe
~ Agiter énergiquement chaque flacon pour remettre en
suspen-
sion les particules de latex ;
~ Déposer une goutte de chaque latex dans les cercles
de la
carte d'agglutination. (Tenir le flacon en position verticale) ;
~ A l'aide d'une pipette, déposer également une
goutte d'extrait
dans chacun de ces cercles ;
~ Homogénéiser le contenu de chaque cercle
à l'aide d'un bâ-
tonnet, changer le bâtonnet pour chaque
réaction ;
~ Agiter la carte selon un mouvement orbital pendant une
mi-
nute maximum
Une réaction positive se traduit par l'agglutination
des particules de latex dans un délai maximum d'une minute. La taille
des agglutinats et la rapidité de leur apparition dépendent de la
concentration antigénique de l'extrait.
Interprétation des résultats
~ Réaction positive : formation
d'agglutinants rouges sur fond
vert. Seule une agglutination franche et
rapide avec un seul de 6 latex permet d'identifier le groupe de la souche
testée.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
~ Réaction négative : Suspension
homogène brune
~ Réactions non interprétables
:
V' Faible agglutinats sur fond brun
V' Agglutination avec plusieurs latex
spécifiques. Dans ce cas, faire un nouvel isolement de la souche
à étudier. Performances du test : Les
performances du test ont été évaluées sur 217
souches dont 162 souches de streptocoques et entérocoques et 55 souches
d'autres espèces, certains concurremment avec des streptocoques tels que
Corynebacteries, Listeria monocytogenes, Gardnerella
vaginalis.
Tableau : Sensibilité du test Pastorex
Bio-Rad
|
Total
|
Positive
|
Négatives
|
Sensibilité
|
|
Streptocoque A
|
67
|
67
|
0
|
100%
|
|
Streptocoque B
|
41
|
41
|
0
|
100%
|
|
Streptocoque C
|
9
|
9
|
0
|
100%
|
|
Streptocoque D
|
27
|
24
|
3
|
88%
|
|
Streptocoque F
|
4
|
4
|
0
|
100%
|
|
Streptocoque G
|
14
|
14
|
0
|
100%
|
Une souche Enterococcus durans n'a pas réagi,
due probablement à un déficit d'antigène de groupe chez
cette souche, 1 souche Enterococcus avium et une souche
Enterococcus gallinarum (ayant présenté des
agglutinations avec la méthode utilisée au laboratoire, n'ont
réagi ni avec Pastorex Strep D ni avec une troisième
technique).
Spécificité du test
· Sur les 55 souches autres que Streptocoques des groups A,
B, C, D, F et G, les résultats suivants ont été
observés :
V' Agglutination du latex C avec 5 souches de
Streptococcus pneu-moniae alpha-hémolytiques (réaction
dues à la présence d'un antigène commun F)
y' Agglutination du latex avec une souche de Corynebacteries
bé-ta-hémolytique.
? Absence de réactions croisées avec les autres
souches (S. mitis, G. va-ginalis, L. monocytogenes et des Corynebacteries non
hémolytiques).
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte
à HGOPY
ANNEXE 6: Résultat du groupage (PASTOREX STREP
Bio-Rad)

Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 7: Le CAMP TEST

CAMP test Positif, source: American Society of
Microbiology,
Microbellibrary.org

CAMP test négatif : Aspect du test réalisé
avec les souches des SGB isolées
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 8 : Formule des
préparations des milieux utilisés
1. COLOMBIA AGAR BASE (Oxoid) 500g pour
12,8litres d'eau
Composition :
· Peptone : 23,0 g/litre
· Chlorure de Sodium : 5,0 g/litre
· Agar 10,0 g/litre
· PH=7,3#177;0,2 à 25°C
Mode opératoire
Ajouter 39 g à 1 litre d'eau distillée. Porter
à ébullition jusqu'à dissolution complète.
Stériliser 15 minutes à 121°C à l'autoclave ;
Refroidir à 50°C et ajouter 5% de sang de mouton defibriné
stérile.
2. MULLER HINTON (Plasmatec) Composition
:
· Beef infusion solids 2 g/litre
· Acid Hyd . Casein 17,5 g/ litre
· Starch 1,5 g/litre
· Calcium 50-100 mg/litre
· Magnesium 20-35 mg/litre
· Agar 17 g/litre
· PH= 7,4#177;0,2
Mode opératoire :
Mettre 38 g de poudre dans un litre d'eau distillée.
Porter à ébullition pendant 10 minutes. Stériliser
à l'autoclave à 121°C pendant 15 minutes. Refroidir à
47°C et ajouter 5% de sang de mouton defibriné stérile.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
1. GELOSE CHOCOLAT
Milieu de base : Blood Agar base (Oxoid)
Formule :
· Poudre 10 g/litre
· Peptone 10 g/litre
· NaCl 5 g/litre
· Agar 15 g/litre
· PH= 7,3#177;0,2 à 25°C
Ajouter 40 g dans 1 litre d'eau distillée et porter
à ébullition jusqu'à dissolution complète ;
stériliser 15 minutes à 121°C à l'autoclave. Laisser
refroidir à 4045°C et ajouter 7% de sang de mouton defibriné
stérile. Chauffer encore quelques minutes pour cuire le sang.
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 9: Présentation du SGB sur
gélose au sang frais et gélose chocolat
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
Geloses chocolat

gélose au sang frais

Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 10 : Présentation des
quelques souches de SGB résistantes à la Gentamycine (CN)
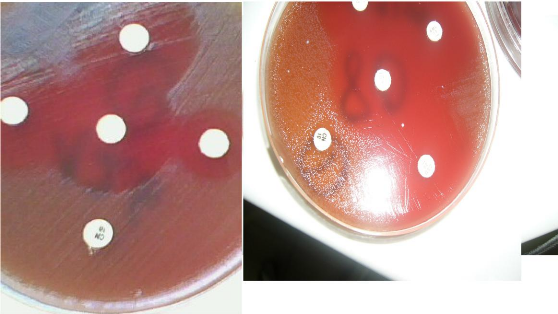
Portage vaginal et profil de sensibilité du
Streptococcus agalactiae aux antibiotiques chez la femme enceinte à
HGOPY
ANNEXE 11 : Tableau de
correspondance pratique entre semaines d'aménorrhée et mois de
grossesse
La durée de la grossesse est indiquée en semaines
d'aménorrhée (SA) ou en mois de grossesse (semaines
d'aménorrhée = nombre de semaines écoulées depuis
les dernières règles, ce qui fait que le terme en semaines
d'aménorrhée compte deux semaines de plus que le terme en
semaines de grossesse).
|
Mois
|
Semaines d'aménorrhée
|
Semaines de grossesse
|
|
1
|
6
|
4
|
|
2
|
10
|
8
|
|
3
|
15
|
13
|
|
4
|
19
|
17
|
|
5
|
24
|
22
|
|
6
|
28
|
26
|
|
7
|
32
|
30
|
|
8
|
36
|
34
|
|
9
|
41
|
39
|
| 


