|
|
|
|
LUBUMBASHI
INDUSTRIELLE
|
|
|
|
|
UNIVERSITE DE
FACULTE POLYTECHNIQUE DEPARTEMENT DE CHIMIE
|
|
|
|
PRODUCTION DU BIODIESEL
PAR
TRANSESTÉRIFICATION À CATALYSE
HÉTÉROGÈNE DE
L'HUILE DE FRITURE
USAGÉE
|
|
Présenté par KAMBALE VITSENGE
Christian
Travail de fin d'études présenté et
défendu en vue de l'obtention du diplôme d'ingénieur civil
en Chimie industrielle
Dirigé par Professeur Jean-Marie KANDA
TUMBA
SEPTEMBRE 2024
|
|
|
|
|
LUBUMBASHI
INDUSTRIELLE
|
|
|
|
|
UNIVERSITE DE
FACULTE POLYTECHNIQUE DEPARTEMENT DE CHIMIE
|
|
|
|
PRODUCTION DU BIODIESEL
PAR
TRANSESTÉRIFICATION À CATALYSE
HÉTÉROGÈNE DE
L'HUILE DE FRITURE
USAGÉE
|
|
Présenté par KAMBALE VITSENGE
Christian
Travail de fin d'études présenté et
défendu en vue de l'obtention du diplôme d'ingénieur civil
en Chimie industrielle
Dirigé par Professeur Jean-Marie KANDA
TUMBA
ANNÉE ACADÉMIQUE 2022-2023
|
|
RÉSUMÉ
Notre travail portait sur l'étude de
transestérification d'une huile de friture usagée (HFU) en vue de
rechercher les meilleures conditions opératoires qui optimisent le
rendement et la qualité du biodiesel produit. En particulier,
l'influence du temps de la réaction, de la concentration en catalyseur
et du ratio molaire éthanol : huile sur les réponses
étudiées a été recherchée. La vitesse
d'agitation et la température de la réaction ont
été maintenues constantes.
Une méthodologie basée sur les plans
d'expériences a été mise en oeuvre et les résultats
de nos essais analysés à l'aide du logiciel EXCEL et MiniTAB. Le
rendement optimal obtenu était de 94 % et ce, en utilisant 3% en
catalyseur (niveau min), un rapport molaire éthanol : huile de 6 :1
(niveau max) et un temps de la réaction de 75 minutes (niveau max).
Du point de vue qualité, le biodiesel répondant
aux normes internationales (en termes de densité, viscosité et
indice d'acide) était celui produit avec une concentration en catalyseur
de 3% (min), un rapport molaire 6 :1 à un temps de réaction de 45
minutes (min).
Mots clés : Biocarburant, biodiesel,
catalyseur, huile usagée, transestérification.
ABSTRACT
Our work focused on the study of transesterification of used
frying oil (HFU) with a view to seeking the best operating conditions which
optimize the yield and quality of the biodiesel produced. In particular, the
influence of the reaction time, the catalyst concentration and the ethanol: oil
molar ratio on the responses studied was sought. The stirring speed and the
reaction temperature were kept constant.
A methodology based on experimental plans was implemented and
the results of our tests analyzed using EXCEL and MiniTAB software. The optimal
yield obtained was 94%, using 3% catalyst (min level), an ethanol: oil molar
ratio of 6:1 (max level) and a reaction time of 75 minutes (max level).
From a quality point of view, the biodiesel meeting
international standards (in terms of density, viscosity and acid number) was
that produced with a catalyst concentration of 3% (min), a molar ratio 6:1 at a
time of reaction of 45 minutes (min).
Key words: Biofuel, biodiesel, catalyst, used
oil, transesterification.

TABLE DES MATIÈRES
TABLE DES MATIÈRES I
LISTE DES FIGURES IV
LISTE DES TABLEAUX V
LISTE D'ÉQUATIONS VI
SIGLE ET ABRÉVIATIONS VII
GLOSSAIRE VIII
ÉPIGRAPHE IX
DÉDICACE X
AVANT-PROPOS XI
INTRODUCTION GÉNÉRALE 1
CHAPITRE I. GÉNÉRALITÉS SUR LES
BIOCARBURANTS 3
I.1 Définition des biocarburants 3
I.2 Historique 3
I.3 Classes des biocarburants 4
I.4 La transestérification 5
I.4.1 Définition 5
I.4.2 Historique 5
I.4.3 Matières premières 7
I.4.4 La transestérification des triglycérides 7
I.4.5 Paramètres importants de la réaction de
transestérification 8
I.5 Le biodiesel 13
I.5.1 Définition du biodiesel 13
I.5.2 L'utilité du biodiesel 13
I.5.3 Caractéristiques physiques et chimiques du biodiesel
14
II
I.5.4 Utilisation du biodiesel dans les moteurs 17
I.5.5 Avantages et inconvénients du biodiesel 20
CHAPITRE II. NOTIONS SUR LA MODÉLISATION
EXPÉRIMENTALE 22
II.1 PLANS D'EXPÉRIENCES 22
II.2 MODÉLISATION MATHÉMATIQUE 24
II.2.1 SYSTEME D'EQUATIONS 24
II.3 PLAN FACTORIEL COMPLET À DEUX NIVEAUX 25
II.3.1 Matrice d'expérience 25
CHAPITRE III. MATÉRIELS ET MÉTHODE 27
III.1 PRÉSENTATION DES MATIÈRES PREMIÈRES
27
III.1.1 Oxyde de fer (III) 27
III.1.2 Huile de soja 27
III.1.3 Éthanol 28
III.2 PRODUCTION DU BIOCARBURANT 28
III.2.1 Échantillonnage 28
III.2.2 Synthèse du biodiesel 29
III.2.3 Protocol expérimental 31
III.3 CARACTÉRISATION PHYSICO-CHIMIQUE DES BIOCARBURANTS
32
III.3.1 Analyses chimiques 32
III.3.2 Analyses physiques 34
CHAPITRE IV. ANALYSE ET INTERPRÉTATION DES
RÉSULTATS 36
IV.1 CARACTÉRISATION DE L'HUILE USAGÉE 36
IV.2 RÉACTION DE TRANSESTÉRIFICATION 37
IV.2.1 Effets de la concentration du catalyseur sur le rendement
38
IV.2.2 Effets du ratio molaire éthanol/huile sur le
rendement 39
IV.2.3 Effets du temps de la réaction sur le rendement
40
IV.3 CARACTÉRISATION DU BIODIESEL OBTENU 41
III
IV.4 MODÉLISATION MATHÉMATIQUE DES RÉSULTATS
OBTENUS 43
CONCLUSION 46
RÉFÉRENCES BIBLIOGRAPHIQUES 48
IV
LISTE DES FIGURES
Figure I.1 : Réaction globale de la
transestérification. 5
Figure I.2 : Les trois étapes successives et
réversibles de la réaction de transestérification [14].
6
Figure I.3 : Réaction globale de la
transestérification des triglycérides avec un alcool (R-OH)
avec R1, R2 et R3 des groupements alkyles présents dans
les acides gras. 8
Figure II.1 : Le domaine expérimental de nos
études. 26
Figure IV.1 : Histogramme représentant l'effet de la
concentration du catalyseur sur le
rendement. 38
Figure IV.2 : Histogramme représentant l'effet du ratio
molaire sur le rendement. 39
Figure IV.3 : Histogramme représentant l'effet du temps de
la réaction sur le rendement. 40
V
LISTE DES TABLEAUX
Tableau I.1 : Acides gras contenus dans les diverses huiles
comestibles. 7
Tableau I.2 : Comparaison entre catalyses homogène et
hétérogène. 11
Tableau I.3 :Propriétés physico-chimiques de
biodiesels produits à partir de diverses matières
premières. 14
Tableau I.4 : La comparaison de certains
paramètres clés pour le carburant B100 par rapport au
gazole [54]. 19
Tableau II.1 : Les niveaux de facteurs pour le plan factoriel
complet. 23
Tableau II.2 : Matrice d'expérience en unité
centrée réduite. 26
Tableau III.1 : Composition de l'huile de soja en acide gras.
28
Tableau III.2 : Conditions opératoires choisies pour les
expériences. 29
Tableau IV.1 : Caractéristiques physico-chimiques des
huiles de soja usagée et vierge. 36
Tableau IV.2 : Les rendements des 10 expériences. 37
Tableau IV.3 : Résultats des caractéristiques
physico-chimiques des biocarburants 41
Tableau IV.4 : Volumes d'HCl des 10 biocarburants. 42
Tableau IV.5 : Paramètres de modélisation. 43
Tableau IV.6 : Analyse de la variance de réponse. 44
VI
LISTE D'ÉQUATIONS
Équation III.1 : Calcul de la masse de
l'éthanol. 29
Équation III.2 : Calcul de la masse du catalyseur.
29
Équation III.3 : Calcul de l'indice d'acide. 32
Équation III.4 : Calcul de l'indice de saponification.
33
Équation III.5 : Calcul de l'indice d'iode. 34
Équation III.6 : Calcul de la densité. 34
Équation III.7 : Calcul de la viscosité par la
formule de Stokes. 35
Équation IV.1 : le modèle de régression
ajusté aux données. 44
VII
SIGLE ET ABRÉVIATIONS
AGL : Acides Gras Libres
ASTM : American Society for Testing and
Materials
BD : Biodiesel
BLC : Biomasse Lignocellulosique
cST : centistokes
CTC : Conversion thermochimique
DG : Diglycéride
EAG : Ester d'acide gras
EEHV : Ester Éthylique d'Huile
Végétale
EMAG : Ester méthylique d'acide
gras
EMHV : Ester Méthylique d'Huile
Végétale
EN : European Norm
G : Glycérol
HFU : Huile de friture usagée
HV : Huile Vierge
IA : Indice d'acide
II : Indice d'iode
IS : Indice de saponification
MG : Monoglycéride
ML : Millions de Litres
Mt : Million de tonnes
Mtep : Million de tonnes équivalent
pétrole
NIST : National Institute of Standards and
Technology
PCS : Pouvoir Calorifique Supérieur
PET : Polyéthylène
téréphtalate
ppm : partie par million
R&D : Recherche et
Développement
TG : Triglycéride
tR : temps de rétention
UE : Union Européenne
VIII
GLOSSAIRE
Acide : Tout corps capable de libérer
des ions hydrogène dans l'eau, de causer la corrosion des métaux,
de colorer en rouge le papier tournesol, possédant un pH
inférieur à 7.
Acide gras : Lipide formé d'une chaine
hydrocarbonée plus ou moins longue comportant un groupe acide
carboxylique à une extrémité et un groupe méthyle
à l'autre
Acide gras libre : Acide gras non
estérifié, ils ne sont pas sous forme d'ester de glycérol.
Présents dans les huiles végétales en faible
quantité, leur concentration devient considérable dans les
graisses ou les huiles usées.
Acidité : l'acidité d'une huile
est la quantité d'acide gras libre exprimé en pourcentage, dans
une masse de 1 gramme d'huile.
Indice d'acide : l'indice d'acide d'une huile
est la quantité en milligramme de KOH pour neutraliser les acides gras
libres présent dans 1 gramme d'huile.
Indice de cétane : C'est la
capacité d'auto-inflammation d'un combustible.
Point de trouble : c'est la
température à laquelle un produit liquide devient trouble par
l'apparition de cristaux lorsque le produit est refroidi dans les conditions
normalisées
Point d'écoulement : c'est la
température la plus basse à laquelle un produit liquide peut
encore couler lorsqu'il est refroidi dans les conditions prescrites.
Point d'éclair : C'est la
température la plus basse à laquelle le liquide
considéré fournit suffisamment de vapeurs pour former, avec l'air
ambiant, un mélange gazeux qui s'enflamme sous l'effet d'une source
d'énergie calorifique telle qu'une flamme pilote ou une
étincelle, mais pas suffisamment pour que la combustion s'entretienne
d'elle-même (pour ceci, il faut atteindre le point d'inflammation).
Viscosité : C'est la capacité d'un
fluide à s'écouler.
IX
ÉPIGRAPHE
« Les biocarburants offrent une voie
durable vers un avenir énergétique plus
respectueux de l'environnement
»
Ir Chris VITSENGE
X
DÉDICACE
À mes très chers parents et à toute la
grande famille VITSENGE À tous ceux qui me sont chers
À tous mes amis et proches
Je dédie le fruit de mes 15 ans
d'études.
XI
AVANT-PROPOS
L'utilisation croissante des énergies renouvelables est
devenue une priorité mondiale pour lutter contre le changement
climatique et réduire notre dépendance aux combustibles fossiles.
Dans ce contexte, la production de biodiesel à partir d'huiles
végétales est une alternative prometteuse et durable aux
carburants traditionnels.
Ipso facto, ce travail s'inscrit dans une démarche plus
large visant à promouvoir le développement d'une filière
de production de biodiesel durable et respectueuse de l'environnement. Il
contribue ainsi à la recherche de solutions innovantes pour
répondre aux défis énergétiques actuels et
futurs.
Je tiens à exprimer mes sincères remerciements
à toutes les personnes qui m'ont soutenu et encouragé tout au
long de ce projet. Coup de maître à mon directeur pour cette
recherche, le Professeur KANDA TUMBA Jean-Marie pour sa guidance
précieuse, son soutien constant et ses conseils éclairés
tout au long de la réalisation de ce mémoire. Sa passion pour la
chimie industrielle et son expertise m'ont inspiré et ont grandement
contribué à la réussite de ce travail.
Je souhaite également exprimer ma gratitude à
mon encadrant, Serge KATUFU, pour sa collaboration étroite, son
expertise complémentaire et ses conseils avisés. Sa
présence et son soutien ont été d'une importance capitale
dans l'accomplissement de ce mémoire.
Leur encadrement attentif, leur disponibilité et leur
engagement ont été des facteurs déterminants dans la
qualité de ce travail de recherche. Je suis reconnaissant d'avoir eu
l'opportunité de travailler avec eux et d'avoir pu
bénéficier de leur expertise et de leurs conseils tout au long de
ce projet.
Je remercie sincèrement les autorités de la plus
prestigieuse École du Cinquantenaire pour leurs multiples efforts
fournis dès mes bas âges et du sens du travail qu'ils m'ont
transmis afin que je devienne ce que je suis maintenant. Je garderai pour
longtemps un souvenir ému de mon passage dans cette grande institution
qui m'a tant donnée. Grâce à vous, j'aborde une nouvelle
étape de ma vie avec confiance et dynamisme.
Mes remerciements s'adressent également au corps
académique de l'Université de Lubumbashi en général
et de la faculté Polytechnique en particulier pour ces années de
formation au sein de ladite institution où j'ai pu acquérir des
plus grandes connaissances sur les plans moral, social et intellectuel.
XII
À mes très chers parents PALUKU VITSENGE JB et
KAVUGHO KAHINDO Zawadi de m'avoir appris à surmonter mes peurs et
d'être toujours là quand cela était nécessaire. Je
vous remercie de m'avoir tant donné, de m'avoir fait croire en l'Amour,
et d'avoir logé en mon coeur tant d'affections, quand le monde
extérieur peut parfois être si cruel, mais aussi pour les
encouragements pour l'école et mes études, votre soutien a
été d'une importance capitale pour m'aider à me lancer
dans ma vie adulte. Votre regard bienveillant sur moi m'a aidé à
pousser droit, à grandir comme il le faut, bien enraciné dans le
sol mais la tête en hauteur, pleine de rêves à
réaliser. Merci infiniment à mon oncle Wilson KALYENE pour son
accompagnement indéfectible tout au long de la rédaction et de la
réalisation de ce travail.
Mille mercis à tous les VITSENGE : Gentille, Ricardo,
Laurène, Lydie, Jospin et Alphonsine, j'ai été
touché par votre présence et par votre soutien. Vous avez rendu
chaque jour plus amusant et je suis tellement heureux que nous ayons grandi
ensemble. Cela m'a fait chaud au coeur.
À tous mes amis de lutte : Roger K.,
Bénédicte K., Néhémie R., Patrocle M., Junior M.,
Guillain N., Victoire K., Jospin S., Josiane S., Enock V., Dovin Z. avec qui
nous avons mené ce très long chemin pour en arriver là que
nous sommes. Il est rare de rencontrer des personnes aussi
dévouées et dignes de confiance. Vos efforts ne passent pas
inaperçus. À tous ceux-là qui nous ont soutenus durant
notre cursus, Merveille Sibita, Inesse Musayi, Paulin Ndethi, Josué
Kombi, André Ndale, Piscas Kitswamba, El-Bethel Kami, Dorcas Kakera et
tous les autres, sentez-vous honorés.
Merci du fond du coeur à tous mes ainés
scientifiques : Ir Archimède, Ir Aristote, Ir Claude, Ir Christian B.,
Ir Donatien, Ir Jonathan W., Ir Grâce K., Ir Pataoli pour votre
attention, votre gentillesse, votre écoute, vos paroles
réconfortantes, votre orientation et votre professionnalisme que j'ai
vécu sereinement et apaisé.
Je tiens à exprimer mes remerciements les plus
sincères à la CEV Saint Ignace de Loyola, et tout
particulièrement à ses membres dévoués, Anastasie
Lulu, Gloire Kanyinda, Arsène Buhika, et tant d'autres, qui ont
joué un rôle crucial dans mon développement spirituel. Leur
accompagnement bienveillant, leurs prières et leur soutien constant ont
été des sources d'inspiration et de force tout au long de notre
parcours d'études. À tous les membres également, je vous
adresse mes plus sincères remerciements pour avoir enrichi mon parcours
académique d'une dimension spirituelle précieuse et pour m'avoir
permis de grandir dans la foi et la fraternité.
1
INTRODUCTION GÉNÉRALE
Depuis des siècles anciens, l'homme a toujours
été à la recherche des solutions pour satisfaire ses
besoins et apaiser les conséquences néfastes qui peuvent
perturber son environnement. Actuellement le pétrole naturel domine
notre vie quotidienne, depuis le transport jusque dans nos cuisines, le
pétrole est utilisé dans presque tous les domaines de notre
quotidien.
Face aux problèmes environnementaux que
présentent les hydrocarbures fossiles, l'homme a eu à penser aux
biocarburants qui ont moins d'effets négatifs sur l'environnement et
dont la fabrication est très simple suite à l'abondance de la
matière première qui est renouvelable.
Ainsi donc, l'humanité entière est à la
recherche de perspectives et des pistes de solution pour satisfaire ses
multiples besoins énergétiques dans le futur, cela suite à
la diminution des ressources mondiales du pétrole et
l'instabilité sur le marché du prix du baril. De toute
évidence, les récits les plus enthousiastes prévoient que
le pic pétrolier sera atteint entre 2028 et 2030 [1].
Par contre, des scénarios les plus pessimistes espèrent qu'on a
déjà atteint ce pic depuis l'année 2010 et que la
production commence à baisser progressivement [1].
L'utilisation croissante des combustibles fossiles et ses
conséquences environnementales ont suscité un
intérêt croissant pour les sources d'énergie renouvelables
et durables. Dans ce cadre, le biodiesel, un carburant produit à partir
de matières premières renouvelables telles que les huiles
végétales, est devenu une alternative prometteuse aux carburants
traditionnels [2].
La gestion d'huile de friture usagée représente
un défi environnemental majeur en raison de son impact potentiel sur
l'écosystème. La transestérification à catalyse
hétérogène offre une solution pour valoriser ces huiles en
produisant du biodiesel, mais des études étant nécessaires
pour optimiser ce processus.
L'objectif principal de ce travail est donc de convertir de
manière efficace et durable l'huile de friture usagée en
biodiesel par le biais de la transestérification à catalyse
hétérogène ainsi qu'à optimiser les conditions de
réaction pour améliorer le rendement et la qualité du
biodiesel obtenu.
Pour ce faire, outre l'échantillonnage de l'huile de
friture usagée qui a été fait dans les restaurants et les
habitations, son traitement ainsi que la réalisation de notre
réacteur de transestérification. Après
caractérisation de l'huile de friture usagée, nous avons
procédé aux
2
différentes réactions dont les réactifs
principaux utilisés étaient l'oxyde ferrique comme catalyseur
hétérogène et l'éthanol comme alcool.
Nous avons réalisé dix expériences tout
en variant certains paramètres entre autres la concentration du
catalyseur, le temps de la réaction et le ratio molaire éthanol :
huile pour voir les impacts sur le produit final, et nous avons maintenu la
température de notre réaction constante 65°C.
L'intérêt du présent travail est qu'en
réduisant la dépendance aux carburants fossiles et en favorisant
l'utilisation de biocarburants plus durables et respectueux de l'environnement,
nous valorisons l'huile de friture usagée en produisant un carburant
alternatif renouvelable tout en contribuant à la réduction des
émissions de gaz à effet de serre en promouvant l'utilisation des
biocarburants. Pendant notre étude, certains paramètres ont
été variés tels que : la concentration du catalyseur (%),
le temps de la réaction ainsi que le rapport molaire huile :
éthanol.
Ainsi, ce présent travail s'est articulé sur
quatre grands chapitres. Le premier est un tour d'horizon sur les
biocarburants, en particulier le biodiesel et toutes les matières
possibles pouvant être utilisées pour sa production.
Les trois derniers chapitres de notre travail seront
consacrés à la partie expérimentale.
Le deuxième chapitre sera consacré à une
notion sur la modélisation expérimentale qui se fera avec un plan
factoriel complet avec quelques paramètres que nous allons choisir et
les faire varier à l'aide des logiciels EXCEL et MiniTAB.
Le troisième et le quatrième chapitre porteront
sur les différentes méthodes et les équipements
nécessaires pour réaliser une meilleure production, nous
présenterons également de manière particulière les
différentes matières premières qui nous
intéresserons dans le cadre de notre étude à
l'échelle laboratoire ainsi que l'analyse de différents
résultats que nous aurons obtenus afin de vérifier ses
propriétés physiques et chimiques et leurs conformités.
En dernier lieu, nous terminerons par une conclusion et des
perspectives de recherche dans ce domaine.
Durant la seconde guerre mondiale, les allemands qui devaient
faire face à des pénuries de carburants utilisèrent un
procédé pour fabriquer l'équivalent du pétrole
à partir du charbon.
3
CHAPITRE I. GÉNÉRALITÉS SUR
LES
BIOCARBURANTS
Ce chapitre aborde les principaux aspects de cette source
d'énergie renouvelable. Il présente d'abord une définition
des biocarburants, qui sont des carburants produits à partir de
matières organiques renouvelables telles que les plantes, les
déchets agricoles ou forestiers. Ensuite, le chapitre explore les
différents types de biocarburants, tels que l'éthanol, le
biodiesel et le biogaz, ainsi que leurs avantages et inconvénients en
termes de durabilité, d'efficacité énergétique et
d'impact environnemental.
I.1 Définition des biocarburants
L'union européenne a défini les biocarburants
(biofuels en anglais) comme des combustibles liquides ou gazeux utilisés
pour le transport et produits à partir de la biomasse [3]
ou en d'autres termes, un biocarburant est un carburant liquide ou
gazeux crée à partir de la transformation de matériaux
organiques non fossiles issus de la biomasse, par exemple des matières
végétales produites par l'agriculture (betterave, blé,
maïs, colza, tournesol, pomme de terre, etc.) [4].
Si la langue anglaise n'a retenu qu'une seule appellation
« biofuel », plusieurs dénominations coexistent dans la langue
française : biocarburant (terme retenu par le Parlement
européen), agrocarburant ou carburant végétal
[4]. Les biocarburants sont assimilés à une
source d'énergie renouvelable. Leur combustion ne produit que du CO2 et
de la vapeur d'eau et pas ou peu d'oxydes azotés et soufrés (NOX,
SOX).
I.2 Historique
Les biocarburants sont connus depuis le début de
l'industrie automobile. En effet Nikolaus Otto, l'inventeur du moteur à
explosion avait conçu son invention pour utiliser de l'éthanol.
De son côté, Rudolf Diesel l'inventeur du moteur à
combustion faisait tourner ses machines à l'huile d'arachide. La Ford T,
produite entre 1903 et 1926 roulait à l'éthanol. Ensuite, le
pétrole que l'on commençait à extraire depuis le milieu du
XIXème siècle devint bon marché, et les consommateurs et
les industriels se détournèrent des biocarburants.
4
Après les chocs pétroliers de 1973 et 1979, les
autorités s'intéressèrent davantage aux biocarburants et
de nombreuses études furent menées à la fin des
années 1970 et au début des années 1980. Avec la baisse du
prix du pétrole en 1986, l'intérêt pour les biocarburants
retomba.
Finalement, au début et au milieu des années
2000, avec la nouvelle hausse du prix du baril de pétrole, et la crainte
du pic pétrolier, la volonté de lutter contre l'effet de serre,
et avec les craintes sur la stabilité de certains pays producteurs, les
gouvernements multiplièrent les discours et aides pour le secteur des
biocarburants.
Par exemple, George Bush, dans son discours de l'union de
janvier 2006, a déclaré qu'il voulait que son pays se passe de
75% du pétrole issu du Proche-Orient pour 2025. La Commission
Européenne veut de son côté que les pays membres incluent
au moins 5,75% de biocarburants dans l'essence [5].
I.3 Classes des biocarburants
Les biocarburants obtenus par valorisation de la biomasse
peuvent être de première, de deuxième ou de
troisième génération.
Les biocarburants de première génération,
ou 1G, sont issus des parties alimentaires de plantes de grande culture
[6 ; 7].
Les biocarburants de première génération
sont principalement de deux types :
? Le bioéthanol : il est produit
à partir de canne à sucre, de l'amidon de céréales
et de betterave sucrière. Il est utilisé dans les moteurs
essences ;
? Le biodiesel : il est dérivé
de différentes sources d'acides gras, notamment les huiles de soja, de
colza, de palme et d'autres huiles végétales. Il est
utilisé dans le moteur diesel [4].
Seuls ces deux biocarburants sont aujourd'hui produits
à l'échelle industrielle grâce à des technologies
matures. Cependant leur utilisation reste minime vis-à-vis du
pétrole, 3,7 % en 2018 avec un potentiel maximum estimé à
10 % de substitution du pétrole consacré aux transports
[6] et leur production représente des perspectives
modestes d'améliorations de rendements [7 ;
8].
5
I.4 La transestérification
I.4.1 Définition
La transestérification est une réaction
organique dans laquelle le groupe organique R1 d'un ester est
échangé avec un autre groupe organique R2 d'un alcool selon un
mécanisme appelé alcoolyse. La réaction globale de la
transestérification est la suivante :

Figure I.1 : Réaction globale de la
transestérification.
I.4.2 Historique
La transestérification n'est pas un processus nouveau.
En effet, elle date de 1853 lorsque Patrick et Duffy ont mené cette
réaction bien plutôt avant que le premier moteur Diesel soit
fonctionnel [9].
Cette réaction a été l'objet de
recherches intensives grâce aux utilisations diverses de ces produits
comprenant entre autres la synthèse des polyesters ou PET
(Polyéthylène téréphtalate) dans l'industrie des
polymères [10], la synthèse des
intermédiaires pour l'industrie pharmaceutique [11], le
durcissement des résines dans l'industrie de peinture et dans la
production du biodiesel en tant qu'alternatif du diesel.
Le choix des huiles ou graisses à utiliser comme charge
pour la production de biodiesel est à la fois une décision de la
chimie du procédé et une décision économique. En ce
qui concerne la chimie du procédé, la plus grande
différence entre le choix des graisses et les huiles est la
quantité d'acides gras libres qui sont associés aux
triglycérides.
La plupart des huiles végétales ont un faible
pourcentage d'acides gras libres associés. Les huiles
végétales brutes contiennent des acides gras libres et des
phospholipides. Les phospholipides sont enlevés dans l'étape de
"dégommage", et les acides gras libres peuvent être retirés
durant le raffinage. On peut avoir l'huile sous sa forme brute,
dégommée, ou raffinée. La sélection du type et de
la qualité de l'huile, a une incidence sur la technologie de production
de biodiésel [12].
La formation d'esters constitue l'une des plus importantes
classes de réactions dans le traitement des graisses animales et des
huiles végétales à valeur ajoutée. Les
schémas typiques pour la formation d'esters comprennent :
6
ROH + R'COOH R'COOR + H2O estérification
ROH + R'COOR» R'COOR + R»OH alcoolyse
RCOOR' + R»COOR''' RCOOR''' + R»COOR'
transestérification
RCOOR' + R»COOH RCOOH + R»COOR' acidolyse
À l'échelle industrielle, les esters d'alkyle
d'acide gras (FAAEs) sont fabriqués soit par estérification
directe des acides gras ou par transestérification (également
appelé alcoolyse) des triglycérides (TG). L'estérification
est réalisée de manière discontinue à 473-573 K
sous pression ; l'eau de réaction doit être éliminée
en continu afin d'obtenir des rendements élevés.
L'estérification peut aussi être réalisée en continu
dans une colonne de réaction à contre-courant en utilisant un
alcool surchauffé [13].
Cependant, le procédé prédominant pour la
production des esters d'alkyle d'acide gras (FAAEs) est la
transestérification de TGs avec l'alcool, à la température
de reflux et à la pression atmosphérique en présence d'un
catalyseur.
La transestérification des huiles
végétales et des graisses animales est une réaction
d'équilibre consistant en un certain nombre de réactions
réversibles et consécutives dans lesquelles un
triglycéride est converti par étapes en diglycéride (DG),
monoglycéride (MG) et enfin le glycérol (GL).
À chaque étape, une molécule d'esters
d'acide gras est formée, comme suit [14] :
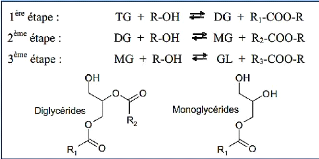
Figure I.2 : Les trois étapes successives et
réversibles de la réaction de transestérification
[14].
7
I.4.3 Matières premières
Un corps gras, huile ou graisse, appelé
également lipide, est composé principalement de
triglycérides à hauteur de 95-98 %. Les constituants mineurs
présents dans les huiles sont des acides gras libres, des mono et
diglycérides, des phospholipides, des tocophérols, des
stérols, des colorants naturels ainsi que des composés odorants
plus ou moins volatils [15]. Les triglycérides sont
constitués d'une molécule de glycérol
estérifiée avec 3 molécules d'acides gras semblables ou
différents [15].
Il existe de l'ordre de 20 acides gras dans la nature et leurs
nombreuses combinaisons possibles avec les 3 fonctions alcool du
glycérol conduisant à l'obtention d'une grande
variété de triglycérides et donc d'huiles [15].
Le Tableau I.1 montre les acides gras contenus dans
les diverses huiles comestibles :
Tableau I.1 : Acides gras contenus dans les diverses huiles
comestibles.
Acide gras Formule Classe
Palmitique C16 : 0 CH2- (CH2)14-COOH
Saturé
Stéarique C18 : 0 CH2-(CH2)16-COOH
Saturé
Oléique C18 : 1 CH3-
(CH2)7-CH=CH-(CH2)7-COOH Insaturé
|
Linoléique C18 : 2
CH3-(CH2)7-CH=CH-CH2-CH=CH-(CH2)4-CO
OH
|
Polyinsaturé
|
|
Linoléique C18 : 3
CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH
- (CH2)7-COOH
|
Polyinsaturé
|
I.4.4 La transestérification des
triglycérides
La transestérification des triglycérides
contenus dans une huile végétale avec un alcool conduit à
la formation du glycérol et un mélange de monoesters
utilisés comme biocarburant. Ce procédé a
été largement utilisé pour réduire la
viscosité des triglycérides [16].
8
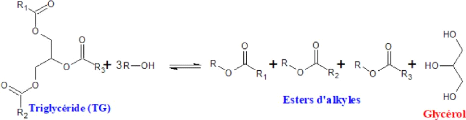
Figure I.3 : Réaction globale de la
transestérification des triglycérides avec un alcool
(R-OH)
avec R1, R2 et R3 des groupements alkyles présents dans les
acides gras.
I.4.5 Paramètres importants de la réaction
de transestérification
Plusieurs paramètres influent sur cette
réaction, tels que le type et la quantité du catalyseur, le choix
de l'alcool, le rapport molaire (alcool : huile), le temps et la
température de réaction ainsi que l'agitation
[18].
I.4.5.1 Type de catalyse
La réaction de transestérification est
thermodynamiquement favorable, mais lente, et réversible. Pour augmenter
sa vitesse et son rendement elle est généralement
facilitée en utilisant un catalyseur [19].
a. La catalyse homogène
C'est la catalyse la plus utilisée et peut être
réalisée avec les catalyseurs basiques ou acides. Les catalyseurs
homogènes constituent la dernière voie de catalyse de
transestérification des triglycérides avec les alcools.
Actuellement, les catalyseurs basiques homogènes sont
les plus utilisés dans les procédés industriels de
transestérification pour la production de biodiesel, principalement en
raison de leur efficacité à des températures relativement
modérées et de leur coût moins élevé que les
catalyseurs hétérogènes et surtout enzymatiques. Les
catalyseurs acides homogènes sont un peu moins utilisés car ils
peuvent être à l'origine de problèmes de corrosion
[17].
? Catalyse homogène basique
Les catalyseurs basiques sont les plus utilisés
grâce à leur grande réactivité et leur
caractère non corrosif des installations industrielles. Le
mécanisme réactionnel qui a lieu en utilisant l'hydroxyde de
sodium (NaOH).
Il est à noter que les catalyseurs solides
utilisés se divisent en deux types : acides comme ZrO et TiO et basiques
: MgO et CaO [26]. Néanmoins, cette technique demande
une modification
9
Le mécanisme de réaction de
transestérification alcaline homogène est simple mais englobe
plusieurs étapes. En effet, une pré-étape de formation de
l'alcoolate [20] est nécessaire pour réaliser la
réaction de transestérification si on utilise les hydroxydes
comme base.
Ce mécanisme consiste d'abord en une attaque
nucléophile du carbonyle (du triglycéride) par l'anion alcoolate
pour former un carbanion intermédiaire (phase d'addition). Puis,
départ nucléofuge lors du rabattement du doublet de
l'oxygène (phase d'élimination). L'alcoolate est
régénéré dès l'apparition d'une fonction
alcoolate du glycérol.
Ce mécanisme se répète à nouveau
pour donner le monoglycéride et la deuxième molécule
d'ester puis une dernière fois pour donner le glycérol et la
troisième molécule d'ester. Toutes les réactions sont
équilibrées [16].
? Catalyse homogène acide
La réaction de transestérification
catalysée par un acide est beaucoup plus lente que celle qui est
catalysée par une base. Cependant, l'utilisation d'un catalyseur acide
présente certains avantages tels que l'absence de la réaction de
saponification qui inhibe la réaction de transestérification (cas
de la catalyse basique). En outre, les matériaux acides sont capables de
catalyser simultanément les réactions de
transestérification et d'estérification de l'huile en biodiesel
même en présence d'une quantité élevée en
acides gras libres [23 ; 24].
b. La catalyse
hétérogène
La corrosion des moteurs due aux particules des catalyseurs
acides dissoutes dans le biocarburant, ou les réactions secondaires
diminuant le rendement dans la catalyse homogène basique, la
difficulté de récupération et de
régénération de ce type de catalyseur, ainsi que les
étapes de purification qui sont très délicates (notamment
d'étape de lavage) ont conduit à chercher d'autres solutions pour
contourner tous ces inconvénients : la catalyse
hétérogène s'avère être l'une des
solutions.
Leur intérêt principal est leur séparation
aisée du milieu réactionnel par simple filtration ainsi que leur
durée de vie plus ou moins élevée selon le catalyseur. En
effet, la possibilité de les réutiliser dans plusieurs cycles de
réaction présente un avantage non négligeable pour la
production de biodiesel à l'échelle industrielle. La
réduction de la consommation des catalyseurs implique une
réduction des coûts de production et de traitement
[25].
10
des conditions opératoires (augmentation de la
température et de pression qui sont élevées de 180
à 220°C sous 40 à 60 bars [27], du temps de
réaction et du rapport alcool : huile) et la réaction se
révèle plus lente en comparaison avec la catalyse homogène
[18].
c. Catalyse enzymatique
Au cours des dix dernières années, la catalyse
enzymatique dans les réactions de transestérification a fait
l'objet de recherches accentuées, en particulier dans le cas de
l'utilisation de la lipase. Cet engouement s'explique par
l'intérêt d'une alternative faisable et du travail dans des
conditions respectueuses de la chimie verte et de l'écologie
[29].
En effet, les enzymes possèdent plusieurs avantages :
Elles sont biodégradables, sélectives [28], ce
qui permet d'augmenter les rendements de la réaction tout en diminuant
la production des sous-produits de la réaction. Les conditions de la
réaction sont relativement douces (température et pression
basses) ce qui diminue le prix en terme d'énergie et
d'équipements et tend vers des coûts de gaspillage plus
faibles.
Dans le cas de la catalyse enzymatique on n'a ni le
problème des acides libres ni la sensibilité à l'eau ; on
peut bien travailler dans un milieu aqueux ou non aqueux. Notons bien que
l'enzyme peut être immobilisée sur un support
[28].
Mais la catalyse enzymatique est dotée de certains
inconvénients : en effet, l'enzyme est trop chère (par exemple la
lipase est plus cher qu'un catalyseur basique) et possède une
activité instable. Aussi, la réaction est trop lente [28]
et est donc limitée industriellement car elle dure entre 4-16 h
pour atteindre une conversion de 95%.
| 


