|
|
|
|
LUBUMBASHI
INDUSTRIELLE
|
|
|
|
|
UNIVERSITE DE
FACULTE POLYTECHNIQUE DEPARTEMENT DE CHIMIE
|
|
|
|
PRODUCTION DU BIODIESEL
PAR
TRANSESTÉRIFICATION À CATALYSE
HÉTÉROGÈNE DE
L'HUILE DE FRITURE
USAGÉE
|
|
Présenté par KAMBALE VITSENGE
Christian
Travail de fin d'études présenté et
défendu en vue de l'obtention du diplôme d'ingénieur civil
en Chimie industrielle
Dirigé par Professeur Jean-Marie KANDA
TUMBA
SEPTEMBRE 2024
|
|
|
|
|
LUBUMBASHI
INDUSTRIELLE
|
|
|
|
|
UNIVERSITE DE
FACULTE POLYTECHNIQUE DEPARTEMENT DE CHIMIE
|
|
|
|
PRODUCTION DU BIODIESEL
PAR
TRANSESTÉRIFICATION À CATALYSE
HÉTÉROGÈNE DE
L'HUILE DE FRITURE
USAGÉE
|
|
Présenté par KAMBALE VITSENGE
Christian
Travail de fin d'études présenté et
défendu en vue de l'obtention du diplôme d'ingénieur civil
en Chimie industrielle
Dirigé par Professeur Jean-Marie KANDA
TUMBA
ANNÉE ACADÉMIQUE 2022-2023
|
|
RÉSUMÉ
Notre travail portait sur l'étude de
transestérification d'une huile de friture usagée (HFU) en vue de
rechercher les meilleures conditions opératoires qui optimisent le
rendement et la qualité du biodiesel produit. En particulier,
l'influence du temps de la réaction, de la concentration en catalyseur
et du ratio molaire éthanol : huile sur les réponses
étudiées a été recherchée. La vitesse
d'agitation et la température de la réaction ont
été maintenues constantes.
Une méthodologie basée sur les plans
d'expériences a été mise en oeuvre et les résultats
de nos essais analysés à l'aide du logiciel EXCEL et MiniTAB. Le
rendement optimal obtenu était de 94 % et ce, en utilisant 3% en
catalyseur (niveau min), un rapport molaire éthanol : huile de 6 :1
(niveau max) et un temps de la réaction de 75 minutes (niveau max).
Du point de vue qualité, le biodiesel répondant
aux normes internationales (en termes de densité, viscosité et
indice d'acide) était celui produit avec une concentration en catalyseur
de 3% (min), un rapport molaire 6 :1 à un temps de réaction de 45
minutes (min).
Mots clés : Biocarburant, biodiesel,
catalyseur, huile usagée, transestérification.
ABSTRACT
Our work focused on the study of transesterification of used
frying oil (HFU) with a view to seeking the best operating conditions which
optimize the yield and quality of the biodiesel produced. In particular, the
influence of the reaction time, the catalyst concentration and the ethanol: oil
molar ratio on the responses studied was sought. The stirring speed and the
reaction temperature were kept constant.
A methodology based on experimental plans was implemented and
the results of our tests analyzed using EXCEL and MiniTAB software. The optimal
yield obtained was 94%, using 3% catalyst (min level), an ethanol: oil molar
ratio of 6:1 (max level) and a reaction time of 75 minutes (max level).
From a quality point of view, the biodiesel meeting
international standards (in terms of density, viscosity and acid number) was
that produced with a catalyst concentration of 3% (min), a molar ratio 6:1 at a
time of reaction of 45 minutes (min).
Key words: Biofuel, biodiesel, catalyst, used
oil, transesterification.

TABLE DES MATIÈRES
TABLE DES MATIÈRES I
LISTE DES FIGURES IV
LISTE DES TABLEAUX V
LISTE D'ÉQUATIONS VI
SIGLE ET ABRÉVIATIONS VII
GLOSSAIRE VIII
ÉPIGRAPHE IX
DÉDICACE X
AVANT-PROPOS XI
INTRODUCTION GÉNÉRALE 1
CHAPITRE I. GÉNÉRALITÉS SUR LES
BIOCARBURANTS 3
I.1 Définition des biocarburants 3
I.2 Historique 3
I.3 Classes des biocarburants 4
I.4 La transestérification 5
I.4.1 Définition 5
I.4.2 Historique 5
I.4.3 Matières premières 7
I.4.4 La transestérification des triglycérides 7
I.4.5 Paramètres importants de la réaction de
transestérification 8
I.5 Le biodiesel 13
I.5.1 Définition du biodiesel 13
I.5.2 L'utilité du biodiesel 13
I.5.3 Caractéristiques physiques et chimiques du biodiesel
14
II
I.5.4 Utilisation du biodiesel dans les moteurs 17
I.5.5 Avantages et inconvénients du biodiesel 20
CHAPITRE II. NOTIONS SUR LA MODÉLISATION
EXPÉRIMENTALE 22
II.1 PLANS D'EXPÉRIENCES 22
II.2 MODÉLISATION MATHÉMATIQUE 24
II.2.1 SYSTEME D'EQUATIONS 24
II.3 PLAN FACTORIEL COMPLET À DEUX NIVEAUX 25
II.3.1 Matrice d'expérience 25
CHAPITRE III. MATÉRIELS ET MÉTHODE 27
III.1 PRÉSENTATION DES MATIÈRES PREMIÈRES
27
III.1.1 Oxyde de fer (III) 27
III.1.2 Huile de soja 27
III.1.3 Éthanol 28
III.2 PRODUCTION DU BIOCARBURANT 28
III.2.1 Échantillonnage 28
III.2.2 Synthèse du biodiesel 29
III.2.3 Protocol expérimental 31
III.3 CARACTÉRISATION PHYSICO-CHIMIQUE DES BIOCARBURANTS
32
III.3.1 Analyses chimiques 32
III.3.2 Analyses physiques 34
CHAPITRE IV. ANALYSE ET INTERPRÉTATION DES
RÉSULTATS 36
IV.1 CARACTÉRISATION DE L'HUILE USAGÉE 36
IV.2 RÉACTION DE TRANSESTÉRIFICATION 37
IV.2.1 Effets de la concentration du catalyseur sur le rendement
38
IV.2.2 Effets du ratio molaire éthanol/huile sur le
rendement 39
IV.2.3 Effets du temps de la réaction sur le rendement
40
IV.3 CARACTÉRISATION DU BIODIESEL OBTENU 41
III
IV.4 MODÉLISATION MATHÉMATIQUE DES RÉSULTATS
OBTENUS 43
CONCLUSION 46
RÉFÉRENCES BIBLIOGRAPHIQUES 48
IV
LISTE DES FIGURES
Figure I.1 : Réaction globale de la
transestérification. 5
Figure I.2 : Les trois étapes successives et
réversibles de la réaction de transestérification [14].
6
Figure I.3 : Réaction globale de la
transestérification des triglycérides avec un alcool (R-OH)
avec R1, R2 et R3 des groupements alkyles présents dans
les acides gras. 8
Figure II.1 : Le domaine expérimental de nos
études. 26
Figure IV.1 : Histogramme représentant l'effet de la
concentration du catalyseur sur le
rendement. 38
Figure IV.2 : Histogramme représentant l'effet du ratio
molaire sur le rendement. 39
Figure IV.3 : Histogramme représentant l'effet du temps de
la réaction sur le rendement. 40
V
LISTE DES TABLEAUX
Tableau I.1 : Acides gras contenus dans les diverses huiles
comestibles. 7
Tableau I.2 : Comparaison entre catalyses homogène et
hétérogène. 11
Tableau I.3 :Propriétés physico-chimiques de
biodiesels produits à partir de diverses matières
premières. 14
Tableau I.4 : La comparaison de certains
paramètres clés pour le carburant B100 par rapport au
gazole [54]. 19
Tableau II.1 : Les niveaux de facteurs pour le plan factoriel
complet. 23
Tableau II.2 : Matrice d'expérience en unité
centrée réduite. 26
Tableau III.1 : Composition de l'huile de soja en acide gras.
28
Tableau III.2 : Conditions opératoires choisies pour les
expériences. 29
Tableau IV.1 : Caractéristiques physico-chimiques des
huiles de soja usagée et vierge. 36
Tableau IV.2 : Les rendements des 10 expériences. 37
Tableau IV.3 : Résultats des caractéristiques
physico-chimiques des biocarburants 41
Tableau IV.4 : Volumes d'HCl des 10 biocarburants. 42
Tableau IV.5 : Paramètres de modélisation. 43
Tableau IV.6 : Analyse de la variance de réponse. 44
VI
LISTE D'ÉQUATIONS
Équation III.1 : Calcul de la masse de
l'éthanol. 29
Équation III.2 : Calcul de la masse du catalyseur.
29
Équation III.3 : Calcul de l'indice d'acide. 32
Équation III.4 : Calcul de l'indice de saponification.
33
Équation III.5 : Calcul de l'indice d'iode. 34
Équation III.6 : Calcul de la densité. 34
Équation III.7 : Calcul de la viscosité par la
formule de Stokes. 35
Équation IV.1 : le modèle de régression
ajusté aux données. 44
VII
SIGLE ET ABRÉVIATIONS
AGL : Acides Gras Libres
ASTM : American Society for Testing and
Materials
BD : Biodiesel
BLC : Biomasse Lignocellulosique
cST : centistokes
CTC : Conversion thermochimique
DG : Diglycéride
EAG : Ester d'acide gras
EEHV : Ester Éthylique d'Huile
Végétale
EMAG : Ester méthylique d'acide
gras
EMHV : Ester Méthylique d'Huile
Végétale
EN : European Norm
G : Glycérol
HFU : Huile de friture usagée
HV : Huile Vierge
IA : Indice d'acide
II : Indice d'iode
IS : Indice de saponification
MG : Monoglycéride
ML : Millions de Litres
Mt : Million de tonnes
Mtep : Million de tonnes équivalent
pétrole
NIST : National Institute of Standards and
Technology
PCS : Pouvoir Calorifique Supérieur
PET : Polyéthylène
téréphtalate
ppm : partie par million
R&D : Recherche et
Développement
TG : Triglycéride
tR : temps de rétention
UE : Union Européenne
VIII
GLOSSAIRE
Acide : Tout corps capable de libérer
des ions hydrogène dans l'eau, de causer la corrosion des métaux,
de colorer en rouge le papier tournesol, possédant un pH
inférieur à 7.
Acide gras : Lipide formé d'une chaine
hydrocarbonée plus ou moins longue comportant un groupe acide
carboxylique à une extrémité et un groupe méthyle
à l'autre
Acide gras libre : Acide gras non
estérifié, ils ne sont pas sous forme d'ester de glycérol.
Présents dans les huiles végétales en faible
quantité, leur concentration devient considérable dans les
graisses ou les huiles usées.
Acidité : l'acidité d'une huile
est la quantité d'acide gras libre exprimé en pourcentage, dans
une masse de 1 gramme d'huile.
Indice d'acide : l'indice d'acide d'une huile
est la quantité en milligramme de KOH pour neutraliser les acides gras
libres présent dans 1 gramme d'huile.
Indice de cétane : C'est la
capacité d'auto-inflammation d'un combustible.
Point de trouble : c'est la
température à laquelle un produit liquide devient trouble par
l'apparition de cristaux lorsque le produit est refroidi dans les conditions
normalisées
Point d'écoulement : c'est la
température la plus basse à laquelle un produit liquide peut
encore couler lorsqu'il est refroidi dans les conditions prescrites.
Point d'éclair : C'est la
température la plus basse à laquelle le liquide
considéré fournit suffisamment de vapeurs pour former, avec l'air
ambiant, un mélange gazeux qui s'enflamme sous l'effet d'une source
d'énergie calorifique telle qu'une flamme pilote ou une
étincelle, mais pas suffisamment pour que la combustion s'entretienne
d'elle-même (pour ceci, il faut atteindre le point d'inflammation).
Viscosité : C'est la capacité d'un
fluide à s'écouler.
IX
ÉPIGRAPHE
« Les biocarburants offrent une voie
durable vers un avenir énergétique plus
respectueux de l'environnement
»
Ir Chris VITSENGE
X
DÉDICACE
À mes très chers parents et à toute la
grande famille VITSENGE À tous ceux qui me sont chers
À tous mes amis et proches
Je dédie le fruit de mes 15 ans
d'études.
XI
AVANT-PROPOS
L'utilisation croissante des énergies renouvelables est
devenue une priorité mondiale pour lutter contre le changement
climatique et réduire notre dépendance aux combustibles fossiles.
Dans ce contexte, la production de biodiesel à partir d'huiles
végétales est une alternative prometteuse et durable aux
carburants traditionnels.
Ipso facto, ce travail s'inscrit dans une démarche plus
large visant à promouvoir le développement d'une filière
de production de biodiesel durable et respectueuse de l'environnement. Il
contribue ainsi à la recherche de solutions innovantes pour
répondre aux défis énergétiques actuels et
futurs.
Je tiens à exprimer mes sincères remerciements
à toutes les personnes qui m'ont soutenu et encouragé tout au
long de ce projet. Coup de maître à mon directeur pour cette
recherche, le Professeur KANDA TUMBA Jean-Marie pour sa guidance
précieuse, son soutien constant et ses conseils éclairés
tout au long de la réalisation de ce mémoire. Sa passion pour la
chimie industrielle et son expertise m'ont inspiré et ont grandement
contribué à la réussite de ce travail.
Je souhaite également exprimer ma gratitude à
mon encadrant, Serge KATUFU, pour sa collaboration étroite, son
expertise complémentaire et ses conseils avisés. Sa
présence et son soutien ont été d'une importance capitale
dans l'accomplissement de ce mémoire.
Leur encadrement attentif, leur disponibilité et leur
engagement ont été des facteurs déterminants dans la
qualité de ce travail de recherche. Je suis reconnaissant d'avoir eu
l'opportunité de travailler avec eux et d'avoir pu
bénéficier de leur expertise et de leurs conseils tout au long de
ce projet.
Je remercie sincèrement les autorités de la plus
prestigieuse École du Cinquantenaire pour leurs multiples efforts
fournis dès mes bas âges et du sens du travail qu'ils m'ont
transmis afin que je devienne ce que je suis maintenant. Je garderai pour
longtemps un souvenir ému de mon passage dans cette grande institution
qui m'a tant donnée. Grâce à vous, j'aborde une nouvelle
étape de ma vie avec confiance et dynamisme.
Mes remerciements s'adressent également au corps
académique de l'Université de Lubumbashi en général
et de la faculté Polytechnique en particulier pour ces années de
formation au sein de ladite institution où j'ai pu acquérir des
plus grandes connaissances sur les plans moral, social et intellectuel.
XII
À mes très chers parents PALUKU VITSENGE JB et
KAVUGHO KAHINDO Zawadi de m'avoir appris à surmonter mes peurs et
d'être toujours là quand cela était nécessaire. Je
vous remercie de m'avoir tant donné, de m'avoir fait croire en l'Amour,
et d'avoir logé en mon coeur tant d'affections, quand le monde
extérieur peut parfois être si cruel, mais aussi pour les
encouragements pour l'école et mes études, votre soutien a
été d'une importance capitale pour m'aider à me lancer
dans ma vie adulte. Votre regard bienveillant sur moi m'a aidé à
pousser droit, à grandir comme il le faut, bien enraciné dans le
sol mais la tête en hauteur, pleine de rêves à
réaliser. Merci infiniment à mon oncle Wilson KALYENE pour son
accompagnement indéfectible tout au long de la rédaction et de la
réalisation de ce travail.
Mille mercis à tous les VITSENGE : Gentille, Ricardo,
Laurène, Lydie, Jospin et Alphonsine, j'ai été
touché par votre présence et par votre soutien. Vous avez rendu
chaque jour plus amusant et je suis tellement heureux que nous ayons grandi
ensemble. Cela m'a fait chaud au coeur.
À tous mes amis de lutte : Roger K.,
Bénédicte K., Néhémie R., Patrocle M., Junior M.,
Guillain N., Victoire K., Jospin S., Josiane S., Enock V., Dovin Z. avec qui
nous avons mené ce très long chemin pour en arriver là que
nous sommes. Il est rare de rencontrer des personnes aussi
dévouées et dignes de confiance. Vos efforts ne passent pas
inaperçus. À tous ceux-là qui nous ont soutenus durant
notre cursus, Merveille Sibita, Inesse Musayi, Paulin Ndethi, Josué
Kombi, André Ndale, Piscas Kitswamba, El-Bethel Kami, Dorcas Kakera et
tous les autres, sentez-vous honorés.
Merci du fond du coeur à tous mes ainés
scientifiques : Ir Archimède, Ir Aristote, Ir Claude, Ir Christian B.,
Ir Donatien, Ir Jonathan W., Ir Grâce K., Ir Pataoli pour votre
attention, votre gentillesse, votre écoute, vos paroles
réconfortantes, votre orientation et votre professionnalisme que j'ai
vécu sereinement et apaisé.
Je tiens à exprimer mes remerciements les plus
sincères à la CEV Saint Ignace de Loyola, et tout
particulièrement à ses membres dévoués, Anastasie
Lulu, Gloire Kanyinda, Arsène Buhika, et tant d'autres, qui ont
joué un rôle crucial dans mon développement spirituel. Leur
accompagnement bienveillant, leurs prières et leur soutien constant ont
été des sources d'inspiration et de force tout au long de notre
parcours d'études. À tous les membres également, je vous
adresse mes plus sincères remerciements pour avoir enrichi mon parcours
académique d'une dimension spirituelle précieuse et pour m'avoir
permis de grandir dans la foi et la fraternité.
1
INTRODUCTION GÉNÉRALE
Depuis des siècles anciens, l'homme a toujours
été à la recherche des solutions pour satisfaire ses
besoins et apaiser les conséquences néfastes qui peuvent
perturber son environnement. Actuellement le pétrole naturel domine
notre vie quotidienne, depuis le transport jusque dans nos cuisines, le
pétrole est utilisé dans presque tous les domaines de notre
quotidien.
Face aux problèmes environnementaux que
présentent les hydrocarbures fossiles, l'homme a eu à penser aux
biocarburants qui ont moins d'effets négatifs sur l'environnement et
dont la fabrication est très simple suite à l'abondance de la
matière première qui est renouvelable.
Ainsi donc, l'humanité entière est à la
recherche de perspectives et des pistes de solution pour satisfaire ses
multiples besoins énergétiques dans le futur, cela suite à
la diminution des ressources mondiales du pétrole et
l'instabilité sur le marché du prix du baril. De toute
évidence, les récits les plus enthousiastes prévoient que
le pic pétrolier sera atteint entre 2028 et 2030 [1].
Par contre, des scénarios les plus pessimistes espèrent qu'on a
déjà atteint ce pic depuis l'année 2010 et que la
production commence à baisser progressivement [1].
L'utilisation croissante des combustibles fossiles et ses
conséquences environnementales ont suscité un
intérêt croissant pour les sources d'énergie renouvelables
et durables. Dans ce cadre, le biodiesel, un carburant produit à partir
de matières premières renouvelables telles que les huiles
végétales, est devenu une alternative prometteuse aux carburants
traditionnels [2].
La gestion d'huile de friture usagée représente
un défi environnemental majeur en raison de son impact potentiel sur
l'écosystème. La transestérification à catalyse
hétérogène offre une solution pour valoriser ces huiles en
produisant du biodiesel, mais des études étant nécessaires
pour optimiser ce processus.
L'objectif principal de ce travail est donc de convertir de
manière efficace et durable l'huile de friture usagée en
biodiesel par le biais de la transestérification à catalyse
hétérogène ainsi qu'à optimiser les conditions de
réaction pour améliorer le rendement et la qualité du
biodiesel obtenu.
Pour ce faire, outre l'échantillonnage de l'huile de
friture usagée qui a été fait dans les restaurants et les
habitations, son traitement ainsi que la réalisation de notre
réacteur de transestérification. Après
caractérisation de l'huile de friture usagée, nous avons
procédé aux
2
différentes réactions dont les réactifs
principaux utilisés étaient l'oxyde ferrique comme catalyseur
hétérogène et l'éthanol comme alcool.
Nous avons réalisé dix expériences tout
en variant certains paramètres entre autres la concentration du
catalyseur, le temps de la réaction et le ratio molaire éthanol :
huile pour voir les impacts sur le produit final, et nous avons maintenu la
température de notre réaction constante 65°C.
L'intérêt du présent travail est qu'en
réduisant la dépendance aux carburants fossiles et en favorisant
l'utilisation de biocarburants plus durables et respectueux de l'environnement,
nous valorisons l'huile de friture usagée en produisant un carburant
alternatif renouvelable tout en contribuant à la réduction des
émissions de gaz à effet de serre en promouvant l'utilisation des
biocarburants. Pendant notre étude, certains paramètres ont
été variés tels que : la concentration du catalyseur (%),
le temps de la réaction ainsi que le rapport molaire huile :
éthanol.
Ainsi, ce présent travail s'est articulé sur
quatre grands chapitres. Le premier est un tour d'horizon sur les
biocarburants, en particulier le biodiesel et toutes les matières
possibles pouvant être utilisées pour sa production.
Les trois derniers chapitres de notre travail seront
consacrés à la partie expérimentale.
Le deuxième chapitre sera consacré à une
notion sur la modélisation expérimentale qui se fera avec un plan
factoriel complet avec quelques paramètres que nous allons choisir et
les faire varier à l'aide des logiciels EXCEL et MiniTAB.
Le troisième et le quatrième chapitre porteront
sur les différentes méthodes et les équipements
nécessaires pour réaliser une meilleure production, nous
présenterons également de manière particulière les
différentes matières premières qui nous
intéresserons dans le cadre de notre étude à
l'échelle laboratoire ainsi que l'analyse de différents
résultats que nous aurons obtenus afin de vérifier ses
propriétés physiques et chimiques et leurs conformités.
En dernier lieu, nous terminerons par une conclusion et des
perspectives de recherche dans ce domaine.
Durant la seconde guerre mondiale, les allemands qui devaient
faire face à des pénuries de carburants utilisèrent un
procédé pour fabriquer l'équivalent du pétrole
à partir du charbon.
3
CHAPITRE I. GÉNÉRALITÉS SUR
LES
BIOCARBURANTS
Ce chapitre aborde les principaux aspects de cette source
d'énergie renouvelable. Il présente d'abord une définition
des biocarburants, qui sont des carburants produits à partir de
matières organiques renouvelables telles que les plantes, les
déchets agricoles ou forestiers. Ensuite, le chapitre explore les
différents types de biocarburants, tels que l'éthanol, le
biodiesel et le biogaz, ainsi que leurs avantages et inconvénients en
termes de durabilité, d'efficacité énergétique et
d'impact environnemental.
I.1 Définition des biocarburants
L'union européenne a défini les biocarburants
(biofuels en anglais) comme des combustibles liquides ou gazeux utilisés
pour le transport et produits à partir de la biomasse [3]
ou en d'autres termes, un biocarburant est un carburant liquide ou
gazeux crée à partir de la transformation de matériaux
organiques non fossiles issus de la biomasse, par exemple des matières
végétales produites par l'agriculture (betterave, blé,
maïs, colza, tournesol, pomme de terre, etc.) [4].
Si la langue anglaise n'a retenu qu'une seule appellation
« biofuel », plusieurs dénominations coexistent dans la langue
française : biocarburant (terme retenu par le Parlement
européen), agrocarburant ou carburant végétal
[4]. Les biocarburants sont assimilés à une
source d'énergie renouvelable. Leur combustion ne produit que du CO2 et
de la vapeur d'eau et pas ou peu d'oxydes azotés et soufrés (NOX,
SOX).
I.2 Historique
Les biocarburants sont connus depuis le début de
l'industrie automobile. En effet Nikolaus Otto, l'inventeur du moteur à
explosion avait conçu son invention pour utiliser de l'éthanol.
De son côté, Rudolf Diesel l'inventeur du moteur à
combustion faisait tourner ses machines à l'huile d'arachide. La Ford T,
produite entre 1903 et 1926 roulait à l'éthanol. Ensuite, le
pétrole que l'on commençait à extraire depuis le milieu du
XIXème siècle devint bon marché, et les consommateurs et
les industriels se détournèrent des biocarburants.
4
Après les chocs pétroliers de 1973 et 1979, les
autorités s'intéressèrent davantage aux biocarburants et
de nombreuses études furent menées à la fin des
années 1970 et au début des années 1980. Avec la baisse du
prix du pétrole en 1986, l'intérêt pour les biocarburants
retomba.
Finalement, au début et au milieu des années
2000, avec la nouvelle hausse du prix du baril de pétrole, et la crainte
du pic pétrolier, la volonté de lutter contre l'effet de serre,
et avec les craintes sur la stabilité de certains pays producteurs, les
gouvernements multiplièrent les discours et aides pour le secteur des
biocarburants.
Par exemple, George Bush, dans son discours de l'union de
janvier 2006, a déclaré qu'il voulait que son pays se passe de
75% du pétrole issu du Proche-Orient pour 2025. La Commission
Européenne veut de son côté que les pays membres incluent
au moins 5,75% de biocarburants dans l'essence [5].
I.3 Classes des biocarburants
Les biocarburants obtenus par valorisation de la biomasse
peuvent être de première, de deuxième ou de
troisième génération.
Les biocarburants de première génération,
ou 1G, sont issus des parties alimentaires de plantes de grande culture
[6 ; 7].
Les biocarburants de première génération
sont principalement de deux types :
? Le bioéthanol : il est produit
à partir de canne à sucre, de l'amidon de céréales
et de betterave sucrière. Il est utilisé dans les moteurs
essences ;
? Le biodiesel : il est dérivé
de différentes sources d'acides gras, notamment les huiles de soja, de
colza, de palme et d'autres huiles végétales. Il est
utilisé dans le moteur diesel [4].
Seuls ces deux biocarburants sont aujourd'hui produits
à l'échelle industrielle grâce à des technologies
matures. Cependant leur utilisation reste minime vis-à-vis du
pétrole, 3,7 % en 2018 avec un potentiel maximum estimé à
10 % de substitution du pétrole consacré aux transports
[6] et leur production représente des perspectives
modestes d'améliorations de rendements [7 ;
8].
5
I.4 La transestérification
I.4.1 Définition
La transestérification est une réaction
organique dans laquelle le groupe organique R1 d'un ester est
échangé avec un autre groupe organique R2 d'un alcool selon un
mécanisme appelé alcoolyse. La réaction globale de la
transestérification est la suivante :

Figure I.1 : Réaction globale de la
transestérification.
I.4.2 Historique
La transestérification n'est pas un processus nouveau.
En effet, elle date de 1853 lorsque Patrick et Duffy ont mené cette
réaction bien plutôt avant que le premier moteur Diesel soit
fonctionnel [9].
Cette réaction a été l'objet de
recherches intensives grâce aux utilisations diverses de ces produits
comprenant entre autres la synthèse des polyesters ou PET
(Polyéthylène téréphtalate) dans l'industrie des
polymères [10], la synthèse des
intermédiaires pour l'industrie pharmaceutique [11], le
durcissement des résines dans l'industrie de peinture et dans la
production du biodiesel en tant qu'alternatif du diesel.
Le choix des huiles ou graisses à utiliser comme charge
pour la production de biodiesel est à la fois une décision de la
chimie du procédé et une décision économique. En ce
qui concerne la chimie du procédé, la plus grande
différence entre le choix des graisses et les huiles est la
quantité d'acides gras libres qui sont associés aux
triglycérides.
La plupart des huiles végétales ont un faible
pourcentage d'acides gras libres associés. Les huiles
végétales brutes contiennent des acides gras libres et des
phospholipides. Les phospholipides sont enlevés dans l'étape de
"dégommage", et les acides gras libres peuvent être retirés
durant le raffinage. On peut avoir l'huile sous sa forme brute,
dégommée, ou raffinée. La sélection du type et de
la qualité de l'huile, a une incidence sur la technologie de production
de biodiésel [12].
La formation d'esters constitue l'une des plus importantes
classes de réactions dans le traitement des graisses animales et des
huiles végétales à valeur ajoutée. Les
schémas typiques pour la formation d'esters comprennent :
6
ROH + R'COOH R'COOR + H2O estérification
ROH + R'COOR» R'COOR + R»OH alcoolyse
RCOOR' + R»COOR''' RCOOR''' + R»COOR'
transestérification
RCOOR' + R»COOH RCOOH + R»COOR' acidolyse
À l'échelle industrielle, les esters d'alkyle
d'acide gras (FAAEs) sont fabriqués soit par estérification
directe des acides gras ou par transestérification (également
appelé alcoolyse) des triglycérides (TG). L'estérification
est réalisée de manière discontinue à 473-573 K
sous pression ; l'eau de réaction doit être éliminée
en continu afin d'obtenir des rendements élevés.
L'estérification peut aussi être réalisée en continu
dans une colonne de réaction à contre-courant en utilisant un
alcool surchauffé [13].
Cependant, le procédé prédominant pour la
production des esters d'alkyle d'acide gras (FAAEs) est la
transestérification de TGs avec l'alcool, à la température
de reflux et à la pression atmosphérique en présence d'un
catalyseur.
La transestérification des huiles
végétales et des graisses animales est une réaction
d'équilibre consistant en un certain nombre de réactions
réversibles et consécutives dans lesquelles un
triglycéride est converti par étapes en diglycéride (DG),
monoglycéride (MG) et enfin le glycérol (GL).
À chaque étape, une molécule d'esters
d'acide gras est formée, comme suit [14] :
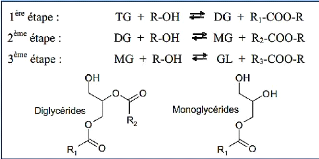
Figure I.2 : Les trois étapes successives et
réversibles de la réaction de transestérification
[14].
7
I.4.3 Matières premières
Un corps gras, huile ou graisse, appelé
également lipide, est composé principalement de
triglycérides à hauteur de 95-98 %. Les constituants mineurs
présents dans les huiles sont des acides gras libres, des mono et
diglycérides, des phospholipides, des tocophérols, des
stérols, des colorants naturels ainsi que des composés odorants
plus ou moins volatils [15]. Les triglycérides sont
constitués d'une molécule de glycérol
estérifiée avec 3 molécules d'acides gras semblables ou
différents [15].
Il existe de l'ordre de 20 acides gras dans la nature et leurs
nombreuses combinaisons possibles avec les 3 fonctions alcool du
glycérol conduisant à l'obtention d'une grande
variété de triglycérides et donc d'huiles [15].
Le Tableau I.1 montre les acides gras contenus dans
les diverses huiles comestibles :
Tableau I.1 : Acides gras contenus dans les diverses huiles
comestibles.
Acide gras Formule Classe
Palmitique C16 : 0 CH2- (CH2)14-COOH
Saturé
Stéarique C18 : 0 CH2-(CH2)16-COOH
Saturé
Oléique C18 : 1 CH3-
(CH2)7-CH=CH-(CH2)7-COOH Insaturé
|
Linoléique C18 : 2
CH3-(CH2)7-CH=CH-CH2-CH=CH-(CH2)4-CO
OH
|
Polyinsaturé
|
|
Linoléique C18 : 3
CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH
- (CH2)7-COOH
|
Polyinsaturé
|
I.4.4 La transestérification des
triglycérides
La transestérification des triglycérides
contenus dans une huile végétale avec un alcool conduit à
la formation du glycérol et un mélange de monoesters
utilisés comme biocarburant. Ce procédé a
été largement utilisé pour réduire la
viscosité des triglycérides [16].
8
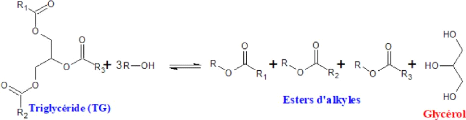
Figure I.3 : Réaction globale de la
transestérification des triglycérides avec un alcool
(R-OH)
avec R1, R2 et R3 des groupements alkyles présents dans les
acides gras.
I.4.5 Paramètres importants de la réaction
de transestérification
Plusieurs paramètres influent sur cette
réaction, tels que le type et la quantité du catalyseur, le choix
de l'alcool, le rapport molaire (alcool : huile), le temps et la
température de réaction ainsi que l'agitation
[18].
I.4.5.1 Type de catalyse
La réaction de transestérification est
thermodynamiquement favorable, mais lente, et réversible. Pour augmenter
sa vitesse et son rendement elle est généralement
facilitée en utilisant un catalyseur [19].
a. La catalyse homogène
C'est la catalyse la plus utilisée et peut être
réalisée avec les catalyseurs basiques ou acides. Les catalyseurs
homogènes constituent la dernière voie de catalyse de
transestérification des triglycérides avec les alcools.
Actuellement, les catalyseurs basiques homogènes sont
les plus utilisés dans les procédés industriels de
transestérification pour la production de biodiesel, principalement en
raison de leur efficacité à des températures relativement
modérées et de leur coût moins élevé que les
catalyseurs hétérogènes et surtout enzymatiques. Les
catalyseurs acides homogènes sont un peu moins utilisés car ils
peuvent être à l'origine de problèmes de corrosion
[17].
? Catalyse homogène basique
Les catalyseurs basiques sont les plus utilisés
grâce à leur grande réactivité et leur
caractère non corrosif des installations industrielles. Le
mécanisme réactionnel qui a lieu en utilisant l'hydroxyde de
sodium (NaOH).
Il est à noter que les catalyseurs solides
utilisés se divisent en deux types : acides comme ZrO et TiO et basiques
: MgO et CaO [26]. Néanmoins, cette technique demande
une modification
9
Le mécanisme de réaction de
transestérification alcaline homogène est simple mais englobe
plusieurs étapes. En effet, une pré-étape de formation de
l'alcoolate [20] est nécessaire pour réaliser la
réaction de transestérification si on utilise les hydroxydes
comme base.
Ce mécanisme consiste d'abord en une attaque
nucléophile du carbonyle (du triglycéride) par l'anion alcoolate
pour former un carbanion intermédiaire (phase d'addition). Puis,
départ nucléofuge lors du rabattement du doublet de
l'oxygène (phase d'élimination). L'alcoolate est
régénéré dès l'apparition d'une fonction
alcoolate du glycérol.
Ce mécanisme se répète à nouveau
pour donner le monoglycéride et la deuxième molécule
d'ester puis une dernière fois pour donner le glycérol et la
troisième molécule d'ester. Toutes les réactions sont
équilibrées [16].
? Catalyse homogène acide
La réaction de transestérification
catalysée par un acide est beaucoup plus lente que celle qui est
catalysée par une base. Cependant, l'utilisation d'un catalyseur acide
présente certains avantages tels que l'absence de la réaction de
saponification qui inhibe la réaction de transestérification (cas
de la catalyse basique). En outre, les matériaux acides sont capables de
catalyser simultanément les réactions de
transestérification et d'estérification de l'huile en biodiesel
même en présence d'une quantité élevée en
acides gras libres [23 ; 24].
b. La catalyse
hétérogène
La corrosion des moteurs due aux particules des catalyseurs
acides dissoutes dans le biocarburant, ou les réactions secondaires
diminuant le rendement dans la catalyse homogène basique, la
difficulté de récupération et de
régénération de ce type de catalyseur, ainsi que les
étapes de purification qui sont très délicates (notamment
d'étape de lavage) ont conduit à chercher d'autres solutions pour
contourner tous ces inconvénients : la catalyse
hétérogène s'avère être l'une des
solutions.
Leur intérêt principal est leur séparation
aisée du milieu réactionnel par simple filtration ainsi que leur
durée de vie plus ou moins élevée selon le catalyseur. En
effet, la possibilité de les réutiliser dans plusieurs cycles de
réaction présente un avantage non négligeable pour la
production de biodiesel à l'échelle industrielle. La
réduction de la consommation des catalyseurs implique une
réduction des coûts de production et de traitement
[25].
10
des conditions opératoires (augmentation de la
température et de pression qui sont élevées de 180
à 220°C sous 40 à 60 bars [27], du temps de
réaction et du rapport alcool : huile) et la réaction se
révèle plus lente en comparaison avec la catalyse homogène
[18].
c. Catalyse enzymatique
Au cours des dix dernières années, la catalyse
enzymatique dans les réactions de transestérification a fait
l'objet de recherches accentuées, en particulier dans le cas de
l'utilisation de la lipase. Cet engouement s'explique par
l'intérêt d'une alternative faisable et du travail dans des
conditions respectueuses de la chimie verte et de l'écologie
[29].
En effet, les enzymes possèdent plusieurs avantages :
Elles sont biodégradables, sélectives [28], ce
qui permet d'augmenter les rendements de la réaction tout en diminuant
la production des sous-produits de la réaction. Les conditions de la
réaction sont relativement douces (température et pression
basses) ce qui diminue le prix en terme d'énergie et
d'équipements et tend vers des coûts de gaspillage plus
faibles.
Dans le cas de la catalyse enzymatique on n'a ni le
problème des acides libres ni la sensibilité à l'eau ; on
peut bien travailler dans un milieu aqueux ou non aqueux. Notons bien que
l'enzyme peut être immobilisée sur un support
[28].
Mais la catalyse enzymatique est dotée de certains
inconvénients : en effet, l'enzyme est trop chère (par exemple la
lipase est plus cher qu'un catalyseur basique) et possède une
activité instable. Aussi, la réaction est trop lente [28]
et est donc limitée industriellement car elle dure entre 4-16 h
pour atteindre une conversion de 95%.
I.4.5.2 Influence de la quantité du
catalyseur
La quantité de catalyseur utilisée est fonction
des autres paramètres de la réaction (température, temps,
ratio alcool/huile). Elle peut d'une part influencer positivement le rendement
de conversion en accélérant la cinétique de la
réaction, ou d'autre part négativement en provoquant des effets
de lessivage du catalyseur [30]. Utilisé en
excès, le catalyseur peut entrainer des réactions secondaires
d'hydrolyse ou de saponification [31 ; 32].
Le rendement de conversion augmente en fonction de la
quantité de catalyseur dans le milieu réactionnel jusqu'à
atteindre un optimum au-delà duquel le rendement n'augmente plus et a
même tendance à baisser par l'effet d'une viscosité
élevée du milieu réactionnel [33 ;
34].
d. Comparaison entre les catalyseurs homogène et
hétérogène
La production du biodiesel par transestérification est
une étape cruciale dans la transformation des huiles
végétales en un carburant alternatif. Les catalyseurs jouent un
rôle essentiel dans ce
11
processus en facilitant la réaction de
transestérification. Le Tableau I.2 compare les
catalyseurs hétérogènes et homogènes
utilisés dans la transestérification pour produire le
biodiesel.
Tableau I.2 : Comparaison entre catalyses homogène
et hétérogène.
Catalyseur homogène Catalyseur
hétérogène
· Catalyseurs souvent plus actifs et plus
sélectifs ;
· Difficultés de séparation et recyclage
de solvants et du catalyseur ;
· Réacteurs plus simples et échanges
thermiques plus favorables ;
· Problèmes de corrosion et de transport de
matière
· Catalyseurs plus stables mais moins actifs et moins
sélectifs ;
· Séparation plus aisée des produits de
réaction et du catalyseur ;
· Réacteurs plus complexes avec problème
important d'échange thermique ;
· Chaleur de réaction récupérable
à un niveau thermique plus élevé
I.4.5.3 Le choix de l'alcool
Les alcools utilisés pour cette réaction sont le
méthanol, l'éthanol, le 1-propanol, le 2-propanol (iso-propanol),
le 1-butanol, le 2-butanol, le 2-méthyl1-propanol (iso-butanol) et le
2-méthyl-2-propanol (tert-butanol), mais les plus fréquemment
utilisés sont le méthanol et l'éthanol, du fait de leur
faible coût et de leurs propriétés physico-chimiques
avantageuses (alcools à chaîne courte, polaires)
[29]. Pour notre étude nous avons utilisé
l'éthanol.
I.4.5.4 Le rapport molaire huile/alcool
L'une des variables les plus importantes affectant le
rendement en esters est le rapport molaire entre l'huile (les
triglycérides) et l'alcool. Dans les conditions stoechiométriques
de la réaction chimique, une mole d'huile réagit avec trois moles
d'alcool, c'est-à-dire un ratio molaire huile/alcool de 1:3.
Mais, comme c'est une réaction réversible, un
excès d'alcool est nécessaire pour déplacer
l'équilibre de la réaction vers les produits. Ainsi, pour qu'il y
ait formation d'ester, la réaction s'effectue toujours avec un
excès d'alcool, le plus souvent à partir d'un ratio molaire
huile/alcool 1:6 [35]. Dans la transestérification
à catalyse basique, un rapport molaire d'au moins 1:6 est
suggéré par de nombreuses études [17]
afin de maximiser le rendement. Un rapport molaire plus grand que 1:6
conduit à une séparation plus difficile des esters.
En effet, elle devient plus difficile car la
miscibilité du glycérol (dans la phase enrichie en esters)
augmente en raison d'une quantité plus élevée en alcool.
Cette quantité de glycérol peut alors
12
réagir avec l'ester, pour déplacer
l'équilibre de réaction vers la formation des
triglycérides, impliquant une diminution de rendement
[17].
I.4.5.5 L'influence de la température, la pression
et le temps de réaction
La plupart des réactions de transestérification
sont conduites au voisinage de la température d'ébullition de
l'alcool utilisé. Les températures d'ébullition du
méthanol et de l'éthanol étant respectivement de 65°C
et 78°C, les réactions sont réalisées
généralement à 60°C avec le méthanol et
à 70-75°C avec l'éthanol [17].
La transestérification est habituellement
réalisée à pression atmosphérique. Cependant,
certains procédés industriels, comme le procédé
Henkel par exemple, peuvent se dérouler à 90 bars et 240°C
[37]. Les procédés en milieu supercritique
(très grand excès d'alcool) sont également conduits sous
pression.
La cinétique de la réaction de
transestérification d'une huile végétale est sensible
à la température et au temps de réaction. Il a
été rapporté que la transestérification de l'huile
de soja avec le méthanol en milieu basique conduit à des
rendements en esters méthyliques de 95 % et 64 % à 60°C et
45°C respectivement après 6 min de réaction [38 ;
37]. Alors qu'après une heure de réaction, les
rendements en esters méthyliques sont du même ordre de grandeur
pour les deux températures.
I.4.5.6 La vitesse d'agitation
Afin d'obtenir une conversion importante lors de la
transestérification, le milieu biphasique de la réaction impose
une agitation suffisamment vigoureuse pour que la surface d'échange
entre les deux phases soit la plus grande possible. De plus, la vitesse
d'agitation est non seulement importante lors de l'amorçage de la
réaction de transestérification, mais également durant le
déroulement du processus réactionnel. Pour certains auteurs
[39], l'étude de ce paramètre à trois
vitesses d'agitation (110, 220 et 330 tr/min) en fonction du temps de
réaction (1, 2 et 3 min), a montré que, pour une durée de
réaction donnée les rendements sont maximums, pour une
durée de réaction donnée, à la vitesse d'agitation
la plus élevée [29].
13
I.5 Le biodiesel
I.5.1 Définition du biodiesel
Le biodiesel est le nom qui a été donné
aux huiles végétales transestérifiées. C'est une
réaction entre l'huile et l'alcool, formant ainsi les esters
méthyliques ou éthyliques d'huiles végétales et du
glycérol, désigné sous le nom de glycérine, qui est
un produit de grande valeur, sa valorisation est déterminante pour
l'équilibre économique de la filière
[40].
I.5.2 L'utilité du biodiesel
Le biodiesel présente certains avantages en tant que
carburant, issu de produits d'agriculture, qui ont des propriétés
proches de celle du gasoil, sont faciles à transporter, disponibles,
renouvelables, biodégradables et qui présentent une
efficacité à la combustion plus élevée. La faible
teneur en soufre et en aromatiques dans le biodiesel a un effet positif sur les
gaz à effet de serre. De plus le biodiesel possède des
caractéristiques intéressantes à savoir un indice de
cétane supérieur et un point d'éclair élevé
[41].
Le biodiesel est un solvant léger, il nettoie et
maintient les réservoirs, les conduits et le système d'injection
propres. Son onctuosité est de loin supérieure à celle du
diesel. L'usure du moteur est par conséquent réduite et sa
durée de vie prolongée. Les mélanges de biodiesel avec le
diesel sont stables sur le plan thermique, ils ne changent pas de façon
significative même en étant exposés à des
températures supérieures à 70 °C. Parce qu'il est
davantage chargé en oxygène (11%), le biodiesel assure une
meilleure combustion du carburant auquel il est mélangé et
diminue les émissions d'hydrocarbures (HC), de monoxyde de carbone (CO)
et de particules mais augmente les émissions d'oxydes d'azote (NOx).
Actuellement, l'utilisation du biodiesel en mélange
avec le diesel à raison de 5%, 10%, et 20 % en volume, montre que les
performances du moteur sont presque identiques à celles du diesel pur et
que le biodiesel offre également une meilleure sécurité de
stockage, de manipulation et d'utilisation par rapport au diesel
conventionnel.
La qualité de biodiesel (Tableau I.3)
dépend de la matière première et du procédé
de production utilisés. Par conséquent, un des principaux
défis lors de la production de biodiesel consiste à
améliorer ses caractéristiques physico-chimiques, à
diminuer sa viscosité et son point de trouble et à augmenter son
indice de cétane.
14
Par exemple, la viscosité du biodiesel produit à
partir de matières premières telles que les huiles de colza, de
soja, de tournesol et d'olive entre autres, varie de 2.83 à 5.12 cSt
[42], tandis que la viscosité du pétrodiesel est
d'environ 3.0 cSt [43] Le pouvoir calorifique du
pétrodiesel, compris entre 42.5 et 45 MJ/kg, est supérieur
à celui du biodiesel [44 ; 45] qui varie entre 35 et 42
MJ/kg [16].
Tableau I.3 :Propriétés physico-chimiques de
biodiesels produits à partir de diverses matières
premières.
|
Source
|
Masse
volumique
(g/l)
|
Viscosité
(Cste à
40°C)
|
Pouvoir
calorifique
(Mj/kg)
|
Point
d'éclair
(°C)
|
Point
de
trouble
(°C)
|
Point
d'écoulement (°C)
|
Références
|
|
Huile de
palme
|
880
|
5,7
|
34
|
164
|
13
|
/
|
[44]
|
|
Huile de
soja
|
885
|
4,1
|
40
|
69
|
-2
|
-3
|
[45]
|
|
Huile de
colza
|
882
|
4,5
|
37
|
170
|
-4
|
-12
|
[16]
|
|
Huile de
tournesol
|
860
|
4,6
|
34
|
183
|
1
|
/
|
[44]
|
|
Huile de
microalgues
|
864
|
5,2
|
41
|
115
|
-12
|
-11
|
[16]
|
I.5.3 Caractéristiques physiques et chimiques du
biodiesel
Tenant compte de son utilisation comme carburant dans un
moteur diesel, les caractéristiques du biodiesel les plus
intéressantes à étudier sont :
1. Densité
Il est connu que la densité du biodiesel dépend
principalement de sa teneur en esters méthyliques et la quantité
résiduelle de méthanol [46]. La densité
d'un biodiesel a un effet important sur les performances du moteur. En effet,
les pompes d'injection du biodiesel sont des pompes volumétriques et le
dosage se fait en calculant la masse du volume injecté en passant par la
densité.
15
Un carburant ayant une densité élevée
conduit à une masse de carburant injectée plus importante et
augmente la consommation. Cette propriété est influencée
principalement par le type d'huile végétale utilisée
[47], et dans une certaine mesure par les étapes de
production appliquées.
2. Viscosité
La viscosité est la plus importante
propriété de biodiesel, elle joue un rôle très
important dans la combustion et affecte les performances du moteur et ses
émissions polluantes. La viscosité élevée conduit
à une mauvaise pulvérisation, ce qui réduit la surface de
contact air biodiesel. Cette mauvaise pulvérisation liée à
une mauvaise volatilité provoque une combustion incomplète dans
le moteur.
Cette mauvaise combustion se traduit par des performances
dégradées du moteur et des émissions polluantes plus
élevées (suies, monoxydes de carbone et hydrocarbures
imbrûlés). Plus la viscosité est dans les normes, plus il
sera facile de pomper le carburant et de le pulvériser en fines
gouttelettes.
La conversion des triglycérides en esters
méthyliques ou éthyliques à travers le processus de
transestérification réduit le poids moléculaire au tiers
de celui du triglycéride et réduit la viscosité par un
facteur d'environ huit [48]. Le biodiesel a une
viscosité proche de celle des carburants diesel.
3. Le point d'éclair (flash point)
Le point d'éclair est la température la plus
basse où la concentration des vapeurs émises est suffisante pour
s'enflammer en présence de l'air au contact d'une flamme pilote, il sert
à classer les liquides en fonction de leurs risques d'inflammation. En
d'autres termes, il est un indice de la présence des matières
volatiles et inflammables dans le biodiesel. Un point d'éclair
élevé indique que la matière présente moins de
risques à s'enflammer lors du stockage ou de la manipulation.
4. Point de trouble (Cloud Point)
Le point de trouble est la température à partir
de laquelle apparaît un début de cristallisation se traduisant par
une altération de la limpidité. Le point de trouble fait partie
des propriétés à froid du biocarburant comme le point
d'écoulement où la température limite de
filtrabilité (TLF). À basse température (en hiver) la
formation des cristaux peut conduire au colmatage du filtre à carburant
et à une panne d'alimentation du moteur.
16
5. Point d'écoulement (Pour Point)
Le point d'écoulement est la température
à partir de laquelle le liquide cesse de s'écouler. À
partir de cette température, on estime que le pompage du carburant n'est
plus possible. Le biodiesel a des points de trouble et d'écoulement
supérieurs par rapport à ceux du pétrodiesel.
6. Pouvoir calorifique
Le pouvoir calorifique mesure la quantité de chaleur
libérée lors de la combustion d'une masse donnée du
biodiesel. Elle s'exprime en kJ/kg. Cette valeur permet de comparer
différents produits de natures différentes.
7. L'indice d'acide
L'acidité ou l'indice d'acide est mesurée par
la quantité d'hydroxyde de potassium en mg nécessaire pour
neutraliser un gramme de biodiesel. Il indique la teneur du liquide en acides
organiques. Les hautes teneurs en acides organiques favorisent la corrosion des
pièces du moteur. L'indice d'acide permet aussi de juger leur
état de détérioration.
On distingue deux formes d'acidité :
? Acidité totale : c'est la quantité de base,
nécessaire pour neutraliser tous les constituants acides présents
dans un gramme de matière grasse.
? Acidité forte : c'est la quantité de base,
nécessaire pour neutraliser les constituants à acidité
forte présentes dans un gramme de matière grasse.
8. Indice d'iode
C'est la masse d'iode (en grammes) absorbée par 100
grammes de biodiesel par réaction d'addition. L'indice d'iode permet de
mesurer le nombre de liaisons doubles ou triples qui se trouvent dans le
biodiesel, c'est-à-dire son degré d'insaturation. La
présence de liaisons multiples favorise les réactions d'oxydation
et de formation de gommes suite à des phénomènes de
polymérisation lors du stockage.
L'indice d'iode dépend de l'origine des
matières premières et influence grandement la tendance à
l'oxydation du biodiesel. Par conséquent, afin d'éviter
l'oxydation, des précautions particulières doivent être
prises lors du stockage de biodiesel. Des antioxydants sont ajoutés au
biodiesel ayant des indices d'iode élevés.
9. Teneur en esters
Théoriquement le biodiesel est composé d'esters
éthyliques ou méthyliques d'acides gras. Mais en pratique, le
biodiesel contient aussi des impuretés qui viennent soit de l'huile qui
n'est pas complètement convertie en esters, d'où la
génération des mono, di et triglycérides. D'autre part,
Les auteurs ont attribué cette différence de
performances à la présence de l'excès d'alcool et des
traces de glycérine dans le biodiesel non lavé
[52].
17
des quantités résiduelles d'alcool, de
glycérine, et des impuretés peuvent se retrouver dans le
biodiesel.
10. Teneur en eau
La teneur en eau est considérée comme un
indicateur de pureté du carburant. Dans le biodiesel, l'eau peut se
retrouver sous deux formes, dissoute ou dispersée sous forme de
gouttelettes [50]. Le biodiesel doit être
séché avant son injection dans le moteur, l'eau pouvant provoquer
la corrosion des pièces du système d'injection de carburant. La
présence d'eau favorise aussi la croissance microbienne qui peut
encrasser le filtre à carburant [50].
Dans les procédés d'estérification, la
présence d'eau a des effets négatifs sur les rendements en esters
méthyliques. Ce paramètre est donc étroitement
surveillé et dépendra de l'humidité de la graine et des
conditions de stockage de l'huile.
11. Teneur en alcool
La présence d'alcool résiduel dans le biodiesel
réduit son point d'auto-inflammation qui risque de tomber en au-dessous
des seuils recommandés par les normes.
I.5.4 Utilisation du biodiesel dans les
moteurs
On peut utiliser le biodiesel pour les moteurs diesel dans
plusieurs secteurs, comme carburant alternatif ou comme complément du
gazole. Plusieurs études ont porté sur l'utilisation du biodiesel
en mélanges avec le gazole ou bien sous forme pure. En
général, la plupart des recherches montrent que les performances
du moteur diesel avec le biodiesel sont similaires à celles du gazole,
mais avec une augmentation de la consommation spécifique en raison de
son pouvoir calorifique plus bas.
Meng et al, ont étudié l'effet de l'utilisation
du biodiesel de l'huile de friture usagée sur un moteur diesel. Pour
cela, ils ont utilisé des mélanges contenant 20% et 50% de
biodiesel. Les mélanges non lavés donnaient des performances
inférieures à celles du biodiesel lavé qui étaient
très proches de celles du gasoil. En termes d'émissions
polluantes, les mélanges du biodiesel non lavé ont conduit
à des émissions de CO et des imbrûlés non
satisfaisantes aux normes. Par contre le mélange du biodiesel
lavé a diminué les imbrûlés, le CO et le NOx.
18
I.5.5.1 Mélanges de
biodiesel-pétrodiesel
Le biodiesel peut être mélangé à
différentes proportions avec le gazole. Les plus courants sont : B100
(biodiesel pur), B20 (20% de biodiesel, 80% de gazole), B5 (5% de biodiesel,
95% de gazole) et B2 (2% de biodiesel, 98% de gazole).
a. Le mélange B100 et mélanges à
haute teneur en biodiesel
Le « B100 » et d'autres mélanges à
haute teneur en biodiesel sont moins fréquents que le mélange B20
en raison d'un manque d'incitations réglementaires et les prix. Les
mélanges à haute teneur en biodiesel nécessitent des
modifications majeures du moteur, L'utilisation de biodiesel pur (B100)
accroît les émissions d'oxydes d'azote, mais réduit
considérablement les autres émissions toxiques. Le « B100
» a un pouvoir solvant élevé, pouvant nettoyer les
dépôts accumulés lors de l'utilisation du gazole
[53].
b. Le mélange B20
Le B20 est le mélange de biodiesel le plus
utilisé aux États-Unis. Il représente en effet, un bon
compromis entre les coûts, les émissions, les performances par
temps froid, la compatibilité des matériaux et la capacité
à agir en tant que solvant. Généralement le B20 est le
mélange qui ne nécessite pas de modifications du moteur. Les
moteurs fonctionnant au B20 développent une puissance similaire à
celle des moteurs fonctionnant au gazole. Les consommations en carburant sont
également similaires. Le B20 doit répondre aux normes de
qualité prescrites par la norme ASTM D7467.
c. Le mélange B5
La plupart des fabricants de moteurs nord-américains
acceptent désormais les mélanges de biodiesel jusqu'à une
teneur de 5%. L'utilisation de B5 ne devrait pas causer de problèmes
pour le système d'alimentation ou le moteur. Le B5 doit être
conforme aux spécifications du gazole, norme ASTM D975 pour être
commercialisé.
I.5.5.2 Comparaison biodiesel - gazole
Le biodiesel a des propriétés chimiques qui sont
voisines de celles du gazole. Le biodiesel est un carburant 100% renouvelable,
et contribue à réduire de manière significative les
niveaux de polluants nocifs et les émissions de gaz à effet de
serre. Le biodiesel est également plus efficient que le gazole lorsqu'on
analyse son cycle de vie total. Selon une étude récente
menée par le Département américain de l'énergie, le
rendement énergétique du biodiesel est de 280% supérieur
à celui du carburant diesel. Le biodiesel peut également apporter
une contribution significative à la sécurité
énergétique.
19
Le biodiesel a de meilleures propriétés
lubrifiantes que le gazole, ce qui améliore la durée de vie du
moteur diesel. Le biodiesel a également un indice de cétane plus
élevé, ce qui signifie qu'il a une meilleure aptitude à
l'auto-inflammation tout en réduisant le niveau de bruit du moteur.
Comme le montre le Tableau I.4 ci-dessous le point
d'éclair du biodiesel est significativement plus élevé que
le diesel (130°C comparé à 60°C pour le gazole, ce qui
en fait un carburant plus sûr). L'inconvénient majeur du biodiesel
comparé au gazole est son coût plus élevé.
Tableau I.4 : La comparaison de certains paramètres
clés pour le carburant B100 par rapport au
gazole [54].
|
Propriété
|
Diesel
|
Biodiesel (B100)
|
Unités
|
|
La norme
|
ASTM D975
|
ASTM D6751
|
|
|
Pouvoir calorifique inférieur
|
~ 129.050
|
~118.170
|
btu/gal
|
|
Viscosité cinématique à 40°C
|
1.3 - 4.1
|
1.9 -6.0
|
mm2/s
|
|
Densité à 60°C
|
0.85
|
0.88
|
kg/l
|
|
Densité
|
7.079
|
7.328
|
lb/gal
|
|
L'eau et les sédiments
|
0.05 max
|
0.05 max
|
% volume
|
|
Carbone
|
87
|
77
|
% masse
|
|
Hydrogène
|
13
|
12
|
% masse
|
|
Oxygène
|
0
|
11
|
% masse
|
|
Soufre
|
0.0015 max
|
0.0 à 0.0024
|
% masse
|
|
Point d'ébullition
|
180 - 340
|
315 -350
|
°C
|
|
Point d'éclair
|
60 - 80
|
130 - 170
|
°C
|
|
Point trouble
|
(-15) - 5
|
(-3) - 12
|
°C
|
|
Point d'écoulement
|
(-35) - (-15)
|
(-15) - 10
|
°C
|
|
Indice de cétane
|
40 - 55
|
47 - 65
|
|
|
Lubrifiant SLBOCLE
|
2.000 - 5.000
|
>7,000
|
grams
|
|
Lubrifiant HFRR
|
300 à 600
|
<300
|
microns
|
20
I.5.5 Avantages et inconvénients du
biodiesel
I.5.5.1 Avantages
Il est vrai que le biodiesel constitue une alternative
intéressante sur le plan environnemental. Son premier avantage est qu'il
pollue moins et a un bilan carbone à peu près neutre. Il peut
être aussi fabriqué à partir des déchets comme les
huiles de friture et les graisses animales, ce qui permet de régler un
problème environnemental. Un carburant qui n'aggrave pas les
émissions de gaz à effet de serre est indispensable aujourd'hui
pour la sauvegarde de notre planète, le biodiesel est facile à
manipuler et à transporter.
La viscosité plus élevée que celle du
gazole lui offre un meilleur pouvoir lubrifiant dans la chambre de combustion
réduisant le travail des frottements et l'usure des pièces
mécaniques, le biodiesel a également un indice de cétane
plus élevé, lui offre une combustion plus rapide et moins
bruyante [53].
En termes de composition chimique, le biodiesel est
essentiellement composé d'esters (éthyliques ou
méthyliques) La présence d'oxygène combinée avec
l'absence de soufre et de composés aromatiques lui offre l'avantage de
réduire les émissions d'hydrocarbures imbrûlés et
des particules ainsi que d'oxydes de soufre lors de sa combustion dans le
moteur [54].
Le biodiesel est non-toxique et se dégrade quatre fois
plus rapidement que le gazole, grâce à sa teneur en oxygène
qui améliore le processus de biodégradation. Il améliore
la performance environnementale du transport routier et il réduit les
émissions des gaz à effet de serre.
D'autre part, tous les produits générés
par les réactions chimiques lors de la production du biodiesel sont
réutilisables, soit pour d'autres réactions chimiques, soit dans
d'autres secteurs industriels. Par exemple le glycérol peut être
utilisé comme lubrifiant dans les moteurs de véhicules.
I.5.5.2 Inconvénients
À côté de ces avantages, le biodiesel
comporte quelques inconvénients comme son point de fusion, son point
trouble et point d'écoulement élevés qui rendent son
utilisation en hiver sous forme pure difficile sur les véhicules dans
les pays à climats froids.
Une solution probable de ce problème consiste à
l'utiliser sous forme de mélanges ou de le préchauffer avant son
injection au moteur, cette deuxième solution est possible sur les
moteurs stationnaires à cogénération, une troisième
solution consiste à séparer la fraction des esters
méthyliques à longues chaînes saturées qui ont des
points de fusion et des points troubles élevés.
21
Un autre problème de biodiesel est sa stabilité
lors du stockage à longue durée, en fait les liaisons doubles et
triples présentes dans les acides gras, sont instables et ont tendance
à s'oxyder ou à former des gommes.
Ce type de problème est résolu soit par
l'addition des antioxydants, soit par l'utilisation directe après la
production. La teneur en acides gras libres peut aussi conduire à des
problèmes de corrosion dans le circuit d'alimentation et d'injection des
moteurs diesel [57] si elle dépasse un certain seuil.
Aussi, il faut bien respecter les normes concernant l'indice d'acide afin
d'éviter ce type de problèmes. La présence
d'oxygène améliore la combustion du carburant mais entraîne
des températures plus élevées dans la chambre de
combustion, ce qui favorise la formation des NOx [58, 59].
Le principal inconvénient du biodiesel est lié
à son prix élevé provenant du prix des huiles
végétales constituant de 70 à 95% du prix total. Un autre
problème associé est la compétition entre l'alimentation
et la production des carburants. D'où la nécessité
d'utiliser les déchets comme matière première de
production du biodiesel (l'huile de friture usagée).
22
CHAPITRE II. NOTIONS SUR LA
MODÉLISATION
EXPÉRIMENTALE
Ce chapitre propose une approche méthodologique pour
étudier et analyser les biocarburants. Il présente les
différentes techniques et outils de modélisation utilisés
pour simuler et prédire le comportement des biocarburants, que ce soit
au niveau de leur production, de leur combustion ou de leur impact
environnemental. Le chapitre aborde également les principes de base de
la modélisation expérimentale, tels que la conception des
expériences, la collecte des données, l'analyse statistique et
l'interprétation des résultats. En mettant en avant l'importance
de la modélisation expérimentale dans le domaine des
biocarburants, ce chapitre vise à fournir aux lecteurs les connaissances
et les compétences nécessaires pour mener des études
approfondies et fiables dans ce domaine en constante évolution.
II.1 PLANS D'EXPÉRIENCES
Tout d'abord, il est primordial de comprendre certains termes
qui interviendront dans la suite de cette étude entre autres :
? Un modèle est une représentation d'un
système réel, capable de reproduire son fonctionnement. Son
principe est de remplacer un système réel en un objet ou
operateur simple reproduisant les aspects ou comportements principaux de
l'original.
? Un facteur (quantitatif ou qualitatif) est un
paramètre ou état du système étudié
(phénomène ou procédé) dont la
variation est susceptible d'en modifier le fonctionnement (ex :
température, concentration d'un réactif...). La réponse
(ou critère) du système correspond au paramètre
mesuré ou observé pour connaître l'effet des facteurs
étudiés sur le système (ex : rendement d'une
réaction...)
Les plans d'expériences permettent d'organiser au mieux
les essais qui accompagnent une recherche scientifique ou des études
industrielles [27].
Les plans d'expériences permettent d'obtenir le maximum
d'informations avec le minimum d'expériences. Pour cela, il convient de
suivre des règles mathématiques et adopter une démarche
rigoureuse [28].
Environ 80 % des applications courantes utilisent les plans
dont les facteurs prennent deux niveaux et dont le modèle
mathématique de la réponse est du premier degré. Mais il
arrive assez
23
souvent que le modèle du premier degré soit
insuffisant pour expliquer les réponses mesurées. Dans ce cas, il
faut passer à un modèle du second degré.
Il existe plusieurs types de plans du second degré,
mais ils permettent tous de trouver les mêmes surfaces de
réponse.
Pour 2 facteurs, on peut représenter la surface de
réponse dans un espace à 3 dimensions. Il y a 2 dimensions pour
les facteurs et 1 pour la réponse.
En général, l'objectif des plans du second
degré est la modélisation du phénomène.
Dans notre travail, nous avons opté pour un plan
factoriel complet. Ce plan est le plus fréquemment utilisé car il
est simple et rapide à mettre en oeuvre, on le note par 2K
où le 2 correspond aux niveaux maximal et minimal qui délimitent
le domaine d'étude d'un facteur Z et k représente le nombre des
facteurs étudiés.
Pour un plan factoriel complet à k facteurs, le nombre
total d'expériences est noté :
|
Exemples :
? Si k = 2, N =
? Si k = 3, N =
? Si k = 4, N =
? Si k = 5, N =
|
22
23
24
25
|
N = 2K
= 4 essais = 8 essais = 16 essais = 32 essais
|
|
?
|
Etc.
|
|
|
L'étude a été réalisée sur
base d'un plan factoriel utilisant un plan factoriel complet à 3
variables et deux niveaux, qui a abouti à 10 expériences dont
deux étaient au centre. Le Tableau II.1 montre les
variables analysées dans l'expérience et leurs niveaux :
Tableau II.1 : Les niveaux de facteurs pour le plan
factoriel complet.
|
Niveau
|
-1
|
0
|
+1
|
|
Concentration de catalyseur (g)
|
M1
|
M2
|
M3
|
|
Temps de réaction (min)
|
t1
|
t2
|
t3
|
|
Rapport molaire
|
RM1
|
RM2
|
RM3
|
Les facteurs variables et leurs valeurs utilisés pour
l'optimisation de processus de transestérification étaient les
suivants : (a) rapports molaires éthanol : huile de 3 :1 ; 4.5 :1 et 6
:1 ; (b) des concentrations de catalyseur de 3% ; 4% et 5% par rapport à
la masse de l'huile initiale et (c) des temps de réaction de 45 ; 60 et
75 minutes.
24
Les conditions opératoires appliquées dans les
expériences étaient les suivantes : (a) température de
réaction 65°C et (b) masse de l'huile 138.3gr.
Volume de l'huile utilisée = 150ml dHU =
0.922gr/cm3
mHU = volume de l'huile utilisée X dHU
mHU = 150 × 0.922
mHU = 138.3gr d'huile usagée
|
% (m /m) =
|
msoluté
|
× 100
|
|
msolution
|
II.2 MODÉLISATION MATHÉMATIQUE
On choisit a priori une fonction mathématique qui relie
la réponse aux facteurs. On prend un développement limité
de la série de Taylor-Mac Laurin. Les dérivées sont
supposées constantes et le développement prend la forme d'un
polynôme de degré plus ou moins élevé :
Y = a0 + ?aiXi + ?aijXij + ?
+ ?aiiXii +
Avec :
Y : la réponse ou la grandeur d'intérêt.
Elle est mesurée au cours de l'expérimentation et elle est
obtenue avec une précision donnée.
Xi : représente le niveau attribué au facteur i
par l'expérimentateur pour réaliser un essai. Cette valeur est
parfaitement connue. On suppose même que ce niveau est
déterminé sans erreur (hypothèse classique de la
régression).
a0, ai, aii, aij sont les coefficients du modèle
mathématique adopté a priori. Ils ne sont pas connus et doivent
être calculés à partir des résultats des
expériences.
L'intérêt de modéliser la réponse
par un polynôme est de pouvoir calculer ensuite toutes les
réponses du domaine d'étude sans être obligé de
faire les expériences. Ce modèle est appelé «
modèle postulé » ou « modèle a priori »
[64].
II.2.1 SYSTEME D'EQUATIONS
Chaque point expérimental permet d'obtenir une valeur
de la réponse. Cette réponse est modélisée par un
polynôme dont les coefficients sont les inconnues qu'il faut
déterminer. À la fin du plan d'expériences, on a un
système de n équations (s'il y a n essais) à p inconnues
(s'il y
La matrice d'expérience reprend les conditions
expérimentales en unité codée (VCR). Les valeurs
réelles sont reprises ans un plan d'expérience.
25
a p coefficients dans le modèle choisi a priori). Ce
système s'écrit d'une manière simple en notation
matricielle :
Y = Xa + e
Avec :
Y est le vecteur des réponses.
X est la matrice de calcul ou matrice du modèle, qui
dépend des points expérimentaux
choisis pour exécuter le plan et du modèle
postulé.
a est le vecteur des coefficients.
e est le vecteur des écarts.
Ce système possède un nombre d'équations
inférieur au nombre d'inconnues. Il y a n équations
et p + n inconnues. Pour le résoudre, on utilise une
méthode de régression basée sur le critère
des moindres carrés. On obtient ainsi les estimations des
coefficients que l'on note : â.
Le résultat de ce calcul est :
â = (tXX)-1 tXY
Formule dans laquelle la matrice tX est la matrice
transposée de X. De nombreux logiciels
exécutent ce calcul et donnent directement les valeurs des
coefficients [64].
II.3 PLAN FACTORIEL COMPLET À DEUX
NIVEAUX
Un plan factoriel est un type de plan d'expérience qui
permet d'étudier les effets que plusieurs facteurs peuvent avoir sur une
réponse.
Ce plan est celui qu'il faut utiliser pour rechercher les
facteurs agissant sur une réponse mesurée. C'est le plu simple
à interpréter et il présente le meilleur rapport
coût/efficacité
Sa notation est 2k où le chiffre 2
correspond au niveau maximal et au niveau minimal, qui délimite le
domaine d'étude d'un facteur X, et la lettre k représente le
nombre des facteurs étudiés.
Pour un plan factoriel complet de 3 facteurs à 2
niveaux, 3 facteurs à 2 niveaux définissent 8 conditions
expérimentales, soit 8 essais s'il n'est pas prévu de
répétitions. Le modèle mathématique de ce plan est
de la forme [64] :
Y = A0 + A1X1 + A2X2 +
A3X3 + A12X1X2 + A13X1X3 + A23X2X3
+ A123X1X2X3 + e
II.3.1 Matrice d'expérience
26
C'est ainsi que notre plan d'expériences a
été conçues en partant de la littérature
précédente.
Tout d'abord, il est important de connaitre qu'une matrice
d'expérience est le plan d'expérience en unité
codée.
Le Tableau II.2 montre la matrice
d'expériences en unité centrée réduite
Tableau II.2 : Matrice d'expérience en unité
centrée réduite.
|
Essais
|
Pourcentage du
catalyseur (X1)
|
Ratio huile :
alcool (X2)
|
Temps de la
réaction (X3)
|
Réponses
|
|
1
|
-1
|
-1
|
-1
|
Y1
|
|
2
|
+1
|
-1
|
-1
|
Y2
|
|
3
|
-1
|
+1
|
-1
|
Y3
|
|
4
|
+1
|
+1
|
-1
|
Y4
|
|
5
|
0
|
0
|
0
|
Y5
|
|
6
|
0
|
0
|
0
|
Y6
|
|
7
|
-1
|
-1
|
+1
|
Y7
|
|
8
|
+1
|
-1
|
+1
|
Y8
|
|
9
|
-1
|
+1
|
+1
|
Y9
|
|
10
|
+1
|
+1
|
+1
|
Y10
|
La figure II.2 nous donne les domaines expérimentaux pour
3 facteurs et pour 2 facteurs.
-1
1
Ratio molaire
Graphique en cube (moyennes ajustées) de
Rendements
79,065
89,237
-1
94,390
76,492
Catalyseur
82,873
79,254
Temps de la reaction
87,306
1
-1
79,127
74,354
1
Point central
Point factoriel
Figure II.1 : Le domaine expérimental de nos
études.
27
CHAPITRE III. MATÉRIELS ET
MÉTHODE
Ce chapitre est une section essentielle d'un rapport de
recherche, car il décrit en détail les procédures et les
outils utilisés pour mener l'étude. Ce chapitre permet aux
lecteurs de comprendre comment l'étude a été menée
et de juger de la validité des résultats obtenus.
III.1 PRÉSENTATION DES MATIÈRES
PREMIÈRES III.1.1 Oxyde de fer (III)
L'oxyde de fer (III), également appelé oxyde
ferrique et sesquioxyde de fer, est le composé chimique de formule
Fe2O3, où le fer a le nombre d'oxydation +III.
L'oxyde de fer III est connu pour sa capacité à
catalyser la réaction de transestérification de manière
efficace, favorisant la conversion des triglycérides en esters
éthyliques ou méthyliques, principaux composants du biodiesel. La
surface spécifique du sesquioxyde de fer influence directement sa
capacité à absorber les réactifs et à fournir des
sites actifs pour la catalyse. Une surface spécifique plus
élevée peut généralement augmenter
l'efficacité du catalyseur.
Ce catalyseur présente généralement une
bonne stabilité et durabilité, ce qui en fait un choix attrayant
pour les applications industrielles à grande échelle mais
également à l'échelle laboratoire.
Il est souvent sous forme de poudre ou de particules, ce qui
facilite sa manipulation dans les réacteurs de
transestérification.
Comparé à d'autres catalyseurs, le sesquioxyde
de fer est généralement économique, ce qui en fait un
choix rentable pour les processus de production du biodiesel.
III.1.2 Huile de soja
L'huile de soja utilisée pour la réaction est
une huile de friture usagée obtenue localement dans la ville de
Lubumbashi dans diverses habitations. Le tableau III.1 suivant indique les
caractéristiques physico-chimiques de l'huile de soja classique selon
différents auteurs.
Le Tableau III.1 représente la
composition de l'huile de soja en acide gras :
L'huile SOYOLA est essentiellement constituée du soja
à 100%, sa composition chimique est reprise dans le Tableau
III.1.
28
Tableau III.1 : Composition de l'huile de soja en acide
gras.
|
Acides gras
|
Symbole
|
Pourcentage en acide gras
|
|
Acide palmitique
|
C16 :0
|
7 à 12
|
|
Acide stéarique
|
C18 :0
|
2 à 5,5
|
|
Acide oléique
|
C18 :1
|
20 à 50
|
|
Acide linoléique
|
C18 :2
|
35 à 60
|
|
Acide arachidique
|
C20 :1
|
1
|
|
Acide gadoléique
|
C20 :1
|
1
|
|
Acide béhénique
|
C22 :0
|
0,5
|
L'huile de soja est riche en acide linoléique (50%) et
en acide oléique (24%) et comprend 15% d'acides gras saturés. La
présence de 7% d'acide linolénique la rend très fragile
à la chaleur et on doit l'utiliser uniquement que pour les
assaisonnements (à froid) [60 ; 61].
III.1.3 Éthanol
De la classe des alcools primaires, l'éthanol de
formule CH3-CH2OH à usage des boissons et usage industriel, est obtenu
par fermentation de solutions sucrées, naturelles (jus de raisin, canne
à sucre, etc.) ou artificielles (hydrolyse de l'amidon). La majeure
partie de l'éthanol à usage industriel est
synthétisé à partir de l'éthanal ou de
l'éthylène issu du pétrole.
L'éthanol a une température de fusion de -
114,1°C, une température d'ébullition de 78,3°C et une
densité de 0,789 à 20°C [62].
L'éthanol est plus soluble mais moins réactif
que le méthanol ce qui a un impact positif sur le rendement mais
négatif sur la vitesse [63] lors des réactions
de transestérification.
III.2 PRODUCTION DU BIOCARBURANT III.2.1
Échantillonnage
La matière première qui a servi à notre
étude est un échantillon obtenu en mélangeant des
équivolumes d'huiles de friture usagées (de la marque SOYOLA)
collectées auprès de trois restaurants de la ville de Lubumbashi
et deux habitations au quartier Gambella II toujours dans la capitale
cuprifère.
29
Calcul des masses de l'éthanol et du
catalyseur
La quantité de l'éthanol à utiliser pour
chaque expérience est déterminée en utilisant
l'équation III.1 suivante :
mEtOH = MEtOH X rapport
mhuile Mhuile
Équation III.1 : Calcul de la masse de
l'éthanol.
Avec :
MEtOH : masse molaire de l'éthanol = 46,068 g/mol
Mhuile: masse de l'huile (utilisée pour chaque
expérience) = 138,3g
Mhuile : Masse molaire de l'huile (g/mol)
Rapport : ratio molaire EtOH/huile
La masse du catalyseur à utiliser pour chaque
expérience est calculée en fonction du
pourcentage de celui-ci par rapport à la masse d'huile
(138,3 g) suivant l'équation III.2 ci-
dessous :
(mhuile X %cat)
Équation III.2 : Calcul de la masse du
catalyseur.
Le Tableau III.2 suivant résume les
conditions opératoires choisies pour les expériences
menées :
Tableau III.2 : Conditions opératoires choisies pour
les expériences.
|
% Catalyseur
Fe2O3
|
Masse du
catalyseur (g)
|
Ratio molaire
EtOH : huile
|
Masse de
l'éthanol (g)
|
Temps de la
réaction (min)
|
|
3
|
4,149
|
3 : 1
|
21,666
|
45
|
|
4
|
5,532
|
4,5 : 1
|
32,499
|
60
|
|
5
|
6,915
|
6 : 1
|
43,332
|
75
|
III.2.2 Synthèse du biodiesel
L'appareil utilisé durant nos expériences, consiste
en un réacteur en verre de 1 L de capacité, muni d'un
réfrigérant, et d'un thermomètre. Le réacteur est
immergé dans un bain marie qui est chauffé à l'aide d'une
plaque chauffante avec agitation magnétique.
Les étapes suivantes ont été suivies pour la
production de nos échantillons :
30
· Mettre à chauffer un bain marie sur une plaque
chauffante ;
· Immerger le réacteur dans le bain marie ;
· Introduire 150 ml de l'huile de friture usagée et
mettre en route le chauffage ;
· Dissoudre le catalyseur dans un peu d'alcool
jusqu'à dissolution totale pour obtenir un mélange
homogène ;
· Le mélange homogène obtenu sera
versé dans le ballon contenant l'huile de friture chaude ;
· Le mélange est agité à l'aide du
barreau magnétique préalablement introduit dans le ballon (600
tr/min) tout en chauffant jusqu'à la température de consigne ;
· Maintenir la température consigne pendant les
minutes choisies (45, 60 et 70) puis arrêter la réaction.
Il est nécessaire de rappeler que l'oxyde ferrique et
l'éthanol ne réagissent pas directement ensemble pour former du
biodiesel.
a. La phase de séparation
À la fin de la réaction, le contenu du ballon
sera versé dans une ampoule à décantation et laisser au
repos pour quelques heures. Durant ce temps-là, la glycérine qui
est immiscible avec les esters se dépose au fond de l'ampoule en gardant
la majorité de catalyseur. La phase supérieure contenant les
esters ou le biodiesel contenant des traces d'alcool, sera
récupéré.
b. Étape de neutralisation
Après récupération du biodiésel,
ce dernier sera neutralisé avec une solution d'acide acétique
jusqu'à pH neutre. Le pH est contrôlé à l'aide de
papier pH.
c. Étape de lavage ou purification
L'étape de lavage de biodiesel est destinée
à éliminer les impuretés du biodiesel telles que la
glycérine résiduelle et l'excès de l'éthanol, les
traces du catalyseur, savons et sels formés par le catalyseur. Le lavage
se fait en ajoutant l'eau au biodiesel dans une ampoule à
décantation. Agiter d'une manière à créer un vortex
pour assurer un rinçage optimal, et répéter cette
étape jusqu'à ce que l'eau de lavage soit claire.
d. Étape de distillation
Pour éliminer les traces d'alcool et les
quantités d'eaux restantes pendant le lavage, l'étape de
distillation est primordiale pour améliorer les caractéristiques
du biodiesel obtenu.
La distillation consiste à chauffer
l'échantillon lentement jusqu'à température
d'ébullition de l'eau, ainsi on s'assure que l'eau et l'éthanol
sont évaporés (Téb de l'éthanol = 78°C).
31
III.2.3 Protocol expérimental
Nous avons réalisé 10 expériences. Elles
ont toutes été réalisées suivant le même
protocole en faisant varier les concentrations du catalyseur, du temps de
réaction et du rapport molaire et en fixant la température de la
réaction à 65°C [39]. Les étapes
suivies sont décrites dans ce qui suit.
III.2.3.1 Prétraitement de l'huile
usagée
a. Filtration
Afin d'éliminer les impuretés solides contenus
dans l'huile usagée, celle-ci a été, dans un premier
temps, filtrée à l'aide d'une passoire, et cela quatre fois pour
éliminer en grande majorité toutes les particules solides.
b. Séchage
La présence d'eau dans l'huile diminue le rendement de
la synthèse, d'où la nécessité de sécher
l'huile avant la réaction en utilisant un agent desséchant, dans
notre cas nous avons utilisé une solution de sulfate de sodium
(Na2SO4).
III.2.3.2 Préparation du mélange
catalyseur/alcool
Une masse du catalyseur est pesée sur un verre de
montre. Le catalyseur est dissout dans un volume adéquat
(Équation III.1) de l'éthanol sous agitation
magnétique et chauffage modéré.
III.2.3.3 Réaction de
transestérification
La solution éthanolique de catalyseur obtenue est
ajoutée à l'huile préchauffée dans un ballon
à la température T de la réaction (Tableau
III.2). La durée de la réaction est variée pour
toutes les expériences. Un montage de chauffage à reflux
thermostaté est utilisé tout en assurant une agitation
magnétique et en contrôlant la température pour la
maintenir constante à 65°C.
III.2.3.4 Purification du biocarburant
a. Décantation
Après la formation des esters au cours de la
transestérification, une étape de décantation du
mélange hétérogène est nécessaire. En effet,
la réaction génère deux nouveaux produits, le
glycérol et le biodiesel. Le glycérol de (couleur marron
foncé) plus dense que le biodiesel se condense dans la partie basse. Les
deux phases peuvent être séparées en soutirant le
glycérol par le bas de l'ampoule à décanter.
32
b. Lavage
Le biodiesel obtenu doit être lavé afin
d'éliminer l'excès d'alcool et de catalyseur résiduels.
Pour cela, le biodiesel est placé dans une ampoule à
décanter puis un volume de 40 ml d'eau distillée est
additionné lentement. Cette opération est délicate, elle
doit être réalisée avec le moins d'agitation possible au
risque de provoquer la formation d'une émulsion qui diminuerait le
rendement de la synthèse.
III.3 CARACTÉRISATION PHYSICO-CHIMIQUE DES
BIOCARBURANTS
III.3.1 Analyses chimiques
III.3.1.1 Indice d'acide
a. Principe
Il s'agit de dissoudre la matière grasse dans de
l'éthanol chaud neutralisé, puis titrer les acides gras libres
(AGL) présents au moyen d'une solution titrée de KOH en
présence de phénolphtaléine comme indicateur
coloré.
b. Mode opératoire
Pour réaliser ce test, une solution de KOH
éthanolique (0,1 M) et 50 ml de solvant constitué d'éther
di-éthylique et d'éthanol dans des proportions de volume à
volume sont préparées au préalable.
La prise d'essai est mise en solution dans 12,5 ml d'un
mélange d'éthanol et d'éther di-éthylique auquel
sont ajoutés quelques gouttes de phénolphtaléine puis
dosé par la solution basique d'hydroxyde de potassium à 0,1M
jusqu'à l'apparition d'une couleur rose persistante.
L'indice d'acide est calculé par l'équation IV.3
suivante :
IA =
V X 56,1 X N
m
Équation III.3 : Calcul de l'indice d'acide.
Avec :
56,1 : Masse molaire de KOH
V : Volume de KOH en ml
N : Concentration de la solution de KOH (0,1mole /l)
m : masse de la prise d'essai en g.
33
III.3.1.2 Indice de saponification
a. Principe
Un excès d'hydroxyde de potassium dans un alcool est
chauffé avec un échantillon de corps gras solubilisé dans
un solvant jusqu'à saponification complète. L'excès
d'alcalin est ensuite titré avec une solution d'acide chlorhydrique.
b. Mode opératoire
Deux solutions de KOH à 0,5 M et de HCl à 0,5 M
sont préparées au préalable.
Une masse d'un gramme du corps gras pesée dans un
bécher est solubilisée dans 12,5 ml du même solvant
utilisé pour l'indice d'acide, puis 25 ml de KOH (0,5 M) sont
ajoutés en prenant soin de maintenir une bonne agitation. Cette solution
du corps gras est placée dans un bain marie bouillant pendant 45
à 60 minutes. À l'issu de cette étape, la solution est
refroidie puis 2 à 3 gouttes de phénolphtaléine lui sont
additionnées.
Nous notons ici qu'un essai à blanc (sans le corps
gras) est traité dans les mêmes conditions. L'excès de
potasse est ensuite dosé par la solution de l'acide chlorhydrique (0,5
M) sous agitation magnétique jusqu'au virage ou à la
décoloration de la phénolphtaléine aussi bien pour la
solution de biocarburant que de l'essai à blanc.
Les volumes d'HCl utilisés pour les divers essais ont
permis grâce à l'équation IV.4 suivante de calculer les
indices de saponification correspondant.
|
IS =
|
V0-V
|
X CHCl X 56,1
|
|
m
|
|
Équation III.4 : Calcul de l'indice de
saponification.
Avec :
V0 : Volume en ml de HCl utilisé pour l'essai à
blanc
V : Volume en ml de HCl utilisé pour l'échantillon
à analyser
m : Masse du corps gras
CHCl : Concentration de la solution de HCl
56,1 : Masse molaire de KOH
III.3.1.3 Indice d'iode
a. Principe
C'est la quantité en grammes d'iode fixée par
addition par 100g de matière grasse en solution
chloroformique (les doubles liaisons des acides gras
insaturés sont capables de subir une
réaction d'addition soit avec I2, soit avec d'autres
halogènes). L'indice d'iode fournit un moyen
pour mesurer le degré d'insaturation de la matière
grasse.
34
b. Mode opératoire
Dissoudre 0,5 g de l'huile dans 10 ml de chloroforme, puis
dans 12,5 ml du diiode (I2) 1N et les mettre dans un erlenmeyer et bien fermer
le récipient, ensuite mettre ce mélange à l'abri de la
lumière pendant deux heures. Au terme de cette durée, on ajoute
10 ml d'une solution d'iodure de potassium (KI) à 50% et 10 ml d'eau
distillée sont ajoutés. Titrer cette solution avec le thiosulfate
en présence de l'empois d'amidon.
L'indice d'iode est calculé par l'équation IV.5
suivante :
II =
m
Équation III.5 : Calcul de l'indice d'iode.
(V1 - V2) X C
Avec :
II : Indice d'iode
C : Concentration de la solution de Na2S2O3 utilisée 1N
V1 : Volume de la solution de Na2S2O3 versée pour l'essai
à blanc (ml)
V2 : Volume de la solution de Na2S2O3 versée pour la prise
d'essai (ml) m : masse de la prise d'essai
III.3.2 Analyses physiques
III.3.2.1 Densité
Pour déterminer la densité du biodiesel produit,
nous avons pesé l'éprouvette vide puis, nous avons
prélevé 45 ml du biodiesel dans la même éprouvette.
Ensuite, nous avons pesé l'éprouvette contenant le biodiesel
à l'aide d'une balance de précision. Enfin, nous avons
prélevé 45 ml d'eau dans une éprouvette où nous
avons pesé cette éprouvette contenant de l'eau.
Nous avons déterminé la densité du
biodiesel en faisant le rapport entre la masse du biodiesel et celle de
référence (eau) par la formule suivante :
méch
d=
mréf
Équation III.6 : Calcul de la
densité.
Avec :
d : densité
méch : masse de l'échantillon (biodiesel) en g
mréf : masse de référence (eau) en g
35
III.3.2.2 Viscosité
Pour réaliser cette analyse, nous avons pesé
l'éprouvette graduée vide puis nous avons prélevé
25 ml du biodiesel dans la même éprouvette où nous avons
encore pesé l'éprouvette contenant l'échantillon à
l'aide d'une balance de précision. Nous avons pesé la bille en
acier, ensuite introduit cette bille en acier de diamètre connu à
l'aide d'un pied à coulisse dans une éprouvette contenant 25 ml
du biodiesel, puis nous avons chronométré le temps de parcours de
la bille dans l'éprouvette. Après, nous avons mesuré la
distance parcourue par la bille dans l'éprouvette à l'aide d'un
pied à coulisse tout en mesurant également le diamètre de
l'éprouvette.
La viscosité du biodiesel est calculée par la
formule de Stokes suivante :
|
ç =
|
ñbille - ñbiodiesel × vbille
× g × 6ð × r × v
|
1 ë
|
Équation III.7 : Calcul de la viscosité par
la formule de Stokes.
Or ë=(1+2,1× R)
Avec :
ç : viscosité dynamique en kg/m.s
ñ : masse volumique en kg/m3
Vbille : volume de la bille en m3
g : accélération de la pesanteur en
m/s2
r : rayon de la bille en m
v : vitesse parcourue par la bille dans l'éprouvette en
m/s
R : rayon de l'éprouvette en m
X : constante de Stokes
36
CHAPITRE IV. ANALYSE ET INTERPRÉTATION DES
RÉSULTATS
Dans ce chapitre, nous aborderons l'analyse et
l'interprétation des résultats obtenus à la suite de notre
étude ou de notre recherche. Nous examinerons les données
collectées, les méthodes statistiques utilisées pour les
analyser, et les conclusions que nous pouvons en tirer.
Ensuite, nous discuterons des résultats obtenus et de
leur signification. Nous mettrons en évidence les tendances
observées, les corrélations entre variables, et toute autre
information importante qui ressort de notre analyse. Nous soulignerons
également les limites de notre étude et les possibles biais qui
pourraient avoir influencé nos résultats.
IV.1 CARACTÉRISATION DE L'HUILE USAGÉE
Quelques caractéristiques physico-chimiques de l'huile
usagée utilisée dans notre étude ont été
déterminées parallèlement à l'huile vierge afin de
pouvoir les comparer. Il s'agit de la densité, la viscosité et
l'indice d'acide. Les valeurs obtenues sont données dans le
Tableau IV.1.
Tableau IV.1 : Caractéristiques physico-chimiques
des huiles de soja usagée et vierge.
|
Huile de soja
|
Densité (g/cm3)
|
Viscosité à 40°C
(mm2
/s)
|
Indice d'acide
(mg KOH/g)
|
|
Notre travail
|
Huile usagée
|
0,9212
|
46,32
|
1,6
|
|
Huile vierge
|
0,9291
|
32,12
|
0,4
|
|
Littérature
|
Huile usagée
|
0,90
|
44,7
|
2,5
|
|
Huile vierge
|
0,91
|
32,9
|
0,2
|
|
? Densité
|
|
|
|
|
La densité de l'huile usagée est
légèrement inférieure à celle de l'huile vierge.
Nos résultats sont en accord avec ceux de la littérature
[36].
? Viscosité
Les valeurs de la viscosité obtenues dans notre travail
sont proches de celles de la littérature et ce, aussi bien pour l'huile
usagée que pour l'huile de soja vierge. Cependant, l'huile de friture
usagée montre une viscosité supérieure à celle de
l'huile vierge. Ces résultats montrent que l'huile usagée ne peut
pas être utilisée directement comme carburant dans un moteur
Diesel, il
37
est donc impératif de réduire sa
viscosité à une valeur similaire à celle
caractérisant le Diesel conventionnel.
La viscosité de l'huile augmente avec les jours de
friture. L'augmentation de la viscosité est due à la formation de
polymères de haut poids moléculaire. Plus l'huile de friture est
visqueuse, plus le degré de détérioration est
élevé. La couleur et la viscosité sont les facteurs
physiques les plus courants utilisés pour évaluer
l'étendue de la détérioration de l'huile de friture dans
la friture commerciale et domestique [27].
? Indice d'acide
L'indice d'acide de l'huile usagée obtenu est de 1,6 mg
KOH/g, il est nettement supérieur à celui de l'huile vierge. Nos
valeurs sont en accord avec celles données dans la littérature.
La différence enregistrée entre l'indice d'acide de l'huile
vierge et l'huile usagée est due à l'hydrolyse des
triglycérides en acides gras libres lors de la friture.
Par ailleurs, sa valeur relativement faible nous renseigne sur
la possibilité de l'utilisation de la catalyse basique dans la
réaction de transestérification [29 ; 23 ;
24].
IV.2 RÉACTION DE
TRANSESTÉRIFICATION
Les valeurs des rendements des 10 expériences
menées sont regroupées dans le Tableau IV.2.
Tableau IV.2 : Les rendements des 10 expériences.
Paramètres de la réaction
|
Exp N°
|
|
|
|
Rendement
(%)
|
|
% du
catalyseur
X1
|
Ratio huile :
éthanol
X2
|
Temps de la
réaction
X3
|
|
|
1
|
3
|
3 :1
|
45
|
89.237
|
|
2
|
5
|
3 :1
|
45
|
87.306
|
|
3
|
3
|
6 :1
|
45
|
79.065
|
|
4
|
5
|
6 :1
|
45
|
79.254
|
|
5
|
4
|
4.5 :1
|
60
|
80.740
|
|
6
|
4
|
4.5 :1
|
60
|
85.006
|
|
7
|
3
|
3 :1
|
75
|
76.492
|
|
8
|
5
|
3 :1
|
75
|
74.354
|
|
9
|
3
|
6 :1
|
75
|
94.390
|
|
10
|
5
|
6 :1
|
75
|
79.127
|
38
IV.2.1 Effets de la concentration du catalyseur sur le
rendement
La Figure IV.1 met en évidence l'effet
de la concentration du catalyseur sur le rendement de la réaction.
Rendement %
100
40
90
70
20
60
50
30
80
10
0
Effet de la concentration du catalyseur sur le
rendement
Max 5% Min 3% Centre 4%
Concentration du catalyseur (%)
2 4 8 10 1 3 7 9 5 6
Figure IV.1 : Histogramme représentant l'effet de la
concentration du catalyseur sur le
rendement.
D'après l'histogramme de la figure IV.1
représentée ci-dessus, on remarque qu'à une concentration
minimale en catalyseur on atteint les valeurs optimales de rendement. Ceci est
observé pour l'expérience 1 (valeurs minimales pour le ratio
EtOH/huile (x2) et le temps de la réaction (x3) et l'expérience 9
(valeurs max pour x2 et x3) avec des rendements de 89 et 94 %
respectivement.
En augmentant le pourcentage en catalyseur à 5% (son
max), on obtient un rendement relativement élevé de 87% pour
l'expérience 2 où x2 et x3 sont à leur niveau min. Les
rendements des expériences 10 et 4 sont du même ordre (79%). Par
ailleurs, ce qui est remarquable pour cette même concentration, notamment
pour l'expérience 8 (où x2 est minimal et x3 est maximal), le
plus faible rendement obtenu. Dans ces conditions de concentration en
catalyseur et de temps de la réaction (les deux à leur niveau
max), la formation des savons est favorisée ce qui explique la
diminution du taux de transformation de l'huile en esters
méthyliques.
39
En ce qui concerne les expériences 5 et 6, pour
lesquelles les trois variables sont à leur valeur centrale, des
rendements respectifs de 80,740 et 85,006% sont obtenus. L'écart
constaté peut être justifié par la perte de quantité
lors des étapes de purification (séparation des deux phases,
lavage). Ceci rend compte de la difficulté de reproduire les
expériences avec les moyens insuffisants mis à notre
disposition.
IV.2.2 Effets du ratio molaire éthanol/huile sur
le rendement
La Figure IV.2 suivante illustre l'effet du
ratio molaire méthanol/huile sur le rendement de la
transestérification.
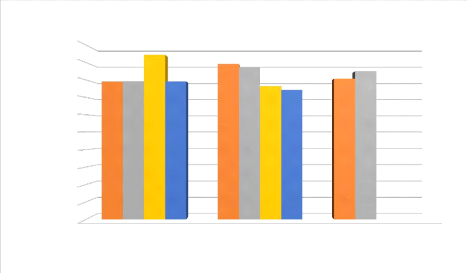
Rendement %
100
40
90
70
20
60
50
30
80
10
0
Effet du ratio éthanol/ huile sur le
rendement
Max 6:1 Min 3:1 Centre 4,5:1
Ratio molaire éthanol : huile
3 4 9 10 1 2 7 8 5 6
Figure IV.2 : Histogramme représentant l'effet du
ratio molaire sur le rendement.
L'expérience 9 présente le taux de conversion le
plus élevé (94%) pour un rapport molaire alcool : huile maximal
de 5:1, quand x1 est min et x3 est max. Les expériences 3, 4 et 10 ont
fournis des rendements proches de l'ordre de 79%.
Pour un ratio molaire minimal de 3:1, les expériences 1
(x1 et x3 min) et 2 (x1 max et x3 min) ont montré les rendements les
plus élevés avec 89,237 et 87,306 % respectivement. On peut
déduire que le passage du niveau min au niveau max en x2
n'améliore pas considérablement le rendement (l'écart
n'est pas très important). Dans la littérature, il a
été rapporté que l'augmentation du ratio molaire implique
une augmentation jusqu'à un certain point, puis une diminution du
rendement. En effet, l'excès d'éthanol complique la
séparation post-réactionnelle
40
des phases (glycérol/phase riche en esters
éthyliques), car la miscibilité du glycérol, dans la phase
enrichie en esters, augmente en raison d'une quantité plus
élevée en alcool. Notons ici que par la même occasion, le
prix de revient de la réaction augmente. Cette quantité de
glycérol peut alors réagir avec l'ester pour déplacer
l'équilibre de la réaction vers la formation des
triglycérides, impliquant une diminution du rendement
[29].
IV.2.3 Effets du temps de la réaction sur le
rendement
La Figure IV.3 montre l'influence du temps de la
réaction sur le rendement.
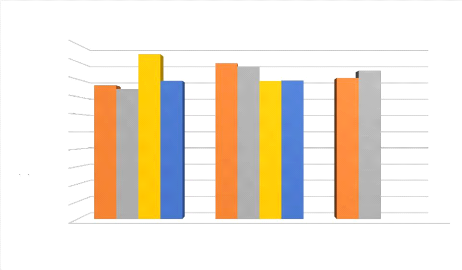
Rendement %
100
40
90
70
20
60
50
30
80
10
0
Effet du temps de la réaction sur le
rendement
Max 75 Min 45 Centre 60
Temps de la réaction (min)
7 8 9 10 1 2 3 4 5 6
Figure IV.3 : Histogramme représentant l'effet du
temps de la réaction sur le rendement.
L'influence de l'augmentation du temps de la réaction a
été étudiée en la faisant varier d'un niveau min
à un niveau max en passant par une valeur centrale. L'augmentation du
temps de la réaction de 45 (min) à 75 minutes (max) a
provoqué une diminution du rendement en passant de 89 à 76 %
respectivement pour les expériences 1 et 7 et de 87 à 74 % pour
les expériences 2 et 8. Nous pouvons suggérer que l'impact de
deux autres facteurs étaient plus importants que celui du temps de la
réaction dans les conditions adoptées.
Dans le cas des expériences 3 et 9, l'augmentation du
temps de la réaction (de 45 à 75 minutes) a conduit à une
augmentation du rendement de 79 à 94 % respectivement. Nous retiendrons
tout de même que le rendement optimal a été obtenu au
niveau max du temps de la réaction (cas de l'expérience 9).
41
Dans la littérature, il est noté que le
chauffage améliore le brassage entre les réactifs et permet de
diminuer la viscosité de l'huile. Cette dernière atteint une
valeur nécessaire pour pouvoir accélérer la
réaction et donner un taux de conversion satisfaisant. Néanmoins,
un chauffage excessif (généralement au-delà de 70°C)
conduit à la diminution du rendement notamment en favorisant
l'évaporation du méthanol [29].
La différence constatée dans notre étude
par rapport à la littérature peut s'expliquer par la
difficulté à contrôler la température
rencontrée au cours de plusieurs de nos expériences.
IV.3 CARACTÉRISATION DU BIODIESEL OBTENU
Le Tableau IV.3 suivant illustre les
résultats des analyses physico-chimiques des 10 biocarburants
obtenus.
Tableau IV.3 : Résultats des caractéristiques
physico-chimiques des biocarburants.
|
Caractéristiques chimiques
|
Caractéristiques physiques
|
|
Exp N°
|
IA (mg
KOH/g)
|
IS (mg
KOH/g)
|
II (mg I2/
100 g)
|
Densité
(g/cm3)
|
Viscosité
(mm2/s)
|
|
1
|
0,5
|
171,105
|
107,87
|
0,8731
|
5,091
|
|
2
|
0,5
|
213,18
|
106,60
|
0,8804
|
5,112
|
|
3
|
0,5
|
207,57
|
105,96
|
0,8780
|
4,991
|
|
4
|
0,5
|
151,47
|
109,13
|
0,8703
|
5,004
|
|
5
|
0,5
|
204,77
|
100,76
|
0,8755
|
4,741
|
|
6
|
0,5
|
210,37
|
114,97
|
0,8763
|
4,691
|
|
7
|
0,5
|
235,62
|
109,36
|
0,8739
|
5,482
|
|
8
|
0,5
|
204,76
|
111,09
|
0,8699
|
4,664
|
|
9
|
0,5
|
154,27
|
112,31
|
0,8711
|
4,554
|
|
10
|
0,5
|
98,17
|
111,67
|
0,8729
|
9,927
|
|
Norme
ASTM D
6751
|
< 0,8
|
-
|
|
0,81 - 0,86
|
1,9 - 6,0
|
|
Norme EN
14214
|
< 0,5
|
-
|
|
0,86 - 0,9
|
3,5 - 5,0
|
|
Biodiesel huile de soja (Littérature)
|
0,15
|
201
|
|
0,885
|
4,08
|
? Indice d'acide
Les indices d'acide des 10 biodiesels obtenus sont de 0,5 mg
KOH/g. Ces valeurs sont conformes aux normes ASTM D6751 et EN14214 qui exigent
respectivement des valeurs de 0.8 et 0,5 mg KOH/g. L'indice d'acide d'un
biodiesel issue de l'huile de soja cité dans la littérature
était de 0,15 mg KOH/g. Cette valeur est nettement inférieure aux
valeurs que nous avons obtenues dans ce travail pour nos 10 biocarburants.
42
? Indice de saponification
L'indice de saponification diffère d'une
expérience à une autre cette différence est
expliquée par le fait que chaque expérience nécessite un
volume défini d'HCl (Tableau IV.4) pour neutraliser
l'excès de KOH qui n'a pas intervenu dans la saponification des esters
d'acides gras (EAG). Le volume d'HCl du test à blanc est de 20,5 ml.
Tableau IV.4 : Volumes d'HCl des 10 biocarburants.
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
VHCl
(ml)
|
14,4
|
12,9
|
13,1
|
12,6
|
13,2
|
13
|
12,1
|
13,2
|
15
|
17
|
On remarque que pour l'expérience 7 il nous a fallu
12,1 ml d'HCl pour neutraliser l'excès de KOH qui n'a pas réagi
avec les esters d'acides gras pour former des savons. Pour cette
expérience, la valeur du IS mesuré est de 235,62 mg KOH/g, on
constate que le biodiesel (7) présente plus d'EAG susceptibles
d'être saponifiés vu la faible quantité de KOH qui n'a pas
intervenu dans la saponification de ces derniers. Contrairement pour le
biodiesel obtenu par l'expérience 10 qui présente moins d'esters
d'acides gras.
Les biodiesels qui ont présentés un indice
proche des valeurs citées dans la littérature (201 mg KOH/g) sont
ceux issues des expériences 3, 5 et 8 avec des valeurs de 207.57, 204.77
et 204.76 mg KOH/g respectivement.
? Indice d'iode
Les valeurs obtenues de l'indice d'iode sont comprises entre
100,76 et 114,97. Ceci ne nous permet pas de dire si ces valeurs correspondent
aux normes ou pas, du fait que nous n'avons pas trouvé des documents qui
parlent de la norme de l'indice d'iode des biocarburants mais dans la
littérature, certains travaux ont trouvé des valeurs proches de
nos valeurs.
? Densité
Les valeurs de la densité des biodiesels produits sont
comprises entre 0,86 et 0,88. Ces valeurs sont en conformité avec celles
de la norme EN14214 (0,86-0,9) mais elles sont légèrement
supérieures à celles des normes américaines (ASTM D6751)
qui exigent des valeurs entre 0,81 et 0,86.
? Viscosité
Les biodiesels issus des expériences (de la 1 à
la 9) ont des viscosités comprises entre 4,5 et 5,9 mm2/s.
Ces valeurs appartiennent à l'intervalle donné par la norme
américaine ASTM D6751, cependant, elles sont légèrement
supérieures aux valeurs fixées par la norme européenne
EN14214.
43
L'expérience 10 a présenté
exceptionnellement une viscosité très élevée par
rapport aux 9 autres, elle est de l'ordre de 9,9 mm2/s ce qui est
largement supérieur aux normes préconisées par les
réglementations américaines et européennes. Toutefois,
celle-ci est environ 5 fois inférieure à celle de l'huile
usagée, ce qui montre l'efficacité de la réaction de
transestérification à réduire la viscosité des
huiles [16].
IV.4 MODÉLISATION MATHÉMATIQUE DES
RÉSULTATS OBTENUS
La méthodologie des plans factoriels complets permet
plusieurs avantages : ils sont faciles à construire, le calcul des
effets et des interactions est très simple et ne demande d'outils
informatiques évolués, l'interprétation des
résultats est à la portée de tout le monde et ne demande
pas des connaissances approfondies en statistique, comme chaque facteur ne
prend que deux niveaux, les essais sont faciles à contrôler et les
risques d'erreurs sont minimisés. Le but est d'obtenir une relation Y =
f(xi), entre la réponse du système (rendement de la
réaction de transestérification) et les facteurs xi.
L'intérêt de modéliser la réponse par un
polynôme est de prédire l'ensemble des réponses du domaine
d'étude, sans réaliser toutes les expériences requises.
Dans notre cas, le modèle mathématique
correspondant au plan factoriel complet est un modèle polynomial du
deuxième ordre, qui prend en compte les effets principaux âi et
les interactions âij.
Le traitement des données, la modélisation du
système et l'optimisation du rendement réactionnel, ont
été effectués en tenant compte des paramètres
recensés dans le Tableau IV.5. Tableau IV.5 :
Paramètres de modélisation.
Coefficients Valeurs Observations
a0 82,40 Rendement au centre du domaine
a1 -2,39 Effet de la concentration en catalyseur
a2 0,56 Effet du ratio molaire éthanol/huile
a3 -1,31 Effet du temps de la réaction
a12 -1,38 Interactions entre la concentration en catalyseur et le
ratio
molaire
a13 -1,96 Interactions entre la concentration en catalyseur et
le
temps de la réaction
a23 5,11 Interactions entre le ratio molaire et le temps de la
réaction
a123 -1,91 Interactions entre la concentration en catalyseur, le
ratio
molaire et le temps de la réaction
Pt ctr 0,47
44
Ces coefficients des effets (ou matrices des effets), des
paramètres étudiés, concernent l'ensemble des essais et
des réponses du système (transestérification
éthanoïque catalysée par le Fe2O3).
L'équation IV.1 donne le modèle de
régression ajusté aux données expérimentales ; elle
exprime les effets des variables considérées sur le rendement du
procédé.
Y = 89,40 - 2,39X1 + 0,56X2 - 1,31X3 - 1,38X1X2 - 1,96X1X3 +
5,11X2X3 - 1,91X1X2X3 + 0,47
Équation IV.1 : le modèle de
régression ajusté aux données.
Ces résultats montrent que le rendement en esters
éthyliques synthétisés dépend
considérablement de trois facteurs, à savoir la concentration en
catalyseur, le ratio molaire et le temps de la réaction.
L'analyse de la variance présentée dans le
Tableau IV.6 est nécessaire pour évaluer la
signification statistique de chaque terme dans le modèle : un
modèle ayant comme résultat une valeur F-valeur de 4,76 indique
que le modèle est significatif.
Tableau IV.6 : Analyse de la variance de
réponse.
|
Source
|
Ddl
|
Somme des carrés ajustés
|
Carrés
moyens
|
Valeur
F
|
Valeur de p
|
|
Modèle
|
8
|
346,301
|
43,288
|
4,76
|
0,341
|
|
X1
|
1
|
45,807
|
45,807
|
5,03
|
0,267
|
|
X2
|
1
|
2,472
|
2,472
|
0,27
|
0,694
|
|
X3
|
1
|
13,779
|
13,779
|
1,51
|
0,434
|
|
X1X2
|
1
|
15,139
|
15,139
|
1,66
|
0,420
|
|
X1X3
|
1
|
30,651
|
30,651
|
3,37
|
0,318
|
|
X2X3
|
1
|
209,050
|
209,050
|
22,97
|
0,131
|
|
X1X2X3
|
1
|
29,051
|
29,051
|
3,19
|
0,325
|
L'interaction entre le rapport molaire éthanol/huile a
la plus faible p-valeur 0,131 et la plus grande valeur de F-valeur (22,97)
parmi les autres variables étudiées.
Une valeur du coefficient de détermination proche de
1,0 (R2 = 0,9744) indique que le rendement en ester éthylique
d'huiles végétales (EEHV) est bien corrélé par le
modèle. Le coefficient R2 prédit (0,8592) est en
accord raisonnable avec celui ajusté (0,7696) et une valeur
élevée de R2 prédit est également une
indication de la précision du modèle établi.
45
Les trois facteurs étudiés influent fortement
sur la conversion en EEHV : un grand coefficient de X2 (ratio molaire
éthanol : huile) indique un effet significatif sur la conversion.
Le coefficient positif correspondant au ratio molaire
éthanol : huile indique qu'une augmentation de cette variable conduit
à une hausse du rendement en EEHV, tandis qu'un signe négatif
indique un effet antagoniste sur la réaction. La solution de
l'équation du modèle fournit les valeurs optimales pour les
variables considérées. Les conditions optimales comme la
concentration en catalyseur, le rapport molaire éthanol : huile et le
temps de la réaction sont : 6:1, 75 minutes et 3% en poids,
respectivement. Dans ces conditions, une conversion théorique du
biodiesel de 94,390% est obtenue.
46
CONCLUSION
La production du biodiesel représente une alternative
de production de combustibles propres, biodégradables, non toxiques et
renouvelables, surtout quand la matière première est un
déchet qui génère de nombreux problèmes
écologiques. Les huiles alimentaires usagées possèdent un
fort potentiel pour être valorisées en carburants, du fait de leur
importante richesse en triglycérides et en acides gras libres.
L'objectif de cette étude était de
synthétiser un biodiesel en valorisant un déchet très
polluant. Il s'agit d'une huile (de soja) usagée (HFU) en appliquant la
réaction de transestérification. Cette dernière
étant influencée par plusieurs paramètres, nous avons
opté pour l'étude de l'effet de la concentration en catalyseur,
le ratio molaire alcool : huile et du temps de la réaction sur le
rendement de la réaction tout en maintenant la température
constante. Une série de 10 expériences ont été
menées en faisant varier ces trois paramètres afin de
dégager un choix de conditions optimales donnant un bon rendement et un
biodiesel de qualité.
La caractérisation de l'huile usagée a permis de
montrer une viscosité et un indice d'acide supérieurs à
ceux de l'huile vierge. Ces résultats sont expliqués par les
réactions de dégradation que subit l'huile au cours du chauffage.
L'analyse des propriétés physico-chimiques des 10 biodiesels
obtenus ont montré une densité et une viscosité
inférieure à celles de l'huile de friture usagée (HFU).
Cette diminution est expliquée par la formation des esters
éthyliques par élimination du glycérol. La majorité
des biodiesels synthétisés se sont avérés contenir
des teneurs en eau très élevées par rapport aux normes
internationales, d'où la nécessité d'un traitement
supplémentaire par séchage à l'étuve.
Par ailleurs, les résultats de l'étude
multiparamétrique ont révélé que le meilleur
rendement est de 94 %. Il a obtenu à l'issue de l'expérience 9
avec 3% en catalyseur (niveau min), un rapport molaire éthanol : huile
de 6 :1 (niveau max) et à un temps de 75 minutes (niveau max). Le second
rendement est fourni par l'expérience 1 avec un taux de conversion de 89
% dans des conditions minimales pour les 3 facteurs (3% en catalyseur, un ratio
molaire de 3 :1 et à 45 minutes).
Du point de vue analyses physico-chimiques, le biodiesel
répondant aux qualités préconisées par les normes
internationales est celui produit par l'expérience 3, effectué
avec une concentration en catalyseur de 3%, un rapport molaire 6 :1 et à
45 minutes. Cette expérience a cependant présenté un
rendement relativement faible 79%.
La méthode adoptée dans ce travail a permis de
sélectionner séparément les conditions optimales pour le
rendement en biodiesel et pour une qualité optimale de celui-ci.
L'idéal aurait
47
été de mener cette étude
multiparamétrique en utilisant les plans d'expériences pour
aboutir à une situation optimale qui prendrait en considération
simultanément le rendement ainsi que les différentes
caractéristiques physicochimiques des biocarburants
synthétisés tout en respectant les normes en vigueur.
48
RÉFÉRENCES BIBLIOGRAPHIQUES
[1] Peak Oil News and Message Boards : [En ligne]
[Consulté le 24 novembre 2023]. Disponible sur «
www.peakoil.com ».
[2] Les avantages et les inconvénients des
biocarburants : [En ligne] [Consulté le 24 novembre 2023]. Disponible
sur «
www.parlonssciences.ca
».
[3] Jean-Paul Charvet, Biocarburants, dans
Dictionnaire collectivités territoriales et développement durable
(2007), page 64 à 67 : [En ligne] [Consulté le 5 décembre
2023]. Disponible sur « www.cairn.info ».
[4] Biocarburant : [En ligne] [Consulté le 5
décembre 2023]. Disponible sur «
www.connaissancedesenergies.org
».
[5] Les biocarburants, rédigé en 2007-2008 par
Catherine Mehmed, Brice Bouyssiere et Laurent Authier. [En ligne]
[Consulté le 5 décembre 2023]. Disponible sur «
wiki.scienceamusante.net
».
[6] S. N. Naik, V. V. Goud, P. K. Rout et al.
Production of first and second generation biofuels: a comprehensive
review. Renewable and sustainable energy reviews, 2010, vol. 14, no 2,
p. 578-597.
[7] D. Pioch et G. Vaitilingom. Palm oil and derivatives:
fuels or potential fuels? Oléagineux, Corps gras, Lipides,
2005, vol. 12, no 2, p. 161-169.
[8] International Energy Agency (IEA), Transport Biofuels,
2020. [En ligne] [Consulté le 5 décembre 2023]. Disponible sur
«
www.iea.org ».
[9] G. Vaitilingom. Huiles
végétales-biocombustible diesel: influence de la nature des
huiles et en particulier de leur composition en acides gras sur la
qualité carburant. 1992. Thèse de doctorat.
Orléans.
[10] A. S. Ramadhas, S. Jayaraj et C. Muraleedharan.
Biodiesel production from high FFA rubber seed oil. Fuel, 2005, vol.
84, no 4, p. 335-340.
[11] K. Bozbas. Le biodiesel comme carburant alternatif :
production et politiques dans l'Union européenne. Revues des
énergies renouvelables et durables, 2008, vol. 12, n° 2, p.
542-552.
49
[12] Anju Dahiya-Bioenergy_ Biomass to Biofuels. Academic
Press, 2014. 641 p. ISBN : 9780-12-407909-0
[13] U.R. Kreutzer (to Henkel KGaA), Manufacture of fatty
alcohols based on natural fats and oils, J. Am. Oil Chem. Soc. 61(2)
(1984) 343-8.
[14] Romain Richard. transestérification
éthanolique d'huile végétale dans des
microréacteurs : transposition du batch au continu. 262 p. et
Thèse de doctorat. Sciences des Agroressources. INP Toulouse. Le mardi
13 décembre 2011.
[15] D. Ballerini. Les biocarburants: répondre aux
défis énergétiques et environnementaux des
transports. Éditions Technip, 2011. [En ligne] [Consulté le
24 décembre 2023]. Disponible sur «
www.ocl-journal.org ».
[16] A. Srivastava et R. Prasad. Triglycerides-based diesel
fuels. Renewable and sustainable energy reviews, 2000, vol. 4, no 2,
p. 111-133.
[17] R. Richard. Transestérification
éthanolique d'huile végétale dans des
microréacteurs : transposition du batch au continu. 2011.
Thèse de doctorat.
[18] I. Boumesbah. Production d'esters d'alkyle d'acides
gras par transestérification d'huiles végétales.
Étude de quelques propriétés physico-chimiques. 2012.
Thèse de doctorat.
[19] R. W. Moussavou Mounguengui. Synthèse
enzymatique d'esters éthyliques d'huiles végétales pour la
production de biodiesel à l'aide de lipases végétales
issues de la biomasse africaine. 2014. Thèse de doctorat.
Montpellier SupAgro.
[20] J. M. Encinar, J. F. González et A.
Rodríguez-Reinares. Ethanolysis of used frying oil. Biodiesel
preparation and characterization. Fuel processing technology, 2007,
vol. 88, no 5, p. 513-522.
[21] D. Ballerini et N. Alazard-toux. The biofuels. State
of the art, perspectives and challenges of the development; Les biocarburants.
Etat des lieux, perspectives et enjeux du developpement. 2006.
[22] G. DI Nicola, M. Moglie, M. Pacetti et al.
Bioénergie II : Modélisation et optimisation multi-objectifs
de différents procédés de production de biodiesel.
Journal international de génie des réacteurs chimiques,
2010, vol. 8, non 1.
[23] M. Berrios, J. Siles, Martin, MA, et al. Une
étude cinétique de l'estérification des acides gras libres
(FFA) dans l'huile de tournesol. Carburant, 2007, vol. 86, n° 15,
p. 2383-2388.
[24] A. K. Endalew, Y. Kiros et R. Zanzi. Inorganic
heterogeneous catalysts for biodiesel production from vegetable oils.
Biomass and bioenergy, 2011, vol. 35, no 9, p. 3787-3809.
50
[25] T. F. Dossin, M. F. Reyniers, R. J. Berger et al.
Simulation of heterogeneously MgO-catalyzed transesterification for
fine-chemical and biodiesel industrial production. Applied Catalysis B:
Environmental, 2006, vol. 67, no 1-2, p. 136-148.
[26] K. Tahvildari, YN. Anaraki, R. Fazaeli, S. Mirpanji,
& E. Delrish. (2015). L'étude du couplage de nano-catalyseurs
hétérogènes CaO et MgO sur l'efficacité de la
réaction de transestérification dans la production de biodiesel
à partir d'huile de cuisson recyclée. Journal of
Environmental Health Science and Engineering, 13 (1), 1-9.
[27] F. Tedjini, M. Guerricha, M. Moussaoui. Production
du biodiesel à partir d'huile de jatropha et d'huile de soja : une
révision. Université Echahid Hamma Lakdhar- ELOued. 2020.
[28] N. Shibasaki-Kitakawa, H. Honda, H. Kuribayashi et
al. Biodiesel production using anionic ion-exchange resin as heterogeneous
catalyst. Bioresource Technology, 2007, vol. 98, no 2, p. 416-421.
[29] K. Khiari. Contribution à l'étude des
propriétés thermo-physiques des biocarburants de seconde
génération et leur influence sur le comportement des
moteurs. 2016. Thèse de doctorat. École des Mines de
Nantes.
[30] S. Baroutian, M. K. Aroua, A. A. A. Raman, et al.
Potassium hydroxide catalyst supported on palm shell activated carbon for
transesterification of palm oil. Fuel Processing Technology, 2010,
vol. 91, no 11, p. 1378-1385.
[31] C. Brunschwig, W. Moussavou, et J. Blin. Use of
bioethanol for biodiesel production. Progress in Energy and Combustion
Science, 2012, vol. 38, no 2, p. 283-301.
[32] S.H. Dhawane, T. Kumar, G. Halder. Central composite
design approach towards optimization of flamboyant pods derived steam activated
carbon for its use as heterogeneous catalyst in transesterification of Hevea
brasiliensis oil. Energy Convers. Manag. 100, 277-287.
doi:10.1016/j.enconman.2015.04.
[33] S. H. Dhawane, T. Kumar, et G. Halder. Parametric
effects and optimization on synthesis of iron (II) doped carbonaceous catalyst
for the production of biodiesel. Energy Conversion and Management,
2016, vol. 122, p. 310-320.
[34] X. F. Li, Y. Zuo, Y. Zhang, Y. Fu et al. In
situ preparation of K2CO3 supported Kraft lignin activated carbon as solid base
catalyst for biodiesel production. Fuel, 2013, vol. 113, p.
435-442.
[35] A. K. Agarwal. Applications des biocarburants (alcools
et biodiesel) comme carburants pour moteurs à combustion interne.
Progrès des sciences de l'énergie et de la combustion, 2007,
vol. 33, n° 3, p. 233-271.
51
[36] AW. Schwab, MO. Bagby, et B. Freedman.
Préparation et propriétés des carburants diesel à
partir d'huiles végétales. Carburant, 1987, vol. 66,
n° 10, p. 1372-1378.
[37] Y. Idrissou.
Préparation-caractérisation des polyoxométallates
supportés-application" synthèse des glycérides".
2016. Thèse de doctorat.
[38] BEHP. Freedman, EH. Pryde et TL. Mounts. Variables
affectant les rendements en esters gras d'huiles végétales
transestérifiées. Journal de l'American Oil Chemists
Society, 1984, vol. 61, n° 10, p. 1638-1643.
[39] R. Stern, G. Hillion, J. Rouxel, Process for the
production of esters from vegetable oils or animal oils alcohols, US Patent 5
908 946, 1999.
[40] A. Datta, et B. K. Mandal. A comprehensive review of
biodiesel as an alternative fuel for compression ignition engine. Renewable
and Sustainable Energy Reviews, 2016, vol. 57, p. 799-821.
[41] Ayhan Demirbas. « Biofuels,Securing the Planet's
Future Energy Needs». Springer.2009.
[42] Demirbas, A. Relationships derived from physical
properties of vegetable oil and biodiesel fuels. Fuel, volume 87,
n° 8-9, 2008. p. 1743-1748.
[43] Pereira, R.G., Oliveira, C.D., Oliveira, J.L., Oliveira,
P.C.P., Fellows, C.E., Piamba, O.E. Exhaust emissions and electric energy
generation in a stationary engine using blends of diesel and soybean biodiesel.
Renewable Energy, volume 32, n° 14, 2007. p. 2453-2460.
[44] Qi, D.H., Chen, H., Geng, L.M., Bian, Y.Z., Ren, X.C.
Performance and combustion characteristics of biodiesel-diesel-methanol blend
fuelled engine. Applied Energy, volume 87, n° 5, 2010. p.
1679-1686.
[45] Kulkarni, M.G., Dalai, A.K., Bakhshi, N.N.
Transesterification of canola oil in mixed methanol/ethanol system and use of
esters as lubricity additive. Bioresource Technology, volume 98,
n° 1, 2007. p. 2027-2033.
[46] Predojeviæ Z. J., The production of biodiesel
fromwastefryingoils: A comparison of different purification steps, 2008, p.
3524.
[47] Mittelbach M., Diesel fuel derived from vegetable oils,
VI: specifications and quality control of biodiesel. BioresourTechno, 1996, p.
56:7-11.
[48] Demirbas A., Biodiesel : A Realistic Fuel Alternative
for Diesel Engines, Chapter 6 Fuel Properties of Biodiesels, 2008, p. 141.
[49] J. V. Gerpen, Cetane Number Testing of Biodiesel,
1996.
[50] Knothe G. et Steidley K. R., Kinematic Viscosity of
biodiesel fuel components and related compounds. Influence of compound
structure and comparison to petro-diesel fuel components, Fuel 84., 2005, p.
1059-1065.
52
[51] Knothe G., Gerpen J.Van et Krahl J., The Biodiesel
Handbook, AOCS Press 2005. 303 p. ISBN 0-000000-00-00 (acid-free paper)
[52] Meng X., Chen G. et Wang Y., Biodiesel production
fromwaste cooking oil via alkali catalyst and itsengine test, Fuel processing
technology, 2008, p. 89: 851 - 857.
[53] « Energy Efficiency & renewable Energy,
Alternative Fuels Data centre.,» [En ligne]. Available:
ww.afdc.energy.gov/fuels/biodiesel_blends.
[54] U.S. Department of Energy, Biodiesel Handling and
Use Guidelines.
[55] Knothe G., Biodiesel and renewable diesel : A
comparaison, Progress in Energy and Combustion Science, 2010, p. 36:
364-373.
[56] Balat M. et Balat H., A criticalreview of bio-diesel
as a vehicular fuel, Energy Conversion and Management, 2008, p. 49:
2727-2741.
[57] Bozbas K., Biodiesel as an alternative motor fuel:
Production and policies in the European Union, Renewable and Sustainable Energy
Reviews, 2008, p. 12:542-552.
[58] Singh S. P. et Singh D., Biodiesel production
through the use of different sources and characterization of oils and their
esters as the substitute of diesel: A review, Renewable and Sustainable Energy
Reviews, 2010, p. 14: 200-216.
[59] Karabektas M., The effects of turbocharger on the
performance and exhaust emission of a diesel engine fuelled with biodiesel,
Renewable Energy, 2009, p. 34: 989-993.
[60] H.Lamballais. Les aliments. Ed.
Maloine. (1989) 94-102.
[61] I.Debruyne.Soja : transformation et aspects industriels.
Techniques d'ingénieur. (2001)1-
6.
[62] ENCARTA, Encyclopédie
Microsoft Encarta 2006.
[63] NTSOUKPOE.K.E, Modélisation
phénoménologique d'un réacteur de
transestérification pour la production de biodiesel comme combustible
pour les moteurs diesel. Mémoire de fin d'études du cycle
d'ingénieur du 2ie. 2008.
[64] Jacques GOUPY, Les plans d'expériences,
Revue MODULAD, 2006.
| 


