|
Année Universitaire : 1993/1994
ÉÜÜÜíÈÚÔáÇ
ÉÜÜÜíØÇÑÞãíÏáÇ
ÉÜÜÜíÑÆÇÒÌáÇ
ÉÜÜÜíÑæåãÌáÇ
République
Algérienne Démocratique et Populaire
íãáÚáÇ
ËÍÈáÇæ
íáÇÚáÇ
ãíáÚÊáÇ
ÉÑÇÒæ
Ministère de l'Enseignement Supérieur et de la
Recherche Scientifique
ÉíÚÇÑÒáÇ
ãæáÚáá
íäØæáÇ
ÏåÚãáÇ
INSTITUT NATIONAL AGRONOMIQUE
EL HARRACH
(ALGER)
THESE
EN VUE DE L'OBTENTION DU DIPLOME DE
MAGISTER
SPECIALITE : PROTECTION DES VEGETAUX
OPTION : ENTOMOLOGIE
APPLIQUEE
Bioécologie des Orthoptères dans la
région de Ghardaïa
- Régime alimentaire d'Acrotylus patruelis
(Herrich-
Schaeffer, 1838) [Orthoptera-Acrididae]
Présentée et soutenue publiquement le 05/06/1994
Par : ZERGOUN Youcef Devant le jury composé
de:
Président DOUMANDJI-MITICHE B Professeur
Directeur de thèse DOUMANDJI S-E Professeur
Examinateur KHELIL M.A. Maitre de conférences
Examinateur BENZARA A. Chargé de cours
DEDICACES
A Mes chers parents
A Toute ma famille
A Tous ceux qui me sont chers
A Tous mes amis
Je dédie le fruit de mes 22 ans d'études.
Youcef
REMERCIEMENTS
La présentation de ce modeste travail m'offre
l'occasion d'exprimer ma profonde gratitude à Monsieur DOUMANDJI
SALAH-EDDINE, Professeur à l'Institut National Agronomique, qui a bien
voulu diriger ce travail pendant toute la durée de
l'expérimentation et la mise en forme du document final. Ses nombreux
conseils ne m'ont jamais fait défaut. Je suis heureux de lui exprimer
ici ma respectueuse reconnaissance.
Je remercie également Madame DOUMANDJI-MITICHE BAHIA,
Professeur à l'Institut National Agronomique, d'abord pour toutes les
facilités accordées et d'avoir bien voulu accepter de
présider le jury de thèse.
Que Monsieur KHELIL MOHAMED ANOUAR, Maitre de
conférences à l'Université de Tlemcen et que Monsieur
BENZARA ABDELMADJID, chargé de cours à l'Institut National
Agronomique, trouvent ici l'expression de notre respectueuse gratitude. Nous ne
saurions assez les remercier du grand honneur qu'ils nous font en jugeant ce
travail.
Je ne pourrais terminer sans évoquer la présence
et le soutien permanent de Melle. DRIOUECHE NAÇIMA, c'est grâce
à son grand coeur, sa compréhension, sa disponibilité, ses
conseils en statistiques, sa correction du document que ce travail a
été réalisé.
J'ai trouvé auprès de Madame NASSIMA SAADA
beaucoup de gentillesse et une grande aide dans l'obtention et la consultation
des documents au sein de la bibliothèque de département de
Zoologie (INA).
Que mes amis (es) de l'institut national d'agronomie El
Harrach Alger soient assurés de mes meilleurs sentiments.
RESUME
Bioécologie des Orthoptères dans la
région de Ghardaïa - Régime alimentaire d'Acrotylus
patruelis (Herrich-Schaeffer, 1838) [Orthoptera-Acrididae]
Nous présentons ici un inventaire de la faune
Acridienne de la vallée du Mzab (Sahara septentrional, Algérie).
Le climat de cette région est saharien avec un hiver
modéré. Les sautériaux ont été
échantillonnées avec des quadrats à Béni Isguen,
Ghardaia et El-Atteuf. Au total, nous avons enregistré 29 espèces
d'Orthoptères (Caelifera), 4 familles et 12 sous-familles, ont
été collectées dans 3 sites différents
échantillonnés de janvier à décembre 1992. Sur la
base du nombre total d'espèces, les Acrididae étaient la famille
dominante avec 24 espèces. Les espèces de sauterelles les plus
communes étaient Ochrilidia gracilis et Acrotylus
patruelis. Sur toutes les espèces recensées, la richesse
totale atteint respectivement 16, 12, 11 à la station du milieu
cultivée de Béni Isguen, la palmeraie de Ghardaia et le milieu
naturel de Béni Isguen. L'indice de diversité Shannon-Weaver (H)
confirme ces résultats, où la valeur la plus élevée
(3,58 bits) est rapportée milieu cultivée, (3,12 bits) est
rapportée à l'environnement naturel et la valeur la plus basse
(1,95 bits) est enregistrée dans la palmeraie de Ghardaia. Des valeurs
élevées de régularité (0,79 <E <0,98)
indiquaient que la communauté des orthoptères était
uniformément répartie dans chaque site. Le régime
alimentaire a été déterminé par l'analyse de
fragments de plantes dans les excréments d'Acrotylus patruelis
prélevés sur le terrain. La sauterelle étudiée
a consommé 07 des 20 espèces végétales
trouvées dans le milieu cultivé. Quantitativement, Cynodon
dactylon est bien consommé, suivi de Setaria verticillata,
Cyperus rotundus, Lageneria vulgaris et Tribulus
terrester; cependant, d'autres espèces végétales sont
moins consommées.
Mots clé : Orthoptera -
Bioécologie - Régime alimentaire - Ghardaïa - Sahara
septentrional
ABSTRACT
Bioecology of Orthoptera in the Ghardaia region - Diet
of Acrotylus patruelis (Herrich-Schaeffer, 1838)
[Orthoptera-Acrididae]
We present here an inventory of Acridid fauna in the Mzab
valley (Septentrional Sahara, Algeria). The climate is Saharan with a moderate
winter. Grasshoppers were sampled with quadrats in Béni Isguen, Ghardaia
and El-Atteuf. In total, we recorded 29 Orthoptera species (Caelifera),
4families and 12 subfamilies, were collected from 3 different sites sampled
during January to December 1992. On the basis of total number of species,
Acrididae was the dominant family with 24 species. The most common grasshopper
species were Ochrilidia gracilis and Acrotylus patruelis. On
all species counted, the total richness reached number 16, 12, 11 respectively
at the station cultivated area of Béni Isguen, date palm grove of
Ghardaia and natural environment of Béni Isguen. The Shannon-Weaver
diversity Index (H) confirms these results, where the highest value (3.58 bits)
is reported at cultivated area, (3.12 bits) is reported at natural environment
of Béni Isguen and the lowest value (1.95 bits) is recorded at date palm
grove of Ghardaia. Higher values of evenness (0.79 < E < 0.98) indicated
that the Orthoptera community was evenly distributed in each site. The diet was
determined by the analysis of plant fragments in the feces of Acrotylus
patruelis sampled in the field. The studied grasshopper consumed 07 of the
20 plant species found in the cultivated environment. Quantitatively,
Cynodon dactylon is well consumed, followed by Setaria
verticillata, Cyperus rotundus, Lageneria vulgaris, and
Tribulus terrester; however, other plant species are less consumed.
Keywords: Orthoptera - Bioecology - Diet -
Ghardaia - Northern Sahara
ÕÎáã
Acrotylus patruelis (Herrich - á
íÆÇÐÛáÇ
ãÇÙäáÇ -
ÉíÇÏÑÛ
ÉÞØäã í
ÉÍäÌáÇÇ
ÊÇãíÞÊÓãá
ÉíæíÍáÇ
ÉÆíÈáÇ
ãáÚ
[Orthoptera-Acrididae] Schaeffer, 1838)
ÉÞØäãáÇ
åÐå í ÎÇäãáÇ
.)ÑÆÇÒÌáÇ
ÁÇÑÍÕáÇ
áÇãÔ ) ÈÇÒíã
íÏÇæ ÉÞØäãá
í ÉÍäÌáÇÇ
ÊÇãíÞÊÓãá
ÏÑÌ ÉãÆÇÞ
Çäå ãÏÞä
ÚæãÌãáÇ í
.ØÚáÇæ
ÉíÇÏÑÛæ
äÞÒí íäÈ í
ÊÇÚÈÑãáÇ í
ÉÍäÌáÇÇ
ÊÇãíÞÊÓãá
ÊÇäíÚ ÐÎ ãÊ
.áÏÊÚã ÁÇÊÔ
Úã íæÇÑÍÕ
ÉáÊÎã ÚÞÇæã 3
äã ÇåÚãÌ ãÊ
ÉíÚÑ ÉáÆÇÚ 12
æ ÊáÇÆÇÚ 4 æ (Caelifera)
ÉÍäÌáÇÇ
ÊÇãíÞÊÓã äã
ÇðÚæä 29 ÇäáÌÓ
íå Acrididae ÊäÇß
ÚÇæäáá
íáÇãÌáÅÇ
ÏÏÚáÇ ÓÇÓ
ìáÚæ . 1992
ÑÈãÓíÏ ìáÅ
ÑíÇäí äã
ÉÑÊáÇ ááÇÎ
Çåäã ÊÇäíÚ
ÐÎ ãÊ
Acrotylus æ Ochrilidia gracilis íå
ÇðÚæíÔ
ÉÍäÌáÇÇ
ÊÇãíÞÊÓã
ÚÇæä ÑËß .Úæä 24
Úã ÉäãíåãáÇ
ÉáÆÇÚáÇ íäÈ
ÉÚæÑÒãáÇ
ÉÞØäãáÇ í
íáÇæÊáÇ ìáÚ
1 1 æ 1 2 æ 16 ãÞÑ
ÇåÄÇÕÍÅ ãÊ
íÊáÇ ÚÇæäáÇ
áßá
íáÇãÌáÅÇ
ÁÇÑËáÇ ÛáÈpatruelis
ËíÍ ÌÆÇÊäáÇ
åÐå Shannon-Weaver (H) ÚæäÊ
ÑÔÄã ÏßÄí
.äÞÓÇ íäÈá
ÉíÚíÈØáÇ
ÉÆíÈáÇæ
ÉíÇÏÑÛ áíÎä
äÇÊÓÈæ äÞÓÇ
äÞÒí íäÈá
ÉíÚíÈØáÇ
ÉÆíÈáÇ í
ÇåäÚ
ÛáÇÈáÅÇ ãÊ
)ÊÈ 3.12(
ÉÚæÑÒãáÇ
ÉÞØäãáÇ í )ÊÈ
3.58( ÉãíÞ ìáÚ äÚ
ÛáÇÈáÅÇ ãÊ
ÚãÊÌã ä ìáÅ <E
<0.98) 0.79( íæÇÓÊáá
ìáÚáÇ
ãíÞáÇ ÊÑÇÔ
.ÉíÇÏÑÛ áíÎä
äÇÊÓÈ í
ÉáÌÓã )ÊÈ 1.95(
ÉãíÞ ìäÏæ
ÒÇÑÈ í
ÊÇÈäáÇ ÁÇÒÌ
áíáÍÊ ááÇÎ
äã íÆÇÐÛáÇ
ãÇÙäáÇ
ÏíÏÍÊ ãÊ
.ÚÞæã áß í
íæÇÓÊáÇÈ
ÚÒæã
ÉÍäÌáÇÇ
ÊÇãíÞÊÓã
.ÉÚæÑÒãáÇ
ÉÆíÈáÇ í
ÇðÏæÌæã
íÊÇÈä Úæä 20 äã
07 ÓæÑÏãáÇ
ÈÏäÌáÇ
ßáåÊÓÇ
.áÞÍáÇ äã
ÐæÎãáÇAcrotylus patruelis æ
Cyperus rotundus æ Setaria verticillata
åíáí ÇðÏíÌ
Cynodon dactylon ßáÇåÊÓÇ
ãÊ ÉíãßáÇ
ÉíÍÇäáÇ äã
.ÇðßáÇåÊÓÇ
áÞ ìÑÎáÇ
ÉíÊÇÈäáÇ
ÚÇæäáÇ
íÞÇÈæ ° Tribulus
terresteræLageneria vulgaris
ÁÇÑÍÕáÇ
áÇãÔ -
ÉíÇÏÑÛ -
íÆÇÐÛáÇ
ãÇÙäáÇ
-ÉíæíÍáÇ
ÉÆíÈáÇ ãáÚ
- ÉÍäÌáÇÇ
ÊÇãíÞÊÓã :
ÉíÍÇÊã
ÊÇãáß
Liste des abréviations
COPR. : Centre for Overseas Pest Research
INPV : Institut National de Protection des
Végétaux
ONM : Office National de la Météorologie
Liste des figures
|
Figure
|
Titre
|
Page
|
|
Figure 1.
|
Cycle biologique du criquet pèlerin Schistocerca
gregaria Forskal, 1775
|
7
|
|
Figure 2.
|
Le relief de la vallée du M'Zab
|
17
|
|
Figure 3.
|
Diagramme Ombrothermique de la région de Ghardaïa
pour une période de 10 ans (1981-1990).
|
20
|
|
Figure 4.
|
Diagramme Ombrothermique de la région de Ghardaïa
pour l'année 1992
|
21
|
|
Figure 5.
|
Climagramme pluviothermique d'Emberger de la région de
Ghardaïa
|
21
|
|
Figure 6.
|
Méthode des quadrats
|
27
|
|
Figure 7.
|
Transect végétal en milieu non cultivé
|
30
|
|
Figure 8.
|
Transect végétal en milieu cultivé
|
31
|
|
Figure 9.
|
Transect végétal en palmeraie
|
32
|
|
Figure 10.
|
Démarche à suivre pour l'analyse des
fèces
|
36
|
|
Figure 11.
|
Fréquence relative des sous familles
d'Orthoptères dans les stations d'études de la région de
Ghardaïa.
|
44
|
|
Figure 12.
|
Nombre de larves et d'imagos d'Acrotylus patruelis
par 45m2 en fonction du temps dans deux stations
d'étude
|
46
|
|
Figure 13.
|
Nombre de larves et d'imagos d'Ochrilidia gracilis par
45m2 en fonction du temps dans deux stations d'étude.
|
48
|
|
Figure 14.
|
Nombre de larves et d'imago d'Aiolopus strepens par
45m2 en fonction du temps dans deux stations d'étude.
|
50
|
|
Figure 15.
|
Nombre de larves et d'imagos de Sphingonotus rubescens
par 45m2 en fonction du temps dans le milieu non
cultivé.
|
51
|
|
Figure 16.
|
Nombre de larves et d'imagos de Pyrgomorpha cognata
par 45m2 en fonction du temps dans trois stations
d'étude.
|
53
|
|
Figure 17.
|
Nombre de larves et d'imagos de Truxalis nasuta par
45m2 en fonction du temps dans trois stations d'étude.
|
55
|
|
Figure 18.
|
Nombre de larves et d'imagos d'Heteracris harterti
par 45m2 en fonction du temps dans deux stations
d'étude.
|
57
|
|
Figure 19.
|
Nombre de larves et d'imagos d'Anacridium aegyptium
par 45m2 en fonction du temps dans le milieu cultivé.
|
58
|
|
Figure 20.
|
Carte factorielle axe (1-2) des espèces
d'Orthoptères.
|
61
|
|
Figure 21.
|
Fréquence le long de l'année (1992) des
espèces d'Orthoptères dans le milieu cultivé
|
64
|
|
Figure 22.
|
Fréquence le long de l'année (1992) des
espèces d'Orthoptères dans la palmeraie
|
65
|
|
Figure 23.
|
Fréquence le long de l'année (1992) des
espèces d'Orthoptères dans le milieu non cultivé
|
66
|
Liste des tableaux
|
Tableau
|
Titre
|
Page
|
|
Tableau 1.
|
Les températures dans la région de Ghardaïa
(1992).
|
18
|
|
Tableau 2.
|
Moyennes mensuelles des températures pour une
période de 10 ans (1981 à 1990).
|
18
|
|
Tableau 3.
|
Précipitations dans la région de Ghardaïa
(1992)
|
19
|
|
Tableau 4.
|
Moyennes mensuelles des précipitations sur une
période de 10 ans (1981 à 1990).
|
19
|
|
Tableau 5.
|
Liste des adventices recencées dans la région de
Ghardaïa.
|
24
|
|
Tableau 6.
|
Liste des oiseaux cités par certains auteurs dans la
région de Ghardaïa.
|
25
|
|
Tableau 7.
|
Liste des Mammifères cités par Le Berre (1989b)
dans la région de Ghardaïa.
|
26
|
|
Tableau 8.
|
Taux de recouvrement des espèces
végétales dans le milieu non cultivé pour un transect de
500m2
|
29
|
|
Tableau 9.
|
Taux de recouvrement des espèces
végétales dans le milieu cultivé pour un transect de
500m2
|
29
|
|
Tableau 10.
|
Taux de recouvrement des espèces
végétales dans la palmeraie pour un transect de 500 m2
|
30
|
|
Tableau 11.
|
Abondance dominance des espèces végétales
présentes dans le milieu cultivé
|
34
|
|
Tableau 12.
|
Faune des Orthoptères Caelifères de la
région de Ghardaïa.
|
41
|
|
Tableau 13.
|
Faune des Orthoptères Caélifères en milieu
non cultivé à Béni Isguen.
|
43
|
|
Tableau 14.
|
Faune Orthoptérologique du milieu cultivé à
Béni Isguen.
|
43
|
|
Tableau 15.
|
Faune Orthoptérologique de la palmeraie à
Ghardaïa
|
43
|
|
Tableau 16.
|
Nombre de larves et d'imagos d'Acrotylus patruelis
par 45m2 en fonction du temps dans deux stations
d'étude.
|
46
|
|
Tableau 17.
|
Nombre de larves et d'imagos d'Ochrilidia gracilis
par 45m2 en fonction du temps dans deux stations
d'étude.
|
48
|
|
Tableau 18.
|
Nombre de larves et d'imago d'Aiolopus strepens par
45m2 en fonction du temps dans deux stations d'étude.
|
50
|
|
Tableau 19.
|
Nombre de larves et d'imagos de Sphingonotus rubescens
par 45m2 en fonction du temps dans le milieu non
cultivé.
|
51
|
|
Tableau 20.
|
Nombre de larves et d'imagos de Pyrgomorpha cognata
par 45m2 en fonction du temps dans trois stations
d'étude.
|
53
|
|
Tableau 21.
|
Nombre de larves et d'imagos de Truxalis nasuta par
45m2 en fonction du temps dans trois stations d'étude
|
55
|
|
Tableau 22.
|
Nombre de larves et d'imagos d'Heteracris harterti
par 45m2 en fonction du temps dans deux stations
d'étude.
|
57
|
|
Tableau 23.
|
Nombre de larves et d'imagos d'Anacridium aegyptium
par 45m2 en fonction du temps dans le milieu cultivé.
|
58
|
|
Tableau 24.
|
Contribution à l'inertie totale ou pourcentage
expliqués par les axes principaux.
|
60
|
|
Tableau 25.
|
Contributions relatives aux espèces
d'Orthoptères ou variables sur l'axe 1 et 2
|
60
|
|
Tableau 26.
|
Fréquences relatives des espèces
d'Orthoptères dans le milieu cultivé à Beni Isguen en
fonction du temps.
|
64
|
|
Tableau 27.
|
Fréquences relatives des espèces
d'Orthoptères dans la palmeraie de Ghardaïa en fonction du
temps.
|
65
|
|
Tableau 28.
|
Fréquences relatives des espèces
d'Orthoptères dans le milieu non cultivé à Béni
Isguen en fonction du temps.
|
66
|
|
Tableau 29.
|
La constance en % des Cælifères dans trois stations
d'étude
|
68
|
|
Tableau 30.
|
Indice de diversité de Shannon Weaver et
équitabilité dans chaque milieu et pour chaque sortie.
|
70
|
|
Tableau 31.
|
Indice de dispersion des espèces Cælifères en
milieu cultivé à Béni Isguen
|
72
|
|
Tableau 32.
|
Indice de dispersion des espèces Cælifères en
palmeraie à Ghardaïa
|
73
|
|
Tableau 33.
|
Indice de dispersion des espèces Cælifères
en milieu non cultivé à Béni Isguen
|
73
|
|
Tableau 34.
|
Fréquence des espèces végétales
présentes dans les excréments des 2 sexes d'Acrotylus
patruelis dans le milieu cultivé de Béni Isguen
|
78
|
|
Tableau 35.
|
Taux, indice d'attraction et surface végétales
moyennes consommées par 50 mâles d'Acrotylus patruelis en
milieu cultivé de Béni Isguen.
|
80
|
|
Tableau 36.
|
Taux, indice d'attraction et surface végétales
moyennes consommées par 50 femelles d'Acrotylus patruelis en
milieu cultivé de Béni Isguen.
|
81
|
Sommaire
Introduction
Chapitre I : Données bibliographiques sur les
Orthoptères
I - 1 - Généralités sur les
Orthoptères
I - 1 - 1 - Importance économique
I - 1 - 2 - 1 - Sous ordre des Ensifères
I - 1 - 2 - Position systématique
I - 1 - 2 - 2 - Sous ordre des Cælifères
I - 1 - 3 - Espèces nuisibles à l'agriculture
I - 1 - 3 - 1 - Locustes
I - 1 - 3 - 1 - 1 - Criquet pèlerin
I - 1 - 3 - 1 - 2 - Criquet migrateur
I - 1 - 3 - 1 - 3 - Criquet marocain
I - 1 - 3 - 2 - Sautériaux ravageurs
I - 1 - 4 - Cycle biologique
I - 1 - 4 - 1 - 1 - Ponte
I - 1 - 4 - 1 - 2 - Incubation
I - 1 - 4 - 2 - Développement larvaire
I - 1 - 4 - 2 - 1 - Eclosion
I - 1 - 4 - 2 - 2 - Nombre de stades larvaires
I - 1 - 4 - 3 - Imago
I - 1 - 4 - 4 - Accouplement
I - 1 - 4 - 5 - Nombre de générations
I - 1 - 5 - Influence des facteurs écologiques
I - 1 - 5 - 1 - Température
I - 1 - 5 - 2 - Humidité
I - 1 - 5 - 3 - Photopériode
I - 1 - 5 - 4 - Sol
I - 1 - 5 - 5 - Végétation
I - 1 - 5 - 6 - L'Homme
I - 1 - 5 - 7 - Les ennemis naturels
I - 1 - 5 - 7 - 1 - Parasites
I - 1 - 5 - 7 - 1 - 1 - Parasites des oothèques
I - 1 - 5 - 7 - 1 - 2 - Parasites des larves et des
ailés
I - 1 - 5 - 7 - 2 - Prédateurs
I - 1 - 5 - 7 - 2 - 1 - Prédateurs des
oothèques
I - 1 - 5 - 7 - 2 - 2 - Prédateurs des larves et des
ailés
I - 1 - 5 - 7 - 3 - Maladies
I - 1 - 5 - 7 - 3 - 1- Protozoaires
I - 1 - 5 - 7 - 3 - 2- Champignons
I - 1 - 5 - 7 - 3 - 3- Entomopoxvirus
Chapitre II : Présentation de la région
d'étude
II - 1 - Situation géographique
II - 2 - Relief
II - 3 - Données climatiques
II - 3 - 1 - Températures
II - 3 - 2 - Pluviométrie
II - 3 - 3 - Humidité relative de l'air
II - 3 - 4 - Vents
II - 3 - 5 - Coefficients climatiques
II - 3 - 5 - 1 - Diagramme Ombrothermique de Bagnouls et
Gaussen
II - 3 - 5 - 2 - Climagramme pluviothermique d'Emberger
II - 4 - Hydrographie
II - 5 - Le sol
II - 6 - Utilisation des terres
II - 7 - La flore
II - 7 - 1 - Palmeraie
II - 7 - 2 - Arbres fruitiers
II - 7 - 3 - Cultures maraichères
II - 7 - 4 - Les adventices
II - 8 - La faune
II - 8 - 1 - Les Arthropodes
II - 8 - 2 - Les Amphibiens et les Reptiles
II - 8 - 3 - Les Oiseaux
II - 8 - 4 - Les Mammifères
Chapitre III matériels et méthodes de
travail
III - 1 - Matériel
III - 1 - 1 - Matériel utilisé sur le terrain
III - 1 - 2 - Matériel employé au laboratoire
III - 1 - 2 - 1 - Matériel utilisé pour la
détermination des Orthoptères
III - 1 - 2 - 2 - Matériel utilisé pour
l'étude du régime alimentaire
III - 2 - Méthode de travail
III - 2 - 1 - Méthodes utilisées sur le terrain
III - 2 - 1 - 1 - Choix des stations d'étude
III - 2 - 1 - 2 - Transect végétal en milieu non
cultivé
III - 2 - 1 - 3 - Transect végétal en milieu
cultivé
III - 2 - 1 - 4 - Transect végétal dans une
palmeraie
III - 2 - 1 - 5 - Méthode des quadrats
III - 2 - 1 - 6 - Méthode d'étude du régime
alimentaire sur le terrain
III - 2 - 1 - 6 - 1 - Caractérisation de la
végétation
III - 2 - 1 - 6 - 2 - Prélèvement des
fèces
III - 2 - 2 - Méthodes employées au laboratoire
III - 2 - 2 - 1 - Détermination des espèces
capturées
III - 2 - 2 - 2 - Détermination des stades larvaires
III - 2 - 2 - 3 - Conservation des échantillons
III - 2 - 2 - 4 - Etablissement du catalogue des
végétaux de référence
III - 2 - 2 - 5 - Analyse des fèces
III - 2 - 3 - Méthodes d'expression des
résultats
III - 2 - 3 - 1 - Analyse statistique
III - 2 - 3 - 1 - 1 - Analyse factorielle des correspondances
III - 2 - 3 - 1 - 2 - Fréquence relative
III - 2 - 3 - 1 - 3 - Constance
III - 2 - 3 - 2 - Analyse par indices écologiques
III - 2 - 3 - 2 - 1 - Indice de diversité et
équirépartition
III - 2 - 3 - 2 - 2 - Indice de dispersion des espèces
acridiennes dans le temps et dans
l'espace
III - 2 - 3 - 3 - Méthodes de quantification relative de
la nourriture ingérée
III - 2 - 3 - 3 - 1 - Méthode des fréquences
III - 2 - 3 - 3 - 2 - Méthode des surfaces
Chapitre IV: Bioécologie des principales
espèces d'Orthoptères dans la région de
Ghardaïa
IV - 1 - Inventaire
IV - 1 - 1 - Inventaire concernant la faune
Orthoptérologique de la région de Ghardaïa
IV - 1 - 1 - 1 - Résultats
IV - 1 - 1 - 2 - Discussion
IV - 1 - 1 - 3 - Conclusion
IV - 1 - 2 - Inventaire concernant les stations
d'étude
IV - 1 - 2 - 1 - Résultats
IV - 1 - 2 - 2 - Discussion
IV - 1 - 2 - 3 - Conclusion
IV - 2 - Bioécologie des principales espèces
acridiennes
IV - 2 - 1 - Biologie et Ecologie d'Acrotylus
patruelis
IV - 2 - 1 - 1 - Biologie
IV - 2 - 1 - 2 - Ecologie
IV - 2 - 2 - Biologie et Ecologie d'Ochrilidia gracilis
IV - 2 - 2 - 1- Biologie
IV - 2 - 2 - 2 - Ecologie
IV - 2 - 3 - Biologie et Ecologie d'Aiolopus strepens
IV - 2 - 3 - 1 - Biologie
IV - 2 - 3 - 2 - Ecologie
IV - 2 - 4 - Biologie et Ecologie de Sphingonotus
rubescens
IV - 2 - 4 - 1 - Biologie
IV - 2 - 4 - 2 - Ecologie
IV - 2 - 5 - Biologie et Ecologie de Pyrgomorpha
cognata
IV - 2 - 5 - 1 - Biologie
IV - 2 - 5 - 2 - Ecologie
IV - 2 - 6 - Biologie et Ecologie de Truxalis
nasuta
IV - 2 - 6 - 1 - Biologie
IV - 2 - 6 - 2 - Ecologie
IV - 2 - 7- Biologie et Ecologie d'Heteracris
harterti
IV - 2 - 7- 1 - Biologie
IV - 2 - 7- 2 - Ecologie
IV - 2 - 8 - Biologie et Ecologie d'Anacridium
aegyptium
IV - 2 - 8 - 1 - Biologie
IV - 2 - 8 - 2 - Ecologie
IV - 2 - 9 - Conclusion
CHAPITRE V : Analyse statistique et écologique
des résultats
V - 1 - Analyse statistique des résultats
V - 1 - 1 - Analyse factorielle des correspondances
V - 1 - 1 - 1- Résultats
V - 1 - 1 - 2- Discussion
V - 1 - 1 - 3- Conclusions
V - 1 - 2 - Fréquence relative
V - 1 - 2 - 1 - Résultats
V - 1 - 2 - 2 - Discussion
V - 1 - 2 - 3 - Conclusion
V - 1 - 3 - La constance
V - 1 - 3 - 1 - Résultats
V - 1 - 3 - 2 - Discussion
V - 1 - 3 - 3 - Conclusion
V - 2 - Analyse des résultats par les indices
écologiques
V - 2 - 1 - Indice de diversité de Shannon Weaver et
équitabilité
V - 2 - 1 - 1 - Résultats
V - 2 - 1 - 2 - Discussion
V - 2 - 1 - 3 - Conclusion
V - 2 - 2 - Indice de dispersion
V - 2 - 2 - 1 - Résultats
V - 2 - 2 - 2 - Discussion
V - 2 - 2 - 3 - Conclusions
CHAPITRE VI : Etude du régime alimentaire
d'Acrotylus patruelis
VI - 1 - Données bibliographique sur le régime
alimentaire des acridiens
VI - 1 - 1 - Relation phytophages - plantes
VI - 1 - 2 - Les variations du régime alimentaire chez
les Orthoptères
VI - 1 - 3 - L'alimentation chez les acridiens
VI - 1 - 3 - 1 - Aspect quantitatif de l'alimentation
VI - 1 - 3 - 2 - Aspect qualitatif de l'alimentation
VI - 1 - 4 - Spectre et préférence alimentaire
chez les acridiens
VI - 1 - 5 - Effet de l'alimentation sur les
Orthoptères
VI - 2 - Etude du régime alimentaire d'Acrotylus
patruelis
VI - 2 - 1 - Fréquence et spectre alimentaire chez
Acrotylus patruelis dans le milieu cultivé
VI - 2 - 1 - 1 - Résultats
VI - 2 - 1 - 2 - Discussion
VI - 2 - 1 - 3 - Conclusion
VI - 2 - 2 - Etude quantitative de la consommation chez les
imagos d'Acrotylus patruelis
VI - 2 - 2 - 1 - Résultats
VI - 2 - 2 - 2 - Discussion
VI - 2 - 2 - 3 - Conclusion
Conclusion générale
Références bibliographiques
1
Introduction
Les pullulations d'Orthoptères en Afrique du Nord
semblent être la conséquence d'accidents
météorologiques. Le climat de la région d'étude se
caractérise, en effet, par des précipitations automno-hivernales
très irrégulières d'une année à l'autre. De
ce fait, le pays traverse des périodes pluriannuelles relativement
humides alternant avec des périodes sèches comme ce fut le cas
des années 1983 et 1987 à déficit hydrique. Il se produit
alors des multiplications intenses de criquets dans différentes
régions d'Algérie notamment dans celles de Médéa
(Doumandji-Mitiche et al..,1992), de Batna, de Sétif et en
particulier de Bordj Bou Arreridj (Doumandji et al, 1993). Les
informations en provenance des pays frontaliers, laissent sans nul doute,
planer sur l'Algérie le spectre d'une menace d'invasion de ce
fléau. Ainsi, les Criquets pèlerins auraient ravagé au
Soudan pas moins de 400.000 hectares. Ceci laisse entrevoir les prémices
d'une imminente invasion au Tchad et au Mali (Anonyme,
1993a). La capitale mauritanienne, Nouakchott, est envahie par
des essaims de Criquets
qui sont devenus un véritable calvaire pour
la nature et pour la population. Dans plusieurs quartiers, des espaces verts
sont totalement détruits. Les arbres jaunissent et se
dégarnissent de leurs feuilles ravagés par les Criquets que l'on
rencontre désormais partout (Anonyme, 1993b). La banque mondiale, qui a
approuvé en décembre 1993 l'octroi à l'Algérie d'un
prêt de 30 millions de dollars pour lutter contre une possible
avancée de Criquets jusqu'au Nord du pays, tient à venir en aide
à l'Algérie en raison des enjeux très importants que
constitue une telle menace. Si la somme de 30 millions de dollars peut
paraître énorme, elle se Justifie pleinement comparée aux
60 millions de dollars de pertes qui pourraient résulter de
l'anéantissement par les sauterelles de seulement 1% de l'agriculture
algérienne. Si l'Algérie ne parvient pas à stopper les
sauterelles au niveau de l'Atlas, les insectes pourraient dévaster la
totalité des cultures, selon la banque mondiale, qui rappelle qu'une
colonie moyenne de Criquets adultes soit 150 millions d'individus peut
dévorer l'équivalent de 100 tonnes de végétation
par jour (Anonyme, 1994). Selon Duranton et al (1986) les moyens
économiques sont paradoxalement plus difficiles à obtenir. Il
faut en contre partie des signes très positifs de relance.
L'émergence de chercheurs nationaux motivés est indispensable. En
effet, l'existence d'équipes pluridisciplinaires et la création
de réseaux associatifs en vue d'échanges d'informations peuvent
mettre fin à ce phénomène. C'est ainsi que de nombreux
travaux sont effectués au Maroc (Ben Halima, 1983) et
particulièrement en Algérie, par Chara (1987) en plus des travaux
faits au département de zoologie agricole et forestière de
l'Institut National Agronomique d'El Harrach, tels que ceux de Fellaouine
(1984,1989), Djenidi (1989), Mohammedi (1989), Hamdi (1989,1992), Benrima
(1990,1993) et Zergoun (1991). Compte
2
tenu des problèmes acridiens posés chaque
année en Algérie nous abordons l'étude
bioécologique des Orthoptères dans la région de
Ghardaïa et le régime alimentaire d'Acrotylus patruelis
(Herrich-Schaeffer, 1838). Le premier chapitre comporte des données
bibliographiques sur les Orthoptères. Nous présentons la
région d'étude dans le deuxième chapitre. Le
matériel utilisé et les méthodes de travail
employées au cours de l'étude, constituent le troisième
chapitre. Dans le quatrième chapitre une approche bioécologique
des peuplements d'Orthoptères dans cette région est
réalisée. Une analyse statistique et écologique des
résultats est présentée dans le cinquième chapitre.
Enfin, nous terminons ce travail en abordant le régime alimentaire
d'Acrotylus patruelis.
3
Chapitre I : Données bibliographiques sur les
Orthoptères
I - 1 - Généralités sur les
Orthoptères
I - 1 - 1 - Importance économique
Il n'y a pratiquement aucun groupe d'animaux que celui des
criquets qui, de tous temps, ait été associé par l'Homme
à l'imagination des événements catastrophiques
destructeurs, fatalement inévitables. Le Criquet pèlerin
étant phytophage, les dégâts causés à
différentes cultures peuvent être très soudains et graves
au point de déstabiliser les communautés rurales dans les pays en
voie de développement et de provoquer des famines qui nécessitent
une aide internationale. Ce ravageur est non seulement capable de se reproduire
de façon colossale, mais il mange chaque Jour son propre poids de
nourriture fraîche. Ainsi, un essaim de quarante millions de criquets
pesant chacun 2 grammes en moyenne représente un poids total de 80
tonnes. Au nombre de 500.000 les criquets pèsent à peu
près 1 tonne et consomment approximativement la même
quantité de nourriture, que celle qui permettrait de nourrir 2500
personnes (Nurein, 1989). D'après Launois (1986), la dernière
invasion grave qui s'est produite en Algérie date de 1974. A cette
époque, les criquets avaient fait perdre 400.000 tonnes de
céréales dans le Sahel alors que les habitants venaient de
connaître quatre années de sécheresse consécutives
engendrant la famine. De même Launois (1988), signale que les
cultivateurs d'oliviers de Sfax en Tunisie ont vu arriver sur leur
récolte en avril 1988, des essaims compacts de Criquets pèlerins
qui ont ravagé les cultures. Les sauterelles dévorent les
céréales, les légumes, les régimes de dattes et
Jusqu'aux feuilles plutôt coriaces des palmiers en ne laissant que la
nervure médiane une palmeraie ravagée par les sauterelles reste
parfois deux ou trois ans sans produire (Capot- Rey, 1953). S'il est vrai que
l'action menée contre les criquets au Maroc ait été
jugée par les experts comme exemplaire, aussi bien pour la mobilisation
de la population que pour l'utilisation coordonnée d'importants moyens
terrestres et aériens, il n'en reste pas moins qu'une nation ne peut
parvenir seule à faire face à ce fléau. Selon Lorelle
(1989), 15 à 18 dollars par ha, constituent le coût de la lutte
antiacridienne au Maroc pour la campagne 1987/1988.
I - 1 - 2 - Position systématique
La classification la plus récente pour l'ordre des
Orthoptères est celle de Dirsh (1965), modifiée par Uvarov
(1966). L'ordre des Orthoptères est divisé en deux sous - ordres,
les Ensifères et les Caelifères (Chopard, 1943).
4
I - 1 - 2 - 1 - Sous ordre des Ensifères
Les Ensifères ont des antennes longues et fines. Les
valves génitales des femelles sont bien développées et se
présentent comme un organe de ponte en forme de sabre ou en
épée, dont les bords sont dentés ou non. L'organe
stridulant du mâle occupe les champs dorsaux des élytres dont
l'émission des sons est due aux frottements de l'un des élytres
contre l'autre. Les organes tympaniques pour la perception des sons sont
situés sur les tibias des pattes antérieures. Les oeufs sont
pondus isolément dans le sol ou à sa surface (Duranton et
al., 1982). Chopard (1943), a divisé le sous ordre des
Ensifères en trois familles, les Stenopelmatidae, les
Tettigoniidae et les Gryllidae.
I - 1 - 2 - 2 - Sous ordre des Cælifères
Les Cælifères ont des antennes courtes bien que
multiarticulées. Ce sont les criquets et les sauterelles. Les valves
génitales des femelles sont robustes et courtes. L'organe stridulant des
males est constitué par une crête du fémur
postérieur frottant sur une nervure intercalaire des élytres. Les
organes tympaniques sont situés sur les cotés du premier segment
abdominal. Les oeufs sont généralement pondus en masse
enrobés ou surmontés de matière spumeuse, et enfouis dans
le sol grâce à la pénétration presque totale de
l'abdomen. Le régime alimentaire habituel est phytophage.
Deux super-familles sont citées pour les sous ordres
des Cælifères. La super-famille de Tridactyloidea
renferme un très petit nombre d'espèces n'offrant pas
d'intérêt agronomique. Elle ne compte qu'une cinquantaine
d'espèces connues dans le monde (Duranton et al, 1982). La
super-famille d'Acridoidea quant à elle compte près de 10.000
espèces (Bonnemaison, 1961). Cette superfamille a été
actualisée grâce au catalogue de Louveaux et Ben Halima (1987),
dans la classification des acridiens de Chopard (1943), à l'ouvrage de
Dirsh (1965) ainsi qu'aux révisions de plusieurs genres. Les
Orthoptères Acridoidea d'Afrique du Nord Ouest englobent 04
familles, celles des Charilaidae, des Pamphagidae, des
Pyrgomorphidae et des Acrididae. La famille des
Pamphagidae présente 02 sous familles celles des Akicerinae
et des Pamphaginae. Par contre la famille de Pyrgomorphidae
possède 3 tribus ou sous familles; il s'agit des Chrotogonini
des Poekilocerini, et des Pyrgomorphini. La famille des
Acrididae est la plus représentée en espèces dans
l'Afrique du Nord Ouest. En effet cette famille est divisée en 13 sous
familles qui sont les suivantes, celles des Dericorythinae, des
Hemiacridinae, des Tropidopolinae, des
Calliptaminae, des Eyprepocnemidinae, des
Catantopinae, des Cyrtacanthacridinae, des
5
Egnatiinae, des Acridinae, des
Oedipodinae, des Gomphocerinae, des Truxalinae, et
des Eremogryllinae.
I - 1 - 3 - Espèces nuisibles à
l'agriculture
Les criquets ravageurs ne sont pas des insectes comme les
autres. Certains d'entre-deux, les Locustes, comme Schistocerca gregaria
(Forskal (1775), Locusta migratoria (Linné, 1778) et
Dociostaurus maroccanus (Thunberg, 1815), sont capables de se
présenter sous deux formes différentes appelées phases
selon qu'ils sont solitaires ou grégaires. D'autres criquets, les
sautériaux conservent au contraire leurs caractéristiques
générales qu'ils soient isolés ou regroupés.
I - 1 - 3 - 1 - Locustes
I - 1 - 3 - 1 - 1 - Criquet pèlerin
Le Criquet pèlerin Schistocerca gregaria
encore appelé «Désert locust», est un fléau
très redoutable, dont les ravages, aux périodes d'invasion, sont
souvent suivis de famines dans les pays envahis. Cette espèce est
importante du fait qu'elle parcourt de 150 à 200Km par jour lorsqu' elle
migre par ses propres moyens et couvre ainsi une très large surface
pendant la période d'invasion. L'aire d'invasion est de 29 millions de
kilomètres carrés et elle concerne 57 pays. Elle s'étend
sur 20% de la superficie de la terre où le Criquet pèlerin peut
détruire environ 10% des ressources vivrières de la population
mondiale. Des dégâts dû au Criquet pèlerin, tout
particulièrement dans les cultures, ont été
déclarés dans de nombreux pays. Cet insecte cause des ravages
durant ses différents stades de développement. Il a
été constaté que 8% des dommages sont dûs aux
larves, 69% aux insectes immatures et 23% aux essaims d'insectes adultes
(Nurein, 1989).
I - 1 - 3 - 1 - 2 - Criquet migrateur
Locusta migratoria est celui qui a l'extension
géographique et la plasticité écologique la plus grande.
Neuf sous-espèces de Locusta ont réussi à
coloniser non seulement l'Afrique et le Madagascar, mais aussi l'Europe jusque
dans les vallées alpines, l'Asie jusqu'en Chine et l'Australie. Partout
où il e pu s'adapter, il a gardé potentiellement la même
aptitude à grégariser (Louveaux et Gillon, 1986). Mason (1989),
signale que Locusta migratoria migratorioides (Reiche et Fairm, 1850)
ou Criquet migrateur africain est très répandu dans toute
l'Afrique. Le principal foyer de reproduction de ce ravageur est l'Afrique de
l'Ouest. Le développement de l'agriculture favorise aussi l'expansion de
ce Criquet qui cause des problèmes dans certaines régions
céréalières d'Afrique du Sud ainsi que dans les
6
cultures de canne à sucre. En outre Kabassina (l990),
note que ce ravageur majeur en période d'invasion provoque des dommages
sur le mil, le maïs, le riz, la canne à sucre et le blé. Il
peut même attaquer le bananier, le palmier à huile, le palmier
dattier et l'ananas.
I - 1 - 3 - 1 - 3 - Criquet marocain
Dociostaurus maroccanus, fait partie des acridiens
ravageurs grégariaptes à polymorphisme phasaire dont les
caractères morphométriques, chromatiques et éthologiques
sont différents, selon qu'il s'agisse d'individus solitaires, transiens
ou grégaires. La maculation ou taches du fémur postérieur
est aussi l'un des principaux critères de distinction phasaire. Le nom
de l'espèce ne lui confère pas une spécificité
marocaine. Elle occupe presque tous les territoires semi-arides du littoral
méditerranéen (Palestine, Jordanie, Syrie, Turquie, Hongrie.,
Yougoslavie, Italie, Midi de la France, Espagne, Algérie, Maroc et
Libye), les îles Canaries et la majorité des îles
méditerranéennes (Corse, Sardaigne, Sicile et Chypre). Les
régions favorables à la grégarisation ont
été décrites au Proche Orient et en Afrique du Nord.
L'action désertifiante de l'homme et de ses troupeaux est souvent
à l'origine des aires de grégarisation. Les dégâts
dûs au Criquet marocain sont très bien connus au cours d'invasions
étendues et prolongées, sévères et même
catastrophiques dans le passé, surtout entre les années 1900 et
1950. Leur gravité tient à la proximité des cultures par
rapport aux foyers de grégarisation. Les pâturages et les cultures
céréalières sont toujours les plus endommagés. Les
pertes sont dues surtout aux jeunes stades larvaires qui se déplacent en
bandes avant les moissons. Leur influence sur la situation économique
précaire des régions semi-arides ou arides demeure très
grande (Skaf, 1989).
I - 1 - 3 - 2 - Sautériaux ravageurs
Les sautériaux sont des Orthoptères ne
présentant pas de transformation phasaire, contrastée comme chez
les locustes. En Afrique du Nord, 17 espèces d'acridiens peuvent causer
des dégâts aux productions agricoles (COPR, 1982). Ould El Hadj
(1991), signale qu'au Sahara, les sautériaux identifiés
actuellement comme les plus dangereux, par les prospecteurs de l'Institut
National de la Protection des Végétaux, appartiennent aux
espèces suivantes, Sphingonotus rubescens, Poekilocerus
bufonius hieroglyphicus et Acrotylus patruelis. Chara (1987),
signale par ailleurs d'importants dégâts sur les pâturages
dus à une grande pullulation de Sphingonotus rubescens dans la
région de Ghardaïa. Les changements de méthodes culturales,
l'introduction de nouvelles variétés cultivées, la
création ou l'extension des périmètres irrigués, la
mécanisation intense sont autant de conditions
favorables à la pullulation de certaines espèces
de sautériaux. En temps favorables, des multiplications importantes de
sautériaux peuvent mettre en danger momentanément ou
chroniquement les cultures vivrières et les cultures de rente. Les
dégâts infligés par les sautériaux sont certes plus
localisés, moins spectaculaires que ceux des locustes mais il arrive que
leurs importances économiques soient comparables (Ould Taleb, 1991).
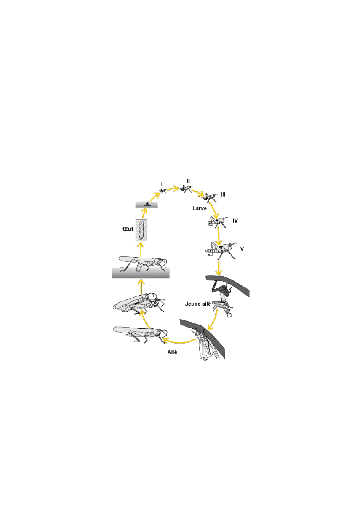
I - 1 - 4 - Cycle biologique
Les acridiens passent toujours par trois états
biologiques au cours de leur vie, les états d'oeuf, de larve et d'imago
(Fig.1). Le terme adulte est réservé aux individus
physiologiquement capables de se reproduire (Appert et Deuse, 1982).
Figure 1. Cycle biologique du criquet pèlerin
Schistocerca gregaria Forskal, 1775 (COPR, 1982)
I - 1 - 4 - 1 - OEufs
Dans les régions tempérées la plupart des
Orthoptères pondent pendant la belle saison et l'éclosion des
oeufs se produit après une incubation très variable, allant de
quelques Jours à plusieurs mois et pouvant même dépasser
une année chez certaines espèces (Chopard, 1943).
7
8
I - 1 - 4 - 1 - 1 - Ponte
La ponte des Orthoptères se fait le plus souvent dans
la terre, bien que quelques très rares espèces déposent
leurs oeufs dans les tissus végétaux. La femelle, après
avoir rencontré l'endroit qui lui convient, se dresse très haut
sur ses quatre pattes antérieures et médianes, l'abdomen
fortement arqué, l'extrémité étant perpendiculaire
à la surface du sol. L'action de l'oviscapte chez les Caelifères
est très différente de celle des Ensifères (Chopard,
1949). C'est par des mouvements alternatifs des valves de l'oviscapte que la
femelle arrive à forer un trou de 6 à 10cm de profondeur
où elle enfonce son abdomen. Celui-ci s'allonge jusqu'à
égaler 2 à 3 fois la longueur initiale de son corps. Chambille
(1977), a étudié le comportement de forage des femelles du
Criquet migrateur africain en milieu humide et sec. Il a remarqué qu'en
milieu humide la ponte s'effectue après peu d'essais infructueux. Les
forages sont superficiels et n'atteignent pas 3cm de profondeur, distance
correspondant à la pénétration de l'abdomen dans le
substrat. Lorsque le forage est profond supérieur ou égal
à 3cm, il est presque toujours suivi du dépôt de
l'oothèque. En milieu sec, les essais sont nombreux pour toutes les
pontes. La profondeur moyenne du forage est significativement plus grande. Elle
résulte d'une augmentation non négligeable des essais infructueux
profonds supérieur ou égal à 3cm. Les oeufs sont pondus
soit isolément soit en masse. Dans le deuxième cas la femelle
commence par déposer un mucus de mucco-polysaccharides au fond du trou.
Puis elle pond ses oeufs qui sont agglomérés par le mucus. La
ponte se termine par un bouchon spumeux ayant la même origine. Le nombre
d'oeufs présents dans une oothèque varie suivant les
espèces allant de 10 à 100 oeufs. Parfois la femelle peut
déposer plus d'une oothèque, 2 ou 3 en général,
parfois une dizaine au cours de sa vie (Chopard, 1938).
I - 1 - 4 - 1 - 2 - Incubation
La durée de l'incubation ou le développement
embryonnaire est variable selon les espèces et les conditions
climatiques. Selon Nurein (1989), les oeufs de Schistocerca gregaria
ont besoin d'une humidité suffisante pour se développer. Ils
puisent de l'humidité dans le sol. Les larves de cet Orthoptère
ne peuvent donc éclore qu'à partir des oeufs
déposés dans le sol. Si l'humidité nécessaire au
développement des oeufs fait défauts ceux-ci peuvent survivre
jusqu'à 60 jours. La période d'incubation des oeufs dépend
aussi de la température du sol. L'incubation dans les champs dure
environ 30 jours. Lorsque les températures sont élevées,
elle ne dure que 23 jours alors que pendant la saison froide, avec des
températures basses, elle peut s'étaler jusqu' à 60
jours.
9
I - 1 - 4 - 2 - Développement larvaire
Les larves vivent à la surface du sol, dans les herbes,
les arbustes et rarement dans les arbres (Appert et Deuse, 1982).
I - 1 - 4 - 2 - 1 - Eclosion
Dans le cas le plus général, au moment de
l'éclosion, l'oothèque étant enfouie dans le sol les
larves néonates cheminent à travers le bouchon spumeux et sortent
à la surface du sol à l'état de larves rampantes. Elles se
déplacent quelques minutes seulement comme un ver; ce sont les larves du
stade rampant; chaque larve est encore emmaillotée dans la membrane
interne de l'oeuf ou aminios ; elle s'en dégage rapidement; c'est la
fausse mue (Chopard, 1938).
I - 1 - 4 - 2 - 2 - Nombre de stades larvaires
En général il y a cinq stades larvaires mais ce
nombre peut varier en fonction des espèces et du sexe. Pour le Criquet
nomade Nomadacris septemfasciata (Serville, 1838) Ndyanabo et
Byaruhanga (1969), signalent 6 ou 7 stades larvaires. La période
larvaire coïncide avec la croissance active de la végétation
qui procure aux criquets la nourriture et la protection nécessaires. La
phase solitaire comprend 7 stades larvaires tandis que la phase grégaire
n'en compte que 6. Le développement complet, depuis l'éclosion de
l'oeuf jusqu'à l'insecte ailé dure 2 mois à 2 mois et demi
dans des conditions favorables. Les larves de Criquet pèlerin passent,
de l'éclosion à l'état imaginal, par plusieurs stades
larvaires. Leur nombre est variable en fonction de la phase: 5 stades chez les
grégaires et 6 le plus fréquemment chez les solitaires. Le stade
supplémentaire se situe entre le troisième et le quatrième
stade (Duranton et Lecoq, 1990). Selon Duranton et al. (1982) le
nombre de stades larvaires n'est pas toujours connu avec certitude sauf pour
les ravageurs les plus importants et les plus étudiés comme
Nomadacris septemfasciata, Locusta migratoria,
Schistocerca gregaria et certains acridiens qui présentent la
particularité d'avoir un nombre de stries oculaires proportionnel au
nombre de stades larvaires. La durée du développement larvaire
varie essentiellement en fonction de la température de l'air. Par
ailleurs, dans des conditions écologiques identiques les
grégaires se développent plus rapidement que les solitaires. Chez
les grégaires dans de bonnes conditions, la durée de
développement larvaire la plus courte est de 25 jours. Dans de mauvaises
conditions elle peut atteindre 50 jours. Chez les solitaires, dans des
conditions optimales, le développement larvaire dure au minimum 30
jours. Il peut s'étendre à trois mois en cas de conditions
très défavorables (Duranton et Lecoq, 1990).
10
I - 1 - 4 - 3 - Imago
La dernière mue donne naissance à un imago. La
première partie de la vie imaginale est surtout consacrée
à la recherche d'un biotope favorable et à l'alimentation.
Mâles et femelles augmentent de poids dans des proportions notables
accumulant du corps gras. Puis le poids des mâles se stabilise, alors que
celui des femelles continue à augmenter. Ce deuxième
accroissement du poids est en rapport avec la maturation ovocytaire
préparant la future première ponte. Lorsque les ailés sont
en période de reproduction, on parle d'adultes (Duranton et
al., 1982). Pasquier (1946) a présenté les
différents âges de Schistocerca gregaria à
l'état imaginal. Selon l'auteur précité, on doit
distinguer d'abord les ailés immatures des adultes vrais
génétiquement parfaits, le mot adulte étant alors pris
dans le sens strict d'insecte en état de reproduction. Par analogie
à une nomenclature utilisée par les ichtyologues les derniers
seront appelés génétiques sachant que le terme
agénétique désigne les immatures. Dans l'Afrique du Nord,
en été, à la suite de la mue imaginale, les ailés
roses Jeunes ou népiogones se trouvent réalisés. Aux
népiogones, succède un âge de durée et d'importance
économique variables, celui des errants roses ou néogones.
Quoiqu'il soit, au bout de peu de temps, les néogones, en vol
élevé, profitant certainement de courants aériens
favorablement orientés, quittent l'Afrique du Nord pour effectuer la
traversée assez rapide du Sahara. En quelques jours ces
hypogénétiques ou migrants roses, dits de retour
(émigrants pour les Nord-africains) gagnent des territoires
méridionaux dont certains sont propices à leur maturation
sexuelle. Devenant génétiques
(éogénétiques), ils jaunissent sans rougir. Les
ailés effectuant leur premier accouplement et leur première ponte
sont appelés néogénétiques. Par la suite, ils
seront désignés par eugénétiques pendant toute la
période de reproduction. Vers la fin de leur vie, en juillet, les
ailés vieillie sont gérogénétique, les males
étant jaunes paille, les femelles plus brunes à abdomen
ardoisé ou violacé.
I - 1 - 4 - 4 - Accouplement
L'époque laquelle l'accouplement a lieu est variable,
suivant les espèces et elle est naturellement liée au moment
où les insectes deviennent adultes, c'est à dire sexuellement
mûrs (Chopard, 1938). Le rapprochement des sexes est
préparé chez un certain nombre d'Orthoptères par des
manifestations liées à la période d'excitation sexuelle.
La plus remarquable de ces manifestations est la stridulation (Chopard, 1943).
En général, pendant l'accouplement le mâle se trouve sur la
femelle, de telle façon que ses pattes antérieures s'accrochent
à l'angle antérieur des lobes latéraux du pronotum il
abaisse et recourbe son abdomen; la plaque sous-génitale est
écartée et le pénis se trouve dégagé de son
prépuce avant
11
d'être introduit entre les valves de l'oviscapte; les
cerques du mâle jouent un rôle en pinçant la plaque
sous-génitale de la femelle (Chopard, 1949).
I - 1 - 4 - 5 - Nombre de générations
Le nombre de générations annuelles qu'une
espèce peut présenter correspond au voltinisme. On distingue des
espèces univoltines, n'effectuant qu'une seule génération
dans l'année et des espèces polyvoltines à plusieurs
générations annuelles. Parmi ces dernières, on
sépare les espèces en bivoltines, en trivoltines et en
tétravoltines selon qu'elles aient 2, 3 ou 4 générations
par an. Le nombre maximal de générations qu'une espèce
peut effectuer en une année semble être de 5 chez les acridiens,
encore que ces cas soient assez rares. A l'opposé, on connaît des
espèces qui ont besoin de deux années au moins pour effectuer un
cycle complet, particulièrement dans les régions froides et
très arides. En zone tropicale sèche, les acridiens
présentent en majorité de 1 à 3 générations
par an. Pour une même espèce, le nombre de
générations peut être variable suivant la région
dans laquelle la population se développe ou en fonction des
caractéristiques météorologiques annuelles (Duranton et
al., 1982). D'après Gillon (1989), plusieurs espèces
dangereuses ne possèdent qu'une génération par an; elles
passent la saison sèche à l'état d'oeuf ou d'ailé
immature. A l'opposé, chez les espèces les plus à craindre
en Afrique comme le Criquet pèlerin et le Criquet migrateur, il peut y
avoir quatre à cinq générations successives dans
l'année si les conditions écologique s'y prêtent. Profitant
des crues saisonnières du Niger pour prolonger sa période
annuelle de reproduction, le Criquet migrateur africain peut avoir par exemple
Jusqu'à 4 ou 5 générations au Mali. Dans les conditions
normales de sécheresse, il n'y a que 2 générations. En
colonisant d'autres habitats dans certaines régions agricoles, comme
c'est le cas notamment, en Afrique du Sud, ce Criquet est capable de
développer 3 à 4 générations, ce qui le rend
problématique (Mason, 1989).
I - 1 - 5 - Influence des facteurs écologiques
I - 1 - 5 - 1 - Température
Dans la nature, l'influence des changements de
température sur le comportement des acridiens est considérable.
Tous les mouvements semblent conditionnés par ce facteur et
l'étude de son action apporte la notion d'un optimum au dessus et au
dessous duquel les mouvements subissent un ralentissement aboutissant,
lorsqu'on s'en éloigne, à l'immobilité, puis à la
mort. La température préférentiel le ou
préférendum thermique varie beaucoup
12
suivant les espèces et selon le stade de
développement. Chez le Criquet pèlerin Schistocerca
gregaria, Bodenheimer (1930) in Dajoz (1971), trouve les
préférendum suivants :
Adulte en période de ponte : 29,4°C
Larve du premier stade : 30,1°C
Larve du second stade : 28,8°C
Larve du troisième stade : 31,6°C
Larve du quatrième stade : 37,1°C
Larve du cinquième stade : 36,7°C
Jeune adulte : 39,3°C
L'importance du préférendum thermique est
grande; elle explique très souvent les particularités de la
répartition des animaux dans leurs biotopes ainsi que leurs
déplacements. Les limites extrêmes sont généralement
assez éloignées, allant parfois de -5 à +55 °C soit
une tolérance de 60 degrés environ; toutefois les insectes ne
sont capables d'une activité normale et de s'alimenter qu'entre 20 et 30
°C environ (Chopard, 1949). Selon Charras (1979), la température
représente le facteur écologique essentiel puisque son influence
se fait sentir de façon constante sur les oeufs, les larves et les
adultes. Elle influe sur l'émergence, l'activité de vol, la
reproduction, le développement embryonnaire, la nutrition et le
métabolisme Albrecht et al., (1978), notent que
l'activité de vol est considérablement augmentée chez
Schistocerca comme chez Locusta, lorsque les insectes sont
élevés à une haute température diurne. Encore plus
souvent, le facteur limitant est la moyenne des températures non pas de
toute l'année, mais seulement de certains mois, les plus importants pour
le cycle de l'espèce. Ceci se manifeste particulièrement pour les
organismes qui passent la mauvaise saison à l'état de vie
ralentie. Ils sont donc pendant ce temps là insensibles à
l'action des températures défavorables. Par exemple, en Europe
Orientale, le Criquet migrateur Locusta migratoria a besoin d'une
moyenne de juin supérieure à 20°C (Dreux, 1980).
I - 1 - 5 - 2 - Humidité
Toutefois, si tous les insectes doivent trouver dans le milieu
où ils se développent l'eau nécessaire à leurs
besoins, chaque espèce fait preuve d'exigences particulières.
Certaines se montrent tout spécialement hygrophiles. La
répartition de chaque insecte dans un milieu donnée traduit
très précisément ses préférences
écologiques (Charras, 1979). Selon Dajoz (1971), les stades les plus
sensibles à l'humidité sont souvent les stades larvaires. Les
migrations d'acridiens sont en partie causées par la sécheresse
qui réduit les possibilités d'alimentation des larves. Dreux 1990
montre chez Locusta migratoria, espèce très importante
13
du point de vue économique par les ravages terribles
qu'elle cause dans beaucoup de pays, que la vitesse de maturité sexuel
le et la fécondité des femelles atteignent leur maximum à
une humidité relative de 70%.
I - 1 - 5 - 3 - Photopériode
En tant que facteur écologique, la lumière
représente un élément déterminant de la vie des
insectes mais la plupart des auteurs considèrent que son rôle
reste secondaire comparé à l'action de la température ou
de l'humidité. Charras (1979), précis qu'il a été
établi que c'est la durée de l'éclairement ou longueur des
jours qui détermine la diapause. Il n'est pas possible d'en dissocier
totalement les conditions trophiques et surtout la température qui agit
en synchronisme avec la lumière. Chez la Sauterelle pèlerine, la
performance au vol est à son maximum lorsque les insectes groupés
sont exposés à des Jours longs ou de durée croissante
(Albrecht et al., 1979). Les déplacements à longue
distance des essaims de Schistocerca gregaria sont typiquement
longitudinaux. Ils se produisent au printemps et à la fin de
l'été lorsque les populations sont exposées à des
Jours longs ou de durée croissante et à des températures
croissantes ou élevées.
I - 1 - 5 - 4 - Sol
D'après la nature des conditions exigées on peut
distinguer des sous groupes. Les plus importants sont constitués par les
spécialistes de la nourriture et par ceux du substrat. Les
Orthoptères sont des spécialistes du substrat. Ils apparaissent
régulièrement là où règne une composition
particulière du sol. Ils sont liés à des sols sableux
(Kuhnelt, 1969). Le Criquet pèlerin recherche pour pondre des sols
sableux meubles en général; en l'absence de ces derniers, des
sols allant des argiles aux graviers fins peuvent être acceptés si
l'oviscapte de la femelle arrive à y pénétrer. Le facteur
limitant le plus important est sans doute l'humidité du sol car si elle
fait défaut la ponte n'a pas lieu ou bien les oeufs périssent
rapidement dans une terre trop sèche (Dajoz, 1974).
I - 1 - 5 - 5 - Végétation
En conditions naturelles, l'insecte choisit des plantes
hôtes appropriées pour sa nutrition, sa survie et celle de sa
progéniture et comme abri contre ses ennemis naturels (Vincent et
Boivin, 1986). Les acridiens selon Chopard (1949) présentent en
général une teinte rappelant de façon remarquable celle de
l'endroit où on les a capturés. Chaque espèce
d'Orthoptère recherche un micro habitat précis au sein de la
végétation là où elle trouve un microclimat
adéquat et surtout un camouflage (Delarze, 1990). D'après Gillon
(1989),
14
l'importance de la végétation ne tient pas
seulement à la nature des plantes consommées, mais aussi à
la structuration du milieu. C'est ainsi que dans une savane le peuplement
acridien change avec la structure du tapis végétal.
I - 1 - 5 - 6 - L'Homme
Les transformations de l'environnement par l'homme provoquent
de profonds bouleversements dans les peuplements. Ceux-ci régressent ou
disparaissent en mme temps que diminue la diversité
végétale (Gillon, 1989). Moissonnie et al. (1977), ont
étudié l'action humaine sur des groupements d'Orthoptères.
Ils ont montré que l'influence humaine se manifeste de la manière
la plus nette dans les prairies où la fauchaison annuelle favorise
l'augmentation de Chorthippus longicornis dont le pourcentage est
souvent supérieur à 80%. A l'inverse, les prairies
abandonnées où la strate herbacée se développe,
sont colonisées par les Ensifères dont le pourcentage peut
atteindre localement 40 à 50%.
I - 1 - 5 - 7 - Les ennemis naturels
A côté des facteurs abiotiques qui regroupent les
facteurs météorologiques, nous avons les facteurs biotiques qui
sont représentés par les différents ennemis naturels. Ces
derniers contribuent à la limitation des populations
d'Orthoptères. Beaucoup de chercheurs se sont intéressés
à l'étude des ennemis naturels des acridiens. Citons entre autres
les travaux de Balachowsky et Mesnil (1936), Roehrich (1951), Bonnemaison
(1961), et Duranton et al., (1982).
I - 1 - 5 - 7 - 1 - Parasites
I - 1 - 5 - 7 - 1 - 1 - Parasites des oothèques
Parmi les parasites des oeufs, il y a lieu de citer de
nombreux Diptères, notamment les Anthrax dont les larves
évoluent à l'intérieur des coques ovigères qu'elles
vident totalement. En Algérie, dans certaines localités
jusqu'à 30% des oothèques de Dociostaurus maroccanus
étaient parasitées par cette espèce. D'autres
Diptères jouent un rôle identique notamment Stomatorrhina
lunata parasite des oeufs de tous les Orthoptères vivant aux
dépens des oeufs de Schistocerca gregaria et de Chortophila
florilega. Parmi les Coléoptères il faut signaler, en
premier lieu les Mylabres et les Clérides, dont les larves
évoluent à l'intérieur des oothèques.
15
I - 1 - 5 - 7 - 1 - 2 - Parasites des larves et des
ailés
Parmi les parasites des larves et des ailés d'acridiens
les plus actifs sont des
Nématodes et des Mouches.
- Nématodes : Mermithidae : Agamermis, Mermis
- Diptères : Nemestrinidae : Neorhynchocephalus,
Symmictus
Calliphoridae: Sarcophaga, Blaesoxipha
Tachinidae: Schistocercophaga. Tachina, Ceracia
Muscidae: Acridomyia.
I - 1 - 5 - 7 - 2 - Prédateurs
I - 1 - 5 - 7 - 2 - 1 - Prédateurs des
oothèques
Les insectes prédateurs des oeufs d'acridiens
déposent en général leurs oeufs près d'une
oothèque où pondent dans le bouchon spumeux c'est le cas de
Systoechus et de Trox. Dans le premier cas la larve
pénètre dans la masse ovigère dans le second, elle est
directement en place pour consommer les oeufs.
I - 1 - 5 - 7 - 2 - 2 - Prédateurs des larves et des
ailés
Les prédateurs importants sont les oiseaux et certains
insectes surtout en cas de fortes
concentrations :
- Hyménoptères : Sphecidae : Sphex,
Tachysphex
- Diptères : Asilidae : Asilius
Oiseaux : Ciconia ciconia, Falco tinnunculus, Milvus
migrans
Les ennemis moins importants sont les araignées, les
mantes, les Tettigoniidae, les
Coléoptères, les Lézard et les Rongeurs.
I - 1 - 5 - 7 - 3 - Maladies
I - 1 - 5 - 7 - 3 - 1- Protozoaires
Papillon et Cassier (1978), notent chez le Criquet
pèlerin Schistocerca gregaria la présence d'un parasite
Malameba locustae identifié dans les tubes de Malpighi,
provoquant une atrophie du corps gras une diminution de la
protéinémie et de ce fait, un ralentissement de l'activité
ovarienne. Henry et Onsager (1982), ont observé l'apparition d'une
infection chez le Criquet Mormon, Anabrus simplex Haldeman due
à des spores de Nosema locustae.
16
I - 1 - 5 - 7 - 3 - 2- Champignons
La contamination des acridiens par les champignons se fait,
par voie orale ou par contact externe. Henry et al., (1985), ont
isolé des champignons chez Oedaleus senegalensis et
Anacridium sp en Afrique de l'Ouest.
I - 1 - 5 - 7 - 3 - 3- Entomopoxvirus
Meynadier et al., (1992), ont isolé un
entomopoxvirus de l'Orthoptère Anacridium aegyptium. La maladie
se traduit par un ralentissement des mouvements et un allongement de la vie
larvaire. L'Orthoptère Acheta domestica est atteint par une
virose du type densonucleose. Ce virus polytrope se multiplie dans le noyau
cellulaire de la plupart des tissus. La mort des Grillons, larves et imagos est
précédée par un état de paralysie. La
mortalité s'échelonne sur au moins 20 jours (Meynadier et
al., 1977). En Afrique de l'Ouest Henry et al., (1985) ont
isolé des entomopoxvirus de Catoloipus fuscocoerlipes (Krauss),
Catoloipus cymbiferus (Krauss), Oedaleus senegalensis
(Krauss). Oedaleus nigeriensis Uvarov, Kraussaria argulifera
(Krauss) et Heteracris annulosus (Walker).
Chapitre II : Présentation de la région
d'étude
II - 1 - Situation géographique
La région du M'Zab est située à 600Km au
Sud d'Alger. Elle se trouve dans la partie centrale du Nord du Sahara aux
portes du désert, dont les coordonnées sont 3°40' de
longitude Est et 32°29' de latitude Nord. Son altitude est de 530m. Le
territoire de la wilaya couvre une superficie de 86105Km2, comptant
trois daïrates, treize communes dont huit nouvelles. La wilaya est
caractérisée au Nord par la présence d'une chaîne de
monticules rocailleux appelée la Chabka et au Sud par un immense plateau
Hamada couvert de pierres. La partie Nord de la wilaya est très
accidentée, ce qui entraîne la formation de nombreuses
vallées appelées Dayates, très fertiles où coulent
et se rejoignent une multitude d'Oueds. Les cours d'eau très nombreux
sont en crue en moyenne une fois tous les deux ans les plus connus sont Oued M'
Zab, Oued labiadh, Oued N'sa, Oued Zegrir, Oued Seb Seb et Oued Metlili (INPV,
1987).
II - 2 - Relief
La région du M'Zab se situe sur le plateau de la
Hamada, sur sa portion Nord. Ce plateau est une véritable charpente
rocheuse, recouverte par des terrains quaternaires dans toute l'étendue
de la zone septentrionale. Sur une partie du plateau d'importantes
érosions ont fait surgir un ensemble de crêtes et de buttes
escarpées : c'est la Chabka du M'Zab (Benyoucef, 1991) (Figure 2).
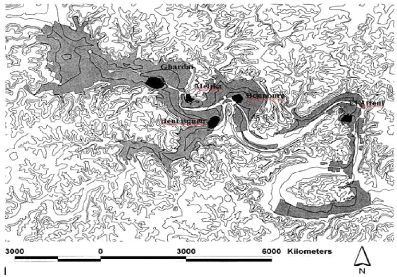
Figure 2. Le relief de la vallée du
M'Zab
17
18
II - 3 - Données climatiques
Les données climatiques sont fournies par la station
météorologique de Ghardaïa. Nous avons pris en
considération les moyennes mensuelles concernant une période
s'étalant sur 10 ans de 1981 à 1990, et des données de
l'année l992, afin de mieux distinguer les variations climatiques de la
région d'étude. Pour Ramade (1984), les données
climatiques sont non seulement des éléments décisifs du
milieu physique mais ont aussi des répercussions profondes sur les
êtres vivants animaux et végétaux.
II - 3 - 1 - Températures
Tableau 1 : Les températures dans la
région de Ghardaïa (1992) (Source : ONM Ghardaïa).
|
mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Températures
moyennes
mensuelles en °c
|
9,0
|
11,9
|
14,4
|
13,6
|
23,6
|
27,6
|
31,1
|
33,0
|
28,8
|
23,6
|
16,0
|
11,4
|
|
Moyenne des
Maxima
|
14,3
|
17,7
|
19,3
|
14,6
|
29,7
|
34,3
|
37,3
|
39,6
|
35,2
|
29,0
|
21,4
|
16,5
|
|
Moyenne des
minima
|
3,7
|
6,0
|
9,4
|
12,6
|
17,4
|
20,9
|
24,8
|
26,4
|
22,5
|
18,1
|
10,5
|
6,3
|
|
Température
maximale absolue
|
18,1
|
24,7
|
27,5
|
33,3
|
40,3
|
40,2
|
43,0
|
42,5
|
38,8
|
36,1
|
24,7
|
22,6
|
|
Température
minimale absolue
|
1
|
2,0
|
4,2
|
7,0
|
10,3
|
16,4
|
20,8
|
23,2
|
18,0
|
10,5
|
7,6
|
1,3
|
Tableau 2 : Moyennes mensuelles des
températures pour une période de 10 ans (1981 à 1990)
(Source : ONM Ghardaïa).
|
mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Moyenne des
Maxima
|
15,8
|
18,5
|
21,9
|
26,8
|
31,2
|
37,4
|
39,7
|
39,5
|
34,6
|
27,8
|
21,5
|
17,7
|
|
Moyenne des
minima
|
5,4
|
7,5
|
10,6
|
13,9
|
18,4
|
22,4
|
26,2
|
26,1
|
23,3
|
16,7
|
11,1
|
6,8
|
|
Températures
moyennes
mensuelles en °c
|
10,6
|
13
|
16,2
|
20,3
|
24,8
|
29,9
|
32,9
|
32,8
|
28,9
|
22,2
|
16,3
|
12,2
|
Les températures moyennes mensuelles sont très
variables, basses en hiver surtout aux mois de décembre janvier et
février avec respectivement 11,4°C., 9,0°C et 11,9°C
(Tableau 1). Les plus basses températures favorisent les gelées
fréquentes en cette période. Par contre, entre juin et septembre
les températures moyennes mensuelles sont élevées variant
entre 27,6°C en Juin et 33°C en aout (Tableau 1). L'influence des
températures élevées se traduit par le dessèchement
des plantes herbacées en dehors des zones irriguées et par
l'entrée en vie ralentie ou estivation d'un certain nombre
d'espèces animales.
19
II - 3 - 2 - Pluviométrie
Tableau 3 : Précipitations dans la
région de Ghardaïa (1992) (Source : ONM Ghardaïa)
|
Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
Total
|
|
Précipitation en
mm
|
9,0
|
Tr
|
16,0
|
3,0
|
15,0
|
0
|
0
|
Tr
|
2,0
|
0
|
15,0
|
4,0
|
64,0
|
Tableau 4 : Moyennes mensuelles des
précipitations sur une période de 10 ans (1981 à 1990)
(Source : ONM Ghardaïa)
|
mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
Total
|
|
Précipitation en
mm
|
6,4
|
5,4
|
7,3
|
7,6
|
4,8
|
2,6
|
3,0
|
1,1
|
4,4
|
7,3
|
12,4
|
3,7
|
66,0
|
La pluviométrie moyenne annuelle ne dépasse pas
66mm dans cette région (Tableau 4). Ces précipitations sont
caractérisées essentiellement par leur rareté ainsi que
par leur irrégularité au cours de l'année (Tableau 3). Au
niveau des Oasis, ces quelques millimètres de pluie ne peuvent, à
eux seuls, suffire pour assurer une bonne production agricole. L'agriculture
doit obligatoirement avoir recours à l'irrigation.
II - 3 - 3 - Humidité relative de
l'air
L'humidité relative de l'air ou degré
hygrométrique est le rapport entre la teneur réelle de l'air en
vapeur d'eau et la teneur d'un air saturé à la même
température. Au Sahara elle est très faible. Elle est comprise
entre 15% et 50%, alors qu'elle dépasse en toute saison 60% à
Paris et 50% à Alger (Ozenda, 1983). L'humidité relative de l'air
est généralement minimum vers 15h et maximum vers 6 heures, au
lever du soleil (Pierre, 1958).
II - 3 - 4 - Vents
Les vents sont inévitables dans les zones sahariennes.
Ils surviennent habituellement au mois de février et se poursuivent
jusqu'à la fin d'avril avec une intensité variable. Les vents du
Nord-Ouest dominent en automne, en hiver et au printemps. Par contre en
été, ce sont les vents chauds du Sud qui sont les plus
fréquents. Ces derniers ont une action indirecte, en activant
l'évaporation, augmentant donc la sécheresse. En plus de son
effet desséchant, le vent exerce une action mécanique importante,
renforcée lorsqu'il transporte des particules minérales. Il
accélère les phénomènes d'érosion. Il courbe
et déchausse les plantes ou participe à leur ensablement.
20
II - 3 - 5 - Coefficients climatiques
Il ne sera fait appel qu'à deux coefficients
climatiques, établis, par des spécialistes de la climatologie
méditerranéenne ou saharienne, soit à l'échelle
mondiale, soit à une échelle restreinte.
II - 3 - 5 - 1 - Diagramme Ombrothermique de Bagnouls
et Gaussen
Selon Bagnouls et Gaussen (1953), un mois est sec lorsque le
total des précipitations P exprimées en millimètres est
égal ou est inférieur au double de la température T
exprimée en degrés centigrades. Une période sèche
est une suite de mois secs, elle peut s'exprimer par P = 2T. Pour l'exprimer on
utilise des figures où sont portées en abscisses les 12 mois de
l'année, et en ordonnées à droite les
précipitations en mm et à gauche les températures en
degrés Celsius à une échelle double de celle des
précipitations. Sur le graphe on représente d'une part la courbe
ombrique concernant les chutes mensuelles de pluie en mm et d'autre part la
courbe thermique à l'aide des températures moyennes mensuelles en
degrés Celsius. Quand la courbe ombrique passe en dessous de la courbe
thermique c'est qu'on a P < 2T, et le polygone alors défini par les
deux courbes indique la durée et dans une certaine mesure
l'intensité de la période sèche (Dajoz, 1971).
L'étude du diagramme Ombrothermique de Bagnouls et Gaussen de la
région d'étude montre que celle-ci est située sous un
climat errémique chaud à tendance méditerranéenne
(Figures 3-4). Le climat est ainsi défini. La courbe thermique est
toujours positive. La courbe ombrique est constamment au dessous de la courbe
thermique, ce qui montre que les douze mois de l'année sont secs.
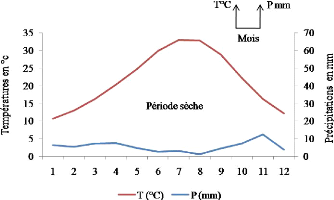
Figure 3. Diagramme Ombrothermique de la
région de Ghardaïa pour une période de 10 ans (1981-1990)
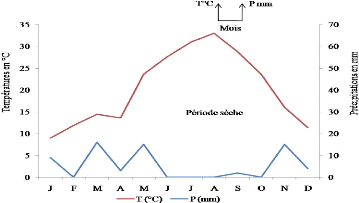
21
Figure 4. Diagramme Ombrothermique de la
région de Ghardaïa pour l'année 1992
II - 3 - 5 - 2 - Climagramme pluviothermique
d'Emberger
La définition des divers types de climat de la
région méditerranéenne peut être faite au moyen du
quotient pluviothermique : Q2 = 3.43 P/ M - m
P est la moyenne annuelle des pluies en millimètres. M
est la moyenne des maxima du mois le plus chaud alors que m est la moyenne des
minima du mois le plus froid. L'amplitude extrême thermique M-m
correspond sensiblement au facteur évaporation. La valeur du quotient
pluviothermique relative à la région d'étude doit
être reportée sur la figure appelée Climagramme
pluviothermique. En abscisses les moyennes des minima du mois les plus froids
sont représentées. En ordonnées on trouve les valeurs du
quotient pluviothermique.
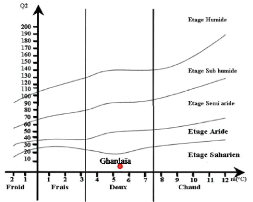
Figure 5. Climagramme pluviothermique
d'Emberger de la région de Ghardaïa
22
Sur ce graphe les limites des divers étages climatiques
reconnues par Emberger sont tracées, Saharien, aride, semi-aride,
subhumide et humide. Dans chacun d'eux des sous-étages à hiver
froid (m < 0°), frais (0° < m < 3°),
tempéré (3°< m <7°) et chaud (7° > m)
sont définis. Pour le calcul du quotient nous considérons les
données de 10 ans de 1981 à 1990 (Tableaux 2 et 4). P = 66 mm ; M
= 39,7 °C ; m = 5,4 °C, d'où Q2 = 6,60
Une fois que cette valeur du quotient est portée sur le
Climagramme pluviothermique, elle situe la région d'étude dans
l'étage bioclimatique saharien à hiver doux (Figure 5).
II - 4 - Hydrographie
On exploite dans la région de Ghardaïa une nappe
phréatique ou nappe de l'inféroflux des alluvions des Oueds.
C'est, dans l'ensemble, une petite nappe qui suffit à la population mais
qui ne permet pas de faire vivre d'importantes palmeraies. En effet, cette
nappe s'épuise facilement (Furon, 1957).
II - 5 - Le sol
Les palmeraies du M'Zab sont installées sur des sols
sablo-limoneux. La texture est assez constante et permet un drainage suffisant.
Les eaux se réunissent dans les points bas de la vallée où
elles sont collectées par un petit canal plus au moins discontinu, qui
les conduit en aval de l'Oued M' Zab. Toutes ces conditions font que les sols
de ces palmeraies sont généralement bons, meubles, profonds et
peu salés (Vilardebo, 1975 in Ben Addoun, 1987).
II - 6 - Utilisation des terres
Selon Furon (1957) la ressource la plus importante dans la
région de Ghardaïa est le palmier dattier. En effet dans les
territoires du sud algérien, le nombre de palmiers dattiers est de
l'ordre de 5 millions. Le rendement est très bas, soit 30 Kg de dattes
par arbre, alors qu'il peut atteindre 100 Kg, si le palmier reçoit assez
d'eau. De plus, les maladies telles que la gale, le boufaroua et le bayoud,
ainsi que les sauterelles sont à l'origine de la baisse de
production.
II - 7 - La flore
II - 7 - 1 - Palmeraie
Dans le Sahara, la culture dominante est le palmier dattier.
Cette culture qui exige beaucoup d'eau, est installée soit le long des
Oueds, soit autour des puits ; ces oasis furent de tous temps irriguées
grâce à une nappe profonde, non artésienne, qu'il fallait
atteindre à une profondeur moyenne de 50 à 60 mètres et
exploiter par puisage à traction animale. Il faut
23
souligner que les palmeraies du M'Zab n'ont jamais
été des exploitations agricoles à but lucratif, ni
même des cultures vivrières d'appoint elles représentent
des jardins d'agrément entretenus parfois à grands frais (Barry
et Faurel, 1973).
II - 7 - 2 - Arbres fruitiers
Selon Ozenda (1983) au moins une dizaine d'espèces
d'arbres fruitiers se rencontrent couramment dans les oasis, mais aucun n'y
atteint le développement du palmier dattier. Les plus importants sont
les agrumes orangers et citronniers, le figuier, l'abricotier, le grenadier et
l'olivier. Les autres arbres fruitiers de la famille des rosacées sont
plus rares et limités dans les oasis du Sahara septentrional où
on rencontre quelquefois des pêchers, des amandiers et des pommiers.
II - 7 - 3 - Cultures maraichères
Les cucurbitacées occupent une grande place parmi les
cultures maraîchères dans la région de Ghardaïa,
notamment la courge, le potiron, la pastèque et le melon. Parmi les
solanacées on peut, trouver la tomate, l'aubergine et les piments.
II - 7 - 4 - Les adventices
Selon le type de milieu on note la présence d'un groupe
bien déterminé d'adventices. En effet dans les palmeraies et dans
les milieux cultivés, il y a généralement Cynodon
dactylon (Linné) Pers. et Setaria verticillata
(Linné) P.B. Ces deux Graminacées sont très
abondantes et favorisent la multiplication de plusieurs espèces
acridiennes dont Ochrilidia gracilis (Krauss, 1902). Cet
Orthoptère se trouve en grand nombre dans les touffes de Setaria
verticillata (Babaz, 1992). Ces dernières créent un
microclimat humide favorable au développement d'Ochrilidia
gracilis. Parmi les Cypéracée il y a une seule espèce
très commune dans les milieux cultivés. Il s'agit de Cyperus
rotundus (Linné). Dans les milieux non cultivés nous
retrouvons une Chénopodiacée très particulière des
milieux secs, c'est Arthrophytum scoparium (Pomel). Cette
espèce se développe dans les Hamadas. Les endroits sablonneux et
secs sont caractérisés par la présence de deux
Graminacées, Aristida obtusa Del et Aristida pungens
Desf. En plus des espèces végétales citées
plus haut nous signalons d'autres adventices (Tableau 5) :
24
Tableau 5 : Liste des adventices
recencées dans la région de Ghardaïa.
|
Familles
|
Espèces
|
|
Graminaceae
|
Echinochloa colona (Linné) Link.
|
|
Hyparrhenia hirta (Linne) Stapf.
|
|
Polygonaceae
|
Rumex vesicarius Linné.
|
|
Caryophyllaceae
|
Paronychia argentea (Pourr.) Lamk.
|
|
Portulacaceae
|
Portulaca oleracea (Linné)
|
|
Amaranthaceae
|
Amaranthus hybridus (Linné)
|
|
Chenopodiaceae
|
Salsola vermiculata (Linné)
|
|
Chenopodium album (Linné)
|
|
Capparidaceae
|
Cleome arabica (Linné)
|
|
Cruciferae
|
Malcolmia aegyptiaca Spr.
|
|
Leguminosae
|
Medicago sativa (Linné)
|
|
Zygophyllaceae
|
Tribulus terrester (Linné)
|
|
Fagonia glutinosa Del.
|
|
Peganum harmala (Linné).
|
|
Malvaceae
|
Malva parviflora (Linné).
|
|
Euphorbiaceae
|
Euphorbia guyoniana B. et R.
|
|
Ombelliferae
|
Pituranthos chloranthus (Coss. et Dur.) Benth.
|
|
Ferula communis (Linné)
|
|
Eryngium ilicifolium Lamk.
|
|
Asclepiadaceae
|
Pergularia tomentosa (Linné)
|
|
Convolvulaceae
|
Convolvulus arvensis (Linné)
|
|
Boraginaceae
|
Echium trygorrhizum Pomel
|
|
Labiateae
|
Mentha pulegium (Linné)
|
|
Plantaginaceae
|
Plantago albicans (Linné)
|
|
Cucurbitaceae
|
Colocynthis vulgaris (Linné) Schrad
|
|
Compositae
|
Launaea resedifolia O.K
|
|
Spitzelia coronopifolia Pomel
|
|
Atractylis serratuloides (Linné)
|
|
Echinops spinosus (Linné)
|
|
Sonchus oleraceus (Linné)
|
|
Erigeron canadensis (Linné).
|
II - 8 - La faune
Pour qu'une espèce animale puisse se maintenir dans le
milieu qu'elle occupe, elle doit trouver des conditions favorables à son
développement. Lorsque celles-ci sont réunies dans un nouveau
milieu rien ne s'oppose à priori à ce qu'il soit colonisé.
De place en place, l'espèce étendrait ainsi, son aire de
répartition si des obstacles ne s'opposaient pas à sa progression
(Vial et Vial, 1974).
II - 8 - 1 - Les Arthropodes
Selon Le Houerou (1990) les Arthropodes comprennent un grand
nombre d'espèces sahariennes. Il y a en particulier des sabulicoles
comme les arachnides avec les scorpions et les solifuges et de nombreux
insectes notamment des dictyoptères mantidés du genre
25
Eremiaphila. Elles comprennent aussi des
Hétéroptères. Des Coléoptères principalement
des Ténébrionidés comme Pimelia et
Zophosis, des carabidés et des curculionidés on y
retrouve des Lépidoptères noctuidés et des
Hyménoptères formicidés avec Cataglyphus albicans
et Monomorium chobauti. Occasionnellement des invasions
d'Orthoptères comme Schistocerca gregaria provoquent des
ravages dans les oasis et en bordure du Sahara. Des travaux sur les
sautériaux ont été réalisés par Zergoun
(1991), Babaz (1992) et Douadi (1992) dans la région de Ghardaïa.
Ces derniers auteurs ont recensé plus de 30 espèces
d'Orthoptères.
II - 8 - 3 - Les Oiseaux
Aucune étude approfondie n'a été faite
dans la région Ghardaïa sur les oiseaux. De ce fait nous allons
donner la liste des espèces d'oiseaux (Tableau 6) qui existent dans la
région de Ghardaïa, citées par Heim De Balsac et Myaud
(1962), Etchecopar et Hue (1964) et Heinzel et al (1985).
Tableau 6. Liste des oiseaux cités par
certains auteurs dans la région de Ghardaïa.
|
Familles
|
Espèces
|
|
Falconidae
|
Falco biarmicus (Temminek, 1625), Faucon lanier
|
|
Otididae
|
Chlamydotis undulata (Jacquin, 1784), Outarde houbara
|
|
Burhinidae
|
Burhinus oedicnemus (Linne, l758), Oedicnème criard
|
|
Glareolidae
|
Cursorius cursor (Latham, 1787), courvite Isabelle
|
|
Pteroclididae
|
Pterocles senegallus (Linne, 1771), Ganga du
Sénégal
|
|
Pterocles coronatus (Lichtenstein, l823), Ganga
couronné
|
|
Columbidae
|
Columba livia (Bonnaterre, 1790), Pigeon biset
|
|
Streptopelia turtur (Linne, 1758), Tourterelle des
bois
|
|
Streptopelia serregalensis (Linne, 1766), Tourterelle
maillée
|
|
Strigidae
|
Athene noctua (Scopoli, 1769), Chouette
chevêtre
|
|
Alaudidae
|
Ammomanes deserti (Lichtenstein, 1823) Ammomane du
désert
|
|
Ammomanes cincturus (Gloud, 1841), Ammomane
élégante
|
|
Alaemon alaudipes (Desfontaines, 1787), Sirli du
désert
|
|
Galerida cristata (Linne, 1758), Cochevis
huppé
|
|
Corvidae
|
Corvus ruficollis (Lesson, 1831), Corbeau brun
|
|
Turbidae
|
Oenanthe deserti (Temminek, 1825), Traquet du
désert
|
|
Oenanthe leucopyga (Brehm, 1855), Traquet tète
blanche
|
|
Oenanthe leucura (Gnelin, 1789), Traquet rieur
|
|
Timaliidae
|
Turdoides fulvus (Desfontaines, 1789), Cratérope
fauve
|
|
Sylviidae
|
Scotocerca inquieta (Cretgschmar, 1826), Dromoique du
Sahara
|
|
Sylvia nana (Hemprich et Ehrenberg, 1833), Fauvette
naine
|
|
Fringillidae
|
Rhodopechys githaginea (Gould, 1837), Bouvreuil
githagine
|
|
Emberizidae
|
Emberiza striolata (Lichtenstein, 1823), Bruant
striolé
|
|
Ploceidae
|
Passer domesticus (Linne, 1758), Moineau domestique
|
|
Passer simplex (Lichtenstein, 1823), Moineau blanc
|
26
II - 8 - 4 - Les Mammifères
Le Berre (1989b) a signalé un nombre important
d'espèces de Mammifères dans la région du M'Zab (Tableau
7).
Tableau 7. Liste des Mammifères
cités par Le Berre (1989b) dans la région de Ghardaïa.
|
Ordres
|
Espèces
|
|
Carnivora
|
Canis aureus (Linnaeus. 1758), Chacal commun
|
|
Vulpes ruppelli (Schinz, 1825), Renard
famélique
|
|
Vulpes vulpes (Linnaeus, 1758), Renard roux
|
|
Poecilictis libyca (Hempricht et Ehrenberg, 1833),
Zorille de Lybie
|
|
Felis margarita (Loche, 1858), Chat des sables
|
|
Rodentia
|
Hystrix cristata (Linnaeus, 1758), Porc-épic
|
|
Massoutiera m'zabi (Lataste, 1891), Goundi du M'Zab
|
|
Gerbillus campestris (Le Vaillant, 1867), Gerbille
champêtre
|
|
Gerbillus namus (B1anford, 1875), Gerbille grobbeni
|
|
Gerbillus pyramidum (I.Geoffroy, 1825), Grande
gerbille
|
|
Merionus crassus (Sundevall, 1842), Mérion du
désert
|
|
Rattus rattus (Linnaeus, 1758), Rat noir
|
|
Mus musculus (Linnaeus, 1758), Souris domestique
|
|
Jaculus jaculus (Linnaeus1758), Petite gerboise
d'Egypte
|
|
Logomorpha
|
Lepus capensis (Linnaeus, 1758), Lièvre du Cap
|
|
Artiodactyla
|
Capra hircus (Linnaeus, 1758), Chèvre
bédouine
|
|
Ovis aries (Linnaeus, 1758), Mouton
|
|
Tylopodia
|
Camelus dromedarius (Linnaeus, 1758), Dromadaire
|
|
Insectivora
|
Aethechinus algirus (Duvernoy et Lereboullet, 1842),
Hérisson d'Algérie
|
|
Paraechinus aethiopicus (Hemprich et Ehrenberg, 1833),
Hérisson du désert
|
|
Chiroptera
|
Asellia tridens (E.Geoffroy, 1813), Trident
|
II - 8 - 2 - Les Amphibiens et les Reptiles
Pour ce qui concerne les Amphibiens et les reptiles nous notons
ici les espèces
signalées par Le Berre (1989a) dans la région du
M'Zab.
Les Amphibiens :
Bufo viridis (Laurenti, 1768), Crapaud vert
Les Reptiles :
Sauradactylus mauritanicus (Linne, 1758), Sauradactyle
de Mauritanie
Tarentola neglecta (Stauch, 1895), Tarente
dédaignée
Acanthodactylus pardalis (Lichtenstein, 1923),
Lézard léopard
Mabuia vittata (Olivier, 1804), Scinque rayé
Sphenops sepoides (Audouin, 1829), Scinqua de
Berberie
Psammophis sibilans (Linnaeus, 1758), Couleuvre
sifflante
Cerastes cerastes (Linnaeus, 1758), Vipère
à cornes
27
Chapitre III matériels et méthodes de
travail
III - 1 - Matériel
III - 1 - 1 - Matériel utilisé sur le
terrain
Pour la capture des Orthoptères nous avons
utilisé un filet fauchoir. Il comprend un manche solide en roseau d'un
mètre et demi de longueur portant sur l'une de ses
extrémités un cercle métallique de 0,4m de
diamètre. Un sac en toile est placé sur ce cercle
métallique. Il est d'une profondeur de 0,5m (Figure 6b). Pour
l'échantillonnage des criquets, nous avons délimité
à l'aide d'une ficelle, des carrés de 3m de coté (Figure
6a). Les Caelifères récoltés sont placés dans des
boites de Pétri chaque boite porte nécessairement une
étiquette indiquant le lieu, la date et le numéro de la station.
Les échantillons sont ramenés au laboratoire pour la
détermination. Durant les sorties nous avons utilisé un carnet de
prospection, dont lequel tous les renseignements concernant la sortie à
savoir la date, le lieu, l'altitude, la pente, la température et la
végétation, ainsi que toutes sortes d'informations sur le
comportement des insectes sont notés.
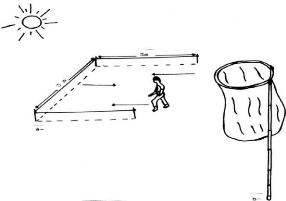
Figure 6. Méthode des quadrats : a)-
carré d'échantillonnage ; b)- filet fauchoir
III - 1 - 2 - Matériel employé au
laboratoire
III - 1 - 2 - 1 - Matériel utilisé pour la
détermination des Orthoptères
Pour la détermination des espèces
Orthoptéroloqiques nous avons utilisé la clé dichotomique
de Chopard (1943) et les boites de collection des Orthoptères de
l'insectarium du département de zoologie agricole de l'Institut National
Agronomique d'El Harrach. Une loupe binoculaire est utilisée pour
examiner avec précision les espèces acridiennes.
28
III - 1 - 2 - 2 - Matériel utilisé pour
l'étude du régime alimentaire
Pour l'analyse des fèces nous avons utilisé 5
verres de montre. Ces derniers servent à contenir les différents
produits pour l'étude du régime alimentaire. Des pinces pointes
fines et lisses sont nécessaires à la trituration des
fèces. Nous avons employé différents liquides de
l'éthanol absolu de l'eau de javel, de l'eau distillée et du
liquide de Faure. Les montages des épidermes sont réalisés
entre lame et lamelle. Une plaque chauffante est nécessaire pour
éliminer les bulles d'air existant entre lame et lamelle. Enfin pour
pouvoir observer les différentes cellules végétales on
doit utiliser un microscope photonique.
III - 2 - Méthode de travail
III - 2 - 1 - Méthodes utilisées sur le
terrain
III - 2 - 1 - 1 - Choix des stations
d'étude
Il convient de choisir la station ou site de prospection dans
un biotope homogène suffisamment vaste de façon à
éviter les effets de bordure et les interférences avec les
biotopes voisins. Le site choisi doit être représentatif d'une
catégorie de biotope largement représenté dans la
région. Par ailleurs, il est impératif de suivre
simultanément l'évolution des populations acridiennes dans
plusieurs biotopes écologiquement contrastés en vue de faire des
comparaisons. En effet, les peuplements acridiens seront différents et
certaines espèces ne pourront être suivies que dans certains
milieux car trop peu abondantes ou absentes dans les autres. L'humidité
constitue, ainsi que nous l'avons vu, le principal facteur discriminant de la
distribution des acridiens dans cette région. C'est pour cela nous avons
choisi 3 stations dans des milieux d'humidités différentes,
milieu non cultivé, milieu cultivé et une palmeraie. Pour
représenter la physionomie de la végétation, nous avons
jugé utile d'établir des transects végétaux pour
chaque type de station. Nous avons délimité une aire
d'échantillonnage de 10m sur 50m soit une surface de 500m2
La parcelle-échantillon de 500m2 est
représentée suivant une projection orthogonale et en vue de
profil. La projection verticale fournit des renseignements sur l'occupation du
sol et sur la structure de la végétation. Ces notions sont
complétées grâce à la représentation de
profil qui donne une idée sur la physionomie du paysage. Celui-ci est de
ce fait soit ouvert, semi fermé ou fermé. La connaissance de la
physionomie du paysage est importante sachant que les Orthoptères qui
sont assez héliophiles ne peuvent vivre en milieu fermé. Le taux
de recouvrement des espèces végétales sur le terrain est
estimé selon la méthode donnée par Duranton et al.,
(1982), qui consiste à estimer la surface de chaque espèce
végétale en
29
calculant la surface occupée par la projection orthogonale
du végétal. La surface est déterminée grâce
à la formule suivant :
it (d /2)2 x N
T = x 100
S
T est taux de recouvrement d'une espèce
végétale donnée
d est le diamètre moyen de la plante en projection
orthogonale
S est la surface du transect végétal soit
500m2
N est le nombre de touffes d'une espèce
végétale donnée
Tableau 8 : Taux de recouvrement des
espèces végétales dans le milieu non cultivé pour
un
transect de 500m2
|
Espèces
|
Nombre de touffes
|
Diamètre en mm
|
Taux de recouvrement en %
|
|
Aristida pungens
|
3
|
1,10
|
0,57
|
|
Aristida obtusa
|
79
|
0,15
|
0,30
|
|
Colocynthis vulgaris
|
2
|
0,75
|
0,20
|
|
Pituranthos
|
7
|
0,60
|
0,40
|
|
chloranthus
|
4
|
0,85
|
0,45
|
|
Pergularia
|
2
|
0,55
|
0,09
|
|
tomentosa
|
9
|
0,80
|
0,14
|
|
Peganum harmala
|
|
|
|
|
Arthrophytum scoparium
|
|
|
|
|
Total
|
2,15
|
Tableau 9 : Taux de recouvrement des
espèces végétales dans le milieu cultivé pour un
transect de 500m2
|
Espèces
|
Nombre de touffes
|
Diamètre en mm
|
Taux de recouvrement en %
|
|
Vitis vinifera
|
12
|
1,10
|
2,30
|
|
Citrus sinensis
|
4
|
1,20
|
0,10
|
|
Olea europea
|
9
|
1,60
|
3,60
|
|
Capsicum annuum
|
16
|
0,30
|
0,20
|
|
Mentha pulegium
|
450
|
0,30
|
6,35
|
|
Lycopersicum esculentum
|
15
|
0,35
|
0,30
|
|
Lageneria vulgaris
|
12
|
0,45
|
0,40
|
|
Cynodon dactylon
|
275
|
0,20
|
1,20
|
|
Cyperus rotundus
|
25
|
0,25
|
0,20
|
|
Setaria verticillata
|
110
|
0,25
|
1,01
|
|
Echinops spinosus
|
7
|
0,35
|
0,10
|
|
Aristida obtusa
|
11
|
0,15
|
0,04
|
|
Amaranthus hybridus
|
20
|
0,20
|
0,12
|
|
Tribulus terrester
|
15
|
0,25
|
0,14
|
|
Total
|
17,06
|
Tableau 10 : Taux de recouvrement des
espèces végétales dans la palmeraie pour un transect de
500 m2
|
Espèces
|
Nombre de touffes
|
Diamètre en mm
|
Taux de recouvrement en %
|
|
Phoenix dactylifera
|
8
|
1,60
|
3,20
|
|
Setaria verticillata
|
460
|
0,25
|
4,50
|
|
Cynodon dactylon
|
195
|
0,20
|
1,20
|
|
Convolvulus arvensis
|
55
|
0,35
|
1,05
|
|
Peganum harmala
|
4
|
0,60
|
0,20
|
|
Total
|
10,15
|
III - 2 - 1 - 2 - Transect végétal en
milieu non cultivé
Le milieu non cultivé est situé à environ
5Km de Béni Isguen. C'est un reg encombré de cailloux, de sables
grossiers et de limons plus fins. La végétation très
éparse, est constituée principalement par une Chenopodiaceae
arbustive à rameaux articulés. Il s'agit d'Arthrophytum
scoparium. Le milieu non cultivé est caractérisé par
son altitude, son exposition et sa pente :
- Altitude : 530 m
- Exposition : Sud
- Pente : 0 %
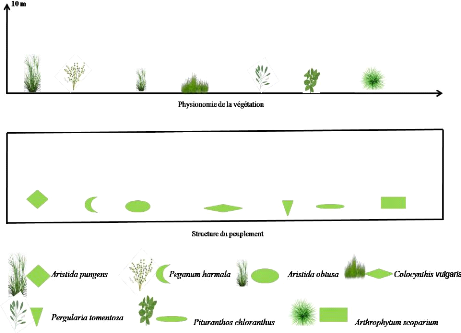
Figure 7. Transect végétal en
milieu non cultivé
30
Le transect végétal doit sa structure à
une Chenopodiaceae arbustive précédemment citée.
Le calcul du taux de recouvrement végétal donne une valeur faible
de l'ordre de 2,157. (Fig.7, Tableau 8).
III - 2 - 1 - 3 - Transect végétal en
milieu cultivé
Le milieu cultivé est situé à environ 7Km
de Béni Isguen. C'est un terrain qui est mis en valeur. Les cultures
sont installées sur des sols sablo-limoneux. Il y a comme cultures des
arbres fruitiers tels que la vigne. L'oranger, le citronnier et l'olivier. Les
Cultures maraichères sont représentées principalement par
le piment, la courge, l'aubergine et la tomate. On y retrouve quelques plantes
adventices comme le chiendent pied-de-poule. Cette station a les mêmes
caractéristiques d'altitude, d'exposition et de pente que la station
précédente
- Altitude : 530 m
- Exposition : Sud
- Pente : 0 %
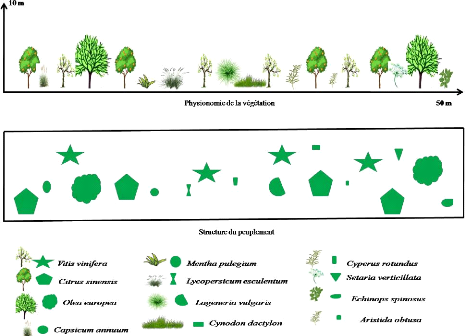
Figure 8. Transect végétal en
milieu cultivé
31
Le transect végétal donne un profil à
deux niveaux, un niveau occupé par les arbres et un autre par les plants
de tomate, piment, courge et par les plantes adventices (Figure 8). La strate
arbustive a une hauteur variant entre 1,5m et 2m. La strate herbacée
quant à elle a une hauteur variant entre 0,1 et 0,5m. Le taux de
recouvrement est estimé à 17,1 %, dû surtout à la
menthe et à l'olivier qui présentent des valeurs respectives de
6,4% et 3,6% (Tableau 9). Pour les plantes adventices le taux de recouvrement
le plus élevé est enregistré pour le chiendent-pied de
poule avec une valeur égale à 1,3%.
III - 2 - 1 - 4 - Transect végétal dans une
palmeraie
La palmeraie est située 5Km de Ghardaïa. La
culture présente est le palmier dattier. Cette dernière est
installée sur un sol sablo-limoneux. Au voisinage du palmier on trouve
des plantes adventices dont la mieux représentée est la setaire
verticillée, Setaria verticillata. La palmeraie d'étude
diffère des deux stations précédentes par son
exposition
- Altitude : 530
- Exposition : Nord
- Pente : 0 %
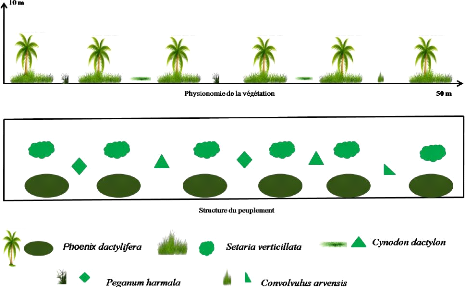
32
Figure 9. Transect végétal en
palmeraie
33
Le transect végétal montre que le terrain est
occupé uniquement par le palmier dattier et les mauvaises herbes (Figure
9). Le taux de recouvrement global de la station est égal à 10,2
% dont 4,5 % est celui de Setaria verticillata et 3,2 % du palmier
dattier (Tableau 10).
III - 2 - 1 - 5 - Méthode des
quadrats
Le but de l'échantillonnage est d'obtenir à
partir d'une surface donnée, aussi restreinte que possible, une image
fidèle de l'ensemble du peuplement (Lamotte et al, 1969).
Plusieurs méthodes sont utilisées pour le dénombrement des
populations d'Orthoptères. La méthode des quadrats est la plus
pratique et qui donne des données exploitables. Selon Chessel et
al., (1975) et Barbault (1981) le principe de cette méthode
consiste à compter le nombre d'individus présents sur une surface
déterminée pour obtenir une estimation satisfaisante de la
diversité de la population. La surface d'échantillonnage dans
laquelle nous intervenons est estimée à un hectare par station.
Cinq prélèvements sont réalisés à
l'intérieur de chaque station, dans des carrés de 9m2
chacun pris au hasard. Les prélèvements selon Voisin (1986)
permettent de connaître la composition spécifique d'un peuplement
d'Orthoptères.
III - 2 - 1 - 6 - Méthode d'étude du
régime alimentaire sur le terrain
III - 2 - 1 - 6 - 1 - Caractérisation de la
végétation
Pour l'étude du régime alimentaire
d'Acrotylus patruelis nous avons choisi le milieu cultivé
décrit plus haut. Le taux de recouvrement des espèces
végétales présentes dans un transect de 500m2
est calculé pour montrer l'importance de chaque espèce
végétale (Tableau 9). De plus nous avons estimé
l'abondance-dominance des espèces végétales
présentes (Tableau 11). D'après Guinochet (1973),
l'abondance-dominance est une expression de l'espace relatif occupé par
l'ensemble des individus de chaque espèce, espace qui est
déterminé à la fois par leur nombre et leurs dimensions.
L'échelle la plus couramment utilisée est celle de
Braun-Blanquet:
+ Simplement présent ou recouvrement très
faible
1 Recouvrement faible de O à 5 %
2 Recouvrement de 5 à 25 %
3 Recouvrement de 25 à 50 %
4 Recouvrement de 50 à 75 %
5 Recouvrement de 75 à 100 %
34
Tableau 11. Abondance dominance des
espèces végétales présentes dans le milieu
cultivé
|
Espèces végétales
|
Abondance-dominance
|
Espèces végétales
|
Abondances
dominance
|
|
Vitis vinifera
|
1
|
Mentha pulegium
|
2
|
|
Citrus sinensis
|
1
|
Echinops spinosus
|
+
|
|
Olea europea
|
1
|
Sonchus oleraceus
|
+
|
|
Capsicum annuum
|
1
|
Erigeron canadensis
|
+
|
|
Lycopersicum esculentum
|
1
|
Launaea resedifolia
|
+
|
|
Lageneria vulgaris
|
1
|
Salsola vermiculata
|
+
|
|
Cynodon dactylon
|
1
|
Chenopodium album
|
+
|
|
Setaria verticillata
|
1
|
Amaranthus hybridus
|
+
|
|
Aristida obtusa
|
+
|
Portulaca oleracea
|
+
|
|
Cyperus rotundus
|
1
|
Tribulus terrester
|
+
|
III - 2 - 1 - 6 - 2 - Prélèvement des
fèces
Les prélèvements des fèces ont lieu dans
le milieu cultivé pendant deux années. Durant les mois allant de
juillet à octobre de l'année 1992 nous avons effectué les
premiers prélèvements. D'autres prélèvements ont
été réalisés durant les mois de Juillet à
septembre au cours de l'année suivante. Les criquets sont
capturés entre 12 et 13 heures. Nous avons placé chaque insecte
dans une boîte de Pétri. La durée suffisante pour que les
acridiens vident leur tube digestif est variable selon les auteurs. Ben Halima
et al., (1984), notent qu'il faut 7 heures pour
récupérer les fèces après le repas d'un insecte.
Par contre Launois (1976), signale que l'insecte doit jeûner 1 à 2
heures. Au contraire nous avons remarqué qu'il faut 24 heures pour vider
le tube digestif d'Acrotylus patruelis. Les fèces de chaque
individu sont conservées dans des cornets en papier, sur lesquels on
inscrit le nom de l'espèce d'Orthoptère, le sexe de l'individu,
la date et le lieu de capture.
III - 2 - 2 - Méthodes employées au
laboratoire
III - 2 - 2 - 1 - Détermination des espèces
capturées
Les échantillons ramenés du terrain font l'objet
d'une détermination spécifique par le Professeur Doumandji
à l'aide des clefs dont notamment celle des Orthoptères de
l'Afrique du Nord de Chopard (1943). Voisin (1980), signale que contrairement
aux imagos, les larves sont les plus souvent difficiles à identifier
spécifiquement, même s'il existe de bons tableaux de
détermination pour certains groupes.
III - 2 - 2 - 2 - Détermination des stades
larvaires
La détermination des stades larvaires des
différentes espèces est nécessaire pour l'étude de
la dynamique de la population. Le nombre de stades larvaires n'est pas
35
généralement facile à déterminer.
Selon Duranton et al., (1982), le nombre réel de stades
larvaires varie de 4 à 8 suivant les espèces. Le nombre le plus
fréquent est de 5 à 6. Les 5 stades larvaires de la lignée
mâle sont classés selon les étapes de développement
des ébauches alaires : La larve de premier stade est
caractérisée par une petite taille celle de l'oeuf et par
l'absence d'ébauches alaires. Celle de deuxième stade a des
ébauches alaires A1 et A2, séparées et ne
présentant pas de nervures. Chez la larve du troisième stade les
ébauches alaires sont présentes, ne se recouvrent pas et montrent
à ce moment là des nervures. Par contre les ébauches
alaires de première paire A1 des larves du quatrième stade L4
recouvrent tout ou partie des ébauches alaires de seconde paire A2.
Elles atteignent le quart ou le tiers de la longueur de l'abdomen Chez la larve
du cinquième stade les ébauches alaires atteignent la
moitié de la longueur de l'abdomen. La lignée femelle compte un
stade larvaire supplémentaire. Les caractères de la larve L6
correspondent à ceux de la larve L5 futur mâle.
III - 2 - 2 - 3 - Conservation des
échantillons
Les échantillons d'Orthoptères qui sont
destinés à la collection sont tués dans un flacon
contenant du coton imbibé d'acétate d'éthyle. Puis on les
place sur des étaloirs en les fixant avec des épingles
entomologiques au niveau du thorax, les ailes A2 et les élytres A1 sont
maintenus dans une position horizontale, le bord postérieur des
élytres faisant 90° avec l'axe du corps. Les étaloirs sont
placés dans l'étuve à 45°C pendant quelques jours
pour dessécher les Orthoptères. Après cela, ils sont
retirés et placés dans une boite de collection. Une collection de
référence est constituée au cours du déroulement
des prospections Son but est de conserver un ou plusieurs individus de chaque
espèce capturée dans les stations étudiées,
généralement un mâle et une femelle par espèce.
Cette collection sert de référence pour toute la durée des
études et permet de vérifier les déterminations
ultérieures.
III - 2 - 2 - 4 - Etablissement du catalogue des
végétaux de référence
Dans le but d'établir un catalogue de
référence on peut distinguer principalement deux méthodes.
Celles-ci consistent à récolter à préparer et
à photographier les fragments d'épidermes présents dans
les fèces d'un animal nourri exclusivement sur une espèce
végétale (Launois,1976), ou bien à prélever
directement les épidermes des différentes parties de la plante et
à les photographier (Chapuis, 1979; Butet, 1985; Ben Halima,1983) Nous
avons employé la deuxième méthode citée qui offre
l'avantage d'être rapide et qui permet surtout de savoir à quelle
partie de la plante correspond l'épiderme étudié. Selon
Butet (1985) l'obtention des épidermes peut se faire selon deux
principes la séparation chimique et la
séparation physique des épidermes. La
séparation chimique des épidermes consiste à plonger des
fragments végétaux dans des liquides de macération qui
permettent de décolorer et de séparer les épidermes des
tissus, tel que l'acide lactique. La deuxième méthode consiste en
une séparation mécanique des épidermes. Les
épidermes sont détachés délicatement des tissus
sous-jacents avec de fines pinces ou quand cela n'est pas possible en
plaçant l'épiderme à étudier en contact avec une
lame de verre et en éliminant l'autre épiderme et les tissus
internes par grattage. L'épiderme va passer dans de l'eau de Javel
pendant 15 secondes. On fait passer l'épiderme dans de l'eau
distillée pendant 2 minutes. Enfin les fragments épidermiques
subissent des bains dans l'éthanol à concentrations progressives
(70°, 90° et 100°). Les fragments épidermiques sont alors
mis entre lame et lamelle dans du liquide de Faure pour l'observation au
microscope photonique au grossissement 125x10. La collection de
référence doit être la plus complète possible, tant
au point de vue espèces, qu'organes de la plante, tige, feuille et
inflorescence Nous signalons que c'est cette méthode que nous avons
utilisée pour l'étude du régime alimentaire.
III - 2 - 2 - 5 - Analyse des fèces
La reconnaissance des débris végétaux
contenus dans les fèces est facilitée par le ramollissement de
celles-ci dans l'eau pendant 24 heures. L'ensemble passe ensuite dans une
série de bains, dans de l'eau de javel, de l'eau distillée et de
l'éthanol à différentes concentrations 70°, 90°
et 100° Les montages se font dans une goutte de liquide de Faure entre
lame et lamelle et sont examinés au microscope photonique (Figure 10).
Selon Chara et al., (1986) l'analyse des contenus de fèces
présente l'avantage de ne pas sacrifier les animaux ce qui peut
être un inconvénient lorsque l'étude de l'alimentation est
associée à une étude démographique de population,
ou qu'elle concerne une espèce rares.
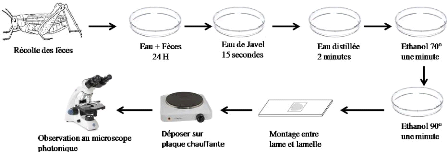
Figure 10. Démarche à suivre
pour l'analyse des fèces
36
37
III - 2 - 3 - Méthodes d'expression des
résultats
Les divers peuplements qui constituent une biocénose
peuvent se définir quantitativement par un ensemble de descripteurs qui
prennent en considération l'importance numérique des
espèces qu'ils comportent (Ramade, 1984). Selon Voisin (1980), les
individus d'une espèce donnée sont d'autant plus nombreux que les
conditions écologiques auxquelles ils sont soumis, température,
humidité et nourriture leur sont plus favorables.
III - 2 - 3 - 1 - Analyse statistique
III - 2 - 3 - 1 - 1 - Analyse factorielle des
correspondances
C'est une méthode d'analyse multidimensionnelle qui
permet d'établir un diagramme de dispersion unique dans lequel
apparaissent à la fois chacun des caractères
considérés et chacun des individus observés. Le
résultat est obtenu grâce à une méthode
particulière de codification et par un calcul de valeurs propres, qui
assurent une parfaite symétrie entre les caractères et les
individus, c'est à dire entre les lignes et les colonnes de la matrice
des données initiales (Dagnelie, 1975). D'après Daget (1976),
l'observation du graphique peut donner une idée sur
l'interprétation des facteurs et montrer quelles variables sont
responsables de la proximité entre telle ou telle observation.
III - 2 - 3 - 1 - 2 - Fréquence
relative
C'est le pourcentage d'individus d'une espèce par
rapport au total des individus. La fréquence relative peut être
calculée pour un prélèvement ou pour l'ensemble des
prélèvements d'une biocénose (Dajoz, 1971). Elle est
représentée par La formule suivante :
Nombre d'individus de l'espèce
F = * 100
Nombre d'individus total
III - 2 - 3 - 1 - 3 - Constance
C'est le rapport exprimé sous forme de pourcentage (Dajoz,
1982) : C = P * 100 / R dans
lequel, P est le nombre de relevés contenant
l'espèce étudiée et R le nombre de relevés
effectués. En fonction de C on distingue :
- Les espèces constantes présentent dans plus de 50
% de relevés
- Les espèces accessoires présentes dans 25
à 50 % de relevés
- Les espèces accidentelles trouvées dans moins de
25 % de relevés.
38
III - 2 - 3 - 2 - Analyse par indices
écologiques
III - 2 - 3 - 2 - 1 - Indice de diversité et
équirépartition
De nombreux indices de diversité sont proposés,
et selon Frontier (1982), l'indice le plus communément utilisé
aujourd'hui est celui de Shannon-Weaver, dérivé de la
théorie de l'information.
i = s
H' = - ? pi* log2 pi
i =1
Où S est le nombre d'espèces et pi
représente la probabilité de rencontre de l'espèce de
rang
i. On peut écrire pi = ni/N, où ni est
l'effectif de chaque espèce dans l'échantillon et N la somme des
ni toutes espèces confondues. H' est l'indice de diversité de
l'échantillon. Il est exprimé en unités d'information par
individu, ou bits par individus. Le logarithme utilisé est de base 2. On
démontre que H' est bien maximal, pour un nombre d'espèces S
donné quand toutes ces espèces sont également
fréquentes. Cette valeur maximale est H'max = log2 S. Enfin la
connaissance de H' et H'max permet de déterminer
l'équitabilité E.
H' H'
E = =
H'max log2 S
E varie entre 0 et 1. Quand E est inférieur à 0,5,
ceci traduit un déséquilibre au sein d'un
peuplement où une ou deux espèces pullulent par
rapport aux autres. Si E est supérieur à 0,5 il s'établit
un équilibre entre les différentes populations composant un
peuplement. Selon Dajoz (1985), un indice de diversité
élevé correspond à des conditions de milieu favorables
permettant l'installation de nombreuses espèces. Une diversité
élevée révèle alors une stabilité plus
grande. Une équitabilité élevée est l'indice d'un
peuplement équilibré.
III- 2- 3- 2- 2- Indice de dispersion des espèces
acridiennes dans le temps et dans l'espace
L'étude de la répartition ou dispersion permet
de déterminer le mode de distribution des Orthoptères dans les
différentes stations en fonction du temps. Selon Bachelier (1978), si N
est le nombre total d'observations, m la moyenne des comptages et X le
résultat d'un comptage quelconque, la variance peut s'écrire :
? (X - m)
S2 =
N - 1
Si m > S2 on a une distribution
régulière
Si m = S2 on a une distribution au hasard ou
aléatoire
Si m < S2 on a une distribution en agrégats
dite encore distribution contagieuse
Si S2 = O la distribution est uniforme (Dajoz,
1971).
39
III - 2 - 3 - 3 - Méthodes de quantification
relative de la nourriture ingérée
Butet (1985), a recensé diverses méthodes de
quantification relative de la nourriture ingérée par des
phytophages; elles sont basées sur le dénombrement ou la mesure
des surfaces des fragments épidermiques présents sur les lames
échantillons. Nous pouvons distinguer les principaux cas suivants :
- Tous les fragments présents sur la
lame-échantillon sont dénombrés (Launois, 1976)
- Un nombre prédéterminé de fragments est
recensé par un balayage méthodique continu de la
lame-échantillon (Chapuis, 1979).
- Les surfaces d'un nombre prédéterminée
de fragments sont mesurées (Nel et al, 1973 in Butet, 1985).
- Le dénombrement ou la mesure des surfaces des
épidermes sont effectués dans des zones définies sur la
lame grille d'observation espace entre deux lignes, champs de microscope,
etc....
Pour l'expression des résultats du régime
alimentaire d'Acrotylus patruelis nous avons utilisé deux
méthodes.
III - 2 - 3 - 3 - 1 - Méthode des
fréquences
Butet (1985), définit une fréquence relative (F
%) d'apparition d'un item donné dans les échantillons :
ni
F % item i = x 100
N
Où ni est le nombre d'échantillons où l'item
i est présent et N est le nombre total
d'échantillons pris en compte.
III - 2 - 3 - 3 - 2 - Méthode des
surfaces
Le principe de la méthode consiste à calculer la
surface ingérée en millimètres carrés pour chaque
espèce végétale. Pour cela nous avons utilisé un
carré, Fenêtre d'un millimètre carré. Le papier
millimétré est collé sur le plateau du microscope
photonique, de façon à ce que l'objectif soit en face du
carré. On place le montage des fèces sur le papier
millimétré, puis on procède à un balayage de toute
la surface de la lamelle. On note la surface des fragments
végétaux qui occupent chaque carré. Pour montrer l'aspect
quantitatif des espèces végétales ingérées
nous avons utilisé les formules suivantes proposées par Doumandji
et al., (1993).
|
n n
Ss = ? xi
i=1 n'
|
|
n
? Ss i=1
S =
N
|
|
S
T =
n
? S i=1
|
T
IA =
RG
40
Ss : est la surface d'une espèce végétale
donnée rejetée dans les fèces et calculée pour un
individu.
Xi : est la surface des fragments du végétal de
l'espèce i notée dans les fèces d'un individu. n : est le
nombre de mm2 de la lamelle soit 576 mm2.
n' : est le nombre de mm2 observés sur la
lamelle vides ou occupés par les fragments végétaux. Le
rapport n/n' délimite le champ de travail et permet de diminuer les
erreurs de manipulation.
S : est la surface moyenne d'une espèce
végétale consommée par N individus. n
? S : est la somme des surfaces moyennes des
végétaux rejetées par individu toutes
i=1 végétales confondues.
N : est le nombre d'individus pris en considération.
T : est le taux de consommation pour une espèce
végétale par rapport à l'ensemble des surfaces
végétales rejetées.
IA : est l'indice d'attraction d'une espèce
végétale donnée.
RG : est le recouvrement global pour une espèce
végétale présente dans la station d'étude.
41
Chapitre IV: Bioécologie des principales
espèces d'Orthoptères dans la région de
Ghardaïa
IV - 1 - Inventaire
IV - 1 - 1 - Inventaire concernant la faune
Orthoptérologique de la région de Ghardaïa
Le prélèvement des données pour
l'étude bioécologique est réalisé sur une
période allant du 28 janvier au 26 décembre 1992 à raison
d'une sortie par mois dans chacune des stations. Nous avons recensé 29
espèces d'Orthoptères que nous avons déterminé avec
l'aide du Professeur Doumandji en utilisant des clefs dont l'ouvrage de Chopard
(1943), les collections de l'insectarium du département de zoologie
agricole et forestière de l'Institut National Agronomique d'El-Harrach,
l'ouvrage de Dirsh (1965) et le catalogue des Orthoptères Acridoidea de
l'Afrique du Nord-Ouest proposé par Louveaux et Ben Halima (1987).
IV - 1 - 1 - 1 - Résultats : Le
tableau n° 8 met en évidence les résultats recueillis lors
de l'inventaire.
Tableau 12. Faune des Orthoptères
Caelifères de la région de Ghardaïa.
|
Familles
|
Sous Famille
|
Espèces
|
|
Acrydiidae
|
Acrydinae
|
Paratettix meridionalis (Rambur, 1838).
|
|
Pamphagidae
|
Akicerinae
|
Tuarega insignis (Lucas, 1851).
|
|
Pyrgomorphidae
|
Chrotogoninae
|
Tenuitarsus angustus (Blanchard, 1837).
|
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
|
Pyrgomorpha conica (Olivier, 1791).
|
|
Acrididae
|
Dericorythinae
|
Dericorys millierei (Finot et Bonnet, 1884).
|
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836).
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889).
|
|
|
Heteracris annulosa (Walker, 1870).
|
|
|
Heteracris harterti (I.Bolivar, 1913).
|
|
Cyrtacanthacridinae
|
Anacridium aegyptium (Linne, 1764).
|
|
|
Schistocerca gregaria (Forskal, 1775).
|
|
Acridinae
|
Acrida turrita (Linne, 1758).
|
|
|
Aiolopus strepens (Latreille, 1804).
|
|
|
Aiolopus thalassinus (Fabricuis, 1781).
|
|
Oedipodinae
|
Acrotylus longipes (Charpentieri, 1843).
|
|
|
Acrotylus patruelis (Herrich -Schaeffer, 1838)
|
|
|
Hyalorrhipis calcarata (Vosseler, 1902).
|
|
|
Pseudosphingonotus azurescens (Rambur, 1838).
|
|
|
Pseudosphingonotus savignyi (Saussure, 1884).
|
|
|
Sphingonotus caerulans (Linne, 1767).
|
|
|
Sphingonotus obscuratus lameerei (Fi., 1902).
|
|
|
Sphingonotus rubescens (Walker, 1870).
|
|
|
Wernerella pachecoi (Bolivar, 1913).
|
|
Gomphocerinae
|
Ochrilidia gracilis (Krauss, 1902).
|
|
|
Ochrilidia geniculata (Bolivar, 1913).
|
|
|
Omocestus lucasii (Brisout, 1851)
|
|
|
Omocestus raymondi (Harz, 1970).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
42
IV - 1 - 1 - 2 - Discussion
D'après le tableau 12, nous constatons que les 29
espèces d'Orthoptères notés appartiennent au sous ordre
des Caelifères. De même Zergoun (1991), Douadi (1992) et Babaz
(1992), ont recensé respectivement 31, 27 et 28 espèces
d'Orthoptères dans la région de Ghardaïa. Parmi les
espèces mentionnées par Douadi (1992) et Babaz (1992), 14 d'entre
elles ne sont pas présentes dans les présentes stations
d'études. Nous n'avons pas trouvé d'Ensifères durant les
échantillonnages de 1992. Par contre en 1991 un Ensifère
Phaneroptera nana (Bruner1878) est observé (Zergoun, 1991).
Louveaux et Ben Halima (1987) citent 140 espèces de Caelifères en
Algérie. La région de Ghardaïa englobe 20,7 % de ces
espèces. De même au Sahara, ces auteurs notent 68 espèces.
La faune d'Orthoptères Caelifères de la région de
Ghardaïa représente 42,6 % des espèces Caelifères
signalées au Sahara. Chopard (1943) note une espèce acridienne
caractérisant les oasis il s'agit d'Ochrilidia gracilis. Elle
est retrouvée lors des différentes études sur les
peuplements acridiens dans la région de Ghardaïa. Nous avons
noté la présence de 12 sous famille et 18 genres. La sous famille
des Oedipodinae est la mieux représentée en
espèces dans la région de Ghardaïa, ce qui confirme les
observations faites par Zergoun (1991) et Babaz (1992). Les Oedipodinae
englobent plus de 31 % des espèces recensées dont les genres
Sphingonotus et Pseudosphingonotus représentent plus
de 55 %. Nous avons également les sous familles des Gomphocerinae
avec 13,8 %, des Eyprepocnemidinae et des Acridinae avec
10,3 % chacune, et 6,9 % pour les Pyrgomorphinae et les
Cyrtacanthacridinae. Par contre les sous familles des
Akicerinae, des Chrotogoninae, des Dericorythinae,
des Calliptaminae, des Truxalinae, et la famille des
Acrydiidae correspondent à peine à 3.5 % chacune.
IV - 1 - 1 - 3 - Conclusion
Le nombre important de 29 d'espèces
d'Orthoptères Caelifères recensées, soit 42,6 % de
l'Orthoptérofaune saharienne dans la région de Ghardaia, montre
la richesse de la zone d'étude en peuplements acridiens. Bien qu'on
retrouve certaines espèces d'acridiens dans les endroits humides, la
très grande majorité de ces insectes ont des formes
xérophiles et thermophiles (Chopard, 1949). En effet le nombre
d'espèces d'Orthoptères augmente au fur et à mesure qu'on
s'éloigne des régions humides.
IV - 1 - 2 - Inventaire concernant les stations
d'étude IV - 1 - 2 - 1 - Résultats
43
Tableau 13. Faune des Orthoptères
Caélifères en milieu non cultivé à Béni
Isguen.
|
Familles
|
Sous Famille
|
Espèces
|
|
Pamphagidae
|
Akicerinae
|
Tuarega insignis (Lucas, 1851).
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
Acrididae
|
Dericorythinae
|
Dericorys millierei (Finot et Bonnet, 1884).
|
|
Cyrtacanthacridinae
|
Schistocerca gregaria (Forskal, 1775).
|
|
Oedipodinae
|
Hyalorrhipis calcarata (Vosseler, 1902).
|
|
|
Pseudosphingonotus azurescens (Rambur, 1838).
|
|
|
Pseudosphingonotus savignyi (Saussure, 1884).
|
|
|
Sphingonotus caerulans (Linne, 1767).
|
|
|
Sphingonotus obscuratus lameerei (Fi., 1902).
|
|
|
Sphingonotus rubescens (Walker, 1870).
|
|
|
Wernerella pachecoi (I.Bolivar, 1913).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
|
3
|
6
|
12
|
Tableau 14. Faune Orthoptérologique du
milieu cultivé à Béni Isguen.
|
Familles
|
Sous Famille
|
Espèces
|
|
Acrydiidae
|
Acrydinae
|
Paratettix meridionalis (Rambur, 1838).
|
|
Pyrgomorphidae
|
Chrotogoninae
|
Tenuitarsus angustus (Blanchard, 1837).
|
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
Acrididae
|
Calliptaminae
|
Calliptamus barbarus (Costa, 1836).
|
|
Eyprepocnemidinae
|
Heteracris adspersa (Redtenbacher, 1889).
|
|
|
Heteracris annulosa (Walker, 1870).
|
|
|
Heteracris harterti (I.Bolivar, 1913).
|
|
Cyrtacanthacridinae
|
Anacridium aegyptium (Linne, 1764).
|
|
Acridinae
|
Acrida turrita (Linne, 1758).
|
|
|
Aiolopus strepens (Latreille, 1804).
|
|
|
Aiolopus thalassinus (Fabricuis, 1781).
|
|
Oedipodinae
|
Acrotylus longipes (Charpentieri, 1843).
|
|
|
Acrotylus patruelis (Herrich -Schaeffer, 1838)
|
|
Gomphocerinae
|
Ochrilidia gracilis (Krauss, 1902).
|
|
|
Ochrilidia geniculata (Bolivar, 1913).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
|
3
|
10
|
16
|
Tableau 15. Faune Orthoptérologique de la
palmeraie à Ghardaïa
|
Familles
|
Sous Famille
|
Espèces
|
|
Acrydiidae
|
Acrydinae
|
Paratettix meridionalis (Rambur, 1838).
|
|
Pyrgomorphidae
|
Pyrgomorphinae
|
Pyrgomorpha cognata (Uvarov, 1943).
|
|
|
Pyrgomorpha conica (Olivier, 1791).
|
|
Acrididae
|
Eyprepocnemidinae
|
Heteracris harterti (I.Bolivar, 1913).
|
|
Acridinae
|
Aiolopus strepens (Latreille, 1804).
|
|
|
Aiolopus thalassinus (Fabricuis, 1781).
|
|
Oedipodinae
|
Acrotylus patruelis (Herrich -Schaeffer, 1838)
|
|
Gomphocerinae
|
Ochrilidia gracilis (Krauss, 1902).
|
|
|
Omocestus lucasii (Brisout, 1851)
|
|
|
Omocestus raymondi (Harz, 1970).
|
|
Truxalinae
|
Truxalis nasuta (Linne, 1758).
|
|
3
|
7
|
11
|
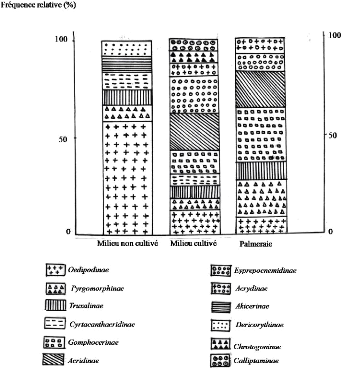
44
Figure 11. Fréquence relative des sous
familles d'Orthoptères dans les stations d'études de la
région de Ghardaïa
IV - 1 - 2 - 2 - Discussion
Chaque station ou milieu est caractérisée par un
nombre d'espèces d'Orthoptères. En effet, la faune
Orthoptérologique du milieu cultivé est composée de 16
espèces, soit 55,2 % de la faune totale des Caelifères de la
région d'étude. Par contre, Douadi (1992) a recensé dans
le milieu cultivé 23 espèces de Caelifères parmi les 27 ce
qui représente 85 % des espèces existant dans la zone
d'étude. Babaz (1992), quant à lui a trouvé presque le
même nombre d'espèces acridiennes dans le milieu cultivé et
le milieu non cultivé avec 19 dans le premier et 16 dans le second. Nous
avons noté dans le milieu non cultivé et dans la palmeraie des
nombres d'espèces de Caelifères qui sont respectivement de 12 et
11 espèces, soit 41,4 % et 37,9 % de la faune Orthoptérologique
globale de la région d'étude. Dans le milieu cultivé, le
sou ordre des Caelifères est subdivisé en dix sous-familles qui
sont classées par ordre d'importance en Eyprepocnemidinae avec
10,3 %, en Acridinae, Oedipodinae et en
45
Gomphocerinae avec 6,9 % chacune. Enfin les
sous-familles des Chrotogoninae, des Pyrgomorphinae, des
Calliptaminae, des Cyrtacanthacridinae, des Truxalinae
et des Acrydinae sont mentionnés chacune avec un taux de
3,5 %. Le milieu non cultivé et la palmeraie sont
représentés respectivement par 6 et 7 sous-familles (Tableaux 13,
14. 15 et la figure 11). Nous remarquons aussi que certaines espèces ne
se retrouvent que dans le milieu cultivé. C'est le cas par exemple
d'Acrotylus longipes. Par contre Zergoun (1991) et Babaz (1992),
citent cette espèce dans les milieux non cultivés. Cela est
dû probablement au fait que cet acridien préfère les
milieux sablonneux et secs. Dans le milieu non cultivé on trouve des
espèces xérophiles. Nous citons entre autres Tuarega insignis
et les genres Sphingonotus et Pseudosphingonotus. Ces
derniers peuvent étendre leur répartition jusqu'aux milieux
cultivés et la palmeraie, surtout durant les Journées très
chaudes d'été. C'est pour cette raison que Zergoun (1991) et
Douadi (1992) les ont cités dans ces deux milieux. La palmeraie est
caractérisée par la présence d'Omocestus raymondi
et d'Omocestus lucasii, ce qui confirme les observations faites
par Babaz (1992). D'autres parts il existe deux espèces communes aux
trois types de milieux, Ce sont Truxalis nasuta et Pyrgomorpha
cognata.
IV - 1 - 2 - 3 - Conclusion
Nous pouvons enfin conclure que chaque type de milieu favorise
le développement de certaines espèces acridiennes. En effet, la
répartition des Orthoptères Caelifères dans les
différentes stations est conditionnée par plusieurs facteurs tels
que le sol, la végétation et le microclimat. Des résultats
obtenus, il ressort que le milieu cultivé à Béni-Isguen
compte le plus grand nombre d'espèces de Caelifères soit 16
contre 12 pour le milieu non cultivé et 11 dans la palmeraie à
Ghardaïa. Par rapport aux 29 espèces recensées dans la
région d'étude, le taux d'Orthoptères communs aux 3
stations est de 6,9 %. Par contre le milieu cultivé et la palmeraie ont
un taux commun de 27,6 %.
IV - 2 - Bioécologie des principales
espèces acridiennes
IV - 2 - 1 - Biologie et Ecologie d'Acrotylus
patruelis
IV - 2 - 1 - 1 - Biologie
Acrotylus patruelis est une espèce commune
dans la région de Saria de zone soudanienne en Afrique de l'Ouest,
particulièrement pendant la saison des pluies. Les études et
observations faites dans cette région ont montrées, l'existence
de 3 générations annuelles chez A. patruelis avec une
diapause imaginale (Lecoq, 1978). Au Mali, Kone (1990) parle de reproduction
continue avec quatre générations par an. En Algérie selon
les travaux de Hamdi
46
(1989,1992) sur le littoral algérien, Guecioueur (1990)
dans la région de Lakhdaria, Bourahla (1990) dans la région de
Chréa et Ould El Hadj (1991) dans le Sahara septentrional, cette
espèce est à l'état imaginal durant une longue partie de
l'année et ne possède qu'une seule génération par
an. D'après Zergoun (1991), Douadi (1992) et Babaz (1992), A.
patruelis semble avoir 2 ou 3 générations annuelles dans la
région de Ghardaïa.
Tableau 16. Nombre de larves et d'imagos
d'Acrotylus patruelis par 45m2 en fonction du temps dans
deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
1
|
0
|
0
|
|
29 février
|
2L3 - 1L5
|
1
|
0
|
0
|
|
30 mars
|
1L5
|
1
|
1L4
|
2
|
|
30 avril
|
0
|
2
|
1L5
|
1
|
|
15 mai
|
0
|
3
|
0
|
1
|
|
15 juin
|
0
|
3
|
1L4
|
1
|
|
16 juillet
|
0
|
2
|
0
|
2
|
|
14 aout
|
0
|
4
|
0
|
1
|
|
14 septembre
|
1L4 - 1L5
|
4
|
1L5
|
1
|
|
18 octobre
|
1L5
|
3
|
1L5
|
2
|
|
15 novembre
|
2L4
|
4
|
1L5
|
1
|
|
26 décembre
|
1L2 - 1L3
|
1
|
0
|
0
|
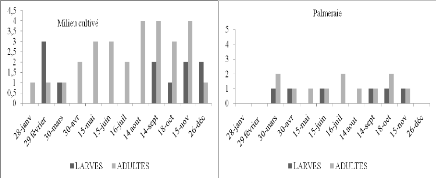
Figure 12. Nombre de larves et d'imagos
d'Acrotylus patruelis par 45m2 en fonction du temps dans
deux stations d'étude
Selon les histogrammes (Figure 12) obtenus à partir du
tableau 16, nous constatons que dans le milieu cultivé, l'espèce
est présente durant toute l'année à l'état imaginal
Les larves apparaissent de février à mars et de septembre
à décembre. Nous avons observé des pontes durant les mois
de juillet et août. C'est la ponte de la première
génération. En septembre, des L4 et L5 sont présentes,
cela veut dire que durant les mois précédents les L1, L2 et L3
ont
47
échappées à notre attention. De
même en palmeraie il y a des L4 en mars. Ainsi en février les L1,
L2, et L3 ont échappé également à notre attention.
Cela peut être dû soit à la faiblesse de la fréquence
des échantillonnages, soit aux déplacements des populations d'une
culture à l'autre ou d'un milieu à l'autre. Briki (1991) a
noté le même phénomène. Les différentes
observations spatio-temporelles montrent qu'A. patruelis semble
présenter une ou deux générations par an.
IV - 2 - 1 - 2 - Ecologie
Acrotylus patruelis semble avoir une large
distribution géographique affectant surtout les types de bioclimats
humides, sub-humides, semi-arides et arides, Sa répartition ne
dépend pas de l'altitude, puisque l `espèce est notée
aussi bien dans les stations littorales de basse altitude qu'à haute
altitude notamment à Tikjda. Au Sahara selon Ould El Hadj (1991) A.
patruelis a une grande répartition. Elle est observée jusque
dans l'extrême Sud du Sahara entre les 18ème et le
19èmeparallèle Nord. Cet Oedipodinae
préfère les endroits ensoleillés à faible taux
de recouvrement herbacé (Anonyme 1982; Kone, 1990; Zergoun, 1991;
Beggas, 1992). Ayant un régime alimentaire mixte, cette espèce a
une certaine importance économique dans le Sahara. Elle cause des
dégâts principalement sur les cultures maraichères (Ould El
Hadj, 1991). A. patruelis est capturée dans le milieu
cultivé et dans La palmeraie. Elle fréquente les endroits
sablonneux. Durant toutes les prospections nous n'avons jamais observé
cette espèce sur la végétation. Elle préfère
par conséquent les endroits ensoleillés. Un quart des effectifs
des espèces acridiennes du milieu cultivé est
représenté par Acrotylus patruelis. Ceci explique sa
grande importance dans ce milieu.
IV - 2 - 2 - Biologie et Ecologie d'Ochrilidia
gracilis
IV - 2 - 2 - 1- Biologie
Les adultes d'Ochrilidia gracilis apparaissent au
Nord du Sahara depuis mars Jusqu' en août et en novembre Par contre en
Arabie Saoudite les adultes sont observés uniquement en automne et au
printemps (COPR, 1982). Dans la région de Ghardaïa Douadi (1992) et
Babaz (1992), notent que les adultes de cette espèce sont
présents Jusqu'en novembre puis ils disparaissent durant l'hiver, pour
réapparaître à nouveau au printemps Selon ces auteurs
l'espèce hiverne à l'état larvaire et possède une
génération annuelle. Durant la période 19901991 les larves
de cette espèce sont présentes presque tout au long de
l'année tandis que les adultes sont observés durant
l'été seulement. Ces données ont permis de conclure
48
qu'O.gracilis pourrait avoir une seule
génération avec une diapause larvaire automno-hivernale (Zergoun,
1991).
Tableau 17. Nombre de larves et d'imagos
d'Ochrilidia gracilis par 45m2 en fonction du temps dans
deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
1
|
3L2 - 6L3
|
0
|
|
29 février
|
1L4
|
0
|
6L2 - 4L4
|
0
|
|
30 mars
|
1L5
|
1
|
3L4 - 1L5
|
3
|
|
30 avril
|
0
|
1
|
2L5
|
3
|
|
15 mai
|
0
|
3
|
0
|
3
|
|
15 juin
|
1L4 - 1L5
|
1
|
1L3 - 3L4 - 5L5
|
1
|
|
16 juillet
|
0
|
2
|
2L5
|
8
|
|
14 aout
|
0
|
3
|
2L5
|
5
|
|
14 septembre
|
1L4 - 1L5
|
2
|
1L4 - 1L5
|
7
|
|
18 octobre
|
0
|
2
|
2L3 - 2L4 - 1L5
|
6
|
|
15 novembre
|
0
|
2
|
4L3 - 2L4 - 1L5
|
6
|
|
26 décembre
|
0
|
0
|
1L2 - 7L3
|
0
|
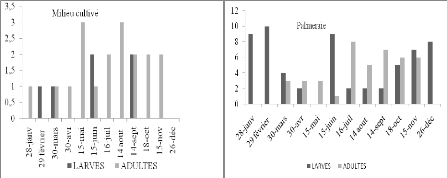
Figure 13. Nombre de larves et d'imagos
d'Ochrilidia gracilis par 45m2 en fonction du temps dans
deux stations d'étude.
D'après les histogrammes de la figure 13 obtenus
à partir du tableau 17 il est à constater qu'O. gracilis
semble présenter dans le milieu cultivé des larves
hivernantes. En effet les L4 de février confirment cette
hypothèse. D'ailleurs leurs effectifs sont trop faibles pour avoir une
autre explication. Vu que cette espèce fréquente les endroits
à végétation herbacée dense, il est difficile
d'observer les accouplements et les pontes de cette espèce. Il est
probable que cet acridien présente une seule génération
avec non seulement une hivernation larvaire mais également une
estivation larvaire. Dans la palmeraie nous avons trouvé des L2 durant
les mois
49
de janvier et février, des L3 en juin et durant la
période s'étalant d'octobre à décembre. De
même il semble que les larves subissent une hivernation et une
estivation. Il semble qu'Ochrilidia gracilis présente une
à deux générations annuelles.
IV - 2 - 2 - 2 - Ecologie
Ochrilidia gracilis est abondante dans les endroits
les plus humides particulièrement dans les plaines inondées par
les rivières. Elle se trouve aussi dans les marécages
salés littoraux de la Lybie (COPR, 1982). Vu qu'elle est toujours
capturée par des pièges lumineux, elle doit être
probablement très mobile. Chopard (1938) a classé le genre
Ochrilidia parmi les acridiens caractéristiques des
régions subdésertiques ou désertiques. Nous avons
capturé ce Gomphocerinae dans deux types de milieux, le milieu
cultivé et la palmeraie. Il est plus abondant dans la palmeraie milieu
caractérisé par une humidité élevée due
à une irrigation régulière. Par conséquent on
assiste à un développement très dense d'une
végétation graminéenne caractérisée
essentiellement par Setaria verticillata. Cet acridien peut se
dissimuler facilement dans les touffes d'herbes. Dans la palmeraie plus de 66 %
des individus acridiens sont représentés par Ochrilidia
gracilis.
IV - 2 - 3 - Biologie et Ecologie d'Aiolopus
strepens
IV - 2 - 3 - 1 - Biologie
En France Aiolopus strepens présente une seule
génération annuelle. Les individus deviennent adultes la fin de
l'été, la maturité et la ponte des oeufs ont lieu au
printemps. En Afrique du Nord, les adultes sont notés tout au long de
l'année (COPR, 1982). D'après les travaux de Hamdi (1989) dans la
région médio-septentrionale de l'Algérie, de Benrima
(1990) dans la région de Koléa de Guecioueur (1990) dans la
région de Lakhdaria, de Fellaouine (1989) dans la région de
Sétif de Zergoun (1991) et de Douadi (1992) dans la région de
Ghardaïa ; Aiolopus strepens est présente à
l'état adulte pendant presque toute l'année. Les larves quant
à elles commencent a apparaître au mois d'avril. Ces auteurs
notent que A.strepens présente une seule
génération annuelle et passe l`hiver à l'état
imaginal. D'après les histogrammes de la figure 14 obtenus à
partir du tableau 18, les larves de cet Acridinae commencent à
apparaître dans le milieu cultivé à partir de mars. Durant
ce mois nous avons trouvé des L5. Vu les conditions difficiles du milieu
durant la période de janvier à février, les autres stades
larvaires ont dû se cacher pour échapper aux intempéries.
Des L3 ont été trouvées pendant les mois allant de Juillet
à novembre. Cette espèce n'est pas très commune dans la
palmeraie. C'est pour cette raison que nous 1`avons trouvé uniquement
trois fois
50
pendant l'année. Nous avons noté dans la
palmeraie la présence des L4 en mai et des L5 en novembre.
D'après ces observations, il est probable que cet Orthoptère
présente une seule génération annuelle.
Tableau n° 18 : Nombre de larves et
d'imago d'Aiolopus strepens par 45m2 en fonction du temps
dans deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
0
|
0
|
|
29 février
|
0
|
0
|
0
|
0
|
|
30 mars
|
1L5
|
0
|
0
|
0
|
|
30 avril
|
1L4
|
0
|
0
|
0
|
|
15 mai
|
1L5
|
0
|
1L4
|
2
|
|
15 juin
|
1L4
|
1
|
0
|
0
|
|
16 juillet
|
1L3
|
1
|
0
|
0
|
|
14 aout
|
1L5
|
2
|
0
|
1
|
|
14 septembre
|
1L5
|
3
|
0
|
0
|
|
18 octobre
|
1L5
|
4
|
0
|
0
|
|
15 novembre
|
0
|
3
|
1L5
|
0
|
|
26 décembre
|
0
|
1
|
0
|
0
|
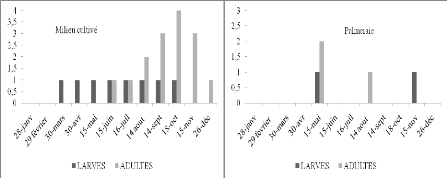
Figure 14. Nombre de larves et d'imago
d'Aiolopus strepens par 45m2 en fonction du temps dans deux
stations d'étude.
IV - 2 - 3 - 2 - Ecologie
Aiolopus strepens est une espèce commune dans
les endroits incultes (Chopard, 1943 ; 1965). En Algérie divers auteurs,
Hamdi (1989), Guecioueur (1990), Tamzait (1990), et Bourahla (1990) notent
qu'A. strepens a une préférence pour les endroits
humides et supporte des températures moyennes Elle est vue
particulièrement dans les milieux à recouvrement herbacé
moyen ou dense. A.strepens est très mobile, car des
individus ont été observés faisant
51
plusieurs kilomètres de vol (COPR, 1982). Benrima
(1990) mentionne qu'A.strepens habite divers biotopes : maquis, friche
et milieu cultivé. Nous avons trouvé cet Acridinae dans
le milieu cultivé et dans la palmeraie. Cette espèce
présente une grande importance numérique dans le milieu
cultivé après A.patruelis. Cet acridien fréquente
les endroits un peu humides comme les parcelles de menthe. Il est rarement vu
dans les endroits nus.
IV - 2 - 4 - Biologie et Ecologie de Sphingonotus
rubescens
IV - 2 - 4 - 1 - Biologie
A Sétif (Fellaouine, 1989) et à Ghardaïa
(Babaz, 1992) notent que Sphingonotus rubescens présente une
seule génération par an avec une diapause embryonnaire
automno-hivernale.
Tableau 19. Nombre de larves et d'imagos de
Sphingonotus rubescens par 45m2 en fonction du temps dans
le milieu non cultivé.
|
Prélèvements durant 1992
|
Nombre d'individus
|
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
|
29 février
|
0
|
0
|
|
30 mars
|
0
|
0
|
|
30 avril
|
1L2
|
0
|
|
15 mai
|
1L2 - 1L3
|
0
|
|
15 juin
|
1L3 - 1L4
|
1
|
|
16 juillet
|
0
|
1
|
|
14 aout
|
0
|
1
|
|
14 septembre
|
0
|
1
|
|
18 octobre
|
0
|
1
|
|
15 novembre
|
0
|
1
|
|
26 décembre
|
0
|
0
|
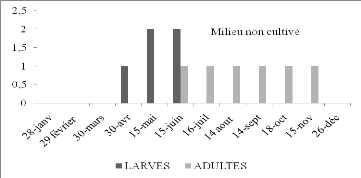
Figure 15. Nombre de larves et d'imagos de
Sphingonotus rubescens par 45m2 en fonction du temps dans
le milieu non cultivé.
52
Les premières larves de S.rubescens, selon
Zergoun (1991) apparaissent au mois de mars. L'espèce est
présente à l'état adulte à partir du mois de
juillet à décembre. Elle semble avoir une seule
génération annuelle. D'après l'histogramme (Figure 15)
obtenu à partir du tableau n°15 nous pouvons constater que les
larves de cet Oedipodinae commencent à apparaître
à partir du mois d'avril ce qui nous amène à penser que
l'éclosion a eu lieu probablement au mois de mars. Nous avons
capturé les premiers adultes durant le mois de juin. De ces
résultats il apparaît que l'espèce présente le cycle
typique d'une espèce à une seule génération
annuelle et hiverne à l'état embryonnaire.
IV - 2 - 4 - 2 - Ecologie
Selon Chopard (1943), Sphingonotus rubescens ne se
trouve guère que dans les endroits à peu près
désertiques. Elle est très vive et vole rapidement au soleil. Sa
capture est signalée aussi durant la nuit attirée par la
lumière des lampes. Elle semble fréquenter des milieux
très arides et dénudés où les températures
estivales sont élevées et où la pluviométrie est
inférieure à 500mm par an (Fellaouine, 1989). Beggas (1992), note
que cet Oedipodinae préfère les milieux salés.
Selon Zergoun (1991) cette espèce est très mobile. En effet 40
individus ont été capturés en dessous d'une lampe
allumée pendant la nuit durant une demi-heure au mois d'août de
l'année 1990. Sphingonotus rubescens a pullulé en 1986
dans la région de Ghardaïa et a causé d'importants
dégâts aux pâturages (Chara, 1987). Nous avons
capturé cette espèce uniquement au niveau du milieu non
cultivé, caractérisé par un sol rocailleux,
extrêmement sec et chaud en été. Cet acridien peut envahir
les milieux cultivés et les palmeraies durant les chaleurs estivales. Il
semble que le genre Sphingonotus, présente une grande
tolérance vis à vis de la chaleur.
IV - 2 - 5 - Biologie et Ecologie de Pyrgomorpha
cognata
IV - 2 - 5 - 1 - Biologie
Au Mali selon Kone (1990) et au Togo d'après Kabassina
(1990). P. cognata est une espèce à reproduction
continue avec trois générations annuelles. Les larves et les
adultes sont présents durant toute l'année. Les
développements embryonnaires et larvaires sont plus longs en saison
sèche qu'en saison des pluies. Babaz (1992), note que
P.cognata présente dans la région de
Ghardaïa une seule génération annuelle avec une diapause
larvaire automno-hivernale. Dans la région de Ghardaïa Zergoun
(1991) a signalé que durant la période 19901991 à
l'exception du mois de Janvier où l'espèce est capturée
seulement à l'état larvaire le restant de l`année elle est
capturée aussi bien aux états larvaires qu'à l'état
adulte. Elle semble
53
avoir une reproduction continue. D'après les
histogrammes (Figure 16) obtenus à partir du tableau 20, il est à
constater que P.cognata est présente dans le milieu
cultivé trois fois pendant l'année à l'état
larvaire seulement.
Tableau 20. Nombre de larves et d'imagos de
Pyrgomorpha cognata par 45m2 en fonction du temps dans
trois stations d'étude.
|
Prélèvements durant 1992
|
Nombres d'individus
|
|
Milieu non cultivé
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
1L3
|
0
|
0
|
0
|
|
29 février
|
0
|
0
|
1L4
|
0
|
0
|
0
|
|
30 mars
|
0
|
1
|
0
|
1
|
1L3
|
1
|
|
30 avril
|
0
|
0
|
1L5
|
1
|
0
|
0
|
|
15 mai
|
0
|
0
|
1L4 - 1L5
|
0
|
1L4
|
0
|
|
15 juin
|
0
|
0
|
0
|
1
|
1L5
|
0
|
|
16 juillet
|
0
|
0
|
1L4
|
1
|
0
|
1
|
|
14 aout
|
1L5
|
0
|
0
|
2
|
0
|
0
|
|
14 septembre
|
0
|
0
|
0
|
1
|
0
|
1
|
|
18 octobre
|
0
|
0
|
0
|
1
|
0
|
0
|
|
15 novembre
|
1L3
|
0
|
0
|
0
|
1L4
|
0
|
|
26 décembre
|
1L3
|
0
|
1L4
|
0
|
0
|
0
|
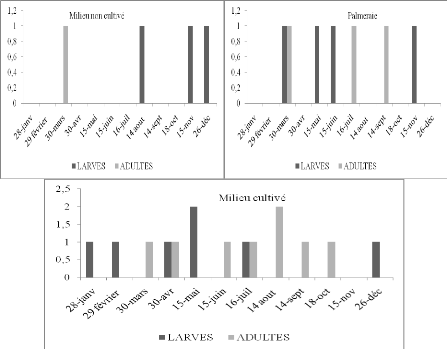
Figure 16. Nombre de larves et d'imagos de
Pyrgomorpha cognata par 45m2 en fonction du temps dans
trois stations d'étude.
54
Nous avons trouvé les L3 au mois de janvier et les L4
au mois de février, puis des L5 en avril, enfin des L4 en
décembre. De même la palmeraie présente aussi des larves en
mars, en mai et juin et enfin en novembre. Par contre le milieu non
cultivé où l'espèce semble être rare, nous avons
trouvé cette espèce 4 fois pendant toute l'année. Les
larves ont été trouvées en août puis en novembre et
en décembre. Les imagos sont plus fréquents dans le milieu
cultivé. Par contre ils sont rares dans les deux autres milieux. Compte
tenu de la faiblesse des effectifs, il est difficile de conclure.
D'après les résultats il est possible que P. cognata
développe 2 générations annuelles.
IV - 2 - 5 - 2 - Ecologie
Pyrgomorpha cognata préfère les
habitats secs où elle peut se nourrir d'arbustes du désert (COPR,
1982). Au Togo, Kabassina (1990), note que cette espèce peut s'attaquer
à plusieurs plantes : coton, arachide et le blé. Les principaux
dégâts sont notés sur le mil et sur les cultures
maraîchères. Dans la région de Ghardaïa Babaz (1992) a
capturé cette espèce dans trois types de stations en milieux
cultivé et non cultivé et en palmeraie. Dans le milieu
cultivé elle fréquente les parcelles de menthe à fort
recouvrement. Dans le milieu non cultivé elle est observée sur
les sols sablonneux nus à proximité des touffes de Thymelaea
microphylla et Oudneya africana. Dans la palmeraie elle est
essentiellement capturée au niveau des endroits ensoleillés
caractérisés par un très faible recouvrement
herbacé à base de Cynodon dactylon. Nous avons
signalé P.cognata dans les trois milieux d'étude avec un
effectif moins important par rapport à la période 1990-1991
où nous avons enregistré 170 individus tandis que pour
l'année 1992 nous avons capturé uniquement 26 individus. Cela est
dû probablement aux conditions du milieu qui tantôt gênent ou
tantôt favorisent la pullulation de cette espèce. P.cognata
tolère des milieux très variés, puisqu'elle supporte
les alternances des variations de température et
d'hygrométrie.
IV - 2 - 6 - Biologie et Ecologie de Truxalis
nasuta
IV - 2 - 6 - 1 - Biologie
A Sétif comme à Lakhdaria, T. nasuta
présente une seule génération annuelle (Fellaouine,
1989 ; Guecioueur. 1990). Dans la région de Ghardaïa les adultes de
cette espèce sont capturés durant une grande période de
l'année de septembre à mai. T. nasuta est univoltine
avec une diapause larvaire automno-hivernale (Babaz, 1992). Elle est
présente pendant une grande partie de la période 1990-1991
à l'état larvaire dans la région de Ghardaïa. Les
adultes de cet Orthoptère commencent à apparaître
dès la fin du mois d'avril.
55
Ils sont présents jusqu'au mois d'août. La
dissection d'une femelle au cours de ce mois montre la présence
d'ovocytes mûrs. Donc la ponte a probablement eu lieu en
août-septembre. Quant au développement larvaire il s'étend
Jusqu'au mois d'avril (Zergoun, 1991).
Tableau 21. Nombre de larves et d'imagos de
Truxalis nasuta par 45m2 en fonction du temps dans trois
stations d'étude
|
Prélèvements durant 1992
|
Nombres d'individus
|
|
Milieu non cultivé
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
0
|
0
|
0
|
0
|
|
29 février
|
1L3
|
0
|
1L4
|
0
|
0
|
0
|
|
30 mars
|
0
|
0
|
1L5
|
0
|
0
|
0
|
|
30 avril
|
0
|
0
|
1L5
|
1
|
0
|
1
|
|
15 mai
|
0
|
0
|
0
|
1
|
0
|
1
|
|
15 juin
|
0
|
0
|
1L5
|
0
|
0
|
0
|
|
16 juillet
|
0
|
0
|
0
|
1
|
0
|
0
|
|
14 aout
|
0
|
1
|
0
|
1
|
0
|
0
|
|
14 septembre
|
0
|
1
|
0
|
1
|
0
|
0
|
|
18 octobre
|
0
|
0
|
1L3
|
0
|
1L2
|
0
|
|
15 novembre
|
1L3
|
0
|
0
|
0
|
1L2
|
0
|
|
26 décembre
|
0
|
0
|
0
|
0
|
0
|
0
|
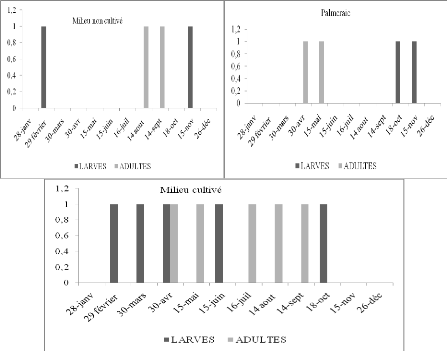
Figure 17. Nombre de larves et d'imagos de
Truxalis nasuta par 45m2 en fonction du temps dans trois
stations d'étude
56
D'après les histogrammes (Figure 17) obtenus à
partir du tableau 21 des L3 de ce Truxalinae ont été
capturées dans le milieu cultivé et non cultivé durant le
mois d'octobre. Dans la palmeraie nous avons noté des L2 durant les mois
d'octobre et novembre. Les accouplements et les pontes ont sûrement
échappé notre attention. Nous avons trouvé
également des larves dans le milieu cultivé durant les mois de
février à avril et de Juin. Durant les mois d'août et de
septembre nous avons noté des imagos dans les milieux cultivés et
non cultivé. Il est difficile de conclure sur le nombre de
générations annuelles de Truxalis nasuta, vu la
faiblesse des effectifs.
IV - 2 - 6 - 2 - Ecologie
Dans la région de Lakhdaria, Guecioueur (1990), a
capturé Truxalis nasuta dans deux types de stations, au niveau
du milieu cultivé où elle occupe les bordures infestées de
mauvaises herbes et au niveau du maquis où elle présente un
effectif assez important. T.nasuta fréquente tous les milieux
de la région de Ghardaïa ; milieu cultivé, milieu non
cultivé et palmeraie (Babaz, 1992; Douadi, 1992). D'après Chopard
(1943) cette espèce est signalée dans les différentes
localités, des plaines côtières jusqu'au Sud
Algérien. Lors de nos prospections nous avons capturé cet
acridien dans toutes les stations d'étude. Elle est présente
aussi bien dans les endroits humides que dans les endroits secs. Au niveau du
milieu cultivé ce Truxalinae fréquente les endroits
à végétations sèches. Nous avons également
constaté que T.nasuta change de couleur en fonction de son
milieu ce qui nous amène à dire que cet acridien présente
le phénomène d'homochromie.
IV - 2 - 7- Biologie et Ecologie d'Heteracris
harterti
IV - 2 - 7- 1 - Biologie
Les adultes du genre Heteracris apparaissent à
partir de la fin de mai et au début de juin. Ils sont observés
durant le reste de l'été (COPR, 1982). Dans la région de
Ghardaia, les adultes de cette espèce sont présents du mois de
juillet jusqu'en décembre. Quant aux larves, elles sont observées
au mois de janvier (Zergoun, 1991). D'après les histogrammes (Figure 18)
obtenus à partir du tableau 22, il est à constater que les larves
d'Heteracris harterti apparaissent dès le mois de juin dans le
milieu cultivé. Cette espèce est absente pendant la mauvaise
saison à l'état embryonnaire. Les imagos ont été
capturés de juillet à novembre. H.harterti est
accidentelle dans la palmeraie. Nous l'avons trouvé une seule fois
pendant toute l'année d'étude. De ces résultats il semble
qu'Heteracris harterti ne présente qu'une seule
génération annuelle.
57
Tableau 22. Nombre de larves et d'imagos
d'Heteracris harterti par 45m2 en fonction du temps dans
deux stations d'étude.
|
Prélèvements
durant 1992
|
Nombre d'individus
|
|
Milieu cultivé
|
Palmeraie
|
|
Larves
|
Imagos
|
Larves
|
Imagos
|
|
28 janvier
|
0
|
0
|
0
|
0
|
|
29 février
|
0
|
0
|
0
|
0
|
|
30 mars
|
0
|
0
|
0
|
0
|
|
30 avril
|
0
|
0
|
0
|
0
|
|
15 mai
|
0
|
0
|
0
|
0
|
|
15 juin
|
1L3
|
0
|
0
|
0
|
|
16 juillet
|
1L2 - 1L3
|
1
|
0
|
0
|
|
14 aout
|
1L5
|
1
|
0
|
1
|
|
14 septembre
|
1L4
|
2
|
0
|
0
|
|
18 octobre
|
0
|
2
|
0
|
0
|
|
15 novembre
|
1L4 - 1L5
|
2
|
0
|
0
|
|
26 décembre
|
0
|
0
|
0
|
0
|
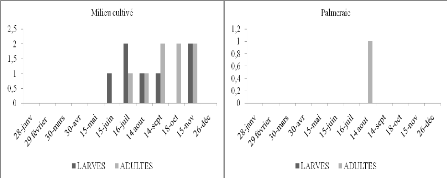
Figure 18. Nombre de larves et d'imagos
d'Heteracris harterti par 45m2 en fonction du temps dans
deux stations d'étude.
IV - 2 - 7- 2 - Ecologie
Heteracris harterti fréquente
généralement les buissons denses et t es arbustes dans lesquels
elles s'abritent en cas de danger (Mestre, 1988). Cet Eyprepocnemidinae
est présent aussi bien dans les zones semi désertiques que
dans les Oasis (COPR, 1982). Nous avons trouvé H.harterti dans
la palmeraie et le milieu cultivé. Cette espèce fréquente
uniquement les parcelles de tomate, d'aubergine et de courge. Les
dégâts dûs au genre Heteracris sont très
bien connus dans les parcelles de courge où nous avons observé en
1992 une superficie de 40m2 entièrement endommagée.
58
IV - 2 - 8 - Biologie et Ecologie d'Anacridium
aegyptium
IV - 2 - 8 - 1 - Biologie
Chopard (1965) note que Anacridium aegyptium est
adulte au mois de septembre, hiverne à cet état et pond au
printemps. Cette espèce a été observée à
l'état adulte au mois de mars dans la région de la Mitidja par
Benarbia (1990) et dans la région de Tizi-Ouzou par Mezreb (1993). Selon
Guecioueur (1990), A. aegyptium est capturé dans la
région de Lakhdaria à l'état adulte dès le mois
d'octobre. Des individus ont été observés en accouplement
en février. La ponte, quant à elle est notée à la
fin de mars. L'éclosion commence probablement en fin printemps
début été, et le développement larvaire s'effectue
durant la période estivale. A. aegyptium est une espèce
univoltine à hivernation imaginale (Fellaouine ,1989). D'après
COPR (1982), les adultes de cette espèce apparaissent souvent et
seulement à la fin de l'été. Ils hivernent sur les hautes
plantes et dans les arbres.
Tableau 23. Nombre de larves et d'imagos
d'Anacridium aegyptium par 45m2 en fonction du temps dans
le milieu cultivé.
|
Prélèvements durant 1992
|
Nombre d'individus
|
|
Larves
|
imagos
|
|
28 janvier
|
0
|
1
|
|
29 février
|
0
|
1
|
|
30 mars
|
0
|
1
|
|
30 avril
|
0
|
0
|
|
15 mai
|
0
|
0
|
|
15 juin
|
1L4 - 1L5
|
0
|
|
16 juillet
|
1L3 - 1L4
|
0
|
|
14 aout
|
2L4 - 1L5
|
0
|
|
14 septembre
|
2L5
|
1
|
|
18 octobre
|
1L5
|
1
|
|
15 novembre
|
0
|
1
|
|
26 décembre
|
0
|
2
|
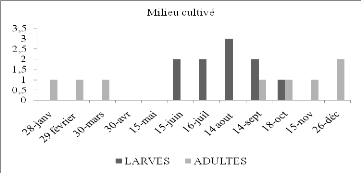
Figure 19. Nombre de larves et d'imagos
d'Anacridium aegyptium par 45m2 en fonction du temps dans
le milieu cultivé.
59
L'histogramme (Figure 19) obtenu à partir du tableau
23, montre que A. aegyptium est à l'état larvaire
pendant la période estivo-automnale s'étalant de juin à
octobre. Les premiers adultes apparaissent dès le mois de septembre
jusqu'au mois de mars. On remarque l'absence des individus de cette
espèce durant les mois d'avril et de mai. Les faits observés
révèlent l'existence, chez A. aegyptium d'une seule
génération annuelle. Cet acridien passe l'hiver à
l'état imaginal.
IV - 2 - 8 - 2 - Ecologie
Anacridium aegyptium préfère les
endroits cultivés, surtout les haies et les arbustes, il est très
commun dans les Oasis (Chopard, 1943). Selon Fellaouine (1989), cette
espèce fréquente les jeunes forêts, les buissons, les
arbustes près des Oueds et les jardins, près des habitations. Ces
lieux sont généralement plus ou moins humides où la
température est tamponnée par la végétation. Nous
avons capturé cet Orthoptère dans le milieu cultivé ainsi
qu'en dehors des stations d'étude, spécialement dans les
Oasis.
IV - 2 - 9 - Conclusion
Il est difficile de conclure à propos du nombre de
génération par an. Cela est dû au fait que nous avons eu
des effectifs trop faibles. A la lumière de ces résultats il faut
penser à changer les méthodes d'investigation utilisées.
Etant donné que nous avons échantillonné dans 5 quadrats
de 9m2 par station, et nous avons réalisé une sortie
seulement par mois, il est évident que plusieurs aspects concernant le
cycle biologique des différentes espèces acridiennes
étudiées ont dû échapper à notre attention.
Donc nous proposons à ce que l'aspect biologique soit
étudié avec beaucoup plus d'attention en modifiant le protocole
expérimental. Il faut augmenter le nombre de quadrats et la
fréquence des échantillonnages. L'examen de l'état des
ovarioles des femelles tout au long de l'année peut aussi
préciser les observations faites sur le terrain. Il est
préférable également d'effectuer des élevages au
laboratoire pour mieux contrôler les conditions de développement
des espèces d'Orthoptères. Il vaut mieux faire 2 sorties sur le
terrain par station et par mois et 10 quadrats de 9m2 chacun au lieu
de 5 quadrats à chaque fois. Malgré ces précautions il est
possible que des lacunes apparentes demeurent prouvant que la plupart des
espèces changent de milieu au cours de l'année, Les larves et les
imagos n'ayant pas les mêmes exigences bioécologiques,
température, humidité et nourriture.
60
CHAPITRE V : Analyse statistique et écologique des
résultats V - 1 - Analyse statistique des résultats
V - 1 - 1 - Analyse factorielle des
correspondances
V - 1 - 1 - 1- Résultats
Pour l'interprétation de l'analyse factorielle des
correspondances, nous nous
sommes basés sur les espèces et les relevés
à forte contribution relative.
Tableau 24. Contribution à l'inertie
totale ou pourcentage expliqués par les axes principaux.
|
Axes
|
1
|
|
2
|
|
3
|
|
4
|
|
|
Contribution à l'inertie totale
|
71,0
|
%
|
29,0
|
%
|
0,0
|
%
|
0,0
|
%
|
Les deux premiers axes 1 et 2 totalisent 100 % de l'inertie
totale. La prise en considération des axes 3 et 4 est inutile.
Tableau 25. Contributions relatives aux
espèces d'Orthoptères ou variables sur l'axe 1 et 2
|
Espèces
|
Code
|
Axe 1
|
Axe 2
|
|
Tuarega insignis
|
TUI
|
6 ,2
|
0,0
|
|
Tenuitarsus angustus
|
TEA
|
1,8
|
5,6
|
|
Pyrgomorpha cognata
|
PYG
|
0,0
|
0,4
|
|
Pyrgomorpha conica
|
PYC
|
0,6
|
15,8
|
|
Dericorys millierei
|
DEM
|
6,3
|
0,0
|
|
Calliptamus barbarus
|
CAB
|
1,6
|
5,6
|
|
Heteracris harterti
|
HEH
|
3,7
|
0,9
|
|
Heteracris annulosa
|
HEA
|
1,8
|
5,6
|
|
Heteracris adspersa
|
HED
|
1,7
|
5,6
|
|
Anacridium aegyptium
|
ANE
|
1,6
|
5,6
|
|
Schistocerca gregaria
|
SCG
|
6,3
|
0,0
|
|
Acrida turrita
|
ACT
|
1,6
|
5,7
|
|
Aiolopus strepens
|
AIS
|
3,7
|
0,9
|
|
Aiolopus thalassinus
|
AIT
|
3,7
|
0,9
|
|
Acrotylus patruelis
|
ACP
|
3,7
|
1,3
|
|
Acrotylus longipes
|
ACL
|
1,6
|
5,6
|
|
Hyalorrhipis calcarata
|
HYC
|
6,3
|
0,0
|
|
Sphingonotus caerulans
|
SPC
|
6,3
|
0,0
|
|
Sphingonotus azurescens
|
SPA
|
6,3
|
0,0
|
|
Sphingonotus obscuratus lameerei
|
SPO
|
6,3
|
0,0
|
|
Sphingonotus rubescens
|
SPR
|
6,2
|
0,0
|
|
Pseudosphingonotus savignyi
|
SPS
|
6,2
|
0,0
|
|
Wernerella pachecoi
|
WEP
|
6,2
|
0,0
|
|
Ochrilidia geniculata
|
OCE
|
1,6
|
5,6
|
|
Ochrilidia gracilis
|
OCG
|
3,7
|
1,3
|
|
Omocestus raymondi
|
OMR
|
0,6
|
15,8
|
|
Omocestus lucasii
|
OML
|
0,6
|
15,8
|
|
Truxalis nasuta
|
TRN
|
0,0
|
0,4
|
|
Paratettix meridionalis
|
PAM
|
3,7
|
1,3
|
Il convient de ne fonder l'interprétation d'un axe que
sur les éléments qui apportent à cet axe les plus fortes
contributions suffisantes pour expliquer le maximum de l'inertie de cet axe. Or
les éléments qui contribuent le plus à la construction de
l'axe sont ceux qui s'écartent do son origine donc ceux qui
présentent les coordonnées les plus élevées. C'est
ainsi que sur les quatre axes que nous donnent le programme utilisé,
nous ne retenons que le premier et le deuxième axe, qui nous semble
être les seuls axes interprétables sur le plan écologique,
d'autant plus que leur somme est de 100 % (Benzekri, 1973). Nous avons
consigné nos résultats dans les tableaux 24 et 25 suivants.




61
Figure 20. Carte factorielle axe (1-2) des
espèces d'Orthoptères.
V - 1 - 1 - 2- Discussion
Il ressort de la figure 20 que les trois stations 001, 002 et
003 se retrouvent dans 3 quadrants différents. Cela s'explique par les
différences de composition en espèces des peuplements
Orthoptérologiques de ces stations. La contribution à l'inertie
totale des peuplements Orthoptérologiques à la formation de l'axe
1 est de 71 % (tableau 24). Cet axe correspond à la
caractéristique écologique majeure du peuplement acridien de la
région de Ghardaïa. En effet une nette différence
apparaît du côté positif (droite) vers le côté
négatif (gauche). Le deuxième axe absorbe 29 % de l'inertie
totale. Dans cet axe on note une
62
séparation entre le peuplement acridien
caractérisant la palmeraie et le peuplement acridien
caractérisant les milieux cultivés et non cultivés. Si
l'on considère l'ensemble des espèces acridiennes sur le plan
défini par les axes 1 et 2 de la figure 19 on observe cinq groupements
de Caelifères. Le groupement Pyrgomorpha conica (PYC),
Omocestus raymondi (OMR) et Omocestus lucasii (OML) (tableau
25). Ces espèces caractérisent la palmeraie car on ne les trouve
uniquement qu'à ce niveau. De même Babaz (1992) note que le genre
Omocestus forme un ensemble à part qui a une affinité
envers les palmeraies. Il a donc une tendance d'après le même
auteur vers les milieux couverts et légèrement
ensoleillés. Par contre Douadi (1992) signale Aiolopus thalassinus
comme étant une espèce caractérisant les milieux
très humides à végétation dense comme la palmeraie.
Le groupement B colonise le milieu cultivé et la palmeraie. Ces
espèces sont Acrotylus patruelis (ACP), Ochrilidia gracilis
(OCG), Heteracris harterti (HEH), Aiolopus strepens
(AIS), A. thalassinus (AIT) et Paratettix meridionalis
(PAM). Le groupement C groupe les espèces acridiennes qui se trouvent
uniquement dans le milieu cultivé. Ces espèces sont Acrotylus
longipes (ACL) Tenuitarsus angustus (TEA), Ochrilidia
geniculata (OCE), Calliptamus barbarus (CAB), Heteracris
adspersa (HED), Heteracris annulosa (HEA), Anacridium
aegyptium (ANE) et Acrida turrita (ACT). Par contre Babaz (1992)
cite les deux premières espèces du groupement C parmi les
acridiens qui se trouvent dans les milieux secs. Cela est dû probablement
au fait que Tenuitarsus angustus et Acrotylus longipes
préfèrent les endroits sablonneux. Le groupement D
caractérise les espèces d'Orthoptères qui se trouvent
uniquement dans le milieu non cultivé, Ces espèces sont
Tuarega insignis, Dericorys millierei, Schistocerca gregaria,
Hyalorrhipis calcarata, Sphingonotus caerulans, S. azurescens, S. obscuratus
lameerei, S. rubescens, Pseudosphingonotus savignyi et Wernerella
pachecoi. Enfin le groupement E englobe les espèces qui
fréquentent divers biotopes, il s'agit de Pyrgomorpha cognata
(PYG) et Truxalis nasuta (TRN). Ces deux espèces sont
aussi signalées par Ould El Hadj (1991), Babaz (1992) et Douadi (1992)
comme étant des acridiens qui tolèrent les conditions de
différents milieux. Selon l'axe 1, les acridiens se répartissent
en fonction de leurs affinités écologiques. La position de chaque
espèce sur cet axe exprime son degré vis-à-vis d'un
ensemble de facteurs écologiques tels que l'humidité, la
luminosité, et le couvert végétal. En effet, les
espèces qui préfèrent l'humidité vivent dans les
endroits moins ensoleillés et fréquentent les parcelles à
recouvrement herbacé dense sont situées du côté
positif de l'axe 1, telles Paratettix meridionalis et Ochrilidia
gracilis. Du côté négatif de l'axe 1 on retrouve les
espèces xérophiles c'est à dire celles qui
préfèrent vivrent dans les endroits secs. Ces derniers sont
caractérisés par une végétation très
éparse et une très forte luminosité Nous pouvons citer
63
entre autre Tuarega insignis et Dericorys
millierei. Les différents gradients qui sont le gradient
d'humidité, le gradient de luminosité et le gradient de
végétation varient de gauche à droite du milieu le plus
sec, le plus ensoleillé et à végétation
dispersée vers le milieu le plus humide, le moins ensoleillé et
à végétation plus dense. Au voisinage de l'origine se
trouve un groupe d'espèces qui tolèrent les différents
types de milieux telles que Truxalis nasuta et Pyrgomorpha
cognata. Ould El Hadj (1991) signale Aiolopus strepens et
Heteracris adspersa dans les milieux plus ou moins secs. Par contre
nos résultats et ceux de Douadi (1992) les classent dans les endroits
plus ou moins humides. Au voisinage de l'origine se trouve un groupe
d'espèces qui sont relativement indifférentes vis-à-vis du
facteur humidité, C'est encore le cas de Truxalis nasuta et de
Pyrgomorpha cognata. Sur l'axe 1 et 2 les espèces se
répartissent en fonction de leur présence dans les milieux
d'études. Ainsi sur la partie positive de l'axe 2 nous retrouvons les
espèces qui fréquentent la palmeraie telle Pyrgomorpha
conica, sur la partie négative nous avons les espèces du
milieu cultivé telle Acrotylus longipes, espèce qui a
été signalée par Babaz (1992) dans les milieux non
cultivés et par Ould El Hadj (1991) comme étant une espèce
qui fréquente les différents biotopes. De plus nous avons aussi
dans la partie négative de l'axe 2 les espèces
caractérisant le milieu non cultivé, telle que Tuarega
insignis. Près de l'origine des 2 axes se retrouvent toujours les
deux espèces peu exigeantes Truxalis nasuta et Pyrgomorpha
cognata présentes dans Les trois milieux. La position des
espèces acridiennes sur l'axe 2 semble donc renseigner sur leur
degré d'affinité vis-à-vis des biotopes. Ainsi
l'importance de la composition floristique des milieux est également un
facteur très important dans la distribution des acridiens dans les
différents biotopes.
V - 1 - 1 - 3- Conclusions
Les stations 001, 002 et 003 appartiennent à 3
quadrants différents parce qu'elles sont différentes en
espèces Orthoptériennes. Les espèces sont réparties
selon un gradient horizontal de gauche à droite horizontal
d'hygrométrie et de végétation croissante, ainsi que de
luminosité décroissante. Dans le groupe de Tuarega insignis
et de Dericorys millierei, les espèces sont
xérophiles. A l'opposé Paratettix meridionalis et
Ochrilidia gracilis sont hygrophiles. A l'origine on retrouve
Pyrgomorpha cognata et Truxalis nasuta, deux acridiens
mésohygrophiles.
64
V - 1 - 2 - Fréquence relative
Selon Voisin (1980), la fréquence permet de dire si une
espèce est commune, rare ou très rare. La fréquence a
déjà été employée dans de nombreux travaux,
dont ceux de Dreux (1962), Voisin (1996; 1990) et Eulalia et al
(1985).
V - 1 - 2 - 1 - Résultats
Tableau 26. Fréquences relatives des
espèces d'Orthoptères dans le milieu cultivé à Beni
Isguen en fonction du temps.
|
Mois Espèces
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus patruelis
|
25
|
50
|
28,5
|
15,4
|
25
|
21,4
|
12,5
|
17,9
|
25
|
21
|
33,3
|
50
|
|
Acrotylus longipes
|
0
|
12,5
|
0
|
7,7
|
0
|
7,1
|
6,2
|
4,3
|
4,2
|
5,3
|
0
|
0
|
|
Aiolopus strepens
|
0
|
0
|
14,3
|
7,7
|
8,3
|
14,3
|
12,5
|
13
|
16,6
|
26,3
|
16,6
|
16,6
|
|
Aiolopus thalassinus
|
0
|
0
|
0
|
15,4
|
8,3
|
7,1
|
6,2
|
4,3
|
8,3
|
5,3
|
11,1
|
0
|
|
Acrida turrita
|
0
|
0
|
0
|
7,7
|
8,3
|
0
|
12,5
|
0
|
0
|
0
|
0
|
0
|
|
Anacridium aegyptium
|
0
|
0
|
0
|
0
|
0
|
7,1
|
6,25
|
4,35
|
0
|
0
|
0
|
0
|
|
Calliptamus barbarus
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4 ,3
|
0
|
0
|
0
|
0
|
|
Heteracris harterti
|
0
|
0
|
0
|
0
|
0
|
7,1
|
12,5
|
8.7
|
12,5
|
10,5
|
22,2
|
0
|
|
Heteracris adspersa
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4,3
|
8,3
|
5,3
|
5,5
|
0
|
|
Heteracris annulosa
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4,3
|
0
|
0
|
0
|
0
|
|
Ochrilidia gracilis
|
25
|
12,5
|
14,3
|
7,7
|
25
|
21,4
|
12,5
|
13
|
16,6
|
10,5
|
11,1
|
0
|
|
Ochrilidia geniculata
|
0
|
0
|
0
|
7,7
|
0
|
0
|
0
|
4,3
|
0
|
5,3
|
0
|
0
|
|
Paratettix meridionalis
|
25
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
16,6
|
|
Pyrgomorpha cognata
|
25
|
12,5
|
14,3
|
7,7
|
16,6
|
7,1
|
12,5
|
8,7
|
4,1
|
5,3
|
0
|
16,6
|
|
Truxalis nasuta
|
0
|
12,5
|
14,3
|
15,4
|
8,3
|
7,1
|
6,2
|
4,3
|
4,2
|
5,3
|
0
|
0
|
|
Tenuitarsus angustus
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
4,3
|
0
|
0
|
0
|
0
|
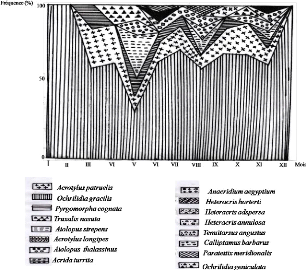
Figure 21. Fréquence le long de
l'année (1992) des espèces d'Orthoptères dans le milieu
cultivé.
65
Tableau 27. Fréquences relatives des
espèces d'Orthoptères dans la palmeraie de Ghardaïa en
fonction du temps.
|
Mois Espèces
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus patruelis
|
0
|
0
|
25
|
25
|
10
|
12,5
|
14,3
|
8,3
|
15,4
|
18,7
|
9,6
|
0
|
|
Aiolopus strepens
|
0
|
0
|
0
|
0
|
30
|
0
|
0
|
8,3
|
0
|
0
|
4,7
|
0
|
|
Aiolopus thalassinus
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
8,3
|
0
|
6,2
|
4,7
|
0
|
|
Heteracris harterti
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
8,3
|
0
|
0
|
0
|
0
|
|
Ochrilidia gracilis
|
100
|
100
|
58,3
|
62,5
|
30
|
62,5
|
71,4
|
85,3
|
69,2
|
68,7
|
61,9
|
100
|
|
Omocestus lucasii
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
7,7
|
0
|
0
|
0
|
|
Omocestus raymondi
|
0
|
0
|
0
|
0
|
0
|
6,2
|
0
|
0
|
0
|
0
|
4,7
|
0
|
|
Paratettix meridionalis
|
0
|
0
|
0
|
0
|
0
|
6,2
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Pyrgomorpha conica
|
0
|
0
|
0
|
0
|
0
|
6,2
|
7,1
|
8,3
|
0
|
0
|
4,7
|
0
|
|
Pyrgomorpha cognata
|
0
|
0
|
16,6
|
0
|
10
|
6,2
|
7,1
|
0
|
7,7
|
0
|
4,7
|
0
|
|
Truxalis nasuta
|
0
|
0
|
0
|
12,5
|
10
|
0
|
0
|
0
|
0
|
6,2
|
4,7
|
0
|
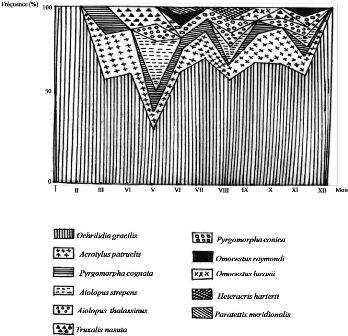
Figure 22. Fréquence le long de
l'année (1992) des espèces d'Orthoptères dans la
palmeraie
66
Tableau 28. Fréquences relatives des
espèces d'Orthoptères dans le milieu non cultivé à
Beni Isguen en fonction du temps.
|
Mois
Espèces
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Dericorys millierei
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
|
Hyalorrhipis calcarata
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
|
Pyrgomorpha cognata
|
0
|
0
|
100
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
50
|
100
|
|
Pseudosphingonotus savignyi
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
0
|
|
Sphingonotus azurescens
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
10
|
0
|
0
|
0
|
0
|
|
Sphingonotus caerulans
|
0
|
0
|
0
|
50
|
50
|
50
|
28,6
|
20
|
33,3
|
33,3
|
50
|
0
|
|
Sphingonotus obscuratus lameerei
|
0
|
0
|
0
|
0
|
0
|
0
|
14,3
|
0
|
0
|
0
|
0
|
0
|
|
Sphingonotus rubescens
|
0
|
0
|
0
|
50
|
50
|
33,3
|
14,3
|
10
|
33,3
|
33,3
|
0
|
0
|
|
Schistocerca gregaria
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
0
|
|
Truxalis nasuta
|
0
|
100
|
0
|
0
|
0
|
0
|
0
|
10
|
33,3
|
33,3
|
0
|
0
|
|
Tuarega insignis
|
0
|
0
|
0
|
0
|
0
|
16,6
|
0
|
10
|
0
|
0
|
0
|
0
|
|
Wernerella pachecoi
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
10
|
0
|
0
|
0
|
0
|
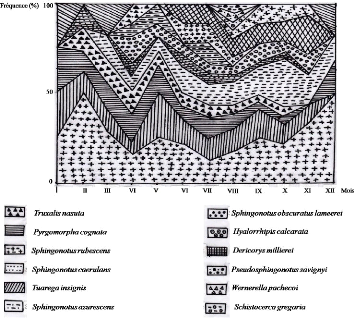
Figure 23. Fréquence le long de
l'année (1992) des espèces d'Orthoptères dans le milieu
non cultivé
V - 1 - 2 - 2 - Discussion
Il ressort des résultats obtenus que chaque milieu est
caractérisé par un peuplement particulier d'Orthoptères
Cælifères. Le milieu cultivé présente des
espèces très communes. Il s'agit d'Acrotylus patruelis,
Aiolopus strepens, Aiolopus thalassinus et Ochrilidia
gracilis. Nous observons ces espèces durant presque toute
l'année. La fréquence de chaque espèce est
67
variable selon les mois. La majorité des espèces
apparaissent durant le mois d'août soit 87.5 % des acridiens
présents dans le milieu cultivé Acrotylus patruelis est
l'espèce la plus fréquente dans ce milieu. Sa fréquence
est de 50 % durant les mois de février et de décembre (Fig. 21,
Tableau 26). Cela est dû au fait qu'elle a pu résister aux
mauvaises conditions climatiques du milieu car la température moyenne
mensuelle durant cette période est de 11.9°C en février et
11.4°C en décembre. Durant les autres mois la fréquence des
espèces acridiennes est en dessous de 50 %. Parmi les espèces qui
présentent une fréquence faible nous pouvons citer
Calliptamus barbarus avec 4.3 % en août et Tenuitarsus
angustus avec la même valeur. Zergoun (1991) note que
Pyrgomorpha cognata présente une fréquence
élevé dans le milieu cultivé. Par contre cette même
espèce est trouvée en 1992 avec une faible fréquence. La
plus Faible valeur a été enregistrée en septembre avec 4.1
%. Quant à la palmeraie on y retrouve une espèce très
fréquente dans ce milieu. Il s'agit d'Ochrilidia gracilis. La
fréquence de cet acridien atteint 100 % durant les mois de janvier,
février et décembre (Fig. 22, Tableau 27). A l'exception du mois
de mai où nous avons enregistré une fréquence de 30 %,
O. gracilis est considéré comme une espèce
très fréquente dans la palmeraie. Selon Chopard (1943) cette
espèce préfère les oasis. D'autres espèces moins
importantes sont aussi présentes dans la palmeraie. C'est le cas
d'Acrotylus patruelis, Pyrgomorpha cognata, Pyrgomorpha
conica et Aiolopus strepens. Ainsi que Heteracris harteti,
Omocestus raymondi et Omocestus lucasii sont les espèces
les moins fréquentes dans la palmeraie. Dans le milieu non
cultivé on note une fréquence de 100 % chez Pyrgomorpha
cognata en mois de mars et décembre. De même Truxalis
nasuta présente une fréquence de 100 % en mois de
février. On note aussi l'existence de deux espèces qui
présentent des fréquences comprises entre 10 % et 50 %. Il s'agit
de Sphingonotus caerulans et S. rubescens. Par contre
Dericorys millierei et Schistocerca gregaria
présentent chacune une très faible fréquence (Fig.
23, Tableau 28).
V - 1 - 2 - 3 - Conclusion
La variation de la fréquence des Orthoptères est
liée aux conditions climatiques. En effet Chopard (1943)
considère que la distribution géographique des acridiens est
conditionnée avant tout par la température. Etant donné
que la fréquence est le pourcentage d'individus d'une espèce par
rapport au total des individus, nous avons enregistré de faibles
fréquences durant les mois les plus chauds et de fortes
fréquences durant les mois les plus froids. La fréquence
d'Acrotylus patruelis dans le milieu cultivé par exemple passe
de 50 % au mois de décembre à 12,5 % au mois de juillet. Cela
s'explique par le fait que lorsque la température
68
de l'air est élevée, le nombre d'espèces
augmente dans la station. Cette augmentation influe sur la fréquence de
chaque espèce. De même les conditions défavorables
favorisent un développement d'une ou deux espèces au
détriment des autres acridiens. C'est le cas par exemple
d'Ochrilidia gracilis qui a enregistré dans la palmeraie une
fréquence de 100 % durant les mois de janvier, février et de
décembre.
V - 1 - 3 - La constance
Selon Dajoz (1982), la constance permet de dire si une
espèce est constante, accessoire ou accidentelle dans un milieu
donné.
V - 1 - 3 - 1 - Résultats
Les résultats des différentes stations sont
consignés dans le tableau 29. Tableau 29. La constance
en % des Cælifères dans trois stations d'étude
|
Espèces
|
Milieu cultivé
|
Palmeraie
|
Milieu non cultivé
|
|
Acrida turrita
|
25
|
-
|
-
|
|
Acrotylus longipes
|
58,33
|
-
|
-
|
|
Acrotylus patruelis
|
100
|
75
|
-
|
|
Aiolopus strepens
|
83,33
|
25
|
-
|
|
Aiolopus thalassinus
|
66,67
|
33,33
|
-
|
|
Anacridium aegyptium
|
25
|
-
|
-
|
|
Calliptamus barbarus
|
8,33
|
-
|
-
|
|
Dericorys millierei
|
-
|
-
|
8,33
|
|
Heteracris adspersa
|
33,33
|
-
|
-
|
|
Heteracris annulosa
|
8,33
|
-
|
-
|
|
Heteracris harterti
|
50
|
8,33
|
-
|
|
Hyalorrhipis calcarata
|
-
|
-
|
8,33
|
|
Ochrilidia geniculata
|
25
|
-
|
-
|
|
Ochrilidia gracilis
|
91,67
|
100
|
-
|
|
Omocestus lucasii
|
-
|
8,33
|
-
|
|
Omocestus raymondi
|
-
|
16,67
|
-
|
|
Paratettix meridionalis
|
50
|
8,33
|
-
|
|
Pyrgomorpha cognata
|
91,67
|
50
|
33,33
|
|
Pyrgomorpha conica
|
-
|
33,33
|
-
|
|
Pseudosphingonotus savignyi
|
-
|
-
|
8,33
|
|
Sphingonotus azurescens
|
-
|
-
|
16,67
|
|
Sphingonotus caerulans
|
-
|
-
|
66,67
|
|
Sphingonotus obscuratus lameerei
|
-
|
-
|
8,33
|
|
Sphingonotus rubescens
|
-
|
-
|
58,33
|
|
Schistocerca gregaria
|
-
|
-
|
8,33
|
|
Truxalis nasuta
|
75
|
33,33
|
33,33
|
|
Tuarega insignis
|
-
|
-
|
16,67
|
|
Wernerella pachecoi
|
-
|
-
|
8,33
|
|
Tenuitarsus angustus
|
8,33
|
-
|
-
|
V - 1 - 3 - 2 - Discussion
Il ressort des valeurs de la constance obtenues (Tableau 29)
que ces dernières varient en fonction du milieu et des espèces de
Cælifères. Le milieu cultivé englobe six espèces
constantes telles que A. patruelis, O. gracilis, P. cognata, T. nasuta, A.
thalassinus et A. longipes. Les valeurs les plus
élevées de la constance sont notées chez A. patruelis
avec 100 %, chez O. gracilis avec 91,66 % et enfin chez
P.cognata avec 91,66 %. (Tableau 29).
69
Ould El Hadj (1991) signale A. Strepens, A.
thalassinus et A. longipes comme étant des espèces
constantes dans toutes les parcelles de la région de Béni Abbes.
Dans la palmeraie de Ghardaïa O. gracilis est très
constante. Le même cas a été noté par Zergoun (1991)
pour Pyrgomorpha cognata en milieu cultivé. Le milieu non
cultivé est caractérisé par la présence de deux
espèces acridiennes qui tolèrent les conditions hostiles du
milieu. Il s'agit de S. caerulans et de S. rubescens. Ces
deux espèces présentent des valeurs respectives de constance de
66,7 % et 50, 3 %. Un quart des espèces acridiennes présentes
dans le milieu cultivé sont accessoires. Parmi elles nous pouvons citer
A. turrita et A. aegyptium. Quant à la palmeraie
presque la moitié de son acridofaune sont accessoire. Cela est dû
au fait que le microclimat humide de la palmeraie favorise le
développement d'un nombre restreint d'espèces
d'Orthoptères. Comme espèces accessoires nous pouvons citer
A. strepens, P. conica et T. nasuta. Par contre le milieu non
cultivé ne renferme que deux espèces accessoires qui sont P.
cognata et T. nasuta. Un quart des acridiens du milieu
cultivé sont accidentelles. C'est le cas par exemple de C.
barbarus. Cette espèce présente une valeur de constance
égale à 8.33 %. Dans la palmeraie plus d'un tiers des
espèces d'Orthoptères sont accidentelles. Nous citons comme
exemple H. harterti. Par contre dans le milieu non cultivé nous
trouvons 8 espèces accidentelles, soit deux tiers des espèces
Cælifères présentes dans cette station. Selon Guecioueur
(1990) une espèce peut être constante dans un milieu et
accidentelle dans un autre. Pour ce qui nous concerne A. strepens et
T. nasuta sont constantes dans le milieu cultivé et accessoire
dans la palmeraie.
V - 1 - 3 - 3 - Conclusion
D'après les résultats obtenus, il est à
constater que chaque espèce est caractérisée par sa
constance, différente d'un milieu à l'autre. Dans le milieu
cultivé 7 espèces sur 16 sont constantes, soit 43,8 % contre 18.8
% pour les espèces accidentelles. Ce taux des espèces
accidentelles du milieu cultivé double dans la palmeraie (36,4 %) et
quadruple presque dans le milieu non cultivé (66,7 %). A.patruelis
en tant qu'espèce constante elle caractérise le milieu
cultivé. Il en est de même pour O.gracilis dans la
palmeraie.
V - 2 - Analyse des résultats par les indices
écologiques
V - 2 - 1 - Indice de diversité de Shannon Weaver
et équitabilité
Selon Frontier (1982) la méthode la plus simple lorsqu
on se trouve en présence d'une récolte d'insectes ou de plancton,
d'une énumération d'oiseau ou d'un débarquement de
poissons consiste à se fonder Sur l'indice de diversité de
Shannon Weaver de l'échantillon.
70
Ainsi l'indice de diversité de Shannon Weaver est la
quantité d'information, apportée par un échantillon sur
les structures du peuplement dont provient l'échantillon et sur la
façon dont les individus y sont répartis entre diverses
espèces (Daget, 1976).
V - 2 - 1 - 1 - Résultats
Les résultats concernant l'indice de diversité de
Shannon Weaver et équitabilité sont consignés dans le
tableau 30.
Tableau 30. Indice de diversité de
Shannon Weaver et équitabilité dans chaque milieu et pour chaque
sortie.
|
Milieu
Sortie
|
Cultivé
|
Non cultivé
|
Palmeraie
|
|
H
|
E
|
H
|
E
|
H
|
E
|
|
28 - I - 1992
|
2
|
1
|
/
|
/
|
0
|
0
|
|
29 - II - 1992
|
2
|
0,86
|
0
|
0
|
0
|
0
|
|
30 - III - 1992
|
2,51
|
0,97
|
0
|
0
|
1,38
|
0,87
|
|
30 - IV - 1992
|
3,08
|
0,97
|
1
|
1
|
1,30
|
0,82
|
|
15 - V - 1992
|
2,62
|
0,93
|
1
|
1
|
1,37
|
0,92
|
|
15 - VI - 1992
|
2,98
|
0,94
|
1,46
|
0,92
|
1,05
|
0,40
|
|
16 - VII - 1992
|
3,25
|
0,98
|
2,51
|
0,97
|
1,02
|
0,51
|
|
14 - VIII - 1992
|
3,58
|
0,94
|
3,12
|
0,94
|
1,95
|
0,75
|
|
14 - IX - 1992
|
3,80
|
0,83
|
1,58
|
1
|
1,35
|
0,67
|
|
18 - X - 1992
|
2,97
|
0,89
|
1,58
|
1
|
1,32
|
0,66
|
|
15 - XI - 1992
|
2,37
|
0,92
|
1
|
1
|
0,96
|
0,32
|
|
20 - XII - 1992
|
1,79
|
0,89
|
0
|
0
|
0
|
0
|
\ : Espèce absente
0 : La valeur zéro indique que le peuplement est
monospécifique.
V - 2 - 1 - 2 - Discussion
Le tableau 30 donne une idée sur la diversité
des peuplements acridiens dans trois types de milieux de la région de
Ghardaïa. Le milieu cultivé est le plus favorable par rapport au
développement de nombreux Orthoptères. En effet il est
caractérisé par une mésothermie et une
mésohygrophie, raisons pour lesquelles nous avons recensé 16
espèces de Cælifères parmi les 29 espèces existant
dans la région d'étude. Les valeurs de l'indice de
diversité maximale enregistrées durant les mois de juillet,
août et septembre sont respectivement de 3,2, 3,6 et 3,8 (Tableau 30).
Pendant cette période la température du milieu est très
favorable pour les pullulations des acridiens. Chopard (1943) note que les
Orthoptères sont des insectes thermophiles et sténothermes. Leur
développement exige presque toujours une température
élevée et une insolation prolongée. Nous avons
capturé durant le mois d'août 14 espèces
d'Orthoptères, soit plus de 82 % des acridiens recensés dans le
milieu cultivé et plus de 48 % de la faune Orthoptérologiques
recensée dans la région de Ghardaïa. Il est aussi à
signaler que le cycle phénologique de nombreuses espèces
végétales plus particulièrement celui des graminées
coïncide avec le développement des espèces acridiennes. Il
ressort des observations faites sur le terrain que chaque espèce ou
groupe d'espèces acridiennes est inféodé à une
ou
71
plusieurs espèces végétales. C'est le cas
par exemple d'Heteracris harterti qui fréquente uniquement les
parcelles de courge, de tomate et d'aubergine. Les indices de diversité
les plus faibles sont notés durant les mois de décembre (1,79),
janvier (2) et de février (2). Ces valeurs indiquent que les conditions
du milieu sont défavorables pour le développement des acridiens.
En effet cette période est la plus mauvaise pour les Orthoptères
dans la région de Ghardaïa. C'est durant cette époque de
l'année que la température moyenne atteint son minimum. Durant le
mois de décembre par exemple nous avons capturé uniquement quatre
espèces d'acridiens. Elles correspondent à 25 % des
espèces inventoriées dans le milieu cultivé et à
13,8 % de la faune Orthoptérologiques de la région de
Ghardaïa. L'équitabilité E ne varie pas beaucoup dans le
milieu cultivé; elle se trouve dans un intervalle de 0,83 à 1,
cela signifie que le milieu est stable, donc les espèces sont
distribuées d'une manière équitable. Le milieu non
cultivé est colonisé par les espèces acridiennes qui ont
une préférence pour les endroits secs et dénudés.
Nous avons capturé dans ce milieu 12 espèces d'Orthoptères
Cælifères. Durant les mois de juillet, août et septembre
nous avons enregistré respectivement des valeurs de l'indice de
diversité de 2,5, 3,1 et 1,6. Le maximum d'espèces est
signalé au mois d'août avec 9 espèces sur les 12
Cælifères recensées dans le milieu non cultivé soit
75 % des espèces présentes dans le milieu non cultivé et
31 % de la faune Orthoptérologiques de la région d'étude.
La plus faible valeur de l'indice de diversité est égale à
1. Elle est enregistrée durant les mois d'avril, de mai et de novembre.
Cette valeur est due au fait que le milieu ne contient que deux espèces
d'Orthoptères en nombre égal. Il s'agit de Sphingonotus
caerulans et S.rubescens. Chacune d'elles est
représentée par deux individus. L'équitabilité dans
le milieu non cultivé est très élevée. Elle varie
de 0,92 à 1. Nous pouvons dire alors que le milieu non cultivé
est très homogène car il permet une distribution
équilibrée des espèces d'Orthoptères dans l'espace
et dans le temps. La palmeraie crée un microclimat très humide
permettant le développement en nombre d'une espèce telle
Ochrilidia gracilis et limite la pullulation d'autres espèces
telles Acrotylus patruelis et Aiolopus strepens. Selon
Frontier (1982) une communauté comprenant un petit nombre
d'espèces très abondantes relativement, les autres rares,
apparaît moins diversifiée qu'une communauté comprenant au
total le même nombre d'espèces, mais avec des fréquences
plus équitablement réparties. Dans le cas de la palmeraie, il
semblerait que nos résultats concordent le plus avec la première
idée du raisonnement de Frontier (1982). En effet, les valeurs
enregistrées montrent la faiblesse des indices de diversité dans
la palmeraie. Dans ce milieu le plus faible indice de diversité est
enregistré le mois de novembre 0,96. Cette valeur montre que sur les
huit espèces acridiennes capturées durant cette période,
seule Ochrilidia gracilis présente un nombre d'individus
très
72
importants. Les autres espèces telles Truxalis
nasuta, Aiolopus strepens et Pyrgomorpha cognata sont
très rares. Cela se traduit aussi au niveau de
l'équitabilité. En effet la plus faible valeur de
l'équitabilité enregistrée durant le mois de novembre est
de 0,3. Cette valeur est la plus faible enregistrée dans les trois
milieux. Ceci est dû au développement d'une
végétation graminéenne dense caractérisée
essentiellement par Setaria verticillata. Cette dernière abrite
en effet un nombre considérable d'individus d'Ochrilidia
gracilis.
V - 2 - 1 - 3 - Conclusion
Il est donc évident que les variations de l'indice de
diversité peuvent s'expliquer par deux aspects, soit par un changement
des conditions climatiques affectant profondément la fréquence
des espèces d'Orthoptères, soit par l'abondance et la composition
floristique du milieu et en parti culier les graminées. En effet nous
avons noté une valeur de l'indice de diversité qui est
égale à zéro durant les mois les plus froids, Des valeurs
élevées de l'indice de diversité sont enregistrées
durant les mois les plus chauds. Ainsi le milieu cultivé, le milieu non
cultivé et la palmeraie présentent des valeurs respectives de
3,6, 3, 1 et 1.9 durant le mois d'août.
V - 2 - 2 - Indice de dispersion
V - 2 - 2 - 1 - Résultats
Les résultats concernant l'indice de dispersion en milieu
cultivé à Béni Isguen sont consignés
dans le tableau 31.
Tableau 31. Indice de dispersion des
espèces Cælifères en milieu cultivé à
Béni Isguen
|
Espèces Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus longipes
|
-
|
H
|
-
|
H
|
H
|
H
|
H
|
H
|
H
|
H
|
-
|
-
|
|
Acrotylus patruelis
|
H
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
|
Aiolopus strepens
|
-
|
-
|
H
|
H
|
H
|
C
|
C
|
C
|
C
|
C
|
C
|
H
|
|
Aiolopus thalassinus
|
-
|
-
|
-
|
R
|
H
|
H
|
H
|
H
|
C
|
H
|
C
|
-
|
|
Anacridium aegyptium
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
H
|
-
|
-
|
-
|
-
|
|
Acrida turrita
|
-
|
-
|
-
|
H
|
H
|
H
|
C
|
-
|
-
|
-
|
-
|
-
|
|
Calliptamus barbarus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Heteracris adspersa
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
C
|
H
|
H
|
-
|
|
Heteracris annulosa
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Heteracris harterti
|
-
|
-
|
-
|
-
|
-
|
H
|
C
|
C
|
C
|
C
|
C
|
-
|
|
Ochrilidia geniculata
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
H
|
-
|
H
|
-
|
-
|
|
Ochrilidia gracilis
|
H
|
H
|
H
|
H
|
C
|
C
|
R
|
C
|
C
|
R
|
R
|
-
|
|
Paratettix meridionalis
|
H
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
|
Pyrgomorpha cognata
|
H
|
H
|
H
|
C
|
C
|
H
|
R
|
R
|
H
|
H
|
-
|
H
|
|
Tenuitarsus angustus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Truxalis nasuta
|
-
|
H
|
H
|
R
|
H
|
H
|
H
|
H
|
H
|
H
|
-
|
-
|
H : au hasard, R : régulière, C : contagieuse
73
Les individus qui constituent un peuplement
d'Orthoptères peuvent présenter divers types de
répartitions spatiales qui traduisent leurs réactions vis
à vis de diverses influences telles que les conditions climatiques, le
tapis végétal et la recherche de la nourriture. Ainsi le cycle
biologique des acridiens joue un rôle important dans leur dispersion.
Tableau 32. Indice de dispersion des
espèces Cælifères en palmeraie à Ghardaïa
|
Espèces Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Acrotylus patruelis
|
-
|
-
|
C
|
R
|
H
|
R
|
C
|
H
|
R
|
C
|
C
|
-
|
|
Aiolopus strepens
|
-
|
-
|
-
|
-
|
C
|
-
|
-
|
H
|
-
|
-
|
H
|
-
|
|
Aiolopus thalassinus
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
H
|
-
|
H
|
H
|
-
|
|
Heteracris harterti
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Ochrilidia gracilis
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
C
|
|
Omocestus lucasii
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
|
Omocestus raymondi
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
H
|
-
|
|
Paratettix meridionalis
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Pyrgomorpha cognata
|
-
|
-
|
R
|
-
|
H
|
H
|
H
|
-
|
H
|
-
|
H
|
-
|
|
Pyrgomorpha conica
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
H
|
-
|
-
|
H
|
-
|
|
Truxalis nasuta
|
-
|
-
|
-
|
H
|
H
|
-
|
-
|
-
|
-
|
H
|
H
|
-
|
H : au hasard, R : régulière, C : contagieuse
Tableau 33. Indice de dispersion des
espèces Cælifères en milieu non cultivé à
Béni Isguen
|
Espèces Mois
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
IX
|
X
|
XI
|
XII
|
|
Dericorys millierei
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
|
Hyalorrhipis calcarata
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
|
Pyrgomorpha cognata
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
H
|
H
|
|
Pseudosphingonotus savignyi
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Sphingonotus azurescens
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
-
|
-
|
-
|
-
|
|
Sphingonotus caerulans
|
-
|
-
|
-
|
R
|
R
|
R
|
R
|
R
|
H
|
H
|
H
|
-
|
|
Sphingonotus obscuratus lameerei
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
|
Sphingonotus rubescens
|
-
|
-
|
-
|
R
|
C
|
C
|
H
|
H
|
H
|
H
|
-
|
-
|
|
Schistocerca gregaria
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Tuarega insignis
|
-
|
-
|
-
|
-
|
-
|
H
|
-
|
H
|
-
|
-
|
-
|
-
|
|
Truxalis nasuta
|
-
|
H
|
-
|
-
|
-
|
-
|
-
|
H
|
H
|
H
|
-
|
-
|
|
Wernerella pachecoi
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
H
|
|
-
|
-
|
-
|
H : au hasard, R : régulière, C : contagieuse
V - 2 - 2 - 2 - Discussion
La répartition spatiale et temporelle des
espèces d'Orthoptères dans la région de Ghardaïa
varie d'un milieu à un autre. Dans le milieu cultivé la plupart
des espèces acridiennes ont une répartition de type
aléatoire (Tableau 31). Dans ce cas la valeur de l'indice de dispersion
est égale à 1. Nous citons comme exemple A.longipes,
T.nasuta, A.aegyptium. Quant à A.patruelis
elle présente une répartition contagieuse de février
à décembre en 1992. Cette contagion est très forte durant
la période s'étalant d'août à octobres. Cela
s'explique par le fait que durant cette période les rapprochements
sexuels et les accouplements ont lieu. Les individus d'A.patruelis se
rassemblent peut être aussi attirés par des plantes hôtes
particulièrement appétissantes en milieu cultivé. La
même explication peut être donnée aussi pour O. gracilis
en palmeraie. Cette espèce acridienne est présente en
agrégats durant toute
74
l'année 1992 (Tableau 32). Zergoun (1991) a
constaté le même fait pour P.cognata en milieu
cultivé. A.thalassinus, O.raymondi, P.conica
et T.nasuta présentent une répartition au hasard
dans la palmeraie. La répartition régulière a
été signalée 4 fois dans la palmeraie, trois fois chez
A.patruelis aux mois d'avril, juin et septembre. Ainsi une seule fois
chez P.cognata au mois de mars. Dans le milieu non cultivé,
S.rubescens est la seule espèce qui présente une
répartition contagieuse pendant une très courte période de
l'année correspondant à la reproduction (Tableau 33). Cette
contagion s'est manifestée aux mois de mai et juin. Cette période
correspond à l'éclosion des oeufs et au fait que les larves se
développent tout en restant groupées. De même Douadi (1992)
a signalé une contagion chez Sphingonotus carinatus et
Tenuitarsus angustus. Des répartitions régulières
sont observées chez S.caerulans du mois d'avril à
août. De même une seule répartition régulière
a été notée pour S.rubescens en avril. Le reste
des espèces Caelifères présentes dans le milieu non
cultivé ont une répartition aléatoire. Cela est dû
probablement au fait que le milieu est très homogène.
V - 2 - 2 - 3 - Conclusions
Au terme de cette étude sur le type de
répartition des Orthoptères dans la région de
Ghardaïa, il est à signaler que la dispersion des acridiens est
liée essentiellement à certains facteurs. Dans le milieu
cultivé A.patruelis a une répartition de type contagieux. Cette
contagion augmente en période estivale à cause des rapprochements
sexuels et des accouplements. O.gracilis est présente en agrégats
dans la palmeraie. Cette espèce se concentre dans les touffes de Setaria
verticillata. Le milieu non cultivé est caractérisé par
une répartition aléatoire des espèces acridiennes
fréquentant ce milieu.
75
CHAPITRE VI : Etude du régime alimentaire
d'Acrotylus patruelis
VI - 1 - Données bibliographique sur le
régime alimentaire des acridiens
VI - 1 - 1 - Relation phytophages - plantes
Les phytophages n'utilisent qu'une faible part du potentiel
offert par l'environnement végétal complexe. Ils
sélectionnent leurs sources alimentaires. L'insecte se nourrit sur les
végétaux lui apportant les éléments
nécessaires à son développement et à sa
reproduction. Il choisit ces sources alimentaires en fonction des
critères visuels, olfactifs ou gustatifs (Le Gall, 1989). En
présence d'une végétation hétérogène
ou dispersée, l'acridien doit repérer rapidement les plantes dont
il peut se nourrir. La probabilité de découverte dépend
des chances de rencontre entre l'insecte et la plante hôte. Elle est
liée donc à la fois au volume relatif du végétal,
aux capacités déambulatoires du criquet, mais aussi à la
faculté de celui-ci a de détecter à distance les
espèces végétales intéressantes. Pour ce
repérage, le criquet dispose de la vision. Les bandes horizontales et
verticales l'attirent ainsi que certaines silhouettes de buissons ou d'arbres.
Il utilise également son odorat pour les faibles distances grâce
à des organes de sens particulières, les chimiorécepteurs,
distribués notamment sur les antennes et les pièces buccales
(Duranton et al, 1982). Selon Louveaux (1976), le nombre des
récepteurs sensoriels sollicités pendant la prise de nourriture
est estimée à plusieurs milliers. Ce sont essentiellement des
chimiorécepteurs rassemblés à l'extrémité
des palpes ou groupés en plages sur l'épipharynx, l'hypopharynx
et les galéas. De nombreux propriocepteurs sont situés à
l'extrémité du labre. Des récepteurs sensoriels bipolaires
à fonction non précisée sont situés à la
base des processus molaires et incisifs des mandibules et dans les points de
lacinias. Enfin il y a une perception tactile et proprioceptive
disséminée à la surface de la cuticule.
VI - 1 - 2 - Les variations du régime alimentaire
chez les Orthoptères
Les différences de régime alimentaire
correspondent d'abord à des différences d'habitats, puis à
l'utilisation différente des ressources de cet habitat. Selon Le Gall et
Gillon (1989), on distingue deux grands ensembles de consommateurs parmi les
acridiens, les consommateurs de graminées et de cypéracées
ou graminivores et les consommateurs des autres familles
végétales ou non graminivores. Classiquement il existe trois
degrés de spécialisation, la monophagie, l'oligophagie et la
polyphagie. D'après Le Gall (1989), l'herbivore monophage ne consomme
qu'une seule espèce végétale, voire quelques
espèces très proches d'un même genre. Les espèces
oligophages sont celles dont le spectre trophique est limité à un
genre ou à une famille végétale donnée. Les
graminivores constituent le seul exemple d'une corrélation
étroite entre taxonomie et spécialisation alimentaire chez les
acridiens. Ce sont les seuls
76
oligophages connus avec certitude. Le polyphage est un
acridien dont le régime concerne différentes espèces issus
de plusieurs familles végétales.
VI - 1 - 3 - L'alimentation chez les acridiens
La quantité et la qualité de l'alimentation
influencent considérablement les caractéristiques de croissance
des populations acridiennes. La natalité, la mortalité et
à la limite la dispersion, en sont effectuées (Duranton et al,
1982).
VI - 1 - 3 - 1 - Aspect quantitatif de l'alimentation
La nourriture source unique de l'énergie dont disposent
les insectes, est un facteur limitant lorsqu'elle est en quantité
insuffisante. La quantité de nourriture nécessaire est à
poids égal, beaucoup plus grande chez les espèces de petite
taille que chez celles de grande taille. La quantité de nourriture
influe sur la taille des individus. De même le jeûne chez les
insectes conduit à une réduction du nombre d'ovarioles et du
nombre d'oeufs pondus. Le développement est beaucoup plus rapide lorsque
les insectes sont nourris que lorsqu'ils sont sous-alimentés (Dajoz,
1971). Selon Gillon (1974), un jeune acridien peut ingérer en une
journée, une quantité de nourriture supérieur à la
moitié de son propre poids, mais très exceptionnellement
équivalente à son poids. D'après Mestre (1984), la
consommation journalière présente de trop grandes variations
selon les espèces acridiennes et celles des végétaux
consommés. Elle dépend de l'état physiologique de
l'insecte ou de la plante ou des conditions d'élevage pour pouvoir en
tirer des conclusions générales.
VI - 1 - 3 - 2 - Aspect qualitatif de l'alimentation
Selon Dajoz (1985), la composition chimique de la nourriture,
la présence en quantités plus ou moins grandes de substances
indispensables comme les protéines, les vitamines et les
oligoéléments sont des facteurs dont l'importance a
été maintes fois démontrée. Chez beaucoup
d'herbivores la nourriture est choisie sélectivement en fonction de sa
richesse en azote. La bonne qualité de l'alimentation est le facteur
essentiel de la survie des jeunes. Selon Launois (1976), l'aspect biologique de
la graminée, son degré de dureté, de teneur en eau ou sa
composition biochimique, conditionne la prise de nourriture de l'insecte pour
un stade phénologique bien précis. La valeur
énergétique globale selon Louveaux et al. (1983), est
également un élément d'appréciation de la
qualité d'un aliment.
77
VI - 1 - 4 - Spectre et préférence
alimentaire chez les acridiens
La détermination du spectre alimentaire d'un acridien
permet de connaitre ces préférences ; ceci peut être utile
le choix des méthodes culturales visant à réduire les
populations de l'espèce en question ou à l'éloigner des
cultures protégées. Selon Le Gall et Gillon (1989), l'utilisation
des ressources alimentaires est variable en fonction du milieu où vit
l'acridien. Le choix de la plante-hôte est basé non seulement sur
les relations biochimiques insecte-plante, mais aussi sur la structure du
milieu. La sélectivité ne dépend pas que du milieu. Elle
dépend aussi de l'acridien. Des acridiens polyphages vivants dans un
même milieu ne consomment pas les végétaux présents
dans les mêmes proportions. Il est alors difficile de reprendre le
cliché classique du criquet polyphage capable d'ingérer toutes
sortes de plantes sans restrictions. Abushama et Elkhider (1976), notent que
Truxalis grandis grandis, est un acridien très répandu
de la région de Khartoum au Soudan. Il s'avère polyphage tout en
montrant une préférence marquée pour les herbes communes
telles que Cyperus rotundus et Cynodon dactylon.
Euphorbia heterophylla et Calotropis procera sont des plantes
invariablement rejetées. Le faite de changer la forme des feuilles ou de
mettre les animaux à jeûne ne semble pas modifier les
préférences alimentaires. D'après Raccaud-Schoeller
(1980), les orthoptères marquent souvent des préférences
nettes pour une espèce végétale donnée. Mestre
(1984), montre que l'acridien Machaeridia bilineata consomme les
graminées des savanes en fonction de leur abondance relative. Par contre
Chara et al. (1986), notent qu'Omocestus ventralis consomme
80%des espèces présentes dans les biotopes, mais exprime
toutefois des préférences qui ne sont pas en relation avec
l'abondance des graminées. En Algérie, Calliptamus barbarus
et Calliptamus wattenwylianus, deux Calliptaminae
très polyphages, font preuve d'une forte sélectivité
dans leur alimentation. En effet 26% et 15% des espèces
végétales présentes sont consommées respectivement
par les deux espèces (Chara, 1987).
VI - 1 - 5 - Effet de l'alimentation sur les
Orthoptères
L'alimentation que se procure l'acridien a un effet direct sur
lui. En effet, la nourriture est un facteur écologique important.
Suivant sa qualité et son abondance, elle intervient en modifiant la
fécondité, la longévité, la vitesse de
développement la mortalité des insectes (Dajoz, 1971). Selon
Chara et al., (1986) l'alimentation intervient également dans
la distribution spatiale et temporelle des insectes phytophages en
général et des acridiens en particulier. En effet, un acridien ne
peut s'installer dans un biotope donné que si celui-ci lui offre la
possibilité de s'alimenter pour se maintenir et de se reproduire. Lee et
Wong (1979)
78
ont étudié l'effet des plantes
nourricières Oryza, Zea mays, Axonopus et
Cyperus sur la croissance ovocytaire des l'acridien Oxya japonica
Willemse. Ils constatent que la résorption des ovocytes est
limitée chez les insectes nourris avec du maïs et qu'elle est
importante chez les insectes nourris à l'aide de riz. De même le
cycle de croissance ovocytaire des reproductrices nourries sur Axonopus
et Cyperus est ralenti. Il dur de 25 à 30 jours. Ils
concluent que les effets de ces régimes sont en corrélation
étroite avec les besoins alimentaires de l'insecte, la composition
chimique des plantes et la quantité de nourriture ingérée.
La ration alimentaire joue un rôle important pour le développement
des acridiens. En effet, Haniffa et Periasmy (1981) ont étudié
l'effet de la ration alimentaire sur le développement larvaire chez
Acrotylus insubricus (Scopoli). Alimenté avec Urochloa
setigera le développement de l'espèce est fortement
influencé par la réduction de la ration alimentaire. Cette
réduction peut augmenter de 70% le taux de mortalité au premier
âge. Elle allonge la période de la vie larvaire de 35 à 84
jours. Elle provoque un accroissement du nombre des stades larvaires de 5
à 7 et entraîne une réduction du poids des adultes de 135mg
à 59mg.
VI - 2 - Etude du régime alimentaire d'Acrotylus
patruelis
VI - 2 - 1 - Fréquence et spectre alimentaire
chez Acrotylus patruelis dans le milieu cultivé
VI - 2 - 1 - 1 - Résultats
Tableau 34. Fréquence des
espèces végétales présentes dans les
excréments des 2 sexes d'Acrotylus patruelis dans le milieu
cultivé de Béni Isguen
|
Espèces végétales
|
Fréquence exprimées en %
|
|
En 1992
|
En 1993
|
|
50 mâles
|
50 femelles
|
50 mâles
|
50 femelles
|
|
Vitis vinifera
|
0
|
0
|
0
|
0
|
|
Citrus sinensis
|
0
|
0
|
0
|
0
|
|
Olea europea
|
0
|
0
|
0
|
0
|
|
Capsicum annuum
|
0
|
0
|
0
|
0
|
|
Mentha pulegium
|
0
|
0
|
0
|
0
|
|
Lycopersicum esculentum
|
0
|
4
|
0
|
0
|
|
Lageneria vulgaris
|
6
|
14
|
0
|
4
|
|
Cynodon dactylon
|
70
|
58
|
56
|
76
|
|
Setaria verticillata
|
16
|
44
|
32
|
24
|
|
Aristida obtusa
|
0
|
0
|
0
|
0
|
|
Cyperus rotundus
|
12
|
4
|
12
|
10
|
|
Echinops spinosus
|
0
|
0
|
0
|
0
|
|
Sonchus oleraceus
|
0
|
0
|
0
|
0
|
|
Erigeron canadensis
|
0
|
0
|
0
|
0
|
|
Launaea resedifolia
|
0
|
0
|
0
|
0
|
|
Salsola vermiculata
|
0
|
0
|
0
|
0
|
|
Chenopodium album
|
0
|
0
|
0
|
0
|
|
Amaranthus hybridus
|
2
|
2
|
0
|
0
|
|
Portulaca oleracea
|
0
|
0
|
0
|
0
|
|
Tribulus terrester
|
0
|
2
|
0
|
0
|
79
VI - 2 - 1 - 2 - Discussion
L'analyse des fèces de 200 individus d'Acrotylus
patruelis montre que cette espèce consomme 7 espèces
végétales parmi les 20 présentes dans la station
d'étude, soit 35% des espèces présentes. Les
espèces végétales consommées par A. patruelis
sont Cynodon dactylon, Setaria verticillata, Cyperus rotundus,
Lageneria vulgaris, Lycopersicum esculentum, Amaranthus hybridus et
Tribulus terrester. Hamdi (1992) a étudié le
régime alimentaire de 5 espèces d'Orthoptères
Caelifères dans les dunes fixées du littoral algérois. Il
note qu'A. patruelis présente le spectre alimentaire le plus
restreint en espèces végétales parmi les acridiens
étudiés. Neufs espèces végétales ont
été consommées par cet Oedipodinae, soit 15% de
l'ensemble des espèces inventoriées dans la station
d'étude. De même Ould El Hadj (1991) note qu'A. patruelis
consomme 9 espèces végétales parmi les 17
présentes dans le biotope, soit 52.9% de l'ensemble des espèces
végétales. Il est à signaler que les 9 espèces
consommées sont toutes des graminées. La fréquence des
espèces végétales dans les fèces d'Acrotylus
patruelis est variable selon le sexe. Elle varie aussi en fonction du
temps. L'utilisation de la niche trophique est différente d'une
année à une autre. Durant la période comprise entre
juillet et octobre de l'année 1992, les mâles d'Acrotylus
patruelis ont consommés en fréquences 70% de Cynodon
dactylon, 16% de Setaria verticillata, 12% de Cyperus
rotundus, 6% de Lageneria vulgaris, et 2% d'Amaranthus
hybridus. Par contre durant la période de juillet à
septembre de l'année 1993, A. patruelis a ingéré
en fréquence 56% de Cynodon dactylon, 32% de Setaria
verticillata, et 12% de Cyperus rotundus (tableau 35). Notons que
durant l'année 1993 la fréquence de Cynodon dactylon a
diminué dans les fèces. De plus la fréquence de
Setaria verticillata a doublé. Par contre Cyperus rotundus
garde le même taux. De plus Lageneria vulgaris et
Amaranthus hybridus sont absentes dans les fèces en 1993. Les
femelles ont consommé le maximum d'espèces
végétales en 1992 soit 7 espèces sur 20. Ces
espèces végétales sont Cynodon dactylon avec 58%
de fréquence, Setaria verticillata avec 44%, Cyperus
rotundus avec 4%, Lageneria vulgaris avec 14%, Lycopersicum
esculentum avec 4% et enfin Amaranthus hybridus et Tribulus
terrester avec 2% chacune. En 1993 les femelles d'Acrotylus patruelis
ont consommé moins d'espèces végétales. Seule
Cynodon dactylon a été bien consommée avec une
fréquence de 76% (tableau 34). Setaria verticillata vient avec
24%, Cyperus rotundus avec 10% et enfin Lageneria vulgaris
avec 4%.
80
VI - 2 - 1 - 3 - Conclusion
L'étude de la fréquence et du spectre
alimentaire d'A. patruelis montre que cet acridien utilise 35% des
espèces végétales présentes. Nous avons
trouvé dans les fèces de cet Oedipodinae, deux Graminaceae, une
Cyperaceae, une Cucurbitaceae, une Solanaceae, une Zygophyllaceae, et une
Amaranthaceae. Malgré sa polyphagie A. patruelis a montré une
véritable tendance vers la consommation des graminéennes. Ceci
est dû, soit à l'abondance des espèces graminées
dans la station d'étude telles Cynodon dactylon et Setaria
verticillata, soit à la spécialisation trophique de
l'espèce acridienne. En effet parmi les 200 individus examinés,
130 ont consommé Cynodon dactylon, soit 65% du régime
alimentaire. Le régime alimentaire des femelles semble être plus
varié que celui des mâles. En effet sur les 20 espèces
végétales présentes dans le milieu d'étude 7 ont
été consommées par les femelles et 5 par les mâles,
soit des taux respectifs de 35% et de 25%. L'étude de la
fréquence, aspect qualitatif a la tendance de surestimer la consommation
d'une espèce végétale. De ce fait il est nécessaire
de compléter cet aspect par une étude quantitative voire une
estimation en surfaces des espèces végétales
consommées.
VI - 2 - 2 - Etude quantitative de la consommation chez
les imagos d'Acrotylus patruelis Nous parton de
l'hypothèse que les quantités d'épidermes
végétaux rejetés dans les excréments sont
proportionnelles à celle ingérées. On admet aussi comme
hypothèse de travail que les coefficients de digestibilité des
différentes espèces végétales consommées
sont égaux.
VI - 2 - 2 - 1 - Résultats
Tableau 35. Taux, indice d'attraction et
surface végétales moyennes consommées par 50 mâles
d'Acrotylus patruelis en milieu cultivé de Béni
Isguen.
|
Espèces végétales
|
|
1992
|
|
|
1993
|
|
|
consommées
|
Smm2
|
T(%)
|
IA
|
Smm2
|
T(%)
|
IA
|
|
|
N = 50
|
|
|
N = 50
|
|
|
Cynodon dactylon
|
27,5
|
70,7
|
58,9
|
29,9
|
53,3
|
44,4
|
|
Setaria verticillata
|
5,7
|
14,6
|
14,5
|
18,8
|
33,4
|
33,0
|
|
Cyperus rotundus
|
4,5
|
11,5
|
57,8
|
7,5
|
13,3
|
66,3
|
|
Lageneria vulgaris
|
1,1
|
2,8
|
7,0
|
-
|
-
|
-
|
|
Amaranthus hybridus
|
0,1
|
0,2
|
2,1
|
-
|
-
|
-
|
(-) : espèces végétales absentes
Smm2 est la surface moyenne du
végétal consommé. T(%) est le taux de consommation du
végétal par rapport à l'ensemble des
végétaux ingérés. IA est l'indice d'attraction
d'une espèce végétale donnée. C'est le rapport
entre le taux de consommation et le recouvrement
81
global des espèces végétales prises en
considération dans un transect de 500m2. Nous partons de
l'hypothèse que le recouvrement global des espèces
végétales présentes dans le transect est le même
à la même époque pour les deux années
d'étude.
Tableau 36. Taux, indice d'attraction et
surface végétales moyennes consommées par 50 femelles
d'Acrotylus patruelis en milieu cultivé de Béni
Isguen.
|
Espèces végétales
consommées
|
|
1992
|
|
|
1993
|
|
|
Smm2
|
T(%)
|
IA
|
Smm2
|
T(%)
|
IA
|
|
N = 50
|
|
|
N = 50
|
|
|
Cynodon dactylon
|
76,0
|
46,7
|
38,9
|
116,1
|
70,9
|
59,1
|
|
Setaria verticillata
|
68,4
|
42,0
|
41,6
|
37,4
|
22,8
|
22,6
|
|
Cyperus rotundus
|
2,7
|
1,6
|
8,3
|
7,1
|
4,3
|
21,7
|
|
Lageneria vulgaris
|
11,6
|
7,1
|
17,8
|
3,1
|
1,9
|
4,7
|
|
Amaranthus hybridus
|
0,5
|
0,31
|
2.56
|
-
|
-
|
-
|
|
Tribulus terrester
|
3,1
|
1,9
|
13,61
|
-
|
-
|
-
|
|
Lycopersicum esculentum
|
0,4
|
0,25
|
0,82
|
-
|
-
|
-
|
(-) : espèces végétales absentes
VI - 2 - 2 - 2 - Discussion
La quantité de nourriture consommée chez
Acrotylus patruelis varie en fonction de temps est du sexe. En 1992
les femelles d'Acrotylus patruelis semble avoir consommé 4 plus
de végétaux et plus de trois fois en 1993 que les mâles. En
1992 les mâles d'A. patruelis consomment par repas une surface
moyenne de 27,5mm2 de Cynodon dactylon, 5,7mm2
de Setaria verticillata, 4,5mm2de Cyperus rotundus
et de 1,1mm2 d'Amaranthus hybridus. Par contre durant
l'année 1993 nous avons enregistré 29,9mm2de
Cynodon dactylon, 18,8mm2 de Setaria verticillata,
et 7,5 de Cyperus rotundus (tableau 35). Il est a constater que
C. dactylon est l'espèce végétale la plus
consommée pour les deux années. Quant à S.
verticillata la surface moyenne a augmenté, passant de
5,7mm2 en 1992 à 18,8mm2 en 1993. Elle a plus que
triplé. Pour C. dactylon nous avons noté une petite
différence. En effet, le taux de consommation de cette espèce
diminue de 70,7% en 1992 à 53,3% en 1993. Cela est dû au fait
qu'en 1992 Acrotylus patruelis consomme beaucoup plus de C.
dactylon que les autres espèces végétales.
L'indice d'attraction montre que les mâles de cet Oedipodinae
marquent des préférences pour certaines espèces
végétales. C'est le cas de C. rotundus. Cette
espèce végétale présente un indice d'attraction de
57,8% en 1992 et de 66,3% en 1993. Cela est dû au fait que cette
espèce a un taux de recouvrement de 0,20% contre 1,20% pour C.
dactylon et 1,01% pour S. verticillata (tableau 9, chapitre III).
Les femelles d'A. patruelis ont consommé en 1992 en moyenne par
individus et par repas 76,0mm2 de C. dactylon,
68,4mm2 de S. verticillata, 2,7mm2 de C.
rotundus, 11,6mm2 de Lageneria vulgaris,
0,4mm2 de
82
Lycopersicum esculentum, 0,5mm2
d'Amaranthus hybridus, et 3,1mm2 de Tribulus terrester
(tableau n°33). Par contre en 1993 on note certaines
différences. En effet C. dactylon est l'espèce
végétale la plus consommée durant cette année, avec
une surface moyenne de 116,1mm2. Au contraire la surface moyenne de
S. verticillata a diminué passant de 68,4mm2 en 1992
à une valeur de 37,4mm2 en 1993, soit une différence
de 31mm2. D'après Mezreb (1993), C. dactylon est
faiblement consommée par Calliptamus barbarus. Cet acridien
consomme une surface moyenne de 0,40mm2 dans la station Bouadas et
11,7mm2 dans la station de Tala Guemdounen. Par contre Bouanane
(1993) n'a pas signalé C. dactylon dans le régime
alimentaire de Dociostaurus maroccanus dans la région de
Sidi-Bel-Abbès. Le taux de consommation de C. dactylon par les
femelles d'Acrotylus patruelis est passé de 46,7% en 1992
à 7,9% en 1993, soit une augmentation de 1,5 fois. Cela est dû au
fait qu'A. patruelis a consommé beaucoup plus C. dactylon
en 1993 que d'autre espèces végétales. L'indice
d'attraction de Tribulus terrester est relativement fort. Il est de 22,1.
Pourtant cette espèce végétale est faiblement
consommée. Elle n'est représentée que par un taux de
consommation de 1,9%. Cela s'explique par un taux de recouvrement faible soit
de 0,14% (tableau n°6, chapitre III).
VI - 2 - 2 - 3 - Conclusion
D'après les résultats précédents,
il ressort qu'A. patruelis présente des
préférences pour certaines espèces
végétales. En effet, parmi les 7 espèces
végétales consommées par A. patruelis, seulement
Cynodon dactylon et Setaria verticillata sont les plus
consommées. Quantitativement les taux de consommation les plus
élevés sont enregistrés pour C. dactylon. Ils
sont de 70,9% chez les femelles en 1993 et de 70,7% chez les mâles en
1992. Il est à constater aussi que la quantité consommée
est variable selon le sexe. A cet effet les résultats nous montrent que
les femelles d'A. patruelis ont consommées plus de 4 fois de
nourriture en 1992 et plus de trois fois en 1993 que les mâles. L'indice
d'attraction de C. rotundus est relativement élevé. Il
est de 57,8 en 1992 et de 66,3 en 1993. Pourtant cette espèce
végétale est faiblement consommée. Elle n'est
représentée que par un taux de consommation de 11,5% en 1992 et
de 13,3 en 1993. Cela s'explique par un taux de recouvrement faible soit
0,2%.
83
Conclusion générale
L'étude est effectuée aux environs de
Ghardaïa dans la partie septentrionale du Sahara. Le bioclimat de cette
région est de type saharien à hiver doux. Les prospections dans
différents milieux, un milieu cultivé, un milieu non
cultivé et une palmeraie, ont permis d'inventorier 29 espèces
d'Orthoptères Caelifères, soit 20,7% des espèces
acridiennes en Algérie et 42,6% des espèces Caelifères
signalées au Sahara par Louveaux et Ben Halima (1987). Nous avons
notés aussi la présence de 12 sous familles et 18 genres. La sous
famille des Oedipodinae est la mieux représentée en
espèces dans la région de Ghardaïa. Elle englobe plus de 31%
des espèces recensées dont les genres Sphingonotus et
Pseudosphingonotus représentent plus de la moitié des
espèces. L'étude relative aux caractéristiques
écologiques et biologiques des peuplements Orthoptéroloqiques
dans la région de Ghardaïa nous a permis de mettre en
évidence le comportement des principales espèces
étudiées. A travers l'étude écologique nous avons
pu faire la distinction entre les espèces qui préfèrent
les milieux humides comme Ochrilidia gracilis et les espèces qui
tolèrent les variations de température et d'humidité
telles que Truxalis nasuta et Pyrgomorpha cognata. Quant à la biologie
des principales espèces d'Orthoptères, il est difficile de
conclure à propos du nombre de générations de certaines
espèces acridiennes. D'où nous proposons à ce que l'aspect
biologique soit étudié avec beaucoup plus d'attention en
modifiant le protocole expérimental en augmentant le nombre de
relevés. L'analyse statistique et écologique des résultats
nous a renseignées sur la dynamique des populations des acridiens dans
la région de Ghardaïa. A travers l'analyse factorielle des
correspondances nous avons pu comprendre les affinités
écologiques de chaque espèce d'Orthoptère et la formation
de groupes bien distincts. Le calcul de la fréquence nous a aidé
à déterminer les espèces les mieux
représentées dans chaque milieu. De même le calcul de la
constance a permis de faire ressortir les espèces
caractéristiques de chaque station. En effet Ochrilidia gracilis
s'avère être une espèce constante dans la palmeraie. Le
milieu cultivé comprend 43,8% d'espèces constantes contre 18,2%
en palmeraies et 16,7% en milieu non cultivé. Il faut souligner que le
fort taux d'espèces accidentelles soit 66,7% concerne le milieu non
cultivé. Le calcul de l'indice de dispersion nous révèle
la présence de deux espèces à répartition de type
contagieux durant presque toute l'année. Il s'agit d'Ochrilidia gracilis
en palmeraie et Acrotylus patruelis en milieu cultivé. L'indice de
diversité de Shannon-Weaver varie en fonction des conditions
climatiques. Les indices de diversité les plus élevés sont
notés en milieu cultivé durant les mois d'out et de septembre
avec respectivement 3,6 et 3,8. Par contre l'indice de diversité le
moins élevé est enregistré en palmeraie au mois de
novembre avec une valeur de 0,96.
84
L'analyse du régime alimentaire de 200 individus
d'Acrotylus patruelis montre que cet acridien utilise 35% de l'ensemble des
espèces végétales présentes. Malgré sa
polyphagie, Acrotylus patruelis a montré une véritable tendance
vers la consommation des graminées. Cynodon dactylon est l'espèce
végétale la plus consommée par Acrotylus patruelis, soit
65% de son régime alimentaire. Les femelles consomment beaucoup plus
d'espèces végétales que les mâles. Pour mieux
comprendre le régime alimentaire nous avons complété le
travail par une étude quantitative à travers une estimation des
surfaces des espèces végétales rejetées dans les
excréments. En effet les femelles d'Acrotylus patruelis ont
consommées quatre fois plus de nourriture en 1992 et plus de trois fois
en 1993 que les mâles. Le calcul de l'indice d'attraction
révèle qu'une espèce végétale peut
être consommée même si elle est très faiblement
représentée dans le milieu. En perspective, quelques points
méritent d'être ultérieurement développés
concernant la dynamique de population, le nombre de générations
et le déplacement des populations Orthoptéroloqiques d'un endroit
à un autre.
85
Références bibliographiques
ABUSHAMA F. T. and ELKHIDER E. T. M., 1976 - Food preference
of the acridid grasshopper Truxalis grandis grandis (Klug). Acrida 5 (3):
245-255.
ALBRECHT FO., MICHEL R. and CASANOVA D., 1978 - The
temperature and photoperiodic control of flight activity in crowded desert
locust, Schistocerca gregaria (Forskal). Acrida 7(4): 289-298.
ANONYME, 1993a - Criquet pèlerin : début
d'infiltration en Algérie. El Watan, n°935, 27 octobre, p. 7.
ANONYME, 1993b - Nouakchott envahie par les criquets. El
Watan, n°979, 18 décembre, p. 13.
ANONYME, 1994 - Sauterelles : la menace ! Horizon,
n°2561, 20 janvier, p.24.
APPERT J. et DEUSE J., 1982 - les ravageurs des cultures
vivrières et maraichères sous les tropiques. Ed. Maisonneuve et
Larousse, paris, 420 p.
BABAZ Y., 1992 - Etude bioécologique des
Orthoptères dans la région de Ghardaïa, Mémoire
Ingénieur Agronome, Inst. Agro., Univ. Sci. Tech., Blida; 93 p
BACHELIER G., 1978 - La faune des sols, son écologie et
son action. O.R.S.T.O.M., Paris, 391p.
BAGNOULS F. ET GAUSSEN H., 1953. Saison sèche et indice
xérothermique. Bull. Soc. Hist. Nat. Toulouse (88), 3-4:
193-239
BALACHOWSKY A. et MESNIL L., 1936 - les insectes nuisibles aux
plantes cultivées .leurs moeurs, leur destruction. Etablissements
Busson. Paris : 1138-1923
BARBAULT R., 1981 - Ecologie des populations et des
peuplements; des théories aux faits. Ed. Masson, Paris, 200p.
BARRY J.P. et FAUREL., 1973 - Notice de la feuille de
Ghardaïa. Carte de la végétation de l'
Algérie. au 1/500.000.
Mém. Soc. Hist. Nat. Afrique du Nord, n°11, 25 tab. 125p.
BEGGAS Y., 1992 Contribution à l'étude
bioécologique des peuplements Orthoptéroloqiques dans la
région d'El Oued - Régime alimentaire d'Ochrilidia
tibialis (Krauss, 1902). Mémoire Ingénieur Agronome, INA,
El- Harrach, Alger, 64p.
BEN HALIMA T., 1983 - Etude expérimentale de la niche
trophique de Dociostaurus maroccanus (Thunberg, 1815) en phase solitaire au
Maroc. Thèse Docteur Ingénieur, Université Paris Sud Orsay
F, 178 p.
BEN HALIMA T., Gillon Y. et LOUVEAUX A., 1984 - Utilisation
des ressource trophiques par Dociostaurus maroccanus (Thunberg , 1815
). Choix des espèces consommées en fonction de leur valeur
nutritive. Acta Oecologica , Oecol . Gener, 5 (4) : 383- 406.
86
BENADDOUN H., 1987 - Etude bioécologique
d'Ectomyelois ceratoniae (Lepidoptera-Pyralidae) à
Ghardaïa. Mémoire Ingénieur Agronome. INA El Harrach, Alger,
72 p.
BENARBIA R., 1990 - Contribution à l'étude
bioécologique du genre Calliptamus dans la Mitidja occidentale.
Mémoire Ingénieur Agronome, Inst. Agro., Univ. Sci. Tech., Blida,
87 p
BENRIMA A., 1990 - la bioécologie de la faune
Orthoptérologique de la région de Koléa. Mémoire
Ingénieur Agronome, Inst. Agro., Univ. Sci. Tech., Blida, 77 p
BENRIMA A., 1993: Bioécologie et étude du
régime alimentaire des espèces d'Orthoptères
rencontrées dans deux stations d'étude situées en Mitidja.
Etude histologique et anatomique du tube digestif de Dociostaurus jagoi jagoi
(Soltani, 1978). Thèse Magister, INA El-Harrach, Alger, 192p.
BENYOUCEF B., 1991 - Le M'Zab : Espace et
société. Ed. Abou Daoud, El Harrach, Alger, 290p.
BENZEKRI, J. P., 1973 - Analyse des données : l'analyse
des correspondances. Ed. Dunod, Paris, 1236p.
BONNEMAISON L., 1961 - Les ennemis animaux des plantes
cultivées et des forêts. Éd. Sep, 599p.
BOUANANE M. R, 1993-Contribution à l'étude
bioécologique des Orthoptères et régime alimentaire de
Dociostaurus maroccanus (Thunberg, 1815) (Orthoptera, Acrididae) dans
la région de Sidi Be labbes. Mémoire Ingénieur Agronome.
INA El Harrach, Alger, 64 p.
BOURAHLA E-B., 1990 - Comparaison de la faune
Orthoptérologique entre quelques Stations de Soumàa et
Chréa. Mémoire Ingénieur Agronome, Inst. Agro., Univ. Sci.
Tech., Blida, 144p
BRIKI Y., 1991- Contribution à l'étude
bioécologique des Orthoptères dans trois stations de la
région de Dellys. Mémoire Ingénieur Agronome. INA El
Harrach, Alger, 73p.
BUTET A., 1985 - Méthode d'étude du
régime alimentaire d'un rongeur polyphage (Apodemus sylvaticus L., 1758)
par l'analyse microscopique des fèces. Mammalia 49 (4) : 455-483.
CAMBILLE I., 1977- Comportement de forage des femelles de
Locusta
migratoria migratorioides (R. & F.) en milieux
humide et sec. Acrida, 6(3) : 232-239. CAPOT-REY R., 1953 - Le Sahara
français : Les Hommes. Ed. Presses Universitaires, Paris,
Tome 2, 564p.
87
CHAPUIS J.L., 1 979 - Le régime alimentaire du Lapin de
garenne, Oryctolagus cuniculus (L.) 1758 dans deux habitats contrastés :
une lande bretonne et un domaine de l'Ile de France. Thèse
troisième cycle, Rennes, 210 p.
CHARA B. 1987: Etude comparée de la biologie et de
l'écologie de Calliptamus barbarus (Costa, 1836), et de Calliptamus
wattenwylianus (Pantel, 1896) (Orthoptera, Acrididae) dans l'ouest
algérien. Mémoire Docteur ingénieur, Université
d'Aix-Marseille, 190p.
CHARA B., BIGOT L., LOISEL R. 1986 - Contribution à
l'étude du régime alimentaire d'Omocestus ventralis Zetterstedt,
1821 (Orthoptera: Acrididae) dans les conditions naturelles. Ecologia
Mediterranea 12 (3-4) : 25-32.
CHARARAS C., 1979 - Écophysiologie des insectes
parasites des forets. Édité par l'auteur, Paris, 297p.
CHESSEL D., DEBOUZIE D., DONADIEU P., ET KLEIN D., 1975 -
Introduction à l'étude de la structure horizontale en milieu
steppique. II - Le traitement statistique des lignes de placettes
contiguës. Oecol Plant, 10 : 211-31.
CHOPARD L., 1943 orthoptéroïdes de l'Afrique du
nord - faune de l'empire français. Ed. Librairie Larose, Paris, 450
p.
CHOPARD, L., 1949 - Ordre des Orthoptères. In: GRASSE
P.P. (Ed.) Traité de Zoologie. Masson, Paris, pp. 617-722
CHOPARD, L., 1965 - Orthoptères et aptérygotes de
France. Ed. Boubée, Paris, 124 p. CHOPRD L., 1938 - La biologie des
Orthoptères. Encyclopédie. Ed. Paul le chevalier, 511p COPR, 1982
- The Locust and Grasshopper Agricultural Manual, Centre for Overseas Pest
Research, London, 690p.
DAGNELIE P., 1975 - Analyse statistique à plusieurs
variables. Ed. Presse agronomiques de Gembloux, 362p.
DAJGET P., 1976 - Les modèles mathématiques en
écologie. Ed. Masson, Paris, 172 p.
DAJOZ R., 1971 - Précis d'écologie. Ed. Dunod,
Paris, 433 p.
DAJOZ R., 1974 - dynamique des populations. Ed. Masson et Cie,
Paris, 301 p.
DAJOZ R., 1982 - Précis d'écologie, Ed.
Gauthier-Villars, Paris, 549 p.
DAJOZ R., 1985 - Précis d'écologie. Ed. Dunod,
Paris, 499 p.
DELARZE R., 1990 - Etude zoologique des Follatères
(Dorénaz et Fully, Valais). III: Les
Orthoptères (Orthoptera). Bull. Murithienne 108: 89-98.
DIRSH V.M., 1965 - The African genera of Acridoidea. Anti-Locust
Research Center. Ed. University Press Cambridge, 579 p.
88
DJINIDI N., 1989 - Approche biosystématique des
Caelifères de quelques stations en Mitidja et sur l'Atlas tellien, en
particulier processus d'invasion de Schistocerca gregaria FORSK dans
la région. Mémoire ingénieur agronome, INA, El-Harrach,
Alger, 102 p.
DOUADI B., 1992 - Contribution à l'étude
bioécologique des peuplements Orthoptérologique dans la
région de Guerrara(Ghardaïa) - Développement ovarien chez
Acrotylus patruelis (Herrich- Schaeffer, 1838). Mémoire
ingénieur agronome, INA, El-Harrach, Alger, 75p.
DOUMANDJI S., DOUMANDJI - MITICHE B., KHOUDOUR A et BENZARA
A., 1993 - Pullulations de sauterelles et de sautériaux dans la
région de Bordj Bou Arréridj (Algérie). Med. Fac.
Landbouww. Univ. Gent 58/24, 329-336.
DOUMANDJI S., DOUMANDJI-MITICHE B. et BENFEKIH L., 1992 -
Données préliminaires sur la bioécologie de la sauterelle
marocaine Dociostaurus maroccanus (THUNBERG, 1815) à Ain Boucif
(Médéa - Algérie) -Med. Fac. Landbouw. Univ. Gent, 57/3a :
659-665.
DOUMANDJI S., DOUMANDJI-MITICHE B., BENZARA A. et TARAI N., 1993
- Méthode de la fenêtre proposée pour quantifier la prise
de nourriture par les criquets. L'entomologiste 49 (5) : 213-215.
DREUX PH., 1962 - Recherches écologiques et
biogéographiques sur les Orthoptères des Alpes françaises.
Thèse Doctorat d'Etat, Faculté des Sciences, Paris, 766p.
DREUX PH., 1980 - Précis d'écologie,
Edité par Presses Universitaires de France, Paris, 231p.
DURANTON J.F. et LECOQ M., 1990 - Le criquet pèlerin au
Sahel. Coll. : Acridologie opérationnelle, n°6. Ministère
des affaires étrangères des Pays-Bas, Ed. La Hague/Montpellier,
183p.
DURANTON J.F., LAUNOIS M., LAUNOIS-LUONG M.H. et LECOQ M.,
1982- Manuel de prospection acridienne en zone tropicale sèche. Ed.
G.E.R.D.A.T., Paris. T.I. 693p.
DURANTON J.F., LAUNOIS M., LAUNOIS-LUONG M.H., LECOQ M.,
MESTRE J. et MONARD A., 1986 - L'Acridologie opérationnelle : 15 ans
avant l'an 2000. Zoologie Africaine, 100 :105-120.
ETCHÉCOPAR, R. D. & HÜE F. (1964) : Les
oiseaux du Nord de l'Afrique. Ed. Boubée et Cie, 606 p.
EULALIA C.E., DOLORES G.G. et JUAN J.P.A., 1985 - Acridofauna
de las dunas de Guardamar. (Alicante). Graellsia XLI: 153-166.
89
FELLAOUINE R., 1984 Contribution à L'étude des
sautériaux nuisible dans la région de Sétif.
Mémoire ingénieur agronome, INA, El-Harrach, Alger, 68 p.
FELLAOUINE R., 1989 - Bioécologie des
orthoptères de la région de Sétif. Thèse magister,
INA, El-Harrach, Alger, 91 p.
FRONTIER S., 1982 - Stratégie d'échantillonnage
en écologie. Ed. Masson et Cie, Coll. d'écologie, n°17,
455p.
FURON R., 1957 - Le Sahara. Géologie, ressources
minérales, mise en valeur. Ed. Payot, Paris, 300 p.
GILLON Y., 1974 - Les peuplements d'acridiens (
Orthoptères ) de la savane du Lamto. Bull .de liaison des chercheurs de
Lamto, N.S, 3 : 23-41.
GILLON Y., 1989. Le risque acridien. In : Le risque en
agriculture, Ed. P. Milleville et M. Eldin, Paris, France, ORSTOM, 143-152
GUECIOUEUR L., 1990 - Bioécologie de la faune
Orthoptérologique de trois stations à Lakhdaria. Mémoire
ingénieur agronome, INA, El-Harrach, Alger, 71 p.
GUINOCHET M., 1973 - Phytosociologie. Edition Masson et Cie,
227p.
HAMDI H., 1989 - Contribution à l'étude
bioécologique de peuplements Orthoptéroloqiques de la
région médio-septentrionale de l'Algérie et de la
région de Gabès (Tunisie). Mémoire ingénieur
agronome, INA, El-Harrach, Alger, 127 p.
HAMDI H., 1992 - Etude bioécologique des peuplements
Orthoptéroloqiques des dunes
fixée du littoral Algérois. Mémoire
ingénieur agronome, INA, El-Harrach, Alger, 167p.
HANIFFA, M.A. And PERIASAMY K., 1981 - Effect of ration level
on nymphal development and food utilization in Acrotylus insubricus (Scopali).
Acrida, 10 (2) : 91-103.
HEIM DE BALSAC H. et MAYAUD N., 1962 - Les Oiseaux du
Nord-Ouest de l'Afrique. Edit. P. Le chevalier, Paris, 448 p.
HEINZEL H., FITTER R., et PARSLOW J., 1972 - Oiseaux d'Europe,
d'Afrique du Nord et du Moyen-Orient. Edité par Neuchatel, Delachaux
& Niestle, Paris, 320p.
HENRI J.E., WILSON M.C., OMA E.A. and FOWLER J.L., 1985 -
Pathogenic microorganisms isolated from West African grasshoppers (Orthoptera:
Acrididae). - Tropical Pest Management, 31: 192-195.
HENRY, J.E. AND ONSAGER, J.A., 1982 - Experimental control of
the Mormon cricket, Anabrus simplex, by Nosema locustae
(Microspora: Microsporida), a
90
protozoan parasite of grasshoppers (Orthoptera: Acrididae).
Entomophaga 27: 197- 201.
INPV, 1987 - la wilaya de Ghardaia en quelque chiffres.
Document de l'institut national de protection des végétaux,
Ghardaia, 15 p.
KARASSINA B.T., 1990 - Comparaison faunistique des
Caelifères de la station de Caid Gacem en Mitidja et de divers
étages bioclimatique du Togo. Mémoire ingénieur agronome,
INA, El-Harrach, Alger, 109 p.
KONE P., 1990 - Comparaison Orthoptérologique entre les
stations du Mali (Bamako-Keti) et en Mitidja (Tessala El Meurdja).
Mémoire ingénieur agronome, INA, El-Harrach, Alger, 92 p.
KUHNELT W., 1969 - Ecologie générale concernant
particulièrement le règne animal. Edité par Masson et Cie,
Paris, 359 p.
LAMOTTE M., GILLON D., GILLON Y. et RICOU G., 1969 -
L'échantillonnage quantitatif des peuplements
d'invertébrés en milieux herbacés. In Problèmes
d'écologie: l'échantillonnage des peuplements animaux des milieux
terrestres. Masson et Cie, 754.
LAUNOIS M., 1976 - Méthode d'étude dans la
nature du régime alimentaire du Criquet
migrateur : Locusta migratoria capito Saussure. Ann. Zool. Ecol.
Anim., 8 : 25-32. LAUNOIS M., 1986 - Les criquets menacent l'Afrique. La
Recherche, 179 : 978-980. LAUNOIS M., 1988 - invasion
généralisée des criquets en Afrique était
évitable. Pour la
science, 128 : 1-3
LE BERRE M., 1989a - Faune du Sahara. 1-
Poissons-Amphibiens-Reptiles. Ed. Le chevalier-Chabaud, Paris, 332 p.
LE BERRE M., 1989b - Faune du Sahara. 2 - Mammifères.
Ed. Le chevalier-Chabaud, Paris, 359 p.
LE GALL P. et GILLON Y., 1989 - Partage des ressources et
spécialisation trophique chez les acridiens (Insecte, Orthoptère,
Acridomorpha) non graminivores dans la savane pré forestière.
(Lamto, Côte d'Ivoire) .Acta Oecologie , Oecol . Gen ., 10 (1) : 51
-74.
LE GALL P., 1989 - Le choix des plantes nourricières et
la spécialisation trophique chez les Acrididea (Orthoptères),
Bulletin d'écologie, 20 : 245-261
LE HOUEROU H.N., 1990 - Définition et limites
bioclimatiques du Sahara. Science et changements planétaires,
Sécheresse. 1(4) : 246-259.
91
LECOQ M., 1978 biologie et dynamique d'un peuplement acridien
de zone Soudanienne en Afrique de l'Ouest (Orthoptères - Acrididae).
Ann. Soc. Ent. France, 14 (4) : 603 - 681.
LEE S.S. and WONG I.M., 1979 - The relationship between food
plants, haemolymph protein and ovarian development in Oxya japonica Willemese
(Orthoptera - Acrididae). Acrida, 8 (1): 1- 8.
LORELLE V., 1989 - Quand la lutte tourne à la guerre :
l'exemple Marocain. Phytoma, 404 : 25-30.
LOUVEAUX A. et BEN HALTIMA T., 1987 - Catalogue des
orthoptères Acrididae d'Afrique du nord-ouest. Bull. Soc. Ent.Fr.91
(3-4) : 73-86.
LOUVEAUX A., 1976 - Prise de nourriture chez le criquet
migrateur Locusta migratoria. Bull. Soc. Zool., France, 101 (5) : 1052-1053.
LOUVEAUX A., MAINGUET A.M. et GILLON Y., 1983 - Recherche de
la signification des différences en valeur nutritive observée
entre feuilles de blé jeunes et âgées chez Locusta
migratoria (R. et F.) (Orthoptera - Acrididae). Bull. Soc. Zool., France, 108
(3) : 453-465.
MASON M., 1989 - Locust et Sautériaux : Le criquet
migrateur africain : Biologie et lutte. Revue phytosanitaire, Paris, 18-20.
MASTER J., 1984 - Régime alimentaire et consommation
des adultes Machaeridia bilineata (Orthoptera - Acrididae) en fonction
de la couverture graminéenne d'une savane (Lamto, côte d'Ivoire).
Acto Oecologica , Oecol . gener. , 5 (1) : 63-70.
MASTER J., 1988 - Les acridiens des formations herbeuses
d'Afrique de l'Ouest. Ed. CIRAD, Paris, 322p.
MEYNADIER G., AMARGIER J., GIRARDIE J. et VAGO C., 1992 - Une
entomopoxivirose, Chez l'orthoptère Anacridium aegyptium.
Entomophaga, 37(3) : 453-464.
MEYNADIER G., MATZ G., VEYRUNES J.C., et BRES N., 1977 -
Virose de type densonucleose chez les orthoptères. Ann. Soc. Ent. Fra.
N.S., 13(3) : 487-493.
MEZREB D., 1993 - Bioécologie des orthoptères et
contribution à l'étude du régime alimentaire de
Calliptamus barbarus (Costa, 1836) dans la région de Ain El Hammam
(Tizi-Ouzou). Mémoire ingénieur agronome, INA, El-Harrach, Alger,
71p.
MOHAMMEDI A., 1989 - Approche biosystématique des
Caelifères dans la région d'Ain-Defla. Mémoire
ingénieur agronome, INA, El-Harrach, Alger, 100P.
92
MOISSONNIE R., MARTY R. et BOUDOU A., 1977 - Gradients
biocénotiques pré-pyrénéens et indicateurs d'action
humain d'après l'étude des groupements d'Orthoptères.
Acrida, 6 (2) : 153-161.
NDYANABO F. et BYARUHANGA E.K., 1989 - Locust et
Sautériaux : Le criquet migrateur africain : Biologie et lutte. Revue
phytosanitaire, Paris, 14-16.
NUREIN M.O.M., 1989 - Locust et Sautériaux : Le criquet
migrateur africain : Biologie et lutte. Revue phytosanitaire, Paris, 3-9.
O.N.M., 1992 - Office national de la
météorologie, Rapport sur les données climatiques de
Ghardaïa, 6 p.
OULD EL HADJ MD., 1991- Bioécologie des Sauterelles et
des Sauteriaux dans trois zones d'étude au Sahara. Thèse
Magister, INA, El-Harrach, Alger, 85p.
OULD TALEB M.D., 1991 - Etude bioécologique des
orthoptères de quelques stations en Mauritanie, Mémoire
ingénieur agronome, INA, El-Harrach, Alger, 104p.
OZENDA P., 1983 - Flore du Sahara. Ed. C.N.R.S, Paris 622
p.
PAPILLON M. et CASSIER P., 1978 - Perturbations morphologiques
dues à la présence du protozoaire parasite Melomeba locustae (K.
et T.) chez Schistocerca gregaria (Forskål). Acrida, 7 (2) : 86-101.
PASQUIER R., 1946 - Les étapes de la vie de la
sauterelle pèlerine. Ext. Bull. Semes. Off. Nat. Ant. Acr., 1 : 7-13.
PIERRE F., 1958 - Ecologie et peuplement entomologique des
sables vifs du Sahara nord-occidental. Ed. Cen. Nat. Rec. Sci., Paris,
19-30.
RACCAUD-SHOELLER J., 1980 - Les insectes. Physiologie et
développement. Ed. Masson, Coll. Biologie maîtrise, Paris, 296p
RAMADE F., 1984 - Eléments d'écologie- Ecologie
fondamentale. Ed. Mc Graw-Hill, Paris, 197p.
ROEHRICH F., 1951 - Parasites et prédateurs du criquet
migrateur Locusta migratoria gallica, dans les landes de Gascogne de
1945 à 1950. Ann. des Epiphyties, Paris, 3-4 : 479-495.
SKAF R., 1989- Locustes et Sautériaux : Le Criquet
marocain. Revue Phytosanitaire, Paris., 10-11.
TAMZAIT A., 1990 Approche biosystématique du genre
Calliptamus (Serville, 1831) dans la région médio septentrionale
de l'Algérie. Mémoire ingénieur agronome, INA, El-Harrach,
Alger, 51 p.
93
UVAROV B., 1966- Grasshopper and locusta and hand book of
general acridology. Anti. Locust. Res. Cent., T. 6, London, 48 p.
VIAL Y .et VIAL M. - 1974 - Sahara milieu vivant. Ed. Hatier,
Paris, 224 p.
VINCENT Y. et BOIVIN G., 1986 - Les relations insectes-plantes
: perspectives de recherches. Revue d'entomologie du Québec, 31 (1-2) :
4-15.
VOISIN J.F, 1986-Une méthode simple pour
caractériser l'abondance des Orthoptères en milieux ouvert.
L'entomologiste, 42 : 113-119.
VOISIN J.F., 1980 - Réflexion à propos d'une
méthode d'échantillonnage des peuplements d'orthoptères en
milieu ouvert. Acrida, 9 : 159-170.
VOISIN J.F., 1990 - Observations sur les Orthoptères du
Massif Central. 4 Chorthippus parallelus (Zetterstedt 1821) (Orthoptera -
Acrididae). Bull Soc Entomol France 95: 89-95.
ZERGOUN Y., 1991 - Contribution à l'étude
bioécologique des peuplements Orthoptérologique dans la
région de Ghardaïa. Mémoire ingénieur agronome, INA,
El-Harrach, Algeria, 73 p.
|
|



