|

REPUBLIC OF CAMEROON
REPUBLIQUE DU CAMEROUN
Peace - Work - Fatherland
Paix - Travail - Patrie
**********
*************
UNIVERSITY OF NGAOUNDERE
UNIVERSITE DE NGAOUNDERE
FACULTY OF SCIENCES
FACULTE DES SCIENCES
****
****
DEPARTEMENT DE CHIMIE
DEPARTMENT OF CHEMISTRY
M. HAROUNA
MASSAÏ
Professeur
FS
Université de Ngaoundéré
Université de Ngaoundéré
M. NSOE MENGUE Jean Jacques Nestor Chargé de
cours
BP: 454 NGAOUNDERE Tel: (237) 222 25 40 32
*******
BP: 454 NGAOUNDERE Tel: (237) 222 25 40 32
********
ADSORPTION DU METRONIDAZOLE EN SOLUTION AQUEUSE
PAR
L'ARGILE MODIFIEE DE MINDIF : APPLICATION DES
PLANS
D'EXPERIENCE
Mémoire présenté en vue de
l'obtention du diplôme de Master en Chimie Inorganique
Option : Chimie physique
Par
HABGUE BASSIGUE Barnabé (Licencié ès
Chimie)
Matricule : 17A055FS
Sous la direction de :
Année Académique 2021-2022

DEDICACE

A la mémoire de feu mon père BASSIGUE GAG
BAROUM , A ma mère LARGUILAH Damaris ,
A mon grand frère Dr. KALPET
Emmanuel.

REMERCIEMENTS
II
Le grand merci est à DIEU `'le tout
puissant» pour la grâce qu'il m'a accordé pour
réaliser ce travail. Ce travail a été
réalisé au sein de laboratoire de Chimie de l'Ecole Polytechnique
et de la faculté des Sciences de l'Université de Maroua.
Mes remerciements les plus sincères à l'endroit
des personnes ci-après :
Je tiens à exprimer ma profonde gratitude à
l'endroit du Pr. Harouna MASSAÏ Vice-recteur de
l'Université de Garoua, qui a accepté superviser ce
mémoire et à qui je suis très reconnaissant pour sa
patience, ses conseils avisés et son soutien en toutes circonstances.
Puisse Dieu vous élever davantage.
Je remercie mon Directeur de mémoire, Dr NSOE
MENGUE Jean-Jacques Nestor, de m'avoir encadré et pour avoir
suivi avec beaucoup d'intérêt ce travail, pour ses nombreux
conseils, son soutien, sa confiance et ses qualités humaines très
exceptionnelles. Qu'il trouve ici l'expression de ma profonde
reconnaissance.
J'adresse mes sincères remerciements au Pr.
NGAMENI Emmanuel , Doyen de la faculté des sciences de
l'Université de Ngaoundéré et son
prédécesseur Pr. EDIMA Helène Carole, au
Pr. NOUMI Guy Bertrand, Chef de Département de Chimie,
pour la qualité de formation et d'encadrement qu'ils ont su donner aux
étudiants de la faculté et du département de Chimie.
A nos Enseignants du département de Chimie de
l'Université de Ngaoundéré, Professeurs TALLA,
TCHAMANGO, MOMENI, et aux Docteurs, ABIA, TCHEKA, NANA, FADIMATOU, KOM, YAYA,
ABDOU et FOMOGNE pour la qualité de leurs enseignements, la
rigueur et l'exemplarité de leur comportement humain et
académique. Recevez aussi notre gratitude pour vos multiples conseils
qui nous ont permis de nous améliorer.
Je dis merci au Pr. KOUBALA BARGUI Benoit,
Chef de Département de Chimie de la faculté des Sciences de
l'Université de Maroua de m'avoir accueilli dans son Laboratoire.
Je ne saurais remercier le Pr NJINTANG YANOU Nicolas,
Pr BIKE MBAH , Enseignants à l'ENSAI et le Pr NOUBISSIE
Éric enseignant à l'Institut Universitaire de
Technologie, pour leurs enseignements.
Je suis infiniment gré aux sieurs TEJEOGUE Jean
Paul, EBIO, DJONKA et aux Docteurs Dobe, TEGUIA ,
WANGSO,BAYANG,WANGMENE et DJAKBA pour leur conseil, leur soutien et
les nombreux sacrifices afin que ce travail puisse être
réalisé.
Mes remerciements vont également à l'endroit de
tous nos amis et camarades : Henry Lona, Abel, Kowé, Dayang,
Aboina Camille, Menwa Kouvou Welcome ,Yiningolo,
III
Wandou, Barka, Kouchakbé, Ambawûmu, Gota
,Aldo, Abya, Nguenamadje pour leurs aides et soutiens multiformes.
Je ne pourrais terminer sans remercier ma famille qui m'a
toujours soutenu. Ce travail est le fruit d'énormes sacrifices qu'elle a
consentis pour mon éducation. Je pense surtout à ma mère
LARGUILAH Damaris ; mes frères, BAROUM, Dr.
KALPET, BAIGAG, ISSA ; mes soeurs DAGUEDJANG, BRILLA et
EÏWA ; mes belles soeurs , RUTH et ROSALIE ainsi que mes
nièces.
Mes remerciements vont enfin à tous ceux qui de
près ou de loin ont contribué à la réalisation de
ce travail. Qu'ils trouvent ici l'expression de ma sympathie.

TABLE DES MATIERES
iv
DEDICACE i
REMERCIEMENTS ii
TABLE DES MATIERES iv
LISTE DES FIGURES vii
LISTE DES TABLEAUX viii
LISTE DES ANNEXES ix
LISTE DES ABREVIATIONS x
RESUME xi
ABSTRACT xii
INTRODUCTION 1
: REVUE DE LA LITTERATURE 3
I.1. Généralité sur les produits
pharmaceutiques 3
I.1.1. L'origine des molécules pharmaceutiques dans les
eaux 3
I.1.2. Caractéristiques et effet toxicologique de produits
pharmaceutiques 4
I.1.3. Fréquence de détection et contamination des
environnements aquatiques 5
I.1.4. Les risques de contamination pour l'homme 6
I.1.5. Toxicités et impact sur la faune et la flore 7
I.1.6. Métronidazole (définition et utilisation)
8
I.1.7. Toxicité de Métronidazole 8
II- Procédés d'élimination des
produits pharmaceutiques 9
II.1. Procédés biologiques : 9
II.1.1. Filtration 9
II.1.2. Procédés membranaires 9
II.1.3. Coagulation/Floculation/Séparation 10
II.2.1. Généralité sur le
phénomène d'adsorption 10
II.2.1.1. Types d'adsorption 11
II.2.1.2. Mécanisme d'adsorption 12
II.2.1.3. Isotherme d'adsorption 14
Classification de Giles 14
Adsorption gaz-solide 16
II.2.1.4. Modélisation des isothermes d'adsorption 18
II.2.1.5. Etude de la cinétique d'adsorption 21
II.2.1.5.1. Modèle cinétique de premier ordre 21
II.2.1.5.2. Modèle cinétique du deuxième
ordre 21
V
II.2.1.5.3.Modèle de diffusion intra-particulaire 22
III. Généralité sur les adsorbants
23
III.1. Généralité sur les argiles
23
III.1.1. Structure des minéraux argileux 24
III.1.2. Classification des argiles 25
III.1.3. Propriétés des argiles 28
IV. LES PLANS D'EXPERIENCES 29
IV.1. Définition et description 29
V. Etat de l'art sur l'adsorption du
métronidazole 31
: MATERIEL ET METHODES 34
II.1 MATERIEL 34
II.2. METHODES 34
II.2.1. Fractionnement et purification de l'argile 34
II.2.2. Purification à l'acide chlorhydrique 35
II.3. MODIFICATION DE L'ARGILE 35
II.3.1. Préparation de l'argile sodique 35
II.3.2. Préparation de l'argile pontée 36
II.3.2.1.Préparation d'une solution pontante :
Solution d'hydroxyde d'aluminium
(A1(OH)3) 36
II.3.2.2. Pontage de l'argile 37
II.4. Méthodes de détermination de
quelques propriétés physico-chimiques de l'argile
purifiée 38
II.4.1. Détermination de la perte au feu (PAF) 38
II.4.2. Détermination du taux d'humidité 39
II.4.3. Détermination de l'indice de gonflement (IG)
39
II.4.4. Détermination de la densité (d) 39
II.4.5. Détermination du pH 39
II.4.6. Détermination de la porosité (P) 40
II.4.7. Détermination du point de charge nul
(pHPZC) 40
II.5. Propriétés physico-chimiques du
métronidazole 40
II.5.1. Préparation de la solution mère du
métronidazole 41
II.5.2. Méthodes de dosage par spectrophotométrie
UV-Visible 41
II.6. Etude de quelques paramètres d'adsorption
42
II.6.1. Temps d'agitation 42
II.6.2 Influence de la concentration initiale 42
II.7. Plan d'expérience 43
II.6.1. Planification du plan d'expérience 43
vi
II.7.2. Choix du Plan d'expérience et facteurs
d'études 43
II.7.3. Application d'un plan factoriel complet
33à la modélisation du
métronidazole 43
II.8. Traitement des données 44
RESULTATS ET DISCUSSIONS 45
III.1. Caractéristiques physico-chimiques de
l'argile naturelle de Mindif 45
III.1.1. Taux d'humidité 45
III.1.2. Perte au feu 45
III.1.3. Indice de gonflement 45
III.1.4. Le pH 46
III.1.5. Le pHpzc 46
III.2 Analyse statistique de la quantité
adsorbée (pourcentage d'élimination) du
Métronidazole 47
Tableau 5: Analyse statistique de la quantité
adsorbée (pourcentage d'élimination) du
Métronidazole 47
III.2.1. Analyse des variances (ANOVA) 48
III.2.2. Modélisation et optimisation du plan factoriel
complet 52
III.2.3. Analyse des principaux facteurs examinés et leurs
interactions 54
III.2.4. Optimisation des facteurs influents par la
méthodologie de surface de réponse 55
III.3. Influence du temps de contact 57
III.4. Influence de la concentration 59
III.5. Etude de la cinétique d'adsorption
60
III.6. Etude des isothermes d'adsorption 62
CONCLUSION ET PERSPECTIVE 67
REFERENCES BIBLIOGRAPHIQUES 69
vii
LISTE DES FIGURES
Figure 1:Mécanisme de diffusion de l'adsorbat vers
l'adsorbant (Sali,2018) 13
Figure 2:Les quatre types d'isotherme selon la classification de
Giles. (Ngakou,2019) 15
Figure 3:Les différents types d'isothermes
d'adsorption/désorption selon l'IUPAC
(Hanen,2015). 18
Figure 4: Représentation des couches octaédriques
et tétraédriques. (Bouzid Samia, 2015). 24
Figure 5:Représentation schématique de la structure
de la kaolinite 26
Figure 6:Représentation schématique de la structure
d'une argile de type TOT 27
Figure 7:Localisation de l'eau dans les particules argileuses,
(Diatta, 2016). 28
Figure 8:Schéma de la démarche
méthodologique lors du choix d'un plan d'expérience
(Adapté
de Ngakou, 2019 ; Mohamed & Yassine, 2013) 31
Figure 9:Dispositif de séparation de la fraction argileuse
35
Figure 10:Protocole de préparation de l'argile sodique
36
Figure 11:Protocole de préparation de l'argile
pontée (Dobe 2018) 38
Figure 12:Courbe d'étalonnage du métronidazole
42
Figure 13: Détermination du point de charge nul de
l'argile brute de Mindif 46
Figure 14:Diagramme de pareto des effets normalisés pour
l'adsorption du métronidazole pour
l'argile brute 53
Figure 15:Diagramme de pareto des effets
normalisés pour l'adsorption du métronidazole par
l'argile sodique 53
Figure 16:Diagramme de pareto des effets
normalisés pour l'adsorption du métronidazole par
l'argile pontée 54
Figure 17:Diagramme de surface de réponse de Qe pour
l'adsorption du MNZ par ABM 55
Figure 18:Diagramme de surface de Qe pour l'adsorption du MNZ par
ASM 56
Figure 19: Diagramme de surface de réponse pour
l'adsorption du MNZ par l'APM 56
Figure 20:Cinétique d'adsorption du Métronidazole
sur les argiles 58
Figure 21:influence de la concentration sur l'adsorption du
Métronidazole sur les argiles. 59
Figure 22:modèle cinétique de l'adsorption du
métronidazole par l'argile brute 60
Figure 23:modèle cinétique de l'adsorption du
métronidazole par l'argile sodique 61
Figure 24:modèle cinétique de l'adsorption du
métronidazole par l'argile pontée 61
Figure 25:Isothermes linéaires d'adsorption du
métronidazole par l'argile brute 63
Figure 26:Isothermes linéaires d'adsorption du
métronidazole par l'argile sodique. 64
Figure 27:Isothermes linéaires d'adsorption du
métronidazole par l'argile ponté 64
VIII
LISTE DES TABLEAUX
Tableau 1:les principales différences entre
l'adsorption physique et l'adsorption chimique.
(Salaa,2021) 12
Tableau 2:Conditions pour la préparation de la solution
pontante 37
Tableau 3:facteurs et domaine d'étude 44
Tableau 4: Caractéristiques physico-chimique de
l'argile brute de Mindif 45
Tableau 5: Résultat des quantités
adsorbées 47
Tableau 6:Analyse de la variance pour Qe de l'argile brute
49
Tableau 7:Analyse de la variance pour Qe de l'argile sodique
50
Tableau 8:Analyse de la variance pour Qe de l'argile
pontée 51
Tableau 9:constante de vitesse et coefficient de
corrélation des modèles cinétiques 62
Tableau 10:Récapitulatif des constantes et des
coefficients de corrélation des isothérmes 65
ix
LISTE DES ANNEXES
Tableau A.1: Détermination du point de charge nul 78
Tableau A. 2:Etalonnage du Métronidazole 78
Tableau A. 3: Plan d'expériences à 27 essais,
résultats expérimentaux 79
Tableau A. 4:Résultats expérimentaux de
l'adsorption du Métronidazole en utilisant un plan
factoriel complet avec l'argile brute 82
Tableau A.
5:Résultats expérimentaux de l'adsorption du Métronidazole
en utilisant un plan
factoriel complet avec l'argile sodique 83
Tableau A
.6:Résultats expérimentaux de l'adsorption du
Métronidazole en utilisant un plan
factoriel complet avec l'argile pontée 84
Tableau A.
7:Evolution de l'adsorption du métronidazole par l'argile brute en
fonction du temps
d'agitation 85
Tableau A. 8:Evolution de l'adsorption du
Métronidazole par l'argile Sodique en fonction du
temps d'agitation 85
Tableau A. 9: Evolution de
l'adsorption du Métronidazole par l'argile Pontée en fonction
du
temps d'agitation 85
Tableau A. 10:Influence de la
concentration sur de l'adsorption du Métronidazole par l'argile
brute 86
Tableau A. 11:Influence de la concentration sur de
l'adsorption du Métronidazole par l'argile
sodique 86
Tableau A. 12:Influence de la concentration sur
de l'adsorption du Métronidazole par l'argile
pontée 86
X
LISTE DES ABREVIATIONS
ABM : argile brute de Mindif ASM : argile sodique de Mindif APM :
argile pontée de Mindif CEC : capacité d'échange
cationique
DL50: Dose létale 50 DDL : degré de liberté
MNZ : métronidazole
pH : Potentiel d'hydrogène
S : Sigmoïde
L : Langmuir
H : Haute affinité
C : Partition Constante
D-R : Dubinin-Radushkevich
STEP : station d'épuration
pHpzc : Point de charge nul

RESUME
xi
Le présent travail porte sur l'étude
d'élimination par adsorption du métronidazole en solution aqueuse
par l'argile de Mindif. De nos jours, des recherches se dirigent vers des
adsorbants naturels tel que l'argile en raison de leur grande capacité
d'échange cationique. Pour ce faire, l'argile a été
purifiée à l'acide, sodée et pontée, puis
calcinée à 400°C. L'utilisation d'une matrice factorielle
complète nous a permis de déterminer les effets principaux et
interactions de facteurs utilisés. Les études montrent que
l'adsorption du métronidazole sur les adsorbants est très rapide.
Le temps d'équilibre du métronidazole est de 20min, 15min et 10
min respectivement pour l'argile brute, l'argile sodique, et l'argile
pontée. Les taux d'élimination à cet équilibre sont
52,638% ; 54,214% ; 66,096% respectivement pour nos adsorbants. Les
quantités adsorbées et le taux d'élimination du
métronidazole augmentent avec une diminution de la masse d'adsorbant et
une augmentation de la concentration du métronidazole en solution. A des
valeurs de pH acide (pH=3), les quantités adsorbées de ce
polluant étant plus élevées qu'à des valeurs de pH
neutre ou de pH basique. Les études montrent également que la
réaction d'adsorption du métronidazole sur les argiles est de
type chimique. Les modèles mathématiques (cinétique) de
pseudo-second ordre ainsi que les isothermes de Freundlich et de Langmuir
peuvent être exploités pour décrire le
phénomène d'adsorption du métronidazole par l'argile de
Mindif, localité de la région de l'extrême-Nord
Cameroun.
Mots clés : Argile,
métronidazole, adsorption, isothermes, cinétique.

ABSTRACT
XII
The present work deals with the study of the removal by
adsorption of metronidazole in aqueous solution by Mindif clay. Nowadays,
research is directed towards natural adsorbents such as clay because of their
high cation exchange capacity. For this purpose, the clay was acid purified,
sodaized and bridged, then calcined at 400°C. The use of a full factorial
matrix allowed us to determine the main effects and interactions of the factors
used. The studies show that the adsorption of metronidazole onto the adsorbents
is very rapid. The equilibrium time of metronidazole is 20 min, 15 min and 10
min for raw clay, sodium clay, and bridged clay respectively. The removal rates
at this equilibrium are 52.638%; 54.214%; 66.096% respectively for our
adsorbents. The adsorbed amounts and removal rates of metronidazole increase
with decreasing adsorbent mass and increasing concentration of metronidazole in
solution. At acidic pH values (pH=3), the adsorbed quantities of this pollutant
are higher than at neutral or basic pH values. The studies also show that the
adsorption reaction of metronidazole on clays is chemical. Pseudo-second order
mathematical (kinetic) models as well as Freundlich and Langmuir isotherms can
be exploited to describe the phenomenon of metronidazole adsorption by Mindif
clay, a locality in the far north region of Cameroon.
Keywords: Clay, metronidazole,
adsorption, isotherms, kinetics.
1
INTRODUCTION
L'eau est une source indispensable à toute forme de
vie. Cette dépendance inévitable conduit à la notion de
patrimoine commun à tous les organismes vivants (Laouameur, 2021). 1%
seulement du volume total d'eau douce de la planète est facilement
accessible et utile pour l'homme soit 0,025% du volume total d'eau de la
planète (Deoliveira,2019). Cette eau utile subit les plus fortes
pressions par les activités humaines dont l'impact a déjà
amorcé d'importantes variations environnementales, entrainant de
répercussions sur les besoins de écosystèmes ainsi que sa
disponibilité pour l'usage humain (Sorower,2020).
Cela souligne les enjeux fondamentaux : le premier est celui
de la préservation des ressources, le second concerne les risques
inhérents à la présence des composés partiellement
actifs dans l'environnement et des écosystèmes. (Laoumeur,2021 ;
Mompelat et al.,2009 ;Humetal,2006).
La contamination par les antibiotiques est l'un des
problèmes mondiaux. La présence de ces contaminants dans
l'environnement pose une menace pour la santé humaine et nuit les
écosystèmes aquatiques et terrestres car ils s'accumulent dans
l'eau, les sols et sédiments.
En général, les produits pharmaceutiques sont
largement utilisés pour traiter ou prévenir les maladies en
médecine humaine et vétérinaire et les antibiotiques font
partie des produits pharmaceutiques les plus importants et les plus
utilisés leur présence même à des très
faibles concentrations dans l'eau a attiré l'attention des scientifiques
en raison des risques sur l'environnement et la santé humaine. Le
métronidazole est l'un des antibiotiques commerciaux les plus importants
au monde avec une consommation annuelle au marché mondial estimé
à 100000 et 200000 tonnes. Il est également utilisé comme
traitement thérapeutique dans le domaine de la médecine humaine
et vétérinaire, la concentration de cet antibiotique dans les
eaux usées est estimée à 1,8 à 9,4ug/L dans les
eaux usées hospitaliers (Deoliveira,2020).
Généralement, l'élimination de ce
composé n'est pas complète, elle est causée par leur
résistance à la biodégradation, donc la rétention
des produits de ce type est considérée comme une technologie dans
les stations de traitement de l'eau.
Cette étude s'inscrit dans une problématique
globale de la préservation de la ressource en eau face au danger que
peuvent générer les produits pharmaceutiques et plus
spécifiquement le métronidazole.
Pour ce faire, différentes techniques ont
été utilisées pour l'élimination de certains
polluants solubles dans les effluents industriels, hospitaliers, domestiques.
Elles sont différentes les unes par rapport aux autres et peuvent
être citées à titre d'illustration : l'adsorption, la
flottation, l'électrocoagulation, la précipitation, les
échanges d'ions, l'extraction liquide-liquide, la filtration
membranaire...(Bouzid,2015). L'adsorption s'est avérée comme une
option
2
économiquement viable et fiable, en raison de son
faible coût d'exploitation (Salaa,2021). Le principe de base est le
transfert des solutés nocifs de la phase liquide à la surface des
adsorbants solides grâces à des attractions
intermoléculaires (Moyo et al., 2014)
Plusieurs adsorbants sont utilisés dans le traitement
de ces eaux, le choix d'argile comme adsorbant se justifie par le fait qu'elle
est une matière première très abondante de la croûte
terrestre (Jalil et al.,2013). Les argiles sont des matériaux
peu onéreux et facilement accessibles qui présentent
d'excellentes propriétés d'échanges de cations et qui
peuvent être utilisés pour adsorber des contaminants.
La présente étude s'inscrit dans le cadre d'une
valorisation des argiles, particulièrement l'argile camerounaise de la
zone de Mindif dans la région de l'Extrême-Nord.
L'objectif général de ce travail est de
réduire, voire éliminer le Métronidazole en solution
aqueuse à partir de l'argile.
De manière spécifique, nous nous proposons :
y' De préparer l'argile sodique et l'argile pontée
à partir de l'argile brute ; y' D'utiliser la méthodologie de la
surface de réponse pour étudier et déterminer les
paramètres maximum d'adsorption tels que : le pH, la masse
et le temps d'équilibre ; y' D'étudier quelques isothermes
d'adsorption et modèles cinétiques.
Les hypothèses qui peuvent être formulées
sont :
+ L'argile brute, l'argile sodique, l'argile pontée
adsorbent le métronidazole en solution aqueuse ;
+ les paramètres expérimentaux (????,
temps de contact et la masse de l'adsorbant) influencent sur l'adsorption du
métronidazole ;
+ Les isothermes et modèles cinétiques connues
décrivent le processus d'adsorption.
Ainsi ce travail est présenté de la manière
suivante :
Le premier chapitre porte sur la revue de la
littérature, il aborde les généralités sur les
argiles, les phénomènes d'adsorption, les résidus
médicamenteux et les plans d'expérience. Le deuxième
chapitre présente le matériel et les méthodes
utilisés tout le long de ce travail, il élucide les protocoles
expérimentaux, ainsi que la matrice d'expérience. En fin, le
troisième chapitre porte sur les résultats et discussion.

: REVUE DE LA LITTERATURE
3
I.1. Généralité sur les produits
pharmaceutiques
Les produits pharmaceutiques sont largement utilisés
pour prévenir et traiter les maladies (Salaa,2021 ;Tiwari et
al.,2017). Ces composés sont classés par
catégorie en tant que polluants émergents, en raison de leur
stabilité et effets néfastes sur la santé humaine et la
vie aquatique (Stadlmair et al.,2018). Les principales sources de la
pollution pharmaceutique sont les déchets des usines, de
médicaments, la santé, les centres, les ménages et les
pharmacies (Chantogra et al.,2019). Les produits pharmaceutiques sont
généralement présents dans l'eau en mélanges, ce
qui étend leur temps de résidence et augmente le risque de
migration (Liu et al.,2019). Ces groupes peuvent être toxiques
même à de faibles concentrations, en raison de l'effet de
coopération (Shaob et al.,2016). Les principaux produits
pharmaceutiques sont les antibiotiques, anti-inflammatoires non
stéroïdiens, régulateurs de lipides, â-bloquants et
hormones (Kanajaraju et al.,2O18).
I.1.1. L'origine des molécules pharmaceutiques
dans les eaux
La présence de composés pharmaceutiques dans les
eaux peut s'expliquer par 4 voies d'entrée :
-La première voie, majoritaire, est celle de
l'excrétion (domestique) des médicaments et de leurs
métabolites après utilisation par les patients.(Tiphanie et
al.,2012). La molécule est administrée au patient,
absorbée et métabolisée par son organisme pour être
excrétée puis rejetée dans les eaux usées qui
seront traitées en station d'épuration (STEP). La quantité
retrouvée dans les eaux dépend donc, pour cette voie d'apport, de
la consommation faite par la population. Celle-ci vieillissant et augmentant,
les quantités consommées, et rejetées, ne font que
croître. De plus, selon (Mountague,2001), 50 à 90 % d'un
médicament absorbé est excrété sous forme
inchangée. -La seconde voie d'apport est constituée par les
rejets des établissements de soins. C'est une source particulière
de contamination car les eaux usées de ces établissements ont un
profil spécifique et contiennent en quantité plus importantes des
antibiotiques, des anti-infectieux, des produits de contraste iodés et
des anticancéreux. Elle a été estimée à
travers plusieurs études à environ 20 % de l'ensemble des
apports. Les effluents n'étant pas traités sur place, ces rejets
se retrouvent dans les STEPs.
-La troisième voie d'apport est constituée par
les rejets des médicaments non utilisés à l'évier
ou dans les toilettes (Voulvoulis et al.,2005).
-La dernière voie d'apport concerne les effluents des
industries qui produisent les différentes molécules
pharmaceutiques. Ce type de production fait l'objet d'un contrôle
sévère de ses
4
effluents après traitement dans les pays
développés ; ce n'est pas encore le cas dans les pays
émergents où sont fabriqués beaucoup de
génériques.
Toutes les différentes classes thérapeutiques
sont retrouvées dans les eaux usées mais
les quantités sont différentes en fonction de la
consommation, du niveau de métabolisation
de la molécule et du taux de dilution dans les eaux
usées urbaines
I.1.2. Caractéristiques et effet toxicologique de
produits pharmaceutiques
Les produits pharmaceutiques sont des produits chimiques
utilisés pour diagnostiquer, traiter, changer et prévenir des
maladies. La définition est étendue aux services
vétérinaires et peut également être appliquée
aux drogues illicites (Daughton et al.,1999). Une grande
variété de médicaments, y compris les antibiotiques,
hormones de synthèse, anti-inflammatoires, statines et ichtyotoxines
sont produits et consommés, certains en milliers de tonnes par an
(Metcalfe et al.,2003). Les produits pharmaceutiques sont des
contaminants chimiques en raison des caractéristiques suivantes
(Langford et al.,2007):
(a) Ils peuvent être formés par d'innombrables
molécules complexes qui varient en terme de poids moléculaire,
structure, fonctionnalité et forme ;
(b) Ils ont la capacité de passer via les membranes
cellulaires et sont donc relativement persistants;
(c) Il s'agit de molécules polaires comportant plus
d'une charge et leur degré d'ionisation, entre autres
caractéristiques, dépend du pH du milieu ;
(d) Ils sont lipophiles et certains sont
modérément solubles dans l'eau ;
(e) Des nombreux groupes des médicaments peuvent
persister dans l'environnement pendant plus d'un an ; d'autres peuvent
persister pendant plusieurs années et devenir biologiquement actifs en
raison de leur accumulation ;
(f) Après administration, les molécules sont
absorbées dans le corps humain, distribuées et soumises à
des réactions métaboliques qui peuvent modifier leur structure
chimique.
Ces substances ont suscité une grande
inquiétude, car après leur consommation, des traces ou des
métabolites sont excrétés et atteignent les sources d'eau,
soit directement, soit après un traitement inefficace (Kummerer,2001).
Même si les concentrations de produits pharmaceutiques dans les eaux de
surface sont faibles, leur présence et persistance menace la vie
aquatique et terrestre, et leur effet ne doit pas être ignoré,
même s'il est très difficile à estimer à long terme
(Asghar et al.,2018). De nombreuses études ont proposé
des traitements pour les éliminer efficacement, tels que la
nanofiltration et osmose inverse (Kamrami et al.,2018), la
photocatalyse , l'ozonisation (Wang et al.,2017) et l'adsorption
(Alvarez et al.,2017).
5
I.1.3. Fréquence de détection et
contamination des environnements aquatiques
La contamination de tous les milieux aquatiques par les
produits pharmaceutiques est de mieux en mieux connue, du fait d'une
bibliographie qui connaît une croissance significative. En effet, si
« seulement » 500 études étaient publiées en
2000, avec pour objectif de caractériser ces contaminations dans les
compartiments aquatiques, plus de 2500 ont été publiées en
2010 sur le sujet (Fatta-Kassinos et al., 2011).
Les eaux concernées sont de plusieurs natures et il est
nécessaire d'évaluer les niveaux de contaminations de chacun des
compartiments aquatiques. Les premières analyses ont été
réalisées dans des stations d'épuration, lieu
privilégié pour la compréhension de la dégradation
des produits pharmaceutiques. Tout d'abord, les produits pharmaceutiques
excrétés convergent vers les installations épuratoires qui
permettent d'intégrer le signal d'un bassin versant, d'une ville ou d'un
quartier. D'autre part, parce que les rejets de ces stations, souvent
pollués par des produits pharmaceutiques, donnent des informations sur
l'efficacité des traitements appliqués ainsi que sur le niveau de
contamination des eaux, qui seront par la suite rejetées dans
l'environnement. Le niveau de contamination des eaux naturelles va
également être anormalement élevé dans certains cas
précis.
On peut notamment prendre l'exemple des effluents
hospitaliers, qui, du fait de la surconsommation de produits pharmaceutiques
dans les hôpitaux par rapport à une population classique,
impliquent des concentrations nettement plus élevées par rapport
à la « normale » et/ou contribuent fortement aux occurrences
en produits pharmaceutiques par rapport aux effluents domestiques en cas de
mélange (Ort et al.,2010a).
6
A titre d'exemple, certains médicaments comme la
codéine ou le métronidazole ont des occurrences à
plusieurs mg.L-1 dans ce type d'eaux (Verlicchi et al., 2010) soit des
concentrations environ 1000 à 10000 fois plus élevées que
pour une eau usée considérée comme classique (Deblonde et
al., 2011 ; Nikolaou et al., 2007 ; Petrie et al.,
2013).
La pollution engendrée par les usines de fabrication de
médicaments constitue une autre source majeure de rejets de produits
pharmaceutiques dans l'environnement (Larsson, 2014). Plusieurs études
mettent en avant le vecteur de pollution majeure que représentent ces
industries à partir de l'exemple d'une usine très importante en
Inde, dont les effluents contaminent les lacs en aval. On retrouve des
occurrences des concentrations de plusieurs mg.L-1 d'antibiotiques dans ces
lacs, située en aval de la manufacture (Fick et al., 2009).
Les flux extrapolés sont tout aussi significatifs. A
titre d'exemple, le flux de 44 kilogrammes de ciprofloxacine rejetés
dans les eaux naturelles chaque jour, équivaut à 5 ans de
consommation pour un pays comme la Suède (Larsson, 2014).
Ces deux exemples de concentrations ponctuelles très
élevées sont donc potentiellement très
problématiques, notamment par rapport à d'éventuels
phénomènes de résistance des communautés
bactériennes, engendrées par une exposition significative et
chronique à ce type de polluants (Kristiansson et al.,
2011).
I.1.4. Les risques de contamination pour
l'homme
Les principes actifs de médicaments appartiennent aux
substances les mieux analysées de la toxicologie humaine. Dans le cadre
de l'autorisation de médicaments, un principe actif ne sera pas
seulement analysé sur son efficacité thérapeutique, mais
aussi sur un grand nombre d'effets secondaires non souhaités.
D'après l'avis unanime des experts, aujourd'hui, tout danger aigu est
exclu pour la santé de voir apparaître de tels effets secondaires
par la consommation d'eau potable polluée (Keil, 2008). D'après
les études menées depuis les années 1980, des
résidus de médicaments sont présents à des doses
très faibles dans les eaux de surface ou souterraines
(inférieures à 100 ng/L) et dans les eaux traitées
(inférieures à 50 ng/L) (Besse et Garric, 2007). Compte tenu des
connaissances actuelles, ces niveaux d'exposition n'entraînent pas de
risques pour la santé humaine (Besse et Garric, 2007), car ils sont
largement inférieurs aux doses thérapeutiques minimales, ainsi,
il a été montré que la dose absorbée par la
consommation d'eau durant toute une vie reste bien inférieure à
une dose thérapeutique quotidienne (Budzinski et Togola, 2006 ;
Kümmerer, 2004).
Aujourd'hui, il reste encore difficile d'évaluer le
risque sanitaire des résidus médicamenteux présents dans
l'eau potable. Effectivement, les doses trouvées restent faibles
même si les molécules sont nombreuses. Les valeurs toxicologiques
disponibles sont définies
7
sur la base d'une exposition aigüe à une seule
molécule alors que nous sommes exposés sur le long terme à
beaucoup de médicaments et polluants en même temps. Les effets
d'une exposition chronique à plusieurs substances de façon
simultanée ne sont donc pas évalués.
Pour l'instant, peu d'études se sont penchées
sur la question (Besse, 2010 ; Keil, 2008). Cependant, l'une d'elles a
récemment révélé que la présence
d'antidépresseurs et de psychotropes dans l'eau potable pouvait activer
l'expression de gênes associés à l'autisme. Leur
consommation ayant augmenté de façon spectaculaire ces 25
dernières années, des scientifiques américains ont
cherché à savoir si les faibles concentrations retrouvées
dans l'eau potable pouvaient affecter le développement du foetus. Ils
ont ainsi exposé des poissons d'eau douce à un mélange
d'antiépileptiques et d'antidépresseurs à de très
faibles doses pendant 18 jours. À l'issue de cette expérience,
ils ont constaté que pas moins de 324 gènes, associés
à l'autisme humain, avaient altéré par ces petites doses
de médicaments. Les poissons exposés avaient aussi tendance
à paniquer et se comportaient différemment de ceux non
exposés (Budzinski et Togola, 2006). Un des risques pour l'homme est
l'ingestion de résidus d'antibiotiques par les poissons et coquillages
commercialisés avec le risque de perturber la flore intestinale normale.
Cette ingestion concerne aussi les viandes et peut aussi générer
des problèmes d'allergie et de toxicité qui sont difficiles
à diagnostiquer (Haguenoer, 2010). Un des problèmes posé
est celui de la sécurité alimentaire car il peut se produire une
colonisation du tube digestif humain par des bactéries
résistantes aux certains antibiotiques. Le danger principal est bien la
sélection des bactéries résistantes susceptibles de se
transmettre à l'homme par l'alimentation ou du transfert des
gènes de résistance, comme en témoignant les
décès observés au Danemark avec une souche de S.
typhimurium DT104 provenant d'une viande de porc contaminée ou
l'épidémie d'infections à Campylobacter
résistants aux quinolones aux Etats-Unis (Haguenoer, 2010). Cette
nocivité indirecte a déjà eu pour conséquence une
restriction drastique de l'utilisation des antibiotiques en aquaculture dans de
nombreux pays (Haguenoer, 2010).
(Colette-Bregand et al ., 2009) ont rapporté
des recherches importantes sur les bactéries résistantes aux
antibiotiques par l'effet de contamination des milieux aquatiques.
I.1.5. Toxicités et impact sur la faune et la
flore
Les études cherchant à démontrer la
toxicité des produits pharmaceutiques sur les êtres vivants sont
de deux types. Premièrement, des études de létalité
(ou toxicité aigüe) durant lesquelles un organisme va être
soumis à une concentration croissante de polluants jusqu'à la
mort. Le second type correspond à des études d'observation ou de
simulation du milieu naturel (toxicité chronique), à des gammes
de concentration en produits pharmaceutiques du même ordre de grandeur
que les occurrences maximales constatées dans l'environnement
(Bousaffir,2015).
8
Le métronidazole est l'un des antibiotiques les plus
utilisés dans le monde départ ses propriétés anti
bactériennes et parasitaires. Cependant, son rejet dans la nature
constitue une source de pollution. A la suite de ce travail, nous
présentons cet antibiotique qui fait l'Object de notre étude.
I.1.6. Métronidazole (définition et
utilisation)
Le métronidazole une substance pharmacologique active
au niveau de l'organisme ; établie à l'origine des indications
thérapeutiques. Son dosage est établi en fonction de l'âge
du patient (enfant, adulte). La plupart du temps, présente en
très faible proportion dans le médicament par rapport aux
excipients (Bogaert,2009). Le métronidazole est un antibiotique et
antiparasitaire appartenant aux nitroimidazoles. Il inhibe la synthèse
des acides nucléique et est utilisé pour le traitement des
infections liées à des bactéries anaérobies ainsi
qu'à des protozoaires. Il peut également être
administré pour traiter la diarrhée due à
Entamoebahistolytica, Giardia lamblia ou Clostridium. Le métronidazole
peut être utilisé pour traiter les infections vaginales ou
diverses types d'infections bactériennes. (Saada,2020)
Le métronidazole est offert sous forme de
comprimés à 250 mg et de capsules à 500 mg, de
crèmes et suppositoires vaginaux et d'une crème pouvant
être appliquée sur la peau. Au besoin, le métronidazole
peut être administré par voie intraveineuse (dans les veines). La
dose recommandée de métronidazole varie en fonction du type
d'infection traitée et peut être pris avec ou sans nourriture
(Saada,2020).
I.1.7. Toxicité de
Métronidazole
Le métronidazole est un dérivé
synthétique de la série des imidazoles connu initialement comme
antiparasitaire actif sur les amibes et les trichomonas. Le
métronidazole est un anti infectieux de la famille des
nitro5-imidazoles. Cependant ce produit à une excellente activité
sur la plupart des bactéries anaérobies (Flabou,2003).
Le métronidazole aux propriétés
anti-inflammatoires et antibactériennes est l'un des antibiotiques les
plus utilisés dans le monde. Cet antibiotique appartient à la
famille des nitroimidazoles et est prescrit dans le traitement des maladies
infectieuses. Il est également utilisé comme agent
antiparasitaire dans les aliments à base de poulet et de poisson (Nasseh
et al.,2019 ;Bahrami et al.,2015). La structure du
métronidazole est en forme d'anneau et, en raison des lésions
lymphocytaires, est potentiellement cancérigène et
mutagène pour l'homme. Le Centre international de recherche sur le
cancer (CIRC) a signalé des mutations mortelles, la
cancérogénicité et la génotoxicité du
métronidazole pour les animaux, mais sa
cancérogénicité pour l'homme n'a pas encore
été prouvée. Une faible dégradabilité et une
solubilité élevée dans l'eau sont deux
caractéristiques de cet antibiotique, ce qui rend difficile voire
impossible son élimination de l'eau par les méthodes
conventionnelles (Andrés et al.,2002)
9
II- Procédés d'élimination des
produits pharmaceutiques
II.1. Procédés biologiques :
Les procédés d'épuration par voie
biologique sont communément utilisés pour le traitement des
produits pharmaceutiques (Gauthier et al., 2010). Ces procédés ne
sont pas toujours applicables sur les effluents industriels en raison des
fortes concentrations de polluants, de la toxicité ou de la très
faible biodégradabilité. Dans le cas des produits pharmaceutiques
non favorables au traitement biologique, il est nécessaire d'utiliser
des systèmes réactifs beaucoup plus efficaces que ceux
adoptés dans les procédés de purification conventionnels.
De plus, ces procédés biologiques génèrent des
quantités importantes de boues biologiques à traiter.
La biodégradation est favorable pour les eaux
usées présentant un rapport DCO/DBO5 < 2, par contre elle est
très limitée lorsque ce rapport dépasse 5. Le rapport
DCO/DBO5, appelé degré de dégradation biochimique, sert de
mesure pour la dégradabilité biochimique des polluants dans les
eaux usées. La quantité de composés non dégradables
biochimiquement est très élevée quand ce rapport tend vers
zéro (Bliefert et Perraud, 2001).
II.1.1. Filtration
La filtration est un procédé physique
destiné à clarifier un effluent qui contient de la matière
en suspension en le faisant passer à travers un milieu poreux. Les
particules en suspension ainsi retenues par le milieu poreux s'y accumulent ;
il faut donc nettoyer ce milieu de façon continue ou de façon
intermittente. Selon le type de filtre adopté, on recourt à
divers matériaux filtrants, comme les tissus de fibres, les toiles
métalliques ou les pierres poreuses interstices très fins. Ces
matériaux retiennent la matière en suspension en surfaces ; ils
sont rarement employés pour traiter des quantités d'eau
importantes (Micheal et al .,2012). L'inconvénient de ce type
de procédé repose sur la dégradation du polluant, et la
production de la boue (Crini et Badot,2007).
II.1.2. Procédés membranaires
Les procédés membranaires sont fortement
développés ces dernières années et constituent une
avancée majeure dans les procédés de séparation.
Une membrane permet de contrôler le transport des espèces
chimiques entre deux phases fluides qu'elle sépare.
Elle oppose une résistance inégale au transport
de différentes espèces quand une force motrice (comme par exemple
un potentiel électrique ou une pression) est appliquée aux
fluides.
10
La séparation des polluants est essentiellement
fondée sur l'affinité des espèces chimiques pour la
membrane, sur la taille et/ou sur la charge électrique des
molécules et ions. Les procédés membranaires sont au
nombre de quatre : la microfiltration, l'ultrafiltration, la nano filtration et
l'osmose inverse (Crini et Badot,2007).
Parmi ces quatre types de procédés, la nano
filtration et l'osmose inverse. Ces procédés sont les plus
adaptées à l'élimination des composés
pharmaceutiques de faible poids moléculaire tels que les antibiotiques
(Halling,2000).
II.1.3.
Coagulation/Floculation/Séparation
La coagulation/floculation/séparation est un
procédé couramment employé dans l'épuration des
eaux usées ; il permet de se débarrasser des matières en
suspension et des particules colloïdales qui ne peuvent décanter
par elles-mêmes, afin de diminuer, par exemple, les teneurs en DCO, DBO5
et COT, ou encore la turbidité de l'eau. Il implique le plus souvent
l'ajout d'un produit chimique (souvent un sel métallique trivalent comme
Al(III) ou Fe(III)), qui déstabilise les particules colloïdales et
mène à la formation de micro-flocs. Le pontage
décès micro-flocs, grâce à l'ajout d'un adjuvant de
floculation (généralement de type anionique), en fait des flocons
plus denses et volumineux, et surtout plus facilement séparables. Une
simple décantation ou une étape de flottation permet ensuite
l'élimination des flocs formés (Crini et Badot,2007).
D'importantes quantités de boues sont formées avec ce
procédé, leur régénération ou
réutilisation reste la seule issue, mais nécessite des
investissements supplémentaires.
Le but de notre travail est l'élimination d'un polluant
émergent en l'occurrence le métronidazole par adsorption. Ainsi,
nous présentons ci-dessous les généralités sur le
phénomène d'adsorption.
II.2.1. Généralité sur le
phénomène d'adsorption
L'adsorption est un phénomène d'interface
(phénomène physique de fixation de molécules à la
surface d'un solide) pouvant se manifester entre un solide et un gaz ou entre
un solide et un liquide. Le phénomène est général
pour toutes les surfaces. Aux interfaces, les attractions
intermoléculaires ne sont pas compensées dans toutes les
directions, et il subsiste par des forces résiduelles dirigées
vers l'extérieur. Ces forces représentent une large
énergie superficielle par unité de surface, comparable à
la tension superficielle des liquides. Ces forces sont neutralisées
lorsque les particules mobiles (un gaz ou un soluté) se fixent en
surface, on dit qu'elles s'adsorbent (Ghiaba,2020).
Cette adsorption se produit spontanément et
s'accompagne d'une diminution de l'énergie libre du système,
c'est un phénomène toujours exothermique. L'étude des
équilibres d'adsorption permet de connaitre le degré maximal de
séparation susceptible d'être obtenu dans des conditions
11
thermodynamiques données. La vitesse avec laquelle on
s'approche de l'état d'équilibre relève de l'étude
cinétique d'adsorption, celle-ci dépend de la vitesse avec
laquelle les constituants du mélange à séparer diffusent
dans l'adsorbant et dans le fluide.
II.2.1.1. Types d'adsorption
Suivant la nature des liaisons entre le substrat et les
particules adsorbées, les forces responsables du phénomène
d'adsorption peuvent être de nature physique ou chimique, Conduisant
ainsi à deux types d'adsorption: l'adsorption physique "physisorption"
et l'adsorption chimique " chimisorption".
Adsorption chimique (ou chimisorption)
La chimisorption s'accompagne d'une profonde modification de
la répartition des charges électroniques des molécules
adsorbées qui conduit à la rupture de liaisons chimiques entre
l'adsorbant et l'adsorbat. Celle-ci peut être covalente ou
ionique(Arris,2008). La chimisorption est donc complète lorsque tous les
centres actifs présents à la surface ont établi une
liaison avec les molécules de l'adsorbat, les forces mises en jeu sont
du même type que celles qui sont impliquées lors de la formation
des liaisons chimiques
Spécifiques (Bouziane,2007).
La chimisorption est essentiellement irréversible et
engendre une couche monomoléculaire, on peut mesurer la chaleur
d'adsorption chimique à partir des isothermes et isobares;
généralement la chaleur de chimisorption n'est pas constante mais
diminue lorsque la quantité de gaz adsorbée augmente(khir,2021).
Ce phénomène peut provenir de
l'hétérogénéité de la surface et de
l'existence d'une répulsion entre les molécules
adsorbées.
Adsorption physique (ou physisorption)
La physisorption met en jeu des liaisons faibles du type
forces de Van der Waals, il se produit bien avant que le gaz n'atteigne une
pression égale à sa tension de vapeur saturante, à des
températures assez basses et voisines du point d'ébullition de la
phase adsorbée. Elle est non spécifique et en
général réversible, où l'équilibre est
obtenu lorsque les vitesses d'évaporation et de condensation sont
égales (Khir, 2021 et Huchon, 2006)
Les majeures caractéristiques des deux types d'adsorption
sont résumées dans le tableau suivant:
12
Tableau 1:les principales différences
entre l'adsorption physique et l'adsorption chimique. (Salaa,2021)
|
Propriétés
|
Adsorption physique
|
Adsorption chimique
|
|
Types de liaison
|
Liaison de Van Der Waals (Électrostatique)
|
Liaison chimique (covalente ou ionique)
|
|
Température de processus
|
Relativement faible
comparée à la température
d'ébullition de l'adsorbat
|
Plus élevée que la température
d'ébullition de l'adsorbat
|
|
Individualité des molécules
|
L'individualité des
molécules est conservée
|
Destruction de l'individualité des molécules
|
|
Désorption
|
Facile
|
Difficile
|
|
Cinétique
|
Rapide, indépendante de la température
|
Très Lente
|
|
Chaleur d'adsorption
|
Inférieur à 5 à 10 kJ/mole
|
20 à 100 kJ/mole
|
II.2.1.2. Mécanisme d'adsorption
L'adsorption est connue comme une liaison entre les
molécules de solutés (contenue dans une phase liquide ou gazeuse)
et la surface d'un solide (adsorbant), ce type de liaison et chimique ou van
Der Waals (Bengaid,2021).
Tous les solides qui ont une structure microporeuse on peut
les classer comme un adsorbant. Les adsorbants les plus utilisés dans le
traitement des eaux sont les suivants: charbon Actif, gel de silice, argile,
tamis moléculaire36 et alumine (Bengaid,2021 ;Giles et
al.,1960)
Le procédé de l'adsorption c'est l'un des
transferts de métiers qui se fait entre le gaz ou liquide (fluide) et le
solide (adsorbant), il y a plusieurs étapes qui entrent dans le
mécanisme de ce processus. Le transfert de matière est le
déplacement de fluide (adsorbat) vers la surface solide (adsorbant). En
passant par les étapes ci-dessous (Kafi,2013) :
? Diffusion de l'adsorbat vers celle située au
voisinage de la surface de l'adsorbant.
? Transfert du soluté à travers le film liquide
vers la surface des granules (diffusion extra granulaire de la
matière).
? Transfert de la matière dans la structure poreuse de
la surface extérieure des granules vers les sites actifs (diffusion
intra granulaire).
? Une molécule est considérée comme un
élément immobile Lorsque le colorant d'adsorption est
connecté aux sites actifs.
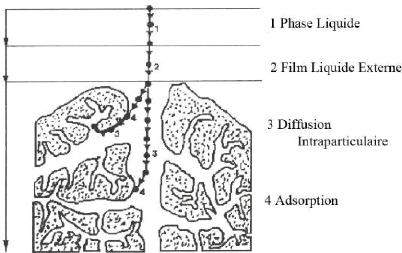
13
Figure 1:Mécanisme de diffusion de
l'adsorbat vers l'adsorbant (Sali,2018)
Facteurs influençant le processus
d'adsorption
Le processus d'adsorption dépend de plusieurs
paramètres qui peuvent influencer la capacité et la
cinétique de la rétention d'un soluté sur un adsorbant. Il
s'agit des paramètres suivants :
- Structure des adsorbants
La structure et la nature des adsorbants jouent un rôle
important pour le piégeage des différents composés
organique et inorganique présent dans les eaux. La taille des
particules, la surface spécifique et la porosité sont les
principales propriétés qui affectent l'affinité d'un
adsorbant vis-à-vis du soluté.
Parmi les adsorbants naturels qui ont fait l'objet de
nombreuses études d'adsorption, on trouve les argiles. La taille de
leurs particules fines, leur structure en feuillet et leur grande surface
spécifique sont les principales propriétés qui leur
confère une importante capacité d'adsorption. Les zéolites
sont aussi parmi les adsorbants naturels qui sont caractérisés
par une grande capacité de rétention qui est due essentiellement
à leurs structures fibreuses et à leurs surfaces
spécifiques importante.
Les adsorbants industriels font aussi partie des solides qui
possèdent des propriétés considérables d'adsorption
; notamment le charbon actif qui est caractérisé par une surface
spécifique importante et par une très forte microporosité.
D'autres adsorbants comme les hydroxydes métalliques ont aussi une
grande surface spécifique. Cette catégorie de solides sont
14
essentiellement utilisés pour adsorber les
métaux lourds vu l'affinité qu'ils ont envers ces
éléments.
- Influence de l'adsorbat
Les propriétés physico-chimiques de l'adsorbat
sont déterminantes et jouent un rôle primordial lors de son
adsorption sur une surface solide de l'adsorbant. La structure
moléculaire est l'un des principaux paramètres qui influence la
rétention des adsorbats. Plus la structure moléculaire est
volumineuse plus sa rétention par certaines phases solides est
difficile. Par ailleurs, l'adsorption des solutés est
conditionnée par la composition de la solution puisqu'en présence
simultanée de plusieurs espèces génère une
concurrence vis-à-vis des sites d'adsorption surtout pour celles qui
possèdent une structure similaire.
- Influence du pH
Le pH est un paramètre prédominant dans le
processus d'adsorption. Il affecte directement l'état de charge de
l'adsorbant et de l'adsorbat. Son effet sur la rétention des
contaminants est souvent étudié. Dans la plupart des cas, le pH
faible favorise l'adsorption des anions alors que le milieu alcalin favorise
celle des cations.
- Influence de la température
L'adsorption est un processus global résultant de
plusieurs processus à l'interface solide-liquide. Elle peut être
exothermique, endothermique ou athermique. Elle est donc conditionnée
par la température. Ainsi, l'augmentation de la température
favorise les processus de chimisorption alors que son abaissement favorise
l'adsorption physique.
II.2.1.3. Isotherme d'adsorption
Tous les systèmes adsorbant/adsorbat ne se comportent
pas de la même manière. Les phénomènes d'adsorption
sont souvent abordés par leur comportement isotherme. Les courbes
isothermes décrivent la relation existant à l'équilibre
d'adsorption entre la quantité adsorbée et la concentration en
soluté dans un solvant donné à une température
constante.
Deux types de classifications sont rencontrés dans la
littérature : celle de Gilles et d'UICPA.
Classification de Giles
Giles et al., en 1974 ont classé les
isothermes d'adsorption en phase liquide/solide en quatre classes principales
nommées : S (Sigmoïde), L
(Langmuir), H (Haute affinité) et C
(partition Constante) (Ziati, 2012).
La classe S (sigmoïde) est obtenue
lorsque les molécules du soluté ne s'accrochent au solide que par
l'intermédiaire d'un seul groupement. L'adsorption du solvant est
appréciable, du fait qu'elle devient progressivement plus facile lorsque
la quantité adsorbée croît. L'explication proposée
est qu'il existe un effet de synergie coopératif à cause de
l'attraction latérale, les
15
molécules suivantes sont adsorbées facilement,
ce qui donne une couche adsorbée dans laquelle les molécules sont
adsorbées verticalement. Cet arrangement est favorisé lorsque les
molécules de solvant rivalisent avec le soluté pour l'occupation
des sites d'adsorption (Bacha & Aichiou, 2017).
La classe L (Langmuir) est la plus
fréquente. Elle est caractérisée par une courbe concave
par rapport à l'axe des concentrations. L'élimination du
soluté devient de plus en plus difficile lorsque le degré de
recouvrement de la surface de l'adsorbant augmente. Cette isotherme
suggère que l'adsorption de la molécule de soluté se fait
à plat sur la surface de l'adsorbant et les molécules du solvant
et du soluté sont en compétition pour l'occupation des sites
d'adsorption (Dabrowski et al., 2005).
La classe H est caractérisée
par une isotherme presque verticale au début. Laquantité
adsorbée apparait importante à concentration quasiment nulle du
soluté dans la solution. Ce phénomène se produit lorsque
les interactions entre les molécules adsorbées et la surface du
solide sont très fortes. L'isotherme de classe H est observée
lors de l'adsorption de micelles ou de polymères formées à
partir des molécules de soluté.
La classe C est celle des isothermes se
caractérisant par une partition constante entre la solution et le
substrat. Cette constante signifie que les sites sont créés au
cours de l'adsorption. Ce qui implique que les isothermes de cette classe sont
obtenues quand les molécules de soluté sont capables de modifier
la texture du substrat en ouvrant des pores qui n'avaient pas été
ouverts préalablement par le solvant (Tahar et al., 2010).
La figure 2 ci-dessous représente les quatre types
d'isotherme selon Giles.
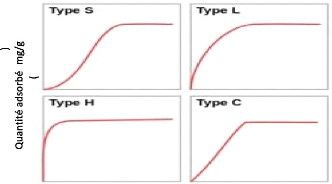
Concentration à l'équilibre (mg/L)
Figure 2:Les quatre types d'isotherme selon la
classification de Giles. (Ngakou,2019)
16
Adsorption gaz-solide
On peut décrire un processus d'adsorption à
l'aide d'une isotherme d'adsorption qui représente, à une
température donnée, la relation entre les concentrations de
soluté et d'adsorbat.
L'isotherme d'adsorption de gaz, d'équation
????????=??(?? ????), est obtenu en mesurant les
quantités
volumiques de gaz adsorbé (Vads) pour des
valeurs croissantes de la pression relative représentée par (
??????), p étant la
pression d'équilibre et p0 la pression de vapeur saturante du
gaz
à la température considérée. Dans
la plupart des cas, le gaz utilisé est l'azote, et la température
est la température d'ébullition de l'azote liquide (77 K). Les
isothermes d'adsorption d'un gaz sur un solide peuvent être
classées en cinq catégories selon la «classification de
Brunauer, L. Deming, W. Deming et Teller» appelée couramment
"classification BDDT" (Brunauer et al.,1940).
Une sixième forme concerne les isothermes à
marches. Les six formes constituent la classification de l'International Union
of Pure and Applied Chemistry (IUPAC). Ces différentes formes
d'isothermes sont caractéristiques de la texture du solide
examiné, et l'allure de ces courbes permet de définir le type de
porosité présente au niveau de l'échantillon
analysé (Figure 3 ).
L'isotherme de type I est
caractérisée par une augmentation rapide de la quantité
adsorbée dans le domaine des faibles pressions d'équilibre suivie
par un palier approximativement horizontal jusqu'à la pression de vapeur
saturante ; (Pression des molécules de gaz en équilibre avec la
phase liquide pour une température donnée). Cette isotherme est
généralement attribuée à l'adsorption sur une
surface comportant des micropores.
Mais ces mêmes courbes peuvent traduire la formation
d'une monocouche sur une surface non poreuse dans certains cas. La
quantité adsorbée correspondant au palier est la quantité
nécessaire pour former une couche monomoléculaire complète
sur la surface du solide.
Les isothermes de type II sont de loin les
plus couramment rencontrées ; elles traduisent l'adsorption sur des
surfaces non poreuses. Leur étude pour de très nombreux couples
adsorbat-
adsorbant a conduit à conclure empiriquement que la
quantité de gaz Vm adsorbée au point B (Figure
3), qui marque le coude sur l'isotherme, devrait correspondre
approximativement à l'adsorption d'une monocouche. L'adsorption
multicouche commence aux pressions plus élevées.
Les isothermes de type III sont assez rares.
Elles montrent une faible adsorption aux basses pressions liées à
un mauvais mouillage de l'adsorbant par l'adsorbat. L'adsorption devient
d'autant plus facile que la quantité déjà adsorbée
est importante. Cela s'explique à la
17
fois par une faible attraction adsorbat-adsorbant et par de
fortes attractions entre molécules adsorbées. Dans un tel cas, la
condensation est atteinte pour sa pression saturante alors que l'adsorption sur
la surface est encore limitée. C'est le cas par exemple de l'adsorption
de l'eau sur le graphite.
Les isothermes de types IV et V ont la
particularité de présenter des hystérèses qui se
manifestent lorsque les pressions d'équilibre sont différentes
lors de l'adsorption et de la désorption. Ces courbes sont obtenues
lorsque les adsorbants contiennent des pores de diamètres se trouvant
dans la catégorie des mésopores. Dans ce cas il peut se
superposer à l'adsorption proprement dite une condensation capillaire de
l'adsorbat. L'analyse de ce type d'isothermes permet d'obtenir plusieurs
informations concernant la texture poreuse du substrat.
L'isotherme de type VI correspond à
une adsorption en multicouches sur une surface non poreuse uniforme, à
chaque marche correspond l'édification d'une couche. Ce type d'isotherme
peut être observé pour l'adsorption d'azote et d'argon à
77K sur un noir de carbone graphité.
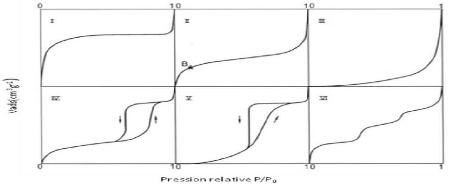
18
Figure 3:Les différents types
d'isothermes d'adsorption/désorption selon l'IUPAC (Hanen,2015).
II.2.1.4. Modélisation des isothermes
d'adsorption
Une isotherme d'adsorption est la représentation
à température constante de la quantité de soluté
adsorbée par un adsorbant en fonction de la concentration à
l'équilibre du soluté en solution. L'étude de l'isotherme
d'adsorption est fondamentale pour décrire le comportement des
interactions entre le soluté et l'adsorbant et pour évaluer la
capacité d'adsorption d'un adsorbant, elle est essentielle dans la
conception d'un système d'adsorption. Il existe un grand nombre
d'équations mathématiques qui permettent de modéliser les
isothermes d'adsorption. La littérature montre que dans la plupart des
cas, les modèles les plus adaptés sont les modèles de
Langmuir et de Freundlich.
Modèle de Langmuir
Il est un modèle simple et largement utilisé. Il
est basé sur les hypothèses suivantes (Langmuir
1918):
- l'espèce adsorbée est située sur un
site bien défini d'adsorbant (adsorption localisée). - chaque
site n'est susceptible de fixer qu'une seule espèce adsorbée.
- l'énergie d'adsorption de tous les sites est
identique et indépendante de la présence des espèces
adsorbées sur les sites voisins (surface homogène et pas
d'interactions entre espèces adsorbées).
Il est applicable à l'adsorption
mono-moléculaire du soluté à la surface de l'adsorbant
à l'équilibre. La non linéaire de l'équation de
Langmuir est :
QQ[~S =
Qm.K1.Ce
1+K1.Ce EquationI.1
Avec :
19
KL : constante d'équilibre, qm : capacité
maximale d'adsorption (mg/g) et Ce : concentration à l'équilibre
(mg/L).
Dans le cas d'une faible quantité de soluté
adsorbé, le terme (KL.Ce) peut être très inférieur
à 1 et il est alors négligé. La relation de Langmuir se
réduit alors à une relation directe entre la capacité
d'adsorption et la concentration à l'équilibre de l'adsorbat en
phase liquide :
?? = ????????????
Dans le cas d'une forte quantité de soluté
adsorbée, le terme (KL.Ce) devient largement supérieur à
1. Cela implique que q tend vers qm.
Par ailleurs, la linéarisation de l'équation nous
donne :
?? = [( ????? ? ????) ( ??????) + ( ????? ?)]
EquationI.2 ??
??
L'équation obtenue est celle d'une droite de pente
???? et d'ordonnée à l'origine
?? ;
???? ????
ce qui permet de déterminer deux paramètres
d'équilibre de la relation : qm et KL. Modèle de
Freundlich
Il s'agit d'une équation qui est souvent
employée dans la représentation pratique de l'équilibre
d'adsorption entre le soluté et la surface
hétérogène d'un solide. Elle se présente sous la
forme suivante (Freundlich 1909) :
?? = ????.??????/??
La linéarisation par changement d'échelle de la
relation de Freundlich conduit à l'équation suivante :
???????? = ???????? + ?? ???????? EquationI.3
??
Avec
qe : la quantité adsorbée (mg/g) ; Ce : la
concentration à l'équilibre (mg/L), KF : le coefficient de
Freundlich, n : l'affinité du soluté pour l'adsorbant.
Le constant 1 ?? (adimensionnel) donne une indication sur
l'intensité d'adsorption.
Il est généralement admis que les faibles valeurs
de ?? 1 (0,1 <1 ?? <0,5) sont Caractéristiques d'une bonne
adsorption, alors que des valeurs plus
élevées révèlent une adsorption
modérée(0,5 < ?? 1 < 1)
20
Modèle de
Dubinin-Kagana-Radushkevich(D-K-R)
Le modèle d'isotherme de D-K-R est
généralement utilisé pour décrire les sites
d'adsorption non homogène et fournit des informations permettant de
connaitre la nature des interactions mis enjeu entre l'adsorbant et l'adsorbat.
(Sali 2018). Son équation est la suivante :
RTIn(1 + 1 )Z
Qe = Qma exp -2E z e
Equationl.4
a
Qma :la quantité maximale pour
remplir une monocouche(mg/g)
E : l'énergie de l'adsorption qu'il faut fournir pour
déplacer l'adsorbat de la surface de l'adsorbant à l'infini de la
solution (J/mol)
Qe :la quantité de
l'adsorbant adsorbée à l'équilibre dans la phase solide
(mg /g)
R : constante des gaz parfaits (Kmol)
;
Sa formule linéaire est la suivante :
lnQe = InQmg - /3 e2 Equationl.
5
Avec le potentiel de Polanyi e = RTIn(1 +
c)
B est obtenu par le tracé de
InQe en fonction de
e2 de l'énergie moyenne
d'adsorption E (en Kj /mol peut être obtenu par la relation
ci-après :
E = (2/3)-1/2
Equationl.6
Modèle d'isotherme de Temkin
Le modèle de Temkin suppose que la chaleur d'adsorption
est due aux interactions entre l'adsorbant et l'adsorbat. De plus, ce
modèle est une application de l'adsorption de Gibbs où la surface
est considérée comme énergétiquement
homogène. L'équation de cette isotherme est donnée par
:
qe = BInKT + BlnCe Equationl.
7
Où ;
B = ????/ : constante liée
l'énergie
b??
R : Constante des gaz parfaits (8 ,314J /mol) ; T :
température(K) ;
bT : potentiel d'adsorption
(J /mol) ;
KT : constante de la liaison
à l'équilibre (L /g)
21
II.2.1.5. Etude de la cinétique
d'adsorption
L'étude d'adsorption d'un soluté en fonction du
temps de contact est souvent décrite comme comportant deux phases. La
première phase d'adsorption est non linéaire et rapide,
correspond à l'adsorption au sens strict (Bouziane ,2015). Les
phénomènes de diffusion étant négligeables. La
deuxième phase, linéaire est interprété comme
étant la phase d'adsorption lente où le processus de diffusion
sont limitantes (Bouziane 2015 , Mritteron 1996, Klan 1982)
II.2.1.5.1. Modèle cinétique de premier
ordre
Le modèle du pseudo premier ordre a été
proposé par Lagergren en 1898, il est basé sur une relation
linéaire entre la quantité de soluté (adsorbat)
fixée à la surface du matériau (adsorbant) en fonction du
temps. De nombreux auteurs ont utilisé ce modèle cinétique
de pseudo premier-ordre pour décrire l'adsorption de solutés
organiques et inorganiques sur des surfaces solides
hétérogènes. Dans la plupart des études sur les
cinétiques d'élimination, ce modèle n'est pas
adapté à toute la gamme de temps de contact, mais il est
généralement applicable au début de l'adsorption, soit
pour les 20 ou 30 premières minutes (Ghemit,2018 ;
Azizian, 2004). Au-delà, les
capacités expérimentales ne sont plus correctement
extrapolées. Le modèle pseudo-premier-ordre est donnée par
l'expression :
dg
= ????(g?? - g??) E??ua????o??l.
8
d??
Avec respectivement qt et
qe les quantités du polluant
adsorbées à un temps et à l'équilibre
Kt(min-1)
: constante de vitesse du premier ordre .
L'intégration de cette équation avec la condition
initiale q=0 et t=0 conduit à l'expression
suivante :
1n(ge - gt) = b??ge
- Kit EquationI.9
Avec :
K1 : constante de vitesse du premier
degré(min-1)
t :temps de contact(min)
qe : capacité
d'adsorption du matériau à la saturation en monocouche ;
qt : quantité
adsorbée (g/g /unité de masse du solvant à l'instant t
II.2.1.5.2. Modèle cinétique du
deuxième ordre
Le modèle pseudo second ordre suppose que la
capacité d'adsorption est proportionnelle au nombre de sites actifs
occupés par l'adsorbat. Le modèle est exprimé par
l'équation I.10 dont la linéarité est
développée par (Ho et al., 1999). Ce
22
modèle permet de décrire correctement la
fixation des molécules de soluté sur la surface solide du
matériau. L'analyse des données cinétiques, relève
qu'un modèle irréversible de second ordre fournit des
résultats de meilleure qualité que les modèles d'ordre
inférieur (Azizian., 2004).
Le modèle cinétique du deuxième ordre ou
modèle de pseudo second ordre peut être exprimée par
l'équation suivante :
???? =??z(???? - ??t)z
EquationI.10
??t
L'intégration de cette fonction suivie d'un
réarrangement nous permet d'avoir la forme linéarisée
suivante :
|
t t
= +
qt
Kzgze
|
t
Equationl.11
qe
|
Avec :
K2:Constante de la vitesse apparente du second
degré (g/g /min) ;
qe :Capacité d'adsorption du
matériau à la saturation(g/g) ;
qt : quantité adsorbée
par le matériau à l'instant t (g /g).
Le tracé de
t/qt en fonction du
temps t permet de déterminer la constante de la vitesse apparente
et la capacité d'adsorption du matériau à la
saturation qe
II.2.1.5.3.Modèle de diffusion
intra-particulaire
Le procédé d'adsorption à partir d'une
solution aqueuse vers des solides passes par plusieurs étapes :
-Transport dans la solution.
-Diffusion à travers le film liquide entourant la
particule solide, connue sous le nom de diffusion externe ou diffusion de la
couche limite.
-Diffusion dans le liquide retenu dans le pores, connue sous
le nom de diffusion interne ou diffusion intra-particulaire.
-Adsorption ou désorption sur la surface intérieure
des sites.
Pendant l'adsorption, le transfert de matière subit une
série de résistance qui peuvent être externes, quand les
molécules de soluté diffusent vers la surface externe des
particules de l'adsorbant, à travers un film de soluté. Elles
peuvent être aussi internes, lorsque les molécules de
soluté diffusent vers les sites d'adsorption, à travers le
liquide remplissant les pores.
A partir de la seconde loi de Fick, Weber et Morris (1963) ont
indiqué que dans le cas où l'adsorption est influencée par
la diffusion intra-particulaire, la rétention d'un adsorbat qt varie
linéairement avec t0,5, selon l'équation :
23
1
qt=Ktt2 + C EquationI.12
|
K1: est la constante de vitesse de
diffusion intra particulaire (g/g.mn
|
1
2)
|
L'ordonnée à l'origine C, renseigne sur
l'épaisseur de la couche limite.
Modèle d'Elovich
L'équation d'Elovich a été
développée par MJD LOW ( Low ,1960) pour décrire la
cinétique de chimisorption hétérogène d'un gaz sur
la surface d'un solide. Dans la chimie des sols, l'équation d'Elovich
décrit la cinétique d'adsorption et désorption des
différentes matières inorganiques dans les sols (Sparks
1989). Une forme simple de l'équation fut
utilisée ces dernières années pour décrire
l'adsorption des polluants en solution aqueuse qui obéit à la
relation ci-dessous :
dqt = aexE uationl.13
d P(-fqt) 9
t
qt : la capacité
d'adsorption à l'instant t ( mg/g) ;
a: la vitesse d'adsorption
initiale(mg.g-1.mn-1)
;
[i: constante de la desorption (
g.mg-1)
Pour simplifier l'équation d'Elovich Chien et Clayton 1980
posent cft » 1. Et obtiennent
l'équation suivante :Qt=f ln(af)+1 n(t)
EquationI.14
Les constantes seront calculées à partir de la
courbe qt en fonction de
Int
III. Généralité sur les
adsorbants
III.1. Généralité sur les
argiles
Les argiles sont des matériaux naturels répandus
sur tous les continents et utilisés depuis l'antiquité. Le mot
argile vient du grec "argilos" dérivé de "argos" qui veut dire
blanc. Une argile résulte essentiellement de la
désintégration physicochimique et thermique des roches. En tant
que matière première brute, l'argile est un mélange de
minéraux argileux et d'impuretés cristallines sous forme de
débris rocheux de composition infiniment diverse. Le terme argile
définit aussi un domaine granulométrique comprenant des
particules minérales, dont le diamètre est inférieur
à 2um (Boucheta ,2017). Leurs
potentialités d'utilisation à l'état naturel, selon les
variétés présentes dans les différentes
régions, sont bien en dessous des possibilités offertes par leurs
diverses propriétés (plasticité, surfaces
spécifiques et porosités élevées, capacités
d'échange cationique et de sorption importantes, etc. ...). Leurs
abondances et leurs propriétés ont fait grandir leurs
intérêts par de nombreux laboratoires de recherche dans le
monde.
Les argiles peuvent acquérir d'autres
propriétés par différentes modifications qui peuvent
être par voie chimique, physique et/ou thermique. Ces
propriétés ouvrent de nouvelles voies d'applications. Ces
matériaux sont d'excellents échangeurs de cations ce qui permet
de les utiliser pour fixer des polluants (Bendaho ;et al,2014).
III.1.1. Structure des minéraux argileux
Les cristallites d'argile sont formées par empilements
de feuillets bidimensionnels silicatés tétraédriques
condensés avec des octaèdres d'oxyde métalliques dans un
rapport 2:1 ou 1:1. Ainsi, les différents groupes de minéraux
argileux sont distingués par l'arrangement de leurs couches
tétraédriques et octaédriques (figure 4).
Couche tétraédrique
Cette couche est formée par l'enchaînement de
tétraèdres dont les sommets sont occupés par des atomes
d'Oxygène et le centre par un atome de Silicium, comme il peut
être aussi occupé par un atome trivalent Al+3.
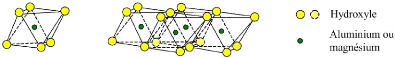
Couche Octaédrique
Elle est constituée par un enchaînement de
plusieurs octaèdres dont les sommets sont occupés par des atomes
d'oxygènes et des groupements hydroxyles, conférant ainsi, une
structure hexagonale compacte. Les centres peuvent être occupés
par des atomes variés de valence trois (Al, Fe) ou deux (Fe, Mg)
(Figure I.1).
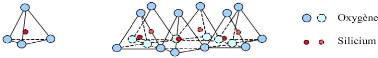
a) tétraèdre couche
tétraédrique
24
b) octaèdre couche octaédrique
Figure 4: Représentation des couches
octaédriques et tétraédriques. (Bouzid Samia, 2015).
25
III.1.2. Classification des argiles
La classification des minéraux argileux est
généralement basées sur les deux critères suivants
(Rauturreau,1982) :
- Type de feuillet ;
- Charge globale du feuillet.
La classification des minéraux argileux est
généralement basées sur les deux critères suivants
(Rauturreau,1982) :
Type de feuillet ; Charge globale du feuillet.
Les minéraux argileux sont classés en fonction de
différents paramètres : - Le type de feuillets, soit T-O ou
T-O-T
- La nature des cations interfoliaires, qui va influer sur la
capacité d'hydratation/gonflement du minéral argileux ainsi que
sur la propriété d'échange cationique
- La charge du feuillet, dépendant du nombre de
substitutions dites « isomorphiques » qui peuvent intervenir dans la
couche tétraédrique (e.g. Si4+ ? Al3+ ou Fe3+) ou dans la couche
octaédrique (e.g. Al3+ ? Fe2+, Mg2+) contrôlant directement la
capacité d'échange cationique du matériau
- Le type de substitutions, soit des substitutions
majoritairement dans la couche tétraédrique, dans ce cas
là l'argile est trioctaédrique, ou des substitutions
principalement dans la couche octaédrique avec des argiles dites
dioctaédriques
- Ces paramètres contrôlent donc la
classification des argiles de type T-O-T, telle que défnie par les
travaux de l'AIPEA (Association Internationale pour l'Etude des Argiles),
précisé dans (Bailey et al., 1980)
Type de feuillet
Selon le l'épaisseur du feuillet ou sa constitution, on
distingue trois familles principales des argiles (Yassine,2016 ;
Caillère,1982)
- Minéraux à 7Å ou de type 1 :1 (TO)
Le feuillet élémentaire de ces phyllosilicates
est formé par la combinaison d'une couche tétraédrique (T)
et une couche octaédrique (O), son épaisseur est d'environ
7Å. A ce type
26
correspond la kaolinite qui est l'un des minéraux
argileux le plus courant. Les argiles riches en ce type de minéraux sont
souvent valorisées en céramique notamment dans la fabrication de
la porcelaine. Le feuillet de la kaolinite est souvent neutre
dioctaédrique et alumineux de composition (Si2) (Al2) O5 (OH)4. La
distance entre les feuillets est faible vue la forte attraction due aux
liaisons hydrogènes établies entre les hydrogènes des
groupements hydroxyles de la couche octaédrique et les oxygènes
de la couche tétraédrique, outre les liaisons de Van der Waals,
ce qui rend les feuillets difficilement séparables. La kaolinite est
répertoriée parmi les argiles non gonflantes. Les substitutions
isomorphiques sont faibles d'où l'absence de déficit de charge.
La capacité d'échange cationique CEC est donc faible vue qu'elle
provient seulement du caractère amphotère des groupements de
surface. La kaolinite est parmi les rares argiles qui peuvent développer
une capacité d'échange anionique appréciable selon le pH.
Elle possède un point isoélectrique généralement
situé entre pH 2 et 3. Cette famille d'argile est
caractérisée par les réflexions suivantes : d001 aux
environs de 7,14 Å et d002 aux environs de 3,57 Å, et leurs raies
dérivées.
La première correspond à la distance
interlamellaire.
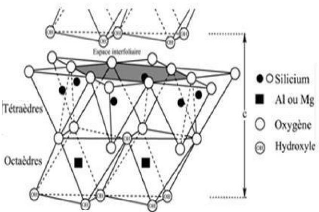
Figure 5:Représentation
schématique de la structure de la kaolinite
- Minéraux a 10 Å ou de type 2:1
(TOT)
Ce type de minéraux est constitué d'une couche
octaédrique située entre deux couches
tétraédriques. L'épaisseur de base du feuillet est de
10Å (figure 7). Cette épaisseur varie en générale
selon la nature du cation interfoliaire et sa sphère d'hydratation. On
distingue deux grandes familles pour ce type de minéraux à savoir
l'illite et les smectites.
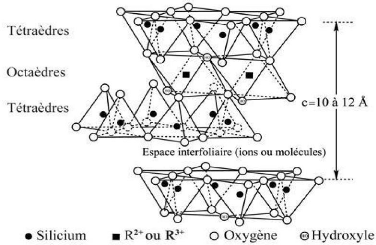
27
Figure 6:Représentation
schématique de la structure d'une argile de type TOT
- Minéraux à 14 Å ou de type 2 :1
:1 (TOTO)
Le feuillet de type 2 :1 :1 est constitué de
l'alternance de feuillet T-O-T et d'une couche octaédrique
interfoliaire. L'équidistance caractéristique est d'environ 14
Å. A ce type de minéraux appartient la famille du chlorite.
Les chlorites se subdivisent en deux feuillets : un feuillet
hydroxyde qui forme un octaèdre [(Mg, Fe)(OH)6] et un feuillet TOT. Le
déficit de charges du feuillet TOT est compensé par des cations
qui se logent dans les cavités hexagonales sous le feuillet hydroxyde ce
qui provoque la pénétration des molécules d'eau entre ces
deux types de feuillets et par conséquence l'accroissement de
l'équidistance fondamentale.
Minéraux interstratifiés
Ces minéraux interstatifiés se caractérisent
par la superposition de deux ou plusieurs feuillets de nature différente
dans une séquence verticale. Il existe deux types d'interstratification
: interstratification régulière caractérisée par
une périodicité d'empilement des différents feuillets et
interstratification irrégulière qui correspond à un
empilement aléatoire des feuillets de nature différente.
Par ailleurs il existe une cinquième catégorie
d'argiles qui n'est pas répertoriée parmi les argiles
phyllosilicatés. Il s'agit des argiles fibreuses à savoir la
sépiolite et la palygorskite.
28
III.1.3. Propriétés des argiles
Indices de gonflement
Généralement, toutes les argiles
possèdent une capacité de former facilement des complexes
lamellaires par l'insertion des molécules d'eau ou organique dans
l'espace interfoliaire (Figure 7). Ce phénomène est appelé
gonflement, le degré de gonflement ou degré d'hydratation varie
d'une famille argileuse à une autre (Beghou,2020).
Les smectites, les vermiculites et les minéraux
interstratifiés sans parmi les argiles qui se caractérisent par
une capacité d'expansion beaucoup plus importante que celles des autres
espèces argileuses. L'incorporation d'eau est réversible à
la pression atmosphérique et dépend de la température et
de l'humidité relative (la pression de vapeur d'eau) de l'air: plus
l'air est humide, plus l'argile pourra incorporer de l'eau jusqu'à sa
limite de saturation. La plupart des phyllosilicates possédant de telles
propriétés de gonflement sont classés dans la famille de
smectites
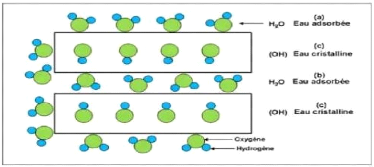
Figure 7:Localisation de l'eau dans les
particules argileuses, (Diatta, 2016).
Capacité d'échange
cationique
Les argiles ont la propriété de fixer de
façon réversible (échangeable) des cations contenusdans
les solutions environnantes, La capacité d'échange cationique
(CEC) est une caractéristique très importante, elle est
définie comme la quantité de cations monovalents et divalents
(Li+, Na+, K+, Ca2+, ou
Mg2+) susceptibles d'être substitués par des cations
compensateurs pour compenser la charge négative de 100 grammes
d'argiles. Elle est conventionnellement exprimée en
milliéquivalents pour 100 grammes d'argile (meq/100g). (Derafa 2014 )
Cette capacité d'échange cationique est considérée
de manière globale et concerne à la fois les cations de l'espace
interfoliaire, les cations de surface et de bordure de feuillets. Il existe
différentes méthodes de mesure de la CEC. En
général, on introduit une
29
montmorillonite naturelle dans une solution contenant un
excès de cations, puis on réalise une analyse
élémentaire afin d'évaluer la quantité de cations
échangés entre l'argile et la solution. Cette méthode se
fait généralement avec NH4 , ou Ba , le dosage est précis
à l'aide de microanalyse élémentaire. Les cations qui
restent dans la montmorillonite définissent la capacité
d'échange cationique qui dépend de l'argile étudie.
(Derafa,2014) Il y a dans les argiles deux principales causes d'existence d'une
capacité d'échange ionique, l'une interne et l'autre externe.
IV. LES PLANS D'EXPERIENCES
Les plans d'expériences permettent d'organiser au mieux
les essais qui accompagnent une recherche scientifique ou des études
industrielles. Ils sont applicables à des nombreuses disciplines et
à toutes les industries à partir du moment où l'on cherche
le lien qui existe entre une grandeur d'intérêt y et des
variables,x1 . Il faut penser aux plans d'expériences
si l'on s'intéresse à une fonction de type y =
f(x1)
Avec les plans d'expériences on obtient le maximum de
renseignements avec le minimum d'expérience. Pour cela, il faut suivre
des règles mathématiques et adopter une démarche
rigoureuse.
IV.1. Définition et description
Les plans d'expérience consistent en la mise en oeuvre
organisée d'un ensemble d'unités expérimentales de
manière à révéler les effets de différents
traitements (Figard, 2009). De manière générale, le plan
d'expérience cherchera à déterminer et à
établir les liens existant entre 2 types de variables :
? La réponse : grandeur physique étudiée
;
? Les facteurs : grandeurs physiques modifiables par
l'expérimentateur, sensées
influer sur les variations de la réponse (Goupy, 2006 ;
Figard, 2009).
Il existe actuellement un grand nombre de plans
d'expériences tous différents. Chaque plan, de par ses
propriétés, permet de résoudre certains problèmes
particuliers. Nous pouvons cependant diviser les plans d'expériences en
deux grandes catégories :
? Les plans pour étudier (estimer et comparer) les effets
des paramètres,
? Les plans pour régler les paramètres afin
d'atteindre un optimum.
Plus précisément, un plan d'expérience
vise aussi bien à comprendre les relations liant la réponse avec
les facteurs, que les facteurs entre eux. Pour cela, la solution
proposée consiste
30
dans tous les cas à établir un modèle,
exprimant la réponse en fonction des facteurs (KalchevaKaradzhova et
al., 2016). Pour bâtir ce modèle, il faut appréhender
ces variations. Celles-ci sont déduites des résultats de
séries d'expériences, c'est-à-dire de plusieurs
configurations pour lesquelles les valeurs des facteurs sont
différentes. Il s'agit donc de la notion de plan d'expériences ou
de la méthode des surfaces de réponses, correspondant à la
réalisation d'une série de N expériences, qui sont toutes
déterminées, obligatoirement réalisables et
indépendantes entre elles (Goupy & Creighton, 2006).
L'expérimentateur doit concevoir le plan
d'expérience adéquat afin de répondre à une
problématique bien précise. Il faut donc choisir ou construire le
plan qui donnera les informations recherchées (Udofia et al.,
2013). Ainsi on ne pourra pas utiliser le même plan pour étudier
efficacement les effets des paramètres tout en cherchant un optimum par
exemple. Démarche méthodologique
La démarche méthodologique peut être
résumée par la figure 8 ci-dessous:
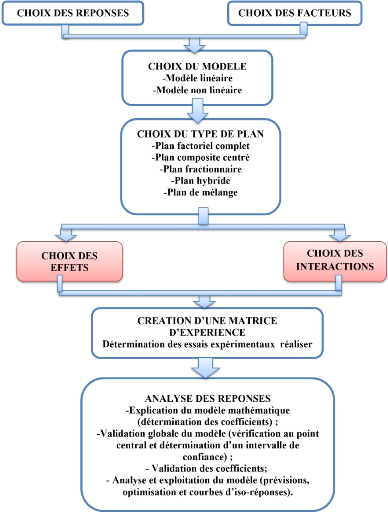
31
Figure 8:Schéma de la démarche
méthodologique lors du choix d'un plan d'expérience
(Adapté de Ngakou, 2019 ; Mohamed & Yassine, 2013)
V. Etat de l'art sur l'adsorption du
métronidazole
L'élimination de l'antibiotique métronidazole en
solution aqueuse par des particules argileuses et autres a été
étudiée. En 2009, Rivera-Utrilla et al., avait comme
objectif d'analyser le comportement du charbon actif avec différentes
propriétés
32
chimiques et texturales dans l'adsorption du nitroimidazole.
Les résultats indiquent que l'adsorption des nitroimidazoles est
largement déterminé par les propriétés chimiques
qui a montré une capacité élevée (Xm=1,04-2,04
mmol/g) pour tous les contaminants étudiés. En 2011, Fang et
al ont étudié l'élimination du
métronidazole par adsorption en utilisant le fer à valence
zéro. Les résultats expérimentaux ont montré que le
métronidazole était complètement éliminé par
ce solide, et que l'éfficacité d'élimination va croissant
avec l'augmentation de la quantité de fer, tandisque celle diminuait
avec l'augmentation de la concentration initiale en métronidazole et du
pH, de la solution initiale. Aarab et al., (2015) Dans cette
étude l'adsorption du métronidazole a été
réalisée, en milieu aqueux, sur un polymère, la
polyaniline (PANI) synthétisée par oxydation à l'aide de
Na2S2O8, par la technique de Batch (régime statique). Les
résultats obtenus au cours de ce travail après avoir
étudié l'influence de plusieurs paramètres : temps de
contact, le rapport (solide/liquide de la solution rs/l), la concentration
initiale, le pH et la température ont montré que le temps
d'équilibre est atteint pour un temps égal à 360
min. D'une autre part la température et le pH ont peu
d'influence sur l'adsorption du polluant sur la PANT. L'examen des isothermes
d'adsorption montre que le modèle de Langmuir est le mieux adapté
pour l'adsorption du métronidazole sur la PANI avec un de coefficient de
corrélation de 0,9897 ; le facteur de séparation
a une valeur comprise entre 0,6896 et 0,0999
montrant que les conditions sont favorables pour l'adsorption. En
2016, Azarpia et al., ont étudié l 'adsorption du
métronidazole (MNZ) par la balle de riz a été
éffectuée en batch. L'influence du temps de contact, de la
concentration initiale, du dosage de l'adsorbant et de la température a
été étudiée. Le temps d'équilibre s'est
avéré être de 90 minutes à toutes
les concentrations. Le pourcentage d'élimination du MNZ augmentait avec
l'augmentation de la température et indiquait que le processus
d'adsorption du MNZ était endothermique et spontané. Les
performances d'adsorption des adsorbants bénins ont été
appliquées aux isothermes de Langmuir, Freundlich, Dubinin-Radushkevich
et Temkin qui fournissent des informations importantes sur les
propriétés de surface de l'adsorbant et son affinité pour
l'adsorbat. Les données correspondent correctement à l'isotherme
de Langmuir par rapport à l'isotherme de Freundlich, Temkin et
Dubinin-Radushkevich prouvant une adsorption monocouche et une surface
homogène de l'adsorbant.
33
Les résultats ont indiqué que la balle de riz
modifiée est un adsorbant technologique prometteur à faible
coût pour l'élimination des antibiotiques. En 2018, nasseh et
al ont étudié l'adsorption de l'antibiotique
métronidazole à partir d'un nanocomposite magnétique. De
cette étude, ils ont obtenu qu'avec l'augmentation de la dose de
nano-adsorbant synthetisé, le pourcentage d'adsorption de l'augmentation
de manière significative de (21,18 à 62,18%). De même avec
l'augmentation de la concentration de métronidazole de 10 à
30mg/L, le pourcentage diminue en raison de la restriction des sites
d'adsorption. Avec une quantité maximum d'adsorption de qmax=135mg/g.
En 2020, Abderrahman , dans sa thèse a
synthétisé et caracterisé un matériau composite
SnO2-Palygorskite pour l'adsorption du métronidazole et
spiramycine. Il ressort de ces travaux que la quantité maximale du
métronidazole adsorbée est 8600ug/g et que l'adsorption est mieux
décrit par une cinétique de pseudo-second ordre, les
données expérimentales sont bien adaptées au modèle
de Langmuir.
Conclusion Partielle :
Les produits pharmaceutiques sont largement utilisés
pour prévenir et traiter plusieurs maladies. Ces composés sont
classés par catégorie en tant que polluant émergent en
raison de leur stabilité et effets néfastes sur la santé
humaine et vie aquatique. Il est donc impérieux de résoudre ce
problème de pollution dû aux produits pharmaceutiques
rejetés dans l'environnement. Les voies de traitement sont biologiques
ou physico-chimiques. Dans le cadre de notre étude, nous avons
opté pour le procédé par adsorption, qui, est l'une des
techniques de traitement les plus utilisées dans le domaine du
traitement des eaux car c'est un procédé simple, peu couteux et
facilement concevable. Sa mise en oeuvre nécessite un adsorbant solide
tel que : les argiles, zéolithes, palygorsky et les charbons actifs. Les
argiles sont des matériaux peu onéreux et facilement accessibles,
qui présentent d'excellentes propriétés d'échanges
de cation et qui peuvent être utilisées pour l'adsorption des
polluants. Cette revue vise également à apporter de
lumière sur l'optimisation des paramètres par la
méthodologie des surfaces de réponse.

: MATERIEL ET METHODES
34
Dans ce chapitre nous présentons le matériel de
base utilisé ; sa nature, son origine , ainsi que leur
préparation. Les différents protocoles expérimentaux
conduisant à la préparation de l'argile brute, sodique et
pontée.
II.1 MATERIEL
Matière première
Pour cette étude, l'argile est extraite du gisement de
Tapareo dans l'arrondissement « Mindif » dans la Région de
l'Extrême-Nord Cameroun.
Il se présente en masse onctueuse, de couleur
grisâtre, friable par temps sec et gonflant à
l'humidité.
II.2. METHODES
II.2.1. Fractionnement et purification de
l'argile
Le processus de fractionnement est de faire la
sédimentation des particules argileuses dans l'eau afin de les
séparer, puis les purifier pour avoir des particules fines d'argiles.
Notre argile qui est soumise à l'étude provient
d'un milieu naturel contenant des impuretés dont il faudra les
éliminer. La partie argileuse se trouvant dans la fraction inferieure de
2???? est recueillie par sédimentation successive après
application de la loi de Stock. Nous avons introduit l'argile dans une bassine
d'eau puis nous avons procédé à la macération
jusqu'à obtention de la solution boueuse qu'on verse dans un sceau de
10L, avec un robinet préalablement adapté à 10cm du bas.
Le protocole expérimental est décrit sur la figure 9.
Après le temps requis, on prélève par le robinet de
l'allonge de sédimentation le mélange se trouvant au-dessus de la
distance maximale de chute. La suspension de sol présente dans l'eau est
recueillie dans des bocaux, puis étuvée à 105°C
jusqu'à évaporation. La fraction séchée est
broyée dans un mortier en porcelaine La poudre obtenue est pesée
et conservée dans un bocal hermétiquement fermé.

35
Figure 9:Dispositif de séparation de la
fraction argileuse
II.2.2. Purification à l'acide
chlorhydrique
Les carbonates et les hydroxydes s'associent aux argiles, qui
forment des revêtements, couvrant les surfaces des particules argileuses.
Ces impuretés sont éliminées par lavage à l'acide
relativement dilué. 50g d'argile, est délayée dans 500
???? d'eau distillée sous agitation pendant 1h et laissée au
repos pendant 24h pour permettre aux feuillets de l'argile de se disperser.
Après rinçage, la suspension est
acidifiée par 500 ???? d'une solution d'acide chlorhydrique à
0,05M. Le mélange acidifié est porté à agitation
pendant 1h ; puis laissé au repos pendant 24h.
Par un dispositif de poire le mélange est
séparé puis lavé à l'eau distillée
jusqu'à disparition de l'acide chlorhydrique (test négatif au
nitrate d'argent). La fraction argileuse purifiée est
séchée à l'étuve à 105°C pendant
24h.
II.3. MODIFICATION DE L'ARGILE
II.3.1. Préparation de l'argile
sodique
Le but de cette opération est de traiter l'argile
purifiée par homo-ionisation sodique (sodification) et consiste à
remplacer tous les cations échangeables des natures diverses par des
cations de sodium tous identiques. Elle permet d'autre part d'avoir des
fractions granulométriques bien définies, de taille
inférieure à 2 micromètres (< 2um), qui correspondent
à la montmorillonite homoionique sodique. Le protocole adopté
dans ce travail est décrit comme suit :
Après lavage à l'acide chlorhydrique et à
l'eau distillée, l'argile récupérée est rendue
sodique par agitation de 50g d'argile dans 1L d'une solution de chlorure de
sodium 1M puis laissé au repos pendant 24h. Ainsi donc l'argile sodique
préparée, est lavée plusieurs fois à l'eau
36
distillée jusqu'à disparition complète
des ions chlorures (test négatif au nitrate d'argent),
homogénéisée par agitation puis séchée
à l'étuve à 105°C pendant deux heures et est
broyée. Le protocole ainsi décrit est représenté
par la figure 10 ci-contre.
Dispersion de l'argile (50??) dans un litre de
N????l (1N) par agitation mécanique pendant 30 min
Décantation
Lavage à l'eau distillée
Elimination des chlorures
Séchage
Broyage
Figure 10:Protocole de préparation de
l'argile sodique d'une solution pontante : Souton d'hydroxy
(????(????)??)
Le but est de préparer une solution pontante par des
composés chimiques afin d'augmenter la surface et la porosité de
l'argile.
Le principe de cette préparation consiste à
titrer une solution de sulfate d'aluminium par une solution d'hydroxyde de
sodium (NaOH) à l'aide d'une burette avec un débit discontinu
(goutte à goutte) sous agitation. Lors du titrage,
l'homogénéisation de la solution est réalisée par
un agitateur magnétique afin d'éviter la suralcalinité
locale des solutions, qui peut déclencher la formation du
précipité de l'hydroxyde métallique
??l(????)3. La solution obtenue (solution de
??l(????)3) appelée solution pontante est
gardée pendant 48 heures en absence de la lumière pour
éviter toute autres réactions et aussi pour qu'elle atteigne son
temps de vieillissement.
37
Tableau 2:Conditions pour la préparation
de la solution pontante
Rapport molaire ????-/????3+= 2/2
Temps de vieillissement 48heures
Température Ambiante
II.3.2.2. Pontage de l'argile
L'intercalation de l'argile sodée par des
différentes espèces chimiques ou composés chimiques a pour
but d'augmenter sa surface et sa porosité. En effet, cette
procédure permet de :
-D'augmenter davantage les distances basales (??(001))et
l'espace entre les feuillets ;
- De créer des pores dans les plans perpendiculaires
des feuillets d'argile.
Le pontage des argiles par des polycations d'oxyde
métallique est réalisé selon une procédure qui est
devenue classique et qui fait appel à une succession d'opérations
fondamentales qui sont l'échange cationique et le traitement
thermique.
Des suspensions d'argile sodique initialement bien
homogénéisées pendant une heure sont titrée goutte
à goutte à l'aide d'une burette par la solution pontante
(Al(OH)3) sous agitation rapide et permanente. A la fin du titrage, nous
laissons les argiles en contact avec les polycations métalliques pendant
48 heures dans le but d'assurer une bonne insertion et d'éviter la
formation de toute autre réaction. Après plusieurs lavages
à l'eau distillée jusqu'à disparition d'ions Chlorure, les
complexes sont séchés dans une étuve à 105°C
pendant 24 heures à l'abri de toute contamination extérieure.
Puis, le solide est calciné à 400°C pendant 3 heures. Les
étapes de la procédure de pontage de l'argile sont
décrites selon le schéma ci-après.
Goutte à goutte
Polymère d'aluminium Al(OH)3
Argiles purifiées
+
Eaux distillée
Repos à l'obscurité (48H)
Lavage et séchage
Calcination
Applications
Argile-Al
NaOH, 0,2M
Goutte à goutte
(????2(????4)36??2?? ; 0,2??)
38
Figure 11:Protocole de préparation de l'argile
pontée (Dobe 2018)
II.4. Méthodes de détermination de quelques
propriétés physico-chimiques de l'argile
purifiée
II.4.1. Détermination de la perte au feu
(PAF)
La perte en masse exprimée en pourcentage est la
masse de poids d'un échantillon après calcination
à 1000°C, rapportée à la masse initiale. Il permet de
connaître la quantité des produits susceptibles de se
décomposer ou de se volatiliser au cours de la cuisson.
Une masse m1 d'argile (1g) est
mise dans un four, avec augmentation progressive de la
température jusqu'à 1000 °C. Cette
température est maintenue pendant 1h. Le creuset est
refroidi et l'argile pesée (m2) (Namory et
al.,2019)
La valeur de la perte au feu est donnée par la relation
(II.1) :
39
PAF = (mi - m2 /m1 ) x 100 (II.1)
Où,
m1 : masse d'argile avant cuisson ;
m2 : masse d'argile après cuisson.
II.4.2. Détermination du taux
d'humidité
La mesure du taux d'humidité consiste à
déterminer la masse d'eau éliminée par le séchage
d'un matériau humide jusqu'à l'obtention d'une masse constante
à une température de 105 #177; 5 °C pendant 24 heures ; la
masse du matériau après l'étuvage est
considérée comme la masse des particules solides
(me). La détermination du taux
d'humidité est faite à partir du rapport de la masse de l'eau
(meau ) sur la masse des particules solides
(me). Celui-ci donne la teneur en eau de
l'échantillon analysé (Chossat et al.,2005). Le taux
d'humidité est donné par la relation (II.2) :
H (%) = me" x 100 = mt-ms x 100
(II.2)
ms ms
Où,
mean: masse d'eau (g) ;
ms : masse de
l'échantillon sec (g) ;
mt: masse de
l'échantillon humide (g).
II.4.3. Détermination de l'indice de gonflement
(IG)
Dans une éprouvette de 100 mL
contenant 50 mL d'eau, sont introduites
0,5 g d'argile.
Après 45 min, sont ajoutées une autre portion de
0,5 g d'argile. Après
2h, on relève le volume
total dans l'éprouvette. L'indice de gonflement est
déterminé par la relation (II.3) :
IG(%) = (volume de gonflementx50)
(II.3)
(50 - %humidité)
II.4.4. Détermination de la densité
(d)
La mesure de la densité apparente (d) de
l'échantillon étudié est effectuée par la
détermination du volume d'une masse m de l'échantillon. La
densité est déterminée par la relation (II.4) :
Masse du volume de
l'échantillon
d = (II.4)
masse du même Volume d'eau
II.4.5. Détermination du pH
Une solution à 10% d'argile m/v est
préparée avec de l'eau, le mélange est laissé
reposer 4h à température ambiante. La solution d'argile obtenue
est homogénéisée par un agitateur magnétique. La
lecture est faite directement par un pH-mètre METTLER TOLEDO( Amin et
al.,2009).
40
II.4.6. Détermination de la porosité
(P)
La détermination de la porosité permet
d'évaluer le pourcentage du vide dans le matériau. Elle est due
alors à la présence dans la structure du solide des pores, de
canaux et des cavités de différentes dimensions. Elle influence
la diffusion des molécules à l'intérieur des solides.
Dans une éprouvette de 10 mL, un volume
(V1=1,5 mL) d'argile de masse M1 (2 g)
est introduit. Le méthanol M2
est ajouté jusqu'à la graduation 2 mL
dans l'éprouvette. La porosité (P) est
déterminée par la relation (II.5) (Gilot,1984)
|
P = Vi
Vt
|
[(M2 - M1) / Pméthanoll -
V2 (II.5)
Vt
|
Avec : pméthanol = 0,
79g/cm3 et Vt =
2mL.
II.4.7. Détermination du point de charge nul
(pHPzc)
Le pHPzC correspond à la
valeur de pH du milieu pour laquelle la
résultante des charges positives et négatives de la surface est
nulle.
La méthode consiste à placer 50 mL
de solution de NaCI 0,01 M en matras
fermés et d'ajuster le pH de chacun (valeurs comprises entre 2 et 12 par
pas de 2) par addition de solution de NaOH ou
HCI de concentration 0,1 M et
0,01M. Dans chaque matras, nous ajoutons 0,15 g d'adsorbant. Les
suspensions sont maintenues en agitation constante, à température
ambiante, pendant 24 h. Le pH final est
mesuré. Le pHPzC est le point où la
courbe pH final =
f (pHintiai) intercepte la ligne
pH finai = pHintiai (Crini et Badot, 2007)
II.5. Propriétés physico-chimiques du
métronidazole
Le métronidazole est un médicament
utilisé pour traiter les infections causées par les
parasites(amibes) et des bacteries anéarobies. Il peut également
être administré pour traiter la diarrhée due à
Entamoeba histolytica, Giardia lamdia ou clistridium difficile. Le
métronidazole est une poudre cristalline, d'odeur
légèrement fétide, de saveur amère et
légèrement amère. Le métronidazole a pour formule
brute C6H9N3O3, de masse molaire 171,5g /mol. Sa solubilité est de 9,5g
/L dans l'eau à 20°C . La nomenclature systématique
donnée est 1-betahydroxylethyl-2-methyl-5-nitromidazole. Sa structure
topologique est :
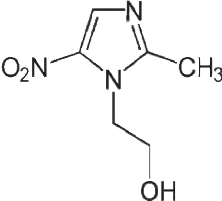
41
II.5.1. Préparation de la solution mère du
métronidazole
Pour préparer la solution mère de
métronidazole de concentration 100ppm, nous introduisons dans une fiole
jaugée de 1L une masse de 1g du métronidazole. Nous laissons sous
agitation jusqu'à dissolution complète des cristaux. Les
solutions filles sont préparées par
dilution successive de la solution mère à
l'ordre de
10ppm,20ppm,30ppm,40ppm,50ppm,60ppm,70ppm et 80ppm.
II.5.2. Méthodes de dosage par
spectrophotométrie UV-Visible
Le dosage par spectrophotométrie dans le domaine de
l'Ultra-Violet(UV) permet de
déterminer les concentrations résiduelles en
métronidazole en utilisant la loi de BEER-
LAMBERT donnée
par la relation : ?? = ????. ??. ??
?? : absorbance ;
???? : coefficient d'absorption molaire à la longueur
d'onde ?? de mesure ;
?? : épaisseur de la solution traversée ;
?? : concentration du soluté.
Courbes d'étalonnage
La longueur d'onde du métronidazole est de 320nm dans
l'U.V, ainsi donc les densités optiques des solutions filles sont
mesurées par un spectrophotomètre. Les résultats sont
enregistrés dans le tableau A.2 de l'annexe. La courbe
d'étalonnage A=f(C) représentée
dans la figure 12 est tracée grâce aux valeurs obtenues
après mesures.

1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
Etalonnage du Metro
0,0
42
0 10 20 30 40 50 60 70 80 90
Concentration (ppm)
y = 0,01031x + 0,11136 R2 =
0,998
Figure 12:Courbe d'étalonnage du
métronidazole
II.6. Etude de quelques paramètres
d'adsorption
II.6.1. Temps d'agitation
Les études concernant le temps d'agitation ont
été faites à une température ambiante. Dans des
réacteurs de 20mL , on introduit 20mL de la solution
du métronidazole de concentration 80ppm ; des masses de l'ordre : 0.01g
;0.09g ; 0.17g d'argile brute, d'argile sodique et d'argile pontée sont
introduites différemment dans chaque réacteur. Chacun des
mélanges est porté sous agitation constante, pendant des
durées progressives 3,30 et 60 minutes. Dans les tubes à essais
sont recueillis le mélange puis dosé par
spectrophotométrie. Les calculs
* v
des quantités absorbées sont effectués en
utilisant la relation de l'équation : qe=C
-Cr
m
II.6.2 Influence de la concentration
initiale
En utilisant les solutions filles de concentration 10;20 ;30
;40 ;50 ; 60 et 70 ppm, on ajuste au pli pour lequel l'adsorption est maximale.
On introduit 20mL de chacune des solutions filles selon leur concentration
respective et la masse adéquate d'argile brute, d'argile sodique et
d'argile pontée. Après agitation selon le temps de contact, le
filtrat est recueilli et la lecture d'absorbance est faite au
spectrophomètre. Le but de l'expérience permet d'évaluer
l'influence de la concentration sur le processus d'adsorption. Comme les cas
précédant la quantité optimale est
déterminée graphiquement.
43
II.7. Plan d'expérience
II.6.1. Planification du plan
d'expérience
Cette section se veut, d'énoncer le problème
à résoudre qui réside dans la présence de plusieurs
paramètres qui influent, d'une façon ou d'une autre, sur le
phénomène d'adsorption du métronidazole en milieu aqueux,
en tenant compte de leur interaction. Notre but est de confirmer l'influence
des paramètres jugés intéressants et la relation entre
eux. Ces paramètres devront répondre à notre objectif
défini par l'obtention du taux d'élimination le plus
élevé en réalisant peu d'expériences et en
exploitant moins de variables.
II.7.2. Choix du Plan d'expérience et facteurs
d'études
Le plan expérimental factoriel consiste à
changer toutes les variables d'une expérience à l'autre pour
estimer l'influence des différentes variables. C'est-à-dire
comment l'effet d'un facteur varie avec le niveau des autres facteurs dans une
réponse. Les avantages des plans factoriels résident
principalement dans le faible coût, le nombre réduit des
expériences et la grande évaluation des interactions possibles
entre les variables. Le plan factoriel complet (FFD) consiste en une
expérience de 3?? (k facteurs, chaque expérience
à trois niveaux), ce qui est très utile pour les études
préliminaires ou pour l'étape d'optimisation, alors que les plans
factoriels fractionnaires sont presque obligatoires lorsque le problème
implique un grand nombre de facteurs. Parce que les études d'adsorption
impliquent plusieurs expériences, le plan d'expérience factoriel
a été appliqué à différents systèmes
d'adsorption de plusieurs substrats. Dans notre étude, un plan factoriel
complet de 33 a été utilisé pour évaluer
l'importance du temps, la masse (quantité d'adsorbant) et le pH du
milieu réactionnel dans l'évaluation des capacités
d'adsorption.
II.7.3. Application d'un plan factoriel complet
????à la modélisation du
métronidazole
Le plan factoriel complet à 3 facteurs et 3 niveaux
(33) est utilisé pour étudier l'adsorption du
métronidazole en solution aqueuse l'argile brute, l'argile sodique et
l'argile pontée. Le but est de modéliser la capacité
d'adsorption en fonction de 3 conditions opératoires employées.
Le plan factoriel est utilisé afin d'identifier et d'évaluer
l'influence de chaque paramètre (facteur) sur l'adsorption du
métronidazole. Les trois facteurs considérés sont : le
temps , la masse et le pH . Chacun d'eux peut prendre 3 niveaux : -1 ;0; +1.
Le tableau ci-après présente les facteurs
choisis et le domaine d'étude dans lequel le travail devrait être
réalisé l'expérience :
44
Tableau 3:facteurs et domaine d'étude
|
Facteurs
|
Niveau -1
|
Niveau 0
|
Niveau +1
|
|
X1
|
Temps de
contact (min)
|
3
|
31.5
|
60
|
|
X2
|
Masse de
l'adsorbant (g)
|
0.01
|
0.09
|
0.17
|
|
X3
|
pH
|
3
|
7
|
11
|
Le but principal qu'on veut atteindre est l'élimination
de la plus grande quantité d'adsorbat par un procédé
respectueux de l'environnement (l'adsorption) dans un milieu aqueux. La
réponse se présente donc par la quantité maximale
d'adsorption du métronidazole
La réponse est calculée à partir de
l'équation :
Ce : la concentration initiale en
métronidazole
Ce : la concentration résiduelle (à
l'équilibre) du métronidazole m : masse de l'adsorbant en
gramme
v : volume de la solution
II.8. Traitement des données
Le traitement des données est fait grâce aux
logiciels Minitab18, pour optimiser la surface de
réponse et le diagramme de pareto, OriginPro2018 32bit ,
nous sert à réaliser les figures des différents
modèles mathématiques à savoir, les isothermes et
cinétiques, Statgraphic, ce logiciel nous a permis de
générer le plan d'expérience et Microsoft Excel
2016 pour le calcul des quantités adsorbées, pourcentage
d'élimination et autres équations mathématiques de
modèles.

RESULTATS ET DISCUSSIONS
45
A la suite du chapitre 2 où il était question de
présenter les différentes méthodes de préparation
de nos adsorbants, les protocoles de manipulation et la matrice
d'expérience, ce chapitre présente les résultats obtenus
au cours des essais d'adsorption, l'étude de l'influence des
paramètres au cours de l'adsorption du métronidazole en solution
aqueuse et la mise en oeuvre de l'application des isothermes et de la
cinétique sur le processus d'adsorption.
III.1. Caractéristiques physico-chimiques de
l'argile naturelle de Mindif
Les caractéristiques physico-chimiques de l'argile brute
utilisée lors de cette étude sont Consignées dans le
tableau 4.
Tableau 4: Caractéristiques
physico-chimique de l'argile brute de Mindif
|
Paramètre
|
%H
|
%PAF
|
%IG
|
d
|
P
|
????
|
??????????
|
|
Valeur
|
8,33
|
19,09
|
61,43
|
1,33
|
66,58
|
8,20
|
7,65
|
%H : taux d'humidité ; %PAF : perte au feu ; %IG :
indice de gonflement ; d : densité ;
P : porosité ; ???? :
potentiel d'Hydrogène ; ?????????? : point de charge nul.
III.1.1. Taux d'humidité
La valeur du taux d'humidité indique le
caractère hygroscopique de l'argile. Cette eau correspond à l'eau
libre d'hydratation qui s'évapore à partir de 100°C. La
quantité de cette relativement basse serait due au fait que l'argile a
été prélevé en saison sèche. (Hyun et
al.,2001).
III.1.2. Perte au feu
Le résultat 19,09% pour la perte au feu, indique que
l'eau de constitution des minéraux argileux s'est évaporée
(valeur moyenne comprise entre 4,6 à 19% du poids des minéraux
selon sa nature minéralogique). Ce résultat reflète
également la faible valeur de la matière organique par rapport
à la fraction minérale (Baize,2018).
III.1.3. Indice de gonflement
Le mécanisme d'hydratation des argiles est
conditionné par divers paramètres à savoir la structure du
matériau, l'espace interfoliaire, la concentration des constituants
chimiques et même l'histoire du matériau. La valeur de l'indice de
gonflement est importante, ceci peut être due à la finesse et
à une forte ionisation des particules entrant dans la constitution de
l'argile (Tejeogue,2019).
46
III.1.4. Le pH
La mesure du pH d'une suspension
d'un échantillon de sol dans l'eau rend compte de la concentration en
ion H30+à l'état
dissocié dans le liquide surnageant. Le résultat de 8,20
révèle la légère basicité de l'argile qui
serait due aux sels solubles basiques comme les carbonates et les bicarbonates
alcalins ou les silicates qui rentrent généralement dans la
composition des argiles
III.1.5. Le pHpzc
Le pHpzc correspond à la
valeur de pH du milieu pour laquelle la
résultante des charges positives et négatives de la surface est
nulle. Les résultats obtenus sont représentés dans le
tableau A.1 de l'annexe et représentés par la figure 13
ci-dessous :
pHfinal = pHinitial pHfinal =
f(pHfinal)
2 4 6 8 10 12
pHinitial (ppm)
Figure 13: Détermination du point de
charge nul de l'argile brute de Mindif
La courbe de la figure 13 montre que l'intersection se produit
à une valeur du pH= 7,65 correspond au point
de charge nul. La charge extérieure a été provoquée
par les interactions entre les ions dans la solution et les groupes
fonctionnels de l'argile. La charge extérieure d'un solide dépend
du type d'ions actuels dans la solution, des caractéristiques de la
surface, de la nature de l'adsorbant, et du pH de la
solution. A pH inférieur au
pHpzc, la charge de surface du matériau est
globalement positive et à pH supérieur
au pHpzc, elle est négative (Injagbemi et
al.,2009 ;Roberto et al.,2008).
47
III.2 Analyse statistique de la quantité
adsorbée (pourcentage d'élimination) du
Métronidazole
Tableau 5: Analyse statistique de la
quantité adsorbée (pourcentage d'élimination) du
Métronidazole
|
Quantités
|
temps
|
masse
|
pH
|
Qe
|
Qe
|
Qe
|
%R
|
%R
|
%R
|
|
adsorbées/Facteurs
|
|
|
|
ABM en
mg/g
|
ASM en
mg/g
|
APM mg/g
|
ABM
|
ASM
|
APM
|
|
Minimum
|
60
|
0,17
|
11
|
0,45
|
0,65
|
1,34
|
4,75%
|
6,93%
|
14,20
|
|
Maximum
|
31,5
|
0,01
|
3
|
80,92
|
82,86
|
99,93
|
50,57%
|
51,79%
|
62,46%
|
48
Les quantités d'adsorption (pourcentage
d'élimination) vont de l'ordre de 0,45 mg/g à 80,92mg/g (4,75%
à 50,57%) ;0,65mg/g à 82,86mg/g (6,93% à 51,79%) et de
1,34mg/g à 99,93mg/g (14,20% à 62,46%) respectivement pour
l'argile brute, l'argile sodique et l'argile pontée. Nous pouvons
constater que l'utilisation de l'argile pontée (intercalée en
aluminium) (APM) aboutit à des meilleurs rendements d'élimination
que l'argile brute, et l'argile sodique(ABM et ASM ). Ce résultat peut
s'expliquer par le fait que la distance interfoliaire est plus importante dans
l'argile pontée que l'argile brute et sodique à cause de la
substitution des cations de cette zone par ceux d'aluminium. Des
résultats similaires ont été obtenus par Thiebault en
(2016), lors de l'adsorption des produits pharmaceutiques par interactions
organo-minérales.
De notre analyse, il ressort que l'adsorption est favorable
à un pH acide (pH = 3) , un pH inférieur au
pH au point de la charge nulle pour nos adsorbants , avec une valeur
de 7,65 (pHzpc). Les variations du pH attribuées à la
charge (matériaux) à différents niveaux de pH et
aux charges éléctriques du métronidazole . le pKa du
métronidazole est de 2,55. Ainsi, cet antibiotique a une charge positive
à des pH acides et est protonés (MNZ-H+). Il est
également connu qu'à des pH inferieur à pHZpc ,
la charge de surface de l'adsorbant est positif.
Ceci peut s'expliquer par la charge positive des groupements
de surface. En effet, ces charges favorisent l'échange ionique (Fumba et
al.,2014). Des résultats similaires ont été
obtenus par Tiago en (2019) lors de l'adsorption de Triméthoprime par
l'argile modifiée ainsi que Ngakou en (2017) , lors de l'adsorption de
la phénacétine (médicament ) en solution aqueuse. La
diminution de la quantité du métronidazole adsorbée avec
l'augmentation du pH peut s'expliquer par le fait que la
solubilité augmente avec le pH et les charges négatives
au niveau de la surface de nos argiles augmentent les répulsions
électrostatiques entre l'adsorbat et les groupes hydroxyles à la
surface de l'argile. L'ensemble des résultats expérimentaux sont
consignés dans le tableau A.3 de l'annexe.
L'étude des effets de différents
paramètres d'adsorption et leurs interactions a été mise
en évidence et diverses méthodes statistiques ont
été appliquées, il s'agit de diagramme de pareto, les
effets principaux, les interactions entre les facteurs, l'analyse des variances
qui indique l'importance des facteurs étudiés et la surface de
réponse.
III.2.1. Analyse des variances (ANOVA)
Cette analyse statistique permet de déterminer les
facteurs qui régissent l'adsorption du métronidazole par nos
adsorbants à savoir l'argile brute, sodique et l'argile pontée,
et, de même que la signification de chaque effet. L'analyse des variances
(ANOVA) a permis de déterminer
49
les effets principaux, d'interaction quadratique des
différents variables et les résultats sont
présentés dans les tableaux ci-dessous pour chaque
matériau. Les tableaux d'analyse comprennent : le coefficient du
modèle l'erreur standard, la valeur du test t student et le niveau de
confiance des facteurs.
Tableau 6:Analyse de la variance pour Qe de
l'argile brute
|
Source
|
Somme des
carrés
|
DDL
|
Moyenne quadratique
|
Rapport F
|
Proba.
|
|
A:temps
|
1,89467
|
1
|
1,89467
|
0,01
|
0,9074
|
|
B:masse
|
2708,83
|
1
|
2708,83
|
19,93
|
0,0003
|
|
C:Ph
|
2945,33
|
1
|
2945,33
|
21,67
|
0,0002
|
|
AA
|
39,4516
|
1
|
39,4516
|
0,29
|
0,5970
|
|
AB
|
14,5506
|
1
|
14,5506
|
0,11
|
0,7475
|
|
AC
|
90,1888
|
1
|
90,1888
|
0,66
|
0,4266
|
|
BB
|
716,259
|
1
|
716,259
|
5,27
|
0,0347
|
|
BC
|
2841,72
|
1
|
2841,72
|
20,91
|
0,0003
|
|
CC
|
705,867
|
1
|
705,867
|
5,19
|
0,0359
|
|
Erreur totale
|
2310,67
|
17
|
135,922
|
|
|
|
Total (corr.)
|
12374,8
|
26
|
|
|
|
R carré R carré
S R carré (ajust) (prév)
0,572049 90,22% 85,04% 73,75%
D'après ce tableau, on remarque que le coefficient de
détermination R2 est d'ordre (0.9022), on peut dire que
90.22% des observations sont expliquées par le modèle. En outre,
les valeurs de P sont trouvées inferieures à 0.05 pour le facteur
masse et pH ; les interactions BC, BB et CC. De ce fait, ces facteurs et
interactions sont significatifs.
50
Tableau 7:Analyse de la variance pour Qe de
l'argile sodique
|
Source
|
Somme des
carrés
|
DDL
|
Moyenne quadratique
|
Rapport F
|
Proba.
|
|
A:TEMPS
|
7,28221
|
1
|
7,28221
|
0,06
|
0,8033
|
|
B:MASSE
|
3997,31
|
1
|
3997,31
|
35,13
|
0,0000
|
|
C:PH
|
3302,69
|
1
|
3302,69
|
29,02
|
0,0000
|
|
AA
|
17,6334
|
1
|
17,6334
|
0,15
|
0,6987
|
|
AB
|
1,21047
|
1
|
1,21047
|
0,01
|
0,9191
|
|
AC
|
17,2663
|
1
|
17,2663
|
0,15
|
0,7017
|
|
BB
|
1037,24
|
1
|
1037,24
|
9,11
|
0,0077
|
|
BC
|
3217,21
|
1
|
3217,21
|
28,27
|
0,0001
|
|
CC
|
649,343
|
1
|
649,343
|
5,71
|
0,0288
|
|
Erreur totale
|
1934,64
|
17
|
113,802
|
|
|
|
Total (corr.)
|
14181,8
|
26
|
|
|
|
R carré R carré
S R carré (ajust) (prév)
0,381213 95,42% 93,00% 87,89%
51
Tableau 8:Analyse de la variance pour Qe de
l'argile pontée
|
Source
|
Somme des
carrés
|
DDL
|
Moyenne quadratique
|
Rapport F
|
Proba.
|
|
A:TEMPS
|
3,2172
|
1
|
3,2172
|
0,02
|
0,8866
|
|
B:MASSE
|
7143,26
|
1
|
7143,26
|
46,55
|
0,0000
|
|
C:PH
|
4454,6
|
1
|
4454,6
|
29,03
|
0,0000
|
|
AA
|
0,87258
|
1
|
0,87258
|
0,01
|
0,9408
|
|
AB
|
0,0472646
|
1
|
0,0472646
|
0,00
|
0,9862
|
|
AC
|
31,9645
|
1
|
31,9645
|
0,21
|
0,6539
|
|
BB
|
1930,78
|
1
|
1930,78
|
12,58
|
0,0025
|
|
BC
|
4652,62
|
1
|
4652,62
|
30,32
|
0,0000
|
|
CC
|
636,516
|
1
|
636,516
|
4,15
|
0,0576
|
|
Erreur totale
|
2608,6
|
17
|
153,447
|
|
|
|
Total (corr.)
|
21462,5
|
26
|
|
|
|
R carré R carré
S R carré (ajust) (prév)
0,206402 98,42% 97,58% 96,12%
D'après la littérature, on dit que qu'un facteur
est signifiant ou bien important lorsque leur probabilité (valeur de P)
est inférieure à 0,05. (Khelifi, 2018).
Les résultats de nos analyses modèle
proposé sont très signifiants (valeur de P < 0,05). Pour
l'ensemble de nos adsorbants (ABM,ASM et APM), les facteurs masse (B), et
????(C) ont un efffet signifiant (valeur de P< 0,05). On remarque que les
interactions BC, BB et CC sont également signifiants. Cependant, le
facteur temps (A) et les interactions AB,AA ont un effet non signifiant.
Le R2 de nos adsorbants est de l'ordre de 90,22% ;
95,42% et 98,21% respectivement pour l'argile brute(ABM), l'argile sodique(ASM)
et l'argile pontée (APM). Nous pouvons dire que cette étude a
donné des paramètres d'adéquation largement satisfaisants.
Le R2 a montré que les trois facteurs étudiés
étaient suffisants pour modéliser l'adsorption du
métronidazole. Le R2 ajusté montre que le
modèle est bien ajusté avec l'expérimentation.
C'est-à dire qu'il
52
tient compte des différents paramètres qui
régissent cette adsorption. Ensuite, le R2 prévu
dénote que ce modèle s'applique pour la prévision. Il est
fiable pour la conjecture d'un pourcentage d'adsorption dans des conditions pas
expérimentées, à condition que les paramètres
considérés appartiennent au domaine d'étude. Pour Haaland,
la pertinence du modèle est justifiée si l'ensemble des
R2 sont supérieures à 0,75 (Haaland,1989). D'autres
travaux ont trouvé des valeurs de R2 très
élevés mais en étudiant 4 facteurs (Dil,2018). Obtenir des
valeurs similaires avec uniquement 3 facteurs témoigne du choix
judicieux des facteurs.
En combinant les conclusions de l'erreur relative moyenne et
de l'adéquation du modèle, on conclut que ce modèle
décrit très bien l'adsorption du métronidazole, est fiable
et prend en considération l'ensemble des paramètres qui
régissent cette adsorption.
III.2.2. Modélisation et optimisation du plan
factoriel complet
Diagramme de Pareto
L'utilité du diagramme de Pareto des effets
normalisés est remarquable ; il sert entre autres, à comparer la
valeur relative et la signification statistique des effets principaux et des
effets d'interaction. Dans notre cas, le test t de student est également
effectué pour déterminer si les effets sont significativement
différents de zéro ou non. (Aloui,2021)
Sur ce diagramme, les colonnes horizontales représentent
les valeurs de t student de chaque effet pour chaque paramètre. Ce
diagramme permet aussi de classer les facteurs ainsi que leur interaction selon
leurs niveaux d'influences sur les réponses du modèle.
L'histogramme montre la contribution de chaque facteur ou interaction sur la
variation de la réponse, Y, par ordre décroissant
(Assaad,2015)
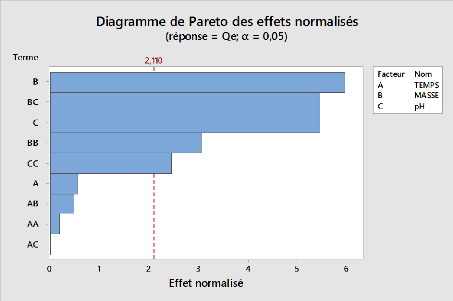
53
Figure 14:Diagramme de pareto des effets
normalisés pour l'adsorption du métronidazole pour l'argile
brute
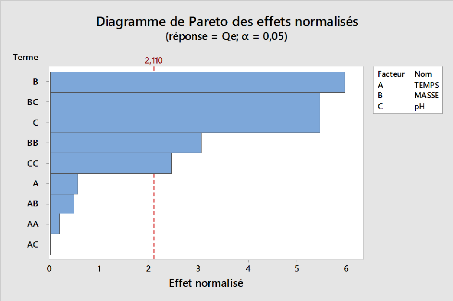
Figure 15:Diagramme de pareto des effets
normalisés pour l'adsorption du métronidazole par l'argile
sodique
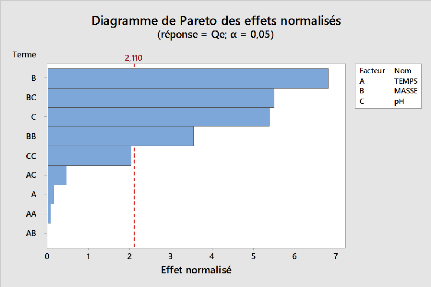
54
Figure 16:Diagramme de pareto des effets
normalisés pour l'adsorption du métronidazole par l'argile
pontée
III.2.3. Analyse des principaux facteurs
examinés et leurs interactions
Les facteurs masse (B), le pH(C) ; les interactions BC et BB,
sont les plus significatifs dans l'adsorption du métronidazole par nos
argiles. Il ressort également que le pH, est le facteur qui
contrôle l'électrostatique d'interaction entre l'adsorbant et
l'adsorbat, sur la base de résultats de l'analyse ANOVA et le diagramme
de Pareto, il semble évident que l'élimination du
métronidazole nécessite un pH bas de la solution. Lorsque nous
introduisons des doses faibles de matériaux dans un milieu acide nous
remarquons une accumulation considérable de quantité
adsorbées du métronidazole. Le pH influence donc notablement la
fixation du métronidazole sur nos argiles préparées. La
capacité maximale d'adsorption du métronidazole a
été observée à pH=3 pour nos trois adsorbants
utilisés et la capacité diminue avec l'augmentation du pH. Au
regard de nos résultats, nous constatons que les rendements
d'élimination du métronidazole augmentent avec la diminution de
la masse.
Le suivi de la teneur résiduelle a été
effectué en fonction du temps d'agitation (3 ; 31,5 ; 60min). Les
résultats présentés sur le diagramme de Pareto et de
l'analyse ANOVA montrent que la cinétique de fixation du
métronidazole est très rapide (Benzaoui,2018). Nous pouvons
cependant constater que l'utilisation de l'argile pontée présente
le meilleur rendement
55
d'élimination du métronidazole que l'argile
sodique et brute. Nous pouvons déduire que la masse et le ????
sont les meilleures variables du procédure globale d'adsorption.
L'adsorption est optimale à un pH et une masse faible (pH=3 et
m=0,01g).
III.2.4. Optimisation des facteurs influents par la
méthodologie de surface de réponse
L'optimisation de surfaces de réponse vise à
déterminer quantitativement les variations de la réponse
vis-à-vis des facteurs d'influence significative. Dans cette partie nous
présentons et discutons l'effet des facteurs en l'occurrence
l'adsorption du métronidazole par l'ABM, l'ASM et l'APM. La
démarche consiste à représenter la variation de la
réponse en fonction de deux facteurs uniquement, le troisième
étant maintenu fixe.
Surface de réponse pour l'argile brute de
Mindif

8
pH
60
40
Qe
20
10
- 10
20
0
MASSE
12
Valeurs de maintien
TEMPS 31,5
MASSE 0,09
pH 7

20
10
0
12
- 10
TEMPS
4
pH
Qe
Qe
0
TEMPS
MASSE
Figure 17:Diagramme de surface de réponse
de Qe pour l'adsorption du MNZ par ABM
Qe
g
e de
rfa c
ra m mes
Valeurs de maintien
TEMPS 31,5
MASSE 0,09
pH 7
Qe
40
60
20
0
MASSE
8
4
12
pH
Qe
20
10
0
,16
0
Dia
TEMPS
MASSE
15
10
Qe
de su
5
12
0
8
TEMPS
4
pH
56
Figure 18:Diagramme de surface de Qe pour
l'adsorption du MNZ par ASM
Surface de réponse pour l'argile
pontée de Mindif
Valeurs de maintien
TEMPS 31,5
MASSE 0,09
pH 7

Qe
50
75
25
0
MAS
SE
8
0
,
1 6
12
pH

Qe
40
20
0
0
,1 6
TEMPS
MAS
SE
8
pH
20
10
12
TEMPS
4
-
0
1 0
Qe
Figure 19: Diagramme de surface de
réponse pour l'adsorption du MNZ par l'APM
57
Les figures (17,18,19) représentent donc le diagramme
de surface de réponse (3D) pour mieux explorer la relation
éventuelle entre les variables sélectionnées ,
l'augmentation du taux d'adsorption (qe) est observé à partir des
niveaux bas pH(3) acide et masse (0,01g)avec une quantité
adsorbée supérieure à 60mg/g (taux d'élimination
supérieur à 50%). Cependant, avec l'APM, la quantité
adsorbée est supérieure à 75mg/g (le pourcentage
d'élimination est supérieur à 60%) et ce résultat
est obtenu à un pH acide (pH = 3).
En prenant en considération que les mécanismes
interactionnels initiant l'adsorption des produits pharmaceutiques sont
essentiellement basés sur les affinités de charges entre
adsorbant et adsorbat, une modification de leur état de protonation
engendre inévitablement des répercussions sur les
quantités adsorbées (De Oliveira et al.,2015). Le pH est
l'un des principaux paramètres à gouverner les processus
d'adsorption. Celui-ci est d'autant plus important puisqu'il intervient
directement sur l'état de protonation des groupements fonctionnels des
molécules ionisées ou ionisables entraînant une
évolution des espèces en solution mais également sur
l'état de charge en surface des matériaux et leur structure. En
effet, il est bien connu qu'un pH très acide conduit à une
dégradation des feuillets octaédriques de l'argile avec une
libération potentielle des cations Al3+ ou Mg2+
pouvant se substituer aux cations sodium, entraînant ainsi une
déstructuration des couches du minéral argileux modifiant les
charges de surfaces et les propriétés d'adsorption (Metz et
al.,2005). Et la quantité maximale est également obtenu
à une masse faible (m=0,01g), un résultat similaire a
été obtenu par Aloui ,2021 lors de la biosorption des produits
pharmaceutiques par les fibres de Luffa Cylindrica. En effet, la
quantité du métronidazole adsorbée décroit avec
l'augmentation de la masse des matériaux et tend à se stabiliser
pour une valeur de masse élevée. Au demeurant, la diminution de
la concentration des argiles, entraine la dispersion des grains dans la phase
aqueuse. Par conséquent, les surfaces adsorbantes seront plus
exposées. Ceci facilitera l'accessibilité d'un nombre de sites du
support à la molécule du métronidazole. D'autre part
l'augmentation de la masse entrainera une croissance des interactions
électrostatiques entre particule de l'adsorbant qui conduit à la
désorption du métronidazole de sites d'adsorbant entrainant ainsi
une agglomération des particules adsorbantes formants ainsi des
agrégats. Il y a une diminution de la surface de contact par le fait que
des sites actifs de nos adsorbants deviennent masquées.
III.3. Influence du temps de contact
La cinétique exprimée en termes de
quantité de soluté adsorbée en fonction du temps de
contact est l'une de plus importantes caractéristiques
définissant l'efficacité d'une adsorption.
58
La célérité avec laquelle
l'équilibre thermodynamique est atteinte en fonction de la vitesse de
diffusion de l'adsorbat et de l'interaction adsorbat-adsorbant (Sinha,2020).
L'adsorption du métronidazole en solution aqueuse de concentration
initiale de 80ppm et de volume de 20mL est faite en utilisant une masse de
0,01g d'argile brute, d'argile sodique et d'argile pontée. Les
résultats des quantités adsorbées pour les
différents temps de contact croissant sont répertoriés
dans le tableau A6,A7 et A8 de l'annexe et répresenté par la
figure 20 ci-contre
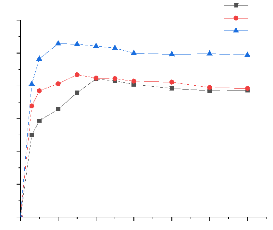
Cinétiques d'adsorption du Métro sur les
argiles
0 10 20 30 40 50 60
100
80
60
40
20
0
120
ABM
ASM
APM
temps (min)
Figure 20:Cinétique d'adsorption du
Métronidazole sur les argiles
L'allure des courbes, nous montre qu'il y a une forte
affinité entre les molécules du métronidazole et les
supports étudiés. Elle nous montre que le processus d'adsorption
se déroule en deux étapes assez distinctes : au cours de la
première étape l'adsorption est très rapide dès les
premières minutes et l'optimum est atteint au bout de 20 min ,15min et
10min respectivement pour l'argile brute, l'argile sodique et l'argile
pontée. Cette adsorption rapide (instantanée) pourrait concerner
les sites d'adsorption de surface où de forte affinité accessible
au métronidazole dès les premiers instants de la mise en
suspension de nos matériaux adsorbants dans la phase liquide contenant
le métronidazole en solution. Ceci pourrait s'expliquer par l'existence
de nombreux sites disponibles à la surface de l'adsorbant permettant la
fixation rapide des molécules d'adsorbat (Ghemit,2020 ;Thiebault et
al.,2015). Les quantités maximales adsorbées sont
84,22mg/g ; 86,74mg/g ; 105,75mg/g respectivement pour l'argile brute, l'argile
sodique et l'argile pontée. Nous remarquons que les quantités
adsorbées du métronidazole
augmentent de l'argile brute à l'argile pontée
via l'argile sodique. Ceci serait due au fait que la distance interfoliaire est
importante de l'argile brute à pontée en passant par l'argile
sodique à cause de la substitution des cations de cette zone par ceux de
sodium (cas de l'argile sodique) ou par ceux d'aluminium (cas de l'argile
pontée). La deuxième étape, montre une augmentation lente
des quantités adsorbées du métronidazole jusqu'au temps
d'équilibre, caractéristique du processus de diffusion à
travers de site moins accessibles (obstrués) avant d'atteindre un
équilibre d'adsorption où tous les sites seront occupés
(Madikizel et Chimika, 2016). Des résultats similaires ont
été observés par des études menées par
Oliviera et al.,2017, lors de l'adsorption du diclofenac par une
montmorillonite organophile.
Dans la suite de ce travail, les temps 20min, 15min et 10min
sont considérés comme temps de contact pour nos adsorbants
respectifs.
III.4. Influence de la concentration
Les expérimentations pour évaluer l'influence de
la concentration sur l'adsorption du métronidazole ont été
faite à dans les conditions optimales des résultats obtenus
précédemment à savoir une masse de 0,01 g ; un temps de
contact de 20min, 15min, 10 min respectivement pour l'argile brute, sodique et
pontée ; avec un pH = 3 , mais avec les solutions de concentrations
différentes en métronidazole, variant de 10 à 80ppm. Les
résultats sont présentés dans le tableau (annexe) et sur
la figure ci-après
Influence de la concentration sur l'adsorption du
Métro sur les argiles
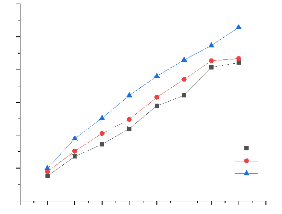
120
100
80
60
40
20
0
0 10 20 30 40 50 60 70 80 90
ABM
ASM
APM
Concentration (ppm)
59
Figure 21:influence de la concentration sur
l'adsorption du Métronidazole sur les argiles.
60
Les résultats montrent que la capacité
d'adsorption augmente avec la hausse des teneurs initiales de soluté
jusqu'à 80ppm et il n'y a pas de palier dans la gamme de concentrations
étudiées. Ceci peut traduire le fait que le taux de saturation
n'est pas atteint et que nos matériaux pourraient encore adsorbés
des quantités remarquables (importantes) du métronidazole.
L'augmentation a permis de déterminer le seuil de la saturation de nos
adsorbants.
III.5. Etude de la cinétique
d'adsorption
Cette étude permet de fournir des informations
relatives au mécanisme d'adsorption et sur sur le mode de transfert de
soluté de la phase liquide à la phase solide. Pour notre cas,
nous avons appliqué quatre modèles à savoir le
modèle pseudo-premier ordre, pseudo-second ordre, modèle
d'Elovich, modèle de diffusuion intra-particulaire. Les figures 22, 23,
24 présentent les courbes des équations linéarisées
de ces quatres modèles cinétiques.
Metro/ABM
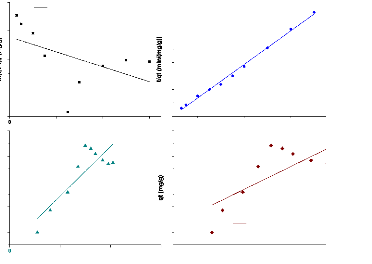
20 40 60
0 20
40 60
t (min)
))
y = 9,82364x + 44,60737 R2 =
0,729
t (min)
Modèle cinétique de Diffusion
Intraparticulaire
y = 4,17581x + 53,45942 R2 =
0,547
90
80
70
60
50
90
80
70
60
50
2 4 6
t (
ln(t) (min)
0 2 4 6
t1/2 (min1/2)
3
2
0,6
0,4
1
0,2
0
0,0
Cinétique Pseudo-second ordre
y = 0,01253x +0,01046 R2 =
0,996
Cinetique Pseudo-premier ordre
y = - 0,02615x + 2,78119 R2 =
0,256
0,8
4
Modèle Cinétique d'Elovich
Figure 22:modèle cinétique de
l'adsorption du métronidazole par l'argile brute
61
Metro/ASM
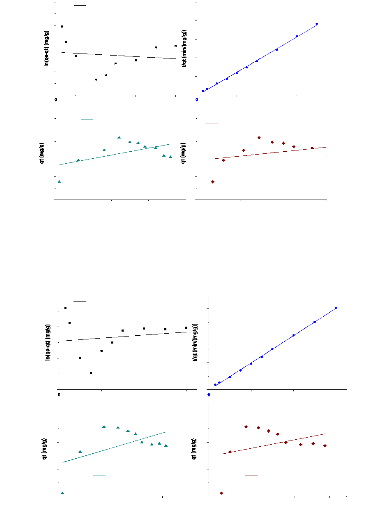
Cinetique Pseudo-premier ordre
y = - 0,00473x + 1,84308 R2 =
0,018
20 40 60
t (min)
Modèle Cinétique d'Elovich
y = 2,97366x + 71,82536 R2 =
0,293
1 2 3 4
ln(t) (min)
Cinétique Pseudo-second ordre
y = 0,01266x - 0,00837 R2 =
0,998
20 40 60
2 4 6
t1/2 (min1/2)
4
3
2
1
0
100
90
80
70
60
1,0
0,8
0,6
0,4
0,2
0,0
100
90
80
70
60
t (min)
Modèle cinétique de Diffusion
Intraparticulaire
y = 0,96488x + 75,91379 R2
=0,128
Figure 23:modèle cinétique de
l'adsorption du métronidazole par l'argile sodique
Metro/APM
20 40
60
0,6
Cinétique Pseudo-second ordre
y = 0,01012x - 0,00361 R2 =
0,999
Cinetique Pseudo-premier ordre
y = 0,00969x + 1,08438 R2 =
0,024
2
0
0,4
2 4
ln(t) (min)
t1/2 (min1/2)
4
0,2
-2
0,0
110
100
90
80
110
100
90
80
t (min)
Modèle Cinétique d'Elovich
y = 3,76514x + 88,40259 R2 =
0,272
20 40 60
t (min)
Modèle cinétique de Diffusion
Intraparticulaire
y = 1,25093x + 93,44152 R2
=0,125
Y1
.
2 4 6 8
(m
tq t (m Figure 24:modèle cinétique de
l'adsorption du métronidazole par l'argile pontée
62
Tableau 9:constante de vitesse et coefficient de
corrélation des modèles cinétiques
|
Modèles
|
Pseudo-premier ordre
|
Pseudo-second ordre Elovich Diffusion
intra-particulaire
|

Param ètres
k1
(min-1)
Qe
(mg/g
)
k2
R2 (g/min
.g)
Qe
(mg/g)
R2 á â R2
C
m2.S-
1
Kint
(mg.L.min1/2
)
R2
|
|
|
0,25
|
|
|
0,99
|
|
|
|
|
|
|
|
ABM
|
0,3
|
84,22
|
|
0,05
|
84,2
|
|
1,35.1033
|
29,34
|
0,729
|
53,5
|
4,17
|
0,547
|
|
|
|
6
|
|
|
6
|
|
|
|
|
|
|
|
|
|
0,01
|
|
|
0,99
|
|
|
0,29
|
|
|
|
|
ASM
|
0,51
|
88,74
|
|
0,01
|
86,74
|
|
6,64.103
|
4,637
|
|
75,9
|
0,96
|
0,128
|
|
|
|
8
|
|
|
8
|
|
|
3
|
|
|
|
|
|
|
0,02
|
|
|
0,99
|
|
|
0,27
|
|
|
|
|
APM
|
1,54
|
105,7
|
|
0,01
|
105,75
|
|
1,09.104
|
4,660
|
|
93,4
|
1,25
|
0,125
|
|
|
|
4
|
|
|
9
|
|
|
2
|
|
|
|
A la suite des résultats de la modélisation,
nous constatons que le processus d'adsorption du métronidazole sur les
différents matériaux adsorbants est bien représenté
par le pseudo-second ordre car les valeurs de coefficients de
corrélations sont proches de 1 (R2=0,996 ;
R2=0,997 ; R2=0,999). En effet, les valeurs de la
capacité d'adsorption à l'équilibre calculée par le
modèle pseudo-second ordre (qe= 84,22 mg/g ; qe=88,74mg/g qe=105,7mg/g)
sont très proches de celles déterminées
expérimentalement (qe=84,2mg/g ; qe=86,74mg/g ; qe=105,75mg/g). Ces
résultats corroborent plusieurs résultats , plusieurs
études ; Rosa et al.,2021 ; Ilaria et al.,2013 ; ainsi
que Julia et al., 2019, qui ont obtenu que le modèle
cinétique d'adsorption de métronidazole par argile est celui du
second ordre. Ce modèle explique
l'hétérogénéité des sites de fixation.
Le mécanisme d'adsorption se fait selon
l'hypothèse du modèle cinétique de pseudo-ordre en deux
étapes :
- La première est la diffusion du métronidazole
vers la surface de l'adsorbant
- La seconde est l'interaction entre molécules
d'adsorbats (métronidazole) et la surface des adsorbants (argiles).
III.6. Etude des isothermes d'adsorption
L'étude des isothermes est réalisée afin
de clarifier le phénomène d'adsorption. Les isothermes
d'adsorption sont très indispensables pour la compréhension du
mécanisme d'adsorption (Khelifi, 2018). De manière
générale, elles fournissent des informations sur
l'amélioration des adsorbants, une description de l'affinité et
de l'énergie de liaison entre
63
l'adsorbat et l'adsorbant (existence des interactions
latérales entre molécules ou non) et de la capacité
d'adsorption (Quilong et al., 2007).
Les isothermes montrent que les quantités du
métronidazole adsorbées augmentent avec les quantités du
métronidazole en solution, puis à se stabiliser. Aussi, une
grande affinité, particulièrement entre l'adsorbant et l'adsorbat
a été observée. Selon la classification de Gil et
al., les isothermes sont de type L, ce type est
caractérisé par une forte attraction entre l'adsorbat et
l'adsorbant à travers des interactions d'échange ionique.
(Gomri,2017)
Afin de mieux élucider le phénomène
d'adsorption à l'équilibre, quatre modèles d'isothermes
sont choisis : les modèles de Langmuir, Freundlich, Dubinig-Radushkevich
et Temkin.
Les figures(25,26,27) ci-après illustrent les courbes
des isothermes pour nos différents matériaux d'argile.
Isothermes Linéaires Metro/ABM
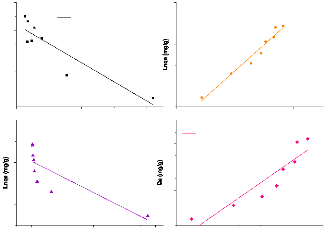
100
80
60
40
20
4
3
Isotherme de Langmuir
y = -0,0137x + 0,0184 R2 =
0,821
0,0 0,2 0,4
Isotherme de Freundlich
y = 0,62985x + 2,10336 R2=
0,965
0 2 4
1/Ce (1/ppm)
Isotherme de DRK
y = -1,86848.10-6x + 4,02515 R2
= 0,665
LnCe (ppm)
Isotherme de Temkin
y = 25,08962x -16,50157 R2= 0,842
0 200000 400000 600000 800000
å2
1 2 3 4
LnCe (ppm)
5
0,020
0,018
0,016
0,014
5
4
3
Lnq
Figure 25:Isothermes linéaires
d'adsorption du métronidazole par l'argile brute
64
Isothermes Linéaires Metro/ASM
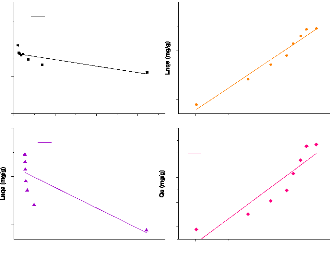
LnCe (ppm)
100
1/Ce (1/ppm)
0,0 0,3 0,6 0,9
Isotherme de Freundlich
y = 0,46703x + 2,77026 R2=
0,967
0 2 4
5
Isotherme de DRK
y = - 4,43427.10-7x + 4,08553 R2
= 0,813
80
Isotherme de Temkin
y = 20,278*x + 6,55599 R2=
0,855
60
40
20
4
3
0 1000000 2000000 3000000
å2
0 2 4
LnCe (ppm)
0,03
0,02
0,01
0,00
5
4
3
Isotherme de Langmuir
y = - 0,00583x + 0,01634 R2 =
0,699
Figure 26:Isothermes linéaires
d'adsorption du métronidazole par l'argile sodique.
Isothermes Linéaires Metro/APM
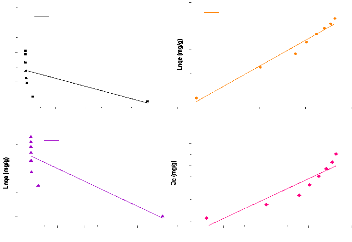
0 4 8 12 16 20
-2 0 2 4
5
Isotherme de Langmuir
y = - 2,04534.10-4x + 0,0132 R2
= 0,381
Isotherme de Freundlich
y = 0,26923x + 3,6634 R2=
0,976
4
3
0,018
0,015
0,012
LnCe (ppm)
120 Isotherme de Temkin
y = 13,30332x + 45,87606 R2=
0,858
90
60
30
0 10000000 20000000 30000000 40000000
50000000
150
å2
-2 0 2 4
LnCe (ppm)
5
1/Ce (1/ppm)
)g
Isotherme de DRK
y = -2,63687.10-8x + 4,26187 R2
= 0,674
4
3
(m
/)gg
Figure 27:Isothermes linéaires
d'adsorption du métronidazole par l'argile ponté
.
65
Tableau 10:Récapitulatif des constantes
et des coefficients de corrélation des isothérmes
|
Modèles
|
Langmuir
|
|
|
Freundlich
|
|
|
Temkin
|
|
|
|
D--R
|
|
|
|
Paramètres
|
RL
|
KL
|
Qm (mg/g)
|
R2
|
Kf
|
N
|
R2
|
Qm
(mg/g)
|
KT
|
B
|
R2
|
E
(KJ/mol)
|
Â
10-6
|
Qm (mg/g)
|
R2
|
|
ABM
|
0,034
|
0,744
|
72,99
|
0,82
|
8,2
|
1 ,6
|
0,965
|
84,22
|
25,089
|
4,77
|
0,842
|
323,64
|
4,7
|
51,10
|
0,665
|
|
ASM
|
0,368
|
0,368
|
166,66
|
0,69
|
16,1
|
2,1
|
0,967
|
86,74
|
20,28
|
1,3.10-6
|
0,855
|
640,18
|
1,3
|
56,05
|
0,813
|
|
APM
|
0,0005
|
64,7
|
4901,9
|
0,38
|
43,5
|
3,7
|
0,976
|
105,75
|
13,30
|
14,48
|
0,858
|
253,41
|
1,19
|
66,86
|
0,674
|
66
Les résultats montrent que les valeurs de coefficient
de corrélation R2 pour les modèles de Freundlich et
Temkin donnent une meilleure corrélation pour les différents
supports.
Au demeurant, l'isotherme de Freundlich décrit
convenablement et mieux le phénomène d'adsorption du
métronidazole par nos adsorbants. Des résultats allant dans le
même sillage ont été obtenus par Rosa et al.,2021
lors de l'adsorption de l'ibuprofène par argile. Ainsi que Calabres et
al., 2013 lors de l'adsorption du métronidazole par la
montmorillonite. Les quantités maximales calculées sont
très proches des valeurs expérimentales. La constante n obtenue
par le modèle de Freundlich renseigne sur la nature de l'adsorption.
Nous constatons que les valeurs de n sont supérieures à 1 ; cela
signifie que l'adsorption est favorable et la capacité d'adsorption
augmente et de nouveaux sites d'adsorption apparaissent., l'adsorption se fait
avec une grande intensité et est caractérisée par une
hétérogénéité entre la surface de nos
argiles du métronidazole.
Les paramètres adimensionnels ???? obtenus
pour chacun de nos matériaux sont compris entre 0 et 1, cela signifie
que l'isotherme de Langmuir est favorable.
Les valeurs d'énergie d'adsorptions des
résultats expérimentaux sont égales à 323,64 ;
640,18 et 253,41 respectivement pour l'argile brute, l'argile sodique et
l'argile pontée. Ces valeurs sont supérieures à 80Kj/mol,
ce qui signifie que l'adsorption est de type chimique. (Talami,2017). Au vu des
résultats obtenus, il semble que les trois adsorbants (ABM, ASM et APM)
n'adsorbent pas avec la même capacité. Ainsi, l'APM s'avère
la plus efficace et ceci serait dû à un plus grand
écartement des feuillets de l'argile pontée. Le paramètre
K de Freundlich de l'APM présente des maxima d'adsorption nettement
supérieures à ceux de l'ABM et l'ASM.
67
CONCLUSION ET PERSPECTIVE
Cette étude a été consacrée au
traitement d'un polluant émergent de type pharmaceutique par adsorption
à base d'argile locale de Mindif.
Bien que la quantité de ces produits rejetés
dans l'environnement soit faible, leur accumulation constitue un risque
potentiel pour l'Homme, la faune et la flore à long terme.
L'optimisation de certains paramètres tels que le
temps, la masse, le pH ont été mise en évidence
grâce à un plan d'expérience généré
par le logiciel statgraphic afin d'obtenir les meilleures interactions et
paramètres les plus influençant dans le processus, mais aussi et
surtout réaliser peu d'expérience.
Suite aux résultats obtenus tout au long de ce travail,
il ressort que :
-l'adsorption du métronidazole est très rapide
et l'équilibre est atteint au bout de 20min, 15min et 10 min
respectivement pour l'argile brute, l'argile sodique et l'argile
pontée.
- les rendements d'élimination du métronidazole
sur nos adsorbants étaient 52,638 % ; 54,214% ; 66,096%, ce
résultat justifie le fait que les modifications textures et structurales
apportées ont permis de booster la capacité d'adsorption d'argile
vis-à-vis du métronidazole.
- parmi les quatre modèles cinétiques
étudiés, c'est le modèle de pseudo-second ordre qui
décrit le mieux et convient à la rétention du
métronidazole par nos argiles. L'adsorption se fait donc en deux
étapes(phases) : la diffusion de l'adsorbat vers l'adsorbant, suivi de
l'interaction adsorbat-adsorbant.
- la fixation du métronidazole augmente avec la
diminution de la masse d'argile introduite et les meilleurs rendements sont
obtenus à un pH acide (pH = 3). L'efficacité
d'adsorption avec l'argile brute, l'argile sodique et l'argile pontée
est améliorée avec l'augmentation de la teneur initiale en
métronidazole.
- les isothermes d'adsorption du métronidazole par nos
adsorbants étudiés sont convenablement décrits par le
modèle de Freundlich, ce qui traduit
l'hétérogénéité de la surface d'argile. La
valeur de n est supérieure à 1, justifiant que l'adsorption est
favorable et la capacité d'adsorption augmente et il y a apparition de
nouveaux sites.
En conclusion, l'optimisation des systèmes
d'épuration basée sur les procédés d'adsorption par
les minéraux argileux naturels modifiés est une solution tout
à fait prometteuse. L'argile de Mindif est un bon adsorbant, elle
possède une bonne capacité d'adsorption et un adsorbant potentiel
et rentable pour l'élimination du métronidazole en solution
aqueuse.
Toutefois, l'objectif étant de trouver des alternatives
efficaces aux traitements de résidus médicamenteux, nous
envisageons de :
68
-Caractériser nos argiles avant et après
modification et après adsorption ;
-Faire la combinaison de nos matériaux argileux avec des
polymères afin de booster la capacité d'adsorption des produits
pharmaceutiques ;
-Faire une étude sur les effluents réels en fixant
les paramètres optimums ;
-Vérifier et optimiser les résultats du
procédé d'adsorption par le plan factoriel fractionnaire en plus
du plan factoriel complet.
69
REFERENCES BIBLIOGRAPHIQUES
Aarab N., Mohamed L., Bazzaoui M., Abdallah A.,
(2015), Elimination d'un médicament, le métronidazole,
par adsorption sur la polyaniline (Elimination of a medicament, the
metronidazol, by adsorption on the polyaniline), J. Mater. Environ. Sci, 6 (5),
1234-1242.
Aloui A. (2018), Biosorption de produits
pharmaceutiques par des fibres de Luffa Cylindrica en milieu aqueux :
application de la forme linéaire de l'isotherme de Redlich-Peterson et
optimisation par le plan factoriel complet, Thèse de doctorat.p158
Alvarez-Torrellas S., J.A. Peres, V. Gil- Alvarez, G.
Ovejero, J. García (2017), Effective adsorption of
non-biodegradable pharmaceuticals from hospital wastewater with different
carbon materials., Chem. Eng. J. 320, 319-329.
Amin N., Andji Y., Ake M., Yolou S.,
Touré-Abba, Kra G. (2009), mineralogy and physicochemistry of
the clays used in the Burulli ulcer treatment in côte d'Ivoire, J. Sci.
pharm. Biol, Vol 10, p21-30.
Arris S. (2008), Etude expérimentale
de l'élimination des polluants organiques et inorganiques par adsorption
sous-produits de céréale , Thèse de doctorat,
l'université de Constantine Algérie.
Asghar M.A., Zhu Q., Sun S., Peng Y., Shuai Q.
(2018), Suspect screening and target quantification of human
pharmaceutical residues in the surface water of Wuhan, China, using
UHPLC-Q-Orbitrap HRMS., Sci. Total Environ. 635 , 828-837.
Azarpira (2016), Rice husk as a biosorbent
for antibiotic Metronidazole removal: Isotherm studies and model validation,
International Journal of ChemTech Research , 9 566-573.
Azizian S. (2004), Kinetic
models of sorption : a theoritical analysis, J. Colloid Interface
Sci,276, 47-52.
Bacha, L. & Aichiou, L. (2017), Etude
cinétique et thermodynamique de procédé d'adsorption du
NET sur l'argile et modélisation pour une surface de réponse.
Mémoire de Master, Université Abderrahamane, Bejaia-
Algérie, 128 pp.
Baize Denis. (2018), Guide des analyses en
pédologie : troisième édition revue et augmentée,
Edition Quae.
Benghou Hanifa (2020), adsorption en milieux
aqueux par le kaolin DD , master 2 en sciences analytiques et l'environnement,
université Larrbi Ben M'hid , pp 18-19
70
Benzaoui K. (2018), Elaboration et
caractérisation de matériaux poreux à base d'argile
modifiée, application à la rétention de polluants,
Thèse de doctorat Ph.D , Université Mustapha Stambuili Mascara
.p205
Besse J-P. (2010), Impact
environnemental des médicaments à usage humain sur le milieu
récepteur : évaluation de l'exposition et des effets biologiques
pour les écosystèmes d'eau douce. These de doctorat.
Université de Metz - UFR SCI.F.A.
Besse J-P., Jeanne. (2007), Médicaments
à usage humain : risque d'exposition et effets sur les milieux
récepteurs. Agence de l'Eau R.M.C., Lyon, 241 p.
Blieffert, C., Perraud, R. (2001),Chimie de
l'environnement, air, eau, sols, déchets. Paris: Editions DeBoek
Université, Paris 2001, p. 102-477
Bogaert M .,Chevalier P . (2009), Equivalence
clinique des génériques. minerval ; vol : 8. Boucheta
Abbès (2017), Adsorption de composés organiques par la
houille de bentonite . Thèse de Doctorat Ph.D en Chimie physique
appliquée, Université Djillali Liabes.p112.
Bouziane N. (2007), Elimination du 2-mercaptobenzothiazole par
voix photochimique et par adsorption sur la bentonite et le charbon actif en
poudre, Magister, Chimie, Université Mentouri de Constantine,205p.
Bouzid Samia. (2015), Adsorption de polluants
organiques sur une argile échangée aux phosphoniums. Thèse
de Doctorat, Université d'Oran Mohamed Boudiaf.p224
Brunauer S., L.S. Deming, W.E. Deming, E.J. Teller
(1940), On a theory of the van der Waals adsorption of gases, Journal
of the American Chemical Society, 62, 1723-1732. Budzinski H., Anne T
(2006). Présence des résidus de médicaments dans
les différents compartiments du milieu aquatique. Environnement, Risques
et Santé. Vol. 5, n° 4.
Caillère S, S Heinin, M Rautureau (2006),
Mineralogie des argiles Tomes 1 &2 ,Paris, 1982.
Çalýþkan E,M Faher,J Poe. (2010),
Adsorption Characteristics of Sulfamethoxazole and Metronidazole on
Activated Carbon , Journal Separation Science and Technology , 45 244-255.
Changotra R., H. Rajput, J.P. Guin, L. Varshney, D. Amit
(2019). Hybrid coagulation, gamma irradiation and biological treatment
of pharmaceutical wastewater, Chem. Eng.J. 370, 595-605.
Chossat Jean Claude. (2005),,
La mesure de la conductivité hydraulique dans les sols - choix
des méthodes, Lavoisier, TEC et DOC, 720p.
Colette-Bregand., James A., Munchy C., Boquenne G.
(2009), Contamination des milieux aquatiques par les substances
pharmaceutiques et cosmétiques. Etat des lieux et perspectives.
Dépatement Biogéochimie et Ecotoxicologie. Direction Centre
Nante.
71
Crini G, P.M. Badot (2007), Traitement et
épuration des eaux industrielles polluées: procédés
membranaires, bioadsorption et oxydation chimique, Presses universitaires de
FrancheComté. Dabrowski, A.; Podkoscielny, P.; Hubicki, Z. &
Barczak, M. (2005), Adsorption of phenolic
compound by activated carbon-a critical review. Chemosphere,
58, 1049-1070. Dalrumple O. K., D.H. Yeh, M. A.
Trotz, (2007), Removing pharmaceutical and
endocrine-distruption compounds from wasterwater by photocatatysis., J. Chem
Technol Biotechnol., 211, 235-253.
Daughton C G. (2001), Pharmaceuticals and
personnal care products in the environment overaching issues and overview, in
pharmaceuticals and car products in the environment. American Chemical Society,
791, 2-38.
Daughton C.G., T.A. Ternes (1999),
Pharmaceuticals and personal care products in the environment: agents
of subtle change, Environ. Heal. Perspect. Bullet. 111, 757- 774.
De Oliveira T., & R. Guenga (2016) ,
coupled/organoclay/micelle Action for the adsorption of diclofenac.
Environmental science & technology , 50 (18), 10209-10215.
De Oliveira T., R. Guengan ; T. Thiebault , T. Milbeau ,
C.L ; F. Teixeira ; M. Giovanel ; Boussafira M. (2017), Adsorption of
diclofenac onto organoclays : effects of surfactant and environmental (pH and
temperature) condition J. Hazard Mat 323, 558-566.
Deblonde, T., Cossu-Leguille, C., Hartemann, P.
(2011), Emerging pollutants in wastewater: A review of the
literature. Int. J. Hyg. Environ. Health, The second European PhD students
workshop: Water and health ? 442-448. doi:10.1016/j.ijheh.2011.08.002
DERAFA Garmia (2014),synthése et caractérisation
de montmorillonite modifiée :Application à l'adsorption des
colorants cationiques ,mémoire de magister
Devesa-rey, R, Delval. J., Feijou,J., Gonzalez ,Cima J.P
, Casteriera.G ; Gonzalez. G (2021), preparation of synthetic clays to
remove phosphate and ibuprofen in water. Water, 13, 2394.
Dil E.A, M. Ghaedi, A. Asfaram, A.A. Bazrafshan (2018),
Ultrasound wave assisted
adsorption of congo red using gold-magnetic nanocomposite loaded
on activated carbon:
Optimization of process parameters, Ultrasonics -
Sonochemistry 46, 99-105.
Dobé N. (2018)., adsorption de la
carmoisine et du cristal violet en solution aqueuse par l'argile de Boboyo,
mémoire de Master, Université de Maroua.p95
Farra-kassinos,D.,Merie,S., Nikoloua,A. (2011),
Pharmaceutical residues in environmental waters and wasterwater
:current state of knowledge and future research. Anal.bienal. chem., 399,
p251-275.
72
Fatta-Kassinos, D., Meric, S., Nikolaou, A. (2011), X
Pharmaceutical residues in environmental waters and wastewater:
current state of knowledge and future research. Anal. Bioanal. Chem. 399,
251-275. doi:10.1007/s00216-010-4300-9
Fick, J., Söderström, H., Lindberg, R.H.,
Phan, C., Tysklind, M., Larsson, D.G.J. (2003), Contamination of
surface, ground and drinking water from pharmaceutical production. Environ.
Toxicol. Chem. 28, 2522. doi:10.1897/09-073.1
Figard, S. (2009),, The basics of
experimental design for multivariate analysis. SAS Global Forum 2009 Paper 284,
pp15.
Fumba, G.; Essomba, J. S.; Tagne, G. M.; Ndi, N. J.;
Bélibi, B. P. D. &Ketcha, M. J. (2014), Equilibrium and
kinetic adsorption studies of methyl orange from aqueous solutions using
kaolinite, metakaolinite and activated geopolymer as low cost adsorbents,
Journal of Academia and Industrial Research, 3(4),
p2278-5213., 2009.
Gauthier, H., Yargeau, V., Gooper, D. G.
(2010), Biodegradation of pharmaceuticals by Rhococcus rhodochrous and
Aspergillus niger by co-metabolism. Science of the Total Environment, 408,.
1701-1706.
Ghemit R. (2018), Préparation et
caracterisation des matériaux à structure lamellairres
modifiée : Etudes d'adsorption et de libération des
médicaments anti-inflammatoires , Thèse de doctorat,
Université Feraht Abbas Setif 1.p216
Ghiaba Leila . (2020), Elimination du nickel
(II) à base de noix des dattes , Master en génie des
procédés, Université Mohamed Khider , pp 19
Giles C.H. , T.H.Mac Evan, S.N Nakhwa, D.J.Smith (1960),
Studies in adsorption. PartXI A System of classification of solution
adsorption isotherms, and its use in diagnosis of adsorption mechanisms and
measurements of specific areas of solids, J Chem Soc, 3973-3993. Gillot
et Jack. (1984)., Clay engineering geology. John Wiley et Sons,
Inc.
Goupy J. (2006), Les plans d'expériences.
Revue MODULAD, 34, 74- 116.
Goupy, J. & Creighton L. (2006),
introduction aux Plans d'Expériences. 3ème
édition, Dunond, 336 pp.
Haaland P.D. (1989), Experimental Design in
Biotechnology Vol. 105, CRC press.
Habibi M, Bakhir S. (2018), Adsorption of
metronidazole and spiramycin by an Algerian palygorskite. Effect of
modification with tin, Microporous and Mesoporous Materials, 268, 293-302.
Haguenoer Jean-Marie. (2010), Les
résidus de médicaments présentent ils un risque pour la
santé publique. Santé publique. 22 (3) : 325-342.
73
Halling-Sorensen B. (2000), Environmental
risk assessment of antibiotics: comparison of mecillinam, trimethoprim and
ciprofloxacin, J. Antimicrob. Chemother. 46 , 53-58.
Hanen Guedidi. (2015),
Préparation et modification de carbones activés pour l'adsorption
de polluants organiques émergents : molécules pharmaceutiques et
liquides ioniques, thèse de l'Université de Grenoble Alpes en
Chimie organique.
Heberer T (2002), Occurrence fate, and emoval
of pharmaceutical residus in the aquatic environment : a review of recent
research data toxicology letters, 131,5-17.
HO , Y.S , Mckay ,G. (1999) , Pseudo-second
order modal for sorption processus, Process Biochem . 34, 451-465.
Huchon R. (2006), « Activité
photocatalytique de catalyseurs déposes sur différents supports
(medias) application a la conception d'un photoréacteurs pilote »,
Thèse de doctorat, Université Claude Bernard - Lyon.
Hummel D., D. Loffler, G. Fink.
(2006), Simultanieous determination of psychoactive drugs and
their metabolites in aqeous matrices by liquid chromatography mass
spectrometry, environmental science and technology, 40, 7321-7328.
Hyun P., Cho H., Hahn S., Kim J. (2001),
Sorption mechanism of UV (VI) on a reference montmorillonite: binding
to the internal and external surfaces, Journal of Radioanalytical and Nuclear
Chemistry Vol 250, N°1, pp55-62.
Ijagbemi C., Baek M. et Kim D. (2009),
Montmorillonite surface properties and sorption characteristics for heavy metal
removal from aqueous solutions, Journal of hazardous Materials, Vol 166,
p538-546.
Illaria C., G. Cavallaro, C. Scialabba, L. Mariano ,
M. Marcello, S. Luciana ,L. Maria. (2013), Montmorillonite nanodevices
for the colon metronidazole delivery international journal of pharmaceutics
457, 224-236.
Julia M., M. Orta , S Carasco, J.L Santos, A. Irene,
E. Alonso (2019), evauation of a maodified mica and montmorillonite
for the adsorption of ibuprofen from aqeous media ; Applied clay science 171,
29-37.
Kalcheva-Karadzhova, K. D.; Mihalev, K. M.; Ludneva,
D. P.; Shikov, V. T.; Dinkova, R. Pen, N. H Peter, Dane. (2016),
Optimizing enzymatic extraction from rose petals (Rosa Damascena
Mill.). Bulgarian Chemical Communications, 48, 459- 463.
Kamrami M., A. Yunnessnia le hi (2018),
Chitosan-modified acrylic nanofiltation membrane for efficient removal of
pharmaceutical compounds, J. Environ. Chem. Eng 6, 583-587.
74
Kamrani M., A. Akbari, A. Yunessnia lehi (2018),
Chitosan-modified acrylic nanofiltration membrane for efficient
removal of pharmaceutical compounds., J. Environ. Chem. Eng. 6 583-587.
Kanakaraju D., B. D, Glass, M. Oelgemoller
(2018), Advanced oxidation process mediated removal
of pharmaceuticals from: a review. Manag., 219, 189-207.
Keil F. (2008),Stratégies à la
Gestion des Résidus de Médicaments dans l'Eau Potable. Institut
de Recherche Sociale-Ecologique. (ISOE) GmbH, Projet de recherche start .
Khelifi O. (2018), Etude de l'adsorption du
nickel et du cuivre sur un charbon actif préparé à partir
des boues de station d'épuration ,Thèse de doctorat,
Université 8 mai 1945 Guelma. Khir Imane et Zebar Rachda
(2021), Elimination des micropolluants organiques par l'adsorption sur
les argiles. Master ,Chimie, Université Mohamed Boudhiaf- M'Sila,.
Kristiansson, E., Fick, J., Janzon, A., Grabic, R.,
Rutgersson, C., Weijdegård, B., Söderström, H., Larsson, D.G.J.
(2011), Pyrosequencing of Antibiotic-Contaminated River Sediments
Reveals High Levels of Resistance and Gene Transfer Elements. PLoS ONE 6,
e17038. doi:10.1371/journal.pone.0017038.
Kristiansson, E., Fick, J., Janzon, A., Grabic, R.,
Rutgersson, C., Weijdegård, B., Söderström, H., Larsson, D.G.J.
(2011), Pyrosequencing of Antibiotic-Contaminated
River Sediments Reveals High Levels of Resistance and Gene Transfer Elements.
PLoS ONE 6, e17038. doi:10.1371/journal.pone.0017038
Kümmerer K (2004), Pharmaceuticals in
the Environment Sources, Fate, Effects and Risks. Springer, XXXI,
p527
Kummerer K. (2001), Drugs in the environment
: emission of drugs, diagnostic acids and desinfectants into wasterwater by
hospitals in relation to other sources-a review, chemosphere. 45, 957-969.
Langford K.V. Thomas, K. (2007),
Occurrence of pharmaceuticals in the aqueous environment, , in
Analysis, Fate and Removal of Pharmaceuticals in the Water Cycle, M.
Petroviæ, D. Barceló eds. 50 337-359.
Langmuir I (1983), The constitution and
fundamental properties of solids and liquids J.Am. Chem soc , 40, 1361-1403.
Laouameur Khaoula. (2021), Validation d'une
méthode de dosage ( les benzodiazépines) lors essais de
contrôle de qualité et de décontamination par adsorption
sur l'alumine, la maghnite et le phosphore d'aluminium et le charbon actif,
Thèse de Doctorat, génie de procédés
pharmaceutiques, Université Ferhat Abbas-Setif1.
75
Larsson,D.G.J. (2014), Pollution from drug
manufacturing : review and perspectives. Philos. Trans.R.Soc, Lond.B. Biol,
Sci369.
Liv Y., X. Lin, G. Zhang, T.Ma, T. Du, Y. Yang, S. Lu, W.
Wang. (2019), Adsorptive removal of sulfamethazine and
sulfamethoxazole from aqueous solution by hexadecyl trimethyl ammonium bromide
modified actived carbon, colloids surf. A. 564, 131-141.
Low M.J.D (1960), kinetics of chimisorption of
Gases on solids, chemical peviews, 60, 267312 ,.
Lu X., Y. Shao, N. Gao, J. Chen, Y. Zhang, Q. Wang, Lu Y.
(2016), Adsorption removal of Clofibric acid and diclofenac from water
with MIEX resin, chemosphere., 161, 400-411. Madikizal L.M, L. Chimika
(2016), Synthesis , adsorption and selectivity studies of a polymer
imprinted with naproxen, ibuprofen and diclofenac. J.Environ .Chem Eng 4,
40294037
Metcalfe C.D, X.S. Miao, B.G. Koenig, J. Struger (2003),
Distribution of acidic and neutral drugs in surface waters near sewage
treatment plants in the lower Great Lakes, Canada., Environ. Toxicol. Chem. 78
, 90-98.
Metz V & J. Gaour (2005) , stoichiometry
ofsmectite dissolution reaction. Geochemical et cosmochimica aceta, 69, (7),
1755-1772.
Michael I, E. Hapeshi, V. Osorio, S. Perez, M. Petrovic,
A. Zapata. (2012), Solar photocatalytic treatment of trimethoprim in
four environmental matrices at a pilot scale: Transformation products and
ecotoxicity evaluation, Sci. Total Environ. 430, 167-173.
Mohamadou Sali , (2018), Adsorption des ions
cuivre (+II) en solution aqueuse par le charbon actif et le biosorbants issus
de coques du noyau de ziziphus mauritiana. Master de Chimie, Université
de Maroua.
Mohamed, A. & Yassine, B. (2013),
Modélisation des bétons ordinaires par des plans
d'expériences, Mémoire pour l'obtention du diplôme de
Master, Universite Abou Bekr Belkaid-Tlemcen,
Tlemcen-Algérie, 130 pp.
-Mompelat S., B. Le Bot. (2009),, Occurence and
fate to pharmaceutical products and by products, from ressource to drinking
water, Environment International 35, 803-314.
Moyo F, R Tandlich , B Whilelmû, Balaz. (2014),
sorption of hydrophobic organic compounds on naturals sorbenysand
organoclays from aqueous and non aqueous solutions, I Mini review, Int Environ
Res Public Heal, 5020-5048.
Namory Meite, Leon Koffi Konan, Bi Irei Herve, Goure
Doubi, Doudjo Soro, et Iuliana Mihaela. (2019), Physico-chemical
Behavior of glycerol coated cassava starch gels
76
incorporating kaolin and metakaolin, American Journal of
Materials Science and Engeering, vol 7 , N°1, , pp1-6.
Ngakou C. (2019), Optimisation de la
préparation des charbons actifs par la méthodologie de surfaces
de réponse ; application à l'adsorption de la phénactine
en solution aqueuse, Thèse de doctorat Ph.D , Université de
Dschang.
Nikolaou, A., Meric, S., Fatta, D. (2007),
Occurrence patterns of pharmaceuticals in water and wastewater
environments. Anal. Bioanal. Chem. 387, 1225-1234.
Oliveira T. De (2019), Adsorption de produits
pharmaceutiques par les organo-clays des matériaux polyvalents pour des
applicatios environnementales, Thèse d doctorat, Université
d'Orléans,.
Petrie, B., McAdam, E.J., Scrimshaw, M.D., Lester, J.N.,
Cartmell, E., (2013)., Fate of drugs during wastewater treatment. TrAC
Trends Anal. Chem. 49, 145-159.
Petrovic M, M. Farré. (2010), Recent
trends in the liquid chromatography-mass spectometry analysis of organic
contaminants in environment samples, Journal of chromatography A. 1217
4004-4017.
Roberto R., Araceli J., Torres-River O. et Guerrero R.
(2008),, Adsorption of chromium (VI) from water solution onto
organobentonite, J. Environ. Eng. Manage., p311-317.
Saada khadidja. (2020), traitement de
métronidazole par procédés électron-fenton,
Master,génie de l'environnement, Univerité A.M.
Oulhaddj-Bouira,.
Salaa Fahima. (2021), Intercalation d'une argile
de type 1 :1 par HDTMA et application à la coadsorption de produits
pharmaceutiques, Thèse de Doctorat, Université Abdelhamid IBN
Badis Mostaganem.p186
Sorower M. G. (2020), Determination on efficacy
of selected common water quality treatment chemicals and drugs used in
Bangladesh, Agr, Food and Environment (JAFE), 1, 1-8.
Sparks D.L (1989), Academic Press San Diego C.A
Kinetics of soilchemical process-250. Stadlmair L. F., T. Letzel, J.E.
Drewers, J. Grassmann (2018), Enzymes in removal of pharmaceuticals
from wasterwater : a critical review of challangess, applications and screening
methods for their selection, chemophere, 205, 649-661.
Tahar, A. ; Choubert, J. M. ; Molle, P. & Coquery,
M. (2010). Matériaux adsorbants pour la rétention et le
traitement de substances pharmaceutiques et
phytosanitaires-caractéristiques et éléments de choix.
Rapport bibliographique, Cemagref,,14 pp.
77
Talami B. (2017), Etude comparative de
l'adsorption du bleu de méthylène et de la tartazine en solution
aqueuse par l'argile brute et l'argile pontée de Boboyo, mémoire
de master en Chimie Inorganique, Université de Maroua, pp 77
Tatiana Diatta M (2016), Matière
première argileuse du Sénégal : caratctéristique et
application aux produits céramiques de grande diffusion, Thèse de
Doctorat Ph.D, Ecole Doctorale sciences et technologies.
Tejeogue J.P (2019), adsorption de lamarante et
du cristal violet en solution aqueuse par l'argile de Ngassa, mémoire de
Master en Chimie , Université de Maroua,pp78.
Thiebault ,R. Guegan ,M . Boussative (2015),
Adsorption mechanism of emerging micro-polluants with a clay mineral
case of tramadol and doxipin pharmaceutical products, J. Colloide Interface
Sci-453.
Thomas K.V., Langfort K. (2007), Occurence of
pharmaceuticals in the water cycle, M. Petrovic, D. Barcelo eds., 50,
337-359.
Thomas Thielbault (2016), l'adsorption des
produits pharmaceutiques par interactions organo-minérales : processus
et applications environnementales , thèse de doctoat Ph.D,
Univrrsité d'Orléans .
Thomson Anthony G (1998), characterization of
pillared layered structure, journal of porous materiels,vol, pp 259-274.
Tiwari B., Sellamuthe B., Ourda Y., Drogui P., Tyagi R.D,
Buelua G. (2017), Review on fate and mechanism of removal of
pharmaceutical polluants from wastewater using biological approach, bioresour.
Technol. 224, 1-12.
Udofia P. G., Udoudo P. J. & Eyen N. O.
Sensory evaluation of wheat-cassava-soybean composite flour (WCS)
bread by the mixture experiment design. African Journal of Food Science,
7(10), 368-374.
Verlicchi, P., Galletti, A., Petrovic, M.,
Barceló, D., (2010), Hospital effluents as a source of emerging
pollutants: An overview of micropollutants and sustainable treatment options.
Wang J., Bai Z. (2017),, Fe-based catalysts
for heterogeneous catalytic ozonation of emerging contaminants in water and
waterwater, Chem. J. 235, 606-612.
Weber ,W.J ,Morris ,J.C (1963),Kinetics of
adsorption on carbon from solution , J. Sanitary Eng. Div. American society of
civil engineers. 89, 31-60.
78
ANNEXE
Tableau A.1: Détermination du point de
charge nul
|
??????????????????
|
2
|
4
|
6
|
8
|
10
|
12
|
|
?????? ????????
|
2,28
|
6,66
|
6,97
|
7,75
|
8,02
|
11,68
|
Tableau A. 2:Etalonnage du
Métronidazole
|
C (ppm)
|
10
|
20
|
30
|
40
|
50
|
60
|
70
|
80
|
|
A
|
0,205
|
0,313
|
0,435
|
0,533
|
0,627
|
0,73
|
0,821
|
0,94
|
1,0

0,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
y = 0,01031x + 0,11136 R2 =
0,998
Etalonnage du Metro
0 10 20 30 40 50 60 70 80 90
Concentration (ppm)
79
Tableau A. 3: Plan d'expériences à
27 essais, résultats expérimentaux
|
Essai /Facteurs
|
temps
|
masse
|
pH
|
Qe(mg /g) ABM
|
Qe(mg /g) ASM
|
Qe(mg /g) APM
|
%R ABM
|
%R ASM
|
%R APM
|
|
1
|
3
|
0,09
|
3
|
7,18095
|
9,12081
|
9,48723
|
40,39282
|
51,30456
|
53,36566
|
|
2
|
31,5
|
0,17
|
11
|
1,16574
|
1,35973
|
1,39396
|
12,38603
|
14,44714
|
14,81086
|
|
3
|
3
|
0,17
|
7
|
2,71764
|
2,8888
|
2,98009
|
28,87488
|
30,6935
|
31,66343
|
|
4
|
60
|
0,17
|
3
|
4,94277
|
5,47909
|
5,01124
|
52,51697
|
58,21532
|
53,24442
|
|
5
|
31,5
|
0,01
|
3
|
80,9234
|
82,86324
|
99,93404
|
50,57711
|
51,78952
|
62,45878
|
|
6
|
31,5
|
0,09
|
11
|
1,29669
|
1,81399
|
1,72777
|
7,29389
|
10,20369
|
9,71872
|
|
7
|
31,5
|
0,09
|
7
|
1,49068
|
2,1373
|
2,35284
|
8,38506
|
12,02231
|
13,23472
|
|
8
|
3
|
0,09
|
7
|
4,59446
|
5,11176
|
5,02554
|
25,84384
|
28,75364
|
28,26867
|
|
9
|
3
|
0,17
|
11
|
0,8120
|
0,65225
|
1,47384
|
8,62755
|
6,93016
|
15,65955
|
|
10
|
60
|
0,01
|
11
|
0,6130
|
7,59651
|
9,1484
|
0,38312
|
2,80795
|
5,71775
|
|
11
|
3
|
0,17
|
3
|
4,61186
|
4,38364
|
5,2851
|
49,00097
|
46,57614
|
56,15422
|
80
12
|
60
|
0,09
|
7
|
0,75784
|
0,97338
|
2,91324
|
4,26285
|
5,47527
|
16,387
|
|
13
|
60
|
0,09
|
11
|
0,67162
|
0,88716
|
1,81399
|
3,77789
|
4,9903
|
10,20369
|
|
14
|
60
|
0,17
|
11
|
0,44685
|
0,65225
|
1,33691
|
4,74782
|
6,93016
|
14,20466
|
|
15
|
31,5
|
0,17
|
3
|
5,10253
|
5,23946
|
5,92412
|
54,21435
|
55,66925
|
62,94374
|
|
16
|
31,5
|
0,01
|
7
|
8,17847
|
15,93792
|
15,93792
|
5,11154
|
9,9612
|
9,9612
|
|
17
|
60
|
0,01
|
3
|
77,4316
|
78,40155
|
98,77013
|
48,39476
|
49,00097
|
61,73133
|
|
18
|
31,5
|
0,01
|
11
|
6,62658
|
7,98448
|
10,5063
|
4,14161
|
4,9903
|
6,56644
|
|
19
|
3
|
0,01
|
11
|
4,10475
|
7,59651
|
11,86421
|
2,56547
|
4,74782
|
7,41513
|
|
20
|
3
|
0,01
|
7
|
13,8041
|
19,23569
|
37,6644
|
8,62755
|
12,02231
|
23,54025
|
|
21
|
3
|
0,01
|
3
|
49,8856
|
67,7323
|
81,11736
|
31,17847
|
42,33269
|
50,69835
|
|
22
|
60
|
0,09
|
3
|
8,15088
|
8,36642
|
8,56041
|
45,84869
|
47,06111
|
48,15228
|
|
23
|
60
|
0,01
|
7
|
0,80698
|
6,62658
|
20,20563
|
0,50436
|
4,14161
|
12,62852
|
|
24
|
31,5
|
0,09
|
3
|
8,62507
|
8,84061
|
10,43561
|
48,516
|
49,72842
|
58,70029
|
81
|
|
|
|
|
|
|
|
|
|
|
25
|
60
|
0,17
|
7
|
0,5952
|
0,56096
|
1,62218
|
6,32396
|
5,96023
|
17,23569
|
|
26
|
3
|
0,09
|
11
|
0,86561
|
1,16737
|
2,09419
|
4,86906
|
6,56644
|
11,77983
|
|
27
|
31,5
|
0,17
|
7
|
1,16574
|
1,41679
|
1,54231
|
12,38603
|
15,05335
|
16,387
|
82
Tableau A. 4:Résultats
expérimentaux de l'adsorption du Métronidazole en utilisant un
plan factoriel complet avec l'argile brute
|
Temps
|
masse
|
pH
|
A
|
Ce
|
qe
|
R%
|
|
3
|
0,01
|
3
|
0,518
|
39,44132
|
81,11736
|
50,69835
|
|
3
|
0,09
|
3
|
0,496
|
37,30747
|
9,48723
|
53,36566
|
|
3
|
0,17
|
3
|
0,473
|
35,07662
|
5,2851
|
56,15422
|
|
31,5
|
0,01
|
3
|
0,421
|
30,03298
|
99,93404
|
62,45878
|
|
31,5
|
0,09
|
3
|
0,452
|
33,03977
|
10,43561
|
58,70029
|
|
31,5
|
0,17
|
3
|
0,417
|
29,645
|
5,92412
|
62,94374
|
|
60
|
0,01
|
3
|
0,427
|
30,61494
|
98,77013
|
61,73133
|
|
60
|
0,09
|
3
|
0,539
|
41,47818
|
8,56041
|
48,15228
|
|
60
|
0,17
|
3
|
0,497
|
37,40446
|
5,01124
|
53,24442
|
|
3
|
0,01
|
7
|
0,742
|
61,1678
|
37,6644
|
23,54025
|
|
3
|
0,09
|
7
|
0,703
|
57,38506
|
5,02554
|
28,26867
|
|
3
|
0,17
|
7
|
0,675
|
54,66925
|
2,98009
|
31,66343
|
|
31,5
|
0,01
|
7
|
0,854
|
72,03104
|
15,93792
|
9,9612
|
|
31,5
|
0,09
|
7
|
0,827
|
69,41222
|
2,35284
|
13,23472
|
|
31,5
|
0,17
|
7
|
0,801
|
66,8904
|
1,54231
|
16,387
|
|
60
|
0,01
|
7
|
0,832
|
69,89719
|
20,20563
|
12,62852
|
|
60
|
0,09
|
7
|
0,801
|
66,8904
|
2,91324
|
16,387
|
|
60
|
0,17
|
7
|
0,794
|
66,21145
|
1,62218
|
17,23569
|
|
3
|
0,01
|
11
|
0,875
|
74,0679
|
11,86421
|
7,41513
|
|
3
|
0,09
|
11
|
0,839
|
70,57614
|
2,09419
|
11,77983
|
|
3
|
0,17
|
11
|
0,807
|
67,47236
|
1,47384
|
15,65955
|
|
31,5
|
0,01
|
11
|
0,882
|
74,74685
|
10,5063
|
6,56644
|
|
31,5
|
0,09
|
11
|
0,856
|
72,22502
|
1,72777
|
9,71872
|
|
31,5
|
0,17
|
11
|
0,814
|
68,15131
|
1,39396
|
14,81086
|
|
60
|
0,01
|
11
|
0,889
|
75,4258
|
9,1484
|
5,71775
|
|
60
|
0,09
|
11
|
0,852
|
71,83705
|
1,81399
|
10,20369
|
|
60
|
0,17
|
11
|
0,819
|
68,63628
|
1,33691
|
14,20466
|
83
Tableau A. 5:Résultats
expérimentaux de l'adsorption du Métronidazole en utilisant un
plan factoriel complet avec l'argile sodique
|
Temps
|
Masse g
|
pH
|
A
|
Ce
|
Qe
|
R%
|
|
|
|
|
|
|
|
|
3
|
0,01
|
3
|
0,587
|
46,13385
|
67,7323
|
42,33269
|
|
3
|
0,09
|
3
|
0,513
|
38,95635
|
9,12081
|
51,30456
|
|
3
|
0,17
|
3
|
0,552
|
42,73909
|
4,38364
|
46,57614
|
|
31,5
|
0,01
|
3
|
0,509
|
38,56838
|
82,86324
|
51,78952
|
|
31,5
|
0,09
|
3
|
0,526
|
40,21726
|
8,84061
|
49,72842
|
|
31,5
|
0,17
|
3
|
0,477
|
35,4646
|
5,23946
|
55,66925
|
|
60
|
0,01
|
3
|
0,532
|
40,79922
|
78,40155
|
49,00097
|
|
60
|
0,09
|
3
|
0,548
|
42,35112
|
8,36642
|
47,06111
|
|
60
|
0,17
|
3
|
0,456
|
33,42774
|
5,47909
|
58,21532
|
|
3
|
0,01
|
7
|
0,837
|
70,38215
|
19,23569
|
12,02231
|
|
3
|
0,09
|
7
|
0,699
|
56,99709
|
5,11176
|
28,75364
|
|
3
|
0,17
|
7
|
0,683
|
55,4452
|
2,8888
|
30,6935
|
|
31,5
|
0,01
|
7
|
0,854
|
72,03104
|
15,93792
|
9,9612
|
|
31,5
|
0,09
|
7
|
0,837
|
70,38215
|
2,1373
|
12,02231
|
|
31,5
|
0,17
|
7
|
0,812
|
67,95732
|
1,41679
|
15,05335
|
|
60
|
0,01
|
7
|
0,902
|
76,68671
|
6,62658
|
4,14161
|
|
60
|
0,09
|
7
|
0,891
|
75,61979
|
0,97338
|
5,47527
|
|
60
|
0,17
|
7
|
0,887
|
75,23181
|
0,56096
|
5,96023
|
|
3
|
0,01
|
11
|
0,897
|
76,20175
|
7,59651
|
4,74782
|
|
3
|
0,09
|
11
|
0,882
|
74,74685
|
1,16737
|
6,56644
|
|
3
|
0,17
|
11
|
0,879
|
74,45587
|
0,65225
|
6,93016
|
|
31,5
|
0,01
|
11
|
0,895
|
76,00776
|
7,98448
|
4,9903
|
|
31,5
|
0,09
|
11
|
0,852
|
71,83705
|
1,81399
|
10,20369
|
|
31,5
|
0,17
|
11
|
0,817
|
68,44229
|
1,35973
|
14,44714
|
|
60
|
0,01
|
11
|
0,913
|
77,75364
|
4,49273
|
2,80795
|
|
60
|
0,09
|
11
|
0,895
|
76,00776
|
0,88716
|
4,9903
|
|
60
|
0,17
|
11
|
0,879
|
74,45587
|
0,65225
|
6,93016
|
84
Tableau A .6:Résultats
expérimentaux de l'adsorption du Métronidazole en utilisant un
plan factoriel complet avec l'argile pontée
|
Temps min
|
Masse g
|
pH
|
A
|
Ce
|
Qe
|
R%
|
|
3
|
0,01
|
3
|
0,518
|
39,44132
|
81,11736
|
50,69835
|
|
3
|
0,09
|
3
|
0,496
|
37,30747
|
9,48723
|
53,36566
|
|
3
|
0,17
|
3
|
0,473
|
35,07662
|
5,2851
|
56,15422
|
|
31,5
|
0,01
|
3
|
0,421
|
30,03298
|
99,93404
|
62,45878
|
|
31,5
|
0,09
|
3
|
0,452
|
33,03977
|
10,43561
|
58,70029
|
|
31,5
|
0,17
|
3
|
0,417
|
29,645
|
5,92412
|
62,94374
|
|
60
|
0,01
|
3
|
0,427
|
30,61494
|
98,77013
|
61,73133
|
|
60
|
0,09
|
3
|
0,539
|
41,47818
|
8,56041
|
48,15228
|
|
60
|
0,17
|
3
|
0,497
|
37,40446
|
5,01124
|
53,24442
|
|
3
|
0,01
|
7
|
0,742
|
61,1678
|
37,6644
|
23,54025
|
|
3
|
0,09
|
7
|
0,703
|
57,38506
|
5,02554
|
28,26867
|
|
3
|
0,17
|
7
|
0,675
|
54,66925
|
2,98009
|
31,66343
|
|
31,5
|
0,01
|
7
|
0,854
|
72,03104
|
15,93792
|
9,9612
|
|
31,5
|
0,09
|
7
|
0,827
|
69,41222
|
2,35284
|
13,23472
|
|
31,5
|
0,17
|
7
|
0,801
|
66,8904
|
1,54231
|
16,387
|
|
60
|
0,01
|
7
|
0,832
|
69,89719
|
20,20563
|
12,62852
|
|
60
|
0,09
|
7
|
0,801
|
66,8904
|
2,91324
|
16,387
|
|
60
|
0,17
|
7
|
0,794
|
66,21145
|
1,62218
|
17,23569
|
|
3
|
0,01
|
11
|
0,875
|
74,0679
|
11,86421
|
7,41513
|
|
3
|
0,09
|
11
|
0,839
|
70,57614
|
2,09419
|
11,77983
|
|
3
|
0,17
|
11
|
0,807
|
67,47236
|
1,47384
|
15,65955
|
|
31,5
|
0,01
|
11
|
0,882
|
74,74685
|
10,5063
|
6,56644
|
|
31,5
|
0,09
|
11
|
0,856
|
72,22502
|
1,72777
|
9,71872
|
|
31,5
|
0,17
|
11
|
0,814
|
68,15131
|
1,39396
|
14,81086
|
|
60
|
0,01
|
11
|
0,889
|
75,4258
|
9,1484
|
5,71775
|
|
60
|
0,09
|
11
|
0,852
|
71,83705
|
1,81399
|
10,20369
|
|
60
|
0,17
|
11
|
0,819
|
68,63628
|
1,33691
|
14,20466
|
85
Tableau A. 7:Evolution de l'adsorption du
métronidazole par l'argile brute en fonction du temps d'agitation
|
t (min)
|
A
|
Ce
|
Qe
|
%R
|
Qe-Qt
|
Ln(Qe-Qt)
|
t/Qt
|
ln(t)
|
t1!2
|
|
3
|
0,679
|
55,072
|
49,886
|
31,178
|
34,335
|
3,536
|
0,060
|
1,099
|
1,732
|
|
5
|
0,634
|
50,615
|
58,615
|
36,634
|
27,606
|
3,243
|
0,085
|
1,609
|
2,236
|
|
10
|
0,597
|
47,103
|
65,792
|
41,120
|
18,429
|
2,914
|
0,152
|
2,302
|
3,162
|
|
15
|
0,545
|
42,601
|
75,879
|
47,425
|
8,342
|
2,121
|
0,198
|
2,708
|
3,873
|
|
20
|
0,502
|
37,889
|
84,221
|
52,638
|
0
|
|
0,237
|
2,995
|
4,472
|
|
25
|
0,508
|
38,471
|
83,057
|
51,911
|
1,164
|
0,152
|
0,301
|
3,218
|
5
|
|
30
|
0,519
|
39,538
|
80,923
|
50,577
|
3,298
|
1,193
|
0,371
|
3,401
|
5,477
|
|
40
|
0,532
|
40,799
|
78,401
|
49,001
|
5,82
|
1,761
|
0,510
|
3,689
|
5,324
|
|
50
|
0,539
|
41,478
|
77,043
|
48,152
|
7,083
|
1,971
|
0,649
|
3,912
|
6,071
|
|
60
|
0,537
|
41,284
|
77,431
|
48,395
|
6,79
|
1,915
|
0,775
|
4,094
|
7,746
|
Tableau A. 8:Evolution de l'adsorption du
Métronidazole par l'argile Sodique en fonction du temps d'agitation
|
t (min)
|
A
|
Ce
|
Qe
|
%R
|
Qe-Qt
|
Ln(Qe-Qt)
|
t/Qt
|
ln(t)
|
t1!2
|
|
3
|
0,587
|
46,134
|
67,732
|
42,333
|
19,01
|
2,945
|
0,044
|
1,098
|
1,732
|
|
5
|
0,539
|
41,478
|
77,044
|
48,152
|
9,69
|
2,272
|
0,065
|
1,609
|
2,236
|
|
10
|
0,517
|
39,344
|
81,311
|
50,819
|
5,432
|
1,692
|
0,122
|
2,302
|
3,162
|
|
15
|
0,489
|
36,629
|
86,743
|
54,214
|
0
|
--
|
0,172
|
2,708
|
3,872
|
|
20
|
0,499
|
37,598
|
84,803
|
53,002
|
1,94
|
0,663
|
0,235
|
2,995
|
4,472
|
|
25
|
0,501
|
37,792
|
84,415
|
52,759
|
2,328
|
0,845
|
0,296
|
3,218
|
5
|
|
30
|
0,509
|
38,568
|
82,863
|
51,789
|
3,88
|
1,356
|
0,362
|
3,401
|
5,477
|
|
40
|
0,512
|
38,859
|
82,281
|
51,426
|
4,462
|
1,495
|
0,486
|
3,689
|
5,325
|
|
50
|
0,529
|
40,508
|
78,984
|
49,364
|
7,763
|
2,049
|
0,633
|
3,912
|
7,071
|
|
60
|
0,532
|
40,799
|
78,401
|
49,001
|
8,342
|
2,121
|
0,765
|
4,094
|
7,746
|
Tableau A. 9: Evolution de l'adsorption du
Métronidazole par l'argile Pontée en fonction du temps
d'agitation
|
t (min)
|
A
|
Ce
|
Qe
|
%R
|
Qe-Qt
|
Ln(Qe-Qt)
|
t/Qt
|
ln(t)
|
t1!2
|
|
3
|
0,518
|
39,44
|
81,12
|
50,69
|
24,634
|
3,204
|
0,036
|
1,098
|
1,732
|
|
5
|
0,439
|
31,78
|
96,44
|
60,28
|
9,314
|
2,231
|
0,051
|
1,609
|
2,236
|
|
10
|
0,391
|
27,12
|
105,7
|
66,09
|
0
|
---
|
0,094
|
2,302
|
3,162
|
|
15
|
0,393
|
27,32
|
105,4
|
65,85
|
0,354
|
-0,947
|
0,142
|
2,708
|
3,872
|
|
20
|
0,399
|
27,84
|
103,2
|
65,13
|
2,554
|
0,439
|
0,192
|
2,995
|
4,472
|
|
25
|
0,405
|
28,48
|
103,0
|
64,39
|
2,754
|
0,999
|
0,243
|
3,218
|
5
|
|
30
|
0,421
|
30,03
|
99,93
|
62,46
|
5,824
|
0,761
|
0,300
|
3,401
|
5,477
|
|
40
|
0,425
|
30,42
|
99,16
|
61,97
|
6,594
|
1,886
|
0,403
|
3,689
|
6,324
|
|
50
|
0,423
|
30,22
|
99,54
|
62,22
|
6,214
|
1,826
|
0,502
|
3,912
|
7,071
|
|
60
|
0,427
|
30,62
|
98,77
|
61,73
|
6,984
|
1,943
|
0,607
|
4,094
|
7,746
|
86
Tableau A. 10:Influence de la concentration sur
de l'adsorption du Métronidazole par l'argile brute
|
C
(ppm)
|
A
|
Ce
|
Qe
|
%R
|
1/Ce
|
1/Qe
|
Ln(Ce)
|
Ln(Qe)
|
E2
|
|
10
|
0,136
|
2,389
|
15,220
|
78,109
|
0,418
|
0,013
|
0,871
|
2,723
|
7,5E5
|
|
20
|
0,178
|
6,463
|
27,073
|
67,681
|
0,015
|
0,014
|
1,866
|
3,298
|
1,2E5
|
|
30
|
0,243
|
12,768
|
34,464
|
57,439
|
0,078
|
0,017
|
2,547
|
3,539
|
3,4E4
|
|
40
|
0,297
|
18,006
|
43,988
|
54,985
|
0,055
|
0,018
|
2,891
|
3,783
|
1,7E4
|
|
50
|
0,328
|
21,013
|
57,974
|
57,974
|
0,047
|
0,017
|
3,045
|
4,060
|
1,3E4
|
|
60
|
0,398
|
27,802
|
53,663
|
53,663
|
0,036
|
0,018
|
3,325
|
4,165
|
7,6E3
|
|
70
|
0,413
|
29,257
|
58,204
|
58,204
|
0,034
|
0,017
|
3,376
|
4,400
|
6,9E3
|
|
80
|
0,502
|
37,889
|
52,638
|
52,638
|
0,0264
|
0,026
|
3,365
|
4,433
|
4,1E3
|
Tableau A. 11:Influence de la concentration sur
de l'adsorption du Métronidazole par l'argile sodique
|
C
(ppm)
|
A
|
Ce
|
Qe
|
%R
|
1/Ce
|
1/Qe
|
Ln(Ce)
|
Ln(Qe)
|
E2
|
|
10
|
0,122
|
1,032
|
17,935
|
89,679
|
0,968
|
0,011
|
0,031
|
2,887
|
2,8E5
|
|
20
|
0,161
|
4,814
|
30,370
|
75,926
|
0,207
|
0,013
|
1,571
|
3,413
|
2,2E5
|
|
30
|
0,209
|
9,470
|
41,059
|
68,432
|
0,105
|
0,014
|
2,248
|
3,715
|
6,2E4
|
|
40
|
0,268
|
15,193
|
49,613
|
62,017
|
0,066
|
0,016
|
2,721
|
3,904
|
2,5E4
|
|
50
|
0,301
|
18,393
|
63,212
|
63,212
|
0,054
|
0,015
|
2,912
|
4,146
|
1,7E4
|
|
60
|
0,348
|
22,952
|
74,095
|
61,745
|
0,004
|
0,016
|
3,133
|
4,305
|
7,6E4
|
|
70
|
0,393
|
27,317
|
85,365
|
60,975
|
0,037
|
0,016
|
3,307
|
4,446
|
1,1E4
|
|
80
|
0,489
|
36,628
|
86,743
|
54,214
|
0,027
|
0,018
|
3,601
|
4,463
|
4,4E3
|
Tableau A. 12:Influence de la concentration sur
de l'adsorption du Métronidazole par l'argile pontée
|
C
(ppm)
|
A
|
Ce
|
Qe
|
%R
|
1/Ce
|
1/Qe
|
Ln(Ce)
|
Ln(Qe)
|
E2
|
|
10
|
0,112
|
0,0620
|
19,875
|
99,379
|
16,109
|
0,010
|
-2,779
|
2,989
|
4,9E7
|
|
20
|
0,122
|
1,0320
|
37,936
|
94,839
|
0,968
|
0,011
|
0,031
|
3,636
|
2,8E6
|
|
30
|
0,161
|
4,8150
|
50,370
|
83,951
|
0,207
|
0,012
|
1,571
|
3,919
|
2,2E5
|
|
40
|
0,192
|
7,8210
|
64,356
|
80,446
|
0,128
|
0,012
|
2,056
|
4,164
|
8,8E4
|
|
50
|
0,235
|
11,992
|
76,015
|
76,015
|
0,083
|
0,013
|
2,484
|
4,331
|
3,9E4
|
|
60
|
0,287
|
17,035
|
85,928
|
71,607
|
0,058
|
0,014
|
2,835
|
4,453
|
1,9E4
|
|
70
|
0,345
|
22,661
|
94,677
|
67,626
|
0,044
|
0,015
|
3,121
|
4,550
|
1,1E4
|
|
80
|
0,391
|
27,628
|
105,75
|
66,096
|
0,037
|
0,015
|
3,300
|
4,661
|
8,0E3
|
Graphiques des contours qe pour l'argile
brute
0,08
0,06
0,04
0,02
0,16
0,14
0,12
0,10
10
11
4
9
8
7
6
5
3
Graphique de contour de Qe et MASSE;
TEMPS
Graphique de contour de Qe et pH;
TEMPS
10 20
10 20
TEMPS
TEMPS
30 40
30 40
50 60
50 60
Valeurs de maintien
Valeurs de maintien
< -5 -5 - 0
0 - 5 5 - 10 10 -
15 15 - 20 20 -
25
< -5 -5 - 0
0 - 5 5 - 10 10 -
15 15 - 20
MASSE 0,09
Qe
Qe
>
>
pH 7
20
25
87
10
11
4
9
8
7
6
5
3
0,02 0,04 0,06 0,08 0,10 0,12 0,14
0,16
Graphique de contour de Qe et pH;
MASSE
MASSE
Valeurs de maintien
< 0
0 - 10
10 - 20 20 - 30 30 -
40 40 - 50 50 -
60
TEMPS 31,5
Qe
>
60
Graphiques des contours pour l'argile sodique
10
11
4
9
8
7
6
5
3
0,02 0,04 0,06 0,08 0,10 0,12 0,14
0,16
Graphique de contour de Qe et pH;
MASSE
MASSE
Valeurs de maintien
< 0
0 - 15
15 - 30 30 - 45 45 -
60
TEMPS 31,5
Qe
>
60
88
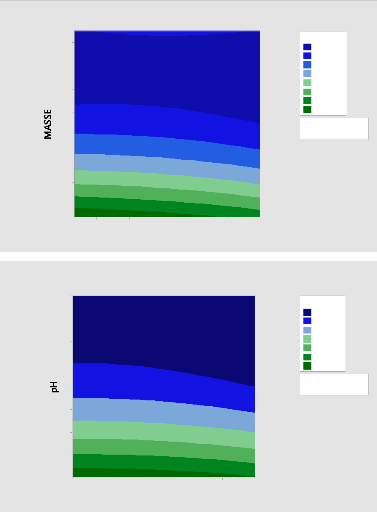
0,08
0,06
0,04
0,02
0,16
0,14
0,12
0,10
10
11
4
9
8
7
6
5
3
Graphique de contour de Qe et MASSE;
TEMPS
Graphique de contour de Qe et pH;
TEMPS
10 20
10 20
TEMPS
TEMPS
30 40
30 40
50 60
50 60
Valeurs de maintien
Valeurs de maintien
< -5 -5 - 0
0 - 5 5 - 10 10 -
15 15 - 20 20 -
25
< -5 -5 - 0
0 - 5 5 - 10 10 -
15 15 - 20
MASSE 0,09
Qe
Qe
>
>
pH 7
20
25
89
Graphique de contours de qe pour l'argile
pontée
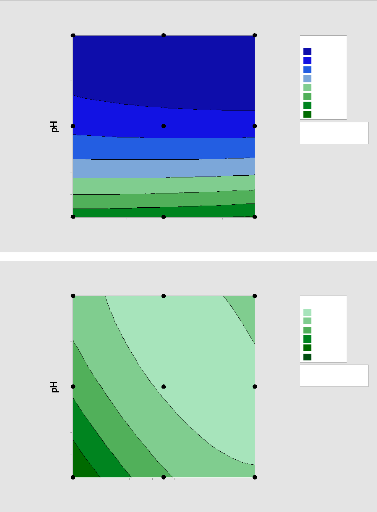
10
10
11
11
4
4
9
8
7
6
9
8
7
6
5
3
5
3
0,02 0,04 0,06 0,08 0,10 0,12 0,14
0,16
Graphique de contour de Qe et pH;
TEMPS
Graphique de contour de Qe et pH;
MASSE
10 20
TEMPS
MASSE
30 40
50 60
Valeurs de maintien
Valeurs de maintien
< 0
0 - 20
20 - 40 40 - 60 60 -
80
< -5 -5 - 0
0 - 5 5 - 10
10 -
15
15 -
20
20 -
25
MASSE 0,09
TEMPS 31,5
Qe
Qe
>
>
25
80
90

0,08
0,06
0,04
0,02
0,16
0,14
0,12
0,10
Graphique de contour de Qe et MASSE;
TEMPS
10 20
TEMPS
30 40
50 60
Valeurs de maintien
< 0 0 - 10
10 - 20 20 - 30
Qe
>
pH 7
30
91
|
|



