|

MINISTERE DES ENSEIGNEMENTS SECONDAIRE ET SUPERIEUR
............................
UNIVERSITE CATHOLIQUE DE L'AFRIQUE DE L'OUEST
UNITE UNIVERSITAIRE A BOBO-DIOULASSO (UCAO/UUB)
...................................
Unité de Formation et de Recherche en Sciences et
Techniques (UFR-ST)
MEMOIRE DE FIN DE CYCLE
Présenté en vue de l'obtention du diplôme de
Master Mention : Sciences Biologiques Appliquées
Spécialité : Bactériologie-Virologie
DIAGNOSTIC MOLECULAIRE DU COMPLEXE
MYCOBACTERIUM
TUBERCULOSIS CHEZ LES PATIENTS A RISQUE DE
TUBERCULOSE RESISTANTE A LA RIFAMPICINE ET/OU
A
L'ISONIAZIDE AU BURKINA-FASO
Soutenu publiquement le 30 juillet 2015 par : M. TOGDE
Gildas le Djimbaye.
Directeur de mémoire : Pr SANGARE
Lassana, professeur titulaire/Université de Ouagadougou, Chef
service bactériologie / Centre Hospitalier Universitaire Yalgado
Ouédraogo de Ouagadougou. Co-directeur de mémoire :
DIANDE Souba, PhD en Biochimie et microbiologie /
Université de Ouagadougou, Responsable Laboratoire National de
Référence des mycobactéries/PNT Ouagadougou.
Composition du jury :
Pr TARNAGDA Zékiba, Institut de Recherche
en Science de la Santé / Bobo-Dioulasso.
Président du Jury
Dr KABORE Jacques, Maître de
conférences, CIRDESS / Université polytechnique de
Bobo-Dioulasso.
Membre du jury.
Dr DIANDE Souba, PhD Biochimie et
microbiologie/Université de Ouagadougou.
Membre du jury.
Présenté par TOGDE Gildas le Djimbaye Page I
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
REMERCIEMENT
Nous rendons grâce à Dieu notre Père et
à l'Esprit Saint notre inspirateur pendant tout le travail.
Merci aux membres du Jury : Pr TARNAGDA Zékiba, Dr
KABORE Jacques et Dr DIANDE Souba pour avoir consacré de leur temps
à juger le travail que j'ai effectué au cours de mon Master II en
bactériologie-Virologie.
Merci au Pr Lassana SANGARE pour avoir accepté
être mon directeur de mémoire de fin de cycle master. Ce qui ne
serait possible sans sa contribution.
Un grand merci au Dr Souba DIANDE pour m'avoir accepté
dans son service, pour ses conseils, ses enseignements sur la culture des
mycobactéries et orientations dans la rédaction du document.
A toute ma famille :
Merci infiniment à mon père Mr Djimbaye MBAIPA
et à ma mère Mme Djimbaye RAMADJI Naidessem pour
l'éducation que j'ai reçue d'eux, les soins dont j'ai
bénéficiés, leur soutien financier pendant mon
séjour au Burkina-Faso pour mes études.
Je remercie mes petits frères Mr KHAUM Elvis le
Djimbaye (informaticien), Mr Madjiam KA-MBAIPA (ingénieur pont et
chaussée), Mlle UBULARE Carine le Djimbaye et Mlle DJILYAM Conforte le
Djimbaye qui m'ont soutenu dans la prière. Pour avoir été
des petits frères et petites soeurs que j'ai toujours
désirés, compréhensifs et patients.
Merci à mes oncles NGARYENA Rasissa et BEMADJITA
Charles pour le soutien moral et financier dont j'ai
bénéficié pendant tout mon séjour au
Burkina-Faso
Merci à mes deux grands cousins ASNGAR Fidèle et
WINDING Richard qui m'ont beaucoup encouragé pour le thème sur la
tuberculose. ASNGAR Fidèle qui lui-même pour avoir
déjà été en contact avec le germe quelques
années en arrière, m'a vraiment galvanisé dans ce
travail.
Merci à tous mes autres cousins et cousines de la
grande famille MBAIPA que je ne peux nommément tous citer.
A tout le personnel du laboratoire :
Merci à Mr Francis OUEDRAOGO, le major du laboratoire
pour ses conseils et pour m'avoir beaucoup appris sur la microscopie à
fluorescence.
Merci à Mr GUEYE Abdoulaye, un grand ami pour moi
à qui je pouvais me confier pendant tout le séjour au
laboratoire. Merci cpour m'avoir appris sur le diagnostic moléculaire,
pour ses conseils et ses soutiens divers.
Présenté par TOGDE Gildas le Djimbaye Page II
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Merci à Mr SAVADOGO Issiaka, Mr MOURFOU Adama, Mr
SAWADOGO Léon, Mr NEBIE Bayema Romaric pour tous les conseils qu'ils
m'ont prodigués durant mon stage auprès d'eux.
Mes remerciements aux médecins cliniciens, biologistes
et personnel soignant intervenant dans la prise en charge des malades
tuberculeux au Burkina-Faso.
A tous mes amis et connaissances
Merci au Dr KY Marcel de la pharmacie Bethel de Bobo-Dioulasso
qui a été comme un père pour moi à Bobo-Dioulasso.
Sa porte m'était toujours ouverte quand je venais à la pharmacie.
Merci à toute sa famille et que Dieu les bénisse.
Merci à la famille de mon pasteur, Mr BAMIKI Hema en
qui j'ai trouvé une deuxième famille à Bobo-Dioulasso.
Pour leur soutien multiforme
Merci à tous mes amis de Bobo-Dioulasso. Mon "grain"
où je venais faire les jeux de société.
Merci à Mr Napoléon Service, un grand
frère qui m'a beaucoup aidé pour la mise en forme du document
Merci à Mr MBATNA Augustin, un grand ami à moi
devenu comme un frère depuis notre rencontre à Bobo-Dioulasso
Merci à Mr KEITOYO Amedé que je viens de faire
connaissance mais dont le soutien moral m'a été très
bénéfique.
Merci à tous mes amis que je ne peux nommément
citer, que Dieu comble chacun de ses riches bénédictions
Présenté par TOGDE Gildas le Djimbaye Page III
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
DEDICACE
? A mon père et ma mère qui ont toujours
été là quand j'ai eu besoin d'eux et pour leur confiance
placée en moi.
? A mes petits frères Elvis et Thierno et à
mes petites soeurs Carine et Conforte.
? A la mémoire de mon petit papa Samson MBAIODJI
qui a vécu avec nous toute sa vie et que Dieu a rappelé pendant
mon temps d'étude au Burkina-Faso.
Présenté par TOGDE Gildas le Djimbaye Page IV
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
SOMMAIRE
PREAMBULE I
DEDICACE III
LISTE DES FIGURES ET TABLEAUX V
REMERCIEMENT I
SIGLES ET ABREVIATIONS VII
RESUME IX
ABSTRACT X
INTRODUCTION 1
GENERALITES 3
I. GENERALITES SUR LES MYCOBACTERIES 4
II. TUBERCULOSE 8
III. TUBERCULOSE ET CO-INFECTION VIH 21
MATERIEL ET METHODES 22
I. CADRE ET POPULATION DE L'ETUDE 23
II. Analyses bactériologiques 24
III. Analyses statistiques 27
RESULTATS ET DISCUSSION 28
I. RESULTATS 29
II. DISCUSSION 38
CONCLUSION-SUGGESTIONS-PERSPECTIVES 40
CONCLUSION 42
SUGGESTIONS 43
BIBLIOGRAPHIE 44
ANNEXES i
Présenté par TOGDE Gildas le Djimbaye Page V
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
LISTE DES FIGURES ET TABLEAUX
|
Figures et tableaux
|
Pages
|
|
Figure 1 : Mycobaterium tuberculosis au microscope
à fluorescence (coloration de Dugommier)
|
07
|
|
Figure 2 : Schémas des enveloppes cellulaires des
mycobactéries
|
07
|
|
Figure 3 : Tuberculose et résistance dans le monde en
2012
|
11
|
|
Figure 4 : Transmission de la tuberculose
|
11
|
|
Figure 5 : Tuberculose en microscopie optique (coloration de
Ziehl- Neelsen)
|
13
|
|
Figure 6 : Tuberculose en microscopie à fluorescence
|
13
|
|
Figure 7 : BCG sur milieu Löwenstein-Jensen
|
14
|
|
Figure 8 : Composantes du test Gene Xpert
|
16
|
|
Figure 9a : Principe de la recherche de mutation dans les
gènes rpoB par hybridation sur bandelette
|
17
|
|
Figure 9b : Exemple de bandelettes GenoType MTBDR plus ver.2
(Hain Science)
|
18
|
|
Figure 10 : Procédure de réalisation du Gene
Xpert
|
27
|
|
|
|
Tableau 1 : Répartition de la résistance à
la rifampicine par sexe
|
30
|
|
Tableau 2 : Répartition des Multi Drug Resistance(MDR) par
sexe
|
30
|
|
Tableau 3 : Répartition de la résistance à
la rifampicine par tranche d'âge
|
31
|
|
Tableau 4 : Répartition des MDR par tranche d'âge
|
32
|
|
Tableau 5 : Résistance à la rifampicine et la
Co-infection TB/VIH
|
32
|
|
Tableau 6 : Multi Drug Resistance (MDR) et la Co-infection
TB/VIH
|
33
|
|
Tableau 7 : Répartition de la résistance à
la rifampicine par type de malade
|
34
|
|
Tableau 8 : Répartition des MDR par type de malade
|
35
|
|
Tableau 9 : Répartition de la résistance à
la rifampicine par région
|
36
|
|
Tableau 10 : Répartition des MDR par région
|
37
|
|
Annexes
|
49
|
Présenté par TOGDE Gildas le Djimbaye Page VI
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
PREAMBULE
L'Université Catholique de l'Afrique de
l'Ouest/Unité Universitaire de Bobo est un établissement
d'enseignements supérieurs à caractère scientifique et
professionnel.
Il convient de préciser que l'idée de
créer l'UCAO avait germé depuis 1983. Elle a fait son petit
bonhomme de chemin jusqu'à la confirmation de son ouverture en 2002 par
les évêques de la Conférence épiscopale Burkina -
Niger. Pendant le processus, l'Etat burkinabè a été aux
côtés de ceux-ci. A la fin de la cérémonie, des
protocoles de partenariat ont été signés avec l'UPB, le
Lycée professionnel de Bobo, l'Institut de l'Environnement et de
Recherche Agricole (INERA), le Centre International de Recherche et de
Développement de l'Elevage en zone Sahélo-Saharienne (CIRDESS) et
la Conférence Episcopale et Régionale de l'Afrique de l'Ouest
(CERAO).
L'UCAO/UUB comporte en son sein les Unité de Formation
et de Recherche (UFR) suivantes :
? Unité de formation et de recherche en sciences et
techniques (UFR-ST) ;
? Unité de formation et de recherche en sciences
juridiques, politiques et humaine (UFR-SJPH) ;
? Unité de formation et de recherche en sciences
économiques et de gestion (UFR-SEG)
Sur le plan académique, l'université a
adopté depuis 2005 le système Licence Master Doctorat (LMD).
Les diplômes à chaque niveau d'étude sont
obtenus après une soutenance publique d'un travail de recherche. C'est
dans ce cadre que s'inscrit cette recherche sur le «
Diagnostic moléculaire du complexe mycobacterium tuberculosis chez
les patients à risque de tuberculose résistante a la rifampicine
et/ou à l'isoniazide au Burkina-Faso.», pour
l'obtention du Diplôme de master en Bactériologie-Virologie.
Présenté par TOGDE Gildas le Djimbaye Page VII
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
SIGLES ET ABREVIATIONS
ADN : Acide Désoxyribonucléique
ARN : Acide Ribonucléique
BAAR : Bacille Acido-Alcolo Résistant
CHR : Centre Hospitalier Régional
CHU-YO : Centre Hospitalier Universitaire-Yalgado
Ouédraogo
CMA : Centre Médical avec Antenne chirurgicale
CMTB : Complexe Mycobacterium tuberculosis
CNLAT : Centre National de Lutte antituberculeuse
DGSP : Direction Générale de Santé
Publique
DLM : Direction de Lutte contre la Maladie
DOTS: Directly Observed Treatment and Supervision
INH: Isoniazide
LNR : Laboratoire National de Référence des
mycobactéries
MCTB : Mycobactéries du Complexe Tuberculosis
MNT : Mycobactérie Non Tuberculeuse
M3+ : contrôle positif en microscopie au 3èm mois
de traitement
OMS : Organisation Mondiale de la Santé
PCR : Polymerisation Chain Reaction
PIT : Primo Infection Tuberculeuse
PPH : Pneumo-Phtysiologie
Protein TACO=P57 : Tryptophan Aspartate containing Coat
protein
Proteine TCO : protein trans-Cyclooctenes
PvVIH : Personne vivant avec le VIH
RIF: Rifampicine
TAG: Test d'Amplification Génique
TB-MDR: Tuberculosis-Multi Drug Resistance
TB-RR: Tuberculosis-Rifampicin Resistance
TNF: Tumor Necrosis Factor
TPM+ : Tuberculose Pulmonaire à Microscopie positive
UITMR: Union Internationale de Tuberculose et des Maladies
Respiratoires
VIH: Virus de l'Immunodéficience Humaine
WHO: World Health Organization
WT : White Type (souche sauvage)
Présenté par TOGDE Gildas le Djimbaye Page VIII
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
inhA : gène codant pour l'enoyl-acyl
réductase de la bactérie
katG : gène codant pour la catalase
réductase
rpoB : gène codant pour la sous-unité
bêta de l'ARN polymerase ADN dépendante
gène :
katG-catalase-péroxydase-péroxynitritaseT (MtH37RV)
gène : inhA-enoyl (acyl carrier protein) reductase
MtCDC1551
Présenté par TOGDE Gildas le Djimbaye Page IX
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
RESUME
La tuberculose est une maladie curable mais qui tue encore des
millions de personnes chaque année et les formes
résistantes/multirésistantes vont de plus en plus croissante de
nos jours dans les pays en développement. L'épidémie du
VIH accroit également le taux d'infection tuberculeuse. La
présente étude a pour objectif d'évaluer la proportion des
cas de tuberculose résistante à la rifampicine et/ou à
l'isoniazide selon les caractéristiques sociodémographiques et
cliniques parmi les malades dont les échantillons ont été
analysés au Laboratoire National de Référence (LNR) des
mycobactéries de Ouagadougou.
De la fin 2012 au début 2013 ; 204 patients avec
tuberculose à microscopie positive (TPM+) ont été
enregistrés au LNR des mycobactéries à Ouagadougou pour la
recherche des mycobactéries chez les cas de tuberculose
résistante à la rifampicine (TB/RR) et multirésistante
(TB/MR). Notre étude de fin de cycle s'était
déroulée entre octobre 2013 et octobre 2014 afin d'évaluer
la proportion des mycobactéries du complexe tuberculosis (MCTB) chez les
patients à risque de tuberculose résistante à la
rifampicine et/ou à l'isoniazide. La microscopie a été
réalisée après la coloration à l'auramine selon la
méthode de fluorescence. Les tests moléculaires ont
été réalisés après décontamination
des échantillons selon la méthode de Petroff pour le test
GenoType MTBDR plus essay ver.2 et après neutralisation pour le test
Xpert TB/RIF.
Au total 204 échantillons ont été
traités pour le diagnostic de mycobactéries du complexe
tuberculosis (MCTB) chez les patients à risque de la tuberculose
résistante à la rifampicine et ou à l'isoniazide. Les
isolats inclus 34 (16,67%) des Mycobactéries Non-Tuberculeuses (MNT) et
170 (83,33%) des MCTB ; 166 (81,37%) des échantillons ont
été collectés des patients de sexe masculin et 38 (16,63%)
des patients féminins. Parmi les 204 échantillons ; 99 (48,53%)
ont été soumis au test de dépistage VIII. La
résistance à la rifampicine totale était d'environ 34% et
une MDR d'environ 32%. Toutefois il n'y avait pas une relation entre la
résistance aux médicaments et la sérologie VIII des
patients.
Conclusion: au Burkina-Faso, les formes de
tuberculose résistante et multirésistante constituent un
problème de santé publique qui doit être rapidement pris en
charge. Avec les taux de résistance (34%) à la rifampicine
supérieur au seuil fixé par l'OMS, le Programme de lutte contre
la tuberculose a encore beaucoup de défis à relever dans la lutte
contre les formes de résistance et de multirésistance.
Mots clés : tuberculose
résistante, tuberculose multirésistante, MCTB, Antituberculeux,
Burkina-Faso.
Présenté par TOGDE Gildas le Djimbaye Page X
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
ABSTRACT
Tuberculosis is a curable disease but it still kills millions
of people around the world each year and the resistance forms of this disease
increase highly nowadays in developed countries. HIV epidemic increases
tuberculosis' rate. This present study is to evaluate the proportion of
resistant tuberculosis to the rifampicin or isoniazid according to the
sociodemographic and clinical's characteristics among patients whom samples
have been analyzed in the National Reference's Laboratory of Mycobacteria in
Ouagadougou.
From the end of 2012 to the beginning of 2013; 204 patients
have been registered into the National Reference's Laboratory of Mycobacteria
to research tuberculosis' resistance against rifampicin and/or isoniazid. Our
study started from October 2013 to October 2014 to evaluate the proportion of
mycobacterium complex to the patients with resistance against rifampicin and
multidrugresistance risk. The microscopy has been realized after the coloration
with auramine according to the fluorescence method. The molecular tests have
been realized after decontamination of samples according to the Petroff's
method for the GenoType MTBDR plus essay ver.2 test and after neutralization
for Xpert TB/Rif.
We got 204 samples which have been analyzed for the
Mycobacterium Tuberculosis Complex diagnosis. The results gave 34 (16.67%)
strains of non-tuberculous mycobacterium and 170 (83.33%) of MTBC; 166 (81.37%)
of samples provided from male patients and 38 (16.63%) from female patients. 99
(48.53%) patients have been submitted to HIV test. The rate of tuberculosis
resistant to rifampicin was about 34% and the multidrugresistance about 32%.
Nevertheless there was no significant link between HIV and the resistance.
Conclusion: In Burkina-Faso, the resistant
and multi-resistant forms of tuberculosis constitute a great public health
problem which should be taken care. With resistance against rifampicin rate
over WHO level, the Program of Fight against Tuberculosis has many challenges
to accept in fighting against resistant and multidrugresistant forms of
tuberculosis.
Keywords:
Resistant, multidrugresistant, tuberculosis, Burkina-Faso
Présenté par TOGDE Gildas le Djimbaye Page 1
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
INTRODUCTION
Les mycobactéries appartiennent au genre
Mycobacterium seul genre bactérien appartenant à la famille
des Mycobacteriaceae et à l'ordre des Actinomycétales avec des
propriétés tinctoriales particulières. Après une
coloration en rouge par la fuchsine, les mycobactéries ne sont pas
décolorées par l'action combinée d'acide-alcool
d'où leur appellation de Bacille Acido-Alcoolo-Résistant (BAAR).
Cette propriété est due à la présence d'une paroi
riche en lipides spécifiques, et en acides mycoliques faisant de la
paroi la plus épaisse des parois bactériennes d'environ 9-10 nm
d'épaisseur (Elena S Kostryukova, 2014). Le
matériel génétique (ADN) des mycobactéries contient
61 à 71% de guanine-cytosine (DIANDE Souba, 2010). Dans
le genre mycobacterium, on compte près de 138 espèces dont
l'espèce majoritaire est le M. tuberculosis ; agent principal
de la tuberculose chez l'homme et certaines espèces plus rares comme
M. bovis et M. africanum. L'ensemble de ces espèces
forme le complexe de mycobactéries tuberculosis. Il existe
également d'autres mycobactéries appartenant à la
même famille mais qui ne font pas partie du complexe tuberculosis et
responsables de plusieurs infections pulmonaires, cutanées,
ganglionnaires et généralisées (Nicolas V.,
2014). On les appelle mycobactéries atypiques ou
mycobactéries non tuberculosis (MNT) et sont de croissance lente
(Carbonelle et al, 2003 ; EL Helari et Vergez,
1993).
La tuberculose est une pathologie infectieuse endémo
épidémique causée par les mycobactéries du complexe
tuberculosis (MCTB). Elle demeure un problème majeur de santé
publique dans le monde. A l'échelle mondiale, l'OMS estime à deux
milliards de personnes infectées par le bacille tuberculeux
(OMS, 2006). Chaque année environ 9,4 millions d'entre
elles font une tuberculose (TB) maladie, tandis que 3 millions en meurent, dont
un quart chez des patients infectés par le VIH (Dye, 2006; OMS,
2006). Un tiers des cas surviennent sur le continent africain en
raison de l'épidémie VIH (Dye, 2006 ; WHO, 2006)
et plus de 95% de mortalité et morbidité s'observent
dans les pays en développement (Sangaré et al,
2010).
Dans la stratégie de lutte contre la TB sous DOTS et le
partenariat Halte à la tuberculose, la microscopie directe est mise en
exergue par l'OMS et l'Union Internationale contre la Tuberculose et les
Maladies Respiratoires (UITMR) pour identifier les patients tuberculeux
contagieux (Enarson, 2000). Elle est recommandée en
priorité comme outil clé du diagnostic de la tuberculose (TB)
dans les pays à faibles ressources chez les malades symptomatiques
toussant et crachant depuis plus de deux semaines.
Présenté par TOGDE Gildas le Djimbaye Page 2
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Malgré le nouvel intérêt porté
à la lutte antituberculeuse à l'échelon mondial, les
mécanismes de résistance augmentent tandis que les options
thérapeutiques s'amoindrissent. En septembre 2006, l'OMS alerte les
professionnels de santé à propos de la menace des tuberculoses
multi résistantes (TB-MDR). Le fardeau des TB-MDR augmente en effet de
façon dramatique dans le monde, environ 500 000 cas chaque année
parmi les nouveaux malades (WHO, 2008). Dans les pays
industrialisés malgré le recul de l'endémie de la
tuberculose, il s'est produit un regain considérable pour la tuberculose
dans les années 90 en raison d'un arrêt brutal de la
régression régulière de l'incidence de la maladie et de la
montée de la résistance aux antibiotiques (Marie-Laure
Uffredi et al, 2000). Outre la remobilisation des
autorités politiques et des acteurs de santé publique, ce regain
de la tuberculose a donné un coup de fouet à la recherche et a
abouti à la mise au point de nouvelles techniques de diagnostic
bactériologique essentielles dans la prise en charge de la maladie
(Marie-Laure Uffredi et al, 2000). La tuberculose
demeure à l'aube du troisième millénaire l'une des
principales causes de mortalité par maladies infectieuses malgré
l'arsenal thérapeutique disponible pour lutter efficacement contre cette
maladie.
Pour le cas spécifique du Burkina Faso, la tuberculose
multirésistante (TB-MDR) est devenue une préoccupation majeure.
Ces dernières années, le pays a enregistré une
augmentation des cas de TB-MDR passant de 12 cas en 2007 à 27 cas en
2011.
La lutte contre cette forme particulière de tuberculose
passe par son diagnostic précoce chez les cas suspects à
frottis-positifs pour leur prise en charge adéquate. C'est pourquoi, le
laboratoire national de référence des mycobactéries (LNR)
à Ouagadougou, a été équipé en Thermocycleur
GTQ-Cycler96 pour la technologie DNA-STRIP et Gene Xpert MTB/RIF en fin 2012 et
courant 2013 respectivement pour réaliser les tests de diagnostic rapide
(le test GenoType MTBDR plus ver.2 et le test Xpert MTB/RIF). A partir de 2013,
une stratégie de collecte et d'acheminement des crachats au LNR a
été instituée systématiquement dans un groupe
restreint de patients (les cas d'échec du traitement, rechute, cas
contact de TB-MR, les reprises après abandon de traitement et les
contrôles positifs au 3e mois de traitement de 1e ligne) dans
les centres de diagnostic et de traitement de la tuberculose (CDT) des 13
régions sanitaires du pays. Actuellement il n'y a pas de données
publiées sur le nombre de cas TB-MR/RR détectés parmi les
catégories de malades soumis au dépistage (Diande et
al, 2009).
Cette information justifie la présente étude qui
a pour objectif d'évaluer la proportion des cas de tuberculose
résistante à la rifampicine et/ou à l'isoniazide selon les
caractéristiques sociodémographiques et cliniques parmi les
malades dont les échantillons ont été analysés
au
Présenté par TOGDE Gildas le Djimbaye Page 3
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Laboratoire National Référence des
mycobactéries. Les généralités sur les
mycobactéries, la tuberculose et la résistance seront
traitées dans la première partie de ce document. Notre
étude proprement dite fera partie de matériel et méthode
qui sera la deuxième partie suivie des résultats.
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
GENERALITES
Présenté par TOGDE Gildas le Djimbaye Page 4
Présenté par TOGDE Gildas le Djimbaye Page 5
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
I. GENERALITES SUR LES MYCOBACTERIES
D'après le Bergey's manual (Murray et al,
1989), le genre mycobacterium est le seul genre de la famille des
Mycobacteriacae. Il comporte trois grands ensembles des
mycobactéries :
? les mycobactéries pathogènes du complexe
tuberculosis qui regroupe les espèces: Mycobacterium tuberculosis,
M. bovis, M. africanum, M. cannettii, M. caprae, M. micoti, M. pinnipeddii
(Radomski, 2012),
? les mycobactéries pathogènes n'appartenant pas
au complexe tuberculosis : M. leprae (aussi nommé bacille de
Hansen ou Bacterium leprae) responsable de la lèpre, le M.
ulcerans responsable de l'ulcère de Burili, le M. marinum
responsable de granulome aquarium et le M. abscessus
(
wikipedia.org/wiki/Mycobacterium),
? les mycobactéries non-tuberculeuses encore connues
sous le nom de mycobactéries atypiques ou encore mycobactéries
environnementales potentiellement pathogènes (Potentially Pathogenic
Environmental Mycobacteria : PPEM) (Inderlied et al, 1993 ;
Caruso et al, 2009).
On compte plus de 100 espèces des Mycobactéries
et seulement trois espèces sont pathogènes pour l'homme, d'autres
le sont mais occasionnellement ou en cas d'immunodépression locale ou
systémique (DOSSO Mireille, 2007). Environ 138
espèces et 11 sous espèces de mycobactéries ont
été répertoriées (
www.bacterio.cict.fr).
2.1. Classification des
Mycobactéries
Les mycobactéries appartiennent à la famille des
Mycobacteriaceae, dans l'ordre des actinomycétales, au genre
Mycobacterium. Le principal point commun à toutes ces
espèces appartenant au genre Mycobacterium dans l'ordre des
actinomycétales, est la propriété tinctoriale
pathognomonique mise en évidence par la coloration de Ziehl-Neelsen :
l'acido-alcoolo-résistance (DOSSO Mireille, 2007).
Toutes les mycobactéries sont des BAAR mais toutes les BAAR ne
sont pas des mycobactéries. Car les nocardia, quelques
corynébactéries et actinomycètes sont faiblement
acido-résistants (Carbonelle et al, 2003).
2.1.1. Mycobactéries du complexe
tuberculosis
Les Mycobactéries du complexe tuberculosis constituent
un groupe très compact et ses membres M. tuberculosis, M.
africanum, M. bovis, M. pinipedi, M. caprae et
M. microti peuvent être considérés comme des sous-
espèces de M. tuberculosis (Dominique Labie,
2003).
Présenté par TOGDE Gildas le Djimbaye Page 6
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
2.1.2. Mycobactéries atypiques
Selon la classification de Runyon basée sur les
caractères phénotypiques qui sont la pigmentation, la
température optimale et la vitesse de croissance ; quatre groupes se
distinguent dans les mycobactéries atypiques (DOSSO Mireille,
2007) :
- groupe I, II et III regroupe les espèces
pathogènes strictes ou opportunistes et à croissance lente
(DOSSO Mireille, 2007):
V' groupe I des mycobactéries photochromogènes
que sont: M. kansasii, M. marinum, M. simiae, M. asiaticum
V' groupe II des mycobactéries scotochromogènes:
M. gordonae, M. szulgai, M. scrofulaceum, M. flavescens
V' groupe III des mycobactéries non chromogènes
qui comprend le complexe aviaire (M. avium, M. intracellulaire et M.
xenopi), le complexe terrae (M. non chromogenicum, M. trivial, M.
gastri M. malmoense) et d'autres espèces telles que M.
ulcerans, M. shimodei, M. paratuberculosis, M. lepraemurium et M.
farcinogène.
- groupe IV qui regroupe des espèces pathogènes
rares ou saprophytes et à croissance rapide (DOSSO Mireille,
2007) :
V' espèces non pigmentées : M. fortuitum, M.
chelonei, M. fallax, M. senegalensis, M. chitae ;
V' espèces pigmentées : M. vaccae, M.
vaccae-aurum, M. engloaecki
V' espèces thermophiles : M. phlei
V' espèces thermoresistibles : M. smeggmatis.
2.2. Caractères morphologiques
Les mycobactéries sont des bacilles droits ou
légèrement incurvés de 0,2 à 0,6um de
diamètre sur 1,0 à 10,0um de longueur présentant parfois
des ramifications ou de renflements formant
des filaments qui se fragmentent très facilement en
éléments bacillaires
(
www.microbia.free.fr).
Elles sont immobiles et non sporulées. Ces bactéries
sont difficilement colorables par la coloration de Gram mais
considérées comme des bactéries à Gram+. Leur mise
en évidence repose sur leur propriété particulière
d'acido-alcoolo-résistance, c'est pourquoi on les appelle BAAR. Deux
colorations sont utilisées à ce sujet : la coloration de
Ziehl-Neelsen et la coloration à l'auramine (Dugommier). L'image
ci-dessous présente les M.tuberculosis en microscopie
électronique.
Présenté par TOGDE Gildas le Djimbaye Page 7
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
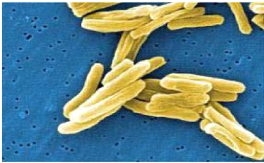
Figure 1 : M. tuberculosis vue en microscopie
électronique (Demangeat et al, 2013).
2.3. Caractères structuraux
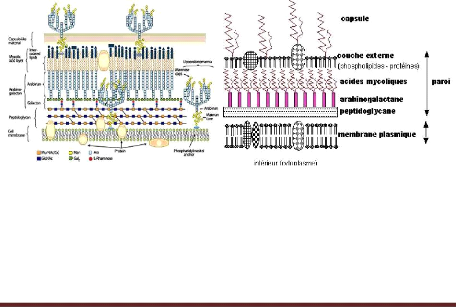
Figure 2 : Schémas des enveloppes cellulaires des
mycobactéries (
www.microbia.free.fr).
Les mycobactéries présentent des
caractères structuraux très complexes. Leur paroi est
formée de l'intérieur vers l'extérieur d'une bicouche
lipidique, d'une bicouche formée d'un polymère (de
molécule d'arabinose, de galactose et d'acides mycoliques) et d'une
seconde bicouche lipidique
(www.wikipedia/Mycobacteriumtuberculosis). Cette paroi est
épaisse d'environ 10 à 20umet le génome entièrement
séquencé. L'espèce M. tuberculosis a un
"chromosome" circulaire de 4 411 529 paires de bases (GC = 65,6%), 3924
gènes. Un gène particulier semble essentiel au pouvoir
pathogène chez l'homme, gène absent chez le BCG et M.
microti. Il s'agit d'un gène codant pour une protéine
ESAT-6, sécrétée par la bactérie et
déclenchant une forte production d'INF-Gamma (Cole S.T et
al, 1998).
Présenté par TOGDE Gildas le Djimbaye Page 8
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
2.4. Caractères culturaux
Selon les espèces, les exigences et le temps de
génération des mycobactéries sont variables : les colonies
ne sont visibles qu'après un temps d'incubation compris entre 2 jours et
10 semaines à 37°C en aérobiose (les mycobactéries
sont aérobies strictes) (
www.microbia.free.fr).
En fonction de leur vitesse de croissance et de leurs exigences, les
espèces du genre mycobacterium sont divisées en 2 groupes:
- les mycobactéries à croissance lente
(incluant les mycobactéries responsables de la tuberculose), ne
formant des colonies qu'après au moins 7 jours de culture sur milieu
enrichi à l'oeuf coagulé (Löwenstein-Jensen) et incapables
de cultiver sur des milieux standards ;
- les mycobactéries à croissance
rapide, formant des colonies en moins de 5 jours et aptes à se
développer sur gélose trypticase soja.
Les colonies apparaissent en 15 jours ou trois semaines
après culture sur le milieu Löwenstein-Jensen et
sont caractéristiques, rugueuses, verruqueuses et de
couleur belge eugonique (Anne Decoster, 2014).
Il convient de noter que M. leprae n'est pas cultivable
sur milieu de culture. II. TUBERCULOSE
La TB est une pathologie infectieuse très ancienne
endémo-épidémique dont l'unité nosologique et la
cause effective n'ont été connues qu'à partir du XIXe
siècle. Le principal agent causal est le M. tuberculosis qui
résulte d'une contagion d'homme à homme bien que le M. bovis
peut également être à la base de la tuberculose
humaine. Mais il s'agit d'une zoonose suite à une consommation du lait
non pasteurisé (Rittaco V et al 1992).
3.1. Physiopathologie
La tuberculose est dans plus de 70% des cas pulmonaire et
n'entraîne aucune manifestation clinique dans un premier temps. Les
bacilles sont inhalés par voie aérienne et se disséminent
ensuite dans d'autres organes par le courant sanguin, le système
lymphatique ou par extension directe. On dit que le sujet fait une «
primo-infection tuberculeuse (PIT) » latente qui est
caractérisée par différents évènements dont
l'intensité varie selon les caractéristiques de l'hôte
(principalement l'âge et l'état immunitaire). Ces
évènements peuvent être :
? un chancre d'inoculation : qui se traduit
par la fixation des bacilles dans un lobe pulmonaire. Il se produit une
réaction inflammatoire où les bacilles dans les macrophages vont
se multiplier et détruire ainsi ces macrophages et atteindre
d'autres.
Présenté par TOGDE Gildas le Djimbaye Page 9
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Les bacilles utilisent une protéine particulière
appelée TACO pour provoquer l'inhibition de la fusion phagosome-lysosome
et pouvant limiter l'acidification due à la pompe à protons du
phagosome.
? adénopathie : c'est la dissémination des
bacilles dans les ganglions puis vers l'ensemble de l'organisme du sujet
primo-infecté. Ce dernier développe une hypersensibilité
à la tuberculine avec activation des lymphocytes T killer.
? une formation de follicule : se caractérise par une
stimulation active et efficace des macrophages contre les bacilles qu'ils vont
attaquer. Les macrophages se transforment en cellules
multinucléées qui entourent le chancre d'inoculation formant un
follicule ou granulome où a lieu la "caséification"
appelée nécrose solide comme dans le fromage sous l'action du
"Tumor Necrosis Factor" ou TNF alpha. Au fur et à mesure que
les mécanismes de défense de l'hôte entrent en jeu, des
tubercules commencent à se former. Une lésion apparaît au
point de pénétration et les ganglions lymphatiques
afférents augmentent de volume, l'ensemble formant le "complexe
tuberculeux primaire" (Myint et al, 1987).
La PIT donne dans moins de 10% de cas, des signes cliniques ou
radiologiques ; on parle d'une PIT patente [Guide de lutte
antituberculeuse 2006]. Lorsqu'elle n'est pas traitée ou
traitée avec négligence, la tuberculose peut devenir
résistante, multirésistante ou ultrarésistante.
3.2. Tuberculose résistante,
multirésistante ou ultrarésistante
La tuberculose est résistante lorsque l'agent causal
développe une résistance à un seul médicament
antituberculeux de première ligne ; la rifampicine
généralement. Elle est dite multirésistante lorsque la
bactérie résiste à l'isoniazide (INH) et à la
rifampicine (RMP) qui sont deux des médicaments de première ligne
utilisés dans le traitement de la tuberculose pulmonaire à frotti
positif (
www.theunion.org).
Selon l'OMS, une résistance supplémentaire aux fluoroquinolones
(FQ) et à au moins un médicament antituberculeux injectable de
deuxième ligne dans le traitement (capréomycine (CPM), kanamycine
(KM) ou amikacine (AMK)) associée à la multirésistance
donne une ultrarésistance (
www.theunion.org).
3.3. Cause d'une tuberculose
résistante/multirésistante
La tuberculose multirésistante est toujours
consécutive à une erreur humaine, notamment lorsqu'une personne
ne suit pas son traitement jusqu'à son terme. Les principales causes de
la tuberculose multirésistante sont: la prescription médicale
inadaptée, la mauvaise qualité des médicaments
antituberculeux, l'interruption du traitement, l'absence de programmes
Présenté par TOGDE Gildas le Djimbaye Page 10
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
nationaux de lutte contre la tuberculose, le manque de
recommandations standardisées, la surveillance insuffisante des
professionnels de santé et l'arrêt précoce du traitement
(
www.european-lung-foundation.org).
Si la tuberculose multirésistante n'est pas
envisagée ou diagnostiquée, les mycobactéries
résistantes auront tout le temps de se développer et de
contaminer d'autres personnes de la communauté, entraînant une
aggravation du problème.
3.4. Epidémiologie
La tuberculose reste un problème de santé
publique majeur. Pour l'année 2012, on estime que 8,6 millions de
personnes ont contracté cette maladie et que 1,3 million en sont morts
soit 15,11% (y compris 320 000 décès parmi les personnes
séropositives pour le VIH) (rapport OMS, 2013). Le
nombre de décès par tuberculose est inacceptablement
élevé sachant que la plupart d'entre eux sont
évitables. La tuberculose multirésistante
progresse considérablement avec 440.000 nouveaux cas chaque année
causant au moins 150.000 cas de décès chaque selon l'OMS
(
www.masantefacile.com).
L'un des pays les plus touchés au monde est l'Inde où on
estime entre 125 à 299 nouveaux cas pour 100 000 habitants soit 26% du
total suivi de la Chine où 50 à 124 nouveaux cas pour 100 000
habitants sont estimés soit 12% du total. L'Afrique enregistre les taux
les plus élevés des nouveaux cas avec plus de 300 pour 100 000
habitants. Les objectifs du millénaire pour le développement
(OMD) consistent à réduire de 50% le taux de mortalité
(par rapport à 1990) et à inverser la tendance concernant
l'incidence de la tuberculose d'ici 2015 (rapport OMS, 2013).
En 2012 à l'échelle mondiale, le taux de
mortalité par tuberculose avait régressé de 45% depuis
1990. Deux régions OMS ont déjà atteint les objectifs : la
région des Amériques et celle du Pacifique occidentale. En 2009,
le Burkina Faso a enregistrés environ 3061 nouveaux cas TPM+ soit une
augmentation de 11% du nombre de cas diagnostiqués en 2008 qui
était de 2724 (Guide de Lutte antituberculeuse
2008).
La tuberculose dans le monde en 2012 a touché plus de 8
millions de personnes avec environ 1,3 millions qui en sont
décédées soit 15,6%. L'OMS estime qu'il n'y aurait pas de
nouveau vaccin avant 2025. Mais un nouveau traitement de tuberculose
multirésistante est mis au point par la bédaquiline qui est un
diarylquinoline. La figure ci-dessous présente la tuberculose dans le
monde en 2012. Le pays le plus touché au monde est l'Inde avec 2,2
million soit 26% du total suivi de la Chine qui présente 12% du total.
En Afrique, l'incidence la plus élevée des nouveaux cas pour
100.000 habitants est observée dans les pays du sud du continent.
Présenté par TOGDE Gildas le Djimbaye Page 11
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
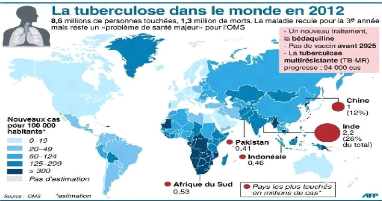
Figure 3 : Tuberculose dans le monde 2012 (
www.masantefacile.com).
3.5. Transmission
La tuberculose se propage par voie aérienne. Lorsque le
malade tousse ou éternue, il produit de fines gouttelettes
appelées gouttelettes de "pflüge". Ces gouttelettes se fixent
à des petites particules dans l'air. Un sujet saint peut s'infecter en
inhalant ces particules. Le mode de transmission est presqu'exclusivement par
voie aérienne. La transmission par voie digestive, par ingestion
d'aliments d'origine animale (lait par exemple) est peu fréquente. Il
existe également des transmissions par voie sexuelle urogénitale
mais qui sont d'une très faible importance épidémiologique
(
www.fares.be).
L'image ci-dessous montre un malade tuberculeux qui après avoir
toussé (voir éternué) émet les fines gouttelettes
de "pflüge" et une personne saine qui en respirant inhale cet air
contaminé. La transmission est exclusivement par voie
aérienne.
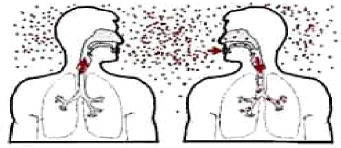
Figure 4 : Transmission de la tuberculose (
www.textbookofbacteriology.net)
Présenté par TOGDE Gildas le Djimbaye Page 12
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
3.6. Symptômes
Les symptômes de la tuberculose sont peu
spécifiques et varient en fonction de sa localisation. En cas d'atteinte
pulmonaire, on peut observer une toux persistante (>3 semaines), des
expectorations parfois sanguinolentes, une difficulté respiratoire et
des douleurs respiratoires, des symptômes généraux tels que
: la fièvre prolongée, anorexie, amaigrissement et sueurs
nocturnes (
www.fares.be).
En cas d'atteinte extrapulmonaire les signes dépendent
de l'organe affecté. Les symptômes sont discrets voire inexistants
et la maladie peut passer totalement inaperçue.
3.7. Diagnostic de la tuberculose
Le diagnostic de la tuberculose repose sur la mise en
évidence des BAAR dans les produits biologiques (crachats, urines, pus,
LCR...). L'examen microscopique reste la technique la plus abordable pour le
diagnostic direct de la tuberculose. Deux méthodes sont
communément utilisées pour cette mise en évidence : la
méthode de Ziehl Neelsen qui utilise la microscopie optique pour la
lecture des BAAR et la méthode de Dugommier qui repose sur la coloration
à l'auramine et qui utilise la microscopie à fluorescence.
D'autres méthodes de mise en évidence sont également
utilisées pour observer la croissance de ces mycobactéries et
détecter leur sensibilité aux médicaments
antituberculeux.
La microscopie des sécrétions bronchiques est
peu sensible parce qu'elle nécessite un nombre important de bacilles
(104 BAAR/ml de crachat pour la technique de Ziehl-Neelsen) dans le
prélèvement pour être positif (Diande S.,
2010). En outre, il faudra retenir que l'acido-alcoolo
résistance est spécifique des mycobactéries mais pas des
bacilles de la tuberculose.
3.7.1. Examen direct
a) Coloration de Ziehl Neelsen
La technique de coloration de Ziehl Neelsen est la technique
de référence dans le diagnostic direct de la tuberculose. Ses
composantes sont la fuchsine, l'alcool-acide et le bleu de
méthylène. La fuchsine colore en rouge les bacilles qui
conservent cette coloration après traitement par l'acide nitrique (ou
sulfurique) dilué et par l'alcool. Le fond de la préparation est
ensuite coloré au bleu de méthylène. Les BAAR apparaissent
rouges sur fond bleu. La lecture se fait à l'objectif x100 à
immersion. Elle est longue car le champ observé est petit.
Présenté par TOGDE Gildas le Djimbaye Page 13
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
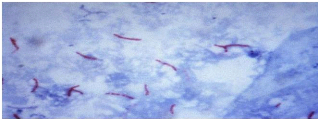
Figure 5 : M. tuberculosis en microcopie optique
(
www.microbia.free.fr).
b) Coloration de Dugommier
La méthode de Dugommier est la technique de lecture par
fluorescence. Ses composantes sont l'auramine, l'acide-alcool et le
permanganate de potassium. L'auramine se fixe sur le bacille et le rend
fluorescent, après traitement à l'acide-alcool et
contre-coloration du fond par le permanganate. La préparation est
examinée au microscope à fluorescence (x25). La lame est
explorée plus rapidement, le champ observé étant plus
grand qu'à l'immersion. Les BAAR apparaissent fluorescents, brillants
sur fond noir de la préparation. Ils sont dénombrés par
champ microscopique (diagnostic positif si au moins un BAAR pour 10 champs
observés).
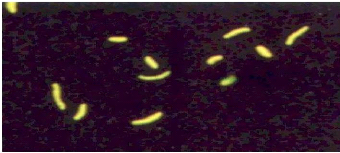
Figure 6 : M. tuberculosis vue en microscopie
à fluorescence (
www.microbia.free.fr).
3.7.2. Culture
Les prélèvements respiratoires (crachats,
tubage, liquide pleural...), les urines et d'autres types de
prélèvements biologiques doivent être
décontaminés avant d'être ensemencés dans les
milieux de culture riche et sélectifs pour les mycobactéries.
La culture permet de comprendre la vitesse de croissance de
mycobactéries et plusieurs milieux sont disponibles pour la
réalisation.
Présenté par TOGDE Gildas le Djimbaye Page 14
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
a) Différents milieux de culture
Les milieux solides sélectifs à l'oeuf
coagulé de Löwenstein-Jensen et de Coletsos définissent les
caractères culturaux classiques de M. tuberculosis: colonies
rugueuses de couleur chamois apparaissant sous l'aspect de "verrue" ou de
"chou-fleur" en 3 semaines environ après incubation à 37°C
en atmosphère ambiante. Les délais sont de 6 à 8 semaines
pour les M. afrcanum et M. bovis (Mode
opératoire-culture des mycobactéries, 2003).
Quelques milieux solides de culture
V' Milieu de Löwenstein-Jensen
V' Milieu de Löwenstein-Jensen + 0,2% de pyruvate de
sodium
V' Milieu de Coletsos
- Les milieux sélectifs liquides qui permettent une
réduction du délai de détection des colonies en quelques
jours pour les prélèvements riches en bacille et à un peu
plus de 2 semaines pour ceux paucibacillaires. Sur ces milieux, M.
tuberculosis apparait sous la forme de longues "cordes" mises en
évidence par la coloration de Ziehl-Nelseen. Nous pouvons citer
quelques-uns de ces milieux :
V' Milieu de Middlebrook
V' Milieu Bactec* 460 TB
V' Milieu BBL* MGIT
V' Milieu MB/Bact TTM
- D'autres milieux dits milieux diphasiques sont
proposés tel le Milieu BBL*Septi-Check AFB (Mode
opératoire-culture des mycobactéries, 2003)
L'identification classique des M. tuberculosis
à partir des cultures repose sur la morphologie des colonies, sur leurs
propriétés physiologiques telle la production d'acide nicotinique
et sur l'effet d'antibiotiques (bactériostase) comme l'acide
para-amino-salicylique (Anne Decoster, 2007). La figure
suivante montre une culture positive de BK sur milieu solide de Löwenstein
Jensen. Les colonies apparaissent en chou-fleur.
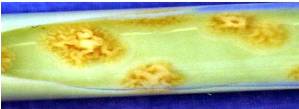
Figure 7 : BCG sur Löwenstein Jensen
(chou-fleur) (
www.recherche-fr.com/bk).
Présenté par TOGDE Gildas le Djimbaye Page 15
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
b) Vitesse de croissance
Sur des milieux de culture à température
optimale, deux types de mycobactéries peuvent être
considérés; les mycobactéries à croissance rapide
et les mycobactéries à croissance lente. La croissance lente
nécessite 7 jours à 3 mois de culture pour voir apparaitre des
colonies (Runyon, 1959). Ces colonies ont un temps de
génération compris entre 12 heures et 24 heures. Tandis que les
mycobactéries à croissance rapide ont un temps de
génération compris entre 2 heures et 6 heures avec formation des
colonies en moins de 7 jours.
3.7.3. La Réaction de Polymérisation en
Chaîne (PCR)
Dans le diagnostic de la tuberculose, la Réaction de
Polymérisation en Chaîne des Mycobactéries est une des
nouvelles techniques mises au point pour détecter la résistance
aux antituberculeux. Elle repose sur la caractérisation des
séquences d'acides nucléiques amplifiés puis
hybridés à l'aide des sondes (Loiez-Durocher et
al, 2000). La PCR s'applique sur des échantillons de
culture à MCTB positive (>108 bacille/ml), de
prélèvement BAAR à microscopie positive (>
105 bacille/ml) ou prélèvement BAAR à
microscopie négative-culture positive (>0 à 104
bacille/ml) (Emmanuel C., 2010).
a) Principe de la Réaction de
Polymérisation en Chaîne
Le principe de la PCR consiste à réaliser une
succession de réactions de réplication de la
matrice double brin d'ADN. Chaque réaction est
constituée de trois étapes :
- Dénaturation de l'ADN pour obtenir des matrices simples
brins
- Hybridation des amorces de part et d'autre de la
séquence à amplifier
- Polymérisation du brin complémentaire
Deux techniques sont utilisées pour le diagnostic de la
tuberculose résistante et
multirésistante: le test Xpert MTB/RIF et le GenoType MDR
plus ver.2.
b) Le test Xpert MTB/RIF
Le test Xpert MTB/RIF est une réaction de
polymérisation en chaîne à temps réel. La
détection moléculaire simultanée du MTBC et des mutations
du gène rpoB associé à une résistance à la
rifampicine accélère significativement le diagnostic de
tuberculose sensible aux médicaments comme celle de tuberculose
multirésistante. Le test Xpert MTB/RIF permet de réaliser cette
détection en moins de 2 heures dans des produits biologiques
(expectorations traitées avec le réactif) ou culots de
centrifugation d'un prélèvement traité avec la
méthode de décontamination décrite par Kubica
(N-Acétyl-L-Cystéine + soude) (Moris SL et al,
1995). Ce test réalisé de façon automatique
avec un système informatique est constitué : d'un PC (Personal
Computer) doté d'un logiciel préinstallé pour la lecture
des échantillons, des
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A RISQUE
DE TUBERCULOSE RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
cartouches jetables et à usage unique, d'un lecteur
code-barres et d'un appareil de lyse ultrasonique MTB-RIF test platform qui
reçoit les cartouches Xpert.

Appareil de lyse ultrasonique MTB-RIF
PC
Cartouche
Lecteur code-barres
Figure 8 : composantes du test Xpert MTB/RIF
(www.tbonline.info). Principe de la procédure
Le test Xpert MTB/RIF comprend les réactifs pour la
détection des mycobactéries appartenant au complexe tuberculosis
et pour la résistance à la rifampicine, ainsi qu'un
contrôle du traitement de l'échantillon permettant de s'assurer du
traitement approprié des bactéries cibles, ainsi que de la
présence d'inhibiteur(s) lors de la réaction PCR (Moris
et al, 1995). Le contrôle de la sonde consiste à
vérifier la réhydratation des réactifs, le remplissage des
tubes de PCR dans la cartouche, l'intégrité de la sonde et la
stabilité du fluorochrome.
Les amorces du test Xpert MTB/RIF amplifient un fragment de 81
paires de bases correspondant à une région connue du gène
rpoB. Les sondes identifient les mutations responsables d'une résistance
à la rifampicine de la région étudiée par
comparaison avec la séquence sauvage de référence.
Présenté par TOGDE Gildas le Djimbaye Page 16
Présenté par TOGDE Gildas le Djimbaye Page 17
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
c) GenoType MTBDR plus ver 2.
Le test GenoType MTBDR plus est un test d'hybridation
moléculaire sur bandelettes pour la détection de la
résistance et de la multirésistance aux antituberculeux. Cette
technique d'hybridation moléculaire sur bandelette est simple à
mettre en oeuvre avec du matériel présent dans beaucoup de
laboratoires de bactériologie (thermocycleur et bain-marie)
(Truffot-Pernot et al, 2010). Deux types de
bandelettes ont été mis sur le marché pour ce test
moléculaire : la bandelette InnoLipa Rif TB®
(Innogenetics) et la bandelette GenoType®MTBDR plus
ver.2 (Hain Science) (Truffot-Pernot et al,
2010). Les deux types de bandelette permettent la détection de
la résistance à la rifampicine, mais la deuxième
bandelette (bandelette GenoType®MTBDR plus ver.2 (Hain
Science)) est utilisée pour la mise en évidence des MDR. Sur la
bandelette InnoLipa Rif TB® (Innogenetics) sont fixées
à :
- des sondes spécifiques des allèles sauvages
gène rpoB de la position 315 du gène katG et des positions -8,
-15 et -16 du régulateur du gène inhA
- des sondes spécifiques des mutations les plus
fréquemment en cause dans la résistance à la rifampicine
(S531 L, H526 Y, H526 D, et D516 V de rpoB) et à l'isoniazide (deux
triplets déterminant la mutation S315 T de katG et -15C?T, -16A ?G, -8T
?C, - 8T ?A de inhA).
Les 2 figures ci-dessous sont des exemples de bandelettes
InnoLipa Rif TB® (Innogenetics) et
GenoType®MTBDR plus ver.2 (Hain Science).
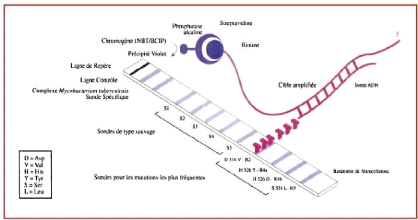
Figure 9a : Principe de la recherche de mutation dans
le gène rpoB par hybridation
sur bandelette (
www.em-consulte.com).
Présenté par TOGDE Gildas le Djimbaye Page 18
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO

Figure 9b : exemple de bandelette
GenoType®MTBDR plus ver.2 (Hain Science).
Sur la bandelette GenoType® MTBDR plus ver.2 sont inscrits
les différents gènes codant pour les deux antituberculeux majeurs
(Rifampicine et Isoniazide) : les gènes rpoB, katG et inhS qui sont des
gènes codant pour l'ARN de la bactérie.
Ils doivent apparaître sur la bandelette afin de confirmer
la bonne réalisation de PCR et la présence des gènes
pouvant traduire la résistance ou la sensibilité à la
rifampicine et/ou à l'isoniazide :
? le rpoB WT, au nombre de 08 et représentent les
souches sauvages (white type) des mycobactéries dans la
résistance à la rifampicine.
? le katG WT et inhS WT : sont les gènes
désignant la souche sauvage dans la résistance à
l'isoniazide
? le rpoB Mut, gènes des souches mutantes de la
bactérie, leur présence confirme qu'il y a eu résistance
à la rifampicine.
? de même, quand les traits apparaissent devant katG
Mut et inhS Mut, cela explique qu'il y a résistance
à l'isoniazide.
d) Mécanisme de résistance
La résistance acquise aux antibiotiques est toujours
liée à des mutations chromosomiques qui codent soit pour les
protéines cibles de certains antibiotiques ou soit pour des enzymes
impliquées dans l'activation de l'antibiotique en substance active :
Présenté par TOGDE Gildas le Djimbaye Page 19
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
- La rifampicine est l'un des antituberculeux clé de la
chaîne thérapeutique de la tuberculose. Sa cible principale est la
sous-unité bêta de l'ARN polymérase codée par le
gène rpoB (Loiez-Durocher et al, 2000).
La résistance à la rifampicine est liée à
des mutations dans une région restreinte du gène rpoB,
qui s'étend du codon 511 au codon 533.
- En ce qui concerne l'isoniazide, au moins trois gènes
sont impliqués dans sa résistance :
y' Le premier est le gène katG impliqué
dans 50 à 60% des cas et codant pour l'enzyme catalase peroxydase de
M. tuberculosis (Heym et al, 1995).
y' Un deuxième gène impliqué dans 10
à 20% de résistance à l'isoniazide. C'est le gène
inhA qui code pour l'enoylacyl carrier protein, protéine
impliquée dans l'élongation des acides gras et dans la
biosynthèse des acides mycoliques (Banerjee et al,
1994).
y' Le troisième est le gène ahpC qui code
pour l'alkyl peroxyde reductase. - L'éthambutol a pour cible
l'arabinosyl transférase codée par trois gènes
organisé en un éperon embCAB de 10 kb. Dans
l'étude de Telenti et al, des mutations du gène embB sont
identifiées chez 70 % des souches résistantes (Telenti A
et al, 1997).
- L'introduction du pyrazinamide dans la
polychimiothérapie de première ligne a permis de réduire
la durée de traitement de 9 mois à 6 mois (Loiez-Durocher
et al, 2000).
- Enfin la streptomycine qui est un antibiotique de la classe
des aminosides a pour cible la sous-unité 30S du ribosome qui comporte
l'ARNr16S codé par le gène rrs et la protéine
ribosomiale S12 codée par le gène rpsL
(Honoré N et al, 1994 ; Meier A et al,
1994).
3.8. Support génétique de résistance
chez les mycobactéries
La résistance aux antibiotiques est programmée
dans le génome bactérien. Les modifications
génétiques responsables de la résistance sont
chromosomiques, secondaire à une mutation, une délétion ou
une insertion portant sur le chromosome. Ces modifications peuvent
également être extra-chromosomiques par acquisition de
gènes (Anne Decoster, 2004). Les mutations chez les
mycobactéries sont ponctuelles dans la région 507-533 du
gène rpoB codant la sous-unité beta de l'ARN
polymérase.
La modification de la séquence nucléotidique
d'un gène chromosomique (Emmanuel C., 2014) :
Présenté par TOGDE Gildas le Djimbaye Page 20
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1. Mutations ponctuelles TCG ---> TTG Sérine --->
Leucine
2. Délétions ACGCCTAGAT ----> AC TAGAT
3. Insertions ACGCCTAG ----> ACCTTGCCTA

L'image ci-dessus est le tableau des mutations du gène
rpoB chez M. tuberculosis dans la région 507-533.
3.9. Traitement de la tuberculose
Le traitement de la tuberculose n'est engagé
qu'après confirmation à l'examen microscopique dépistant
une tuberculose. L'OMS recommande une stratégie thérapeutique
standardisée basée sur le DOTS (OMS, 1997). La
streptomycine fut le premier antituberculeux actif mis en place. De nos jours,
cinq antibiotiques dits de 1ère ligne sont utilisés
dans le traitement efficace de la tuberculose: le pyrazinamide, l'isoniazide,
l'éthambutol, la rifampicine et la streptomycine. Ces antibiotiques sont
utilisés en polychimiothérapie. Un guide d'entretien et de prise
en charge est proposé dans nos annexes.
3.10. Traitement et prise en charge de la tuberculose
multirésistante
Le traitement de la tuberculose
pharmaco-résistante se révèle beaucoup plus chère
et peut durer jusqu'à deux ans (
www.theunion.org).
Un nouveau traitement est proposé pour le traitement par l'agence
américaine de médicament : le Sirturo® (bedaquiline)
(
www.theunion.org).
Présenté par TOGDE Gildas le Djimbaye Page 21
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
La prise en charge se fait dans les structures
spécialisées (PPH) au niveau des CHU et un patient qui n'est plus
bacillifère peut être confié au niveau des CMA/CHR pour son
suivi (Guide technique de lutte contre TB, 2011). Un
algorithme de prise en charge en ambulatoire dans les CHU, CMA a
été proposé dans les annexes.
III. TUBERCULOSE ET CO-INFECTION VIH
4.1. Physiopathologie
Le VIH entraîne une immunodépression importante
avec un déficit cellulaire de CD4 et une baisse de cytokines (IFN-y,
IL2, TNF) (Kassi A., 2007). Ce terrain permet une croissance
accrue des mycobactéries avec risque de réactivation conduisant
à une tuberculose maladie (production de TNF-á, IL-6,
IL-1/granulome). Le résultat final est l'augmentation importante de la
charge virale locale et systémique, risque d'évolution vers le
stade SIDA (Kassi A., 2007).
4.2. Epidémiologie de la co-infection
L'OMS estime en 2000 que 11,5 million de personnes ont fait
une co-infection tuberculose VIH. Environ 70% en Afrique subsaharienne, 20% en
Asie, et 4% en Amérique latine et aux Caraïbes (OMS,
2004). Le VIH accroit la vitesse de progression vers une infection de
la tuberculose. Avec un statut VIH+, une personne est capable de
développer une tuberculose maladie dans 50% des cas.
4.3. Conséquence de la co-infection
En Afrique subsaharienne, un tiers ou plus des personnes
infectées par le VIH sont susceptibles de développer une
tuberculose (OMS, 2004). Un sujet atteint du VIH
présente 10 fois plus de risque de développer une tuberculose
maladie et la séroprévalence est d'environ 75% chez les sujets
atteints de tuberculose. La conséquence majeure de la co-infection est
l'augmentation de taux de mortalité par la tuberculose.
4.4. Actions conjointes TB/VIH (OMS, 2004)
La tuberculose est une des premières causes de
décès évitable chez les PvVIH. Pour atténuer ce
double fardeau, l'OMS a élaboré une politique en 2004 qui permet
de mener des activités conjointes afin de lutter contre la co-infection
tuberculose VIH. Cette politique consiste à:
- mettre en place et renforcer les mécanismes de
collaboration pour la prestation de
services intégrés tuberculose VIH
- réduire la charge tuberculeuse chez le PvVIH et
commencer rapidement le traitement antirétroviral
- réduire la charge du VIH chez les patients
présumés ou diagnostiqués tuberculeux
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
MATERIEL ET METHODES
Présenté par TOGDE Gildas le Djimbaye Page 22
Présenté par TOGDE Gildas le Djimbaye Page 23
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
I. CADRE ET POPULATION DE L'ETUDE
Notre stage de fin de cycle s'est déroulé
pendant 12 mois au sein du laboratoire du Centre National de Lutte
Antituberculeuse (CNLAT) de Ouagadougou. Le CNLAT est un centre de lutte contre
la tuberculose qui a créé en 1969 au Burkina-Faso.
Premièrement connu sous le nom du Centre de Coordination de Lutte
Antituberculeuse (CCLAT) ; il devient ensuite le Centre National de Lutte
Antituberculeuse (CNLAT) en 1982.
La population de notre étude est constituée
d'hommes et de femmes de 15 à 65 ans en provenance des 13 régions
du Burkina-Faso. Les échantillons ont été collectés
à partir des CDT des 13 régions sanitaires du Burkina-Faso.
a. Type d'étude
Notre avons mené une étude transversale
analytique au laboratoire du CNLAT d'octobre 2013 en octobre 2014.
b. Collecte des échantillons
Les échantillons collectés ont
été seulement d'origine pulmonaire et les crachats
représentaient plus de 90%. La collecte est effectuée sous la
demande du médecin traitant ou
du laboratoire. Pour collecter les crachats, deux pots sont
remis au patients et on explique
de collecter le premier échantillon
le soir avant de dormir et le second au petit matin avant d'acheminer au
laboratoire pour l'analyse. La collecte de LBA est faite par un
spécialiste chez les patients incapables d'émettre d'eux
même de crachats.
Le même échantillon a été
utilisé pour les deux tests de résistance (Xpert MTB/RIF et
Genotype plus essay ver.2).
c. Inclusion des malades
Les types de malades suivants ont été inclus dans
l'étude :
- Les cas de rechute : ce sont des patients déjà
traités pour une tuberculose, déclarés guéris et
qui reviennent avec une tuberculose confirmée bactériologiquement
(frottis positif ou culture positive) (Guide technique de lutte contre
TB, 2011) ;
- les cas d'échec du traitement de
1ère ligne. Ces types de patients sont ceux dont l'examen de
crachat est positif au 5ème ou 6ème mois de
traitement ;
Présenté par TOGDE Gildas le Djimbaye Page 24
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
- les cas d'échec de retraitement : sont les malades
tuberculeux dont l'examen de crachat confirmé par un second examen est
positif à 5 mois ou plus tard au cours d'un retraitement de 8 mois
donné sous la supervision directe d'un agent de santé.
(Guide technique de lutte contre TB, 2011) ;
- la reprise de traitement : c'est ceux qui ont interrompu
leur traitement pendant 2 mois consécutifs ou plus et qui reviennent
avec une preuve bactériologique de tuberculose (frottis positif ou
culture positive) (Guide technique de lutte contre TB, 2011)
;
- les contrôles positifs au 3ème mois
de traitement de 1ère ligne ;
- les cas contacts de TB-MR : ce sont les sujets en contact
avec un patient TB-MR.
II. Analyses bactériologiques
a. Examen microscopique
L'examen microscopique est le premier examen effectué
après réception des échantillons. Les échantillons
reçus sont étiquetés conformément aux
numéros du registre de biologie moléculaire. Les frottis sont
confectionnés et la technique de coloration de Dugommier est
appliquée pour la microscopie.
La lecture est faite en microscopie à fluorescence
après la coloration. Les BAAR apparaissent en bâtonnet brillant
sur un fond noir.
b. Tests moléculaires : GenoType MTBDR plus ver.2
et test Xpert TB/RIF i. GenoType MTBDR plus ver.2
a) Décontamination
Les expectorations ont été
décontaminées par la soude 4% (NaOH4%) selon la méthode de
Petroff modifiée. Environ 5 ml de crachat sont prélevés
dans un flacon stérile de type Falcom dans lequel on mélange 2
fois le volume de NaOH 4%. Le flacon refermé hermétiquement on a
agité puis homogénéiser. Ensuite les tubes ont
été incubés à 37 °C pendant 30 min. La
décontamination a été suivie de la neutralisation à
l'eau distillée puis après centrifugation à 3000 trs/min
pendant 15 min le culot est recueilli. On a ajouté ensuite 4 ml d'eau
distillée puis procéder à une nouvelle centrifugation ; le
culot recueilli a été remis en suspension avant l'extraction
d'ADN pour réaliser le test GenoType MTBDR plus ver.2.
Présenté par TOGDE Gildas le Djimbaye Page 25
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
b) Extraction d'ADN
Après décontamination, les échantillons
sont distribués dans de cryotubes (500 uL) et mis en centrifugation
à 10.000 tr/min pendant 15 min. Le surnageant a été
rejeté et environ 100 uL de la solution de Lys-A a été
ajoutée sur le culot recueilli avant d'incuber à 95°C
pendant 5 min. Une solution de neutralisation, appelée A-NB a
été ajouté et on a procédé à une
nouvelle centrifugation à 10.000 tr/min pendant 5 min pour extraire le
matériel génétique à partir du surnageant (ADN).
c) Procédure de réalisation du test dans
la salle pré-PCR L'ADN extrait a été
préparé avec différents amorces. Le mélange a
été fait dans des petits tubes appelés tubes PCR. Cette
phase est encore appelée phase de master mix. La salle pré-PCR
est dotée d'une hotte laminaire (voir annexes) sous laquelle les
manipulations de l'ADN ont été effectuées.
La hotte a été bien nettoyée avec de
l'éthanol 70%, ensuite elle a été allumée suivant
la procédure d'allumage. Les micropipettes et autres matériels de
manipulation ont été nettoyés également à
l'éthanol 70% sous la hotte. Les tubes PCR sont numérotés
de 1 à 11 et une lettre C est attribué au tube contrôle.
Les solutions de master mix utilisées comme amorces dans la
réaction ont été préparées pour 10
échantillons et un témoin (eau distillée). Environ 110 uL
de Mix A ont été préparés dans un tube
stérile et 385 uL de Mix B dans un second tube stérile. Dans
chaque tube PCR, 45 uL de solution sont aliquotés soit 10 uL de Mix A et
35 uL de Mix B plus 5 uL d'ADN. Les tubes refermés hermétiquement
ont été transportés dans la salle PCR.
d) Procédure de réalisation du test dans
la salle PCR
Le thermocycler GTQ cycler 96 allumé et les
réactifs de révélations ont été
portés à température ambiante dans le bain-marie. Nous
avons ensuite choisi le type de test à réaliser avec le GTQ
cycler 96, le volume et le nombre d'échantillons à introduire ont
été également précisés au niveau du
thermocycler GTQ cycler 96. Les tubes PCR hermétiquement fermés
(afin d'éviter l'échappement d'ADN), le bouton START a
été appuyé pour lancer la PCR qui comporte les trois
phases: la dénaturation (95° C), l'hybridation (50-60° C) et
la polymérisation (72°). La première étape avec les
trois phases a duré environ 3 heures, les tubes PCR ont
été ensuite retirés du GTQ cycler 96 pour l'étape
suivante. Les pipettes et la plaquette PCR (avec 12 puits) ont
été nettoyées à l'éthanol 70%. Environ 20 uL
de solution DEN (dénaturation) et 20 uL de l'amplicon ont
été déposés dans chaque puits de la plaquette
Présenté par TOGDE Gildas le Djimbaye Page 26
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
PCR. On a mixé pendant 5min avant d'ajouter 1mL de HYB
(solution d'hybridation) et homogénéiser doucement. Les DNA strip
ou bandelettes ADN, numérotés de 1 à 11 + une bandelette
annotée "C" pour le contrôle ont été placés
en dans les différents puits de la plaquette PCR. Ensuite on a
incubé pendant 30 min à 45° C. Après avoir
aspiré complètement la solution HYB, 1 mL de solution STR a
été ajouté puis on a incubé une deuxième
fois pendant 15 min à 45° C. La solution STR a été
aspirée complètement puis nous avons rincé pendant 1 min
avec la solution de RIN. Les solutions CON-C et CON-D pour la
révélation ont été préparées pour les
11 échantillons et le contrôle C. Environ 10 uL de CON-C + 990 uL
de CON-D soit 12 mL de CON-D et 120 uL CON-C pour les 12 échantillons
dans un tube stérile. On prélève ensuite le mélange
de conjugué dilué (CON-C+CON-D) et distribuons environ 950 uL
dans chaque puits. Après 30 min d'incubation, la solution
conjuguée a été aspirée complètement avant
de rincer avec 1 mL de RIN pendant 1 min et à l'eau distillée
pendant 1 min. Nos résultats ont été
interprétés par révélation sur les bandelettes
PCR.
ii. Test Xpert TB/RIF
Le test Xpert TB/RIF repose sur la détection des
mutations du gène rpoB impliqué dans la
résistance à la rifampicine. La manipulation a été
faite sous la hotte laminaire. Les tubes coniques ont été
étiquetés et environ 5uL d'échantillons y ont
été transférés. Pour neutraliser les germes
opportunistes dans l'échantillon, nous avons ajouté 2ml de la
solution de neutralisation déjà conditionnée dans la boite
Xpert TB/RIF et nous avons bien agité avant de laisser reposer pendant
20 min dans un premier temps. Ensuite nous avons agité à nouveau
et laisser reposer pendant 15 min. Le système d'utilisation du GeneXpert
MTB/RIF est composé d'un appareil, d'un ordinateur personnel, d'un
lecteur de code-barres et d'un logiciel préinstallé pour
effectuer le test sur des échantillons prélevés et
afficher les résultats. Ce système requiert l'utilisation des
cartouches jetables et à usage unique GeneXpert contenant des
réactifs PCR. Les cartouches de TB/RIF ont été
déballés, étiquetés et on a distribué
environ 5 uL de l'échantillon dans les cartouches. Les cartouches TB/RIF
préparés ont été introduites dans l'appareil
GeneXpert et le test est lancé à partir de l'ordinateur.
Après 1 à 2 heures la lecture est faite.
La photo ci-dessous montre les différentes
étapes du test Xpert TB/Rif.
Présenté par TOGDE Gildas le Djimbaye Page 27
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
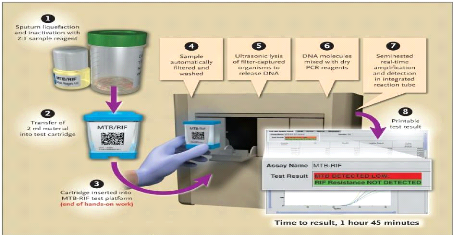
Figure 10: procédure de réalisation du test
Xpert TB/RIF [Catharina C.B. et al 2010]
III. Analyses statistiques
Les données ont été saisies sur Excel avant
d'être transférées sur SPSS 20.0 pour analyse. Le lien
statistique entre la résistance et les différentes variables de
l'étude a été établi grâce au logiciel Epi
InfoTM7. La valeur statistique significative a été
située à P?0,05.
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
RESULTATS ET DISCUSSION
Présenté par TOGDE Gildas le Djimbaye Page 28
Présenté par TOGDE Gildas le Djimbaye Page 29
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
I. RESULTATS
L'étude a été poursuivie sur 204 patients
avec 166 (81,4%) patients de sexe masculin et 38 (18,6%) de sexe féminin
d'âge moyen de 25 #177; 10 ans inclus dans les différents centres
de santé des 13 régions du Burkina-Faso. Environ 99 patients soit
48,5% ont été soumis au test de dépistage VIH. L'âge
des patients de l'étude est de 15 à plus de 65 ans, avec 144
(70,59%) d'hommes ayant un âge compris entre 15 et 54 ans et 35 (17,16%)
de femmes ayant l'âge de 15 à 54 ans (d'âge moyen =25
ans#177; 10). Les types de malade ont été : cas de contage avec 2
hommes (0,98%) et 0% de femmes; cas M3+ avec 29 (14,22%) hommes et 7 (3,43%)
femmes; les cas d'échec avec 76 (37,25%) hommes et 15 (7,35%) femmes;
les cas de rechute 42 (20,59%) hommes et 12 (5,88%) femmes; les PDV avec 3
(1,47%) hommes et 0% de femmes et les cas non précisé avec 14
(6,86%) hommes et 4 (1,96%) femmes.
Des 204 échantillons analysés : 170 (83,33%)
MCTB et 34 (16,67%) MNT. Les mutations ont été observées
au niveau des gènes rpoB sur 58 souches de MCTB soit 34, 12%
des rpoB WT. Elles ont été au niveau des gènes katG et
inhA sur 45 souches de MCTB soit 32,60% des katG WT et inhWT.
Nos résultats ont été ceux des tests
moléculaires : le test Xpert MTB/Rif et du GenoType MTBDR plus ver.2. Le
même échantillon a été utilisé pour les deux
tests et compte tenu de l'insuffisance de quantité de certains
échantillons, les 170 échantillons ont été
utilisés pour la réalisation du test Xpert MTB/Rif (test de
résistance à la rifampicine) et 138 pour réaliser le test
GenoType MTBDR plus ver.2 (test de multirésistance).
Les tableaux suivants donnent les résultats de
TB-RR/MDR répartie par sexe, âge, statuts VIH/TB, type de malades,
et par régions.
Présenté par TOGDE Gildas le Djimbaye Page 30
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.1. Profil de résistance à la rifampicine par
sexe
Le profil de résistance à la rifampicine par sexe
se traduit dans le tableau ci-dessous. R=Résistance, S=Sensible,
M=Masculin, F=Féminin, N=Nombre de patients
Tableau N° 1 :
Répartition de la résistance à la rifampicine par
sexe
|
Sexe
|
|
|
Rif
|
|
N
|
Total
%
|
|
S
|
R
|
|
|
N
|
%
|
N
|
%
|
|
M
|
94
|
55,29
|
47
|
27,64 141
|
82,94
|
|
F
|
18
|
10,58
|
11
|
6,47 29
|
17,06
|
|
Total
|
112
|
65,88
|
58
|
34,12 170
|
100
|
Le Tableau1 ci-dessus nous donne la
résistance à la rifampicine répartie par sexe. Au
total, 141 souches des mycobactéries du complexe
tuberculosis chez les hommes soit 82,94% et 29 souches chez les femmes soit
17,06%. La résistance à la rifampicine chez les patients de sexe
masculin est 27,64% et 11 (6,47%) chez les femmes. La résistance
à la rifampicine totale par sexe enregistrée pendant
l'étude de la période fin 2012 début 2013, est d'environ
34,12%.
1.2. Répartition des cas de TB-MR par sexe
Le tableau suivant est la répartition des MDR par sexe.
Les MDR représentent 32,60% des cas enregistrés dans le tableau
n02. Ce sont les résultats de la résistance à
la rifampicine et/ou à l'isoniazide par sexe. Au total, 138 patients ont
été enregistrés soit 81,17%. Le taux de TB-MR chez les
hommes est de 26,08% et 6,52% chez les femmes.
Tableau N°2:
Répartition de la TB/MR par sexe
|
|
|
MDR
|
|
|
Total
|
|
Non-MDR
|
|
MDR
|
|
SEXE
|
|
|
|
|
N
|
%
|
|
N
|
%
|
N
|
%
|
|
M
|
76
|
55,07
|
36
|
26,08
|
112
|
81,15
|
|
F
|
17
|
12,31
|
9
|
6,52
|
26
|
18,83
|
|
Total
|
93
|
67,38
|
45
|
32,60
|
138
|
100
|
Présenté par TOGDE Gildas le Djimbaye Page 31
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.3. Répartition par tranche d'âge de la
résistance à la rifampicine
Le tableau ci-dessous, présente la répartition
de la résistance à la rifampicine par tranche d'âge de
moins de 15 ans à plus de 65 ans. La résistance totale à
la rifampicine enregistrée est de 34,09% pour les 170
échantillons de l'étude. Les tranches d'âge de 24 à
34 et de 34 à 44 ans présentent les résistances à
la rifampicine les plus élevées soit respectivement 14,70% et
10,58%.
Tableau N03:
Répartition par tranche d'âge de la résistance à la
rifampicine
Rif
|
Age
|
|
|
|
|
Total
|
|
S
|
|
R
|
|
|
N
|
%
|
N
|
%
|
|
moins 15 ans
|
2
|
1,17
|
1
|
0,58
|
3
|
1,76
|
|
15 à 24 ans
|
7
|
4,11
|
6
|
3,53
|
13
|
7,64
|
|
24 à 34 ans
|
28
|
16,27
|
25
|
14,70
|
53
|
31,17
|
|
35 à 44 ans
|
29
|
17,06
|
18
|
10,58
|
47
|
27,64
|
|
45 à 54 ans
|
14
|
8,23
|
8
|
4,70
|
22
|
12,94
|
|
54 à 64 ans
|
11
|
6,47
|
0
|
0
|
11
|
6,47
|
|
65 ans et plus
|
21
|
12,35
|
0
|
0
|
21
|
12,35
|
|
Total
|
112
|
65,66
|
58
|
34,09
|
170
|
100
|
Présenté par TOGDE Gildas le Djimbaye Page 32
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.4. La répartition des TB-MR par tranche d'âge
Le tableau n04 donne les cas de TB-MR
répartis dans les tranches d'âge de moins de 15 ans à plus
de 65 ans.
Tableau N°4 : La
répartition des TB-MR par tranche d'âge
MR
|
Age
|
Non-MDR
|
|
MDR
|
N
|
Total
%
|
|
N
|
%
|
N
|
%
|
|
moins 15
|
3
|
2,17
|
0
|
0
|
3
|
2,17
|
|
15 à 24
|
8
|
5,79
|
5
|
3,62
|
13
|
9,41
|
|
24 à 34
|
23
|
16,66
|
19
|
13,76
|
42
|
30,40
|
|
35 à 44
|
21
|
15,21
|
15
|
10,86
|
36
|
26,07
|
|
45 à 54
|
14
|
10,14
|
6
|
4,34
|
20
|
14,48
|
|
54 à 64
|
7
|
5,07
|
0
|
0
|
7
|
5,07
|
|
65 et plus
|
17
|
12,31
|
0
|
0
|
17
|
12,31
|
|
Total
|
93
|
67,35
|
45
|
32,60
|
138
|
100
|
Le taux global de TB-MR est de 32,60%. Les taux de MDR les plus
élevés sont observés dans les tranches d'âge de 24
à 34 ans avec 13,76% et 34 à 44%.
1.5. Profil de résistance à la rifampicine selon le
statut VIH des patients
Le tableau ci-après fait état de résistance
à la rifampicine et de la co-infection TB/VIH. Tableau
N° 5: Résistance à la
rifampicine et la co-infection TB/VIH.
RIF
|
VIH
|
|
S
|
|
R
|
|
Total
|
|
N
|
%
|
N
|
%
|
N
|
%
|
|
VIH+
|
6
|
6,81
|
3
|
3,4
|
9
|
10,2
|
|
VIH-
|
55
|
62,5
|
24
|
27,27
|
79
|
89,77
|
|
Total
|
61
|
69,31
|
27
|
30,68
|
88
|
100
|
On note dans le tableau n05 la proportion de
patients VIH positif tuberculeux et résistants à la rifampicine
qui est de 3,4%. Le nombre de patients co-infectés soumis au test de
résistance à
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
la rifampicine est de 09 patients soit 10,22%. Le
dépistage du VITT a été effectué sur 88 patients
soit 51,76% de l'étude.
1.6. Répartition des cas de TB-MR selon leur statut
VITT
Le tableau ci-après est le résultat de la
co-infection TB/VITT et les MDR Tableau
N06: Les TB/MDR et co-infection TB/VITT
|
VITT
|
|
|
TB-MR
|
|
|
Total
|
|
Non-TB-MR
|
|
TB-MR
|
|
N
|
%
|
N
|
%
|
N
|
%
|
|
VIH+
|
3
|
4,68
|
3
|
4,68
|
6
|
9,37
|
|
VIH-
|
40
|
62,5
|
18
|
28,12
|
58
|
90,62
|
|
Total
|
43
|
67,1
|
21
|
32,8
|
64
|
100
|
Le tableau ci-dessus est le récapitulatif des TB-MR
répartis sur les patients soumis au dépistage VIH. Environ 64
patients soit 37,64% de l'étude. Il ressort du tableau que la proportion
des patients Co-infectés TB/VITT est de 4,68%.
Présenté par TOGDE Gildas le Djimbaye Page 33
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.7. Profil de la résistance à la rifampicine selon
le type de malade
Le tableau ci-dessous est le profil de la résistance
à la rifampicine selon le type de malade Tableau
N07: Répartition de la résistance
à la rifampicine par type de malade.
RIF
|
Type malade
|
|
|
|
|
Total
N
|
%
|
|
S
|
|
R
|
|
|
N
|
%
|
N
|
%
|
|
contage
|
1
|
0,59
|
1
|
0,59
|
2
|
1,18
|
|
M3+
|
24
|
14,12
|
9
|
5,29
|
33
|
19,41
|
|
échec
|
49
|
28,82
|
30
|
17,65
|
79
|
46,46
|
|
rechute
|
28
|
16,47
|
11
|
6,47
|
39
|
22,94
|
|
PDV
|
1
|
0,59
|
2
|
1,18
|
3
|
1,75
|
|
Non précisé
|
9
|
5,29
|
5
|
2,94
|
14
|
8,23
|
|
Total
|
112
|
65,95
|
58
|
34,09
|
170
|
100
|
Au vu du tableau n07, il ressort les
différents types de malades inclus dans l'étude, les perdus de
vue (PDV) et ceux dont le statut n'est pas précisé. La
résistance la plus élevée est observée chez les
patients en échec de traitement avec 17,65% suivi des cas de rechute
avec 6,47% et ceux dont la microscopie est positive au 3ème
mois de traitement 5,29%.
Présenté par TOGDE Gildas le Djimbaye Page 34
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.8. Répartition des cas de TB-MR par type de malade
La répartition de TB-MR par type de malade est
récapitulée dans le tableau suivant Tableau
N08: Répartition des TB-MR par type de malade
MDR
|
Type malade
|
Non-TB-MR
|
|
TB-MR
|
N
|
Total
%
|
|
N
|
%
|
N
|
%
|
|
contage
|
1
|
0,72
|
1
|
0,72
|
2
|
1,44
|
|
M3+
|
20
|
14,49
|
8
|
5,79
|
28
|
20,28
|
|
échec
|
38
|
(27,53)
|
24
|
17,39
|
62
|
44,92
|
|
rechute
|
25
|
28,11
|
7
|
5,07
|
32
|
23,18
|
|
PDV
|
0
|
0
|
2
|
1,44
|
2
|
1,44
|
|
Non précisé
|
9
|
6,52
|
3
|
2,17
|
12
|
8,69
|
|
Total
|
93
|
67,37
|
45
|
32,58
|
138
|
100
|
Le tableau n08 présente les MDR reparties
par type de malades. Les cas d'échec ont une multirésistance plus
élevée dans une proportion de 17,39% suivis des patients positifs
en microscopie au 3ème mois de traitement 5,79% et des cas de
rechute, environ 5,07%.
Présenté par TOGDE Gildas le Djimbaye Page 35
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.9. Répartition de la résistance à la
rifampicine par région
Le tableau ci-après est le tableau récapitulatif
de la résistance à la rifampicine dans les 13 régions du
Burkina-Faso.
Tableau N09:
Répartition de la résistance à la rifampicine par
région
RIF
|
Régions
|
|
S
|
|
R
|
Total
N
|
%
|
|
N
|
%
|
N
|
%
|
|
CENTRE
|
30
|
17,64
|
22
|
12,94
|
52
|
30,58
|
|
CENTRE EST
|
11
|
6,47
|
2
|
1,17
|
13
|
7,64
|
|
EST
|
0
|
0
|
1
|
0,58
|
1
|
0,58
|
|
CENTRE OUEST
|
9
|
5,29
|
4
|
2,35
|
13
|
7,64
|
|
CENTRE NORD
|
3
|
1,76
|
3
|
1,76
|
6
|
3,52
|
|
CENTRE SUD
|
3
|
1,76
|
4
|
2,35
|
7
|
4,11
|
|
SUD OUEST
|
2
|
1,17
|
2
|
1,17
|
4
|
2,34
|
|
SAHEL
|
11
|
6,47
|
0
|
0
|
11
|
6,47
|
|
HAUTS BASSINS
|
11
|
6,47
|
9
|
5,29
|
20
|
11,76
|
|
BMH
|
11
|
6,47
|
2
|
1,17
|
13
|
7,64
|
|
NORD
|
5
|
2,94
|
3
|
1,76
|
8
|
4,7
|
|
CASCADES
|
5
|
2,94
|
5
|
2,94
|
10
|
5,88
|
|
PLC
|
4
|
2,35
|
0
|
0
|
4
|
2,35
|
|
DRS non précisée
|
7
|
4,12
|
1
|
0,58
|
8
|
4,69
|
|
Total
|
112
|
65,88
|
58
|
34,06
|
170
|
100
|
Dans le tableau n09, les régions du Centre
et des Hauts Bassins présentent respectivement les taux de
résistance de 12,94% et 5,29%. Le résultat total de la
résistance à la rifampicine des 13 régions du Burkina
pendant la période d'étude est de 34,06%.
Présenté par TOGDE Gildas le Djimbaye Page 36
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1.10. Profil de TB-MDR dans les différentes
régions
Le tableau suivant présente les différents taux
de TB-MDR dans les 13 régions du Burkina-Faso.
Tableau N010:
Répartition des TB/MDR dans les différentes régions
MDR
|
Régions
|
|
|
|
|
N
|
Total
%
|
|
Non-MDR
|
|
MDR
|
|
N
|
%
|
N
|
%
|
|
CENTRE
|
27
|
19,56
|
16
|
11,59
|
43
|
31,15
|
|
CENTRE EST
|
9
|
6,52
|
2
|
1,45
|
11
|
7,97
|
|
EST
|
1
|
0,72
|
0
|
0
|
1
|
0,72
|
|
CENTRE OUEST
|
6
|
4,34
|
4
|
2,89
|
10
|
7,23
|
|
CENTRE NORD
|
3
|
2,17
|
1
|
0,72
|
4
|
2,89
|
|
CENTRE SUD
|
2
|
1,45
|
3
|
2,17
|
5
|
3,62
|
|
SUD OUEST
|
1
|
0,72
|
2
|
1,45
|
3
|
2,17
|
|
SAHEL
|
9
|
6,52
|
0
|
0
|
9
|
6,52
|
|
HAUTS BASSINS
|
9
|
6,52
|
7
|
5,07
|
16
|
11,59
|
|
BMH
|
9
|
6,52
|
2
|
1,45
|
11
|
7,97
|
|
NORD
|
4
|
2,89
|
3
|
2,17
|
7
|
5,06
|
|
CASCADES
|
5
|
3,62
|
4
|
2,89
|
9
|
6,51
|
|
PLC
|
1
|
0,72
|
0
|
0
|
1
|
0,72
|
|
DRS non précisée
|
7
|
5,07
|
1
|
0,72
|
8
|
5,79
|
|
Total
|
93
|
67,34
|
45
|
32,57
|
138
|
100
|
Au regard du tableau n010, il ressort que les
régions du centre et des hauts bassins présentent les MDR les
plus élevées ; soit 11,59% et 5,07%.
Présenté par TOGDE Gildas le Djimbaye Page 37
Présenté par TOGDE Gildas le Djimbaye Page 38
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
II. DISCUSSION
Dans l'objectif d'évaluer la proportion de cas de
TB-MR/RR selon les caractéristiques sociodémographiques et
cliniques des malades nous avions inclus 204 patients pour le diagnostic de
tuberculose résistante à la rifampicine et multirésistante
selon les variables suivantes : le sexe, l'âge, le statut VIH, le type de
malade et la provenance géographique. Les isolats inclus 170 (83,33%) de
MCTB et 34 (16,66%) de MNT. Deux tests moléculaires : le test Xpert
TB/Rif et le GenoType MTBDR plus ver.2 ont été utilisés
pour la mise en évidence de la résistance aux antituberculeux. La
taille de l'échantillon était de 170 pour la réalisation
du test Xpert TB/rif et de 138 pour réaliser le GenoType MTBDR plus
ver2. Le test Xpert TB/Rif a été réalisé avant le
GenoType MTBDR plus ver.2 et le même échantillon a
été utilisé pour les deux tests. On se retrouve avec des
patients dont seul le test Xpert TB/Rif est réalisé. L'infection
VIH n'est pas liée à la résistante. Toutes fois, 88
échantillons (n=170) ont été soumis au test de la mise en
évidence de la résistance à la rifampicine et 64
échantillons (n=138) pour le test GenoType MTB plus ver 2.
La résistance à la rifampicine est plus
élevée chez les patients de sexe masculin que chez les patients
de sexe féminin. De même, les cas de MDR sont plus
élevés chez les hommes que chez les femmes. Plus de patients
masculins s'étaient présentés au laboratoire pour les cas
M3+ (14,21%), cas d'échec (37,25%) et rechute (20,58%). Ceci pourrait
expliquer les pourcentages élevés de résistance à
la rifampicine et ou à l'isoniazide chez les hommes. Nous pouvons
émettre cette hypothèse que les hommes sont plus exposés
dans leur rôle sociétal en rapport avec leurs activités. Ce
qui faciliterait la transmission du bacille et les risques de
résistance. Comparativement à d'autres travaux, ce constat a
été également démontré dans les travaux sur
la résistance aux antituberculeux menés par SANGARE L. et al
(2010) sur la résistance aux antituberculeux chez les cas de
tuberculose pulmonaire nouveaux ou traités antérieurement au
Burkina-Faso. D'autres études en Afrique ont également
démontré que le genre masculin présente plus de
résistance que le genre féminin (Kouassi B. et al,
1998).
Dans nos collectes de données, les tranches d'âge
15 ans ou moins et au-delà de 65 ans ne présentent presque pas de
résistance à la rifampicine, ni de MDR. La résistance
à la rifampicine est plus élevée dans les tranches
d'âge de 24-34 ans et de 35-44 ans contrairement aux autres tranches qui
présentent moins de résistance ou presque pas à la
rifampicine. Ces tranches d'âge présentent également une
multirésistance plus élevée que les autres tranches
Présenté par TOGDE Gildas le Djimbaye Page 39
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
d'âge. Les jeunes sont affectés dans beaucoup de
secteurs d'activités de la société et les voyages, ce qui
rendrait leur exposition au risque de tuberculose (Kouassi B. et
al, 1998).
Dans les cas d'échec, 17,65% des cas ont
été résistants à la rifampicine et 17,39% ont
été MDR. Le taux de 13% de MDR rapporté par l'OMS dans les
cas d'échec au traitement (WHO, 2009) est très
inférieur à celui de notre étude, il peut provenir de
pratiques de routine et non d'une étude (SANGARE L. et al.
2010). Lorsque nous appliquons les recommandations de l'OMS, les
malades en contrôle positifs au 3èm mois de traitement de
1ère ligne (M3+) et en cas de rechute présentent les taux
élevés de multirésistance avec respectivement 5,79% et
5,07%. Dans notre étude, les hommes sont plus nombreux dans les cas
d'échec, de rechute et M3+.
La région du centre présente les taux de
résistance à la rifampicine et de MDR plus élevé
que les autres régions, celle des hauts bassins présente
également un taux de MDR élevé. D'après le
recensement du Burkina-Faso en 2010, ces deux régions sont les plus
peuplés avec respectivement 12,3% et 10,5% de la population
(insd, 2008). Ces deux régions représentent un
carrefour avec plusieurs peuples de l'intérieur comme de
l'extérieur du pays. La densité populaire et le fait que dans ces
deux grandes régions se trouvent les grandes structures de santé
où sont acheminés la plupart de prélèvement,
pourraient expliquer ces taux élevés. Une étude similaire
de résistance aux antituberculeux a été
réalisée dans la région des hauts bassins par LOMPO Amelie
(2012) avait donné 5,9% de MDR.
Les difficultés majeures rencontrées au cours de
l'étude étaient les problèmes liés aux
réactifs. Ceci a contribué au prolongement de notre stage
initialement prévu pour 06 mois à 12 mois. Nous étions
conformés au programme de biologie moléculaire du laboratoire.
Outre ces difficultés rencontrées, nous avons
bénéficiés d'un bon encadrement du personnel de CNLAT et
d'un environnement accueillant.
En perspectives, nous nous proposons de poursuivre avec
l'étude des mycobactéries par la caractérisation
génétique, biochimique et structurale de leur ATP synthase qui
pourrait être une cible de traitement.
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
CONCLUSION-SUGGESTIONS
Présenté par TOGDE Gildas le Djimbaye Page 40
Présenté par TOGDE Gildas le Djimbaye Page 41
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Présenté par TOGDE Gildas le Djimbaye Page 42
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
CONCLUSION
En conclusion de notre étude, nous pouvons dire que la
tuberculose résistante à la rifampicine et ou à
l'isoniazide constitue un grand problème de santé publique et un
obstacle majeur pour le contrôle de la tuberculose au Burkina-Faso. Les
taux de résistance à la rifampicine de 34,11% et les MDR de
32,63% pour les variables : sexe, âge, type de malade et région
(respectivement p=0,017 et p=0,022) constituent pour le
Programme National Tuberculose des grands défis de dépistage
précoce et le suivi rigoureux d'une surveillance continue des malades
contagieux jusqu'à la guérison complète sans risque de
récidive. Le diagnostic moléculaire pour détecter des
mutations des mycobactéries du complexe tuberculosis dans les
expectorations des malades tuberculeux est à recommander et
s'étendre dans les différents centres régionaux de lutte
antituberculeuse. Bien que la fréquence de résistance aux
antituberculeux dans la co-infection TB/VITT soit négligeable du fait de
l'augmentation des cas de décès chez les personnes
co-infectées (Guide de lutte ATB 2008), la lutte contre
la tuberculose résistante doit s'élargir davantage afin de
répondre aux activités de collaboration TB/VITT
recommandées par l'OMS. Ce qui constitue un pilier dans la coordination
des programmes anti-VITT, anti-TB et un moyen d'empêcher la progression
de la tuberculose pharmacorésistante.
Présenté par TOGDE Gildas le Djimbaye Page 43
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
SUGGESTIONS
Au vu de nos résultats, la tuberculose
résistante et multirésistante va de plus en plus croissant. Nous
suggérons quelques conduites à tenir afin de prévenir
cette forme de tuberculose et d'éviter la propagation :
1) Dès l'apparition des premiers symptômes,
prescrire les médicaments adaptés en association avec un suivi
rigoureux. C'est-à-dire traiter le problème à la base, ce
qui augmenterait les chances de guérison et réduirait les risques
de réapparition des symptômes
2) Isoler le sujet tuberculeux résistant
jusqu'à la disparition des symptômes afin de prévenir la
transmission de la tuberculose résistante/multirésistante.
3) Renforcer l'équipement de nos structures de
santé dans le diagnostic de la tuberculose résistante et
multirésistante
L'Université Catholique de l'Afrique de l'Ouest est
notre structure de formation en master de recherche. Nous suggérons
à l'administration encore plus de suivi pour les étudiants en fin
de cycle, leur proposer de thèmes de recherche avec des mesures
d'accompagnement pour l'acquisition des réactifs et trouver des lieux de
stage si possible. Nous suggérons que l'université donne un
intervalle de temps pour les soutenances de mémoires.
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
BIBLIOGRAPHIE
Présenté par TOGDE Gildas le Djimbaye Page 44
Présenté par TOGDE Gildas le Djimbaye Page 45
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
1. Alexandra K., Jean-Louis K., Michel F., Vincent
F., Remy T., Vincent H., et al. Apport de la biologie
moléculaire dans le diagnostic de la tuberculose. Revue
Française des Laboratoires 2002 ; 343 : 67-70
2. Anne Decoster, 2004. Résistance
aux antituberculeux.
www.anne.decoster.free.fr/atb/resab.htm
3. Banerjee A., Dubnau E., Quemard A., et
al. inhA, a gene encoding a target for isoniazid and
ethionamide in Mycobacterium tuberculosis.
Science 1994; 263: 227-30.
4. Carbonelle B., Dailloux M., Lebrun L., et
al. Biologie médicale. Mycobactéries,
mycobactérioses. Cahier de formation, 43. In Pettrof S A.
Some cultural studies on tubercle bascillus. Bull Jonhs Hopkins Hosp 2003 ;
272-279.
5. Caruso G., Passàli F.M., Salerni L.,
Molinaro G., et Messina M. Head and neck mycobacterial infections in
pediatric patients. International Journal of Pediatric Otorhinolaryngology
2009 ; 73 (1) :38-41.
6. Catharina C.B., Pamela N., Doris H., et al.
Rapid molecular detection of tuberculosis and rifampin resistance. N
Engl J Med 2010; 363:1005-1015 September 9, 2010.
7. Cole S.T., Broch R., Parkhil J., Garnier T.,
Churcher C., Harris D., et al. Deciphering the biology of
Mycobacterium tuberculosis from the complete genome sequence.
Nature Australia 1998. 393: 537-544.
8. Demangeat C., Fontaine M., et Medda F. La
tuberculose du XIXème au XXIème siècle. Consulté le
07/02/2014.
9. Diandé S. Evaluation de la
résistance de Mycobacterium tuberculosis aux antibiotiques et
exploration des facteurs de risque associés à la
multirésistance au Burkina Faso. Université Ouagadougou 2010; 117
: 26-27.
10. Diande S., Sangaré L., Kouanda S.,
Dingtoumda B.I., et Traoré A.S. Drug resistant of mycobacterium
tuberculosis complexa mong newly diagnosed tuberculosis cases in Burkina-Faso.
West african journal of medecine 2009, ISSN : 2333-9721.
11. Dye C. Global epidemiology of
tuberculosis. Lancet 2006; 367: 938-940.
12. Elena S. Caractérisation
génétique, biochimique et structurale de l'ATP synthase
des mycobactéries, la cible d'un nouvel antituberculeux de la famille
des diarylquinolines. Université Pierre et Marie Curie-ParisVI
2012; 228: 11-12.
13. EL Helali N., et Vergez P.
Identification des mycobacteries. Feuillet de Biologie, 1993 ; 34:
5-15.
Présenté par TOGDE Gildas le Djimbaye Page 46
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
14. Emmanuel Cambeau. Outils de diagnostic
de la résistance : pratiques actuelles et perspectives. Paris
Diderot 2010.
15. Emmanuel Cambeau. Résistance aux
antituberculeux. Paris Diderot 2014 ; 16: 1-76
16. Enarson D.A., Rieder H.L., Arnadottir T., et
Trébucq A. Management of tuberculosis: guide for low-income
countries, 5th ed. Paris, France: International Union Against Tuberculosis and
Lung Disease, 2000.
17. Frieden T. R., Sterling T., Pablos-Mendez A., et
al. The emergence of drug-resistant tuberculosis in New York
City. N Engl J Med 328: 521-532.
18. Guide de lutte contre la tuberculeuse
2006. PNT-Burkina Faso édition 2006.
19. Guide de lutte contre la tuberculose 2011.
PNT-Burkina Faso édition 2011.
20. Heym B., Honoré N., Truffot-Pernot C., et
al. Implications of multidrug resistance for the future of
short course chemotherapy of tuberculosis: a molecular study. Lancet
1994; 344: 293-8.
21. Honoré N., et Cole S. T.
Streptomycin resistance in Mycobacteria. Antimicrobial Agents Chemother 1994;
38: 238-42.
22. Inderlied C. B., Kemper A. C., et Bermudez L. M.
The Mycobacterium avium complex. Clinical Microbiology
Review 1993; 6(3): 266-310.
23. Kassi A., et Bissagnené E.
Problématiques de la co-infection VIH/Tuberculose dans le contexte de
l'accès aux soins et au traitement. Service des maladies
infectieuses CHU de Treichville 2007; P1-34
24. Kouassi B., Horo K., N'douba K. A., Koffi N.,
Ngom et al. Profil épidémiologique et
microbiologique des malades tuberculeux en situation d'échec ou de
rechute à Abidjan. J "santé publique" n02539 rev
2004.
25. Lemaître N. Epidémiologie
de la tuberculose et état de la résistance. DUACAI 2009
26. Loiez-Durocher C., Vaché A., et
Lemaître N. La résistance de Mycobacterium tuberculosis
aux antituberculeux : méthodes diagnostiques.An. Biol.Clin, 2000; 58:
291-7.
27. Lompo B. Y. A. Etude de la
résistance primaire et secondaire du complexe tuberculosis aux
antituberculeux dans la region des Hauts-Bassins. Université
Polytechnique de Bobo 2012.
28. Marie-Laure Uffredi et Jacques Grosset.
Données réscentes sur la tuberculose.
Médecine Thérapeutique 2000, 6(6): 429-33.
Présenté par TOGDE Gildas le Djimbaye Page 47
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
29. Meier A., Kirschner P., Bange F. C., Vogel U., et
Böttger E. C. Genetic alterations in streptomycin-resistant
Mycobacterium tuberculosis: mapping of mutations conferring resistance.
Antimicrobial Agents Chemother 1994; 38: 228-33.
30. Mireille Dosso 2007. Mycobactéries :
classification, méthode d'identification classique et
pathogène.
www.pasteur-yaounde.org/Buruli/presentations/Dosso.pps
31. Morris S. L., Bai G. H., Suffys P., Portillo-Gomez
L., Fairchok M., et Rouse D. Molecular mechanisms of
multidrugresistance in clinical isolates of Mycobacterium tuberculosis. J.
Infect Dis 1995 ; 171:954-60.
32. Murray R. G. E., Brenner D. J., Bryant M. P., Holt
J. G., Krieg N. R., Mouldier J. W., et al. Bergey's manual of
systematic and Bacteriology. Baltimore USA, in Williams and
wilkins.1989, 2 : 1599.
33. Myint T. T., Win H., Aye H. H., et
al. Case-control study on evaluation of BCG vaccination of
newborn in Rangoon Burma Ann Trop Paediatr 1987; 7:159-166.
34. Nicolas Radomski. Source des
mycobactéries non-tuberculeuses dans le bassin du versant.
Université Pierre et Marie Curie-ParisVI 2012; 219: 20-35.
35. Nicolas VEZIRIS. Actualités
thérapeutiques et épidémiologiques sur les
Mycobactéries atypiques : immunodéprimés...et
non-immunodéprimés. Laboratoire de
Bactériologie-Hygiène Pitié-Salpêtrière
2004.
36. OMS 1997. La stratégie DOTS de lutte
contre la tuberculose.
37. OMS 2004. TB/VITT: manuel Clinique 2004.
210p ISBN: 9241546344.
38. OMS 2006. International standards of
tuberculosis care.
39. OMS 2013. Rapport 2013 sur la lutte contre
la tuberculose dans le monde.
40. Ouédraogo M., Ouédraogo S. M.,
Diagbouga S., Coulibaly G., Achi V., et al. Résistance
simultanée a la rifampicine et a l'isoniazide chez des malades atteints
de tuberculose pulmonaire. RMR-05-2000-17-2-0761-8425-101019-ART65.
41. Rittaco V., et Isabelle N. Zoonotic
tuberculosis in Latin America. J. Clin. Microbiol 1992 ;
30:3299-3300.
42. Rodrigue S., et Andrej T. La
deuxième vie de la Rifampicine Rev Med Suisse 2014; 10:670-672.
43. Runyon E. H. Anonymous mycobacteria in
pulmonary disease Medclin Am 1959; 43 : 273-290
44. Sangare L., Diande S., Badoum G, et al.
Résistance aux antituberculeux chez les cas de tuberculose
pulmonaire nouveaux ou traités antérieurement au Burkina-Faso.
int j tuberc lung dis 2010, 14(11):1424-1429.
Présenté par TOGDE Gildas le Djimbaye Page 48
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
45. Telenti A., Honoré N., Bernasconi C., et
al. Genotypicassessment of isoniazid and rifampin resistance
in Mycobacterium tuberculosis: a blind study at reference laboratory level.
J ClinMicrobiol 1997; 35: 719-723.
46. Telenti A., Philipp W. J., Sreevatsan S., et
al. The embB operon, a gene cluster of
Mycobacterium tuberculosis involved in resistance to ethambutol.
Nature Med 1997; 3: 567-70.
47. Trébucq A., Anagonou S., Gninafon M.,
Lambregts K., et Boulahbal F. Prévalence de la
résistance primaire et acquise de Mycobacterium tuberculosis
aux antituberculeux au Bénin après 12 ans
d'utilisation des traitements courts. Int. J. tuberc lung dis 1999 ; 3
(6): 466-470.
48. Truffot-Pernot C., et Nicolas V. Tests
bactériologiques de la tuberculose maladie : standards et perspectives.
RMR 2011 ; 28 : 1034-1047.
49. U.S. Department of health and human service, Atlanta
et Georgia. Prevention and treatment of tuberculosis among patients
infected with human immunodeficiency virus: principles of therapy and revised
recommendation. MMWR 1998; 47: 1-58.
50. U.S. Department of health and human service,
Atlanta et Georgia. Management of persons exposed to
multidrug-resistant tuberculosis. MMWR 1992 ; 41:
61-71.
51. WHO 2008. Anti-tuberculosis drug
resistance surveillance. WHO/HTM/TB/2008.394
52. WHO Repport 2009. Global Tuberculosis
Control 2009.
53. WHO. TB country file: Burkina-Faso. Geneva,
Switzerland. WHO/2009. www.apps.who.int/global
atlas/predefinedreports/tb/PDF Files/bfa.pdf Accessed August 2010.
54. Zager E. M, McNerney R.
Multidrug-resistant tuberculosis. BMC Infect Dis 2008; 8: 10.
55. Institut National de Statistique et de
Développement. Recensement de la
population 2008.
Présenté par TOGDE Gildas le Djimbaye Page 49
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
SITES WEB
1.
www.bacterio.cict.fr
2.
wikipedia.org/wiki/Mycobacterium
3.
www.masantefacile.com
Tuberculose dans le monde 2012
4.
www.fares.be Transmission de la
tuberculose
5.
http://www.infectiologie.com/site/medias/JNI/JNI13/posters/2013-JNI-N-17
De la tuberculose à la tuberculose multi
résistante : Revue des cas déclarés au CHU d'Amiens de
1996 à 2008
6.
http://www.theunion.org/what-we-do/journals/ijtld/non-english-versions/french-issn-1815-8439/article/Jonsson2012janvp4fr.pdf
(consulté 20novembre2014) Le diagnostic moléculaire de la
tuberculose multirésistante améliorera-t-il le devenir des
patients ?
7.
http://www.wikiburkina.net/2014/10/23/tuberculose-le-nombre-de-cas-superieur-aux-estimations-precedentes-oms/(consulté
23-10-2014)
8.
http://tpetuberculose.wordpress.com/type/quote/
(consulté le 14-01-15)
9.
www.european-lung-foundation.org
10. www.wikipedia/mycobacteriumtuberculosis
Présenté par TOGDE Gildas le Djimbaye Page i
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
ANNEXES
Présenté par TOGDE Gildas le Djimbaye Page ii
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
ANNEXE I : GUIDE D'ENTRETIEN DE MISE EN TRAITEMENT
Dans le cadre de la prise en charge du malade tuberculeux,
l'entretien de mise en traitement est une étape fondamentale qu'il ne
faut pas négliger. L'adhésion du patient au traitement sera
très grandement influencée par cet entretien. Il faut donc qu'il
soit bien mené.
LES OBJECTIFS
Les objectifs à atteindre au cours de cet entretien se
situent à trois niveaux :
l'agent de santé ;
le malade ;
la famille du malade.
Au niveau de l'agent de santé
L'agent de santé chargé du traitement devra
être capable :
d'identifier avec précision son malade : identité,
antécédents, lieu de résidence etc...
de s'informer des préoccupations du patient,
de s'informer sur la perception que le malade a de sa maladie,
de connaître l'itinéraire thérapeutique du
patient,
d'identifier un ou des parents du malade à contacter en
cas de besoin,
de susciter une expression libre du malade,
d'établir une relation de confiance mutuelle entre lui et
le malade.
Au niveau du malade
Le malade devra être capable:
d'expliquer simplement sa maladie,
de donner le mode de transmission,
de préciser la durée du traitement,
d'expliquer la manière de prendre les
médicaments,
de citer quelques effets secondaires du traitement,
de donner les conditions qui conduisent à la
guérison,
de citer les comportements qui peuvent créer les
résistances
de montrer la bonne manière de tousser,
de définir le rôle d'une bonne hygiène de
vie.
Au niveau de la famille
L'accompagnant du malade devra être capable :
Présenté par TOGDE Gildas le Djimbaye Page iii
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
d'expliquer simplement la maladie,
de donner le mode de transmission,
de préciser la durée du traitement,
d'expliquer la manière de prendre les
médicaments,
de citer quelques effets secondaires du traitement,
de donner les conditions qui conduisent à la
guérison,
de citer les comportements qui peuvent créer les
résistances
de montrer la bonne manière de tousser,
de définir le rôle d'une bonne hygiène de
vie.
PRINCIPES DE L'ENTRETIEN
Il faut être méthodique pour ne pas oublier
certains points :
connaissance du patient,
connaissance de la maladie,
connaissance du traitement,
connaissance des conditions d'hygiène,
connaissance du rôle de la famille.
Il faut permettre au malade de parler, savoir l'écouter
et utiliser des termes simples.
CONDUITE DE L'ENTRETIEN
(Avec le malade et son accompagnant)
Accueillir le malade et son accompagnant,
Se présenter,
Identifier le malade,
Donner l'objet de l'entretien,
S'informer sur les préoccupations du malade,
Demander la perception du malade sur la tuberculose,
S'informer sur son itinéraire thérapeutique,
Donner des informations complémentaires ou rectifier
les connaissances du malade sur la tuberculose :
Principaux signes,
Mode de transmission,
Localisation
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Donner des informations sur le traitement :
La gratuité, la durée ;
Le mode délivrance des médicaments;
Les conditions de la prise des médicaments ;
Le suivi (période de contrôle des crachats) ;
Les effets secondaires ;
Les conditions d'une guérison ;
Le rôle de la famille
Donner des informations sur les conditions
d'hygiène,
Donner des informations sur la bonne manière de
tousser,
Demander à l'accompagnant et au malade de
répéter toutes ces informations
Le TDO et les contacts de suivi du traitement doivent
permettre d'évaluer régulièrement ces informations et
les
corriger.
Présenté par TOGDE Gildas le Djimbaye Page iv
ANNEXE II : FICHE DE TRAITEMENT ANTITUBERCULEUX
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
BURKINA FASO
Programme National Tuberculose
FICHE DE TRAITEMENT ANTITUBERCULEUX
N°
NOM
PRENOMS
AGE SEXE
ADRESSE PRATIQUE
CENTRE DE TRAITEMENT
DATE DE DEBUT DE TRAITEMENT
Phase initiale intensive
Régime prescrit et nombre de comprimés RHZ
?RHZE ?SRHZE ?
Nouveau cas Retraitement
(RHZE) S
(RH) Z (RHZE)
RH) = Rifampicine/Isoniazide ; E = Etambutol ;
(RHZE) = Rifampicine/Isoniazide/Pyrazinamide/Etambutol ; S =
Streptomycine
Jour ?
|
Forme de maladie
Pulmonaire Extrapulmonaire
Site
|
|
Type de malade Nouveau _ Rechute _ Echec _ Transfert _ Reprise
après abandon _ Autre (préciser)
|
|
Résultats d'examen des crachats
|
|
Mois
|
Date
|
N° Lab
|
Résultats
|
Poids
|
|
0
|
|
|
|
|
|
2
|
|
|
|
|
|
3
|
|
|
|
|
|
5
|
|
|
|
|
|
Fin de traitement
|
|
|
|
|
|
Mois
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
21
|
22
|
23
|
24
|
25
|
26
|
27
|
28
|
29
|
30
|
31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Phase de continuation
Sérologie VIH et PEC
Présenté par TOGDE Gildas le Djimbaye Page v
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
(RH)
(RH)
Nouveau cas Retraitement
Régime et nombre de comprimés
E
Durée Durée 5 mois
Prise 3 f/sem{lun,Mer, vend} * code
Jour ?
|
MOIS
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
21
|
22
|
23
|
24
|
25
|
26
|
27
|
28
|
29
|
30
|
31
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Présenté par TOGDE Gildas le Djimbaye Page vi
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
ANNEXE III : Algorithme pour le diagnostic de la
tuberculose chez des patients VIH + pris en charge en ambulatoire
(CMA-CHR-CHU)

Amélioration
Traitement contre la TB CTX Evaluation de l'infection
à
VIH
Traitement contre la PCP
Evaluation de
l'infection
à VIH
BAAR+
Patient ambulatoire toussant depuis 2 semaines, mais ne
présentant pas de signe d'alerte *
Absence d'amélioration Ou amélioration
partielle
Recherche de BAAR par microscopie
Réévaluation Amélioration à
la recherche d'une TB
TB
probable
Traitement contre les infections
bactériennes
(Éviter les fluoroquinolones) Evaluation
de
l'infection à VIH CTX
TB improbable - Penser aux autres infections
Radiographie thoracique
Recherche des BAAR
sur
frottisd'expectorations
Evaluation clinique
Amélioration
BAAR-
* On entend par signe d'alerte l'un des signes suivants :
fréquence respiratoire >30/min, fièvre >39 °C,
fréquence des pulsations >120/min et impossibilité de
marchersans aide.

Au niveau CSPS toute PVVIH présentant une toux
>2 semaines et/ ou de BAAR+ à l'expectoration doit être
référée au niveau supérieur
Présenté par TOGDE Gildas le Djimbaye Page vii
Présenté par TOGDE Gildas le Djimbaye Page viii
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
ANNEXE IV : TRAITEMENT ANTIRETROVIRAL CHEZ LES PATEINTS
COINFECTES TB/VIH
|
Situation
|
Recommandation
|
Observation
|
|
CD4
<
50 / mm3
|
1- Mettre en route le traitement anti-TB
2- Débuter les ARV TDF+3TC+EFV* AZT (ou d4T)
+3TC+EFV*
|
Commencer l'administration de l'une des associations d'ARV
ci-dessous 2 semaines après le début du traitement
antituberculeux (si le traitement anti-TB est toléré).
|
|
AZT + 3TC +ABC° d4T + 3TC + ABC°
|
Pour les femmes enceintes** ou pour VIH2
|
|
CD4 entre
50-200/mm3
|
1- Mettre en route le traitement anti-TB
2- Débuter les ARV TDF+3TC+EFV* AZT (ou d4T)
+3TC+EFV*
|
ARV après 15 jours à 2 mois selon l'état
général du patient
|
|
AZT+3TC+ABC° d4T + 3TC + ABC°
|
Pour les femmes enceintes** ou pour VIH2
|
|
CD4 entre
200-350/mm3
|
1- Mettre en route le traitement anti-TB
2- Débuter les ARV
|
ARV après la première phase (mêmes
schémas)
|
|
CD4
> 350/ mm3
|
1- Mettre en route le traitement anti-TB
2- Différer les ARV
|
|
* Le dosage d'EFV reste 600 mg/jour pour tous les malades
** EFV est contre-indiqué pendant le premier trimestre de
la grossesse. Si une femme enceinte développe une tuberculose au
deuxième ou troisième trimestre, on peut prendre en compte un
régime avec EFV.
O En cas d'allergie à ABC, on peut utiliser la NVP avec
une surveillance des transaminases en raison du risque
d'hépatotoxicité (surveillance après 2, 4, 8, 12 semaines
et après s'il y a des symptômes d'hépatite).
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Présenté par TOGDE Gildas le Djimbaye Page ix
ANNEXE V. Photos des appareils utilisés dans le diagnostic
moléculaire

Photo 1a : Hotte laminaire de la salle d'extraction et de culture
[CNLAT 2014]

Photo 1b : Hotte laminaire de la salle pre-pcr[CNLAT
2014]
Photo 2 : Thermocycler GTQ cycler-96 [CNLAT
2014]
Présenté par TOGDE Gildas le Djimbaye Page x
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO
Présenté par TOGDE Gildas le Djimbaye Page xi
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO

Photo 3 : Système du test Xpert TB/Rif[CNLAT
2014]
Présenté par TOGDE Gildas le Djimbaye Page xii
DIAGNOSTIC MOLECULAIRE DU CMTB CHEZ LES PATIENTS A
RISQUE DE TUBERCULOSE
RESISTANTE A LA RIFAMPICINE ET/OU A L'ISONIAZIDE AU
BURKINA-FASO

Photo 4 : bain-marie et le Twin cubator[CNLAT
2014]
| 


