|

UNIVERSITE MARIEN NGOUABI
************
ECOLE NATIONALE SUPERIEURE D'AGRONOMIE ET DE
FORESTERIE
**************
Année : 2021-2022
N° d'ordre
RAPPORT
DE FIN DE FORMATION
Pour l'obtention du diplôme de licence professionnelle en
productions
végétales
Parcours : Phytotechnie et biodiversité Option :
Productions végétales
THEME
ESSAI DE BOUTURAGE DES
INDIVIDUS « PLUS »
DE
THEOBROMA CACAO L.
Présenté et soutenu par : Aymard
KANGA
Maitre de stage : Dr. Chrissy Garel MAKOUANZI
EKOMONO
Maitre-assistant CAMES en Génétique et
Amélioration des Plantes
Directeur scientifique de l'Institut
National de Recherche Forestière.
Table des matières
Dédicace i
Remerciements ii
Listes des figures iii
Liste des tableaux iv
Liste des abréviations v
Présentation de la structure d'accueil :
l'Institut national de Recherche Forestière
(IRF) vi
I. Création et statut vi
II. Ressources vi
III. Missions vi
IV. Départements vii
V. Domaines de compétences viii
VI. Organigramme de l'Institut national de Recherche
forestière viii
VII. Services à la communauté x
Introduction 1
Contexte et justification 1
Problématique 1
Objectif principal 2
Objectifs spécifiques 2
CHAPITRE I : REVUE BIBLIOGRAPHIQUE 3
I.1. Historique et répartition du cacaoyer 3
I.2. Description 4
I.3. Importance et usages 5
I.4. La reproduction du matériel végétal
6
I.5. Influence de la feuille et de l'aoutement de la tige sur
l'enracinement des
boutures du cacaoyer 6
I.6. Les facteurs qui conditionnent l'enracinement des boutures
7
CHAPITRE II : MATERIEL ET METHODES 8
II.1. Présentation du milieu d'étude 8
II.1.1. Localisation et situation géographique du milieu
d'étude 8
II.1.2. Aperçu de la pépinière de l'IRF
8
II.1.3. Climat 9
II.2. Matériel 10
II.2.1. Matériel végétal 10
II.2.2. Matériel technique 10
II.3. Méthodes 11
II.3.1. Préparation du substrat 11
II.3.2. Préparation des graines 12
II.3.3. Mise en place du 1er Dispositif
expérimental et ensemencement 12
II.3.4. Suivi et entretien des semis 13
II.3.5. Etude de cas n°1 : Bouturage sur pied mère
hors sol 14
II.3.6. Etude de cas N°2 : Bouturage classique 15
II.3.6.1. Première situation : Boutures à tige
verte 15
II.3.6.2. Deuxième situation : Boutures à tige
brune (aoutées) 16
II.4. Traitement et analyse des données 18
Chapitre III : Résultats et Discussion 21
III.1. Résultats 21
III.1.1. Bouturage hors sol 21
III.1.2. Bouturage classique 22
III.1.2.1. Première situation : Boutures à tige
verte 22
III.1.2.2. Deuxième situation : Boutures à tige
brune (aoutées) 24
III.2. Discussion 26
III.2.1. Bouturage hors sol 26
II.2.2. Bouturage classique 26
II.2.2.1. Première situation : Boutures à tige
verte 26
II.2.2.2. Deuxième situation : Boutures à tige
brune (aoutées) 26
Conclusion et perspectives 28
Références bibliographiques 29
Annexes 31

Dédicace
Le présent rapport est dédié principalement
à :
> Mon père ITAMBALA Joël
> Ma mère KANGA Christelle
> Mon grand-père MAVOUNGOU Joseph
> Ma Tante maternelle KANGA Rosly
> Ma grand-mère KANGA Guillaumette
> Toute la famille KANGA
En réalité ce travail est le fruit de vos efforts
et je ne s'aurai passé par là sans vous rendre hommage.
II
Remerciements
Arriver jusqu'ici a été une expérience de
travail acharné, de sur quoi je ne s'aurai passé par là
sans pourtant exprimer les sentiments de ma profonde gratitude. A ce fait, je
tiens à remercier le Directeur de l'Ecole Nationale Supérieure
d'Agronomie et de Foresterie en sigle ENSAF le Professeur Parisse
AKOUANGO pour ses conseils et ses motivations durant le long du
parcours.
Mes remerciements vont à l'endroit du Docteur
Victor KIMPOUNI, Directeur Général de l'Institut
national de Recherche Forestière de m'avoir permis d'intégrer
cette structure pour y effectuer mon stage de licence.
Je suis en quête des mots pour remercier le
Docteur Chrissy Garel MAKOUANZI EKOMONO, Maitre-assistant
CAMES en Génétique et amélioration des plantes, Directeur
scientifique de l'Institut national de Recherche Forestière de m'avoir
accepté, orienté et encadré jusqu'à la
réalisation de ce document ; mes remerciements ne pourront pas atteindre
votre grand coeur d'enseignant, de conseiller, car vous étiez
présent avec moi du début jusqu'à la fin de mon stage.
Durant mes trois années passées au sein de
l'établissement, plusieurs enseignements m'ont permis d'acquérir
des connaissances capitales à ma formation et les personnes qui ont
été à l'oeuvre de ces disciplines étaient
extraordinaire dans la transmission de leur savoir.
J'exprime mes remerciements au Docteur Alain Mercier BITA pour
sa contribution massive à ma formation et son amour infini envers les
étudiants.
Je désire aussi remercier le Docteur François
MANKESSI de sa façon de travailler avec les étudiants dans la
perspective des exposés sur PowerPoint.
Je tiens à remercier profondément mes tuteurs de
stage pour votre rigueur sur le terrain car cela m'a permis de me
découvrir moi-même, je cite : Noémy LOUBAKI, Nestoroi
MPOUKI, jules NKOUNKOU, Kevin MANGANE et Jobercia MOULAMBI.
iii
Listes des figures
Figure 1 : Organigramme de l'IRF ix
Figure 2 : Répartition mondiale de la
culture du cacaoyer. Source : (Loor-solorzano, 2007) 3
Figure 3 : Cacaoyer cultivé 5
Figure 4 : Milieu d'étude (source Google
Earth) 8
Figure 5 : Parc à pied mère 8
Figure 6 : Aire d'enracinement 9
Figure 7 : Aire d'acclimatation 9
Figure 8 : Diagramme ombrothermique de la ville
de Brazzaville (source : ANAC, 2020) .... 10
Figure 9 : 1(phase de chauffage de la terre
noire), 2(phase de mélange), 11
Figure 10 :
A (Nettoyage des graines dans la solution fongique) ; B
(Graines dépourvues du
mucilage et de l'enveloppe externe) 12
Figure 11 : Dispositif expérimental 1 en
binôme de culture 13
Figure 12 : Pulvérisation d'un produit
phytosanitaire 13
Figure 13 : 1 (pied front au stade 4 feuilles)
; 2 (pied étêté) ;
3 (réaction du pied front après 15 jours)
; 4 (repiquage des boutures récoltées
au niveau des bourgeons terminaux) ; 5
(serre de propagation sous tunnel) 14
Figure 14 :
Approche de la récolte des boutures : A (Pied
front au stade 4 feuilles), B (Bouture récoltée
avec apex), C (Pied dépourvu de la partie apicale),
D (Bouture post-
Apicale avec cotylédons) 15
Figure 15 : Repiquage des boutures dans les
caissettes noires 16
Figure 16 : Dispositif expérimental sous
tunnel de propagation 17
Figure 17 : Dispositif expérimental 2
18
Figure 18 : Bouture verte enracinée avec
apex sous tunnel de propagation 21
Figure 19 : a (bouture enracinée avec
cotylédons), b (bouture enracinée avec apex). 24
Figure 20 : Corrélations entre l'aptitude
à l'enracinement et la dimension des boutures 25
Figure 21 : A (cabosses de cacao), B (plantules
de cacaoyer) 31
Figure 22 : Vue du dispositif
expérimental 31
Figure 23 : Etêtage des plants 32
Figure 24 : Entretien des plants 32
iv
Liste des tableaux
Tableau 1: Différentes unités de
recherche (UR) de chaque département scientifique
fonctionnel de l'IRF vii
Tableau 2: Matériel utilisé 10
Tableau 3 : Effet du groupe
génétique sur l'enracinement obtenu avec le modèle 4 21
Tableau 4 : Résultats du test de
Scheirer-Ray-Hare sur l'enracinement obtenu avec le
modèle 2 22
Tableau 5 :
Résultats du test de Scheirer-Ray-Hare sur l'enracinement
obtenu avec le
modèle 3 22
Tableau 6 :
Résultats du test de Scheirer-Ray-Hare sur l'enracinement
obtenu avec le
modèle 1 23
Tableau 7 : Comparaison de l'enracinement entre
les groupes génétiques 23
Tableau 8 : Comparaison du potentiel
d'enracinement des parties 23
Tableau 9 : Influence de l'hormone sur
l'enracinement 23
Tableau 10 : Résultat du test de
Scheirer-Ray-Hare sur l'enracinement obtenu avec le
modèle 3 24
Tableau 11 : Comparaison des parties
repiquée sur l'enracinement 25
Tableau 12 : Comparaison du traitement hormonal
sur l'enracinement 25
V
Liste des abréviations
IRF : Institut national de Recherche
Forestière
UR : Unité de Recherche
ORSTOM : Office de Recherche Scientifiques et
Technique Outre-Mer
ANAC : Agence Nationale d'Aviation Civile
DDL : Degré de liberté
SCE : Somme des carrés des
écarts
H : Statistique de test
Long : Longueur
Diam : Diamètre
Nr : Nombre de racine
vi
Présentation de la structure d'accueil :
l'Institut national de Recherche
Forestière (IRF)
I. Création et statut
o Loi n°23-2012 du 24 septembre 2012 portant
création de l'Institut national de Recherche Forestière ;
o Établissement public administratif à
caractère scientifique, doté de la personnalité morale et
de l'autonomie financière.
II. Ressources
o Subventions de l'Etat ;
o Prestations de l'Institut ;
o Contributions du fonds de soutien à la recherche
scientifique ;
o Dons et legs.
III. Missions
L'Institut de Recherche Forestière a pour missions :
o D'organiser, de conduire et d'exécuter toute
recherche fondamentale et appliquée visant la promotion du
développement forestier durable ;
o Mettre en oeuvre une programmation scientifique autour des
axes prioritaires pour le développement du pays ;
o Effectuer des expertises scientifiques dans son champ de
compétence ;
o Participer à la valorisation des résultats de
ses recherches et de son savoir-faire ;
o Contribuer à l'élaboration de la politique de
recherche dans les domaines relevant de sa compétence ;
o Apporter son concours à la formation, à la
recherche et par la recherche ;
o Publier et diffuser les résultats de ses travaux et
concourir au développement des connaissances et de l'information
scientifique.
VII
IV. Départements
Au sein de l'Institut national de Recherche Forestière,
nous comptons deux (2) groupes de départements à savoir : les
départements fonctionnels et les départements non
fonctionnels.
Pour les départements fonctionnels de l'IRF, nous citons
les départements suivants :
o Sylviculture et dynamique forestière ;
o Amélioration génétique ;
o Valorisation des produits forestiers non ligneux ;
o Changement climatique et implication sur les ressources
forestières ;
o Ecologie Forestière
o Technologie du Bois
o Environnement et Société
Pour les départements non fonctionnels de l'IRF, nous
citons les départements suivants :
o Entomologie et Phytopathologie Forestière
o Economie et Société Rurale
Les départements scientifiques fonctionnels sont
structurés en unités de recherche. Le tableau 1 présente
les différentes unités de recherche par département
Tableau 1: Différentes unités de
recherche (UR) de chaque département scientifique fonctionnel de
l'IRF
N°
|
Départements
|
Unités de recherche (UR)
|
1
|
Sylviculture et
Dynamique Forestière
|
UR 11 : Connaissance et fonctionnement des
écosystèmes
forestiers
UR 12 : Dynamique et fonctionnement des plantations
forestières
UR 13 : Dynamique des systèmes agroforestiers
|
2
|
Amélioration Génétique
|
UR 21 : Arboriculture fruitière
UR 22 : Caractérisation de la diversité
génétique des essences forestières
UR 23 : Multiplication végétative des essences
à reproduction sexuée complexe
|
3
|
Valorisation des
Produits Forestiers
|
UR 31 : Caractérisation et valorisation des arbres
fruitiers
sauvages
|
|
VIII
Non Ligneux
|
UR 32 : Caractérisation des PFNL d'origine animale et
végétale
|
4
|
Changement
Climatique et
Implication sur les
Ressources
Forestières
|
UR 41 : Extrêmes climatiques et fonctionnement des
écosystèmes forestiers
UR 42 : Impacts des activités anthropiques sur les
écosystèmes forestiers
|
5
|
Environnement et
Société
|
UR 51 : Arbres et foresterie urbaine
UR 52 : Biens et services environnementaux
|
6
|
Ecologie Forestière
|
UR 61 : Diversité faunistique des
écosystèmes forestiers
UR 62 : Diversité et structure des peuplements dans
les
écosystèmes forestiers
|
7
|
Technologie du Bois
|
UR 71 : Caractérisation physiques et mécaniques
du bois des essences forestières
UR 72 : Caractérisation chimique du bois des
essences
forestières
|
|
V. Domaines de compétences
L'IRF opère dans plusieurs domaines dont nous pouvons
citer :
o L'aménagement forestier ;
o La sylviculture ;
o L'agroforesterie ;
o La génétique forestière ;
o La technologie du bois ;
o Les produits forestiers non ligneux ;
o La conservation et gestion de la biodiversité ;
o Le changement climatique ;
o L'environnement.
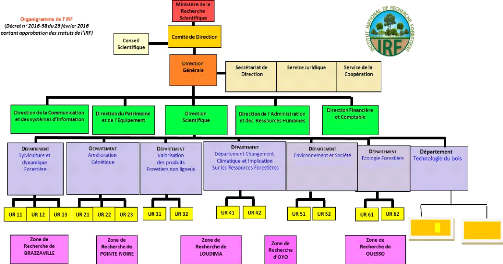
VI. Organigramme de l'Institut national de Recherche
forestière
L'institut national de Recherche Forestière est
administré par un comité de direction et géré par
une direction générale. Il dispose de deux organes consultatifs :
le conseil scientifique et le conseil d'établissement ; le comité
de direction de l'IRF est l'organe délibérant sur l'orientation
de la politique de
recherche de l'institut, le programme annuel
d'activités, le budget, les statuts, les rapports d'activités, le
programme des investissements, les règlements intérieurs et
financiers, les comptes administratifs et financiers, les mesures de
redimensionnement de l'institut, etc.
La direction générale de l'IRF, outre le
secrétariat de direction, le service juridique et le service de la
coopération, comprend (figure 1) :
La direction scientifique ;
La direction de l'administration et des ressources humaines ;
La direction financière et comptable ;
La direction du patrimoine et de l'équipement ;
La direction de la communication et des systèmes
d'information ;
Les zones de recherche.
UR 71
UR 72
ix
Figure 1 : Organigramme de l'IRF
X
VII. Services à la communauté
Les services de l'IRF à la communauté sont :
o Appui à la mise en place des
pépinières forestières ;
o Appui à la mise en place des forêts
communautaires ;
o Production des semences ;
o Lutte contre les érosions hydriques ;
o Etude d'impact environnemental et social ;
o Contribution à la mise en oeuvre des plans
d'aménagement forestier.
1
Introduction
Contexte et justification
Le cacaoyer est une plante tropicale très ancien qui
était cultivé par les Mayas en Amérique centrale et au
Mexique bien avant la découverte du Nouveau Monde par les Espagnols en
1502 (Mossu, 1990). Quelques chiffres illustrent l'évolution de la
production mondiale de cacao depuis presque deux siècles. En 1830, 10
000 tonnes de cacao sont produites en totalité en Amérique
tropicale (Jagoret, 2011). En 1900, la production mondiale de cacao atteint 115
000 tonnes dont 17% proviennent d'Afrique. En 1964, elle atteint 1 528 000
tonnes dont 78 % sont produites en Afrique. Mais après avoir
été pendant des siècles exclusivement américaine,
la cacaoculture est aujourd'hui devenue principalement africaine. Actuellement,
la production africaine de cacao est évaluée à 2,6
millions de tonnes pour une production mondiale de cacao qui oscille entre 3,4
et 3,7 millions de tonnes (Jagoret, 2011). Cultivé principalement pour
ses fèves qui entrent en industrie, la cacaoculture joue plusieurs
rôles majeurs dans l'économie des principaux pays africains
producteurs de cacao tels que : procurer des devises au pays, contribuer au
budget de l'Etat et fournir un revenu aux populations rurales qui en vivent,
c'est dans cette optique que la cacaoculture a été introduite en
République du Congo où l'on observait les premières
plantations à Cayo (sud du Congo) dans le Kouilou (Lecomte et Chalot,
1897).
Problématique
Après plusieurs années de contribution à
la production mondiale, le Congo peine à se relever suite aux
perturbations de l'environnement socio-politique qui a entrainé un
freinage au niveau du cycle de production cacaoyère. Dans le contexte de
la diversification de l'économie nationale, le Congo compte relancer la
cacaoculture sur le territoire national. Depuis 2014, les organisations de la
société civile et les collectivités ont
réalisé des diagnostics et des concertations dans la
région de la Sangha, afin d'identifier les problématiques
prioritaires d'intérêt général inscrites dans le
plan national de développement de la production de cacao (2014-2018). Un
cercle de réflexion et d'action regroupant les représentants des
6 bassins de production (Sembé, Souanké, Ngbala, Mokéko,
Pikounda et Pokola) et les pouvoirs publics ont été
créé afin d'émettre des recommandations relatives à
l'augmentation
2
de la production et à l'amélioration de la
qualité du cacao. Ainsi la relance de la cacaoculture est
confrontée à un problème de la quantité et de la
qualité du matériel végétal afin de satisfaire la
demande des producteurs locaux en vue de maximiser les rendements. C'est dans
cette problématique que cette étude propose d'essayer le
bouturage des individus « plus » de Theobroma cacao L. pour
l'obtention de plants de qualité et productif à des âges
physiologiques différents et des milieux variés au sein de la
pépinière.
Objectif principal
Expérimenter deux (02) techniques de bouturage sur le
cacaoyer.
Objectifs spécifiques
o Bouturer différents descendants d'individus «
plus » par la technique de bouturage classique ;
o Bouturer différents descendants d'individus «
plus » par la technique de bouturage sur pied mère hors sol.
Structure du rapport
Ce présent rapport s'articule comme suit : Après
l'introduction, s'ensuit la revue bibliographique, la méthodologie qui
expose la démarche observée, les résultats et la
discussion, enfin la conclusion et les perspectives.
3
CHAPITRE I : REVUE BIBLIOGRAPHIQUE
I.1. Historique et répartition du cacaoyer
Le cacaoyer est originaire d'Amérique centrale, c'est
une espèce diploïde (2n = 20) de la famille des
sterculiacées. Parmi la vingtaine d'espèces du genre
Théobroma, c'est la seule qui soit cultivée à
grande échelle pour la production de cacao. D'après son histoire,
sa mise en culture remonte au VIe siècle (Eskes et Lanaud,
1997) où les Indiens produisaient une boisson appelée «
cacahuatl » qui était destinée aux dieux et ses fèves
étaient également employées comme monnaie
d'échange. Après la conquête du Mexique par les Espagnols,
les variétés de cacaoyer d'Amérique centrale, les Criollo
ont été introduites dans les Caraïbes, au Venezuela, puis
aux Philippines. Les Forastero bas-amazoniens ou Amelonado d'origine du
Brésil (figure 2), ont été introduits en Afrique en 1822,
à São Tomé, et plus tard au Ghana, au Nigeria et en
Côte d'Ivoire. En Equateur, un type local, le Nacional, a commencé
d'être cultivé à grande échelle au début du
XIXe siècle. Les trinitario sont des hybrides issus des Forastero et des
Criollo, et sont apparus sur l'île de la Trinité vers 1800 (Eskes
et Lanaud, 1997).
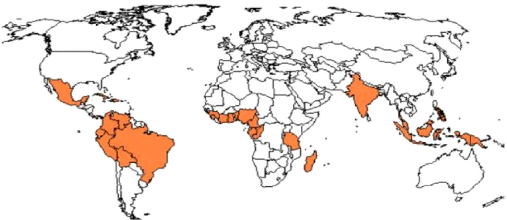
Figure 2 : Répartition mondiale de la
culture du cacaoyer. Source : (Loor-solorzano,
2007)
4
I.2. Description
Le cacaoyer (Theobroma cacao L.) est un arbre
à feuilles persistantes de la famille des Sterculiacées selon la
classification classique, ou des Malvacées selon la classification
phylogénétique. C'est une plante pérenne qui peut
atteindre 25 m de hauteur à l'état sauvage (Soupi-Nkeutcha,
2013).
C'est une plante à système racinaire pivotant,
ayant une graine à germination épigée. Chez l'arbre adulte
issu de semis, le pivot vertical atteint en moyenne 40 à 80 cm de
profondeur. Il est prolongé par plusieurs racines orthotropes qui
peuvent plonger dans le sol jusqu'à 1,20 à 1,50 m (Charrier,
1969). Les graines germent rapidement après leur extraction des cabosses
arrivées à maturité et lorsqu'elles sont mises dans des
conditions favorables d'humidité. La croissance de la tige se poursuit,
ensuite verticalement avec une émission régulière de
feuilles allongées suivant une phyllotaxie 3/8 (Martinez, 2009). Les
feuilles de cacaoyer sont persistantes simple, molles et rougeâtres
à l'état jeune et d'un vert foncé plus tard.
Les fleurs blanches apparaissent sur le tronc des arbres
âgés d'au moins 3 ans. Ces fleurs sont solitaires groupées
en inflorescence, et ont la couleur blanchâtre ou jaunâtre. La
floraison est souvent abondante mais peu de fleurs sont fécondées
et se développent en cabosse environ 5 à 7 mois après la
floraison jusqu'à maturité. La floraison se passe toute
l'année (Ataka, 2013).
La fécondation est entomophile. Le fruit du cacaoyer
est relié au tronc ou aux branches maitresses par un fort et court
pédoncule. Les cabosses présentent une grande diversité de
couleurs de formes et de tailles, qui dépendent de l'origine
génétique de l'arbre et de l'état de murissement du fruit.
Le fruit est une sorte de baie appelée cabosse et les
caractéristiques morphologiques très diverses des cabosses
servaient traditionnellement à classer les populations. Avant
maturité, la cabosse est verte ou rouge - violette, et devient jaune
rouge ou rouge à maturité, l'intérieur de la cabosse mure
contient une pulpe molle blanchâtre, sucrée ou acidulée qui
enrobe les graines (Loor-Solorzano, 2007). Les fleurs, poussant le long du
tronc et des grosses branches donnent entre 10 et 80 fruits communément
appelés cabosses (Figure 3), contenant 20 à 50 fèves
blanches (Kokou et Ngo-Samnick, 2014). La fève du cacaoyer est une
graine sous albumen à deux cotylédons (Charrier, 1969). Le
cacaoyer est une plante à ombre qui exige une température
relativement élevée avec une moyenne annuelle située entre
30-32oau maximum et 18-21° au minimum,
5
une pluviométrie de 1500 à 2000mm d'eau par an
considéré généralement comme la plus favorable.
Figure 3 : Cacaoyer cultivé
I.3. Importance et usages
Le cacaoyer a une importance plus économique dans la
création de plusieurs entreprises. Les fèves de cacao constituent
la matière première d'une importante industrie qui fabrique soit
des produits semi-finis destinés à d'autres industries :
-Pâte de cacao, utilisée en chocolaterie,
biscuiterie, pâtisserie ;
- fondue de cacao, destinée à diverses industries
alimentaires de produits sucrés ;
- beurre de cacao, utilisé en confiserie, chocolaterie,
parfumerie et pharmacie.
Soit des produits finis destinés directement à la
consommation :
- chocolat en poudre ;
- chocolat en tablette ;
- confiserie de chocolat (Mossu, 1990).
Les sous-produits de cette industrie : coques, matières
grasses extraites des coques et des « germes » peuvent être
utilisés pour l'alimentation du bétail, la fabrication
6
d'engrais, les produits pharmaceutiques et la savonnerie.
Aujourd'hui, les cabosses sont utilisées pour la fabrication du charbon
écologique (Mossu, 1990).
I.4. La reproduction du matériel
végétal
Le cacaoyer se reproduit à l'état naturel par
la multiplication générative bien que la multiplication
végétative puisse intervenir par la formation de rejets
orthotropes sur des troncs ou des branches tombés à terre. La
multiplication végétative horticole est réalisée
par bouturage ou greffage d'axes orthotropes et plagiotropes (Eskes et Lanaud,
1997). Aussi, Pound, qui a commencé ses recherches en 1933, a mis au
point une technique utilisant à la fois la greffe et la bouture.
L'enracinement des boutures prises sur les arbres en production réussit
rarement, car il faut choisir ces boutures pour être sûr du
succès. Aussi, est-il plus commode de prendre les boutures des jeunes
plantes (Tissot, 1939). Les boutures plagiotropes mises au champ font l'objet
d'une taille intense au jeune âge pour donner une forme agronomiquement
acceptable aux arbres. Dans certains pays, comme la Trinité, les
agriculteurs laissent former des rejets orthotropes pour ensuite obtenir des
plantes qui ont la forme de semenceaux. Au Cameroun, de sérieux
problèmes d'adaptation au champ ont été observés
avec l'utilisation à grande échelle de boutures plagiotropes
(Eskes et Lanaud, 1997).
I.5. Influence de la feuille et de l'aoutement de la
tige sur l'enracinement des boutures du cacaoyer
Les diverses méthodes de bouturage utilisées
chez le cacaoyer font toutes appel à des fragments feuillés de
tiges semi-aoûtées (Charrier, 1969). Sans feuille en effet, les
boutures ne s'enracinent pas. Avec feuilles, elles se dessèchent si on
les plante à l'air libre. De ce fait, on doit réduire la surface
foliaire des boutures, leur éviter un ensoleillement direct et les
maintenir dans une atmosphère saturée d'humidité. Par
ailleurs, l'utilisation de « boutures vertes » (c'est-à-dire
à tige verte) conduit à de fortes attaques mycéliennes,
tandis que celle de « boutures aoûtées » (à tige
brune) donne un enracinement lent et difficile (Sequier, 1966-1969).
7
I.6. Les facteurs qui conditionnent l'enracinement des
boutures
Parmi les facteurs externes importants affectant
l'enracinement des boutures de cacaoyers figurent la lumière, la
température, l'humidité et les relations air-humidité du
milieu d'enracinement. Les facteurs techniques les plus importants qui
affectent l'enracinement des boutures sont le traitement hormonal (Amoah,
2006). Ces facteurs peuvent influencer le succès de l'enracinement
isolément ou en combinaison les uns avec les autres car il est souvent
impossible de séparer l'effet d'un facteur de l'autre.
L'intensité lumineuse à laquelle l'enracinement se produit
dépend de la température. L'humidité relative dans
l'installation de la propagation est liée à l'intensité
lumineuse et à la température associée. Les effets de
divers milieux sur l'enracinement des boutures sont généralement
étroitement influencés par les relations entre la
température et l'eau (Amoah, 2006).
8
CHAPITRE II : MATERIEL ET METHODES II.1.
Présentation du milieu d'étude
II.1.1. Localisation et situation géographique du
milieu d'étude
Notre étude s'est déroulée à la
pépinière de l'IRF qui se trouve dans l'enceinte de la
cité scientifique de Brazzaville (ex-ORSTOM) (Figure 4) ; et ce dernier
appartient à la réserve de la forêt de la patte d'Oie dont
elle est logée sur un plateau de 309 m d'altitude au sud-ouest de
Brazzaville (15°14' de longitude Est et 4°16' de latitude Sud). Cette
forêt a une superficie de 22,48 hectares.

Figure 4 : Milieu d'étude (source
Google Earth)
II.1.2. Aperçu de la pépinière de
l'IRF
La pépinière de l'IRF est séparée
en trois (3) compartiments qui sont : le parc à pied - mère ;
l'aire d'enracinement ou rhizogenèse et l'aire d'acclimatation.
Le parc à pied mère : Ce
compartiment (Figure 5) renferme les pieds mères hors sol
d'espèces diverses, qui sont des donneurs de bouture.

Figure 5 : Parc à pied mère
9
L'aire d'enracinement ou aire de rhizogenèse :
C'est le compartiment dans lequel séjournèrent les
boutures après leur récolte pour l'enracinement. Il est recouvert
d'une ombrière réduisant à 50% le rayonnement solaire
(Figure 6), le but est de réduire l'évapotranspiration des jeunes
boutures et des plantes.

Figure 6 : Aire d'enracinement
L'aire d'acclimatation : C'est le lieu dans
lequel sont placés les plants d'au
moins deux (2) mois (Figure 7) qui sont sortis de l'aire
d'enracinement.

Figure 7 : Aire d'acclimatation
II.1.3. Climat
Le climat de Brazzaville, est un climat équatorial de
type bas congolais qui règne sur le sud-ouest du Congo (Samba-Kimbata,
1978). Les pluies commencent très faiblement en septembre,
s'établissent en octobre et se terminent en mai tel que
10
nous le montre le diagramme ombrothermique de la ville de
Brazzaville (figure 8) allant de 2009 à 2020 (ANAC, 2020).
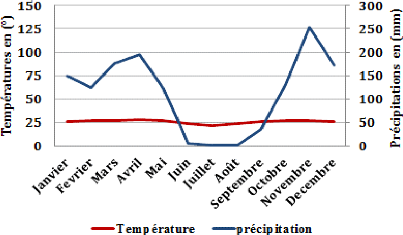
Figure 8 : Diagramme ombrothermique de la
ville de Brazzaville (source : ANAC,
2020)
II.2. Matériel
II.2.1. Matériel végétal
Dans cette étude, le matériel
végétal est constitué de deux groupes
génétiques de cacaoyer : les Trinitario et les Forastero dont les
cabosses provenaient de Kandeko dans la Sangha ; et 100 boutures de cacaoyer
obtenues à partir des pieds front âgés d'au moins deux (2)
ans qui se trouvaient à la pépinière.
II.2.2. Matériel technique
Le matériel technique que nous avons utilisé
à la pépinière est consigné dans le tableau 2
ci-dessous.
Tableau 2: Matériel utilisé
|
Matériel
|
Quantité
|
Usage
|
|
Pulvérisateur à dos (CP15)
|
1
|
-Traiter/Pulvériser les boutures et les plants
|
|
Arrosoir
|
1
|
-Arroser les boutures et les plants
|
|
Caissettes noires
|
7
|
-Repiquer les boutures
|
|
Sachets noirs en polyéthylène
|
100
|
-Mettre en place les pieds mères
|
11
Seaux
|
2
|
-Doser la terre noire et le copeau de bois ; -Transporter de
l'eau
|
|
Ciseaux
|
2
|
-étêter les pieds mères ;
|
|
Pelle
|
1
|
Malaxer le substrat
|
|
Etiquettes
|
12
|
-Préciser les dates de repiquages ; -Différencier
les groupes génétiques
|
|
Plantoir
|
2
|
-ensachage du substrat
|
|
Brouette
|
1
|
-transporter le terreau
|
|
Cuve à stériliser
|
2
|
-stériliser le terreau
|
|
Pied à coulisse
|
1
|
-Mesurer le diamètre des boutures
|
|
Règle graduée
|
1
|
-mesurer la hauteur des boutures
|
|
Hygromètre
|
1
|
-pour mesurer la température et le taux
d'humidité
|
II.3. Méthodes
II.3.1. Préparation du substrat
La terre noire que l'on avait préparée, a
été chauffée à des températures
extrêmes pendant 4heures afin de détruire quelques germes
pathogènes, au lendemain de la stérilisation nous avons
mélangé 75% de terre noire avec 25% de copeau ; sachant que le
seau de 10 L utilisé en pépinière correspondait à
25%.

1
2
3
Figure 9 : 1(phase de chauffage de la terre
noire), 2(phase de
mélange),
3(obtention du substrat)
12
II.3.2. Préparation des graines
Avant de passer au semis, les cabosses ont été
cassées afin de sortir les graines ; et ces graines étaient
plongées dans une solution fongique (4 grammes de mancozèbe 400EC
diluée dans 10L d'eau) pour les prévenir contre les attaques
fongiques (Figure 10 : A). Notons que, nous avons enlevé
complètement le mucilage et l'enveloppe externe pour faciliter
l'entrée rapide en germination (Figure 10 : B).

A B
Figure 10 : A (Nettoyage des graines dans la
solution fongique) ; B (Graines
dépourvues du
mucilage et de l'enveloppe externe)
II.3.3. Mise en place du 1er Dispositif expérimental
et ensemencement
Le dispositif installé en pépinière dans
l'aire de rhizogenèse (serre), fut un dispositif en binôme de
culture (constitué de deux groupes différents) reparti en deux
blocs comme le présente la figure 11, le bloc 1 a été
constitué de 50 phytocells qui contenait 50 graines de Trinitario
à raison d'une graine par phytocell d'une part et d'autre part le bloc 2
qui contenait aussi 50 phytocells et 50 graines de Forastero à raison
d'une graine par phytocell.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sens de
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BLOC1:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P10 P20
|
|
|
|
|
|
|
|
|
|
|
P9 P19
|
|
|
|
|
|
dispositif en binome de cultures
P30 P40 P50
P29 P39 P49
P8 P18 P28 P38
P48 lecture P7 P17 P27
P37 P47 P6 P16
P26 P36
P46 P5 P15
P25 P35
P45 P4 P14
P24 P34
P44 P3 P13
P23 P33
P43 P42 P41 Trinitario
P50 P49 P48 P47 P46
BLOC 2: Forastero Figure 11 : Dispositif
expérimental 1 en binôme de culture
P2
P12
P22 P32
P1 P11
P21 P31
P5 P10 P15 P20
P25 P30 P35
P40 P45 P4 P9 P14 P19
P24 P29 P34
P39 P44 Sens de lecture P3 P8
P13 P18
P23 P28 P33
P38 P43 P2 P7 P12 P17
P22 P27 P32
P37 P42 P1 P6
P11 P16 P21 P26
P31 P36 P41 II.3.4. Suivi et entretien des
semis
Après le semis des graines au sein du dispositif en
binôme de culture à partir du quinzième (15) jour
après levée des premières graines, nous avons
observé une
attaque d'insecte et des champignons au niveau des jeunes
plants puis on a procédé
à un traitement qui s'est effectué en deux
fractions : au niveau de la première fraction, nous avons utilisé
un insecticide à titre curatif ( 2,5 ml du produit dilué dans

10 L d'eau) et après 4 jours s'en suivait une
deuxième fraction dont la pulvérisation s'est effectuée
à base d'un produit fongique dans la même dose que la
première fraction.
13
Figure 12 : Pulvérisation d'un produit
phytosanitaire
14
II.3.5. Etude de cas n°1 : Bouturage sur pied
mère hors sol
Dans le but de former un pied mère hors sol futur
donneur de boutures de cacaoyer, nous avons essayé de transférer
la technique d'obtention du pied mère hors sol de l'eucalyptus chez le
cacaoyer en supprimant l'apex, pour voir la réaction physiologique de la
plante à lever la dormance des bourgeons axillaires. Retenons que nous
avions étêté 30 pieds (soit 15 pieds de Trinitario et 15
pieds de Forastero) ; à partir du quinzième jour après
étêtage, nous avons observé un débourrement au
niveau des bourgeons terminaux et non au niveau de la tige ; puis nous avons
récoltés ces fragments végétaux à raison de
48 boutures (soit 24 boutures de Trinitario et 24 boutures de Forastero) et ces
derniers ont été repiqués avec de l'aloe Vera comme bio
hormone dans une serre de propagation sous tunnel.

4 5
1 2 3
Figure 13 : 1 (pied front au stade 4 feuilles)
; 2 (pied étêté) ;
3 (réaction du pied front après 15 jours)
; 4 (repiquage des boutures récoltées
au niveau des bourgeons terminaux) ; 5 (serre de
propagation sous tunnel)
15
II.3.6. Etude de cas N°2 : Bouturage classique
II.3.6.1. Première situation : Boutures à
tige verte
Cette opération consiste à prélever un
fragment de la plante, le mettre dans les conditions optimales de germination
afin de favoriser la rhizogenèse.
II.3.6.1.1. Critère de sélection
Dans cette étude, le critère de sélection
était de prélever les boutures de cacaoyer sur un pied front hors
sol au stade 4 feuilles. Après la récolte, les boutures furent
immergées dans une solution fongique (mancozèbe) pour
éviter les éventuels risques de contamination. Il sied de
signifier que les boutures utilisées sont issues de la tige principale
de part et d'autre des cotylédons.

C
A
D
B
Figure 14 : Approche de la récolte des
boutures : A (Pied front au stade 4 feuilles),
B
(Bouture récoltée avec apex), C (Pied
dépourvu de la partie apicale), D
(Bouture
post-Apicale avec cotylédons)
16
II.3.6.1.2. Repiquage des boutures
Les boutures récoltées ont été
classées en deux lots : l'un fut repiqué sans hormone et l'autre
avec de l'aloe Vera comme bio hormone de bouturage, elles furent
repiquées dans des caissettes noires à alvéoles amovibles
contenant le substrat ainsi préparé, et placées dans
l'aire d'enracinement pendant 60 jours. Notons que nous eûmes
repiqué 24 boutures de Trinitario (soit 12 boutures repiquées
avec Hormone et 12 boutures sans Hormone) et 24 boutures de Forastero (suivant
la même logique que les boutures de Trinitario) ; avec une moyenne de 24
pieds bouturés dans l'ensemble des blocs du 1er dispositif
expérimental.

Figure 15 : Repiquage des boutures dans les
caissettes noires
II.3.6.2. Deuxième situation : Boutures à
tige brune (aoutées)
II.3.6.2.1. Mise en place du milieu
d'expérimentation pour le deuxième dispositif Un tunnel,
d'une longueur de 3 m sur 1 m de largeur, constitua le milieu de culture des
boutures (figure 16). Pour sa construction, des barres de fer ont
été arquées et piquées à raison de 4 barres
par tunnel. Sur ces barres de fer, il a été disposé des
traverses en fer au nombre de 3 par tunnel. Cet ensemble d'une hauteur de 0,8 m
a été ensuite recouvert par un film plastique translucide. Les
caissettes de pépinière à alvéoles amovible ont
été remplies de substrat et disposés dans le tunnel. Le
tunnel fut disposé sous un abri de pépinière qui a
été constitué d'une charpente de palmes de 2 m de hauteur
qui laissa passer environ 50 % de la lumière totale. Avec le lent
dessèchement des palmes, le passage de la luminosité
extérieure devint progressif jusqu'à 65 %, favorisant
l'acclimatation et l'endurcissement des boutures durant leur
17
développement avec une température qui oscille
entre 27,9°C et 32°C et une hygrométrie de 91 à 95%. Un
modèle d'habillage des boutures a été effectué,
consistant à la réduction de la surface foliaire de
moitié. Chaque bouture comporta quatre feuilles selon sa longueur.
Après l'habillage, les boutures avaient subi 4 traitements avec un
effectif de 100 boutures qui était reparti comme suit :
? 25 boutures avec apex ont été repiquées
avec hormone ; ? 25 boutures avec apex ont été repiquées
sans hormone ; ? 25 boutures sans apex ont été repiquées
avec hormone ; ? 25 boutures sans apex ont été repiquées
sans hormones.

Figure 16 : Dispositif expérimental
sous tunnel de propagation
18
|
|
|
|
|
|
|
|
Traitements des boutures semis
aoutées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
boutures Avec apex
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P1
|
|
P2
|
|
P3
|
|
P4
|
|
P5
|
P1
|
|
P2
|
|
P3
|
|
P4
|
|
P5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P10
|
|
P9
|
|
P8
|
|
P7
|
|
P6
|
P6
|
|
P7
|
|
P8
|
|
P9
|
|
P10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P11
|
|
P12
|
|
P13
|
|
P14
|
|
P15
|
P11
|
P12
|
|
P13
|
|
P14
|
|
P15
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P20
|
|
P19
|
|
P18
|
|
P17
|
|
P16
|
P16
|
P17
|
|
P18
|
|
P19
|
|
P20
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P21
|
|
P22
|
|
P23
|
|
P24
|
|
P25
|
P21
|
P22
|
|
P23
|
|
P24
|
|
P25
|
|
|
|
|
|
|
|
|
|
|
|
Caissette 1: Avec Hormone
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
boutures sans apex
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
caissette 2: Sans Hormone
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P1
|
|
P2
|
|
P3
|
|
P4
|
|
P5
|
P1
|
|
P2
|
|
P3
|
|
P4
|
|
P5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P24
|
|
P25
|
|
|
|
|
|
P6
P7
P8
P9
P10
|
P6
P7
P8
P9
P10
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P11
P12
P13
P14
P15
caissette 3: Sans Hormone
|
|
P11
|
P12
P13
P14
P15
caissette 4: Avec Hormone
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P16
|
|
P17
|
|
P18
|
|
P19
|
|
P20
|
|
P16
|
|
P17
|
|
P18
|
|
P19
|
|
P20
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P24
P25
P21
P22
P23
Figure 17 : Dispositif expérimental 2
P21
P22
P23
II.4. Traitement et analyse des données
Une principale variable d'appréciation a fait l'objet
de notre étude en pépinière, à savoir :
l'enracinement des boutures
Les données recueillies ont été
enregistrées dans le tableur Excel 2013 afin de constituer une base de
données, cette base de données a été
importée dans le
19
logiciel R studio version 4.2.1 où nous avons
utilisé les tests non paramétriques de
Scheirer-Ray-Hare, Kruskal-Wallis et post hoc de Dunn.
Pour le bouturage classique, les modèles
linéaires généralisés appliqués avec le
test
de Scheirer-Ray-Hare sont les suivants :
1ere situation : Boutures à tige
verte
Y= u+ GG+ T+ GGXT+ å (modèle
1)
Y= variable de réponse (nombre de racine)
u : Moyenne générale des observations pour la
variable réponse
GG : Effet du groupe génétique (Trinitario et
Forastero) sur l'enracinement
T : Effet du traitement sur l'enracinement
GGXT : Effet d'interaction groupe génétique X
Traitement
å : Effet résiduel associé à
l'erreur expérimentale
Y= u+ GG+ P+ GGXP+ å (modèle
2)
Y= variable de réponse (nombre de racine)
u : Moyenne générale des observations pour la
variable réponse
GG : Effet du groupe génétique (Trinitario et
Forastero) sur l'enracinement
P : Effet de la partie sur l'enracinement (bouture avec apex
et avec cotylédons)
GGXP : Effet de l'interaction groupe génétique X
Partie
å : Effet résiduel associé à
l'erreur expérimentale
2eme situation : Boutures à tige
brune
Y= u+ T+ P+ PXT+ å (modèle
3)
Y= variable de réponse (nombre de racine)
u : Moyenne générale des observations pour la
variable réponse
P : Effet de la partie sur l'enracinement
T : Effet du traitement sur l'enracinement (avec ou sans
Hormone)
20
P×T : Effet de l'interaction Partie X Traitement å :
Effet résiduel associé à l'erreur expérimentale
Pour le bouturage hors sol le modèle utilisé pour
le test de Kruskal-Wallis est le suivant :
Y : u + GG + å (modèle
4)
Y : variable de réponse (nombre de racine)
u : Moyenne générale des observations pour la
variable réponse
GG : Effet du groupe génétique sur
l'enracinement
å : Effet résiduel associé à l'erreur
expérimentale
Les corrélations de Pearson entre le diamètre des
boutures, leur enracinement, ainsi que leur longueur ont été
déterminées suivant la formule suivante :
?????? (??, ??) ?( ???? - ??) × (????- ??)
???? × ???? ???? × ????
21
Chapitre III : Résultats et Discussion III.1.
Résultats
III.1.1. Bouturage hors sol
L'analyse de l'effet du groupe génétique sur
l'enracinement (Tableau 3) à partir du test de Kruskal-Wallis avec une
p-value = 0.2833 nous montre qu'il n'y a pas de différence significative
entre ces deux groupes génétiques sur l'enracinement.
Tableau 3 : Effet du groupe
génétique sur l'enracinement obtenu avec le modèle 4
Groupe génétique Moyenne racinaire Test
de Dunn
Trinitario 1,21 A
Forastero 0,86 A

Figure 18 : Bouture verte enracinée
avec apex sous tunnel de propagation.
La figure 18 nous montre un aperçu de la bouture
à tige verte enracinée à deux (2) mois
d'expérience, sachant que cette bouture était placée dans
le tunnel de propagation.
22
III.1.2. Bouturage classique
III.1.2.1. Première situation : Boutures à
tige verte
Le test d'hypothèse montre qu'il n'y a pas d'effet
significatif du groupe génétique avec une p-value=0,18821
(Tableaux 4 et 7). Un non-effet de la partie repiquée «
p-value=0,41567 » (Tableaux 4 et 8), et un non-effet de l'interaction
groupe génétique× partie (p-value=0,77573) sur
l'enracinement sont observés.
Tableau 4 : Résultats du test de
Scheirer-Ray-Hare sur l'enracinement obtenu avec
|
le modèle 2
|
|
|
|
|
|
Source de variation
|
DDL
|
SCE
|
H
|
P-value
|
|
Groupe génétique
|
1
|
196,0
|
1,73
|
0,18
|
|
Partie
|
1
|
75,0
|
0,66
|
0,41
|
|
Groupe génétique X Partie
|
1
|
9,2
|
0,08
|
0,77
|
|
Résiduelle
|
44
|
5040,3
|
|
|
Le test de Scheirer-Ray-Hare effectué avec le
modèle 3 nous montre qu'il n'y a pas d'effet traitement
(p-value=0,48902) et d'interaction partie × traitement (p-value=0.94592)
sur l'enracinement (Tableaux 5 et 9).
Tableau 5 : Résultats du test de
Scheirer-Ray-Hare sur l'enracinement obtenu
|
avec le modèle 3
|
|
|
|
|
|
Source de variation
|
DDL
|
SCE
|
H
|
P-value
|
|
Partie
|
1
|
75,0
|
0,66
|
0,41
|
|
Traitement
|
1
|
54,2
|
0,47
|
0,48
|
|
Partie X Traitement
|
1
|
0,5
|
0,004
|
0,94
|
|
Résiduelle
|
44
|
5190,8
|
|
|
Le test de Scheirer-Ray-Hare effectué avec le
modèle 1 montre également un non-effet de l'interaction groupe
génétique × Traitement (p-value=0,51494) sur l'enracinement
(Tableau 6).
23
Tableau 6 : Résultats du test de
Scheirer-Ray-Hare sur l'enracinement obtenu avec le modèle 1
|
Source de variation
|
DDL
|
SCE
|
H
|
P-value
|
|
Groupe génétique
|
1
|
196,0
|
1,73
|
0,18
|
|
Traitement
|
1
|
54.2
|
0,47
|
0,48
|
|
Groupe génétique X Traitement
|
1
|
48,0
|
0,42
|
0,51
|
|
Résiduelle
|
44
|
5022,3
|
|
|
Tableau 7 : Comparaison de l'enracinement entre
les groupes génétiques
Groupe génétique Moyenne racinaire
Signification
Trinitario 0.54 A
Forastero 1.04 A
Tableau 8 : Comparaison du potentiel
d'enracinement des parties
Moyenne racinaire Test de Dunn
Avec apex 0.54 A
Avec cotylédons 1.04 A
Tableau 9 : Influence de l'hormone sur
l'enracinement
Moyenne racinaire Test de Dunn
Avec Hormone 0.96 A
Sans Hormone 0.63 A

a
b
24
Figure 19 : a (bouture enracinée avec
cotylédons), b (bouture enracinée avec apex).
La figure 19 nous présente deux parties du cacaoyer
bouturées, le (a) est une bouture enracinée avec
cotylédons car nous voyons une réaction au niveau des bourgeons
apicaux et le (b) est une bouture enracinée avec apex.
III.1.2.2. Deuxième situation : Boutures à
tige brune (aoutées)
L'analyse de la variance par le test de Scheirer-Ray-Hare
ayant permis de rechercher les effets « Partie » et « Traitement
» sur l'enracinement à 2 mois (Tableau 10) montre qu'il n'y a pas
d'effet significatif au niveau des parties repiquées (P-value= 0,1552),
du traitement utilisé et de leur interaction sur l'enracinement.
Tableau 10 : Résultat du test de
Scheirer-Ray-Hare sur l'enracinement obtenu avec
|
le modèle 3
|
|
|
|
|
|
DDL
|
SCE
|
H
|
P-value
|
|
Partie
|
1
|
100
|
2,02
|
0,15
|
|
Traitement
|
1
|
100
|
2,02
|
0,15
|
|
Partie ×Traitement
|
1
|
100
|
2,02
|
0,15
|
|
Résiduelle
|
96
|
4600
|
|
|
25
Le traitement de données par le test de Dunn vient
confirmer ceux de Scheirer-Ray-Hare, en évoquant qu'il n'y a pas de
différence significative entre les parties repiquées (tableau 11)
et entre le traitement utilisé (Tableau 12).
Tableau 11 : Comparaison des parties
repiquée sur l'enracinement
Moyenne racinaire Test de Dunn
Bouture avec apex 0,04 A
Bouture sans apex 0,00 A
Tableau 12 : Comparaison du traitement hormonal
sur l'enracinement
Moyenne racinaire Test de Dunn
Avec Hormone 0,04 A
Sans Hormone 0,00 A
III.1.2.2.1. Relation entre les variables
étudiées
Cette matrice (figure 20) montre l'existence des
corrélations entre les différentes variables
étudiées. En ce qui concerne la liaison entre la longueur et le
diamètre des boutures, elle est positive, les deux variables sont
significativement corrélées. Entre la longueur et le nombre de
racine, elle est positive mais faible, donc les deux variables sont faiblement
liées. Enfin la liaison entre le diamètre et le nombre de racine
est positive mais presque nulle, ce qui veut dire que les deux variables ne
sont pas liées.
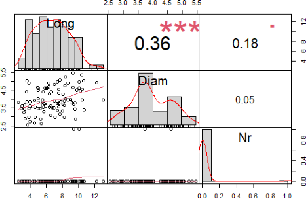
Figure 20 : Corrélations entre
l'aptitude à l'enracinement et la dimension des
boutures
26
III.2. Discussion
III.2.1. Bouturage hors sol
Après avoir récolté puis repiqué
dans le tunnel de propagation les boutures vertes issues des plants
étêtés, l'analyse statistique nous révèle que
le groupe génétique n'a pas d'effet significatif sur
l'enracinement des boutures, notons que lors de l'expérimentation
l'observation faite est que le groupe Trinitario était performant dans
le tunnel de propagation en terme de réaction physiologique avec un taux
de boutures enracinées de 37,5% où l'on observe le
débourrement à partir de deux semaines avec une moyenne racinaire
sensiblement supérieure à celui du groupe Forastero qui peine
à se manifester dans le tunnel de propagation avec un taux de boutures
enracinées de 16,6% et cela peut être dû à
l'environnement qui était saturé d'humidité avec un risque
élevé de contamination par les champignons vue l'âge
physiologique des boutures.
II.2.2. Bouturage classique
II.2.2.1. Première situation : Boutures à
tige verte
Dans cet essai de bouturage sous l'aire d'enracinement, les
boutures avec apex et avec cotylédons n'ont pas eu d'influence
significative ainsi que le traitement sur l'enracinement ; dans ce milieu, nous
avons observé le débourrement à partir de la
quatrième semaine (4), les boutures avec cotylédons
étaient performantes( taux de boutures enracinées avec
cotylédons 29,16%) que les boutures avec apex avec un taux de boutures
enracinées de 20,83%, cela peut être expliqué par le fait
que ces boutures possédaient des réserves cotylédonaires
pour permettre son renouvellement et le groupe Forastero s'exprime mieux dans
l'aire d'enracinement que sous tunnel de propagation avec un taux de 33,33% par
rapport au groupe Trinitario qui a un taux de 16,66%, cela contredit donc
l'observation faite sous tunnel où le groupe Trinitario était
performant par rapport au groupe Forastero cela peut s'expliquer par le fait de
placer les boutures dans différents milieux d'élevage avec des
facteurs environnementaux presque différents.
II.2.2.2. Deuxième situation : Boutures à
tige brune (aoutées)
En ce qui concerne le bouturage classique, les
résultats ont montré que ni le traitement, ni la partie de la
bouture repiquée n'a eu un effet significatif sur l'enracinement des
boutures placées sous le tunnel de propagation, lors de
l'expérimentation des boutures semis aoutées. Nous avons
observé des
27
débourrements des bourgeons à partir de la
quatrième semaine et cela a été observé par Koko et
al. (2011) qui ont également expérimentés le
bouturage classique des clones de cacaoyer sous tunnel de propagation. En effet
ils ont observé sur les clones T60/887, T79/799, Pa150, IFC5, ICS1
l'émission rapide des premières poussées foliaires
à partir de la quatrième (4) semaine avec 12% de boutures
à flushes. Pour Sery et al. (2019) qui ont travaillé sur
l'essai de bouturage du colatier sous tunnel de propagation, ils enregistrent
un taux de mortalité important. Au cours de notre
expérimentation, au stade de cinq semaines, on a enregistré un
taux de mortalité des boutures post apicale (sans apex)
significativement important (60%). En effet, l'excès d'humidité
dans cette serre (hygrométrie max=95%, température max= 32°)
pourrait être un facteur limitant l'enracinement car des observations
similaires ont été évoquées par Amoah (2006) qui
rapporte que la température, l'humidité et le rapport
air-humidité sont les principaux facteurs externes qui influencent
l'enracinement des boutures. Suite au calendrier d'activés, à 2
mois le taux d'enracinement des boutures semis aoûtées est
mitigé ce qui confirme l'hypothèse de charrier (1969) qui
évoque que l'enracinement des boutures aoûtées est lent et
difficile.
28
Conclusion et perspectives
Cette étude expérimentale portant sur «
l'essai de bouturage des individus plus de Theobroma cacao L. » a
été menée dans l'enceinte de la cité scientifique
de Brazzaville sous tutelle de l'Institut national de Recherche
Forestière (IRF) et s'est déroulée à la
pépinière de ladite Institution, avait pour but
d'expérimenter deux techniques de bouturage sur le cacaoyer. Une seule
variable d'appréciation a été étudiée
(l'enracinement) pour l'observation de l'efficacité du traitement, de la
partie et du groupe génétique sur le bouturage. Il ressort de
cette étude que suite à la méthodologie adoptée,
les techniques appliquées ne présentent aucune différence
significative sur l'enracinement des boutures de cacaoyer. Retenons que
même les parties repiquées, les traitements et les groupes
génétiques n'ont pas eu d'effet significatif sur
l'enracinement.
Les recherches devraient se poursuivre pour orienter les travaux
futurs vers :
? La recherche de la bonne période de bouturage ;
? La recherche de l'âge optimum de bouturage ;
? La variation de température et d'humidité dans
différents milieux
expérimentaux ;
? L'utilisation des auxines de synthèse pour
l'amélioration de l'enracinement et
du taux de survie des boutures ;
? La variation du substrat pour l'enracinement des boutures.
29
Références bibliographiques
Amoah F., 2006. Review of vegetative
propagation of cacao (Theobroma cacao L.) by rooted cuttings.2.
Environmental and technical considerations. Ghana Journal of Agricultural
Science 39: 217-226.
Ataka., 2013. Contribution à
l'installation et conduites de la pépinière. Mémoire de
master, Ecole Nationale Supérieure d'Agronomie et de Foresterie,
Université Marien Ngouabi, Brazzaville, Congo, 47p.
Braudeau J., 1969. Le cacaoyer. In : Cahiers
d'outre-mer. N°88-22e année, Octobre-décembre.
Pp.438-439.
Charrier A., 1969. Contribution à
l'étude de la morphogenèse et de la multiplication
végétative du cacaoyer (Theobroma cacao L.). Café
Cacao Thé, Paris, France,13,2, 103-105.
Eskes A et Lanaud.,1997. Le cacaoyer. In
: L'amélioration des plantes tropicales. CIRAD-ORSTOM,
pp141-170.
Gervais M., 1981. Greffage du cacaoyer en
fente terminale. Café Cacao Thé 25 : 55-59.
Jagoret P., 2011. Analyse et
évaluation de système agroforestiers complexes sur le long terme
: Application aux systèmes de culture à base de cacaoyer au
centre Cameroun. Thèse de doctorat, Sup Agro, Montpellier, 263p.
Koko L., Koffi N., Konan A., 2011.
Multiplication végétative du cacaoyer sous tunnel
plastique. Journal of Applied Biosciences 46: 3124-3132.
Kokou E. et Ngo-Samnick L., 2014. Production et
transformation du cacao. Pro-Agro, Cameroun, 44p.
Leconte H. et Chalot C., 1897. Le cacaoyer et
sa culture. Georges Carré et C. Naud. Paris, France, 120p.
Loor-Solorzano R., 2007. Contribution
à l'étude de la domestication de la variété de
cacaoyer Nacional d'Equateur : Recherche de la variété native et
de ses ancêtres sauvages. Thèse de doctorat en Sciences
Agronomiques, Sup agro, Montpellier, France,201p.
30
Martinez M., 2009. Etude comparative des
caryotypes de phytophtora megakarya et de phytophtora palmivora
pathogènes du cacaoyer. Mémoire de master «
santé des plants », Montpellier, France, 51p.
Mossu G.,1990. Le cacaoyer. Le technicien
d'agriculture tropicale. Edition Maisonneuve et Larose, Paris, France,82p.
Samba-Kimbata M., 1978. Le climat
bas-Congolais. Thèse de Doctorat 3ème cycle,
Université de Bourgogne, Dijon,280p.
Sequier J., 1966-1969. Travaux non
publiés. Rapports annuels d'activité déposés
à l'ORSTOM et à l'IFCC à Paris
Sery D., Bonsson B., Gnogbo R., Gbedie N., Ouattara
Y., Legnate H., Keli Z., 2019. Influence du génotype et du
nombre de feuilles sur la croissance en pépinière des boutures du
colatier (cola nitida [vent.] Schott Endlicher). International journal
of biological and chemical sciences 13(7) : 3144-3156.
Soupi-Nkeutcha M., 2013. Implication des
arabinogalactanes protéines dans le développement des embryons
chez le Theobroma cacao L. Thèse d doctorat, Faculté des
sciences, Université de Yaoundé, 188p.
Tissot P., 1939. Recherches récentes
sur le cacaoyer à Trinidad. In : Revue de botanique appliquée et
d'agriculture coloniale, 19e année, bulletin n°209,
pp.29-42.
31
Annexes
Quelques illustrations de nos travaux

A
B
Figure 21 : A (cabosses de cacao), B
(plantules de cacaoyer)

Figure 22 : Vue du dispositif
expérimental


Figure 24 : Entretien des plants
32
Figure 23 : Etêtage des plants
| 


