|

B.P. 1825
PROFIL EPIDEMIOCLINIQUE, THERAPEUTIQUE ET EVOLUTIF DE
L'ICTER NEONATAL
(Cas de l'hôpital Sendwe du 01 janvier au 31
décembre 2017)
Par DIANGIENDA MBULU Joseph
Mémoire présenté et
défendu en vue de l'obtention du grade de docteur en
médecine
Aout 2018
I | P a g e

B.P. 1825
PROFIL EPIDEMIOCLINIQUE, THERAPEUTIQUE ET EVOLUTIF DE
L'ICTER NEONATAL
(Cas de l'hôpital Sendwe du 01 janvier au 31
décembre 2017)
Par DIANGIENDA MBULU Joseph
Mémoire présenté et
défendu en vue de l'obtention du grade de docteur en
médecine
Dirigé par : CT Dr KAMONA Lewis
Année Académique : 2016-2018
II | P a g e
PLAN DU TRAVAIL
III | P a g e
INTRODUCTION
PREMIERE PARTIE : PARTIE THEORIQUE CHAPITRE I LA
PHYSIOLOGIE DE LA BILIRUBINE CHAPITRE II DESCRIPTION DE L'ICTERE NEONATAL
II.1. DEFINITIONS
II.2. EPIDEMIOLOGIE
II.3. ETIOPHYSIOPATHOGENIE
II.4. DIAGNOSTIC
II.4.1. CLINIQUE
II.4.2. PARACLINIQUE
II.5. EVOLUTION ET COMPLICATIONS
II.6. MODALITES DE PRISE EN CHARGE
DEUXIEME PARTIE : PARTIE PRATIQUE
CHAPITRE III PRESENTATION DU CADRE DE RECHERCHE
CHAPITRE IV POPULATION D'ETUDE; MATERIELS, METHODES, ET
DIFFICULTES
RENCONTREES
CHAPITRE V PRESENTATION DES RESULTATS
CHAPITRE VI DISCUSSIONS ET COMMENTAIRES
CONCLUSION GENERALE
SUGGESTIONS ET RECOMMENDATIONS
BIBLIOGRAPHIE
ANNEXES
EPIGRAPHE

La sagesse a bâti sa maison, elle a
taillé ses sept colonnes. Elle
a égorgé ses victimes,
mêlé son vin, et dressé sa table.
Proverbe 9 :
1-2
Donne au sage et il deviendra plus sage ; instruit
le juste, et il
augmentera son savoir. Le commencement de la sagesse,
c'est
la crainte de l'Eternel, et la science des saints
c'est
l'intelligence
IV | P a g e
V | P age
DEDICACE
A mes très chers parents,
Aucun mot ne saurait exprimer ma profonde gratitude et ma
sincère reconnaissance envers les deux personnes les plus chères
à mon coeur ! Si mes expressions pourraient avoir quelque pouvoir, j'en
serais profondément heureux. Je vous dois ce que je suis. Vos
prières et vos sacrifices ; votre affection et soutien indispensable
m'ont comblé tout au long de mon existence. Que ce mémoire soit
au niveau de vos attentes, présente pour vous l'estime et le respect que
je voue, et qu'il soit le témoignage de la fierté et l'estime que
je ressens. Je ferai toujours de mon mieux pour rester votre fierté et
ne jamais vous décevoir. Puisse Dieu tout puissant vous procurer
santé, bonheur et prospérité.
A mes très chers et adorables soeurs et
frère : NDAYA MUABANA Annie, NSAMBA pauline,
NZEBA Yonel et MUKENDI
Kevin
Vous savez que l'affection et l'amour fraternels que je
vous porte sont sans limite. Je vous dédie ce travail en
témoignage de l'amour et des liens de sang qui nous unissent.
Puissions-nous rester unis dans la tendresse et fidèles à
l'éducation que nous avons reçue. J'implore Dieu qu'il vous
apporte bonheur, longue vie et vous aide à réaliser tous vos
voeux.
A mon oncle BUKASA MUKENDI Martin
Pour votre assistance tant spirituelle que matérielle,
trouvez à travers ce travail l'expression de mes sentiments les plus
affectueux.
A ma cousine MANYONGA MUTOMBO
Lili
Pour vos encouragements et soutien si indispensables. Que ce
travail soit pour vous le témoignage de mes sentiments les plus
sincères et les plus affectueux.
A la famille du Feu professeur MUSASA
KABOBO
Que ce mémoire soit pour vous le témoignage
de mes sentiments les plus sincères et les plus affectueux
A mes très chers collègues et
amis
FOMBENO KUETA Pascal, KILESHE MWAMBA Zorinho, LUKUMWENA
KALALA Jérôme, KABANGU TSHIBANDA Arsène, ILUNGA KABULO
Michael, KALULUMIA BIMPA Samuel, KINAKIAKU MBOMBI Bienvenu, Dr NVUNZI KANOWA
Gatien, FATUMA USENI Sarah, FANKAM TOUKO Stéphanie, ...
Merci pour les bons moments passés ensemble. Que
chacune et chacun trouve ici l'expression de mon profond attachement. Puisse
Dieu nous assister dans nos projets et guider nos pas dans la future vie
professionnelle active.
A tous mes enseignants du primaire, secondaire et
de la faculté de médecine/ Unilu
Aucune dédicace ne saurait exprimer le respect que
je vous porte, de même que ma reconnaissance pour tous les sacrifices
consentis pour mon éducation, mon instruction et mon bien être.
Puisse Dieu, tout puissant vous procurer santé bonheur et longue
vie.
VI | P a g e
REMERCIEMENT
Marquant la fin de notre parcours au deuxième cycle
à la faculté de médecine ; ce travail, fruit de notre
bagage intellectuel, est pour nous une occasion de remercier tous ceux qui, de
près ou de loin ont participé à son élaboration et
à notre formation car dit-on : rien de ce qui est grand ne peut
être l'oeuvre d'une seule personne. Nous ne sommes que les
héritiers de nos précédents, les
bénéficiaires de nos contemporains car la connaissance n'a jamais
été l'apanage d'un seul peuple.
En cela, nous rendons d'abord hommage à la sainte
trinité Dieu le père, le fils et le saint esprit, papa Simon
KIMBANGU KIANGANI, source de notre inspiration et de toute connaissance pour la
réalisation de ce travail.
Nous tenons à remercier sincèrement le docteur
C.T KAMONA, qui en tant que
directeur de mémoire, s'est toujours montré
à l'écoute et très disponible tout au long de sa
réalisation et sans qui ce mémoire n'aurait jamais vu le jour.
Ainsi que pour l'inspiration, l'aide et le temps qu'il nous a
consacré.
Nous témoignons de même notre gratitude au Feu
professeur MUSASA KABOBO, à toutes les autorités
académiques de l'UNILU en général et
particulièrement à celles de la faculté de médecine
pour leurs savoir qu'elles nous ont inculqué et qui font de nous
aujourd'hui finaliste du deuxième cycle.
D'une façon spéciale, nous remercions grandement
nos parents et toute notre grande famille, nous sommes fiers d'être
né de vous et profiter de votre affection. Et dans cette même
perspective, que nos ainés et camarades scientifiques qui nous ont
accueillis et encadré à la faculté tout comme au stage
trouvent ici notre reconnaissance.
Nous serions ingrats si nous omettions de
réitérer notre attachement indéfectible aux compagnons et
amis du savoir pour leur esprit d'équipe, de compatir avec nous dans
toute notre vie estudiantine, nous citons notamment :
DIANGIENDA LOHOSO Joseph, KABEZYA MUGANZA Pierrette, et
KALOMBO KALOMBO Joseph.
Ce travail est le couronnement de notre parcours scientifique.
Etant une oeuvre humaine, Il n'a donc pas la prétention d'être
parfait. Nous remercions tous ceux qui ont contribué à sa
réalisation.
VII | P a g e
TABLE DES MATIERES
Plan du travail I
Epigraphe II
Dédicace ..III
Remerciements .V
Liste des tableaux .VIII
Liste des figures ..IX
Sigles et abréviations X
Résumé XI
Introduction 1
Chapitre I Physiologie de la bilirubine .2
I.1. Le métabolisme normal de la bilirubine
(physiopathologie de l'ictère néonatal) 2
I.1.1. Etape pré-hépatique : synthèse de la
Bilirubine 2
I.1.2. Etape hépatique: conjugaison 3
I.1.3. Etape post-hépatique: élimination 3
I.2. Particularités du métabolisme de la
bilirubine en période néonatale 4
Chapitre II Description de l'ictère néonatal ..5
II.1. Définitions ..5
II.2. Epidémiologie 5
II.3. Etiophysiopathogenie .6
II.3.1. Les ictères
à bilirubine non conjuguée : hyper bilirubinémie à
prédominance indirecte.6
Les facteurs favorisant et aggravant l'hyperbilirubinemie
7
II.3.2. Les ictères à bilirubine conjuguée ou mixte
avec prédominance de bilirubine directe .10
II.4. Diagnostic 15
II.4.1. Clinique 15
II.4.2. Paraclinique 17
II.5. Evolution et Complication de l'ictère 18
II.6. Modalités de prise en charge 19
II.6.1. Prise en charge préventive 19
II.6.2. Prise en charge thérapeutique 20
II.6.2.1. traitement de l'ictère à bilirubine
indirecte 20
a. Traitement non médicamenteux . 20
b. Traitement médicamenteux 25
VIII | P a g e
c. Traitement adjuvant 26
II.6.2.2. traitement de l'ictère à bilirubine
directe 27
a. Traitement médicamenteux .27
b. Traitement chirurgical 27
Chapitre III Présentation du cadre de travail . 28
III.1. Situation géographique et organisation
administrative .....28
III.2. Organisation technique 28
III.3. Organigramme de l'hôpital 30
Chapitre IV Population d'étude ; matériels,
méthodes, et difficultés rencontrées .. 31
IV.1. Population d'étude ..31
IV.2. Matériels et Méthodes 31
IV.3. Difficultés rencontrées . 31
Chapitre V Présentation de résultats .. 32
Chapitre VI Discussions et commentaires . 54
VI.1. La fréquence de l'ictère néonatal
54
VI.2. Caractéristiques socio démographiques
....55
VI.3. Caractéristiques cliniques . 55
VI.4. Caractéristiques para cliniques 58
VI.5. Traitement . 59
VI.6. Caractéristiques évolutives
d'hospitalisation 60
Conclusion générale 61
Suggestions et recommandations 63
Biographie 64
Annexe 68
Fiche de récolte 68
Quelques figures .70
LISTE DES TABLEAUX
Tableau I : Principales causes d'ictère indirect chez
le nouveau-né .7
Tableau II : Principales causes d'ictère direct chez le
nouveau-né et le nourrisson 11
Tableau III : Les valeurs normales de la bilirubinémie
.. 17
Tableau IV : risque du nouveau-né par rapport à
l'âge gestationnel . 20
|
Tableau V : Indications de photothérapie et
d'exsanguino-transfusion selon le taux de
|
|
bilirubine et le poids de naissance
|
25
|
|
Tableau VI : Répartition des patients selon l'âge
maternel
|
35
|
|
Tableau VII : Répartition des patients selon les
Infections génito-urinaire
|
37
|
|
Tableau VIII : Répartition Selon l'APGAR
|
..41
|
|
Tableau IX : Répartition Selon le poids de naissance
|
42
|
|
Tableau X : Répartition Selon l'âge d'apparition de
l'ictère
|
..43
|
|
Tableau XI : Répartition Selon les facteurs de risque
|
45
|
|
Tableau XV : Répartition des patients selon les signes
associés
|
47
|
|
Tableau XVI : Répartition Selon le type d'ictère
|
...50
|
|
Tableau XVII : Répartition Selon l'évolution
|
....52
|
|
Tableau XVIII : Répartition Selon le séjour
|
.. 53
|
IX | P a g e
X | Page
LISTE DES FIGURES
Figure 1 : le métabolisme de la bilirubine 2
Figure 2 : images de photothérapie classique et
intensive . 21
Figure 3 : Courbes de référence de la
bilirubinémie pour les indications de la photothérapie
intensive . 23
Figure 4 : Courbes de référence de la
bilirubinémie d'exsanguinotransfusion . 25
Figure 5 : la fréquence intra hospitalière de
l'ictère néonatal 32
Figure 6 : Répartition selon le sexe 33
Figure 7 : Répartition selon la commune de
résidence .. 34
Figure 8 : Répartition des selon le suivi des CPN .
36
Figure 9 : Répartition selon la maturité
38
Figure 10 : Répartition selon les
antécédents d'ictère néonatal dans la fratrie
...39
Figure 11 : Répartition Selon le type d'accouchement
40
Figure 12 : Répartition Selon le mode d'alimentation
44
Figure 13 : Répartition Selon l'étiologie 46
Figure 14 : Répartition selon le groupe sanguin
maternel et néonatal ...48
Figure 15 : Répartition Selon le rhésus maternel
et du nouveau-né . 49
Figure 16 : Répartition Selon la prise en charge 51
LISTE DES ABBREVIATIONS
AAP : Académie Américaine de Pédiatrie
AG : âge gestationnel
ATCD : antécédent
BC : Bilirubine conjuguée
BGT : bilirubine glucuronyl-transférase
BI : bilirubine indirecte
BNC : Bilirubine non conjuguée
BSS : bosse séro-sanguine
BT : Bilirubine totale
BTC : bilirubinometre transcutané
CHU : centre hospitalier universitaire
CPN : Consultations prénatales
ECBU : examen cytobactériologique des urines
ET : écart type
EST : Exsanguinotransfusion
G6PD : Glucose-6-phosphate déshydrogénase
HPM : Hépatomégalie
HTA : hypertension artérielle
IFME : Incompatibilité foeto-maternelle
érythrocytaire
IUG : Infection Urogénitale
LA : Liquide Amniotique
LCR : Liquide céphalo-rachidien
RCIU : retard de croissance intra-utérin
RH : rhésus
SA : semaine d'aménorrhée
XI | P a g e
XII | P a g e
RESUME
Les nouveau-nés présentent très souvent
une hyper bilirubinémie se manifestant par un ictère. Bien que
physiologique, celui-ci peut relever des étiologies variées des
significations différentes au point de devenir pathologique, avec le
risque des complications neurologiques ou être témoin d'une
affection grave dont la rapidité du diagnostic et de prise en charge
conditionne la chance de succès.
Le but de ce travail est d'analyser les
caractéristiques épidemiocliniques, thérapeutiques et
évolutives des nouveau-nés ictériques hospitalisés
au service de néonatologie de l'hôpital général de
référence Jason Sendwe entre janvier et décembre 2017.
Nous avons mené une étude descriptive
transversale dont la récolte de données s'est faite de
manière rétrospective. L'exploitation des dossiers s'est faite
à partir d'une fiche pré établie et a permis le recueil
des données concernant les parturientes, le déroulement de la
grossesse et de l'accouchement, la date d'apparition de l'ictère chez le
nouveau-né, son étiologie présumée, les pathologies
qui lui sont associées, le traitement prescrit et l'évolution
Résultats : 236 cas d'ictère néonatal ont
été enregistrés parmi 1001 nouveau-nés
hospitalisés pendant cette période soit une fréquence
hospitalière de 23.57 %. Une prédominance masculine a
été notée avec 53%. L'ictère était
précoce dans 9,36% des cas. L'asphyxie périnatale, les bosses
sero-sanguineson et la prématurité constituent les principaux
facteurs de risque dans notre série. L'ictère était
physiologique dans 51,27% des cas ; les étiologies sont dominés
par l'infection néonatale dans 24.15%, et l'incompatibilité
foeto-maternelle dans 13,56%(rhésus dans 3.81% et ABO dans 9.75%). La
fièvre est apparue dans 25.42% des cas, la pâleur dans 7.20%, les
selles décolorés dans 1.69% et l'hépatomégalie dans
0.42% des cas. L'antibiothérapie et la photothérapie ont
constitué l'essentiel de la prise en charge. Aucune
exsanguino-transfusion n'a été réalisée.
L'évolution a été marquée par le
décès dans 7.63% des cas. La durée d'hospitalisation
moyenne était de 10.89 #177; 6.20 jours.
Conclusion : Malgré l'évolution favorable de
l'ictère dans la majorité des cas, il reste un symptôme
fréquent à risque de complications graves nécessitant une
prise en charge dans des structures de néonatologie
spécialisées et une prévention grâce au renforcement
du
programme de consultation prénatale et post-natale.
1 | P age
INTRODUCTION
Le nouveau-né traverse lors de ses premiers jours de vie
une période de vulnérabilité. En effet, il doit
réaliser une série d'ajustements fonctionnels,
métaboliques, respiratoires et circulatoires destinés à
autonomiser les grandes fonctions vitales, c'est la période d'adaptation
à la vie extra-utérine. Parmi les fonctions à maturation
essentiellement postnatale avec un ajustement dans les premiers jours de vie,
figure le métabolisme de la bilirubine.
Les nouveau-nés présentent très souvent
une hyper bilirubinémie se manifestant par un ictère (coloration
jaune des téguments et des muqueuses), un phénomène
fréquent puisqu'il concerne 60 à 80% des nouveau-nés mais
le plus souvent transitoire [1-3]. L'absence des complications et
l'évolution spontanément favorable dans la majorité des
cas peuvent conduire à sa négligence. [4]
C'est pourquoi, bien que physiologique, l'ictère
néonatal ne doit pas pour autant être négligé. Il
mérite une attention particulière car il peut relever des
étiologies variées des significations différentes au point
de devenir pathologique, exposant ainsi l'enfant à des complications
neurologiques ou être témoin d'une affection grave dont la
rapidité du diagnostic et de prise en charge conditionne la chance de
succès. [5]
La prise en charge soulève des problèmes, vu que
les moyens sont très limités dans un pays à faible revenu
comme le nôtre.
Le diagnostic étiologique de certitude reste difficile
parce qu'il existe une gamme d'examens para cliniques dont la plupart sont
irréalisables.
Nous avons décidé dans le cadre de ce travail,
de faire un état de lieu concernant les aspects
épidemiocliniques, thérapeutiques et évolutifs de
l'ictère néonatal dans notre milieu.
Ce travail est une étude réalisée dans le
service de pédiatrie, unité de néonatologie de
l'hôpital provincial de référence Jason Sendwe, de la
période allant du 01 janvier au 31 décembre 2017.
Nous avons retenu tout nouveau-né présentant un
ictère cutanéomuqueux soit au moment de l'admission, soit au
cours de l'hospitalisation. Nous avons comme objectifs :
? General : contribuer à la connaissance sur
l'ictère néonatal
? Spécifiques :
y' Déterminer la fréquence intra
hospitalière de l'ictère néonatal.
y' Décrire les caractéristiques
épidémiologiques, cliniques, thérapeutiques et
évolutifs de l`ictère néonatal dans notre milieu.
Notre travail est subdivisé en deux parties : la
première est théorique et comprend les
généralités sur l'ictère ; la seconde est pratique
et traite des données, fruits de notre travail.
2 | P age
CHAPITRE I PHYSIOLOGIE DE LA BILIRUBINE
I.1. LE METABOLISME NORMAL DE LA BILIRUBINE
(PHYSIOPATHOLOGIE DE L'ICTERE NEONATAL)
Pendant la vie intra utérine, la bilirubine produite
par le foetus est conjuguée et épurée par le foie de la
mère. A la naissance, quelques jours sont nécessaires pour que
les mécanismes d'épuration propres du nouveau-né
parviennent à équilibrer la production de pigment. Alors, il y a
une accumulation de bilirubine entraînant un ictère cutané,
muqueux et conjonctivale et une hyper bilirubinémie. [6-7]

Figure 1 : le métabolisme de la bilirubine
[3]
I.1.1. ETAPE PRE-HEPATIQUE : SYNTHESE DE
LA BILIRUBINE
Dans le système
réticulo-endothélial :
Les globules rouges vivent en moyenne 120 jours, ce qui
signifie qu'ils doivent être détruits et remplacés par de
nouveaux au bout de cette période. Cette destruction se fait par les
macrophages qui se trouvent dans les capillaires de la rate, du foie et de la
moelle osseuse. Ces cellules phagocytaires ont pour rôle de capturer les
microorganismes indésirables ou les vieilles cellules, de les englober
et de les digérer. Le rôle des macrophages est donc de
débarrasser le sang des globules rouges vieillis. Il semble que des
modifications au niveau de la membrane cytoplasmique dues au vieillissement de
ces globules rouges réduisent leur souplesse de sorte qu'ils restent
immobilisés dans les capillaires de la rate par exemple (qui
3 | P a g e
joue ainsi le rôle de filtre) permettant ainsi aux
macrophages de les distinguer des plus jeunes et de les phagocyter. Une fois le
globule rouge englobé par le macrophage, sa membrane est
digérée de telle sorte que l'hémoglobine soit
libérée et aussitôt dégradée en ses
constituants de base par les enzymes de dégradation du macrophage. On
obtient alors deux composants : de la globine et le groupement hème.
Ainsi, les acides aminés résultant de la dégradation de la
globine sont envoyés dans le sang afin d'être
réutilisés par les cellules de l'organisme, l'hème est
ensuite dissocié en deux composants : fer et porphyrine. Le fer est
transporté sous forme lié à des protéines
(ferritine, hémosidérine) dans le sang et mis en réserve
dans les cellules du foie ou de la rate où il peut également
servir à la production de nouveaux globules rouges dans la moelle
osseuse. La porphyrine se transforme en biliverdine, étape ou intervient
l'enzyme hème-oxydase puis en bilirubine grâce à une
réductase. La bilirubine est déversée dans le secteur
vasculaire.
Dans toutes les situations aggravant l'hémolyse
(maladies hémolytiques néonatales immunologiques, rhésus,
ABO, ou constitutionnelles telle que le déficit en G6PD) cette
production est accrue et les ictères sont souvent intenses. Certains
facteurs augmentent l'activité de l'hème oxydase : situations de
carence calorique et/ou de stress (stress oxydatif post anoxique,
hyperinsulinisme, jeûne, endotoxine bactérienne...). (Voir les
facteurs favorisants ou aggravants l'ictère).
Dans le secteur vasculaire :
La molécule de bilirubine non conjuguée,
insoluble dans l'eau, se lie de manière équimolaire à
l'albumine pour être transporté vers le foie, elle est dite alors
liée (en opposition à la forme dite libre). Lorsque le potentiel
de liaison de l'albumine pour la bilirubine est dépassé, la
bilirubine peut se fixer sur les graisses tissulaires dont celle du
système nerveux central et entrainer l'ictère
nucléaire.
1.1.2. ETAPE HEPATIQUE: CONJUGAISON
Dans le foie :
Au niveau des hépatocytes, la bilirubine se fixe
à des ligandines (protéines Y et Z, déficientes aussi chez
le nouveau-né). Puis elle est « conjuguée »par l'acide
glycuronique qui est un produit intermédiaire du cycle de Krebs ; et
devient hydrosoluble donc excrétable grâce à la
glucuronyltransférase.
1.1.3 ETAPE POST-HEPATIQUE: ELIMINATION
Dans l'intestin :
La bilirubine conjuguée est transformée par les
enzymes bactériennes de la flore bactérienne, (qui colonise le
tube digestif du nouveau-né de manière progressive) en une
série
4 | P a g e
de dérivés, les urobilinogènes. La plus
grande partie de ces urobilinogènes est éliminée dans les
matières fécales après avoir été
transformée en stercobilinogène puis en stercobuline (expliquant
la couleur marron des selles). Une petite partie est réabsorbée
puis éliminée dans les urines sous forme d'urobiline (coloration
jaune). Il existe un cycle enterohépatique : la bilirubine
conjuguée est en partie déconjuguée sous l'action de la
glucuronidase (enzyme produite par le tube digestif, et contenue dans certains
laits maternels) et réabsorbée au niveau de la muqueuse
digestive, cela contribue à entretenir un taux élevé de
bilirubine sanguine. Ce cycle enterohépatique est majoré dans
toutes les situations de retard d'émission de méconium.
Dans les situations pathologiques de cholestase, la
réduction du flux biliaire (au niveau des voies extra hépatiques,
intra hépatiques, ou au niveau cellulaire) entraîne une
augmentation dans le sang de la bilirubine directe, normalement
excrétée dans la bile.
I.2. PARTICULARITES DU METABOLISME DE LA BILIRUBINE EN
PERIODE
NEONATALE
? Production augmentée de bilirubine en
période néonatale
Dans les premiers jours de vie, la production de la bilirubine
est augmentée. Celle-ci est le reflet d'une polyglobulie physiologique
chez le nouveau-né associée à une durée de vie
diminuée des érythrocytes, mais aussi de l'activité
importante de l'hème oxygénase (proportionnellement huit fois
plus concentrée chez le nouveau-né que chez l'adulte). La
production de bilirubine chez un nouveau-né est estimée à
8,5 mg/kg/24 h, soit deux à trois fois plus élevée que
chez l'adulte (1 g d'hémoglobine fournit 35 mg de bilirubine). [6-7]
? Elimination diminuée de la bilirubine en
période néonatale
A cette production augmentée s'ajoute une
élimination diminuée de la bilirubine dans les premiers jours de
vie impliquant une conjugaison hépatique diminuée du fait : y' de
l'immaturité hépatique : on a une diminution de la captation
hepatocytaire de la bilirubine (déficit en ligandine) et un
déficit des systèmes de conjugaison notamment de la
glycuronyl-transférase dont l'activité débute après
la naissance et dépend de la qualité et de la quantité
d'alimentation;
y' d'une augmentation du cycle entéro-hépatique
(aggravée par le jeûne) : l'absence de la flore bactérienne
ne permet pas la transformation de la bilirubine conjuguée en
urobilinogène, celle-ci est réabsorbée et
deconjuguée [8];
y' et d'une élimination digestive diminuée :
résultant d'une motilité intestinale peu
active, le nouveau-né s'alimentant peu pendant les
premiers jours de vie.
[6-7,9]
5 | P a g e
CHAPITRE II DESCRIPTION DE L'ICTERE NEONATAL
II.1. DEFINITIONS
L'ictère est la coloration jaune des téguments,
qui apparaît à partir d'un taux de bilirubinémie
supérieures à 50-70 ìmol/l (3-4,2 mg/dl).
L'ictère précoce du nouveau-né est celui
qui apparait avant 24 heures de vie
L'ictère prolongé du nouveau-né : c'est
l'ictère persistant à plus de 10-15 jours de vie. Chez
un nouveau-né à terme, eutrophique et persistant au-delà
de trois semaines pour le nouveau-né prématuré ou de petit
poids [6].
Contrairement à l'adulte, l'ictère du
nouveau-né est, dans l'immense majorité des cas, à
bilirubine (BR) indirecte (attention à ne pas reproduire la confusion,
hélas fréquente et désastreuse de sens, entre les termes
« BR indirecte » et « BR libre »).
II.2. EPIDEMIOLOGIE
L'ictère est de très loin le plus
fréquent des symptômes observés à la période
néonatale. Souvent « physiologique », l'ictère est un
symptôme dont la signification clinique reste en règle difficile
à appréhender.
Il est délicat d'évaluer l'incidence vraie de
l'ictère du nouveau-né en raison des difficultés de
définition.
L'OMS a estimé, en 2007 que plus de 80% des
prématurés et 50% des nouveaux nés à terme
présentent l'ictère néonatal [10].
En France l'incidence n'est pas connue
précisément. Elle est estimée à 60% chez les
nouveau-nés à terme (90% chez le prématuré).
Environs 6-10% des nouveau-nés à terme ont une
bilirubinémie > 220 ìmol/l. Au Royaume Uni, en 2001,
l'incidence est de 5,5/1000 naissances d'ictère sévère
(Bilirubinémie supérieure à 350ìmol/l). 174 cas
d'ictères nucléaires ont été recensés aux
USA (1/100 000 naissances) et le même chiffre d'incidence est
avancé en Europe. L'incidence des cholestases néonatales est
estimée à 1/2500 naissances.
Au Bénin, des taux de 32% d'ictère
néonatal ont été trouvé dans une population des
nouveaux nés hospitalisés [11].
Au Maroc, les mêmes valeurs qu'en France avec 60% chez
les nouveaux nés à terme et 90% chez les prématurés
[12].
L'expérience du CHU Mohammed VI de Marrakech en 2009 a
trouvé une incidence de 25% d'ictère néonatal dans une
population des nouveaux nés hospitalisés [5].
6 | P a g e
Aux cliniques Universitaires de Lubumbashi (RDC) en 2010 des
taux de 17.7% de l'ictère néonatal ont été
trouvé dans une population des nouveaux nés hospitalisés
[13].
II.3. ETIOPHYSIOPATHOGENIE
On distingue deux catégories d'ictères
néonatales, selon la prédominance de l'augmentation sur la
bilirubine non conjuguée ou sur la bilirubine conjuguée
[9,14].
II.3.1. LES ICTERES A BILIRUBINE NON CONJUGUEE :
HYPERBILIRUBINEMIE A PREDOMINANCE INDIRECTE (BILIRUBINE CONJUGUEE < 34
uMOL/L OU 20 MG/L)
C'est la forme la plus fréquente d'ictère
néonatal ; par définition, la bilirubine directe ou
conjuguée ne dépasse pas 34 umol/L (20 mg/L).
Les principales étiologies de l'hyper bilirubinémie indirecte
figurent dans le tableau 1. Les principales entités causant un
ictère indirect sont les suivantes:
1) ICTERE SIMPLE DU NOUVEAU-NE
II est si fréquent qu'il est qualifié de
"physiologique". II résulte de la seule "immaturité" des
processus hépatiques d'épuration de la bilirubine produite en
grande quantité, sans facteur pathologique associé.
II est caractérisé par :
? Sa survenue au 2ème -
3ème jour de vie, et son pic maximal vers le
4ème - 5ème jour ;
? Son caractère isolé cliniquement, "nu" ;
? La nette prédominance de la BNC, et la
négativité du test de Coombs ;
? Sa régression à la fin de la première
semaine, parallèlement à la coloration progressive des urines.
? L'hyper bilirubinémie ne dépasse pas 250
umol/L (146 mg/L) chez l'enfant allaité ou 200 umol/L (117 mg/L) chez
l'enfant nourri artificiellement, quel que soit son âge; elle augmente
à un rythme inférieur à 86 umol/L / 24 heures (50 mg/L/24
heures).
Ces caractères rassurants chez le nouveau-né
à terme sans anomalie viennent à manquer quand s'ajoutent des
facteurs de surproduction de la bilirubine ou des obstacles à son
épuration (on parle alors d'ictère simple « aggravé
»). Au total, l'ictère simple comprend l'excès de production
de bilirubine et le défaut de captation hépatique et de
conjugaison de cette bilirubine. La présence des facteurs favorisants
peut majorer cet ictère simple.
La plupart du temps, aucun traitement n'est nécessaire,
sauf si la bilirubine augmente à un niveau trop élevé, ce
qui est rare (on parle alors d'hyper bilirubinémie néonatale).
Les indications de la photothérapie et de l'exsanguino-transfusion sont
les mêmes que dans le cas d'une maladie hémolytique du
nouveau-né (voir plus loin).
Tableau I Principales causes
d'ictère indirect chez le nouveau-né
Cause d'hyper bilirubinémie non
conjuguée
Ictère physiologique et hyper
bilirubinémie néonatale (très
fréquents)
Ictère au lait maternel (assez
fréquent)
Maladie hémolytique du nouveau-né (assez
fréquente) :
> incompatibilité Rhésus
> incompatibilité ABO
Ecchymoses, hématomes (assez
fréquents)
Polycythémie (assez
fréquente)
Anémies hémolytiques congénitales
(rares) :
> sphérocytose
> déficience en glucose-6-phosphate
déshydrogénase
> déficience en pyruvate-kinase
> thalassémie
Hypothyroïdie (rare)
Sténose du pylore (rare)
Hyperbilirubinémie néonatale transitoire
et familiale (très rare)
Maladie de Gilbert (rare)
Syndrome de Crigler-Najjar (très rare)
LES FACTEURES FAVORISANT ET AGGRAVANT
L'HYPERBILIRUBINE
En cas d'hyper bilirubinémie néonatale à
prédominance non conjuguée, plusieurs facteurs favorisants
peuvent soit majorer un ictère physiologique soit entrainer son
évolution vers un ictère nucléaire [15-16].Ce sont :
> Le jeûne
V' Jl entraine l'hypoglycémie qui
stimule la sécrétion abondante de Glucagon et
d'Epinéphrine augmentant ainsi l'activité de
l'hème-oxygénase.
V' Le manque de glucose pendant le
jeûne entraine le recours aux lipides pour la production de
l'énergie. L'augmentation des acides gras libres circulants qui agissent
comme inhibiteurs compétitifs de la bilirubine au niveau de la
glucuronyl transférase par l'intermédiaire de la Pregnane-3
alpha-20 bêta-diol participe à l'hyper bilirubinémie.
V' Le jeûne aggrave aussi le cycle entero
hépatique.
> Tout facteur de stress (anoxo ischémie,
infection maternofoetale...)
Le stress stimule la sécrétion abondante de
Glucagon et d'Epinéphrine.
> L'asphyxie périnatale qui
entraine le stress et l'acidose (persistance de la perméabilité
du canal d'Arantius, synthèse retardée des enzymes)
> L'hypo-albuminémie, par un
défaut de protéines de transport de bilirubine entrainant
un excès de bilirubine libre qui ne sera pas par
conséquent conjuguée et éliminée. >
L'hyper osmolarité,
7 | P a g e
8 | P a g e
> Le refroidissement (hypothermie),
par l'hypoglycémie et la baisse du métabolisme
de base qu'il entraine avec comme conséquence la baisse
des fonctions de synthèse.
> La prématurité, par
immaturité hépatique
> Le jeune âge (exemple : le
nouveau-né de moins de 24 heures de vie est plus
vulnérable que celui de quelques jours),
> L'acidose, par diminution
affinité de la bilirubine vis-à-vis de l'albumine
sérique.
> Les hématomes ; ecchymose ou bosse
sero-sanguine, par augmentation de la charge
en hémoglobine dégradée. La
résorption entraine un catabolisme accru de l'hème et
donc une augmentation de la bilirubine.
> L'administration de
médicaments qui déplacent la bilirubine de
l'albumine
(exemple : sulfamides, ocytociques...).
> L'antécédent de mère
diabétique : le diabète maternel expose le
nouveau-né à un
risque accru d'hypoglycémie néonatal.
> Nouveau-né avec antécédent
de photothérapie
> Polyglobulie, incompatibilité avec Coombs
positif ou maladie hémolytique
2) ICTERE NEONATAL "AU LAIT DE MERE"
II apparaît vers le 5ème jour de vie
seulement (mais il peut prolonger un ictère simple). II est
isolé. L'hyper bilirubinémie porte sur la fraction non
conjuguée. Elle peut persister plusieurs semaines.
Cet ictère est provoqué par le pouvoir
inhibiteur du lait de certaines femmes sur les mécanismes
d'épuration hépatique de la bilirubine. (Une lipase contenue dans
certains laits maternels, hydrolyse les triglycérides ; les acides gras
libérés agissent comme inhibiteurs compétitifs de la
bilirubine au niveau de la glucuronyl transférase par
l'intermédiaire de la « Pregnane-3 alpha-20
bêta-diol »). Le Lait maternel (surtout le colostrum), contient
beaucoup de bêta-glycuronidase.
Ce pouvoir ne semble s'exercer que sur le foie immature; il
disparait par chauffage du lait à 56°C pendant 15 minutes.
En pratique, si la jaunisse est mal tolérée
psychologiquement par l'entourage ou si l'hyperbilirubinémie est
élevée, on conseille de suspendre l'allaitement pendant 48 heures
; lors de la reprise de l'allaitement au sein, l'hyperbilirubinémie se
stabilise à un palier inférieur, mieux toléré et
moins inquiétant.
3) ICTERE HEMOLYTIQUE PRECOCE
Il est le plus souvent d'origine immunologique
(incompatibilité Rhésus ou ABO). Si ce n'est pas le cas, il faut
rechercher une anémie hémolytique congénitale comme une
sphérocytose :
a) 9 | P a g e
Incompatibilité Rhésus ou
érythroblastose foetale
Son incidence a fortement diminué depuis que les
femmes à risque reçoivent la prophylaxie anti-D. La mère
est Rhésus négative et le foetus Rhésus positif. Le
premier enfant ne peut pas être atteint, sauf si la mère a
été sensibilisée antérieurement, par exemple lors
de l'avortement d'un foetus Rhésus positif, si elle n'a pas reçu
la prophylaxie anti-D. Les formes graves peuvent s'accompagner d'anasarque
Foeto-placentaire, d'hépatomégalie, de
splénomégalie et d'insuffisance cardiaque. L'hémolyse est
plus active que dans le cas de l'incompatibilité ABO. L'ictère
apparaît pendant les premières heures de vie et le taux de
bilirubine augmente rapidement. Une anémie très profonde peut
être présente. Le taux de réticulocytes est
élevé. Le test de Coombs direct est positif, ce qui indique la
présence d'anticorps érythrocytaires. Une hypoglycémie
peut survenir ;
b) Incompatibilité ABO
Elle cause une hémolyse moins active que
l'incompatibilité Rhésus. Habituellement, le groupe sanguin de la
mère est O et celui du foetus A ou B. Le premier enfant peut être
atteint. En général, l'ictère apparaît plus
tardivement et il est moins intense qu'en cas d'érythroblastose foetale.
L'hémoglobine peut baisser et le taux de réticulocytes peut
être élevé. Le test de Coombs indirect est positif, ce qui
indique la présence d'anticorps plasmatiques. Le test de Coombs direct
est négatif ;
c) Anémies hémolytiques
congénitales
Plusieurs de ces anémies peuvent se manifester
dès la période néonatale ; il s'agit surtout de la
sphérocytose, de la thalassémie, de la déficience en
glucose-6-phosphate déshydrogénase et de la déficience en
pyruvate-kinase.
4) LES ENDOCRINOPATHIES :
a) Ictère de l'hypothyroïdie
L'ictère à bilirubine non conjuguée est
l'un des signes classiques de l'hypothyroïdie congénitale ; les
hormones thyroïdiennes sont en effet nécessaires à la
synthèse de l'enzyme glycuronyl transférase.
b) Insuffisance surrénalienne
L'insuffisance surrénalienne entraine
l'hypoglycémie [6].
5) ICTERE DE LA MALADIE DE GILBERT
Il est lié à un déficit partiel de la
glycuronyl transférase ; il s'agit d'une maladie autosomique dominante ;
l'ictère reste modéré en période
néonatale.
6) 10 | P a g e
ICTERE DE LA MALADIE DE CRIGLER NAJJAR :
Il s'agit d'un déficit complet de la
glucuronyltransferase dans la forme du type I, la maladie est
généralement fatale au cours des 15 premiers mois de la vie. Le
déficit est partiel dans la forme du type II, seul viable.
7) LES INFECTIONS GRAVES NOTAMMENT LE SEPSIS ; LES
INFECTIONS URINAIRES... L'infection entraine une hyper
bilirubinémie par deux mécanismes :
? hémolyse par la toxine infectieuse et les radicaux
libres, responsables de la production accrue de bilirubine
? l'acidose métabolique
8) CERTAINES ANOMALIES DU TUBE DIGESTIF (ATRESIE
DUODENALE, STENOSE DUODENALE...)
La Sténose du pylore s'associe rarement à un
ictère non conjugué. Le mécanisme physiopathologique de
cet ictère demeure imprécis. Le jeûne pourrait jouer un
certain rôle. On a rapporté quelques cas de maladie de Gilbert se
manifestant de cette façon.
II.3.2. LES ICTERES A BILIRUBINE CONJUGUEE OU MIXTE
AVEC
PREDOMINANCE DE BILIRUBINE DIRECTE
Ces types d'ictères sont plus rares puisqu'ils
représentent moins de 1% des ictères du nouveau-né.
Néanmoins ils sont toujours pathologiques et doivent faire l'objet d'une
exploration spécialisée en hépatologie pédiatrique.
Leur pronostic dépend de la précocité du diagnostic
étiologique et la sanction est soit chirurgicale soit
métabolique.
La présence d'une hyperbilirubinémie directe
chez un nouveau-né ou un nourrisson indique la possibilité d'une
maladie grave; l'enfant doit donc être dirigé immédiatement
vers un centre spécialisé. Le nourrisson a souvent une coloration
jaune verdâtre. La démarche diagnostique tient compte de
l'ensemble du tableau clinique et des principales causes possibles (tableau
2).
1) INFECTION BACTERIENNE
Elle peut être la cause d'un ictère direct chez
un nouveau-né. Cette étiologie doit surtout être
suspectée si l'enfant présente de la fièvre ou de
l'hypothermie, de la léthargie, de l'anorexie ou une altération
de l'état général. Dans ces circonstances, il est
recommandé de faire des cultures du sang, du liquide
céphalorachidien et de l'urine, puis de traiter l'enfant empiriquement
à l'ampicilline et à la gentamicine pendant 48 heures, jusqu'au
moment où les cultures se révèlent négatives.
Même si aucun des signes et symptômes mentionnés ci-dessus
n'est présent, il est prudent de faire au moins une culture d'urine.
Tableau II : Principales causes
d'ictère direct chez le nouveau-né et le nourrisson
Causes d'ictère à bilirubine
conjuguée
Infections :
V' Infections bactériennes (infection urinaire (E.
coli,...), sepsis)
V' Infections virales et parasitaires
congénitales (cytomégalovirus, Herpès virus, virus de la
rubéole, entérovirus, Toxoplasma gondii et autres)
syphilis
Atrésie des voies biliaires extra
hépatiques
Hypoplasie des canalicules biliaires
intrahépatiques :
V' syndrome d'Alagille (dysplasie
artério-hépatique)
V' syndrome de Zellweger (syndrome
cérébro-hépato-rénal)
V' maladie de Byler
Cholangite sclérosante
Kyste du cholédoque
Syndrome de la bile épaisse (chez le
nouveau-né qui a présenté une anémie
hémolytique)
Hépatite néonatale idiopathique
(hépatite à cellules géantes)
Cholestase du nouveau-né qui a reçu une
alimentation parentérale
Maladies métaboliques; exemples :
V' Galactosémie congénitale
V' Intolérance héréditaire au
fructose
V' Tyrosinémie congénitale
V' Déficience en alpha-1-antitrypsine
V' Fibrose kystique (Mucoviscidose) Maladie de Dubin
Johnson
Maladie de Rotor
2) INFECTIONS CONGENITALES
Il s'agit surtout des infections causées par les
agents suivants : cytomégalovirus, virus de la rubéole,
entérovirus (exemple : Coxsackie), Herpès virus, virus de
l'hépatite B, Toxoplasma gondii, spirochète de la
syphilis. On suspecte ces infections chez tout nouveau-né qui
présente un ictère direct, particulièrement s'il est
associé à une hépatosplénomégalie, à
un purpura thrombopénique, à un retard de croissance
intra-utérine, à une microcéphalie, à des
calcifications intracrâniennes, à des cataractes, à une
cardiopathie congénitale, ou à une atteinte rétinienne. Le
diagnostic repose sur les recherches virales et les épreuves
sérologiques.
3) ATRESIE DES VOIES BILIAIRES EXTRA
HEPATIQUES
Elle doit être à l'avant-plan des
préoccupations chez tout nouveau-né qui présente un
ictère cholestatique, parce qu'une porto-entérostomie
(opération de Kasaï) doit être effectuée le plus
tôt possible (avant l'âge de deux à trois mois) si l'on veut
que les chances de succès soient optimales. Le taux de réussite
de cette intervention est de l'ordre de 90 % lorsqu'elle est effectuée
aux environs de l'âge d'un mois. L'atrésie des voies biliaires est
difficile à différencier de l'hépatite néonatale.
Sur le plan clinique, des selles décolorées suggèrent le
diagnostic d'atrésie des voies biliaires. Il peut y avoir une
hépatomégalie et la consistance du
11 | P a g e
12 | P a g e
foie peut être plus ferme que la normale.
L'échographie du foie est utile, notamment pour exclure un kyste du
cholédoque et pour déterminer si la vésicule biliaire est
présente ou absente. La scintigraphie hépatobiliaire permet de
mettre en évidence l'absence de passage de la bile dans l'intestin. La
biopsie hépatique à l'aiguille complète le bilan. Le
diagnostic de certitude repose sur l'exploration chirurgicale et la
cholangiographie peropératoire. La porto-entérostomie peut se
compliquer d'échecs précoces, d'échecs tardifs ou de
cholangite ascendante ; il peut y avoir une évolution vers la cirrhose
et l'hypertension portale. Lorsque cette intervention se solde par un
échec, le dernier recours est la transplantation hépatique.
4) HEPATITE NEONATALE
Elle peut être due à l'un des agents infectieux
mentionnés plus haut, mais, dans un certain nombre de cas, on ne trouve
aucune étiologie et on parle alors d'hépatite néonatale
idiopathique. Cette entité peut ressembler cliniquement à une
atrésie des voies biliaires et le diagnostic différentiel peut
être difficile (voir plus haut).
5) CHOLANGITE SCLEROSANTE
Elle est caractérisée par une atteinte à
la fois extra- et intrahépatique des voies biliaires donnant une image
en chapelet à la cholangiographie percutanée ou
rétrograde. Elle peut se retrouver de façon isolée au
cours de la période néonatale (cholangite sclérosante
primitive congénitale), en association avec une histiocytose chez le
jeune enfant, ou avec une maladie inflammatoire de l'intestin chez le grand
enfant ou l'adolescent.
6) KYSTE DU CHOLEDOQUE
Il peut se manifester par un ictère obstructif chez le
nouveau-né et le nourrisson, mais aussi chez l'enfant plus
âgé ; ce dernier peut également présenter des
douleurs abdominales. Une masse est parfois palpable dans l'hypochondre droit.
La fonction hépatique peut se détériorer rapidement.
L'échographie met facilement en évidence une dilatation kystique
du cholédoque. Le traitement est chirurgical.
7) HYPOPLASIE DES CANALICULES BILIAIRES
INTRAHEPATIQUES
a) Syndrome d'Alagille ou dysplasie
artério-hépatique
Il se caractérise par un ictère obstructif, un
faciès anormal, une anomalie oculaire « embryotoxon »
postérieur, qui est mise en évidence par l'examen à la
lampe à fente, des anomalies vertébrales, «vertèbres
en papillon » et des malformations cardiovasculaires (exemple :
sténose pulmonaire périphérique). Il y a une hypoplasie
des voies biliaires intrahépatiques et/ou extra hépatiques.
b) 13 | P a g e
Syndrome de Zellweger, syndrome
cérébro-hépatorénal (autosomique récessif)
Mis à part l'ictère, il est
caractérisé par un ensemble de signes dysmorphiques : front haut,
épicanthus et hypoplasie des arcades sourcilières. Les enfants
atteints présentent également une atteinte neurologique grave
(hypotonie, convulsions), des kystes rénaux et des anomalies oculaires
(nystagmus, atrophie optique, opacités cornéennes, glaucome,
cataractes, rétinite pigmentaire et taches de Brushfield). Ce syndrome
est fatal à court terme.
c) Maladie de Byler
Cette affection rare associe un ictère cholestatique,
un retard de croissance staturopondérale, un rachitisme, du prurit et
une stéatorrhée. Le cholestérol sérique est normal,
de même que la gamma-glutamyl-transpeptidase, ce qui est exceptionnel en
cas de cholestase. Une certaine proportion des enfants atteints
présentent une anomalie du métabolisme des acides biliaires
primaires.
8) SYNDROME DE LA BILE EPAISSE
Il doit surtout être suspecté chez le
nouveau-né qui a présenté une anémie
hémolytique grave.
9) CHOLESTASE DU NOUVEAU-NE AYANT REÇU UNE
ALIMENTATION PARENTERALE Il s'agit d'un diagnostic d'exclusion.
10) MALADIES METABOLIQUES
Un grand nombre d'anomalies du métabolisme
intermédiaire peuvent être responsables d'une atteinte
hépatique avec ou sans ictère. En cas d'ictère à
composante directe, les entités suivantes doivent surtout être
prises en considération :
a) Galactosémie congénitale
(autosomique récessive)
Elle peut se manifester peu de temps après que le
nouveau-né commence à boire du lait. Outre l'ictère, les
principales manifestations cliniques possibles sont les suivantes :
altération inexpliquée de l'état général,
vomissements, difficultés alimentaires, irritabilité,
léthargie, convulsions, hépatomégalie,
splénomégalie, hypoglycémie, acidose métabolique,
cataractes, infections, particulièrement causées par des
bactéries à Gram négatif. Les transaminases sont
élevées. Le test de dépistage consiste à rechercher
dans l'urine, au moyen du Clinitest, la présence de sucres
réducteurs autres que le glucose. Le diagnostic de certitude repose sur
le dosage de l'enzyme déficiente dans les globules rouges. En cas de
doute, il faut recourir immédiatement à une alimentation sans
lactose, en attendant le résultat du dosage enzymatique.
L'intolérance Héréditaire au fructose peut se manifester
de façon assez similaire après l'introduction du fructose dans
l'alimentation ;
b) 14 | P a g e
Fructosemie congénitale
C'est une maladie
congénitale/héréditaire interdisant l'absorption de
fructose et des sucres en contenant sous formes polymères (saccharose,
de sorbitol). Elle est liée à un déficit en aldolase B,
enzyme de clivage dans le foie, l'intestin grêle et les reins, du
fructose-1-phosphate en DHAP et en glycéraldéhyde afin de
permettre la suite de la glycolyse en vue de la production d'ATP par la
cellule. L'intoxication arrive habituellement quand l'alimentation est
transférée du lait maternel à l'alimentation
diversifiée [17].
c) Tyrosinémie congénitale (autosomique
récessive)
Sa forme précoce se manifeste au cours des six
premiers mois de vie par un retard de croissance et de développement, de
l'irritabilité, des vomissements, un ictère, une
hépatomégalie, de l'hypoglycémie une atteinte
rénale et une diathèse hémorragique. Des crises
neurologiques peuvent survenir. Les transaminases et
l'alpha-foeto-protéine sont élevées. On note une
augmentation de la succinylacétone dans le plasma et l'urine. Le
traitement consiste en une alimentation pauvre en phénylalanine et en
tyrosine. Malgré ce traitement, l'évolution peut être
défavorable et une transplantation hépatique peut se
révéler nécessaire.
d) Déficience en alpha-1-antitrypsine
(autosomique récessive)
Les homozygotes peuvent présenter un ictère
cholestatique en bas âge, pouvant évoluer ensuite vers la
cirrhose. Le diagnostic repose sur le dosage sérique de
l'alpha-1-antitrypsine et sur la biopsie hépatique. Si le dosage de
l'alpha-1-antitrypsine s'avère bas, le typage de l'inhibiteur de la
protéase est nécessaire. Lorsque l'évolution est
défavorable, une transplantation hépatique peut devenir
nécessaire.
e) Mucoviscidose
Maladie génétique autosomique récessive
qui résulterait du défaut d'expression de la protéine CFTR
au niveau des cellules hépatiques. Elle peut se révéler
par un ictère cholestatique associé parfois à une
décoloration des selles [18]. Elle est éliminée par un
test de la sueur. Des faux négatifs sont fréquents au cours de la
période néonatale, et il n'est pas toujours facile d'obtenir
suffisamment de sueur.
11) MALADIE DE DUBIN JOHNSON
Cette maladie autosomique récessive est
caractérisée par une hyper bilirubinémie conjuguée
observée chez l'enfant et chez l'adulte. L'hyper bilirubinémie
serait due à un défaut de la sécrétion biliaire de
la bilirubine conjuguée. La déficience de la
sécrétion des composés n'est pas limitée à
la seule bilirubine mais implique aussi les oestrogènes
15 | P a g e
conjuguées et les colorants tels la brome-sulfone
phtaléine utilisée comme teste d'exploration
chez les patients atteints de cette maladie [15].
12) MALADIE DE ROTOR
C'est une affection rare avec défaut d'excrétion
de la bilirubine au niveau de la bile
comme dans la maladie de Dubin Johnson,
caractérisée par une hyper bilirubinémie chronique
sans anomalie histologique du foie. Sa cause n'est pas encore
connue mais elle pourrait
résulter d'un défaut de transport y compris de la
bilirubine par les hépatocytes [19].
II.4. DIAGNOSTIC
II.4.1. CLINIQUE
L'interrogatoire porte sur cinq éléments principaux
:
> la date d'apparition de l'ictère
> les antécédents :
Recherche d'une sensibilisation maternelle par contact accidentel
ou médical avec des
produits sanguins (au cours d'avortements ou par des transfusions
sanguines), présence d'un
ictère chez les enfants précédents de la
fratrie ;
> la recherche d'un contexte d'infection materno-foetale ;
> le retentissement de l'ictère sur l'état
général de l'enfant : courbe pondérale, troubles
digestifs
> le mode d'alimentation du nouveau-né.
L'examen clinique analyse surtout trois éléments
:
> l'intensité de l'ictère cutané :
Cette évaluation est dépendante des conditions
d'éclairage (accentuation habituelle par
l'éclairage électrique par incandescence).
L'ictère n'est cliniquement perceptible que si la
bilirubinémie dépasse 70 ìmol/l ; au niveau
des téguments, il progresse de façon centrifuge et
céphalo-caudale. Suivant son intensité, on
distingue :
y' L'ictère discret ou subictère qui doit
être recherché à la lumière du jour au niveau
des muqueuses : conjonctives et muqueuse de la face
inférieure de la langue, qui
correspond à un taux de bilirubine totale compris entre 15
et 30 mg/1.
y' L'ictère franc : quand il touche les mains et les
jambes ; c'est couleur jaune safran,
qui est généralisé aux téguments et
aux muqueuses, qui correspond à un taux de
bilirubine totale supérieur à 30 mg/1.
y' L'ictère très intense : couleur brun
verdâtre au maximum « bronze florentin » qui
s'accompagne d'un taux de bilirubine totale entre 300 et 400
mg/1.
16 | P a g e
Il faut connaître la possibilité d'un
décalage entre l'hyper bilirubinémie et l'ictère, l'hyper
bilirubinémie précède et survit à l'ictère
[20].
> L'aspect des selles (décolorées ou non) et des
urines (claires ou foncées) et
> Le caractère isolé ou accompagné de
l'ictère : hépatomégalie et/ou
splénomégalie, pâleur et/ou hémorragies,
symptômes neurologiques ; un nouveau-né jaune est volontiers
hypotonique.
Trois éléments doivent toujours être tenus
pour pathologiques :
> l'apparition précoce de l'ictère : avant la
12ème heure de vie chez le prématuré et la
24ème heure chez 1'enfant à terme, ou sa prolongation
anormale au-delà de la première semaine de vie chez le
nouveau-né à terme et de la deuxième semaine de vie chez
l'enfant prématuré ;
> la constatation clinique de signes d'accompagnement :
l'ictère n'est pas "nu" ;
> la décoloration partielle ou totale des selles, qui
signe une rétention biliaire.
a. Ictère à bilirubine indirecte
> Ictère survenant pendant les 24 ou 48 heures
après la naissance
> Ictère de conjonctives bulbaires, face et thorax
parfois,
> Pâleur cutanéomuqueuse ;
> Splénomégalie
> Urines claires ; Selles normales
> Fièvre ou non
b. Ictère à bilirubine directe
> Ictère survenant avant 24 heures chez le
nouveau-né à terme et avant 12 heures chez
le prématuré ou soit tardivement ;
> Ictère franc de la tête jusqu'aux pieds ;
> Hépatomégalie ; Splénomégalie
;
> Selles décolorées : selles mastiques; Urines
foncées ;
> Fièvre ou non
c. Ictère à bilirubine mixte
> Englobe tous les signes ci hauts cités.
d. Diagnostic différentiel :
L'ictère doit être différencié des
faux ictères :
> Pâleur jaunâtre de certaines anémies.
> Hypercarotinémie.
Dans ces deux cas, les conjonctives sont de coloration
normale.
17 | P a g e
? Pseudo-ictère picrique apparaissant après
l'absorption d'acide picrique.
II.4.2. PARA CLINIQUE
Seule la mesure du taux de bilirubine par une prise de sang ou
par un flash cutané permet d'en apprécier la gravité
[21-22].
Le bilirubinomètre transcutané
(biliflash)
Apparu dans les années 1980, le bilirubinomètre
transcutané ou BTC est un outil de dépistage non invasif de
l'ictère néonatal. Il ne constitue pas un substitut au
prélèvement sanguin mais permet de les réduire [22].
Le principe du BTC consiste en une spectrophotométrie
par réflexion : le BTC émet de la lumière blanche en
direction de la peau, une partie de celle-ci n'est pas absorbée et est
recaptée sous forme de longueurs d'onde par l'appareil. Plus la peau est
jaune et plus elle absorbe la composante bleue de la lumière blanche. La
différence entre le signal émis initialement et celui reçu
par l'appareil permet de mesurer l'intensité de l'ictère
néonatal. Le dosage sanguin de la bilirubinémie
Valeur de référence en termes de diagnostic et
thérapeutique, le dosage sanguin est le « gold standard » de
la mesure de l'intensité de l'ictère. Différentes
fractions de la bilirubine peuvent être dosées : la bilirubine
libre ou non conjuguée (BNC), la bilirubine
conjuguée (BC) et la bilirubine totale (BT). BT = BNC + BC
Le dosage de chaque fraction de bilirubine permet d'orienter
le diagnostic étiologique de l'ictère néonatal comme nous
l'avons vu précédemment. Un dosage sanguin de la bilirubine
s'interprète toujours en fonction de l'âge de l'enfant en heure
puisque les normes évoluent avec l'adaptation postnatale du
métabolisme de la bilirubine. Celui-ci est exprimé en
ìmol/l ou en mg/dl [7].
Tableau III : Les valeurs normales de
la bilirubinémie (1 ìmol = 0,6 mg), [23].
Age Taux normal de bilirubine totale
A la naissance 0.8 à 2.5 mg /
dl
A la 1ère semaine de vie 2.5
à 12 mg / dl
A la 2ème semaine 1 à
11 mg / dl
A la 3ème semaine 0.6 à
3 mg / dl
A la 4ème semaine 0.3 à
1.5 mg / dl
A partir d'un mois- adulte 0.3 à
1 mg / dl
D'autres examens complémentaires simples sont
indispensables :
? dosage des protides sanguins totaux et, si possible, de
l'albuminémie, ? groupes érythrocytaires de la mère et de
l'enfant,
18 | P a g e
> test de Coombs direct chez l'enfant, > test de Coombs
indirect chez la mère,
> hémogramme et numération des plaquettes et des
réticulocytes.
Les examens complémentaires à réaliser en
fonction du contexte [24]. :
En cas d'ictère à bilirubine indirect :
> Recherche d'anticorps irréguliers maternels
> Marqueurs d'infection (CRP, fibrinogène, pro
calcitonine) > ECBU
> TSH et T4
En cas d'ictère à bilirubine directe ou mixte,
le bilan sera alors complété par :
> Le dosage des enzymes hépatiques (ASAT, ALAT,
Phosphatases alcalines, gamma-GT)
> Echographie du foie et des voies biliaires
> Scintigraphie du foie
II.5. EVOLUTION ET COMPLICATIONS DE
L'ICTERE
L'ictère nucléaire constitue le risque majeur
des hyper bilirubinémies néonatales. En moyenne, 40 % de la
bilirubine dans le sang est liée à l'albumine. La fraction de
bilirubine qui est à la fois non conjuguée et non liée
à l'albumine (bilirubine indirecte) est toxique pour le cerveau :
lorsque son potentiel de liaison à l'albumine est dépassé,
la bilirubine peut se fixer sur les graisses tissulaires dont celle du
système nerveux central. En effet, liposoluble, elle traverse librement
la barrière hémato-encéphalique et se dépose sur
les noyaux gris centraux du cerveau induisant une nécrose cellulaire. Le
calcul de ce potentiel de liaison estime qu'il y a risque de fixation sur le
système nerveux central pour un taux de bilirubinémie totale >
320340 ìmol/l. Chez le nouveau-né prématuré,
hypoalbuminémique, les capacités de transport de la bilirubine
sont affaiblies. Certaines situations (anémie, hypoxie, acidose, faible
âge gestationnel, hypoglycémie, infection bactérienne)
entraînent une altération, fragilisation de la barrière
hématoencéphalique. Cette barrière fonctionnelle repose
sur plusieurs mécanismes cellulaires (diffusion passive, transports
facilités, transports énergétiques dépendants,
bilirubine oxydase intracellulaire...) qui permettent en situation
physiologique de maintenir des taux intracellulaires de bilirubine bas.
Certaines drogues modifient la concentration cellulaire intra
cérébrale de bilirubine (Ceftriaxone, par exemple);
L'immaturité des jonctions cellulaires, de l'expression des
protéines de transport explique la vulnérabilité des
nouveau-nés, d'autant plus s'ils sont nés
prématurément. Il existerait une susceptibilité
individuelle à la bilirubine (variant des protéines de
transport).
19 | P a g e
On parle d'encéphalopathie bilirubinémique aigu
ou d'ictère nucléaire et au stade de séquelles
d'encéphalopathie bilirubinémique chronique [3].
Clinique de l'encéphalopathie
bilirubinémique
Il faut évaluer la conscience, le tonus et le cri.
L'ictère nucléaire se manifeste cliniquement en 3 phases :
1° phase : (lors des premiers jours)
elle est marquée par une stupeur, une hypotonie et une succion
faible.
2° phase : apparait une hypertonie (Avec
attitude en opistotonos) .Tous les enfants qui présentent ce signe
développeront plus tard une encéphalopathie chronique.
3° phase : (après une semaine)
Cette phase est marquée par une disparition de l'hypertonie, paralysie
du regard vers le haut, des crises oculogyres hypertoniques une respiration
périodique apparait à la phase terminal 4% des nouveaux
nés atteints meurent pendant la phase aigüe aux USA.
L'encéphalopathie bilirubinique chronique survient
à long terme vers la première année, en l'absence de
traitement ou lorsque celui-ci intervient trop tardivement, sous forme des
séquelles suivantes : déficits auditifs centraux, trouble du
langage, troubles de la coordination motrice avec paralysie
cérébrale athétosique, une dysplasie dentaire, des
troubles de l'oculomotricité (verticalité du regard), une
ataxie.
II.6. MODALITES DE PRISE EN CHARGE
II.6.1. PRISE EN CHARGE PREVENTIVE
L'AAP a établi en 2004 dix recommandations clés
pour prévenir l'ictère néonatal [25] :
1. La promotion d'un allaitement de bonne qualité
2. L'établissement dans toute unité
néonatale des « protocoles ictères » précisant
en particulier les situations où les puéricultrices peuvent
prélever un dosage de bilirubine sans avis du pédiatre
3. Le dosage plasmatique de bilirubine pour tout
ictère des 24 premières heures de vie
4. L'estimation visuelle de l'ictère est source
d'erreur surtout sur les peaux foncées
5. L'interprétation des taux de bilirubine en fonction
de l'âge post-natal en heures
6. Les enfants nés avant 38 SA en particulier en cas
d'allaitement maternel sont à haut risque d'ictère
sévère
7. La mise en place d'une évaluation rationnelle du
risque d'hyper bilirubinémie sévère avant la sortie
8. L'organisation d'un suivi adapté en fonction de
l'âge de sortie de la maternité et de l'évaluation du
risque d'ictère sévère
9. La délivrance d'une information orale et écrite
« ictère » aux parents
10. L'instauration d'un traitement adapté de
l'ictère dès l'indication posée
En pratique, la prévention de l'ictère à
bilirubine non conjugué passe par :
? Le bon suivis des CPN et dosage des anticorps
irréguliers chez les femmes à risque
pendant la grossesse
? L'administration du vaccin Anti D chez toutes femmes
rhésus négatives en situation de
risque (accouchement, avortement, amniosynthèse, ...) a
fait considérablement régresser la
fréquence de l'affection mettant ainsi en lumière
l'existence d'autres incompatibilités [26]
? In utero : la surveillance des signes d'anémie foetale
par l'échodoppler cardiaque foetale
[transfusion ou exsanguinotransfusion foetale], puis prise en
charge programmée en
post natal
? Eviter les drogues en compétition avec les sites de
fixation de la bilirubine
? Le Dépistage avec la BTC en maternité chez les
nouveau-nés à risques (voir facteurs
favorisants et aggravant l'hyper bilirubinémie)
II.6.2. PRISE EN CHARGE THERAPEUTIQUE
Le choix de la thérapeutique à utiliser est
fonction du taux de bilirubine atteint.
L'usage des courbes est nécessaire pour évaluer le
risque encouru par le nouveau-né.
Tableau IV : risque du
nouveau-né par rapport à l'âge gestationnel
Risque Age gestationnel (AG) Facteurs
aggravant
Faible >38 Non
Moyen 35 à 37 Non
>38 Oui
Elevé 35 à 37 Oui
II.6.2.1. TRAITEMENT DE L'ICTERE A BILIRUBINE
INDIRECTE
a. TRAITEMENT NON MEDICAMENTEUX
Il existe différentes modalités de traitement de
l'ictère selon l'étiologie de l'ictère
néonatal. En raison des progrès techniques, la
photothérapie constitue le traitement de 1ère
intention tandis que l'exsanguino-transfusion représente
celui de dernier recours [7-9].
1. La photothérapie
Elle a été décrite pour la première
fois comme traitement des ictères néonatale en 1958 par
Crémer et coll. [7].
a) principe
Le principe de la photothérapie consiste à exposer
la peau de l'enfant à une lumière de
spectre bleu (spectre 420-490nm) : la bilirubine non
conjuguée présente en sous-cutanée
20 | P a g e
21 | P a g e
absorbe alors l'énergie lumineuse dans cette partie du
spectre induisant sa conversion en photo-dérivés qui pourront
être excrétés directement sans conjugaison hépatique
dans les selles et les urines.
On distingue trois modes de photothérapie :
La photothérapie dite conventionnelle ou
classique, dispensant de l'énergie lumineuse d'intensité
modérée à forte sur une seule face du
nouveau-né,
La photothérapie intensive dispensant
une exposition complète, pluridirectionnelle du nouveau-né avec
un éclairement énergétique intense. La
photothérapie intensive permet une décroissance du taux de
bilirubine plus rapide que la photothérapie conventionnelle (6 à
20% sur 24h dans les ictères non hémolytiques versus 30 à
40%). Le choix du type de photothérapie se fera selon le taux de
bilirubinémie interprété en fonction de l'âge du
nouveau-né et de l'étiologie suspectée.
La Photothérapie maternisée :
dans laquelle il y a une application de la lumière directement sur la
peau grâce à fibres optiques (irradiation d'une surface
limitée de peau, s'adresse à prématurés). Pas de
séparation d'avec la maman ; l'enfant revêt une turbulette
spéciale sur un bilibed (NNAT en suite de couche) ; Pas d'irradiation de
la face (donc pas de protection des yeux) ; Pas de risque d'hypothermie car
nouveau-né habillé ; Pas d'éblouissement pour le personnel
et les parents.

Figure 2 : images de photothérapie classique et
intensive [27].
b) Mode d'action
Le mécanisme d'action consiste en une
photo-isomérisation de la bilirubine non conjuguée en trois
isomères facilement éliminables sous l'action d'un rayonnement
lumineux. Ce processus irréversible transforme la bilirubine en un
isomère structural appelé lumirubine qui sera
excrétée dans la bile et les urines. La lumirubine est
hydrosoluble et possède un pic
22 | P a g e
d'absorption de 453 nm. La photothérapie agit sur la
bilirubine indirecte présente sous l'épiderme à une
profondeur de 2nm [28]. La longueur d'onde la plus efficace pour la
dégradation de la bilirubine au niveau cutané est comprise entre
400 et 520 nm avec un pic à 460 nm (avec une variation de plus ou moins
10 nm). [29] La lumière la plus efficace actuellement est une
lumière bleue. Il existe plusieurs types de lampes utilisées pour
la photothérapie : les tubes fluorescents, lampes halogènes,
système à fibre optique, les diodes électroluminescentes
mais aussi ici chez nous l'exposition au soleil reste d'actualité
[30].
c) Efficacité de la photothérapie
La rapidité d'élimination de la bilirubine non
conjuguée au cours de la photothérapie dépend de trois
grands processus : la rapidité d'altération de la bilirubine par
la photothérapie, le transport des photocomposés hydrosolubles de
la peau vers la circulation sanguine, et l'excrétion de ces
composés par le foie et par le rein. Cette élimination de la
bilirubine dépendra de plusieurs paramètres techniques [31].
> Des quantités spectrales de la lumière
délivrée (longueur d'onde) ;
> De l'intensité de la lumière
> De la surface corporelle exposée ;
> Du taux de bilirubine
> De la durée d'exposition
> De la course de l'hyper bilirubinémie
> De la distance entre l'enfant et la source lumineuse (20
à 30cm) [7].
Plus le taux initial de bilirubine totale plasmatique sera
élevé plus la diminution sera
rapide sous traitement par photothérapie. La cause de
l'ictère intervient également dans l'efficacité de la
photothérapie [32].
d) indications
Les indications de la photothérapie se font sur un
dosage sanguin de bilirubine interprété en heure de vie
post-natale et en fonction des facteurs de risques de toxicité
neurologique aggravé (âge gestationnel, hypo albuminémie,
infection, maladie hémolytique....). On définit ainsi trois
catégories d'indications :
> nouveau-né d'AG>38 SA et sans facteurs de
risque,
> nouveau-né d'AG>38SA avec facteurs de risques
ou si AG = 35-37SA sans facteurs de risques,
> enfin nouveau-né d'AG=35-38SA avec facteurs de
risques.
Les courbes d'indication de traitement de l'American Academy
of Pediatrics 2004 permettent de décider chez le nouveau-né de
plus de 35 SA de l'indication de la photothérapie intensive.
23 | P a g e
En cas de photothérapie conventionnelle, les valeurs
d'indication se situent 50ìmoles/l en-dessous de celles indiquées
sur les courbes.

Figure 3 : Courbes de référence de la
bilirubinémie pour les indications de la photothérapie
intensive
La photothérapie reste par sa facilité d'emploi
le traitement de choix de la majorité des ictères à
bilirubine non conjuguée ; elle a cependant ses impératifs et ses
inconvénients : danger de l'irradiation oculaire, risque d'apnée
....
e) Surveillance du traitement
La surveillance du traitement par photothérapie
consiste en un monitorage continu des fonctions vitales et de la
température. Une protection oculaire est indispensable lors des
séances de photothérapie. En effet, la photothérapie
comporte comme effets secondaires des troubles de la régulation
thermique (hyperthermie), une déshydratation et des atteintes oculaires.
Elle peut se compliquer de baby bleu syndrome (pour les enfants exposés
pendant longtemps à la photothérapie et ceux qui
présentent un ictère à bilirubine conjuguée mais
placées à la photothérapie). [3] Afin de contrôler
son efficacité un dosage à 6-8h ou 12h de la bilirubinémie
est recommandé. L'évaluation transcutanée du taux de
bilirubine est perturbée pendant 12 à 24h par les interactions
entre la lumière et la bilirubine présente dans la peau et ne
peut donc être utilisé. A noter que les ictères
hémolytiques et du prématuré sont fréquemment
à l'origine de rebonds.
2. L'exsanguino-transfusion
Elle se discute lorsque le taux de bilirubine est
supérieur à 350 mmol/l ; elle permet dans le même temps une
élimination de la bilirubine, des anticorps, une correction de
l'anémie ; cette technique expose cependant à des complications.
Son indication actuelle est réservée aux allo-iso-immunisations
sévères.
L'exsanguino-transfusion (EST) constitue le traitement de
dernier recours pour les hyper bilirubinémies sévères ou
associées à des signes neurologiques. C'est une technique qui
permet l'échange volume à volume de 1,5 à 2 masses
sanguines d'un individu par du sang d'un donneur exempt de bilirubine.
a) Mécanisme d'action
Son but est de soustraire des globules rouges recouverts
d'anticorps immuns, d'épurer la bilirubine libre et de corriger
l'anémie, cette technique remplace le sang du malade pour un sang
provenant d'un ou plusieurs donneurs, par soustraction et injections
successives de petits volumes de sang dans la veine ombilicale. Les
modalités de réalisation sont bien définies : le sang
total conservé moins de 3 à 5 jours et de plasma frais
congelé peut être utilisé [28]. Le volume d'échange
doit être égal à 2-2.5 fois le volume sanguin total de
l'enfant. La volémie du nouveau-né étant habituellement
considérée de 80ml/kg. O, effectue des cycles successifs avec des
échanges de 3 à 5ml/kg. Ces échanges doivent être
effectués lentement. Au cours de sa réalisation, il est
nécessaire d'injecter du gluconate de calcium
régulièrement afin d'éviter l'hypocalcémie. La
première soustraction permet de réaliser les examens biologiques.
L'exsanguino-transfusion se termine toujours par une injection du sang.
b) Efficacité
L'EST permettrait de faire baisser le taux de bilirubine
totale de 50% rapidement lors d'un échange de deux masses sanguines.
c) Indications
De moins à moins utilisé devant les
progrès de la photothérapie. Ce traitement est encore
utilisé dans certains cas d'hyper bilirubinémies
sévères avec signes neurologiques ou pour des taux de bilirubine
dépassant de 75 à 100ìmoles/l les indications de
photothérapie intensive pour l'âge. Pour exemple, le CNRHP a
réalisé 19 exsanguino-transfusions sur l'année 2011 (8 ET
concernaient des incompatibilités rhésus, 5 des
incompatibilités ABO et 5 des déficits en G6PD) [21].
Tableau V : Indications de
photothérapie et d'exsanguino-transfusion selon le taux de
bilirubine et le poids de naissance
Poids de naissance Photothérapie
Exsanguino-transfusion
< 1 500 g 135 à 170 ìmol/L*
(80 à 100 mg/L)
1500 à 2500 g 170 à 200
ìmol/L*
(100 à 120 mg/L)
> 2500 g 255 à 300 ìmol/L*
(150 à 175 mg/L)
170 à 255 ìmol/L*
(100 à 150
mg/L)
255 à 300 ìmol/L*
(150 à 175 mg/L)
340
ìmol/L*
(200 mg/L)
24 | P a g e
* Ces seuils doivent être réduits de 34
ìmol/L (20 mg/L) en présence de facteurs de risque telsqu'une
infection, une acidose, une hypoxie, une hyper osmolarité ou une
hypo-
25 | P a g e
albuminémie. Quel que soit le niveau de bilirubine, une
exsanguino-transfusion doit être effectuée si des signes
suggestifs d'ictère nucléaire apparaissent. Le risque diminue de
façon importante après l'âge de cinq jours.

Figure 4 : Courbes de référence de la
bilirubinémie d'exsanguinotransfusion
d) Complications de l'EST
Les risques de cette procédure sont difficiles à
quantifier. Aux USA, la mort occasionné par l'EST et estimé
à 3 cas sur 1000, une mortalité évaluée entre 15%
et 74% lors de la réalisation d'une EST, les risques infectieux vitaux
étant actuellement faibles pour un donneur unique. Les complications
attendues lors de sa réalisation sont :
> Une hypocalcémie > Des apnées
> Une thrombopénie > Des hyper kaliémies
> Des infections > Des cas d'entérocolites
ulcero-
> Une acidose métabolique necrosantes(ECUN)
Le traitement est spécifique dans 50% des cas [33].
b. LE TRAITEMENT MEDICAMENTEUX
Il semble être abandonné mais encore utilisé
dans notre milieu pour ses meilleurs résultats
1. les métallo porphyrines (zinc,
protoporphyrine)
Ils agissent en inhibant l'hème oxygénase donc
en limitant la production de biliverdine puis de bilirubine. Elles ne sont pas
utilisées en France et sont plutôt réservées au
traitement des ictères ABO.
2. le phénobarbital (Gardénal)
Le phénobarbital est un inducteur enzymatique de la
bilirubine glycuronyl transférase et des protéines Y et Z. Son
utilisation a été proposée dans les années 1970
mais son action thérapeutique limitée a conduit à son
abandon progressif. Il a par ailleurs un effet indésirable
26 | P a g e
potentiel de sédation et éventuellement de
dépression respiratoire chez le nouveau-né surtout
prématuré. [28] Habituellement administré en dose unique
de 50 mg (soit 0,25ml/kg, solution orale), le Gardénal est actuellement
réservé à l'ictère de la maladie de CriglerNajjar
type II.
3. le clofibrate (Lipavlon)
Il a été utilisé jadis en tant
qu'inducteur enzymatique de la glycuronyl transférase chez les
prématurés. Il n'est plus fabriqué et n'est donc plus
utilisé.
c. TRAITEMENT ADJUVANTS
4. L'albumine
Un gramme d'albumine fixe 17mg de bilirubine
(théoriquement), le rapport 1/1 et non 1/2. On donne 1g/kg dans le
sérum glucosé 5%, proportion 1/6 d'albumine et 5/6 sérum
glucosé 5%. Ce traitement consiste à perfuser de l'albumine
humaine afin d'augmenter la quantité d'albumine circulante et donc les
possibilités de fixation de la bilirubine libre toxique pour le
système nerveux central. On conçoit qu'une hypo
albuminémie ou l'utilisation des médicaments entrant en
compétition avec la liaison bilirubine-albumine (l'indométacine,
furosémide, cotrimoxazol...) [7] majorent la part de bilirubine non
liée avec risque d'ictère nucléaire [34]. Son indication
est posée lorsque l'enfant est particulièrement vulnérable
dans son métabolisme de la bilirubine, que l'on ne dispose pas avant
plusieurs heures d'une photothérapie optimale et au mieux si on dispose
d'un dosage de BNL ou bilirubine libre non liée à l'albumine
authentifiant cette fragilité. Elle est aussi utilisée en cas
d'hyper bilirubinémie sévère, persistant malgré le
traitement par photothérapie intensive. L'albumine est donc souvent
utilisée en perfusion lente pour augmenter l'albuminémie du
nouveau-né et ainsi essayer d'augmenter la liaison bilirubine-albumine.
Elle est aussi utilisée avant la réalisation d'une EST dans le
but d'attirer la BNC dans le secteur plasmatique par son pouvoir oncotique et
ainsi permettre son élimination par l'EST. [32]. En néonatologie,
seule la forme albumine à 20% est employée. La posologie est
variable, de l'ordre de 1 à 2g/kg de l'enfant, dilué de
moitié avec du glucosé à 5% à administrer en
perfusion lente de 2 heures. La perfusion peut être renouvelée 24
heures plutard si la bilirubinémie reste dans les zones dangereuses
[35].
5. L'injection d'immunoglobulines intraveineuse
Le mécanisme d'action des immunoglobulines consiste
à assurer le blocage de l'hémolyse. L'injection
d'immunoglobulines G (IgG) appauvri en anticorps anti-A et anti-B en
intraveineuse est préconisée dans les ictères
hémolytiques par incompatibilité foeto-maternelle (Rhésus
D et système ABO). Il n'existe aucune prophylaxie pour ce type
d'incompatibilité. Des études portant sur le traitement des
nouveau-nés atteints de la maladie
hémolytique à incompatibilité ABO et
rhésus ont montré que l'administration d'IgG IV réduisait
le nombre d'enfants ayant besoin d'exsanguino-transfusions, ainsi que la
durée du traitement par photothérapie. Il a également
été montré que cette thérapie réduisait
l'hémolyse, les taux de bilirubinémie et la
nécessité de pratiquer des exsanguino-transfusions.
6. Autres
> Traitement de l'anémie associée : une
anémie parfois s'avère peut être associée à
l'ictère ou être le seul témoin de l'hémolyse. [36]
Les seuils transfusionnels sont différents de ceux habituels et tiennent
comptent de différents facteurs : le taux d'hémoglobine et
d'hématocrite; l'existence des signes de
régénération médullaire, de la rapidité
d'installation de l'anémie, des signes de mauvaise tolérance, des
pathologies ou facteurs de risque associés (détresse
respiratoire, prématurité...)
> Post care : tout nouveau-né ayant fait
l'ictère sera suivi même après guérison en vue de
dépister les complications et séquelles passées
inaperçues. Il sera revu une fois le mois pendant le premier mois puis
une fois tous les trois mois, une fois tous les six mois enfin une fois l'an.
Les examens suivants sont réalisés : l'examen neurologique
complet, ophtalmique et l'audiométrie [32]
II.6.2.2. TRAITEMENT DE L'ICTERE A BILIRUBINE DIRECTE ET
MIXTE
a. TRAITEMENT MEDICAMENTEUX
> Pas de photothérapie,
> Apport hydrique [glucosé 10%],
> Supplémentation en vitamine
> Il dépend de l'étiologie. Exemple :
traitement antibiotique pour les infections ...
b. TRAITEMENT CHIRURGICAL
L'intervention de Kasaï (hépatoentérostomie)
qui consiste à réaliser un court-circuit des canaux biliaires
atrésiques ou fibrosés [24].
27 | P a g e
28 | P a g e
CHAPITRE III PRESENTATION DU CADRE DE TRAVAIL
III.1. SITUATION GEOGRAPHIQUE ET ORGANISATION
ADMINISTRATIVE
L'hôpital provincial général de
référence JASON SENDWE a constitué notre lieu de
recherche. Il est situé dans la commune urbaine de
Lubumbashi, plus précisément délimité :
> Au nord : par l'avenue Likasi
> Au sud : par le couvent des soeurs et le bâtiment du
lycée WEMA
> A l'Est : par le marché MZEE L.D. KABILA
> A l'ouest : par le ministère provincial de la
santé du Haut Katanga et le camp assistant.
La capacité d'accueil de ce grand hôpital est
estimée à environ 1200 lits, 2ème hôpital
du pays après Mama Yemo de Kinshasa, mais il connait le plus souvent un
taux d'occupation de plus de 100%.
L'hôpital est dirigé par un comité de
gestion avec à sa tête un médecin directeur. Celui-ci
s'occupe de l'administration courante de l'hôpital, coordonne les
différents services, et engage son personnel soignant. Plusieurs
médecins directeurs se sont succédé à la tête
de l'hôpital et l'actuel est le Dr. MWELWA André,
spécialiste en anesthésie - réanimation.
LE SERVICE DE PEDIATRIE
Le service de Pédiatrie a constitué le cadre
spécifique de notre étude, précisément dans sa sous
unité de néonatologie. Appart cette dernière, le service
comprend aussi les sous unités des Urgences pédiatriques et de
Nutrition.
L'hôpital provincial général de
référence Jason Sendwe est constitué de 2 blocs :
V' Le bloc à étages, constitué par 4
niveaux, actuellement en réhabilitation et
V' Le bloc pavillonnaire constitué des pavillons
Le service de néonatologie qui nous a servi de cadre
est situé dans le bloc pavillonnaire, précisément dans le
sud-est de l'hôpital.
29 | P a g e
III.2. ORGANIGRAMME DE L'HOPITAL

30 | P a g e
CHAPITRE IV POPULATION D'ETUDE; MATERIELS,
METHODES,
ET DIFFICULTES RENCONTREES
IV.1. POPULATION D'ETUDE
Notre population d'étude a inclut tout nouveau-né
hospitalisé dans le service de pédiatrie,
sous unité de néonatologie durant la
période allant du 1er janvier au 31 Décembre 2017.
Considérant nos critères d'inclusion, sur un total
de 1001 Cas hospitalisé, nous avons retenu pour
notre étude 236 cas.
Critères d'inclusion
> Etre âgé de 0
à 28 Jours
> Etre admis au service de
néonatologie de l'hôpital général de
référence Jason Sendwe
> Avoir développé
l'ictère néonatal durant la période d'étude
> Avoir un dossier médical
complet
Critères d'exclusion
> Tout âge supérieur
à 28 jours
> Tout nouveau-né sans
dossier médical
> Tout nouveau-né ne
présentant pas l'ictère
IV.2. MATERIEL ET METHODE
Nous avons mené une étude descriptive
transversale dont la récolte de données s'est faite de
manière rétrospective à partir des fiches
préétablies des nouveaux nés, des fiches de suivies au
cours de l'hospitalisation.
Le recueil des données a été
effectué à l'aide d'un questionnaire préétabli.
Le traitement de nos données a été fait
à l'aide des logiciels Epi Info 7.2.1.0 et Microsoft office Excel 2013.
Elles ont été présentées sous forme de diagramme,
d'histogramme et des tableaux
IV.3. DIFFICULTES RENCONTREES
La tâche ne nous a pas été facile. Nous
étions confrontés aux difficultés suivantes :
> Eparpillement des dossiers des
malades, d'autres perdues
> Mauvais enregistrement de
certains paramètres et absence d'autres sur les fiches.
31 | P a g e
CHAPITRE V : PRESENTATION DE RESULTATS
Sur 1001 nouveau-nés admis en néonatologie
pendant la période allant du 1er janvier au 31
décembre 2017, nous avons enregistré 236 cas d'ictère
néonatal soit une fréquence 23.57 %.
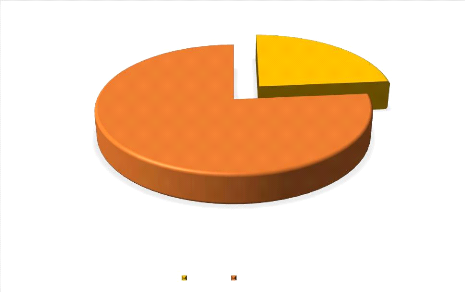
[NOM DE CATÉGORIE]
76,43%
Ictèrique Non ictèrique
[NOM DE CATÉGORIE]
23,57%
Figure 5 : la fréquence intra
hospitalière de l'ictère néonatal
32 | P a g e
Répartition des patients selon le sexe
Cette figure nous montre la prédominance du sexe
masculin avec 53% des cas, soit un sexe ratio de 1.13
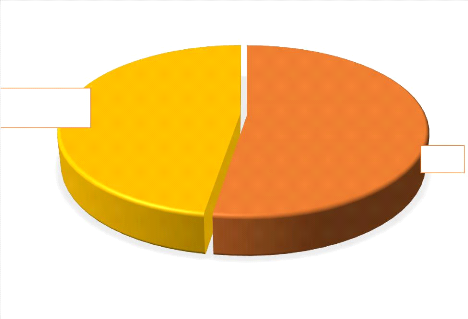
[NOM DE
CATÉGORIE]Féminin [POURCENTAGE]
Masculin
53%
Figure 6 : Répartition des
patients selon le sexe
33 | P a g e
Répartition des patients selon la commune de
résidence
La commune de Kampemba était la plus
représentée avec 26,27% des cas suivi de la commune annexe avec
22,03%
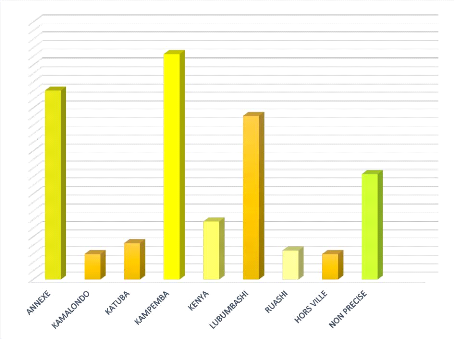
30
25
20
15
10
5
0
22.03
2.97
4.24
26.27
6.78
19.07
3.39 2.97
12.29
Figure 7 : Répartition selon
la commune de résidence
Tableau VI : Répartition des
patients selon l'âge maternel
Age maternel Fréquence
Pourcentage
< 18 ans 10 4,23
18 - 24 ans 50 21,18
25 - 31 ans 69 29,23
32 - 38 ans 58 24,58
39 - 45 ans 21 8,90
Non précisé 28
11,90
Total 236 100,00
Moyenne = 28.85 ET =
6,94
Ce tableau nous montre que la tranche d'âge de 25
à 31 ans était dominante avec 29,23%. La moyenne d'âge
maternel était de 28.85 avec un minimum de 15 ans et un maximum de 45
ans.
34 | P a g e
35 | P a g e
Répartition des patients selon le suivi des CPN
Cette figure nous renseigne que la majorité des
mères, soit 86,44% ont suivi les CPN

Non, 5.93%
Ignoré, 7.63%
Oui, 86.44%
Figure 8 : Répartition des
patients selon le suivi des CPN
Tableau VII : Répartition des
patients selon les Infections génito-urinaire
36 | P a g e
IUG Fréquence Pourcentage
Oui 113 48,09
Non 70 29,79
Ignoré 53 22,13
Total 236 100,00
Ce tableau nous renseigne que la plupart des mères soit
48,09% avait développé une IUG au 3ème trimestre de la
grossesse.
37 | P a g e
Répartition des patients selon la
maturité (âge gestationnel)
Il ressort de cette figure que la majorité des
nouveau-nés étaient matures (65.25%), tandis que les
prématurés ont une proportion de 33% de notre échantillon.
L'AG moyen est de 36,7 SA

Matures
65,25%
Matures Post matures Prematurés
[NOM DE CATÉGORIE]
33,05%
[NOM DE CATÉGORIE]
1,70%
Figure 9 : Répartition selon
la maturité
38 | P a g e
Répartition selon les antécédents
d'ictère néonatal dans la fratrie
Il ressort de cette figure que dans 95.34% des cas, il n'y
avait pas d'antécédent d'ictère dans la fratrie

Oui Non
95;34%
4,66%
Figure 10 : Répartition selon
les antécédents d'ictère néonatal dans la
fratrie
39 | P a g e
Répartition des patients Selon le type
d'accouchement
La majorité des nouveau-nés ont été
issus d'un accouchement eutocique (58.47%)
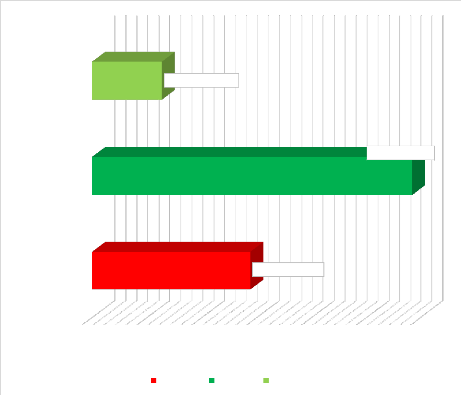
Type d'accouchement
Non précisé
Dystocique
Eutocique
0 10 20 30 40 50 60
Dystocique Eutocique Non précisé
Non précisé, 12.71
pourcentage
Dystocique, 28.81
Eutocique, 58.47
Figure 11 : Répartition des
patients selon le type d'accouchement
Tableau VIII Répartition Selon
l'APGAR
40 | P a g e
Apgar Fréquence Pourcentage
Bon 90 38,13
Déprimé 80 33,90
Mort apparente 4 1,70
Ignoré 62 26,27
Total 236 100,00
Le score d'APGAR était bon chez 38.13% des
nouveau-nés ictériques et déprimé chez 33.9 % des
cas.
41 | P a g e
Tableau IX : Répartition Selon
le poids de naissance
Poids de naissance Fréquence
Pourcentage
<2500 g 108 45,76
2500 - 4000 g 107 45,34
>4000 g 9 3,81
Ignoré 12 5,08
Total 236 100,00
Ce tableau nous renseigne que 45.76% des nouveau-nés
ictériques avaient un faible poids de naissance
(<2500 g) tandis que 45.34% autres avaient
un poids variant entre 2500 et 4000 g.
Tableau X : Répartition Selon
l'âge d'apparition de l'ictère
42 | P a g e
Age d'apparition de l'ictere Fréquence
Pourcentage
< 24h 22 9,36
24h-48h 75 31,91
> 48h 112 47,66
Non précisé 27 11,06
Total 236 100,00
Il ressort de ce tableau que 47.66% des nouveau-nés ont vu
apparaitre leur ictère au de-là de 48h
Répartition des patients selon le mode
d'alimentation
La majorité des nouveau-nés avaient une
alimentation au lait maternel, soit 82%
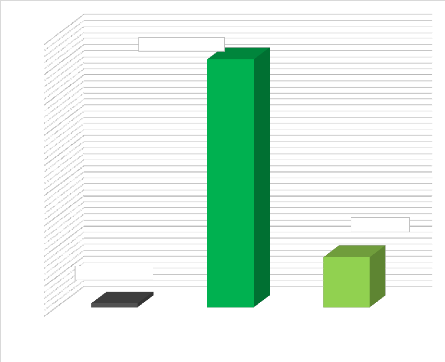
Lait infantile, 1.28%
Lait maternel, 82.05%
Mixte, 16.67%
Lait infantile Lait maternel Mixte
Type d'allaitement
90.00%
80.00%
70.00%
60.00%
50.00%
40.00%
30.00%
20.00%
10.00%
0.00%
Figure 12 : Répartition Selon
le mode d'alimentation
43 | P a g e
Tableau XI : Répartition Selon
les facteurs de risque
44 | P a g e
Facteur de risqué Fréquence
Pourcentage
Jeûne, Hypoglycémie 20
8,47
BSS, Hématome, Ecchymose 28
11,86
Polyglobulie 8 3,39
Asphyxie périnatale 29 12,29
Hypothermie 7 2,97
Ce tableau montre que les facteurs de risque étaient
présents dans 39,98% des cas parmi lesquels l'asphyxie périnatale
était prédominante avec 12,29%.
45 | P a g e
Répartition des patients selon
l'étiologie
Il ressort de ce tableau que l'ictère physiologique
était majoritaire avec 51,27% suivi des causes infectieuses avec
24,15%.

[NOM DE CATÉGORIE]
11,02%
[NOM DE CATÉGORIE]
51,27%
Infection indeterminée physiologique
Incompatibilité ABO incompatibilité Rh
[NOM DE CATÉGORIE]
24,15%
IFM, 13,56%
[NOM DE CATÉGORIE]
3,81%
[NOM DE CATÉGORIE]; [VALEUR]
Figure 13 : Répartition Selon
l'étiologie
Tableau XV : Répartition des
patients selon les signes associés
46 | P a g e
Signes associés Fréquence
Pourcentage
Hépatomégalie 1 0,42
Splénomégalie 0 0
Selles décolorées 4
1,69
Fièvre 60 25,42
Pâleur 17 7,20
Signes neurologique 0 0
Il ressort de ce tableau que 25.42% des cas étaient
associés à la fièvre alors que les selles
décolorés sont apparus seulement dans 1.69%
47 | P a g e
Répartition des patients selon le groupe
sanguin maternel et néonatal
Le groupe O était majoritaire dans les deux cas, soit
respectivement 38.57% et 32.2%
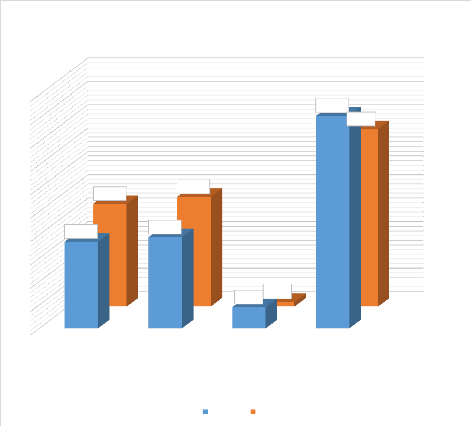
18,64%
19,92%
15,68%
16,52%
3,81%
0,84%
38,57%
32,2%
Nné
maternel
A B AB O
maternel Nné
100
90
80
70
60
50
40
30
20
10
0
Figure 14 : Répartition selon
le groupe sanguin maternel et néonatal
48 | P a g e
Répartition des patients selon le rhésus
maternel et du nouveau-né
Le groupe rhésus positif était majoritaire avec
respectivement 94.34% et 98.8% chez les mères et chez les nouveaux
nés.

Rhesus +, 98.80%
Rhesus +, 95.35%
Rhesus -, 1.20%
Rhesus -, 5.65%
maternel
Nné
Rhesus + Rhesus -
maternel Nné
100.00%
90.00%
80.00%
70.00%
60.00%
50.00%
40.00%
30.00%
20.00%
10.00%
0.00%
Figure 15 : Répartition Selon
le rhésus maternel et du nouveau-né
Tableau XVI : Répartition Selon
le type d'ictère
49 | P a g e
Type d'ictère Fréquence
Pourcentage
I. A bilirubine Directe 4 1,69
I. A bilirubine Indirecte 147 62,29
I. A bilirubine Mixte 21 8,90
Non déterminé (bilirubines non
dosés) 64 27,12
Total 236 100,00
Au vu de ce tableau, l'ictère néonatal
était principalement à bilirubine indirect, soit 62.29%. 27.12%
des cas n'ayant pas réalisés les examens paracliniques
50 | P a g e
Répartition des patients selon la prise en
charge
Cette figure nous montre que l'antibiothérapie a
été utilisé chez 94% des patients alors que la
photothérapie a été utilisé chez 86
nouveau-nés ictériques soit 36.44% de toute
l'échantillon.
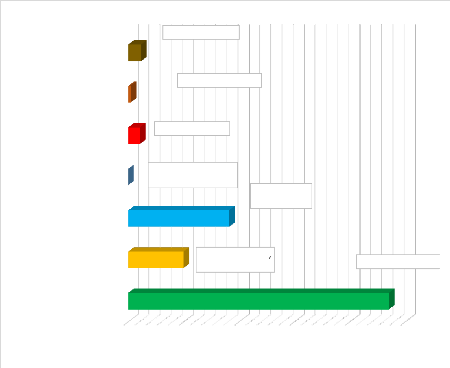
Hydratation
Hydratation, 4.66%
Phénobarbital, 0.85%
Phénobarbital
Transfusion
Exsanguinotransfusion
Photothérapie
Exposition au soleil
Antibiotique
Transfusion, 4.24%
Exsanguinotransfusion
, 0%
Prise een charge
Exposition au soleil
19.92%
Antibiotique, 94.07%
Photothérapie,
36.44%
0.00% 20.00% 40.00% 60.00% 80.00% 100.00%
Figure 16 : Répartition Selon
la prise en charge
Tableau XVII : Répartition des
patients selon l'évolution
51 | P a g e
Evolution Fréquence
Pourcentage
Guérison 169 71,61
Décès 18 7,63
Non précisé 49 20,76
Total 236 100,00
Ce tableau montre que l'évolution était
favorable dans 71.61% des cas, seuls 7.63% sont décédés
avec un taux de mortalité de 1,79%.
Tableau XVIII : Répartition
Selon le séjour
52 | P a g e
Séjour Fréquence
Pourcentage
< 7 jours 56 23,70
7 - 14 jours 67 28,40
15 - 21 jours 26 11,00
22 - 30 jours 22 9,30
> 1 mois 23 9,70
Non precise 42 17,80
Total 236 100,00
Moyenne : 10,89 ET =
6,20
La majorité des nouveau-nés ictériques
avaient un séjour de 7 à 14 jours, avec une moyenne de 10.89
#177; 6.20 jours.
53 | P a g e
CHAPITRE VI DISCUSSIONS ET COMMENTAIRES
I. LA FREQUENCE HOSPITALIERE DE L'ICTERE
NEONATAL
Sur un total de 1001 nouveau-nés, nous avons
enregistré dans notre serie 236 cas, soit une fréquence
hospitalière de 23.57%.
> Ce résultat se rapproche de ceux trouvés par
:
V' BARKAT, en 2003 à rabat(Maroc) (26.3%) [12].
V' RIMBAUD, en 2005 à Grenoble (France) (20.9%) [37].
V' HASSNA TAIRAN, en 2009, Rabat (Maroc) (25.2%) [5].
V' SAOUDI F. en 2011, au Caire (Egypte) (27%) [38].
> Cependant, il est supérieur à ceux
rapportés par :
V' MONGA KALENGA, en 2010 à Lubumbashi (RDC) qui avait
trouvé 17.7% avec un échantillon de 51 cas sur 297
nouveau-nés concernés pour une période d'étude de 9
mois. ceci pourrait s'expliquer par le fait qu'elle a travaillé sur
l'ictère à bilirubine indirect seulement ; la taille de son
échantillon et la durée d'étude étant
réduites par rapport aux nôtres, mais aussi le type d'étude
qui était prospective transversale [13].
V' OZKAN H. en 2008 à Bamako(Mali) : 19.5%, ceci
pourrait être dû à un faible échantillon de 310 cas
sur 1583 nouveau nés, malgré une période d'étude de
2 ans [39].
V' KABAMBA MUKUKU, en 2014 à Mbuji-Mayi (RDC) qui avait
obtenu une fréquence de 4,9%, cette infériorité
s'expliquerait par le fait que celui-ci a travaillé uniquement sur
l'ictère pathologique dont la survenu est rarissime avec un taux annuel
de 24 cas [40]. Alors que nous par contre, avons travaillé sur tous les
ictères.
> En outre des taux supérieurs sont rapportés
dans les séries de KHARTOOM et RFFIONG qui ont respectivement
trouvé 35% et 32% [41].
54 | P a g e
II. CARACTERISTIQUES SOCIO DEMOGRAPHIQUES
a. Le Sexe
Une légère prédominance masculine a
été notée dans notre série avec un sexe ratio de
1,13 ; Même constat fait par MONGA KALENGA avec un sexe ratio de 1.04 et
BARKAT et all soit un sexe ratio de 1.3 [12].
b. La Commune de provenance
La commune de Kampemba était la plus
représentée avec 26,27%. Cette fréquence s'expliquerait
d'une part par la proximité géographique et
l'accessibilité facile aux soins, d'autre part le fait que
l'hôpital SENDWE est une structure sanitaire de référence
par excellence. Nos résultats rejoignent ceux rapportés par CHOLA
CHEMBO en 2014, soit 25% [41].
III. CARACTERISTIQUES CLINIQUES
1) L'âge maternel
La tranche d'âge maternel de 25 à 31 ans
était dominante, soit 29.23% avec un minimum de 15 ans, un maximum de 45
ans et une moyenne de 28.85 #177; 3.39 ans alors que l'étude de BERKOUD
NAIMA en Algérie (2016) a trouvé que l'âge maternel moyen
est de 24 ans [42]. Nos résultats peuvent s'expliquer par le fait que la
tranche d'âge correspond à l'âge de la procréation
avec une activité sexuelle intense.
2) Les consultations prénatales
Notre étude a révélé que 86,44%
des mères ont suivi les consultations prénatales. Cette
fréquence est approximative à celle trouvée par MBO
LESELEBE, soit 84 % [43]. Mais elle est largement supérieur à
l'étude de BARKAT et all. qui ont rapporté 32 %. L'étude
de MONGA KALENGA avait rapporté aussi un taux élevé, soit
96,1 % des cas. Ceci s'expliquerait par le fait que la majorité des
femmes soient informées sur l'importance des consultations
prénatales et les complications lors de l'accouchement.
3) Antécédent
d'IUG
Nous avons enregistré 48.09% des mères avec
antécédent d'infection urogénitale au troisième
trimestre de la grossesse contre 18% dans l'étude de MBO LESELEBE. Ceci
peut s'expliquer par le fait que l'IUG au 3ème trimestre peut
favoriser une infection néonatale qui sera responsable de
l'ictère chez le nouveau-né.
4) 55 | P a g e
Maturité
Dans notre série, les prématurés ont
représentés 33,05% soit 78 cas contre 69 ,95% soit 158
nouveau-nés à terme. Ces résultats se rapprochent de ceux
de KABENGELA KABAMBA en 2015 à Lubumbashi et BARKAT au Maroc en 2003 qui
ont trouvés respectivement : 22,13% des prématurés soit 15
sur 71 cas contre 78,8% des nouveau-nés à terme soit 56/71 cas
[44]. Et 40% des prématurés contre 60% des nouveau-nés
à terme. Ils se conforment aussi au rapport de la société
suisse de néonatologie de mai 2006 qui a rapporté qu'environ 60 %
des nouveau-nés à terme présentent l'ictère dans
leurs premiers jours de vie.
5) Antécédent d'ictère
néonatal dans la fratrie
Dans 4,1% des cas, nous avons noté les
antécédents d'ictère néonatal dans la fratrie, ce
qui nous rapproche des travaux de MAUD BELLAVARY et de SAOUDI F qui ont
trouvé respectivement 4% et 5% des cas [7, 38].
6) Type d'accouchement
Plusieurs études ont montré que le clampage
tardif du cordon et les extractions instrumentales par forceps ou ventouse sont
des facteurs favorisants reconnus de l'ictère néonatal. Les
extractions instrumentales étant peut-être à l'origine
d'une stimulation de l'hème-oxygénase liée au stress [45].
L'utilisation d'ocytocine au cours du travail augmente l'incidence de l'hyper
bilirubinémie néonatale [46-48]. Mais il existe une controverse
[49] et le mécanisme en cause n'est pas bien défini.
L'anesthésie péridurale surtout avec l'utilisation de
xylocaïne est aussi incriminée [50].
Des taux relativement importants des accouchements par voie
basse sont marqués dans notre étude soit 58.47 % et 68
césarienne soit 28.81 %
7) APGAR et réanimation
néonatale
33.9% des nouveau-nés avaient un APGAR
déprimé et ont bénéficié de ce fait d'une
réanimation néonatale. Ce résultat est supérieur
à celui rapporté par KABAMBA M. et MONGA KALENGA qui ont
trouvé respectivement 12,5% et 5,9% des cas avec APGAR
déprimé. La différence ainsi constaté peut
s'expliquer par le fait que notre échantillon contenait plus des
prématurés que les leurs (33.5%). Le lien entre ictère et
APGAR déprimé peut s'expliquer par le fait que ce dernier traduit
une hypoxémie, qui est reconnue comme facteur favorisant
l'ictère.
8) 56 | P a g e
Poids de naissance
Dans notre série, 45.76% des cas avaient un faible poids
de naissance.
Ceci peut s'expliquer par le fait que la plupart
étaient prématurés et donc, présentant une
immaturité hépatique les exposant à l'ictère.
9) Age d'apparition de l'ictère
L'ictère néonatal était plus
d'apparition tardive (> 48h) dans 47,66% et d'apparition précoce
(premières 24 h) dans 9,36% des cas. L'étude de HASSNA TAIRAN
évoque un taux de 92.3 % d'ictère d'apparition entre 36h et une
semaine ; KABAMBA M. : ictère avant 48h avec un taux de 31,2% ; entre
3ème et 4ème jour avec un taux de 48% des
cas et MONGA KALENGA : 39,2% au 3ème jour de vie, nous
pensons que c'est l'intervalle des temps qui explique ces
différences.
10) Mode d'alimentation
Dans notre série L'allaitement au lait maternel
était prédominant suivi de l'allaitement mixte avec
respectivement 82.05% et 16.67% des cas. Ce taux élevé se
conforme aux objectifs du programme national de nutrition (PRONANUT) qui lutte
pour un allaitement maternel exclusif jusqu'à l'âge de 6 mois.
Ceci rejoint des multiples études qui ont démontré au
cours des 25 dernières années une forte association entre
l'allaitement maternel et l'hyper bilirubinémie du nouveau-né
[51]. L'étude de Schneider met en évidence un risque 3 fois plus
important pour les nouveau-nés recevant un allaitement maternel d'avoir
une BT >12 mg/dl par rapport aux enfants recevant un allaitement artificiel,
et 6 fois plus important d'avoir une BT >15mg/dl [52].
11) Les Facteurs de risque
La souffrance foetale et néo-natale a
été retenue par certains auteurs, comme facteur favorisant la
survenue de l'ictère nucléaire [53]. L'apparition des facteurs
favorisant a été remarqué dans 39.98% des cas : l'asphyxie
périnatale dans 12.29%, les bosses sero-sanguines et hématomes
dans 11.86%, et en fin l'hypothermie est survenue dans 2.97% seulement.
12) Les étiologies
L'ictère était physiologique dans 51,27% des
cas, résultat semblable à celui de ABDULAZIZ et all. qui a
trouvé l'ictère physiologique dans 53,9% des cas (129/239) [54].
Concernant l'ictère pathologique, les infections ont occupé la
1ère place dans notre série, suivies des
incompatibilités matérno-foetales soient respectivement 24,15% et
13,56% des cas. Ce
57 | P a g e
constat est similaire à celui fait par CHOLA CHEMBO en
2015, soit 53,7% et 27,8%. Les causes indéterminées
représentent 11,02% dans notre étude.
13) Signes cliniques associés
Nous avons constaté que 25.42% des cas étaient
associés à la fièvre ; 7.20% à la pâleur
alors que les selles décolorés sont apparus seulement dans 1.69%
et l'hépatomégalie dans 0.42% des cas contrairement au travail de
HASSNA TAIRAN qui avait trouvé les anomalies neurologiques dans 45,7%
des cas ; à l'étude de MONGA Joséphine qui avait
trouvé la pâleur avec 15,7% et à celle de KABAMBA M. qui
avait trouvé le même signe pâleur cutanéomuqueux
à 100% des cas, ce qui était normal puisqu'il avait
travaillé sur l'ictère pathologique.
IV. CARACTERISTIQUES PARACLINIQUES
1) le groupe sanguin maternel et du
nouveau-né
Nous avons remarqué au cours de notre étude que
la majorité des mères étaient du groupe O avec 38,57%
suivi du groupe B avec 16,52%. Ces résultats se rapprochent des ceux
trouvés par MONGA KALENGA et MBO LESELEBE qui avaient rapporté
respectivement 51% des mères du groupe O suivi du groupe A avec 29% et
44% du groupe O suivi du groupe A avec 20%.
De même que chez les nouveau-nés, le groupe O
était fréquent dans 32,2 % suivi du groupe B avec 19.92%,
résultats presque similaires à ceux trouvés par MONGA
Joséphine : 43,1% des nouveau-nés du groupe O, suivi du groupe B
avec 27,5% et SAOUDI F. : 52% du groupe O suivi du groupe A soit 38%.
2) le groupe rhésus maternel et du
nouveau-né
Le groupe rhésus positif était
prédominant chez les mères tout comme chez les nouveau-nés
avec respectivement 94.34% et 98.8 % rejoignant ainsi l'étude de KAFUTI
NGOY qui avait rapportée 88,68% des mères rhésus positif
[55]. Concernant le sous-groupe rhésus, nos résultats sont
approximatifs à ceux de KABENGA KABAMBA réalisée en 2015
qui a rapportée 94.4% des rhésus positif chez les
nouveau-nés [44].
3) Les bilirubinémies
Les valeurs de la bilirubinémie indirectes variaient de
0,65 mg/dl à 26,3 avec une moyenne de 8,76 #177; 5,23 mg/dl. Tandis que
dans la série de SAOUDI F. la moyenne était de 22,5#177; 5,2
mg/dl. Cette différence se justifie par le fait que son étude
concernait les ictères néonatals intenses d'origine
indéterminée alors que la nôtre concerne toutes les formes
d'ictère.
58 | P a g e
C'est le double de médiane du travail de MONGA
Joséphine qui était de 11,56 mg%, qui concernait l'ictère
à bilirubine libre.
La bilirubinémie totale fluctuait entre 1,08 et 33,71
mg% avec une moyenne de 11,53 #177; 6,01 mg%. Notre constat se rapproche de
celui de OZKAN H et coll. qui rapportait une moyenne de 14,1#177;2,7 mg% et
s'éloigne cependant de la recherche de MAUD BEVALLARY qui a
rapporté 24 à 26 mg%. Les différences ainsi
constatée peuvent s'expliquer par des échantillonnages totalement
différents, les types d'études et milieux d'études
respectifs, et des critères de sélection différents.
4) Le type d'ictère
Selon la prédominance du type de bilirubine, nous avons
ressorti dans notre série que la majorité des nouveau-nés
soit 62,29% ont présenté l'ictère à bilirubine
indirecte suivi de l'ictère à bilirubine mixte avec 8,90 % ; ceci
confirme ce que nous dit la littérature par rapport à la
prédominance de l'ictère à bilirubine indirecte [27].
V. TRATEMENT
L'antibiothérapie représente 94.07 % des cas
dans notre échantillon. Ce qui se justifie par le fait que les causes
infectieuses étaient majoritaires mais aussi et surtout parce que la
plupart des nouveau-nés avaient soit un risque infectieux soit majeur,
soit mineur vu les conditions d'asepsie qui ne sont guère souvent
appliqué avec rigueur dans nos structures sanitaires. Ce
résultant est proche de celui rapporté par KABAMBA M. à
l'hôpital BONZOLA de Mbuji-Mayi en 2014 avec 64% des cas dans le cadre
d'une infection néonatale. La photothérapie a été
faite dans 36.44% des dans notre série. MONGA KALENGA a trouvé la
photothérapie dans 54% des cas aux Cliniques Universitaires de
Lubumbashi alors que dans la serie de SAOUDI F. elle a constitué le
traitement de première intention avec 71%.
Malgré les différentes proportions
trouvées, la photothérapie constitue le traitement de choix et de
1ère intention en cas d'ictère à bilirubine
libre et ceci rejoint la littérature [27].
59 | P a g e
VI. CARACTERISTIQUES EVOLUTIVES D'HOSPITALISATION
1) L'évolution
L'évolution était favorable dans 71.61% des cas
contre 7.63% des décès.
Comparativement à l'étude de RIMBAUD qui avait
trouvé l'évolution vers la guérison dans 81% des cas et de
MONGA Joséphine qui a rapporté 88,2% de sortie et 11,8% de
décès, ce taux légèrement bas de guérison
s'expliquerait par le fait que dans notre échantillon 20.76% avaient une
évolution non précisé. Dans toutes ces études, les
taux de décès étaient dus probablement à
l'infection.
2) La durée d'hospitalisation
La durée d'hospitalisation fluctuait de 4 à 38
jours avec une moyenne de 10.89 #177; 6.20
jours. Résultats supérieure à la
série de SAOUDI F. au Maroc qui avait trouvé 2,2 jours, avec une
durée allant de 1 à 17 jours. Ceci peut se justifier par le fait
que dans notre étude, nous avons enregistré un taux
supérieur des prématurés : 33,05% contre 15,5% dans la
série de SAOUDI F. sachant que la prématurité augmente le
séjour à l'hôpital mais aussi par le fait que les
conditions socioéconomique défavorables de la plupart des
accouchées contribuent au prolongement du séjour par manque de
moyens pour payer les frais de l'hôpital.
60 | P a g e
CONCLUSION GENERALE
Au terme de notre étude descriptive transversale sur le
profil épidemioclinique,
thérapeutique et évolutif de l'ictère
néonatal au cours de la période allant du 01 janvier au 31
décembre 2017, soit 12 mois ; il ressort les conclusions
suivantes :
> Dans notre milieu, l'ictère néonatal est
fréquent avec une prévalence de 23.57%
> Le sexe masculin était prédominant avec un
sexe ratio de 1,13.
> La commune de Kampemba était la plus
représentée avec 26,27%
> La tranche d'âge maternel de 25 à 31 ans
était dominante avec une moyenne de 28.85 #177;
3.39 ans
> La majorité des mères avaient suivi les
consultations prénatales et la plupart d'entre elles
étaient multipares.
> La plupart des nouveau-nés étaient issus d'une
grossesse mono foetale.
> Les prématurés ont représentés
33,05% contre 69 ,95% des nouveau-nés à terme.
> Des taux relativement importants des accouchements par voie
basse ont été enregistré soit
58.47 % et 33.9% des nouveau-nés avaient un APGAR
déprimé et ont bénéficié de ce fait
d'une réanimation néonatale.
> Les nouveau nés de faible poids de naissance
(<2500 g) étaient majoritaires.
> L'ictère néonatal était plus
d'apparition tardive (> 48h) que précoce.
> L'allaitement au lait maternel était
prédominant.
> L'apparition des facteurs favorisant était
signalé dans 39.98% des cas : l'asphyxie
périnatale dans 12.29%, les bosses sero-sanguines et
hématomes dans 11.86%, et en fin
l'hypothermie est survenue dans 2.97% seulement.
> L'ictère était physiologique dans 51,27% des
cas et concernant l'ictère pathologique, les
infections ont occupé la 1ère place,
suivies des incompatibilités matérno-foetales soient
respectivement 24,15% et 13,56% des cas.
> 25.42% des cas étaient associés à la
fièvre ; 7.20% à la pâleur alors que les selles
décolorés sont apparus seulement dans 1.69% et
l'hépatomégalie dans 0.42% des cas
> Nous avons remarqué au cours de notre étude
que la majorité des mères étaient du groupe
O avec 38,57% suivi du groupe B avec 16,52%. Le groupe
rhésus positif était
61 | P a g e
prédominant chez les mères tout comme chez les
nouveau-nés avec respectivement 94.34% et 98.8%
? Les valeurs de la bilirubinémie indirectes variaient
de 0,65 mg/dl à 26,3 avec une moyenne de 8,76 #177; 5,23 mg/dl. La
bilirubinémie totale fluctuait entre 1,08 et 33,71 mg% avec une moyenne
de 11,53 #177; 6,01 mg%.
? Selon la prédominance du type de bilirubine, 62,29%
avaient présenté l'ictère à bilirubine indirecte
alors que l'ictère à bilirubine mixte a constitué 8,90 %
des cas.
? L'antibiothérapie a été utilisée
dans 94.07 % des cas tandis que la photothérapie a été
faite dans 36.44% des cas.
? L'évolution était favorable dans 71.61% des
cas contre 7.63% des décès et la durée
d'hospitalisation fluctuait de 4 à 38 jours avec une
moyenne de 10.89 #177; 6.20 jours.
Eu égard à tout ce qui précède,
l'ictère reste une pathologie fréquente pendant la période
néonatal ; puisque la littérature médicale lui apporte
environ deux tiers de nouveau-nés et notre étude le retrouve dans
un quart des patients hospitalisés. C'est une pathologie bénigne
qui peut guérir même sans traitement avec un risque imminent de
donner des complications graves, voilà pourquoi il nécessite une
surveillance particulière et une prévention grâce au
renforcement des CPN et CPoN
62 | P a g e
SUGGESTIONS ET RECOMMENDATIONS
Les observations retenues au cours de notre travail nous
permettent de suggérer dans le souci de diminuer considérablement
la fréquence de l'ictère néonatal.
Aux personnels soignants nous recommandons:
> Que le diagnostic soit explicité, cela permettrait
de faire une étude sur la cause que prévaut dans l'apparition de
l'ictère néonatal à l'hôpital Jason Sendwe.
> Une bonne prise en charge du nouveau-né
ictérique. Celle-ci nécessite un personnel qualifié et
expérimenté et un outil approprié pour les soins.
Nous demandons à l'administration de revoir la facture
de laboratoire pour le dosage de bilirubine parce que la plupart des parents ne
parviennent pas à doser au temps voulu suite au montant fixé.
Aux parents, nous demandons de :
> Prendre en considération la gravité de
l'ictère néonatal qui, si non traité, peut entrainer des
séquelles neurologiques graves et de fois conduire à la mort.
> Honorer les factures et passer aux examens para cliniques
en vue d'une bonne meilleure et efficace prise en charge de leurs enfants.
Au gouvernement tant provincial que national :
> Que les services sanitaires renforcent la politique de
vulgarisation pour une large diffusion de l'information sur la pathologie, sur
les facteurs favorisants ainsi que leur prise en charge.
> Que l'hôpital général de
référence Jason Sendwe soit équipé à la
hauteur d'un hôpital provincial de référence en lui
octroyant :
y' Des réactifs et appareils de laboratoire permettant le
diagnostic étiologique pour une meilleure prise en charge.
y' Des bilirubinometres transcutanés afin d'éviter
des prélèvements sanguins itératifs y' Des appareils de
photothérapie correspondant à la capacité d'accueil de
service de néonatologie.
63 | P a g e
BIBLIOGRAPHIE
1. VERT P. ARTHUIS M. Rapport de l'Académie Nationale de
médecine. La première semaine de vie, 31.mai.2005
2. STRACZEK H., VIEUX R. Sorties précoces de
maternité : quels problèmes anticiper, Archives de
Pédiatrie, 2008, Vol 15, 1076-1082
3. CORTEY A. Ictères et hyper bilirubinémies du
nouveau-né. [En ligne] CNRHP. Mars 2011. [Référence du 15
janvier 2013] 213.218.138.82/
www.3cfr.fhpmco.fr/dragon-media/8mars
2011Icteresethyperbilirubinémiesdunouveaune.pdf
4. LABRUNE P. Ictère grave du nouveau-né.
Définition et prise en charge, Archives de pédiatrie, 1998, Vol
5, 1162-7
5. HASSNA Tairan, ictère néonatale,
expérience du chu Mohammed VI de Marrakech, thèse pour
l'obtention de doctorat de médecine, 2009 [en ligne]
6. SABINE ALCAYDE, Ictère du nouveau-né,
Hôpital Paule de Viguier, FMC Octobre 2008
7. Maud BELLAVARY. Ictère du nouveau-né et sortie
de maternité Un bilan en Ile-de-France. Mémoire de fin
d'étude, faculté de médecine paris Descartes 2012. 104 p.
[en ligne]
8. BOURILLON A. Pédiatrie pour praticien,
5ème édition, Masson, Paris 2008
9. GOLD. F. ictère néonatale, faculté de
médicine de Grenoble 2007.
10. OMS, soins hospitaliers pédiatriques 2007, prise en
charge des affections courantes dans les hôpitaux
11. BIGOT A ZOHOUM I. KODJO L. F et AKUETE E(1996) étude
d'incompatibilité foeto-maternelle dans le système ABO à
Cotonou. Med. D'afrique Noir.
12. BARKAT A, Mdagri A, BelahssenA, BassriB, Hamadani S,
Lamadour N, ictère à bilirubine indirecte. Centre national de
référence en néonatologie CHU de rabat, Novembre 2003.
13. Joséphine MONGA KALENGA, étude de
l'ictère néonatal à bilirubine libre dans les Cliniques
Universitaires de Lubumbashi, faculté de Médecine Unilu,
décembre 2009 à Aout 2010.
14. BHUTANI VK, JOHNSON L. A proposal to prevent severe neonatal
hyperbilirubinemia and kernicterus, Journal of perinatology, 2009, Vol 29,
S61-S67
15.
64 | P a g e
www.etudiant.net/bilirubinemie,interetdudosage
16. TADY M.B., BANDORA (P.), LUKUSA n.), TSHIANI (K.)
IZEMENGIA (O.), BUNGA (M.) Aspects étiologiques et thérapeutiques
des ictères néonataux dans les cliniques universitaires de
Kinshasa. Afri. Med. , 1982.
17. NAILA, la galactosémie congénitale, forum
de l'union médical 2010,
www.fumed.com
18.
www.inloraire.org
19. KEITH BARRIGTON KORAVANGATTU sankaran, prévention,
dépistage et prise en charge de la jaunisse chez le nouveau-né
à terme et les prématurés, 2007.
20. Précis de sémiologie
21. JEFFREY MAISELS M. Screening and early postnatal
management strategies to prevent hazardous hyperbilirubinemia in newborn of 35
or more weeks of gestation, fetal et neonatal medicine, 2010,Vol 15,
129-135;
22. MAZURIER E. Dépistage de l'ictère
néonatal et évaluation transcutanée de la
bilirubinémie avec le bilirubinomètre transcutanée,
Archives de Pédiatrie, 2011, Vol 18, 5S1, Ph15-16
23.
www.santé-medecine.journaldesfemmes.com
24. T. LAUSSAUER, pédiatrie, manuelle illustré,
1998.
25. AMERICAN ACADEMY OF PEDIATRICS, Management of
hyperbilirubinemia in the newborn infant 35 or more weeks of gestation,
Pediatrics, 2004, 114;297
26. GERALDINE LAMBOLEY et coll, évaluation et soins du
nouveau-né à terme : revue du praticien, 2002.
27. BOURILLON A : pédiatrie pour praticien,
6ème édition, Masson, Paris 2011
28. MARIE MITANCHEZ D. syndrome anémique foetale,
hématologie, 2004 pages 2-8.
29. MALU M. and LANGEVIN L. prise en charge de l'hyper
bilirubinémie du nouveau-né à terme en maternité,
1998 pages 1156-1161
30. SOUILLE JC. LARSEN M, ANDREW G. et AL. Etude
rétrospective sur l'exsanguino-transfusion du nouveau-né,
Clinique et biologie, 1999, Pages 166-173.
31. DEFAWEG. Annexe pédiatrique, hôpital sud
1999.
32. LYONEL ROSSANT, JACQUELINE LUMBROSO, ictère du
nouveau-né, 2009.
33. GOMARI S, les ictères néonatales à
bilirubine libre, Archives de pédiatrie, volume 17, issue 6, page 74
Tlemcen, Algérie 2009
34.
65 | P a g e
TOUNIAN, pediatrie DCEM, pages 42, 222
35. LABRUNE P. Denis ORIO et coll, Urgences
pédiatriques, 2ème Ed, deboekestem, Paris, 2010
36. YABA, module d'hématologie, notes de cours D3
Médecine Unilu, 2011-2012, inédit
37. RAMBAUD P. ictère du nouveau-né. Corpus
médical de la faculté de médecine à Grenoble
2005
38. SAOUDI F. les ictères néonatals intenses
d'origine indéterminée, Université SIDI Mohamed ben
Abdellah. Faculté de médecine et de pharmacie
39. OZKAN H, HALE OREN MANSUR TATTLI, HALIL, ATTES, ABDOULLAH
KUMRAL, and NURAY : erythroid apoptosis in idiopathic neonatal jaundice,
pediatrics volume 121, november, may 2008.
40. KABAMBA A MUKUKU O, KASONGO B, MULANGU A, MUTOMBO A,
DIBUE J et coll. Ictère pathologique du nouveau-né à
l'hôpital BONZOLA de Mbuji-Mayi. The pan african médecine journal
2014
41. CHOLA CHEMBO, problématique de la prise en charge
de l'ictère néonatal à l'hôpital Jason Sendwe,
mémoire de fin d'étude, Médecine Unilu Aout 2015
inédit
42. BERKOUD NAIMA, ictère néonatal à
l'hôpital tlemcen, mémoire de fin d'étude,
Université Abou bekr Belkaid, septembre 2016 [en ligne]
43. MBO LESELEBE Joseph, profil épidemio-clinique de
l'ictère néonatal à l'hôpital Sendwe, mémoire
de fin d'étude, Médecine Unilu, Aout 2015
44. KABENGA KABAMBA Henry, ictère néonatal
pathologique, aspect clinique, thérapeutique et évolutif cas des
Cliniques universitaire, Mémoire de fin d'étude septembre 2015,
Inédit
45. RODGERS PA, STEVENSON DK: Developmental biology of heme
oxygenase. Clin Perinatol 1990, 17(2): 275-291.
46. MAISELS MJ, GIFFORD K, ANTLE CE, and LEIB GR: Jaundice in
the healthy newborn infant: a new approach to an old problem. Pediatrics 1988,
81(4) :505-511.
47. BUCHAN PC: Pathogenesis of neonatal hyperbilirubinaemia
after induction out labour with oxytocin. Br Med J 1979
48.
66 | P a g e
WOYTON J, AGRAWAL P, ZIRNRNER M: Evaluation of the effect of
oxytocin use for labor induction on frequency of occurrence and severity of
neonatal jaundice].Ginekol Pol 1994 65(12): 682-
49. V. J. FLAHERMAN, A FERRARA,T B NEWMAN. Predicting
significant hyperbilirubinaemia using birth weight: Arch Dis Child Fetal
Neonatal Ed 2008;
50. LAPLANE (R.) Ictères. 1n : Abrégés
de Pédiatrie Paris, Masson ed.
51. GOURLEY GR: Breast-feeding, neonatal jaundice and
kernicterus. Semin Neonatol 2002,7(2) : 135-141.
52. SCHNEIDER AP. Breast milk jaundice in the newborn. A real
entity. Jama 1986, 255(23):3270-3274.
53. PERELMAN (R.), AMIEL TISON (CL.), DESBOIS (J.C.).
Pédiatrie Pratique - Périnatalogie. Paris, Maloine ed. , 1985
54. ABDULAZIZ ALKHOTANI, ESSAM ELDIN MOHAMED NOUR ELDIN, AMAL
ZAGHLOUL et SHAKIL MUJAHID, évaluation de l'ictère
néonatal dans la région de La Mecque, Scientific Reports 4,
Numéro d'article: 4802. 2014
55. KAFUTI NGOY, profil épidémiologique et
prise en charge de l'ictère néonatal, aux Cliniques
Universitaires de Lubumbashi, mémoire de fin d'étude, Mai 2015,
Inédit
ANNEXE
FICHE DE RECOLTE DES DONNEES
I. ASPECTS EPIDEMIOCLINIQUES
? RENSEIGNEMENT EN RAPPORT AVEC LE NNE
1. AG : SA 2. AGE NNE (Jrs) 3. SEXE : M F 4. GS et Rh
NNE
8. LIQ AMNIOTIQ
5. POIDS DE NCE : <2500 g 7. ATCD D'ICTERE : OUI
2500-4000g
NON
>4000g
6. COMMUNE)
? ANTECEDENTS MATERNELS
|
1. AGE : 2. NOTION DE SENSIBILISATION MATERNELLE : OUI
|
NON
|
NON
3. GS et Rh MATERNEL 4. ID OBSTETRICALE : P G A D 5. IUG :
OUI
|
6. CPN : OUI
|
NON
|
7. TYPE GROSSESSE 8. TYPE D'ACCOUCHEMENT
|
|
8. RUPTURE DES MEMBRANES : RPM
|
PRECOCE
|
INTEMPESTIVE
|
TEMPESTIVE
|
|
? CLINIQUES
1. APGAR : EXCELLENT
|
BON
|
DEPRIME
|
2. SOUFFRANCE PERINATALE
|
3. AGE D'APPARITION DE L'ICTERE : < 24h 24h-48h > 48h
4. DEGRE D'ICTERE : VISAGE
|
VISAGE ET TRONC
|
TOUT LE CORP
|
|
5. SIGNES D'ACCOMPAGNEMENT : -PALEUR : OUI
|
NON
|
-HPM : OUI
|
NON
|
|
-SPLENOMEGALIE : OUI
|
NON
|
- T° : NORMALE
|
FIEVRE
|
HYPOTHERMIE
|
|
- SELLES(ASPECT) -URINE FONCEE : OUI
|
NON
|
6. SIGNES NEUROLOGIQUES
|
Lesquels :
9. ALIMENTATION DU NOUVEAU NNE : LAIT MATERNEL LAIT INFANTIL
10. AUTRES SIGNES
? PARACLINIQUE
1. HB HCT TEST DE COOMBS : DIRECT INDIRECT CRP
VS TRANSAMINASES: ALAT: ASAT: BD BI BT
|
AUTRE
? ETIOLOGIE
1. INFECTION NEONATALE : OUI
|
NON
|
|
2. INCOMPATIBILITE FOET0MATERNEL : OUI
|
NON
|
Laquelle
|
67 | P a g e
3. PRESENCE D'UN HEMATOME/CEPHALEMATOME: OUI NON
4. ASPHYXIE PERINATALE 5. PHYSIOLOGIQUE AUTRE CAUSE
? TYPE D'ICTERE SELON LA BILIRUBINEMIE
1. BILURIBINE DIRECTE
2. BILURIBINE INDIRECTE
3. I. A BILURIBINE MIXTE
II. ASPECTS THERAPEUTIQUES
|
1. PHOTOTHERAPIE : OUI
|
NON
|
2. EXSANGUINOTRANSFUSION : OUI
|
NON
|
NON
NON
8. AUTRE TRAITEMENT
3. ANTIBIOTIQUE : OUI
7. EXPOSITION AU SOLEIL
III. ASPECTS EVOLITIFS
4. TRANSFUSION : OUI
5.PHENOBARBITAL
68 | P a g e
|
1. GUERISON
|
2. DECES
|
3. NON PRECISE
|
4. COMPLICATION : 5. SEJOUR :
69 | P a g e
QUELQUES FIGURES

Figure : Principe d'action de la photothérapie
[3].

Figure : courbe d'indication de la phototherapie en
fonction de la bilirubinemie, du poids de naissance et de
l'age selon
cockington 1979
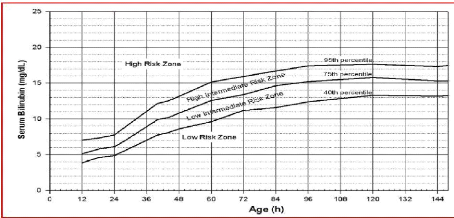
Figure : hyperbilurinémie néonatale en
fonction de l'âge du nouveau-né et définition des zones
risque
(Bhutani et Johnson)
| 


