CHAPITRE IV : Hydrochimie
dans la plupart des eaux. L'altération des roches
cristallines libère du calcium et du magnésium, mais en
quantité moindre que certaines roches sédimentaires
carbonatées, dont les principales sont la calcite (CaCO3), la dolomie
(CaMgCO3), la magnésie (MgCO3), le gypse (CaSO4).
|
Contexte
|
Mg2+ (mg/l)
|
Ca2+(mg/l)
|
|
Eaux souterraines Terrains calcaires
|
70<C<120
|
3<C<25
|
|
Eaux souterraines Terrains cristallins
|
2<C<10
|
<2C<6
|
|
Eau de mer
|
1400
|
1200
|
Tableau n°16 - Echelle de concentration des ions
Ca2+ et Mg2+
Les valeurs maximum enregistrées des teneurs en
ca2+ de 114 mg/l sont observées en 2018.
Les valeurs les plus faibles avec un minimum de 84.96 mg/l sont
observées en2010.
Nous constatons qu'il n'y a pas une grande variation des
teneurs, ceci pourrait justifier une même dissolution de formations
carbonatées des roches calcaires du Tertiaire du Murdjadjo.
Les ions (Mg2+) proviennent, comme
les ions calcium, de la dissolution des formations carbonatées riches en
magnésium (Dolomite).
La moyenne enregistrée pendant la campagne de 2018
(65mg/l) est supérieure à celle enregistrée durant 2011
(46.06 mg/l), ceci montre l'importance de la dilution par rapport à la
concentration pour l'acquisition de cet élément. Les variations
de concentration sont très faibles.
Dans l'ensemble, on peut constater, sensiblement une
légère stabilité des teneurs en ions Ca et Mg. Cependant,
cette concentration peut légèrement augmenter suite à de
fortes précipitations.
L'évolution du magnésium et du calcium est
représentée par la (Figure n°36) ci-dessous.
- 75 -
CHAPITRE IV : Hydrochimie
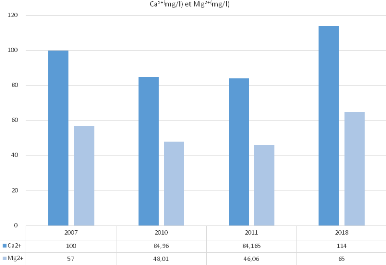
Figure n°36 - Évolution de Ca2+
et Mg 2+ du bassin de Ras-el-Aïn
2007-2018
V/-4-2 Les Sulfates :
Les origines des sulfates dans les eaux sont variées. Les
origines naturelles sont l'eau de pluie (Evaporation d'eau de mer) 1 < C
< 20 mg/l) et la mise en solution de roches sédimentaires
évaporitiques, notamment le gypse (CaSO4).
Au contact du gypse, fréquent dans les terrains
tertiaires, l'eau se charge en sulfate de calcium et devient dure
(séléniteuse) et impropre à la consommation.
D'une façon générale, la présence de
sulfate dans des eaux naturelles "non polluées" invoque la
présence de gypse ou de pyrite.
Pour l'eau destinée à la consommation humaine, en
raison de problèmes particuliers susceptibles d'introduire une
gêne pour le consommateur (goût, corrosion), l'OMS recommande comme
valeur limite 250 mg/L.

- 76 -
| 


