CHAPITRE IV : Hydrochimie
La concentration de chaque élément chimique est
figurée par une ligne verticale en échelle logarithmique.
La ligne brisée est formée en reliant tous les
points qui représentent les différents éléments
chimiques.
Un groupe d'eau de minéralisation variable mais dont
les proportions sont les mêmes pour les éléments dissous,
donnera une famille de lignes brisées parallèles entre elles.
Lorsque les lignes se croisent, un changement de faciès chimique est mis
en évidence.
IV/-2-3 Diagramme de Wilcox :
Il est utilisé pour évaluer le risque de
salinisation des sols. Il prend en ligne de compte, la conductivité
électrique ou la charge totale dissoute, toutes deux relatives à
la salinité de l'eau, et l'indice d'absorption du sodium aussi
appelée « pouvoir salinisant »
V/- Résultats et Discussions :
Présentation et interprétation des
résultats : V/-1 Balance ionique :
Avant de traiter et d'interpréter les analyses des eaux
prélevées au niveau des différentes stations), il faut
analyser la fiabilité des résultats de ces analyses.
La méthode utilisée est la Balance Ionique (BI).
Il faut rappeler qu'en théorie, une eau naturelle est
électriquement neutre. De ce fait, la somme (en équivalents
chimiques) des cations devrait être égale à celle des
anions (en équivalents chimiques). En réalité, cette
égalité est rarement obtenue. De façon
générale, la différence est attribuée aux
incertitudes, à la présence de certains ions non dosés ou
à d'éventuelles erreurs d'analyse. Ainsi, une certaine marge de
déséquilibre entre anions et cations est admise. Elle est
exprimée sous forme d'un écart relatif par la formule :
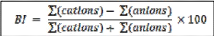
Le calcul de la balance ionique permet
généralement de vérifier la fiabilité des
résultats des analyses chimiques. Cependant, les incertitudes sur les
résultats, variables selon les techniques d'analyse, peuvent expliquer
les erreurs parfois
- 65 -
| 


