|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA
RECHERCHE
SCIENTIFIQUE
UNIVERSITE SAAD-DAHLAB DE BLIDA
FACULTE DES SCIENCES
AGRO-VETERINAIRES
DEPARTEMENT DES SCIENCES AGRONOMIQUES
Valorisation de résidus de transformation
industrielle de tomates :
Extraction et caractérisation de l'huile de
graines de tomates
PROJET DE FIN D'ETUDES EN VUE DE L'OBTENTION DU
DIPLOME
D'INGENIEUR D'ETAT EN AGRONOMIE
SPECIALITE : SCIENCES ALIMENTAIRES
AHISHAKIYE B. Martin
AIT AMMOUR Mohand
Soutenu le 10/06/2010 devant le jury composé de :
|
Mr. RAMDANE S.
|
MAA
|
USDB
|
Président
|
|
Mr. AMALOU D.
|
MAA
|
USDB
|
Promoteur
|
|
Mr. MEGATLI S.
|
MCA
|
USDB
|
Examinateur
|
|
Mme MAMECHE D.
|
MCA
|
USDB
|
Examinatrice
|
Remerciements
Nos sincères remerciements vont premièrement
à notre promoteur Mr AMALOU pour l'attention qu'il a portée
à la conception et à la réalisation de notre travail, et
dont l'aide et la disponibilité nous ont été très
précieuses.
Nos vifs remerciements à Monsieur RAMDANE pour avoir
accepté de présider notre jury, Mr. MEGATLI et Mme DOUMANDJI qui
ont accepté d'examiner et de faire partie de notre jury.
Nous tenons aussi à remercier toutes les personnes qui de
loin ou de près ont contribué à la réalisation de
ce travail, il s'agit de :
- La direction de la conserverie du Maghreb - Groupe Amour qui
a accepté de nous accueillir et nous guider pendant notre stage, en
particulier Mr MISSOUM Ahmed.
- La direction du département de Biologie qui nous a
acceptés dans ses laboratoires, particulièrement Mlle
Nabila A., Amina, Chafika, Houria et Sabrina.
- Mr Boutoumi et Mlle Chorfa du département de chimie
industrielle pour leur soutien et conseil.
- Mr Bencherchali du laboratoire de zootechnie, pour nous avoir
guidés tout au long des analyses effectuées dans son
laboratoire.
- La direction des corps gras du groupe CEVITAL pour nous
avoir accordé l'accès et encadrement lors de notre stage, plus
particulièrement Mr Youkenane, Mr Aliane, Mr Hadjal et Mr Mourad.
AHISHAKIYE B. Martin et AIT AMMOUR Mohand
Je tiens tout d'abord à remercier Dieu, de m'avoir
donné le courage pour réaliser ce travail.
Vifs remerciements
à mes parents, qu'ils trouvent dans ce travail la
récompense de leur patience et de leur soutien.
AIT AMMOUR Mohand
Mes sincères remerciements à Mr Iraguha Valens qui
m'a accueilli chez lui pendant la durée de mon stage à Bejaia.
AHISHAKIYE B. Martin
Dédicaces
le dédie ce travail :
A mes parents ;
A fa
mémoire de mes grands~ parents et de Bachir ;
A monfrere et mes swurs
;
A toute mafamiffe ;
Et a tous mes amis.
Ait Ammour Mohand
A fa mémoire de mon grandfrere D. Christo pher
décédé au 01/06/2010 a Lusaka
AHISHAKIYE B. Martin
Résumé
L'objectif de la présente étude est
d'évaluer la quantité de l'huile de grains de tomate, la
faisabilité de la valorisation économique des résidus de
transformation de tomate et la détermination des caractéristiques
de grains et de l'huile de grains de tomates produites en Algérie.
Les résidus utilisés au cours de cette
étude proviennent des tomates transformées à la
conserverie du Maghreb - groupe Amour. Ils ont été
récupérés, séchés au soleil puis les grains
ont été séparés des pelures. Après broyage
des graines, les analyses chimiques ont été effectuées
puis l'huile de grains de tomates a été extraite et
caractérisée.
La teneur de l'huile dans les graines de tomates est de
26,20%, cependant les extractions de deux heures ont permis d'en extraire
82,48%. L'acidité et l'indice de peroxyde étaient très
faibles, ce qui reflète sa bonne conservation. La détermination
du profil en AG a révélé une teneur en AGE de 54,02%, soit
52,12% d'acide linoléique (C :18 Ä9,12) et 1,9% d'acide
linolénique (C :18 Ä9,12,15). Les acides gras
saturés (AGS) les plus dominants étaient l'acide palmitique (C16
:0) dont la teneur est de 13,91% et l'acide stéarique (C18 :0)
représentant 6,18%. La teneur en acides gras insaturés (AGI) de
l'huile de graines de tomates est plus élevée que celle de
l'huile d'olive et elle est comprise dans les mêmes limites de celle de
l'huile de soja, de tournesol et de maïs.
La quantité de l'huile de grains de tomates extractible
à partir des résidus de tomates reste très faible pour
concurrencer l'huile d'olive produite en Algérie et les autres huiles
végétales importées. Mais la valorisation de
résidus de tomates est possible si la production de tomates
destinées à la transformation industrielle est doublée.
Summary
The aim of this study is to evaluate the quantity of oil from
tomato seeds, the economic feasibility of the valorization of the tomato
processing waste and the determination of the characteristics of seeds and oil
from tomato residues produced in Algeria.
The residues used during this study come from tomatoes processed
at the Conserverie du Maghreb - Groupe Amour. They were recovered, dried by sun
and then seeds were separated from peels. After crushing of seeds, the chemical
analyses were carried out and the tomato seeds oil were extracted and
characterized.
The content of oil in tomato seeds is 26,20%, however the two
hours extractions made it possible to extract 82,48% from them. The peroxide
index and acidity value were very low, which reflects its good conservation.
The determination of the fatty acids profile revealed a content in essential
fatty acids of 54,02%, with 52,12% of linoleic acid (C:18 A 9,12)
and 1,9% of linolenic acid (C:18 A 9,12,15). The most dominant saturated fatty
acids were the palmitic acid (C16:0) whose content is 13,91% and stearic acid
(C18:0) accounting for 6,18%.
The unsaturated fatty acids content of the tomato seeds oil is
higher than in the olive oil and it is included within the same limits of the
corn, sunflower and soya oil.
The extractable quantity tomato seeds oil from the tomato
residues remains very low to compete with the olive oil produced in Algeria and
other imported vegetable oils. But the valorization of tomato residues is
possible if the production of tomatoes intended for the industrial
transformation is doubled.
Key words: tomato wastes, oils extraction,
valorization, tomato seeds oil.
j4,11A
|
~~~~~LN lb1 s1=7 A,3.).1.7N41
Lo..3
|
,
|
1.3=1.41,11
j33..144.4311 4.3S J L.4).111 63.4 cy.3
,_;41
|
. yly11 A-N:LIA1-
1"1"11.c31.:) (:)c. ""S.1.
lai="11 J49.-N5
~~ , Lr.-42,11
cfi ..41-2445
|
~.~ . ..).9.4c
· -
uj .11
|
1.3=1.41,11 4.
j.hu..c6 *L.13 (..3 1+4
1.5 L.4).111 b cri 4`.1.1..a,..J' 1
|
4111
|
171.11.111
|
~~~~,~ Ls.11
|
4`1_511 u.Z1.&:1
1.5
|
,113 .1%43 A41: 1411
LLIILNall Ls.11 .3* 5 , ~~(,~~
~~+~~~
|
c:)-4
|
~~~~~(~
|
.
|
~+~~~
|
|
82,48y _AI 4`3NIc jicL.. S.L.3 ~~
~~~~~ ~~~~ ~~#~*~~%~ , k,L4114 26,20
Sal s -.44z
|
4.2S vl I Ap.:=4_NI1 A445111 cyc.
LILC* 11
|
. 41-1,....*Ai J
Li-s..5 40:.11 Letil
|
,
|
L.:cLia:14 4`,1.311 3 ~,
|
',UL4114
.
|
|
7, cy.3
',UL4114
|
1,93 40034. c.>:=A. cD-4 .'41. 52,12
|
cl*J:1. A:1.4114
|
54,02 `73j
|
~~~~~%~ Ap*A.111 7,%
|
7, 3 ZIL4114
13,91y.A. Liall d41-111 C.);=.4 ~SIAZ
Z2÷1A1. .44.111
c.);=141 .411.
(~~
4- c:).° A-.9..) 9 ~~~~~~~ ~~~ ~~ ~~~~~~~~ 4- cD-4
_;61 Z24-- ~~ ~~ AP.4.111
c.).°1-4)11 -.444S
.(761-16,18)4..J1
|
. 1~~~ 0+ ~~~!
|
,
|
1÷3-11 ~~~~
~~ ~~~~ ~~~~
|
3 .511.341
vi 4114"11 ca34.511 Jima
1.11.41,11 J.1.11111 c).3 Lca&I,.11
1.11.41,11 j33..1
-44÷s
. J. l :;4.4.1.411
e.)=1.41.11 X15,1 44.:J1.2S 'Alct.:=.4 1.5 131
USIA4.4.1.1.1".01111.111 b L) a,1
CA3 .s~~34wAll Ayluil a },
j11
. ~~~~~~~..)33-.1 ~~~ ,LN
a, ,~~~~~ u.Z1.&:uw' 1
,eintALLII ~~~,~ ~~~~~ :
4.)11 4:1A15II
Sommaire
Sommaire
Introduction générale 1
Partie I : Etudes bibliographique
1. Situation économique de la filière tomate 4
2. Présentation botanique 12
3. Composition chimique de la tomate fraiche 14
4. Technologie de transformation de tomate 15
5. Les sous produits de tomate 19
6. La valorisation 22
Partie II : Etude expérimentale
Chapitre 2 : Matériel et méthodes
31
2.1. Matériel végétal . 31
2.2. Méthodes d'analyses 40
Chapitre 3 : Résultats et discussions
62
3.1. Résultats analyses chimiques des graines de tomates
62
3.2. Analyses physico-chimiques de l'huile de graines de tomates
66
3.3. Résultats de la détermination du profil en
acides gras de l'huile de graines de 70
tomates
3.4. Résultats de la détermination de la
résistance à l'oxydation 75
Conclusion générale 78
Liste des abréviations
- AG: acide gras
- AGE : Acides gras essentiels
- AGI : Acide gras insaturé
- AGL : Acides Gras Libres
- AGMI : Acides gras Monoinsaturés
- AGPI : Acide Gras Polyinsaturé
- AGS : Acides Gras Saturé
- AMITOM : Association
Méditerranéenne Internationale de la Tomate
- ASE : Accelerated Solvent Extraction :
Extraction par solvant accéléré
- Ca: Calcium
- Cu: Cuivre
- DCT: Double Concentré de Tomates
- DHA: DocosaHexanoic Acid : acide
docosahéxanoïque
- EPA: EicosaPentanoic Acid: Acide
Eicosapentaénoïque
- Fe: Fer
- HAP : Hydrocarbures Polycycliques
Aromatiques
- HE: Huile Essentielle - K:
Potassium
- MAE : Microwaves-Assisted Extraction :
Extraction Assistée par microondes - MAT:
Matière Azoté Totale
- Mg: Magnésium
- MG: Matière Grasse
- MM: Matière minérale
- Mn: Manganèse
- MS: Matière Sèche - Na:
Sodium
- Nsol: Azote soluble -
Ntot: Azote totale
- P: Phosphore
- PL: Phospholipides - S:
Soufre
- SAE : Sonicated-Assisted Extraction :
Extraction assistée par Ultrasons
- SBA : Sidi Bel Abes
- SC-CO2 Extraction :
Supercritical CO2 Extraction : Extraction par CO2 Supercritique
- SFE : Supercritical Fluid Extraction :
Extraction par Fluide Supercritique - TDA: Terres
décolorantes Activées
- USDA: US Department of Agriculture
- UAE : Ultrasound- assisted Extraction :
Extraction assistée par Ultrasons - WPTC: world
processing tomato council ( Conseil mondial de la tomate d'industrie)
- Zn: Zinc
Liste de Tableaux et figures
1. Liste de Tableaux
Titres pages
Tableau 1 : Principaux pays consommateurs de tomates 6
Tableau 2 : Evolution des productions des tomates industrielles
(00 - 06) 8
Tableau 3 : Transformation de tomates en Algérie
(2000-2004) 8
Tableau 4 : Les entreprises de transformation de tomates
industrielle en Algérie 9
Tableau 5 : Composition de la tomate fraiche 13
Tableau 6 : Composition chimique globale des résidus de
tomates 18
Tableau 7 : Composition chimique de graines de tomates 20
Tableau 8 : Caractéristiques physico-chimiques de l'huile
de grains de tomates 26
Tableau 9 : Composition de la fraction stérol de l'huile
de grains de tomates... 27
Tableau 10 : Profil en AG de l'huile de grains de tomates 28
Tableau 11 : Résultats des analyses des grains de tomates
62
Tableau 12 : Résultats de l'extraction et du dosage
spectrophotométrique 64
de lycopène et du â--carotène
Tableau 13: Rendement globale d'extraction de l'huile de graines
de 65
tomates après 2 heures d'extraction
Tableau 14 : Caractéristiques physico-chimiques de l'huile
de graines 66
des tomates et des autres huiles végétales
Tableau 15 : Profil en acides gras de l'huile de graines de
tomates 70
Tableau 16 : comparaison du profil en acides gras de l'huile de
graines de 73
tomates raffinée aux principales huiles
végétales consommées en Algérie
Tableau 17 : Principaux pays producteurs de tomates (2000 - 2005)
Annexe i
Tableau 18 : Les principaux acides gras saturés Annexe
ii
Tableau 19 : Les principaux acides gras insaturés Annexe
iii
Tableau 20 : Prétraitement des résidus de
fabrication de concentré de 1-Annexe iv
tomates pour l'extraction de l'huile de grains de tomates
Tableau 21 : Teneur en résidus sec total dans les graines
de tomates 1-Annexe iv
Tableau 22 : Teneur en cendres des grains de tomates 1-Annexe
iv
Tableau 23: Détermination de la teneur en
Azote/protéines 2-Annexe iv
Tableau 24: Dosage de la teneur en MG des grains des tomates par
l'éther de pétrole 2-Annexe iv
Tableau 25 : Dosage de la teneur en MG des grains des tomates par
l'hexane 2-Annexe iv
Tableau 26: Dosage de la teneur en MG des grains des tomates par
le diéthyl-éther 2-Annexe iv
Tableau 27: Extraction et dosage de lycopène et de
â--carotène 3-Annexe iv
Tableau 28 : Détermination de la teneur en cellulose brute
3-Annexe iv
2. Liste de figures
Figure 1 : repartition de la production de tomate dans les
principaux pays 4
producteur en 2005
Figure 2 : production de tomate en Algérie 1990 - 2005
7
Figure 3 : Evolution des importations de conserve de tomates en
Algérie 10
01-04
Figure 4 : Coupe longitudinale (à gauche) et coupe
transversale d'un fruit 12
de tomate
Figure 5 : Diagramme de fabrication de concentré de
tomates 17
Figure 6 : Extraction assistée par ultrasons, microondes
ou 24
accélérée
Figure 7 : Mode d'obtention de la matière première
32
Figure 8 : Dispositif de dégommage-neutralisation 36
Figure 9 : Dispositif de décoloration 38
Figure 10 : Filtration de l'huile après
décoloration 38
Figure 11 : Dispositif de désodorisation 38
Figure 12 : Courbe du test d'oxydation
accélérée 60
Figure 13 : histogramme de composition des résidus humides
et des 61
résidus secs
Figure 14 : Chromatogramme du profil en acides gras de l'huile de
69
graines de tomates
Figure 15 : Courbe de temps d'induction de l'huile de graines de
tomates 75
aux températures de 100, 110 et 120°C
Figure 16 : Courbe d'extrapolation des temps d'induction à
20°C 76
Figure 17 : Courbe d'étalonnage des sucres totaux
4-Annexe iv
Figure 18 : Courbe d'étalonnage phosphore 4-Annexe iv
Figure 19 : Courbe de temps d'induction à 100°C
5-Annexe iv
Figure 20 : Courbe de temps d'induction à 110°C
6-Annexe iv
Figure 21 : Courbe de temps d'induction à 120°C
7-Annexe iv
Introduction générale
Introduction générale
La gestion des déchets est une question importante pour
l'industrie alimentaire qui est un secteur important de l'économie
mondiale. Au-delà de la manipulation des produits frais, les nouvelles
biotechnologies permettent une réutilisation des résidus afin
d'obtenir des bioproduits à valeur ajoutée élevée.
Les tonnes de tomates sont traitées chaque année dans le monde
par l'industrie agro-alimentaire (Rosales et al. 2002; Tommonaro et al.
2008). La dessiccation des résidus solides de tomate produite
représente une approche importante pour produire des engrais ; le but de
la récupération des ces résidus solides est d'extraire des
bio-polymères, du lycopène, de l'huile et la production
d'aliments pour le bétail et du compost. Cette approche est une
excellente alternative pour une exploitation adaptée à la
nouvelle philosophie du développement durable (Leoni, 1992;
Tommonaro et al. 2008).
Les premiers travaux concernant l'utilisation des coproduits
de la tomate datent des années 1960, travaux menés dans les pays
où la production et l'utilisation industrielle de ce fruit
dégagent des volumes de résidus très important (Chine, les
pays d'Amérique du Sud, Italie, Espagne, Iran etc.). Ces travaux
visaient avant tout l'utilisation de ces résidus dans l'alimentation du
bétail plus particulièrement les ruminants, du fait de la forte
teneur en fibre des pelures, même si quelques expérimentations ont
eu lieu sur les porcs et les volailles (Cotte, 2000).
Les travaux récents menés par différents
chercheurs visent à exploiter les propriétés
fonctionnelles ou extraire des molécules contenues dans ces
résidus. C'est le cas de l'étude Réalisée par les
chercheurs iraniens (Fahnaky et al. 2008). Les résultats de ce
travail ont montré que la poudre de pelures de tomate peut être
utilisée en petite quantité (1-2%) comme un agent
épaississant pouvant remplacer des hydrcolloïdes comme la gomme
guar, la gomme de xanthane ou la gomme de caroube. Cette utilisation
satisferait la demande croissante en ingrédients naturels à la
place des additifs synthétiques.
L'élimination des graines, des peaux et des parties
gélatineuses lors de la transformation de tomate, entraine une
diminution en certains constituants biofonctionnels du concentré de
tomate comme la cellulose, les pectines et le lycopène ; leur
réincorporation sous forme de poudre signifie le retour de ces
ingrédients dans le produit (Fahnaky et al. 2008).
Le projet EUTOM coordonné par Sijmom dont le but est de
créer de nouveaux additifs à partir de résidus de la
transformation de tomate, prévoit de transformer près de 4
millions de tonnes de sous produits de tomate en protéines, sucres,
fibres et huiles. Le centre de recherche espagnol AZTI affirme que l'huile
provenant des résidus de tomates est intéressante du fait de sa
teneur en acides gras polyinsaturés (AGPI) (Anonyme (c),
2009).
Une étude menée par des chercheurs italiens
visait à isoler à partir des résidus issus de la
transformation industrielle de tomates, des polysaccharides naturelles à
application industrielle ayant une activité antigénique
utilisé dans l'industrie pharmaceutique pour la formulation des vaccins,
ainsi que leur utilisation comme additifs alimentaires grâce à
leurs propriétés émulsifiantes, viscoélastiques,
polyélectrolytiques, adhérentes, biocompatibilité,
stabilisantes, etc.
(Tommonaro et al. 2008).
Sur le continent africain, les travaux visant la valorisation
des résidus de tomates ont été effectués en Egypte
(El-Tamimi et al. 1982). Le but de cette étude était de
déterminer le profil en acide gras, l'hydrogénation et la
stabilité de l'huile de grains de tomates en comparaison avec l'huile de
coton.
En Algérie la production de tomate est de 1 092 270
tonnes en 2004 (FAQ-STAT, 2007) dont 276 000 tonnes sont
transformés industriellement (Anonyme (f), 2006), ce
qui représentent environ 8 280 tonnes de déchets. Ces
résidus constituent une excellente source en nutriments tels que les
caroténoïdes (lycopène, â--carotène, etc), les
protéines, les sucres, les fibres, les cires et l'huile qui peuvent
être utilisés pour des applications industrielles, alimentaires,
pharmaceutiques et cosmétiques (Elvira et al. 2006).
Ce travail a pour but d'estimer la faisabilité et
l'exploitation économique des résidus de transformation
industrielle des tomates produites en Algérie ; évaluer le
rendement en huile de tomates extractible à partir des graines ; et la
caractérisation physico-chimiques de l'huile ainsi extraite.
La méthodologie adoptée pour la réalisation
de ce travail comporte 5 étapes, il s'agit :
- Prétraitements : la
récupération, le séchage des résidus et la
séparation des graines et des pelures
- Extraction par solvants de l'huile des graines
de tomates
- Caractérisation physico-chimiques des
graines de tomates
- Caractérisation physico-chimiques de
l'huile des graines de tomates
- Détermination du profil en acides gras
de l'huile des graines de tomates.
PARTIE I :
Etude bibliographique

PARTIE I : Etude bibliographique
1. Situation économique de la filière
tomate 1.1. Dans le monde
1.1.1. La production
La tomate est, après la pomme de terre, le
légume le plus consommé dans le monde. Selon les statistiques de
l'organisation des Nations unies pour l'alimentation et l'agriculture, la
production mondiale de tomates s'élevait en 2007 à 126,2 millions
de tonnes pour une surface de 4,63 millions d'hectares, soit un rendement moyen
de 27,3 tonnes à l'hectare (FAQ-STAT,
2009).
Ces chiffres ne tiennent toutefois compte que de la production
commercialisée, et n'incluent pas les productions familiales et
vivrières qui peuvent être non négligeables dans certaines
régions (Anonyme (b), 2010).
La Chine avec une production de 33,6 millions de tonnes est de
loin le premier producteur mondial de tomate. 85% de cette production est
destinée essentiellement au marché intérieur pour la
consommation en frais (Heuvelink, 2009 ; Anonyme (b)
2010). Elle est suivie par cinq pays produisant chacun plus de 5
millions de tonnes : les États-Unis, la Turquie, l'Inde,
l'Égypte, et l'Italie. (Anonyme (b),
2010)
La figure 1 donne la répartition de la production de
tomate dans les principaux pays producteurs en 2005.
|
30 25 20 15 10 5 0
|
|
|
%
e
n
2 0 0 5
|
|
|
Chine
USA
Turquie
Inde
Egypte
Italie
Iran
Espagne
Bresil
Mexique
Russie
Grece
Ukraine
Uzbekistan
Chilie
Maroc
Portugal
Nigerie
Algerie
Tunisie
Syrie
Canada
Cuba
France
|
Pays
Figure 1 : repartition de la production de tomate dans
les principaux pays producteur en 2005 (Source :
United Nations, Food and Agriculture Organization, FAO- Stat database
(10/2007).
La production de tomates fraîches pour la transformation
industrielle représente 26,8 millions de tonnes, soit 23,4 % de la
production mondiale en 2002 (Anonyme (b), 2010). Les
trois principales zones de production sont la Californie, le bassin
méditerranéen et la Chine.
La Californie produit 10 millions de tonnes, soit 96 % de la
production des États-Unis. La production des pays du bassin
méditerranéen (onze pays dont cinq de l'Union européenne)
s'élève à 10,5 millions de tonnes.
La production chinoise atteint 2,8 millions de tonnes en 2002,
mais connaît une croissance très rapide. Les autres pays
producteurs sont localisés dans l'hémisphère nord : le
Canada, la Hongrie et la Bulgarie, et dans l'hémisphère sud : le
Brésil, le Chili et l'Argentine (Anonyme(b)
2009). (annexe i).
1.1.2. Échanges internationaux
En 2006, les exportations de tomates fraiches ont porté
sur un peu plus de 6 millions de tonnes, soit 4,8 % de la production mondiale
de l'année.
Les trois premiers pays exportateurs (environ 1 million de
tonnes chacun) sont le Mexique, la Syrie et l'Espagne. Le Mexique fournit
essentiellement les États-Unis, et l'Espagne l'Union européenne
(FAO-STAT, 2009 ; Anonyme (b) 2010).
La même année les premiers pays importateurs de
tomates fraiches sont dans l'ordre les États-Unis, l'Allemagne, la
France, le Royaume-Uni et la Russie (Anonyme (b), 2010).
Concernant la tomate transformée (pâte et
purée), les principaux pays exportateurs sont en 2006 la Chine, l'Union
européenne, les États-Unis, le Chili et la Turquie. Cependant, la
Chine, dont la production connaît une croissance impressionnante, est de
loin l'exportateur le plus important avec 675 000 tonnes de pâte
exportée en 2007, chiffre multiplié par six entre 1999 et 2007
(ANONYME (K), 2007). La même
année, les principaux pays importateurs sont la Russie, le Japon,
l'Union européenne, le Mexique et le Canada (Anonyme
(b) 2010).
1.1.3. Consommation
Selon les statistiques de la FAO, la consommation mondiale de
tomates s'élevait en 2003 à 102,8 millions de tonnes.

Elle est un peu moins élevée que la production,
les 18 premiers pays grands consommateurs de tomates représentant 77 %
de la consommation global. En tête figure la Chine (24,6 %) suivie par
les États-Unis (9,8 %), l'Inde (8,7 %), la Turquie (5,9 %) et
l'Égypte (5,9 %) (Anonyme (b),
2010). Parmi ces pays, apparaissent aussi la France, l'Allemagne
et le Japon qui jouent un moindre rôle dans la production.
Si l'on considère la consommation annuelle par
habitant, le record appartient à la Libye avec 117 kg, suivie par la
Grèce (115 kg) et d'autres pays du bassin méditerranéen
(Tunisie, Turquie, Égypte, Italie, Liban). Ces chiffres ne tiennent pas
compte de l'autoconsommation (Anonyme (b),
2010).
Les Principaux pays consommateurs de tomates sont donnés
dans le tableau 1.
Tableau 1 : Principaux pays consommateurs de
tomates
|
Année 2003
|
Consommation totale (milliers de tonnes)
|
Consommation par habitant
(kg/habitant/an)
|
|
Grèce
|
1 268
|
115
|
|
Turquie
|
6 112
|
85
|
|
Égypte
|
6 070
|
84
|
|
Italie
|
3 797
|
66
|
|
Iran
|
3 394
|
49
|
|
Espagne
|
1 753
|
42
|
|
Ouzbékistan
|
1 096
|
42
|
|
États-Unis
|
10 109
|
34
|
|
France
|
1 556
|
25
|
|
Ukraine
|
1 170
|
24
|
|
Royaume-Uni
|
1 347
|
22
|
|
Chine
|
25 265
|
19
|
|
Brésil
|
3 305
|
18
|
|
Russie
|
2 540
|
17
|
|
Allemagne
|
1 226
|
14
|
|
Mexique
|
1 253
|
12
|
|
Japon
|
1 066
|
8
|
|
Inde
|
6 836
|
6
|
Source : Anonyme (b), 2010
PARTIE I : Etude bibliographique 1.2. En
Algérie
La production de la tomate en Algérie était de
402 020 tonnes en 1990, elle a connu des variations (augmentations et
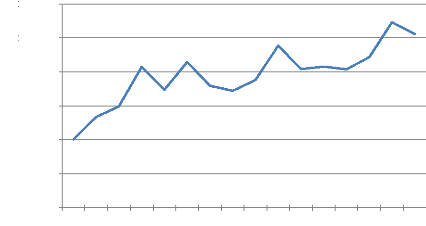
diminutions) pour atteindre son pic en 2004 de 1 092 270 tonnes. La figure 2
représente l'évolution de la tomate en Algérie entre 1990
et 2005 :
production de Tomate en Algérie de 1990-2005
1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002
2003 2004 2005
Production en milliers de tonnes
1 200,00
1 000,00
400,00
800,00
600,00
200,00
0,00
Années
Figure 2 : Evolution de la production de tomate en Algérie
1990 - 2005 Source : FAO-STAT, 2007
1.2.1. Tomate industrielle et Industrie de conserve de
tomate en Algérie
La culture de la tomate industrielle en Algérie a
démarré dans les années 1920, dans la région de
l'est avec la création de la première conserverie TOMACOOP
à Bône (actuellement Annaba). Le nombre d'usines à
l'échelle nationale est passé de 5 à 26 entre 1970 et
2000. Les surfaces consacrées à la tomate d'industrie ont
également augmenté, pour passer de 100 hectares en 1930 à
2 000 en 1960, pour arriver à une fourchette comprise entre 24 000 et 31
000 hectares ces dernières années (AMITOM,
2010).
La tomate est, en 2003, la principale culture industrielle.
Elle connaît actuellement un renforcement de sa culture en raison du
niveau important que connaisse la consommation nationale de conserves de
tomate. Consommation estimée à plus de 3 kg par habitant et par
an et susceptible de croissance importante (Rachedi,
2004).
Cette culture occupe environ 25 000 Ha. Elle est fortement
concentrée (plus de 80%) dans la région Est, notamment dans les
wilayat de El-Tarf, Skikda, Guelma, Annaba et Jijel. Le reste, soit 20%,
étant réparti entre le centre et l'ouest de pays. Régions
où cette culture prend de l'ampleur suite aux rendements importants
obtenus en irrigué (Rachedi, 2004).
Tableau 2 : Evolution des productions des tomates
industrielles (2000-2006)
|
2000/2001
|
2001/2002
|
2002/2003
|
2004
|
2005
|
2006
|
|
Superficie (ha)
|
28 864
|
24 246
|
24 690
|
27 307
|
21 265
|
10 569
|
|
Produits frais (t)
|
475 643
|
296 617
|
413 977
|
580 078
|
509 665
|
247 226
|
|
Rendement (t/ha)
|
16,5
|
12,2
|
16,8
|
21,24
|
23,97
|
23,39
|
Source : Rachedi, 2004 et Anonyme (e),
2007
Le potentiel de production mis en place à travers les
unités de fabrication de conserve de tomates est évalué
à environ 25 200 tonnes de tomates fraiches /jour. Les unités de
transformation sont principalement localisées à l'Est du pays
à proximité des lieux de production de tomates. De 2000 à
2003, la transformation de tomates à évolué comme suit
(Rachedi, 2004):
Tableau 3 : Evolution de la transformation de tomates en
Algérie (en tonnes)
|
Quantités
|
2000
|
2001
|
2002
|
2003
|
2004
|
|
Transformées
|
343 113
|
224 070
|
241 514
|
259 788
|
276 000
|
|
Conserves
|
61 069
|
40 740
|
51 768
|
52 800
|
55 000
|
AMITOM, 2010
Les principaux produits fabriqués sont le simple et le
double concentré, parfois le triple concentré. Les principales
entreprises intervenant dans ce domaine sont données ci-après
à titre indicatif, en l'absence d'un recensement exhaustif :
Tableau 4 : Les entreprises de transformation de tomates
industrielle en Algérie
|
Entreprise
|
Adresse
|
Ville
|
Production (t) en 2008
|
|
COJEK
|
Rte de la Gare BP15- El Kseur
|
Béjaia
|
4 932
|
|
JUCOB
|
RN N° :1 Boufarik 09400
|
Blida
|
|
NCA
|
RN : N°5 Rouïba
|
Alger
|
|
SICAM
|
Ferme Tarzali centre Ferroukha
Soumaa
|
Blida
|
|
TRISTAR
|
Sidi Abdelkader Rte de Zabana Ben Boulaid
|
Blida
|
|
AMOUR
|
Z.I Amour Noureddine Mouzaia
|
Blida
|
|
IZDIHAR
|
Ain Nechma
|
Annaba
|
40 000
|
|
SIPA
|
8ème KM Rte de constantine
|
Annaba
|
|
N'GAOUS
|
Z.I Route Barika BP 7-05600
|
Batna
|
|
SOUMAA
|
Bd du 1er Novembre 54 Berrahal
|
Annaba
|
|
CAB
|
Bouati Mouhamed Boumahra
|
Guelma
|
|
HIMANIA
|
Z.I de Sidi Bel Abess
|
SBA
|
7 120
|
|
LA TELLOISE
|
Z.I BP 103
|
Relizane
|
|
Total en Algérie
|
52 052
|
Source : Rachedi, 2004 et Anonyme (d), 2009
1.2.2. Echanges commerciaux de la tomate en
Algérie
Les besoins annuels nationaux en double concentré sont
estimés à 80 000 tonnes alors que la capacité actuelle
totale des usines de transformation en Algérie est de l'ordre de 140 000
tonnes de concentré par an (AMITOM, 2010).
Le secteur de la transformation de la tomate produit
essentiellement du double concentré de tomate (22% et 28%) en
boîtes métalliques (1/4 et 1/2), destiné exclusivement au
marché national (Pascal et Branthome,
2006).
Le commerce extérieur, en ces produits, concerne pour
l'essentiel l'importation de concentré de tomates sous les formes de
triple concentré destiné à être étendu en
double concentré en vue de sa mise à la consommation et de double
concentré pour sa vente en l'état.
Les importations en ces produits proviennent pour l'essentiel de
l'Europe, de Tunisie et plus récemment d'Asie (Rachedi,
2004).
Les quantités de concentré importé se
sont envolées, passant de 2 600 tonnes en 2001 à 38 100 tonnes en
2004 du fait du démantèlement tarifaire décidé par
le gouvernement en 2001 concernant aussi bien le double que le triple
concentré : à partir de 2001 la taxation additionnelle à
l'importation est passée de 60 % à 30 % (AMITOM,
2010). L'évolution des importations de conserves de
tomates en Algérie a évolué comme suit :
Importations des conserves de tomates en Algérie
2001-2004
|
|
45000
40000
35000
30000
25000
20000
15000
10000
5000
0
|
|
|
Q u a n t i
t
é
e
n
|
t o n n e s
|
|
2001 2002 2003 2004
Années
Figure 3 : Evolution des importations de conserves de tomates en
Algérie 2001-2004 (Source : AMITOM, 2010).
Les exportations enregistrées de 2000 à 2003
n'ont pas dépassé 100 tonnes de Double concentré de
tomates (DCT). En 2004, elles progresseraient significativement en
données relatives pour atteindre 240 tonnes.
Le solde des échanges reste très largement
déficitaire, à plus de 200 000 tonnes d'équivalents de
tomates fraiches (Pascal et Branthome, 2006).
2. Présentation botanique
La tomate (Solanum lycopersicum L.)
est une espèce de plante herbacée de la famille des
solanacées, originaire du nord-ouest de l'Amérique du Sud,
largement cultivée pour son fruit. Le terme désigne aussi ce
fruit charnu, qui est l'un des légumes les plus importants dans
l'alimentation humaine et qui se consomme frais ou transformé. La tomate
est devenue un élément incontournable de la gastronomie de
nombreux pays, et tout particulièrement en Grèce, en Italie, en
Espagne et en France (Anonyme (b),
2010).
La plante est cultivée, en plein champ ou sous abri,
sous presque toutes les latitudes, sur une superficie d'environ trois millions
d'hectares, ce qui représente près du tiers des surfaces
mondiales consacrées aux légumes. La tomate a donné lieu
au développement d'une importante industrie de transformation, pour la
production de concentrés, de sauces, de jus et de conserves.
L'espèce compte quelques variétés
botaniques, dont la « tomate cerise », mais la « tomate
groseille » appartient à une espèce voisine,
Solanum pimpinellifolium L. et plusieurs milliers de
variétés cultivées (cultivars).
Compte tenu de son importance économique, elle est
l'objet de nombreuses recherches scientifiques, elle est
considérée comme une plante modèle en
génétique. Elle a donné naissance à la
première variété génétiquement
transformée autorisée à la consommation
commercialisée aux États-Unis dans les années 1990
(Anonyme (b) 2010).
Il existe de très nombreuses variétés
cultivées de Lycopersicon esculentum. La
sélection faite par les hommes a privilégié les plantes
à gros fruits. On distingue cependant plusieurs catégories de
tomates, selon le mode de croissance de la plante `indéterminé ou
déterminé' et surtout selon le type de fruit :
- Les variétés à fruit plat et
côtelé, de type tomate Marmande, dont le poids est
élevé puisqu'il peut dépasser 1 kg ; les
variétés à fruit arrondi, dont le poids varie de 100
à 300 grammes, pour lesquelles il existe des hybrides dont les fruits se
conservent plus longtemps ;
- Les variétés à fruit allongé avec
une extrémité arrondie, de type Roma, ou
pointue, de type
Chico. Ces dernières variétés sont destinées
à l'industrie.
Elles ont toutes un port déterminé et leurs fruits
répondent à un certain nombre de critères technologiques
liés à leur transformation (Anonyme (b),
2010).
La tomate est une plante de climat
tempéré chaud, s
a température idéale de
croissanc e se situe entre 15 °C et 25
°C
. Elle craint le gel et ne supporte pas les
températures inférieures à + 2
°C. C'est une plante héliophile, elle demande une
2
hygrométrie moyenne, parfois un apport de
CO(sous serre verre). Sa période de végétation est assez
longue : il faut compter jusqu'à cinq à six mois entre le semis
et la prem
ière récolte. La longueur du jour a
aussi une grande importance. Sous les climats
tempérés, la tomate poussera mieux et plus vite en juillet
(durée du jour de 17 à 18h) qu'en septembre lorsque la
durée du jour diminue (durée du jour moins de 12h). Ceci
exp
lique aussi pourquoi la culture de la tomate s'adapte
mal dans certains
Anonyme(b) 2010).
pays ayant un climat propice ( La figure suivante
présente le
contenu interne d'une tomate.
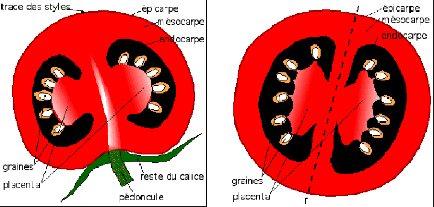
Figure 4 : Coupe longitudinale (à gauche) et co
upe transversale d'un fruit de tomate Source : Anonyme
(a) , 2005
de la tomate est la suivante:
La classification botanique
Genre : Solanum
Nom binominal (espèce) :
Solanum lycopersicum L., 1753
(Anonyme (b), 2010)
Règne : Plantae Sous-règne
: Tracheobionta Division : Magnoliophyta
Classe : Magnoliopsida Sous-classe :
Asteridae Ordre : Solanales
Famille : Solanaceae
3. Composition chimique de la tomate fraiche
Les principaux constituants chimiques de la tomate fraiche sont
donnés dans le tableau 5 :
Tableau 5 : Composition de la tomate fraiche
|
Eau (%)
|
Glucides (%)
|
Substance azotées (%)
|
Lipides (%)
|
Cendres (%)
|
|
93,5
|
3,6
|
0,95
|
0,30
|
0,74
|
(Source : cotte, 2000)
La composition biochimique des fruits de tomate fraîche
dépend de plusieurs facteurs, à savoir : la
variété, l'état de maturation, la lumière, la
température, la saison, le sol, l'irrigation et les pratiques culturales
(SALUNKHE et al. 1974). Le jus représente la
majeure partie des constituants physiques de la tomate. La tomate est
constituée de 94 à 96 % de jus, 1 à 1.5 % de pépins
et 1,5 à 2,5% de pelures et fibres. Les sucres contenus dans la tomate
sont essentiellement des sucres réducteurs : le glucose
représente 0,88-1,25%, et le fructose 1,08-1,48% (MORESI et
LIVEROTTI, 1982).
Les constituants protéiques sont présents en
faible concentration dans la majorité des fruits et légumes. Ils
sont toutefois d'une importance capitale en tant qu'enzymes impliquées
dans le métabolisme des fruits au cours de leur
croissance.
La tomate malgré sa faible teneur en protéines
(1,1%) contient pratiquement tous les acides aminés (Yu et
al. 1967).
La composition en lipides varie en fonction de la
variété et du degré de maturité lors de la
récolte ; il répertorie plus de 33 acides gras dans le
péricarpe, la teneur en lipides et 0,3 g par 100g de poids frais
(SOLTNER, 1988).
La teneur globale en cendres et de 0,75%. Les principaux
minéraux qui entre dans la constitution de la tomate sont : le Calcium
(2,95 à 3,95 ppm), le Magnésium (2,5 à 4 ppm), le Fer (0,6
à 0,8 ppm), le Phosphore (2,4 à 2,9 ppm), le Potassium (18,7
à 29,5 ppm) et le Sodium (15,7 à 17,6 ppm) (Cotte,
2000).
Outre ces principaux constituants le fruit de la tomate
contient les vitamines, des enzymes, des substances pectiques, des pigments
porphyriques comme les chlorophylles et les caroténoïdes dont le
carotène, le lycopène, les xanthophylles, etc (HART
et SCOOT, 1995).
4. Technologie de la transformation des
tomates
4.1. Nomenclature des différents produits à
base de tomates
La tomate est utilisée dans l'industrie alimentaire
pour la préparation des produits à base de tomates tels que la
pulpe, le jus, la sauce, la purée, le concentré et la poudre de
tomate (GOLOUBIEV et CHEBANE, 1988).
- La pulpe de tomate : il s'agit de tomates
écrasées avant ou après élimination des peaux et
des graines.
- Le jus de tomates : c'est le jus provenant
des tomates entières écrasées dans lesquelles la peau et
les graines ont été éliminées et qui a
été soumis à une fine désagrégation et qui
est donné à la consommation sans dilution ou concentration.
- Le sérum de tomate : c'est le jus de
tomate qui a été filtré ou centrifugé pour
éliminer complètement les particules solides en suspension.
- Les pâtes de tomates : c'est le
produit résultant de la concentration de la pulpe de tomates
après l'élimination des peaux et les graines, et contenant 24% ou
plus de substances solubles totales.
Les pâtes de tomates sont commercialisées dans
des petits emballages et vendues comme condiments et peuvent aussi être
décrites comme purée de tomates.
- La purée de tomates : c'est le terme
appliqué aux pâtes de tomates de faible concentration comprises
entre 8 et 24% de substances solides solubles. Aux USA, la purée de
tomates peut aussi être appelée « pulpe de tomate ou
concentré de jus de tomates ».
- Le sirop d tomate : il correspond au
sérum de tomate qui a été concentré. - Les
sauces de tomates :
· Le ketchup : il est
présenté comme une sauce tomate fabriquée aux USA et en
grande Bretagne à partir de purée de tomate à laquelle on
ajoute le vinaigre, le sucre, le sel, l'oignon, ail, et le poivre.
· La sauce chili : la
préparation de cette sauce est identique au ketchup, sauf que les
tomates sont utilisées entières et pelées. Il existe
d'autres sauces de tomate telles que Sauce tomate au basilic, Sauce Pizza,
Coulis de tomates, Sauce Toma coulis, etc.
4.2. Technologie de fabrication de tomates
concentrées
La transformation de la tomate en concentré de tomates
passe par les étapes suivantes :
4.2.1. Le lavage et le triage
Cette opération commune à tous les
végétaux, consiste à éliminer toutes les souillures
qui peuvent être à l'origine d'une éventuelle
contamination. Les tomates sont lavées avec de l'eau tiède et
chlorée à 5 ou 10 ppm dans des tanks ou dans des bacs sous
pression ou sous agitation permanente, suivie d'un rinçage par aspersion
d'eau à haute pression pour éliminer les résidus, les
microorganismes, les insectes, les larves et les saletés adhérent
aux fruits (GOOSE et al.1973).
4.2.2. Le broyage
Les fruits de tomates lavés sont comprimés entre 2
rouleaux de manière à faire couler le liquide des loges du
fruit.
Le mélange obtenu passe ensuite à travers d'un
tamis rotatif pour séparer le liquide des parties solides de la tomate.
Les tomates débarrassées de leurs peaux et de leurs graines sont
alors envoyées au broyeur qui assure le concassage (GOOSE et
al. 1973).
4.2.3. Le préchauffage
Il a pour rôle de cuire la pulpe afin de faciliter la
séparation de la peau et de maîtriser les propriétés
physico-chimiques du jus. Selon l'usage final du produit à fabriquer,
deux modes de préchauffage sont pratiqués ; il s'agit du cold
break qui consiste à un broyage à température ambiante
suivi d'un préchauffage à 60°C (Bartholin et Kouaa, 1981) et
le hot break dont le principe consiste à porter les tomates
immédiatement après leur broyage à la température
de 90 à 95°C pendant un temps très court (15s).
PARTIE I : Etude bibliographique 4.2.4. Le
raffinage
Permet l'obtention du jus de tomate après
élimination de la peau et des graines. le raffinage se déroule
dans une raffineuse constituée d'une série de tamis dont le
diamètre des perforation est différents. La pulpe de tomate est
introduite à l'intérieur à l'aide de pales tournant
à grande vitesse dont l'effet est de forcer le jus à travers les
perforations du tamis pour retenir les particules les plus grosses. Le pulpeur
de diamètre 1,2mm permet de retenir les peaux, les graines, les
pédoncules et les parties lignifiées. Le dernier tamis ou le
finisseur de diamètre 0,2 à 0,4 mm permet de
récupérer un jus très homogène renfermant des
particules les plus fines possibles. Un second passage des résidus
permet de récupérer le jus restant entrainant ainsi
l'augmentation du rendement d'extraction. Par ailleurs, on obtient à la
fin de cette opération des résidus qui seront valorisés,
les graines seront utilisées soit comme semences, soit pour l'extraction
d'huile, les peaux et les autres parties végétales seront
destinées pour l'alimentation animale ou brulée comme combustible
ou fuel (Moresi et Liverotti, 1982).
4.2.5. La concentration
C'est l'opération qui permet de prolonger la
durée de conservation de la tomate en éliminant la
quantité d'eau active à l'origine du volume et des coûts de
stockage (Hayes et Al. 1998).
Le jus de tomate raffiné est concentré par
évaporation sous vide partielle dans des évaporateurs à
multiples effets. Ce procédé décrit par Goose et al. 1973
est repris par Hayes et al. 1998 a l'avantage de prévenir le
brunissement et d'améliorer le transfert de chaleur. Par ailleurs,
d'autres procédés tel que l'osmose inverse et la cryodessiccation
sont utilisés dans la production des concentrés de tomates.
4.2.6. La pasteurisation
Elle assure la stabilité du concentré de tomate
par un traitement thermique de quelques secondes à une
température supérieure à 85°C, ce traitement permet
de prévenir l'altération par les lactobacilles
(Moresi et Liverotti, 1982).
La pâte de tomate est ensuite aspirée de
l'évaporateur vers la remplisseuse, qui est constituée d'un tank
de réception de la pâte de tomate, d'un échangeur de
chaleur tubulaire de pasteurisation et d'un tube de circulation
(GOOSE et al. 1973).
4.2.7. Le remplissage, sertissage et
refroidissement
La pâte pasteurisée est automatiquement
versée chaude dans les boîtes en fer blanc
pré-stérilisées avec de la vapeur. Les boîtes sont
immédiatement sorties puis retournées et laissées ainsi
pendant 3 minutes pour stériliser le couvercle (Moresi et
Liverotti, 1982).
Les boites de pâte de tomate doivent ensuite être
rapidement refroidies afin d'éviter la détérioration de la
flaveur et de la couleur à la suite de la rétention de la
chaleur. Parmi les techniques utilisées lors du refroidissement, on peut
soit pratiquer un refroidissement par l'air des boîtes empilées et
rangées de façon à permettre une bonne circulation de
l'air, soit pratiquer le refroidissement avec de l'eau chlorée par
aspersion ou par immersion (Gould, 1992).
La figure 5 résume les principales étapes entrant
dans la fabrication du concentré de tomates.
Récolte
Lavage

Broyage


Inspection et triage
Réchauffage

|
Concentration sous vide
|
|
|
|
Raffinage
|
|
|
Tamisage
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Préchauffage
|
|
|
|
|
|
|
|
|
|
Mise en boîtes
|
|
Fermeture des boîtes
|
|
|
|
Pasteurisation
|
|
|
|
Refroidissement
|
|
|
|
|
|
|
|
|
|
|
|
|
Figure 5: Diagramme de fabrication de concentré de
tomates (Source : Carvajal. 1992)
5. Les sous produits de tomates
Les coproduits de tomates sont un mélange de peaux,
graines et un peu de pulpe solidarisée aux téguments. Ils
comportent aussi de pédoncules et des parties dures de la pulpe, de
feuilles et des écarts de triage. Ils représentent selon la
technique de transformation utilisée, 2 à 5% de la masse globale
de tomates fraiches.
En Italie, dont la production est de 6 300 000 tonnes de tomates,
ils représentent 126,000 tonnes, soit 2%. (Antonio et al.
2009).
En Algérie et plus particulièrement à la
conserverie du Maghreb - Groupe Amour, ils sont estimés à 3% de
la masse de tomates fraiches transformées.
5.1. Composition chimique
Le tableau suivant donne la composition globale des
résidus de tomates. Tableau 6 : Composition chimique globale des
résidus de tomates
|
Composants
|
Teneur en %
|
|
Matière sèche (MS)
|
92.2 à 95
|
|
Matière azotée totale (MAT)
|
16.8 à 29,58
|
|
MG
|
3.45 à 21.93
|
|
Glucides :
Glucides cytosoliques 3.6
|
|
Glucides pariétaux
|
|
cellulose
|
4
|
|
pectines
|
5
|
|
Hémicelluloses (xylanes, glucanes, mannanes,
arabinoglactone)
|
25 - 30
|
|
glucoprotéines
|
5
|
|
lignines
|
20 - 25
|
|
Les cendres :
Les macroéléments : Ca (1.1 à 5.2g/Kg), P
(0.91 à 8g/Kg), Mg (2.1 à 2.41g/Kg),
Na (0.14 à 0.27g/Kg), K (7 à 8.35g /Kg)
|
|
Les oligoéléments : Fe (246 à 551ppm), Cu
(12.15 à 20ppm), Zn (5 à 56.9ppm), Mn (31.71 à 37.2ppm)
Source : Cotte, 2000)
|
Le taux de matière sèche (MS) varie en fonction
d'un éventuel séchage appliqué aux coproduits de la tomate
avant leur utilisation. Lorsque celui-ci est pratiqué, le taux de
matière sèche varie de 92,2 à 95%. En
général. les coproduits sont utilisés à
l'état frais, ce taux varie alors de 21,91 à 32,69%. L'eau
représente ainsi 3/4 du poids total du coproduit, ce qui est une des
limites à son utilisation. Seuls deux valeurs indiquent des taux de
14,64 et de 4,9% de MS. Pour cette dernière, ce taux très faible
correspond en fait à l'utilisation de tomates fraiches entières.
Pour la valeur précédente, les conditions de stockage avant
analyse ou un défaut d'extraction du jus ou concentré peuvent
expliquer cette humidité assez élevée (Cotte,
2000).
Les matières azotées totales (MAT) sont
comprises entre 16,8 et 29,58% de la matière sèche. Ces
protéines ont une composition en acides aminés proche de celle du
tourteau de soja. Ceci place les coproduits de la tomate parmi les aliments
ayant une valeur protéique intéressantes pour les ruminants. Par
ailleurs, le pourcentage d'azote soluble peut aller de 11,01 à 46,6% de
l'azote. Cette large plage de variation s'explique par la proportion d'azote
liée aux différentes fractions glucidiques, ellemême
dépendante des processus technologiques (Cotte,
2000).
Le taux de matière grasse (MG) varie de 3,45 à
21,93% de la MS et en moyenne 11,4% ce qui confère aux coproduits de la
tomate une valeur énergétique intéressante.
Ce taux dépend avant tout de l'importance des
pépins, principale source de MG, dans la masse totale du coproduit.
Sont inclus dans les MG différents pigments dont les
caroténoïdes, solubles dans les solvants lipidiques mais aussi
certaines cires, constituants de la cuticule des fruits (Cotte,
2000).
La présence des polysaccharides est remarquable. La
cellulose, la pectine, les hémicelluloses et l'amidon sont des
polysaccharides ayant des propriétés structurales,
émulsifiantes, stabilisant, gélatinisant, condensant et
rhéologiques. (Antonio,2009).
PARTIE I : Etude bibliographique 5.2. Les
graines
La quantité de graines par rapport à la masse
totale des résidus de tomates varie selon les variétés.
Elle présente une particularité d'avoir un taux
élevé en MG avec une composition en AG proche de celle des
graines de soja ou de tournesol. Les parois de graines de tomates à
maturité sont très lignifiées. Leur composition est
donnée dans le tableau 7.
Tableau 7 : Composition chimique de graines de
tomates
|
Constituants
|
Abdel-Hamid, 1982
|
CANTARELLI et al. 1993
|
|
Cendre
|
5.5
|
2.0 à 9.6
|
|
Fibre brut
|
20.1
|
14.8 à 41.8
|
|
Sucres totaux
|
3.1
|
2.9 à 5.4
|
|
Protéines (Nx6.25)
|
26.2
|
22.9 à 36.8
|
|
MG
|
30.4
|
14.6 à 29.6
|
|
Extraits d'azote libre
|
14.7
|
--
|
5.3. Les pelures
La peau de tomate est constituée d'un hypoderme, d'un
épiderme, et d'une cuticule. Dans un fruit mûr, les peaux sont
essentiellement constituées de dépôts de cellulose,
d'hémicellulose et d'imprégnation de lignine. La lignine peut
représenter 15 à 35% de la paroi en liaison avec les
hémicelluloses, les substances pectiques et certaines protéines.
Elles contiennent le lycopène à l'ordre de 54mg/100g
(Elvira et al. 2006).
La cuticule correspond aux produits d'excrétion
lipidique très complexes désignés globalement sous le
terme de cire ou cutine qui sont à bases d'alcools à longues
chaînes (18 à 22 atomes de carbone) estérifiés
également par des acides gras à longues chaînes, d'acides
gras libres, d'alcools primaires (Jarrige, 1981), et
de cétones (Bonner, 1950 ; Meyer, 1961). Les
principaux acides gras retrouvés sous forme d'esters ou sous libres sont
les acides palmitique, stéarique, oléique et linoléique
(Bonner, 1950 ; Meyer, 1961). La cuticule est
également imprégnée de silice (Grenet et Besle 1991).
Certains auteurs ajoutent dans la composition de la cuticule la
subérine, substance cireuse qui relie les parois
cellulaires entre elles (Meyer, 1961).
PARTIE I : Etude bibliographique 6.
Valorisation
La production de tomates en Europe est estimé en 2005
à 16 millions de tonnes (AMITOM, 2010) dont 10
millions de tonnes ont été transformée
générant ainsi plus de 200 mille tonnes de résidus solides
(graines, peaux) (Elvira et al. 2006).
Selon la législation européenne
(directive2006/12/EC), les résidus doivent être
débarrassés sans mettre en danger la vie humaine et en
évitant d'utiliser les méthodes qui peuvent nuire à
l'environnement. (Elvira et al. 2006).
Outre la valorisation des résidus de transformation
industrielle de fruits de tomates par les méthodes classiques
(alimentation animale, compostage, épandage, etc.). Il est possible
grâce au progrès de la recherche de récupérer
certains constituants nobles nutritionnellement intéressants, à
l'instar des pigments caroténoïdes (lycopène,
â--carotène), des protéines, des sucres, des fibres et de
l'huile (75% en AGI). Ces produits peuvent être utilisés pour des
applications industrielles, alimentaires et cosmétiques
(Elvira et al. 2006). En
général. la valorisation
des résidus de tomates se résume à la
récupération des constituants suivants :
6.1. Le lycopène
Il est essentiellement abondant dans les peaux (54mg/100g). Il
est le plus commun des caroténoïdes qui se trouve dans le corps
humain et il est l'un des plus puissants antioxydants caroténoïdes.
Son nom est d'ailleurs dérivé de la classification de
l'espèce de la tomate « solanum lycopersicum »
anciennement appelé « Lycopersicum
esculentum) (Elvira et al. 2006).
Le lycopène peut être extrait de sa source
naturelle par différents processus d'extraction. Pour l'extraction des
oléorésines, on utilise l'extraction par solvant (hexane)
(Zelkha et al. 1997 in Zhao et al. 2008) ou par
fluides supercritiques, essentiellement le CO2.
Selon Zhao et al (2008), le propane qui a une
température critique douce de 96,7°C et une faible pression
critique de 4,25 MPa possède une forte puissance de dissolution des
composés non Polaires et faiblement polaires, ce qui le rend plus
approprié pour l'extraction du lycopène.
Le lycopène a un effet antioxydant et protège
contre les maladies dégénératives. Il diminue en plus le
risque de maladie cardiovasculaires et de cancer (essentiellement le cancer de
la prostate). Il a également un effet stimulateur de l'immunité
et renforce la santé de la peau et la protège contre les dangers
des UV (Elvira et al. 2006).
Les études sont en cours pour étudier d'autres
effets potentiels du lycopène tel que son rôle dans la lutte
contre le cancer du tube digestif, du sein et de la prostate
(Elvira et al. 2006).
6.2. Les fibres de tomate
Elles constituent la partie non digestible des aliments
végétaux qui favorisent le transit digestif. Les fibres
diététiques sont constituées par des polysaccharides
autres que l'amidon et plusieurs autres composés de plantes tels que la
cellulose, les dextrines, l'inuline, la lignine, les cires, la chitine, les
pectines, les â-glucanes et les oligosaccharides.
Leurs effets métaboliques sont :
> Effet positif lors des mécanismes de mastications,
> Réduire la contribution énergétique des
aliments, le taux la glycémie et le taux de cholestérol,
> Induire une sensation de satiété,
> Piéger les substances toxiques,
> Stimuler la digestion,
> Augmenter la durée de transit intestinal. etc.
The U.S. national academy of sciences, institut of medecine
conseille une prise de 25-30g de fibres diététiques/jour.
Une fraction de 75% des fibres diététique peut
être extraite des résidus de transformation industrielle de
tomate. (Elvira et al. 2006)
Les polysaccharides naturels obtenus à partir des
résidus de transformation industrielle de tomate à application
industrielle ont une activité antigénique utilisée dans
l'industrie pharmaceutique pour formuler les vaccins et d'autres produits
utilisés comme additifs alimentaires grâce à leurs
propriétés émulsifiantes, viscoélastiques,
polyélectrolytiques, adhérentes, biocompatibilité,
stabilisante, etc. (Tommonaro et al. 2008).
6.3. L'huile de graines de tomates
La quantité d'huile contenue dans les résidus de
tomate est en quasi-totalité concentré dans les graines (14.6
à 30.4% de la MS de graines ou environ 10.82% de la MS totale des
résidus). Elle est caractérisée par un taux
élevé en AGPI (68.6 à 75%) et par la présence
d'antioxydant (lycopène). Cette huile a un effet protecteur du
système vasculaire, adoucissant et calmant sur la peau
(Elvira et al. 2006).
6.3.1. Mode d'obtention
Elle est extraite par pression à chaud (Anonyme
(f) 2009) et/ou par solvant. Les extractions assistées par
ultrason (SAE ou UAE) ou par microondes (MAE) ou extraction par solvants
accélérée (ASE) sont similaires à l'extraction
conventionnelle. L'utilisation des microondes, des ultrasons ou l'augmentation
de la température et de la pression augmentent le rendement et
réduisent le volume de solvant utilisé et le temps d'extraction
(Elvira et al. 2006).
6.3.1.1. Extraction par pression (pressage
mécanique)
Le pressage de la graine préparée se fait
principalement de façon continue dans des presses à cages
métalliques filtrantes constituées par des barreaux plus ou moins
jointifs suivant la partie de la cage intéressée. La graine
préparée (flocons cuits) y est introduite et comprimée par
une combinaison de vis sans fin à pas dégressifs tournant
à vitesse généralement lente. Un cône, dont on peut
régler la position, délimite à l'extrémité
de la cage un espace annulaire plus ou moins rétréci et par
lequel sort le tourteau ou plus exactement les écailles de presse. Ce
tourteau de pression reste plus ou moins chargé en matière grasse
suivant la nature de la graine et les conditions de pression. Plus la pression
est élevée du fait du choix des arrangements et plus le taux de
déshuilage est important. Par contre, le débit est faible et
l'usure plus importante, notamment au niveau des barreaux de presse.
L'huilier est donc amené à adopter un compromis au
niveau du taux de déshuilage visé en tenant compte de son outil
industriel (Pages, 2008).
Les triturateurs industriels disposant d'une unité
d'extraction au solvant permettant
de récupérer la
quasi-totalité de l'huile restante dans les écailles de presse
n'ont pas
intérêt à procéder à un
déshuilage trop poussé à ce niveau. Des taux de l'ordre de
20% de matière grasse résiduelle sont courants pour les tourteaux
de pression de tournesol et le colza ; il ne s'agit donc à ce niveau que
d'un déshuilage partiel par pré pression. Par contre, les
artisans huiliers, ne disposant pas d'installation d'extraction, ont
intérêt à déshuiler le plus possible, l'huile
présentant la plus forte valeur ajoutée. Il faut noter que ce
système mécanique d'extraction d'huile présente des
limites.
Les presses les plus modernes ne déshuilent pas, de
façon industriellement acceptable, au-dessous de 5 à 6%.
(Pages, 2008)
6.3.1.2. Extraction par solvant
Elle repose sur le principe de mise en contact de la
matière solide et le solvant liquide. Le choix du solvant est
guidé par les propriétés chimiques et physiques de la
substance cible ; en particulier sa stabilité thermique et son
caractère polaire. Pour facilité le transfert de la substance
à extraire au liquide, la matière première est normalement
traité mécaniquement. Ce processus est utilisé pour
extraire les huiles, mais il n'est pas approprié pour les substances
thermolabiles. Certains solvants organiques qui peuvent être
utilisés comme moyen d'extraction sont toxiques et peuvent laisser des
traces dans le produit fini. L'éthanol peut être utilisé
pour remplacer ces solvants toxiques ou dangereux. En plus toutes les
extractions par solvant demandent une étape de purification après
extraction, comme la filtration ou centrifugation. L'hexane
est l'auxiliaire technologique utilisé actuellement pour l'exercice de
l'activité classée en France sous la rubrique « extraction
d'huiles végétales et de graisses animales »
(Elvira et al. 2006).
Le diagramme ci-dessous illustre ces différents modes
d'extraction par solvant :

6.3.1.3. Extraction par Fluides supercritiques (SFE) -
Extraction par CO2 supercritique (SC-CO2)
L'état supercritique d'un fluide est atteint en apportant
celui-ci à température et pression supérieures de celles
de son point critique.
Les fluides supercritiques présentent des
caractéristiques à la fois des gaz et des liquides,
propriétés qui les rendent spécialement favorables aux
opérations d'extraction. Ils ont des coefficients de diffusion plus
élevés et en même temps des viscosités et tensions
superficielles plus basses que les solvants conventionnels. La capacité
de dissolution des fluides supercritiques dépend de leur densité,
ainsi la sélectivité de l'extraction peut être
changé en ajustant la température et /ou la pression de
l'extraction (Elvira et al. 2006). Après
l'étape de l'extraction, la pression est réduite ou la
température augmentée pour diminuer la solubilité de
l'extrait, ce qui permet la séparation.
Le solvant le plus utilisé est le CO2, moins cher, sans
risques, non toxique et ses conditions supercritiques peuvent être assez
facilement atteintes. Elle peut être utilisée pour extraire les
polyphénols et autres antioxydants naturel à partir des des
résidus de tomates (Elvira et al. 2006).
Elle est convenable pour les substances thermolabiles et elle
peut être utilisée aussi pour les substances polaires si certains
modérateurs comme l'eau, l'éthanol, le méthanol et
l'acétone lui sont ajoutés (Elvira et al.
2006).
6.3.2. Caractéristiques physico-chimiques de
l'huile de graines de tomates
Les caractéristiques physico-chimiques de l'huile de
graines de tomate sont résumées dans le tableau 8.
Tableau 8 : Caractéristiques physico-chimiques de
l'huile de graines de tomates
|
Evangelos et al. 1998
|
Lois et al. 2004
|
Ayhan,
2009
|
|
Caractéristiques
|
H. brute
|
H. raffinée
|
--
|
---
|
|
Densité à 25°C
|
0.9160 #177;
24.10-5
|
0.9156 #177;
19.10-5
|
0.9151
|
0.91177
|
|
Indice de réfraction à
40°C
|
1.4603 #177;
22.10-5
|
1.4610 #177;
16.10-5
|
|
1.4733
|
|
Viscosité à 21°C (mPa.s)
|
75 #177; 0.4
|
74 #177; 0.3
|
|
|
|
Point de fumée
|
176 #177; 63.0
|
208 #177; 54
|
189
|
|
|
Couleur
|
rouge
|
22 #177; 0.5
|
10 #177; 0.1
|
-
|
Jaune
|
|
jaune
|
10 #177; 0.1
|
2 #177; 0.0
|
-
|
-
|
|
Indice de saponification (mg KOH/g MG)
|
184 #177; 6.6
|
166 #177; 2.5
|
195
|
190.2
|
|
Indice d'Iode (g I2/100g MG)
|
105 #177; 0.7
|
104 #177; 0.9
|
124
|
126.8
|
|
Insaponifiable (%)
|
1.4 #177; 0.02
|
0.9 #177; 0.01
|
|
4.33
|
|
Acidité (%)
|
1.01 #177; 8.10-4
|
0.05 #177; 10-4
|
|
0.2416
|
|
Indice de péroxyde (méq/Kg)
|
9.3 #177; 0.055
|
9.1 #177; 0.54
|
|
15
|
|
Temps d'induction à 120°C
(heures)
|
5,15
|
4,9
|
|
|
(Source : Evangelos et al. 1998; Lois et al. 2004 ;
Ayhan, 2009)
6.3.3. La partie insaponifiable de l'huile de graines de
tomates
La partie insaponifiable l'huile de graines de tomate est
représentée par les tocophérols (a-tocophérol : 202
mg/Kg, ä-tocophérol : 1059mg/Kg) et par les stéroïdes
(325 - 533 mg/100g). La composition de la fraction « stérol »
de l'huile graines de tomate est donnée dans le tableau 9.
Tableau 9 : Composition de la fraction «
stérol » de l'huile de graines des tomates
|
Stérols
|
TRR
|
Huile brute (%)
|
Huile purifiée (%)
|
|
Cholestérol
|
0.64
|
15 #177; 0.2
|
16 #177; 0.2
|
|
Brassicastérol
|
0.71
|
1.5 #177; 0.04
|
1.1 #177; 0.12
|
|
24-methylènecholestérol
|
0.81
|
1.2 #177; 0.02
|
0.9 #177; 0.004
|
|
Campestérol
|
0.83
|
6.7 #177; 0.04
|
6.1 #177; 0.06
|
|
Stigmastérol
|
0.89
|
14.6 #177; 0.24
|
14.6 #177; 0.17
|
|
A7Campestérol
|
0.92
|
0.3 #177; 0.0003
|
Trace
|
|
Clerostérol
|
1.00
|
52 #177; 2.22
|
53 #177; 1.17
|
|
A5Avenastérol
|
1.04
|
6.7 #177; 0.22
|
7 #177; 0.029
|
|
A7,24stigmastadienol
|
1.09
|
0.5 #177; 0.0005
|
0.3 #177; 0.003
|
|
A7stigmastenol
|
1.11
|
0.4 #177; 0.0003
|
0.2 #177; 0.0001
|
|
A7Avenasterol
|
1.17
|
0.1 #177; 0.0001
|
Trace
|
|
Erythrdiol
|
1.47
|
0.1 #177; 0.0000
|
ND
|
> TRR : relative retention time : temps
relatif de rétention par rapport à b-sitostérol (temps de
retention = 20.7 min pris comme 1)
> ND : Non Detecté
> Trace : < 0.1%
Source : Evangelos et al. 1998
6.3.4. Profil en acides gras
La qualité de l'huile de graines de tomate est due
à sa grande teneur en AGI (acide oléique : 23.8%, acide
linoléique : 56.5%, acide linolénique : 1.8%), et à la
présence des pigments antioxygènes (lycopène : 1.5 -
3.1ppm, il représente 90% des pigments ; b-carotène : 0.4 - 1ppm
et la tomatine, glucoalcaloïde proche de la solanine). Le profil de
l'huile de graines de tomate en acides gras est résumé dans le
tableau 10.
Tableau 10 : Profil en acides gras de l'huile de graines
de tomates
28
|
Evangelos et al. 1998
|
E. Lois et al. 2005
|
Ayhan 2009
|
|
Nom de l'acide gras
|
Acide gras
|
H. brute (%)
|
H. raffinée (%)
|
-(%)-
|
-(%)-
|
|
Acide myristique
|
C14 :0
|
0.2 #177; 0.0001
|
0.1 #177; 0.0000
|
0.10
|
1.1
|
|
Acide myristoléique
|
C14 :1
|
--
|
--
|
|
0.2
|
|
Acide palmitique
|
C16 :0
|
14.0 #177; 0.12
|
13.6 #177; 0.10
|
12.26
|
18.1
|
|
Acide hypogéique
|
C16 :1 Cis co9
|
0.4 #177; 0.0004
|
0.6 #177; 0.0001
|
0.35
|
3.2
|
|
Acide palmitoléique
|
C16 :1Cis co7
|
0.1 #177; 0.0000
|
ND
|
|
|
|
Acide margarique
|
C17 : 0
|
0.3 #177; 0.003
|
0.1 #177; 0.0002
|
0.10
|
|
|
Acide
|
C17 :1Cis co9
|
--
|
--
|
0.04
|
|
|
Acide stéarique
|
C18 :0
|
6.0 #177; 0.01
|
6.0 #177; 0.05
|
5.15
|
4.0
|
|
Acide oléique
|
C18 :1co9
|
22.0 #177; 0.21
|
22.0 #177; 0.12
|
22.7
|
24.6
|
|
Acide
|
C18 :1co7
|
0.6 #177; 0.001
|
0.1 #177; 0.0001
|
|
|
|
Acide linoléique
|
C18 :2
|
53.6 #177; 0.28
|
54.0 #177; 0.65
|
56.12
|
46.8
|
|
Acide
|
C18 :2 trans
|
0.1 #177; 0.0000
|
0.8 #177; 0.0002
|
0.08
|
|
|
Acide linolénique
|
C18 : 3
|
2.0 #177; 0.003
|
2.1 #177; 0.002
|
2.77
|
0.4
|
|
Acide arachidique
|
0 : 0
|
0.3 #177; 0.0001
|
0.2 #177; 0.0001
|
0.41
|
1.0
|
|
Acide éicosonoïque
|
0 :1
|
0.1 #177; 0.0000
|
0.2 #177; 0.0000
|
0.12
|
0.6
|
|
Acide béhénique
|
2 :0
|
trace
|
0.1 #177; 0.0000
|
0.09
|
|
|
Acide lignocérique
|
4 :0
|
0.1 #177; 0.0000
|
0.1 #177; 0.0000
|
0.17
|
|
PARTIE I : Etude bibliographique 4.1.1. Usage
Dans la majorité des cas, l'huile de graines de tomate
est intégrée dans les oléorésines de tomates
vendues pour leur richesse en lycopène. En Asie (Chine, Iran), la
production et la commercialisation de l'huile de graines de tomates est
fréquente (Anonyme (d), 2009), alors qu'en Europe,
l'huile de graines de tomates est nouvelle ; une compagnie italienne (biolyco),
prévoyait de démarrer la production industrielle de l'huile de
graines de tomate à bas prix à partir de résidus de
tomate. La production était prévue pour fin 2008 ; le prix pour
le consommateur se situant entre 6.80 et 27$ le Kg (Elvira et al,
2006).
L'huile de graines de tomate peut être utilisée
comme ingrédient alimentaire riche en AGPI, et également comme
ingrédient cosmétique et pharmaceutique (Elvira et al.
2006).
L'huile de graines de tomate comme la plupart des huiles
végétales peut être utilisée après
traitements appropriés pour la production de biocarburants (Lois,
2005) et aussi dans l'industrie de peinture, de vernis, etc.
PARTIE II :
Etude expérimentale
Chapitre 2 :
Matériel et Méthodes
CHAPITRE 3 : Résultats et discussions
3.1. Résultats des analyses chimiques des graines
de tomates
Après le séchage des résidus au soleil et
leur séparation des graines et des pelures, les déterminations de
la matière sèche, des cendres, de matière azotée
totale et les protéines, la teneur en matière grasse, en sucres
totaux, en cellulose et des pigments caroténoïdes ont
été réalisées sur les graines de tomates.
3.1.1. Rendement en graines de tomates
La composition des résidus est donnée par la figure
suivante

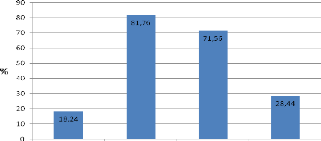

Figure 13 : histogramme de composition des résidus
humides et des résidus secs
D'après les résultats ci-haut, on constate que
la teneur en MS des résidus humides (18,24%) est 3 fois plus
élevée que celle de la tomate fraiche (6,5%); ceci s'explique par
le fait que la grande quantité d'eau contenue dans la tomate est
concentrée dans la pulpe qui est extraite pour la fabrication du DCT.
Après séchage au soleil, le taux de MS des
résidus sec est de 93,03%. Ceci montre une différence
négligeable par rapport à celui rapporté par cotte (2000)
de l'ordre de 93,5 à 95%. Ce taux dépend de l'efficacité
du séchage. En rapportant le taux de matière sèche aux
résidus humides résultant de la transformation industrielle de
tomates en 2004 (8280 tonnes), il en résulte 1510,27 tonnes de MS de
résidus secs, soit 429,52 tonnes de graines sèches et 1080,75
tonnes de pelures.
3.1.2. Caractéristiques biochimiques du
matériel végétal
La composition biochimique des graines de tomates
utilisées lors de l'expérimentation est indiquée dans le
tableau 11. Cette composition décrit de façon quantitative et
qualitative le matériel végétal destiné à
l'extraction de l'huile.
Tableau 11 : Résultats des analyses des grains
de tomates
|
Composition
|
Teneur
|
|
Eau (%)
|
6,97
|
|
MS (%)
|
93,03
|
|
Cendres (%)
|
4,16
|
|
MAT (%)
|
3,95
|
|
Protéines (%)
|
24,72
|
|
MG (%)
|
26,2
|
|
Sucres totaux (%)
|
4,25
|
|
Cellulose brute (%)
|
24,24
|
|
â--caraotène (mg/100g)
|
1,76
|
|
Lycopène (mg/100)
|
2,76
|
La détermination de la teneur en MS des graines
préalablement séchés au soleil montre un taux de
matière sèche de 93,030% et un taux d'humidité de 6,97%,
un taux favorable à l'extraction de l'huile. Ces résultats
correspondent à l'intervalle rapporté par Cotte (2000) qui est de
92,2 à 95%. Vu que le taux d'humidité résiduelle
était inférieur à 10%, aucun autre séchage
n'était nécessaire avant l'extraction de l'huile. Selon la norme
NF V 05-105 (1974), la différence entre les résultats de deux
déterminations effectuées simultanément, ou rapidement
l'une après l'autre, par le même analyste, ne doit pas être
supérieure à 2% en valeur relative pour les teneurs en
résidus sec inférieurs ou égales à 10g pour 100 g
d'échantillon (AFNOR,1982).
Cette exigence est satisfaite car, la plus grande
différence entre les résultats obtenus (voir annexe iv - tableau
21) est égale à 0,26%. Cette détermination de
matière sèche est primordiale car tous les résultats
seront exprimés par rapport à celle-ci.
Les résultats obtenus montrent un taux en cendres de
4,16%. Ce résultat est dans les mêmes plages que ceux obtenus par
les différents auteurs et chercheurs qui ont travaillé sur les
résidus de tomates tels que Cantarelli et al (1993) qui ont obtenu des
teneurs en cendre allant de 2,0 à 9,6%.
Ils sont un peu moins élevés que ceux obtenus
par Abdel-Hamid (1982) dont la teneur en cendre rapportée était
de l'ordre de 5,5%. La variabilité de la teneur en matière
minérale (cendres totaux) peut être influencée par
différents facteurs comme :
- les étapes de lavage insuffisantes ou par la
contamination par la terre, - la qualité de transport (contamination par
les bennes),
- la nature des terrains de culture et l'importance des
engrais.
Selon Cotte (2000), ce taux est faible pour l'utilisation des
résidus de tomates à l'alimentation des animaux.
Le résultat de la détermination de l'azote
montre une teneur en azote de 3,95% et une teneur en protéines de
24,72%. Cette valeur est un peu moins élevée que celle obtenue
par Abdel-Hamid (1982) qui est de 26,2%, elle est dans l'intervalle des valeurs
obtenues par Cantarelli et al (1993) dont les valeurs varient entre 22,9
à 36,8%, elle est très proche de 24,5% obtenue par Cotte (2000).
Notons que nous avons utilisé la même méthode de Kjedahl
que les auteurs cités ci-dessus. Au vue de ces résultats, les
graines de tomates disposent d'un grand potentiel en matière
azotée pour l'alimentation animale et même après
l'extraction de l'huile.
La détermination de la teneur en matière grasse
dans les graines de tomates a été réalisée en
utilisant 3 solvants à savoir, le n-hexane, l'éther de
pétrole et le diéthyléther. La teneur en MG de notre
poudre de graines de tomates est d'environ 23,40 à 26,20% selon la
nature du solvant utilisé, le taux en MG le plus élevé a
été obtenu à l'aide du n-hexane (27,26%) par contre le
taux le plus faible a été obtenu par le
diéthyl-éther (22,01%), alors que le taux intermédiaire a
été obtenu avec l'éther de pétrole (24,42%). Ceci
montre que l'hexane est le solvant le plus approprié pour cette
extraction. Ce résultat est proche de celui rapporté par
Cantarelli et al (1993) qui est de 14.6 à 29.6% de la MS de graines. La
variation de la teneur en MG peut être expliquée par les
conditions d'expérimentation et les caractéristiques du
matériel végétal (la variété, la
maturité des tomates, etc.) Les résidus issus de la fabrication
du concentré de tomates sont majoritairement constitués par les
pelures qui ne contiennent quasiment pas d'huile ; ce qui fait que le taux de
MG rapporté à la masse des résidus est de 7,45%, il faut
donc séparer les graines des pelures si l'on s'intéresse à
l'extraction de l'huile de graines de tomates.
L'extraction après 2 heures a permis d'obtenir un
rendement de 21,6%. Elle a permis de récupérer 82,48% de la
quantité de matière grasse contenue dans les graines de
tomates.
En considérant la quantité totale de tomates
transformées en Algérie (276 000 tonnes en 2004, qui ont
généré environ 8280 tonnes de résidus humides), on
constate qu'il est possible de produire 112,53 tonnes d'huile, ce qui
représente 0,32% de l'huile d'olive produite en Algérie en
2005/2006 et 0,027% des huiles végétales importées en
2009.
Le résultat obtenu lors de la détermination de
sucres totaux (oses et les hexoses) par la méthode de Dubois montre un
taux de sucres totaux de 4,25%, un taux plus élevé que celui
obtenu par Abdel-Hamid, 1982 (3,1%), nos résultats sont compris dans
l'intervalle des résultats retranscrits par Cantarelli et al, 1993 (2,9
à 5,4%).
La tener en cellulose brute de notre matériel
végétal est de 24,24% de MS. Cette valeur est proche de celle
obtenu par Abdel-Hamid (1982) qui est de 20.1%, elle se trouve dans les limites
de 14.8 à 41.8% rapportés par Cantarelli et al (1993).
Ce résultat rapporté à la quantité
des résidus de 2004 montrent un potentiel en fibres alimentaires de
104,12 tonnes à partir de graines de tomates et 303,69 tonnes de fibres
à partir des pelures, soit un totale de 407,81 tonnes de fibres.
Résultats de l'extraction et dosage
spectrophotométrique de lycopènes et du
â?carotène
L'analyse des pigments contenus dans les grains de tomates a
été réalisée en utilisant différents
solvants (voir tableau 12). Le mélange de solvant été
constitué de 50% de n-hexane, 25% d'acétone et 25%
d'éthanol.
Tableau 12 : Résultats de l'extraction et du
dosage spectrophotométrique de lycopène et du
â-carotène
|
Mélange
|
Acétone
|
Hexane
|
|
Lycopène (mg/100g)
|
1,58
|
2,76
|
1,58
|
|
â?carotène (mg/100g)
|
1,09
|
1,75
|
1,52
|
Les résultats du dosage
spéctrophotométrique de lycopènes et de
â--carotènes dans les graines de tomates montrent que
l'acétone (respectivement 2,76 mg/100g et 1,75mg/100g) permet une
meilleure extraction des caroténoïdes que les autres solvants
utilisés.
La concentration en lycopène rapporté à
la matière sèche est de 2,76 mg/100g. Cette concentration est de
loin inférieure à 54mg/100g contenus dans les pelures (Elvira et
al. 2006) ; il est donc préférable de séparer les pelures
des graines si l'on vise la valorisation du lycopène. Cette
concentration rapportée à la quantité des résidus
de transformation industrielle de tomates en 2004 permet de produire 11,85kg de
lycopène à partir de graines et 583,6 kg à partir des
pelures, soit un total de 595,5 kg de lycopène.
3.2. Analyses physico-chimiques de l'huile de graines de
tomates
L'huile extraite a été soumis aux analyses. Ces
dernières ont été réalisées à
l'unité de raffinage des huiles végétale du groupe CEVITAL
à Béjaïa.
3.2.1. Rendement d'extraction de l'huile de graines de
tomates
Les résultats du rendement d'extraction de l'huile de
graines de tomates sont donnés dans le tableau suivant :
Tableau 13: Rendement globale d'extraction de l'huile de
graines de tomates après 2 heures d'extraction
|
M1 (g)
|
M2(g)
|
V2 (ml)
|
M3 (g)
|
V3 (ml)
|
R1 (%)
|
R2 (%)
|
|
934,06
|
209,86
|
228,11
|
201,88
|
219,43
|
22,47
|
21,6
|
M1 : masse totale de poudres de graines de tomates
M2 : Masse d'huile obtenue après extraction
M3 : Masse d'huile obtenue après filtration
R1 : Rendement globale d'extraction
R2 : rendement globale d'extraction après filtration de
l'huile
Pour cette extraction, nous avons utilisé 934,06 g de
graines de tomates broyées, à partir desquelles on a obtenu une
masse d'huile de 209,86 g, soit un rendement massique de 22,47%, ce rendement
devient égal à 21,6% après filtration. Afin
d'améliorer la stabilité de l'huile obtenue, nous avons
procéder à une filtration pour éliminer les particules en
suspension. Après cette filtration, le volume d'huile obtenue est de
219,43 ml, correspondant à un rendement volumique de 96,2%.
Les échantillons d'huile brute ont été
conservés au réfrigérateur à l'abri de la
lumière avant leur raffinage et analyse. Il faut noter que ce rendement
est obtenu après des extractions de 2 heures, alors que le temps minimum
requis pour épuiser un échantillon est de 6 heures.
3.2.2. Rendement après raffinage de l'huile de
graines de tomates
Le raffinage a été réalisé avec
138 g d'huile brute, cette quantité a permis de récupérer
117,3 g d'huile raffinée. Le rendement du raffinage est donc de 85%. Ce
rendement est très faible par rapport au rendement du raffinage
industriel (97%).
3.2.3. Caractérisation physico-chimiques de
l'huile de graines de tomates
Les résultats des analyses effectuées sur
l'huile de graines de tomates et leur comparaison à celles des autres
principales huiles végétales sont présentés dans le
tableau suivant :
Tableau 14: Caractéristiques de l'huile de graines de
tomates et des autres principales huiles végétales
|
Analyses
|
H.T.B
|
H.T.R
|
Tournesol
|
soja
|
maïs
|
H.O.V
|
|
Acidité (%)
|
0,9
|
0,06
|
Max 0,3
|
Max 0,3
|
Max 0,3
|
< 2
|
|
I.I. (g I2/100g MG)
|
117
|
-
|
118-141
|
124-139
|
103-135
|
75-95
|
|
I.P (méq O2/kg)
|
-
|
0,4
|
Max 10
|
Max 10
|
Max 10
|
< = 20
|
|
I.S. (mg KOH/g MG)
|
188
|
-
|
188-194
|
189-195
|
187-195
|
184-196
|
|
I. R. (40°C)
|
-
|
1,467
|
1.466-1.470
|
1.466-1.470
|
1.465-1.468
|
1.4677-1.4705
|
|
Insapo. (g/kg)
|
1,8
|
-
|
< = 15
|
< = 15
|
< = 28
|
15
|
|
Phosphore (ppm)
|
66
|
0,0
|
0,0
|
0,0
|
0,0
|
-
|
|
Couleur 5 1/4 P
|
Jaune
|
-
|
26
|
max 10
|
max 10
|
Max 20
|
-
|
|
Rouge
|
-
|
3,2
|
max 10
|
max 10
|
Max 2,5
|
-
|
|
Chlorophyl (ppm)
|
15,46
|
0,0092
|
-
|
-
|
-
|
|
Note : I.I : Indice d'iode ; I.P : Indice de peroxyde ; I.S :
Indice de saponification, I.R : Indice de réfraction
Insapo. : Insaponifiable ; Chlorophyl : Chlorophylle ; HTB et
HTR : Huile de tomates Brute et raffinée ;
H.O.V : Huile d'olive
vierge.
Les résultats obtenus sont indiqués dans le
tableau 14. Le raffinage provoque la modification des caractéristiques
physico-chimiques tels que : l'acidité, la couleur, la teneur en
chlorophylle et la teneur en phosphore.
L'acidité est le pourcentage en AGL
éliminés principalement lors de la neutralisation. La
désodorisation permet également d'éliminer les AGL
résiduels. Le raffinage a permis de ramener l'acidité de 0,9%
à 0,06% ; soit une diminution de 93,33%. L'acidité mesure la
dégradation chimique de l'huile, plus l'huile se dégrade, plus
les AGL sont libérés des glycérides, augmentant le niveau
d'acidité et par conséquent la rancidité.
L'acidité de notre échantillon de l'huile de
graines de tomates raffinée est très faible. Elle est
inférieure aux limites fixées par la norme CODEX STAN 210-1999
pour les huiles végétales, elle est moins élevée
que celle de l'huile de d'olive vierge. Elle est très proche de la
valeur obtenue par Evangelos et al. 1998 (0,05%).
L'indice d'iode renseigne sur le degré d'insaturation
d'une huile, cette caractéristique ne change pas avec le raffinage. Le
résultat obtenu est de 117 g d'iode/100 de MG. Il est moins
élevé que celles de l'huile de tournesol et de soja, il se situe
dans les limites de celle de l'huile de maïs. Il est plus important que
l'indice d'iode de l'huile d'olive vierge. Il est aussi plus important que 105
#177; 0,7 obtenue par Evangelos et al (1998). Ces données montrent que
l'huile de graines de tomates renferme plus d'insaturation que l'huile d'olive,
et moins que l'huile de Tournesol et de Soja. Par contre elle est comparable
à l'huile de maïs.
Une autre mesure de la dégradation chimique de l'huile
est l'indice de peroxyde, qui mesure le niveau d'oxydation de l'huile, une
autre cause de la rancidité. L'indice de peroxyde obtenu est de 0,4
méq O2/kg MG, cet indice de peroxyde est plus faible que la valeur de
9,1 #177; 0,54 rapportée par Evangelos et al (1998). Il est
inférieur aux limites fixées par les normes CODEX STAN 210-1999
et CODEX STAN 33-198 pour les huiles de tournesol, soja, maïs et
d'olive.
Le raffinage n'influe pas sur l'indice de saponification car
ce dernier renseigne sur la teneur en glycérides. Le résultat
obtenu est de 188 mg KOH/g MG. Il se situe dans les limites imposées par
la norme CODEX STAN 210-1999 relatif aux huiles végétales telle
que l'huile de tournesol, de soja, de maïs, etc. Il est aussi
inférieur à l'indice de saponification de l'huile d'olive
conformément à la norme CODEX STAN 33-1981. En revanche, notre
résultat est proche de la valeur obtenue par Evangelos et al (1998), de
l'ordre de 184 #177; 6 mg KOH/g MG.
L'indice de réfraction permet de mesurer le pouvoir
réfringent des huiles par rapport à la raie «D» du
sodium (589,6 nm). Il nous renseigne sur le degré de déviation de
la lumière par les huiles. Il dépend, comme la densité, de
la composition chimique de l'huile et de la température. Il croit avec
l'insaturation ou la présence sur les chaînes grasses des
fonctions secondaires. L'indice de réfraction est selon, AFNOR
(1993), lié au degré d'insaturation c'est-à-dire au
nombre de doubles liaisons sur la chaîne carbonée. L'indice de
réfraction à 40°C ne varie pas avec le raffinage, il n'a
été déterminé qu'une seule fois sur l'huile
raffinée. Le résultat obtenu (1,467) est presque le même
que le résultat obtenue par Evangelos et al (1998) de l'ordre de 1,4610
#177; 16.10-5, cet indice est situé dans l'intervalle
établie par les normes CODEX STAN 210-1999 et CODEX STAN 33-1981 pour
les principales huiles végétales et l'huile d'olive.
La teneur de notre échantillon d'huile de graines de
tomates en insaponifiable est de 1,8 g/kg MG. Cette teneur est proche de 1,4
#177; 0,02 obtenue par Evangelos et al (1998). Ce résultat est
très faible en comparaison avec les limites établies par les
normes CODEX STAN 210-1999 et CODEX STAN 33-1981 pour les principales huiles
végétales et l'huile d'olive.
Le phosphore qui est présent dans l'huile sous forme de
phospholipides, il est éliminé principalement au cours du
dégommage, mais la décoloration en élimine les
quantités résiduelles. D'après le résultat obtenu,
on constate que le dégommage a éliminé 94,55% de
Phosphore, en passant de 66 ppm à 3,6 ppm.
La quantité résiduelle (5,45%) a
été éliminée lors de la décoloration. Cette
nouvelle valeur de la teneur en phosphore (0,0 ppm) de notre échantillon
d'huile de graines de tomates raffinée est conforme à la norme
CODEX STAN 210-1999 pour les principales huiles végétales.
La couleur est essentiellement due à la présence
de pigments (le lycopène, le béta carotène, la
chlorophylle, etc.) dans l'huile. La majeure partie de la chlorophylle est
éliminée au cours de la décoloration et au cours de la
désodorisation. Par contre, les pigments caroténoïdes, sont
légèrement détruits au cours du dégommage, de la
neutralisation, à la décoloration, et beaucoup plus fortement
à la désodorisation.
Contrairement à la mesure par le Lovibond qui
évalue l'intensité de la couleur, le niveau de dégradation
des pigments est évalué par le dosage de la chlorophylle et des
caroténoïdes par les méthodes spectrophotométriques.
La désodorisation a donc permis de réduire l'intensité de
la couleur rouge de 6,4 unités à 3,2 unités, et
l'intensité de la couleur jaune de 36 unités à 26
unités. La couleur est globalement plus foncée que celle des
autres huiles végétales. Le jaune est plus intense que les
limites établies par la norme CODEX STAN 210-1999, alors que le rouge se
situe en dessous des limites fixes pour le tournesol et le soja et un peu plus
élevée que celle fixée pour le maïs. Le
résultat obtenu affiche une grande différence par rapport
à celui rapporté par Evangelos et al.1998 (Rouge : 10 ; Jaune :
2).
La chlorophylle est presque entièrement
éliminée lors de la décoloration et lors de la
désodorisation. Sa concentration dans l'huile brute était de
15,46 ppm et de 11,5 ppm dans l'huile séchée. La
décoloration a permis de la réduire à 0,032 ppm et atteint
0,0092 ppm après la désodorisation.
3.3. Résultats de la détermination du
profil en acides gras de l'huile de graines de tomates
Le profil en AG de l'huile de graines de tomate est
décrit dans la figure 14, représentant le chromatogramme des
acides gras de l'huile considérée. La résolution de la
colonne utilisée a permis d'identifier 7 acides gras.
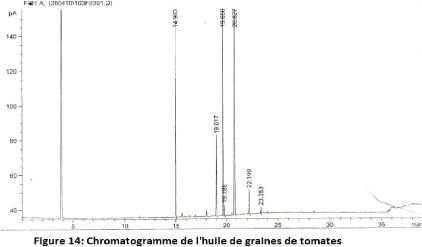
Tableau 15 : Profil en acides gras de l'huile de graines
de tomates
|
AG
|
C16 :0
|
C18 :0
|
C18 :1w9
|
C18 :1w7
|
C18 :2
|
C18 :3
|
0 :0
|
|
%
|
13,81
|
6,18
|
24,73
|
0,80
|
52,12
|
1,90
|
0,47
|
Les résultats indiqués dans le tableau 15
montrent une composition en acides gras comparable à celle obtenue par
Evangelos et al, 1998, avec des légères variations : L'acide
myristique (C14 :0), l'acide gadoléique (0 :1) et l»acide
béhénique (2 :0) n'ont pas été
détectés, alors qu'ils représentent respectivement 0.1 ;
0.2% et 0.1% selon Evangelos et al (1998).
Les acide palmitoléique (C16 :1), l'acide margarique
(C17 :0), l'acide linolélaïque (C18 :2 trans) et l' l'acide
lignocérique (4 :0) ne font pas partie de la base de données du
logiciel utilisé, par contre leurs teneurs sont respectivement 0.6% ;
0.1% ; 0.8% et 0.1% selon Evangelos et al (1998)
La teneur en acides gras saturés (AGS) de notre
échantillon d'huile est de 20.46% Les AGS sont : l'acide palmitique
(13,81%), l'acide stéarique (6.18%) et l'acide arachidique (0,47%).
Evangelos et al (1998) ont obtenu des valeurs voisines
à nos résultats, ces teneurs sont de : 13.6% d'acide palmitique ;
6,0% d'acide stéarique et 0,2% d'acide arachidique, soit un taux global
en AGS de 19,8%.
La teneur en acide gras mono-insaturés (AGMI) de notre
huile est de 25.53%, soit 24,72%, d'acide oléique (C18 :1 w9) et 0,80%
de (C18 :1 w7). Ces valeurs sont un peu plus élevées que celles
obtenues par Evangelos et al (1998) qui sont respectivement de 22% et de
0.1%.
La composition de l'huile de grains de tomates
analysées en acides gras polyinsaturés (AGPI) est de 54.02%. Il
s'agit de l'acide linoléique (C18 :2) qui représente 52,12% et
l'acide linolénique (C18 :3) dont la teneur est de 1,9%. Cette
composition est un peu moins élevée que celle
déterminée par Evangelos et al (1998), ils ont obtenu
respectivement 54% et 2.1%, soit un total de 56.1%.
Compte tenu de sa teneur en acides gras insaturés
(79,54%) et en acides gras polyinsaturés (54,02%), l'huile de graines de
tomates constitue une des meilleures sources en acides gras essentiels (AGE).
Cette caractéristique lui confère d'importantes
propriétés métaboliques. Les AGPI de la famille des «
oméga-3 » et « oméga-6 » sont des acides gras
essentiels pour l'homme et les animaux. Ils sont impliqués dans
différentes fonctions de l'organisme et leur carence peut conduire
à de sévères anomalies physiologiques (retards de
croissance, troubles cutanés et rénaux, anomalie des fonctions de
reproduction, etc.) (Anonyme (g), 2008).
Les caractéristiques de l'huile de graines de tomates
confirment son aptitude alimentaire. L'évaluation des matières
grasses du point de vu diététique et nutritionnel est
basée sur le rapport entre les AGS et les AGI, plus
particulièrement sur le rapport AGPI/AGS. Notre huile présente un
rapport est de 2.64, ce qui montre la dominance des acides gras essentiels
(AGE) par rapport aux AGS.
Sur la base des recommandations nutritionnelles actuelles
plaçant l'optimum du rapport w6/w3 aux environs de 5 (Xavier 2008), on
remarque que la teneur de l'huile de graines de tomates en w3 est faible, car
ce rapport est d'environ 27. Les huiles du groupe alpha linolénique
telle que le colza dont le ratio est de 2 à 3 (Pages, 2008)
sont particulièrement intéressantes pour leur contribution
à l'amélioration de la qualité nutritionnelle de l'huile
de graines de tomates.
L'huile de graines de tomates contient les acides gras
essentiels (54,02%) et d'autres composants comme les antioxydants, les
vitamines, les minéraux, les carotènes y compris le
lycopène et les phytostérols et d'autres substances (dont la
teneur n'a pas été déterminée au cours de cette
étude), ces diverses substances jouent un rôle important sur la
santé et sur la brillance de la peau. Les huiles riches en
lycopènes sont des ingrédients essentiels pour le traitement et
la prévention de signes de vieillissement et la réduction des
effets néfastes des rayons UV sur la peau. (Anonyme (d),
2010).
L'huile de graines de tomates est stable et très
pénétrante. C'est un ingrédient remarquablement nutritif
des crèmes de massage facial, des sérums antirides, des produits
antivieillissement, produits de soins de lévres et maquillage, soin de
cheveux, de bronzage, rasage et d'autres formulations cosmétiques. Elle
convient à la peau sèche, huileuse ou mixte. (Anonyme
(d), 2010).
D'autres auteurs ont rapporté l'intérêt de
l'huile de graines de tomates dans d'autres industries. Selon Giannelos et al
(2005), l'huile de graines de tomates ne convient pas à l'usage direct
comme biocarburant à cause de son indice d'iode élevé, son
écoulement à froid faible, sa densité et viscosité
élevées.
Elle ne convient pas également à la fabrication
des peintures et vernis, du fait de sa faible teneur en acide
linolénique (C18 :3) responsable de la propriété
auto-siccative comme l'huile de lin dont la teneur en C18 :3 est de 45 - 70% ;
mais elle peut être mélangée avec cette dernière en
tant que imprégnateur et protecteur des bois à l'intérieur
comme à l'extérieur (protection contre l'humidité, les
champignons, insectes et contre la poussière par son caractère
antistatique) ; composant de certains vernis de finition ; liant des pigments
des peintures à huile ; agent plastifiant du mastic de vitrier ; agent
durcisseur de diverses préparations etc. (Anonyme (h),
2010).
La comparaison du profil en acides gras de l'huile de graines
de tomates raffinée par rapports à ceux des principales huiles
végétales consommées en Algérie est donnée
dans le tableau 16.
Tableau 16 : comparaison du profil en acides gras de
l'huile de graines de tomates raffinée aux principales huiles
végétales consommées en Algérie
|
ACIDES GRAS
|
HUILE DE
GRAINES DE
TOMATES
|
HUILE DE
TOURNESOL
|
HUILE DE
SOJA
|
HUILE DE MAIS
|
HUILE D'OLIVE
|
|
C12 :0
|
0
|
0-0,1
|
0-0,1
|
0-0,3
|
-
|
|
C14 :0
|
0
|
0-0,2
|
0-0,2
|
0-0,3
|
0-0,5
|
|
C16 :0
|
13,81
|
5-7,6
|
8-13,5
|
8,6-16,5
|
7,5-20
|
|
C16 :1
|
-
|
0-0,3
|
0-0,2
|
0-0,5
|
0,3-3,5
|
|
C17 :0
|
-
|
0-0,2
|
0-0,1
|
0-0,1
|
0-0,3
|
|
C17 :1
|
0
|
0-0,1
|
0-0,1
|
0-0,1
|
0-0,3
|
|
C18 :0
|
6,18
|
2,7-6,5
|
2-5,4
|
0-3,3
|
0,5-5
|
|
C18 :1
|
25,52
|
14-39,4
|
17-30
|
20-42,2
|
55-83
|
|
C18 :2
|
52,12
|
48,3-74
|
48-59
|
34-65,6
|
3,5-21
|
|
C18 :3
|
1,90
|
0-0,3
|
4,5-11
|
0-2
|
-
|
|
0 :0
|
0,47
|
0,1-0,5
|
0,1-0,6
|
0,3-1
|
0-0,6
|
|
0 :1
|
0
|
0-0,3
|
0,1-0,5
|
0,2-0,6
|
0-0,4
|
|
0 :2
|
-
|
0
|
0-0,1
|
0-0,1
|
-
|
|
2 :0
|
0
|
0,3-1,5
|
0-0,7
|
0-0,5
|
0-0,2
|
|
2 :1
|
-
|
0-0,3
|
0-0,3
|
0-0,3
|
-
|
|
2 :2
|
-
|
0-0,3
|
0
|
0
|
-
|
|
4 :0
|
-
|
0-0,5
|
0-0,5
|
0-0,5
|
0-0,2
|
|
4 :1
|
-
|
0
|
0
|
0
|
-
|
Source : CODEX STAN 210 - 1999 ; CODEX STAN
33-1981
Au vu des données précedentes, il s'avère
que l'huile de graines de tomates ressemble à l'huile de maïs par
rapport à tous les acides gras excepté l'acide stéarique
(C18 :0) où sa teneur est de 0 à 3,3% dans l'huile de maïs
contre 6,18% dans l'huile de graines de tomates.
L'huile de tournesol peut être comparée à
l'huile de graines de tomates, cette huile diffère par sa teneur en 2
acides gras, à savoir l'acide linolénique (C18 :3) dont la teneur
dans l'huile de tournesol est de 0 à 0,3%, alors qu'elle est de 1,90%
dans l'huile de graines de tomates, et par la teneur en acide palmitique (C16
:0) qui varie entre 5 et 7,6% dans l'huile de tournesol, alors que sa teneur
est de 13,81% dans l'huile de graines de tomates.
L'huile de soja diffère beaucoup plus de l'huile de
graines de tomates puisque sa composition en 3 acides gras ne correspond pas
à celle de l'huile de graines de tomates. Ces acides gras sont : l'acide
linolénique (C18 :3) dont la teneur dans l'huile de soja est de 4,5
à 11% contre 1,90% dans l'huile de graines de tomates. La teneur en
acide palmitique (C16 :0) est comprise entre 8 à 13,5% dans l'huile de
soja alors qu'elle est de 13,91 dans l'huile de graines de tomates. La teneur
en acide stéarique (C18 :0) dans l'huile de soja est de 2 à 5,4%
alors qu'elle de 6,18% dans l'huile de graines de tomates.
3.4. Résultats de la détermination de la
résistance à l'oxydation
Le test de Rancimat détermine la stabilité des
huiles à l'oxydation. Il n'est réalisé que sur les huiles
raffinées pour évaluer leur stabilité au cours du
stockage.
Dans les mêmes conditions d'aération, le test de
Rancimat a montré qu'une augmentation de température de 10°C
réduit de deux fois la durée de stabilité de l'huile. Les
résultats obtenus au cours de cette détermination sont
donnés dans la figure 15.
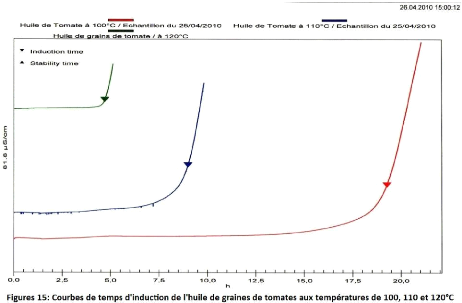
La figure ci-haut montre que les temps d'induction de l'huile
de grains de tomates sont de 19,28 heures à 100°C, de 9 heures
à 110°C et de 4,70 heures à 120°C. Le dernier
résultat est proche de 4,9 heures obtenu par Evangelos et al (1998). Ces
résultats permettent d'estimer la durée de conservation à
une température définie. La figure 16 donne l'estimation de la
durée de conservation de l'huile de graines de tomates à
20°C
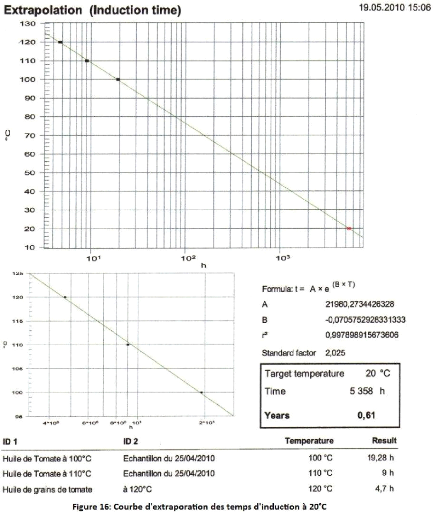
D'après la courbe précédente, on constate
que notre échantillon peut être abandonné à une
température de 20°C et à l'air libre pendant 5358 heures,
soit 223 jours correspondant à 0,61 année sans altérations
notables.
Conclusion générale
La valorisation des résidus de transformation
industrielle de tomates dépend des quantités transformées.
En 2004 deux cent soixante seize milles (276 000) tonnes de tomates ont
été transformées en concentré de tomate, ce qui a
généré 8280 tonnes de résidus humides. Ces derniers
sont constitués de 28,44% de graines et 71,56% de pelures. Après
séchage et séparation, ces résidus sont susceptibles de
produire 429,52 tonnes de graines de tomates capable de générer
112,5 tonnes d'huile. Cette quantité représente 0,32% de l'huile
d'olive produite en Algérie en 2005/2006 et 0,023% de la quantité
des huiles importées en 2009.
Cette quantité est capable d'être valorisée
par certaines industries, telles que l'industrie alimentaire
(diététique) et l'industrie parapharmaceutique.
Pour estimer la faisabilité et exploitation
économique des résidus de transformation industrielle de tomates
produites en Algérie, on se basera su une étude menée par
un groupe de chercheurs représentant des entreprises allemandes,
espagnoles et italiennes. Cette étude stipule 3 hypothèses.
- Hypothèse minimum : valorisation de 150 tonnes des
résidus de tomates humides/an.
- Hypothèse intermédiaire : valorisation de 750
tonnes de résidus de tomates humides/an.
- Hypothèse maximum : valorisation de 11 250 tonnes de
résidus de tomates humides/an.
Pour comparer la valorisation économique des
résidus de transformation industrielle de tomates produites en
Algérie et en Europe, nous supposons que la main d'oeuvre moins cher en
Algérie et plus cher en Europe compense l'investissement qui est plus
onéreux en Algérie et moins couteux en Europe.
La même étude a démontré que
l'exploitation économique des résidus de tomate n'est rentable
que si les exigences de l'hypothèse maximum sont satisfaites, soit, 11
250 tonnes de résidus humides par an.
En 2004, la transformation industrielle de tomates en
Algérie a généré 8280 tonnes des résidus qui
sont susceptibles de produire 112,5 tonnes d'huiles, 303,69 tonnes de fibres et
0,56 tonnes de lycopène. Ces chiffres rangent la valorisation des
résidus de tomates en Algérie dans l'hypothèse
intermédiaire.
La production de tomate industrielle en Algérie reste
très faible par rapport au potentiel agricole et à la
capacité des unités de production de concentré de tomate
(140 000 tonnes de concentré par an). Cette situation est due
essentiellement au faible rendement (23,9t / ha). En effet, les
variétés les plus utilisées sont des
variétés fixées peu performantes et cultivées sans
irrigation. Il faut noter que la très faible utilisation de
variétés hybrides à haut rendement, est essentiellement
due au manque de vulgarisation des techniques culturales de pointe.
Pour rentabiliser l'exploitation économique des
résidus de transformation industrielle de tomates, il faut multiplier la
quantité des tomates destinées à la transformation
industrielle par deux. Ceci est réalisable si le rendement de production
de tomates atteint 48 t/ha. Pour ce faire, il faut améliorer les
techniques culturales (variétés performantes, technique
d'irrigation) et vulgariser les agriculteurs.
Cependant, en Algérie, il est possible de valoriser les
résidus de tomates sans satisfaire les exigences de l'hypothèse
maximum, car on peut réduire les coûts de production en
procédant au séchage au soleil, à la place des
séchoirs dont le coût atteint 2,80% de l»investissement
initial pour l'extraction par fluide supercritique ou 3,28% du coût
d'investissement initial pour l'extraction par solvant.
Vue l'immensité de l'Algérie, il faudrait penser
à la valorisation des résidus de transformation industrielle de
tomates en fonction des grandes régions productrice de tomates. La
région Est représente 76,85% de la production nationale peut
valoriser ces résidus si la production est doublée, alors que
l'Ouest et le centre qui représentent respectivement 13,45% et 9,47%
devraient augmenter leur production de plus de 10 fois et de 14 fois pour
pouvoir valoriser les résidus issus de cette industrie.
Les analyses chimiques effectuées sur les graines de
tomates ont révélé que ces graines constituent une bonne
ressource énergétique et en matière azotée pour
l'alimentation des ruminants. Leur teneur en lycopène les rend moins
intéressantes que les pelures pour la valorisation des
caroténoïdes. Les graines sont donc plus intéressantes pour
l'extraction de l'huile dont la teneur est de 26,20%.
Les résultats des analyses physico chimiques de l'huile
de graines de tomates montrent que c'est une huile de bonne qualité
alimentaire. Ses indices physicochimiques sont comparables à ceux des
principales huiles végétales et son profil en AG lui confie la
propriété d'être une bonne source des acides gras
insaturés (79,54% des AGI et 54,02% des AGE).
L'huile de graines tomates ressemble à l'huile de
maïs à l'exception de sa couleur et de sa teneur en acide
stéarique (C18 :0). Ses caractéristiques la rendent plus
intéressante pour l'alimentation et la formulation de produits
cosmétiques.
L'huile de grains de tomates étudiée a
révélé une bonne aptitude à la conservation,
puisqu'elle peut rester inaltérée pendant plus de sept mois
à la température de 20°C et à l'air libre.
Afin de compléter ce travail, d'autres recherches
devraient être menées pour étudier l'amélioration de
la production de tomate en Algérie et plus particulièrement dans
la région d'Est qui concentre la majeure partie de cette production
destinées à la transformation.
Les études de projet de valorisation de résidus
doivent aussi être conduites en tenant compte des facteurs de production
disponibles en Algérie. Des moyens conséquents devraient
être débloqués pour pouvoir procéder à la
valorisation des résidus de conserverie. Pour confirmer nos
résultats, des études de caractérisation physico-chimique
plus complète doivent être menées afin de pouvoir
évaluer les divers potentiels des résidus de tomates, plus
particulièrement la valorisation des pelures pour l'extraction du
lycopène, et l'extraction de l'huile à partir des graines.
Ce même travail doit aussi être refait en
comparant plusieurs méthodes d'extraction (par pression, fluide
supercritique et par solvant) afin d'établir le moyen le plus
approprié pour l'extraction et la valorisation des résidus de
tomates.
Des études de comportement de l'huile de graines de
tomates vis-à-vis de certain traitement technologique, et l'étude
de l'aptitude de ses graines au stockage pourraient être menées
afin d'identifier les divers domaines d'application.
Références bibliographiques
Références bibliographiques
o Abdel-Hamid Youssef Abdel-Rahman (1982). The Chemical
Constituents of Tomato Seeds. Food Chemistry 9 (1982) 315-318
o AFNOR (1982). Recueil de normes françaises des
produits dérivés des fruits et
légumes et jus de
fruits, 1ère édition. AFNOR, Paris-La défense
1982, 327P.
o Anonyme (d) (2009). Evaluation de la
campagne de transformation de tomate en Algérie Ministère du
commerce. Algérie
o Anonyme (e) : (2007) Bilan de la production de tomate
en 2007. Ministère de l'Agriculture. Algérie
o Anonyme (k) : USDA, FAS. 2007. World Markets and
Trade: Tomato & Tomato Products [online):
http://www.fas.usda.gov/htp/2007%20Tomato%20article08-
24-07.pdf [archive] 6P.
o Antonio de Falco, Michele Caiazza, Mario Malinconico,
Barbara Immirzi, Maurizio Avella, Barbara Nicalaus, Giuseppe Strazzullo, Anna
Poli (2009). Cost-effective utilization of agro-food processing waste. Eureco
European Environmental
Company.
www.eurocompany.com . 8P.
o AMITOM : Association Méditerranéenne
Internationale de la Tomate. La tomate d'industrie en
Algérie [archive]. 2P. Site officiel :
http://www.amitom.org
o Ayhan Demirbas (2009) . Oil, micronutrients and heavy
metal of tomatoes. Sciencedirect 14P.
o Bonner J. (1950). The plant waxes in Plant
biochemistry. Academic press, New York, 365-368
o CANTARELLIP.R. ; M.A.B. REGITANO-d'ARCE; E.R. PALMA
(1993).
Physicochemical characteristics and fatty acid
composition of tomato seed oils from processing wastes. Dep de Ciência e
technologia agroindustrial da ESALQ/USP. Piracicaba.
o Carvajal A.P (1992). Deshydratation osmotique des
produits végétaux. Application à l'obtention de
concentré de tomates Thèse de doctorat, Université de
Montpellier II, 160P.
o CODEX Alimentarius (1981). CODEX 33-1981: Codex
standard for olive oils and olive pomace oils P.8
o CODEX Alimentarius (1999). CODEX STAN 210-1999: Codex
standard for named vegetable oils P.13
o Cotte Fabrice (2000). Etude de la valeur alimentaire de
pulpe de tomate chez les ruminants : Thèse pour l'obtention de grade de
Docteur vétérinaire - Université Claude Bernard de Lyon1,
135P.
o El-Tamimi A. , Morad M., Raof M. , Rady A., ( 2009).
Tomato Seed Oil/ Fatty Acid Composition, Stability and Hydrogenation of the
Oil. Department of Food Science and Technology, University of Cairo/ Egypt
[online].
www.sciencedirect.com
consulté le 25/10/2009
o Elvira Casas, Marianna Faraldi and Marie Bildstein
(2006) «HANDBOOK on BIOACTIVE COMPOUNDS from TOMATO PROCESSING
RESIDUES».
www.bioactive-net.com
[Archive] 44P.
o Evangelos S Lasos, John Tsaknis and Straus Lalas
(1998). Caracteristics and composition of tomato seed oil. Grosas y aceites vol
49 Fasc 5-6 (1998), 440-445.
o Fahnaky A., Abbasi, J. Jamalian, G. Mesbahi (2008)."The
use of tomato pulp powder as a thickening agent in the formulation of tomato
ketchup". In Journal of Texture Studies 39 (2008) 169-182
o FAOSTAT (2009). World tomatoes, all: Production by
country, 1990-2005
http://faostat.fao.org/site/567/DesktopDefault.aspx?PageID=567#ancor
[archive].
o Giannelos P.N. , Sxizas S., Lois E., Zannicas F.,
Anastopoucous G. (2005). Physical and fuel related properties of tomato seed
oil for evaluating its direct use in diesel engines in industrial crops and
products 22 (2005) 193-199.
o Giuseppina Tommonaro, Annarita Poli, Salvatore De Rosa
and Barbara Nicolaus (2008). Tomato Derived Polysaccharides for
Biotechnological Applications: Chemical and Biological Approaches. In Molecules
ISSN 1420-3049
o Golouviev V.N. et Chibane M. (1988). Traitement par
membrane de pulpe de tomate. Ind. Alim. agric. 10 : 929-932.
o Goose P. and Binstead R. (1973). Tomato paste and other
tomato products. Food trade press 2nd edition. London V2.
270P
o Gould W.A. (1992). Tomato production, processing and
technology. CTI publishing, Baltimore.
o GRAILLE J. (2003). Lipides et corps gras alimentaires.
Ed Tec & Doc Lavoisier, Paris 469P.
o Grenet E., Besle J.M. (1991). Microbes and fiber
degradation in Jouany J.P.
(eds). Rumen microbial metabolism and ruminant digestion.
INRA, Paris, 107- 131.
o Hayes W.A., Smith P.G. and Morris A.E.J. (1998). The
production and quality of tomato concentrates. Cri. Review in food Sci; and
Nutr. 38 (7): 537-564.
o Heuvelink Ep. (2009). World tomato exports have
increased by 30 per cent over the last 5 years. S&G and Rogers
(Syngenta).
o Jarrige R. (1981). Les constituent glucidiques des
fourrages: variation, digestibilité et dosage. In Demarquilly C.
Prevision de la valeur nutritive des aliments des ruminants. INRA, Versailles,
13-40.
o Meyer (1961). Vegetable and fruits, Chap 7. In Food
chemistry. Chapman et Hall, London, 218-293.
o Moresi M. and Liverotti C. (1982). Economic study of
tomato paste production. J. Food Technology 17: 177-199.
o ADSULE AMBA DAN (1979). Simplified extraction procedure
in the rapid
spectrophometric method for lycopene estimation in
tomato. In Journal of food science and technology, Vol 16, Sept-October,1979. P
216-217
o Pascal L. et Branthome F. (2006). Rapport de
synthèse : Analyse de la
filière transformation de la tomate en
Algérie. Euro développement pme, Alger Septembre 2006.
P.57
o RACHEDI M.F (2004). Cultures maraichères et
industrielle in collection études
sectorielle : agroalimentaire en Algérie 2004.
Cabinet Tiers Consult P 169-178
o Pages X. - Xatart - Pares (2008). Technologie des corps
gras (huile et graisses végétales). Techniques de
l'ingénieur Décembre 2008. Ref. 6070. 19P
o Zhao Suoqi, Hu Yunxiang, Qi Guopeng, Wang Renan, Liu
Kuifang, Liu Yumei, Chen Dejun, and Liu Yuyin. Extracting lycopene from tomato
powders by supercritical propane and carbon dioxide with industrial scale pilot
(online) [Archivce] P.6
Liste des sites consultés
Anonyme (a) :
http://www.snv.jussieu.fr/bmedia/index.htm
, La tomate: une baie, dernière mise à jour, le
21/03/2005
Anonyme (b) : Wikipédia,
La tomate,
http://fr.wikipedia.org/wiki/Tomate
, consulté le 13/03/2010
Anonyme (c): Food navigator du
18-Feb-2004
Natural additives from tomato waste, research continues
(en ligne):
www.foodnavigator.com
, consulté le 12/12/2009
Anonyme (f) : goodoils (2009) Tomato oil
www.goodoils.com
Anonyme (g): lareal (2008)
Note scientifique les acides gras [Archive]
www.lareal.com
Anonyme (h) : wikipédia (2010)
L'huile de lin
http://fr.wikipedia.org/wiki/huiledelin
Anonyme (i) : Natural sourcing, specialists in cosmetical
ingredients (2010) Tomato Seed Oil (CP) INCI: Solanum Lycopersicum Seed Oil
http://www.naturalsourcing.com/oiltomato
Table des Matières
Table de Matière
Remerciements
Dédicaces
Résumés
Sommaire
Liste des abréviations
Liste des tableaux et figures
Introduction générale 1
Partie I : Etudes bibliographique
1. Situation économique de la filière tomate 4
1.1. Dans le monde 4
1.1.1. La production 4
1.1.2. Echanges internationaux 5
1.1.3. Consommation 5
1.2. En Algérie 7
1.2.1. Tomate industrielle et industrie de conserve de tomate en
Algérie 7
1.2.2. Echanges commerciaux de la tomate en Algérie ..
9
2. Présentation botanique .. 11
3. Composition chimique de la tomate fraiche 13
4. Technologie de transformation de tomate 14
4.1. Nomenclature des différents produits à base
de tomates 14
4.2. Technologie de fabrication de tomates concentrées
15
4.2.1. Le lavage et le triage 15
4.2.2. Le broyage 15
4.2.3. Le préchauffage 16
4.2.4. Le raffinage 16
4.2.5. La concentration 17
4.2.6. La pasteurisation 17
4.2.7. Le remplissage, sertissage et refroidissement 17
5. Les sous produits de tomate 18
5.1. Composition chimique 18
5.2. Les graines 20
5.3. Les pelures 20
6. La valorisation 21
6.1. Le lycopène 21
6.2. Les fibres de tomate 22
6.3. L'huile de grain de tomates 22
6.3.1. Modes d'obtention 23
6.3.1.1. Extraction par pression (pressage mécanique)
23
6.3.1.2. Extraction par solvant 24
6.3.1.3. Extraction par Fluides supercritiques (SFE) - Extraction
par CO2 25
supercritique (SC-CO2)
6.3.2. Caractéristiques physico-chimiques de l'huile de
graines de tomates 25
6.3.3. La partie insaponifiable de l'huile de grains de tomates
26
6.3.4. Profil en acides gras 27
6.3.5. Usages 29
Partie II : Etude expérimentale
Chapitre 2 : Matériel et méthodes
30
2.1. Matériel végétal 30
2.1.1. Présentation du matériel
végétal 30
2.1.2. Récupération et préparation des
résidus 30
2.1.3. Extraction de l'huile de grains de tomates 34
2.1.4. Raffinage de l'huile de graines des tomates à
l'échelle de laboratoire 35
2.2. Méthodes d'analyses 39
2.2.1. Analyses chimiques des grains de tomates 39
2.2.1.1. Détermination de la teneur en matière
sèche/eau 39
2.2.1.2. Détermination de la teneur en cendre 40
2.2.1.3. Détermination de la teneur en Azote totale et
protéines 40
2.2.1.4. Détermination de la teneur en matière
grasse 43
2.2.1.5. Détermination de la teneur en sucres totaux
44
2.2.1.6. Détermination de la teneur en cellulose brute
46
2.2.1.7. Extraction de lycopène et dosage
spectrophotométrique 47
2.2.2. Analyses physico-chimiques de l'huile de grains de tomates
49
2.2.2.1. Détermination de l'acidité et indice
d'acide 49
2.2.2.2. Détermination de l'indice d'iode 50
2.2.2.3. Détermination de l'indice de peroxyde 50
2.2.2.4. Détermination de l'indice de saponification
52
2.2.2.5. Détermination de l'indice de réfraction
53
2.2.2.6. Détermination de l'insaponifiable 53
2.2.2.7. Détermination des phosphores et phosphatides
55
2.2.2.8. Détermination de la couleur 56
2.2.2.9. Détermination de la teneur en chlorophylle 57
2.2.3. Détermination du profil en acide gras de l'huile de
grains de tomate 57
2.2.3.1. Préparation des esters méthyliques
d'acides gras 57
2.2.3.2. Analyse Chromatographique 58
2.2.4. Détermination de la résistance à
l'oxydation 59
Chapitre 3 : Résultats et discussions
61
3.1. Résultats analyses chimiques des graines de tomates
61
3.1.1. Rendement en graines de tomates 61
3.1.2. Caractéristiques biochimiques du matériel
végétal 62
3.2. Analyses physico-chimiques de l'huile de graines de tomates
65
3.2.1. Rendement d'extraction de l'huile de graines de tomates
65
3.2.2. Rendement après raffinage de l'huile de graines de
tomates 66
3.2.3. Caractéristiques physico-chimiques de l'huile de
graines de tomates 66
3.3. Résultats de la détermination du profil en
acides gras de l'huile de graines de 69
tomates
3.4. Résultats de la détermination de la
résistance à l'oxydation 74
Conclusion générale 77
Références bibliographiques
Table des matières
Annexes
ANNEXES
Tableau 17 : Principaux pays producteurs de tomates
(Année 2000 - 2005)
|
Pays/Année
|
2000
|
2001
|
2002
|
2003
|
2004
|
2005
|
% en 2005
|
|
China
|
22 324,77
|
24 116,21
|
27 153,12
|
28 842,74
|
30 143,93
|
31 644,04
|
25,38
|
|
USA
|
11 558,80
|
10 001,72
|
12 383,20
|
10 522,00
|
12 867,18
|
11 043,30
|
8,86
|
|
Turkey
|
8 890,00
|
8 425,00
|
9 450,00
|
9 820,00
|
9 440,00
|
10 050,00
|
8,06
|
|
India
|
7 430,00
|
7 240,00
|
7 460,00
|
7 600,00
|
8 176,13
|
8 585,57
|
6,89
|
|
Egypt
|
6 785,64
|
6 328,72
|
6 777,88
|
7 140,20
|
7 640,82
|
7 600,00
|
6,10
|
|
Italy
|
7 538,10
|
6 387,89
|
5 750,04
|
6 651,51
|
7 683,07
|
7 187,01
|
5,77
|
|
Iran
|
3 191,00
|
3 009,45
|
4 109,00
|
4 429,43
|
4 022,88
|
4 781,02
|
3,84
|
|
Spain
|
3 766,33
|
3 971,69
|
3 979,72
|
3 947,33
|
4 383,20
|
4 651,00
|
3,73
|
|
Brazil
|
2 982,84
|
3 103,29
|
3 652,92
|
3 708,60
|
3 515,57
|
3 452,97
|
2,77
|
|
Mexico
|
2 086,03
|
2 182,93
|
1 989,99
|
2 148,13
|
2 968,88
|
2 800,12
|
2,25
|
|
Russia
|
1 685,10
|
1 950,60
|
1 979,53
|
2 021,07
|
2 017,86
|
2 295,90
|
1,84
|
|
Greece
|
2 085,00
|
2 048,00
|
1 752,00
|
1 830,00
|
1 962,58
|
1 711,55
|
1,37
|
|
Ukraine
|
1 126,50
|
1 155,60
|
1 311,70
|
1 265,20
|
1 145,70
|
1 471,80
|
1,18
|
|
Uzbekistan
|
970,00
|
1 022,00
|
1 079,77
|
1 410,30
|
1 245,47
|
1 317,16
|
1,06
|
|
Chile
|
1 185,00
|
1 262,65
|
1 287,00
|
1 250,00
|
1 200,00
|
1 230,00
|
0,99
|
|
Morocco
|
1 008,90
|
881,00
|
991,02
|
1 036,84
|
1 213,53
|
1 205,51
|
0,97
|
|
Portugal
|
1 009,68
|
1 072,24
|
867,42
|
894,18
|
1 200,93
|
1 085,27
|
0,87
|
|
Nigeria
|
879,00
|
879,00
|
889,00
|
889,00
|
992,28
|
1 057,15
|
0,85
|
|
Algeria
|
816,84
|
830,53
|
814,94
|
887,10
|
1 092,27
|
1 023,45
|
0,82
|
|
Tunisia
|
950,00
|
750,00
|
907,00
|
992,00
|
1 118,00
|
960,00
|
0,77
|
|
Syria
|
753,22
|
771,76
|
900,60
|
900,00
|
920,00
|
945,50
|
0,76
|
|
Canada
|
701,33
|
670,26
|
791,95
|
717,39
|
805,09
|
839,25
|
0,67
|
|
Cuba
|
554,30
|
452,70
|
496,00
|
643,70
|
788,70
|
802,60
|
0,64
|
|
France
|
848,17
|
859,33
|
802,55
|
825,42
|
848,47
|
790,05
|
0,63
|
|
....
|
|
|
|
|
|
|
|
|
Total mondial
|
105 774,76
|
104 170,20
|
112 424,72
|
116 191,33
|
124 253,95
|
124 666,13
|
100,00
|
Source: United Nations, Food and Agriculture Organization,
FAOStat database (10/2007). Unité: 1000 tonnes
|
Désignation
|
Structure
|
Nom systématique
|
Nom commun
|
Point de fusion
|
|
a) Acides gras saturés à nombre paires de
carbone
|
|
4 :0
|
CH3(CH2)2COOH
|
Acide butanoïque
|
Acide butyrique
|
-5.3, -7.9, -8.0
|
|
6:0
|
CH3(CH2)4COOH
|
Acide hexanoïque
|
Acide caproïque
|
-3.2, -3.9
|
|
8:0
|
CH3(CH2)6COOH
|
Acide octanoïque
|
Acide caprylique
|
16.3, 16.5, 16.7, 17.0
|
|
10:0
|
CH3(CH2)8COOH
|
Acide décanoïque
|
Acide caprique
|
31.2, 31.3, 31.6,
32.0
|
|
12:0
|
CH3(CH2)10COOH
|
Acide dodécanoïque
|
Acide laurique
|
43.9, 44.0, 44.2,
44.8
|
|
14:0
|
CH3(CH2)12COOH
|
Acide tétradecanoïque
|
Acide myristique
|
54.1, 54.4
|
|
16:0
|
CH3(CH2)14COOH
|
Acide hexadécanoïque
|
Acide palmitique
|
62.7, 62.9, 63.0,
63.1
|
|
18:0
|
CH3(CH2)16COOH
|
Acide octadécanoïque
|
Acide stéarique
|
69.0, 69.6, 70.1
|
|
20:0
|
CH3(CH2)18COOH
|
Acide eicosanoïque
|
Acide arachidique
|
75.0, 75.3, 75.4,
76.1
|
|
22:0
|
CH3(CH2)20COOH
|
Acide docosanoïque
|
Acide béhénique
|
79.9, 80.0
|
|
24:0
|
CH3(CH2)22COOH
|
Acide tétracosanoïque
|
Acide lignocérique
|
84.0, 84.2
|
|
26:0
|
CH3(CH2)24COOH
|
Acide hexacosanoïque
|
Acide cérotique
|
87.7, 87.8
|
|
28:0
|
CH3(CH2)26COOH
|
Acide octacosanoïque
|
Acide montanique
|
90.9
|
|
b) Acides gras à nombre impair d'atome de
carbone
|
|
5:0
|
CH3(CH2)26COOH
|
Acide pentanoïque
|
Acide valérique
|
-34.5
|
|
7:0
|
CH3(CH2)26COOH
|
Acide heptanoïque ou
heptylique
|
Acide énanthique
|
-7.5
|
|
9:0
|
CH3(CH2)26COOH
|
Acide nonanoïque
|
Acide pélargonique
|
12.5
|
|
11:0
|
CH3(CH2)26COOH
|
Acide undécanoïque
|
Acide undécanoïque
|
28.1, 29.3
|
|
15:0
|
CH3(CH2)26COOH
|
Acide pentadécanoïque
|
Acide
pentadécanoïque
|
52.1, 52.3, 52.5
|
|
17:0
|
CH3(CH2)26COOH
|
Acide heptadécanoïque
|
Acide margarique
|
61.3
|
Annexe iii : Tableau 3.1. : Les principaux acides gras
saturés (Source : Jean Graile 2003)
|
Désignation
|
Structure
|
Nom commun ou systématique
|
Pf (°C)
|
|
a) Acides gras avec doubles liaisons non
conjuguées
|
|
12 :1 n-3
|
CH3-CH2-CH=CH-CH2-(CH2)6-COOH
|
a. laurolique (9,
dodécénoïque)
|
|
|
14 :1 n-5
|
CH3-(CH2)3-CH=CH- CH2- (CH2)6-COOH
|
a. myristoléique
(9,
tetradécénoïque)
|
|
|
16 :1 n-7
|
CH3-(CH2)5-CH=CH- CH2- (CH2)6-COOH
|
a. palmitoléique
(9,
hexadécénoïque)
|
0.5
|
|
16 :1 n-9
|
CH3-(CH2)7-CH=CH- CH2- (CH2)4-COOH
|
Acide hypogéique
|
|
|
18 :1 n-7
|
CH3-(CH2)5-CH=CH- CH2- (CH2)8-COOH
|
a.
cis-vaccénique
(11,octadécénoïque)
|
13.0
|
|
18 :1 n-9
|
CH3-(CH2)7-CH=CH- CH2- (CH2)6-COOH
|
a. oléique (9,
octadécénoïque)
|
10.5, 13.4
|
|
18 :1 n-12
|
CH3-(CH2)10-CH=CH- CH2- (CH2)3-COOH
|
a.
pétrosélinique(6,
octadécénoïque)
|
|
|
20 :1 n-9
|
CH3-(CH2)7-CH=CH- CH2- (CH2)8-COOH
|
a. gondoïque (11,
eicosénoïque)
|
|
|
20 :1 n-11
|
CH3-(CH2)9-CH=CH- CH2- (CH2)6-COOH
|
a. gadoléique(9,
éicosénoïque)
|
|
|
22 :1 n-9
|
CH3-(CH2)7-CH=CH- CH2- (CH2)10-COOH
|
a. érucique(13,
docosénoïque)
|
33.5, 34.7
|
|
22 :1 n-13
|
CH3-(CH2)11-CH=CH- CH2- (CH2)6-COOH
|
a. cétoléique(11,
docosénoïque)
|
|
|
24 :1 n-9
|
CH3-(CH2)7-CH=CH- CH2- (CH2)12-COOH
|
a. nervonique(15,
tétracosénoïque)
|
42.5
|
|
18 :2 n-6
|
CH3-(CH2)4-(CH=CH-CH2)2-(CH2)6-COOH
|
a. linoléique(9,
12-
octadédioénoïque)
|
-5.0
|
|
18 :3 n-6
|
CH3-(CH2)4-(CH=CH-CH2)3-(CH2)3-COOH
|
a.
ã-linoléique(6,9,12-
octadécatriénoïque)
|
|
|
20 :3 n-6
|
CH3-(CH2)4-(CH=CH-CH2)3-(CH2)5-COOH
|
a.
dihomo-ã-linoléique
(8,11,14-éicosatriénoïque)
|
|
|
20 :4 n-6
|
CH3-(CH2)4-(CH=CH-CH2)4-(CH2)2-COOH
|
a. arachidonique (AA) (5,
8, 11,
14-
eicosatétraénoïque)
|
-49.5
|
|
22: n-6
|
CH3-(CH2)3-(CH=CH-CH2)5-(CH2)2-COOH
|
a. 4, 7, 10, 13, 16- docosapentaénoïque
|
|
18:3 n-3
|
CH3-CH2-(CH=CH-CH2)3-(CH2)6-COOH
|
a. á-linolénique (9,
12,
15-octadécatriénoïque)
|
-11.0, -
12.0
|
18:4 n-3
|
CH3-CH2-(CH=CH-CH2)4-(CH2)3-COOH
|
a. stéaridonique
|
|
20:5 n-3
|
CH3-CH2-(CH=CH-CH2)5-(CH2)2-COOH
|
a. 5, 8, 11, 14, 17- eicosapentaénoïque (EPA)
|
|
|
|
22:5 n-3
|
CH3-CH2-(CH=CH-CH2)5-(CH2)4-COOH
|
a. 7, 10, 13, 16, 19-
docosapenténoïque
|
|
|
22:6 n-3
|
CH3-CH2-(CH=CH-CH2)6-CH2-COOH
|
a. 4, 7, 10, 13, 16, 19-
docosahexaénoïque
(DHA)
|
|
b) Acides gras avec liaisons trans non
conjuguées
|
|
18 :1 (9t)
|
CH3-(CH2)7-CH=CH-(CH2)7-COOH
|
a. élaïdique
|
44.0, 46.0
|
|
18 :1 (11t)
|
CH3-(CH2)5-CH=CH-(CH2)9-COOH
|
a. trans-vaccénique
(trans-
11-octadécénoïque)
|
|
|
18 :2 (9,12t)
|
CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH
|
a. linolélaïque
|
28.0
|
|
22 :1 (13t)
|
CH3-(CH2)7-CH=CH-(CH2)11-COOH
|
a. brassidique
(trans-13-
décosénoïque)
|
|
c) Acides gras avec doubles liaisons
conjuguées
|
|
18 :3 (9,11,13)
|
CH3-(CH2)3-CH=CH-CH=CH-CH=CH-(CH2)7-COOH
|
a. á-éléostéarique
(cis-9,
trans-11,13-octadécénoïque)
|
44.0, 48.0
|
|
18 :3 (9t,11t,13t)
|
CH3-(CH2)3-CH=CH-CH=CH-CH=CH-(CH2)7-COOH
|
a. 3-éléostéarique
(trans-
9,11,13-octadécatriénoïque)
|
71.5
|
|
18 :4
(9,11t,13t,15t)
|
CH3-CH2-(CH=CH)3-CH=CH-(CH2)7-COOH
|
a. parinarique (cis-9,
trans-
11,13,15-octadécatétraénoïque)
|
85.0
|
Tableau3.2 : Les principaux acides gras insaturés
(Source : Jean Graille 2003)
Nota : a. = acide
Tableau 20 : Prétraitement des résidus de
fabrication de concentré de tomates pour
l'extraction de l'huile de
grains de tomates
|
Date de récupération de résidus de
tomates
|
Quantité récupérée (kg)
|
|
Le 15/07/2009
|
9,895
|
|
Le 18/07/2009
|
17,045
|
|
Le 09/09/2009
|
21,805
|
|
Masse totale de résidus humides
|
48,715
|
|
Masse totale de résidus secs
|
9, 54745
|
|
Masse total de grains secs
|
2,715
|
Tableau 21 : Teneur en résidus sec total et teneur
en eau de grains de tomates
|
N° échantillon
|
m1 (g)
|
m2 (g)
|
m3 (g)
|
m4 (g)
|
H (%)
|
MS (%)
|
|
1
|
32,3998
|
36,4849
|
4,0851
|
36,1959
|
7,07449022
|
92,9255098
|
|
2
|
31,2309
|
36,9705
|
5,7396
|
36,5668
|
7,03359119
|
92,9664088
|
|
3
|
35,8964
|
39,1174
|
3,221
|
38,898
|
6,81154921
|
93,1884508
|
|
4
|
31,977
|
36,2515
|
4,2745
|
35,954
|
6,95987835
|
93,0401217
|
|
Moyenne
|
|
|
4,33005
|
|
6,96987724
|
93,0301228
|
Avec :
m1: masse de la capsule vide
m2: masse de la capsule + échantillon humide
m3: masse de l'échantillon humide
m4: masse de la capsule + échantillon sec
MS: matière sèche
H: Humidité
Tableau 22 : Teneur en cendres des grains de
tomates
|
N° éch.
|
p1(g)
|
p2(g)
|
p3(g)
|
p5(g)
|
p4(g)
|
MS (%)
|
%MM
|
|
1
|
34,827
|
36,855
|
2,028
|
1,88665089
|
34,9018
|
93,0301228
|
3,964697464
|
|
2
|
27,7024
|
29,7719
|
2,0695
|
1,925258391
|
27,784
|
93,0301228
|
4,238392123
|
|
3
|
32,691
|
34,7562
|
2,0652
|
1,921258096
|
32,7734
|
93,0301228
|
4,288856358
|
|
|
|
|
|
|
|
|
|
Moyenne
|
|
|
2,0542333
|
1,911055793
|
|
93,0301228
|
4,163981981
|
Avec :
p1: masse de la capsule vide
p2: masse de la capsule + échantillon
p3: masse de l'échantillon
p4: masse de la capsule + MM
p5: masse de la matière sèche dans
l'échantillon MM: matière minérale
(cendre)
Tableau 23: Détermination de la teneur en
Azote/protéines
|
éch1
|
éch2
|
éch3
|
éch4
|
Moyenne
|
|
X: (ml)
|
30
|
30,8
|
31,1
|
30,2
|
|
|
Y (g)
|
1,0066
|
1,0073
|
1,0007
|
1,0063
|
|
|
A (ml)
|
50
|
50
|
50
|
50
|
|
|
%N
|
4,17246175
|
4,28075052
|
4,35095433
|
4,20153036
|
4,25142424
|
|
%N par MS
|
3,88164117
|
3,98238221
|
4,04769282
|
3,90868369
|
3,95509997
|
|
%protéines
|
24,2602573
|
24,8898888
|
25,2980801
|
24,4292731
|
24,7193748
|
X : volume de H2SO4 N/50 (en ml)
Y : Poids de l'échantillon (poudre) (en g) A : Volume de
la prise d'essai en (ml)
Tableau 24: Dosage de la teneur en MG des grains des
tomates par l'éther de pétrole
|
Solvant
|
N° éch.
|
m.ech.
|
MBV (g)
|
MBH (g)
|
ME
|
M.G (%)
|
|
Ether de pétrole
|
1
|
5,0435
|
155,2691
|
156,3791
|
4,691974243
|
23,65741887
|
|
2
|
5,0951
|
154,7971
|
155,923
|
4,739977787
|
23,75327587
|
|
3
|
5,0243
|
157,6939
|
158,9016
|
4,67411246
|
25,83806039
|
|
Moyenne
|
5,0543
|
|
|
4,702021497
|
24,41625171
|
Tableau 25 : Dosage de la teneur en MG des grains des
tomates par l'hexane
|
Solvant
|
N° éch.
|
m.ech.
|
MBV (g)
|
MBH (g)
|
ME
|
M.G (%)
|
|
Hexane
|
1
|
5,001
|
154,7343
|
155,9993
|
4,652436441
|
27,19005442
|
|
2
|
5,001
|
179,4552
|
180,7235
|
4,652436441
|
27,26098499
|
|
3
|
5,001
|
177,8834
|
179,0073
|
4,652436441
|
24,15723491
|
|
Moyenne
|
5,001
|
|
|
4,652436441
|
26,2027581
|
Tableau 26: Dosage de la teneur en MG des grains des
tomates par le diéthyl-éther
|
Solvant
|
N° éch.
|
m.ech. (g)
|
MBV (g)
|
MBH (g)
|
ME
|
M.G (%)
|
|
Diéthyléther
|
1
|
5,0107
|
173,9711
|
175,0671
|
4,661460363
|
23,51194507
|
|
2
|
5,0581
|
157,704
|
158,8651
|
4,705556641
|
24,67508285
|
|
3
|
5,0239
|
182,1573
|
183,1861
|
4,673740339
|
22,01234825
|
|
Moyenne
|
5,0309
|
|
|
4,680252448
|
23,39979206
|
Avec :
MG : Matière Grasse
m.éch: masse de l'échantillon
MBH : Masse du ballon + Huile MBV : Masse du
Ballon Vide
ME : Masse de matière Sèche
contenue dans l'Echantillon.
Tableau 27: Extraction et dosage
spectrophotométrique de lycopènes
|
Mélange H-A-E
|
Acétone
|
Hexane
|
|
m.éch.
|
2,0081
|
2,0078
|
2,0064
|
|
ME
|
1,868137896
|
1,867858806
|
1,86655638
|
|
A à 451nm
|
0,217
|
0,365
|
0,285
|
|
C 13-caro (mg/l)
|
0,406845
|
0,652275
|
0,566502
|
|
A à 470nm
|
0,224
|
0,369
|
0,277
|
|
C Carot (mol/l)
|
|
|
|
|
A à 503nm
|
0,193
|
0,335
|
0,255
|
|
C Lyco (mg/l)
|
0,589185
|
1,032075
|
0,824712
|
Avec :
m.éch.: masse de l'échantillon
Mélange H-A-E : Mélange
Hexane-Acétone-Ethanol (2/1/1) ME: Masse de la
matière sèche dans l'échantillon
C Lyco (mol/l): concentration de lycopène
en mol/l
C 13-caro (mol/l):
Concentration de 13-carotène en mol/l
C Carot (mol/l): Concentration globale des
Carotènes en mol/l
Tableau 28 : Détermination de la teneur en
cellulose brute
|
n° éch
|
m.éch
|
m1
|
m2
|
Mse
|
%CB
|
|
1
|
2,0101
|
63,715
|
63,2859
|
1,8699985
|
22,9465425
|
|
2
|
2,0127
|
63,445
|
62,9872
|
1,87241728
|
24,4496782
|
|
3
|
2,0124
|
65,8142
|
65,3402
|
1,87213819
|
25,3186438
|
|
Moyenne
|
2,01173333
|
|
|
1,87151799
|
24,2382882
|
Avec :
m1 : masse de la capsule + échantillon
sec
m2 : masse de la capsule + cendre (MM)
MSe : masse de la matière sèche
dans l'échantillon

A490nm
0,6
0,5
0,4
0,3
0,2
0,1
Courbe d'étalonnage des sucres totaux
0
0 20 40 60 80 100 120 140
C ppm
y = 0,004x + 0,005 R2 = 0,928
Figure 17 : Courbe d'étalonnage des sucres totaux
A b s o r
b
a
n
c
phosphore mg/ml
e
0,6
0,5
0,4
0,3
0,2
0,1
0
0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09
Courbe d'etalonnage phosphore
y = 5,942x + 0,007
R2 = 0,99
9
Figure 18 : Courbe d'étalonnage phosphore
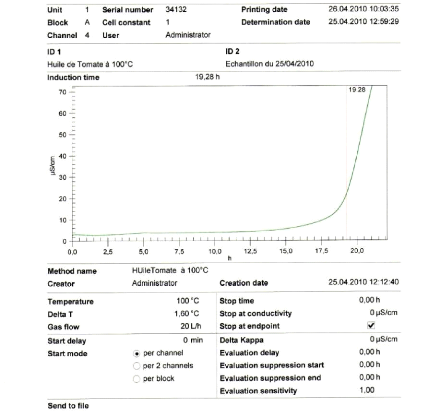



Figure 19 : Courbe de temps d'induction a 100°C


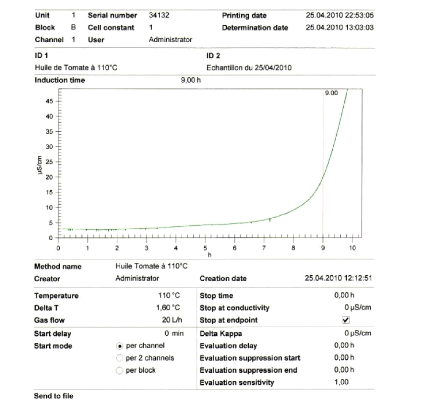
Figure 20 : Courbe de temps d'induction a 110°C




Figure 21 : Courbe de temps d'induction a 120°C
|
|



