UNIVERSITE CATHOLIQUE DU GRABEN
B.P. 29 BUTEMBO/NORD-KIVU

FACULTE DE MEDECINE

CARACTERISTIQUES PHENOTYPIQUES DES STAPHYLOCOQUES
AUREUS METHICILLINO-RESISTANTS ISOLES AU CENTRE UNIVERSITAIRE DE
DIAGNOSTIC DU GRABEN DU 1ER SEPTEMBRE AU 31
DECEMBRE 2018

Mémoire présenté en vue de
l'obtention du grade de Docteur en Médecine.
Par Agnès KAVIRA KATSIOTO
Directeur : Zacharie TSONGO KIBENDELWA,
Professeur
Encadreur : Gabriel KAMBALE BUNDUKI,
Assistant
ANNEE ACADEMIQUE : 2017-2018
i
Dédicace
A tous ceux qui ont apporté un soutien financier,
matériel, moral, psychologique,... à ma formation et
transformation
Agnès Kavira Katsioto
II
REMERCIEMENTS
Que la gloire soit rendue à notre Dieu, pour son
souffle de vie et pour tant d'autres merveilles qu'il ne cesse de manifester
à notre égard.
A l'équipe de direction de ce travail, le Professeur
Tsongo Kibendelwa Zacharie et le Dr. Gabriel Kambale Bunduki, qui malgré
leurs multiples occupations étaient toujours prêts à nous
donner des conseils et à apporter leurs expertises du début
à la fin de la rédaction de ce travail.
A l'Université Catholique du Graben qui, à
travers sa formation conséquente, est dévouée à
fournir à la société une élite compétitive
et compétente
Nous remercions également le Chef de Département
de Microbiologie du Centre Universitaire de Diagnostic au Graben, Mwanzo
Wavindu et la technicienne Jeanine, avec qui nous avions travaillé pour
la réussite de ce travail
A ma très chère mère Nathalie Kyakimwa et
mes soeurs Grace Kavugho et Francine Kasoki et tous les membres de ma famille
pour leur amour inébranlable et support durant ce long parcours.
A la famille Servites qui est le promoteur et la base de ma
formation depuis le
début.
Nos remerciements s'adressent au système de bourse
d'excellence BEBUC, à la Fondation Else-Kroner-Fresenius-Stiftung et
à la Fondation Holger Poehlmann Stiftung qui ont financé nos
études et même le projet de ce travail d'une manière ou
d'une autre.
A mes marraines, Prof Dr Sandra B. Hake, Mme Cathérine
Caillot et Mme Symphorose Kahindula, votre bonté a comblé mon
existence.
Nos rémerciements les plus sincères à nos
amis Michel Mukululi, Job Isombi, Roland Muyisa, Hervé Mbuyamba, Didos
Kahemu ; votre soutien m'a été très utile.
A mes compagnons de lutte Merveille Syaghuswa, Wivine
Mwengesyali, Ismen Lumika, Nguru Musese, Furaha Mugheni, Lydie Valimwingighe,
Maggy Ngahinga, Desanges Tibamwenda, vous avez rendu ma vie belle.
Tous ceux-là qui nous ont aidés à
résister aux tourbillons existentiels trouvent en ces lignes
l'éloquent témoignage de notre reconnaissance.
Agnès Kavira Katsioto
III
PLAN DU TRAVAIL
Introduction
Chapitre I : Généralités
Chapitre II : Matériel et méthodes
Chapitre III : Résultats
Chapitre IV : Discussion
Conclusion
Recommandations
Références
Table de matières
Annexes
iv
SIGLES ET ABREVIATIONS
ABR : Antibiorésistance
ANC : Acide nalidixique et de colistine
APAB : Acide para-amino-benzoïque
BMR : Bactérie multirésistante
BORSA : Borderline Staphylocoque aureus
CDC: Centers for Disease Control and Prevention
CLSI: Clinical and Laboratory Standards Institute
CUDG : Centre Universitaire de Diagnostic au Graben
DHFS : Dihydrofolique acide synthétase
ECDC : Centre Européen de Prévention et de
Contrôle des Maladies
GS : Gélose au sang
IC : Intervalle de confiance
ISO: Infection du site opératoire
KTG : Kanamycine-Tobramycine-Gentamicine
LCR : Liquide céphalo-rachidien
LPV : Leucocidine de Panton et Valentine
MLS : Macrolides-Lincosamides - Streptogramine
MODSA : Modified Staphylocoque aureus
OMS : Organisation Mondiale de la Santé
OR: Odds Ratio
ORL: Oto-Rhino-Larynologie
PBP : Pencilln binding proteins
RDC : République Démocratique du Congo
SARM : Staphylocoque aureus résistantes
à la méthicilline
SASM : Staphylocoque aureus sensibles à la
méthicilline
THF : Acide tétrahydrofolique
V
TSI : Triple Sugar Iron
VRSA : Staphylocoque aureus résistant à la
vancomycine VP : Voges-Proskauer
VW : Von Willbrand
vi
LISTE DES FIGURES
Figure 1 : Amas de Staphylocoque après coloration de Gram
Figure 2 : Ordinogramme des cultures effectuées
LISTE DES TABLEAUX
Tableau I : Facteurs socio-démographiques de SARM
Tableau II : Type d'échantillon et origine de SARM
Tableau IV : Sensibilité de S. aureus et de SARM aux
antibiotiques
Tableau V : Antibiosensibilité des SARM par rapport
à l'origine de l'échantillon
vii
RESUME
Introduction : Le Staphylococcus aureus
résistant à la méthicilline (SARM)
constitue mondialement un problème de santé
publique. La prévalence des infections à ce germe,
hospitalière et communautaire, augmente de façon
régulière; et leur traitement devenu difficile à cause de
l'émergence des souches multi résistantes. L'objectif de ce
travail est de rechercher phénotypiquement le SARM dans les
échantillons cliniques reçus au Centre Universitaire de
Diagnostic du Graben. Le but est de contribuer à l'amélioration
de la prise en charge des infections liées à ces germes et la
surveillance de leur émergence.
Méthodologie : L'étude est
prospective longitudinale, allant du 1er Septembre 2018 au 31 Décembre
2018. Notre échantillon était164 souches de S. aureus.
L'identification de SARM a été faite par des méthodes
phénotypiques. La sensibilité aux antibiotiques a
été faite par la méthode de diffusion de disque. L'analyse
des données a été faite par le logiciel SPSS version 22.
P-value <0.05 était considéré significatif.
Résultat : Sur 164 souches de S. aureus,
102 (62,2%) cas de SARM ont été isolés. Le SARM concerne
les hommes d'âge variant entre 25 à 40 ans, souvent acquis en
communauté et fréquemment dans les sécrétions de la
sphère urogénital. Les non SARM sont plus sensibles à la
plupart d'antibiotiques. Les SARM expriment un taux de résistance plus
élevé. La sensibilité de SARM aux antibiotiques ne
dépend pas de l'origine de l'échantillon. 100% des SARM
étaient résistants à l'oxacilline, la cloxacilline, la
meropèneme et la cotrimoxazole ; 97,2 ; 96,8 et 89,9% respectivement
pour la clarythromycine, l'azythromycine et la ceftriaxone. Les souches ont
exprimé la résistance la plus faible à la vancomycine et
l'augmentin.
Conclusion : La prévalence de SARM est
élevée dans notre milieu, et il présente la
résistance à la quasi-totalité des antibiotiques
utilisés localement.
Mots clés : SARM, phénotypes,
antibiogramme
VIII
ABSTRACT
Background: Methicillin-resistant Staphylococcus
aureus (MRSA) is a public health problem throughout the world. The prevalence
of MRSA infections, both in hospitals and community is increasing; and their
treatment has become difficult due to the multi drugs resistant strains. The
objective of our study is to search phenotypically the MRSA in clinical
specimens isolated at the Centre Universitaire de diagnostic au Graben. The
final target is to contribute to the improvement of the management of
infections linked to these germs and the surveillance of their emergence.
Methodology: It's a cross-sectional and
prospective study carried out from September 1st, 2018 to December 31, 2018.
Our sample was constituted with 164 strains of S.aureus.
Identification of MRSA strains was made through phenotypic method, the
antibiotic susceptibility patterns of strains was done by disk diffusion
method. Data was analyzed by SPSS version 22. P -value of <0.05 was
considered as significant.
Results: Out of 164 examined samples, 102
(62,2%) of them were MRSA. The MRSA concerns more men with 25 to 40 years old,
often acquired in community and frequently isolated in the secretions of the
urogenital tract. The non MRSA strains are more susceptible to almost
antibiotics; the MRSA expresses a high rate of resistance. The susceptibility
of MRSA to the antibiotics is independent to its hospital and community
acquirement. The susceptibility antibiotics showed that 100% of MRSA were
resistant to oxacillin, cloxacillin, meropenem and cotrimoxazol; 97,2; 96,8 and
89,9% respectively for clarythromycin, azythromycin and ceftriaxone. The
strains expressed the lowest resistance was observed to vancomycin.
Conclusion: Our study has reported a relatively
high prevalence of MRSA in our country; and they present a resistance to the
quasi-totality of antibiotics used locally.
Key words: Phenotypics, MRSA, antibiogramme,
CUD.
1
INTRODUCTION
Le Staphylococcus aureus est une bactérie
pyogène. Son caractère ubiquitaire, sa virulence et sa
remarquable capacité de survie dans un environnement défavorable
ou même hostile expliquent sa grande fréquence en pathologie
communautaire et nosocomiale. S. aureus est responsable d'une grande
variété d'affections de gravité variable parfois
bénignes comme les infections cutanées et muqueuses, ou
sévères comme l'endocardite et la septicémie. Bien qu'il
soit virulent, S. aureus n'infecte pas forcement son hôte mais
le colonise [1].
La prévalence des infections staphylococciques,
nosocomiales et communautaires augmente de façon
régulière. Le traitement de ces infections est devenu de plus en
plus difficile à cause de l'émergence des souches multi
résistantes. Ce phénomène est observé aussi bien
à l'hôpital que dans la ville.
Les souches de S. aureus de phénotype sauvage
sont sensibles aux pénicillines (Penicillin G, Penicillin M, Penicillin
A), à la céfalotine, à la céfoxitine, au
moxalactam, à la céfotaxime, aux macrolides, lincosamides et
streptogramines, aux aminosides, aux tétracyclines, aux
fluoroquinolones, au chloramphénicol, aux rifamycines, aux sulfamides et
à la triméthoprime, à l'acide fusidique, à la
fosfomycine et aux glycopeptides. S. aureus a une résistance
naturelle à l'acide nalidixique, aux polymyxines, à
l'aztréonam et aux 5-nitro-imidazolés [2-5].
En effet, dès 1950, c'est-à-dire dix ans
après la découverte de la pénicilline, les
Staphylococcus aureus deviennent un problème
thérapeutique majeur par l'acquisition de la résistance
plasmidique à la pénicilline. Peu après l'introduction de
la méthicilline en 1959, apparaissent des souches de S. aureus
résistantes à la méthicilline (SARM) [6]. La
résistance à la méthicilline est liée à
l'acquisition d'une autre protéine liant la pénicilline, la PLP2a
ou PLP2', présentant peu d'affinité pour les
béta-lactamines. La production de PLP2a est codée par le
gène chromosomique mecA dont l'origine reste encore inconnue [7].
Les SARM présentent également une
résistance à d'autres antibiotiques. Les SARM sont aussi
résistants aux bêta-lactamines, à la tétracycline,
au chloramphénicol et aux macrolides [8]. Par la suite, ces souches sont
devenues résistantes à la gentamicine [9]. La plupart des SARM
isolés dans le monde expriment des phénotypes de multi
résistance, une caractéristique qui, jusqu'en 1995, s'appliquait
seulement aux SARM acquis dans les hôpitaux [6].
2
La diffusion des SARM concerne aujourd'hui tous les types
d'établissements de soins, mais tend également à
déborder de plus en plus sur le milieu communautaire. Il est reconnu que
les SARM ne remplacent pas les souches sensibles mais s'y ajoutent ; par
conséquent, il y a une augmentation globale du nombre d'infections
[10].
Les études antérieures ont montré que le
SARM constituait un problème mondial [11-13] et constitue un
problème majeur de santé publique [14]. D'après une
étude coordonnée par un économiste britannique, environ
700 000 personnes décéderaient chaque année à cause
des résistances aux antimicrobiens (antibiotiques, antiviraux,
antifongiques et antiparasitaires). Si les tendances se confirment dans les
années à venir, ce nombre pourrait atteindre 10 millions de
décès dans le monde en 2050 [15]. Les infections
résistantes feraient alors plus de morts que le cancer (8,2 millions).
D'après Wakefield et al. [16], les SARM prolongent la
durée d'hospitalisation dans 71% de cas, augmentent le coût des
examens (33%) et celui des antibiotiques (43%) en comparaison avec les patients
ayant présenté une infection aux souches des Staphylocoque
aureus sensibles à la méthicilline (SASM).
D'après les données du Centre Européen de
Prévention et de Contrôle des Maladies (ECDC), 33 000 personnes
décèdent chaque année de suites d'une infection à
bactérie multirésistante (BMR) dans les pays de l'Union
Européenne [17]. Alors qu'aux Etats Unis d'Amérique, les centres
pour le contrôle et la prévention des maladies (Centers for
Disease Control and Prevention (CDC)) cité par Leaper et al.
[18] estiment que chaque année, 2 millions d'américains sont
victimes d'infections provoquées par une BMR et que 23 000 en
meurent.
En France, les résultats des enquêtes nationales
de prévalence de 1996, 2001 et 2006 montrent que les BMR occupent une
place importante. Le Staphylococcus aureus représentait en 2006
un cinquième de l'ensemble des bactéries responsable des
infections, y compris des bactériémies, et un tiers des
bactéries responsables des infections du site opératoire (ISO).
Par contre, l'ensemble des entérobactéries représentait
40% des bactéries, responsables de bactériémies, deux
tiers des infections urinaires et un quart des ISO. SARM était alors la
plus fréquente des BMR (environ 13% de l'ensemble des bactéries),
suivi par les entérobactéries résistantes à la
céfotaxime (5%) [19-21].
Au Québec comme au Canada, le système de
surveillance des infections montre que le taux de prévalence de SARM est
passé de 16,6% en 2000 à 48% en 2003 dans les centres
hospitaliers de courtes durées et que 82% des cas de SARM seraient des
bactériémies dont la mortalité moyenne est de 30% des cas
[22].
3
La résistance aux antibiotiques dans la région
Africaine constitue un domaine qui n'est pas bien documenté dans les
rapports de l'Organisation Mondiale de la Santé (OMS). Les
données ne sont rassemblées que dans un nombre limité de
pays. Une résistance importante est constatée pour plusieurs
bactéries qui se sont propagées dans les communautés et
dans les hôpitaux. La prédominance des SARM a été
déterminée dans huit pays africains entre 1996 et 1997 et a
été relativement élevée au Nigeria, au Kenya et au
Cameroun (21 à 30%) et inférieur à 10% en Tunisie et en
Algérie [23].
En Afrique de l'Ouest, la menace est inquiétante
concernant le SARM avec une prévalence qui est supérieure
à 30% [24]. Une étude mauritanienne a montré que
l'activité de la pénicilline G sur les souches de
Staphylococcus aureus isolées dans la région de Nouakchott
est quasi nulle et le taux de SARM communautaire est important, atteignant
jusqu'à 34% [25].
Le travail de Vlieghe et al. concernant
l'étude systématique de la littérature publiée sur
la résistance bactérienne en Afrique centrale entre 1955 et 2008,
a montré de taux de résistance élevés dans presque
tous les pathogènes. Ils ont également constaté la
multi-résistance de Shigella et de Salmonella spp.
ainsi que l'émergence de SARM [26]. Les conclusions de Vlieghe
et al. montrent que la région d'Afrique Centrale n'est pas
exclue de la tendance mondiale d'antibiorésistance croissante et a donc
besoin d'une surveillance urgente basée sur la microbiologie pour
fournir les données claires sur l'antibiorésistance (ABR).
En République Démocratique du Congo (RDC), les
recherches de Nyembwe et al. sur la prévalence de SARM à
Kinshasa ont montré un taux élevé de SARM dans le milieu
hospitalier mais aussi, elles ont montré l'existence du portage sain a
une fréquence élevée chez les soignants [27].
L'usage irrationnel d'antibiotiques a déjà
été démontré à l'Est de la RDC.
Les
antibiotiques comme amoxicilline-acide clavulanique, penicilline,
amoxicilline, ciprofloxacine, erythromycine et doxycycline sont beaucoup
utilisés abusivement dans le milieu académique pour le traitement
des infections urinaires et respiratoires [28-29]. Ce qui favoriserait
l'accroissement des BMR.
Cependant, au Nord-Kivu, la plupart des structures sanitaires
manquent la capacité d'identifier microbiologiquement des agents de
maladies infectieuses, y compris les infections bactériennes
envahissantes. Butembo n'est donc pas loin de cette triste
réalité d'ABR. Bunduki et al. ont démontré
que S. aureus est le germes fréquemment isolé des
urocultures [30] et hémocultures [31], respectivement avec une
fréquence de 47,0% et 39,9%. Ce germe
4
était résistant aux antibiotiques les plus
couramment utilisés, sauf pour les quinolones comme la ciprofloxacine
pour laquelle il était sensible. Mais aucune étude publiée
n'a analysée les caractéristiques phénotypiques et
génotypiques de S. auresus résistants à la
méthiciline.
Malgré l'importance du problème d'ABR et de
conséquences sanitaires et économiques qui en découlent,
rares sont les pays d'Afrique qui disposent de programme et plan nationaux de
surveillance et de lutte contre la résistance comme le recommande l'OMS
[32]. Le niveau de la recherche sur la résistance aux antibiotiques dans
ces pays reste encore trop faible. En RDC, aucune étude n'a
été effectuée sur les caractéristiques
phénotypique et génotypique d'antibiorésistance de
bactéries.
Les SARM sont l'une des BMR faisant l'objet de la plupart des
programmes nationaux en raison de leur fréquence élevée,
leur potentiel pathogène se traduisant par une morbi-mortalité et
des surcoûts économiques associé à leur
caractère commensal qui expose au risque de diffusion, et de leur
caractère clonal ou du caractère aisément
transférable des mécanismes de résistance impliqués
[16,19-21,24,33].
Un point important est de connaître les
phénotypes des souches SARM chez les patients qui nécessitent un
traitement adéquat comme c'est le cas de ceux qui souffrent de
bactériémies [31] et d'infections nosocomiales et d'autres
infections liées à ces germes. En effet, les traitements
empiriques administrés chez ces patients pourraient ne pas être
efficaces vis-à-vis des SARM. Vu l'importance du problème
lié aux SARM, son étude phénotypique serait important dans
le milieu démuni comme le nôtre.
Ainsi, l'objectif de ce travail est de rechercher
phénotypiquement le S. aureus
méthicillino-résistant dans les échantillons
cliniques reçus au Centre Universitaire de Diagnostic au Graben en vue
de contribuer à l'amélioration de la prise en charge des
infections liées à ces germes et la surveillance de leur
émergence.
Les objectifs spécifiques sont :
- Déterminer la prévalence des souches de S.
aureus résistantes à la méthicilline ;
- Étudier la sensibilité de SARM aux antibiotiques
couramment utilisés ;
- Comparer la sensibilité aux antibiotiques des SARM
d'origine hospitalière à celle
d'origine communautaires.
L'intérêt de ce travail se résume par le
fait que les SARM est une cause de morbidité et mortalité tant
dans les pays développés que dans les pays en voie de
développement, en milieu hospitalier comme dans les communautés
et avec une élévation du coût des soins médicaux. La
connaissance de la sensibilité de SARM aux différents
antibiotiques servira de guide pour le clinicien lors du traitement.
5
Les résultats de cette étude serviront des
données locales sur les SARM, leur surveillance
épidémiologique, et orienteront les mesures préventives et
hygiéniques à mettre en place dans la politique locale de lutte
contre l'antibiorésistance.
6
CHAPITRE I : GENERALITES SUR LES
STAPHYLOCOQUES
AUREUS METHICILLINO-RESISTANTS
I.1. Staphylococcus aureus
I.1.1. Historique
Observés par Pasteur en 1879 dans un pus de furoncle, les
staphylocoques
doivent leur nom à Ogston (1881) qui les a mis en
évidence dans des abcès aigus et chroniques [34]. Trente-cinq
espèces sont actuellement répertoriées dans le genre
Staphylococcus [35].
I.1.2. Habitat
S. aureus est un commensal de la peau et des muqueuses
de l'homme et des
animaux à sang froid. Le site de colonisation de S.
aureus est préférentiellement la muqueuse nasale, la peau,
les zones humides (aisselles, aines, périnée) et les mains.
Trente à cinquante pourcent des adultes sains sont
colonisés avec 10 à 20% de porteurs chroniques[2].
I.1.3. Caractères bactériologiques a)
Morphologie
Ce sont des cocci à Gram positif, isolés ou
groupés en diplocoques, en courtes chaînettes ou en amas, ayant la
forme de grappe de raisin, immobiles, non sporulés mais parfois
encapsulés. Ils mesurent 0,8 à 1 ìm de diamètre.
b) Caractères culturaux
S. aureus se cultive facilement sur tous les milieux
usuels, et aussi sur des milieux riches en NaCl à des conditions de pH
et de température variables. Sur gélose Columbia
additionnée de sang de mouton (5%) d'acide nalidixique et de colistine
(ANC), les colonies sont lisses, brillantes, bombées et rondes.
En milieu liquide (hémoculture), il produit dans le
bouillon un trouble homogène. Certaines souches sont pigmentées
en jaune doré ; d'où, le nom d'aureus. Le pH varie de 5,6
à 8,1 ; l'optimum est de 7,5.
La température optimale de croissance est de 37°C.
Mais, la culture est possible de 10 à 45°C. S. aureus est
une bactérie aéro-anaérobie facultative,
c'est-à-dire qu'il est capable de se développer à la
surface de la peau, en aérobiose et aussi dans les tissus mal
oxygénés [36].
7
I.1.4. Substances biologiquement actives
a) Le génome
Le génome du S. aureus est constitué
d'un chromosome circulaire d'environ 2800 paires de bases. Les gènes de
virulence et de résistance aux antibiotiques sont retrouvés
à la fois sur le chromosome et sur des éléments
extra-chromosomiques. Cela permet ainsi leur transfert d'une bactérie
à l'autre dans la même espèce et dans les espèces
différentes.
b) La paroi
Elle est formée de peptidoglycane, des acides
teichoïques et lipoteichoïques. Les acides teichoïques sont des
polymères linéaires du ribitol phosphate liés de
façon covalente au peptidoglycane. Ces composants possèdent des
effets biologiques démontrés in vitro. Ils ont une
activité endotoxin-like stimulant la sécrétion de
cytokines par les cellules lympho-monocytaires, l'activation du
complément, et l'agrégation plaquettaire.
Les acides téichoïques sont les récepteurs
des bactériophages et donnent naissance à des anticorps que l'on
retrouve dans le sérum du malade (lysotypie des staphylocoques).
c) La capsule
La capsule polysaccharidique est impliquée dans le
phénomène d'adhérence et permet également une
meilleure résistance des souches à la phagocytose et à
l'opsonisation. d) Les protéines de surface
Plusieurs de ces protéines de surface jouent un
rôle dans la capacité des staphylocoques à coloniser les
tissus. S. aureus se fixe aux cellules et à la matrice
extracellulaire par l'intermédiaire de ces protéines de surface
dénommées adhésines.
La protéine A inhibe l'opsonophagocytose grâce
à sa capacité de fixation au fragment Fc des immunoglobulines.
Elle se lie au facteur de Von Willbrand (VW) et au fragment Fab (partie
variable) des immunoglobulines.
e) Les toxines
? Hémolysines ou staphylolysines
Plusieurs ont été décrites (alpha,
bêta, gamma, delta). Elles ont une action cytolytique sur les plaquettes
et les globules rouges. L'alpha-toxine est une toxine à action
membranaire. Après liaison au récepteur membranaire, elle forme
des pores d'où peuvent s'échapper des cations et des petites
molécules. Elle a un effet vasoconstricteur et nécrotique sur la
peau. Son poids moléculaire est de 33 kDa.
8
? Superantigènes
Ce sont des toxines pyrogènes qui se lient au complexe
majeur d'histocompatibilité de type II et causent une
prolifération majeure des lymphocytes T avec production de cytokines. Ce
sont :
? Les entérotoxines
Il en existe sept : A, B, C 1, C 2, C 3, D et E. Elles sont
responsables du choc toxique staphylococcique, de toxi-infection alimentaire et
d'entérocolite aiguë pseudomembraneuse. Elles résistent aux
protéases du tube digestif et partiellement à la chaleur. Leur
origine est chromosomique.
? Toxine du choc toxique staphylococcique ou TSST1
D'origine chromosomique, elle induit la synthèse
d'anticorps dont la fréquence augmente avec l'âge. On la trouve
dans 20 % des souches S. aureus.
? Exfoliatines
Ce sont des toxines épidermolytiques A et B. Elles sont
responsables d'érythème et de clivage de l'épiderme,
causant l'épidermolyse bulleuse staphylococcique (A et B responsables
d'infections néonatales : syndrome de Ritter, impétigo
bulleux)
? Leucocidine de Panton et Valentine (LPV)
Ce sont des protéines à deux composants non
associés mais agissant en synergie sur les membranes cellulaires. Ces
toxines ont des cellules cibles telles que les polynucléaires, les
monocytes, et les macrophages, et sur lesquelles elles se fixent et provoquent
la formation des canaux membranaires laissant passer les cations divalents.
La LPV constituée d'un composant de classe S et d'un
composant de classe F est dermonécrotique et leucotoxique [4].
f) Les enzymes
Les staphylocoques produisent de nombreuses enzymes comme les
protéases, lipases, hyalurodinases qui lysent les tissus et peuvent
faciliter l'extension de l'infection aux tissus adjacents.
? La coagulase libre
S. aureus fabrique une exoenzyme capable de coaguler
en quelques heures le plasma humain citraté ou hépariné.
La coagulase est une protéine extracellulaire qui se lie à la
prothrombine de l'hôte et forme un complexe appelé
staphylothrombine. La thrombine activée transforme donc le
fibrinogène en fibrine. C'est la base du test de la coagulase en tube.
C'est un marqueur classique de l'identification de S. aureus.
9
· La coagulase liée ou clumping factor
C'est une protéine constituant la paroi, elle fixe le
fibrinogène et entraîne l'agglutination des staphylocoques.
· La fibrinolysine ou staphylokinase
Elle active le plasminogène en plasmine et contribue
à la dislocation du caillot et à la formation de microembols
bactériens responsables des métastases septiques.
· La désoxyribonucléique thermostable
C'est une nucléase ayant des propriétés
endo et exonucléasiques et elle est active sur les ADN et les ARN. Elle
est produite par la plupart des souches de S. aureus.
· Les bêta-lactamases
Elles inactivent la pénicilline. Les PBP (pencilln
binding proteins) sont situées dans la membrane cytoplasmique, leur
modification confère une résistance aux pénicillines A et
M et aux céphalosporines.
I.1.5. Pouvoir pathogène
S. aureus est responsable d'infections suppuratives
superficielles et profondes ainsi que des syndromes liés à
l'action des toxines.
a) Les infections suppuratives
Les infections à S. aureus les plus
fréquentes sont les infections cutanéo-muqueuses telles que les
folliculites, les furoncles, les anthrax, le panaris, les cellulites ou les
sinusites et les otites. Il s'agit le plus souvent d'auto-infestation. Ces
infections se compliquent parfois par extension loco-régionale ou par
diffusion hématogène de la bactérie. S. aureus
peut alors être responsable de septicémies, d'endocardites,
de pneumopathies, d'ostéomyélites, d'arthrites, de
méningites ou d'infections urinaires.
b) Les infections d'origine toxinique
· Syndromes cutanés staphylococciques
Le syndrome de la peau ébouillantée chez les
jeunes enfants est provoqué par la diffusion d'exfoliatines de
même que le syndrome de Ritter observé chez les
nouveaux-nés. Quant à l'impétigo bulleux, il est induit
par productions d'exfoliatines au sein même des lésions
cutanées.
· Choc toxique staphylococcique
Ce syndrome est provoqué par la diffusion dans
l'organisme du TSST-1 et ou des entérotoxines. Ce même syndrome a
été décrit en pédiatrie comme étant une
complication d'infections suppuratives staphylococciques. Il est
caractérisé par une fièvre à 39°C, une
10
hypotension artérielle, une érythrodermie
scarlatiniforme, une desquamation diffuse, des diarrhées, une
céphalée et une atteinte multiviscérale.
? Intoxications alimentaires
Elles sont provoquées par l'ingestion
d'entérotoxines thermostables. L'intoxication est
caractérisée par une incubation courte d'une à six heures
après l'ingestion, on a des crampes abdominales douloureuses, des
nausées, des diarrhées, des vomissements, absence de
fièvre et parfois, on a des collapsus cardiovasculaires.
I.1. 6. Diagnostic bactériologique des
infections à S. aureus
a) Le prélèvement
Le résultat des examens bactériologiques
dépend pour une grande part des conditions de prélèvement
et de transport de l'échantillon. Les prélèvements doivent
être effectués en principe avant l'administration
d'antibiotiques.
Ainsi, les modalités pour un bon
prélèvement sont :
? Pour les lésions cutanéo-muqueuses : on
désinfecte au préalable la zone à prélever, puis on
procède par aspiration douce à l'aide d'une aiguille
stérile surmontée d'une seringue stérile.
? Pour les urines, les sécrétions vaginales et
autres liquides, le prélèvement se fait dans un étui
stérile pour éviter toute contamination. L'acheminement au
laboratoire du produit pathologique doit être fait le plus rapide
possible.
b) Diagnostic direct
Les produits pathologiques sont systématiquement
examinés au microscope optique, à l'état frais
après étalement entre lame et lamelle ou à l'aide d'une
cellule de Malassez. Ensuite, on procède à la coloration de Gram
qui nous montre des cocci à Gram positif, le plus souvent groupés
en amas ou en diplocoques (Fig. n° 1).
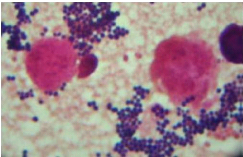
Fig 1 : Amas de Staphylocoque après coloration de Gram
11
La culture se fait généralement sur milieu
sélectif notamment sur gélose Columbia additionnée au sang
de mouton (5%) d'acide nalidixique et de colistine et incubée à
37°C pendant 24 à 48 heures sous dioxyde de carbone ou en
anaérobiose. S. aureus pousse également sur milieu de
CHAPMAN. Pour obtenir des cultures pures, il faut réensemencer les
germes prédominants lorsque la première culture
révèle un caractère impur.
L'identification de S. aureus repose sur les
caractères suivants : présence d'un pigment
caroténoïde, d'une coagulase, d'une protéine A, d'une
hémolysine alpha, la réduction des nitrates, la fermentation du
mannitol, la présence de l'acétoïne, d'une phosphatase et la
sensibilité à la novobiocine[37-39].
c) Diagnostic indirect
Ce diagnostic repose sur la recherche des antistaphylolysines
alpha et les anticorps anti-acide teichoïques dans le sérum
[40].
I.2. Les antibiotiques
I.2.1. Définition
En 1942, WAKSMAN définit un antibiotique comme
étant un dérivé produit
par métabolisme de micro-organisme, possédant
une activité antibactérienne à faible concentration et
n'ayant pas de toxicité sur l'hôte. Il est aussi défini
comme une substance d'origine biologique ou synthétique, agissant
spécifiquement sur une étape essentielle du métabolisme
des bactéries [38].
I.2.2. Les différentes classes
d'antibiotiques
a) Les bêta-lactamines
Ce sont des antibiotiques dont la structure de base est le cycle
bêta-lactame et
trois groupes sont individualisés dans cette classe. Les
pénicillines et les céphalosporines
feront l'objet de notre étude.
? Mécanisme d'action
Les bêta-lactamines agissent par inhibition de la
dernière étape de la synthèse
du peptidoglycane de la paroi bactérienne.
? Mécanismes de résistance
Ils existent plusieurs mécanismes.
? Modification de la cible :
La résistance est due à la présence de
protéine de liaison à la pénicilline
additionnelle la PLP 2a qui a une très faible
affinité pour l'ensemble des bêta-lactamines.
Cette résistance peut être soit homogène
soit hétérogène. La production de ces PLP anormales
12
est codée par un gène chromosomique mec A qui
appartient à un fragment additionnel d'ADN intégré
à celui des SARM.
+ Production de bêta-lactamase : souches BORSA (borderline
S. aureus)
Cette résistance est due à une
sécrétion importante de bêta-lactamase. Ce sont notamment
des souches qui n'ont pas de résistance intrinsèque,
c'est-à-dire ni PLP 2a, ni gène mec A et il y a restauration in
vitro si l'oxacilline est associée à un inhibiteur de
bêta-lactamase.
+ Production de méthicillinase
Quelques souches semblent produire une méthicillinase
capable d'hydrolyser la méthicilline, en absence de gène mec
A.
+ Modification des PLP autre que la PLP 2a (souches MODSA :
modified S. aureus)
Les souches résistantes à bas niveau à
l'oxacilline et non productrices de bêta-lactamase présentent une
modification d'affinité de leurs PLP, normales vis-à-vis des
bêta-lactamines.
? Phénotypes de résistance
On distingue trois phénotypes de résistance aux
bêta-lactamines chez S. aureus, selon que les souches sont sensibles ou
résistantes à la méthicilline.
+ Peni S- méti S : Ce sont des souches sensibles
à la pénicilline G et à la méthicilline
sensible.
+ Peni R-méti S : Ces souches sont productrices d'une
pénicillinase plasmidique qui hydrolyse la pénicilline G, V, les
amino, carboxy et uréidopénicillines. Mais ces souches restent
sensibles aux céphalosporines et aux inhibiteurs de
bêta-lactamase.
+ Péni R-méti R : En plus de la
pénicillinase, les SARM produisent une PLP 2a ayant peu
d'affinité pour la méthicilline. Ce type de résistance est
chromosomique inductible et est croisée à toutes les
bêta-lactamines.
La recherche de la résistance s'est faite par la
méthode de disques. Ainsi la diminution du diamètre d'inhibition
< à 20 mm ou la présence de colonies autour du disque
(même si le diamètre reste = 20 mm) montre une résistance
à l'oxacilline. Il faut rajouter un disque de céfoxitine qui est
un meilleur substrat pour l'expression de la résistance à
l'oxacilline. Le phénotype oxacilline sensible et céfoxitine
résistant ne sont pas possibles. En Europe, les SARM représentent
25 à 30 % des souches de S. aureus et 40 à 60 % en Afrique.
13
b) Les aminosides
· Mécanisme d'action
Bactériostatiques à faible dose et très
bactéricides à forte dose, les aminosides se fixent sur des sites
divers de la sous-unité 30 S des ribosomes bactériens et
perturbent la lecture du code génétique de même que la
synthèse protéique. Il en résulte des protéines
anormales pour la bactérie, ce qui entraîne sa mort.
· Mécanismes de résistance
Plusieurs mécanismes interviennent dans l'apparition de
résistances.
- Réductionde la fixation sur la surface cellulaire,
- Dégradation de la molécule d'aminoside par trois
types d'enzymes : phosphotransférases,
acétyltransférases,
adényltransférases.Ces enzymes sont généralement
codées par des
plasmides et le transfert de résistances'effectue par
conjugaison.
- Mutation ribosomale
· Phénotypes de résistance.
Sept phénotypes de résistance ont
été décrits chez Staphylococcus aureus : -
Phénotype S : il correspond à la résistance isolée
à la streptomycine.
- Phénotype KNm : résistance à la fois
à la kanamycine et à la néomycine (paromomycine et
framycétine).
- Phénotype KTG (Kanamycine-Tobramycine-Gentamicine) :
il confère une résistance totale à ces trois
molécules et une résistance partielle à l'amikacine et
à la nétilmicine, soit une résistance à tous les
aminosides utilisable en pratique clinique.
- Phénotype KT : ce phénotype confère une
résistance totale à la kanamycine et à la tobramycine et
une résistance partielle à la néomycine.
- Phénotype S+KNm : il confère une
résistance à la streptomycine, à la kanamycine, à
la néomycicne et une résistance partielle à
l'amikacine.
- Phénotype S+KTG : Il confère une
résistance à la streptomycine, à la kanamycine, à
la tobramycine, à la gentamicine et une résistance partielle
à la nétilmicine.
- Phénotype S+KNm+KTG:Il confère une
résistance à la totalité des aminosides. Toutefois la
résistance pour l'amikacine et la nétilmicine n'est que
partielle.
· Fréquence de résistance.
Plus de 90 % des souches résistantes à
l'oxacilline sont résistantes à la streptomycine, à la
kanamycine, à la gentamicine et à la tobramycine. La
résistance à la gentamicine et à la tobramycine doit
être considérée comme croisée à la
nétilmicine et à
14
l'amikacine quel que soit le résultat de l'antibiogramme
en raison du mécanisme commun de résistance.
c) Macrolides, Lincosamides et Streptogramines
(MLS)
· Mécanisme d'action
Les MLS inhibent la synthèse des protéines en se
fixant au niveau de la sous unité 50 S du ribosome bactérien et
cette fixation empêche celle du chloramphénicol (antagonistes).
Les MLS sont des antibiotiques bactériostatiques.
· Mécanisme de résistance
De nombreux déterminants sont impliqués dans la
résistance aux MLS, leur conférant ainsi une résistance
par altération de la cible ribosomale (ARNr 23 S). Cette
résistance est soit inductible, soit constitutive.
· Phénotypes de résistance
- Phénotype sensible: souche sensible à tous les
MLS
- Phénotype MLSB : Constitutif : souche résistante
à tous les macrolides (M), aux
lincosamides (L) et aux streptogramines B : résistance
MLSB
Inductible : souche résistante à
l'érythromycine, sensible aux autres macrolides, aux
lincosamides et aux streptogramines.
- Phénotype LSA : souche sensible aux macrolides,
résistante aux lincosamides (L) et à
lastreptogramine A.
- Phénotype L : souche résistante uniquement
à la lincomycine.
- Phénotype MLSB + SA : résistance aux macrolides,
lincosamides et aux streptogramines A
et B
- Phénotype SA : souche résistante aux
Streptogramines A. Cette résistance est due à
unmécanisme d'efflux et à
l'acétyltransférase.
· Fréquence
En France, les souches de staphylocoques résistantes aux
macrolides ont une résistance de type MLSB dans 89% des cas,
constitutive en général chez les SARM et inductible chez les
SASM. Une résistance par efflux est observée dans 2 % des cas
[40]. d) Quinolones : Ciprofloxacine
· Mécanisme d'action
Il s'agit d'une inhibition de l'ADN-gyrase bactérienne,
enzyme indispensable à la synthèse de l'ADN pour sa
transcription. Elle a un effet bactéricide.
· Mécanisme de résistance
15
La résistance bactérienne est de type
chromosomique et non plasmidique. Cette résistance est associée
à celle des pénicillines M. S. aureus a aussi une
résistance naturelle à l'acide nalidixique.
e) Phénicolés :
Chloramphénicol
? Mécanisme d'action
Le chloramphénicol est un antibiotique
bactériostatique agissant par inhibition de la synthèse des
protéines bactériennes au niveau de la sous unité 50 S.
? Mécanisme de résistance
Le mécanisme de résistance est plasmidique, mais
il existe une résistance chromosomique.
f) Tétracyclines
? Mécanisme d'action
Les tétracyclines ont une action
bactériostatique par inhibition de la synthèse protéique
bactérienne. Elles se lient à la sub-unité 30 S des
ribosomes bactériens (et secondairement à la fraction 50 S) et
inhibent l'enzyme de liaison de l'aminocyl-transférase-RNA au
ribosome.
? Mécanisme de résistance
La résistance est souvent plasmidique et
transférable. Ceci s'explique par la sécrétion d'une
protéine qui empêche la pénétration
intrabactérienne de l'antibiotique.
g) Sulfamides et Triméthoprime
? Mécanisme d'action
Les sulfamides sont bactériostatiques. Leur
mécanisme d'action est fondé sur l'inhibition de la
synthèse par la bactérie, de l'acide folique nécessaire
à l'édification de ses bases puriques et pyrimidiques (donc de
son ADN). La membrane bactérienne étant imperméable
à l'acide folique, la bactérie doit en effet édifier son
acide folique de ses trois constituants élémentaires : acide
para-amino-benzoïque (APAB), acide glutamique, ptéridine. Elle en
réalise l'assemblage grâce à une enzyme, la dihydrofolique
acide synthétase (DHFS), c'est celle-ci qui est inhibée par les
sulfamides.
Le triméthoprime se fixe sur une autre enzyme, la
dihydrofolate réductase (DHFR) et empêche la formation de l'acide
tétrahydrofolique (THF) nécessaire à la synthèse de
l'ADN à partir des précurseurs, grâce en particulier
à une enzyme, la thymidine synthétase. En présence de
triméthoprime et pour échapper à l'action de celui-ci, les
bactéries sont
16
capables d'effectuer la synthèse de l'ADN directement
à partir de la thymidine lorsque celle-ci est présente dans le
milieu.
L'effet inhibiteur de la DHFR est complémentaire à
celui de DHFS et explique la parfaite synergie entre sulfamide et
triméthoprime.
? Mécanisme de résistance
Les souches résistantes sont capables soit de surmonter
l'effet inhibiteur par une synthèse accrue d'APAB ou soit de
synthétiser une dihydrofolique acide synthétase et une
dihydrofolate réductase présentant une affinité moindre
pour leurs antagonistes respectifs.
h) Acide fusidique
? Mécanisme d'action
L'acide fusidique agit sur la synthèse protéique en
inhibant le facteur d'élongation, ce qui bloque la traduction de l'ARN
messager au niveau de la sous-unité 50 S du ribosome.
? Mécanisme de résistance
Chez S. aureus, la résistance à l'acide fusidique
est due à une mutation chromosomique, ce qui justifie l'emploi de cet
antibiotique en association. L'incidence est de 1 à 2% en France.
i) Fosfomycine
? Mode d'action
C'est un antibiotique bactéricide qui agit en inhibant la
synthèse de la paroi bactérienne, mais de façon
différente de celle des bêta-lactamines alors il peut y avoir une
association entre les deux molécules.
En effet, la fosfomycine inhibe la pyruvyl-transférase,
enzyme intervenant dans la première étape de la synthèse
du peptidoglycane.
? Mécanisme de résistance
La fosfomycine n'induit pas de résistance plasmidique mais
une résistance chromosomique est d'apparition fréquente et
rapide. Donc, il faut éviter de l'utiliser au long cours, en
monothérapie [39].
17
CHAPITRE II : MATERIEL ET METHODES
II.1. Cadre de l'étude
Notre étude a été effectuée au
Centre Universitaire de Diagnostic du Graben (CUDG) à Butembo. Il
organise en son sein les services suivants : microbiologie, hématologie,
parasitologie, immuno-sérologie, biochimie, hormonologie,
anatomo-cyto-pathologie, physico-chimie et bromatologie, contrôle
pharmaceutique et l'unité de production d'eau distillée et autres
réactifs.
Les objectifs poursuivis par le CUDG sont :
- Servir d'outil pédagogique et de recherche aux
professeurs et étudiants de l'Université Catholique du Graben et
ceux des autres institutions de l'enseignement supérieur et
universitaire de la place en vue d'une formation pratique ;
- Contribuer à la résolution de grands
problèmes sanitaires du milieu en élevant le niveau technique du
diagnostic qui demeure rudimentaire ;
- Effectuer les surveillances épidémiologiques,
qualitatives, toxicologiques grâce aux analyses des aliments, des
boissons et des médicaments afin de contribuer à la
prévention ;
- Servir d'outil précieux aux médecins
grâce aux analyses biomédicales.
II.2. Matériel
La population d'étude est constituée des
patients qui se sont présentés au CUDG et/ou ceux dont un
échantillon a été envoyé au CUDG pour des analyses
microbiologiques (culture) après suspicion d'une infection
bactérienne invasive. Ces patients étaient de tout âge,
sans distinction de sexe ni du type d'échantillon prélevé
pour la culture (sang, urines, pus, sécrétions respiratoires,
frottis vaginal, selles,...).
II.3. Méthodes
Nous avons procédé à une étude
prospective transversale allant du 1er Septembre 2018 au 31
Décembre 2018.
Ont été inclus dans cette étude, tous les
patients chez qui le germe S. aureus a été isolé
de l'échantillon prélevé. Les échantillons
cliniques humains concernés par cette étude étaient le
sang, les urines, le selles, les secrétions purulentes de la peau/plaie,
oreilles-nasopharynx-larynx, frottis vaginal et urétral, liquide
céphalo-rachidien(LCR), etc.
18
Ont été exclus de notre étude tous les
patients dont le germe isolé était autre que le S.
aureus, ceux dont le germe isolé était des souches de
staphylocoques à coagulase négative, ceux dont les
paramètres n'étaient pas complets et ceux dont les
résultats n'étaient pas disponibles pendant la période de
notre étude.
Notre échantillon était exhaustif et non
probabiliste, incluant tous les patients ayant réuni les critères
d'inclusion. Pour des raisons pratiques d'accessibilité et de
coût, la technique de sélection par convenance a été
utilisée pour les analyses des échantillons
prélevés.
La collecte des données a été faite
à l'aide d'une fiche de collecte de données, reprise en annexe
n°1. Un numéro était attribué à chaque patient
pour conserver l'anonymat. Les données sociodémographiques des
patients dont les échantillons prélevés ont répondu
à nos critères d'inclusion étaient trouvées dans le
registre du service de microbiologie du CUDG. Les variables d'étude
étaient constituées de : sexe, âge, adresse, type de
produit biologique prélevé, origine de l'échantillon, type
d'examen microbiologique réalisé, résultats de la culture
et de la coloration Gram de SARM
Analyses bactériologiques
Le prélèvement est une étape essentielle
du diagnostic car, c'est de sa qualité que dépend l'analyse
bactériologique. Les prélèvements provenant de divers
produits pathologiques (sang, urine, pus, LCR, frottis vaginal, frottis
urétral, selles, secrétions diverses,...) ont été
effectuées selon la technique appropriée à chaque
prélèvement. Ensuite, les souches de germes ont été
isolées et identifiées.
On procèdait directement à une recherche de
germes et cela en déchargeant en stries condensées
l'écouvillon de prélèvement sur toute la surface de la
boite gélosée. Trois types de milieux de culture ont
été utilisés : la gélose Chapman, gélose au
sang (GS), gélose de Mac-Conkey et incubés pendant 18 à 24
h à 37°C.
La purification des souches était basée sur les
caractères culturaux et la coloration de Gram. A partir des colonies
isolées sur les différents milieux (Chapman, GS, Mac-Conkey), on
procèdait directement à la coloration de Gram. Ensuite, les
colonies étaient sélectionnées : cocci à Gram
positif et bacilles à Gram négatifs. Le germe de candida qui
était isolé était confirmé par la croissance sur le
milieu de Sabouraud. La purification se faisait en poursuivant le repiquage sur
le même type de milieu jusqu'à l'obtention d'un isolat pure
présentant les mêmes caractéristiques que celui obtenu en
premier isolement. La dernière culture pure était faite sur
gélose nutritive pour faire l'objet d'autres tests.
19
La conservation de courte durée des isolats
purifiés était réalisée par ensemencement sur
gélose nutritive inclinée par l'anse de platine. Après
incubation à 37°C pendant 24 heures, les tubes étaient
conservés au réfrigérateur à 4°C. Les tubes
étaient stockés à la température ambiante.
Après la coloration Gram et les caractéristiques
de la colonie, les germes isolés étaient identifiés
à partir d'autres techniques standard de la microbiologie : les
propriétés biochimiques incluant la catalase, la coagulase (libre
ou liée), la production d'ADNase, la croissance sur le disque d'agar de
mannitol salé et l'activité hémolytique sur le disque
d'agar. Pour les germes Gram-négatif, le Triple Sugar Iron (TSI), la
motilité, l'indole, l'utilisation du citrate, l'uréase, l'oxydase
et la production de sulfure d'hydrogène, l'épreuve de
Voges-Proskauer (VP) étaient utilisés.
La sensibilité aux antibiotiques testée pour
tous les germes isolés était faite à l'aide de la
méthode de diffusion de disque de Kirby-Bauer sur le milieu de
Mueller-Hinton (oxoid) conformément aux recommandations du Clinical and
Laboratory Standards Institute (CLSI, 2017) [43]. L'interprétation des
souches (sensibles, intermédiaires ou résistantes) se faisait
selon les diamètres critiques recommandés par le CLSI.
Les antibiotiques dont la sensibilité était
testée sont les suivants :
- Les bêta-lactamines : oxacilline (1jig),
amoxicilline-acide clavulanique (20+10jig), cefotaxime (30 jig), ceftriaxone
(30 jig), méropenème (10 jig),
- Un glycopetide : vancomycine (30 jig),
- Les aminosides : gentamicine (10 jig), Amikacine (30
jig), neomycine (30 jig), spectinomycine (100 jig),
- Un phénicolé : chloramphénicol (30
jig),
- Une tétracycline : doxycycline (30 jig),
- Les macrolides: érythromycine (15 jig),azithromycine
(15 jig), clarithromycine (15 jig),
- Un lincosamide : clindamycine (2 jig),
- Les fluoroquinolones systémiques : ciprofloxacin (5 jig)
et levofloxacin (5 jig),
- Un sulfamidé : co-trimoxazole(200 jig+5 jig)
La suspicion de la résistance à la
méthicilline étaient effectuée par la méthode de
diffusion, d'une part du disque de céfoxitine 30 jig où un
diamètre d'inhibition autour du disque de moins de 27 mm et la
présence de colonies dans la zone d'inhibition témoignaient
20
de la présence d'un SARM, et d'autre part, par le
disque d'oxacilline 5 mg où la présence d'une souche ayant un
diamètre < 20 mm était considérée comme SARM.
? Saisie et analyses des données
La saisie et l'analyse des données ont
été effectuées à l'aide du logiciel SSPS Version
22.
Les liens entre les différentes variables ont
été examinés à travers les tableaux
bi-variés en utilisant les tests de signification tels que les Odds
Ratio (OR), les intervalles de confiance (IC) et le P-value. Le seuil
de signification était fixé à 95%. L'association
était dite significative si l'OR était supérieur à
1 et quand l'intervalle de confiance ne contenait pas 1. Elle était
aussi significative si P était inférieur à 0,05. L'OR a
été utilisé pour déterminer le niveau de risque
attribuable à un facteur F dans l'exposition de la population à
un germe antibiorésistant. Cette association était
qualifiée de significative quand l'intervalle de confiance ne contenait
pas 1.
II.4. Considérations éthiques
Nous avons reçu l'autorisation de mener notre
étude par les autorités de la faculté de Médecine
de l'Université Catholique du Graben . Comme il s'agit d'une
étude prospective, les patients ont été renseignés
et informés à propos de l'étude et ont donné un
consentement libre et éclairé. Une fiche de formulaire de
consentement éclairé, en annexe, était signée par
nos patients (annexe n°2). Ils étaient libres d'adhérer
à l'étude et le retrait du consentement était
également libre.
21
CHAPITRE III : RESULTATS
III.1. Prévalence des souches de S. aureus
résistantes à la méthicilline
a) Ordinogramme de prévalences
globales
Parmi les 373 cultures microbiennes faites, 280 cultures ont
été positives (soit 75,1%). Les bactéries Gram positif ont
été isolées en 70% et 30% était des
bactéries Gram négatif. Parmi, les bactéries Gram positif,
on a isolé 83,2% de Staphylocoque aureus. Le Staphylocoque
méthicillino-résistant a été retrouvé
dans 62,2% des cas. Ceci est montré dans la figure n°2.
373 Cultures
|
93 Cultures négatives
|
|
280 Cultures positives
|
|
|
|
196 Gram positif
84 Gram négatif
Streptocoque 20
Listéria 10
Bacillus 2
164 Staphylococcus
aureus
102 SARM
Figure 2 : Ordinogramme des cultures effectuées
22
b) Facteurs socio-démographiques en rapport avec
le SARM
Le tableau I montre les caractéristiques
socio-démographiques des patients chez qui le SARM a été
isolé. Le SARM a été plus isolé chez les hommes
(57,8%) que chez les femmes (48,2%). Les adultes de 25 à 40 ans sont les
plus touchés par le SARM avec un cumul de 67,7% et les habitants de la
ville sont représentés à 79,4%. Aucune liaison n'a
été retrouvée entre le sexe, l'âge, la
résidence et la présence de SARM.
Tableau I : Facteurs socio-démographiques de
SARM
|
Variables
|
SARM
|
OR
|
IC 95%
|
P-value
|
|
Oui n (%)
|
non n (%)
|
|
Sexe
|
|
|
|
|
|
|
Masculin
|
59 (57,8)
|
32 (51,6)
|
1.29
|
0.68-2.43
|
0.54
|
|
Féminin
|
43 (42,2)
|
30 (48,4)
|
0.78
|
0.41-1.47
|
|
|
Classe d'âges (années)
|
|
|
|
|
|
= 8
|
3 (2,9)
|
3 (4,8)
|
0.59
|
0.12-3.01
|
0.84
|
|
9-16
|
5 (4,9)
|
2 (3,2)
|
1.54
|
0.29-8.22
|
0.90
|
|
17-24
|
1 (1,0)
|
4 (6,5)
|
0.14
|
0.015-1.3
|
0.13
|
|
25-32
|
31 (30,4)
|
16 (25,8)
|
1.25
|
0.62-2.54
|
0.65
|
|
26-40
|
38 (37,3)
|
22 (35,5)
|
1.08
|
0.56-2.08
|
0.95
|
|
41-48
|
10 (9,8)
|
8 (12,9)
|
0.73
|
0.27-1.97
|
0.72
|
|
49-56
|
11 (10,8)
|
7 (11,3)
|
0.95
|
0.35-2.6
|
1.00
|
|
= 57
|
3 (2,9)
|
0 (0,0)
|
-
|
-
|
0.44
|
|
Résidence
|
|
|
|
|
|
|
Hors ville
|
21 (20,6)
|
18 (29,0)
|
0.63
|
0.3-1.31
|
|
|
Ville
|
81 (79,4)
|
44 (71,0)
|
1.58
|
0.76-3.27
|
0.29
|
|
Total
|
102 (100)
|
62 (100)
|
|
|
|
23
c) Répartition des SARM par rapport au type
d'échantillon et origine de
l'échantillon
Le tableau II montre les types et l'origine
d'échantillon chez les patients chez qui SARM a été
isolé. Les SARM étaient d'origine communautaire dans 67,6% des
cas. Le SARM a été plus trouvé dans le frottis
urétral, le frottis vaginal et les urines avec un cumul de 65,6%.
L'origine de l'échantillon et le type d'échantillon ne sont pas
statiquement liés à la survenue de SARM. Les infections ORL
présentent significativement un risque 3,93 fois plus
|
élevée d'être associé aux SARM
comparativement
(OR=3.93 ;IC 95% =1.1-14.2 ; P =0.046).
Tableau II : Type d'échantillon et origine de
SARM
|
à d'autres
|
types d'échantillons
|
|
Caractéristiques
|
SARM
|
OR
|
IC 95%
|
P value
|
|
Oui (%)
|
Non (%)
|
|
Origine de l'échantillon
|
|
|
|
|
|
|
Communauté
|
69 (67,6)
|
45 (72,6)
|
0.79
|
0.39-1.58
|
|
|
Hôpital
|
33 (32,4)
|
17(27,4)
|
1.27
|
0.63-2.55
|
0.509
|
|
Type d'échantillon
secrétions
cutanées
|
6 (5,8)
|
10 (16,1)
|
0.33
|
0.11-0.96
|
0.06
|
|
Sécrétion ORL
|
17 (16,7)
|
3 (4,8)
|
3.93
|
1.1-14.02
|
0.046
|
|
Sperme
|
4 (3,9)
|
4 (6,5)
|
0.59
|
0.14-2.45
|
0.72
|
|
Urine
|
23 (22,5)
|
14 (22,6)
|
1
|
0.47-2.13
|
1.00
|
|
Frottis urétral
|
27 (26,4)
|
10 (16,1)
|
1.87
|
0.83-4.19
|
0.18o
|
|
Frottis vaginal
|
17 (16,7)
|
14 (22,6)
|
0.69
|
0.31-1.52
|
0.20
|
|
Sang
|
5 (4,9)
|
6 (9,7)
|
0.4
|
0.12-1.38
|
0.37
|
|
Selles et LCR
|
3 (2,9)
|
1 (1,6)
|
1.85
|
0.9-18.19
|
0.98
|
|
Total
|
102 (100)
|
62 (100)
|
|
|
|
Légende : N : Nombre de fois qu'un
antibiotique a été utilisé
24
III.2. Staphylococcus aureus résistant à
la methiciline et antibiogramme
Le tableau III montre la sensibilité des 164 souches de
S. aureus et des 102 souches de SARM aux antibiotiques les plus
utilisés localement.
L'association amoxycilline-acide clavulanique( augmentin), la
ciprofloxacine, la clindamycine, la doxycicline ont été plus
actives sur les souches non SARM que sur les souches SARM (différence
statistiquement significative). Généralement, le taux de
résistance de SARM à la plupart d'antibiotiques testés a
été élevé comparativement à celui de non
SARM. Le SARM a été plus sensible à la vancomycine
qu'à tous les autres antibiotiques, les non SARM étant plus
sensibles à la neomycine et à l'oxacilline. Au-delà de la
résistance à l'oxacilline, le SARM a été plus
résistant à la meropenème, à la cotrimoxazole,
à la clarythromycine et à l'azythromycine.
Tableau III : Sensibilité de S. aureus et de SARM
aux antibiotiques
|
Antibiotiques
|
N
|
Non SARM
|
SARM
|
|
P-value
|
|
S (%)
|
R (%)
|
S (%)
|
R (%)
|
|
Amykacine
|
77
|
5 (6,5)
|
36 (46,7)
|
9 (11,7)
|
27
|
(35,1)
|
0,25
|
|
Augmentin
|
157
|
52 (33,1)
|
8 (5,1)
|
69 (43,9)
|
28
|
(17,8)
|
0,039
|
|
Azythromycin
|
66
|
3 (4,5)
|
11 (16,7)
|
2 (3,0)
|
50
|
(75,6)
|
0,1
|
|
Ceftriaxone
|
160
|
4 (2,5)
|
57 (35,6)
|
10 (6,3)
|
89
|
(55,6)
|
0,62
|
|
Ciprofloxacin
|
97
|
25 (25,8)
|
25 (25,8)
|
13 (13,4)
|
34
|
(35,1)
|
0,04
|
|
Clindamycine
|
157
|
37 (23,6)
|
21 (13,4)
|
38 (24,2)
|
61(38,8)
|
0,003
|
|
Gentamycine
|
64
|
15 (23,4)
|
10 (15,6)
|
21 (32,8)
|
18
|
(28,1)
|
0,82
|
|
Erythromycin
|
136
|
21 (15,4)
|
34 (25,0)
|
21 (15,4)
|
60
|
(44,1)
|
1,18
|
|
Levofloxacin
|
63
|
4 (6,3)
|
8 (12,7)
|
21 (33,3)
|
30
|
(47,6)
|
0,86
|
|
Neomycine
|
18
|
8 (44,4)
|
3 (16,7)
|
3 (16,7)
|
4
|
(22,2)
|
0,44
|
|
Meropèneme
|
28
|
0(0)
|
4 (14,3)
|
0 (0)
|
24
|
(85,7)
|
-
|
|
Oxacilline
|
162
|
62 (38,3)
|
0 (0)
|
0 (0)
|
100
|
(61,7)
|
0
|
|
Cloxacilline
|
2
|
0 (0)
|
0 (0)
|
0 (0)
|
2
|
(100)
|
0
|
|
Cotrimoxazol
|
62
|
0 (0)
|
12 (19,4)
|
0 (0)
|
50
|
(80,6)
|
-
|
|
Vancomycine
|
56
|
9 (16,1)
|
1 (1,8)
|
38 (67,8)
|
8
|
(14,3)
|
0,92
|
|
Spectinomycine
|
62
|
5 (8,1)
|
7 (11,3)
|
16 (25,8)
|
34
|
(54,8)
|
0,77
|
|
Chloramphénicol
|
55
|
5 (9,1)
|
10 (18,2)
|
17 (30,9)
|
23
|
(41,8)
|
0,75
|
|
Doxycycline
|
124
|
26 (20,9)
|
16 (12,9)
|
24 (19,3)
|
58
|
(46,7)
|
0,0008
|
|
Clarithromycine
|
58
|
1 (1,7)
|
11 (18,9)
|
1 (1,7)
|
45
|
(77,6)
|
0,88
|
25
III.3. La sensibilité des antibiotiques aux
souches hospitalières et des souches
communautaires de S.
aureus
Le tableau V montre la sensibilité des antibiotiques
par rapport à l'origine de l'échantillon. La sensibilité
d'aucun antibiotique n'est statiquement liée à l'origine de
l'échantillon dans lequel le germe a été isolé. Les
souches d'origine hospitalière ont été plus sensibles
à la vancomycine et l'augmentin ; et ont présenté plus de
résistance à la méropèneme, clarythromycine,
azythromycine. Les souches d'origine communautaire ont été plus
sensibles à la vancomycine et augmentin et ont présenté
une résistance à la cotrimoxazole, azythromycine et
clarithromycine.
Tableau IV : Antibiosensibilité des SARM par
rapport à l'origine de l'échantillon
|
Antibiotiques
|
N
|
HOPITAL
|
COMMUNAUTE
|
P-value
|
|
S (%)
|
R (%)
|
S (%)
|
R (%)
|
|
amykacine
|
63
|
10 (15,8)
|
9 (14,3)
|
26 (41,2)
|
18 (28,7)
|
0,84
|
|
augmentin
|
97
|
23 (23,7)
|
9 (9,3)
|
46 (47,4)
|
19 (19,6)
|
1
|
|
azythromycin
|
52
|
1 (1,9)
|
17 (32,7)
|
1 (1,9)
|
33 (63,5)
|
1
|
|
ceftriaxone
|
99
|
4 (4,0)
|
28 (28,2)
|
6 (6,0)
|
61 (61,8)
|
0,85
|
|
ciprofloxacin
|
47
|
4 (8,5)
|
11 (23,4)
|
9 (19,1)
|
23 (49)
|
1
|
|
clindamycine
|
99
|
10 (10,1)
|
23 (23,2)
|
28 (28,3)
|
38 (38,4)
|
0,34
|
|
gentamycine
|
39
|
8 (20,5)
|
7 (17,9)
|
13 (33,3)
|
11 (28,2)
|
1
|
|
erythromycin
|
81
|
9 (11,1)
|
17 (21,0)
|
12 (14,8)
|
43 (53,1)
|
0,12
|
|
levofloxacin
|
51
|
7 (13,7)
|
10 (19,6)
|
14 (27,4)
|
20 (39,3)
|
1
|
|
neomycine
|
7
|
0 (0)
|
2 (28,6)
|
3(42,8)
|
28 (28,6)
|
0,55
|
|
meropèneme
|
24
|
0 (0)
|
9 (37,5)
|
0 (0)
|
15 (62,5)
|
-
|
|
oxacilline
|
99
|
0 (0)
|
33 (33,3)
|
0 (0)
|
66 (66,7)
|
-
|
|
cloxacilline
|
2
|
0 (0)
|
0 (0)
|
0 (0)
|
2 (100)
|
-
|
|
cotrimoxazol
|
50
|
0 (0)
|
17 (34,0)
|
0 (0)
|
33 (66)
|
-
|
|
vancomycine
|
46
|
16 (34,8)
|
1 (2,2)
|
22 (47,8)
|
7 (15,2)
|
0,24
|
|
spectinomycine
|
50
|
4 (8,0)
|
14 (28,0)
|
12 (24,0)
|
20 (40)
|
0,43
|
|
chloramphénicol
|
41
|
8 (19,5)
|
7 (17,1)
|
11 (26,4)
|
16 (39)
|
0,64
|
|
doxycycline
|
82
|
6 (7,3)
|
19 (23,1)
|
18 (21,9)
|
39 (47,5)
|
0,67
|
|
clarithromycine
|
46
|
1 (2,2)
|
16 (34,8)
|
0 (0)
|
29 (63,0)
|
0,78
|
26
III.4. L'antibioréistance des SARM par rapport
au type d'échantillon
Concernant les résultats de l'antibiorésistance
des SARM par rapport au type d'échantillon, il faut se
référer dans le tableau trouvé en annexe n°III.
Quel que soit le type d'échantillons, les souches de
SARM isolés ont présenté un taux de résistance
maximale (100%) à l'oxacilline, la cloxacilline, le
méropèneme et la cotrimoxazole. Le taux de résistance est
respectivement de 97,8% ; 96,2% et 89,9% pour la clarythromycine,
l'azythromycine et la ceftriaxone. Le taux le plus faible de résistance
a été observé pour la vancomycine (14,3%) et augmentin
(17,6%).
27
CHAPITRE IV : DISCUSSION
IV.1 Prévalence des souches de S. aureus
résistantes à la méthicilline
Cette étude a porté sur 164 cas de S. aureus,
parmi lesquels 102 (62.2%) cas étaient des SARM. La littérature
existante sur le SARM a démontré qu'il y a une variation
géographique considérable dans la fréquence de ce
phénotype [44]. Ce taux de SARM est identique à celle de 62,4%
rapportée par Alioua et a.l au CHU de Annaba en Algérie
[45]. Cette prévalence est statistiquement plus élevée que
celle de 32,7% obtenue par Aouati et al. en 2010 au CHU Ben Badis de
Constantine [46]. En Afrique subsaharienne, plusieurs études ont
indiqué que la prévalence de SARM est entre 25 et 50% ou moins
que 25% [26 ,44]. Elle était de 36% au Bénin en 2006 avant de
diminuer en 2008 avec un taux de 14 ,5% ; (10%) à Tunisie dans une
étude réalisée à l'hôpital Charles Nicolle
[47] et 10% au Maroc comme rapportée par Elazhari et al.
à Casablanca [48]. Cependant, cette prévalence de SARM est
aussi élevée comme celles rapportées dans certains pays de
l'Europe : Grèce (44%), Italie (38%), Espagne (38%), Grande Bretagne
(44%) et Irlande (42%) [49].
D'autre pays européens gardent une faible
prévalence de SARM, comme la Belgique (13%) et l'Allemagne (5%) [50]. Et
même en dessous de ce seuil pour la Hollande, le Danemark, la
Suède et la Finlande [49]. Cette situation s'explique par l'importance
de l'engagement des hôpitaux de ces pays dans des programmes
conséquents de lutte anti-SARM. Ces programmes sont
développés et mis en pratique depuis longtemps, ils concernent la
surveillance des infections nosocomiales et leur prévention, d'où
une meilleure gestion du risque de leur survenue et une meilleure
maîtrise et utilisation des antibiotiques.
La prévalence locale de SARM est bien inférieure
aux valeurs qui ont été rapportées dans d'autres pays de
l'Afrique sub saharienne: Sénégal (sang) (72%) [51],
Algérie (plaies chirurgicales) (75%) [52]; Egypte (malades du cancer)
[53]; Nigeria (blessure) (73.8%) [54]; Rwanda (types de l'échantillon
multiples) (82%) [55], Erythrée (types d'échantillons multiples)
(72%) [56]. Des hautes fréquences de SARM ont été aussi
rapporté dans d'autres parties du monde: Pérou (80%) [57] et
Colombie (90%)[ 58], USA( 70% ) [59].
Ces variations intra et intercontinentales de la
prévalence de SARM peuvent être lié à plusieurs
facteurs : la différence dans le type d'étude, types
d'échantillon pour prélèvement, les techniques de
laboratoire, la population d'étude et la durée d'étude. En
plus de cela, la
28
politique de la prévention et contrôle des
infections dans chaque pays expliqueraient ces variations.
Le SARM a été retrouvé chez 57,8%
d'hommes et aucune différence significative n'a été
retrouvée entre le sexe et la présence de SARM. Ces
données sont similaires à celles retrouvées
récemment en Ethiopie et en Alger [60, 61]. La plupart des études
confirme cette observation, en dehors d'une seule qui suggère que le
taux de bactériémies dues au SARM serait plus élevé
chez les femmes que chez les hommes [62]. Cependant les données sur la
responsabilité du sexe sont insuffisantes dans la littérature
puisque la majorité des études cas-témoins
réalisent, entre autres critères, un appariement sur le sexe.
Aucune différence significative n'a été
observée entre l'âge et le SARM. Néanmoins, les adultes de
25 à 40 ans sont les plus touchés par le SARM avec un cumul de
67,7%. Ces résultats joignent celui trouvé au Maroc par
Elhamzaoui [63], où on note une prédominance de la
résistance à la méthicilline chez les adultes (77,6%),
même résultats obtenus par Garnier à Pologne [64]. Ce
résultat ne concorde pas avec la littérature qui souligne que
l'âge est un facteur de risque infectieux aux deux
extrémités de la vie, avant 1 an et après 75 ans ou ceci
peut aisément s'expliquer par l'importance de la morbidité chez
le sujet âgé[65]. C'est comme dans une étude menée
récemment en Erythrée où le taux d'isolement de SARM
était considérablement élevé chez les patients de
moins de 18 ans [56]. La fréquence élevée de SARM chez les
adultes, moins susceptibles d'avoir des antécédents
récents d'antibiothérapie ou des facteurs de risque liés
aux soins ; dans notre milieu serait lié à l'absence d'une
assurance maladie qui favoriserait une non accessibilité des sujets aux
âges extrêmes aux soins et examens médicaux à faveur
des jeunes et adultes qui ont des moyens pour ce payer des soins.
Les SARM ont été retrouvé en 79% chez les
habitants de la ville. Cependant, il n'y avait pas de différence
significative entre l'adresse et la présence de SARM. Ceci ferait penser
à la présence d'un foyer d'épidémie de SARM dans la
ville, ou alors aux conditions précaires de mesures préventive et
contrôle des infections. Cette différence serait également
liée à l'accessibilité facile aux antibiotiques dans la
ville, ce qui favoriserait la résistance et l'émergence des
germes multirésistants [29]. Dans la littérature, nous n'avons
retrouvé aucun auteur ayant pris en compte ce paramètre pour
l'étude de SARM. Cette prédominance de SARM dans la ville qu'en
dehors de la ville serait liée aux différences des conjonctures
géographiques, culturelles et économiques rencontrée dans
les deux milieux.
Du tableau III, il ressort que 67,6% des SARM étaient
d'origine communautaire. Nos résultats ne sont pas similaires à
ceux trouvés par d'autres études. Une étude menée
par
29
Dicko au Mali montre que sur 494 souches de Staphylococcus
aureus, 297 étaient d'origine hospitalière [66]. Au Canada,
entre 2007 et 2009, le programme CANWARD a évalué les
caractéristiques démographiques, la sensibilité
antimicrobienne et l'épidémiologie moléculaire du SARM-C
et du SARM-H dans les hôpitaux canadiens. Parmi les 3589 souches de S.
aureus qui ont été soumises à cette évaluation, 889
(24,8 %) étaient résistantes à la méthicilline; on
a de plus identifié des phénotypes de SARM-C et de SARM-H chez
224 (25,2 %) et 644 (72,4 %) de ces souches, respectivement [67].
L'élévation du taux des souches de SARM d'origine communautaires
dans notre milieu est liée aux conditions de promiscuité
favorisant un contact étroit entre les individus et une hygiène
inadéquate.
Le SARM a été plus trouvé dans les
échantillons de la sphère uro-génital (frottis
urétral, urines et frottis vaginal) avec un cumul de 65,7%. Le type
d'échantillon n'est pas statistiquement lié à la survenue
de SARM ; mais les infections ORL présentent significativement un taux
élevé de SARM (P =0.046). Ce résultat concorde
avec plusieurs investigations qui ont rapporté une prévalence de
SARM beaucoup plus importante au niveau des urines (61 - 64%) qu'au niveau des
hémocultures et des pus [66, 68]. Cette prédominance des SARM
dans les urines, les sécrétions vaginales et le frottis
urétral serait lié au fait que les infections urinaires et
génitales sont une des symptomatologies pour lesquels
l'automédication aux antibiotiques est plus pratiquée [29,30].
Ceci est source d'émergence de germes multirésistants. Concernant
les sécrétions ORL, Chatterjee et al. avait
déjà trouvé que la prévalence of S. aureus
dans les colonisations nasales est de 52.3% et que 3.89% sont des SARM,
indiquant un taux élevé de S. aureus et SARM dans les
sécrétions nasales [69].
IV.2. Staphylococcus aureus résistant à la
methiciline et antibiogramme
Cette étude révèle que le germe non SARM
ont un taux de sensibilité plus élevé à
l'augmentin, la ciprofloxacine, la clindamycine, la doxycilline comparativement
aux souches SARM. Cette différence est statistiquement significative.
Ces résultats sont similaires à ceux trouvés au Mali par
Dicko ; où les souches de SASM sont plus sensibles aux antibiotiques que
les souches de SARM [66]. Ceci était déjà trouvé
démontré par d'autres études quant à ce qui est de
la ciprofloxacine et la doxycilline [66, 70] ; tandis que d'autres auteurs
avaient plutôt un avis contraire par rapport à la ciprofloxacine
[71]. Cette différence serait liée au type d'échantillon
considérée. Ce dernier avait pris en compte les pyodermites alors
que dans le nôtre il s'agissait des échantillons multiples.
30
Le SARM a été plus sensible à la
vancomycine (67,8%) et l'augmentin (43,9%) qu'à tous les autres
antibiotiques testés. Les non SARM étaient plus sensibles
à la neomycine (48,4%) et à l'oxacilline (38,3%). Ceci ne
s'éloigne pas des résultats des autres études prouvant la
sensibilité maximale de SARM à la vancomycine [25, 71,72].
Néanmoins, la résistance à la vancomycine a
été démontrée dans d'autres études [56,73].
La vancomycine est une molécule rarement prescrite par les
médecins dans nos hôpitaux ; ce qui serait un facteur justifiant
la bonne sensibilité des germes à celle-ci. Des études
menées en rapport avec la sensibilité de la néomycine aux
non SARM sont rares. Cependant, il est évident que l'oxacilline soit
parmi les antibiotiques adaptés dans les infections aux staphylocoques
non SARM.
Au-delà de la résistance à l'oxacilline,
le SARM a été plus résistant à la
meropenème, cotrimoxazole, clarythromycine et à l'azythromycine
tandis que les non SARM ont exprimé une forte résistance à
l'amykacine et au ceftriaxone. Une hyperproduction de pénicillinase par
les SARM peut être responsable de l'hydrolyse des pénicillines M,
céphalosporines et des carbapénèmes dont fait partie
l'oxacilline et la meropenème, et ceci expliquerait la résistance
à ces antibiotiques. Dans la littérature, il est dit qu'aucun
carbapénème n'est actif sur SARM [74]. Mais cette situation est
alarmante car dans nos conditions de travail où l'antibiothérapie
est conduite de manière empirique, la meropenème est presque le
dernier recours des cliniciens alors que le SARM est assez fréquent dans
les infections à germes multi résistants. La forte
résistance de SARM à la cotrimoxazole avait déjà
aussi retrouvé dans une étude mauritanienne où 77% des
souches était inactif à la molécule [25]. D'autre part,
l'usage des macrolides comme l'azythromycine et la clarithromycine
étaient déjà découragé dans le traitement
des infections à SARM [75,76].
Bien que l'amykacine soit faiblement utilisée et
commercialisée dans notre milieu, elle s'avère être
l'antibiotique la plus résistante aux staphylocoques non SARM. Ceci
serait lié soit à une résistance croisée aux
aminosides, ou lié à la taille de notre échantillon. Au
Liban, la résistance des Staphylocoques aux aminosides avait
été représentée par deux pourcentages relativement
éloignés ; ainsi paradoxalement à un faible taux (6.25%)
vis-à-vis de la gentamicine et de la tobramycine, et un taux
élevé (90%) vis-à-vis de l'amikacine et la kanamycine
[77].
31
IV.3. La sensibilité des antibiotiques aux
souches hospitalières et des souches communautaires de S.
aureus
Les souches d'origine hospitalière ont
été plus sensibles à la vancomycine (35%) et à
l'augmentin (20%) et ont présenté plus de résistance
à la ceftriaxone (38%) et à la cotrimoxazole (35%). Ces
résultats corroborent presque avec ceux de la surveillance
épidémiologique de SARM en milieu hospitalier où à
l'échelle nationale, aucune résistance à la vancomycine
parmi les isolats testés n'a été documentée. La
proportion d'isolats testés présentant une résistance
à la ciprofloxacine, à l'érythromycine et aux
céphalosporines et une petite proportion d'isolats présente une
résistance à la cotrimoxazole [78]. D'après l'étude
de Dicko, l'association amoxicilline + acide clavulanique avait
été la molécule la plus active sur les souches
communautaires que sur les souches hospitalières [66]. L'usage
irrationnel et abusif de la ceftriaxone dans nos hôpitaux serait la cause
de la résistance des germes à celle-ci.
Les souches d'origine communautaire ont été plus
sensibles à la vancomycine (48%) et à l'augmentin ; et ont
présenté une résistance à la cotrimoxazole (66%),
azythromycine (63%) et clarithromycine (63%) au-delà de la
résistance à l'oxacilline et la cloxacilline. La
sensibilité aux antibiotiques précédentes a
été démontré aussi dans dans plusieurs
études [25, 71, 72, 75]. La résistance élevée
à l'azythromycine et clarythromycine, toutes deux apparentées
à l'erythromycine ; de même qu'à la cotrimoxazole se
justifierait à une automédication élevée et une
usage inappropriée de ces antibiotiques dans le traitement des certaines
symptômes comme la toux.
IV.4. L'Antibioréistance des SARM par rapport au
type d'échantillon
L'activité nulle ou quasi nulle de certaines
bêta-lactamines comme l'oxacilline, la cloxacilline, la
méropèneme et la ceftriaxone sur les SARM comme trouvé
dans notre étude concorde avec les résultats des recherches
menées sous d'autres cieux comme en Mauritanie [25]. Une étude
récente menée en Iran a rapporté un taux
élévé de résistance de 100% pour les
pénicillines, 88.5% pour tetracycline ,85.7% pour les fluoroquinolones
[79]. Le taux de résistance des SARM au cotrimoxazole (100%) est
légèrement supérieur par rapport à celui
rapporté par Parhizgari [80] et Lemine Ould Salem [25] qui avaient
trouvé un taux de 86.44% au et77% à Nouakchott, toutes ces deux
études considéraient aussi des produits biologiques
diversifiés. Ce taux élevé de la résistance au
cotrimoxazole dans notre milieu peut se justifier par un usage abusif de cet
antibiotique du fait qu'il est très connu et accessible par toutes la
32
population. La résistance aux macrolides : azytromycine
(96,2%) et clarythromycine (97,8%) est un phénomène
rencontré aussi ailleurs. En Iran par exemple, le taux de
résistance à la
Clarithromycine était de 88.13%. Selon BUU-HOI , la
quasi-totalité des souches SARM est
résistante aux macrolides-lincosamides - streptogramine
(MLS) en milieu hospitalier [40]. Cependant, un taux faible a été
observé par Salem pour qui la résistance aux MLS donnant le
phénotype MLSb inductible, était
retrouvée dans 6% des souches urinaires et 27% des souches
isolées à partir des suppurations. Cette différence est
liée au fait que lui ne tenait compte que d'une résistance
associé à des molécules de 3 groupes.
Le taux faible de résistance a été
observé à la vancomycine (17,4%) indépendamment du type
d'échantillon considéré ; alors qu'ailleurs aucune
résistance n'a été soulignée quant à ce qui
est de cette molécule [25, 73, 77, 79,80]. En Erythrée, une
étude a rapporté récemment un taux de résistance de
13,8% à la vancomycine. Cependant cette étude confirme la
présence de Staphylocoque aureus vancomycine- résistant (VRSA) .
Falagas et al. avait déjà estimé que la sensibilité
de SARM isolé en Afrique à la vancomycine varie entre 82 et 100%
[44]. Ces résultats et ces estimations contredisent la conclusion
récente par Kong et al. pour qui les souches VRSA sont rares et les
évidences pour leur taux d'accroissement sont limités [81]. Comme
la vancomycine est le traitement de choix des infections à SARM [82],
notre position est que la proportion de VRSA rapporté dans cette
étude nécessite des recommandations pour une prescription
appropriée et rationnelle.
33
CONCLUSION
Notre étude ayant porté sur les
caractéristiques phénotypiques des staphylocoques
methicillino-resistants au CUDG a permis de mettre en évidence une
prévalence élevée (62,2%) de SARM dans notre milieu.
Les hommes d'âge variant entre 25 à 40 ans,
habitant en ville sont les plus concernés par le SARM ; et celui-ci est
souvent acquis en communauté et fréquemment isolés dans
les sécrétions de la sphère urogénital ; avec un
risque 4 fois plus élevé d'être retrouvé dans les
sécrétions ORL.
Les souches non SARM sont plus sensibles à la plupart
des antibiotiques ; les souches SARM exprimant un taux de résistance
plus élevé et cela indépendamment de l'origine de
l'échantillon. L'activité de l'oxacilline, la cloxacilline, le
méropèneme , la cotrimoxazole est nulle sur les souches SARM
isolées ; et est quasi nulle pour la clarythromycine, l'azythromycine et
la ceftriaxone .
Notons que la vancomycine et l'augmentin gardent une certaine
activité sur les souches de SARM et pourraient constituer par
conséquent une alternative pour le traitement de ces infections.
Nos données ont une importante implication dans
l'amélioration de la qualité de soins de patients avec infections
à SARM dans les cadres suivants : sélection de
l'antibiothérapie, contrôle des infections en pratique et
nécessité des études supplémentaires.
34
RECOMMANDATIONS
A l'issue de notre étude nous formulons les
recommandations suivantes :
1. Au ministère de la santé
? Doter les laboratoires de biologie médicale de
structures sanitaires d'une unité de bactériologie en vue de la
réalisation de l'antibiogramme ;
- Développer un plan d'action national pour la lutte et
la surveillance des infections et de l'antibiorésistance.
2. Au personnel de la santé
- Appliquer les précautions standards de
préventions, hygiène et contrôle des infections ;
- Appliquer les mesures hygiéniques simples comme le
lavage des mains, stérilisation et désinfection correcte du
matériel, renouvellement des sondes urinaires et des cathéters
périphériques pour prévenir les infections
nosocomiales;
- Adapter l'antibiothérapie à un antibiogramme
tout en respectant la durée du traitement et la dose d'antibiotique et
cela dans le but d'une utilisation rationnel des antibiotique ;
- Faire l'éducation sanitaire en masse pour la
promotion de l'hygiène et la prévention des infections.
3. A la population
? Eviter l'automédication qui favoriserait
l'émergence des germes multirésistants ;
- Respecter les recommandations médicales par rapport
à la prise d'antibiotiques, les
doses prescrites et la durée de traitement ;
- Respecter les règles élémentaires
d'hygiène
4. Aux futurs chercheurs
- Conduire des études d'épidémiologie
moléculaire afin de comprendre et de contrôler la diffusion et
l'augmentation de la résistance aux antibiotiques et pour savoir la
clonalité des souches impliquées dans les infections à
SARM ;
- Faire des études sur la transmission du SARM et sur
l'efficacité des interventions de lutte contre l'infection, et les
résultats des stratégies d'éducation et de lutte contre
l'infection.
35
36
REFERENCES
[1]. Duval J. Évolution des résistances. In :
Le Minor L. et Véron M. Bactériologie médicale. Paris :
Flammarion, 1999 ; 355-69.
[2]. Duval J. Classification et mécanisme d'action des
agents antibactériens. In : Le Minor L et Véron M.
Bactériologie médicale. Paris : Flammarion, 1989 ; 273-96.
[3]. Bismuth R. Cocci à Gram positif et aminosides. In
: Courvalin P, Goldstein F, Philippon A et Sirot J. L'antibiogramme. Paris :
MPC-Vidéom, 1985 ; 29-39.
[4]. Fauchère JL et Avril JL. Bactériologie
générale et médicale. Paris : Ellipses, 2002 ; 365 p.
[5]. Mougeot C., Guillaumat-taillet J et Libert JM.
Staphylococcus aureus : nouvelle détection de la résistance
intrinsèque par la méthode de diffusion. Pathol Biol 2001 ; 49 :
199-204.
[6]. Bengualid V. et Berger J. Community acquired methicillin
resistant Staphylococcus aureus. Clin Infect Dis 2003 ;37 : 466.
[7]. Hameg S, May-Michelangeli L, Le Turdu F. Apport du kit
Servitex Staphylocoque MRSA® dans le diagnostic rapide des souches de
Staphylococcus aureus résistantes à la méticilline. Med
Mal Infect. 2002; 32:107-14.
[8]. Elazhari M. Activité de 16 Antibiotiques
vis-à-vis des Staphylococcus aureus communautaires à Casablanca
(Maroc) et prévalence des souches résistantes à la
méthicilline. Eur Sci Res. 2009;30(1):128-37.
[9]. Sexton T, Clarke P, O'Neill E, et al. Environmental
reservoirs of methicillin-resistant Staphylococcus aureus in isolation rooms:
correlation with patient isolates and implications for hospital hygiene. J Hosp
Infect 2006; 62:187-194.
[10]. Graffunder EM, Venezia RA. Risk factors associated with
nosocomial methicillinresistant Staphylococcus aureus (MRSA) infection
including previous use of antimicrobials. J Antimicrob Chemother 2002;
49:999-1005.
[11]. World Health Organization. Initiative for Vaccine
Research (IVR). Bacterial Infections: Staphylococcal infection. 2011
[12]. Otto M. Basis of virulence in community-associated
methicillin-resistant staphylococcus aureus. Ann Rev of Microbiology 2010;
64:143-162.
37
[13]. Centers for Disease Control and Prevention. 2011.
Active Bacterial Core Surveillance Report, Emerging Infections Program Network,
Methicillin-Resistant Staphylococcus aureus, 2011.
[14]. Brucker G. Impact sur la prevention des infections
nosocomiales. In Infections nosocomiales et environnement hospitalier.
Flammarion Médecine-Sciences, Paris, 1998,10 :72-80
[15]. O'Neil L. L'antibiorésistance est la plus grande
menace sanitaire mondial. Angeterre. Juin 2016
[16]. Wakefied DS, Helms CM, Massanari RM, Mori M, Pfaller M.
Cost of nosocomial infection: relative contributions of laboratory, antibiotic,
and per diem costs in serious S.aureus infections. Am J infect control 1998;
16:185-192.
[17]. Résumé et rapport complet, EARS-Net 2017,
disponibles à partir de l'URL:
http://www.ecdc.europa.eu/en/healthtopics/antimicrobial_resistance/epidemiological
_data/Pages/ears-net_annual_reports.aspx
[18]. Leaper DJ, Edmiston CE. World Health Organization:
global guidelines for the prevention of surgical site infection. J Hosp Infect.
2017 Feb;95(2):135-6.
[19]. Réseau d'alerte, d'investigation et de
surveillance des infections nosocomiales (Raisin). Enquête nationale de
prévalence des infections nosocomiales, France, juin 2006. Saint-Maurice
: Institut de veille sanitaire, mars 2009. 81 p. Disponible sur
http://www.invs.sante.fr/publications/2009/enquete_prevalence_infections_nosocomi
ales/index.html
[20]. Réseau d'alerte, d'investigation et de
surveillance des infections nosocomiales (Raisin). Enquête nationale de
prévalence des infections nosocomiales 2001. Résultats.
Saint-Maurice : Institut de veille sanitaire, octobre 2003. 84 p. Disponible
sur
http://www.invs.sante.fr/publications/2003/raisin_enp_2001/index.html
[21]. Réseau d'alerte, d'investigation et de
surveillance des infections nosocomiales
(Raisin). Rapport annuels BMR-Raisin. Disponible sur
http://www.invs.sante.fr/surveillance/raisin/surveillance_reseau.htm
[22]. Honeyman, Allen L, Friedman, Herman, Mauro.
Staphylococcus aureus infections and Disease. Kluw Ac Pub 2002 :143-44
[23]. Kesah C. , Ben Redjeb S ,Odugbemi TO , Boye CS ,Dosso M
, Ndinya Achola JO , KoullaShiro S. , Benbachir M., Rahal K. and M Borg.
Prevalence of methicillin-resistant Staphylococcus aureus in eight Africain
hospitals and Malta.clin.Microbial.Infect.2003; 9:153- 56
38
[24]. Ouedraogo AS., Jean Pierre H., Ranuls AL.,
Ouédrraogo R., Godreuil S., Emergence and spread of antibiotic
resistance in West Africa :contributing factors and threat assessment. Med
Sante Trop 2017 ; 27 : 147-154.
[25]. Salem ML , Ghaber SM, Baba SI , Maouloud MO. Antibiotic
susceptibility of community-acquired strains of staphylococcus aureus in
Nouakchott Region (Mauritania). Pan African Med J. 2016; 24:276
[26]. Vlieghe E, Phoba MF, Tamfun JM, Jacobs J. Antibiotic
resistance among bacterial pathogens in Central Africa: a review of the
published literature between 1955 and 2008. Inter J of Antimicrob Ag 2009;
04.
[27]. Nyembwe KM, Manlenga KJ, Manywebwa KJD, Mulumba MP,
Verhaegen J., Muyembe J. Profil de la méthicillinoresistance de
Staphylococcus à Kinshasa et implication dans l'hygiène
hospitalier. Congo medical 2004;3(14):1262-5.
[28]. Thriemer K., Katuala Y., Batoko B., Alworonga J-P,
Devlieger H. et al. Antibiotic Prescribing in DR Congo: A Knowledge, Attitude
and Practice Survey among Medical Doctors and Students. PLoS ONE 2013;8(2).
[29]. Bunduki GK, Mumbere M, Mbahweka FK., Assessment of
antibiotic self-medication pattern among university students in Eastern
Democratic Republic of the Congo. J of Pharmaceutica Res Inter.
2017;18(1):1-7
[30]. Bunduki GK,Kibendelwa ZT, Nzanzu AK, In-vitro Antimicrobial
Susceptibility Pattern of Isolates from Urine in Butembo, Democratic Republic
of the Congo. J Antimicrob Agents 2017,3:154.
[31]. Bunduki GK, Kibendelwa ZT, Nzanzu AK. Bacteriological
profile and antimicrobial susceptibility pattern of isolates from patients with
septicaemia in Butembo, Democratic Republic of the Congo. J of Adv in
Microbiology 2017;6(4):1-8.
|
[32]. WHO. (Date de consultation
|
: octobre
|
2018)
www.who.int/csr/resources/publications/drugresist/whocdscsrdrs20015.pdf
[33]. Réseau d'alerte, d'investigation et de
surveillance des infections nosocomiales (Raisin). Surveillance des
bactéries multirésistantes 2012 - Août 2013.
[34]. Avril JL, Dabernat H, Denis F et Monteil H.
Bactériologie clinique, 3 éd. Paris : Ellipses, 2000 ; 602 p.
[35]. Berche P. Les staphylocoques. In : Berche P., Gaillard
L., Simonet M. Bactériologie : les bactéries des infections
humaines. Paris: Flammarion, 1988 ; 267-77.
39
[36]. Brun Y., Bes M. Staphylococcus. In: Freney J, Hansen
W., Bollet C, eds. Précis de bactériologie clinique. Paris : Eska
2000 ; 781-819.
[37]. Fleurette J. Staphylocoques et microcoques. In : Le
Minor L ET Véron M, Bactériologie médicale. Paris :
Flammarion, 1989 ; 774-94
[38]. Jehl F., Chomarat M., Weber M., Gérard A. De
l'antibiogramme à la prescription. Lyon : Biomérieux, 2004 ; 136
p.
[39]. Philippon A, Arlet G.,Schlemmer B. Bêtalactamines
(I). Encycl Med Chir, Maladies Infectieuses, 1993.
[40]. Buu-hoi A. Cocci à gram positif et
macrolides-lincosamides-streptogramines. In : Courvalin P., Goldstein F.,
Philippon A., Sirot J. L'antibiogramme. Paris :MPC-Vidéom, 1985 ;
41-8.
[41]. Quentin C., Grobost F., Fischer I., Dutilh B., Brochet
JP, Jullin J et al. Résistance aux antibiotiques de Staphylococcus
aureus en pratique de ville : étude sur six mois en Aquitaine. Pathol
Biol 2001; 49 : 33-40.
[42]. Seydi M., Sow AI, Soumaré M., Diallo HM, Hatim
B, TINE RCK et al. Place des bactériémies à Staphylococcus
aureus au CHU de Fann à Dakar. Med Mal Infect 2004 ; 34:210-5.
[43]. Clinical and Laboratory Standards Institute (CLSI),
corp-author 16th informational supplement M100-S16. CLSI; Wayne, PA: 2018.
Performance standards for antimicrobial susceptibility testing.
[44]. M. E. Falagas, D. E. Karageorgopoulos, J. Leptidis, and
I. P. Korbila, «MRSA in Africa: filling the global map of antimicrobial
resistance,» PLoS ONE 2013; 8(7).
[45]. Alioua MA , Labid A, Amoura K, Bertine M, Gacemi-Kirane
D, Dekhil M (2014).Emergence of the European ST80 clone of community-associated
methicillin-resistant Staphylococcus aureus as a cause of healthcare-associated
infections in Eastern Algeria. Med Mal Infect .2014;44(4):180-3.
[46]. Aouati H, Arafa N, Benlabed K, Boulahrouf A, Bousseboua
H (2010). Methicillinresistant Staphylococcus aureus at university hospital
center Ben Badis of Constantine Algeria. Rev Tunis Infect. 4: 129-133.
[47]. Saidani M, Boutiba I, Ghozzi R, Kammoun A, Ben Redjeb
(2006). Profil bactériologique desbactériémies à
germs multirésistants à l'hopital Charles-Nicolle de Tunis. Med
Mal Inf 2006. 36.
40
[48]. Elazhari M, Zerouali K, Elhabchi D, Cohen N, Elmalki A,
Dersi N, Hassar M, Timinouni M, Salie R . Antibiotic susceptibility of strains
of Staphylococcus aureus community in Casablanca (Morocco) 2010. Rev Tunis
Infect. 4:134-140.
[49]. Conseil scientifique de l'ONERBA. Bacterial resistance
to antibiotics. Data from the National Observatory of Bacteria. Resistance
Epidemiology (ONERBA). Med Mal Infect 2005 Mars; 35 (3): 155-69
[50]. Centre de Coordination de la Lutte contre les
Infections Nosocomiales de l'interrégion Nord (CCLIN Paris-Nord).
www.cclinparisnord.org
[51]. Seydi M, Sow AI, Soumaré M, Diallo et al.
Staphylococcus aureus bacteremia in the Dakar Fann university hospital. Med Mal
2004;34:210-215.
[52]. Rebiahi SA, Abdelouahid DE, Rahmoun M., Abdelali S. ,
Azzaoui H. Emergence of vancomycin-resistant Staphylococcus aureus identified
in the Tlemcen university hospital (North-West Algeria). Med Mal Inf
2011;41(12): 646-651.
[53]. Ashour HM, El-Sharif A. Microbial spectrum and
antibiotic susceptibility profile of Gram-positive aerobic bacteria isolated
from cancer patients. J Clinic Oncology 2007;25(36) : 5763-9.
[54]. Udobi CE. , Obajuluwa AF. , Onaolapo J A. Prevalence
and antibiotic resistance pattern of methicillin-resistant Staphylococcus
aureus from an orthopaedic hospital in Nigeria. BioMed Res Inter 2013.
[55]. Ntirenganya C., Manzi O., Muvunyi CM., Ogbuagi O. High
prevalence of antimicrobial resistance among common bacterial isolates in a
tertiary healthcare facility in Rwanda. Am J of Trop Med and Hygiene 2015;92(
4): 865-870
[56]. Garoy EY, Gebreab YB, Achila OO, Tekeste DG, Kesete R,
Ghirmay R et.all. Methicillin-Resistant Staphylococcus aureus (MRSA):
Prevalence and Antimicrobial Sensitivity Pattern among Patients--A Multicenter
Study in Asmara, Eritrea . Canadian J of Inf Diseases and Med Microbiology
2019.
[57]. Guzman-Blanco M. , Carlos M., Raul I. et al. Review
epidemiology of meticillin-resistant Staphylococcus aureus (MRSA) in Latin
America. Inter J of Antimicrobial Agents 2009;34(4): 304-308.
[58]. Jimenez JN, Ocampo AM, Vanegas JM et al. CC8 MRSA
strains harboring SCCmec type IV are predominant in Colombian hospitals . PloS
ONE 2012;7(6).
41
[59]. Awad S., Elhabash S., Lee L., and al. Increasing
incidence of methicillinresistant Staphylococcus aureus skin and soft-tissue
infections: reconsideration of empiric antimicrobial therapy . Am J Surg 2007;
194: 606-610
[60]. Dilnessa T., Bitew A. Prevalence and antimicrobial
susceptibility pattern of methicillin resistant Staphylococcus aureus isolated
from clinical samples at Yekatit Hospital Medical College, Addis Ababa,
Ethiopia. BMC Inf Dis 2016;16(1).
[61]. Antri K, Rouzic N, Boubekri I, Dauwalder O, Beloufa A,
Ziane H, Djennane F, Neggazi M, Benhabyles B, Bes M, Tazir M, Etienne J,
Ramdani-Bouguessa N . High prevalence of community and hospital acquired
infections of methicillinresistant Staphylococcus aureus containing
Panton-Valentine leukocidin gene in Algiers. Pathol Biol 2010;58:15-20.
[62]. Morgan M, Salmont R, Keppie N, Evans-William D, Hosein
I, Looker DN. All Wales surveillance on Methicillin-Resistant Staphylococcus
aureus (MRSA): The first year's results. J Hosp Infect 2010;41:173-179.
[63]. Elhamzaoui S, Benouda A, Allali F, Abouqual R,
Elouennass M. Antibiotic susceptibility of Staphylococcus aureus strains
isolated in two university hospitals in Rabat, Morocco. Med Mal Infect
2009;39:891-895.
[64]. Garnier F, Mariani-Kurkdjian P, Nordmann P, Ferroni A,
Vu-Thien H, Philippe JC, and al . Antibiotic susceptibility of strains of
staphylococci and enterococci isolated in pediatric. Med Mal Infect 2002;32:
432-438.
[65]. Cruse P, Foord R. The epidemiology of wound infection.
A10 year prospective study of 62939 wound .Surg.clin.North Amer
1980;60:27-40.
[66]. DICKO OA. Prévalence des souches de Staphylococcus
aureus résistantes à la méticilline au CHU du Point G
à Bamako de 2007 à 2009. Thèse. Bamako.
[67]. Nichol KA et al. Comparison of community-associated and
health care-associated methicillin-resistant Staphylococcus aureus in Canada:
results of the CANWARD 2007-2009 study. Diagnostic Microbiol Infect Dis 2011;
69:320-32
[68]. Mastouri M., Nour M., Ben Nejma M., Bouallegue O.,
Hammami M.e, Khedher M. Résistance aux antibiotiques de Staphylococcus
aureus résistants à la méticilline: détection des
premières souches de sensibilité diminuée aux
glycopeptides. Path. Biol.2013 54: 33-36.
[69]. Chatterjee SS, Ray P, Aggarwal A, Das A, Sharma M. A
community?based study on nasal carriage of Staphylococcus aureus. Indian J Med
Res 2009;130:742?8.
42
[70]. Soussy CJ. Quinolones. In : Courvalin P, Goldstein F,
Philippon A et Sirot J,. L'antibiogramme. Paris : MPC-Vidéo, 1985 ;
57-63.
[71]. Venniyil PV, Ganguly S, Kuruvila S, Devi S. A study of
community-associated methicillin-resistant Staphylococcus aureus in patients
with pyoderma. Indian Dermatol Online J 2016;7:159-63.
[72]. Elhabri I.,Balouch L., Elayadi R., Benouda A.
Methicillin-resistant staphylococcus in hospital environment : antibiotics
sensitivity. Maroc Médical 2004.26(1).
[73]. Ghenghesh KS. Methicillin-resistant Staphylococcus
aureus (MRSA) in a tertiary surgical and trauma hospital in Benghazi, Libya.J
of Infect in Dev Countries 2011; 5(10):723-726.
[74]. Gauzit R. , Gutmann L., Brun-Buisson C., Jarlier V.,
Fantin B. Guidelines for good practice of carbapenems. Antibiotiques
2010;12:183-9
[75]. Rolando PO., Seila IP., Cervi MC., Denissani AF.,
Martinez R., Bellissimo-Rodrigues F. Is community-associated
methicillin-resistant Staphylococcus aureus (CAMRSA) an emerging pathogen among
children in Brazil?. braz j infect dis 2018;22(5):371-376
[76]. Nichol K, Adam H, Roscoe D,et al.Changing epidemiology
of methicillin-resistant Staphylococcusaureus in Canada .J Antimicrob
Chemother.2013;68Suppl.1:47-55
[77]. Hamze M, Dabboussi F, Daher W, Izard D . Antibiotic
resistance of Staphylococcus aureus at north Lebanon: place of the methicillin
resistance and comparison of detection methods. Pathol Biol 2003; 51: 21-26.
[78]. Agence de la santé publique du Canada.
Staphylococcus aureus résistant à la méthicilline dans les
hôpitaux de soins de courte durée : Rapport de surveillance du 1er
janvier 2008 au 31 décembre 2012. Centre de la lutte contre les maladies
transmissibles et les infections, Agence de la santé publique du Canada,
2014.
[79]. Jafari-Sales A., Farhadi F., Ezdiyadi M.,
Tarbiat-Nazloo1 M. Study of antibiotic resistance pattern in
methicillin-resistant Staphylococcus aureus isolated from clinical samples of
hospitals in Tabriz - Iran. Int J BioMed Public Health. 2018; 1(2):71-75.
[80]. Parhizgari N, Moosavian S, Sharifi A. Antibiotic
resistant pattern of methicillin resistant and sensitive S. aureus isolated
from patients during 2009-2010 in Ahvaz, Iran. Armaghane danesh J.
2013;18(9):757-67
[81]. Kong EF, Johnson JK, Jabra-Rizk MA. Community
associated methicillin-resistant Staphylococcus aureus: an enemy amidst us.
PLOS Pathogens 2016;12(10).
43
[82]. Omuse G., Kariuki S., Revathi G. Unexpected absence of
meticillin-resistant Staphylococcus aureus nasal carriage by healthcare workers
in a tertiary hospital in Kenya. J of Hosp Infect 2012;80(1): 71-73.
44
TABLE DES MATIERES
Dédicace i
REMERCIEMENTS ii
PLAN DU TRAVAIL iii
SIGLES ET ABREVIATIONS iv
LISTE DES FIGURES vi
LISTE DES TABLEAUX vi
RESUME vii
ABSTRACT viii
INTRODUCTION 1
CHAPITRE I : GENERALITES SUR LES STAPHYLOCOQUES AUREUS
METHICILLINO-RESISTANTS 6
I.1. Staphylococcus aureus 6
I.1.1. Historique 6
I.1.2. Habitat 6
I.1.3. Caractères bactériologiques 6
I.1.4. Substances biologiquement actives 7
I.1.5. Pouvoir pathogène 9
I.1. 6. Diagnostic bactériologique des infections
à S. aureus 10
I.2. Les antibiotiques 11
I.2.1. Définition 11
I.2.2. Les différentes classes d'antibiotiques 11
CHAPITRE II : MATERIEL ET METHODES 17
II.1. Cadre de l'étude 17
II.2. Matériel 17
II.3. Méthodes 17
Analyses bactériologiques 18
? Saisie et analyses des données 20
II.4. Considérations éthiques 20
III.1. Prévalence des souches de S. aureus
résistantes à la méthicilline 21
III.2. Staphylococcus aureus résistant à la
methiciline et antibiogramme 24
45
III.3. La sensibilité des antibiotiques aux souches
hospitalières et des souches communautaires de
S. aureus 25
IV.1 Prévalence des souches de S. aureus
résistantes à la méthicilline 27
IV.2. Staphylococcus aureus résistant à la
methiciline et antibiogramme 29
IV.3. La sensibilité des antibiotiques aux souches
hospitalières et des souches communautaires de
S. aureus 31
IV.4. L'Antibioréistance des SARM par rapport au type
d'échantillon 31
RECOMMANDATIONS 34
REFERENCES 36
TABLE DES MATIERES 44
ANNEXES a
ANNEXE I. FICHE DE RECOLTE DES DONNEES a
ANNEXE II FORMULAIRE DE CONSENTEMENT ECLAIRE b
Annexe III : ANTIBIORESISTANCE DE SARM PAR RAPPORT AU TYPE
D'ECHANTILLONS c
a
ANNEXES
ANNEXE I. FICHE DE RECOLTE DES DONNEES
1. N° /2018
2. SEXE : M F
3. AGE : (an)
4. RESIDENCE :
5. ORIGINE DE L'ECHANTILLON : Hôpital Communauté
6. TYPE D
7. COLORATION GRAM : GRAM positive GRAM negative
8. CULTURE MICROBIENNE: positive negative
9. COAGULASE : positive negative
10. GERMES ISOLEES: Si Staphylocoques, alors
11. ANTIBIOGRAMME:
|
ANTIBIOTIQUES
|
SENSIBLE
|
INTERMEDIAIR
|
RESISTANT
|
12. IDENTIFICATION DE SARM
|
STAPHYLOCOQUES ISOLEES
|
SARM positif
|
SARM négatif
|
b
ANNEXE II FORMULAIRE DE CONSENTEMENT ECLAIRE
Consentement éclairé expliqué verbalement au
participant dans la langue qu'il parle :
Nous sommes en train de mener une étude sur «
l'antibiorésistance aux staphylocoques au Centre Universitaire de
Diagnostic au Graben » dans le but de connaître les
phénotypes des souches SARM chez les patients qui nécessitent un
traitement adéquat comme c'est le cas de ceux qui souffrent de
bactériémies et d'infections nosocomiales et d'autres infections
liées à ces germes comme des infections de cutanées, des
infections urogénitales,...
Sur ce, avons-nous besoin de récolter des informations
personnelles chez tous les patients venant faire l'examen de culture. Ces
informations seront gardées anonymes et votre nom ne sera pas lié
aux données récoltées. Seule l'équipe de recherche
aura accès à ces informations. Vous êtes libre d'accepter
ou de refuser de participer à cette étude. Le retrait du
consentement est également garanti à toute liberté.
Acceptez-vous librement de participer à cette étude
? Oui, j'ai compris et j'accepte de participer
Signature
C
Annexe III : ANTIBIORESISTANCE DE SARM PAR RAPPORT AU
TYPE D'ECHANTILLONS
|
Antibiotiques
|
N
|
|
|
|
Type échantillon
|
|
|
|
Total
|
|
Sang
|
Frottis vaginal
|
Frottis urétral
|
Urine
|
Sperme
|
Sécrétion ORL
|
secrétions cutanées
|
Autres
|
|
Amykacine
|
63
|
0(0,0%)
|
4(6,3%)
|
11(17,5%)
|
5(7,9%)
|
2(3,2%)
|
2(3,2%)
|
2(3,2%)
|
1(1,6%)
|
27(42,9%)
|
|
Augmentin
|
97
|
1(1,0%)
|
7(7,2%)
|
7(7,2%)
|
8(8,2%)
|
1(1,0%)
|
2(2,1%)
|
1(1,0%)
|
1(1,0%)
|
28(28,9%)
|
|
Azythromycin
|
52
|
1(1,9%)
|
10(19,2%)
|
20(38,5%)
|
8(15,4%)
|
3(5,8%)
|
2(3,8%)
|
5(9,6%)
|
1(1,9%)
|
50(96,2%)
|
|
Ceftriaxone
|
99
|
5(5,1%)
|
14(14,1%)
|
24(24,2%)
|
23(23,2%)
|
3(3,0%)
|
11(11,1%)
|
6(6,1%)
|
3(3,0%)
|
89(89,9%)
|
|
Ciprofloxacin
|
47
|
0(0,0%)
|
6(12,8%)
|
14(29,8%)
|
7(14,9%)
|
2(4,3%)
|
4(8,5%)
|
1(2,1%)
|
0(0,0%)
|
34(72,3%)
|
|
Clindamycine
|
99
|
3(3,0%)
|
9(9,1%)
|
17(17,2%)
|
11(11,1%)
|
2(2,0%)
|
14(14,1%)
|
3(3,0%)
|
2(2,0%)
|
61(61,6%)
|
|
Gentamycine
|
39
|
0(0,0%)
|
4(10,3%)
|
7(17,9%)
|
3(7,7%)
|
1(2,6%)
|
0(0,0%)
|
2(5,1%)
|
1(2,6%)
|
18(46,2%)
|
|
Erythromycin
|
81
|
1(1,2%)
|
11(13,6%)
|
19(23,5%)
|
16(19,8%)
|
2(2,5%)
|
5(6,2%)
|
5(6,2%)
|
1(1,2%)
|
60(74,1%)
|
|
Levofloxacin
|
51
|
0(0,0%)
|
5(9,8%)
|
12(23,5%)
|
6(11,8%)
|
2(3,9%)
|
1(2,0%)
|
3(5,9%)
|
1(2,0%)
|
30(58,8%)
|
|
Neomycine
|
7
|
0(0,0%)
|
0(0,0%)
|
0(0,0%)
|
0(0,0%)
|
0(0,0%)
|
0(0,0%)
|
3(42,9%)
|
1(14,3%)
|
4(57,1%)
|
|
Meropèneme
|
24
|
1(4,2%)
|
6(25,0%)
|
8(33,3%)
|
3(12,5%)
|
1(4,2%)
|
2(8,3%)
|
3(12,5%)
|
0(0,0%)
|
24(100,0%)
|
|
Oxacilline
|
100
|
5(5,0%)
|
16(16,0%)
|
27(27,0%)
|
23(23,0%)
|
4(4,0%)
|
17(17,0%)
|
5(5,0%)
|
3(3,0%)
|
100(100,0%)
|
|
Cloxacilline
|
2
|
0(0,0%)
|
1(50,0%)
|
0(0,0%)
|
0(0,0%)
|
0(0,0%)
|
0(0,0%)
|
1(50,0%)
|
0(0,0%)
|
2(100,0%)
|
|
Cotrimoxazol
|
50
|
1(2,0%)
|
9(18,0%)
|
19(38,0%)
|
8(16,0%)
|
3(6,0%)
|
4(8,0%)
|
5(10,0%)
|
1(2,0%)
|
50(100,0%)
|
|
Vancomycine
|
46
|
0(0,0%)
|
1(2,2%)
|
5(10,9%)
|
0(0,0%)
|
0(0,0%)
|
2(4,3%)
|
0(0,0%)
|
0(0,0%)
|
8(17,4%)
|
|
Spectinomycine
|
50
|
1(2,0%)
|
7(14,0%)
|
14(28,0%)
|
5(10,0%)
|
1(2,0%)
|
1(2,0%)
|
4(8,0%)
|
1(2,0%)
|
34(68,0%)
|
|
Chloramphénicol
|
41
|
0(0,0%)
|
4(9,8%)
|
13(31,7%)
|
2(4,9%)
|
0(0,0%)
|
1(2,4%)
|
2(4,9%)
|
1(2,4%)
|
23(56,1%)
|
|
Doxycycline
|
82
|
1(1,2%)
|
11(13,4%)
|
15(18,3%)
|
14(17,1%)
|
4(4,9%)
|
7(8,5%)
|
3(3,7%)
|
3(3,7%)
|
58(70,7%)
|
|
Clarithromycine
|
46
|
1(2,2%)
|
8(17,4%)
|
18(39,1%)
|
7(15,2%)
|
3(6,5%)
|
2(4,3%)
|
5(10,9%)
|
1(2,2%)
|
45(97,8%)
|



