|
Soutenu publiquement le 02 juillet 2016

|
UNIVERSITE D'ANTANANARIVO
DOMAINE : SCIENCES ET
TECHNOLOGIES
MENTION : ZOOLOGIE ET BIODIVERSITE ANIMALE
|
|

MEMOIRE
POUR L'OBTENTION DU
Diplôme
de Master
Parcours : Biologie de la Conservation
Animale
Etudes biologique et écologique des
chauves-souris de l'Aire
Protégée Complexe
Tsimembo-Manambolomaty, Région
Melaky, Madagascar
Présenté par :
Ny Anjara Fifi RAVELOMANANTSOA
Devant le Jury composé
de :
Président : Monsieur Aristide
ANDRIANARIMISA
Professeur d'ESR
Rapporteur : Madame Julie C. RANIVO
RAKOTOSON
Maître de Conférences
Co-rapporteur : Monsieur Beza RAMASINDRAZANA
Docteur
Examinateurs : Monsieur Zafimahery
RAKOTOMALALA
Maître de Conférences
Madame Fanomezana M. RATSOAVINA Maître de
Conférences
|
UNIVERSITE D'ANTANANARIVO
DOMAINE : SCIENCES ET
TECHNOLOGIES
MENTION : ZOOLOGIE ET BIODIVERSITE ANIMALE
|
|

MEMOIRE
POUR L'OBTENTION DU
Diplôme
de Master
Parcours : Biologie de la Conservation
Animale
Etudes biologique et écologique des
chauves-souris de l'Aire
Protégée Complexe
Tsimembo-Manambolomaty, Région
Melaky, Madagascar
Présenté par :
Ny Anjara Fifi RAVELOMANANTSOA
Devant le Jury composé
de :
Président : Monsieur Aristide
ANDRIANARIMISA
Professeur d'ESR
Rapporteur : Madame Julie C. RANIVO
RAKOTOSON
Maître de Conférences
Co-rapporteur : Monsieur Beza RAMASINDRAZANA
Docteur
Examinateurs : Monsieur Zafimahery
RAKOTOMALALA
Maître de Conférences
Madame Fanomezana M. RATSOAVINA Maître de
Conférences
Soutenu publiquement le 02 juillet 2016

i
REMERCIEMENTS
A l'issue de ce mémoire de fin d'étude, je
souhaite adresser mes remerciements les plus sincères aux personnes qui
m'ont aidée à la réalisation de ce travail, plus
particulièrement :
- A Monsieur Marson RAHERIMANDIMBY, Professeur titulaire et
Doyen de la Faculté des Sciences de l'Université d'Antananarivo,
qui m'a permis de réaliser cette soutenance ;
- A Monsieur Zafimahery RAKOTOMALALA, Maître de
Conférences, Responsable de la Mention Zoologie et Biodiversité
Animale de la Faculté des Sciences de l'Université
d'Antananarivo, qui m'a aidé dans les divers aspects administratifs,
dans le bon déroulement du travail et qui a aussi accepté
d'être parmi les membres du Jury de ce mémoire ;
- A Monsieur Aristide ANDRIANARIMISA, Professeur d'ESR au sein
de la Mention Zoologie et Biodiversité Animale de la Faculté des
Sciences de l'Université d'Antananarivo, qui m'a fait l'honneur
d'être le président du Jury de ce mémoire ;
- A Madame Julie RANIVO, Maître de Conférences au
sein de la Mention Zoologie et Biodiversité Animale de la Faculté
des Sciences de l'Université d'Antananarivo, mon encadreur
pédagogique, qui a été toujours présente et
à l'écoute durant la réalisation de ce travail, surtout
pour son aide ;
- A Monsieur Beza RAMASINDRAZANA, Docteur, Ecologiste et
Mammalogiste à l'Unité Peste de l'Institut Pasteur de Madagascar,
mon encadreur technique, pour sa générosité, ses critiques
et sa patience malgré ses différentes charges pour
l'amélioration de ce mémoire ;
- A Madame Fanomezana M. RATSOAVINA, Maître de
Conférences au sein de la Mention Zoologie et Biodiversité
Animale de la Faculté des Sciences de l'Université
d'Antananarivo, qui a accepté d'être parmi les membres du Jury
;
- A l'ONG The Peregrine Fund (TPF) qui a proposé cette
étude et qui m'a aidé dans la réalisation de ce travail,
depuis la descente sur le terrain jusqu'à la réalisation finale
de ce mémoire ;
ii
- A Monsieur Lily-Arison RENE DE ROLAND, Professeur HDR,
Directeur National du TPF à Madagascar qui m'a apporté ses
critiques constructives dans la réalisation de ce livre ;
- A la Fondation pour les Aires Protégées et la
Biodiversité de Madagascar (FAPBM) qui a apporté son aide
financière pour la réalisation de cette présente
étude ;
- A Monsieur Marius RAKOTONDRATSIMA, Docteur, Coordinateur
scientifique au sein du TPF qui m'a donné son aide dans la
réalisation de ce livre ;
- A l'Association VAHATRA, plus particulièrement
à Monsieur Steven Michael GOODMAN, Docteur HDR, pour ses conseils, son
appui logistique et son aide pour les diverses documentations ;
- A Madame Balsama RAJEMISON, Responsable du laboratoire du
California Academy of Sciences (CAS), Parc Botanique et Zoologique de
Tsimbazaza, qui m'a aidé dans l'identification et la
détermination des restes d'arthropodes. Sans son aide et son
expérience, les analyses n'ont pas pu être réalisées
;
- Aux enseignants et personnels de la Mention Zoologie et
Biodiversité Animale de la Faculté des Sciences de
l'Université d'Antananarivo, qui m'ont aidé à poursuivre
mes études durant mon cursus universitaire ;
- Au Ministère de l'Ecologie, Environnement et
Forêt pour le permis de recherche N : 241/15/MEEMF/SG/DGF/DAPT/SCHT ;
- Aux techniciens et assistants du TPF pour leur aide dans les
travaux sur le terrain et pour leur collaboration ;
- A ma famille, à mes amis et aux membres et
étudiants du TPF qui m'ont soutenu dans l'accomplissement de ce
travail.
Trouvez ici l'expression de ma profonde gratitude et
reconnaissance.
iii
RESUME
Un inventaire biologique des chauves-souris a
été réalisé dans l'Aire Protégée
Complexe Tsimembo-Manambolomaty (Région Melaky, Madagascar) entre le
mois de septembre et octobre 2015, dans le but de connaître la richesse
spécifique, la biologie et l'écologie des chauves-souris de
l'Aire Protégée. L'évaluation de la diversité
spécifique des chiroptères a été faite par des
séries d'observations au niveau des gîtes diurnes et par des
séries de captures des espèces en utilisant des filets japonais
(6 m et 12 m), et un piège harpe. Au total, 16 points de capture ont
été échantillonnés. La capture à la main et
l'utilisation d'un filet à papillons ont aussi servi à collecter
des individus dans leurs gîtes diurnes pendant le jour et à
capturer celles qui sont en vol pendant la nuit. Au total, 72 individus
appartenant à huit espèces ont été capturées
pendant les 26 jours d'étude après un total de 2 556 (fhm), dont
sept espèces animalivores et une espèce frugivore. Une autre
espèce de chauves-souris frugivore, Pteropus rufus, a
été observée dans son gîte diurne. Après la
réalisation des dissections et des mesures morphométriques,
à part l'observation d'une femelle de Mops leucostigma en
gestation, seul un individu mâle de Chaerephon leucogaster
présentait un épididyme développé et un
individu femelle qui était en phase de gestation. Mops leucostigma
et Taphozous mauritianus présentent un dimorphisme sexuel
au niveau des paramètres morphométriques. Le résultat des
analyses des matières fécales ont permis de connaître le
régime alimentaire de certaines espèces, 10 ordres d'arthropodes
ont été identifiés avec des proportions variables selon
les espèces, dont l'ordre des Coléoptères et des
Lépidoptères sont les plus consommées. La consommation des
proies varie aussi en fonction de la taille des individus. Davantage
d'études seraient encore nécessaires afin de compléter les
informations sur la chiroptérofaune de l'Aire Protégée
Complexe Tsimembo-Manambolomaty, leur écologie et les menaces
potentielles sur les espèces présentes.
Mots clés : Chiroptères,
richesse spécifique, reproduction, régime alimentaire,
Tsimembo-Manambolomaty, Région Melaky, Madagascar
iv
ABSTRACT
A bat inventory has been undertaken in Tsimembo-Manambolomaty
Protected Area (Melaky Region, Madagascar) between September and October 2015
to know the diversity, the biology, and the ecology of bat species occurring in
this area. Chiropteran diversity was evaluated by using two types of trapping
techniques, through observations of day roost sites, and during a survey of the
local population. 6 m and 12 m mist nets and a harp trap were installed along
or across rivers and the forest pathways during the night in 16 capture sites.
Bats were also caught directly by hand inside their day roost sites or in
flight with a butterfly net. In total, 72 individuals belonging to eight bat
species were captured during 26 days after the totality 2 556 (fhm), with seven
insectivorous bat species and one frugivorous bat. A second frugivorous bat
species, Pteropus rufus, was observed in his day roosts site. After
dissection and the morphological measurements, only one female individual of
Mops leucostigma was pregnant, and one male individual of
Chaerephon leucogaster presents a convoluted epididymis and one female
individual is in gestation phase. Mops leucostigma and Taphozous
mauritianus show a sexual dimorphism based on their morphometrical
parameters. The fecal analysis revealed that animalivorous bat species captured
exploit 10 orders of arthropods in different proportions according to the
species, and their respective size, with Order of Coleoptera and Lepidoptera
being the most consumed. Further studies in the area would be necessary to
complete available information on the bat fauna of the Tsimembo Manambolomaty
area, their biology and ecology, and the potential threats of occurring bat
species.
Key words: Chiroptera, species richness,
reproduction, diet, Tsimembo-Manambolomaty, Melaky Region, Madagascar
v
TABLE DES MATIERES
INTRODUCTION 1
I. REVUE DE LITTERATURE 3
Généralités sur les chauves-souris 3
Diversité des chauves-souris dans certaines régions
de Madagascar 4
Régime alimentaire des chauves-souris 5
Cas des Pteropodidae 5
Cas des autres familles 6
II. METHODOLOGIE 7
II.1. Milieu d'étude 7
II.1.1. Localisation géographique 7
II.1.2. Climat 7
II.1.3. Hydrographie 9
II.1.4. Caractéristiques du sol 9
II.1.5. Flore 10
II.1.6. Faune 10
II.2. Matériels et méthodes 10
II.2.1. Période et site d'étude 10
II.2.2. Méthode de capture des chauves-souris 10
II.2.3. Méthode d'étude des individus
capturés 13
II.2.4. Etude du régime alimentaire 15
II.2.5. Traitement des données 16
III. RESULTATS ET INTERPRETATIONS 19
III.1. Résultats d'inventaire 19
III.1.1. Effort de capture 19
III.1.2. Richesse spécifique du site 19
III.2. Affinité biogéographique 20
III.3. Dimorphisme sexuel en relation avec les paramètres
morphométriques 22
III.4. Reproduction 23
III.5. Régime alimentaire des chiroptères du site
23
III.5.1. Variation des proies entre les sites 23
vi
III.5.2. Pourcentage volume et pourcentage fréquence 23
IV. DISCUSSION 29
IV.1. Richesse spécifique 29
IV.2. Variabilité des habitats 29
IV.3. Dimorphisme sexuel 30
IV.4. Reproduction 31
IV.5. Régime alimentaire 31
CONCLUSION ET PERSPECTIVES 34
BIBLIOGRAPHIE 36
ANNEXES I
vii
LISTE DES FIGURES
Figure 1. Carte de localisation de l'AP
Tsimembo-Manambolomaty et des différents sites
d'étude. 8
Figure 2. Courbe ombrothermique de l'AP
Tsimembo-Manambolomaty (2010-2014) 9
Figure 3. Photo d'un piège harpe 12
Figure 4. Schéma d'un filet japonais.
12
Figure 5. Photo d'un filet papillon 13
Figure 6. Les différentes mesures
morphométriques effectuées sur les individus. 14
Figure 7. Schéma d'un piège
malaise 16
Figure 8. Courbe cumulative des espèces
capturées durant la période d'étude 19
Figure 9.Dendrogramme de dissimilarité de
certaines localités de l'ouest 22
Figure 10. Pourcentage volume et pourcentage
fréquence des ordres d'arthropodes consommés
par Taphozous mauritianus 24
Figure 11.
Pourcentage volume et pourcentage fréquence des ordres
d'arthropodes consommés
par Scotophilus marovaza 25
Figure
12. Pourcentage volume et pourcentage fréquence des ordres
d'arthropodes
consomméspar Scotophilus robustus
26
Figure 13. Pourcentage volume et pourcentage
fréquence des ordres d'arthropodes consommés
par Myotis goudoti 26
Figure 14.
Pourcentage volume et pourcentage fréquence des ordres
d'arthropodes consommés
par Pipistrellus spp. 27
Figure 15. Variation du régime
alimentaire en fonction de la taille 28
viii
LISTE DES TABLEAUX
Tableau 1. Liste des espèces de
chauves-souris dans l'AP Tsimembo-Manambolomaty 20
Tableau 2. Nombre des arthropodes dans les sites
d'études 23
ix
LISTE DES ANNEXES
Annexe 1. Statut UICN des espèces de
chauves-souris de Madagascar I
Annexe 2. Répartition des
espèces de chauves-souris dans quelques sites de l'ouest III
Annexe 3. Description et coordonnées
des sites V
Annexe 4. Mesures morphométriques des
espèces capturées dans l'AP VII
Annexe 5. Etat de reproduction de quelques
espèces VIII
Annexe 6. Indice de similarité de
quelques localités de l'ouest de l'île XI
Annexe 7. Pourcentage volume et
fréquence des arthropodes consommées XII
Annexe 8. Variation de la consommation des
proies en fonction de la taille XIII
Annexe 9. Photo des espèces de
chauves-souris identifiées à Tsimembo-Manambolomaty
XIV
1
INTRODUCTION
La flore et la faune de Madagascar présentent diverses
spécificités (Battistini,1996) liées à son origine
et à son histoire évolutive (Nicoll & Langrand, 1989). En
effet, faisant partie du Gondwana, Madagascar s'est détaché de
l'Inde et de l'Afrique pendant le Mésozoïque, respectivement il y a
80 et 140 Millions d'années (Battistini, 1996 ; Goodman, 2008).
Considéré comme un « Hot Spot » de la
biodiversité, la Grande Ile se distingue des autres îles du
sud-ouest de l'Océan Indien par son taux d'endémisme
élevé liés à la variété des milieux
naturels et des niches écologiques (Battistini, 1996). Les habitats
naturels vont des forêts tropicales humides à l'est, des
forêts décidues à l'ouest aux forêts épineuses
dans l'extrême sud-ouest (Nicol & Langrand, 1989). Une des
spécificités de la flore de Madagascar est la complexité
de la communauté végétale (Gautier & Goodman, 2008).
Quant à la faune, elle est caractérisée par une richesse
aussi bien chez les invertébrés (Elouard et al., 2008;
Fisher & Penny, 2008 ; Griffiths & Herbert, 2008) que chez les
vertébrés (Goodman, 2008).
En effet, Madagascar présente une richesse
spécifique considérable en terme d'amphibiens et de reptiles
(Glaw & Vences, 2008), d'oiseaux (Goodman & Hawkins, 2008 ; Raherilalao
& Goodman, 2012) et de mammifères (Goodman et al., 2008 ;
Goodman, 2011 ; Soarimalala & Goodman, 2011). Ce dernier groupe a fait
l'objet de diverses investigations afin de mieux élucider leur histoire
naturelle et évolutive (Goodman et al., 2008) et le fruit de
ces travaux ont permis de mieux connaître leur taxinomie et leur
distribution (Goodman & Ramasindrazana, 2013). Chez les chauves-souris, 47
espèces sont répertoriées à Madagascar avec la
description de Miniopterus egeri (Goodman et al., 2011),
Neoromicia robertsi (Goodman et al., 2012), Miniopterus
ambohitrensis (Goodman et al., 2015a), Hypsugo bemainty,
(Goodman et al., 2015b)et Hipposideros cryptovalorona
(Goodman et al., 2016), parmi lesquelles 38 espèces sont
endémiques. De plus, Madagascar possède une famille
endémique qui est celle des Myzopodidae représentée par
deux espèces géographiquement distinctes, Myzopoda aurita
et M. schliemanni (Goodman, 2011).
Du point de vue de distribution géographique, la
région sèche occidentale de Madagascar possède plus
d'espèces de chauves-souris par rapport à la région
orientale humide (Eger &Mitchell, 2003) et contient une plus grande
endémicité (Wilmé et al., 2006). Actuellement,
cette partie occidentale possède 30 espèces, où les cinq
espèces récemment
2
décrites ont été découvertes
(Goodman et al., 2011, 2012, 2015a, 2015b, 2016). Malgré
l'importance des études entreprises sur les chauves-souris de
Madagascar, toujours est-il que certaines localités ont reçu
moins d'attention, comme le cas de la partie centre-ouest malgache dont la
diversité chiroptérologique reste encore peu connue.
Vu que Madagascar possède cette richesse
spécifique en chiroptère, certaines espèces de
chauves-souris de l'île sont menacées (IUCN, 2015) (Annexe 1). La
pression exercée par l'Homme en est la principale cause de cette menace
dont la destruction des habitats est la plus frappante poussant les individus
à quitter leurs dortoirs (Andrianaivoarivelo et al., 2011). A
part cette perte d'habitat, la collecte des fèces dans leur gîte
pour la fabrication des engrais entrainerait des perturbations sur les
individus qui y vivent (Furey & Racey, 2016). Sans oublier la consommation
de leur viande en tant que gibiers d'une part et aussi comme source de
protéines pendant la période de soudure d'autre part. 4
espèces en sont concernées, à savoir : Pteropus
rufus, Eidolon dupreanum, Rousettus madagascariensis
étant les plus consommées (Jenkins & Racey, 2008) et
Hipposideros commersoni (Rakotoarivelo, 2011)
Dans la partie centre-ouest de Madagascar se situe l'Aire
Protégée (AP) Complexe Tsimembo-Manambolomaty où aucune
étude concernant les chauves-souris n'a pas encore été
réalisée. L'objectif principal de cette étude est donc
d'obtenir des informations sur la diversité, la biologie et
l'écologie des chauves-souris de cette localité.
Tsimembo-Manambolomaty Pour ce faire, nous allons :
? Inventorier les espèces de chauves-souris
présentes dans le site ;
? Comparer la diversité chiroptérologique du
site par rapport à d'autres régions de l'île ; ? Etudier la
reproduction des espèces capturées ;
? Déterminer le régime alimentaire des
espèces animalivores.
Pour atteindre ces différents objectifs, des
études sur terrain et au laboratoire ont été
réalisées dont les différentes étapes seront
abordées dans le présent travail qui sera divisé en quatre
parties. La première partie résume les études faites
auparavant concernant les chauves-souris malgaches. Cette partie sera suivie de
la méthodologie qui décrit le milieu et la période
d'étude, ainsi que les matériels utilisés. Vient ensuite
les résultats obtenus et leur interprétation. La dernière
partie sera consacrée à la discussion qui compare nos
résultats par rapport aux autres résultats déjà
disponibles. Ce travail sera terminé par une conclusion suivie de
quelques perspectives.
3
I. REVUE DE LITTERATURE
Généralités sur les
chauves-souris
Les chauve-souris sont des micromammifères volants qui
ont déjà existé depuis l'Eocène, il y a environ 64
millions d'années (Teeling et al., 2005). Entre -55,8 et -33,9
millions d'années, elles ont subi une radiation évolutive durant
laquelle certaines familles étaient apparues. Par la suite, ces
dernières ont pu s'adapter à divers niches écologiques
grâce au vol et à l'écholocation (Simmons, 2005b) qui est
la capacité d'émettre des ultrasons et d'analyser l'écho
émise sur les objets détectés. Ce système aide
certains groupes de chauves-souris à s'orienter, à se
déplacer et à identifier leurs proies (Neuweiler, 2000). Pendant
cette période, ces groupes d'animaux ont acquis le vol grâce
à une adaptation au niveau de ses membres antérieurs, ces membres
sont modifiés et possèdent des métacarpes allongées
reliées par une fine membrane qui est le patagium pour former une aile.
Ce caractère permet de les classer dans l'ordre des Chiroptères
(Neuweiler, 2000).
Du point de vue biologique, les chauves-souris sont
homéothermes et certaines espèces présentent un
dimorphisme sexuel, les mâles se différencient des femelles par
leur taille, leur pelage, voire leur vocalisation et leur comportement, qui
pourraient varier selon d'espèces (Racey, 1988). Sur le plan
alimentaire, les chauves-souris peuvent être soit frugivores,
insectivores ou carnivores (Whitaker et al., 2009).
Du point de vue écologique, étant un groupe
nocturne, les chiroptères utilisent des gîtes pour se reposer le
jour dont les types de dortoirs varient suivant les espèces, comme les
arbres, les constructions humaines, les points d'eau, les grottes, les
crevasses (Kunz, 1982). Dans ces gîtes, certaines espèces peuvent
vivre en sympatrie où des individus d'espèces différentes
partagent ensemble le même gîte. Ce groupe de mammifères
peut aussi fréquenter les constructions humaines où elles sont
qualifiées d'espèces synanthropiques (Kunz, 1982).Les
chauves-souris jouent également un rôle écologique dans le
fonctionnement de l'écosystème, comme la pollinisation de
certaines plantes (Von Helversen & Winter, 2003) et peuvent être
prédateurs d'insectes (Patterson et al., 2003) et transmetteurs
de maladies (Calisher et al., 2006).
4
La classification basée sur la morphologie des
individus (classification monophylétique) divise les chauves-souris en
deux sous-ordres, à savoir, les Mégachiroptères et les
Microchiroptères (Simmons & Geisler, 1998). Cependant, cette
classification a été remise en question après les diverses
études moléculaires récentes permettant ainsi de reclasser
ces groupes de mammifères à partir des données
moléculaires et évolutives (Teeling et al., 2002,
2005) aboutissant ainsi à la nouvelle classification
phylogénétique. Les chiroptères sont alors
regroupés soit parmi les sous-ordres des Yinpterochiroptera
(Pteropodiformes) soit parmi les Yangochiroptera (Vespertilioniformes).
Pour le cas de Madagascar, l'île partage certaines
espèces avec l'Afrique et l'Asie, mais la plupart des espèces non
endémiques sont originaires d'Afrique (Peterson et al., 1995),
de même pour les espèces endémiques, ce sont les migrants
africains qui sont susceptibles d'évoluer suite à l'isolement de
l'île dans l'Océan Indien (Eger & Mitchell, 1996).
Répartition des chauves-souris dans le monde et
à Madagascar
Les chiroptères se répartissent partout dans le
globe (Patterson & Willig, 2003) sauf en Antarctique (Simmons, 2005a). Ils
constituent les majeurs composants des mammifères dans les
régions tropicales et tempérées (Simmons, 2005a), mais la
plus grande diversité d'espèces se trouve dans les régions
équatoriales (Eger & Mitchell, 2003). Actuellement, plus de 1 116
espèces de chauve-souris ont été recensées dans le
monde (Simmons, 2005a) soit plus d'un cinquième des espèces de
mammifères existantes.
Actuellement, Madagascar possède 47 espèces de
chauves-souris dont 38 sont endémiques. Parmi ces 47 espèces, 29
se trouvent dans la région occidentale et 22 dans la région
orientale.
Diversité des chauves-souris dans certaines
régions de Madagascar
Cette partie parle des résultats des études qui
ont été réalisées dans les AP ayant quelques
caractéristiques en commun avec l'AP Complexe Tsimembo-Manambolomaty,
c'est-à-dire, les AP possédant des forêts sèches
dans la région ouest de l'île. L'ensemble de recherches
effectuées par quelques chiroptérologues permet de
connaître la répartition géographique de certaines
espèces de chauves-souris dans certaines localités de Madagascar
(Annexe 2). Ces AP étant le (Parc National) PN d'Ankarana qui contient
17 espèces, la zone d'Anjohibe avec 18 espèces, le PN de Namoroka
qui possède 19 espèces, le PN de Bemaraha où 18
espèces s'y trouvent, le PN d'Isalo avec 13 espèces, le PN de
Tsimanampetsotsa qui
5
héberge 6 espèces, le PN de Zombitse-Vohibasia
hebergeant 13 espèces le PN de Kirindy Mitea avec 12 espèces
(Goodman, 2011) et le PN de Kirindy CNFEREF avec 10 espèces (Goodman,
2011; Goodman et al., 2015a).
Régime alimentaire des chauves-souris
Cas des Pteropodidae
Peu d'informations sur le régime alimentaire des
chauves-souris frugivores malgaches sont actuellement disponibles.
D'après les études réalisées par
Raheriarisena (2005), le régime alimentaire de Pteropus rufus
est composé particulièrement de fruits, de fleurs et de
feuilles de Tamarindus indica (voamadilo) et d'Agave rigidana
(taretra) dont les proportions dépendent de la phénologie
des plantes consommées et de l'activité de l'espèce
surtout pendant la reproduction, cette espèce se nourrit aussi de
Ceiba pentandra (kapoaka).
Eidolon dupreanum se nourrit du nectar
d'Adansonia suarezensis (baobab) et d'Adansonia grandidieri,
et aussi de C. pentandra (Andriafidison et al., 2007) et de
certaines parties des plantes (fruits, pollen ou les deux) dans laquelle les
fruits de 11 espèces sont consommées : Aphloia theiformis
(goavy), Psidium guajava, Cussonia bojeri
(hazongoaika), Ficus lutea (amontana), F. reflexa
(laza), F. pachyclada, Passiflora caerulea (garana),
Morus alba (voarohy hazo), Rubus mollucanus (voaloboka),
Prunus sp. (cerise), Solanum mauritianum et Grewia
saligna (sely) (Ratrimomanarivo, 2007).
Rousettus madagascariensisse nourrit de nectar, des
fleurs de feuilles ou de fruits en drupe et de fruits de Ficus rubra,
des fruits de Litchi chinensis (litchis) et de Dimocarpus longan
(Andrianaivoarivelo et al., 2007, 2011, 2012), et consomme
largement du nectar, des fleurs, des fruits et six espèces de plantes
(Dypsis sp. (rofia), F. soroceoide, F.
botryoïdes, F. rubra, Rubus mollucanus, une espèce de
la famille des Solanaceae) (Andrianaivoarivelo et al., 2011), de
Ziziphus jujuba (voatsinefy) et de F. sakalavarum
(adabolahy), mais la préférence entre les deux fruits varie
en fonction de l'âge de l'animal. Les jeunes ont une
préférence pour F. sakalavarum, tandis que les adultes
mangent des fruits de F. sakalavarum qui ne sont
généralement pas très mûrs (Andrianaivoarivelo
et al., 2012).
6
Cas des autres familles
Des études concernant le régime alimentaire des
chauves-souris animalivores ont été réalisées par
divers chercheurs (Razakarivony et al., 2005 ; Andrianaivoarivelo
et al., 2006 ; Ramasindrazana, 2009 ; Ramasindrazana et al.,
2012 ; Rakotondramanana et al., 2015 ; Rasoanoro et al.,
2015). Ce groupe rassemble toutes les autres familles de chauves-souris qui se
nourrissent généralement d'insectes, voire de petits arthropodes
(Whitaker et al., 2009) comme l'ordre des Coléoptères,
Lépidoptères, Hyménoptères,
Hémiptères, Araneae, Diptères, Trichoptères,
Homoptères, Blattes, Orthoptères et Isoptères dont la
composition et la proportion pourraient varier en fonction de la saison, de
l'habitat, du pays, de la disponibilité des proies, de la
préférence alimentaire de l'espèce, ainsi que l'âge
et dans certains cas du sexe des espèces. Seul l'ordre des
Coléoptères est consommé par la majorité des
espèces.
7
II. METHODOLOGIE II.1. Milieu d'étude
II.1.1. Localisation
géographique
Sous la gestion de « The Peregrine Fund » (TPF) qui
est un Organisme Non Gouvernemental (ONG), l'AP Complexe Tsimembo-Manambolomaty
est composée de trois écosystèmes : des lacs, des
mangroves et la forêt de Tsimembo qui est délimitée par la
rivière de Manambolomaty au sud et par la rivière de Beboka au
nord (Projet ZICOMA, 1999). Par la présence de ces lacs, l'AP forme un
Complexe de zones humides, classés comme site RAMSAR depuis 1999 et est
entourée par la forêt de Tsimembo pour constituer le Complexe
Tsimembo-Manambolomaty. Cette AP a obtenu le statut d'Aire
protégée définitif de catégorie V ou « Paysage
Harmonieux Protégé » de l'UICN (Union International de la
Conservation de la Nature) en 2015.
L'AP Complexe Tsimembo-Manambolomaty est située dans la
partie centre-ouest de Madagascar, dans la région Melaky, district
Antsalova, dans les communes rurales de Masoarivo, de Trangahy et d'Antsalova.
Elle est située à environ 150 km à l'est de Morondava et
50 km à l'ouest du PN de Bemaraha (à vol d'oiseau). L'AP Complexe
Tsimembo-Manambolomaty possède une superficie de 62 745 ha avec une
altitude allant de 20 à 100 m (The Peregrine Fund, 2013) et
localisée à 19°00'00»S, 44°23'29»E (Figure
1).
II.1.2. Climat
L'AP Complexe Tsimembo-Manambolomaty présente un climat
tropical sec alterné par deux saisons bien distinctes : une saison
pluvieuse pendant cinq mois, de novembre à mars, avec une
précipitation maximale au mois de février, et une saison
sèche durant sept mois, du mois d'avril à octobre (Bousquet &
Rabetaliana, 1992). La température minimale de l'année est de
23°C de juin en août, la moyenne est de 26°C et la plus
élevée est de 28°C du mois de novembre au mois d'avril. Pour
la pluviométrie, l'indice la plus basse est de 0,16 mm en mois de juin,
la moyenne est de 99,5 mm et la plus élevée est de 463,9 mm en
mois de janvier (Figure 2).

8
Figure 1. Carte de localisation de l'AP Complexe
Tsimembo-Manambolomaty et des différents sites d'étude. (Source :
FTM, modifiée par Fifi Ravelomanantsoa, 2016)

(mm)
(°C)
500
450
400
350
300
250
200
150
100
50
50
25
0
0
9
Mois
Précipitation (mm) Température (°C)
Figure 2. Courbe ombrothermique de l'AP
Complexe Tsimembo-Manambolomaty
(2010-2014) (Source : Service météorologique
d'Ampandrianomby, Antananarivo,
Madagascar).
II.1.3. Hydrographie
L'AP Complexe Tsimembo-Manambolomaty est
caractérisé par la présence de trois lacs qui sont
Befotaka, Soamalipo et Ankerika. Ces deux derniers sont reliés par une
ouverture d'une cinquantaine de mètres pour former le lac d'Andranobe.
Ces lacs sont alimentés par la rivière Manambolo au début
de la saison de pluie. La température moyenne de l'eau étant de
26°C tout au long de l'année (Rasamoelina, 2000).
II.1.4. Caractéristiques du
sol
Une des caractéristiques de la région ouest de
Madagascar est la présence de dépôts de calcaires massifs,
karstiques et un relief déchiqueté dont l'érosion par
l'eau a entrainé la formation du Tsingy comme le PN de Bemaraha
(Bousquet & Rabetaliana, 1992), de même pour la forêt de Beanka
qui possède aussi une massif calcaire (Gautier et al., 2013).
Pour l'AP Complexe Tsimembo-Manambolomaty, elle ne possède pas ces
critères. Par contre, le sol est de type argilo-sableux contenant 60
à 67,91% de matières organiques, 27,2 à 42,8% d'argile,
9,1 à 27,4% de limons et 21,1 à 35,1% de sables (The Peregrine
Fund, 2013).
10
II.1.5. Flore
La forêt de Tsimembo possède une superficie de 32
800 ha et est majoritairement composée d'espèces à
feuilles caduques. Elle est constituée par une succession de forêt
sèche non dégradée (qui occupe 65,5% de l'aire totale), de
forêt sèche dégradée et des savanes dominées
par des Ziziphus jujuba. La forêt sèche
dégradée est caractérisée par l'abondance des
lianes et des espèces héliophiles de petite taille (The Peregrine
Fund, 2013). Récemment, 290 espèces de plantes appartenant
à 69 familles ont été inventoriées dans l'AP
Complexe Tsimembo-Manambolomaty (Andriafanomezantsoa, 2012).
II.1.6. Faune
L'AP Complexe Tsimembo-Manambolomaty est doté d'une
grande diversité de vertébrés dont la plupart sont
endémiques de la Grande Ile. Cette AP héberge 69 espèces
d'amphibiens et de reptiles (Razafimahatratra, 2011), 13 espèces de
mammifères non-volants (The Peregrine Fund, 2013) et 16 espèces
de poissons (Ratsoavina & Ravelomanana, 2014). Ce site abrite
également 115 espèces d'oiseaux (Morris & Hawkins, 1998) et
constitue une zone de refuge pour certaines espèces d'oiseaux,
principalement pour l'aigle pêcheur de Madagascar (Haliaeetus
vociferoides) où 10% de sa population mondiale s'y trouve
(Razafimanjato, 2011).
II.2. Matériels et méthodes
II.2.1. Période et site
d'étude
Une descente sur terrain dans l'AP Complexe
Tsimembo-Manambolomaty a été entreprise pendant la saison
sèche, du 22 septembre au 31 octobre 2015, dont le choix des sites a
été basé à partir des prospections : par
l'existence des gîtes et des zones de passage potentiels. De ce fait 16
points de capture ont été choisis (Annexe 3).
II.2.2. Méthode de capture des
chauves-souris
Le succès de capture des chauves-souris est basé
sur la connaissance de leurs dortoirs, de leur comportement de dispersion et de
leur habitude de recherche de nourriture (Kunz & Kurta, 1988), les
séances de capture ont été alors entreprises en tenant
compte de ces diverses conditions.
Les pièges ont été installés avant
le coucher du soleil et ouverts 30 mn après le coucher du soleil,
coïncidant au début de l'activité de chasse des
chauves-souris, c'est-à-dire à partir de
11
18h30mn et est fermé après 21h ou juste avant le
lever du soleil. Ces pièges ont été installés au
bord des lacs, à travers les zones de passage comme les tunnels
naturelles dans les forêts, les trajets de l'homme, ou près de
leur perchoir. En outre, certains sites ont été revisités
pendant l'étude, vu que ce sont dans ces sites que certaines
espèces sont les plus abondants et que ces sites possèdent aussi
plusieurs gîtes.
II.2.2.a. Piège harpe
Le piège harpe est composé verticalement de deux
rangées en parallèle de fils en nylon qui sont soutenus chacun en
haut et en bas par une barre horizontale. Pour que les fils soient tendus, les
deux barres horizontales des deux côtés de chaque rangée de
filets sont reliées par une barre verticale, qui est aussi
reliées entre eux pour pouvoir soutenir une poche qui sert à
retenir les individus piégés. Le tout est supporté par
deux barres obliques se reliant chacun des deux côtés (Figure
3).
II.2.2.b. Filet japonais
De même type de piège que celui utilisé
pour capturer les oiseaux, les filets japonais utilisés durant cette
étude sont fabriqués avec des fils en nylon, avec une maille de
36 mm, ils ont une largeur de 6 m ou de 12 m et une hauteur moyenne de 2,4 m.
Ce piège contient quatre poches tout le long de sa largeur pour pouvoir
retenir les individus capturés. Une fois ouvert, les pièges sont
visités tous les 15 mn (Figure 4).
II.2.2.c. Capture à la main
Cette technique consiste à capturer les individus
à la main (Kunz & Kurta, 1988) pour ceux qui nichent dans les
constructions humaines ou qui sont au repos dans leur gîte.

12
Figure 3. Photo d'un piège harpe (Photo
: Beza Ramasindrazana, 2015)

Figure 4. Schéma d'un filet japonais
(Kunz & Kurta, 1988).
II.2.2.d. Filet à papillon
C'est un piège utilisé pour capturer les
insectes, mais il est aussi utilisé pour capturer les chauves-souris. Le
filet papillon est constitué par un sac profond avec une ouverture en
cercle, relié à un bâton dont la longueur est
réglable (Figure 5).

13
Figure 5. Photo d'un filet à papillon
(Source :
http://www.dickssportinggoods.com/graphics/product_images/pDSP1-10155440p275w.jpg)
II.2.2.e. Observation au niveau des
gîtes
Des observations au niveau des gîtes ont
été réalisées durant le jour pour pouvoir
identifier les individus qui y sont présente.
II.2.3. Méthode d'étude des individus
capturés
Une fois que les chauves-souris sont capturées, elles
sont placées séparément dans des pochons en tissus propres
pour diverses études morphologiques et morphométriques.
II.2.3.a. Mensuration et pesage
Les individus ont fait l'objet de mensuration avant leur
préparation. Pour ce faire, une règle plastique avec une
précision de 0,5 mm a été utilisée pour mesurer les
différentes parties du corps de l'animal dont l'unité
étant exprimée en millimètre (Figure 6). Par ailleurs, les
mesures suivantes ont été relevées :
? La longueur totale du corps (LT) qui est la longueur entre
le bout du museau jusqu'à la dernière vertèbre caudale.
Pendant cette mensuration, la partie ventrale de l'animal est placée sur
la règle et la queue étant étirée.
? La longueur de la queue (LQ) qui est la distance entre lla
première et la dernière vertèbre caudale.
? La longueur du pied (Pied) qui est la distance entre le
talon et l'orteil le plus long, sans les griffes
14
? La longueur de l'oreille (OR) qui est mesurée de la
base au bout de l'oreille. Si l'individu possède un tragus, alors ce
dernier a été mesuré à partir de sa base
jusqu'à son extrémité distale.
? La longueur de l'avant-bras (AB) qui est la distance entre
le coude et l'articulation qui porte les différents
métacarpes.

Figure 6. Les différentes mesures
morphométriques effectuées sur les individus
(Réalisée
par : Fifi Ravelomanantsoa, 2016).
Après les diverses mensurations, le poids de l'animal a
été pris à l'aide d'une balance de précision (0,1
g) dont l'unité de poids est exprimé en gramme.
Pour le cas des individus relâchés, seul le poids
et la longueur de l'avant-bras ont été pris.
II.2.3.b. Détermination du sexe
Les mâles des chauves-souris se différencient des
femelles par la présence d'un pénis et d'une paire de testicules,
qui sont en position abdominale pour les juvéniles, ou scrotale pour les
adultes. Cela détermine l'état de reproduction des mâles.
Tandis que chez les femelles, la présence du vagin qui est
perforé ou non, d'une paire de mamelles (petite, large ou en lactation),
et de la cicatrice placentaire indiquent l'état de reproduction des
femelles (Racey, 1988 ; Hutson & Racey, 2004).
II.2.3.c. Prélèvement des
ectoparasites
Pour des études ultérieures, des ectoparasites
ont été prélevé sur chaque individu. Ces
ectoparasites ont été ensuite placés dans des tubes
contenant de l'alcool 90°.
15
II.2.3.d. Prélèvement des
tissus
Les individus ont subi des prélèvements de
tissus pectoraux qui ont été ensuite placés dans des tubes
contenant de l'Ethyl Diamine TétrAcétique (EDTA) pour des futures
analyses moléculaires.
Une fois que les mensurations et les
prélèvements ont été fini, le crâne a
été préparé et mis dans de l'alcool à
70°, tandis que le cadavre a été placé dans du formol
à 12,5%.
II.2.4. Etude du régime
alimentaire
La connaissance du régime alimentaire des
chiroptères est obtenue grâce à l'analyse de leurs
fèces (Pavey & Burwell, 2000) dont la collecte est nécessaire
pour analyser les fragments d'invertébrés qu'elles contiennent
(Shiel et al., 1997).
II.2.4.a. Méthode de capture des insectes par le
piège Malaise
Les insectes sont les principales sources alimentaires de la
plupart des chauves-souris animalivores (Whitaker et al., 2009), la
capture de ces petits invertébrés est alors nécessaire
pour évaluer les proies probables des chauves-souris, aussi, ces
arthropodes servent de guide pendant l'analyse des fèces au laboratoire.
Dans cette étude, le piège Malaise a été
utilisé pour l'échantillonnage des proies et le piège a
été installé pendant les mêmes heures de capture que
celle des chauves-souris et placés pas loin de celle-ci pour quelques
sites.
Le piège Malaise est un piège pliable
fabriqué en toile à maille fine. Ressemblant à une tente,
le toit présente une ouverture à l'intérieur duquel est
attaché un récipient présentant une petite ouverture pour
le passage des insectes. Le récipient est tenu grâce aux tendons
qui maintiennent le piège en place. Pour que les insectes soient
conservés (figure 7), le récipient contient de l'alcool à
90°.

16
Figure 7. Photo d'un piège Malaise
(Source :
http://insectafgseag.myspecies.info/files/SLAM_MCV.jpg)
II.2.4.b. Collecte des pelotes
fécales
Les pelotes fécales sont obtenues grâce aux
défécations que les individus effectuent dans le pochon quelques
heures après leur capture. Les pelotes fécales sont ensuite
placées dans des tubes contenant de l'alcool à 90° pour que
les débris des arthropodes soient conservés.
II.2.4.c. Analyse des pelotes fécales au
laboratoire
Afin de connaître le régime alimentaire des
chauves-souris, l'analyse des pelotes fécales au laboratoire est
nécessaire. Cela consiste à les ramollir dans de l'alcool
à 90° pour pouvoir identifier les parties non
digérées, tels que les fragments de pattes, antennes,
d'élytres, de mandibules, d'écailles des
invertébrés (Whitaker et al., 2009).Vu que les pelotes
fécales collectées sont peu nombreuses toutes les crottes de
chaque individu ont été analysées.
II.2.5. Traitement des
données
Pour pouvoir atteindre les objectifs et donner les
réponses aux hypothèses proposées dans l'étude, des
analyses statistiques ont été réalisées à
partir des données récoltées sur terrain et au
laboratoire. Les tests ont été effectués grâce au
logiciel R (R Core Team, 2014) et à l'Excel.
17
II.2.5.a. Effort de capture
Pour pouvoir estimer l'effort réalisé pour la
capture dans chaque site durant l'étude, l'effort de capture a
été calculé. La formule étant la suivante :
E = F X H X M
E = Effort de capture (fhm)
F =Nombre de filets (f)
H =Durée d'ouverture de filets (h) M =Longueur total des
filets (m)
II.2.5.b. Pourcentage volume
La quantité de chaque groupe d'arthropodes
consommés par les espèces est déterminée en
calculant le pourcentage volume. Le pourcentage volume est la quantité
de chaque taxon d'arthropodes identifiés dans les pelotes fécales
de chaque espèce étudiée. Il est calculé comme suit
:
??
PV= X 100
??
PV= pourcentage volume (%)
v= somme du pourcentage de chaque taxon identifié dans
les pelotes fécales d'un individu (%) V= somme du pourcentage des taxons
identifiés dans les pelotes fécales d'un individu (%)
II.2.5.c. Pourcentage fréquence
Le pourcentage fréquence est le pourcentage des
individus d'une espèce étudiée qui consomme un ordre
donné (Whitaker et al., 2009). La formule étant :
PF= f X 100
??
PF= pourcentage fréquence (%)
f= nombre de pelotes fécales d'un individu contenant un
ordre donné F= nombre de pelotes fécales d'un individu
analysés
II.2.5.d. Test de normalité de Shapiro-Wilk
(Dytham, 2011)
Appelé aussi test de Shapiro-Wilk, ce test est une des
étapes à faire pour pouvoir réaliser le choix d'un test
statistique. Il permet de connaitre si la distribution de la fréquence
observée
18
correspond à la distribution de la fréquence
attendue. L'hypothèse nulle H0 est que les données sont
normalement distribuées, si la probabilité p est supérieur
à 0,05, H0 est acceptée, par contre si p est inférieur
à 0,05, H0 est rejetée.
II.2.5.e. Etude de la distribution
géographique
Pour connaitre la proximité biogéographique
entre les localités, l'indice de Jaccard a été
calculé. Tsimembo-Manambolomaty Il permet d'évaluer la
similarité entre les localités en tenant compte des
espèces qu'ils ont en commun et compare les sites deux à deux.
Plus le résultat se rapproche de 1, plus les deux sites sont
similaires.
II.2.5.f. Etude du dimorphisme sexuel (Dytham,
2011)
Le test de Wilcoxon Mann-Whitney est utilisé pour
connaitre s'il y a un dimorphisme sexuel ou non chez une espèce. C'est
un test de comparaison qui est utilisé pour les échantillonnages
non apparié et pour les données qui ne sont pas normalement
distribuées (non paramétrique). L'hypothèse nulle H0
étant que les mâles et les femelles ne présentent pas de
dimorphisme. Si p est inférieure à 0,05, H0 est rejetée et
si la probabilité p est supérieure à 0,05, H0 est
acceptée.
19
III. RESULTATS ET INTERPRETATIONS III.1.
Résultats d'inventaire
III.1.1. Effort de capture
Pendant les 26 jours d'étude, neuf espèces de
chiroptères ont été identifiées dont huit
capturées et une observée. Les pièges utilisés ont
tous aboutit à l'obtention des individus mais le taux de capture varie
selon le type de piège. Les filets japonais ont permis de capturer plus
d'individus avec un effort d'échantillonnage total de 2 556
filet-heure-mètre. Au premier jour de capture, une espèce a
été capturée. Ce nombre a augmenté de quatre
espèces au deuxième jour jusqu'au 4ème jour. Du
5èmeau 8ème jour, au total cinq espèces ont
été identifiées et au 9ème jusqu'au
13èmejour ce nombre a atteint de six espèces. Au
14ème jour, le nombre d'espèce a augmenté de
huit, et à partir du 15ème jour jusqu'au dernier jour
d'étude (26ème jour), neuf espèces ont
été identifiées. Le plateau de saturation a
été atteint, ce qui signifie que la durée de
l'étude est suffisante pour l'inventaire de la faune
chiroptérologique de l'AP (Figure 8). Cependant, étant
donnée l'étendue de la zone et la diversité d'habitats,
d'autres espèces pourraient s'ajouter à cette liste.
|
10 9 8 7 6 5 4 3 2 1 0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nombre cumulé des espèces recensées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 2 3 4 5 6 7 8 9 1011121314151617181920212223242526 Nombre de
jours
Figure 8. Courbe cumulative des espèces
capturées durant la période d'étude.
III.1.2. Richesse spécifique du
site
Au total 72 individus appartenant à neuf espèces
de chauves-souris ont été identifié dans l'AP Complexe
Tsimembo-Manambolomaty : deuxespèces appartenant au sous-ordre des
20
Yinpterochiroptera (Pteropus rufus et Rousettus
madagascariensis)et sept espèces appartenant au sous-ordre des
Yangochiroptera (Taphozous mauritianus, Myotis goudoti,
Pipistrellus spp., Scotophilus marovaza, Scotophilus
robustus, Mops leucostigma et Chaerephon leucogaster).
Seule Pteropus rufus n'a pas été capturée mais
observée (Tableau 1). Les espèces Taphozous mauritianus
et Mops leucostigma sont les plus abondants du faite que leur
gîte sont nombreuses dans l'AP (abondance de Cocos nucifera) et
que l'AP pourrait posséder les conditions nécessaires pour leur
survie et leur développement comme l'abondance de nourriture et le
climat, tandis que Myotis goudoti, Pipistrellus spp., S.
marovaza et S. robustus sont des espèces
considérées comme rares au sein de l'aire protégée
vue qu'il y a peu de leur gîte qui existe.
Tableau 1. Liste des espèces de
chauves-souris dans l'AP Complexe Tsimembo-Manambolomaty
|
Sous-ordres
|
Familles
|
Genres et espèces
|
Nombre
d'individus
capturés
|
|
YINPTEROCHIROPTERA
|
PTEROPODIDAE
|
Pteropus rufus
|
*
|
|
Rousettus madagascariensis
|
10
|
|
YANGOCHIROPTERA
|
EMBALLONURIDAE
|
Taphozous mauritianus
|
21
|
|
VESPERTILIONIDAE
|
Myotis goudoti
|
1
|
|
Pipistrellus spp.
|
2
|
|
Scotophilus marovaza
|
1
|
|
Scotophilus robustus
|
1
|
|
MOLOSSIDAE
|
Mops leucostigma
|
32
|
|
Chaerephon leucogaster
|
4
|
|
TOTAL
|
|
|
72
|
* : Espèce observée
III.2. Affinité biogéographique
Les localités sont regroupées selon la
présence et l'absence des espèces dans chaque site, plus les
sites présentent des espèces en commun, plus ils sont similaires.
Ici, les localités sont regroupées en deux: le premier groupe est
constitué par deux sous-unités, le PN d'Ankarana se trouvant au
nord-ouest de l'île est la première sous-unité, et la
deuxième sous-
21
unité qui est constituée par la zone d'Anjohibe
au sud-ouest d'une part, et le PN de Namoroka au nord-ouest et le PN de
Bemaraha au centre-ouest d'autre part. Le deuxième groupe est aussi
composé de deux sous-unités qui sont le PN de l'Isalo au
sud-ouest et le PN de Tsimanampetsotsa au centre-ouest pour la première
sous-unité, et pour la deuxième sous-unité, elle
possède encore deux regroupements qui sont le PN de Zombitse Vohibasia
au sud-ouest d'une part, l'AP Tsimembo-Manambolomaty, la concession
forestière de Kirindy CNFEREF au centre-ouest et le PN de Kirindy Mitea
d'autre part au sud-ouest (Figure 9).
Dans le premier groupe, le PN de Namoroka et le PN de Bemaraha
partagent 17 espèces en commun, ces deux derniers sites sont les plus
similaires pour ce groupe, avec une indice de similarité de 0,87 (Annexe
6), et partage 11 espèces avec Ankarana et 12 espèces avec
Anjohibe. Le PN d'Ankarana et le zone d'Anjohibe partagent 12 espèces en
commun
Pour le deuxième groupe, Isalo et Tsimanampetsotsa
hébergent 13 et six espèces dont 99% des espèces
rencontrées à Tsimanampetsotsa se trouvent à Isalo. Dans
ce groupe encore, il y a le PN de Zombitse Vohibasia et l'AP
Tsimembo-Manambolomaty qui partagent trois espèces en commun. D'autre
part, Kirindy CNFEREF et Kirindy Mitea sont assez similaires avec neuf
espèces en commun et une indice de similarité de 0,62 (Annexe 6),
et partage quatre espèces avec Zombitse Vohibasia et
Tsimembo-Manambolomaty .

22
Figure 9. Dendrogramme de dissimilarité
de certaines localités de l'ouest.
III.3. Dimorphisme sexuel en relation avec les
paramètres morphométriques
Le dimorphisme sexuel est ici basé sur les
données morphométriques obtenues après les diverses
mensurations (Annexe 4). Les espèces capturées possédant
à la fois des individus mâles et femelles capturées ont
été prises en compte, dont Mops leucostigma,
Chaerephon leucogaster, Taphozous mauritianus et
Rousettus madagascariensis.
Chaerephon leucogaster et Rousettus
madagascariensis ne présente pas de dimorphisme sexuel au niveau
des paramètres morphometriques (p>0,05).
Mops leucostigma présente un dimorphisme
notable au niveau de la longueur de l'avant-bras (Mann-Whitney : W= 28,5,
p=0,017). Les mâles étant plus grands que les femelles.
23
Taphozous mauritianus présente un dimorphisme
au niveau de l'avant-bras (Mann-Whitney : W=60, p=0,020) et du poids
(Mann-Whitney : W=60,5, p=0,019). Les femelles étant plus grandes que
les mâles.
III.4. Reproduction
Les études sur la reproduction ont été
faites sur les individus possédant des caractères sexuels
secondaires (Annexe 5). Chez les femelles de Chaerephon leucogaster,
un individu femelle était en période de gestation, la
présence d'un embryon a été identifiée. Pour
Mops leucostigma, un individu femelle aussi était en phase de
gestation, celle-ci a été confirmée par la présence
d'un embryon. Pour les mâles, il y en a un en phase de reproduction. Les
testicules étaient en position scrotale et l'épididyme
était contourné. Ces espèces étaient donc en phase
de reproduction pendant la saison sèche (septembre-octobre), tandis que
les individus de Taphozous mauritianus et de Rousettus
madagascariensis n'ont montré aucun signe de reproduction.
III.5. Régime alimentaire des chiroptères
du site
III.5.1. Variation des proies entre les
sites
Quatre ordres d'arthropodes ont été
identifiés dans les sites d'étude, avec un total de 130
individus, y compris l'ordre des Diptères (96,15%), des
Homoptères (1,54%), des Coléoptères (1,54%) et des
Hyménoptères (0,77%) (Tableau 2).
Tableau 2.Répartition des arthropodes
dans deux sites de capture (Ankivahivahy 1 et 2)
|
Taxon
|
Localités
|
Total
|
|
Ankivahivahy 1
|
Ankivahivahy 2
|
|
HYMENOPTERES
|
1
|
0
|
1
|
|
DIPTERES
|
71
|
54
|
125
|
|
COLEOPTERES
|
1
|
1
|
2
|
|
HOMOPTERES
|
0
|
2
|
2
|
|
TOTAL
|
73
|
57
|
130
|
III.5.2. Pourcentage volume et pourcentage
fréquence
Les résultats ont montré que dans 46 pelotes
fécales provenant de cinq espèces de chiroptères
(Myotis goudoti, Pipistrellus. spp, Scotophilus
marovaza, S. robustus, Taphozous mauritianus),
10 taxa d'arthropodes sont répertoriées, mais la proportion et la
présence de ces derniers varient pour chaque espèce. L'ordre des
Coléoptères sont toujours présent dans les pelotes
fécales lors des analyses (Annexe 5).
24
III.5.2.a. Taphozous mauritianus (n=
3)
Pendant l'analyse fécale, quatre ordres d'arthropodes
ont été identifiés dans les pelotes fécales des
individus analysés : 68% pour les Lépidoptères, 5% pour
les Hémiptères, 25,2% pour les Coléoptères et 1,7%
pour les Diptères dont 100% des individus consomment les
Lépidoptères, 27,8% mangent les Hémiptères, 72,2%
se nourrissent des Coléoptères et 16,7% des Diptères
(Figure 10).

(%)
100
40
20
60
80
0
Pourcentage volume Pourcentage fréquence
Ordres
Figure 10. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes
consommés par Taphozous mauritianus.
III.5.2.b. Scotophilus marovaza (n=
1)
Les analyses montrent que Scotophilus marovaza
consomme trois ordres d'arthropodes : 88,3% pour les
Coléoptères, 1,7% pour les Ephéméroptères et
10% pour les Homoptères. Le pourcentage fréquence permet de dire
que 100% des individus consomment les Coléoptères, 16,7% des
Ephéméroptères et 66,7% des Homoptères (Figure
11).
(%)

100
80
60
40
20
0
Ordres
Pourcentage volume Pourcentage fréquence
25
Figure 11. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes
consommés par Scotophilus marovaza.
III.5.2.c. Scotophilus robustus (n=
1)
Le résultat des analyses montrent que Scotophilus
robustus mangent 3 ordres d'Insectes : 99% pour les
Coléoptères dont 100% des individus les consomment, 0,5% chacun
pour les Diptères et les Hyménoptères dont 10% des
individus se nourrissent des Diptères et 10% des
Hyménoptères (Figure 12).
III.5.2.d. Myotis goudoti (n= 1)
Au total, cinq ordres d'arthropodes ont été
identifiés dans les pelotes fécales de Myotis goudoti
dont 47,5% pour les Lépidoptères, 41,5% pour les
Coléoptères, 4,5% pour les Homoptères, 4% pour les
Isoptères et 2,5% pour les Araneae, avec 100% des individus qui mangent
des Lépidoptères, 100% des Coléoptères, 40% des
Hyménoptères, 30% des Isoptères et 30% des Araneae (Figure
13).
(%)
100
80
60
40
20
0
Pourcentage volume Pourcentage fréquence


Ordres
26
Figure 12. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes consommés par Scotophilus
robustus.
(%)

100
40
20
60
80
0
Ordres
Pourcentage volume Pourcentage fréquence
Figure 13. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes consommés par Myotis
goudoti.
27
III.5.2.e. Pipistrellus spp. (n = 2)
Au total, 6 ordres d'arthropodes ont été
identifiés dans les pelotes fécales de Pipistrellus spp.
dont 11% de Lépidoptères, 4,67% d'Hémiptères, 54%
de Coléoptères, 2% d'Homoptères, 20,7%
d'Hyménoptères et 7% d'Araneae (Figure 14).

Ordres
Pourcentage volume Pourcentage fréquence
Figure 14. Pourcentage volume et pourcentage
fréquence par ordres d'arthropodes
consommés par Pipistrellus spp.
III.5.3. Variabilité des proies en fonction de
la longueur de l'avant-bras
Dans cette étude, la consommation des proies en
relation avec la longueur de l'avant-bras est aussi prise en compte (Annexe 8)
pour l'étude du régime alimentaire. La longueur de l'avant-bras
varie en fonction de la taille de l'individu, plus l'avant-bras est longue,
plus l'individu est de grande taille, et inversement.
En se basant sur la longueur de l'avant-bras, les
Coléoptères sont les proies les plus consommées car les
individus de tout type de taille se nourrissent de cette proie. Suivi des
Lépidoptères qui sont consommées par les individus de
grandes tailles et de petites tailles. Tandis que les Diptères, les
Homoptères, les Isoptères et les Orthoptères sont les
moins consommés (Figure 15). Ces dernières sont donc des proies
mineures et seuls les Coléoptères et Lépidoptères
constituent les proies majeures des chiroptères. De plus, les individus
de petite taille consomment divers types de proies mais de faible
quantité pour chaque type consommé, tandis que les individus de
grande taille ne consomment que quelques types de proies mais de
28
quantité élevé. Cette variation de
consommation, de proies est dû à la taille de l'individu (car la
grandeur du corps nécessite une plus grande quantité de
nourriture à consommer), par la préférence et par la
disponibilité des proies.
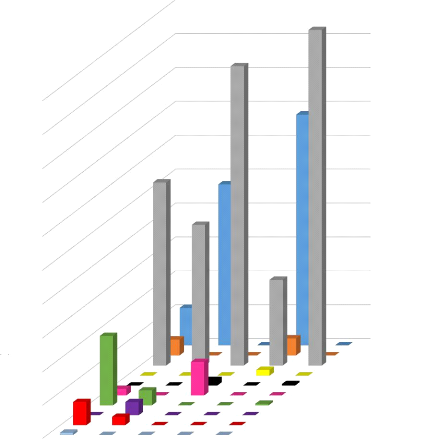
Pourcentage volume des proies (%J
100
40
90
70
20
60
50
30
80
10
0
Orthoptères
Lépidoptères Hémiptères
Coléoptères Diptères
Ephéméroptères Homoptères
Hyménoptères Isoptères
Araneae
30,5 39 43 60,9 63
Longueur de l'avant-bras (mm)
Figure 15. Variation du régime
alimentaire en fonction de la taille
29
IV. DISCUSSION
IV.1. Richesse spécifique
Neuf espèces de chauves-souris ont été
identifiées dans l'AP Complexe Tsimembo-Manambolomaty. La
diversité y est moyenne par rapport aux autres localités de
l'ouest, car certaines en possède des dizaines d'espèces, comme
le cas du PN de Namoroka par exemple qui contient 19 espèces de
chauves-souris, mais la richesse spécifique du PN de Tsimanampetsotsa
est encore faible en comparant à celle de Tsimembo-Manambolomaty avec
six espèces seulement. Cette moyenne diversité en
chiroptère est dû au fait que cette AP ne présente pas des
grottes vue que la plupart des espèces sont cavernicoles, et qu'elle
possède une forêt sèche sur formation sableuse et aussi que
ce site est abrité par plusieurs espèces d'oiseaux dont la
plupart consomment des chauves-souris comme nourriture (Goodman et al.,
2015c).Alors que certaines localités (cas du premier groupe)
possèdent des formations karstiques offrant ainsi des gîtes
propices pour de nombreuses espèces de chauves-souris.
IV.2. Variabilité des habitats
Tsimembo-Manambolomaty Deux espèces de chauves-souris
frugivores ont été recensées lors de cette étude.
Vue que Pteropus rufus ont comme gîtes les arbres (Jenkins
et al., 2007 ; Rahaingodrahety et al., 2008 ; Johnson et
al., 2010), 12 individus de Pteropus rufus ont été
observés dans les branches de deux pieds de Cocos nucifera
situé en plein village. Concernant Rousettus
madagascariensis, elle se repose dans des caves, dans des crevasses
(Goodman et al., 2010), mais leurs gîtes n'étaient pas
identifiés durant cette étude.
Pour les espèces animalivores, sept espèces ont
été inventoriées :
Durant les études antérieures, Taphozous
mauritianus a été rencontrée dans des arbres, sur des
fissures de rochers et sur des murs de bâtiments (Kofoky et al.,
2007 ; Goodman & Ramasindrazana, 2013). Dans cette AP, deux individus de
cette espèce ont été vues sur le tronc d'un Cocos
nucifera durant le jour où elle change de pied à un autre
lorsqu'elle est dérangée, mais des dizaines d'individus ont
été capturé pendant l'heure de piégeage.
A propos des Vespertilionidae : Scotophilus marovaza
se gîte dans les toits de maison fabriqué en palmiers
(Ratrimomanarivo, 2005) mais leur dortoir n'était pas identifié
lors de cette inventaire, elles ont été capturé dans des
forêts de Musa sinensis. De même pour
30
Scotophilus robustus qui a été aussi
capturé dans des forêts de Musa sinensis, Myotis
goudoti capturés en plein forêts et Pipistrellus
spp. piégés dans des forêts
dégradées, leurs dortoirs n'étaient pas
identifiés. Selon Ratrimomanarivo (2005), Scotophilus robustus
est une espèce synanthropique vivant dans les toits des
bâtiments. Pour le cas de Myotis goudoti, elle se gîte sur
des rochers (Jenkins et al., 2007), et pour Pipistrellus spp.
certaines espèces comme Pipistrellus raceyi est une
espèce synanthropique qui a comme gîte les toits des
bâtiments (Rasoanoro et al., 2015).
Concernant les Molossidae, Mops leucostigma abrite
les toits des bâtiments et dans les Cocos nucifera, même
que celle rencontrées dans le PN de Mantadia et dans la Réserve
Spéciale (RS) d'Analamazotra par Randrianandrianina et ses
collaborateurs (2006), mais cette espèce peut vivre dans le tronc
d'Andansonia madagascariensis avec Miniopterus manavi, dans
Cocos nucifera (Andriafidison et al., 2006) et dans un
Commiphora (Burseraceae) avec Mops midas (Rakotondramanana &
Goodman, 2011). Cette espèce vit aussi en sympatrie avec Mormopterus
jugularis, Chaerephon pumilus et Chaerephon leucogaster
(Andrianaivoarivelo et al., 2006). L'espèce Chaerephon
leucogaster utilise les bâtiments comme gîtes.
IV.3. Dimorphisme sexuel
Dans cette étude, la longueur de l'avant-bras des
individus de Mops leucostigma permet de différencier les
mâles des femelles de cette espèce à part le sexe.
Ramasindrazana (2008) affirme la présence de dimorphisme pour tous les
paramètres mesurés sauf pour l'avant-bras, tandis que
(Rakotonandrasana, 2008) montre une différence entre les deux sexes pour
tous les caractères mesurés. Cette absence au niveau des
résultats peut-être dû au fait que les individus proviennent
des populations différentes ou à une grande différence
entre les nombres des mâles et des femelles capturées.
L'espèce Taphozous mauritianus présente
un dimorphisme sexuel au niveau de la longueur de l'avant-bras et du poids. Par
contre, la recherche faite par Dengis (1996) montre que cette
espèce ne présente aucun dimorphisme sexuel et que la taille des
individus varie d'un pays à un autre. A part les caractères
morphométriques, la présence de sac gulaire permet de distinguer
les mâles des femelles. Cette différence est due à la
variation du milieu et à la différence entre le nombre des
individus mâles (quatre individus) et femelles (17 individus).
IV.4. 31
Reproduction
Un individu de Mops leucostigma et unindividu de
Chaerephon leucogaster étaient en période de gestation
lors de l'étude, et un individu mâle de Mops leucostigma
possédait un épididyme contourné. C'est-à-dire
que pendant la saison sèche (septembre-octobre), ces espèces sont
en pleine période de reproduction. Pourtant la recherche faite par
(Rasoanoro, 2014) affirme que Mops leucostigma est en période
de gestation pendant la saison des pluies (janvier-février).Mops
leucostigma pourrait alors se reproduire à n'importe quelle
saison.
Parmi les individus de Taphozous mauritianus
étudiés, aucun d'entre eux n'a montré un signe de
reproduction. Mais d'autres recherches montrent que la période de
reproduction varie selon les pays. A titre d'exemple, au Zambie et au
Zaïre du sud-ouest, la naissance se passe au mois de février,
tandis qu'au Tanzanie, au Kenya et au nord du Zaïre, la mise bas se passe
au mois d'avril et mai et au Zanzibar, le mois d'octobre et novembre (Anciaux
de Faveaux, 1983).
Pendant la descente sur terrain, aucun signe de reproduction
n'a été observé chez les individus de Rousettus
madagascariensis capturés, la saison sèche serait une
période qui n'est pas favorable pour la procréation de cette
espèce. De plus, le résultat de (Andrianaivoarivelo, 2012) montre
que les femelles allaitantes sont nombreuses en saison de pluie, mais
néanmoins il y a quelques individus allaitants pendant les autres
saisons.
IV.5. Régime alimentaire
Les analyses montrent que les espèces dont les pelotes
fécales qui ont été étudiées consomment tous
des Coléoptères mais avec une proportion variée.
Pour Taphozous mauritianus, les individus sont
capturées juste durant leur sortie dans leur gite, c'est-à-dire
avant la chasse, ce qui explique le faible nombre des pelotes
collectées, et probablement que ces dernières sont les restes du
repas de la dernière chasse. Le résultat de l'analyse a
montré que la majorité des fèces est composé de
Coléoptères. Par rapport aux autres espèces de même
genre comme Taphozous melanopogon, une espèce existant en Inde,
en Thaïlande et en Chine d'une part, et Taphozous longimanus qui
se trouve en Thaïlande d'autre part, la consommation des
Lépidoptères, des Hémiptères et des
Coléoptères est un point commun chez eux mais avec des
quantités différentes (Srinivasulu & Srinivasulu, 2005 ; Wei
et al., 2008 ; Weterings et al., 2015). En comparant avec
Taphozous melanopogon, Taphozous mauritianus ne consomme que
peu d'ordres, vu que cette espèce de l'Inde mange
32
11 ordres d'Arthropodes et que le Taphien collecté
à Madagascar ne mange que quatre ordres. Cette différence est due
à la différence au niveau de l'espèce et du milieu.
Dans cette recherche, l'analyse fécale montre que
Scotophilus robustus consomme plus les Coléoptères,
résultat qui est à peu près le même que celui obtenu
par Rasoanoro et ses collaborateurs (2015) à Kianjavato. La
différence avec cette étude réside dans le fait que
Scotophilus robustus ne mange que des Coléoptères, des
Diptères et des Hyménoptères alors que celle de la
population de Kianjavato, en plus de ces taxa l'espèce mange en plus des
Araneae, des Lépidoptères et des Orthoptères. La
différence au niveau du régime alimentaire est Ce qui est due
à la variation saisonnière, à la variation de l'habitat et
aux conditions du milieu (température, types de forêts).
Rakotondramanana et ses collaborateurs (2015) ont aussi fait des études
sur le régime alimentaire de cette espèce à Kirindy
CNFEREF. Et même si Tsimembo-Manambolomaty, se trouve aussi dans la
région de Menabe, les résultats sont très
différents car la recherche menée à Kirindy montre que
Scotophilus robustus a une préférence pour les
Lépidoptères et en plus consomment des Blattes et des
Homoptères mais ne mange pas de Diptères. Cette différence
est due à la variation saisonnière, car la présente
étude a été faite pendant la saison sèche alors que
l'étude antérieure a été faite pendant la saison
humide, alors que les arthropodes sont abondants pendant la saison humide.
Les pelotes fécales de Myotis goudoti
contenaient, avec une proportion qui est à peu près la
même pour les Lépidoptères et les
Coléoptères. Par contre, le résultat d'analyse
menée par Rakotoarivelo et ses collaborateurs (2007) dans le PN de
Bemaraha montre une préférence pour les Coléoptères
et où M. goudoti ne mange pas de Lépidoptères et
d'Isoptères (comme le cas de cette étude). Seuls les
Coléoptères et les Hyménoptères sont les proies en
commun qui sont à la fois identifiés dans les pelotes
fécales des individus provenant du PN de Bemaraha et de la forêt
de Tsimembo-Manambolomaty. Ceci est dû à la variation de
l'habitat. L'étude faite par Rakotondramanana et ses collaborateurs
(2015) à Kirindy montre une proportion élevée pour les
Lépidoptères, suivi de Coléoptères et une faible
consommation pour les Hyménoptères ; résultat causé
par la variation saisonnière. Celle réalisée par Rasoanoro
et ses collaborateurs (2015) à Kianjavato montre que M. goudoti
consomme les mêmes proies que celle des individus de
Tsimembo-Manambolomatymais de quantité différentes. Cela est
probablement causé par la variation saisonnière.
33
Pour Pipistrellus spp., le résultat
de l'analyse fécale montre une grande proportion pour les
Coléoptères. En comparant cette étude avec celle de
Ramasindrazana (2008), les individus capturés lors de la présente
étude semblent exploiter une grande variété de proies mais
ne consomme pas de Dictyoptères. Ceci s'explique par l'absence de cet
ordre dans l'environnement, car durant l'inventaire il n'y avait pas de
Dictyoptères capturées. Comparé à celui de
Rasoanoro et ses collaborateurs (2015), le résultat est à peu
près la même mais la quantité identifiée les
différencie. Cette différence est due à la disposition et
à la quantité des proies dans la nature.
34
CONCLUSION ET PERSPECTIVES
Cette étude en chauves-souris qui est la
première à être réalisée dans l'AP Complexe
Tsimembo-Manambolomaty pendant la saison sèche a permis d'obtenir un
aperçu de la faune chiroptérologique de ce site en mettant en
exergue la biologie et l'écologie des chauves-souris qui y existe. Des
données sur la diversité spécifique, le régime
alimentaire et la reproduction ont été récoltés
afin de combler les informations sur l'histoire naturelle des chauves-souris de
Madagascar surtout dans la région occidentale. Les résultats ont
été obtenus grâce aux inventaires réalisés
dans 16 sites situées dans l'AP, aux différentes dissections et
mensurations suite aux captures réalisées dans les sites qui ont
été choisis à partir des enquêtes faites
auprès des populations locales et des reconnaissances au niveau des
sites.
Neuf espèces de chiroptères ont
été recensées, dont huit capturées (Rousettus
madagascariensis, Taphozous mauritianus, Myotis goudoti,
Pipistrellus spp., Scotophilus marovaza, Scotophilus
robustus, Mops leucostigma, Chaerephon leucogaster) et
uneespèce observée dans son gîte diurne (Pteropus
rufus). Parmi ces espèces, plusieurs individus de Taphozous
mauritianus ont été capturés, cette capture va
permettre d'étudier la biologie et l'écologie de ce taxon, qui
est la première à Madagascar. En comparant la richesse
spécifique de chauves-souris de la région occidentale de
Madagascar par rapport à Tsimembo-Manambolomaty, cette dernière
possède moins d'espèces.
Parmi toutes les espèces recensées, Mops
leucostigma et Taphozous mauritianus présente un
dimorphisme sexuel. Il a été démontré
également que la reproduction des chauves-souris peut varier suivant les
espèces et les localités, pour le cas des Molossidae, la
gestation peut se passer pendant la saison sèche.
L'étude sur les régimes alimentaires a
montré que la consommation des proies dépend de la
préférence alimentaire de chaque espèce et de la
disponibilité des proies. Le résultat des analyses ont
montré que la majorité des espèces capturées se
nourrissent des Coléoptères mais avec de proportion varié.
La consommation des proies se diffèrent aussi par la longueur de
l'avant-bras.
Toutefois, cette recherche présente quelques limites.
Premièrement, vu que l'étude n'était
réalisée que pendant la saison sèche, l'étude n'est
pas suffisante pour capturer les espèces présentes dans la
localité. Deuxièmement, certains individus n'ont pas pu
être capturés mais
35
seulement observés. Troisièmement, l'analyse des
pelotes fécales ne permet pas de bien déterminer le régime
alimentaire des espèces, car la majorité des proies sont tous non
identifiables après digestion.
Afin de pouvoir capturer la majorité des espèces
existantes, d'autres techniques seraient nécessaires. Concernant
l'identification de l'espèce, l'utilisation d'un détecteur
ultrasonique pour l'identification des fréquences d'émissions de
chaque espèce serait utile, sans oublier les études
génétiques, car deux espèces morphologiquement semblables
pourraient être génétiquement différentes.
L'AP Complexe Tsimembo-Manambolomaty possède encore des
forêts intactes, mais la plupart des espèces qui s'y trouvent sont
menacées, comme le cas des chauves-souris. Ces dernières sont
reconnues comme gibier (Rakotoarivelo et al., 2011) et
considérées comme des animaux nuisibles et maléfiques, ce
qui sont les causes de leur capture, or quelques espèces de
chauves-souris sont utiles dans la réduction de nombres d'insectes
transmetteurs de maladie (Patterson et al., 2003) et joue aussi un
rôle dans la pollinisation de certaines plantes(Von Helversen &
Winter, 2003), ainsi des mesures de conservation sont alors nécessaires
pour la conservation de ces groupes d'animaux. La sensibilisation des
populations locales en leur expliquant les effets néfastes de la
disparition et la surpopulation de ces types de mammifères sont
indispensables. Des suivis aussi sont utiles pour voir leur évolution
afin de prendre les décisions nécessaires pour leur
sauvegarde.
36
BIBLIOGRAPHIE
Anciaux de Faveaux, M. (1983). Les cycles annuels de
reproduction chez les chiroptères phytophiles au Shaba (S.E. Zaire) et
au Rwanda. Koninklijk Museum voor Midden-Afrika Tervuren Belgie Annalen
Zoologische Wetenschappen, 237, 27-34.
Andriafanomezantsoa, E. T. (2012). Analyse de
l'application des schémas d'aménagement de la Nouvelle Aire
Protégée Manambolomaty en vue d'une amélioration dans la
gestion des ressources naturelles existantes. (Mémoire
d'Ingéniorat en Sciences Agronomiques), Université
d'Antananarivo, Madagascar.
Andriafidison, D., Andrianaivoarivelo, R. A. & Jenkins, R.
K. B. (2006). Records of tree roosting bats from western Madagascar.
African Bat Conservation News, 8, 5-6.
Andriafidison, D., Kofoky, A., Mbohoahy, T., Racey, P. A.
& Jenkins, R. K. B. (2007). Diet, reproduction and roosting habits of the
Madagascar free-tailed bat, Otomops madagascariensis Dorst, 1953
(Chiroptera: Molossidae). Acta Chiropterologica, 9,
445-450.
Andrianaivoarivelo, R., Ranaivoson, N., Racey, P. &
Jenkins, R. K. B. (2006). The diet of three synanthropic bats (Chiroptera:
Molossidae) from eastern Madagascar. Acta Chiropterologica, 8,
439-444.
Andrianaivoarivelo, R., Ramilijaona, O. & Andriafidison,
D. (2007). Rousettus madagascariensis Grandidier 1929 feeding on
Dimocarpus longan in Madagascar. African Bat Conservation News,
11, 3-4.
Andrianaivoarivelo, R., Ramilijaona, O., Racey, P.,
Razafindrakoto, N. & Jenkins, R. K. B. (2011). Feeding ecology, habitat use
and reproduction of Rousettus madagascariensis Grandidier, 1928
(Chiroptera: Pteropodidae) in eastern Madagascar. Mammalia, 75,
69-78.
Andrianaivoarivelo, R. A., Andrafidison, D., Rahaingonirina,
C., Raharimbola, S., Rakotoarivelo, A., Ramilijaona, O. R., Racey, P. A. &
Jenkins, R. K. B. (2011). A conservation assessment of Rousettus
madagascariensis (G. Grandidier, 1928, Pteropodidae) roosts in eastern
Madagascar. Madagasar Conservation & Development, 6, 78-82.
Andrianaivoarivelo, R. A. (2012). Ecologie et population
de Rousettus madagascariensis G. Grandidier, 1928 (Pteropodidae).
(Thèse de Doctorat), Université de Rennes, France.
37
Andrianaivoarivelo, R. A., Petit, E. J., Razafindrakoto, N.
& Racey, P. A. (2012). Alimentation et dispersion de graines chez
Rousettus madagascariensis G. Grandidier 1928, dans le Nord-Ouest de
Madagascar. Annual Review of. Ecology and Systematics. (Terre Vie),
67, 179-191.
Battistini, R. (1996). Paléogéographie et
variété des milieux naturels à Madagascar et dans les
îles voisines : quelques données de base pour l'étude
biogéographique de la « Région Malgache ». In W. R.
Lourenço. (Ed.), Biogéographie de Madagascar. (pp.
1-17).
Bousquet, B. & Rabetaliana, H. (1992). Site du
patrimoine mondial des Tsingy de Bemaraha et autres sites
d'intérêt biologique et écologique du fivondronana
d'Antsalova.
Calisher, C. H., Childs, J. E., Field, H.E., Holmes, K.V.
& Schountz, T. (2006). Bats: Important reservoir hosts of emerging viruses.
Clinical Microbiology Reviews, 19, 531-545. Dengis, C. A. (1996).
Taphozous mauritianus. Mammalian Species . 522, 1-5.
Dytham, C. (2011). Choosing and using statistics: A
Biologist's Guide. (3rd ed.).
Eger, J. L. & Mitchell, L. (1996). Biogeography of bats of
madagascar. In W. R. Lourenço (Ed.), Biogeography of Madagascar.
(pp. 321-328). Paris: Edition de l'Orstom.
Eger, J. L. & Mitchell, L. (2003). Chiroptera. In J. P.
Benstead. & S. M. Goodman. (Eds.), The natural history of Madagascar.
(pp. 1287-1298). Chicago: The University of Chicago Press.
Elouard, J. M., Gibon, F. M. & Gattolliat, J. L. (2008).
Les invertébrés aquatiques. In S. M. Goodman. (Ed.), Paysages
naturels et biodiversité de Madagascar. (pp. 213-226). Paris:
Museum national d'Histoire naturelle.
Fisher, B. L. & Penny, N. D. (2008). Les arthropodes. In
S. M. Goodman. (Ed.), Paysages naturels et biodiversité de
Madagascar. (pp. 183-212). Paris: Muséum national d'Histoire
naturelle.
Furey, N. & Racey, P. A. (2016). Conservation ecology of
cave bats. In V. Christian. & K. Tigga. (Eds.), Bats in the
Anthropocene: Conservation of bats in a changing world. (1st
ed., pp. 463-500): Springer.
Gautier, L., Goodman, S. M. & Raherilalao, M. J. (2013).
La forêt de Beanka, Région Melaky, Ouest de Madagascar :
Introduction et présentation du milieu, Malagasy Nature : 7 :
313).
38
Gautier, L. & Goodman, S.M. (2008). Introduction à
la flore. In S. M. Goodman. (Ed.), Paysages naturels et biodiversité
de Madagascar. (pp. 103- 140). Paris: Muséum national d'Histoire
naturelle.
Glaw, F. & Vences, M. (2008). Les amphibiens. In S. M.
Goodman (Ed.), Paysages naturels et biodiversité de Madagascar.
(pp. 311-340). Paris: Museum national d'Histoire naturelle.
Goodman, S. M. (2008). Introduction. In S. M. Goodman
(Ed.), Paysages naturels et
biodiversité de Madagascar. (pp. 19-56).
Paris: Museum national d'Histoire naturelle. Goodman, S. M. (2011). Les
chauves-souris de Madagascar. Antananarivo: Association
Vahatra.
Goodman, S. M., Andriafidison, D., Andrianaivoarivelo, R.,
Cardiff, S. G., Ifticene, E., Jenkins, R. K. B., Kofoky, A., Tsibara, M.,
Rakotondravony, D., Ranivo, J., Ratrimomanarivo, F., Razafimanahaka, J. &
Racey, P. A. (2005). The distribution and conservation of bats in the dry
regions of Madagascar. Animal Conservation, 8, 153-165.
Goodman, S. M. & Hawkins., F. A. (2008). Les oiseaux. In
S. M. Goodman (Ed.), Paysages naturels et biodiversité de
Madagascar. (pp. 383-384). Paris: Museum national d'Histoire naturelle.
Goodman, S. M., Chan, L. M., Nowak, M. D. & Yoder, A. D.
(2010). Phylogeny and biogeography of western Indian Ocean Rousettus
(Chiroptera: Pteropodidae). Journal of Mammalogy, 91, 593 -
606.
Goodman, S. M., Ganzhorn, J.U. & Rakotondravony, D.
(2008). Les Mammifères. In S. M. Goodman (Ed.), Paysages Naturels et
Biodiversité de Madagascar. (pp. 435-484). Paris: Muséum
national d'Histoire naturelle.
Goodman, S. M., Ramasindrazana, B. (2013). Bats or the order
Chiroptera. In S. M. Goodman.&M. J. Raherilalao. (Eds.), Atlas of
selected land vertebrates of selected land vertebrates of Madagascar. (pp.
169-209). Antananarivo: Association Vahatra.
Goodman, S. M., Rakotondramanana, C. F., Ramasindrazana, B.,
Kearney, T., Monadjem, A., Schoeman, M. C., Taylor, P. J., Naughton, K. &
Appleton, B. (2015a). An integrative approach to characterize Malagasy bats of
the subfamily Vespertilioninae Gray, 1821, with the description of a new
species of Hypsugo. Zoological Journal of the Linnean Society,
173, 988-1018.
39
Goodman, S. M., Ramasindrazana, B., Naughton, K. &
Appleton, B. (2015b). Description of a new species of the Miniopterus
aelleni group (Chiroptera: Miniopteridae) from upland areas of central and
northern Madagascar. Zootaxa, 3936, 538-558.
Goodman, S. M., Razakaratrimo, S. V. J. & René de
Roland. L.-A. (2015c). An Analysis of Bat Hawk Macheiramphus alcinus
diet in the Melaky Region of lowland western Madagascar. Ostrich,
87(1), 77-80.
Goodman, S. M., Ramasindrazana, B., Maminirina, C. P.,
Schoeman, M.C. & Appleton, B. (2011). Morphological, bioacoustical, and
genetic variation in Miniopterus bats from eastern Madagascar, with
the description of a new species. Zootaxa, 2880, 1-19.
Goodman, S. M., Schoeman, M. C., Rakotoarivelo, A. &
Willows-Munro, S. (2016). How many species of Hipposideros have
occurred on Madagascar since the Late Pleistocene? Zoological Journal of
the Linnean Society, 177, 428-449.
Goodman, S. M., Taylor, P. J., Ratrimomanarivo, F. &
Hoofer, S. (2012). The genus Neoromicia (Family Vespertilionidae) in
Madagascar, with the description of a new species. Zootaxa, 3250,
1-25.
Griffiths, O. & Herbert, T. (2008). Les mollusques
terrestres et dulçaquicoles. In S. M. Goodman. (Ed.), Paysages
naturels et biodiversité de Madagascar. (pp. 227-248). Paris:
Museum national d'Histoire naturelle.
Hutson, M. & Racey, P. A. (2004). Examining bats. In A. P.
McLeish. J. Mitchell-Jones. (Ed.), Bat workers' manual.
(3rd ed., pp. 49-58).
IUCN. (2015). The IUCN Red List of Threatened Species.
Retrieved 26 May, 2016, from
http://www.iucnredlist.org/search
Jenkins, R. K. B., Andriafidison, D., Razafimanahaka, H. J.,
Rabearivelo, A., Razafindrakoto, N., Ratsimandresy, Z., Andrianandrasana, R.
B., Razafimahatratra, E. & Racey, P. A. (2007). Not rare, but threatened:
the endemic Madagascar flying fox Pteropus rufus in a fragmented
landscape. Oryx, 41, 263-271.
Jenkins, R. K. B. & Racey, P. A. (2008). Bats as bushmeat
in Madagascar. Madagasar Conservation & Development, 3, 22-30.
Johnson, S. A., Perryman, R. J. Y., Steer, M. D. & Belle,
E. M. S. (2010). Observations of a Pteropus rufus colony in a dry
deciduous forest fragment of northern Madagascar. African Bat Conservation
News, 23, 3-5.
40
Kofoky, A., Andriafidison, D., Ratrimomanarivo, F.,
Razafimanahaka, J., Rakotondravony, D., Racey, P. & Jenkins, R. K. B. .
(2007). Habitat use, roost selection and conservation of bats in Tsingy de
Bemaraha National Park, Madagascar. Biodiversity Conservation, 16,
1039-1053.
Kunz, T. H. (1982). Roosting ecology of bats. In T. H. Kunz.
(Ed.), Ecology of bats. (pp. 1-55). Kunz, T. H. & Kurta. A.
(1988). Capture methods and holding devices. In T. H. Kunz. (Ed.),
Ecological and behavioral methods for the study of bats.
(pp. 1-29). Washington, D.C:
Smithsonian Institution Press.
Morris, P. & Hawkins, A. F. A. (1998). Birds of
Madagascar. A Photographic Guide.: Pica Press.
Neuweiler, G. (2000). The Biology of bats.: Oxford
University Press.
Nicoll, M. E. & Langrand, O. (1989). Madagascar: Revue
de la Conservation et des Aires Protégées.Switzerland: World
Wildlife Fund for Nature, Gland.
Patterson, B. D., Willig, M. R & Stevens,R. D. (2003).
Niche partitioning, and patterns of ecological organization. In M. B. Fenton.
& T. H. Kunz. (Eds.), Bat Ecology. (pp. 346- 397). Chicago:
University of Chicago Press.
Pavey, C. R. & Burwell, C. J. (2000). Foraging ecology of
three species of hipposiderid bats in tropical rainforest in north-east
Australia. Wildlife Research, 27, 283-287.
Peterson, R. L., Eger, J. L. & Mitchell, L. (1995).
Chiroptères. Faune de Madagascar. (Vol. 84). Paris: Muséum
National d'Histoire Naturelle.
Projet ZICOMA., P. (1999). Les zones d'importance pour la
conservation des oiseaux à Madagascar. Projet Zicoma.
Racey, A. P. (1988). Reproductive assessment in bats. In T. H.
Kunz. (Ed.), Ecological and Behavioral Methods for the study of bats.
(1st ed., pp. 31-45). Washington. D. C: Smithsonian Institution
Press.
Rahaingondrahety, V. N., Andriafidison, D., Ratsimbazafy, J.
H., Racey, P. A. & Jenkins, R. K. B. (2008). Three flying fox
(Pteropodidae: Pteropus rufus) roosts, three conservation challenges
in southeastern Madagascar. Madagascar Conservation & Development,
3, 17-21.
Raheriarisena, M. (2005). Régime alimentaire de
Pteropus rufus(Chiroptera : Pteropodidae) dans la région
sub-aride du sud de Madagascar. Revue d'écologie, 60,
255-264.
41
Raherilalao, M. J. & Goodman, S. M. (2012). Histoire
naturelle des familles et sous familles endémiques d'oiseaux de
Madagascar. Madagascar: Association Vahatra.
Rakotoarivelo, A. R., Ranaivoson, N., Ramilijaona, O. R.,
Kofoky, A. F., Racey, P. A. & Jenkins, R. K. B. (2007). Seasonal food
habits of five sympatric forest microchiropterans in Western Madagascar.
Journal of Mammalogy, 88, 959-966.
Rakotoarivelo, A. R., Razafimanahaka, J. H., Rabesihanaka, S.,
Jones, J. P. G. & Jenkins, R. K. B. (2011). Lois et règlements sur
la faune sauvage à Madagascar : Progrès accomplis et besoins du
futur. Madagascar conservation & development, 6(1), 37-44.
Rakotonandrasana, R. E. (2008). Etudes faunistiques et
biogéographiques des chauves-souris dans les îles de Nosy Be, de
Nosy Komba et de Sainte-Marie. (Mémoire de Diplôme d'Etudes
Approfondies), Université d'Antananarivo, Madagascar.
Rakotondramanana, C. F. & Goodman, S. M. (2011).
Inventaire de chauves-souris dans la concession forestière de Kirindy
CNFEREF, Morondava, Madagascar. Malagasy Nature, 5, 109-120.
Rakotondramanana, C. F., Rajemison, B. & Goodman, S. M.
(2015). Comportement alimentaire des communautés de chauves-souris
animalivores de Kirindy (CNFEREF) et d'Antsahabe, Madagascar :
répartition, partage et disponibilité de niche alimentaire.
Malagasy Nature, 9, 68-87.
Ramasindrazana, B. (2008). Aperçu de la biologie de
reproduction, du régime alimentaire et de l'écologie des
populations de chauves-souris (microchiroptera) dans la station
forestière d'Ivoloina, Région Atsinanana. (Mémoire de
Diplôme d'Etudes Approfondies), Université d'Antananarivo,
Madagascar.
Ramasindrazana, B. (2009). Bat inventory of the Ivoloina
Foresty Station, Atsinanana Region, Madagascar. African Bat Conservation
News, 21, 7-10.
Ramasindrazana, B., Rajemison, B. & Goodman, S. M. (2009).
The diet of the endemic bat Myzopoda aurita (Myzopodidae) based on
fecal analysis. Malagasy Nature, 2, 159-163.
Ramasindrazana, B., Rajemison. & Goodman, S. M. (2012).
Bio-écologie des chauves-souris du Parc National de Tsimanampetsotsa. 2.
Variation interspécifique et saisonnière du régime
alimentaire. Malagasy Nature, 6, 117-124.
Randrianandrianina, F., Andriafidison, D., Kofoky, A. F.,
Ramilijaona, O., Ratrimomanarivo, F., Racey, P. A. & Jenkins, R. K. B.
(2006). Habitat use and
42
conservation of bats in rainforest and adjacent human-modified
habitats in eastern Madagascar. Acta Chiropterologica, 8, 429-437.
Rasamoelina, A. D. (2000). Contribution à
l'étude de la faune ichtyologique du complexe des trois lacs : Befotaka,
Soamalipo et Ankerika dans la région d'Antsalova. (Mémoire
de Diplôme d'Etudes Approfondies), Université d'Antananarivo,
Madagascar.
Rasoanoro, M. (2014). Bio-ecologie des chauves-souris de
Kianjavato, Région Vatovavy Fitovinany. (Mémoire de
Diplôme d'Etudes Approfondies), Université d'Antananarivo,
Madagascar.
Rasoanoro, M., Ramasindrazana, B., Rajemison, B.,
Razafimahatratra, E. & Goodman, S. M. (2015). Préférence
alimentaire des chauves-souris de Kianjavato, région de
Vatovavy-Fitovinany, Madagascar. Malagasy Nature, 9, 58-67.
Ratrimomanarivo, F. H. (2005). The first records of the
synanthropic occurrence of Scotophilus spp. on Madagascar. African
Bat Conservation News, 6, 3-4.
Ratrimomanarivo, F. H. (2007). Etude du régime
alimentaire d'Eidolon dupreanum (Chiroptera : Pteropodidae) dans la
région anthropisée des hautes terres du centre de Madagascar.
Revue d'écologie, 62, 229-244.
Ratsoavina, F. & Ravelomanana, T. (2014). Mise
à jour des données sur les espèces et évaluation
des stocks des poissons des quatre lacs (Soamalipo, Befotaka, Ankerika et
Masama) au sein de la AP Tsimembo-Manambolomaty, District d'Antsalova. The
Peregrine Fund, Madagascar.
Razafimahatratra, B. (2011). Inventaire des reptiles et
des amphibiens dans le complexe Tsimembo-Manambolomaty. The Peregrine
Fund, Madagascar.
Razafimanjato, G. (2011). Conservation de l'aigle
pêcheur de Madagascar Haliaeetus vociferoides Desmurs, 1845 : Etude
bio-écologique et impacts de l'application de la « Gelose ».
(Thèse de Doctorat), Université d'Antananarivo,
Madagascar.
Razakarivony, V., Rajemison, B. & Goodman, S. M. (2005).
The diet of Malagasy Microchiroptera based on stomach contents. Mammalian
Biology, 70, 312-316.
Robert, J. C. (1992). Le piège Entomologique Composite
(P.E.C.): une technique d'échantillonnage à large spectre de
l'entomofaune terrestre circulante. Bulletin de la société
entomologique Suisse, 65, 395-411.
Shiel, C., McAney, C., Sullivan, C. & Fairley, J. (1997).
Identification of arthropod fragments in bat droppings.: Mammal
Society Occasional Publications.
43
Simmons, N. B. (2005a). Order Chiroptera. In D. M. Reeder.
& D. E. Wilson. (Eds.), Mammal species of the World: a taxonomic and
geographic reference. (3rd ed., pp. 312-529). Baltimore: Johns
Hopkins University Press.
Simmons, N. B. (2005b). An Eocene big bang for bats.
Science, 307, 527-528.
Simmons, N. B. & Geisler, J.H. (1998). Phylogenetic
relationships of Icaronycteris, Archaeonycteris,
Hassianycteris, and Palaeochiropteryx to extant bat lineages,
with comments on the evolution of echolocation and foraging strategies in
Microchiroptera. Bulletin of the American Museum of Natural History,
235, 1-152.
Soarimalala, V. & Goodman, S. M. (2011). Les petits
mammifères de Madagascar. Antananarivo: Association Vahatra.
Srinivasulu, B. & Srinivasulu, C. (2005). Diet of the
black-bearded tomb bat Taphozous melanopogon Temminck, 1841
(Chiroptera:Emballonuridae) in India. Zoos' print journal, 20,
1935-1938.
Teeling, E. C., Maden, O., Van Den Bussche, R. A., De Jong, W.
W., Stanhope, M. J. & Springer, M. S. (2002). Microbat paraphyly and the
convergent evolution of a key innovation in Old World Rhinolophoid microbats.
Proceedings of the National Academy of Sciences of the United States of
America, 99, 1431-1436.
Teeling, E. C., Springer, M. S., Madsen, O., Bates, P., Brien,
S. J. O. & Murphy, W. J. (2005). amolecular phylogeny for bats illuminates
biogeography and the fossil record. Science, 307, 580-584.
The Peregrine Fund. (2013). Plan d'aménagement et
de gestion de la Nouvelle Aire Protégée de
Tsimembo-Manambolomaty.
Von Helversen, O. & Winter, Y. (2003). Glossophagine bats
and their flowers : Costs and benefits for plants and pollinators. In M. B.
Fenton. & T. H. Kunz. (Eds.), Bat Ecology. (pp. 536-579). Chicago:
University of Chicago Press.
Wei, L., Han, N., Zhang, L., Helgen, K. M., Parsons, S., Zhou,
S. & Zhang, S. (2008). Wing morphology, echolocation calls, diet and
emergence time of black-bearded tomb bats (Taphozous melanopogon,
Emballonuridae) from southwest China. Acta Chiropterologica, 10,
51-59.
Weterings, R., Wardenaar, J., Dunn, S. & Umponstira, C.
(2015). Dietary analysis of five insectivorous bat species from Kamphaeng Phet,
Thailand. Raffles bulletin of zoology, 63, 91-96.
44
Whitaker, J. O., Mccracken, G. F. & Siemers, B. M. (2009).
Food habits analysis of insectivorous bats. In T. H. Kunz. & Parsons, S.
(Eds.), Ecological and behavioural methods for the study of bats.
(2nd ed., pp. 567-592). Baltimore: The Johns Hopkins University
Press.
Wilmé, L., Goodman, S. M. & Ganzhorn, J. U. (2006).
Biogeographic evolution of Madagascar's microendemic biota. Science,
312, 1063-1065.
I
ANNEXES
Annexe 1. Statut UICN des espèces de
chauves-souris de Madagascar
|
Famille
|
Espèces
|
Statut UICN
|
|
PTEROPODIDAE
|
Eidolon dupreanum*
|
Vulnérable
|
|
Pteropus rufus*
|
Vulnérable
|
|
Rousettus madagascariensis*
|
Vulnérable
|
|
HIPPOSSIDERIDAE
|
Hipposideros commersoni*
|
Quasi menacée
|
|
Hipposideros cryptovaloronaa *
|
Données insuffisantes
|
|
RHINONYCTERIDAE
|
Paratriaenops auritus*
|
Vulnérable
|
|
Paratriaenops furculus*
|
Préoccupation mineure
|
|
Triaenops menamena*
|
Préoccupation mineure
|
|
EMBALLONURIDAE
|
Taphozous mauritianus
|
Préoccupation mineure
|
|
Coleura kibomalandy
|
Préoccupation mineure
|
|
Paraemballonura tiavato*
|
Préoccupation mineure
|
|
Paraemballonura atratra*
|
Préoccupation mineure
|
|
NYCTERIDAE
|
Nycteris madagascariensis*
|
Données insuffisantes
|
|
MYZOPODIDAE
|
Myzopoda aurita*
|
Préoccupation mineure
|
|
Myzopoda schliemanni*
|
Préoccupation mineure
|
|
MOLOSSIDAE
|
Chaerephon atsinanana*
|
Données insuffisantes
|
|
Chaerephon jobimena*
|
Préoccupation mineure
|
|
Chaerephon leucogaster*
|
Préoccupation mineure
|
|
Mops leucostigma*
|
Préoccupation mineure
|
|
Mops midas
|
Préoccupation mineure
|
|
Mormopterus jugularis*
|
Préoccupation mineure
|
|
Otomops madagascariensis*
|
Préoccupation mineure
|
|
Tadarida fulminans
|
Préoccupation mineure
|
|
VESPERTILIONIDAE
|
Eptesicus matroka*
|
Préoccupation mineure
|
|
Scotophilusborbonicus
|
Données insuffisantes
|
|
Scotophilus marovaza*
|
Préoccupation mineure
|
|
Scotophilus robustus*
|
Préoccupation mineure
|
|
Scotophilus tandrefana*
|
Données insuffisantes
|
|
Pipistrellus hesperidus
|
Préoccupation mineure
|
|
Pipistrellus raceyi*
|
Données insuffisantes
|
|
Hypsugo bemainty*
|
Données insuffisantes
|
|
Neoromicia malagasyensis*
|
En danger
|
|
Neoromicia capensis
|
Préoccupation mineure
|
|
Neoromicia robertsi*
|
Données insuffisantes
|
|
Myotis goudoti*
|
Préoccupation mineure
|
II
Annexe 1 (Suite). Statut UICN des espèces
de chauves-souris de Madagascar
|
Famille
|
Espèces
|
Statut UICN
|
|
MINIOPTERIDAE
|
Miniopterus aelleni
|
Données insuffisantes
|
|
Miniopterus brachytragos*
|
Données insuffisantes
|
|
Miniopterus egeri*
|
Préoccupation mineure
|
|
Miniopterus ambohitrensis*
|
Données insuffisantes
|
|
Miniopterus gleni*
|
Préoccupation mineure
|
|
Miniopterus griffithsi*
|
Données insuffisantes
|
|
Miniopterus mahafaliensis*
|
Données insuffisantes
|
|
Miniopterus majori*
|
Préoccupation mineure
|
|
Miniopterus manavi*
|
Préoccupation mineure
|
|
Miniopterus petersoni*
|
Données insuffisantes
|
|
Miniopterus sororculus*
|
Préoccupation mineure
|
|
Miniopterus griveaudi
|
Préoccupation mineure
|
* : Espèces endémiques
III
Annexe 2. Répartition des espèces
de chauves-souris dans quelques sites de l'ouest
|
Espèces
|
PN d'Ankarana (1)
|
Anjohibe(1)
|
PN de Namoroka(1)
|
PN de Bemaraha(1)
|
Kirindy CNFEREF(1) (2)
|
Zombitse-Vohibasia(1)
|
PN de l' Isalo(1)
|
Kirindy-Mitea(1)
|
PN de Tsimanampetsotsa(1)
|
Tsimembo-Manambolomaty
|
|
Eidolon dupreanum
|
+
|
+
|
+
|
+
|
-
|
+
|
+
|
-
|
+
|
-
|
|
Pteropus rufus
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
+
|
-
|
+
|
|
Rousettus madagascariensis
|
+
|
+
|
+
|
+
|
-
|
-
|
+
|
+
|
-
|
+
|
|
Hipposideros commersoni
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
|
Paratriaenops auritus
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Paratriaenops furculus
|
-
|
+
|
+
|
+
|
-
|
-
|
-
|
+
|
+
|
-
|
|
Triaenops menamena
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
+
|
+
|
-
|
|
Paremballonura atrata
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Paremballonura tiavato
|
+
|
+
|
+
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Coleura kibomalandy
|
+
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Taphozous mauritianus
|
-
|
-
|
+
|
+
|
-
|
+
|
-
|
-
|
-
|
+
|
|
Myzopoda aurita
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Myzopoda schliemanni
|
-
|
+
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Chaerephon leucogaster
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
-
|
+
|
|
Chaerephon atsinanana
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Chaerephon jobimena
|
+
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
-
|
-
|
|
Mops leucostigma
|
+
|
-
|
+
|
+
|
+
|
+
|
-
|
+
|
-
|
+
|
|
Mops midas
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
-
|
-
|
|
Mormopterus jugularis
|
+
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
-
|
|
Otomops madagascariensis
|
+
|
+
|
+
|
+
|
-
|
-
|
+
|
-
|
-
|
-
|
|
Tadarida fulminans
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
|
Eptesicus matroka
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Scotophilus cf.
borbonicus
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
Annexe 2 (Suite).Répartition des
espèces de chauves-souris dans quelques sites de l'ouest
IV
Espèces
|
PN d'Ankarana(1)
|
Anjohibe(1)
|
PN de Namoroka(1)
|
PN de Bemaraha(1)
|
Kirindy CNFEREF(1) (2)
|
Zombitse-Vohibasia(1)
|
PN de l' Isalo(1)
|
Kirindy-Mitea(1)
|
PN de Tsimanampetsotsa(1)
|
Tsimembo-Manambolomaty
|
|
Scotophilus marovaza
|
-
|
+
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
+
|
|
Scotophilus robustus
|
-
|
+
|
+
|
+
|
-
|
+
|
-
|
-
|
-
|
+
|
|
Scotophilus tandrefana
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Pipistrellus spp.
|
-
|
+
|
-
|
-
|
+
|
-
|
-
|
+
|
-
|
+
|
|
Hypsugo anchietae
|
-
|
-
|
-
|
-
|
+
|
+
|
-
|
+
|
-
|
-
|
|
Hypsugo bemainty
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
|
Neoromicia malagasyensis
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
|
Neoromicia capensis
|
-
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
|
Neoromicia robertsi
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Myotis goudoti
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
+
|
-
|
+
|
|
Miniopterus aelleni
|
+
|
+
|
+
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Miniopterus brachytragos
|
-
|
-
|
+
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Miniopterus gleni
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
-
|
-
|
-
|
|
Miniopterus griveaudi
|
+
|
+
|
+
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Miniopterus mahafaliensis
|
-
|
-
|
-
|
-
|
-
|
-
|
+
|
+
|
+
|
-
|
|
Miniopterus majori
|
-
|
+
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Miniopterus manavi
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Total
|
17
|
18
|
19
|
18
|
13
|
10
|
13
|
12
|
6
|
9
|
+indique la présence de l'espèce
-indique l'absence de l'espèce
Pipistrellus spp. : rassemble Pipistrellus raceyi
et Pipistrellus hesperidus
(1) : Goodman, 2011
(2) : Goodman et al., 2015a
V
Annexe 3. Description et coordonnées des
sites
|
Sites
|
Coordonnées
géographiques
|
Description
|
Nombre de pièges et
caractéristiques
|
|
1
|
Ambereny 1
|
18°55,495'S; 44°23,180'E
|
plein village, végétation dominé par des
Cocos
nucifera et des Ceiba pentandra
|
deux filets de 6 m et un filet de 12 m
placés
à proximité d'un Cocos nucifera
|
|
2
|
Ambereny 2
|
18°55,550'S; 44°23,185'E
|
enceinte du village, auprès d'un petit
lac,
végétation dominé par des Mangifera indica
et des
Cocos nucifera
|
un filet de 6 m placé juste dans l'entrée
vers
le lac et un filet de 6m et de 12 m
installés tout autour.
|
|
3
|
Ambereny 3
|
18°55,522'S; 44°23,152'E
|
école au centre du village
|
Capture à la main
|
|
4
|
Ankivahivahy 1
|
19°01,168'S; 44°26,125'E
|
auprès du lac Soamalipo à côté du
campement
|
un filet de 6 m et deux filets de 12 m
placés
à travers les passages menant vers
le lac Soamalipo, et deux filets
de 12 m
installés perpendiculairement près du lac
et un
filet de 6m et de 12 m recoupaient
des chemins qui y dirigent.
|
|
5
|
Ankivahivahy 2
|
19°01,183'S; 44°26,246'E
|
auprès du lac Soamalipo à côté du
campement
|
un filet de 12 m recoupait un chemin
forestier
|
|
6
|
Antsakoramby
|
19°02,504'S; 44°25,860'E
|
Fumoir à poissons
|
Capture à la main
|
|
7
|
Antseranama 1
|
19°01,122'S; 44°26,388'E
|
près du lac Ankerika
|
un filet de 6 m et de 12 m placés autour de certaines
parties du lac Ankerika
|
|
8
|
Antseranama 2
|
19°00,942'S; 44°26,375'E
|
auprès du lac Ankerika
|
un filet de 6m et de 12 m placés autour de certaines
parties du lac Ankerika
|
VI
Annexe 3 (Suite). Description et coordonnées des
sites
|
Sites
|
Coordonnées
géographiques
|
Description
|
Nombre de pièges et
caractéristiques
|
|
9
|
Bemolaka
|
19°01,195'S; 44°26,157'E
|
passage forestier
|
un piège à harpe utilisé en recoupant
un
passage forestier
|
|
10
|
Mahatsinjo 1
|
19°04,230'S; 44°26,859'E
|
végétation dominé par des Musa
sinensis
|
deux filets de 6 m et un filet de 12 m
placés
à proximité des s.
|
|
11
|
Mahatsinjo 2
|
19°04,115'S; 44°26,818'E
|
végétation dominé par des Musa
sinensis
|
deux filets de 6 m et un filet de 12 m placés à
proximité des Musa sinensis
|
|
12
|
Masoarivo
|
19°01,623'S; 44°20,435'E
|
église en plein village
|
Filet papillon
|
|
13
|
Soatana
|
19°05,030'S; 44°29,293'E
|
mairie
|
Capture à la main
|
|
14
|
Soavala
|
19°00,822'S; 44°23,763'E
|
auprès du lac Befotaka
|
un filet de 6 m et de 12 m ont coupait des
passages
forestiers
|
|
15
|
Tseranandaka 1
|
18°50,035'S; 44°24,748'E
|
végétation dominé par des Musa
sinensis
|
un filet de 6 m recoupait un chemin près
du lac, un
filet de 12 m installé auprès des
bananiers et un filet de 6m
recoupait un
chemin forestier
|
|
16
|
Tseranandaka 2
|
18°50,295'S; 44°25,082'E
|
autour d'un lac à côté du Ficus
cocculifolia
|
un filet de 12 m placé près de
Ficus
cocculifolia et un filet 6 m auprès du lac
|
VII
Annexe 4. Mesures morphométriques des
espèces capturées dans l'AP : LT, LQ, LP, OR ; TR, AB (mm), Poids
(g)
|
Espèces
Taphozous mauritianus
|
Sexe
Mâle
|
LT
105,5#177; 4,5
101,0-
110,0
(n=2)
|
LQ
23,5#177; 1,5
22,0- 25,0
(n=2)
|
LP
10#177; 0
10
(n=2)
|
OR
18,5#177; 0,5
18,0- 19,0
(n=2)
|
TR
|
AB
59,3#177; 1,11
60,0- 67,0
(n=4)
|
Poids
27,9#177; 1,48
28,0-39,0
(n=4)
|
|
Femelle
|
111,6#177; 1,63
|
25,3#177; 0,61
|
10,0#177; 0,19
|
19,9#177; 0,77
|
|
62,5#177; 0,46
|
32,2#177; 0,68
|
|
|
104,0- 120,0
|
23,0- 28,0
|
9,0- 11,0
|
18,0- 25,0
|
|
60,0- 67,0
|
28,0- 39,0
|
|
|
(n=8)
|
(n=8)
|
(n=8)
|
(n=8)
|
|
(n=17)
|
(n=17)
|
|
Scotophilus marovaza
|
Mâle
|
110
|
40
|
9
|
9
|
14
|
43
|
11,1
|
|
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
|
Scotophilus robustus
|
Femelle
|
147
|
61
|
12,5
|
13
|
19
|
63
|
36
|
|
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
|
Pipistrellus spp.
|
Mâle
|
75,5 #177; 2,50
|
38,0 #177; 4,0
|
4,5 #177; 0,5
|
6,0 #177; 0,0
|
10,5 #177; 0,5
|
30,5 #177; 0,5
|
3,8 #177; 0,25
|
|
|
73,0 - 78,0
|
34,0- 42,0
|
4,0- 5,0
|
6
|
10,0- 11,0
|
30,0- 31,0
|
3,5- 4,0
|
|
|
(n=2)
|
(n=2)
|
(n=2)
|
(n=2)
|
(n=2)
|
(n=2)
|
(n=2)
|
|
Myotis goudoti
|
Femelle
|
87
|
41
|
7
|
8
|
14
|
39
|
5,5
|
|
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
|
Mops leucostigma
|
Mâle
|
113,1#177; 1,4
|
38,5#177; 0,8
|
8,8#177; 0,3
|
17,9#177; 0,2
|
|
43,1#177; 0,3
|
17,1#177; 0,5
|
|
|
106,0- 120,0
|
35,0- 42,0
|
8,0- 10,0
|
17,0- 19,0
|
|
40,0- 44,0
|
14,0- 20,0
|
|
|
(n=8)
|
(n=8)
|
(n=8)
|
(n=8)
|
|
(n=9)
|
(n=9)
|
|
Femelle
|
113,8#177; 0,8
|
37,3#177; 0,9
|
8,5#177; 0,6
|
17,2#177; 0,4
|
|
41,8#177; 0,3
|
16,2#177; 0,4
|
|
|
110,0- 119,0
|
34,0- 44,0
|
6,0- 13,0
|
13,0- 19,0
|
|
40,0- 44,0
|
16,0- 20,0
|
|
|
(n=13)
|
(n=13)
|
(n=13)
|
(n=13)
|
|
(n=15)
|
(n=15)
|
|
Chaerephon leucogaster
|
Mâle
|
94
|
31,5
|
6
|
16
|
|
35,25#177;0,5
|
6,75#177;0,25
|
|
|
|
|
|
|
|
34,0-36,0
|
6,0-7,0
|
|
|
(n=1)
|
(n=1)
|
(n=1)
|
(n=1)
|
|
(n=4)
|
(n=4)
|
|
Femelle
|
86#177; 1
|
33,7#177; 2,7
|
7#177; 0
|
16,3#177; 1,46
|
|
35,3#177; 0,9
|
8,7#177; 1,7
|
|
|
84,0- 87,0
|
31,0- 39,0
|
7
|
14,0- 19,0
|
|
32,0- 38,0
|
6,0- 7,2
|
|
|
(n=3)
|
(n=3)
|
(n=3)
|
(n=3)
|
|
(n=6)
|
(n=6)
|
|
Rousettus madagascariensis
|
Mâle
|
120,3 #177; 2,1
|
16,0 #177; 0,7
|
13,5 #177; 0,6
|
18,3 #177; 0,5
|
|
72,1 #177; 0,5
|
54,0 #177; 4,3
|
|
|
115,0- 125,0
|
15,0- 18,0
|
12,0- 15,0
|
17,0- 19,0
|
|
71,0- 73,0
|
43,0- 64,0
|
|
|
(n=4)
|
(n=4)
|
(n=4)
|
(n=4)
|
|
(n=4)
|
(n=4)
|
|
Femelle
|
115,2 #177; 2,2
|
15,7 #177; 0,7
|
11,1 #177; 0,9
|
18,3 #177; 0,2
|
|
69,6 #177; 0,9
|
46,7 #177; 1,8
|
|
|
105,0- 119,0
|
14,0- 18,0
|
9,0- 14,0
|
18,0- 19,0
|
|
67,5- 72,0
|
41,0- 52,0
|
(n=6) (n=6) (n=6) (n=6) (n=6) (n=6)
VIII
Annexe 5. Etat de reproduction de quelques
espèces
|
Espèces
|
Sexe
|
Position
du
testicule
|
Testicule
|
Epididyme
|
Condition
mammaire
|
Vagin
|
Embryon
|
|
Long (mm)
|
larg (mm)
|
|
Chaerephon leucogaster
|
Femelle
|
|
|
|
|
large
|
perforé
|
R*1 C.R*3
|
|
Chaerephon leucogaster
|
Femelle
|
|
|
|
|
petit
|
perforé
|
rien
|
|
Chaerephon leucogaster
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Chaerephon leucogaster
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Mâle
|
scrotale
|
4
|
2
|
contourné
|
|
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
large
|
perforé
|
L*5 R*1 CR*5
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Mâle
|
scrotale
|
7
|
3
|
|
|
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Mâle
|
abdominale
|
2
|
1
|
non contourné
|
|
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
IX
Annexe 5 (Suite). Etat de reproduction de
quelques espèces
|
Espèces
|
Sexe
|
Position du
testicule
|
Testicule
|
Epididyme
|
Condition
mammaire
|
Vagin
|
Embryon
|
|
Long (mm)
|
Larg (mm)
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Mops leucostigma
|
Mâle
|
scrotale
|
7
|
4
|
|
|
|
|
|
Mops leucostigma
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Mops leucostigma
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Mops leucostigma
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Mops leucostigma
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Myotis goudoti
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Pipistrellus sp.
|
Mâle
|
scrotale
|
5
|
4
|
|
|
|
|
|
Rousettus madagascariensis
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Rousettus madagascariensis
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Rousettus madagascariensis
|
Mâle
|
scrotale
|
12
|
6
|
|
|
|
|
|
Rousettus madagascariensis
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Rousettus madagascariensis
|
Mâle
|
scrotale
|
10
|
9
|
|
|
|
|
|
Rousettus madagascariensis
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Rousettus madagascariensis
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
X
Annexe 5 (Suite). Etat de reproduction de
quelques espèces
|
Espèces
|
Sexe
|
Position du
testicule
|
Testicule
|
Epididyme
|
Condition
mammaire
|
Vagin
|
Embryon
|
|
Long (mm)
|
larg (mm)
|
|
Rousettus madagascariensis
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Scotophilus marovaza
|
Mâle
|
abdominale
|
|
|
|
|
|
|
|
Scotophilus robustus
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Mâle
|
scrotale
|
|
|
|
|
|
|
|
Taphozous mauritianus
|
Mâle
|
scrotale
|
|
|
|
|
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
large
|
perforé
|
|
|
Taphozous mauritianus
|
Femelle
|
|
|
|
|
petit
|
imperforé
|
|
XI
Annexe 6. Indice de similarité de
quelques localités de l'ouest de l'île
|
Sites
|
Ankarana
|
Anjohibe
|
PN de
Namoroka
|
PN de
Bemaraha
|
Kirindy
CNFEREF
|
PN de
Zombitse
Vohibasia
|
PN
d'Isalo
|
PN de
Kirindy
Mitea
|
PN de
Tsimanampetsotsa
|
AP
Complexe
Tsimembo
Manambolomaty
|
|
Ankarana
|
1
|
|
|
|
|
|
|
|
|
|
|
Anjohibe
|
0,52
|
1
|
|
|
|
|
|
|
|
|
|
PN de Namoroka
|
0,517
|
0,517
|
1
|
|
|
|
|
|
|
|
|
PN de Bemaraha
|
0,5
|
0,5
|
0,863
|
1
|
|
|
|
|
|
|
|
Kirindy
CNFEREF
|
0,322
|
0,322
|
0,353
|
0,375
|
1
|
|
|
|
|
|
|
PN de Zombitse
Vohibasia
|
0,259
|
0,148
|
0,455
|
0,438
|
0,358
|
1
|
|
|
|
|
|
PN d'Isalo
|
0,522
|
0,347
|
0,34
|
0,355
|
0,308
|
0,242
|
1
|
|
|
|
|
PN de Kirindy
Mitea
|
0,347
|
0,347
|
0,375
|
0,4
|
0,62
|
0,334
|
0,4
|
1
|
|
|
|
PN de
Tsimanampetsotsa
|
0,24
|
0,193
|
0,344
|
0,36
|
0,305
|
0,392
|
0,4
|
0,4
|
1
|
|
|
AP
Complexe
Tsimembo-
Manambolomaty
|
0,25
|
0,297
|
0,467
|
0,5
|
0,479
|
0,44
|
0,231
|
0,455
|
0,28
|
1
|
XII
Annexe 7. Pourcentage volume et fréquence
des arthropodes consommées
|
Taxon
|
Myotis
goudoti
(n=1)
|
Pipistrellus.
spp.
(n=1)
|
Scotophilus
marovaza
(n=1)
|
Scotophilus
robustus
(n=1)
|
Taphozous
mauritianus
(n=3)
|
|
PV
|
PF
|
PV
|
PF
|
PV
|
PF
|
PV
|
PF
|
PV
|
PF
|
|
Lépidoptères
|
47,5
|
100
|
11
|
60
|
0
|
0
|
0
|
0
|
68,06
|
100
|
|
Hémiptères
|
0
|
0
|
4,67
|
19,17
|
0
|
0
|
0
|
0
|
5
|
27,78
|
|
Coléoptères
|
41,5
|
100
|
54
|
100
|
88,33
|
100
|
99
|
100
|
25,28
|
72,22
|
|
Diptères
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1,67
|
16,67
|
|
Ephéméroptères
|
0
|
0
|
0
|
0
|
1,67
|
16,67
|
0,5
|
10
|
0
|
0
|
|
Homoptères
|
0
|
0
|
2
|
20
|
10
|
66,68
|
0
|
0
|
0
|
0
|
|
Hyménoptères
|
4,5
|
40
|
20,67
|
33,33
|
0
|
0
|
0,5
|
10
|
0
|
0
|
|
Isoptères
|
4
|
30
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Araneae
|
2,5
|
30
|
7
|
30,83
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Orthoptères
|
0
|
0
|
0,67
|
6,67
|
0
|
0
|
0
|
0
|
0
|
0
|
XIII
Annexe 8. Variation de la consommation des
proies en fonction de la taille des chauves-souris
|
Longueur
de
l'avant-
bras
(mm)
|
PV des arthropodes consommés (%)
|
|
Orthoptères
|
Araneae
|
Isoptères
|
Hyménoptères
|
Homoptères
|
Ephéméroptères
|
Diptères
|
Coléoptères
|
Hémiptères
|
Lépidoptères
|
|
30,5
|
0,67
|
7
|
0
|
20,67
|
2
|
0
|
0
|
54
|
4,67
|
11
|
|
39
|
0
|
2,5
|
4
|
4,5
|
0
|
0
|
0
|
41,5
|
0
|
47,5
|
|
43
|
0
|
0
|
0
|
0
|
10
|
1,67
|
0
|
88,33
|
0
|
0
|
|
60,9
|
0
|
0
|
0
|
0
|
0
|
0
|
1,67
|
25,28
|
5
|
68,06
|
|
63
|
0
|
0
|
0
|
0,5
|
0
|
0,5
|
0
|
99
|
0
|
0
|
XIV
Annexe 9. Photo des espèces de
chauves-souris identifiées à Tsimembo-Manambolomaty

Pteropus rufus Rousettus madagascariensis
(Source :
http://www.quizz.biz/quizz-
(Source : Ravelomanantsoa, 2015)
358922.html)

Myotis goudoti Pipistrellus sp
(Source : Ramasindrazana, 2015) (Source : Ramasindrazana,
2015)

Scotophilus marovaza
(Source : Ravelomanantsoa, 2015) Scotophilus robustus
(Source : Ravelomanantsoa, 2015)

Mops leucostigma Chaerephon leucogaster
(Source : http://www.ispotnature.org/ (Source :
http://www.boldsystems.org/index.
node/463953) php/Taxbrowser Taxonpage?taxid=71876)

XV
Taphozous mauritianus
(Source : Ravelomanantsoa, 2015)
TITRE : Etudes biologique et
écologique des chauves-souris de l'Aire Protégée Complexe
Tsimembo-Manambolomaty
RESUME
Un inventaire biologique des chauves-souris a
été réalisé dans Tsimembo-Manambolomaty l'Aire
Protégée Complexe Tsimembo-Manambolomaty (Région Melaky,
Madagascar) entre le mois de septembre et octobre 2015, dans le but de
connaître la richesse spécifique, la biologie et l'écologie
des chauves-souris du site. L'évaluation de la diversité
spécifique des chiroptères a été faite par capture
des espèces en utilisant deux types de pièges, par série
d'observations au niveau des gîtes et des enquêtes auprès de
la population locale. Des filets japonais (6 m et 12 m), et un piège
harpe ont été installés durant la nuit à travers
des rivières et des chemins forestiers dans 16 sites différents.
La capture à la main et l'utilisation des filets à papillons ont
aussi servi à collecter des individus dans leurs gîtes diurnes
pendant le jour et à capturer celles qui sont en vol pendant la nuit. Au
total, 72 individus appartenant à huit espèces ont
été capturées pendant les 26 jours d'étude
après un total de 2 556 (fhm), dont sept espèces animalivores et
une espèce frugivore. Une autre espèce frugivore, Pteropus
rufus, a été observée dans son gîte diurne.
Après la réalisation des dissections et des mesures
morphométriques, à part l'observation d'une femelle de Mops
leucostigma en gestation, seul un individu mâle de Chaerephon
leucogaster présentait un épididyme développé
et un individu femelle était en phase de gestation. Mops leucostigma
et Taphozous mauritianus présentent un dimorphisme sexuel
au niveau des paramètres morphométriques. Le résultat des
analyses des matières fécales ont permis de recenser 10 ordres
d'arthropode dans le régime alimentaire des espèces
capturées avec des proportions variables selon les espèces. La
consommation des proies varie aussi en fonction de la taille des individus.
Davantage d'étude serait encore nécessaire afin d'obtenir des
informations exhaustives de la chiroptérofaune du Complexe
Tsimembo-Manambolomaty , leur écologie et les menaces potentielles des
espèces existantes.
Mots clés : Chiroptère,
richesse spécifique, reproduction, régime alimentaire,
Tsimembo-Manambolomaty , Région Melaky, Madagascar
ABSTRACT
A bat inventory has been undertaken in Tsimembo-Manambolomaty
Protected Area (Melaky Region, Madagascar) between September and October 2015
to know the diversity, the biology and the ecology of bat species occurring in
this area. Chiropteran diversity was evaluated by using two types of trapping
techniques, through observations of day roost sites, and during a survey of the
local population. 6 m and 12 m mist nets and a harp trap were installed along
or across rivers and the forest pathways during the night in the 16 different
sites. Bats were also caught directly by hand inside their day roost sites or
in flight with a butterfly net. In total, 72 individuals belonging to eight bat
species were captured during 26 days after the totality of 2 556 (fhm) with
seven insectivorous bat species and one frugivorous bat. A second frugivorous
bat species was observed in his day roosts site. After dissection and the
morphological measurements, only one female individual of Mops
leucostigma was pregnant, and one male individual of Chaerephon
leucogaster presents a convoluted epididymis and one female individual is
in gestation phase. Mops leucostigma and Taphozous
mauritianus exhibit sexual dimorphism based on their morphometrical
parameters. The fecal analysis showed that animalivorous bat species captured
exploit 10 orders of arthropods in different proportions according to the
species, and their respective size. Further studies in the area would be
necessary to obtain additional information on the bat fauna of the
Tsimembo-Manambolomaty area, their biology and ecology, and the potential
threats of occurring bat species.
Key words: Chiroptera, species richness,
reproduction, diet, Tsimembo-Manambolomaty , Melaky Region, Madagascar
Encadreurs : Impétrante:
Madame Julie C. RANIVO RAKOTOSON Ny Anjara Fifi
RAVELOMANANTSOA
Maître de conférences Adresse : Lot IVY 18D bis
Anosipatrana
Monsieur Beza RAMASINDRAZANA Tel : 034 99 203 84
Docteur E-mail :
ravelomanantsoa@gmail.com
|
|



