
 |
Distribution des Anophèles Nili et Anophèles Moucheti au sud du Cameroun : influence des facteurs du milieu.( Télécharger le fichier original )par Carlos Dendi LACGNI ISSEA - Ingénieur d'Apllication de la Statistique 2007 |
LE PALUDISMEI.1 GénéralitésLe paludisme est une maladie parasitaire, transmise à l'homme par l'anophèle femelle et causée par un hématozoaire du genre Plasmodium. Il est encore appelé malaria (de l'italien mal-aria, air vicié) et dérive du latin paludis qui signifie marais. Les premières descriptions cliniques des fièvres palustres, avec les symptômes habituels ont été réalisées par Hippocrate (Ve siècle avant Jésus Christ). Dès le XVIIe siècle, c'est par l'administration de l'écorce du quinquina que l'on combattait ces fièvres. Le mystère qui les entourait ne fut élucidé qu'en 1880 avec la découverte de l'agent pathogène, le Plasmodium par Alphonse Laver. Son cycle a été décrit plus tard en Italie par Grassi et al. (1899). En 1900, Ce sont les recherches de Manson (cf. Manson (1900)) qui viendront confirmer le rôle du moustique dans la transmission de cette maladie. Dès lors, la lutte antivectorielle accompagnée de l'administration de la quinine aux populations devinrent les principales stratégies de lutte antipaludique. Avec la découverte des insecticides à effet rémanent tel que le DDT (Dichlorodiphenyltrichloéthane), et la mise au point de nouveaux médicaments très efficaces (chloroquine, amodiaquine), cette lutte a connu un succès et un essor sans pareil au cours de la deuxième guerre mondiale. Les campagnes de pulvérisation intra domiciliaire de DDT qui ont suivi permirent d'éradiquer le paludisme dans de nombreuses régions du monde notamment en Amérique du Nord et en Europe. Les premières résistances des moustiques au Dichlorodiphenyltrichloéthane (DDT) apparurent en Grèce à partir de 1951. Ceci incita à une accélération des opérations de lutte afin d'atteindre l'objectif visé (éradication du paludisme) avant que cette résistance ne soit généralisée. Peu après, la résistance des Plasmodium aux médicaments notamment à la chloroquine vint compromettre les efforts d'éradication de la maladie. En 1969, la 22e assemblée mondiale de la santé confirma l'échec du programme mondial d'éradication du paludisme, adopté lors de la 8e assemblée de Mexico en 1955. Ainsi, la stratégie d'éradication fut remplacée par celle du contrôle avec pour but de : - réduire la transmission ; - réduire la morbidité ; - réduire la mortalité. Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu Une stratégie mondiale de lutte contre le paludisme, basée sur quatre principes a été définie en 1992 par la conférence ministérielle d'Amsterdam. Ces quatre principes sont : le diagnostic et le traitement rapide des cas ; la prévention et la lutte antivectorielle; la prévention et l'endiguement des épidémies et le renforcement des capacités nationales (développement et modernisation des structures sanitaires). En Afrique, l'initiative Roll Back Malaria (faire reculer le paludisme) préconise de réduire de moitié les cas de paludisme d'ici 2010, puis de moitié encore avant 2015 (RBM, 2005). De nos jours, le paludisme reste la principale affection parasitaire dans le monde notamment dans les pays d'Afrique tropicale au Sud du Sahara où il représente la première cause de morbidité et de mortalité. L'OMS estime entre 300 et 550 millions le nombre de cas par an, dont plus de 80% en Afrique subsaharienne. Plus de 1 million de personnes meurent du paludisme chaque année (OMS, 2005). I.2 Le paludisme au CamerounAu Cameroun, le paludisme est la maladie la plus répandue. À l'exception des zones montagneuses de l'Ouest où son incidence est faible, les cas de paludisme sont reportés sur toute l'étendue du pays (Garde et al., 1991). La lutte contre cette maladie a commencé dès 1949 à Yaoundé et Douala par les services d'hygiène mobile. Les vastes campagnes de pulvérisation intradomiciliaire d'insecticide menées à partir de 1953 ont conduit à une interruption momentanée de la transmission au Sud Cameroun (Livadas et al., 1958). Depuis la fin des années 1980, le paludisme connaît une résurgence alarmante. Le ministère de la santé publique estime à 2 millions le nombre de cas par an, avec 30 à 35 % de décès, dont 40 % d'enfants de moins de 5 ans ; 22 à 23 % des admissions hospitalières sont attribuées au paludisme (MINSANTE, 2002). Sur les quatre espèces plasmodiales pathogènes pour l'homme, trois sont présentes au Cameroun : P. falciparum responsable de la fièvre tierce maligne, P. ovale et P. malariae responsables respectivement de la fièvre tierce bénigne et de la fièvre quarte bénigne (Mouchet et al., 2004). Les principaux vecteurs qui assurent la transmission sont : Anopheles gambiae et Anopheles funestus présents dans toutes les régions, Anopheles moucheti et Anopheles nili en zone de forêt, Anopheles arabiensis en zone de savane (Carnevale et al. (1992), Antonio-Nkondjio et al. (2002 a) et Mouchet et al. (2004)). I.3 Le parasite et le vecteurI.3.1 Le parasiteLes Plasmodium sont des protozoaires intracellulaires de la classe des sporozoaires ayant un cycle dixène. La phase asexuée se déroule chez un hôte vertébré (hommes, singes, rongeurs, oiseaux) et la phase sexuée chez un hôte invertébré (moustiques du genre Anophèles ou culex). Parmi ces plasmodium, quatre espèces affectent l'homme : Plasmodium malariae identifié en 1881 par Laveran, Plasmodium vivax identifié par Grassi et Feletti en 1890, Plasmodium falciparum mis en évidence par Welch en 1897 et Plasmodium ovale identifié en 1922 par Stephens. Parmi ces espèces, Plasmodium falciparum est le plus redoutable car elle est à l'origine des accès pernicieux mortels. I.3.2 Le vecteur : l'anophèle femelleDans le genre Anopheles, c'est l'anophèle femelle qui transmet le parasite responsable du paludisme. I.3.2.1 Position systématique des anophèlesD'après Rodhain et Pérez (1985), les anophèles appartiennent au : - Règne : Animal - Embranchement : Arthropodes - Sous-embranchement : Antennates ou Mandibulates - Classe : Insectes - Sous classe : Ptérygotes - Section : Oligonéoptères - Super ordre : Mécoptéroîdes - Ordre : Diptères - Sous-ordre : Nématocères - Famille : Culicidés - Sous-famille : Anophélines - Genre : Anopheles I.3.2.2 Biologie et cycle de développement des anophèlesLes anophèles sont les seuls moustiques capables d'assurer la transmission du paludisme à l'homme. Environ 450 espèces d'anophèles sont connues dans le monde mais seules quatre-vingt sont impliquées dans la transmission du paludisme (Mouchet et al., 2004). Trois critères pratiques permettent de considérer une espèce d'anophèle comme vectrice de Plasmodium humains : 1°) elle doit permettre le développement du Plasmodium (compétence vectorielle) 2°) elle doit avoir une grande longévité et être suffisamment abondante, au moins à certaines régions ou saisons ; 3°) elle doit être anthropophile. Les anophèles ont un corps fusiforme et grêle avec des palpes dont la longueur est égale à celle de la trompe, des pattes longues et des ailes tachetées de noir et blanc. Les mâles et les femelles se nourrissent de jus sucré (nectar des fleurs). Seules les femelles sont hématophages et piquent surtout la nuit. Leur durée de vie moyenne est de 3 à 4 semaines. (Mouchet et Carnevale, 1991). Les préférences tropiques varient en fonction des espèces d'anophèles ; certaines piquent préférentiellement les animaux (espèces zoophiles) alors que d'autres préfèrent prendre du sang chez l'homme (espèces anthropophiles). Outre le paludisme, les anophèles peuvent transmettre les filarioses et les arboviroses. Généralement, l'anophèle femelle ne s'accouple qu'une fois dans sa vie, aussitôt après émergence à l'âge adulte. Les spermatozoïdes reçus lors de l'accouplement sont stockés dans la spermathèque et permettent de féconder plusieurs lots d'oeufs successifs (Mouchet et al., 2004). La femelle fécondée a besoin d'un repas de sang d'où elle tire les éléments protéiques indispensables à la maturation des ovocytes. Cependant dans le cas d'Anopheles gambiae et d'Anopheles funestus, la femelle a besoin de deux repas de sang avant d'effectuer la première ponte, le premier repas de sang étant utilisé pour la phase pré gravide (Klein, 1997). Après le repas de sang, la femelle gorgée (abdomen rouge) se repose sur un support (murs, vêtements, végétaux) pour digérer le sang. À la fin de la digestion, la femelle gravide (abdomen blanc, rempli d'oeufs) recherche un site d'oviposition où elle dépose les oeufs, puis repart à la recherche d'un nouvel hôte. La période qui s'écoule entre la prise du repas de sang et la ponte est appelée cycle gonotrophique. Sa durée moyenne est située entre 48 et 72 heures dans les régions tropicales et subtropicales (Mouchet et al., 2004). Les gîtes de ponte des anophèles sont variés et constitués de collections d'eau permanentes (rivières ou fleuves), temporaires (marécages, lacs, rizières, flaques), ou saumâtres (lagunes). Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu Le développement des anophèles se déroule en milieu aquatique et aérien. Il comporte quatre stades successifs : l'oeuf, la larve, la nymphe et l'adulte. La durée du développement larvaire dépend de la température de l'eau et de la disponibilité en nourriture. Plus la température est élevée, plus le développement est rapide (OMS, 2003). L'anophèle femelle pond des lots de cent à cent cinquante oeufs qui sont déposés isolement à la surface de l'eau. L'éclosion de l'oeuf libère une larve de stade I qui mesure environ 1 mm. Après un à deux jours, elle mue et devient une larve de stade II, suivi du troisième et quatrième stade, à intervalle de deux jours environ. La larve de stade IV subit la nymphose pour donner une nymphe immobile qui ne se nourrit pas. Cette nymphe se transforme en adulte qui se repose pendant 10 à 24 heures dans un gîte de repos (végétation, termitière, rocher...) avant de s'envoler. Ce temps est nécessaire pour le durcissement de la cuticule et l'achèvement du développement des organes sexuels chez le mâle (Mouchet et al., 2004). I.3.2.3 Les anophèles d'AfriqueEn Afrique, la faune anophélienne comporte environ 145 espèces d'anophèles mais 16 espèces seulement sont impliquées dans la transmission du paludisme à l'homme. Cinq vecteurs sont qualifiés d'importance majeure : Anopheles gambiae s .s et Anopheles funestus largement répartis sur tout le continent, Anopheles nili et Anopheles moucheti confinés en régions forestières et post forestières et Anopheles arabiensis rencontré en zones de savane (Gillies et Meillon, 1968). D'autres vecteurs secondaires tels que Anopheles paludis, Anopheles flavicosta transmettent le paludisme occasionnellement dans certaines localités où ils sont peu nombreux et peu infectés (Hamon et Mouchet, 1961). À ces vecteurs secondaires, s'ajoute une nouvelle espèce vectrice, Anopheles ovengensis récemment découverte au Sud Cameroun (Awono-Ambene et al., 2004). I.4 Les vecteurs Anopheles moucheti et Anopheles niliI.4.1 Le vecteur Anopheles mouchetiAnopheles moucheti est un groupe composé de trois formes : Anopheles moucheti Evans (1925) (forme typique), Anopheles moucheti nigeriensis Evans (1931) et Anopheles moucheti bervoesti d'Haenens (1961) rencontré en République Démocratique du Congo (Gillies et Meillon, 1968). Les populations anophéliennes du Cameroun présentent un fort polymorphisme. Cependant l'étude de la structure génétique des populations naturelles n'a révélé aucune différenciation génétique significative aussi bien entre formes morphologiques qu'entre populations géographiques présentes au Cameroun (Antonio-Nkondjio et al., 2002b). Ainsi, malgré une forte variété morphologique, ce vecteur constitue une entité génétique homogène au Cameroun. La description faite par Gillies et Meillon (1968) de cette espèce est la suivante : Ailes : Les ailes, de couleurs sombre ou claire sont totalement recouvertes d'écailles foncées. La bande pâle sur la costale et courte. La 3e zone apicale sombre de la première nervure est ininterrompue. La tâche pâle de la frange alaire à l'apex de la nervure anale est très souvent absente. Palpes : Les palpes d'Anopheles moucheti présentent deux tâches pâles apicales séparées par une zone sombre plus petite que les taches pâles. Chez certains spécimens, les deux bandes pâles peuvent fusionner. Pattes : Le tibia présente sur toutes les pattes une petite tâche pâle distincte. Les tarsomères 1 à 3 des pattes antérieures et les tarsomères des pattes médianes et postérieures présentent des bandes pâles apicales. Mesonetum : Les écailles de la moitié antérieure du corps sont plus larges que celles de la moitié postérieure qui sont effilées. Au sein du groupe Anopheles moucheti, les adultes de Anopheles moucheti nigeriensis diffèrent de la forme typique par la présence d'une tâche sur l'apex du tarsomères 4 de la patte antérieure et par la présence d'une tâche pâle sur la frange alaire à l'opposée la nervure 6. Chez Anopheles moucheti bervoesti, en plus de ces critères, il y a fusion de la tâche pâle sectoriale à la tâche pâle accessoire de la nervure 1. Anopheles moucheti est le vecteur majeur du paludisme humain dans les régions forestières situées le long des cours d'eau en Afrique équatoriale (Languillon et al.,1956); Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu (Njan-Nloga et al., 1993 ) ; (Antonio-Nkondjio et al., 2002a); (Antonio-Nkondjio et al. 2005). Au Cameroun, dans les villages du bloc forestier, cette espèce est responsable de plus de 96% de la transmission estimée entre 260-322pi/h/Anopheles Son taux d'infestation est compris 1,34 et 2,1 % (Antonio-Nkondjio, 2003); (Antonio-Nkondjio et al., 2005). I.4.2 Le vecteur Anopheles NiliAnopheles nili a été décrit pour la première fois en 1903 par Theobald. Il appartient à la section Ardensis, à la série Néomyzomyia et sous-genre Cellia. Cette espèce a été signalée partout en Afrique (Gillies et Meillon, 1968), (Carnevale et al., 1992). Anopheles nili est principalement rencontré le long des cours d'eau et joue un rôle déterminant dans la transmission du paludisme en Afrique. En zone de forêt du Sud Cameroun, cet anophèle constitue le principal vecteur du paludisme avec un taux d'inoculation annuel de 104 piqûres infectant par homme et par an (Carnevale et al., 1992). Ce vecteur est très anthropophile. Cependant, en 1978 Carnevale et Boreham ont remarqué qu'une proportion de la population pouvait s'avérer zoophile. D'autre part, Anopheles Nili présente de fortes variations quant à son endophagie et son endophilie (Languillon et al., 1956). Dans le complexe Anopheles nili on trouve actuellement Anopheles nili s.s. (Theobald, 1904), Anopheles somalicus (Rivola et Holstein ,1957 ) et Anopheles carnevalei(Brunhes, 1998), Anopheles ovengensis (Awono -Ambene et al., 2004). Au Cameroun, bien que certains travaux fassent état de sa présence au Nord du pays (Hamon et Mouchet, 1961), Anopheles nili est principalement rencontré au Sud. Ce vecteur fut signalé par les premières enquêtes entomologiques réalisées au Cameroun (Vaucel et Campourcy ,1943); (Adam ,1955). Au sud du pays, ce vecteur est présent en zone forestière et périforestière (Livadas et al., 1958), (Carnevale et al., 1992) et dans les montagnes de l'Ouest Cameroun (Mouchet et al., 1960). Quant à Anopheles somalicus et Anopheles carnevalei, ces espèces sont présentes au sud Cameroun. Anopheles ovengensis a été découvert au sud Cameroun (Awono-Ambene et al., 2004). I.5 Le contrôle du paludismeLe contrôle du paludisme a pour objectif la réduction de l'incidence de la maladie. Elle comporte deux volets :
La lutte antivectorielle peut être dirigée contre les stades larvaires (larvicide) ou adultes (adulticite). Les principales méthodes de contrôle contre les vecteurs sont : - l'élimination des gîtes larvaires par le drainage ou le remblayage des zones marécageuses ou des mares stagnantes ; - les pulvérisations intradomiciliaires d'insecticide qui tue les anophèles qui investissent les habitations ; - l'utilisation des moustiquaires imprégnées d'insecticide qui préviennent les piqûres des moustiques tout en les tuant ; - l'utilisation des répulsifs (serpentins anti-moustiques, bombe aérosol, plaquettes insecticides à vaporisation électrique) ; - la protection des ouvertures des habitations par des grillages à mailles fines pour empêcher la pénétration des moustiques (OMS, 2003). La recherche d'un vaccin contre le paludisme est en cours. Elle est dirigée sur trois axes principaux : un vaccin contre les formes rérythrocytaires (sporozoites et formes hépatiques,), un vaccin contre les formes érythrocytaires asexuées et un vaccin contre les stades sporogoniques. La tendance actuelle est de combiner plusieurs antigènes qui couvriraient la biologie des différents stades du parasite et toutes les espèces de Plasmodium humains. Le séquençage du génome de P. falciparum devrait faciliter la recherche d'antigènes candidats pour les éventuels vaccins (Mouchet et al., 2004). Au terme de ce chapitre, nous pouvons dire que le paludisme est une maladie qui affecte l'homme par le biais d'un parasite : le plasmodium. Ce parasite étant transmis à l'homme par un vecteur du genre anophèles. Nous avons constaté que Anopheles nili et Anopheles moucheti sont confinés en zone forestière et périforestière. Le chapitre suivant consistera en la présentation de la structure d'accueil, du cadre général de l'étude et de la méthodologie d'analyse
CHAPITRE IIPRÉSENTATION DE LA STRUCTURE D'ACCUEIL ET
CADRE
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CHAPITRE III |
|||
Au Cameroun, Anopheles nili et Anopheles moucheti sont des espèces fortement impliquées dans la transmission du paludisme. Leur distribution ainsi que leur adaptation à l'environnement sont mal connues. Dans ce chapitre, nous étudierons la répartition de ces espèces selon chacun des facteurs environnementaux mis en évidence. Nous nous bornerons à une étude de la distribution des Anopheles nili et Anopheles moucheti selon ces facteurs.
Les collectes ont été effectuées dans 22 cours d'eaux distribués dans 5 provinces du pays (Est, Sud, Ouest, Centre, Nord-ouest). Au total, 2942 larves appartenant à 5 espèces ont été collectées au cours de cette étude. Les larves du groupe Anopheles nili étaient les plus abondantes suivies des larves d'Anopheles moucheti. Les autres espèces collectées étaient : Anopheles paludis, Anopheles funestus et Anopheles Sp ( voir Tableau 1). L'espèce Anopheles nili est un groupe d'espèces qui a en son sein 4 espèces différentes Anopheles Somalicus, Anopheles Ovengensis, Anopheles Carnevalei et Anopheles nili ss.
Dans la province du Centre, Anopheles nili est le vecteur majoritaire. On le retrouve dans presque tous les sites de cette province sauf à Olama. Anopheles moucheti n'est présente dans cette province que dans les sites à Olama sur le Nyong et à Simbock sur la Méfou.
Dans la province du Sud et de l'Est, le vecteur majoritaire est Anopheles moucheti suivi de Anopheles nili et Anopheles paludis. Cependant dans les provinces du Nord Ouest et à l'Ouest, seules Anopheles nili et An funestus étaient présent.
Dans le tableau 1 suivant, nous pouvons remarquer que plus de 34 % des larves collectées ont été recensées dans le seul site de Nkolbison.
Tableau 1 : Répartition des anophèles par sites et par cours d'eau
|
Province |
Sites |
Cours d'eau |
Anopheles |
Anopheles |
Anopheles |
Anopheles |
Anopheles |
Total |
Moy |
% |
|
Centre |
Ebebda |
Sanaga |
0 |
0 |
119 |
0 |
0 |
119 |
23,8 |
4,0% |
|
Centre |
Ebogo |
Nyong |
0 |
125 |
0 |
0 |
0 |
125 |
25 |
4,2% |
|
Centre |
Mbébé |
Sanaga |
0 |
0 |
164 |
0 |
0 |
164 |
32,8 |
5,6% |
|
Centre |
Mfou |
Ntot |
0 |
0 |
54 |
0 |
0 |
54 |
10,8 |
1,8% |
|
Centre |
Nkolbison |
Méfou |
0 |
0 |
1000 |
0 |
0 |
1000 |
200 |
34,0% |
|
Centre |
Olama |
Nyong |
0 |
76 |
0 |
0 |
0 |
76 |
15,2 |
2,6% |
|
Centre |
Simbock |
Méfou |
0 |
50 |
128 |
0 |
0 |
178 |
35,6 |
6,1% |
|
Est |
Baad |
Baad |
0 |
0 |
3 |
9 |
0 |
12 |
2,4 |
0,4% |
|
Nako |
||||||||||
|
Est |
Ekelemba |
Paka |
0 |
0 |
46 |
10 |
1 |
57 |
11,4 |
1,9% |
|
Est |
Moloundou |
Boumba |
0 |
0 |
63 |
1 |
0 |
64 |
12,8 |
2,2% |
|
Est |
Moloundou |
Ngoko |
0 |
19 |
5 |
0 |
0 |
24 |
4,8 |
0,8% |
|
Est |
Kentzou |
Kadei |
0 |
4 |
1 |
37 |
0 |
42 |
8,4 |
1,4% |
|
Nord-Ouest |
Ako |
Akon |
35 |
0 |
35 |
11 |
0 |
81 |
16,2 |
2,8% |
|
Nord-Ouest |
Ako |
Atoro |
11 |
0 |
130 |
0 |
0 |
141 |
28,2 |
4,8% |
|
Ouest |
Magba |
Mappe |
2 |
0 |
28 |
1 |
0 |
31 |
6,2 |
1,1% |
|
Sud |
Afan Essokie |
Bitande |
0 |
0 |
34 |
0 |
51 |
85 |
17 |
2,9% |
|
Sud |
Ambam |
Ntem |
0 |
93 |
11 |
10 |
0 |
114 |
22,8 |
3,9% |
|
Sud |
Djoum |
Etjia'a |
0 |
0 |
0 |
2 |
30 |
32 |
6,4 |
1,1% |
|
Sud |
Djoum |
Otozen |
0 |
14 |
15 |
0 |
15 |
44 |
8,8 |
1,5% |
|
Sud |
Nyabessan |
Njoh |
0 |
89 |
13 |
6 |
1 |
109 |
21,8 |
3,7% |
|
Sud |
Nyabessan |
Ntem |
0 |
192 |
64 |
37 |
0 |
293 |
58,6 |
10,0% |
|
Sud |
Sangmelima |
Meyo |
0 |
5 |
0 |
0 |
92 |
97 |
19,4 |
3,3% |
|
Total |
48 |
667 |
1913 |
124 |
190 |
2942 |
100% |
|||
|
Pourcentage |
1,6% |
22,7% |
65,0% |
4,2% |
6,5% |
100% |
Source : élaboré par l'auteur avec les données de l'OCEAC
Etant donné que la tâche qui nous a été confiée était de mettre en évidence l'influence des facteurs relatifs au milieu sur la distribution de ces deux espèces, il serait intéressant dans la section suivante d'analyser comment les différents vecteurs se répartissent selon ces variables.
Nous nous proposons dans cette section d'étudier la distribution des espèces Anopheles nili et Anopheles moucheti en fonction de différents paramètres.
pH
Le pH est un paramètre qui permet de déterminer le niveau d'acidité ou de basidité du milieu. Un milieu avec un pH inférieur à 7 est dit acide, proche ou égal à 7 il est dit neutre, supérieur à 7, il est dit basique.
Anopheles moucheti a été retrouvé en abondance dans des cours d'eau dont le PH est compris entre 5,4 et 8 (voir annexe 2, tableau 12). Le pH moyen favorable au développement d'Anopheles moucheti est de 5,8618 (voir annexe 2, tableau 12).
Anopheles nili se trouve dans des cours d'eau avec un pH plus étendu que celui de Anopheles moucheti. Elle a été récoltée dans des cours d'eau dont le pH varie entre 4,5 et 8 (voir annexe 2, tableau 11). Le PH moyen favorable à la présence des Anopheles nili est de 6,51(voir annexe 2, tableau 11).
Environ 1349 (Plus de 70 %) des 1909 larves de Anopheles nili recensés, ont été collectées dans les cours d'eau à pH neutre (voir tableau 2). 447 (23,4 %) ont été collectées dans les cours d'eau à pH acide (voir tableau 2 suivant).
Tableau 2 : Distribution des larves d'anophèles en fonction du pH
Milieu
pH acide pH neutre pH basique
|
Anopheles nili |
447 |
1349 |
113 |
1909 |
|
Anopheles |
630 |
33 |
4 |
667 |
|
Autres |
200 |
104 |
58 |
362 |
|
Total |
1277 |
1486 |
175 |
2938 |
Graphique 1 : Distribution des Anopheles nili et Anopheles moucheti en fonction du PH
|
Nbre de larves collectees |
1200 |
Moucheti Nili |
||
0 2 4 6 8 10
PH
Le graphique 1 nous indique que les Anopheles nili s'adaptent à divers niveau de pH. Contrairement aux Anopheles moucheti qui se regroupent autour du pH moyen.
La température d'un milieu ou d'un corps est une grandeur physique qui mesure le degré de chaleur de ce milieu ou de ce corps. Elle mesure aussi l'agitation moyenne des particules qui compose le milieu (atome, molécule). Plus la température est élevée, plus le corps est chaud.
Graphique 2 : Distribution des Anopheles nili et Anopheles moucheti en fonction de la température
|
nbre de larves |
1200 |
Moucheti Nili |
||
0 5 10 15 20 25 30 35
Température (°C)
Le graphique 2 montre que Anopheles nili et Anopheles moucheti peuvent cohabiter dans les cours d'eau dont la température se trouve entre 20°C et 27°C.
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
La température moyenne des cours d'eau où Anopheles nili a été retrouvée est de 24,999°C. Chez Anopheles moucheti, cette moyenne est de 24,87°C (voir annexe 2, tableaux 11 et 12).
La conductivité d'un cours d'eau est sa capacité à laisser le courant électrique circuler librement. Ici, elle s'exprime en uS/cm. Elle permet de mesurer la quantité de matière inorganique dans l'eau ainsi que la présence d'ions. Plus elle est élevée, plus le cours d'eau est riche en ces éléments.
On peut observer sur le graphique 3 que l'ensemble des larves d'Anopheles moucheti a été collecté dans des cours d'eau ayant une conductivité inférieure à la valeur 30 uS/cm. La conductivité moyenne sur les 11 cours d'eau où il a été retrouvé est de 26,288 #177; 2,25 uS/cm (voir annexe 2, tableau 12).
Graphique 3 : Distribution des Anopheles nili et Anopheles moucheti en fonction de la
conductivité

Moucheti Nili
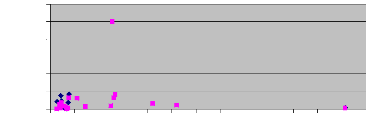
nbre de larves
1200
1000
400
800
600
200
0
0 30 60 90 120 150 180 210 240 270 300 330 360
390
Conductivité
En revanche, Anopheles nili a été collectée dans les cours d'eau dont la conductivité variait entre 8 et 364 uS/cm. La conductivité moyenne des cours d'eau où elle a été récoltée est de 69,33 #177; 0,81 uS/cm (voir annexe 2, tableau 11).
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
Le potentiel d'oxydo réduction mesure la capacité d'un ion à échanger des électrons. S'il est oxydant il accepte facilement les électrons, s'il est réducteur il libère facilement des électrons. Dans les milieux réducteurs, on dénombre plus d'électrons libres que dans les milieux oxydant.
Dans les cours d'eau avec un potentiel inférieur à 125 mV, aucune larve d'Anopheles moucheti n'a été retrouvée (voir graphique 4). L'essentiel des Anopheles nili et Anopheles moucheti semble être confiné dans les cours d'eau avec un potentiel compris entre 125 mV et 225 mV. Le potentiel moyen propice à la présence de Anopheles nili est de 159,40#177; 0,96 mV. Par contre, celui de Anopheles moucheti est de 200,102 #177; 1,47 mV (voir annexe 2, tableau 11 et 12).
Graphique 4 : Répartition des Anopheles nili et Anopheles moucheti selon le potentiel d'oxydo réduction

Moucheti Nili

nbre de larves
1200
1000
400
200
800
600
0
0 50 100 150 200 250 300 350
Potentiel
Dans leurs milieux naturels, les larves d'Anopheles nili et d'Anopheles moucheti s'abritent près des plantes aquatiques et débris présents dans le cours d'eau pour échapper à leurs prédateurs. D'autre part, ces milieux s'avèrent être un garde manger important pour ces larves, car ces plantes abritent également au même titre le plancton et le zooplancton. L'ensemble de ces paramètres fait en sorte que la distribution des larves de moustiques n'est pas aléatoire, mais répond à certains besoins.
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
Tableau 3 : Distribution des Anopheles nili et Anopheles moucheti en fonction du type de plantes aquatiques
Plantes aquatiques
|
Pistia |
Paspallum |
Débris |
Pistia et |
Débris |
Total |
|
|
Anopheles |
||||||
|
nili |
13 |
1178 |
161 |
358 |
199 |
1909 |
|
Anopheles |
||||||
|
moucheti |
290 |
50 |
19 |
308 |
0 |
667 |
|
Autres |
2 |
0 |
201 |
51 |
108 |
362 |
|
Total |
305 |
1228 |
381 |
717 |
307 |
2938 |
Lorsqu'on observe le tableau 3 ci-dessus, sur les 1909 larves d'Anopheles nili collectées, plus de 80 % provenaient des collectes faites sous les nappes de Pistia ou Paspallum. Il en est de même pour Anopheles moucheti. Quelques rares spécimens d'Anopheles moucheti (moins de 5 %) ont été collectées sous les feuilles mortes, résidus de bois (des débris végétaux).
En vue de confirmer l'association entre le type de plantes aquatiques et la nature des espèces de larves, nous avons effectué le test du Khi-deux de Pearson (voir tableau 4 suivant)
Tableau 4 : Résultat du test d'indépendance entre le type d'anophèle et la nature des plantes
Tests du Khi-deux
|
Valeur |
ddl |
Signification |
|
|
Khi-deux de Pearson Rapport de vraisemblance Association linéaire par linéaire Nombre d'observations valides |
1309,809a 1380,371 21,334 2576 |
4 1 |
,000 ,000 |
a. 0 cellules (,0%) ont un effectif théorique inférieur à 5. L'effectif théorique minimum est de 46,61.
Ce test montre qu'il y a une forte association entre la nature des plantes aquatiques et l'abondance des larves. En effet, la valeur du Khi-deux de Pearson est de 1309,8 avec une p-valeur inférieure à 1 % (p-valeur <0,01).
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
La nature du sol est essentielle pour mettre en évidence certaines propriétés chimiques du milieu. Lorsqu'on observe le tableau 5, on remarque que, 1011 larves d'Anopheles nili ont été retrouvées sur les sols argileux. 513 larves ont été collectées sur sol latéritique et 385 ont été recensées sur les sols sablonneux. À la différence de Anopheles nili, Anopheles moucheti a été collectée essentiellement dans les cours d'eaux au sol latéritique : sur les 667 larves collectées, 536 ont été recensées dans les cours d'eaux au sol latéritique.
Tableau 5 : Distribution des larves de Anopheles nili et Anopheles moucheti selon le type de sol
|
Nature du sol |
||||
|
Latéritique |
Argileux |
Sablonneux |
Total |
|
|
Anopheles nili |
513 |
1011 |
385 |
1909 |
|
Anopheles moucheti |
536 |
93 |
38 |
667 |
|
Autres larves |
50 |
44 |
268 |
362 |
|
Total |
1099 |
1148 |
691 |
2938 |
En vue de confirmer l'association entre la nature du sol et le type de larves, nous avons effectué le test du Khi-deux de Pearson (voir tableau 6 suivant)
Tableau 6 : Résultat du test d'indépendance entre le type d'anophèle et la nature du sol
Tests du Khi-deux
|
Valeur |
ddl |
Signification |
|
|
Khi-deux de Pearson Rapport de vraisemblance Association linéaire par linéaire Nombre d'observations valides |
585,866a 599,141 445,355 2576 |
2 1 |
,000 ,000 |
a. 0 cellules (,0%) ont un effectif théorique inférieur à 5. L'effectif théorique minimum est de 109,53.
Le test de Khi-deux de Pearson effectuées nous permet de confirmer pour un seuil de 1 % l'existence d'une relation entre la nature du sol et le type de vecteur. (p-valeur<0,01).
CHAPITRE IV |
|||
Nous avons constaté dans la phase de l'analyse descriptive sur la répartition des larves collectées que l'abondance des larves d'Anopheles nili et d'Anopheles moucheti serait en relation avec le type de milieu. Dans ce chapitre, l'objectif visé est la détermination des combinaisons de facteurs qui sont en relation avec la présence ou l'absence de ces espèces.
Ainsi, nous allons dans un premier temps étudier l'influence des paramètres quantitatifs pH, conductivité, potentiel d'oxydo réduction et température sur les chances de trouver Anopheles nili et Anopheles moucheti dans un milieu (IV.1), dans un second temps, nous déterminerons la combinaison du type de sol et de la végétation aquatique qui sont propices à la présence de Anopheles nili et Anopheles moucheti dans un milieu (IV.2).
Dans cette section, nous ressortirons la combinaison des facteurs pH, conductivité, potentiel d'oxydo réduction et température en relation avec la présence de Anopheles nili et Anopheles moucheti dans le milieu.
IV.1.1 Influence des paramètres sur les chances de trouver Anopheles nili dans un cours d'eau
Pour vérifier si une combinaison de deux ou plusieurs paramètres influence la probabilité de présence de Anopheles nili, nous avons effectué une régression logistique. Les variables explicatives du modèle sont : le pH, la température, la conductivité et le potentiel d'oxydo réduction. Les résultats de l'estimation du modèle pour Anopheles nili sont consignés dans le tableau 7 suivant. Nous fixons le seuil de signification à 10%.
Tableau 7 : Résultat de l'estimation du modèle de régression logistique pour Anopheles nili
Variables dans l'équation
|
B |
E.S. |
Wald |
ddl |
Signif. |
Exp(B) |
|
|
Etape PH a |
1,612 |
1,030 |
2,450 |
1 |
,118 |
5,013 |
|
1Température |
-,587 |
,331 |
3,142 |
1 |
,076 |
,556 |
|
Conductivité |
-,023 |
,019 |
1,415 |
1 |
,234 |
,978 |
|
Potentiel |
,024 |
,014 |
2,914 |
1 |
,088 |
1,024 |
a. Variable(s) entrées à l'étape 1 : PH, Température, Conductivité, Potentiel.
Il ressort du tableau 7 que pour un seuil de 10 %, seule une combinaison des facteurs température et potentiel est significatif pour mettre en évidence les chances trouver Anopheles nili dans un cours d'eau. Si la température diminue pendant que le potentiel d'oxydo réduction augmente, la probabilité de trouver ce vecteur dans le cours d'eau augmente.
IV.1.2 Influence des paramètres sur les chances de trouver Anopheles moucheti dans un cours d'eau
De même que pour Anopheles nili, nous avons effectué un modèle de régression logistique qui nous permet de voir comment ces paramètres du milieu influencent les chances de trouver où non Anopheles moucheti dans un cours d'eau. En prenant les paramètres température, pH, potentiel d'oxydo réduction et conductivité comme variables explicatives pour la construction de notre modèle, nous avons obtenu les résultats du tableau 8 suivant.
.
Tableau 8 : Résultat de l'estimation du modèle de régression logistique pour Anopheles
moucheti
Variables dans l'équation
|
B |
E.S. |
Wald |
ddl |
Signif. |
Exp(B) |
|
|
Etape Température a |
,089 |
,225 |
,155 |
1 |
,693 |
1,093 |
|
1Potentiel |
,004 |
,011 |
,159 |
1 |
,690 |
1,004 |
|
PH |
-,774 |
,782 |
,980 |
1 |
,322 |
,461 |
|
Conductivité |
,048 |
,023 |
4,391 |
1 |
,036 |
1,049 |
a. Variable(s) entrées à l'étape 1 : Température, Potentiel, PH, Conductivité.
Pour le seuil 10 %, le tableau 8 montre que seul le paramètre conductivité influence significativement la probabilité de trouver Anopheles moucheti dans un cours
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
d'eau. Si la conductivité augmente, la probabilité de trouver ce vecteur dans le milieu augmente. L'influence des autres facteurs n'étant pas significative.
Les résultats du test U de Mann-whitney confirme l'influence de la conductivité sur la présence de Anopheles moucheti (voir tableau 9 suivant). Le test U de Mann-Whitney (nous l'avons présenté au chapitre II) est un test non paramétrique. Il est applicable lorsque les données ne suivent pas une loi d'un type connu et est adapté aux échantillons de taille réduite. Pour un seuil de 10 %, le paramètre conductivité ne suit pas une loi normale : P = 0,09 < 10 % (voir annexe 2, tableau 13). Les résultats de ce test sont consignés dans le tableau 12. L'hypothèse nulle est :
Ho : la conductivité moyenne des cours d'eau où Anopheles moucheti est présente et celle des cours d'eau où il est absent sont identiques,
Contre l'hypothèse alternative :
H1 : la conductivité moyenne des cours d'eau où Anopheles moucheti est présent et celle des cours d'eau où il est absent sont différentes.
Tableau 9 : Résultat du test U de Mann-Whitney
Test b
|
Conductivité |
||
|
U de Mann-Whitney W de Wilcoxon Z Signification asymptotique (bilatérale) Signification exacte [2*(signification unilatérale)] |
25,500 91,500 -2,822 ,005 |
a |
a. Non corrigé pour les ex aequo.
b. Critère de regroupement : Moucheti
Il ressort du tableau 12 que la conductivité moyenne des cours d'eau où les Anopheles moucheti étaient présents et celle des cours d'eau où ils étaient absents diffèrent significativement. Autrement dit, le paramètre conductivité permet de distinguer la présence ou l'absence de Anopheles moucheti dans un cours d'eau.
Au terme de cette section, nous pouvons affirmer que, pour un seuil de 10%, si la température diminue pendant que le potentiel d'oxydo réduction augmente, la probabilité
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
de trouver Anopheles nili dans un cours d'eau augmente. Si la conductivité augmente, la probabilité de trouver Anopheles moucheti dans le milieu augmente.
Dans la suite, nous déterminerons la nature du sol ainsi que le type de végétation aquatique propice au développement de chacun de ces vecteurs du paludisme.
Dans cette section, nous nous proposons de déterminer le type de sol ainsi que la végétation aquatique qui sont propices à chaque type d'anophèles. Pour cela nous allons effectuer une analyse des correspondances multiples (nous l'avons présentée au chapitre 2). Cette étude est adaptée à l'analyse des variables qualitatives. Dans notre base de données nous avons considéré trois variables qualitatives :
· Le type de vecteurs avec 2 modalités : Anopheles nili ou Anopheles moucheti.
· La nature du sol avec trois modalités : Latéritique, Argileux, ou Sablonneux.
· Le type de plantes aquatiques avec 5 modalités : Pistia, Paspallum, Débris végétaux, Pistia+paspallum (mélange de Pistia et de Paspallum), Débris végétaux+paspallum (mélange de Paspallum et de Débris végétaux).
· L'acidité du milieu (pH_milieu) avec 3 modalités : Acide, Neutre, Basique.
Nous nous proposons d'étudier les associations existantes entre les différentes modalités de ces variables.
Nous avons effectué cette analyse des correspondances multiples avec le logiciel SPAD. Les résultats sont présentés à l'annexe 3. Lorsqu'on observe ces résultats, on constate que le premier axe explique à lui seul 32,56 % de la variabilité totale. Ensemble, les deux premiers axes expliquent 57,74 % de l'inertie totale. Le résultat graphique de la projection des variables sur ces deux premiers axes factoriels sont représentés sur le graphique suivant.
Graphique 5 : Résultat de la projection des variables sur les facteurs 1 et 2
Seules les modalités dont la contribution à la formation d'un axe est élevée, sont à considérer pour l'interprétation de cet axe factoriel.
Les modalités à considérer pour l'interprétation de l'axe 1 sont pour chacune des variables suivantes :
· Anophèles (type de vecteurs) : Anopheles moucheti (dont la contribution vaut 16,6 %) et Anopheles nili (avec une contribution de 5,8 %). Ces deux modalités représentent à elles seules 22,4 % de l'inertie de l'axe 1. Elles ont chacune un cosinus carré de 0,66.
· Type de plantes aquatiques : les plantes Pistia (ayant pour contribution 8,4 %), Paspallum (avec pour contribution 7,2 %) et Pistia+Paspallum (dont la contribution est de 8,5 %). Ces trois modalités représentent 24,1 % de l'inertie du premier axe factoriel. Leurs cosinus carré sont respectivement 0,28 ; 0,40 et 0,33.
· Nature du sol : Latéritique (ayant pour contribution 14,8 %), Argileux (dont la contribution est de 7,3 %). A elles seules, ces deux modalités
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
représentent 22,1% de l'inertie de l'axe 1. leurs cosinus carré respectifs sont 0,73 et 0,38.
· Acidité du milieu (pH milieu) :
Acide (avec pour contribution 15,2 %), Neutre (dont la contribution est 9,7 %).
Ces deux modalités représentent 24,9 % de l'inertie de l'axe 1.
Le cosinus carré de la modalité Acide est 0,76 et celui de la
modalité Neutre est 0,61.
Interprétation :
Nous pouvons interpréter le graphique 5 ainsi :
L'axe 1 oppose les Anopheles nili qui sont abondants dans les cours d'eau neutres, sur des sols argileux avec une végétation aquatique faite de plantes Paspallum, aux Anopheles moucheti qui sont nombreux dans les cours d'eau acides, sur des sols latéritiques avec une végétation aquatique faite de plantes Pistia et aussi d'un mélange de Pistia et de Paspallum.
Nous consignons ces résultats dans le tableau 10 suivant.
Tableau 10 : Nature du sol, type de plantes et pH du milieu propices au développement des
vecteurs
|
Anopheles nili |
Anopheles moucheti |
|
|
Sol propice |
Sols argileux |
Sols latéritiques |
|
Plantes aquatiques propices |
Paspallum |
Pistia ou Pistia +Paspallum |
|
pH propice |
Milieux neutres |
Milieux acides |
Au terme de ce chapitre, nous pouvons dire que Anopheles nili et Anopheles moucheti ont chacun des préférences quant aux paramètres du milieu.
Lorsque la température diminue et le potentiel d'oxydo réduction augmente, la probabilité de trouver Anopheles nili augmente. Pour Anopheles moucheti, si la conductivité augmente, les chances de le trouver dans un cours d'eau augmentent. Tandis que les larves de Anopheles nili trouvent un abri favorable sous les plantes Paspallum, dans un cours d'eau neutre et sur un sol argileux, celles de Anopheles moucheti sont majoritaires dans les cours d'eau acides, sur un sol latéritique et s'abritent de préférence sous les plantes Pistia ou d'un mélange de Pistia et de Paspallum.
La Partie discussion qui va suivre, nous permettra de confronter nos résultats avec des études antérieures, de faire certaines remarques et proposer des recommandations.

Anopheles nili et Anopheles moucheti étaient présents dans la plupart des rivières et fleuves prospectés. Ces informations sont conformes à la carte de distribution de ces espèces au Cameroun et en Afrique (Gillies et De Meillon, 1968) ; (Antonio-Nkondjio et al., 2006). Toutefois nous avons relevé une hétérogénéité quant à la répartition de ces espèces qui pourrait refléter la variation des propriétés physico-chimique des cours d'eau de cette région. Pendant cette étude, plusieurs paramètres ont été mesurés il s'agit de la température, pH, potentiel d'oxydo-réduction, conductivité, présence des plantes aquatiques et type de sol. Pour Anopheles moucheti, exception faite de la conductivité dont les valeurs moyennes égales à 26,288 uS/cm étaient associées à sa présence et à son abondance dans un cours d'eau, les autres paramètres pris isolément n'ont pas été significatifs pour expliquer la présence ou l'absence de ce vecteur. Ceci suggère entre autre que la présence ou l'absence de ce vecteur est liée à une interaction complexe entre les différents facteurs du milieu. Des observations comparables ont été rapportées des études effectuées sur les larves des membres du complexe Anopheles gambiae au Sénégal et au Mali (Awono-Ambene et al., 1998) ; (Edillo et al., 2006). Les conditions favorables au développement du vecteur Anopheles moucheti étaient donc: conductivité moyenne de 26,288 uS/cm, pH moyen de 5,862 et température moyenne de 24,873°C. Par contre chez Anopheles nili les conditions favorables étaient : conductivité moyenne de 69,33 uS/cm, pH moyen de l'ordre de 6,51, température moyenne de 24,999°C et potentiel d'oxydo réduction moyen de 159,40 mV. Toutefois, remarquons que Anopheles nili a semblé tolérer de fortes variations des paramètres physicochimiques du milieu, ce qui justifierai probablement sa large distribution à travers le continent africain contrairement à Anopheles moucheti qui est confiné au domaine forestier et péri-forestier (Gillies et De Meillon, 1968), (Hervy et al., 1997).
D'autres paramètres du milieu répertoriés au cours de cette étude ont semblé jouer un rôle déterminant dans la distribution des larves de ces deux espèces. C'est le cas des plantes aquatiques du type Pistia ou Paspallum qui étaient toujours associées à la présence et à l'abondance des larves de ces 2 espèces. Ces plantes en abritant les larves régulent la dynamique des populations de ces espèces et limitent l'action néfaste de la prédation sur ces populations. Il a été démontré que la prédation des larves par le biais des poissons larvivores pouvait influencer significativement la dynamique des populations d'anophèles (Awono-Ambene et al., 1998). Dans ces cours d'eaux la
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
présence de prédateurs tels que les poissons larvivores, les larves d'odonates, les odonates (Exemple : les libellules) pourraient constituer un frein au développement de ces espèces. Ceci est du moins corroboré par le fait que les densités larvaires diminuent considérablement avec la destruction des plantes aquatiques le long du fleuve ou après élimination naturelle de ces plantes pendant la saison sèche (Antonio-Nkondjio et al., 2005). Ces informations pourraient s'avérer utile dans le contrôle de ces vecteurs dans leur milieu de vie. Certaines espèces de poisson du genre Gambusia ou Tilapia sont largement utilisées dans la lutte biologique contre les moustiques.
Il faut toutefois noter que certains facteurs du milieu non mesurés au courant de cette étude telle que la teneur en ions, orthophosphate, nitrite ou densité optique pourraient mieux expliquer la distribution de ces espèces.
Notre étude a porté sur les facteurs du milieu dont la présence ou l'absence expliquerait le mieux la distribution des larves d'Anopheles nili et d'Anopheles moucheti. Sur un plan global il ressort de cette étude que la présence et la distribution des larves de ces deux espèces répondent à un complexe système d'interaction entre les facteurs du milieu. Toutefois des études complémentaires méritent d'être menées en vue de rechercher comment de telles informations pourraient être utilisées pour le contrôle des populations de ces vecteurs qui constituent d'importants vecteurs de paludisme en Afrique subsaharienne.


Le travail dont nous venons de présenter les résultats avait pour but : i) de décrire la distribution des Anopheles nili et Anopheles moucheti au Cameroun et ensuite ii) de faire ressortir les facteurs environnementaux qui expliquent la présence et l'abondance de ces espèces d'anophèles.
Une analyse descriptive nous a permis d'abord de donner la répartition de ces larves d'anophèles dans les différents cours d'eau du sud Cameroun et ensuite de répartir les larves collectées en fonction des paramètres du milieu. L'utilisation des tests du Khideux, du test U de Mann Whitney nous a permis de mettre en évidence l'existence d'une relation entre le type de vecteurs et certains paramètres du milieu. En utilisant des régressions logistiques nous avons mesuré l'influence des paramètres pH, conductivité température et potentiel sur les chances de trouver chacun de ces vecteurs dans un cours d'eau. L'analyse des correspondances multiples nous a permis de ressortir le type de sol ainsi que la végétation aquatique propice au développement de chaque vecteur.
Au terme de ce travail, nous pouvons conclure que Anopheles nili et Anopheles moucheti sont des espèces majeures dans la transmission du paludisme au Cameroun. Il ressort de nos analyses que ces deux vecteurs du paludisme au Cameroun ne sont pas répartis au hasard dans leur environnement. Leur répartition respecte un certain nombre de critères. Si la température diminue pendant que le potentiel d'oxydo réduction augmente, la probabilité de trouver Anopheles nili dans le cours d'eau augmente. Si la conductivité augmente, les chances de trouver Anopheles moucheti dans le milieu augmentent. Les cours d'eau où les vecteurs Anopheles moucheti étaient présents ont en moyenne une conductivité de 26,28 uS/cm, un pH de 5,862, une température de 24,873°C et un potentiel d'oxydo réduction de 200,10 mV. Par contre les cours d'eau où Anopheles nili a été retrouvé ont une conductivité moyenne de 69,33 uS/cm, un pH moyen de 6,51, une température moyenne de 24,999°C et potentiel d'oxydo réduction moyen de 159,40. Tandis que Anopheles nili trouve un abri favorable sous les plantes paspallum, dans un cours d'eau neutre à sol argileux, Anopheles moucheti quant à lui se développe majoritairement dans les cours d'eau acide où la végétation aquatique est faite de pistia ou de paspallum, sous un sol latéritique.
Ces résultats seront utiles dans la lutte antivectorielle en ce sens qu'elles permettront aux acteurs engagés dans cette lutte de pouvoir modifier les paramètres du
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
milieu de façon à créer un environnement moins favorable à la prolifération de ces vecteurs du paludisme dans les cours d'eau. Ce qui contribuerait à faire reculer le taux d'infection.
Adam, J. P. (1955). Quelques Anopheles nouveaux pour la faune camerounaise. Ann. Parasit. Hm. Camp. 20 (4) : 389 - 394.
Annan Z., Kengne P., Berthomieu A., Antonio-Nkondjio C., Rousset F., Fontenille D., & Weil M. (2003). Isolation and characterization of polymorphic microsatellitemarkers from the mosquito Anopheles moucheti, malaria vector in Africa. Mol. Ecol. Note. 56-57
Antonio-Nkondjio C., Awono-Ambene P., Toto J.c., Meunier J. Y., Zebaze-Kemleu S., Nyamban R., Wondji C. S., Tchuinkam T. & Fontenille D. (2002a). High malaria transmission intensity in village close to Yaoundé, the Capital city of Cameroon. J. Med. Entomol. 39 (2): 330-355.
Antonio-Nkondjio C., Simard F., Cohuet A., & Fontenille D. (2002b). Morphological variability in Anopheles moucheti is not indicative of speciation: evidences from sympatric south Cameroon populations. Infect, Gen. and Evol. 2:69-72.
Antonio-Nkondjio C. (2003). Biologie, comportement et structure génétique d'Anophèles moucheti, vecteur de plasmodium au Cameroun. Thèse de doctorat, université de Yaoundé I.
Antonio-Nkondjio C., Simard F., Awono-Ambene P., Ngassam P., Toto J. C., Tchui T. & Fontenille D. (2005) : Malaria vectors and urbanization in the equatorial forest region of south Cameroon. Royal Soc. Of Trop. Med. And Hyg. 99 : 347-354.
Antonio-Nkondjio C., Hinzoumbe-Kerah C., Simard F., Awono-Ambene P. (2006). Complexity of the Malaria vectorial system in Cameroon: Contribution of secondary vectors to Malaria transmission. J. Med. Entomol 43(6) : 1215-1221.
Ayala F. J. (1976). Molecular evolution. Sinauer Associates, Sunderland, Mass.
Awolola T. S., Okwa O., Hun T. R., Ogurinade A. F. & Coetzee M. (2002). Dynamics of the malaria-vector populations in costal Lagos, south-western Nigeria. Am. Trop. Med. Parasitol. 96 (1) : 75-82.
Awono-Ambene, Kengne P., Simard F., Antonio-Nkondjio, Fontenille D. (2004), Description and Bionomics of Anopheles (Cellia) ovengensis (Diptera : Culicidae), a New Malaria Vector Species of the Anopheles nili Group from South Cameroon. J. Med. Entomol. 41 (4) : 561-568.
Awono-Ambene, Robert V. & Thioulouse J. (1998), Ecology of larval mosquitoes, with special reference to Anopheles arabiensis in Market-Garden Wells in Urban Dakar, Senegal. J. Med. Entomol. 35(6) : 948-955.
Bourbonnais Regis, Econométrie, manuel et exercices corrigés, 5ième édition.
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
Bowcok A. M., Ruiz Lineares A., Tomfohrde J., Minch E., Kidd J.R. & Cavalli-Sforza L. L. (1994). High resolution of human evolutionary tree with polymorphic microsatellites. Nature 368:455- 457.
Carnevale P., Le Goff G., Toto J. C. & Robert V. [1992]. Anopheles nili as the main malaria vector of human malaria in village of sourthern Cameroun. Med. Vet. Entomol. 6: 135-138.
Coustani C., Li S. G, Delle-Tore A., Sagnon N.F., Coluzzi M. & Talylor C. E. (1996). Density, survival and dispersal of Anopheles gambiae complex mosquitoes in west African Sudan savanna village. Med. Vet. Ent. 10: 203-219.
Danis M. & Mouchet J. (1991). Paludisme. Paris, Université francophone UREF. 240pp.
Edillo, Frederic Tripét, Yeya T Touré, Grégory C Lanzaro, Guimogo Dolo and Charles E Taylor.[2006] Water quality and immatures of the M and S forms of Anopheles gambiaes s.s. and Anopheles Arabiensis in Malian village. Malaria Journal
Evans, A. M. (1931) . - Notes on African Anophelines. Annals of tropical Medicine and parasitology, 25 : 129 - 143.
Evans, M. H. (1925). - A new variety of Anopheles marshalli from the Belgian Congo. Annals of tropical Medicine and parasitology, 19 : 211 - 213.
Fontenille D., Cohuet A., Awono-Ambene P., Antonio Nkondjio C. & Simard F. (2003). Systématique et biologie des anophèles vecteurs de plasmodium en Afrique: données récentes. Med. Trop. 63 : 247-253.
Garde X., Njan Nloga A., Toto J. C., Carneval P. & Robert V. (1991). Résultat d'une enquête entomologique à Dschang (Cameroun). Ouest-Santé 3 : 2-12.
Gillies M. T. & Coetzee M. (1968). The Anophelinea of Africa south of sahara. Pub. South Afr. Inst. Med. Res. 54 : 343 pp
Gillies M. T. & Coetzee M. (1987). A supplement to the Anophelinae of Africa south of Sahara. Publications of the south African Institut for Medical Research, Johannesburg, 143 pp.
Gillies M. T. & Meillon B. (1968). The Anophelinae of Africa South of the Sahara (Ethiopian zoogeographical region). Publications of the South Africa Institute for Medical Research, Johannesburg, 20 Ed. 343 pp.
Grassi B., Bignami A., Bastianelli G. (1899). Ciclo evolutivo della semilune nell, Anopheles claviger. Atti. Soc. Studi Malar 1 :14.
Hamon J. & Mouchet J. (1961). Les vecteurs secondaires du paludisme humain en Afrique. Med. Trop. 21: 643-666.
Hervy J. P., Le Goff G., Geoffroy B., Hervé J. P., Manga L. & Brunhes J. (1998). Les anophèles de la région afro-tropicale. CD-ROM, ORSTOM-éditions, Paris.
Klein J. M., 1997. Cours de physiologie et d'écologie des moustiques. 91 p.
Krafsur, E. S. (1970) Anopheles nili as a vector of malaria in a lowland region of Ethiopia. Bull world Health Organ 42 : 466 - 71.
Languillon J., Mouchet J., Rivola E. & Rateau J. (1956). Contribution à l'étude du paludisme dans la région forestière du Sud-Cameroun. Med. Trop. 16 (3) : 247-379.
Livadas G., Mouchet J., Gariou J. & Chastang R. (1958). Peut-on envisager l'éradication du paludisme dans la région forestière du Sud Cameroun ? Estrato dalla Ravista di Malarialogiaroma 37 : 228-256.
Manson, P. (1900). Experimental proof of the mosquito - malaria theory. Lancet 2 : 923-925.
Ministère de la santé du Cameroun (2002). Plan stratégique de lutte contre le paludisme au Cameroun, 171 p
Mouchet J. & Carnevale P. (1991). Les vecteurs de la transmission. In danis M. et Mouchet J. UREF. Marketing/Ellipse (Ed). Paris. 35-58.
Mouchet J., Carneval P., Coosemans M., Julvez J., Manguin S., Richard-Lenoble D. & Sircoulon J. (2004). Biodiversité du paludisme dans le monde. Edition John Libbey Eurotext, Paris France.
NDO cyrille (2005), structure génétique des populations d'anopheles moucheti Evans, 1925 vecteur du paludisme au Cameroun : apport des marqueurs microsatellites. Université de Yaoundé I.
Njan-Nloga A., Robert V., Toto J. C. & Carnevale P. (1993b) : La durée du cycle gonotrophique d'Anopheles moucheti varie de trois à quatre jours en fonction de la proximité par rapport au gîte de ponte. Bull. Liais. Doc. OCEAC. 26 (2) 69-72.
OMS (2002). Document d'information WHO/CDS/RBM/2002.
OMS (2003). Entomologie du paludisme et contrôle des vecteurs : guide du stagiaire. Edition provisoire : 59-89 pp
OMS (2005). Rapport mondial sur le paludisme.
Rivola, E. et Holstein, M. H. (1957). Note sur une variété d'Anopheles nili (Theo). Bull. Soc. Path. Exot. 50 : 382-386.
RBM (2005) : Plan stratégique mondial faire reculer le paludisme 2005-2015.
Robert V., Awono-Ambene H.P., & Thioulouse J. (1998), Ecology of larval Mosquitoes, with special Reference to Anopheles arabiensis (Diptera : Culcidae) in Market Garden Wells in Urban Dakar, Senegal. J. Med. Entomol. 35 (6) : 948-955.
Rodhain F. et Perez C. (1985). Precis d'entomologie médicale et vétérinaire. Maloine, Ed.
Paris. 458 p.
Simard F., Lemhann T., Lemason J. J., Diatta M., & Fontenille D. (2000). Persistance of anopheles arabiensis from West Africa and eastern outer islands. Am. J. Trop. Med.
Hyg. 60 (6): 1000-1009.
Vaucel, M. and Campourcy, A. (1943). - L'anophélisme au Cameroun francais. Riv. Sci. Méd. Phar. Vet. Afr. Libre, 2 : 85.
Sites Web: http// www.malariajournal.com/content/5/1/35. http// www.oceac.org
|
Secrétariat Générale |
Cabinet |
||
Services extérieurs
Services Rattachés

Département Administratif
et
financier
Services de la
Documentation et des
Services de la Comptabilite
et du Budget


Services du Materiel et du
Personnel
Département Programme
et
Recherche

|
Services des Programmes |
||||
|
VIH |
||||
|
THA |
||||
|
PALU |
||||
|
SP |
||||
Services de la Recherche

Services des Etudes et de
la
Planification

Service de la Formation
Département des études
et
planification
Tableau 11 : Caractéristiques des paramètres des cours d'eau où Anopheles nili était présent
Statistiques descriptives
|
N |
Intervalle |
Minimum |
Maximum |
Moyenne |
Ecart type |
Variance |
||
|
Statistique |
Statistique |
Statistique |
Statistique |
Statistique |
Erreur std |
Statistique |
Statistique |
|
|
Ph |
1900 |
3,50 |
4,50 |
8,00 |
6,5171 |
,01688 |
,73575 |
,541 |
|
Température |
1900 |
9,00 |
21,20 |
30,20 |
24,9985 |
,04190 |
1,82624 |
3,335 |
|
conductivité |
1900 |
356,00 |
8,00 |
364,00 |
69,3316 |
,80456 |
35,07007 |
1229,910 |
|
potentiel |
1900 |
198,00 |
112,00 |
310,00 |
159,4026 |
,95787 |
41,75247 |
1743,269 |
|
N valide (listwise) |
1900 |
|||||||
Tableau 12 : Caractéristiques des paramètres des cours d'eau où Anopheles moucheti était présent et celles des cours d'eau où il était absent
Statistiques descriptives
|
N |
Intervalle |
Minimum |
Maximum |
Moyenne |
Ecart type |
Variance |
||
|
Statistique |
Statistique |
Statistique |
Statistique |
Statistique |
Erreur std |
Statistique |
Statistique |
|
|
Ph |
667 |
2,60 |
5,40 |
8,00 |
5,8618 |
,01409 |
,36386 |
,132 |
|
Température |
667 |
5,10 |
21,50 |
26,60 |
24,8726 |
,04574 |
1,18134 |
1,396 |
|
conductivité |
667 |
356,00 |
8,00 |
364,00 |
26,2879 |
2,25053 |
58,12308 |
3378,292 |
|
potentiel |
667 |
173,00 |
112,00 |
285,00 |
200,1019 |
1,47151 |
38,00381 |
1444,290 |
|
N valide (listwise) |
667 |
|||||||
Tableau 13 : Résultat du test de normalité des paramètres des cours d'eau étudiés
Test de Kolmogorov-Smirnov à un échantillon
|
PH |
Température |
Conductivité |
Potentiel |
|
|
N |
25 |
25 |
25 |
25 |
|
Paramètres normaux a,b Moyenne |
6.352 |
24.884 |
59.28 |
179.04 |
|
Ecart-type |
.9946 |
2.1075 |
75.640 |
51.283 |
|
Différences les plus Absolue |
.115 |
.115 |
.249 |
.126 |
|
extrêmes Positive |
.115 |
.074 |
.236 |
.126 |
|
Négative |
-.103 |
-.115 |
-.249 |
-.062 |
|
Z de Kolmogorov-Smirnov |
.576 |
.575 |
1.245 |
.631 |
|
Signification asymptotique (bilatérale) |
.894 |
.896 |
.090 |
.821 |
a. La distribution à tester est gaussienne.
b. Calculée à partir des données.
Distribution de Anopheles nili et Anopheles moucheti au sud du Cameroun : influence des facteurs du milieu
Tableau 14 : Résultats de la régression logistique avec tous les paramètres du milieu pour Anopheles moucheti
Variables dans l'équation
|
B |
E.S. |
Wald |
ddl |
Signif. |
Exp(B) |
|
|
Etape PH a |
-,774 |
,782 |
,980 |
1 |
,322 |
,461 |
|
1Température |
,089 |
,225 |
,155 |
1 |
,693 |
1,093 |
|
Conductivité |
,048 |
,023 |
4,391 |
1 |
,036 |
1,049 |
|
Potentiel |
,004 |
,011 |
,159 |
1 |
,690 |
1,004 |
a. Variable(s) entrées à l'étape 1 : PH, Température, Conductivité, Potentiel.
Tableau de classificationa
|
Observé |
Prévu |
||||
|
Moucheti |
Pourcentage |
||||
|
Présence |
Absence |
||||
|
Etape 1 |
Moucheti Pourcentage global |
Présence Absence |
10 4 |
1 10 |
90,9 |
a. La valeur de césure est ,500




La distribution logistique à l'origine du modèle Logit admet comme fonctions de répartition et de densité les expressions suivantes :
( ) ( )
exp x â ( ) ( )
exp x
F x â
i i
â = f x â =
i i
1 exp
+ ( )
x â 1 exp
+ ( ) 2
x â i i
On a ainsi :
1
( ) ( ) ( )
exp - x â
F x F x 1
i
â = - =
â =
i i 1 exp
+ -
( ) ( )
x â 1 exp
+ x â
i i
Remarquons que la probabilité associée à la loi logistique peut être inversée. Si on note pi la probabilité que yi = 1, on a alors la représentation suivante :
â
p i
Log =x i

1
- p i
Et l'on vérifie bien que la probabilité que yi = 1 est une fonction croissante de la combinaison linéaire
4.1. Estimation du modèle Logit
L'estimation du modèle Logit repose aussi sur la maximisation de la log-vraisemblance.
La vraisemblance s'écrit
.
1 - y y i
i
N 1 exp ( )
x â
i
L y x
( )
, , â = ?
1 exp
+ ( )
x â 1 exp
+ ( )
x â
i = 1 i i
soit la log-vraisemblance :
N { ( ) ( ( ) ) ( ) ( ( ) ) }
- 1
= -
Log L 1 y Log 1 exp
+ x + y x yLog
- 1 exp
+ x
i i â i i â i i â
i=1
N
=- {( ) }
Log 1 exp
+ x yx
â â
-
i i i
i=1
Les conditions du premier ordre sont :
N N
? LogL exp N
( )
x i â
G ( â ) = = yx ' - x ' = ?
0 y F x x
- ( â ) ' = 0
i i
? + ( ) i i i
â = i
1 1 1 exp x
i i = i â
i=1
Le Hessien est :
N exp ( )
x i â
H ( )
â = - x x
' i i

( ) 2
i = 1 1 exp
+ x i â
Après convergence, les valeurs des probabilité estimées sont alors calculées en remplaçant â par son estimation â.
exp ( )
Pi =
x â à
i
( )
x â à
i
1 exp
+
4.2. Effets marginaux
Les effets marginaux mesurent la sensibilité de la probabilité de l'événement yi = 1 par
rapport à des variations dans les variables explicatives xi. En plus des multiples avantages que présente la forme de la fonction logistique, il existe une égalité qui est en outre particulièrement intéressante en ce qui concerne l'analyse économique des résultats d'estimation. Il s'agit de la relation suivante
P
xi â = i
e
1 - P i
En effet, on sait que la probabilité Pi désigne la probabilité associée à l'événement complémentaire yi = 1, et que 1-Pi désigne par conséquent la probabilité associée à l'événement complémentaire yi = 0.
De façon générale, la quantité c i = p i (1 - p i ) représente le rapport de la probabilité
associée à l'événement yi = 1 à la probabilité de non survenue de cet événement : il s'agit de la cote. Dans un modèle Logit, cette cote correspond simplement à la quantité xi
e â :
xi â
P i
c = = e
i 1 P
|
- |
i |
Si ce rapport est égal à ci pour l'individu i, cela signifie qu'il a ci fois plus de chance que l'événement associé au code yi = 1 se réalise, qu'il ne se réalise pas.

