

Présenté et soutenu par
Adolphe Sètondji AVOCANH
Thème: Lutte biologique contre
l'adventice
Imperata cylin drica (L.) Beauv., à partir
des
champignons pathogènes indigènes au
Bénin
Directeur de Recherche Directeur de Mémoire
Dr. Fenton BEED Prof. Adam AHANCHEDE
Phytopathologiste Agronome Malherbologiste
Institut International d'Agriculture Faculté des
Sciences Agronomiques
Tropicale (IITA-Bénin) (FSA/UAC)
REPUBLIQUE DU BENIN
UNIVERSITE D'ABOMEY CALAVI
Ecole Doctorale
Pluridisciplinaire: Espace Cultures et Développement
MEMOIRE POUR L'OBTENTION DU DIPLÔME D'ETUDES
APPROFONDIES (DEA)
Option : Gestion de l'environnement
Spécialité: Environnement et développement
i
Sommaires
Titre page
Sommaires i
DEDICACE iii
REMERCIEMENTS iv
Liste des tableaux vi
Liste des Figures vii
Liste des annexes x
Liste des sigles et abréviations xi
Introduction 1
CHAPITRE 1 : REVUE DE LITTERATURE a
1.1 Biologie, écologie et gestion de I. cylindrica 4
1.1.1 Systématique 4
1.1.2 Description morphologique 4
1.1.3 Biologie 4
1.1.4 Distribution Géographique 5
1.1.5 Importance agronomique et économique de Imperata
cylindrica dans la
problématique du développement 8
1.1.6 Méthodes classiques de lutte contre I.
cylindrica 9
1.1.6.1 Lutte mécanique 9
1.1.6.2 Lutte culturale 10
1.1.6.3 Lutte chimique 11
1.2 Théorie et principes de la lutte biologique 12
1.2.1 Lutte biologique classique 12
1.2.2 Lutte biologique inondative 14
1.3 Les options de la lutte biologique contre I. cylindrica
16
CHAPITRE 2 : MATERIEL ET METHODES a
2.1 Production de plants de I. cylindrica 18
2.2 Prospection des champignons pathogènes 19
2.2.1 Collecte des feuilles avec symptômes 19
2.2.2 Isolement des champignons à partir des feuilles
malades 20
2.2.3 Détermination de la pathogénicité:
vérification du postulat de Koch 21
2.2.4 Identification et conservation des pathogènes 21
2.3 Etude des caractéristiques physiques des isolats
22
2.3.1 Choix des isolats pour l'étude 22
2.3.2 Aspects et croissance radiale des colonies des isolats
choisis sur Potato
Dextrose Agar (PDA) 23
2.3.3 Production en masse des spores 24
ii
2.3.3.1 Les milieux et substrats utilisés 24
2.3.3.2 Inoculation des milieux et substrats 24
2.4 Etude de la virulence des isolats 25
2.4.1 Préparations des inocula utilisés 26
2.4.1.1 Les Suspensions de mycélia 26
2.4.1.2 Les Suspensions de spores 26
2.4.2 Virulence in vitro 26
2.4.3 Virulence in vivo 27
2.5 Analyse des données 29
CHAPITRE 3 : RESULTATS a
3.1 Résultats 30
3.1.1 Prospection, isolement et pathogénicité
30
3.1.2 Etude des caractéristiques physiques
différentiels entre les isolats 42
3.1.2.1 Choix des isolats 42
3.1.2.2 Caractéristiques physiques et croissances radiales
sur milieu artificiel PDA
des isolats choisis 42
3.1.2.3 Production de spores 50
3.1.3 Etude comparée de la virulence des isolats 52
3.1.3.1 Virulence in vitro 52
3.1.3.2 Virulence in vivo 57
CHAPITRE 4 : DISCUSSIONS a
4.1 Discussion 64
4.1.1 Prospection pour la collecte des isolats, leur isolement
et test de pathogénicité 64
4.1.2 Caractéristiques physiques des isolats 66
4.1.3 Etude comparée de la virulence des isolats 66
Conclusions et recommandations 69
Références bibliographiques 71
ANNEXES a

DEDICA CE
A toi Nassirath, et à nos enfants, Yasmine,
Fen,
Adnete et Nasnette, vous êtes les mobiles de
ma
motivation. Ce travail vous est particulièrement
dédié
iv
REMERCIEMENTS
Ce travail est intégralement réalisé
grâce au soutien matériel de l'Institut International
d'Agriculture Tropicale, station du Bénin. Nous témoignons ici
nos remerciements à toutes les autorités de cet institut. En
particulier au Dr James Braima, Directeur de l'IITA-Bénin et au Dr
Fenton Beed chercheur à l'IITA-Bénin et chef de la section de
lutte microbiologique contre les mauvaises herbes, qui a co-supervisé ce
travail;
Nous remercions Prof. Adam Ahanchédé,
Maître de conférences à la Faculté des Sciences
Agronomiques (FSA) de l'Université d'Abomey Calavi (UAC), pour avoir
accepté de superviser ce travail;
Egalement merci à Prof. Bonaventure Ahohuendo,
Maître de Conférences à la Faculté des Sciences
Agronomiques (FSA) de l'Université d'Abomey Calavi (UAC), pour le temps
qu'il a sacrifié pour suivre et améliorer la qualité de ce
travail;
Nous adressons notre sincère gratitude à tous
les enseignants de la formation doctorale, Espace, Culture et
Développement pour tous les enseignements reçus;
Notre reconnaissance à Dr. Peter Neuenschwander qui
malgré ses multiples occupations nous a aidé à parfaire ce
document;
A vous tous qui avez de près ou de loin,
contribué à ce travail, nous disons merci. Nous pensons
spécialement à Dr. Rachidatou Sikirou, Dr. Alexis Honzo, Dr
André Fanou, Dr. Léonard Afouda, Dr. Fabien Hountondji, Dr. Afio
Zannou, Dr. Pierre Vissoh, M Damien Gbado, M. Denis Djegui, M. Cyria que
Agboton, M. Kpindou Douro, M. John Laloudé, M. Sylvain Anato, Mme Berthe
Rasoamampionona et Mme Prisca Aguessi;
A tous mes collègues de service pour leur apport
technique nous disons merci, Il s'agit de Mme Josephine Hotègni, M.
André Aivodi, M. Germain Kolombia, M. Flavien Zinsou, M. Vincent Ezin,
et M. Firmin Adjahossou;

Notre reconnaissance va également à M.
Yussuf Rémi et M. Moussa Mahaman pour leur assistance à la
réalisation des cartes de ce document;
Nous remercions particulièrement Mme Sidicath
Ayeni, pour son soutien pour la collecte des données des prospections et
tous les chauffeurs de l 'IITA-Bénin qui nous ont conduits lors de nos
différents déplacements particulièrement à M.
Firmin Hounkposso et à M. Mathieu Houssou.
vi
Liste des tableaux
Titres Pages
Tableau 1: Quelques champignons commercialisés ou
utilisés comme agents de lutte
biologique 14
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin 33
Tableau 3: Nombre d'isolats obtenus par zone et par
département 40
Tableau 4: Résultats du test de
pathogénicité des41 isolats choisis, sur Jeunes plants
de I. cylindrica 41
Tableau 5: Nombre (X
107) de spores produites par flacon par chaque type de milieu ou
substrat 51
Tableau 6: Dimensions et formes des spores 52
Tableau 7: Classification des isolats suivant leur virulence
in vitro 57
Tableau 8 : Moyennes des étendues des lésions 6
semaines après pulvérisation in vivo,
de suspension de mycélium à 5% p/v et de spore
suspension à 106 de spore/ml 62
Tableau 9: Comparaison de
la production de nouvelle feuilles 6 semaines après
Pulvérisation in vivo, de suspension de
mycélium et de spore 63
Liste des Figures
Titre Page
Figure 1: Distribution de I. cylindrica au Bénin
(Taux d'infection) 7
Figure 2: Semis de I. cylindrica sur du coton (a) jeunes
plantes de I. cylindrica
transplantées après semis ( b) 18
Figure 3: Cage d'expérimentation 28
Figure 4: Système d'incubation (a), pulvérisation
simultanée des 4 plantes du même traitement (b) 28
Figure 5:
Proportions des pathogènes collectés dans les trois zones (a),
selon les
saisons (b), dans la ZH seule (c) et dans la ZSH seule (d)
37
Figure 6: Lésions dues à C. caudatum (a),
lésions dues à G. cingulata et Glomerella
spp.(b) et lésions causées par B. sacchari, D.
gigantea E. rostratum ou E.
longirostratum (c) 38
Figure 7: Carte de distribution
des espèces retrouvées sur I. cylindrica au
Bénin. BIS =
B. sacchari, COC = C. caudatum, DRG = D.
gigantea, EXL = E. longirostratum EXR
= E. rostratum, GLC = G. cingulata et GLSP =
Glomerella spp. 39
Figure 8: Colonies de B. sacchari du
Bénin (BISBEN (a)) et des Florides ( BISFLOR
(b)) 43
Figure 9: Croissances radiales sur PDA des 3 isolats
de B. sacchari en 7 jours
(moyenne de 3 répétitions) 44
Figure 10:
Croissances radiales sur PDA des 4 isolats de C. caudatum en 7
jours
(moyenne de 3 répétitions) 44
Figure 11:
Différents aspects présentés par les colonies de C.
caudatum sur PDA après
7 jours 45
Figure 12: Aspects morphologiques des
micélia de DRGBEN1 (a) et de
DRGFLOR1(b) 46
Figure 13: Croissance radiale sur PDA de
DRGBEN1 et de DRGFLOR1 en 7 jours
(moyenne de 3 répétitions) 47
Figure 14: Aspects
morphologiques présentés par EXLBEN1 (a), EXLFLOR1 (b) et
EXLBEN2 (c) sur PDA 48
Figure 15: Croissances radiales des 3 isolats de E.
longirostratum sur PDA en 7 jours (moyenne de 3 répétitions)
49
Figure 16: Aspects morphologiques présentés par EXRBEN1
(a), EXRBEN2 (b),
EXRBEN3 (c) et EXRFLOR1 (d) 49
Figure 17: Croissance radiale des isolats de E.
rostratum (moyenne de 4 répétitions) 50
Figure 18: Evolution des lésions causées in
vitro, par les isolats de B. sacchari. Symptômes
évalués sur des morceaux de feuilles en boîtes humides
(moyennes de 4 répétitions avec les écarts types)
54
Figure 19: Evolution des lésions causées in vitro,
par les isolats de C. caudatum. Symptômes
évalués sur des morceaux de feuilles en boîtes humides
(moyennes de 4
répétitions avec les écarts types)
54
Figure 20: Evolution des lésions causées in vitro,
par les isolats de D. gigantea. Symptômes
évalués sur des morceaux de feuilles en boîtes humides
(moyennes de 4
répétitions avec les écarts types)
55
Figure 21: Evolution des lésions causées in vitro,
par les isolats de E. longirostratum Symptômes
évalués sur des morceaux de feuilles en boîtes humides
(moyennes de 4
répétitions avec les écarts types)
55
Figure 22: Evolution des lésions causées in vitro,
par les isolats de E. rostratum Symptômes évalués
sur des morceaux de feuilles en boîtes humides (moyennes de 4
répétitions avec les écarts types)
56
Figure 23: Evolution des lésions causées in vivo
par les isolats de B. sacchari après utilisation de suspension
à 106 de spore/ml (a) et de suspension de mycélium
à 5% p/v
(b) comme inoculum. BISBEN = B. sacchari originaire du
Bénin, BISFLOR = B. sacchari originaire des Florides, chiffre
(1, 2) = ordre d'isolement. 58
Figure 24: Evolution des lésions
causées in vivo par les isolats de C. caudatum
après utilisation de suspension de spore à 106 de
spore/ml (a) et de suspension de mycélium à
5% p/v (b) comme inoculum. COCBEN = C. caudatum
originaire du Bénin, chiffre 8,11,41,48 = ordre d'isolement 59
Figure
25: Evolution des lésions causées in vivo par les
isolats de D. gigantea après utilisation de suspension à
106 de spore/ml (a) et de suspension de mycélium à 5%
p/v
(b) comme inoculum. DRGBEN = D. gigantea originaire du
Bénin, DRGFLOR= D. gigantea originaire des Florides, chiffre 1
= ordre d'isolement 59
Figure 26: Evolution des lésions
causées in vivo par les isolats de E. longirostratum
après utilisation de suspension à 106 de spore/ml (a)
et de suspension de mycélium à
5% p/v (b) comme inoculum. EXLBEN = E. longirostratum
originaire du Bénin, EXLFLOR= E. longirostratum originaire des
Florides, chiffre 1 et 2 = ordre d'isolement 60
Figure 27: Evolution des
lésions causées in vivo par les isolats de E.
rostratum après utilisation de suspension à 106
de spore/ml (a) et de suspension de mycélium à 5% p/v
(b) comme inoculum. EXRBEN = E. rostratum originaire du
Bénin, EXRFLOR= E. rostratum originaire des Florides, chiffre
1, 2 et 3 = ordre d'isolement 61
Liste des annexes
Titre page
Annexe 1: Préparation du milieu de culture Eau-Agar 79
Annexe 2: Préparation du milieu de culture Potato Dextrose
Agar (PDA) 79
Annexe 3: Méthode de conservation des champignons sur
silicagel, et par la méthode
de cryopréservation 79
Annexe 4: Echelle d'évaluation de l'étendu des
lésions 80
xi
Liste des sigles et abréviations
ANOVA: Analysis of variance
BISBEN: Bipolaris sacchari en provenance du
Bénin
BISFLOR: Bipolaris sacchari en provenance des
Florides
OC: Degré Celsius
CABI: Centre of Agriculture and Bioscience International
cm: Centimètre
COCBEN: Colletotrichum caudatum en provenance du
Bénin
DRGBEN: Drechslera gigantea en provenance du
Bénin
DRGFLOR: Drechslera gigantea en provenance des
Florides
EPAC: Ecole Polytechnique d'Abomey Calavi
ESA: Ecole Supérieure d'Agronomie
EXLBEN: Exserohilum longirostratum en provenance de
Bénin
EXLFLOR: Exserohilum longirostratum en provenance des
Florides
EXRBEN: Exserohilum rostratum en provenance de
Bénin
EXRFLOR: Exserohilum rostratum en provenance des
Florides
FSA: Faculté des Sciences Agronomiques
GLCBEN: Glomerella cingulata en provenance du
Bénin
GLSPBEN: Glomerella spp. en provenance du
Bénin
GPS: Global Positioning System
ha: Hectare
IITA-Bénin: Institut International d'Agriculture
Tropicale, station du Bénin
JAC: Jours après culture
JAI: Jours après inoculation
L: Litre
LUBILOSA: Lutte Biologique contre les Locustes et les
Sauteriaux
ml: Millilitre
mm: Millimètre
PDA: Potato Dextrose Agar
PDB: Potato Dextrose Broth
SAI: Semaines après inoculation
SAS: Satistical Analysis System
SNK: Student Newman Keuls
UAC: Université d'Abomey Calavi
ZH: Zone humide
ZSA: Zone semi-aride
ZSH: Zone semi-humide
RESUME
Imperata cylindrica est une herbe redoutable qui
infeste toutes les cultures, et par conséquent affecte le niveau de vie
des paysans. Ce travail se propose d'étudier le potentiel des
champignons pathogènes indigènes pouvant contribuer à la
gestion de cette herbe. Pour cela, une collection de champignons
pathogènes dans les trois régions agroécolgiques du
Bénin (Zone humide (ZH), Zone semi-humide (ZSH) et Zone semi-aride
(ZSA)) a été faite en 2003 et en 2004. Celle-ci a permis
d'identifier soixante-huit (68) isolats pathogènes regroupés
entre sept (7) espèces dont Bipolaris sacchari,
Colletotrichum caudatum, Drechslera gigantea, Exserohilum
longirostratum, Exserohilum rostratum, Glomerella
cingulata et Glomerella sp. 56 isolats ont été
retrouvés dans la ZH, 10 dans le ZSH et seulement 2 dans la ZSA. Une
sélection basée sur les coordonnées géographiques
des origines des isolats et sur les tests préliminaires sur jeunes
plantes de I. cylindrica (tenant lieu de test de
pathogénicité) a abouti au choix de 12 isolats indigènes
dont B. sacchari, C. caudatum, D. gigantea, E.
longirostratum et E. rostratum auxquels nous avons ajouté
4 isolats importés des Florides, Etas Unis. (B. sacchari,
D. gigantea, E. longirostratum et E. rostratum). Les
isolats indigènes ont présenté des différences
caractéristiques par rapport aux isolats exogènes pour ce qui
concerne leur vitesse de croissance sur PDA, les aspects de leur
mycélium et les tailles et formes de leurs spores. Par ailleurs, une
simple vérification de la virulence in vitro ne donne pas
exactement les renseignements sur la virulence réelle des isolats
(in vivo). Aussi les virulences des isolats basées sur une
annotation échelonnée de 11 classes de
sévérité, ont- elles varié selon que l'on utilise
la suspension de mycélium ou la suspension de spore comme inoculum, mais
aucun des isolats n'entraîne la destruction totale des plants de I.
cylindrica. Cependant l'amélioration des techniques d'inoculation
et ou des formulations pourront permettre d'atteindre ce but dans le futur.
Les meilleurs isolats indigènes sont E.
rostratum (EXRBEN2, originaire du Mono), C. caudatum (COCBEN46,
originaire du Couffo) et C. caudatum (COCBEN8, originaire du Borgou)
avec une stabilité de classe pour COCBEN46 quel que soit le type
d'inoculum utilisé.
Mots clés : Imperata cylindrica,
zones agroécolgiques, Bénin, champignons pathogènes,
virulence, isolats indigènes, isolats exogènes, inoculum, lutte
biologique.
ABSTRACT
Imperata cylindrica is a troublesome weed which
infests all crops and consequently reduces the livelihood of farmers. This
study aims to determine the potential of fungal pathogens as biocontrol agents
for the weed Imperata cylindrica in Benin. Surveys were performed
across the three agroecological zones of the country (humid Zone (ZH),
semi-humid Zone (ZSH) and semi-arid Zone (ZSA) in 2003 and 2004. Fungal
pathogens causing disease symptoms on leaves were recovered, cultured,
identified and tested for pathogenicity leading to a collection of sixty eight
isolates from seven species; Bipolaris sacchari, Colletotrichum
caudatum, Drechslera gigantea, Exserohilum
longirostratum, Exserohilum rostratum, Glomerella
cingulata and Glomerella sp. 56 of the isolates were found in
the ZH, 10 in the ZSH and only 2 in the ZSA. From this collection 12 isolates
(B. sacchari, C. caudatum, D. gigantea, E.
longirostratum et E. rostratum) from species were selected that
originated from the most diverse locations and demonstrated the greatest
virulence after a preliminary test on young plants of I. cylindrica.
To this collection 4 further isolates (B. sacchari, D.
gigantea, E. longirostratum and E. rostratum) imported
from University of Florida (USA) were added that have shown potential in
studies as biocontrol agents for Imperata cylindrica in South East
USA. The isolates from Benin differed in culture morphology, growth rate and
conidia length and shape. A disease score was used to determine the severity of
disruption to the weed by fungal pathogens but results in virulence tests
in vitro did not compare with tests in vivo probably because
of difference between physiological capabilities, related to each isolate.
Virulence of isolates was dependent on the form of inoculum. The indigenous
isolates that demonstrated the greatest potential as biocontrol agents for
I. cylindrical, were the isolates of E. rostratum (EXRBEN2,
from Mono), C. caudatum (COCBEN46, from Couffo) and C.
caudatum (COCBEN8, from Borgou). This later is, irrespective of
inoculum type. Further studies should focus on the development of
formulations to carry these isolates and for improved application technologies
in order to increase infection levels combined with other control option can
significantly reduce the weed infestation.
INTRODUCTION
Introduction
Selon Harlet et Forno (1992), les mauvaises herbes sont des
plantes nuisibles préjudiciables à la production agricole, qui
poussent à un endroit où elles ne sont pas
désirées. Lorsque les plantes sont introduites dans un nouveau
milieu, leurs ennemis naturels sont généralement laissés
dans le milieu d'origine, et quand les conditions physiques et biotiques sont
favorables dans le nouveau milieu, ces espèces introduites, se
développent exagérément et deviennent indésirables.
Par ailleurs, il peut arriver que les activités humaines altèrent
l'environnement au point de compromettre l'équilibre assuré par
les ennemis naturels. Dans ce cas une population indigène de plantes
préalablement inoffensives peut devenir agressive et constituer un
danger. C'est le cas de Imperata cylindrica, une herbe indigène
transplantée et entretenue par les paysans béninois pour des
raisons de construction (Ahanchédé, 1988), qui est devenue
redoutable à cause de son expansion favorisée par
l'appauvrissement des terres. I. cylindrica est actuellement devenue
pantropicale dans sa distribution (Evans, 1987 Holm et al, 1977).
C'est une plante, avec un double potentiel de régénération
grâce à ses rhizomes abondants, et à ses graines facilement
dispersées par le vent. Les rhizomes prolifèrent très
rapidement et peuvent produire 4,5 millions de repousses par hectare (Soerjani,
1970) pouvant atteindre 40 tonnes de poids frais à l'hectare (Terry
et al., 1997). Un seul fragment de rhizomes peut
régénérer 350 pousses en 6 semaines (Eussen, 1980) et
atteindre 2,73 m de longueur en 109 jours (Wilcut et al. ,1983).
I. cylindrica affecte plusieurs cultures dont le maïs, le manioc,
l'igname, le niébé, l'arachide et le coton en Afrique occidentale
(Chikoye et al., 1999 ; 2000 ; 2001 ; Ayeni et al., 2004). A
cause de la compétition pour l'eau, les nutriments, et la lumière
(Atchade, 2004), et aussi à cause de ses rhizomes pointus qui
endommagent les tubercules, les pertes de rendement dues à l'infestation
de I. cylindrica sont très sévères. Elles peuvent
atteindre 80% pour le manioc et 50% pour le maïs (Chikoye et al.,
2001) et peuvent contraindre les paysans à l'abandon des terres, ce qui
contribue à l'exode rurale et au désespoir. (Ayeni et
al., 2004 ; Avocanh, 2005).
Face à la menace de I. cylindrica, les paysans
à faibles revenus ont recourt à l'usage de
méthodes de
lutte mécanique (sarclage et arrachage) qui ne sont pas efficaces
bien
qu'elles nécessitent beaucoup de main d'oeuvre et de temps de
travail (Brook, 1989), ou
au brûlis qui a montré ses limites, car la
régénérescence se produit après seulement 72 heures
(Avocanh, 2005). L'une des méthodes les plus efficaces est l'utilisation
des plantes de couverture (par exemple Mucuna sp.) ou les essences
forestières qui réduisent sensiblement l'infestation en diminuant
la quantité de lumière indispensable au développement de
l'adventice (Atchade, 2004). En effet, l'augmentation de la pression
démographique entraîne la destruction des forêts au profit
des terres cultivables et les terrains une fois mis à nus, deviennent
susceptibles à l'invasion de I. cylindrica dont le
développement est normalement handicapé par le couvert
végétal fourni par les essences forestières ou les plantes
de couverture.
Malheureusement, l'espoir suscité par l'utilisation des
plantes de couverture s'estompe de jour en jour car dans les régions
à fortes densités de populations les petits producteurs
n'acceptent pas de consacrer leurs maigres ressources (terre et main d'oeuvre)
pour une culture sans intérêt immédiat (sans valeurs
alimentaire ni commerciale). Par ailleurs, selon les paysans, les plantes de
couverture mobilisent les terres, ce qui les empêche de produire les
cultures vivrières durant la petite saison (Vissoh et al.,
2004).
Au vue des facteurs qui limitent l'adoption des
recommandations de la recherche, il est alors impérieux de
réfléchir aux solutions alternatives pour recréer
l'équilibre biologique où I. cylindrica serait
contrôlé par d'autres composants de l'environnement. Dans les
nombreux efforts de recherche de solutions, on peut citer l'utilisation des
champignons agents de luttes biologiques contre les mauvaises herbes qui est
l'une des plus récentes approches de lutte (Evans, et al.,
2001). Aussi, Beed et al, (2004) ont démontré
l'efficacité des bioherbicides exotiques et indigènes contre les
biotypes africains de Imperata cylindrica. Or, à cause du
fauchage, le brûlis, et la déforestation pour la production
agricole, I. cylindrica colonise de grandes surfaces et ses ennemis
naturels et pathogènes présents dans le milieu ne seraient pas de
ce fait suffisants pour le contenir et ont besoin donc d'être introduits
en quantité suffisante (approche mycoherbicidique). Au Bénin, le
constat de lésions foliaires sur les plantes de I. cylindrica
est une évidence à l'existence de pathogènes
indigènes capables de contrôler les infestations. Certes, la
partie la plus redoutable de la plante est constituée par les rhizomes,
cependant les pathogènes foliaires peuvent occasionner une
déplétion des
hydrates de carbones qui constituent les réserves
fondamentales des rhizomes, en drainant et en suçant les ressources
nutritives de la plantes. Elles peuvent aussi produire des toxines
systémiques qui pourront tuer l'herbe et réduire de ce fait le
potentiel d'infestation. Puisque les paysans souhaitent une application de
mycoherbicide, un produit à base de champignon qui tue les herbes, dans
le but d'une approche de lutte durable (Ayeni et al., 2004), cette
étude se propose de contribuer à la lutte intégrée
contre I. cylindrica par une approche de lutte biologique basée
sur l'utilisation de champignons pathogènes indigènes. Pour
atteindre cet objectif, la démarche suivante a été
adoptée :
· Faire l'inventaire des pathogènes de I.
cylindrica au Bénin ;
· Caractériser morphologiquement les isolats
inventoriés et confirmer leur pathogénicité;
· Sélectionner les souches et espèces de
champignons plus virulents et donc capables de lutter contre I.
cylindrica.
CHAPITRE 1 : REVUE DE LITTERATURE
1.1 Biologie, écologie et gestion de I.
cylindrica
1.1.1 Systématique
I. cylindrica est un végétal de
l'embranchement des Spermaphytes, du sous-
embranchement des Angiospermes, de la classe des
Monocotylédones, de l'ordre des Cyperales, de la famille des
Poaceae, de la sous famille des Panicoidae, de la tribu des
Andropogoneae, de la sous tribu des Saccharinae, du genre
Imperata et de l'espèce cylindrica. C'est est une
graminée monocotylédone, ainsi son méristème apical
reste proche de la surface du sol alors que les feuilles sont
érigées. Hubbard et al. (1944), reconnaissent cinq
variétés de I. cylindrica: Var. condensata
(2n=10), Var. major (2n = 20), Var. lactifolia (2n=30),
Var. africana (2n = 40), Var. europa (2n = 60).
1.1.2 Description morphologique
I. cylindrica est une herbe érigée
à rhizome dont la pousse est un chaume cylindrique
formé de gaines de feuilles roulées les unes
aux autres. Le rhizome est blanc segmenté, pointu et peut percer les
tubercules sous terre, voire piquer les pieds et mains des personnes
travaillant dans les champs infestés. Le système racinaire est
fibreux et se développe au niveau des noeuds des rhizomes. La tige est
pratiquement invisible et donne l'impression que les feuilles sortent
directement de terre. Les feuilles de la plante adulte mesurent 1,25 cm
à 2,5 cm de large et sont généralement de 30 cm à
75 cm de long. Elles sont rarement d'une couleur vert foncée mais
tendent sur du vert pâle avec une bordure tranchante grâce à
leur richesse en silice. Contrairement à la plupart des plantes, la
nervure blanchâtre qui traverse la surface supérieure n'est pas
médiane et permet de distinguer aisément l'espèce.
L'inflorescence est une panicule cylindrique de couleur blanchâtre ou or.
La panicule mesure en moyenne 10 à 20 cm de long sur 0,5 à 2,5 cm
de large (MacDonald, 2004). Les pédicelles sont inégaux et les
pollens allongés ou lancéolés sont entourés de
poils soyeux. Chaque graine est munie d'une queue ou d'une plume.
1.1.3 Biologie
I. cylindrica se reproduit aussi bien de façon
sexuée, par les graines, que de façon
asexuée, par les rhizomes (Bryson and Carter, 1993). En
effet, c'est une plante qui
produit plus de 3000 graines par plante.
L'inflorescence est induite par les conditions
rudes telles que le fauchage et le brûlis, et les
graines peuvent être transportées sur des centaines de
mètres.
Une plante obtenue à partir d'un semis peut donner des
rhizomes en 4 semaines (Bryson et Carter, 1993). Les rhizomes
représentent plus de 60% de la biomasse totale, et le faible rapport
pousse/rhizome contribue à sa régénération rapide
après un brûlis, un sarclage ou un labour (MacDonald, 2004). La
capacité de régénération des rhizomes augmente avec
leur âge et leur poids car les rhizomes matures sont plus riches en
nutriments que les jeunes rhizomes (MacDonald, 2004). De même, les
bourgeons des rhizomes matures qui sont proches de l'apex sont les premiers
à régénérer lorsqu'ils sont séparés
de la plante mère. En revanche, leur diamètre et leur nombre de
noeuds n'influencent pas de façon significative leur croissance (Ayeni
et Duke, 1985). Les rhizomes tolèrent bien la dessiccation et se
reproduisent mieux sur les sols acide (Wilcut et al., 1988). Chaque
segment de rhizome peut produire une nouvelle plante, ce qui peut arriver avec
les pratiques culturales et les applications partielles d'herbicide. La
régénération des bourgeons est favorisée par leur
exposition à la lumière (MacDonald, 2004 ; Atchade, 2004) alors
que l'enfouissement des fragments de rhizomes à plus de 8 cm de
profondeur peut limiter la propagation de l'adventice (Wilcut et al.,
1988).
1.1.4 Distribution Géographique
I. cylindrica pousse souvent dans les régions
sub-tropicales et se développe bien dans les milieux où la
pluviométrie annuelle se situe entre 750 mm et 5000 mm (Bryson and
Carter, 1993). Elle envahit les régions qui sont soumises à de
fortes pressions humaines et atteint sa croissance maximale sur les sols
fertiles mais son développement normal n'est pas limité par la
fertilité du sol.
I. cylindrica est enregistrée comme mauvaise
herbe dans 73 pays de par le monde et est présente sur tous les 5
continents. Sa présence est remarquable en Afrique, en Australie, en
Asie du sud et dans le Pacific tandis qu'elle est moins abondante ou constitue
un problème mineur en Europe du sud, en Méditerranée et en
Amérique du sud (Van Loan et al, 2002). Selon Hubbard et
al (1944) et Santiago (1980), I. cylindrica var europa
est rencontrée en Afrique du Nord et en Europe autour de la
Méditerranée, et à l'Est de l'Afghanistan, I.
cylindrica var. major est indigène à l'Afrique de
l'Est, à l'Asie, à l'Australie, et aux Iles de l'Océan
pacifique. I. cylindrica var africana est rencontrée
en
Afrique de l'Ouest, I. cylindrica var.
lactifolia se développe seulement au Nord de l'Inde, alors que
I. cylindrica var condensata est retrouvée en Chili et
en Amérique du Sud (MacDonald, 2004).
Selon une prospection couvrant le Bénin, le Cameroun,
le Ghana et le Nigéria, la fréquence d'apparition de I.
cylindrica diffère suivant les zones agroécologiques mais
pas suivant la saison de collection (Chikoye et al, 2001). Ceci
suppose que dans une région de forte infestation, l'herbe est aussi
présente en saison pluvieuse qu'en saison sèche (Ayeni, 2004).
Selon Ayeni et al, 2004, au Bénin, les taux
moyens d'infestation dans les champs cultivés, étaient
respectivement de 67%, 45% et 6% (Figure 1) dans la zone humide au sud (2
saisons pluvieuses avec 1200 - 1300 mm de pluies annuelles), dans la zone
subhumide au centre (1100 - 1200 mm), et dans la zone subaride au nord (900 -
1000 mm avec une saison de pluie).
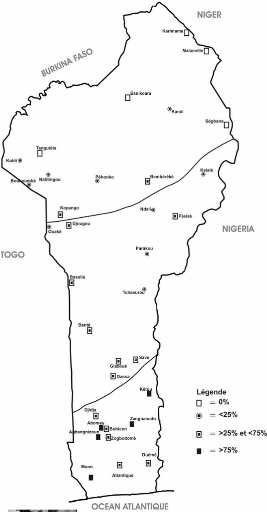
Zone subhumide
Zone humide
Zone subaride
1.1.5 Importance agronomique et économique de
Imperata cylindrica dans la problématique du
développement
I. cylindrica a été
désignée parmi 88 autres espèces comme la pire des
mauvaises herbes, par la majorité des paysans interviewés dans
différentes zones agro-écologiques des zones humides et
subhumides au Bénin, au Nigéria et en Côte d'Ivoire
(Chikoye et al., 2000; Ayeni et al, 2004 ; Vissoh et
al., 2004). Elle est classée 7ème mauvaise herbe
sur le plan mondial (Holm et al, 1977).
Sur le plan économique, I. cylindrica est
considérée comme un sérieux problème en Afrique
occidentale et centrale. Les pertes qu'elle inflige aux cultures à
tubercules telles que le manioc et l'igname, ne sont pas seulement dues
à la compétition directe, mais aussi aux infections qui
surviennent lorsque les rhizomes de l'herbe percent les tubercules. De
même, par exemple au Bénin, l'enlèvement manuel de I.
cylindrica coûte, 40.000 à 50.000 FCFA par ha (Vissoh et
al., 2004). Le coût de l'enlèvement de I. cylindrica
par l'usage des herbicides est estimé à $400 par hectare (Van
Loan et al., 2002). I. cylindrica est un fourrage de peu
d'importance parce que le bord tranchant des feuilles (riches en silice), la
rend indésirable par les animaux (Coile et Shilling, 1993). Selon
Hubbard et al. (1944) I. cylindrica est utilisée pour
l'emballage des biens en milieu rural en Afrique. En Irak, elle sert à
fabriquer des brosses ; en Egypte elle sert dans la fabrication des cordes et
des tapis, des nattes, des tapis-brosses et en Union Soviétique dans la
fabrication des essuie-pieds. Au sud et au centre du Bénin, I.
cylindrica est utilisée pour couvrir les cases (Ayeni et
al, 2004). Certaines populations l'utilisent dans le domaine
médicinal. En effet dans la région de Dangbo au Bénin, les
rhizomes de I. cylindrica sont utilisés comme aphrodisiaque, ou
pour renforcer la santé des enfants en période de dentition
(Ayeni et al, 2004).
Sur le plan social, on assiste à l'abandon de terres
cultivables envahies par I. cylindrica à cause du
caractère compétitif de l'herbe, mais aussi à cause de sa
capacité de repousse (Terry et al., 1997).
Sur le plan environnemental, même si l'herbe est une
des rares espèces qui oeuvrent à la réduction de
l'érosion du sol, elle a indirectement des effets nuisibles sur la
nature. Entre autres effets, on peut signaler que la grande capacité
d'extension de I. cylindrica entraînant l'abandon des terres
infestées, favorise l'exploitation abusive d'autres surfaces
avec comme corollaire la destruction des espaces
boisés. De même, cet abandon pousse les jeunes paysans à
l'exode rural dans les grandes villes où ils s'adonnent à la
vente de l'essence au bord des voies, puis à la conduite de taxi-moto,
contribuant ainsi à augmenter les risques de pollution.
A la lumière de cette analyse, il est évident
que I. cylindrica est une herbe qui présente d'avantages
minimes par rapports aux dommages qu'elle cause à la
société. Ainsi, en 2004 au Bénin, la perception des
paysans dans toutes les trois zones ci-dessus décrites étaient
que I. cylindrica évolue plus comme une herbe
indésirable qu'une herbe utile (Ayeni, 2004). C'est pourquoi dans les
régions de fortes infestations, 96% des paysans interviewés
pensent que l'herbe est nuisible, tandis 89% d'entre eux souhaitent une
éradication totale (Ayéni, 2004) et en attendant une meilleure
solution, ils développent diverses stratégies pour ramener les
taux d'infestation à des niveaux acceptables.
1.1.6 Méthodes classiques de lutte contre I.
cylindrica 1.1.6.1 Lutte mécanique
Une lutte mécanique réussie nécessite la
destruction de la capacité de repousse des rhizomes et des graines,
habituellement par des perturbations physiques, enfouissement ou
enlèvement complet de l'herbe pour empêcher sa croissance. Ainsi,
elle a pour but de couper les rhizomes en morceaux et de les exposer au soleil
ou les enfouir en profondeur afin de prévenir leur repousse (Brook,
1989).
Dans la pratique, un tel but est impossible à
atteindre, cependant la lutte mécanique reste de loin, une des
méthodes les plus largement répandues.
Les paysans à faibles revenus se limitent au fauchage,
à l'enlèvement manuel ou au brûlis parce que ces techniques
ne nécessitent que l'énergie humaine et l'usage d'instruments
simples (Brook, 1989). Mais elles ne garantissent pas à elles seules une
réduction de la biomasse des rhizomes et du feuillage (Willard et
al., 1996).
Le brûlis utilise le même principe que le
fauchage, c'est-à-dire l'enlèvement de la partie aérienne.
Il est préféré en Afrique centrale et occidentale au
fauchage mais il induit les repousses (Avocanh, 2005) et accentue
l'inflorescence, et par conséquent la production de graines (CABI,
2005). De plus, il comporte les risques d'extension du feu à d'autres
champs ou aux agglomérations mais aussi un risque de pollution
environnementale (Menz et al., 1998) et de l'érosion des
sols.
Au sud-Bénin, les paysans billonnent les terres, ce qui
a un double avantage de recycler la fertilité et de réduire
l'infestation du sol (Vissoh et al., 2004).
1.1.6.2 Lutte culturale
La fumure et l'utilisation des jachères constituent les
principales méthodes culturales. L'utilisation de la fumure est
basée sur le principe que la fumure, en particulier l'azote, peut
favoriser la compétitivité des cultures désirées en
défaveur de I. cylindrica (MacDonald, 2004). En effet, l'apport
d'engrais influence très peu le développement de I.
cylindrica (Atchade, 2004) et permet aux cultures d'être
compétitives par leur couverture végétale dont l'ombrage
peut réduire le développement de l'herbe.
L'observance des jachères, utilise également
comme principe, le caractère héliophile de I. cylindrica
(Brook, 1989 ; Atchade, 2004). Une période de jachère naturelle
adéquate pour venir à bout de l'herbe peut durer plusieurs
années. Or, la pression démographique et l'augmentation des
besoins alimentaires ont conduit à la nécessité de
réduire les périodes de jachères. Au sud Bénin, par
exemple, les périodes traditionnelles de jachères ne sont plus
respectées. C'est seulement dans quelques régions comme
Pobè et Bonou que certains paysans continuent à observer entre 4
à 5 années de jachère (Vissoh et al., 2004).
L'utilisation des plantes de couverture peut permettre de réduire le
temps de jachère et par conséquent, limiter la contrainte
liée aux jachères naturelles. En effet, selon Vissoh et
al., (2004), les plantes de couverture permettent de réduire le
temps de jachère jusqu'à 2- 5 ans. Selon Brook (1989), les
espèces recommandées sont : Calopogonium mucunoides
Desv., Centrosema pubescens BTH, Pueraria phaseoloides
(Roxb.) BTH, Psophocarpus palustris Desv., Crotolaria spp.,
Styloxanthes spp., Moghania macrophylla (Willd.) et
Gliciridia maculata HBK.
Déjà en 1992 le projet Sasakawa Global 2000 a
entrepris au Bénin la vulgarisation de Mucuna spp pour lutter
contre I. cylindrica. Après 3 années consécutives
d'utilisation du Mucuna spp, 100% des exploitants avaient reconnu que
cette plante de couverture contribuait à améliorer la
fertilité des sols tandis que 84% d'entre eux ont confirmé son
pouvoir d'éradication de I. cylindrica en deux années
(Galiba et al, 1998). Paradoxalement de nos jours l'utilisation de
Mucuna se raréfie de plus en plus à causes de plusieurs
contraintes. Selon une enquête menée au Bénin, au
Nigéria et en Côte d'Ivoire par Chikoye et al., 2000,
seulement 12,7% des paysans interviewés utilisaient les
jachères améliorées (utilisation de
Mucuna spp.). Ceci montre que des réticences persistent par
rapport à l'adoption de cette technique pour venir à bout de
I. cylindrica, car les plantes de couverture occupent des espaces
réservés aux cultures. C'est comme si les investissements
nécessaires pour leur établissement ne sont pas
bénéfiques par rapport aux avantages qu'elles
génèrent (Manyong et al., 1999). Selon Chikoye et
al., (2002), il est invraisemblable que les plantes de couverture soient
totalement adoptées dans une condition de manque cruel d'espaces
cultivables. Ainsi, au Bénin, les plantes de couverture, comme
Mucuna spp, et Aeschynomene histrix qui occupent le sol pour
une courte durée sont peu adoptées (Vissoh et al., 2004)
alors que les espèces pérennes comme Cajanus cajan,
Acacia auriculiformis sont mieux adoptées parce qu'elles sont
également exploitées pour leurs bois, leurs graines et feuilles
comestibles (Vissoh et al., 2004). Comme les graines de Mucuna
spp. n'ont aucune valeur alimentaire (Vissoh et al.,
2004), Versteeg et al. (1998) avaient initié au Bénin un
processus de désintoxication des graines de Mucuna spp., pour
pouvoir l'utiliser dans les principaux plats. Or les études
menées par Ayeni et al. (2004), confirment toujours la
non-adoption de cette plante par les paysans. Cette réticence dans
l'adoption des plantes de couvertures au sud Bénin peut être
expliquée par l'augmentation de la pression démographique. En
réalité, l'importance économique des plantes de couverture
peut varier selon les cultures. Elles sont par exemple en général
bénéfiques dans un champ de manioc tandis que l'effet contraire
est observé pour le maïs (Chikoye et al., 2001). Face
à ces faiblesses, d'autres auteurs ont tendance à
privilégier la lutte chimique.
1.1.6.3 Lutte chimique
La lutte chimique permet d'obtenir un résultat rapide
et en plus elle n'est pas fastidieuse dans sa mise en oeuvre. Comparativement
aux méthodes de lutte mécanique, elle évite la
perturbation du sol qui entraîne l'érosion (Brook, 1989).
Plusieurs herbicides existent et ont été testés pour leur
efficacité contre I. cylindrica (Brook, 1989; MacDonald, 2004).
Les herbicides usuels sont Dalapon, Glufosinate, Imazapyr et Glyphosate qui est
le plus fréquent sur le marché. Cette préférence au
Glyphosate est due à sa faible toxicité pour les
mammifères et son absence de résidus phytotoxiques sur le sol
(Terry et al., 1997) et son coût relativement faible.
Malheureusement, les herbicides sont seulement utilisés par les paysans
à forts revenus; ils ne sont pas spécifiques et
nécessitent la disponibilité de
grandes quantités d'eau. Mal utilisés, les
herbicides peuvent entraîner des problèmes sur la santé et
sur l'environnement. La limitation de l'utilisation des herbicides dans les
pays au sud du Sahara est due à quatre facteurs majeurs : la non
disponibilité d'herbicide de bonne qualité, la non
disponibilité d'équipements adéquats, l'absence de
formation adéquate et les coûts élevés. Sur 300
paysans interviewés au Bénin aucun n'utilisait d'herbicide contre
I. cylindrica (Ayeni et al, 2004).
Si le problème constitué par I.
cylindrica augmente d'année en année (Ayeni, 2004), ceci
suppose qu'aucune des méthodes ci-dessus mentionnées n'est encore
suffisante et par conséquent de nouvelles méthodes de lutte telle
que la lutte biologique peuvent être envisagées.
1.2 Théorie et principes de la lutte
biologique
Les végétaux, tout comme les animaux,
possèdent des ennemis naturels (insectes ou pathogènes) qui
coexistent normalement dans un certain équilibre, mais qui peuvent dans
certaines conditions occasionner leur destruction partielle ou totale. La lutte
biologique est l'étude et l'utilisation de ces ennemis naturels pour
réguler la densité d'une population d'hôte donnée
qui croit à cause du déséquilibre de l'environnement
original (Harlet et Forno, 1992). La lutte biologique peut
être classique (inoculative) ou
inondative.
1.2.1 Lutte biologique classique
La plupart des pestes ne sont des contraintes que dans leur
nouveau milieu d'introduction, où elles rencontrent des conditions
favorables à leur développement pendant que leurs ennemis
naturels sont absents. La lutte biologique classique consiste à : «
introduire l'agent de lutte biologique dans une région qui n'est pas son
origine afin de réduire de façon significative une population
d'hôte qui est le plus souvent introduite ». Les cas de
succès de cette technique sont légion. C'est par exemple
l'utilisation d'un parasitoïde, Anagyrus (Epidinocarsis)
lopezi De Santis originaire d'Argentine du Nord, qui a permis de
lutter efficacement contre la cochenille farineuse du manioc Phenacoccus
manihoti Matile-Ferrero (Homoptera, Pseudococcidae) au Nigéria et
au Bénin (Neuenschwander, 2002). De même, Typhlodromalus
aripo De Leon un prédateur originaire du Brésil, qui s'est
établi rapidement en Afrique subsaharienne, a réduit
considérablement la population de l'acarien vert du manioc,
Mononychelus tanajoa (Bondar) (A cari Tetranychidae).
(Yaninek et Hanna, 2003). De 1995 à 1998 le
succès des lâchers de Pareuchaetes pseudoinsulata Rego
Barros (Lepidoptera, Arctiidae) au Ghana a permis de réduire
l'infestation de Chromolaena odorata (L.) (Asteraceae) de 85%
à 32% (James et al., 2002). Au Bénin, dans les
localités de Tévèdji, Lihu, et Kafedji, sur le fleuve
Ouémé la jacinthe d'eau, Eichhornia crassipes (Mart.)
Solms-Laubach (Pontederiaceae) a été réduite de
la surface du fleuve Ouémé, de 100% à 5%, en 8
années par les lâchers de Neochetina eichhorniae Warner
(Coleoptera curculionidea) et de Neochetina bruchi Hustache
(Coleoptera curculionidea) (Ajuona et al., 2003).
Dans le cas d'utilisation des champignons pathogènes,
cette forme de lutte peut être assimilée au lâcher des
champignons biotrophes contre une cible. L'un des succès en
matière de ce genre de lutte est l'utilisation de la rouille (champignon
biotrophe) Uromycladium tepperianum pour contrôler Acacia
saligna en Afrique du sud (Charudattan, 2001). Ce champignon a
été importé de l'Australie vers l'Afrique du Sud
après des tests de spécificité effectués sur une
large variété de culture d'importance économique (Morris,
1987). C'est aussi le cas de l'établissement de Neozygites
tanajoae (Entomophtorales, Neozygitaceae) d'origine
brésilienne, causant une infection moyenne de 25% des populations
d'acarien vert au Bénin (Hountondji et al., 2002).
La lutte biologique classique contre les mauvaises herbes
implique le plus souvent l'utilisation des champignons pathogènes. Pour
être efficace, elle doit prendre en compte l'écologie de l'herbe,
sa biologie et les informations climatiques et géographiques sur les
régions où l'herbe constitue un problème. Si dans le cas
d'utilisation des insectes comme agent de lutte contre les mauvaises herbes, de
grands succès ont été obtenus avec des insectes exotiques,
dans le cas de l'utilisation des microbes (le plus souvent des champignons),
les problèmes d'homologation constituent une contrainte majeure. En
effet, l'évaluation de l'effet des microorganismes lâchés
dans l'environnement nécessite des connaissances et moyens
spécifiques qui font défauts dans les pays africains. Ceci
suscite une méfiance à l'égard des microorganismes
d'origine exogène d'où des difficultés d'homologation.
Depuis les années 2000 certains champignons
pathogènes sont déjà classés
ou
commercialisés comme des agents de lutte biologique contre les
mauvaises herbes dans
les pays développés comme les Etats-Unis,
l'Italie, le Canada et l'Australie, mais aussi en Inde et en Chine (Tableau
1).
Tableau 1: Quelques champignons commercialisés
ou utilisés comme agents de lutte biologique Champignons Noms
commerciaux Herbes cibles
Acremonium diospyri - Diospyros virginiania
Alternaria zinniae - Xanthium occidentale
Alternaria eichhorniae - Eicchornia
crassipes
Alternaria cassiae CASST Cassia obtusifolia
Cercospora rodmanii ABG 5003 Eicchornia
crassipes
Colletotrichum coccodes VELGO Abutilon
theophrasti
Colletotrichum gloesporiodes f. sp LUBOA 2 Cuscuta
chinensis et, Cuscuta
cuscutae australis
Colletotrichum gloesporiodes f. sp malvae
|
BIOMAL Malva pusilla
|
|
Colletotrichum gloesporiodes f. sp COLLEGO
Aeschynomene virginica
aeschynomene
Colletotrichum orbiculare - Xanthium
spinosum
Condrosterium purpureum BIOCHON Prunus
serotina
Phytophtora palmivora DEVINE Morrenia
odorata
Source: Les champignons agents de lutte biologiques,
Butt et al., 2001
En Afrique, des efforts sont aussi déployés
dans la recherche d'agents microbiens de lutte contre les mauvaises herbes.
C'est le cas de Sporisorium ophiuri (P. Henn) Vanky (Ustilaginales),
un charbon bactérien utilisé dans la lutte contre Rottboellia
cochinchinensis (Lour.) Clayton, appelée encore herbe queue de rat
(Valverde, 2005). Il en est de même pour les isolats de Fusarium
oxysporum f. sp. Striga qui réduisent significativement
l'émergence de Striga hermonthica dans les champs de
céréales (Kroschel et al., 1996; Ciotola et
al., 1999, Elzein et Kroschel, 2004).
1.2.2 Lutte biologique inondative
Selon Harley et Forno (1992), contrairement à la lutte
biologique classique où l'agent de lutte biologique reste permanent et
se perpétue une fois établie, dans le cadre de la lutte
biologique inondative, l'agent n'est pas un élément permanent du
biotype. Même lorsqu'il y est présent, sa densité n'est pas
à même d'assurer une maîtrise de l'hôte. Il s'agit
donc de l'introduction dans l'environnement à plus d'une fois, une
grande quantité d'inoculum pour induire une population d'agent de lutte
biologique capable de contrôler efficacement l'hôte (approche
inondative), ou pour compléter périodiquement
l'effectif
d'une population d'agent de lutte biologique existante, afin de
maîtriser l'hôte (approche augmentative).
Le type de formulation utilisé pour un biopesticide
prend en compte les exigences écologiques, les techniques d'application
disponibles, la biologie de l'hôte et celle du pathogène, mais
aussi le mode d'action de ce dernier. C'est ainsi que dans le cadre de la lutte
contre les sauteriaux, le projet LUBILOSA (IITA-Benin) a fait le
développement de la formulation huileuse des spores du champignon
Metarhizium anisopliae. Ce type de formulation favorise
l'adhésion des spores à la cuticule des insectes mais garantit
aussi l'infection dans les conditions d'humidité relative faible comme
dans le désert (Bateman, 1997) en ce sens que l'émulsion huileuse
protège les propagules contre la dessiccation et les rayons UV. Dans le
cadre de la lutte biologique contre les adventices, le choix de l'approche
inondative a pour finalité le développement d'un mycoherbicide.
Le mot mycoherbicide se décompose en `'Myco» qui signifie : «
champignon » et `'Herbicide» qui signifie : « qui tue les herbes
». Un mycoherbicide est un herbicide dont le principe actif est une
propagule de champignon (mycélium, conidies, sclérotes,
chlamydospores, etc.) mélangé à d'autres
ingrédients (sources d'énergie et surfactants), le tout dans un
support convenablement choisi pour faciliter le début de l'infection, le
développement de l'infection, l'application du produit, sa conservation,
et sa durée de vie (formulation). L'apport de tween 80 dans certaines
formulations facilite par exemple, la dispersion uniforme des propagules et
assure un début d'infection correct. Il faut aussi signaler l'usage
d'abrasives comme le Gasil dans les formulations mycoherbicidiques qui permet
de faciliter l'infection des herbes hôtes par le pathogène
inoculé en causant préalablement des dommages dans le tissus
foliaire.
1.3 Les options de la lutte biologique contre I.
cylindrica
Imperata cylindrica importé aux Etats Unis
pour lutter contre l'érosion de sols s'est propagé rapidement
pour devenir une adventice. Alors des chercheurs de l'université des
Florides ont entamé des prospections sur les ennemis naturels et ont
abouti à la découverte de pathogènes, d'arthropodes et
d'autres invertébrés capables d'attaquer I. cylidrica
(Van Loan et al., 2002).
Parmi les insectes reportés de par le monde, seul
Orseolia javanica Kieffer et van Leeuwen-Reijnvaan (Cecidomyidae), est
spécifique à I. cylindrica (Van loan et al.,
2002). Il se trouve en abondance dans les endroits où I.
cylindrica est régulièrement coupé ou fauché.
Ses femelles pondent des oeufs qui, après éclosion, donnent des
larves qui pénètrent dans la plante pour y créer des
galles. Mais les chances de considérer O. javanica comme un
agent potentiel de lutte biologique efficace sont réduites par
l'existence de Platygaster oryzae (Hym., Platygasteridae) qui est son
prédateur (Van Loan et al., 2002).
Plusieurs pathogènes sont associés à
I. cylindrica. On peut citer par exemple Myrellina imperatae
Sankaran et Sutton qui causent en Malaisie des taches et des chloroses sur les
feuilles (Sankran and Sutton 1992). De même on peut citer,
Xanthomonas albilineans (Ashby) Dowson en Australie, qui est
responsable d'une décoloration foliaire (Persley, 1973). Beaucoup
d'autres pathogènes sont cités dans le monde incluant Puccina
rufipes Diet., Claviceps imperatae Tanda et Kawatani,
Monodisma fragilis Alcorn, Deightoniella africana Hughes,
Mycosphaerella imperatae Sawada, Bipolaris maydis (Y. Nisik.)
Shoemaker, Colletotrichum caudatum (Sacc.) Peck, C. graminicola
(Ces.) G.W. Wilson, Aschochyta sp., Didymaria sp.,
Dinemasporium sp., Chaetomium fusiforme Chivers et
Helminthosporium, Curvularia et Fusarium species
(Chadrasrikul, 1962; Chase et al., 1996; Caunter, 1996).
Déjà en 1985, 12 champignons pathogènes
de I. cylindrica avaient été listés en Albanie
(Ravenell, 1985). En Afrique on peut citer Giberella imperatae C.
Booth et Prior qui cause des dessèchements au niveau de I.
cylindrica en Nouvelle Guinée (Booth et Prior 1984).
D'autres études effectuées aux Etats-Unis ont
montré d'une part, l'efficacité d'un
mélange de
pathogènes (Drechslera gigantea et Bipolaris sacchari)
en formulation sur
plusieurs adventices de la famille des Poacae
dont I. cylindrica (Yandoc et al., 1999), et d'autre part,
l'efficacité de Drechslera gigantea (Heald et Wolf)
(Pleosporaceae), Exserohilum rostratum (Drechsler) Leonard et
Suggs (Pleosporaceae), Exserohilum longirostratum
(Pleosporaceae) et Bipolaris sacchari
(Pleosporaceae) sur I. cylindrica (Charudattan, 1996).
Des efforts de collection de pathogènes au niveau de
rhizomes ont été faits en 2005 au Bénin et ont permis
d'identifier Fusarium oxysporum Schlecht. Emend. Synd.et Hans.
(Tuberculariaceae), Macrophomina phaseolina (Tassi) Goid et
Chaetomium spp (Kunze) (Chaetomiaceae) (Ali-Bidjowe, 2006) mais aucun
espoir de lutte n'est obtenu après leur application. L'utilisation des
champignons foliaires reste donc à ce jour la seule
possibilité.


CHAPITRE 2 : MATERIEL ET METHODES
2.1 Production de plants de I.
cylindrica
De jeunes plants de 6 semaines d'âge ayant une hauteur
comprise entre 8-10 cm et 4
feuilles, ont été utilisés pour le test de
pathogénicité tandis que des plantes adultes à feuilles
lignifiées ont servi pour le test de virulence.


b
Les jeunes plantes ont été produites à
partir de semis de graines de I. cylindrica sur du coton
humidifié (Figure 2a). Quatorze jours après germination, chaque
plantule a été transplantée dans un pot en plastique (4 cm
x 7 cm x 10 cm) rempli de sol stérilisé à l'autoclave
(121 OC et 1,2 bar) (Figure 2b) pour être utilisée 4
semaines après. Pour les tests de pathogénicité.
a
Figure 2: Semis de I. cylindrica sur du coton
(a) jeunes plantes de I. cylindrica transplantées après
semis ( b)
Les plants adultes avec des feuilles lignifiées et
riches en silice ont été transférés directement
d'un champ naturellement infesté dans la station de l'IITA-Bénin,
à raison d'un plant par pot, ceci afin d'être proche des
conditions et aspects naturels des plants. Lorsque les plants
transplantés ont un minimum de deux nouvelles feuilles, toutes les
anciennes feuilles ont été enlevées. Lorsque tous les
plants ont eu un minimum de cinq feuilles, les plus vieilles feuilles ont
été enlevées pour laisser les trois plus jeunes feuilles.
Ces trois feuilles ont été marquées de fines ficelles de
couleur jaune, verte, bleue pour identifier respectivement la plus jeune, la
moins jeune et la plus vieille feuille.
2.2 Prospection des champignons pathogènes 2.2.1
Collecte des feuilles avec symptômes
Pour la collecte des pathogènes foliaires de I.
cylindrica, le Bénin a été subdivisé en trois
zones agroécologiques selon la segmentation de Ker (1992). Il s'agit de
:
- la zone humide (ZH) au
sud, située au dessous de la 7ème
parallèle Nord, qui regroupe les départements de l'Atlantique, de
l'Ouémé, du Plateau, du Mono, du Couffo et du Zou. Elle a une
pluviométrie bimodale, caractérisée par une moyenne
annuelle de 1200 - 1300 mm de pluie s'étendant sur 190 - 230 jours de
mars à juillet et de septembre à novembre. La température
moyenne annuelle est de 26,5°C avec une humidité
relative de 75% en moyenne par an. L'insolation moyenne annuelle est de 2290
heures ;
- la zone subhumide (ZSH), se situant entre la 7è et
la 9è parallèle Nord, regroupe les départements des
Collines, du Borgou et de la Donga. Elle est caractérisée par une
transition allant d'une pluviométrie de type bimodal à monomodal
avec une moyenne annuelle de 1100-1200 mm couvrant 140-190 jours d'avril
à octobre. La température moyenne annuelle est de
27°C avec une humidité relative de 60% en moyenne par
an. L'insolation moyenne annuelle est de 2305 heures.
- la zone subaride (ZSA) située au Nord de la
9è parallèle, est constituée de l'Atacora et de l'Alibori.
Elle a un régime de pluie monomodal caractérisé par une
moyenne annuelle de 900 - 1000 mm de pluie couvrant 90-140 jours de mai
à septembre. La température moyenne annuelle est de
27,5°C, l'humidité relative est de 50% en moyenne par an
et l'insolation est de 2862 heures.
Les prospections ont été conduites en 2003 et
en 2004. En 2003, elles ont été conduites en avril à
raison de 60 champs par zone correspondant à la saison pluvieuse pour la
ZH et la ZSH, et à la saison sèche pour la ZSA. En 2004, les
prospections ont eu lieu en Août, ce qui correspond à la saison
pluvieuse pour la ZSA et à la saison sèche pour les deux autres
zones. Ici aussi, 60 champs ont été visités par zone. Au
total, 360 champs ont été visités au cours des deux
années. Pour chaque prospection, les coordonnées
géographiques (GPS) des champs ont été enregistrées
par un enregistreur de type «MAGELAN SporTrak PRO».
Les dimensions des champs étant variables selon les
sites, une portion de champ
d'environ 0,5 ha est délimitée au
hasard dans chaque champ. L'échantillonnage des
feuilles ayant présenté des lésions
s'est fait sur cette portion de champ délimitée, en suivant les
deux diagonales en zigzagant sur une bande de 4 m de large. Sur chaque plant,
les feuilles présentant des symptômes sont délicatement
coupées, étalées et mises en presse afin de les garder
dans leurs formes initiales. Chaque échantillon est
étiqueté par rapport au nom du village, au GPS du champ, la date
de collection et la description du symptôme observé. Le nombre
d'échantillons collectés par champ a varié de 0 à
10 en fonction de la fréquence des symptômes sur feuille.
2.2.2 Isolement des champignons à partir des
feuilles malades
Une fois au laboratoire, les échantillons de feuilles
ont été dépouillés, triés et soumis selon le
cas, à un isolement direct ou indirect.
L'isolement direct a été réalisé
lorsque des propagules (spores ou mycélium) du champignon
suspecté ont été perceptibles à l'oeil nu ou au
binoculaire à travers le symptôme. Il a consisté à
enlever avec une aiguille stérilisée au feu d'un bec bunsen, la
structure visible et de la transférer sur une boîte de
Pétri stérile en plastique (9 cm diamètre) contenant du
milieu gélosé (Eau-Agar, Annexe 1). Ce milieu est utilisé
parce qu'il ne contient pas de substances nutritives, ce qui limite
l'émergence des saprophytes qui pourraient se développer au
détriment du pathogène recherché.
Lorsque les propagules n'ont pas été
perceptibles nous avions suscité leur apparition en utilisant des
chambres humides. Les chambres humides ont été faites de
boîtes de Pétri dont l'intérieur est tapissé de deux
papiers filtres humidifiés à l'eau stérile. Sur ces
papiers filtres nous avions déposé le morceau de feuille
prélevé à l'intersection de la lésion et du tissu
sain, car le champignon est plus actif à cet endroit (Baxter et Van der
Linde, 1997), ce qui facilite son isolement en culture pure. Après 3
à 5 jours d'incubation, les structures émergées
grâce à la forte humidité de la chambre humide ont
été transférées sur le milieu Eau-Agar.
L'isolement indirect a été
réalisé dans les cas où la méthode des chambres
humides n'a abouti à l'émergence d'aucune structure. Nous avions
d'abord procédé à une stérilisation de surface par
trempages successifs de petits morceaux (4 mm2) de feuille
(prélevés à l'intersection de la lésion et du tissu
sain), dans une solution d'hypochlorite de sodium à 1% pendant 1-2 mn,
puis dans de l'alcool éthylique à 70% pendant 1-2 mn, suivi d'un
triple rinçage dans l'eau distillée stérile. Après
cette stérilisation de surface, les morceaux
de feuilles ont été séchés sur du
papier filtre stérile avant d'être transférés
aseptiquement sur le milieu Eau-Agar pour permettre l'émergence du
pathogène à partir du morceau de feuille.
Dans tous les cas, les boîtes ont été
incubées à 25oC pendant 4-7 jours, puis les colonies
développées ont été aseptiquement
transférées sur du milieu gélosé de Potato Dextrose
Agar (PDA, Annexe 2). Ce milieu contient d'élément nutritif et
permet le développement rapide du champignon isolé en culture
pure. Pour chaque isolat, la forme, la couleur, la pigmentation de la culture
pure obtenue ont été notées et les types de conidies
produites ont été décrits.
2.2.3 Détermination de la
pathogénicité: vérification du postulat de
Koch
Les colonies d'isolats cultivés sur PDA ont
été utilisées pour inoculer les jeunes plants obtenus
à partir des semis (cf 2.1). L'inoculation a été faite
à l'aide de minces couches (4 mm2) de blocs d'Agar contenant
le pathogène, maintenus à la surface des feuilles à l'aide
d'une mince mèche de coton préalablement mouillée à
l'eau stérile. Les plants inoculés ont été par la
suite incubés (28-30 0C) sous des sachets de plastique
pendant 48 heures. Par traitement, trois plants ont été
inoculés par isolat et sur chaque plant, c'est la feuille la plus
âgée (5-7mm de large) qui a reçu l'inoculât.
Après cinq jours, les feuilles nécrosées sont
prélevées et les symptômes sont comparés à
ceux observés au champ, puis l'agent responsable a été
isolé à l'aide du milieu Eau-Agar à nouveau, en utilisant
l'une des méthodes précédemment décrites au
paragraphe 2.2.2. Les colonies obtenues après ce nouvel isolement ont
été comparées (formes et couleurs des mycelia, couleur de
la pigmentation et conidies produites) aux colonies ayant servi à
l'inoculation. Lorsque celles-ci étaient identiques, et que les
symptômes aussi étaient identiques à ceux observés
au champ, nous avions conclu à la vérification du postulat de
Koch.
2.2.4 Identification et conservation des
pathogènes
L'identification des isolats ayant satisfait au postulat de
Koch a été faite en se basant sur les structures (mycelia et
conidies), à l'aide de clés dichotomiques et d'ouvrages
d'identification. Deux documents principaux ont été
utilisés. Il s'agit de :
- Cours Internationnal sur l'Identification des Champignon
Agricoles et Evironnementaux (CABI, 2001)
- Genres illustrés des champignons imparfaits (Barnett
et Hunter).
Après identification, les pathogènes ont
été conservés au laboratoire sur silicagel, ou par la
méthode de la cryopréservation (Nakasone et al, 2004)
pour une conservation à long terme (Annexe 3).
Pour les prospections, les isolements, et la
pathogénicité, les proportions des pathogènes, et les
proportions de chaque espèce de pathogène ont été
calculées par zone et ont été représentés
par des digrammes de pie. Les nombres des différentes espèces
collectionnées par zone et par département ont été
présentés sous forme de Tableaux. Les proportions des
pathogènes isolés ont été présentées
sous forme de diagramme de pie, en fonction des zones et des saisons et les
coordonnées géographiques de leurs origines ont été
utilisées pour construire une carte de distribution.
2.3 Etude des caractéristiques physiques des
isolats 2.3.1 Choix des isolats pour l'étude
Afin de réduire le nombre d'isolats pour
l'étude des caractéristiques et les tests de virulence, et pour
répondre aux contraintes de matériel et de temps, une double
sélection a été faite pour réduire les isolats
retrouvés sur I. cylindrica de soixante quatre (64) à
douze (12).
La première sélection qui a tenu compte des
espèces, des périodes de collection (année et saison), et
des coordonnées géographiques, a permis de choisir quarante et un
(41) isolat. Pour la deuxième sélection, les quarante et un (41)
isolats ont été soumis à un test préliminaire sur
de jeunes plantes exactement comme au paragraphe 2.2.3. Ce test
préliminaire a été considéré comme le test
de pathogénicité. Les symptômes obtenus après deux
semaines d'infection ont été évaluées par notation
du pourcentage de symptômes sur chaque feuille inoculée. Les
moyennes de pourcentage de symptôme produit par chaque isolat pour 3
répétitions ont été alors calculées et les
12 isolats qui ont présenté un pourcentage de lésion
supérieur à 3% ont été choisis. Cette limite est
choisie parce qu'à partir des observations au champ et les tests
préliminaires, nous avons constaté qu'une lésion due
à un isolat donné est nettement visible à partir de 3% de
la surface foliaire attaquée. Pour une comparaison des
caractères, quatre (4) autres isolats, de D. gigantea, B.
sacchari, E. longirostatum et E. rostratum,
préalablement utilisés avec succès en formulation
mycoherbicidique à l'Université des Florides (isolats
exogènes)
ont été ajoutés aux 12 isolats
indigènes pour la suite de l'étude. Ces 4 isolats stockés
en tubes sur du PDA, ont été importés des Florides sous
signature de certificat d'importation délivré par le Service de
Protection de Végétaux du Bénin, et de d'accord de
transfert de matériel délivré par l'Université des
Florides.
2.3.2 Aspects et croissance radiale des colonies des
isolats choisis sur Potato Dextrose Agar (PDA)
Des boîtes de PDA ont été
ensemencées en pré-culture avec les isolats
sélectionnés. Après une semaine d'incubation à
25oC à l'obscurité permanente, ces cultures ont servi
à ensemencer les boîtes destinées à l'étude
des aspects physiques et de croissance radiale. L'inoculation a
été faite en utilisant une emporte stérilisée
à l'alcool (96o) et au feu d'un bec bunsen, pour
prélever sous une hotte à flux laminaire, un morceau de culture
(5 mm de diamètre). Le morceau a été déposé
au centre du milieu de culture avec la face mycélienne contre la surface
de ce dernier. Ces morceaux ont été prélevés en
bordure de culture où le mycélium est plus actif, et à un
endroit équidistant du centre de la colonie mère. Quatre (4)
boîtes (répétitions) ont été faites par
isolat. Pendant sept (7) jours d'incubation à 25oC les
variables suivantes ont été mesurées ou observées
chaque jour pour déterminer les différences morphologiques entre
isolats de même espèce et entre espèces.
· La croissance radiale ou diamètre (mm) des
colonies est mesurée à l'aide d'une règle
graduée;
· L'aspect physique des mycélia a été
décrit après observation macroscopique: la
couleur de la colonie et la pigmentation en arrière de
la boîte ont été déterminées
par simple observation, de même il a été
vérifié si la colonie est adhésive ou
aérienne par rapport au milieu de culture. Lorsque la
colonie a présenté des
mycélia aériens, il a été
vérifié si ces mycélia sont abondants, cotonneux
(semblable à du coton), ou floconneux (en petites boules
comme des flocons).
La croissance moyenne par isolat a été
déterminée pour les quatre répétitions de
même que les écarts types. Ceci a permis de faire des courbes
d'évolution de la croissance radiale. Quant à l'aspect physique
des colonies il a été décrit et présenté
sous forme de photo.
2.3.3 Production en masse des spores
Le PDA n'a pas permis une production suffisante (106
spores/ml) de spores pour tous les
isolats. Alors pour étudier les formes et dimensions des
spores, nous avons testé quatre (4) milieux et substrats.
2.3.3.1 Les milieux et substrats
utilisés
- Le V8AGAR a été préparé en prenant
20% v/v de jus deV8 manufacturé auquel ont été
ajouté 2% p/v de la gélose (Agar) et 3g de
carbonate de calcium (CaCO3) pour un litre de milieu de culture (Harigan,
1998). Ce milieu a été distribué dans des boîtes de
15 cm de diamètre après stérilisation pendant 15 mn
à 121 0C à une pression de 1,2 bar.
- Le Bouillon de pomme terre enrichi aux sels minéraux
(spécifique pour la production des spores de C. caudatum) a
été choisi comme milieu liquide. Il a été
préparé en râpant 200g de pomme de terre dans 1 litre d'eau
distillée et en les laissant en solution pendant 1 heure de temps avant
de les faire bouillir (5mn). Après filtration, il a été
ajusté à 1 litre, puis il a été ajouté 20g
de sucrose, 10g de Nitrate de potassium (KNO3), 5g dihydrogénophosphate
de potassium (KH2PO4), 2,5g de sulfate de magnésium (MgSO4), 0,02g de
chlorure de fer (FeCl2) avant que le pH n'ait été ajusté
à 6. La solution ainsi obtenue a été distribuée
dans des erlenmeyer de 250 ml à raison de 100 ml par flacon avant
d'être stérilisé.
- Le substrat à base de rhizome de I.
cylindrica (les tests préliminaires ont montré qu'il produit
facilement les spores de Exserohilum) a été
préparé en immergeant 100g de morceaux (1 cm) dans l'eau toute
une nuit, puis en les stérilisant (121 0C à une
pression de 1,2 bar) dans un erlenmeyer de 500 ml après avoir
versé le liquide d'immersion.
- Le substrat à base de riz (utilisé par le
projet LUBILOSA pour la production en masse des spores de M.
anisopliae) a été préparé de la même
façon que précédemment tout en utilisant des graines de
riz enveloppées de la variété Nerica en place des morceaux
de rhizomes.
2.3.3.2 Inoculation des milieux et substrats
Le V8Agar et le milieu liquide ont été
ensemencés d'un explant (5 mm2) de culture de
champignon (5 jours d'âge). Pour le V8AGAR, l'explant a
été déposé au centre du milieu
de culture et les
boîtes ont été incubées à 25 0C
pendant 15 jours. Les spores sont raclées
à l'aide de l'eau
distillée et le mélange obtenu a été filtré
à l'aide d'un morceau de
mousseline. Pour le milieu liquide, l'explant a
été introduit dans les flacons contenant le milieu, puis ces
flacons ont été soumis à une agitation de 200 tours/mn
à la température ambiante (25 - 28 0C) pendant 15
jours.
Pour inoculer les substrats, nous avions
récupéré les surfaces des cultures sur PDA dans 4 ml d'eau
distillée stérile qui ont permis par la suite d'inoculer les 100g
de substrat. Les flacons sont laissés incubés à la
température ambiante (25 - 28 0C) sur les paillasses au
laboratoire pendant 15 jours mais ils ont été agités
fréquemment pour favoriser une bonne colonisation des substrats. Les
substrats colonisés ont été par la suite suspendus dans
100 ml d'eau pour en extraire les spores produites après filtration.
La concentration des spores en filtrats (nombre de spores/ml)
a été déterminée à l'aide d'un
hématimètre (de type Neubauer (Hawhsley) avec un microscope
à axes gradués de type Leitz qui permet de mesurer les dimensions
des spores. L'hématimètre de NEUBAUER est une lame épaisse
quadrillée. L'intersection du quadrillage donne une configuration de 25
carrés subdivisés en 16 autres petits carrés. Chaque petit
carré à une surface de 1/400mm2 et une profondeur de
0,1 mm. Avant d'introduire la suspension à évaluer, on a
placé la lamelle sur l'hématimètre. Pour respecter la
profondeur de 0,1mm prescrite par le fabriquant il est important que la lamelle
soit correctement adhérée à l'hématimètre
(présence d'empreintes digitales). Une fois la lamelle placée, on
a introduit à l'aide d'une micropipette une goutte de la suspension
entre lame et lamelle. Cette dernière a migré par
capillarité pour occuper l'intersection entre lame et lamelle donc le
quadrillage qui a permis de compter aisément les spores.
Les formes et couleurs des spores (pigmentées ou non)
sont décrites et leur dimensions sont prises sur un échantillon
de 50 spores à l'aide de la graduation des axes du microscope à
un grossissement X 100. Les dimensions sont données en
micromètres en considérant les intervalles entre les minima et
maxima. Pour les conidies ayant de flagelles, les dimensions de ces
dernières sont prises en compte.
2.4 Etude de la virulence des isolats
La virulence des isolats a été
étudiée aussi bien in vitro qu'in vivo. Les
tests in vitro sont plus faciles (conditions d'expérimentation stables)
et ont permis d'avoir rapidement d'information sur les isolats en peu de temps
(6 jours). Cependant pour vérifier si dans le futur nous pourrions nous
baser uniquement sur les tests in vitro pour conclure de la
performance des isolats, il a été
nécessaire de compléter les résultats du test in
vitro par un test in vivo qui prend en compte la plante
entière avec toute sa physiologie.
2.4.1 Préparations des inocula
utilisés
2.4.1.1 Les Suspensions de mycélia
Le mycélium de chaque isolat a été produit
dans des flacons de 250 ml contenant 100ml
du milieu liquide Potato Dextrose Broth (PDB, 24 g/L). La
production a été faite à l'aide d'un agitateur
électrique de type GFL de fabrication allemande à raison de 120
tours/mn pendant 15 jours. Les mycélia produits ont été
filtrés et séchés pendant 4 heures, sous la ventilation
d'une hotte à flux laminaire de type ESCO, Classe II (Singapoure). Ils
ont été ensuite mélangés dans une proportion de 5 g
de mycélium pour 5 g de poudre de kaolin auquel a été
ajouté le filtrat de culture jusqu'à avoir 100 ml de suspension.
Ce mélange a été ensuite enrichi de la gélatine
à 1% (pour assurer l'adhésion des morceaux de mycelium au tissu
végétal) et de Tween 80 à 0,02 % (pour disperser les
morceaux de mycelium) avant d'avoir été broyé à
l'aide d'un moulinex pendant 30 secondes.
2.4.1.2 Les Suspensions de spores
Les spores ont été produites en utilisant les
substrats ou milieux de cultures convenables à
chaque type d'isolat, après les résultats de
l'étude sur la production en masse des spores (paragraphe 2.3.3). Les
suspensions de spores obtenues ont été recueillies dans une
solution de PDB enrichie de la gélatine à 1% et du tween 80
à 0,02%, puis ajusté à 106 spores/ml. à
l'aide de l'hématocimètre.
2.4.2 Virulence in vitro
Nous avons utilisé des boîtes de pétri
stérile, en plastique de 15 cm de diamètre
manufacturées par Fisher Brand, dont
l'intérieur est tapissé de 2 papiers filtre de 15 cm de
diamètre. Avant d'être déposés au fond des
boîtes, ces papiers ont été imbibés de 4 ml d'une
solution de glycérol à 20 % (pour éviter le
dessèchement) et garder pendant longtemps l'humidité dans les
boîtes. Au dessus des papiers filtres ont été
déposées des pièces foliaires (13 cm de long)
prélevées à la partie médiane (largeur
homogène) des feuilles adultes (lignifiées) de I.
cylindrica. Ces pièces ont été déposées
(3 par boîte) de façon que leur surface adaxiale soit visible.
La suspension mycélienne de chaque isolat a
constitué un traitement et chaque traitement a été
répété trois fois (3 boîtes par traitement). La
pulvérisation a été faite à l'aide d'un
pulvérisateur en plastique de 22 ml à raison de 250 litres/ha
(Bateman, 2002) soit 0,4ml (4 pulvérisations) d'inoculum (4
pulvérisations) par boîte de Pétri. Les témoins ont
été pulvérisés uniquement d'une solution de PDB
enrichie de 1 % de gélatine et de 0,02 % de tween seulement. Les
boîtes ont été ensuite incubées sur les paillasses
au laboratoire à une température de 25 - 280C.
Les symptômes ont été
évalués chaque jour pendant 6 jours à l'aide de
l'échelle suivante: 0= 0%, 1= 0-3%, 2 = 3-6%, 3 = 6-12%, 4 = 12-25%, 5 =
25-50%, 6 = 50-75%, 7 = 75- 88%, 8 = 88-94%, 9 =94-97%, 10 = 97-100%. Cette
échelle a été inspirée des images de Clives, 1971
(Pourcentage de symptôme sur feuille de céréale
après une infection causée par Drechslera gigantea).
2.4.3 Virulence in vivo
Le test de virulence in vivo est fait dans des pots
installés dans des cages grillagés (pour éviter la
confusion qui pourrait provenir d'éventuelles attaques d'insectes)
où la température variait entre 24,4oC et
30oC et une humidité relative variant entre 60 et 96% (Figure
3). Les 16 isolats ont été inoculés
séparément sous forme de suspension de mycélium et de
suspension de spores pour comparer les deux méthodes d'inoculation (pour
déterminer la meilleur façon de formuler chaque isolat). Les
traitements ont été appliqués dans un dispositif de bloc
complètement randomisé à quatre
répétitions.
Figure 3: Cage d'expérimentation
L'inoculation a été faite comme
précédemment sur les faces adaxiales des feuilles des plants
placés dans un cadrant de 0,25 m2 à raison de 250 L/ha
de suspension de spore (106 spores/ml) ou de mycélium (5%),
soit 6,25 ml, soit 24 pulvérisations par cadrant à l'aide d'un
pulvérisateur manuel de type Harry Brand Sprayer préalablement
calibré (Figure 4b). Les plants témoins ont été
pulvérisés uniquement d'une solution de PDB enrichie de 1% de
gélatine et de 0,02% de tween seulement.
Après l'inoculation, les plants ont été
disposés en dehors des cages sous une enceinte recouverte de sachet de
plastique pendant 48 heures afin de favoriser l'humidité
nécessaire au début de l'infection (Figure 4a).

a

b
Figure 4: Système d'incubation (a),
pulvérisation simultanée des 4 plantes du même traitement
(b)
Les variables suivantes ont été
mesurées:
· Les classes des symptômes sur feuilles (anciennes,
nouvelles et repousses) ;
· le nombre de fleurs ;
· le nombre de rejets ;
· le nombre de nouvelles feuilles ;
A la fin de l'essai, les poids secs des parties aériennes
ont été mesurés :
Les moyennes des classes d'étendues des
symptômes ont été calculées pour chaque jour quand
il s'agissait du test in vitro et pour chaque semaine lorsqu'il
s'agissait des tests in vivo. Ces moyennes ont été
utilisées pour construire des courbes d'évolutions des
symptômes.
2.5 Analyse des données
Toutes les données ont été saisies
à l'aide du programme Excel. Le calcul des moyennes et des écarts
types qui ont servi à tracer les différentes Figures, a
été fait à l'aide du logiciel SAS 9.1 tandis que ces
Figures ont été faites à l'aide du programme Excel. Pour
le choix des isolats les plus virulents, les résultats des
dernières évaluations (6 JAI pour le test in vitro et 6
SAI pour les tests in vivo) ont été soumis à une
analyse de variance (ANOVA) en utilisant le logiciel SAS 9.1, suivie d'une
séparation par le test de StudentNewman-Keuls (SNK) au seuil de 5%.
CHAPITRE 3 : RESULTATS
3.1 Résultats
3.1.1 Prospection, isolement et
pathogénicité
Soixante huit (68) isolats pathogènes de I.
cylindrica, répartis en 7 espèces sont identifiés
comme pathogènes durant la période de cette étude (Tableau
2). Le nombre de pathogènes obtenu varie selon les zones et selon les
saisons (Figure 5). Dans la ZH, 56 isolats (82% des pathogènes)
étaient collectés contre respectivement 10 isolats (15%) et 2
isolats ( 3%) dans la ZSH et la ZSA (Figure 5a). Quant aux saisons, la majeure
partie des pathogènes était collectée en saison pluvieuse
(82%), contre un nombre relativement réduit en saison sèche (18%)
(Figure 5b).
Considérant séparément les zones, tous
les 2 isolats de C. caudatum obtenus dans la ZSA sont
collectionnés en saison pluvieuse tandis que pour les deux autres zones,
les pathogènes sont différemment retrouvés au cours des
deux saisons avec une prédominance en saison pluvieuse pour la ZH et en
saison sèche pour la ZSH. En effet, 51 isolats (91% des
pathogènes) de la ZH sont collectionnés en saison pluvieuse
contre 5 isolats (9%) seulement en saison sèche (Figure 5c). Alors que
dans la ZSH, la majorité des pathogènes retrouvés
proviennent de la saison sèche, soit 7 isolats (70%) contre 3 isolat
(30%) pour la saison pluvieuse (Figure 5d). Les symptômes causés
par ces pathogènes sur I. cylindrica sont
caractérisés par:
· Des lésions sombres en forme de petites taches
(1mm) évoluant sous forme de demi-lune de 50 mm de diamètre en
bordure de la feuille (Figure 6a). Ces lésions sont surmontées de
halo jaune, et peuvent s'unir pour occuper toute la surface de la feuille.
L'observation à la loupe montre des fructifications sous forme
d'acervulles contenant des setae noirs sur la face supérieure de la
feuille. (Figures 6a). De ces types de lésions, est isolé par la
méthode directe, Colletotrichum caudatum qui présente un
mycélium gris, fin, cotonneux ou floconneux sur PDA. L'observation
microscopique présente des spores en forme de faucilles ((30-35) um x
(3,75-5) um), munies de flagelles;
· Des lésions brunes ou marron
irrégulières, observées sur les vielles feuilles des
plantes retrouvées dans les jachères qui sont
caractérisées par une nécrose peu prononcée avec de
petits nodules alignés dans les sillons du tissu foliaire (Figure
6b). L'observation à la loupe montre des
fructifications (sous formes de nodules marron), s'incrustant dans le limbe de
la feuille. Malgré la présence remarquable des fructifications,
l'isolement par la méthode directe est souvent sans succès. De
ces lésions, ont été isolés Glomerella
cingulata ou Glomerella spp qui se présente sous forme de
colonies jaune à jaune foncé, parsemées de pycnides orange
sur PDA. L'observation microscopique du contenu de ces dernières montre,
des ascospores de 15-20 um.
· Des brûlures longitudinales, de dimensions
variables et coalescentes de couleurs brunes à marrons ont
été aussi observées sur les feuilles (Figure 6c).
L'isolement par la méthode de stérilisation de surface a permis
d'isoler Bipolaris sacchari, Drechslera gigantea,
Exserohilum longirostratum, ou Exserohilum rostratum. La
différenciation de ces espèces uniquement par les symptômes
foliaires n'est pas aisée. Cependant, les lésions dues à
Drechslera gigantea se présentent comme des traces
longitudinales marron et sombre sur le limbe de la feuille tandis que les
autres espèces se caractérisent par des brûlures
longitudinales marron moins sombres en bordure de la feuille. 1). Les colonies
de B. sacchari sont d'un gris- clair sur PDA, et sont de dimensions
variant entre 64,5 et 85 mm après 7 jours. L'observation microscopique
montre des spores marrons, fusiformes et segmentées de dimensions
(20-110) x (5-15) tm. 2). Les colonies de D. gigantea sont d'un gris
surmonté d'une touffe claire sur PDA, et sont de diamètres
réduits (36 - 51,5 mm en 7 jours). L'observation microscopique montre
des spores marron rectilignes ou courbées selon les isolats avec des
segmentations claires ou sombres selon les isolats et mesurent (20-125) tm x
7,5-10) tm. 3). Les colonies de E. longirostratum sont de couleur
gris-clair avec une bordure claire. Elles remplissent la boîte de PDA (85
mm) en 6 jours. L'observation microscopique montre des spores fusiformes de
couleur marron à marron sombre de dimensions (20-110) tm x (7,5-10) tm.
Quant aux isolats de E. rostratum, leurs colonies sur PDA sont d'un
gris-clair à gris foncé avec des micelia fins, cotonneux, ou
floconneux. L'observation microscopique montre des spores fusiformes à
segment sombres et de dimensions (20 - 135) tm x (5-9) tm.
Les différences entre isolats de mêmes
espèces sont exprimées en 3.1.2.3.
Des 68 isolats, 45 sont identifiés comme C.
caudatum, 6 comme G. cingulata, 9 comme Glomerella
Spp., 2 comme E. longirostratum, 3 comme E.
rostratum, 2 comme B. sacchari et un seul comme D.
gigantea (Tableau 3.). Leur répartition varie suivant les zones et
les départements. C. caudatum est distribué dans toutes
les 3 zones, G. cingulata et Glomerella spp. sont
répartis dans la ZH et la ZSH tandis que E. longirostratum,
E. rostratum, B. sacchari et D. gigantea sont
seulement localisés dans la ZH (Figure 7).
Il faut signaler que les différentes espèces
pathogènes isolées étaient le plus souvent
associées à des champignons saprophytes. Il s'agit de
Pestalotia sp, Alternaria sp, Phoma sp, Botryodiplodia et Nigrospora.
Les tests de pathogénicité in vivo n'ont montré
aucun symptôme pour aucune de ces espèces.
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
1
|
BISBEN1
|
625
|
B. sacchari
|
ZH
|
Oueme
|
Adjohoun (Gbada)
|
60 38,76 N 20 31,23 E
|
2
|
BISBEN2
|
629
|
B. sacchari
|
ZH
|
Mono
|
Come (Bohoue-gbedji)
|
60 27,83N 10 54,99E
|
3
|
COCBEN1
|
451
|
C. caudatum
|
ZH
|
Oueme
|
Kouti
|
60 35,35N 20 39,23E
|
4
|
COCBEN10
|
494
|
C. caudatum
|
ZH
|
Atlantique
|
Tori Dognonko
|
60 30,19N 20 11,20E
|
5
|
COCBEN1 1
|
45
|
C. caudatum
|
ZH
|
Mono
|
Adjahonmey
|
70 2,56N 10 47,3 8E
|
6
|
COCBEN12
|
513
|
C. caudatum
|
ZH
|
Atlantique
|
Iiita-Cotonou
|
60 25,24N 20 19,68E
|
7
|
COCBEN13
|
521
|
C. caudatum
|
ZH
|
Mono
|
Agatogbo
|
60 24,07 N 10 55,53 E
|
8
|
COCBEN14
|
522
|
C. caudatum
|
ZH
|
Mono
|
Adjido
|
60 50,51N 10 47,43E
|
9
|
COCBEN15
|
530
|
C. caudatum
|
ZH
|
Mono
|
Kpovidji
|
60 34,43N 10 52,17E
|
10
|
COCBEN16
|
531
|
C. caudatum
|
ZH
|
Mono
|
Ayivedji
|
60 40,28N 10 43,07E
|
11
|
COCBEN17
|
523
|
C. caudatum
|
ZH
|
Mono
|
Ayivedji
|
60 40,28N 10 43,07E
|
12
|
COCBEN18
|
514
|
C. caudatum
|
ZH
|
Couffo
|
Toviklin
|
60 53,61N 10 50,01E
|
13
|
COCBEN19
|
515
|
C. caudatum
|
ZH
|
Couffo
|
Ayahohoue
|
60 57,59N 10 49,42E
|
14
|
COCBEN2
|
452
|
C. caudatum
|
ZH
|
Mono
|
Aveganmey
|
702,27N 10 68,76E
|
15
|
COCBEN20
|
516
|
C. caudatum
|
ZH
|
Couffo
|
Toviklin
|
60 53,61N 10 50,01E
|
16
|
COCBEN21
|
517
|
C. caudatum
|
ZH
|
Couffo
|
Kpassakanmey
|
60 54,47N 10 56,29E
|
17
|
COCBEN22
|
518
|
C. caudatum
|
ZH
|
Couffo
|
Lokogba
|
60 52,21N 10 51,9E
|
|
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin (suite)
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
18
|
COCBEN23
|
519
|
C. caudatum
|
ZH
|
Couffo
|
Meganhoue
|
60 53,47N 20 39,28E
|
19
|
COCBEN24
|
524
|
C. caudatum
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
20
|
COCBEN25
|
526
|
C. caudatum
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
21
|
COCBEN26
|
527
|
C. caudatum
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
22
|
COCBEN27
|
528
|
C. caudatum
|
ZH
|
Couffo
|
Fonkome
|
60 46,67N 10 46,37E
|
23
|
COCBEN28
|
520
|
C. caudatum
|
ZH
|
Couffo
|
Meganhoue
|
60 53,47N 20 39,28E
|
24
|
COCBEN29
|
535
|
C. caudatum
|
ZH
|
Atlantique
|
Toffo (Ague)
|
60 43,57N 20 16,12E
|
25
|
COCBEN3
|
453
|
C. caudatum
|
ZH
|
Atlantique
|
Kpomasse
|
60 27,49N 20 1,04E
|
26
|
COCBEN30
|
538
|
C. caudatum
|
ZH
|
Oueme
|
Bonou
|
60 47,24N 20 29,01E
|
27
|
COCBEN31
|
539
|
C. caudatum
|
ZSA
|
Atacora
|
Agboute
|
100 15,14N 00 59,43 E
|
28
|
COCBEN32
|
594
|
C. caudatum
|
ZSA
|
Borgou
|
Bouay
|
100 22,33N 20 46,43E
|
29
|
COCBEN33
|
595
|
C. caudatum
|
ZH
|
Mono
|
Come
|
60 28,23N 10 54,44E
|
30
|
COCBEN34
|
597
|
C. caudatum
|
ZH
|
Zou
|
Saclo
|
708,23N 2012,07E
|
31
|
COCBEN35
|
598
|
C. caudatum
|
ZH
|
Zou
|
Avokanzoun
|
7012,95N 202,41E
|
32
|
COCBEN36
|
599
|
C. caudatum
|
ZH
|
Zou
|
Avlame
|
707,37N 208,50E
|
33
|
COCBEN37
|
600
|
C. caudatum
|
ZH
|
Mono
|
Zoungbonou
|
60 13,19N 10 47,60E
|
34
|
COCBEN38
|
618
|
C. caudatum
|
ZSH
|
Collines
|
Dassa (Atagui)
|
70 49,96N 20 11,20E
|
|
Tableau 2: Liste des isolats des pathogènes
retrouvés sur I. cylindrica au Bénin (suite)
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
35
|
COCBEN39
|
619
|
C. caudatum
|
ZSH
|
Collines
|
Bante )Gouka)
|
80 10,49N 20 58,67E
|
36
|
COCBEN4
|
454
|
C. caudatum
|
ZH
|
Zou
|
Pouto
|
7013,75N 2027,60E
|
37
|
COCBEN40
|
620
|
C. caudatum
|
ZSH
|
Collines
|
Glazoue (Gbanli)
|
80 1 1,10N 20 11,20E
|
38
|
COCBEN41
|
621
|
C. caudatum
|
ZH
|
Plateau
|
Ketou (Odometa 1)
|
70 12,59N 20 38,80E
|
39
|
COCBEN43
|
623
|
C. caudatum
|
ZH
|
Oueme
|
Adjara (Honvie)
|
60 36,07N 20 39,95E
|
40
|
COCBEN44
|
626
|
C. caudatum
|
ZH
|
Mono
|
Houyogbe (Se)
|
60 31,14N 10 48,72E
|
41
|
COCBEN46
|
628
|
C. caudatum
|
ZH
|
Couffo
|
Kluekanmey (Lanta)
|
70 6,20N 10 52,47E
|
42
|
COCBEN47
|
646
|
C. caudatum
|
ZH
|
Couffo
|
Kluekanmey (Carder)
|
60 59,15N 10 51,15E
|
43
|
COCBEN5
|
455
|
C. caudatum
|
ZH
|
Plateau
|
Onigbolo
|
709,46N 2039,28E
|
44
|
COCBEN6
|
456
|
C. caudatum
|
ZH
|
Mono
|
Se (Gbadagri)
|
60 31,14N 20 12,07E
|
45
|
COCBEN7
|
457
|
C. caudatum
|
ZH
|
Mono
|
Zoungbonou
|
60 13,19N 10 47,60E
|
46
|
COCBEN8
|
458
|
C. caudatum
|
ZSH
|
Borgou
|
Gorou
|
80 58,58N 20 47,38E
|
47
|
COCBEN9
|
459
|
C. caudatum
|
ZSH
|
Borgou
|
Axe Tchaorou-Beterou
|
80 54,32N 2033,8E
|
48
|
DRGBEN1
|
536
|
D. gigantea
|
ZH
|
Plateau
|
Adjaouere
|
60 59,44N 20 36,47E
|
49
|
EXLBEN1
|
640
|
E. Longirostratum
|
ZH
|
Couffo
|
Lalo
|
60 53,21N 10 58,50E
|
50
|
EXLBEN2
|
648
|
E. Longirostratum
|
ZH
|
Couffo
|
Kluekanmey (Carder)
|
60 59,15N 10 5 1,15E
|
51
|
EXRBEN1
|
537
|
E. rostratum
|
ZH
|
Oueme
|
Bonou
|
60 47,24N 20 29,01E
|
|
Tableau 2: Liste des isolats des pathogènes
retrouvés de I. cylindrica au Bénin (suite)
n0
|
Isolats
|
IITA Code
|
Champignons
|
Zones
|
Département
|
Villages
|
GPS
|
52
|
EXRBEN2
|
596
|
E. rostratum
|
ZH
|
Mono
|
Come (Bohoue-gbedji)
|
60 27,83N 10 54,99E
|
53
|
EXRBEN3
|
624
|
E. rostratum
|
ZH
|
Oueme
|
Avrankou(Ounho)
|
60 32,14N 20 39,42E
|
54
|
GLCBEN1
|
450
|
G. cingulata
|
ZH
|
Collines
|
Paouian
|
70 39,67N 20 14,19E
|
55
|
GLCBEN2
|
504
|
G. cingulata
|
ZH
|
Atlantique
|
Tokan
|
60 27,57N 20 19,10E
|
56
|
GLCBEN3
|
505
|
G. cingulata
|
ZH
|
Mono
|
Yehoumey
|
60 56,84N 10 42,29E
|
57
|
GLCBEN4
|
525
|
G. cingulata
|
ZH
|
Couffo
|
Kpassakanmey
|
60 54,47N 10 56,29E
|
58
|
GLCBEN5
|
614
|
G. cingulata
|
ZSH
|
Collines
|
Glazoue (Gbanli)
|
80 1 1,10N 20 11,20E
|
59
|
GLCBEN6
|
615
|
G. cingulata
|
ZSH
|
Collines
|
Hoco
|
70 52,91N 20 56,12E
|
60
|
GLSPBEN1
|
442
|
Glomerella spp
|
ZH
|
Mono
|
Kpinnou
|
60 34,95N 10 46,25E
|
61
|
GLSPBEN2
|
36
|
Glomerella spp
|
ZH
|
Zou
|
Koguede
|
7012,5N 2010,51E
|
62
|
GLSPBEN3
|
506
|
Glomerella spp
|
ZSH
|
Collines
|
Oougui
|
807,17N 3033,55
|
63
|
GLSPBEN4
|
507
|
Glomerella spp
|
ZH
|
Atlantique
|
Houegbo
|
60 39,06N 20 4,66E
|
64
|
GLSPBEN5
|
529
|
Glomerella spp
|
ZH
|
Mono
|
Ouedeme-Pedah
|
60 29,47N 10 55,75E
|
65
|
GLSPBEN6
|
533
|
Glomerella spp
|
ZH
|
Couffo
|
Kpassakanmey
|
60 54,47N 10 56,29E
|
66
|
GLSPBEN7
|
534
|
Glomerella spp
|
ZH
|
Couffo
|
Sokohoue
|
60 54,04N 10 41,21E
|
67
|
GLSPBEN8
|
616
|
Glomerrela spp
|
ZSH
|
Collines
|
Dassa (Atagui)
|
70 49,96N 20 11,20E
|
68
|
GLSPBEN9
|
617
|
Glomerrela spp
|
ZSH
|
Collines
|
Save (Atchakpa)
|
7059,45N 2023,61E
|
|
1 .5

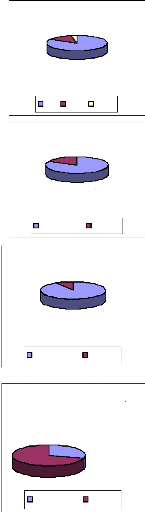
15% 3%
a
18%
b
82%
ZH ZSH ZSA
82%
PLUVIEUSE SECHE
c
9%
91%
PLUVIEUSE SECHE
d
30%
70%
PLUVIEUSE SECHE

38
c
b
a

Figure 6: Lésions dues à C. caudatum
(a), lésions dues à G. cingulata et Glomerella
spp.(b) et lésions causées par B. sacchari, D.
gigantea E. rostratum ou E. longirostratum (c)


Figure 7: Carte de distribution des espèces
retrouvées sur I. cylindrica au Bénin. BIS = B.
sacchari, COC = C. caudatum, DRG = D. gigantea, EXL =
E. longirostratum EXR = E. rostratum, GLC = G. cingulata
et GLSP = Glomerella spp.
Tableau 3: Nombre d'isolats obtenus par zone et par
département
|
|
|
|
ISOLATS
|
|
|
|
|
ZONES
|
DEPARTEMENTS
|
BIS
|
COC
|
DRG
|
EXL
|
EXR
|
GLC
|
GLSP
|
Total
|
|
ATLANTIQUE
|
0
|
4
|
0
|
0
|
0
|
1
|
1
|
6
|
|
COUFFO
|
0
|
13
|
0
|
2
|
0
|
1
|
2
|
18
|
|
MONO
|
1
|
12
|
0
|
0
|
1
|
1
|
2
|
17
|
ZH
|
OUEME
|
1
|
3
|
0
|
0
|
2
|
0
|
0
|
6
|
|
PLATEAU
|
0
|
2
|
1
|
0
|
0
|
0
|
0
|
3
|
|
ZOU
|
0
|
4
|
0
|
0
|
0
|
0
|
1
|
5
|
|
BORGOU
|
0
|
2
|
0
|
0
|
0
|
3
|
3
|
8
|
ZSH
|
COLLINES
|
0
|
3
|
0
|
0
|
0
|
0
|
0
|
3
|
|
DONGA
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
ATACORA
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
ZSA
|
ALIBORI
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
TOTAL
|
|
2
|
45
|
1
|
2
|
3
|
6
|
9
|
68
|
|
Tableau 4:
|
Résultats du test de pathogénicité
des41 isolats choisis, sur Jeunes plants de I. cylindrica
|
Isolats
|
Lab code
|
Moyennes #177; Ecarts types
|
1
|
BISBEN2
|
4,7 #177; 1,2
|
2
|
EXRBEN1
|
4,3 #177; 1,5
|
3
|
EXRBEN3
|
4,3 #177; 0,6
|
4
|
BISBEN1
|
4,0 #177; 1,0
|
5
|
EXLBEN1
|
4,0 #177; 1,0
|
6
|
EXLBEN2
|
4,0 #177; 0,0
|
7
|
COCBEN46
|
3,7 #177; 0,6
|
8
|
DRGBEN1
|
3,3 #177; 1,5
|
9
|
EXRBEN2
|
3,3 #177; 1,5
|
10
|
COCBEN11
|
3,3 #177; 1,2
|
11
|
COCBEN8
|
3,3 #177; 1,2
|
12
|
COCBEN41
|
3,0 #177; 0,0
|
13
|
COCBEN4
|
2,0 #177; 0,0
|
14
|
COCBEN15
|
1,7 #177; 1,2
|
15
|
GLSPBEN5
|
1,7 #177; 1,2
|
16
|
COCBEN12
|
1,7 #177; 0,6
|
17
|
COCBEN32
|
1,7 #177; 0,6
|
18
|
COCBEN36
|
1,7 #177; 0,6
|
19
|
COCBEN44
|
1,7 #177; 0,6
|
20
|
COCBEN5
|
1,7 #177; 0,6
|
21
|
GLSPBEN1
|
1,7 #177; 0,6
|
22
|
GLSPBEN8
|
1,7 #177; 0,6
|
23
|
GLSPBEN8
|
1,7 #177; 0,6
|
24
|
GLSPBEN6
|
1,3 #177; 1,5
|
25
|
COCBEN1
|
1,3 #177; 0,6
|
26
|
COCBEN18
|
1,3 #177; 0,6
|
27
|
COCBEN2
|
1,3 #177; 0,6
|
28
|
COCBEN30
|
1,3 #177; 0,6
|
29
|
COCBEN47
|
1,3 #177; 0,6
|
30
|
GLCBEN2
|
1,3 #177; 0,6
|
31
|
GLSPBEN4
|
1,3 #177; 0,6
|
32
|
COCBEN31
|
1,0 #177; 0,0
|
33
|
COCBEN40
|
1,0 #177; 0,0
|
34
|
COCBEN43
|
1,0 #177; 0,0
|
35
|
GLCBEN1
|
1,0 #177; 0,0
|
36
|
GLCBEN3
|
1,0 #177; 0,0
|
37
|
GLCBEN4
|
1,0 #177; 0,0
|
38
|
GLCBEN6
|
1,0 #177; 0,0
|
39
|
GLSPBEN2
|
1,0 #177; 0,0
|
40
|
GLSPBEN3
|
1,0 #177; 0,0
|
41
|
COCBEN29
|
0,3 #177; 0,6
|
|
*Moyenne sur 3 répétitions
BIS = B. sacchari, COC = C. caudatum ,
DRG = D. gigantea, EXL = E. longirostratum EXR = E.
rostratum, GLC = G. cingulata et GLSP = Glomerella spp, BEN =
Bénin Les chiffres = ordre d'isolement
3.1.2 Etude des caractéristiques physiques
différentiels entre les isolats 3.1.2.1 Choix des isolats
Afin de réduire le nombre des isolats pour la suite
des essais seuls les isolats ayant présentés des classes de
symptôme supérieur à 3 % pour le test de
pathogénicité sont retenus (en gras dans le Tableau 4).
· Aucun des isolats de Glomerella n'a
été choisi parce que ne présentant pas de symptômes
> 3% comme indiqué dans la méthodologie. D'ailleurs ces
symptômes sont caractéristiques des vieilles plantes
retrouvées dans les jachères et ne montrent pas d'effets
sensibles sur les feuilles.
· Parmi les isolats de C. caudatum, seuls
COCBEN8, COCBEN1 1, COCBEN41 et COCBEN46 ont présenté des
lésions foliaires supérieures à 3%, et ont
été choisis pour la suite des essais ;
· Tous les isolats des autres espèces (B.
sacchari, D. gigantea et Exserohilum spp.) ont produit des
symptômes supérieurs à 3% et sont choisis pour la suite des
essais (Tableau 4).
3.1.2.2 Caractéristiques physiques et croissances
radiales sur milieu artificiel PDA des isolats choisis
Les isolats indigènes de B. sacchari (BISNEB1
et BISBEN2) sont similaires du point de vue de l'aspect des mycélia et
de leur croissance alors que l'isolat exogène BISFLOR1 a eu une
croissance nettement inférieure (Figure 8). En effet, les isolats
indigènes ont rempli la boîte de pétri (85 mm) après
6 jours tandis que 7 jours après culture, (JAC) BISFLOR1 a encore une
moyenne de croissance de 65 mm (Figure 9).
La couleur des mycélia est variable chez C.
caudatum selon les isolats (Figure 11). COCBEN1 1 et COCBEN8 ont un
mycélium gris aérien et cotonneux (Figure 1 1a), COCBEN46
présente un mycélium gris foncé et adhésif (Figure
1 1c), tandis que COCBEN41 a un mycélium gris clair avec une coloration
orange diffuse (Figure 1 1b) provenant de la pigmentation en arrière de
la boîte. COCBEN8, COCBEN41 et COCBEN46 ont une croissance similaire
tandis que celle de COCBEN1 1 est plus

BISBEN (a)
BISFLOR (b)

retardée. Ce dernier atteint sa croissance maximale (85
mm) à 6 JAC tandis tous les trois autres isolats ont atteint cette
croissance maximale à 5 JAC (Figure 10).
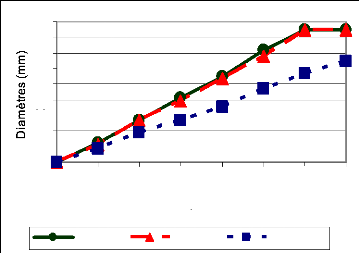
40
90
80
60
50
30
20
70
10
0
0 1 2 3 4 5 6 7
BISBEN1 BISBEN2 BISFLOR1
Jours après culture

1 .5
Figure 9: Croissances radiales sur PDA des 3 isolats
de B. sacchari en 7 jours (moyenne de 3
répétitions)
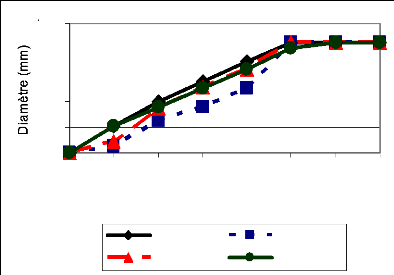
100
40
60
20
80
0
0 1 2 3 4 5 6 7
COCBEN8 COCBEN11
COCBEN41 COCBEN46
Jours après culture

1 .5
Figure 10: Croissances radiales sur PDA des 4 isolats
de C. caudatum en 7 jours (moyenne de 3
répétitions)

a
b
c
1 .5
Figure 11: Différents aspects
présentés par les colonies de C. caudatum sur PDA
après 7 jours
45

b
a
DRGFLOR
DRGBEN
DRGBEN1 (Figure 12a) a un mycélium cotonneux gris
sombre surmontée par une touffe plus claire avec un arrière de
boîte clair tandis que l'isolat indigène DRGFLOR1 montre un
mycélium gris sombre adhésif (Figure12b) avec un arrière
de boîte sombre. Ici également l'isolat exogène DRGFLOR1 a
présenté une croissance plus lente avec un maximum de 36 mm
à 7 JAC contre 51 mm pour l'isolat indigène DRGBEN1 (Figure
13).
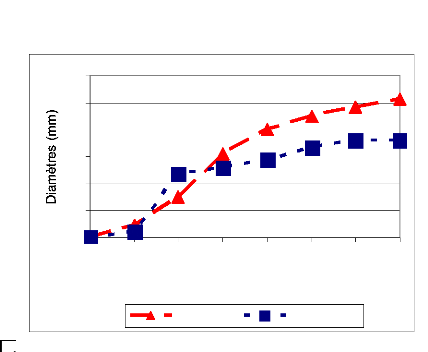
47
1 .5
60
50
40
30
20
10
0
0 1 2 3 4 5 6 7
DRGBEN1 DRGFLOR1
Jours après culture
Figure 13: Croissance radiale sur PDA de DRGBEN1 et de
DRGFLOR1 en 7 jours (moyenne de 3 répétitions)
Les isolats de E. longirostratum ont les mêmes
caractéristiques physiques (Figure 14) et même croissance radiale
(Figure 15) quelle que soit leur origine. Leurs mycélia forment des
colonies adhésives, d'une couleur grise claire avec une bordure
blanchâtre. Leurs croissances radiales sont superposables avec un maximum
de 85 mm à partir de 6 JAC (Figure 15).
Pour ce qui concerne les isolats de E. rostratum,
EXRBEN1, EXRBEN2 et EXRBEN3, ils ont présenté un mycélium
abondant gris clair à gris sombre (Figure 16). EXRBEN2 et EXRBEN3 sont
un peu plus épais (Figure 16b et 16c) alors que EXRBEN1 est moins
épais (Figure 1 6a). L'isolat exogène EXRFLOR1 a
présenté un mycélium fin adhésif gris avec une
bordure claire (Figure 1 6d). Tous les quatre isolats ont une croissance
similaire avec une croissance radiale maximale de 85 mm à partir de 6
jours (Figure 17).
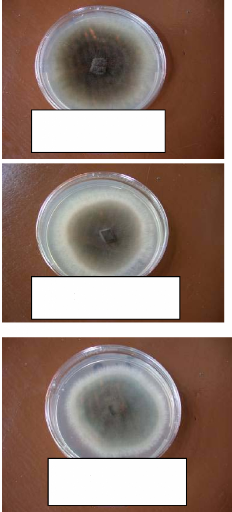
EXLBEN1 (a)
EXLFLOR1 (b)
EXLBEN2 (c)

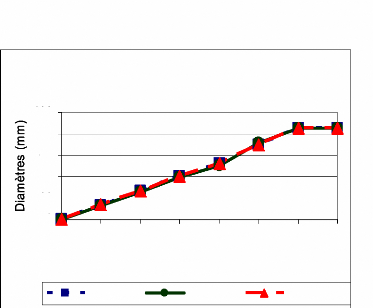
49
100
80
60
40
20
0
0 1 2 3 4 5 6 7
Jours après culture
EXLBEN1 EXLBEN2 EXLFLOR1


EXRBEN1 (a)
EXRBEN3 (c)
EXRBEN2 (b)
EXRFLOR1 (d)

1 .5
1 .5
Figure 15: Croissances radiales des 3 isolats de E.
longirostratum sur PDA en 7 jours (moyenne de 3
répétitions)

50
1 .5
100
80
60
40
20
0
0 1 2 3 4 5 6 7
EXRBEN1 EXRBEN2
EXRBEN3 EXRFLOR1
Jours après culture
Figure 17: Croissance radiale des isolats de E.
rostratum (moyenne de 4 répétitions) 3.1.2.3 Production de
spores
- Identification du meilleur substrat pour la production
de spores
Le bouillon salé de pomme de terre est seulement
favorable à la production de spores des isolats de C. caudatum
(COCBEN8, COCBEN11, COCBEN41 et COCBEN46). COCBEN8 a montré une
meilleure performance sur substrat de rhizome à 4,6 x107
contre 3,5 x107 spores pour le bouillon (Tableau 5). Ce substrat de
rhizome est aussi le meilleur pour la production des spores de EXLBEN2 mais la
production reste relativement faible (1,6 x107 spores par flacon) de
100 g de substrat.
Le substrat de riz entraîne la meilleure production de
spores de BISFLOR1 (4,4 x107), DRGFLOR1 (6,0 x 107 ) et
EXLBEN1 (3,1 x107).
Le V8 Agar est un milieu producteur de spores pour la plupart
des isolats sauf pour C. caudatum. Il est le seul milieu qui a permis
de produire les spores de BISBEN1 (0,3 x1 07) et DRGBEN1 (1,1 x1
07) et est le meilleur milieu pour la production des spores de
EXLFLOR1 (0,7 x107), EXRBEN2 (0,3 x107), EXRBEN3 (1,8
x107) et EXRFLOR1 (0,7 x107) (Tableau 5).
Ces résultats ont permis de choisir différentes
méthodes de production de spores, en se basant sur la capacité de
production de spores, la disponibilité et le coût des substrats
pour la suite des travaux.
Tableau 5: Nombre (X 107) de spores produites
par flacon par chaque type de milieu ou substrat
|
ISOLAT
|
LIQUIDE
|
RHIZOME
|
RIZ
|
|
V8AGAR
|
|
BISBEN1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,3
|
#177; 0,1
|
|
BISBEN2
|
0,0
|
#177; 0,0
|
0,1
|
#177; 0,1
|
0,1
|
#177; 0,0
|
0,1
|
#177; 0,1
|
|
BISFLOR1
|
0,0
|
#177;0,0
|
2,7
|
#177; 0,7
|
4,3
|
#177; 0,0
|
3,6
|
#177; 0,2
|
|
COCBEN11
|
1,7
|
#177; 0,2
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
|
COCBEN41
|
0,3
|
#177;0,1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
|
COCBEN46
|
1,1
|
#177; 0,0
|
0,0
|
#177;0,0
|
0,0
|
#177;0,0
|
0,0
|
#177;0,0
|
|
COCBEN8
|
3,5
|
#177; 0,4
|
4,6
|
#177; 0,2
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
|
DRGBEN1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177;0,0
|
1,1
|
#177; 0,2
|
|
DRGFLOR1
|
0,0
|
#177; 0,0
|
3,7
|
#177; 0,5
|
6,0
|
#177; 0,4
|
4,9
|
#177; 0,3
|
|
EXLBEN1
|
0,0
|
#177; 0,0
|
1,9
|
#177; 0,3
|
3,1
|
#177; 0,3
|
0,1
|
#177; 0,0
|
|
EXLBEN2
|
0,0
|
#177; 0,0
|
1,6
|
#177; 0,2
|
0,7
|
#177; 0,2
|
0,6
|
#177; 0,0
|
|
EXLFLOR1
|
0,0
|
#177; 0,0
|
0,1
|
#177; 0,0
|
0,1
|
#177; 0,1
|
1,4
|
#177; 0,1
|
|
EXRBEN1
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,0
|
#177; 0,0
|
0,1
|
#177; 0,1
|
|
EXRBEN2
|
0,0
|
#177; 0,0
|
0,2
|
#177; 0,1
|
0,1
|
#177; 0,1
|
0,3
|
#177; 0,1
|
|
EXRBEN3
|
0,0
|
#177; 0,0
|
0,3
|
#177; 0,1
|
0,5
|
#177; 0,1
|
1,8
|
#177; 0,3
|
|
EXRFLOR1
|
0,0
|
#177; 0,0
|
0,2
|
#177; 0,1
|
0,1
|
#177; 0,1
|
0,7
|
#177; 0,1
|
* Moyennes pour 4 répétitions
BIS = B. sacchari, COC = C. caudatum ,
DRG = D. gigantea, EXL = E. longirostratum EXR = E.
rostratum, GLC = G. cingulata et GLSP = Glomerella spp, BEN =
Bénin Les chiffres = ordre d'isolement
- Formes et dimensions des spores produites par les
isolats
Pour ce qui concerne les dimensions et formes des spores,
elles sont pour la plupart similaires pour les isolats de la même
espèce à l'exception des isolats exogènes qui ont
présenté des différences par rapport aux isolats
indigènes (Tableau 6).
Les isolats de B. sacchari ont tous montré des
spores de couleur marron, fusiformes et segmentées. BISFLOR1 a eu des
spores plus longues et effilées [20-110 x 7.5-10] um tandis que celles
des isolats indigènes (BISBEN1 et BISBEN2) ont produit des spores plus
courtes et plus larges ((20-60) x (5-15)) um. Quant aux isolats de C.
caudatum, elles sont toutes identiques avec des spores en forme de
faucilles munies de flagelles claires. Les spores de DRGBEN1 sont de couleur
marron, rectiligne avec des segments clairs, alors que celles de DRGFLOR1 sont
aussi marron mais courbées avec des segments sombres. On ne note pas de
différences remarquables entre leurs tailles (Tableau 6).
EXLBEN1 et EXLBEN2 qui sont indigènes ont montré
des spores plus longues, fusiformes ((20-1 10)x(7.5-10))tm de couleur sombre
tandis que l'isolat exogène EXLFLOR1 a produit des spores plus courtes
((20-90)x(7,5-10))tm, fusiformes et rectilignes de couleur marron claire
(Tableau 6).
Pour ce qui concerne les isolats de E. rostratum, les
spores sont toutes fusiformes de couleur marron clair avec des segments sombres
mais celles des isolats indigènes (EXRBEN1, EXRBEN2, EXRBEN3) sont plus
longues et effilées (20-135)x(5-9)tm que celles de l'isolat
exogène (EXRFLOR1) qui sont plus courtes (20-90)x(7.5-10)tm (Tableau
6).
Tableau 6: Dimensions et formes des spores
|
Isolats
|
Tailles (um)
|
Formes
|
Couleur
|
Segmentation
|
|
BISBEN1
|
(20-60)x(5-15)
|
Fusiforme
|
Marron claire
|
Segment sombre
|
|
BISBEN2
|
(20-60)x(5-15)
|
Fusiforme
|
Marron claire
|
Segment sombre
|
|
BISFLOR1
|
(20-110)x(7,5-10)
|
Fusiforme
|
Marron claire
|
Segment clair
|
|
COCBEN1 1
|
(30-35)x(3,75-5)
|
Forme de faucille
|
Claire
|
Pas de segment
|
|
COCBEN41
|
(30-35)x(3,75-5)
|
Forme de faucille
|
Claire
|
Pas de segment
|
|
COCBEN46
|
----
|
----
|
----
|
----
|
|
COCBEN8
|
(30-35)x(3,75-5)
|
Forme de faucille
|
Claire
|
Segment clair
|
|
DRGBEN1
|
(20-110)x(7,5-10)
|
Droite
|
Marron claire
|
Segment clair
|
|
DRGFLOR1
|
(20-125)x(7,5-10)
|
Courbée
|
Marron claire
|
Segment sombre
|
|
EXLBEN1
|
(20-1 10)x(7,5-10)
|
Fusiforme
|
Marron sombre
|
Segment sombre
|
|
EXLBEN2
|
(20-1 10)x(7,5-10)
|
Fusiforme
|
Marron sombre
|
Segment sombre
|
|
EXLFLOR1
|
(20-90)x(7,5-10)
|
Fusiforme et rectiligne
|
Marron claire
|
Segment sombre
|
|
EXRBEN1
|
(20-135)x(5-9)
|
Fusiforme effilée
|
Marron claire
|
Segment sombre
|
|
EXRBEN2
|
(20-135)x(5-9)
|
Fusiforme effilée
|
Marron claire
|
Segment sombre
|
|
EXRBEN3
|
(20-130)x(5-9)
|
Fusiforme effilée
|
Marron claire
|
Segment sombre
|
|
EXRFLOR1
|
(20-100)x(5-9)
|
Fusiforme
|
Marron claire
|
Segment sombre
|
3.1.3 Etude comparée de la virulence des isolats
Les symptômes observés sur les pièces de
feuilles (pour les tests in vitro) et sur les
feuilles des plants en pots (pour les tests in vivo)
sont similaires à ceux observés au champ lors des
prospections.
3.1.3.1 Virulence in vitro
Pour les isolats de B. sacchari, l'isolat exogène
BISFLOR1 a développé de symptôme, à
1 jour après inoculation (JAI), comparé aux
isolats indigènes BISBEN1 et BISBEN2 qui
n'ont
développé de symptôme qu'à partir de 2 JAI. De plus
BISFLOR1 est resté
nettement plus virulent que les isolats
indigènes durant la durée de l'essai (Figure 18). A
6 JAI il cause des lésions dont la moyenne des classes est
de 4,5 contre respectivement 2,75 et 2,25 pour BISEN2 et BISBEN1.
Pour les isolats de C. caudatum (Figure 19), l'isolat
COCBEN8 a très tôt développé de symptôme (1
JAI) comparé aux isolats COCBEN41 et COCBEN46 qui n'ont
développé de symptôme qu'à partir de 3 JAI, tandis
que COCBEN1 1 n'a présenté aucune lésion avant la fin de
l'essai. De plus COCBEN8 est resté nettement virulent avec une moyenne
de classe de 3,75 contre 0,75 pour COCBEN41 et COCBEN46.
Des deux isolats de D. gigantea, l'isolat
exogène DRGFLOR1 est resté nettement plus virulent (5,25 de
moyenne de classe) que l'isolat indigène DRGBEN1 (2,25 de moyenne de
classe), cependant ces deux isolats ont très vite
développé de lésions à partir de 1 JAI (Figure
20).
Des trois isolats de E. longirostratum, l'isolat
exogène EXLFLOR1 a très tôt développé de
lésions (1 JAI) comparativement aux isolats indigènes EXLBEN1 et
EXLBEN2 qui ont commencé un jour plus tard. Mais les lésions
causées par EXLBEN2 ont rapidement évolué à partir
de 2 JAI, pour finalement surpasser le degré de lésions de
l'isolat exogène (5,5 contre 3,25) entre 5 JAI et 6 JAI (Figure 21).
Des quatre isolats de E. rostratum, l'isolat
exogène EXRFLOR1 a très tôt développé de
symptôme (1 JAI) par rapport aux isolats indigènes EXRBEN1 et
EXRBEN2 et EXRBEN3 (Figure 22). Mais les symptômes causés par
EXRBEN3 ont rapidement évolué à partir de 2 JAI, pour
finalement atteindre le degré des lésions de EXRFLOR1 (2,75) de 4
JAI à 6 JAI. Quant à EXRBEN2 et à EXRBEN1,
l'étendue de leur lésion est restée nettement
inférieure (respectivement 1 et 0,75) à celle causée par
EXRFLOR1 et EXRBEN3 (Figure 22).

Figure 18: Evolution des lésions causées
in vitro, par les isolats de B. sacchari.
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)
4
5
3
2
0
1
1 2 3 4 5 6
COCBEN8 COCBEN11
COCBEN41 COCBEN46
Jours après inoculation
1 .5
Figure 19: Evolution des lésions causées
in vitro, par les isolats de C. caudatum.
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)
54
1 .5
6
5
4
3
2
1
0
1 2 3 4 5 6
BISBEN1 BISBEN2 BISFLOR1
Jours après inoculation

7
6
5
4
3
2
1
0
1 2 3 4 5 6
DRGBEN1 DRGFLOR1
Jours après inoculation
1 .5
Figure 20: Evolution des lésions causées
in vitro, par les isolats de D. gigantea.
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)

4
2
7
6
5
3
0
1
1 2 3 4 5 6
EXLBEN1 EXLBEN2 EXLFLOR1
Jours après inoculation
1 .5

Figure 21: Evolution des lésions causées
in vitro, par les isolats de E. longirostratum
Symptômes évalués sur des morceaux de feuilles en
boîtes humides (moyennes de 4 répétitions avec les
écarts types)
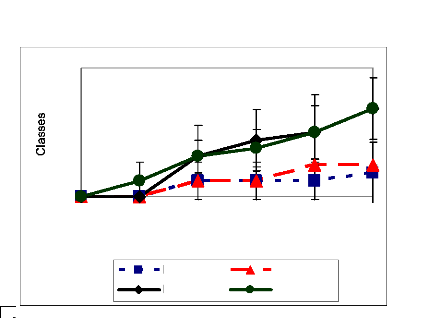
56
4
3.5
3
2.5
2
1.5
1
0.5
0
1 2 3 4 5 6
EXRBEN1 EXRBEN2
EXRBEN3 EXRFLOR1
Jours après inoculation
1 .5
Figure 22: Evolution des lésions causées
in vitro, par les isolats de E. rostratum Symptômes
évalués sur des morceaux de feuilles en boîtes humides
(moyennes de 4 répétitions avec les écarts
types)
L'analyse de variance de l'étendue des lésions
causées par les isolats à la fin de l'essai (6 JAI) montre une
différence significative au seuil de 5% (Tableau 7). EXLBEN2 avec une
classe de 5,5 est le meilleur isolat pour le test in vitro, suivi des
isolats DRGFLOR1 (5,25), BISFLOR1 (4,50).
Tableau 7: Classification des isolats suivant leur
virulence in vitro
|
ISOLATS
|
Moyennes #177; Ecarts types
|
|
EXLBEN2
|
5,5 #177; 0,6a
|
|
DRGFLOR1
|
5,2 #177; 0,5a
|
|
BISFLOR1
|
4,5 #177; 0,6ab
|
|
COCBEN8
|
3,7 #177; 0,5bc
|
|
EXLFLOR1
|
3,2 #177; 0,9cd
|
|
BISBEN2
|
2,7 #177; 0,5cd
|
|
EXRFLOR1
|
2,7 #177; 0,9cd
|
|
EXRBEN3
|
2,7 #177; 0,9cd
|
|
EXLBEN1
|
2,5 #177; 0,6cd
|
|
DRGBEN1
|
2,5 #177; 0,6cd
|
|
BISBEN1
|
2,2 #177; 0,9d
|
|
EXRBEN2
|
1,0 #177; 0,0e
|
|
COCBEN41
|
0,7 #177; 0,5e
|
|
COCBEN46
|
0,7 #177; 0,5e
|
|
EXRBEN1
|
0,7 #177; 0,9e
|
|
COCBEN11
|
0,0 #177; 0,0e
|
TEMOIN 0,0 #177; 0,0e
*Moyennes de 4 répétitions
*Les moyennes suivies d'une même lettre ne sont pas
significativement différentes au seuil de 5% avec le test de Studen
Newman Keuls(SNK)
3.1.3.2 Virulence in vivo
- Evolution des lésions sur feuille
Sur les graphes présentés ici, les
étendues de lésions représentent les mêmes variables
que les classes précédemment inscrites en ordonnées. La
différence est que les observations sont faites in vivo et sur une plus
longue période.
Les isolats indigènes BISBEN1 et BISBEN2 n'ont pas
produit suffisamment de spores pour le test in vivo. Seules les spores
de l'isolat exogène BISFLOR1 sont inoculées. Mais
l'évolution des lésions causées par ces dernières
(Figure 23a) est restée inférieure à l'évolution
des lésions lorsque l'inoculum est fait à partir de suspension
mycélienne (Figure 23b). En effet, à la 6ème
semaine après inoculation (SAI), la suspension mycélienne a
produit près de 1,5 fois plus de lésions que la suspension de
spore (Figure 23). De même pour ce qui concerne l'utilisation de la
suspension de mycélium, les lésions provoquées in
vivo par l'isolat exogène BISFLOR1 sont restées nettement
supérieures à celles des isolats indigènes BISBEN1 et
BISBEN2 qui n'ont présenté aucune différence significative
entre eux.
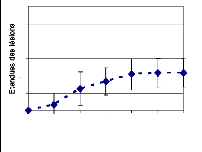
4
6
5
3
2
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines après
inoculation
a

4
6
5
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
BISBEN1 BISBEN2 BISLFLOR1
Semaines après inoculation
b

Figure 23: Evolution des lésions causées
in vivo par les isolats de B. sacchari après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. BISBEN =
B. sacchari originaire du Bénin, BISFLOR = B. sacchari
originaire des Florides, chiffre (1, 2) = ordre d'isolement.
Parmi les isolats de C. caudatum, COCBEN41 est le
moins virulent pour les lésions
causées à partir de la
suspension de mycélium. De plus il n'a pas produit suffisamment
de
spores pour que ces dernières soient utilisées en
suspension, comme inoculum (Figure
24a). Quant aux isolats COCBEN1 1, COOBEN8 et COCBEN46,
l'ordre de virulence est le même qu'on utilise une suspension de spore ou
de mycélium (COCBEN46 suivi de COCBEN8 puis après COCBEN1 1).
Mais la différence entre les capacités d'infection est plus
remarquée quand on utilise la suspension de spore comme inoculum. En
effet à la 6ème semaine COCBEN8 reste nettement inférieur
(2,3 de classe) à COCBEN46 lorsque les spores sont inoculées (3,3
de classe) tandis qu'ils se confondent (respectivement 3,3 et 3,6 de classe) en
cas d'utilisation de suspension de mycélium comme inoculum (Figure
24b).
Lorsque les suspensions de spore sont utilisées,
DRGBEN1 et DRGFLOR1 ne montrent pas de différence remarquable. A la
6ème semaine, ils montrent respectivement 1,8 et 2,1 comme
moyenne de classe (Figure 25a). Mais l'isolat exogène est plus de deux
fois virulent (3,8 de classe) que l'isolat indigène (1,8 de classe)
lorsque la suspension de mycélium est pulvérisée (Figure
25b).

4
5
3
2
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines après inoculation
COCBEN11 COCBEN46 COCBEN8
a

4
5
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
Semaines
après inoculation
b
COCBEN11 COCBEN41
COCBEN46 COCBEN8

Figure 24: Evolution des lésions causées
in vivo par les isolats de C. caudatum après
utilisation de suspension de spore à 106 de spore/ml (a) et
de suspension de mycélium à 5% p/v (b) comme inoculum. COCBEN =
C. caudatum originaire du Bénin, chiffre 8,11,41,48 = ordre
d'isolement

4
6
5
3
2
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
a
Semaines après inoculation
DRGBEN1 DRGFLOR1

4
6
5
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
b
Semaines après inoculation
DRGBEN1 DRGLFLOR1
Figure 25: Evolution des lésions causées
in vivo par les isolats de D. gigantea après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. DRGBEN =
D. gigantea originaire du Bénin, DRGFLOR= D. gigantea
originaire des Florides, chiffre 1 = ordre d'isolement
Les trois isolats de E. longirostratum ont
provoqué des lésions d'étendues semblable lorsque la
suspension de mycélium est pulvérisée. A la
6ème semaine, ils ont tous eu 2,3 de moyennes de classe. Mais
les spores de l'isolat exogène EXLFLOR1 sont plus virulentes que son
mycélium (Figure 26a). A la 6ème semaine, ces
dernières montrent une nette supériorité (3,5) contre
respectivement 2,4 et 1,7 comme moyenne de classe pour EXLBEN2 et EXLBEN1
lorsque les spores sont utilisées comme inoculum (Figure 26b).
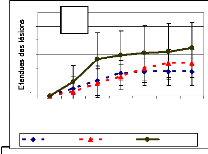
4
2
6
5
3
0
1
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines après
inoculation
EXLBEN1 EXLBEN2 EXLFLOR1
a
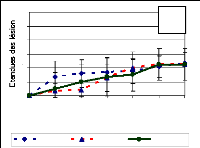
6
5
4
3
2
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
Semaines
après inoculation
EXLBEN1 EXLBEN2 EXLFLOR1
b
Figure 26: Evolution des lésions causées
in vivo par les isolats de E. longirostratum après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. EXLBEN =
E. longirostratum originaire du Bénin, EXLFLOR= E.
longirostratum originaire des Florides, chiffre 1 et 2 = ordre
d'isolement
EXRBEN1 et EXRBEN2 qui n'ont pas produit suffisamment de
spores pour l'inoculation ont nettement provoqué plus de lésion
que EXRBEN3 et EXRFLOR1 pour les suspensions de mycélium (Figure 27b). A
la 6ème semaine, ces derniers ont montré comme moyenne
de classe pour les lésions, respectivement 2,1 et 0,6 contre
respectivement 3,8 et 3 pour EXRBEN1 et EXRBEN2, lorsque la suspension de
mycélium est utilisée. L'utilisation de suspension de
mycélium a diminué les performances de EXRBEN3 et EXRFLOR1 en ce
sens qu'à la 6ème semaine, on obtient respectivement
2,1 et 0,6 de moyenne de classe lésion pour la suspension de
mycélium contre respectivement 2,9 et 2,7 pour la suspension de spore
(Figure 27a).

4
6
5
3
2
0
1
a
SAI0 SAI1 SAI2 SAI3 SAI4 SAI5 SAI6
Semaines apres inoculation
EXRFLOR1 EXRBEN3

4
2
6
5
3
0
1
SAI0 SAI 1 SA1 2 SAI 3 SAI 4 SAI 5 SAI 6
b
Semaines après inoculation
EXRBEN1 EXRBEN2
EXRBEN3 EXRFLOR1
Figure 27: Evolution des lésions causées
in vivo par les isolats de E. rostratum après
utilisation de suspension à 106 de spore/ml (a) et de
suspension de mycélium à 5% p/v (b) comme inoculum. EXRBEN =
E. rostratum originaire du Bénin, EXRFLOR= E.
rostratum originaire des Florides, chiffre 1, 2 et 3 = ordre
d'isolement
L'analyse des variances qui a porté sur les
lésions à 6 SAI, a montré une différence
significative entre les isolats. La suspension de mycélium est
généralement de loin plus virulente que la suspension de spores
(Tableau 8). On peut classer par ordre de virulence BISFLOR1 (3,9), DRGFLOR1
(3,8), EXRBEN1 (3,8), COCBEN46 (3,6), COCBEN8 (3,3), EXRBEN2 (3,0), BISBEN2
(2,5) et EXLBEN2 (2,3). Il faut noter cependant que l'ordre des virulences peut
changer qu'il s'agisse de suspension de spore ou de suspension de
mycélium (Tableau 8). En effet, les 5 isolats les plus virulents
après inoculation de suspension de mycélium ne sont pas les
meilleurs lorsque la suspension de spore est utilisée. Par exemple, le
Tableau 8 montre que BISFLOR1 est le plus virulent pour la suspension de
mycélium (3,9) alors qu'il ne se retrouve même pas parmi les 5
meilleurs isolats (2,2) pour la suspension de spore (Tableau 8). De même
EXRFLOR1 qui est en 4ème position pour la suspension de spore
(2,7) a occupé la dernière place pour la suspension de
mycélium (0,6). La performance de COCBEN46 est relativement stable en ce
sens qu'il se retrouve dans les 5 meilleurs isolats pour les deux types
d'inoculum, mais aussi il a provoqué des lésions
d'étendues similaires pour les deux types d'inoculum soit,
respectivement 3,6 et 3,3 moyenne de classe pour la suspension
mycélienne et la suspension de spores (Tableau 8).
Tableau 8 : Moyennes des étendues des
lésions 6 semaines après pulvérisation in vivo,
de suspension de mycélium à 5% p/v et de spore suspension
à 106 de spore/ml
ISOLATS
BISLFLOR1
DRGLFLOR1
EXRBEN1
COCBEN46
COCBEN8
EXRBEN2

BISBEN2
EXLBEN2 EXLFLOR1 EXLBEN1 BISBEN1 COCBEN11 EXRBEN3
DRGBEN1 COCBEN41 EXRFLOR1 TEMOIN
|
Suspension de mycélium
|
Suspension de spore
|
|
3,9 #177; 1.4a
3,8 #177; 1,5a
3,8 #177;
1,5a
|
2,2 #177; 0,8ab 2,1 #177; 0,8ab .
|
|
3,6 #177; 0,5ab
|
3,3
|
#177; 0,9a
|
|
3,3 #177; 1,0abc
|
2,4 #177; 0,5ab
|
|
3,0 #177; 1 ,5abcd
|
.
|
|
2,5 #177; 1 ,3bcd
|
.
|
|
2,3 #177; 1,1bcd
|
2,4 #177; 1,1ab
|
|
2,3 #177; 1,1bcd
|
3,5
|
#177; 1,8a
|
|
2,3 #177; 0,8bcd
|
1,7
|
#177; 1,0b
|
|
2,2 #177; 1,2bcd
|
.
|
|
|
2,2 #177; 1,0bcd
|
1,5
|
#177; 0,9b
|
|
2,1 #177; 1,1cd
|
2,9 #177; 1,1ab
|
|
1,8
|
#177; 0,6d
|
1,8
|
#177; 1,1b
|
|
1,8
|
#177; 0,5d
|
.
|
|
|
0,6
|
#177; 0,9e
|
2,7 #177; 1,6ab
|
|
0,0
|
#177; 0,0e
|
0,0
|
#177; 0,0c
|
*Moyennes de 4 répétitions avec les
écarts types
*Les moyennes suivies d'une même lettre ne sont pas
significativement différentes au seuil de 5% avec le test de Student
Newman Keuls(SNK).
Dans le groupe des B. sacchari, l'isolat le plus
virulent est BISFLOR1 avec 3,9 comme classe contre 2,2 pour BISBEN1 qui est
l'isolat indigène qui le suit immédiatement.
Dans le groupe des C. caudatum, COBEN46 (3,6) et
COCBEN8 (3,3) sont les plus virulents. Il faut ajouter que la performance de
COCBEN46 est restée stable quel que soit le type d'inoculum
utilisé soit 3,3 pour la suspension de spore mais il a fait un score
très bas par rapport à COCBEN8 lorsque le test est
déroulé in vitro.
Dans le groupe des D. sacchari l'isolat exogène
DRGFLOR1 (3,3) est deux fois plus virulent que l'isolat indigène DRGBEN1
(1,8).
Pour le groupe des E. longirostratum, tous les
isolats ont la même performance (2,3) lorsque la suspension de
mycélium est inoculée mais l'isolat exogène EXLFLOR1 s'est
le mieux comporté (3,5) en cas d'utilisation de suspension de spore.
Pour les E. rostratum l'isolat indigène
EXRBEN1 (3,8) s'est le mieux comporté en cas d'utilisation de suspension
de mycélium et maintient un score relativement bon (2,1) lorsqu'on
utilise la suspension de spore.
- Influence des infections sur la croissance et le
développement de I. cylindrica
La croissance est l'ensemble des augmentations en dimensions
et en masse (hauteur poids secs) alors que le développement est
lié au changement d'état de la plante (production de feuilles, de
fleurs et de repousse).
Durant les deux tests in vivo aucune production de
fleurs n'a été observée par contre les productions de
rejets et de nouvelles feuilles ont été remarquables sans la
moindre contamination croisée.
Les différents traitements n'ont pas eu d'effets
significatifs sur la production de rejet quel que soit le type d'inoculum
utilisé. Par contre, pour la production de nouvelles feuilles, quelques
différences sont remarquables lorsque la suspension de mycélium
est utilisée. La production de nouvelles feuilles est nettement
réduite lorsque l'isolat COCBEN46 est inoculé avec la suspension
de mycélium, soit en moyenne de 0,7 feuille contre une production de 2,0
feuilles pour le témoin (Tableau 9).
Pour ce qui concerne les poids secs, les différents
isolats n'ont pas eu d'effets significatifs sur les poids secs ni sur ceux des
rejets.
Tableau 9: Comparaison de la production de nouvelle
feuilles 6 semaines après Pulvérisation in vivo, de
suspension de mycélium et de spore
|
ISOLATS
|
Suspension de mycélium
|
Suspension de spore
|
|
COCBEN11
|
3,3 #177; 1,5a
|
0,5 #177; 0,6a
|
|
EXRBEN3
|
2,2 #177; 0,5ab
|
0,5 #177; 0,6a
|
|
EXLBEN1
|
2,0 #177; 1,4ab
|
0,2 #177; 0,5a
|
|
BISBEN1
|
2,0 #177; 0,8ab
|
.
|
|
BISBEN2
|
2,0 #177; 0,8ab
|
.
|
|
EXLBEN2
|
2,0 #177; 0,0ab
|
0,7 #177; 0,5a
|
|
EXRBEN2
|
2,0 #177; 0,0ab
|
.
|
|
EXRFLOR1
|
2,0 #177; 0,0ab
|
1,0 #177; 0,8a
|
|
TEMOIN
|
2,0 #177; 0,0ab
|
0,5a #177; 0,0
|
|
COCBEN41
|
2 #177; 0,8ab
|
.
|
|
BISLFLOR1
|
1,7 #177; 0,9ab
|
0,7 #177; 0,5a
|
|
DRGLFLOR1
|
1,7 #177; 0,9ab
|
0,7 #177; 0,5a
|
|
COCBEN8
|
1,7 #177; 0,5ab
|
1,2 #177; 0,5a
|
|
EXRBEN1
|
1,7 #177; 0,5ab
|
.
|
|
EXLFLOR1
|
1,5#177; 0,6ab
|
0,7a #177; 0,5a
|
|
DRGBEN1
|
1 ,0b#177; 0,0b
|
1,0 #177; 0,8a
|
|
COCBEN46
|
0,7 #177; 0,5b
|
1,2 #177; 1 ,0a
|
Moyennes de 4 répétitions avec les
écarts types
*Les moyennes suivies d'une même lettre ne sont pas
significativement différentes au seuil de 5% avec le test de Studen
Newman Keuls(SNK)
a
CHAPITRE 4 : DISCUSSIONS
4.1 Discussion
4.1.1 Prospection pour la collecte des isolats, leur
isolement et test de pathogénicité
Globalement, tous
les pathogènes étaient présents dans les zones humides
(ZH)
contrairement aux autres zones. Ceci suppose que les conditions
météorologiques (en
particulier l'humidité, la
température et la durée de la rosée peuvent
influencer
sensiblement le développement et la présence
d'agents de lutte biologique sur I.
cylindrica. En effet, la ZH est
plus humide et plus arrosée (1300 mm contre
respectivement 1200 mm et
1000 mm de pluie annuelle pour la ZSH et la ZSA). Aussi
l'humidité
relative annuelle dans cette zone est plus élevée à savoir
75% contre
respectivement 60% et 50% pour la ZSH et la ZSA. Les travaux de
Kudsk et al, 1988
avaient déjà démontré
l'effet favorisant des fortes humidités et durée de la
rosée sur la
production des feuilles et le nombre de stomates. En
effet le principe actif d'un
mycoherbicide étant la propagule d'un
champignon, plus le nombre de stomate est grand,
plus la
pénétration des propagules dans le tissu végétal
serait plus facile. Ceci a d'ailleurs
été
démontré par Zhang et Watson (1997) qui ont signalé qu'une
période de rosée
adéquate a contribué à
augmenter la capacité de Exserohilum monoceras à
réduire à
100% les jeunes plants de Echinochloa spp.
Il faut cependant remarquer dans la ZSH un
effet contraire des saisons.
Alors qu'en régions humide et semi-aride, la majeure partie
des
pathogènes était collectée en saison pluvieuse, c'est en
saison sèche qu'elle l'a été en
région semi
humide. Ceci pourrait s'expliquer par son caractère de zone de
transition qui
la classe à cheval sur les deux autres zones. Ceci
pourrait aussi s'expliquer par les fortes
différences de
températures entre le jour et la nuit dans cette zone. En effet il
existe une
corrélation entre la température et la
quantité de rosée. Les fortes différences
de
température entre les jours et les nuits favorisent une forte
condensation de rosée qui
pourrait favoriser les taux d'infection. De
plus les températures trop fortes peuvent
détruire les
propagules contenues dans l'inoculum alors que les températures trop
basses
peuvent empêcher le début de l'infection et son
évolution. De même il faut remarquer
que le nombre de
pathogènes collectés dans la ZSA et la ZSH (respectivement 2 et
10)
sont relativement faibles pour qu'on puisse parler de majorité de
pathogènes retrouvés
dans l'une ou l'autre saison dans ces
zones.
Plus d'une douzaine d'espèces de champignons est
documentée par Evans (1987) comme agents probables de lutte contre
I. cylindrica. Aucune D'elles ne figure parmi les espèces
identifiées comme agents potentiels de luttes contre I.
cylindrica dans le cadre de cette étude. Mais, C. caudatum
isolé sur I. cylindrica en Malésie en 1996, était
cité par Caunter (1996) comme ayant un potentiel bioherbicide. Quant aux
genres Glomerella il n'a jamais été signalé sur
I. cylindrica. D'ailleurs Mike et Helen (1996) ont reconnu que ces
pathogènes infectent rarement les feuilles ou que, quand ils sont
présents sur feuille, les lésions sont très diffuses. Ceci
est conforme avec les résultats de notre étude où
malgré leur forte capacité de production de spores, les isolats
de Glomerella n'ont pas pu significativement infecter le tissu
foliaire.
Bipolaris, Exserohilum et Drechslera sont
regroupés au sein du même groupe, celui des
Helminthosporium, et causent des lésions similaires (Alcon,
1988). Ceci est confirmé par nos observations selon lesquelles, il
n'était pas possible de reconnaître B. sacchari, D.
gigantea, E. longirostratum ou E. rostratum en se basant
uniquement sur l'observation des lésions. En se basant uniquement sur
les observations visuelles au champ, les lésions dues à B.
sacchari, D. gigantea, E. longirostratum ou E.
rostratum sont les moins fréquents mais quand ils sont
présents ils apparaissent comme les lésions les plus capables de
contrôler l'herbe. D'ailleurs ces champignons ont été
utilisés avec succès aux Etats-Unis. Yandoc et al., 1999 ont
utilisé Drechslera gigantea et Bipolaris sacchari en
formulation sur plusieurs adventices de la famille des Poacae dont
I. cylindrica. Mais ces isolats sont localisés uniquement dans le
ZH et ne sont pas fréquent.
Le fait que C. caudatum est présent dans
toutes zones agroécologiques et donc peut s'adapter à toutes les
régions du Bénin, le classe comme le meilleur candidat pour
contrôler I. cylindrica, lorsqu'il est convenablement
formulé pour augmenter son potentiel d'infection au dessus du seuil
d'infection naturelle. Ceci rime avec les opinions de Caunter, 1996 qui
qualifie ce champignon de spécifique à I. cylindrica.
Certes les isolats de G. cingulata et de Glomerella spp. sont
présents dans deux zones agroécologiques et viennent en nombre en
deuxième position par rapport aux isolats de C. caudatum. Mais
ce paramètre seul ne saurait les classer comme bon potentiel de lutte
biologique. En effet, l'observation au champ des lésions dues à
ces deux types de
champignon montre que ces lésions sont bénignes
(toujours présente sur des plants adultes et vigoureux retrouvés
dans les jachères).
4.1.2 Caractéristiques physiques des
isolats
Contrairement aux isolats de C. caudatum, E.
longirostratum et de E. rostratum, qui ont présenté
la même allure de croissance quelle que soit leur origine, pour B.
sacchari et D. gigantea, les isolats qui sont exogènes ont
eu une croissance lente par rapport à ceux qui sont indigènes.
Les dimensions des conidies de C. caudatum isolés ((30-35) x
(3.75-5) um) sont proches mais plus diversifiées que celles
décrites par Caunter (1996) sur des plants de I. cylindrica
soit ((20,5-38,5) x (2,8-4,2))um. Ceci laisse penser que C. caudatum
présente des caractéristiques similaires quelle que soit son
origine, contrairement à B. sacchari, D. gigantea, E. rostratum et
E. longirostratum. En effet pour ces espèces, les isolats
exogènes sont pour la plupart, différents du point de vue de leur
caractéristiques, des isolats indigènes, qui sont tous
identiques, surtout lorsqu'on considère les formes et dimensions des
spores. Ceci laisse penser que les conditions environnementales peuvent donc
être l'objet de caractères spécifiques chez les isolats et
donc certains isolats peuvent mieux convenir à certaines
régions.
4.1.3 Etude comparée de la virulence des isolats
L'analyse des résultats montre qu'il n'existe pas de
corrélation entre la taille des lésions obtenues à partir
du test in vitro et du test in vivo. Ceci suppose qu'on ne
pourra pas se baser sur les résultats du test in vitro pour
prédire la classification des isolats selon leur virulence. En effet,
les tests in vitro ont été faits avec des pièces
de tissus végétaux qui n'assurent plus leurs fonctions
physiologiques. Ils sont faits en conditions de laboratoire où
l'humidité et la température sont stables (70% et 25
0C) alors que le matériel végétal (pièce
de feuille) contrairement à la plante, n'assure plus ses fonctions de
photosynthèse donc pas de réaction de défense. Ainsi, les
lésions se sont développées plus rapidement sur le tissu
que sur la plante entière et les isolats n'ont pas montré les
mêmes performances lorsqu'ils sont inoculés à des plantes
entières. Le pathogène se développerait alors très
rapidement pendant que `'l'hôte» est inerte. De plus les morceaux de
feuilles portent déjà des blessures à leurs
extrémités qui pourraient faciliter la pénétration
des propagules et par conséquent favoriser l'infection. Ceci est
conforme
avec les remarques de Madar et Kimchi (1998) lorsqu'ils ont
inoculé les plants de Juniperus oxycedrus L., avec
Phomopsis occulta (Sacc.). En effet, lorsque ces auteurs faisaient des
entailles sur les tiges avant l'inoculation, ceux-ci développaient des
chancres alors qu'aucun symptôme ne se développait quand il n'y
avait pas d'entailles. Toutefois, la réalisation des tests in
vitro apparait comme un chemin raccourci à la sélection des
isolats pathogènes après les prospections et permettra donc la
gestion d'un nombre réduit de pathogènes pour les tests in
vivo. Contrairement à notre attente de départ, l'utilisation
de suspension de spore comme inoculum n'a pas toujours été plus
efficiente que celle des suspensions de mycélium. Pour la plupart des
isolats choisis, la suspension de mycélium a été plus
agressive. Ceci peut s'expliquer par le fait que le mycélium est la
propagule qui pousse le plus vite possible. En effet, cette propagule exige
moins d'humidité pour coloniser le tissu végétal mais elle
ne tolère pas les conditions de sécheresse. Or nos
expérimentations ayant été faites en cage où la
température journalière moyenne ne dépassait jamais
28oC, ceci favoriserait une meilleure infection à partir du
mycélium, contrairement aux spores qui sont des structures de
résistance et qui ont besoin davantage d'humidité pour le
début de l'infection, d'où une germination plus lente. Par
contre, dans des conditions semblables, Madar et Kimchi (1998) ont
montré que l'inoculation des plants de J. oxycedrus avec les
spores de P. occulta ont développé plus de
symptômes que l'inoculation avec le mycélium. En milieu
réel, dans les conditions correspondantes à celles des pays
tropicaux où I. cylindrica est un problème, une
meilleure option est d'utiliser les spores à cause de leur
résistance mais en contournant leur faiblesse par le
développement des formulations qui pourront augmenter leur vitesse
d'infection en créant une humidité artificielle et
circonstancielle par l'apport d'adjuvants et d'émulsifiants comme la
gélatine, l'huile, le sucre, le tween etc.
La croissance de la plante est le plus souvent plus importante
que le développement des pathogènes et il en découle une
incidence faible. Ceci peut s'expliquer d'une part par la forte capacité
de repousse de I. cylindrica qui est en mesure de produire en moyenne
une feuille par semaine (Atchade, 2004). D'autre part, aucune contamination
croisée n'était possible à cause des conditions
expérimentales. En effet, l'essai était installé dans des
cages et l'arrosage se faisant directement dans les pots et non sur les
plantes. Cette pratique n'a pas permis de bénéficier des agents
extérieurs que sont les insectes, le vent et
la pluie qui pourraient faciliter le transport des propagules
(spores ou fragments de mycélium) vers les nouvelles feuilles et les
repousses. Remarquons aussi que la plus forte étendue de lésion
est au dessous de la classe 4 correspondant à 12%-25% de feuille
brûlée (Annexe 4), qui est de loin inférieur à la
classe 10 qui correspond à la destruction totale de la plante. Ceci est
conforme aux résultats de Caunter (1996) avec C. caudatum qui a
démontré que les lésions n'ont jamais pu tuer la plante
entière.
Nous n'avons pas pu faire des études de
spécificité des isolats les plus virulents malgré la
grande importance de cette étape dans le processus de la lutte
biologique (Pearson et Callaway, 2003). Mais une brève bibliographie a
permis de déduire qu'une attention particulière doit être
accordée aux deux isolats de C. caudatum COCBEN8 et COCBEN46.
En effet plusieurs espèces du groupe des Helminthosporium dont
B. sacchari, D. gigantea, E. longirostatum et E.
rostratum, n'attaquent pas I. cylindrica seul en ce sens que
Chandramohan et al, 2001 ont utilisé un mélange de ces 3
espèces de champignons contre 7 différentes espèces
d'herbes (ce qui est idéal pour les champs abandonnées). De plus,
certaines espèces de ce groupe peuvent produire des mycotoxines qui
peuvent affecter le foie (Leonard et Suggo, 1974), ou peuvent
causer l'allergie. Par contre, C. caudatum dont
l'isolat COCBEN46 est relativement virulent par la suspension mycélienne
que par la suspension de spore est spécifique à I.
cylindrica (Caunter et Wong, 1988) et pourra faire l'objet d'attention
particulière dans le futur. La tendance générale
étant de penser que la mise au point des mycohebicide couterait trop
cher pour les pays africains, il est impérieux de faire des
études sur la production en masse des spores de C. caudatum
à partir des sous produits agricoles et de chercher des formulations et
des méthodes d'applications simples pour augmenter le taux d'infection.
Nous proposons par exemple la récupération des spores dans du
kaolin ou dans de la pâte sèches (pour faciliter leur conservation
et servir de véhicule) et leur formulation avec un faible pourcentage de
gomme arabique (10% p/v) ou de gélatine (pour augmenter
l'humidité et capter les gouttelettes de la rosée).
CONCLUSIONS ET SUGGESTIONS
Conclusions et recommandations
Cette étude destinée à priori à
identifier une souche de pathogène indigène, capable de
contrôler Imperata cylindrica, nous a permis d'accéder
à beaucoup d'informations utiles dans la recherche d'une
stratégie de lutte durable contre cette adventice.
Les prospections que nous avons effectuées ont permis
de démontrer que la majorité des pathogènes de I.
cylindrica (surtout les champignons) signalés ailleurs dans le
monde existent aussi au Bénin et pourront constituer un stock de
pathogènes indigènes. C. caudatum
précédemment signalé par les journaux scientifiques comme
ayant un potentiel de lutte biologique contre I. cylindrica, est pour
la première fois identifié au Bénin (en Afrique). De plus
certains de ces isolats indigènes se sont montrés plus virulents
que leurs homologues exogènes. Le nombre et la distribution des isolats
de ces champignons pathogènes varient selon les zones
agroécologiques et les saisons de collections.
Les 7 espèces de champignons isolés
diffèrent selon leurs caractères (aspect des mycéliums,
aspect des spores et croissances) et leur virulence, de même que les
isolats de la même espèce diffèrent selon leur origine. Ils
produisent différemment leurs spores en fonction des substrats
utilisés pour les multiplier. Dans nos conditions expérimentales,
l'utilisation de mycélium comme inoculum donne une meilleure
sévérité que l'utilisation de suspension de spore comme
inoculum mais la meilleur option en milieu tropical reste la formulation avec
les spores. Aussi une simple vérification de la virulence in
vitro ne donne pas exactement les renseignements sur la virulence
réelle des isolats (in vivo). Toutefois les tests in
vitro permettent de sélectionner rapidement les isolats.
Parmi tous les isolats, C. caudatum est le plus
largement distribué et est collecté dans les trois zones
agroécologiques, il est relativement virulent et est spécifique.
L'espoir d'utilisation de ces isolats comme mycoherbicide sera renforcé
par la recherche de différentes formulations pour augmenter le taux
d'infection obtenu dans cette étude. A la lumière de ces
constats, nous formulons les recommandations suivantes:
· Tester BISFLOR1 DRGFLOR1 EXLBEN1 (3 meilleurs isolats)
dans les régions où I. cylindrica est une contrainte et
où ces espèces sont absentes;
· Produire en masse les spores de COCBEN8 et COCBEN46 en
testant des substrats locaux;
· Faire des études de formulations de ces isolats
pour amener les degrés d'infections des isolats au-delà des
performances obtenues dans cette étude;
· Faire une étude de la capacité
d'infection des isolats COCBEN8 et COCBRN46, en plein champs durant une
période plus longue incluant la saison sèche et la saison
pluvieuse pour en maîtriser l'épidémiologie;
· Faire une étude du mode d'infection des isolats
afin de maîtriser l'épidémiologie.
REFERENCES BIBLIOGRAPHIQUES
Références bibliographiques
Ahanchédé, A., 1988. Le
problème des adventices sur le plateau Adja. Rapport Scientifique
d'Etude. 33p
Alcon, J. L., (SD) The taxonomy of
`'Helminthosporiose» species. Annual Review of Phytopathology 26, 37-55
Ali-Bidjowé, I., 2006. Etude
d'efficacité des champignons pathogènes des rhizomes dans une
perceptive de lutte biologique contre Imperata cylindrica (Poacea)
(L.) Raeuschel au Bénin. Mémoire pour l'obtention du
diplôme d'Ingénieur agronome. ESA,Université de
Lomé-Togo., 82p.
Ajuona, O., Schade, V., Veltman, B., Sedjro, K. &
Neuenschwander P., 2003. Impact of the exotic weevils
Neochetina spp: (Coleoptera: Curculionidae on water hyacinth,
Eichhornia crassipes (Lil: Pontederiaceae) in Benin, West Africa.
African Entomology 11, 153-161
Atchade N. S. 2004. Effet de l'eau et de
l'engrais sur la croissance et le développement des mauvaises herbes:
cas de Imperata cylindrica (L.). Mémoire pour l'obtention du
diplôme d'Ingénieur des travaux. EPAC, Université d'Abomey
Calavi., 90p.
Auld B. A., Medd R. W., 1987. Weeds. An
illustrated botanical guide to the weeds of Australia. Intata Press. Melbourne.
Sydney., 255p.
Avocanh A., 2005. Introduction à la
lutte biologique contre le chiendent : In Recherches Agriculture.
AgriCulture.Bimensuel Beninois d'Analyse Economiques et Socioculturelles pour
le Monde Rural. N0 067, 10-11.
Ayeni A. O. et Duke W.B., 1985. The influence
of rhizomes features on subsequent regenerative capacity in Speargrass
(Imperata Cylindrica (L.) Beauv.) Agriculture Ecosystem and Environment. 13,
309-3 17.
Ayeni S., 2004. Contribution à la
lutte contre Imperata cylindrica au Bénin: Distribution
Géographique, perceptions paysannes et approches de gestion.
Mémoire pour l'obtention du diplôme d'Ingénieur des
travaux. EPAC, Université d'Abomey Calavi., 78p.
Ayeni S. Avocanh A. et Beed F., 2004.
Perception of farmers in Benin, West Africa, toward Imperata
cylindrica. Proceeding of 4th International Weed Science
Congress 20-24 th june. Durban. South Africa., 45p.
Barnett H. L. et Hunter B. B., 1979. Illustrated
Genera Of Imperfect Fungi. 4, 218p
Bateman R., 2002. Tank tests for Water Hyacinth
mycoherbicide. Standard Operating Protocol. V. 2.1
Baxter A. P. et Van Der Linde E., 1997.
Collecting and Preserving Fungi. A Manuel for a Pratical Course in
Mycology held in Pretoria, October 1997.
Beed F. Charudattan R. et Den Breeyen A.,
2004. Biological Control of Imperata Cylindrica. Proceeding
of 4th International Weed Science Congress 20-24 th June. Durban.
South Africa. 33.
Booth, C., Prior, C., 1984. A new
Giberella species on Imperata (Graminae). Transactions of the
British Mycological Society 82, 180-182.
Brook R. M., 1989. Review of literature on
Imperata cylindrica (L.) Raeuschel with particular reference to South
East Asia. Tropical Pest Management. 35(1),12-25.
Bryson C. T. et Carter R.,
1993. Congograss, Imperata cylindrica, in United
States. Weed Technology. 7, 1005-1009.
Butt T. M. Jackson C.W. et Magan N., 2001. Fungi
as Biocontrol Agents. Progress,Problems and Potential. CABI Publishing.,
390p.
CAB International., 2001a. Crop protection
compendium. 2001 Edition. OXON, U. K. CD format.
CAB International., 2001b. International Course on the
Identification of Fungi of
Agricultural and Environmental Significance.
16-july-24 August 2001
Caunter I. G. et Wong S. H., 1988. Foliar
disease of lalang in Penang. Biocontrol potential. MAPPS Newsletter. 2, 6p.
Caunter I.G., 1996. Colletotrichum
caudatum, a potential bioherbicide for control of Imperata
cylindrica. Proceeding of the IX International Symposium on Biological
control. Stellenbosch. South Africa.,19-26.
Chandramohan S. and Charudattan R., 2001.
Control of seven grasses with a mixture of three fungal pathogens with
Restricted Host Ranges. Biological Control 22, 246-255.
Chandramohan, S., Charudattan, R., Sonoda, R.M.,
Singh, M., 2002. Field evaluation of a fungal pathogen mixture for the
control of seven weedy grasses. Weed Science 50, 204-213.
Chandrasrikul, A., 1962. A preliminary host
list of plant diseases in Thailand. Technical Bulletin 6. Department of
Agriculture, Bangkok, 23p.
Charudattan R.,1996. Biological Control of
Noxious Weed Species Using Plant Pathogens. Environmental Management Workshop.
Orlando,Florida. October 8- 10, 1996
Charudattan R. 1997. Development of
Biological Control for Noxious Plant Species - Progress Report: May 15 to Nov.
14, 1997. University of Florida, Gainesville.
Chase, M.W., Soltis, D.E., Olmstead, R.G., Morgan, D.,
Les, D.H., Mishler, B.D., Duvall, M.R., Price, R.A., Hills, H.G., Qiu, Y.L.,
Kron, K.A., Rettig, J.H., Conti, E., Palmer, J.D., Manhart, J.R., Sytsma, K.J.,
Michaels, H.J., Kress, W.J., Karol, K.G., Clark, W.D., Hedren, M., Gaut, B.S.,
Jansen, R.K., Kim, K.J., Wimpee, C.F., Smith, J.F., Furnier, G.R., Strauss,
S.H., Xiang, Q.Y., Plunkett, G.M., Soltis, P.S., Swensen, S.M., Williams, S.E.,
Gadek, P.A., Quinn, C.J., Eguiarte, L.E., Golenberg, E., Learn, G.H., Graham,
S.W., Barrett, S.C.H., Dayanandan, S., Albert, V.A., 1993.
Phylogenetics of seed plants: an analysis of nucleotide sequences from the
plastid gene rbcL. Annals of the Missouri Botanical Garden 80,
528-580.
Chikoye D Ekeleme F and Ambe JT (1999). Survey
of distribution and farmers perceptions of speargrass (Imperata
cylindrica [L.] Raeuschel) in cassava based
systems in West Africa. International Journal of Pest
Management 44,1-7.
Chikoye D., Manyong V. M., Ekeleme F., 2000.
Characteristics of speargrass (Imperata cylindrica) dominated fields
in West Africa: Crops, soil properties, farmer perceptions and management
strategies. Crop Protection 19, 48 1-487.
Chikoye D Ekeleme F and Udensi E., 2001.
Cogongrass suppression by intercropping cover crops in corn/cassava systems.
Weed Science 49, 658-667.
Chikoye D., Manyong V. M., Carsky R. J., Ekeleme F.,
Gbehounou G., Ahanchede A., 2002. Response of speargrass (Imperata
cylindrica) to cover crops integrated with handweeding and chemical
control in maize and cassava. Crop Protection. 21(2), 145-156.
Chikoye D., 2003. Characteristics and
management of Imperata cylindrica (L.) Raeuschel in smallholder farms
in developing countries. In Weed management for developing countries. FAO.,
81-88.
Ciotola M., Ditommaso A., et Watson A., 1999.
Chlamydospore Production, Inoculation Methods and Pathogenicity of Fusarium
oxysporum M12-4a, A Biocontrol for Striga hermonthica. Biocontrol Sciences
and Technologies. 10, 129-145.
Clive J., 1971. A manual of assessment keys
for plant diseases. Canada Departemant of Agriculture Publication N0. 1458
1971, 8p.
Coile N. C. and Shilling D.G., 1993.
Congograss, Imperata cylindrica(L.) Beauv; a good grass gone
bad! Botany Circular 28. Department of Agriculture and Consumer Services.
Gainesville, Florida, USA. 3p
Elzein A. et Kroschel J., 2004. Fusarium
oxysporum Foxy 2 shows potential to control both Striga hermonthica and
F. asiatica. European Weed research Society 44, 433-438.
Evans H. C. Greaves M. P. and Watson A. K.,
2001. Fungal Biocontrol Agents of Weeds. In: T.M. Butt, C. Jakson and
N. Magan. Fungi as Biocontrol Agents . CAB International, 169- 192.
Fournet J., Hammerton J. L., 1991. Mauvaises
herbes des petites Antilles. INERA, Edition Cardi. Paris., 214p.
Galiba M., Vissoh P., Dagbénonbakin G. et
Fagbohoun F., 1998. Réaction et craintes des paysans
liées à l'utilisation du pois mascate (Mucuna pruriens
var. utilis). In Cover Crop in West Africa to Sustainable
Agriculture. Sasakawa Global 2000. 55-65.
Harigan W. E., 1998. Laboratory Methods in
Food Microbiology. Academic Press. 3, 532p
Harley K.L.S. et Forno I. W., 1992.
Biological Control of Weeds. CSIRO Division of Entomology, Brisbane, Australia.
Inkata Press., 73p.
Hasan S, 1983 Plant pathogen
and Biological Control of weeds. In Commonwealth Mycological Institute,1983.
Plant Pathologist Pocketbook. 2, 269-274.
Holm, L.G.; Plucknett, D.L.; Pancho, J.V.; Herberger,
J.P., 1977. Imperata cylindrica (L.) Beauv. In the world
`s worst weeds, University Press of Hawaii, Honolulu, 62-71.
Hountondji, F. C. C., Yaninek, J. S., De Moraes, G.J
Odour, G.I. (2002) Host specificity of the cassava green mite pathogen
Nezygites floridana. BioControl. 47, 61-66
Hubbard, C.E.; Whyte, R.O.; Brown, D.; Gray, A.P,
1944 Imperata cylindrica. Taxonomy, distribution, economic
significance and control. Imperial Agricultural Bureaux Joint
Publication. 7, 63p.
Ivens, G.W., 1980. Imperata
cylindrica (L.) Beauv. In West African agriculture.
Proceedings of a
BIOTROP Workshop on alang-alang, Bogor., 149-156.
James A. T., Costas Z. & Harura B., 2002.
Biological Control AND Management Of Alien Invasive Shrub Chomolaena odorata in
Africa. In In Biological contro in IPM system in Africa . CABI
publishing-CTA-SDS., 145-160.
Ker A., 1992. Farming systems of African
savanna: A continent in crisis. International Development Research Centre
(IDRC), Ottawa, Canada, 167.
Kroschel J., Hundt A., Abbasher A. A.and Sauerborn
J.,1996. Pathogenicity of fungi collected in northern Ghana
to Striga hermonthica. European Weed research Society Weed Research.
36, 515-520.
Kudsk P. and Kristensen J. L., 1992. Effect
of environmental factors on herbicide performance. Proceeding of the First
International Weed Control Congress, Melbourn. 173-185.
Leonar et Suggo, 1974. Exserohilum sp.
http://coproweb.free.fr/mycoweb/texte/109.htm
accédé le 22 septembre 2007
MacDonald G. E., 2004. Congograss
(Imperata cylindrica) -Biology, Ecology, and Management. Critical
reviews in Plants Sciences.367-380.
Madar Z., Kimchi M., 1998. Branch diebackof
Brown-Berried Juniper in Israel Caused by Phomopsis occulta.
Phytoparasitica 26 (2), 1-2.
Manyong, V.M., Smith, J., Weber, G. K., Jagtap S.S.,
Oyewole, B., 1999. Macrocharacterisation of agricultural systems in
west Africa: An overview. Resource and Crop Management Monograph 21, 33-40.
Menz K., Ellis K., Conroy C. and Grist P.,
1998. Fire as an economic desencitive to smallholder rebber planting
in Impertata areas of Indonesia. Environnemental Modelling and Software. 14
(1), 27-35.
Mike Mannin A. and Helen Perrey R., 1996.
Glomerella (Glomerellacingulata) in apples and pears. An Introduction
to the disease (www.Hortnet. Co.nz/publications/hprfacts accédé
le 22 juin 2007.
Nakasone K. K., Peterson S. W.and Jong S.,
2004. Presevation and Distribution of Fungal Cultures. In Biodiversity
of Fungi. Inventory and Monitoring Methods. Elsier Academic Press. 37-47
Neuenschwander P., 2002. Biological control
of Cassana and Mango Mealibug in Africa. In Biological control in IPM system in
Africa . CABI publishing-CTASDS., 45-59.
Pearson D. E. et Callaway r. M., 2003.
Indirect effects of host-specific biological control agents. Trend in
Ecology end Evolution 2, 456-461.
Persley, G.J., 1973. Naturally occurring
alternative hosts of Xanthomonas albilineans in Queensland. Plant
Disease Reporter 57, 1040-1042.
Ravenell. D. I.,1985. Evaluation of Bipolaris
setariae as a potential biocontrol agent for Abarachiaria platyphylla:
efficacy and host range studies. M. S. thesis, North California State
University, Raleigh 19p.
Sankaran, K.V., Sutton, B.C., 1991.
Myrellina imperatae sp. Nov. on Imperata from Papua New
Guinea and Australia. Mycological Research 95, 102 1-1022.
Santiago A., 1980. Gene ecological aspects of
the Imperata weed and practical implications. Biotrop. Spec. Publ. 5, 23-34.
Smith I. M., Dunez J., Philips D. H., Lelliott R. A.,
et Archer S. A., 1988. Europea handbook of Plant diseases. Blackwell
Scientific Publications : Oxford., 583p.
Soerjani, M., 1970. Alang-alang Imperata
cylindrica (L.) Beauv. Pattern of growth as related to its problem of
control. BIOTROP Bulletin, 1, 88-96.
Terry P. J., Adjers G., Akobundu I. O., Anoka A. U.,
Drilling M. E., Tjtrosemito S. and Utomo M., 1997. Herbicide and
mechanical control of Imperata cylindrica as first step in gras sland
rehabilitation. Agroforestry Systems 36, 151-179.
Valverde B. E., 2005. Progrès sur la
gestion de Rottboellia cochinchinensis. In Gestion des mauvaises herbes pour
les pays en développement. Etude FAO Production Végétale
et Production des plantes. Rome., 7 1-84.
Van Loan A. N., Meeker J. R., Minno M. C.,
2002. Congo Grass. In Biological Control of Invasive Plants in the
Eastern United States, USDA Forest Service. Publication FHTET-2002-04. 41,
3p.
Versteeg M. N., Amadji F., Etèka A., Houndekon
V., et Manyong V. M.1998. Collaboration to increase the use of Mucuna
in production in Benin. In Cover Crop in West Africa to Sustainable
Agriculture. Sasakawa Global 2000. 3 3-43.
Vissoh, P. V.; Gbèhounou, G.;
Ahantchédé, A.; Kuyper, T. W. and Roling, N. G. 2004.
Weeds as agricultural constraint to farmers in Bénin: results of a
diagnostic study. NJAS 52-3/4, 308 - 329.
Willard T. R., Shilling, D. G., Gaffney J. F., and
Currey W. L. 1996. Mechanical and chemical control of cogongrass
(Imperata cylindrica). Weed Techno. 10, 722- 726.
Wilcut J. W. Dute R.R., Truelove B., and Davis D. E.,
1988. Factors Limiting the Distribution of Congograss, Imperata
cylindrica, and Torpedograss, Panicum repens. Weed Science.
36, 577-582.
Yanineck et R. Hanna, 2002. Cassava green
mite in Africa-a Unique Example of Successful Classical Biological Control OF
MITE Peste on Continental Scale. In Biological contro in IPM system in Africa .
CABI publishing-CTA-SDS., 61-75.
Yandoc CB, Charudattan R and Shilling DG
(1999). Enhancement of efficacy of Bipolaris Sacchari (E.
Butler) Shoem., a bioherbicide agent of cogongrass [Imperata cylindrica
(L.)Beauv.], with adjuvants. Weed Science Society of America Abstracts.
39p.
Zhang W.M., Watson A. K., 1997. Effect of Dew
Period and Temperature on the ability of Exserohilum monceras to cause
Seedling Mortality of Echinochloa Spicies. The American
Phytopathological socity. Plant Disease. 81, 629-634
ANNEXES
Annexe 1: Préparation du milieu de culture
Eau-Agar
Le milieu Eau-Agar n'est pas riche en éléments
nutritifs et est utilisé pour les isolements.
Pour le préparer on suit la procédure suivante:
- Peser 15 gramme de gélose Agarose (Difco) dans un
erlenmeyer de 1,5 -2 litres; - Ajouter 1 litre d'eau distillée;
- Mettre au bain-marie (100 oC) pour faciliter la
dissolution de la gélose;
- Stériliser à l'autoclave à 121
oC pendant 15mn à une pression de 1,2 bar; - Laisser refroidi
jusqu'à 55 oC pour éviter la condensation de
vapeur;
- Distribuer dans des boîtes de pétri
stériles, de 9 cm de diamètre, à raison de 20 ml
par boîte.
Annexe 2: Préparation du milieu de culture
Potato Dextrose Agar (PDA)
Le PDA est le milieu usuel de culture pour la plupart des
champignons. Il contient de la
pomme de terre, du sucre sous forme de dextrose et de la
gélose (Agar). Il est préparé selon la procédure
suivante:
- Peser 39ramme de poudre de PDA (BDH) dans un erlenmeyer de 1,5
-2 litres; - Ajouter 1 litre d'eau distillée;
- Mettre au bain-marie pour faciliter la dissolution de la
gélose;
- Stériliser à l'autoclave à 121
oC pendant 15mn à une pression de 1,2 bar; - Laisser refroidi
jusqu'à 55 oC pour éviter la condensation de
vapeur;
- Distribuer dans des boîtes de pétri
stériles, de 9 cm de diamètre, à raison de 20 ml
par boîte;
Annexe 3: Méthode de conservation des champignons
sur silicagel, et par la méthode de cryopréservation
La conservation des champignons par la méthode du
silicagel est adaptée pour les
espèces qui produisent facilement de spores. Pour la
faire, on suit la procédure suivante: - Produire le champignon sur un
milieu convenable;
- Récupérer les spores dans 5% de lait
préalablement stérilisé à l'autoclave;
- Remplir à moitié des flacons de 22 ml de
silicagel puis stériliser à deux reprises au four à
180oC;
- Ajouter la suspensions de spore au silicagel de chaque flacon,
au 3/4 de son volume;.
- Laisser à la température ambiante pendant 14
jours;
- Contrôler la pureté et la viabilité des
spores en mettant quelques grains de silicagel sur un milieu de culture
(PDA);
- Fermer les flacons et conserver à -25oC.
Annexe 4: Echelle d'évaluation de
l'étendu des lésions
12 classes correspondent aux pourcentages des lésions sur
feuille
0= 0%, 1= 0-3%, 2 = 3-6%, 3 = 6-12%, 4 = 12-25%, 5 = 25-50%, 6 =
50-75%, 7 = 75-
88%, 8 = 88-94%, 9 =94-97%, 10 = 97-100%, 11= 100%



