|


Ê~È~Ô~Ç
Ê~ØÇÑÞæí~~Ç
ÊíÑÆÇÓ~~Ç
Êí~ìåæ~~Ç
République algérienne démocratique et
populaire
íæá~~Ç Ë~È~Ç
æ í~~~~Ç ä~á~Ê~Ç
É~ÇÒæ
Ministq~re de l'enseignement supérieur et de la
recherche scientifique
Ü áÔ~Ç Ü
íáÚì~ ä~ ÊÈ~ÓÍ
Ê~å~Ì
Université Hassiba Ben Bouali
Chlef
Ê~Ìì~ì~È~Ç
ãìá~~Ç æ
Ê~ÍáÇ~Ç ãìá~~Ç
Ê~áß
Faculté des sciences agronomiques et
des sciences
biologiques
~~Ìì~ì~È~Ç
ÉÑÆÇÏ
Département de
biologie

En vue de l'obtention du diplôme
d'ingénieur d'état en
biologie
Option : Biotechnologie
Thème:
|
Essai de prévision de la valeur
nutritive de la pulpe et les
feuilles d'arganier
|
Présenté par :
Mr: KHELIFA ZOUBIR Mahdi Mr: MEROUANE Abdelaziz
Membres du jury :
Président : Mr ALI BENAMARA. B,
Chargé de cours UHBC Promotrice : Melle. NOURA.
A, Chargé de cours UHBC Examinateurs : Mr.
KOUIDRI.M, Chargé de cours UHBC
Melle. HAMDANI.F/Z
Chargé de cours UHBC
|
|
|
Année universitaire : 2008/2009
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Dédicace
A mes très chers parents qui ont toujours
été là pour moi, et
qui m'ont donné un magnifique modèle de
persévérance.
J'espère qu'ils trouveront dans ce travail toute ma
reconnaissance et tout mon amour.
A mes chers frères et soeurs.
A mes neveux, surtout kheir Eddine.
A ma promotrice.
A mes meilleurs amis (es).
A Toute la promotion biotechnologie générale
2008/2009.
Je dédie ce mémoire.
ABDELAZIZ

REMERCIEMENT
En premier lieu, Nous remercions notre promotrice
Melle NOURA. A pour avoir accepter
de nous encadrer, pour son suivi et ses conseils.
Nos remerciements les plus respectueux vont à
Mr ALIBENAMARA. B, qui a bien voulu nous faire
l'honneur de présider le jury.
Nos remerciements et reconnaissance à
Mr KOUIDRI. M pour l'honneur qu'il nous a fait en
acceptant d'examiner ce travail et nous avoir procuré
l'échantillon de la pulpe d'argan.
A Melle HAMDANI,
Nous sommes très sensibles à l'honneur que vous nous faites en
acceptant de participer à ce jury de Thèse. Soyez assurée,
Mademoiselle, de nos plus profonds respects.
Nous tenons vivement remercier : Mme BOUTIBA.
A, pour son aide dans la réalisation de ce travail.
Nos remerciements gracieux à
Melle BENNOUR. W pour son aide
à la réalisation de ce travail.
Nous souhaitons inclure dans nos remerciements les personnes qui
ont bien voulu nous faire part de leur expérience pratique, notamment
aux ingénieurs des laboratoires: Mr
BELÂALIA. A, Melle DHELÂA. Z,
Melle GADOUCHE. Mme RIATI. S, Mme
OUCHENE. K.
Nous voudrions adresser un remerciement à tous les
enseignants qui ont participé à notre formation,
particulièrement : Mr SAÂDI. A &
Mr EL AMRI. L.
Nos remerciements les plus sincères vont également
à nos amis et collègues notamment : NOUI. A, DAHNANE. A,
MIMOUN. M, BENZAAMIA. F, SABER. A, MELLAH. M, ALOUACHE. E, ZAOUNANE. A,
MEDJAHED. H, BERBERI. A, BENTEYEB. H, et à toutes les
étudiantes de la promotion biotechnologie générale
2008/2009.
Enfin nous tenons à remercier tout les gens et les
personnes qui nous ont aidés tout au long de notre travail.
Liste des tableaux
Tableau I : Evolution du cheptel algérien
(milliers de têtes) 04
Tableau II: Les ressources fourragères en
Algérie 05
Tableau III : Evolution des importations d'orge
et de maïs (milliers de tonnes) 06
Tableau IV : Matériel et appareillage
utilisés durant l'expérimentation 18
Tableau V: La composition chimique (% de MS) des
sous produits étudiés et deux
autres fourrages .23
Tableau VI : Valeur énergétique de
la pulpe 26
Tableau VII : la valeur azotée de la
pulpe ...27
Tableau IIX : Valeur énergétique
des feuilles ...27
Tableau IX : la valeur azotée
prédite des feuilles 28
Tableau X: Résultats de la fermentation
des échantillons [volume de gaz produit
(en ml) pendant des intervalles de temps] ..28
Liste des figures
Figure 01 : les sous produits disponibles en
Algérie (milliers de tonnes). 09
Figure02 : localisation d'arganeraie en
Algérie 13
Figure 03 : schéma d'obtention des
produits et sous produits de l'arganier 14
Figure 04: Dispositif de fermentation ..21
Figure 05: La saturation en CO2 par la levure de
bière 22
Figure 06 : comparaison de la composition
chimique des sous produits étudiés 25
Figure 07: Evolution de la production du gaz
pendant l'incubation de la pulpe et des feuilles de l'arganier
29
Figure 08 : Evolution de la production de gaz des
produits de l'arganier après
correction 30
Liste des abréviations.
A D EME: L'Agence de l'Environnement et de la Maîtrise de
l'Energie. ANPCE: Agence National de Promotion du Commerce Extérieur.
CB: cellulose brûte.
dMO: digestibilité de la matière organique.
MAD: matière azotée digestible.
MADR: Ministère d'Agriculture et de Développement
Rural.
MAT: matière azotée totale. MG: matière
grasse.
MM : matière minérale. MO: matière
organique. MS : matière sèche.
OAIC: Office Algérien Interprofessionnel des
Céréales.
R : coefficient de corrélation. ST: sucres totaux.
UFL: unité fourragère lait. UFV: unité
fourragère viande.

INTRODUCTION .1
0 ARTIE BIBLIOGRAPHIQUE
CHAPITRE I : L'ALIMENTATION
ANIMALE EN ALGERIE
I. Le secteur de l'élevage en Algérie 4
II. Les fourrages en Algérie 5
2.1 Les ressources fourragères .. .5
2.2 Taux de couverture des besoins alimentaires du cheptel 6
III . Importation d'alimentation animale 6
IV. Valorisation des sous produits en Algérie 7
4.1 Les sous produits existant en Algérie 7
4.1.1les sous produits céréaliers 7
4.1.2 Les sous produits de l'olivier 8
4.1.3 Les sous produits de la tomate .8 4.1.4 Les sous
produits du palmier dattier ..8 4.1.5 Les sous produits de la vigne 8
CHAPITRE II : L'ARGANIER
I. Historique 10
II. Botanique .10
2.1 Taxonomie 10
2.2 Caractéristiques .1 0
III. L'importance de l'arganier 1 1
3.1 L'importance économique .11
3.1.1 Production des huiles et ces dérivées ..11
3.1.2 Production du bois 11
3.1.3 Production pastorale 11
3.2 L'importance sociale 11
3.3 L'importance environnementale .12
IV. Répartition 12
V. Les sous produit de l'arganier 13
5.1 La pulpe 13
5.2 Les feuilles 13
5.3 Le tourteau .. 14
CHAPITRE III : LES METHODES DE
PREVISION DE LA VALEUR NUTRITIVE DES ALIMENTS
I. Prévision à partir des caractéristiques
botaniques des fourrages 15
II. Méthodes chimiques 15
III. Méthodes physiques 15
IV. Méthodes enzymatique 15
V. Méthodes microbiologiques 16
5.1 Méthodes directes (in vivo) .16
5.2 Méthodes indirectes .16
5.2.1 Digestibilité in sacco .16
5.2.2 Digestibilité in vitro 16
Partie expérimentale
CHAPITRE I : MATERIELS ET METHODES
I. Matériel 18
1.1 Les échantillons 18
1.2 Appareillage 18
II. Méthodes d'analyses fourragères 18
2.1 Détermination de la composition chimique 19
2.1.1 Dosage de la matière sèche (MS) 19
2.1.2 Dosage des matières minérales (MM) 19
2.1.3 Dosage des matières grasses (MG) 19
2.1.4 Dosage de la cellulose brute (CB) .19
2.1.5 Dosage des matières azotées totales (MAT)
....19
2.1.6 Dosage des sucres totaux (ST) 19
2.2 Méthode de prévision par les équations
d'INRA 20
2.3 Méthode de prévision par gaz test 20
2.3.1 Méthode de fermentation 20
2.3.2 Animaux donneurs de jus 20
2.3.3 Solution tampon 21
2.3.4 Mode opératoire 21
2.3.4.1 Début d'incubation 21
2.3.4.2 la lecture .....22
CHAPITRE II : RESULTATS ET DISCUSSION
I. La composition chimique 23
1.1 Teneur en MS 23
1.2Teneur en MM 23
1.3Teneur en MG 24
1.4Teneur en ST 24
1 .5Teneur en CB 24
1.6Teneur en MAT 25
II. Prévision de la valeur nutritive des sous produits de
l'arganier à partir de la
composition chimique ....26
2.1 Les équations de prévision pour la pulpe
.26
2.1.1Valeur énergétique . 26
2.1.2Valeur azotée ...27
2.2Les équations de prévision pour les feuilles ..
27
2.2.1valeur énergétique 27
2.2.2Valeur azotée . 28
III. Résultats de la fermentation par " gaz test " 28
Conclusion et perspectives 33
LES REFERENCES
BIBLIOGRAPHIQUES.
LES ANNEXES.
Chapitre I : L'alimentation animale en Algérie
I. Le secteur de l'élevage en Algérie
Selon Nedj raoui (2001), l'élevage, en Algérie,
concerne principalement les ovins, les caprins, les bovins et les camelins
où les régions steppiques et présahariennes
détiennent 80 pourcent de l'effectif total constitué
essentiellement par le cheptel ovin.
Les effectifs recensés durant les dernières
années (1987-2006) sont représentés dans le tableau I.
Tableau I : Evolution du cheptel algérien
(milliers de têtes).
|
Espèce Année
|
Bovin
|
Ovin
|
Caprin
|
Total
|
|
1987
|
1416
|
16148
|
2568
|
20132
|
|
1988
|
1435
|
16428
|
2232
|
20095
|
|
1989
|
1405
|
17316
|
2404
|
21125
|
|
1990
|
1392
|
17697
|
2472
|
21561
|
|
1991
|
1300
|
16891
|
2484
|
20675
|
|
1992
|
1334
|
17723
|
2775
|
21832
|
|
1993
|
1394
|
18665
|
2683
|
22742
|
|
1994
|
1269
|
17842
|
2544
|
21655
|
|
1995
|
1267
|
17301
|
2780
|
21348
|
|
1996
|
1228
|
17565
|
2895
|
21688
|
|
1997
|
1255
|
17387
|
3120
|
21762
|
|
1998
|
1317
|
17948
|
3256
|
22521
|
|
1999
|
1649
|
17988
|
3061
|
22698
|
|
2000
|
1595
|
17615
|
3026
|
22236
|
|
2001
|
1613
|
17298
|
3129
|
22040
|
|
2002
|
1551
|
17587
|
3280
|
22418
|
|
2003
|
1560
|
17502
|
3324
|
22386
|
|
2004
|
1613
|
18293
|
3450
|
23356
|
|
2005
|
1586
|
18910
|
3589
|
24085
|
|
2006
|
1607
|
19610
|
3755
|
24972
|
(MADR, 2007 in ROUCHOU, 2009)
Les besoins alimentaires de ce cheptel ont été
estimés, pour l'année 2001, à 10,5 milliards d'UF. (ADEM
& FERRAH, 2002).
II. Les fourrages en Algérie
2.1 Les ressources fourragères
Selon HAMADACHE (2001) in AMRANI (2006), les
ressources fourragères en Algérie se composent essentiellement
des chaumes des céréales, végétation de
jachères pâturés, parcours steppiques, forêts, maquis
et de peu de fourrages cultivés qui sont répertoriés dans
le tableau II.
Tableau II : Les ressources fourragères
en Algérie.
|
Sources fourragères
|
Superficie (hectares)
|
Productivité moyenne U F/ ha
|
observations
|
|
Parcours steppique
|
15 à 20 millions
|
|
100
|
Plus ou moins
dégradés
|
|
Les forêts
|
Plus de 03 millions
|
|
150
|
-
|
|
Chaumes de
céréales
|
Plus de 03 millions
|
|
300
|
Nécessité
d'améliorer la
qualité des chaumes
|
|
Végétation de
jachères pâturées
|
Moins de
millions
|
02
|
250
|
|
Nécessité d'orienter la végétation
|
|
Fourrages cultivés
|
Moins de 500
|
|
|
1000 à 1200
|
Orge, avoine, luzerne, trèfle, vesce avoine et le
sorgho
|
|
Les prairies
permanentes
|
Moins de 300
|
|
|
-
|
Nécessité
d'une prise en
charge
|
(AMRANI, 2006)
L'Algérie disposait en 2001 de 8 milliards d'UF issues
principalement des zones
céréalières (52 %) et des parcours
steppiques (44 %). Les chaumes et les pailles contribuent pour 37 % dans
l'offre fourragère globale.
Ces données témoignent, encore une fois, du
caractère extensif de la production fourragère en Algérie
(ADEM & FERRAH, 2002).
2.2 Taux de couverture des besoins alimentaires du
cheptel
Une analyse de la balance fourragère pour
l'année 2001 a permis de mettre en exergue la persistance d'un
déficit fourrager estimé à 22 %. Mais cette moyenne
recèle des disparités régionales importantes. En effet,
l'analyse selon les diverses zones agroécologiques montre que les
déficits sont beaucoup plus prononcés dans les zones littorales,
steppiques et sahariennes pour des taux respectifs de 58 %, 32 % et 29 %. Ce
déficit fourrager a des répercussions négatives sur la
productivité des animaux et se traduit par un recours massif aux
importations de produits animaux à l'instar des produits laitiers et
carnés. (ADEM & FERRAH, 2002)
Toutefois les systèmes d'élevage sont mixtes et
la part de la production annuelle de chaque type de produit (lait, viande)
dépend de la pluviométrie, qui conditionne les
disponibilités fourragères, mais aussi leur qualité.
(MADANI & al, 2004). Ce qui exige la recherche des solutions pour
corriger ce déficit, et parmi ces solutions adoptés par
l'Algérie c'est l'importation et la valorisation (RUINA, 1986).
III. Importation d'alimentation animale
La dépendance algérienne pour les
céréales importées étant 30% pour l'alimentation
animale. (CNA, 2008), dont des quantités très importantes d'orge
et de maïs sont importées pour combler le déficit fourrager.
En 2008, l'OAIC (L'Office algérien interprofessionnel des
céréales) a été instruit d'importer 300 000 tonnes
d'orges destinés à l'alimentation de bétail (Dalila,
2008). Le tableau III montre les importations Algériennes de l'orge et
de maïs entre 1983-1993.
Tableau III : Evolution des importations d'orge
et de maïs (en milliers de tonnes)
|
1983
|
1984
|
1985
|
1986
|
1987
|
1988
|
1989
|
1990
|
1991
|
1992
|
1993
|
|
Orge
|
482
|
614
|
338
|
000
|
157
|
848
|
259
|
307
|
37
|
103
|
549
|
|
Maïs
|
383
|
615
|
605
|
998
|
874
|
1209
|
1066
|
1198
|
1099
|
939
|
1300
|
(OA IC in Nedjraoui, 2001)
En vue de développement du secteur agro-alimentaire, et
la recherche des éleveurs d'un coût alimentaire réduit, les
sous produits accordent de plus en plus une grande importance. (BOUDJELTIA,
1997).
Selon MOREL (1990) cité par BOUDJELTIA (1997), les sous
produits agro- alimentaires peuvent couvrir les besoins de 1 à 1,5
millions de gros bovins par an en France.
IV. Valorisation des sous produits en Algérie
Selon ADEME (2000), un sous-produit est un produit
résidu qui apparaît durant la fabrication ou la distribution d'un
produit fini. Il est non intentionnel et non prévisible, et est
accidentel. Il peut être utilisé directement ou bien constituer un
ingrédient d'un autre processus de production en vue de la fabrication
d'un autre produit fini. Pour la plupart d'entre eux, ces sous-produits sont
conformes avec la législation en vigueur concernant l'alimentation
animale.
Les sous-produits agro-industriels ont une importance
considérable pour l'alimentation animale dans la région
méditerranéenne compte tenu des caractéristiques
nutritionnelles des ressources fourragères disponibles dans cette
région, en particulier pour les Ruminants. (RENE, 1991).
La bonne utilisation de ces sous-produits dans l'alimentation
animale nécessite la maîtrise de leur conservation, la
connaissance de leur composition, de leur valeur alimentaire et des moyens
susceptibles de I' améliorer. (LAURE, 1991).
4.1 Les sous produits existant en Algérie
Les résidus de récolte : paille de
céréales, bois de taille (sarments de vigne, brindilles
d'olivier,...), et les sous produits de la transformation des fruits et des
légumes : grignons d'olive, pulpe, les marcs de raisin,
représentent des tonnages importants (figure 01) qui sont le plus
souvent inutilisés. Dans certains cas ils contribuent à
élever le niveau de pollution.
La valorisation de ces sous produits dans l'alimentation
animale, permet de baisser les coûts et d'atténuer le
déficit fourrager (LAURE, 1991).Et parmi les sous produits importants en
Algérie (figure 01) on peut citer :
4.1.1 les sous produits céréaliers
La part des céréales dans l'alimentation humaine
en Algérie est importante. Cette forte consommation génère
un tonnage important des sous produits, utilisés pour réduire le
coût de l'alimentation animale (SADDEK, 2008), parmi lesquelles le son
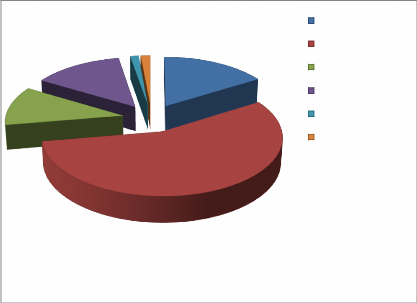
qui occupe une large part (figure01) environ 85 % de la production totale de la
meunerie (BOUDOUMA, 2005), et la paille disponibles en grande quantité:
25 à 30 millions de quintaux par an (TRIKI & al, 2008).
4.1.2 Les sous produits de l'olivier
L'Algérie se classe au 7eme rang des
producteurs d'olive dans le monde. Dont le vergé occupe 280 000 hectares
(AN PCE, 2008)
Les sous produits de l'extraction de l'huile laissent un
résidu dont le poids représente 80% de celui des olives
traités (LOUSSERT & BROUSSE, 1978). En Algérie, l'industrie
oléicole laisse chaque année un sous produit solide abondant et
abandonné. Ce résidu peut constituer une ressource
fourragère importante pour les ruminants grâce à l'aptitude
de ces derniers à utiliser et valoriser les aliments lignocellulosiques.
(ZAIDI & al, 2007).
Les sous-produits principaux d'olivier sont les grignons, mais
aussi les feuilles. Ce sont des aliments ligno-cellulosiques qui
présentent des caractéristiques comparables à celles de la
paille. (RENE, 1991).
4.1.3 Les sous produits de la tomate
La tomate est le second produit maraîcher de par la
place qu'elle occupe dans les habitudes alimentaires (BACI, 1995), et la
production annuelle de tomate selon les statistiques officielles est
estimée à 700 000 quintaux. (M'HAMMED, 2008).
Selon BOUDJELTIA (1997), Ces principaux sous produits servis
à l'alimentation animale sont: la peau, les pépins et le
tourteau.
4.1.4 Les sous produits du palmier dattier
Selon CHEHMA & al (2000), les sous produits sont
disponibles avec des tonnages annuelles estimés à 135 000 tonnes
de palmes sèches, 5 000 tonnes de pédicelles de dattes et 67 500
tonnes de rebuts de dattes, et l'étude de leur valeur alimentaire a
donné des résultats plaçant les rebuts de dattes dans la
catégorie des concentrés énergétiques avec 0,94
unité fourragère / kg de matière sèche.
4.1.5 Les sous produits de la vigne
Selon LAURE (1991), les sous-produits de la vigne peuvent
être classés en : le marc et ses dérivés(le marc de
raisin, les pépins), le jus de raisin concentré et les sarments
et les feuilles.
50
61
5,6 6,5
250
72
grignon
son
pulpe d'agrumes marc
levure
melasse
Figure 01 : les sous produits disponibles en
Algérie (milliers de tonnes). (FAO, 1990 in
BOUDJELTIA, 1997).
Chapitre II : L'arganier
Historique
Les premiers à avoir mentionné l'existence de
l'arganier au Maghreb sont les géographes et les savants arabes. En
effet l'usage de fruits de l'arganier ont été relatées en
X siècle, XI siècle et XII siècle respectivement par : Ali
Ibn Rodhouan, EL Beckri et El Idrissi.
Vers 1219, le médecin égyptien Ibn El Baytar,
parle de l'arganier et le décrit comme « un arbre de haute taille,
épineux, donnant un fruit du volume d'une amande et contenant un noyau
que l'on recueille, que l'on broie et dont on extrait l'huile pour l'employer
dans les préparation alimentaires». (M'HIRIT & al.
1998).
II -Botanique :
2.1 Taxonomie
La systématique de l'arganier selon Radi (2003), M'HIRIT
& al (1998) est comme suit :
Embranchement Phanérogame.
Sous embranchement Angiospermes.
Classe Dicotylédones.
Sous classe Gamopétales.
Ordre .Ebénales.
Famille Sapotacées.
Genre .Argania.
Espèce .Argania Spinosa L.
2.2 Caractéristiques
L'arbre ressemble quelque peu à un olivier, il peut
atteindre 8 à 10 mètres de taille. (DEBBOU & CHOUANA,
2003).
Sa cime est large, étalée, dense et ronde. Son
tronc est court, noueux, tourmenté, même souvent multiple et
formé alors de plusieurs tiges entrelacées. (RA DI, 2003).
Le fruit de l'arganier est une baie de forme variable, de
couleur verte à jaune clair, il se compose d'un péricarpe charnu
(pulpe) et d'un noyau central dur. Au centre du fruit se trouve une amande qui
est constituée de plusieurs graines concrescentes. (CHERROUF, 1995).
III. / IP SHItDayIiideii/DUDaier
Parmi les fonctions qui remplis l'arganier. Nous parlerons en
particulier des fonctions économiques, sociales et environnementales.
3.1 / P SMtDayIiiéyoaIP ITXI
Au Maroc l'économie locale est dépendante du fruit
d'argan, cet arbre a une valeur très importante chez le peuple
Berbère. (K ITTY , 2004).
3.1.1 Production des huiles et ces
dérivées
L'huile d'argan constitue le produit principal de l'arganier.
Elle est extraite à partir de l'amande, qui contient environ 50% d'huile
comestible. (CH ERROU F, 1995 &2002 ; DI RK, 1998 & DAVID, 2004).
L'huile d'argan vierge renferme essentiellement des
triglycérides (94,5-97,3 %) ; l'insaponifiable y présente de 1,0
à 1,1 % (RA HMANI, 2005). En plus de son utilisation en alimentation
humaine, elle est utilisée dans la préparation des crèmes
et d'autres produits cosmétiques. (DAVID, 2004 ; LUIS, 2005 &
GILLES, 2007).
3.1.2 Production du bois
Le bois est résistant et lourd. C'est un excellent charbon
utilisé pour le chauffage mais il est impropre à la menuiserie.
(DEBBOU & CHOUANA, 2003)
Le bois de l'arganier est utilisé comme combustible (CH
ERROU F, 2007).
Au Maroc, la production de bois est de l'ordre de 8 tonnes /ha
de matière vivante ce qui constitue l'équivalent de 50 tonnes/ ha
de matière sèche. Vu qu'un gramme de matière sèche
équivaut à 4.5 kilocalories, la production actuelle de
l'arganeraie est de 180000 milliards de kilocalories. Partant du fait que le
litre de pétrole équivaut à 10000 kilocalories, on peut
affirmer que l'arganeraie marocain recèle une énergie
équivalente à 18 milliards de litres de pétrole brut.
(BENZYANE, 1995).
3.1.3 Production pastorale
Les troupeaux de bovins, d'ovins et surtout de caprins et de
camelins y pâturent pendant une grande partie de l'année par les
produits d'arganier. (EL A ICH , 2007)
3 mii/ P SortDayeiisoyiDa
En plus de son vaste importance, l'arganier permet de
stabiliser les populations des compagnes, et donc de limiter le
phénomène de l'exode rural dans les régions où se
cultive. (BENZYANE, 1995 & BENHAMOU, 2007).
3.3 I 'iP S1rtIXce environnementale
L'arganier joue un rôle irremplaçable dans
l'équilibre écologique grâce :
· A son système raciner puissant qui contribue au
maintien du sol et à la lutte contre l'érosion.
· Aux nombreux micro-organismes vivants liés
à sa présence, où la disparition de l'arganier
entraîne la disparition de plusieurs espèces, donc une
réduction du patrimoine génétique (RADI, 2003).
· A son effet ombrage et améliorateur du sol
(BENZYANE, 1995).
IV. Répartition
L'aire principale de répartition d'arganier se situe entre
29° et 32°de latitude Nord. (DEBBOU & CHOUANA, 2003).
En Algérie, selon les estimations des services de la
conservation des forêts, les forets d'arganier recouvrent une superficie
avoisinant les 3000 hectares dans la wilaya de Tindouf, depuis le Djbel
Ouarkziz jusqu'a la Hamada de TINDOUF (figure02).
Aussi il existe six arbres à Mostaganem et une à Mascara.
Aujourd'hui, on en trouve à Baïnem (Alger) et à
l'Université de technologie d'Oran (USTO), mais en laboratoire. (MILAGH,
2007).
Au Maroc, l'arganier occupe une surface très importante,
où il couvre environ 800 milles hectares. (M'HIRIT & al,
1998).
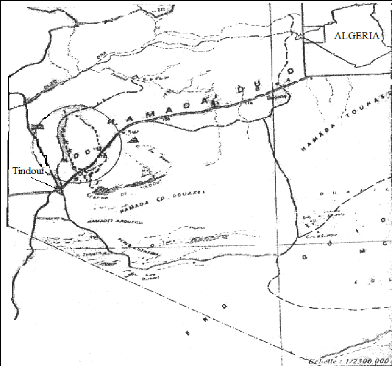
Figure 02 : localisation d'arganeraie en
Algérie (MORSLI, 1999).
V. Les sous produit de l'arganier
5.1 La pulpe
La pulpe du fruit, appelée encore péricarpe, est
la partie la plus externe enveloppant la graine, obtenue après
dépulpage de fruit (figure 03), sa couleur change suivant le
degré de maturation du fruit ; du vert au jaune veiné, de rouge
puis au brun. Cette pulpe est charnue, amère. Elle est utilisée
comme aliment pour les caprins. (CHERROUF & GUILLAUME, 1998 & RADI,
2003).
5.2 Les feuilles
Les feuilles servent de pâturage suspendu pour les
caprins (ANONYME, 1995), plusieurs flavonoïdes ont été
isolés des feuilles de l'arganier: la myrécitine, la
quercétine et autres dérivés glycolsylés. (CH ERROU
F, 2007).
5.3 Le tourteau
C'est le résidu de l'extraction (figure 03),
utilisé comme aliment d'engraissement pour les bovins, il est riche en
glucides et une fraction protéique de poids moléculaire
élevé. Sa composition lui confère des
propriétés pharmaceutiques intéressantes. (CHERROUF, 2002
& GILLES, 2007).
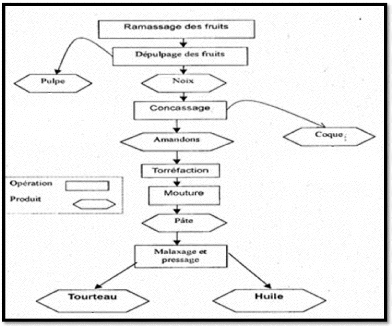
Figure 03 : schéma d'obtention des
produits et sous produits de l'arganier. (ANONYME, 2006).
Chapitre III : Méthodes d'évaluation de la valeur
nutritive des aliments
Selon TISSERAND (1991), Une meilleure connaissance de la valeur
alimentaire des sous-produits locaux constitue incontestablement un
clément déterminant pour le
développement de systèmes d'élevage
adaptés aux conditions particulières du pays.
La digestibilité d'un constituant chimique exprime sa
proportion disparue entre sa consommation et son excrétion dans les
fèces. La digestibilité de la matière organique (dMO) des
fourrages est une base essentielle pour estimer leur valeur
énergétique (DACCORD, 1999).
I. Prévision à partir des
caractéristiques botaniques des fourrages
Selon DEMARQUILLY & JARRIGE (1981), la composition chimique
et l'âge sont les deux caractéristiques principales qui
déterminent la digestibilité de la plante sur pied et permettent
donc de la prévoir.
II. Méthodes chimiques
C'est à partir de la composition chimique qu'on peut
prévoir la digestibilité des fourrages, cette dernière est
liée positivement à la teneur en constituants cytoplasmiques
totaux et négativement à la teneur en parois lignifiées et
cutinisées (DEMARQUILLY & JARRIGE, 1981)
III. Méthodes physiques
Les propriétés mécaniques comme la
résistance au broyage, sont susceptibles de refléter non
seulement la digestibilité mais également la vitesse de
dégradation des parois et par là leur ingestibilité (CH
ENOST, 1991).
IV. Méthodes enzymatique
La méthode est proposée par JO NES & HAYWARD
(1975) a été l'une des plus utilisée pour prévoir
la digestibilité des fourrages. Elle comprend deux étapes : un
pré- traitement par la pepsine dans de l'acide chlorhydrique
dilué (0,1 N) pendant 24 heures suivi d'un traitement par la cellulase
pendant 48 heures. (AUFRERE, 1982)
V. Méthodes microbiologiques
5.1 Méthodes directes (in vivo)
Selon D EMA RQU ILLY et BOISSA U (1978) cité par B
ENCHERCHALI (1994), elle constitue la méthode de
référence. La mesure de la digestibilité se fait sur 4
à 6 béliers, de préférence castrés,
âgé de 2 à 5 ans, en bonne santé et qui
représentent une résistance à la cage de
métabolisme.
5.2 Méthodes indirectes 5.2.1 Digestibilité
in sacco
La méthode in sacco consiste à introduire
des petits sachets de nylon qui ont une grandeur de 10 - 20 centimètres,
une grandeur de pore de 50 um (+/-10) dans le sac ventral de rumen, ces sachets
contiennent environ 5 g de l'aliment. La période d'incubation se fait
à 0, 3, 6, 9, 12, 24, 36, 48 et 72 heures. Après chaque
période d'incubation, les sacs de nylon sont enlevés de rumen et
lavés avec l'eau distillée pour enlever le jus de rumen. Puis
séchés à 65°C pendant 48 heures (PAMUNGKAS et
SEVILLA, 2005).
5.2.2 Digestibilité in vitro
Généralement, les techniques in vitro sont
basées sur la mesure des résidus de fermentation ou les produits
non fermentés après incubation dans le jus de rumen. (GETACHEW
& al, 2004). Parmi les méthodes les plus exactes et
pratiques disponibles celle de TILLEY & TERRY annoncée en 1963
(MABJEESH & al, 2000).
La méthode du gaz test a été aussi
utilisée avec succès pour prédire la digestibilité
d'un aliment. La mesure du gaz produit donne une meilleure estimation de la
valeur nutritive. (GETACHEW & al, 2004)
Chapitre I : Matériel et méthodes
I. Matériel
1.1 les échantillons
Notre échantillon d'étude est constitue de la
pulpe des fruits de l'arganier obtenue de l'échantillon utilisé
par monsieur Kouidri(2008) dans ses travaux de thèse et de feuilles
recueillies à partir de jeunes arbres (4ans) implantées au
service de forêts à CHLEF.
1.2 Appareillage
Au cours de notre expérimentation au laboratoire de
zootechnie et physiologie animale, nous avons utilisé le matériel
mentionné dans le tableau IV :
Tableau IV : Matériel et appareillage
utilisés durant l'expérimentation
Appareils
|
Objectif et utilisation
|
Verrerie.
|
Préparation des solutions, titrage, filtration....
|
Broyeur.
|
Broyage des échantillons.
|
Etuve.
|
Séchage de l'échantillon pour déterminer la
MS
|
Four à moufle.
|
Incinération pour déterminer la MM
|
Balance de précision.
|
La pesée des échantillons à analyser
|
soxhlet.
|
Détermination de la MG.
|
Büchi.
|
Distillation lors de détermination de la MAT.
|
Spectrophotomètre UV-V.
|
Lecture de DO pour déterminer la teneur en ST.
|
Bain marie.
|
Fermentation des échantillons.
|
pH mètre.
|
Ajustement du pH de milieu de LOWE.
|
Plaques résistantes
|
Minéralisation pour convertir l'azote organique en azote
minérale.
|
|
II. Méthodes d'analyses
fourragères
Avant d'effectuer les analyses, les échantillons sont
finement broyés (annexe 01),
et conservés dans des flacons hermétiquement
fermés nettoyés et séchés au
préalable
Tous les dosages sont effectués en triple, et les
résultats sont rapportés par
rapport à 100g de matière sèche (%MS).
2.1 Détermination de la composition
chimique
Les méthodes utilisées sont des méthodes
classiques de l'analyse fourragère (annexe 02).
2.1.1 Dosage de la matière sèche
(MS)
Principe : La teneur en matière sèche par un
double séchage des aliments est déterminée
conventionnellement par le poids de ces aliments après séchage
dans une étuve à circulation d'air.
2.1.2 Dosage des matières minérales
(MM)
Principe : La teneur en MM d'un produit est, son résidu
après destruction de la matière organique par
incinération.
2.1.3 Dosage des matières grasses (MG)
Principe : Les matières grasses des aliments sont
obtenues par extraction directe au moyen d'un solvant, puis élimination
du solvant par distillation et déssication. Pesé du
résidu.
2.1.4 Dosage de la cellulose brute (CB)
Principe : La teneur en cellulose brute d'un aliment est le
résidu insoluble après traitement par un acide puis par une base,
elle est déterminée par la méthode de WEENDE, ce
procédé a été normalisé aux Etats-Unis, et y
utilisé pour établir les tables alimentaires modernes (GAUTIER
& al, 1991).
2.1.5 Dosage des matières azotées totales
(MAT)
Principe : L'azote total est dosé par la méthode
de KJELDAHL : on minéralise le produit par l'acide sulfurique en
présence d'un catalyseur ; l'azote organique est transformé en
azote ammoniacal ; on déplace l'ammoniac par la soude et on le dose
après avoir reçu dans une solution d'acide borique. (Lecoq,
1965).
2.1.6 Dosage des sucres totaux (ST)
Principe : La méthode de DUBOIS et al (1956)
permet de doser les oses en utilisant le phénol et l'acide sulfurique
concentré, en présence de ces deux réactifs, les oses
donnent une couleur jaune-orange dont l'intensité est proportionnelle
à la concentration des glucides, la densité optique est
déterminée entre 450 à 550 nm (NIELSEN, 1997)
2.2 Méthode de prévision par les
équations d'INRA
La prévision de la valeur alimentaire,
particulièrement de la valeur énergétique, des alimentes
des ruminants, a toujours été une préoccupation constante
de tous ceux qui s'intéressaient à l'élevage et à
l'alimentation de ces animaux.
Tenant compte du progrès considérable des
connaissances acquises depuis 1950, sur les besoins des animaux et sur
l'utilisation digestive et métabolique des alimentes, l'INRA proposait
en 1978, de nouveaux système pour exprimer les besoins des animaux et la
valeur nutritive des aliments (UFL, UFV, MAD...).
Après avoir fait le point des connaissances actuelles
sur la composition chimique (constituant glucidiques, azotés, lipidique,
minéraux) des fourrages et alimentes concentrés ou
composés, nous avons utilisé les équations de l'INRA pour
prévoir la valeur énergétique et azotées des sous
produits d'arganier étudiées.
2.3 Méthode de prévision par gaz
test
2.3.1 Méthode de fermentation
La digestibilité des aliments peut être
estimée par les méthodes biologiques connues comme les techniques
in vitro, qui sont conduites hors de l'animal, ces techniques sont
basées sur la mesure des résidus de fermentation.
Les méthodes les plus récentes mesurent les
produits de fermentation anaérobique. La fermentation par jus de rumen a
pour résultat la production d'acides gras volatils, gaz (le dioxyde de
carbone [CO2] et méthane [CH4]) et la masse microbienne. La
quantité de gaz produite pendant l'incubation est mesurée pour
prévoir la digestion de l'aliment. (GETACHEW & al,
2004).
2.3.2 Animaux donneurs de jus
Vue l'absence des animaux donneurs de jus dans la station
expérimentale, nous avons ramené le jus de rumen qu'on a
utilisé pour fermenter la pulpe et les feuilles de la battoire de CH L
EF, dans un thermos pour le conserver à sa température de
sortie.
1er essai, l'animal donneur est un boeuf pesant en moyenne 400 Kg
âgé de 4ans.
2eme essai, l'animal donneur est une vache pesant en moyenne 450
Kg âgée de
4ans.
2.3.3 Solution tampon
La principale fonction de salive est ce d'un lubrifiant pour
aider la mastication et déglutition, et la plupart des solutions tampon
sont basées sur la solution de McDOUGALL reconstitué à
partir des analyses de salive d'ovins (McDOUGALL, 1947), et parmi eux le milieu
de LOWE, proposé par LOWE et al (1956) qui comporte
essentiellement des composants de salive artificielle, solution
résazurine et des traces éléments minéraux.
2.3.4 Mode opératoire
Dans notre expérimentation nous avons utilisé la
méthode de « gaz test », où la fermentation aura lieu
dans un Erlen Meyer Connecté par un tuyau à un flacon rempli
d'eau, et ce dernier connecté à une éprouvette
graduée. La quantité de gaz produite et évacuée est
proportionnelle au volume d'eau évacué dans l'éprouvette
(figure04).
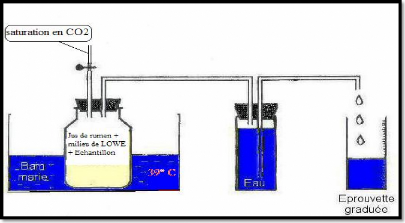
Figure 04 : Dispositif de fermentation.
2.3.4.1 Début d'incubation
Le jus de rumen est mélangé avec le milieu de
LOWE à raison de 1/3 et 2/3 (KHAZAAL, 1995), soit 100 ml jus de rumen et
200 ml de milieu de LOWE plus 500 mg de l'échantillon dans un bain marie
réglé à 39°C. (DEMARQUILLY et JARRIGE, 1981et
BENCHERCHALI., 1999).
On agite le contenu de temps en temps.
Deux séries de mesures sont effectuées, chaque
échantillon est traité en triple, soit six
répétitions, deux blanc (jus de rumen + solution tampon) sont
utilisés simultanément.
La saturation en CO2 est réalisée à l'aide
de la fermentation à la levure de bière (figure05) pour assurer
les conditions d'anaérobiose.
Figure 05 : La saturation en CO2 par la levure
de bière.
2.3.4.2 la lecture
Le gaz produit est lu dans des intervalles de temps : 0-4h, 4-8h,
8-12h, 12-24h, 24-36h, 36-48h, 48-72h., 72-96h.
Chapitre II : Résultats et discussion
I. La composition chimique
Les résultats de l'analyse fourragère des
échantillons étudiés, ainsi que celle de deux fourrages de
comparaison soit un fourrage de qualité: luzerne et un aliment
médiocre: paille sont répertoriés dans le tableau V.
Tableau V: La composition chimique (% de MS) des
sous produits étudiés et deux autres fourrages.
|
Composant Aliment
|
MS
|
MM
|
MG
|
MAT
|
CB
|
ST
|
|
PULPE
|
85.41 %
|
9.44 %
|
8.84 %
|
4.74 %
|
8.85 %
|
15.32 %
|
|
FEUILLE
|
85.56 %
|
8.04 %
|
3.37%
|
12.46 %
|
5.91 %
|
2.30%
|
|
LUZERNE*
|
80 %
|
2.2 %
|
0.7 %
|
16.5 %
|
33.5 %
|
19 %
|
|
PAILLE**
|
93.8 %
|
6.9 %
|
-
|
3.4 %
|
41.70 %
|
-
|
* : JARRIGE et al (1995). ** : NOURA (2001).
1.1 Teneur en MS
Généralement, les éléments
déshydratés présentent une teneur en MS assez importante.
La pulpe et les feuilles se rapprochent dans leur teneur en MS soient 85.41%
pour la pulpe et 85.56% pour les feuilles. Ces résultats sont
légèrement élevés par rapport à ceux obtenus
par CHERROUF, (1998) (80% de MS pour la pulpe).cette différence peut
être expliqué par les conditions de séchage ainsi que les
conditions de culture de nos arganiers.
1.2Teneur en MM
Les analyses ont révélé des compositions
minérales respectives de la pulpe et les feuilles : 9.44 %MS et 8.04 %MS
ces valeurs sont nettement supérieures à celle obtenues par
CHERROUF (1998) (4.1% MS) et DEBBOU & CHOUANA (2003) (2.58% MS) du fait que
une part de nos échantillons proviennent d'arbres cultivés
à MOSTAGANEM pour la pulpe et à CHLEF pour les feuilles où
les sols sont relativement riches en minéraux.
1.3Teneur en MG
La fraction lipidique des aliments concentrés est d'une
importance primordiale puisque leurs valeurs nutritives en dépend et que
son état de conservation peut avoir un effet direct sur
l'appétibilité de ces aliments. La connaissance de cette
composition est donc intéressante.
Selon MORAND-FEHR (1979) la teneur en MG des aliments
concentrés se situent entre 15 et 65g/Kg de MS, mais il existe d'autres
aliments plus riches comme les graines oléagineuses et notre
échantillon de pulpe a une valeur nettement supérieure soit 88.4
g/Kg de MS, cette valeur se rapproche plus ou moins des valeur apporté
par CHERROUF (1998) soit 60g/Kg de MS, mais relativement faible par rapport au
résultat de DEBBOU & CHOUANA (2003) soit 31,20%MS.
Nos résultats révèlent que les feuilles
sont trois fois moins riche que la pulpe en MG soit de 3.37% MS à ce
moment les feuilles ne peuvent pas être considérées comme
une source lipidique en alimentation animale bien quelles soient plus riches
que la luzerne (0.7 %MS) (JARRIGE & al, 1995).
1.4Teneur en ST
Nos résultats n'appellent pas de commentaires
particuliers, comparés aux résultats de CHERROUF (1998) la teneur
en sucre de la pulpe est assez proche soit 15.32%MS contre 18.5%MS, alors que
par rapport aux résultats de DEBBOU & CHOUANA (2003) on se trouve
avec des valeurs trois fois plus élevée (49.83%MS),
Les feuilles présentent une valeur faible
comparée à la pulpe, cette différence peut être
expliquée par l'état physiologique de es feuilles
prélevées d'arbres très jeunes en début de leur
développement.
On constate que la pulpe présente une valeur comparable
à celle de la luzerne (1 9%MS).
1.5Teneur en CB
Contrairement a ce qu'a été observé pour
les composants précédents on distingue une faible teneur en CB
soit 8.85%MS par rapport au résultat de CHERROUF (1998) qui est de
l'ordre de 12.9% MS et celle obtenue par DEBBOU & CHOUANA (2003), 10.94%MS.
Cette différence pourrait s'expliquer par l'état de la
maturité de la pulpe et le moment de récolte des fruits.
La faible valeur en CB des feuilles (5.91 %MS) pourrait avoir
les mêmes raisons que
pour la faible teneur en ST ; Comparé
à la luzerne et aux pailles qui ont respectivement
les valeurs de 33.5%MS et de 41%MS, les sous produits de
l'arganier sont considérés comme des aliments très riches
en éléments solubles et pauvres en CB.
1.6Teneur en MAT
L'apport d'azote dans les sous produits de l'arganier
étudié est considérablement variable, plus
élevé dans les feuilles (12.46 % MS) et faible dans la pulpe
(4.74 %MS), ce dernier résultat concorde avec celui obtenu par CHERROUF
(1998) (5.9%MS) ainsi que celui DEBBOU.B & CHOUANA.T (2003) (5.35%MS).
De point de vue valeur azotée les feuilles de
l'arganier se rapprochent à la luzerne (1 6.5%MS), elles sont donc
considérés comme une source d'azote non négligeable pour
les ruminants des zones sahariennes où les fourrages de qualité
font défaut et compléter ainsi des rations à base de
paille qui n'apportent que de faibles quantités en azote soit 3.4%MS.
La pulpe est moins riche que les feuilles en azote et selon
JARRIGE & al (1995) de très nombreuses protéines se
trouvent au niveau de feuilles dont la plupart ayant des activités
enzymatiques, les chloroplastes à eux seuls contiennent plus de la
moitié des protéines foliaires en plus des protéines
membranaires.
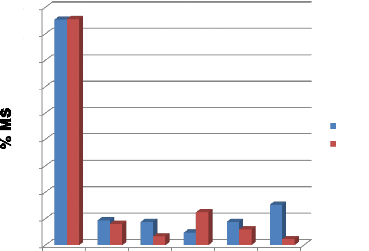
Pour une étude comparative entre la composition chimique
des feuilles et celle de la pulpe, les résultats sont
représentés sous forme d'histogrammes (figure N°06)
MS MM MG MAT CB ST
40
90
80
70
60
50
30
20
10
0
PULPE FEUILLE
Figure 06 : comparaison de la composition
chimique des sous produits étudiés.
De point de vue valeur alimentaire, nous constatons que la
pulpe est une source énergétique assez intéressante vue sa
richesse en MG et en ST comparé aux feuilles qui apportent une
quantité considérable en MAT ; l'idéal serait que les
animaux consomment les deux produits en même temps pour en faire une
ration complète.
Dans le cas du développement de l'extraction de l'huile
d'argan la pulpe pourrait être utilise comme concentré pour
compléter les rations pauvres en produits rapidement fermentescibles.
II. Prévision de la valeur alimentaire des sous
produits de
l'arganier à partir de la composition
chimique
2.1 Les équations de prévision pour la
pulpe
2.1.1 Valeur énergétique
Vue la difficulté de la détermination de la
digestibilité et de la valeur nutritive due à la faible
quantité d'échantillon disponible nous avons jugé
intéressant d'utiliser les équations de prévision de l
'INRA en utilisant les résultats de l'analyse fourragère, en
effet la valeur énergétique ou azotée d'un aliment
dépend avant tous de sa composition chimique et particulièrement
sa teneur en MAT.
Les équations que nous avons utilisées sont le
fruit d'un très grand nombre de travaux (JARRIGE, 1980 et MORRISON
(1976), le choix de ces équations ne rencontre aucun inconvénient
vue la faible teneur en CB (SAUVANT, 1981).
dMO = 91,7 - 1,48 CB. R=0,95
UFL = 121,80 + 0,11 MAT - 1,81 CB + 1 ,26MG.
UFV= 124,15 + 0,06 MAT - 2,20 CB + 1,22 MG.
En remplaçant dans les équations chaque
paramètre par une moyenne rapportée à 100g de MO, les
résultats sont répertoriées dan le tableau VI.
Tableau VI : Valeur énergétique de
la pulpe
|
MG%MO
|
MAT%MO
|
CB%MO
|
dMO
|
UFL
|
UFV
|
|
9.37%
|
5.02%
|
9.38%
|
77.82%
|
0,93
|
0,92
|
Comparé aux différents aliments
concentrés dont la valeur énergétique varie de 1,17
à 0,16 pour les UFL et de 1,26 à 0,07 pour les UFV la pulpe est
considérée comme un aliment de qualité ayant 0,93 UFL et
0,92 UFV.
En vue de développement de la production de l'huile
d'argan il serait intéressant d'utiliser ce sous produit comme aliment
pour toute type de productions.
2.1.2Valeur azotée
Nous avons fait de même pour la prévision de la
valeur azotée de la pulpe, on utilisant les équations (VERITE et
SAUVANT, 1981).
MAD1= 0,914 MAT (g/kg / MO)
MAD2= 0,917 MAT - 0,055 CB (g/kg / MO)
Tableau VII : la valeur azotée de la
pulpe
|
MG%MO
|
MAT%MO
|
CB%MO
|
MAD1
|
MAD2
|
|
9.37%
|
5.02%
|
9.38%
|
4.71
|
4.09
|
Les résultats obtenus n'appellent pas de commentaire
particulier car comme pour tous les aliments lorsque la teneur en MAT est
faible la quantité en MAD l'est aussi, nous constatons une
légère surestimation lorsque les équations n'utilisent pas
la CB.
La pulpe seule ne peut être considérée comme
un apport d'azote.
2.2Les équations de prévision pour les
feuilles
2.2.1valeur énergétique
Pour prédire la valeur énergétique des
feuilles des équations de prévision de
|
l'INRA (JARRIGE et al, 1981) sont utilisés,
|
|
|
dMO = 0.717+0.001222 MAT-0.000748 CB.
|
R=0,833
|
|
UFL = 0.840 + 0.001 330 MAT - 0.000832 CB.
|
R=0,833
|
|
UFV= 0.762 + 0.001443 MAT - 0.000946 CB.
|
R=0,848
|
En remplaçant, chacun des paramètres de
l'équation par les valeurs moyennes trouvées, les
résultats sont répertoriés dans le tableau IIX.
Tableau IIX : Valeur énergétique
des feuilles
|
MG%MO
|
MAT%MO
|
CB%MO
|
dMO
|
UFL
|
UFV
|
|
3.62%
|
13.39%
|
6.35%
|
72%
|
0,85
|
0,77
|
La majorité des foins ont une valeur
énergétique située entre 1,03 à 0,16 pour les UFL
et de 0,99 à 0,16 pour les UFV donc les feuilles peuvent être
considérées comme un bon foin ayant 0,85 UFL et 0,77 UFV.
La richesse des feuilles en MAT et leur faible teneur en CB
explique la valeur élevée de la dMO (0.72%), cette valeur est
comparable à celles des fourrages de qualité.
Grâce à sa teneur élevé en UFL, les
feuilles peuvent être utilisées en alimentation des ruminants en
vue de la production laitière dans les régions où pousse
l'arganier. 2.2.2 Valeur azotée
Pour la prévision de la valeur azotée des feuilles,
nous avons utilisé l'équation suivante :
MAD = 0,742 MAT. (JARRIGE et al, 1981)
Tableau IX : la valeur azotée
prédite des feuilles
Ce résultat n'appelle pas de commentaires particulier
car il est naturel que la quantité en MAD des feuilles soit
élevée soit environ 10g/kg de MO vue leur teneur en MAT qui est
supérieur à 13% MO.
Comparée aux valeurs de la table INRA (1988) les
feuilles ont la même valeur azotée que la plupart des
légumineuses, à cet effet les feuilles de l'arganier peuvent
êtres considérer comme une source d'azotée compensant ainsi
la rareté des fourrages de qualité dans les zones
désertiques.
III. Résultats de la fermentation par " gaz test
"
Les résultats bruts du gaz test sont
représentés en annexe (02), le tableau X présente la
production moyenne de gaz de 500mg d'échantillon.
Tableau X: Résultats de la fermentation
des échantillons [volume de gaz produit (en ml) pendant des
intervalles de temps].
|
Temps
|
0 - 4
|
4 -8
|
8 - 12
|
12 - 24
|
24 - 36
|
36 - 48
|
48 - 72
|
72 - 96
|
|
h
|
h
|
h
|
h
|
h
|
h
|
h
|
h
|
|
Ech
|
|
|
|
|
|
|
|
|
|
Pulpe
|
136,83
|
139
|
98,66
|
115,5
|
67,5
|
42,33
|
31,33
|
5,16
|
|
Feuille
|
146,83
|
147,33
|
89,5
|
121,33
|
90,16
|
70,83
|
42
|
14,83
|
|
Blanc
|
76,5
|
84
|
82
|
79
|
43
|
27.5
|
10
|
00
|
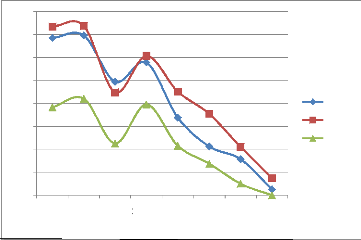
L'évolution de la cinétique de la production de gaz
durant la fermentation des échantillons est représentée
par la figure (07).
Partie pratique Chapitre II : résultats et
discussion
160
140
120
100
80
40
60
20
0
0 -4 04_08 8 -12
h
12 -24
h
24 -36
h
36 -48
h
48 -72
h
72 -96
h
Pulpe Feuille Blanc
Figure 07: Evolution de la production du gaz
pendant l'incubation de la pulpe et des feuilles de l'arganier.
La figure montre une production importante de gaz pendant les
premières heures d'incubation (140 à 150 ml), ceci est due en
grande partie à la composition de jus utilisé pour la
fermentation, qui atteint à lui seul environ 80ml, ce dernier doit
être très riche en produits solubles (concentré) rapidement
fermentescibles, ce qui nous a amené à faire une correction en
considérant que le blanc ne produit que très peu ou pas de gaz au
cours de l'incubation, les résultats après correction et en
comparaison avec deux aliments de valeurs nutritives très distinctes
sont représentés dans la figure 08.
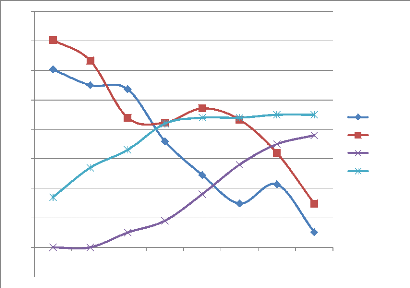
-10
40
70
60
50
30
20
10
0
0-4h 4 -8h 8 -12 h 12 -24 h24 -36 h36 -48 h48 -72 h72 -96 h
Pulpe Feuille- paille luzerne
Figure 08 : Evolution de la production de gaz
des produits de l'arganier après correction.
La dégradation des aliments dans le rumen s'accompagne
d'une importante production de gaz, le CO2 (60 à 70 %) qui provient des
bicarbonates apportées par la salive et de nombreux processus de
fermentation, et du CH4 (25 à 35%) qui provient de la réduction
du CO2 par l'hydrogène avec toutefois de fortes variations (JARRIGE,
1980 & JOUANY & al (1995).
Les résultats de NOURA(2001) pour les pailles et de
GETACHEW & al (2004) pour le foin de luzerne montrent que
l'évolution de la production de gaz suit une progression linéaire
où les courbes représentent trois parties distinctes :
-Une partie de démarrage où les valeurs
initiales sont relativement faibles bien que la luzerne démarre avec une
production de 27 ml par rapport à une valeur relativement nulle pour les
pailles;
-Après un séjour en contact de la flore
ruminale, la production augmente progressivement jusqu'à une valeur
optimale ; atteinte après 12h pour le foin de luzerne et 48h pour la
paille;
-La production de gaz devient stationnaire et forme un
plateau.
Pour l'évolution de la production de gaz de nos
échantillons, nous observons une allure tout à fait
différente, où on distingue quartes parties:
Fraction A : son intervalle se situe entre 0
et 8h pour la pulpe alors que pour les feuilles c'est entre 0 à 12h, la
production de gaz démarre avec une production maximale puis diminue, la
fermentation des feuilles est plus importante (70ml) par rapport
à celle de la pulpe (60ml), cela peut être
argumenté par la présence des éléments rapidement
fermentescibles (ST, MG et MAT) par rapport à la paille et le foin de
luzerne, la différence entre les feuilles et la pulpe peut être
expliquée par la teneur élevée en MAT des feuilles.
Fraction B : limitée entre 8 -12h, se
caractérise par une production constante alors que pour les feuilles,
l'évolution se stabilise entre 12 et 24h. Cet état peut
être expliqué par la résistance des particules insolubles
à l'attaque microbienne et le temps d'adhésion sur les parois.
Fraction C : cette troisième partie se
limite dans l'intervalle de [12 _ 48h] pour la pulpe où on observe une
diminution très nette de la production de gaz, ce qui reflète
l'activité microbienne qui devient de plus en plus faible en
conséquence de l'épuisement rapide de la MO ; pour les feuilles
l'intervalle se situe entre [12 _ 36h] et contrairement à la pulpe on
observe un rebondissement de la courbe due à sa richesse en azote.
Fraction D : à partir de 36h, on
constate une diminution progressive du volume de gaz produit, expliquée
également par la diminution de l'activité microbienne et la
solubilisation complète de la MO contenues dans les feuilles;
La pulpe, riche en MG et en CB, permet durant cette phase une
augmentation de la production de gaz qui dure environ 12h, suivie d'une
diminution ayant les mêmes raisons que pour les feuilles.
Par comparaison de la cinétique de production de gaz
entre nos échantillons et celle de la paille ou de foin de luzerne, la
différence réside dans le temps de latence très important
pour ces derniers soient respectivement plus de 48h et plus de 12h. Cette
différence s'explique par la teneur de ces derniers en CB soit
respectivement 41 .7%MS 33.5%MS contre 8.85%MS et 5.91%MS pour la pulpe et les
feuilles ; en effet la teneur en CB conditionne la vitesse de la production de
gaz et la fermentation des produits solubles.
CONCLUSION ET PERSPECTIVE
Au terme de ce modeste travail et à partir des
résultats trouvés on conclu que :
La composition chimique montre la richesse de la pulpe d'arganier
en éléments solubles, dont elle renferme environ 1 5,5%MS de
glucides, 9%MS de lipides et 5%MS de l'azote, tandis que les feuilles sont
trois fois moins riche que la pulpe en MG soit environ 3,5%MS et faible en ST
soit 2,5%MS, mais riche en MAT qui représente 12,5%MS. La teneur en CB
est très faible d'environ 9%MS pour la pulpe et 6%MS pour les
feuilles.
De point de vue valeur énergétique et
azotée, la pulpe est considérée comme un aliment de
qualité ayant 0,93 UFL ou 0,92 UFV malgré sa pauvreté en
MAD qui représente environ 4%MO. Les feuilles apparaissent comme un bon
foin ayant environ 0,9 UFL, 0,8 U FV et 10 %MAD :
· La pulpe pourrait être utilisée comme
concentré pour compléter les rations pauvres en produits
rapidement fermentescibles vue sa richesse en MG et en ST comparée aux
feuilles apportant une quantité considérable en MA D
considérées comme une source azotée compensant ainsi la
rareté des fourrages dans les zones désertiques donc, il serait
intéressant d'utiliser les deux aliments en même temps pour en
faire une ration complète.
· Les feuilles peuvent être utilisées en
alimentation des ruminants en vue de la production laitière tandis que
la pulpe peut être utilisée pour tout type de productions.
La fermentation de la pulpe et des feuilles donne une production
rapide et importante de gaz, à partir de ce résultat on conclu
que ces aliments sont très solubles et rapidement fermentescibles.
Toute étude en continuité de ce travail doit
consister à:
* Une analyse approfondie qui portera sur plus des
paramètres et réalisera des analyses plus précises et plus
différentielles, nous citerons dans ce contexte, le dosage des acides
aminés essentiels, des vitamines et des facteurs antinutritionnels
(tanins, alcaloïdes, saponines) pour une estimation plus précise de
l'énergie nette.
* Un essai sur animaux et détermination de
l'ingestibilité et de la digestibilité in
vivo.
L'Algérie n'a pas le choix quant à la
récupération des sous produits, tant que la production
fourragère n'a pas eu une véritable exécution, et bien que
le pays se prêt bien à la culture d'arganier, et dans un prochain
avenir, on y développera l'extraction de l'huile d'argan, ce jour
là l'utilisation en alimentation animale de ses sous produits aura une
extension importante.
LES REFERENCES BIBLIOGRAPHIQUES
ADEM. R, FERRAH A. 2002. Les ressources
fourragères en Algérie. [
www.gredaal.com] consulté le
: 11/06/2009.
ADEME. 2000. Les coproduits d'origine
végétale des industries agroalimentaires, Ademe Editions, 76 p in
[
http://coproduits.blogspot.com/2007/05/dfinition-dun-sous-produit.html].
consulté le1 1/05/2009.
AMRANI. O. 2006. Valeur nutritive du chardon
marie silybum marianum(l)Gaerthen « Tawra ». Thèse
magister Agro. univ BATNA. 81 p.
ANDERIEU. J. DEMARQUILLY. C. 1981. Panorama des
méthodes de prévision de la digestibilité et de la valeur
énergétique des fourrages, prévision de la valeur nutritve
des aliments des ruminants, Ed INRA publication, paris, pp41-56
ANONYME. 1995. les produits de l'arganier.
Al biruniya, Rev. Mar.Pharm, tome 11 n°02pp: 120-126.
ANONYME. 2006. L'Arganier, l'huile d'Argan et
ses produits dérivés. Rapport de la coopérative Tidzi
Rabat le: 1-13/01/2006.
ANPCE. 2008. Lettre Bimensuelle N°02.
Alger:15 /04/2008. 04p.
AUFRERE. J.1 982, Etude de la prévision
de la digestibilité des fourrages par une méthode enzymatique.
Ann. Zootech.1982 ,31 (2), 111-130.
BACI. L. 1995. Les contraintes au
développement du secteur des fruits et légumes en Algérie.
Options Méditerranéennes, Série B /
14, 265-277.
BENCHARCHALI. M.1994.contribution a
l'étude de quelques sous -produits agroindustriels. Thèse
magister agronomie univ Blida 107p.
BENDAANOUN, 1998. L'arganier une espèce
fruitière forestière à usage multiple. Ed pierre Mardaga
Belgique 11 p.
BENHAMMOU. B. 2007. Problématique de la
conservation et du développement de l'arganeraie. Colloque
international Rabat : 27-28 avril 2007.
BENZYAN.M. 1995. Le rôle de l'arganier
socio-economique et environnemental de l'arganier. Ministère de
l'agriculture. RABAT, 21p.
BOUDJELTIA. F. 1997. Essai de
prévision de la valeur alimentaire du sous produit de la transformation
de la tomate industrielle par des équations d'INRA. Thèse Ing
Agro INES Chlef. 74p.
BOUDOUMA. D, 2005. Introduction du son de
blé dur dans 'alimentation de dindonneaux en croissance.
Sixièmes Journées de la Recherche Avicole. St
Malo : 30 et 31 mars 2005. pp282-286.
CHEHMA. A. et LONGO.H.F.2001. Valorisation des
Sous-produits du Palmier Dattier en Vue de leur Utilisation en Alimentation du
Bétail. Rev. Energ. Ren. : Production et Valorisation -
Biomasse, 02 : 59-64.
CHENOST. M, 1991. Utilisation digestive des
pailles. Options Méditerranéennes - Série
Séminaires N° 16 : 67-72.
CHERROUF. Z, GUILLAUME.D.1998. Ethnoeconomical,
ethnomedical,and phytochemical study of argania spinosa (l) skeels.
ELSEIVER 11: 42-52
CHERROUF.Z, GUILLAUME. D. 2007. Huile d'argan
une production devenue adulte. Les technologies de laboratoire
n°6 Septembre - Octobre 2007.
CHERROUF.Z. 2001 .Valorisation de l'arganier :
résultats et perspectives. Actes du 5e colloque produits naturels
d'origine végétale (Québec 7-9 août 2001).
Université du Québec, Chicoutimi, Québec pp : 261-270.
CHERROUF.Z, 1995, Valorisation des sous produits
de l'arganier. Actes des Journées d'étude sur
l'Arganier. Essaouira : 29-30 Septembre, in [
http://users.casanet.net.ma/arganier/journees_etude/valprodo.htm]
consulté le : 17/06/2009 CHERROUF. Z. 2002L'huile
d'argan, une prodigieuse vitalité née au bord du désert.
Espérance Médicale Tome 9 N° 87.
CIRAD-EMVT. Mars 2003. Techniques d'analyses des
aliments pour animaux. Ed campus international de Baillarguet. Montpellier pp :
10-17. 81p
CNA. 2008. Synthèse conclusive et
recommandations des travaux. Quatrièmes journées
d'études Parlementaires Sur La défense nationale « La
défense économique », Alger : 07-08 juin 2008. 09p.
DACCORD. R. 1999: Digestion chez les ruminants
et digestibilité des fourrages in INWETHZ, le 13 mai 2005.
DALILA. B. 2008.L'OAIC instruit d'importer 300
000 tonnes d'orge. LE MAGHREB le 15/08/2008 p7.
DAVID. L. 2004. Argan oil: Implications as a
Geographical Indication. TED Case Studies: An Online
Journal [
http://www
.american.edu/TED/class/al l.htm], consulté le: 25/04/2009.
DEBBOU. B, CHOUANA.T. 2003. Extraction et
caractérisation biochimique de l'huile d'argan (Argania spi noza L.
Skeels). Thèse Ing Technologie alimentaire INA. 83p.
DIRK. E. 1998, Argan (Argania
spinosa) in the New Crops LISTSERV 10: pp12-15.
EL AICH. A, EL ASSOULI. N, FATHI. A, MORAND-FEHR,
BOURBOUZE.A. 2007. Ingestive behavior of goats grazi ng in the South
western Argan (Argania spinosa) forest of Morocco. Small Ruminant
Research 70: 248-256.
JARRIGE. R. 1980. Chemical method for predicting
the energy and protein value of forager. Ann. Zootech, 29: 299-323.
JOUANY.J.P.1 994. les fermentations dans le
rumen et leurs optimisation.
Prod. Anim 7(3) :207-225.
GAUTIER. A, RENAULT. P, PELLERIN. F. 1991. Fiche
technique d'analyse bromatologique. Société d'édition
d'enseignement supérieur 5eme édition. Paris.
GETACHEW. G, EDWARD J. D, ROBINSON P. H. 2004.In vitro gas
production provides effective method for assessing ruminant feeds.
California agriculture, vol 58, N°1p 54-58.
GILLES. P, FLORENCE. H, CHARROUF. Z. 2007.
Activité cosmétologique de l'huile d'argan et des
dérivés de l'arganier. Colloque international Rabat :
27-28 avril 2007. KHAZAAL. K. 1995. The in vitro gas
production technique. Ed the international feed resources unit, Aberdeen,
Scotland, UK. 6p.
KITTY.M. 2004. Come to see my goats. saudi
aramco world 55 (5) : 12-15.
LECOQ. R. 1 965.Manuel
d'analyses alimentaires tome II. Ed Dion Paris pp161 6-1621
LOUSSERT, R.; BROUSSE, G. 1978. L'olivier.
Editions GP Maisonneuve et Larose. 464p. LUIS B. R, STEÄPHANE. Q,
PATRICK. P, CHERROUF.Z. 2005. Colorimetric Evaluation of Phenolic
Content and GC-MS Characterization of Phenolic Composition of Alimentary and
Cosmetic Argan Oil and Press Cake J. Agric. Food Chem 53: 9122-
9127. LOWE.SE, THEODORO.M.K,
TRINCI. A. P. J, HESPELL. R. B. 1985. Growth of anaerobic rumen fungi
on defined and semi defined media lacking rumen fluid. J. GEN.
Microbial 131: 2225_2229.
0 f $0 (' uif . 2008. Tipaza : Les champs de
tomates détruits par un parasite. ELWATAN p12 le: 19/08/2008.
M'HIRIT. O, BENZYANE. M, BENCHEKROUNE. F, ELYOUSFI. S. M
et MABJEESH. S. J., COHEN.M et ARIELI.A. 2000. In Vitro Methods for
Measuring the Dry Matter Digestibility of Ruminant Feedstuffs: Comparison of
Methods and Inoculums Source. Journal of Dairy Science. Vol.
83, N° 10: 2289-2294.
MADANI .T, MOUFFOK. C, FRIOUI.M. 2004. Effet du
niveau de concentré dans la ration sur la rentabilité de la
production laitière en situation semi-aride algérienne. Renc.
Rech. Ruminants., 11, p244.
MANGNIER. L.1990. utilisation des sous produits
de la vigne dans l'alimentation animale. Thèse magister INA
El-Harrach.73p.
McDOUGALL. E. I. 1947. Studies on Ruminant
Saliva. BIO CHEMICAL JOURNAL vol 43, n°
01: 99-109.
MILAGH.M. 2007. L'arbre vert du désert
menacé. El Watan : Jeudi 23 août 2007 p21.
MORAND-FEHR, R.1981 .les lipides dans les aliments
concentrés pour ruminants : in prévision de la valeur
nutritive des aliments des ruminants. Ed. INRA publications, Versailles.
pp: 297-305.
MORRISON. I. M, 1976. New laboratory methods for
predicting what the nutritive value of forage crops. World Rev Animal Prod.
12: 75-80.
MORSLI. A. 1999. Etude de la vitro propagation
de l'arganier (Argania spinosa L. skeels) vis-à-vis le
microbouturage. Thèse magister INA El Harrach 68p.
NEDJRAOUI, D. 2001 .profil fourrager.
Ministère de l'agriculture et du développement rural de
l'Algérie. p 36.
NIELSEN. S. S. 1997.Food Analysis Laboratory
Manual. Edition Kluwer Academic Plenum Publishers. New York. USA.
NOURA. 2001. Etude de la valeur alimentaire de
onze pailles de blé récoltés et traités en
Algérie : essai de prévision par la méthode de gaz test.
Thèse Magister INA El Harrach 59p. PAMUNGKAS. D, SEVILLA
C.C. 2005.The in sacco feed dry matter degradability of inoculated
sheep's rumen derived from rumen content of goat. Seminar nasional
teknologi peternakan dan veteriner, pp467- 472.
RADI.N. 2003. L'arganier : arbre du sud-ouest
marocain, en péril, à protéger. Thèse doctorat.
Pharmacie. Univ de NANTES, 59p.
RAHMANI. M. 2005. Composition chimique de
l'huile d'Argan « vierge ». Cahiers Agricultures, 14
(5) : 461-465.
RENE. S. 1991. Problèmes
généraux de l'utilisation des sous-produits agro-industriels en
alimentation animale dans la région méditerranéenne.
Options Méditerranéennes - Série séminaires
16 : 75-79.
ROUCHOU, N. 2009. L'évaluation des
performances techno-économiques de la production laitière dans
quelques exploitations dans la wilaya d'AIN DEFLA. Thèse Ing Agro.UHBC
Chlef. 75p
ROUINA.A.D. 1986. Intérêts des sous
produits de l'oléiculture en alimentation animale. Ed OPU Alger, 55
p.
SADDEK. A, MOHAMED. S,
LYAMINE. M, ALI. T. 2008. Etude de la
Complémentation des Pailles Traitées à L'ammoniac (PNH3)
avec les pulpes de tomates en vue de réduire la dépendance
alimentaire des ruminants domestiques en Algérie. European Journal
of Scientific Research vol 22 N° 02 pp: 168-176.
SAUVANT.D, 1981. Valeur
énergétique des concentrés in prévision de la
valeur nutritive des aliments des ruminants. Ed. INRA publications,
Versailles. pp :238-258.
SOOFI R., FAHEY G. C, BERGER L. L ET HINDS F. C.
1982. Digestibilities and Nutrient Intakes by Sheep Fed Mixtures of Soybean
Stover and Alfalfa. J Anim Sci 54:841 - 848.
TISSERAND. J. L. 1991 Présentation des
Tables de la valeur alimentaire pour les ruminants des fourrages et
sous-produits d'origine méditerranéenne. Options
Méditerranéennes - Série Séminaires
N°16: 23-25.
TRIKI. S, CHABACA. R,
BENMESSAOUD. N, FRIOUI. M, TIKIALINE.
H.2008. Diversité des systèmes d'élevage ovin et
stratégie d'amélioration de l'alimentation par l'utilisation des
sous produits agricoles et agro-alimentaires in [
http://www.ina.dz] consulté le
17/06/2009.
VERITE. R ET SAUVANT. D.1981. valeur
azotée des concentrés in prévision de la valeur
nutritive des aliments des ruminants. Ed. INRA publications, Versailles.
pp :279-296.
ZAIDI. F, HASSISSENE. N, BOUBEKEUR. N, BOUAICHE. A ,
BOUABDELLAH. A, GRONGNET. J F, BELLAL. M. M ET YOUYOU. A. 2007. Etude
in vitro de facteurs limitant la valeur nutritive du grignon d'olive:
effets des matières grasses et des métabolites secondaires.
Lives tock Research for Rural Development, 20 (3) in [
http://www.lrrd.org], consulté
le 07/05/2009.
I. Préparation des échantillons 1.1
Broyage des échantillons

01 02
Figure 01: pulpe broyée (01) et feuilles
broyées (02).
II. Préparation de milieu de LOWE
Tableau I: Préparation du milieu de
LOWE.
|
Les éléments
|
pour1000ml
|
pour 1500ml
|
pour 2000ml
|
|
KCl
|
0.6g
|
0.9g
|
1 .2g
|
|
NaCl
|
0.6g
|
0.9g
|
1.2g
|
|
MgSo4
|
0.5g
|
0.75g
|
1g
|
|
NH4Cl
|
0.6g
|
0.9g
|
1.2g
|
|
CaCl2
|
0.1g
|
0.15g
|
0.2g
|
|
Solution d'oligo-éléments
|
10ml
|
15ml
|
20ml
|
|
Résazurine a 0.1%
|
1ml
|
1.5ml
|
2ml
|
|
Eau distillée
|
960ml
|
1440ml
|
1920ml
|
|
PH 7.5 avec KoH 1M
|
|
KH2Po4
|
0.68g 0.3
|
1.02g
|
1.36g
|
|
Na2Co3
|
0.4g
|
0.6g
|
0.8g
|
|
Porter à ébullition puis laissé
refroidir (couvrir de papier aluminium)
|
|
Mettre sous CO2 et attendre que cela
refroidisse
|
|
NaHCo3
|
6g
|
9g
|
12g
|
|
Cystéine HCL
|
1g
|
1 .5g
|
2g
|
|
Placer le milieu sous courant de CO2 jusqu'à sa
décoloration
|
(LOWE et al, 1985)
III. Analyse des échantillons 3.1 MS

105°C
Figure 02 : Séchage des
échantillons à l'étuve.
3.2 MM

550°C
Figure 03 : Incinération des
échantillons dans le four.
3.3 CB

Fi
Figure 04: Centrifugation après hydrolyse
acide.

Figure 05 : filtration après hydrolyse
alcaline.
3.4 MG

01
02
Fig 06 : Extraction de MG par soxhlet (01) et
évaporation du solvant par rotavapor(02).
3.5 MAT

01
02
Figure 07: Dosage de l'azote par
minéralisation(01), et distillation par BUCHI (02).
3.6 ST

Figure 08 : spectrophotomètre UV-V
utilisé pour lire l'absorbance.

Figure 09 : Dispositif de fermentation.
Figure 10 : Gaz produit dans une seringue.
45
IV. Fermentation des échantillons
I. Les méthodes d'analyses chimiques
Les méthodes de dosage de la MS, M M , MG, CB sont
tirées d'une publication de : CI RA D-EMVT, Mars 2003.
1.1 Dosage de la matière sèche
(MS)
Mode opératoire :
Dans une capsule en porcelaine séchée et
tarée au préalable, introduire 2 à 5 grammes de
l'échantillon à analyser. Porter la capsule dans une étuve
à air réglée à 105°c #177;2°c, laisser
durant 24 heures.
Refroidir au déssiateur, peser, remettre 1 heure, 3heures
à l'étuve et procéder à une nouvelle pesée.
Jusqu'à un poids constant.
La teneur en matière sèche est calculée par
la relation suivante :
* 100
MS % =y
x
x: Poids de la prise d'essai.
y: Poids de l'échantillon après
déssication.
1.2 Dosage des matières minérales
(MM)
Mode opératoire :
Porter au four à moufle la capsule plus le résidu
qui a servi à la détermination de la MS.
Chauffer progressivement afin d'obtenir une carbonisation sans
inflammation de la masse :
1 heure 30 mn à 200°c.
2 heures 30mn à 500°c.
L'incinération doit être poursuivie
jusqu'à combustion totale de charbon formé et obtention d'un
résidu blanc ou gris clair. Refroidir au déssiateur la capsule
contenant le résidu de l'incinération, et peser.
|
teneur en MM % MS =
x: Poids des cendres.
y: Poids de la prise d'essai.
|
x * 100
|
|
y * MS
|
1.3 Dosage des matières grasses (MG) Mode
opératoire :
Peser 3 à 5 grammes de l'échantillon à
analyser, mettre dans une cartouche de
soxhlet. Peser le ballon de soxhlet sec (ballon de 250 ml).
Placer la cartouche dans un dans l'extracteur de soxhlet, monter le ballon sur
l'extracteur, monter lui-même par un réfrigérant. Verser 1
volume et 1/2 de solvant dans l'extracteur.
Extraire pendant 6 à 8 heures. A la fin de l'extraction,
siphonner le solvant restant dans l'extracteur dans le ballon.
Faire évaporer à l'aide d'un rotavapor rotatif
jusqu'à sec (la température d'évaporation varie selon le
solvant utilisé).placer le ballon et le résidu à
l'étuve à 102°c
pendant 3 heures. Laisser refroidir au déssiateur, puis
peser.
teneur en MG % MS =
* 100
z * MS
x -- y) * 100
x: Poids du ballon + résidu après 3 heures
à l'étuve.
y: Poids du ballon vide.
z: Poids de la prise d'essai.
1.4 Dosage de la cellulose brute (CB)
Mode opératoire :
Hydrolyse acide: introduire 1 à 2 grammes de
l'échantillon dans un ballon de 750 ml. Ajouter 200 ml d'acide
sulfurique à 12,5 g/l , préalablement porté à
l'ébullition. Adapter le réfrigérant, porter rapidement
à l'ébullition. Maintenir celle-ci exactement pendant 30 minutes
en agitant le ballon, toutes les 5 minutes, par mouvement rotatoire de
façon à remettre en contact avec le liquide les particules
collées sur la paroi du ballon. Laisser décanter quelques
minutes.
Transvaser quantitativement le liquide dans des tubes à
centrifuger en évitant d'entrainer la fraction insoluble. Centrifuger
jusqu'à ce que le liquide surnageant le culot soit parfaitement clair.
Eliminer la solution par décantation sans entrainer la fraction
insoluble. Laver le résidu du ballon et celui des tubes
avec de l'eau distillée bouillante en s'aidant de la centrifugation
jusqu'ace que l'eau de lavage soit neutre.
Hydrolyse alcaline : introduire les résidus insolubles
des tubes dans le ballon qui a
servi à effectuer l'hydrolyse acide. Ajouter 200 ml de
soude 12,5 g/l, préalablement porté à l'ébullition.
Faire bouillir durant 30 minutes avec agitation toutes les 5 minutes.
Ensuite filtrer sur creuset en silice, préalablement
pesée. Lavé avec de l'eau distillée bouillante. Passer le
creuset + résidu à l'étuve à 105°c
jusqu'à poids constant, effectuer les pesées après
refroidissement au déssiateur, puis incinérer au four à
moufle à 400°c durant 5 heures, refroidir et peser
à nouveau.
Teneur en CB % MS = (x-y)*100* 100
Z*MS
x: Poids du creuset + résidu après
déssication
y: Poids du creuset + résidu après
incinération Z: Poids de la prise d'essai.
1.5 Dosage des matières azotées totales
(MAT)
Mode opératoire :
Minéralisation : introduire 0,5 à 2 grammes de
l'échantillon dans un matras sec. Ajouter 2 grammes de catalyseur (250 g
de K2SO4 ; 250 g de Cu SO4 et 5 g de Se), et 20 ml H2SO4 pur (d = 1,84). Porter
le matras sur le support d'attaque et poursuivre le chauffage jusqu'à
décoloration du liquide ou l'obtention d'une coloration verte stable.
Laisser refroidir, puis ajouter peu à peu, avec
précaution l'eau distillée jusqu'a 200 ml, en refroidissant sous
un courant d'eau. Laisser refroidir complètement.
Distillation : transvaser 10 à 50 ml du contenu du matras
dans l'appareil distillatoire (Büchi) avec quelques gouttes de
phénolphtaléine. Dans un bécher destiné à
recueillir le distillat, introduire 20 ml de l'indicateur composé de
:
Pour 1 litre :
20 g d'acide borique.
200 ml d'éthanol.
10 ml d'indicateur contenant :
1/4 de rouge de méthyle à 0,2% dans l'alcool
95°
3/4 de vert de bromocrésol 0,1% dans l'alcool 95°
Verser lentement dans le matras de Büchi lessive de soude (d
= 1,33) jusqu'à apparition d'une couleur rose, mettre l'appareil en
marche jusqu'à obtention d'un volume de 100 ml au moins.
Titrer par l'acide sulfurique N/20 ou N/50 jusqu'à virage
de couleur. 1 ml d' H2SO4 à 1N correspond 0,014 g d'N.
1 ml d' H2SO4 à N/20 correspond 0,0007 g d'N.
100 200
N (g) = x * 0.0007 * y * Z
Teneur en MAT % MS = N (g) * 6,25
x: Descente de burette (ml).
y: Poids de prise d'essai.
z: Volume transvasé au Büchi (ml).
(Lecoq. R, 1965).
1.6 Dosage des sucres totaux
Mode opératoire :
Peser 10 grammes de l'échantillon dans un bécher de
500 ml et additionner 400 ml d'eau distillée, et 3 grammes de
l'acétate de sodium pour neutraliser l'acidité. Porter à
ébullition en agitant, pendant 30 mn.
Transvaser, après ébullition la solution dans une
fiole de 1 litre. Additionner des petites quantités d'acétate de
plomb à 10% tout en agitant jusqu'apparition d'un
précipité qui se dépose au fond de la fiole. Ensuite
ajouter l'eau distillée dans la fiole jusqu'à trait de jauge, et
procéder à la filtration.
Additionner au filtrat une petite quantité d'oxalate de
potassium ou carbonate de sodium déshydraté pour
précipiter l'acétate de plomb. Filtrer la solution pour
éliminer le plomb précipité.
Vérifier la présence de plomb dans la solution en
ajoutant une petite quantité d'oxalate de potassium à une partie
de solution contenue dans un tube à essai. Si le précipité
apparait, continuez à ajouter l'oxalate de potassium jusqu'à la
disparition de tous les ions de plomb.
Dosage :
Prendre 5 ml du filtrat, les faire diluer dans 50 ml de l'eau
distillée, et à partir de cette solution prendre 1 ml et faire
introduire dans un tube à essai, ajouter 1 ml de la solution de
phénol à 5%, agiter énergiquement puis verser 5 ml de
l'acide sulfurique concentré, agiter, laisser refroidir à
l'obscurité pendant 30mn, lire la densité optique à 490
nm.
Préparation de la courbe d'étalonnage :
Dissoudre 100 mg de glucose dans 100 ml de l'eau
distillée.
Prendre de la solution précédente 4 ml et
compléter à 50 ml.
Préparer une série de tubes à essai dans
lesquels on verse 0 ,1 m.....0,9 ml à partir de la solution fille
(4/50).
Compléter les tubes à 1 ml avec de l'eau
distillée, ajouter 1 ml de phénol 5 % à
tous les tubes à essai ; et agiter. Verser 5 ml de l'acide
sulfurique dans chaque tube,
laisser refroidir dans la température de la salle pendant
30 mn, et à l'obscurité. Lire la densité optique à
490 nm.
Le tableau suivant montre le contenu de chaque tube.
Tableau I I : préparation de la courbe
d'étalonnage.
|
Tubes
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
S. de glucose (ml)
|
0
|
0,1
|
0,2
|
0,3
|
0,4
|
0,5
|
0,6
|
0,7
|
0,8
|
0,9
|
|
Eau distillée (ml)
|
1
|
0,9
|
0,8
|
0,7
|
0,6
|
0,5
|
0,4
|
0,3
|
0,2
|
0,1
|
|
Phénol (ml)
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
1
|
|
AC.
|
5
|
5
|
5
|
5
|
5
|
5
|
5
|
5
|
5
|
5
|
|
Sulfurique(ml)
|
|
|
|
|
|
|
|
|
|
|
|
Concentration ug/2ml
|
0
|
8
|
16
|
24
|
32
|
40
|
48
|
56
|
64
|
72
|
(NIELSEN.S.S, 1997)
II. Résultats
2.1 Résultats d'analyses de : MS et MM
Tableau III : Teneur de la pulpe en MS et MM
dans différents essais.
|
N°
|
P0.Ech
|
P24h. Ech
|
P24h+3h. Ech
|
P24h+3h+1h. Ech
|
MS (%)
|
P four. Ech
|
MM (%)
MS
|
|
01
|
2.24
|
2.00
|
2.91
|
1.91
|
85.41
|
0.18
|
9.42
|
|
02
|
3.00
|
2.60
|
2.57
|
2.56
|
85.41
|
0.25
|
9.76
|
|
03
|
2.74
|
2.40
|
2.33
|
2.33
|
85.40
|
0.22
|
9.44
|
|
04
|
3.22
|
2.95
|
2.76
|
2.75
|
85.42
|
0.28
|
10.18
|
|
05
|
3.08
|
2.75
|
2.64
|
2.63
|
85.40
|
0.27
|
10.26
|
|
06
|
2.08
|
1.90
|
1.77
|
1.77
|
85.42
|
0.16
|
9.03
|
|
07
|
1.93
|
1.69
|
1.65
|
1.64
|
85.39
|
0.14
|
8.53
|
|
08
|
2.19
|
1.89
|
1.88
|
1.87
|
85.43
|
0.17
|
9.09
|
|
09
|
2.54
|
2.23
|
2.19
|
2.16
|
85.41
|
0.19
|
8.79
|
|
10
|
2.59
|
2.30
|
2.20
|
2.21
|
85.42
|
0.22
|
9.95
|
|
MOY
|
-
|
-
|
-
|
-
|
85.41
|
-
|
9.44
|
Tableau IV : Teneur des feuilles en MS et MM
dans différents essais.
|
N°
|
P0.Ech
|
P24h. Ech
|
P24h+3h. Ech
|
P24h+3h+1h. Ech
|
MS (%)
|
P four. Ech
|
MM (%)
MS
|
|
01
|
1.500
|
1.289
|
1.285
|
1.283
|
85.53
|
0.10
|
7.79
|
|
02
|
1.500
|
1.290
|
1.285
|
1.284
|
85.60
|
0.10
|
7.79
|
|
03
|
1.500
|
1.289
|
1.284
|
1.283
|
85.53
|
0.10
|
7.79
|
|
04
|
1.500
|
1.290
|
1.284
|
1.285
|
85.66
|
0.10
|
7.79
|
|
05
|
1.500
|
1.285
|
1.283
|
1.282
|
85.46
|
0.10
|
7.79
|
|
06
|
1.000
|
0.859
|
0.858
|
0.856
|
85.16
|
0.07
|
8.17
|
|
07
|
1.000
|
0.858
|
0.857
|
0.857
|
85.70
|
0.07
|
8.17
|
|
08
|
1.000
|
0.861
|
0.855
|
0.855
|
85.50
|
0.07
|
9.41
|
|
09
|
1.000
|
0.860
|
0.853
|
0.853
|
85.30
|
0.08
|
8.17
|
|
10
|
1.000
|
0.865
|
0.861
|
0.859
|
85.90
|
0.07
|
8.17
|
|
MOY
|
-
|
-
|
-
|
-
|
85. 56
|
-
|
8.07
|
P0. Ech : poids de l'échantillon de départ (g).
P24h. Ech: poids de l'échantillon après 24h de
séchage à l'étuve(g).
P24h+3h. Ech: poids de l'échantillon après 24h + 3h
de séchage à l'étuve(g). P24h+3h+1h. Ech: poids de
l'échantillon après 24h + 3h + 1h de séchage à
l'étuve(g). P four. Ech : poids de l'échantillon
après incinération au four(g).
2.2 Résultats d'analyse de: MG
Tableau V : Teneur de la pulpe en MG dans
différents essais.
|
N°
|
Prise d'essai (g)
|
MG (g)
|
MG (%)
|
|
01
|
03
|
0.25
|
9.75
|
|
02
|
03
|
0.20
|
7.80
|
|
03
|
03
|
0.23
|
8.97
|
MG pulpe % MS = 8.84 %
Tableau VI : Teneur des feuilles en MG dans
différents essais.
|
N°
|
Prise d'essai (g)
|
MG (g)
|
MG (%)
|
|
01
|
03
|
0.07
|
2.72
|
|
02
|
03
|
0.1
|
3.89
|
|
03
|
03
|
0.09
|
3.50
|
MG feuilles % MS = 3.37 %
2.3 Résultats d'analyse de: CB
Tableau VII : Teneur de la pulpe en CB dans
différents essais.
|
N°
|
Prise d'essai (g)
|
CB (g)
|
CB (%)
|
|
01
|
01
|
0.075
|
8.78
|
|
02
|
01
|
0.071
|
8.31
|
|
03
|
01
|
0.081
|
9.48
|
CB pulpe % MS = 8.85 %
Tableau VIII : Teneur des feuilles en CB dans
différents essais.
|
N°
|
Prise d'essai (g)
|
CB (g)
|
CB (%)
|
|
01
|
01
|
0.048
|
5.61
|
|
02
|
01
|
0.055
|
6.42
|
|
03
|
01
|
0.049
|
5.72
|
CB feuilles % MS = 5.91 %
2.4 Résultats d'analyse de: MAT
Tableau IX : Teneur de la pulpe en MAT dans
différents essais.
|
N°
|
Volume H2SO4 0.05N (ml)
|
MAT
%
|
|
01
|
2.3
|
4.8
|
|
02
|
2.3
|
4.8
|
|
03
|
2.2
|
4.59
|
MAT pulpe % MS = 4.74 %
Tableau X : Teneur des feuilles en MAT dans
différents essais.
|
N°
|
Volume H2SO4 0.05N (ml)
|
MAT
%
|
|
01
|
5.7
|
12.46
|
|
02
|
5.7
|
12.46
|
|
03
|
5.7
|
12.46
|
MAT feuilles % MS = 12.46 %
2.5 Résultats d'analyse de: ST
0,8
0,6
0,4
0,2
1,4
1,2
0
1
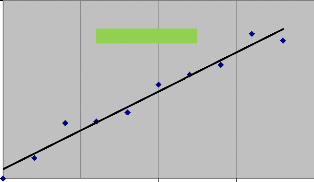
y = 0,0153x + 0,0722
0 20 40 60 80
teneur en glucose (ug/2ml)
Figure 11 : La courbe d'étalonnage de
glucose à 490nm.
Tableau XI : Teneur de la pulpe en ST dans
différents essais.
|
N°
|
Absorbance à 490 nm
|
ST (%)
|
|
01
|
0.341
|
14.99%
|
|
02
|
0.346
|
15.27%
|
|
03
|
0.354
|
15.72%
|
ST pulpe % MS = 15.32 %
Tableau XII : Teneur des feuilles en ST dans
différents essais.
|
N°
|
Absorbance à 490 nm
|
ST (%)
|
|
01
|
0.110
|
2.11 %
|
|
02
|
0.115
|
2. 16 %
|
|
03
|
0.119
|
2.61 %
|
ST feuilles % MS = 02.30 %
Tableau XIII : Teneur des sous produits en CB,
MAT et MG par rapport à la
MO.
|
composant Ech
|
MO
(%MS)
|
MG
|
MAT
|
CB
|
ST
|
|
pulpe
|
90,56%
|
9.37%
|
5.02%
|
9.38%
|
16,24%
|
|
feuilles
|
91,96%
|
3.62%
|
13,39%
|
6.35%
|
2.47%
|
2.6 Résultats de fermentation par « par gaz
test ».
Tableau IVX : Résultats des
différents essais de fermentation de la pulpe et des feuilles.
|
Temps Ech
|
0 - 4 h
|
4 -8 h
|
8 - 12 h
|
12 - 24
h
|
24 - 36
h
|
36 - 48
h
|
48 - 72
h
|
72 - 96
h
|
|
Blanc 1
|
73
|
85
|
40
|
86
|
36
|
15
|
00
|
00
|
|
F 1
|
145
|
147
|
82
|
125
|
83
|
59
|
32
|
18
|
|
F 2
|
140
|
143
|
80
|
126
|
85
|
57
|
34
|
16
|
|
F 3
|
147
|
142
|
82
|
125
|
82
|
60
|
32
|
19
|
|
P 1
|
133
|
135
|
93
|
126
|
62
|
31
|
22
|
07
|
|
P 2
|
137
|
139
|
99
|
120
|
60
|
28
|
19
|
05
|
|
P 3
|
141
|
142
|
94
|
123
|
61
|
29
|
21
|
05
|
|
Blanc 2
|
80
|
83
|
50
|
72
|
50
|
40
|
20
|
00
|
|
F 1
|
150
|
151
|
105
|
118
|
99
|
83
|
50
|
10
|
|
F 2
|
151
|
151
|
95
|
116
|
96
|
84
|
53
|
12
|
|
F 3
|
153
|
150
|
93
|
118
|
96
|
82
|
51
|
14
|
|
P 1
|
137
|
139
|
103
|
108
|
75
|
55
|
41
|
03
|
|
P 2
|
135
|
138
|
102
|
108
|
73
|
55
|
42
|
04
|
| 


