
République Algérienne Démocratique Et
Populaire.
Ministère de l'enseignent supérieur et de la
recherche scientifique.
Université Mentouri
Constantine.
Faculté des sciences de la nature et de la
vie.
Département De Biologie Animale.
Mémoire de fin d'étude
En vue de l'obtention du diplôme DES en Biologie.
Option: Biologie Et Physiologie Animale.
FRACTIONNEMENT DES PROTEINES SERIQUES PAR
THEME:
ELECTROPHORESE SUR GEL POLYACRYLAM IDE.
Présenté par: Encadré par:
Belaouar Hamza. Pr. Douadi Khelifi.
Lamri Adlène.
Promotion: 2008/2009.
Remerciement


A Dieu Le Tout Miséricordieux,
Ton amour, Ta miséricorde et Tes grâces à
mon endroit m'ont fortifiée dans la persévérance et
l'ardeur au travail.
A monsieur le professeur Douadi Khelifi qui nous a fait
l'honneur de bien vouloir diriger ce mémoire, dont l'enthousiasme a
fait
naître ce travail qu'il a continué à
entourer de son attention, qui nous a non seulement permis d'accéder
à le laboratoire de biochimie génétique mais qui nous y a
guidé avec beaucoup de bienveillance, nous exprimons notre très
respectueuse reconnaissance et nous tenons à adresser nos très
sincères remerciements.
A mademoiselle Bellil Inès dont la consciencieuse et
généreuse
participation afavorisé l'orientation de nos
recherches, qui nous a guidées avec la plus grande bienveillance, qui
nous a sans cesse
prodigué ses encouragements et ses judicieux
conseils et qui nous a manifesté toute son attention et sa
bienveillance, nous présentent nos vifs remerciements... nous disons un
chaleureux merci.
Notre gratitude s'adresse aussi à tout l'équipe
du laboratoire de biochimie génétique-Centre de
biotechnologie-Université Mentouri Constantine, où nous
réalisons notre partie expérimental.
Nombreux sont et celles qui, inlassablement pendant ces
années d'étude, nous ont encouragée et aidée
à atteint ce niveau...
Enseignants, enseignantes, amis et collègues nous
exprimons notre gratitude.
...Belaouar Hamza/Lamri Adlène

IV
A ma mère.
A mon père.
A mes soeurs.
A mes proches.
Sans oublier...
Tous mes amis...
Mes collègues...
Tous ce qui est attend
Cet instant de moi...
« A ma soeur Mouna,
...ma cousine Kenza
...qui suivent mes pas »
A l'exception de Mouna et Kenza
Je ne mention pas des noms pour ne pas
favorisé
certains a des autres...ils sont beaucoup.
...Belaouar Hamza.
Le plus beau sentiment c'est le
mystère,
C'est l'origine de l'art et de
science.
Albert Einstein
Remerciement I
Dédicace II
Sommaire 1
Liste des tableaux 5
Liste des figures et des schémas 7
Liste des abréviations 10
Introduction 13
Partie théorique
Synthèse
bibliographique 16
I. Généralité sur les
protéines sériques 17
A. Hétérogénéité 18
1. Hétérogénéité structurale
18
2. Hétérogénéité
fonctionnelle 18
3. Hétérogénéité dans
l'échelle des concentrations 18
B. Valeur sémiologique de la protidémie 18
1. Valeur normale et variation physiologique 18
2. Variation pathologique 18
3. Répercussion de la variation de la protidémie
sur d'autres paramètres biochimiques 19
II. Etude descriptive des principales protéines
sériques 23

Le groupe des Albumines: 24
1. Pré albumine(PA) et Rétinol-binding
protéine(RBP) 24
2. Albumine ou sérumalbumine 26

Le groupe des Globulines: 31
A. Le groupe des ALPHA-1-GLOBULINES 31
1. Alpha-1-antitrypsine (á 1-AT) 31
2. Orosomucoïde ou Alpha-1-glycoprotéine acide 33
3. Alpha-1-foetoprotéine 34
B. Le groupe des ALPHA-2-GLOBULINES 36
1. Haptoglobine (Hp) 36
2. Alpha-2-macroglobuline (á 2M) 38
3. Céruléoplasmine, céruloplasmine (CE R)
39
C. Le groupe des BETA GLOBULINES 42
1. Transferrine (Tf) ou Sidérophiline 42
2. C-réactive protéine (CRP) ou protéine C
réactive 43
3. Fibrinogène (FIB) 44
D. Le groupe GAMMA GLOBULINES 47
1. Définition. 47
2. Propriétés 47
3. Structure générale des immunoglobulines. 48
4. Structure particulière des immunoglobulines 54
5. Les classes et sous-classes d'immunoglobulines. 54
6. Exploration des immunoglobulines sériques. 56
7. Fonctions des immunoglobulines 58
8. principales anomalies des immunoglobulines. 60
III. Etude de quelques syndromes: 67
A. Syndrome de dénutrition. 68
B. Syndrome inflammatoire. 69
C. Syndrome néphrotique. 70
D. Gammapathies. 72
y' Etude détaillé d'un syndrome; le syndrome
inflammatoire. 73
Partie expérimental
Matériels et méthodes 98
Résultats et Discussion 106
Conclusion 112
Références bibliographiques 114
Annexes 118
Résumé 127
Liste des tableaux
Liste des tableaux
Chapitre 1:
1. Classification des protéines sériques en
fonction de leur concentration plasmatique (Tableau 1) P 17.
Chapitre 2:
2. Niveau du risque lié à la variation du CRP
(tableau 2) P43.
3. Tableau comparatif de déficience congénital
(tableau 3) P45.
4. Classes et sous classes des immunoglobulines (tableau 4)
P54.
5. Dysglobulinémies monoclonales (tableau 5) P61.
Chapitre 3:
6. Répartition de la réponse inflammatoire
(tableau6) P78.
7. Variation de la VS (vitesse de sédimentation) du
Fibrinogène selon l'âge et
le sexe (tableau 7) P79.
8. Propriétés biologiques des protéines
inflammatoires (tableau 8) P83.
9. Facteurs susceptibles de modifier le dosage sérique
des protéines de l'inflammation (tableau 9) P85.
Matériels et méthodes:
10. Les échantillons utilisés pour
l'électrophorèse sur gel polyacrylamide (tableau 10) P98.
Liste des figures et des schémas
|
Liste des figures et des schémas
|
8
|
|
Les figures:
Chapitre2:
1. Structure biochimique d'une immunoglobuline (figure 1)
P48.
2. Les différents types des immunoglobulines (figure2)
P48.
3. Organisation en domaine (figure 3) P50.
4. Structure tridimensionnel d'une immunoglobuline (figure 4)
P52.
5. Profil électrophoritique d'un patient atteint le
myélome multiple classique (figure 5) P63.
6. Profil électrophoritique d'un patient atteint le
syndrome MGUS (figure 6) P65.
Chapitre 3:
7. Comparaison entre des profiles nutritionnelles (figure 7)
P68.
8. Electrophorèse des protéines sérique au
cours du syndrome
inflammatoire (figure 8) P69.
9. Electrophorèse des protéines sériques au
cours du syndrome néphrotique (figure 9) P70.
10. Electrophorèse des protéines sériques
d'une personne atteint d'un
Gammapathie (figure10) P71.
11. Phase d'initiation du syndrome inflammatoire (figure 11)
P74.
12. Phase d'amplification du syndrome inflammatoire (pré
activation des cellules inflammatoires) (figure 12) P75.
13. Phase d'amplification du syndrome inflammatoire (activation
des
cellules inflammatoires) (figure 13) P76.
14. Profil protéique des protéines sériques
inflammatoires (figure 14) P91.
15. Profil protéique des protéines sériques
inflammatoires (figure 15) P91.
Matériels et méthodes
1. comparaison entre le résultat de fractionnement sur
gel d'acétate cellulose et sur gel de polyacrylamide (figure 16)
P106.
2. Comparaison entre les résultats de fractionnement sur
gel Acide PAGE,
SDS-PAGE, PAGE (figure 17) P106.
3. variation des bandes protéiques ; malade-malade
(figure 18) P107.
4. variation des bandes protéiques ;
malades-témoins (figure 19) P107.
5. comparaison entre deux profils ; malade-témoin (figure
20) P108.
6. comparaison entre les profils des malades (figure 21)
P109.
7. comparaison entre les profils des témoins (figure 22)
P109.
|
Liste des figures et des schémas
|
9
|
|
Les schémas: Chapitre 2:
1. Mouvement d'eau et des aliments contrôlé par la
Ponc (schéma 1) P26.
Chapitre 3:
2. Mécanisme du système inflammatoire
(schéma 2) P68.
3. La réponse inflammatoire (schéma 3) P77.
|
Liste des abréviations
|
11
|
Abréviations
Les protéines sériques: AFP: Alpha
foetoprotéine. ALB: Albumine.
CER: Céruléoplasmine, céruloplasmine. CRP:
protéine C réactive.
FIB : Fibrinogène.
Hp: Haptoglobine.
Ig : Immunoglobuline.
ORO: Orosomucoïde.
PA: Préalbumine.
RBP : Rétinol binding protein.
Tf: Transferrine.
á1-AT: Alpha-1-antitrypsine.
Á1-GA: Alpha-1-glycoprotéine acide. á2-M:
Alpha-2-macroglobuline.
Les acides amines:
Asp: Asparagine.
Glu: Glutamine.
Leu: Leucine. Lys: Lysine. Val: Valine.
12
Liste des abréviations
Autre abréviation:
APS : Ammonium persulfate. BCG : bromocrésol.
CIVD: coagulation intravasculaire disséminée.
DICS: Déficits immunitaires combinés
sévères.
Hb: Hémoglobine.
IDR: immunodiffusion radiale. IN:
immuno-néphélométrie.
KDa: Kilo Dalton (1KDa=1000Dalton).
MGUS: Gammapathies monoclonales de signification
indéterminée.
NFS: numération formulaire sanguine.
Ponc: Pression oncotique.
PRI- : protéine négative de la réaction
inflammatoire.
PRI+: protéine positive de la réaction
inflammatoire.
RI : Réaction inflammatoire.
SAM : syndrome hémophagocytaire.
SI : Syndrome inflammatoire. TBG: Tyroxine binding globuline.
TBPA: thyroxine binding pré albumine.
VS : Vitesse de sédimentation.
Introduction
14
Introduction
Les protéines sont des grosses molécules non
dialysables de masse moléculaire supérieure à 100000
daltones constituées par un enchaînement d'acides aminés
dans un ordre spécifique qui est différent d'une protéine
à une autre. Ce sont les constituants les plus abondants du plasma et du
sérum. Elles sont surtout des glycoprotéines sauf l'albumine, la
â2 micro globuline, la protéine Creactive.
Les protéines sont les constituants les plus abondants du
plasma et du sérum. Historiquement ont d'abord été
étudiées les protéines totales, puis la
sérumalbumine et la sérum-globuline qui en ont été
séparées.
Les protéines sont en fait présentes dans toutes
les cellules, où elles jouent des rôles très variés
sous formes d'éléments de structures, de molécules
contractiles, d'enzymes,... etc. Les protéines globulaires, parmi
lesquelles figurent les protéines douées d'activités
biologiques, le plus souvent solubles dans l'eau ou dans les solutions salines
diluées, de structure générale sphérique ou
ovoïde. C'est dans cette classe que nous retrouvons les protéines
du sérum, milieu biologique très complexe provenant de la
coagulation du sang extravasé qui renferme une forte quantité de
protéines.
Nous examinerons ici les principales de ces protéines,
classées d'après leur migration électrophorétique.
Leurs rôles biologiques sont très variés et leur dosage
dans le sérum revêt une grande importance en biochimie clinique
où il contribue au diagnostic de nombreuses affections.
La diversité des constituants protéiques du
sérum laisse supposer à juste titre que chacun de ses
éléments joue un rôle spécifique. Cependant, les
principales fonctions physiologiques, dont les protéines sériques
sont responsables, sont assurées par toutes les protéines
ensemble; Fonction de transport, Maintien de la stabilité du volume
sanguin, Maintien du PH sanguin, Action sur la calcémie sanguine,
Protection contre l'hémolyse.
Une protéinémie basse ou élevée ne
permet donc pas de définir un type de pathologie, mais elle est souvent
le point de départ d'investigations plus complètes. Inversement,
une protéinémie dont la valeur reste dans les normes
physiologiques peut masquer une pathologie dont le diagnostic ou le suivi
évolutif ne sera effectué qu'après une exploration des
protéines dites "spécifiques" par différent
méthodes d'exploration.
Les méthodes électrophorétique ; ce sont les
plus importantes actuellement. Elles se fondent sur la charge électrique
des protéines en solution et sur leur mobilité. Le but de notre
travail est basé sur le fractionnement des ces protéines par la
méthode d'électrophorèse sur gel de polyacrylamide.
Synthèse bibliographique
Chapitre 1
Généralités sur les protéines
sériques
|
Chapitre1: Généralité sur les
protéines sériques
|
18
|
|
A. Hétérogénéité:
1. Hétérogénéité
structurale:
Plus de 300 protéines plasmatiques différentes
(isolables à l'électrophorèse en 2D).
2. Hétérogénéité
fonctionnelle:
-Homéostasie corporelle: Pression oncotique, pH,
balance ionique. -Fonctions de transport: hormones, lipides, métaux,
médicament. -Fonctions anti-protéasiques.
-Fonctions hémostatiques.
-Fonctions immunitaires,...
3. Hétérogénéité dans
l'échelle des concentrations:
Il existe de très grandes différences de
concentration entre les protéines plasmatiques (par exemple : entre
sérumalbumine et IgE, il y a une échelle 107). On va
ainsi classer les protéines en fonction de leur concentration
plasmatique:
-protéines prédominantes 10-40g/l Albumine(ALB),
immunoglobuline G (IgG).
|
-protéines majeures
|
1- 1O g/l
|
Fibrinogène (Fib), Transferrine (Tf), IgA, IgM.
|
|
|
-protéines mineures 0,1-1g/l CER, plasminogène.
|
-protéines traces
|
< 0,1g/l
|
CRP, IgE, rétinol binding protein (RBP).
|
Tableau 1: classification des protéines
sériques en fonction de leur concentration plasmatique.
B. VALEUR SEMEIOLOGIQUE DE LA PROTIDEMIE:
1. Valeur normale et variations
physiologiques:
· Valeur normale chez l'adulte : 70g/l (60-80 g/l).
· Variations avec l'âge: dans le sens de
l'hypoprotidémie:
>Prématuré: 40 g/l.
>Nouveau-né: 60 g/l, avec chute à 45-50 g/l au
bout de 4 jours. >Nourrisson (2 ans): 60 g/l.
> Après 70 ans: 65 g/l par diminution de l'albumine
et/ou des Ig.
· grossesse: 60 g/l par hémodilution et diminution
de l'albumine et/ou des Ig.
2. Variations pathologiques:

Les variations absolues :
a) Hyper-protidémies absolues : immunoglobulines et
Fibrinogène:
Les hyper protéinémies sont dues essentiellement
à deux phénomènes
a. L'hémoconcentration.
b. L'hémoconcentration hypergammaglobulinémies.
|
Chapitre1: Généralité sur les
protéines sériques
|
19
|
|
V' par augmentation des Immunoglobulines: Les
hypergammaglobulinémies:
+ hypergammaglobulinémies polyclonales:
Augmentation d'un groupe hétérogène
d'immunoglobulines. Soit en réponse à une stimulation
antigénique.
Soit à la suite d'une multiplication
incontrôlée de plusieurs clones de cellules productrices
d'immunoglobulines.
N'est pas obligatoirement accompagnée d'une augmentation
des protéines totales et se retrouve dans de nombreuses.
+ Les hypergammaglobulinémies
monoclonales:
Dans ces maladies, une bande d'immunoglobuline étroite
et intense, produite par un seul clone de lymphocytes se localise à
l'électrophorèse entre les á-globulines et les â
globulines.
On a appelé ces immunoglobulines anormales,
protéines "M" (M venant de maligne) ou para protéines.
Les paras protéinémies s'accompagnent d'une
augmentation des protéines totales avoisinant ou dépassant 90
g/I. L'identification de la para protéine en cause se fait par
immunochimie Des examens biologiques complémentaires doivent être
effectués, afin de mettre en évidence une éventuelle
protéinurie (en particulier, protéines de BenceJones), une
insuffisance rénale ou une Cryoglobulinémie.
Les principales para protéinémies sont la
maladie de Kahler, la macroglobulinémie de
Waldenström; *la maladie des chaînes lourdes- et la maladie
des chaînes légères D'autres para
protéinémies sont bénignes : on ne trouve dans ces cas
jamais de protéine de Bence-Jones dans les urines et aucun
symptôme clinique et radiologique n'apparaît : elle
représente moins de 1 % des immunoglobulinopathies totales.
V' par augmentation du fibrinogène:
Hyperfibrinogènémie, notamment dans les syndromes
inflammatoires.
b) Hypo-protidémies absolues : Albumine ou des
immunoglobulines.
Les principales causes des hypo protéinémies sont -
un défaut d'apport alimentaire (malnutrition, Kwashiorkor)
(l'albuminémie est alors fortement diminuée) Un défaut de
synthèse lors d'une insuffisance hépatique sévère
(hépatite grave, cirrhose évoluée).
Une fuite anormale rte protéines: hémorragie
massive plasmaphérèse, fuites urinaires (syndrome
néphrotique), déperditions cutanées ou
tissulaires (brûlures, entéropathies,). Les signes cliniques
majeurs de l'hypoprotéinémie sont fonte du tissu musculaire,
d'oedèmes, voire d'ascite, expliqués par une fuite d'eau dans le
compartiment du liquide interstitiel par diminution de la pression oncotique
intravasculaire.
V' par carence d'apport alimentaire en
protéines:
· Malnutrition, déséquilibre en Acides
aminés.
· Syndrome de dénutrition.
· Par malabsorption intestinale (insuffisance
pancréatique):
- une hypo albuminémie.
- une sidéropenie avec élévation de la
capacité totale de saturation de la sidérophiline.
V' par diminution de la synthèse : en cas
d'insuffisance hépatique.
· Anomalies du bilan biologique:
- Diminution de l'albumine (tardive).
- Diminution d'autres protéines: haptoglobine,
transferrine.... V' par catabolisme exagéré dans les
dénutritions sévères.
V' par augmentation des pertes:
> d'origine rénale (syndrome néphrotique). >
d'origine cutanée (brûlures).
> d'origine digestive (entéropathie exsudative).
|
Les variations relatives de la protidémie :
|
Elles sont liées à des modifications dans
l'état d'hydratation du sujet.
a) Hyper-protidémie par hémoconcentration:
Se voit dans les DEC= déshydratation extracellulaire.
b) Hypoprotidémie par hémodilution:
Se voit dans les HEC= hyper hydratation extracellulaire.
3. Répercussion de la variation de la
protidémie sur d'autres paramètres biochimiques:
a) Les relations avec la calcémie:
> Calcium plasmatique:
Le calcium plasmatique existe sous deux formes :
1- calcium non ultra filtrable (lié aux
protéines), 45% : dont (30% lié à
l'Albumine, 10% aux globulines) de la proportion totale du calcium lié
aux protéines plasmatiques.
2- calcium ultra filtrable (non ionisé et
ionisé) ou libre, dont 55% calcium ionisé, 5%
calcium complexé (bicarbonates, citrates,...).
> Variation physiologique:
90 à 100 mg/l = 2,25 à 2,62 mmole/l
· fraction non diffusible liée aux protéines
(albumine: 80%; globuline : 20%).
· fraction diffusible ionisée (Ca ) formant des sels
de phosphates, citrates et bicarbonates.
La forme physiologiquement active est le Ca (ionisé).
L'importance de la partie du calcium lié aux protéines explique
que la calcémie totale soit influencée par la concentration en
protéines du plasma. Le degré de liaison aux protéines et
d'ionisation dépend du Ph du milieu et des autres électrolytes
(bicarbonate, phosphate et magnésium). Ce sont les déviations de
la normale du calcium ionisé qui entraînent les manifestations
cardiaques et neuromusculaires de l'hyper et de l'hypocalcémie.
La calcémie varie avec la protéinémie.
Plasma-Calcium (substc): 2, 20 - 2, 70 mmole/L. Plasma-Calcium
ionisé (substc): 1, 06 - 1, 30 mmole/L.
Il existe un équilibre entre le calcium libre
ionisé et le calcium ionisé fixé sur les protéines
plasmatiques:
[Ca ][Albumine]
= ( [Ca lié à l'Albumine]
> Variation pathologique:
· En cas d'hypoprotidémie:
· Le calcium total : diminue.
· Le calcium libre ionisé : normal.
· En cas d'hyper-albuminémie ; il y un transfert
d'une partie du calcium ionisé vers l'albumine ce qui provoque une
augmentation du calcium lié aux protéines plasmatiques, et par
conséquent diminution du calcium ionisé.
· En cas d'hypo-albuminémie (insuffisance
hépatocellulaire, syndrome néphrotique) ; il y a un effet
inverse.
· La liaison du calcium aux protéines plasmatiques
dépend du pH;
Si pH diminue 4diminution Ca-Protéines 4augmentation Ca
.
|
Chapitre1: Généralité sur les
protéines sériques
|
22
|
|
b) Les relations avec le sodium:
Le sodium plasmatique : Natrémie (Na):
1. Principal cation extracellulaire de
l'organisme:
Représente 95% des cations du LEC, reflet du degré
d'hydratation du LIC
Son abondance dans les liquides extracellulaires et la quasi-
imperméabilité des membranes cellulaires à cet ion lui
confèrent un fort pouvoir osmotique (principal cation contributeur de
l'osmolalité plasmatique).
Rôle central dans l'équilibre
hydro-électrolytique de l'organisme : l'état d'hydratation des
secteurs hydriques, les mouvements d'eau intracellulaire et extracellulaire.
Ses perturbations (dysnatrémies) indiquent souvent une
anomalie initiale du métabolisme hydrique.
2. Valeurs de référence : 135
à 145 mmole/l.
3. Principales perturbations lié aux
protidémie:
a) Hyponatrémies : Na < 135
mmole/l:
> Il existe des pseudo-hyponatrémies
(isotoniques) :
Présence de quantités anormalement
élevées de substances entrainant une réduction du volume
plasmatique (Hyper protéinémies, Hyperlipidémies)
> Hyponatrémies vraies
(hypotoniques):
Avec volume extracellulaire augmenté
(hypervolémique) Signes cliniques et biologiques d'hyperhydratation
extracellulaire par rétention hydrosodée (hypoprotidémie,
état confusionnel, puis coma; hypotonie des globes oculaires, signe du
pli cutané, oedèmes périphériques, HTA, baisse
hématocrite) - insuffisance hépatique avec cirrhose ascitique, -
syndrome néphrotique - insuffisance cardiaque.
b) Hypernatrémies : Natrémie > 145
mmole/L:
Les hyper hydratations intra cellulaires sont dues à des
chutes de l'osmolarité plasmatique soit par:
· Chute du taux de sodium du liquide extra cellulaire. En
ce qui concerne les chutes du taux de sodium, il y a deux cas:
· Soit la perte de sodium: hyponatrémie de
dépression.
· Soit la dilution du sodium: hyponatrémie de
dilution.
· Chute du taux d'urée.
Fausses hyponatrémies = concentrations
élevées de macromolécules (protides, lipides)
|
Chapitre1: Généralité sur les
protéines sériques
|
23
|
|
Remarque:
1-Protidémie et non Protéinémie (plus
rigoureux).
2- La protidémie est la concentration des protides du
plasma (protéines+ AA...).
3- Protidémie plasmatique > Protidémie
sérique.
4- Protidémie plasmatique = Protidémie
sérique + fibrinogène (2 à 4g/1).
Chapitre 2
Etude descriptive des principales protéines
sériques.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
25
|
|
|
LE GROUPE DES ALBUMINES
|
1. Pré albumine (PA) et Rétinol-binding
protein (RBP):
Ce complexe appartient aux fractions protéiques mineures
(<1 % des protéines claires). Il est le plus anodique à
l'électrophorèse (migre le plus vite), que la Pré albumine
soit seule ou complexée à RBP (RBP seule se comporte comme une
á-2 globuline).
a) Propriétés:
> Physico-chimiques:
Ce sont des holoprotéines, c'est-à-dire
constituées uniquement d'acides aminées et sans copule glucidique
(ce ne sont donc pas des glycoprotéines).
Elles sont très riches en tryptophane.
Ce sont des protéines de petite taille : Pré
albumine= 55 kDa et RBP= 21 kDa.
> Métaboliques:
Leur synthèse est hépatique.
Le zinc est indispensable à la synthèse de
rétinol-binding protein(RBP). Leur demi-vie biologique est très
courte, moins à 12 h.
> Biologiques : fonctions de transport
plasmatique:
· La pré-albumine(PA):
Fixation et transport des hormones thyroïdiennes (T3
>T4). On l'appelle alors TBPA (thyroxin binding prealbumin) ou
transthyretine.
· La Rétinol-binding protein(RBP):
Fixe le rétinol (vitamine A).
Se combine au pré albumine dans un rapport
stoechiométrique (1:1).
Le complexe assure la fixation et le transport plasmatique de la
vitamine A.
Le complexe PA-RBP se dissocie en deux composantes quand le
rétinol est capté par les cellules cibles.
b) Valeur sémiologique: > Méthodes de
dosage:
Le dosage se fait par immuno-néphélométrie
(IN) ou par immuno-diffusion radiale (IDR).Ce sont des marqueurs.
26
Chapitre 2 : Etude descriptive des principales
protéines sériques > Valeurs normales et
variations physiologiques:
· Pré albumine(PA): 0.2 à 0.4 g/l
· Rétinol-binding protein(RBP) : 35 à 90
mg/l.
> Variations pathologiques:
>Valeurs 2 fois plus faibles chez l'enfant.
>Pré albumine et Rétinol-binding protein sont
des marqueurs de dénutrition.
- diminution dans les états de malnutrition.
-plus sensibles que l'albumine (ALB) ou la transferrine (Tf).
· Variations de Pré albumine: - Diminution
au cours des:
- états inflammatoires aigus : cette protéine est
donc dite « RI» (protéine de la réaction
inflammatoire).
- néoplasies (cancers).
- hépatopathies atteintes rénales et
digestives.
- Augmentation dans :
- maladie de Hodgkin.
- les traitements hormonaux par corticostéroïdes,
androgènes anabolisants, oestroprogestatifs.
· Variations de la Rétinol-binding protein: -
Diminution au cours des:
- états de malnutrition protéique.
- insuffisances hépatiques (diminution de
synthèse). - carences en zinc.
- carences en vitamine A = avitaminoses A.
- Augmentation dans :
-les néphropathies chroniques (surtout les
protéinuries tubulaires).
27
Chapitre 2 : Etude descriptive des principales
protéines sériques 2. Albumine
(Sérum-albumine) ;(ALB):
C'est la protéine majeure du plasma : 54-65 % (38
à 64 g/l) des protéines totales.
a) Propriétés:
> Physico-chimiques:
C'est une holoprotéine.
Sa taille est relativement faible: 564 acides aminés,
pour une masse moléculaire de 66kDa.
Sa structure est uni peptidique et globulaire (17 ponts
disulfure S-S).
Remarquable stabilité (10h à 60°C).
Richesse en certains acides aminés (Glu (10% des AA),
Asp, Val, Leu, Lys).
Une fonction thiol (sur un résidu cystéine) libre
: fixation possible de différents ligands comme les métaux, les
halogènes, les acides gras, les stéroïdes, les colorants,
les médicaments.
Son pH isométrique est bas: pHi=4,7 ce qui explique
qu'elle migre rapidement à l'électrophorèse.
> Métaboliques:
Sa synthèse est active (10 à 12 g/l),
principalement au niveau du foie.
Son espace de diffusion est le secteur vasculaire (40%) et le
secteur extravasculaire (interstitiel) (60%).
Sa demi-vie biologique est de 15 à 20 jours. Son
catabolisme est effectué dans tous les tissus par pinocytose et
hydrolyse dans les lysosomes (par des enzymes protéolytiques).
Dans l'intestin, il existe un phénomène
physiologique de transsudation : exsudation normale de plasma au niveau de
l'épithélium digestif. Cette exsudation est
exagérée dans l'entéropathie exsudative.
Elle est non filtrée par le rein. Se traduit en
pathologie par une albuminurie. > Biologiques:
· Maintien de la pression oncotique (Ponc) du
plasma.
Ponc : pression osmotique développée par
les protéines,
Ponc=C/M, avec C : concentration et M : masse
moléculaire.
La Ponc développée par la sérumalbumine est
négligeable par rapport à la Ponc

EXOGENES
ENDOGENES
ENDOGENE
Transport de
macro-
molécules
Élimination des
déchets
Régulation thermique
Boissons: 600 à 1200 mL/24h
Aments
Aliments: 1000ml/24h
1000 mL/24h
Produit du métabolisme des substrats:
400
A 500ml/24h
Chapitre 2 : Etude descriptive des principales
protéines sériques
développée par les électrolytes.
MAIS elle a un rôle essentiel dans les échanges
d'eau au niveau des capillaires du réseau vasculaire. Cette Ponc va
permettre le contrôle des échanges d'eau entre secteur vasculaire
et secteur interstitiel.
Mouvements de l'eau:

Sorties
S i
Entrées
Rôles de l'eau
Urines : 1000 à 1500 ml(ajustables)
Ui 1000 à 1500 L bl
|
|
Perspiration : 600 ml
Piti 600 L
|
|
Schéma 1: Mouvement d'eau et des aliments
contrôlé par la Ponc.
PH : pression hydrostatique (liée
à la force de propulsion du sang développée par le
coeur).
PO : pression oncotique du plasma.
Dans les hypo albuminémies, il va y avoir une baisse de
la pression oncotique. Au pôle veineux des capillaires, la Ponc va
être insuffisante par rapport à la Pression hydrostatique pour
assurer le rappel d'eau dans le secteur vasculaire. Il y a donc stase de fluide
interstitiel c'est-à-dire hyper hydratation du secteur interstitiel avec
des oedèmes dans les tissus périphériques.
· Transport plasmatique de ligands variés:
L'albumine est un transporteur non spécifique de ligands.
- D'origine endogène:
- ions organiques ou inorganiques.
- bilirubine (protecteur de la sérumalbumine). -
acides gras non estérifiés (5% des acides gras). - hormones
thyroïdiennes (T3 >T4) et stéroïdes. - glucose.
29
Chapitre 2 : Etude descriptive des principales
protéines sériques
- D'origine exogène:
- médicaments.
- colorants (à l'origine d'une méthode de dosage
cf. plus loin): bleu Evans, vert de bromocrésol : BCG.
- vitamine C, iode...
La fixation aux ligands est en général solide mais
non covalente. Ceci permet à la fixation d'être
réversible.
b) Valeurs sémiologiques:
>
Méthodes de dosage:
· Méthode directe:
>Colorimétrique:
Affinité de l'albumine .Exemple: vert de
bromocrésol (BCG).
>Immunochimique:
Utilisation d'anticorps mono spécifiques anti-albumine en
immuno-néphélométrie et en immuno-diffusion radiale.
· Méthode indirecte par estimation:
Cette méthode est moins spécifique. Il faut
pratiquer deux examens et les combiner pour avoir le résultat:
- électrophorèse des protéines
sériques pour avoir le pourcentage d'albumine parmi celles-ci.
- dosage des protéines totales.
> Valeur normale et variations
physiologiques:
· Valeur normale:
L'albumine représente 55 à 60% des
protéines sériques soit 40-45 g/l. L'albuminémie chez
l'homme est 5% supérieure à celle chez la femme.
Le rapport Albumine/Globuline est normalement de 1/3.
· Variations physiologiques:
- nouveau-né: 30 g/l.
- grossesse: augmentation légère au début,
puis diminution d'environ 25% par hémodilution et stabilisation à
la limite inférieure de la normale.
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
30
|
|
|
- diminution sous oestroprogestatifs.
- sujet âgé après 60 ans: diminution
à 30-35 g/l.
> Variations pathologiques:
· Anomalies acquises:
>Hyper-albuminémies :
Elles se font surtout par hémoconcentration.
> Hypo-albuminémies :
· carence d'apport protéique:
- Carence nutritionnelle: cachexie, cancer.
-Troubles de l'assimilation digestive, malabsorption
intestinale.
· diminution de la synthèse :
-insuffisances hépatocellulaires (IHC). -Hépatite
aiguë grave.
-Cirrhose hépatique décompensée.
· accroissement du catabolisme azoté:
- Lésions tissulaires ou traumatismes chirurgicaux.
- États inflammatoires (l'albumine est également
'PRI').
· augmentation des pertes :
- par voie rénale : glomérulonéphrites,
syndrome néphrotique.
-par voie digestive : entéropathies exsudatives,
mucoviscidose, syndrome coeliaque.
- par voie cutanée : brûlures, eczéma
étendu et suintant.
>Bis-albuminémies transitoires :
-traitement antibiotique intense par les âlactamines
(pénicilline) : c'est alors un de surdosage.
-faux kyste du pancréas fistulisé dans les espaces
interstitiels: le suc pancréatique contenant de la trypsine (enzyme
protéolytique) va digérer en partie l'albumine qui va migrer plus
vite à l'électrophorèse.
? Anomalies génétiques: >An-albuminémie
de Bennhold: rarissime.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
31
|
|
Ces individus sont incapables d'assurer la synthèse
d'albumine. Cette affection est bien tolérée.
A l'électrophorèse pas de pic d'albumine.
> Bis-albuminémie héréditaire:
Il y a coexistence de 2 formes d'albumines différentes (2
gènes différents) dont un est variante pour un acide
aminé. Cette anomalie est découverte à
l'électrophorèse. Elle est sans traduction pathologique et bien
supportée. L'expression des 2 gènes se fait pour 50 % chacun :
expression Co-dominante.
La transmission de cette anomalie se fait sur le mode
autosomique.
32
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
LE GROUPE DES GLOBULINES:
|
A. LE GROUPE DES ALPHA-1-GLOBULINES:
C'est un groupe hétérogène et on y trouve :
á 1 antitrypsine, orosomucoïde, AF1 (á 1
foetoprotéine), anti-chymotrypsine, á 1 lipoprotéine,
prothrombine, transcortine, TBG (thyroxin binding globulin).
Ils sont représentent 1.1 à 3.7 % (0.8 à 2.6
g/l) des protéines totaux.
1) Alpha-1-antitrypsine
(á1-AT):
C'est une protéine positive de la réaction
inflammatoire (elle est PRI+). Elle présente une action
antiprotéasique : elle s'oppose à l'action des protéases
qui sont des enzymes protéolytiques. Un déficit est
associé à des pathologies pulmonaires chez l'adulte et
hépatiques chez l'enfant.
a) propriétés:
> Physico-chimiques:
L' á 1 antitrypsine est le constituant principal des
á 1 globulines : elle en représente 90%.
C'est une protéine de petite taille et sa masse
moléculaire est de 55 kDa. Elle présente une structure
uni-peptidique (une seule chaîne). Son pH isoélectrique (pHi) est
de 4,8 ; elle migre donc vers l'anode à pH alcalin.
C'est une glycoprotéine qui présente 10 à 12
% de glucides. > Métaboliques:
Sa synthèse est hépatique et sa demi-vie biologique
est de 5 jours.
Elle présente un grand polymorphisme
génétique (c'est à dire qu'elle a plusieurs formes
moléculaires). Plusieurs gènes sont impliqués dans sa
biosynthèse : il existe 23 allèles différents soit 23
génotypes différents. Il existe des centaines de
phénotypes différents.
En France, l'allèle le plus courant est l'allèle M
qui à l'état homozygote donne le phénotype normal MM et il
existe de nombreux phénotypes hétérozygotes.
L'allèle Z rare peut donner à l'état
homozygote le phénotype ZZ qui est associé à un
déficit en a 1 antitrypsine (10 à 15% de la valeur normale). La
protéine ne peut exercer son action antiprotéasique.
33
Chapitre 2 : Etude descriptive des principales
protéines sériques > Biologiques:
* Protéine douée d'action
antiprotéasique.
Elle fait partie du système Pi (protéase inhibitor)
qui comporte aussi l'á 1 antichymotrypsine et l'á 2
macroglobuline.
Elle est capable de se lier aux enzymes protéolytiques
pour les inactiver. S'il existe un déficit en á 1 antitrypsine,
les enzymes protéolytiques peuvent dégrader les tissus : cela
explique les pathologies pulmonaires lors du déficit de la
protéine.
* protéine de la réaction inflammatoire.
Elle est PRI+ et participe à la réaction
inflammatoire locale.
b) Valeurs sémiologiques: > Méthodes de
dosage:
On peut faire une appréciation du dosage par l'examen du
profil électrophorétique (si le profil
électrophorétique est vide en á 1, on peut suspecter un
déficit en á1 antitrypsine car elle est majoritaire).
*Le dosage:
> Par méthode indirecte : électrophorèse
+ protéines totales
>par méthode directe:
- mesure du pouvoir antiprotéasique du sérum.
- dosage par méthode immunochimique ((IDR) ou (IN)).
> Valeurs normales et variations
physiologiques:
Les valeurs usuelles se situent entre 0,8 et 2,0 g/l. Cela
augmente pendant la grossesse et lors de la prise d'oestroprogestatifs.
> Variations pathologiques:
- Diminution: le déficit en á1
antitrypsine.
En pathologie pulmonaire : chez un adulte
jeune (30-40 ans).
Hétérozygote Z ? Prédisposé à
la bronchite chronique et à l'emphysème pulmonaire.
Homozygote ZZ : emphysème pulmonaire avec destruction de
la structure des alvéoles pulmonaires (l'attaque protéolytique
n'est pas compensée par le taux d'á1 antitrypsine circulant).
La transmission est autosomique récessive et l'incidence
est de : 1/5000.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
34
|
|
En pathologie hépatique : chez un
enfant en bas âge.
Sujets homozygotes ZZ : cirrhose hépatique infantile
(remaniement fibreux du tissu hépatique). Il y a des dépôts
PAS+ dans les hépatocytes qui sont dus à
l'accumulation de matériel glucidique. En effet la
glycoprotéine á1 antitrypsine s'accumule dans les
hépatocytes mais ne peut aller dans le sérum et ne peut donc pas
être dosée).
La transmission est autosomique récessive.
- Augmentation:
Lors de la phase aiguë de la réaction inflammatoire.
- Marqueur de déperdition protéique
digestive.
2) Orosomucoïde ou á 1 glycoprotéine
acide (á-1GA):
a) Propriétés:
> Physico-chimique:
Protéine à caractère très acide :
pHi=2,5. La migration est rapide vers l'anode mais moins que pour l'albumine,
alors que le pHi de l'orosomucoïde est inférieur, cela veut dire
que la migration électrophorétique ne dépend pas seulement
du pHi mais d'autres facteurs interviennent.
Protéine de faible masse moléculaire : 41 kDa.
C'est une glycoprotéine avec 40% de glucides.
> Métaboliques:
La synthèse et le catabolisme sont hépatiques,
leur demi-vie est 2 à 3 jours. > Biologiques :
(rôle mal connu).
C'est une protéine de la phase aiguë de la
réaction inflammatoire (PRI+) et elle aide au transport plasmatique de
la progestérone et de certains médicaments.
b) Valeurs sémiologiques: > Méthode de
dosage:
Immunochimie (IN et IDR). > Valeur normale:
0,55 à 1,4 g/l.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
35
|
|
> Variations pathologiques:
s Diminution:
-états de malnutrition.
-insuffisances hépatiques sévères. -syndrome
néphrotique.
-entéropathies exsudatives.
s Augmentation:
-réaction inflammatoire aiguë (rhumatisme articulaire
aigu chez l'enfant). -lésions tissulaires (infarctus du myocarde).
- certaines néoplasies malins.
Comme l'orosomucoïde augmente lors de la réaction
inflammatoire et lors de certains cancers, le suivi de cette protéine
est intéressant pour juger de l'efficacité d'une
antibiothérapie anti-inflammatoire ou d'une chimiothérapie
anticancéreuse (si on observe une diminution du taux de la
protéine, cela veut dire que le traitement est efficace).
3) Alpha-1-foetoprotéine:
a) Propriétés:
> Physico-chimique:
Cette glycoprotéine, présente dans le sérum
foetal humain, a un poids moléculaire de l'ordre de 70KDa, et contient
4.3% de glucides.
> Métaboliques:
L'alpha-foeto-protéine (AFP) est synthétisée
par les hépatocytes chez le nouveau- né, et par le corps jaune
pendant la gestation, de même par certaines tumeurs hépatiques ou
digestives ; il constitue donc un marqueur de cancer hépatocellulaire et
digestive.
> Biologiques:
Elle est essentielle au développement normal de l'embryon.
a) Valeurs sémiologiques:
> Dosage:
L'á FP est à un taux maximum de 3mg/ml dans le
sérum du foetus de 13 semaines ; ce taux descend à quelques ug
à la naissance, et à quelques ng chez l'adulte.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
36
|
|
> Valeurs normales et variations physiologiques:
Son taux de référence chez l'adulte est 4,5 - 2,6
mg/l.
Chez la femme enceinte, le taux sérique normal entre la
15è et la 30è semaine est de plusieurs mg/l ; il
s'élève en cas de grossesses multiples mais aussi dans 60% des
cas d'atteinte du tube neural du foetus.
> Variations pathologiques:
La concentration d' á-FP s'élève dans
diverses circonstances pathologiques : - Cancer primitif du foie :
élévation non constante (2/3 des cas).
- Cancer de l'estomac.
- Tératocarcinome testiculaire : élévation
presque constante.
- Hépatites, hépatectomie partielle : rarement.
-Chez le nouveau-né, qui a un ictère, et
où le diagnostic hésite entre une hépatite
néonatale et une atrésie des voies biliaires. Le dosage de l'
á-FP permet de trancher entre une hépatite (á-FP
élevée car cytolyse) et une atrésie (á- FP normale,
pas de cytolyse).
La cause la plus importante est le cancer primitif du foie.
Son dosage permet de surveiller les gens à risque par exemple les
cirrhotiques qui développent souvent des cancers primitifs du foie.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
37
|
|
B. LE GROUPE DES ALPHA-2-GLOBULINES
On y trouve l'haptoglobine, l'á2 macroglobuline, la
céruloplasmine. Ces protéines constituent 8.5 à 15 % (6
à 10 g/l) des protéines sériques. 1) Haptoglobine
(HP):
C'est une protéine de la réaction inflammatoire,
elle est PRI+. Son taux peut s'effondrer au cours des hémolyses
intra-vasculaires.
a) Propriétés:
> Physico-chimiques:
L'haptoglobine (Hp) est une protéine du groupe des
á2 globulines est une glycoprotéine qui comporte 19% de glucides.
Son pHi est de 4,2, il est du à une richesse en acides aminés
acides comme l'acide aspartique et l'acide gluconique et à une richesse
en lysine.
Il existe deux formes possibles pour cette protéine:
1> Forme monomérique : 4 sous unités comprenant
2 chaînes á et 2 chaînes â (á2â2) selon
le schéma á ââá. Il existe 2 variantes pour
á : á1 et á2, d'où 3 phénotypes possibles
:
Hp 1-1: á 1-â -â -á 1 masse
moléculaire = 86 kDa. Hp 2-1 : á 2-â -â -á1
masse moléculaire = 120 kDa. Hp 2-2 : á 2-â -â
-á2 masse moléculaire = 160 kDa.
2 >Forme oligomérique : constituée de
monomères complets ou partiels (masse moléculaire allant de 200
à 400 kDa).
> Métaboliques:
La synthèse est surtout hépatique et la demi-vie
biologique est de 3 à 5 jours. Le catabolisme se fait dans les
hépatocytes et dans les macrophages.
> Biologiques: *Combinaison à
l'hémoglobine:
Le complexe Hb/Hp (hémoglobine/haptoglobine) se fait dans
les proportions stoechiométriques. En cas d'hémolyse
l'hémoglobine libérée est captée par l'haptoglobine
et la fixation est irréversible, le complexe Hb/Hp est donc
épuré dans le
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
38
|
|
système réticulo-endothélial. La demi-vie
biologique de ce complexe est très courte: moins de 20 minutes (complexe
capté et dégradé dans le système
réticulo-endothélial). Ce complexe a des propriétés
peroxydasiques.
* Protéine la réaction inflammatoire : PRI+
La synthèse de l'haptoglobine est stimulée dans les
états comportant des destructions tissulaires avec hémolyse et
libération d'hémoglobine.
b) Valeur sémiologique: > Méthode de
dosage:
Immunochimie (IN).
> Valeurs normales et variations physiologiques:
>valeurs normales:
0,3 à 2,0 g/l chez les adultes (valeurs supérieures
de 10% chez la femme par rapport à l'homme en général).
> Variations physiologiques:
Chez les nouveaux nés on trouve seulement des traces de
cette protéine. Les valeurs adultes sont atteintes à 6 mois.
Le taux d'haptoglobine diminue lors de la pratique de certains
sports (hémolyse lors de microtraumatismes observables chez les
marathoniens par exemple).
> Variations pathologiques: - Diminution:
-insuffisances hépatiques (cirrhose)
-hémolyse intravasculaire (effondrement du taux
d'haptoglobine)
-déficit congénital : anhaptoglobinémie
(rare, chez 3% des noirs).
- Augmentation : de 2 à 10 g/l soit 4
à 6 fois la normale.
-syndromes inflammatoires aigus, subaigus, chroniques
(protéine PRI+ : marqueur très sensible de l'inflammation mais
non spécifique sans valeur diagnostique ni pronostique).
-maladies infectieuses : pneumonie-tuberculose.
-néoplasies.
-syndrome néphrotique.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
39
|
|
-Limites du dosage de l'haptoglobine:
Coexistence réaction inflammatoire aigue et
hémolyse intravasculaire. 2) Alpha- 2 macroglobuline
(á2-M):
C'est une protéine assez abondante dans le
sérum, pouvant former des complexes avec diverses protéases. Elle
augmente peu dans le syndrome inflammatoire mais beaucoup au cours du syndrome
néphrotique.
a) Propriétés: >
Physico-chimiques:
Masse moléculaire est 850 KDa, sa constante de
sédimentation est de 19S (unités Sievert) à
l'ultracentrifugation.
C'est une glycoprotéine qui comporte 8% de glucides.
PHi=5,4
Elle est composée de 4 sous-unités reliées
par des ponts disulfures ce qui permet de pouvoir former des dimères.
> Métaboliques:
Sa synthèse se réalise dans le foie et dans le
système réticulo-endothélial. La demi-vie biologique de la
forme non complexée est de 5 jours, alors après complexation avec
des protéases la demi-vie est de 10 minutes.
Il existe un polymorphisme génétique pour cette
protéine.
> Biologiques:
L'á 2 macroglobulines peut se lier avec diverses
molécules : ions, hormones (insuline).
Elle possède un rôle antiprotéasique avec
des endopeptidases bactériennes et leucocytaires et avec d'autres
protéases circulantes comme la plasmine, la pepsine, la trypsine, la
chymotrypsine, la cathepsine.
b) Valeur sémiologique: > Méthode de
dosage:
Immunochimie (IN et IDR).
> Valeurs normales et variations physiologiques:
Adultes : 1,5 à 3,5 g/l (supérieur de 10% chez
les femmes).
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
40
|
|
Nouveau-nés : 5g!l (valeurs plus
élevées de 50% environ). Le maximum est atteint vers 1 à 3
ans, puis diminution progressive avec stabilisation à 25 ans. Jusqu' 15
ans les valeurs sont supérieures aux adultes.
Après 70 ans : augmentation
légère.
> Variations pathologiques:
L'intérêt clinique est assez limité et on ne
trouve que des augmentations.
Dans le syndrome néphrotique :
(jusqu'20 à 30 g!l) il y a une atteinte glomérulaire qui
entraîne une protéinurie sélective avec perte des
protéines de faible masse moléculaire comme l'albumine et
rétention des grosses protéines comme l'a 2 macroglobuline
(à l'électrophorèse : pic à a 2 macroglobuline).
Dans l'inflammation aiguë (PRI+) :
augmentation moins nette que CRP (C réactive protéine),
orosomucoïde ou haptoglobine...
Augmentation lors de la grossesse et la prise de contraceptifs
oraux. 3) Céruléoplasmine, céruloplasmine
(CER):
C'est une glycoprotéine colorée en bleu qui fait
partie des á 2-globulines et qui contient huit atomes de cuivre.
a) Propriétés:
> Physico-chimiques:
La céruloplasmine est une protéine à cuivre
de 134 kDa, pHi=4.4, présente chez les vertébrés et
complexant plus de 95 % du cuivre présent dans le plasma.
Elle fait partie de la famille des oxydases bleues à
cuivre, et catalyse l'oxydation à 4 électrons de nombreux
substrats (amines, phénols, Fe2+...) couplée à
la réduction du dioxygène en eau.
> Métaboliques:
Le cuivre est incorporé dans la molécule de
Céruléoplasmine lors de sa synthèse dans les
hépatocytes.
Après sécrétion par le foie la
Céruléoplasmine migre vers les tissus où le cuivre est
utilisé ; elle y est catabolisée avec libération du
cuivre. Outre sa fonction de protéine de transport du cuivre, la
Céruléoplasmine possède une fonction catalytique lors de
l'oxydation du fer (Fe2+ en Fe3+), de polyamines, de
catécholamines et de polyphénols.
41
Chapitre 2 : Etude descriptive des principales
protéines sériques
Du fait de ces différentes activités catalytiques,
elle jouerait un rôle antioxydant, serait impliquée dans de
nombreux processus métaboliques comme celui du cuivre, des amines
biogéniques, et du l'oxyde nitrique.
Toutefois, il semble maintenant établi que la
céruloplasmine joue un rôle physiologique important dans le
métabolisme et l'homéostasie du fer.
En effet, la céruloplasmine oxyde le Fe2+ en
Fe3+ (activité ferroxydase) et permet l'incorporation du
Fe3+ dans la transferrine.
La demi-vie biologique du céruloplasmine est 4 à 5
jours. > Biologiques:
La Céruléoplasmine est une « protéine
de la phase aiguë de l'inflammation » et une protéine de
transport.
Fixation du cuivre plasmatique, Oxydation du fer.
b) Valeur sémiologique: > Méthode de
dosage:
Le dosage de la Céruléoplasmine s'effectue par
immunodiffusion, néphélométrie ou turbidimétrie.
> Valeurs normales et variations physiologiques:
Valeur normal chez l'adulte est de 0.2 à 0.6 g/l.
> Variations pathologiques:
- Diminution:
La concentration en Céruléoplasmine est
diminuée dans la maladie de Wilson (dégénérescence
hépatolenticulaire à transmission autosomique
récessive).
Dans cette maladie où la synthèse de la
Céruléoplasmine est diminuée, l'incorporation du cuivre
Cu2+ dans la molécule de Céruléoplasmine ne se fait pas,
en raison d'une anomalie du métallo thionine.
Il en résulte une accumulation pathologique de cuivre dans
le foie (avec développement d'une cirrhose), le cerveau (avec des
manifestations neurologiques), la cornée (anneau de Kayser-Fleischer) et
les reins (hématurie, protéinurie, aminoacidurie). Chez les
porteurs homozygotes de ces signes le taux de Céruléoplasmine est
fortement diminué.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
42
|
|
Les porteurs hétérozygotes présentent une
diminution moindre ou pas de diminution du taux de
Céruléoplasmine.
Dans le syndrome de Meknès, qui est une maladie rare, il y
a une perturbation génétique de l'absorption du cuivre avec
diminution du taux de Céruléoplasmine.
Les syndromes de pertes protidiques et les insuffisances des
cellules hépatiques sont les principales causes des diminutions acquises
du taux de Céruléoplasmine.
- Augmentation:
Le taux de Céruléoplasmine augmente dans les
inflammations aiguës et chroniques. En cas d'augmentation importante, le
sérum peut présenter une coloration bleu-vert.
Et aussi Nécrose tissulaire et traumatismes, obstruction
des voies biliaires (cholestase).
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
43
|
|
C. LE GROUPE DES BETA-GLOBULINES
Cette groupe constitue 8.5 à 15 % (6 à 10 g/l) des
protéines sériques. 1) Transferrine (Tf) ou
Sidérophiline:
La transferrine est une protéine soluble qui assure le
transport du fer dans le sang. Les cellules de l'organisme dont la teneur en
fer est trop basse synthétisent et expriment à leur surface des
récepteurs à la transferrine. Elles assurent ainsi leur
réapprovisionnement en fer, en internalisant la
transferrine par endocytose.
a) Propriétés: >
Physico-chimiques:
La transferrine sérique ou sidérophiline est une
glycoprotéine, sa masse moléculaire 76 kDa, contenant 6% de
glucides. Leur PHi varie entre 5.5 et 5.9.
> Métaboliques:
Synthétisée dans le foie et sa concentration
sérique est influencée par le contenu du fer dans l'organisme, et
présente une variabilité génétique : 03
phénotypes principaux B.C.D.Sa demi-vie est de 7 jours.
> Biologiques:
Transport du Fe3+, régule l'absorption du fer
suivant sa saturation, mais possède des propriétés
inhibitrices de la multiplication virale.
b) Valeur sémiologique: > Méthode de
dosage:
On sépare la transferrine aisément par
électrophorèse en gel d'amidon. > Valeurs normales et
variations physiologiques: Valeurs normales généralement
admises : 02 à 03,8 g/litre.
Variations physiologiques : chez la femme enceinte, en fin de
grossesse, la concentration s'élève autour de 04,4g/l, en raison
de l'anémie ferriprive, habituelle à cette période.
> Variations pathologiques:
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
44
|
|
-Diminution : dans la néphrose,
syndromes inflammatoires, infectieux et néoplasiques, fuites
protéiques, états de dénutrition ou malnutrition,
insuffisances hépatocellulaires sévères, surcharges en
fer.
-Augmentation : dans la sidéropenie et en
fin de la grossesse, anémies ferriprives, hémorragies aigues ou
chroniques et occultes.
2) C-reactive protein (CRP) ou protéine C
réactive:
La c reactive protein a été ainsi nommée
pour ses capacités à précipiter le polysaccharide C de
Streptococcus pneu moniae.
C'est une protéine de la phase aigue et un marqueur
systémique sensible de l'inflammation et des lésions
tissulaires.
a) Propriétés: >
Physico-chimiques:
La CRP est une holoprotéine de 120 KDa, elle est
constituée d'un pentamère cyclique de 5 protomères de206
aminoacides chacun.
> Métaboliques:
La CRP plasmatique est essentiellement produite par les
hépatocytes.sa transcription
est sous le contrôle de cytokines comme IL-6, TNF-alpha, et IL-1â.
Sa demi-vie est de 6 à 8 heurs.
La sécrétion de CRP débute 4a6 heures
après le stimulus, double ensuit toutes les 8eures et atteint son pic
vers 36-50 heures .la demi-vie plasmatique de la CRP est de 19 heures, mais la
demi-vie clinique des concentrations de CRP après un seul stimulus comme
la chirurgie ou un traumatisme demande plusieurs jours avant de revenir a sa
valeur de base.
> Biologiques:
La CRP est reconnue pour jouer un rôle dans
l'élimination des bactéries .les souris transgéniques pour
la CRP montrent une résistance accrue contre l'infection létale a
Salmonella typhimurium (bactérie Gram-négative).
Elle a par ailleurs un rôle d'activation du
complément, de facilitation de la phagocytose des bactéries et de
modulation de la multiplication des lymphocytes T.
b) Valeur sémiologique: > Méthode de
dosage:
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
45
|
|
Pas visible sur électrophorèse, dosage
spécifique.
> Valeurs normales et variations
physiologiques:
chez l'adulte sain ,le taux de CRP est inferieur a 3 mg/l et
croit en réponse a un stimulus inflammatoire .les taux plasmatiques de
CRP sont déterminés par le taux de synthèse, un marqueur
de l'intensité du processus pathologique stimulant la production de CRP.
L'hémodialyse n'affecte pas le taux de CRP.
> Variations pathologiques:
CRP Ultra sensible au risque cardiovasculaire hors inflammation
(tableau 2).
<1mg/l Pas de risque.
|
1 à 5 mg/l Risque
modéré.
|
>5 mg/l Risque élevé.
Tableau 2: niveau de risque lié à la
variation du CRP.
Toujours dans le sens d'une augmentation: Etats inflammatoires
aigus, quelle que soit leur étiologie, états infectieux,
lésions traumatiques, Néoplasies.
Grand intérêt en pratique médicale
courante.
3) Fibrinogène (FIB):
Le Fibrinogène est une glycoprotéine circulante
soluble. Lorsque sa molécule est scindée par la thrombine au
cours d'une réaction enzymatique, le fibrinogène est
transformé en une protéine plasmatique insoluble : la fibrine. La
conversion du fibrinogène en fibrine est la dernière et plus
importante étape dans la formation du caillot hémostatique
primaire dont le rôle est d'empêcher les pertes liquidiennes
consécutives à un traumatisme.
a) Propriétés:
> Physico-chimiques:
La structure moléculaire du fibrinogène se compose
de trois chaînes polypeptidiques reliées entre elles par des ponts
disulfures pour former un dimère, sa masse moléculaire 330
KDa.
Lors de la conversion du fibrinogène en fibrine, deux
paires de peptides (fibrinopeptide A et fibrinopeptide B) se libèrent
des segments N-terminaux des chaînes á et ß pour former un
monomère, la fibrine, qui est la protéine structurale
prédominante dans la formation du caillot.1-4 Comme presque toutes les
autres protéines responsables de la coagulation.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
46
|
|
> Métaboliques:
Le fibrinogène est synthétisé par le foie,
avec demi-vie de 3 à 5 jours. Les anomalies relatives à la
production du fibrinogène peuvent être congénitales ou
acquises et se traduisent généralement soit par une diminution de
la production de fibrinogène
(afibrinogénémie/hyperfibrinogènémie) ou par une
production de molécules de fibrinogène anormales
(dysfibrinogénémie).
> Biologiques:
Le fibrinogène est le précurseur protéique
plasmatique de la fibrine, qui polymérisé, devient le principal
composant du caillot de fibrine. Sous l'action de la thrombine, le
fibrinogène est clivé et forme un monomère de fibrine. Les
monomères de fibrine sont polymérisés en un réseau
de fibrine insoluble.
c) Valeur sémiologique: > Méthode de
dosage:
On peut doser le niveau de fibrinogène dans le sang par un
prélèvement sanguin. > Valeurs normales et variations
physiologiques:
Le taux normal du fibrinogène dans le sang est de 2
à 4 g/l.
> Variations pathologiques:
-L'afibrinogénémie: (absence de
fibrinogène):
Dans cette forme de déficit en fibrinogène on note
une absence complète du fibrinogène. Le taux du
fibrinogène est < 0,2 g/l de plasma. Environ cinq personnes sur dix
millions en sont atteintes. Des trois types de déficit, c'est celui qui
provoque les saignements les plus graves.
L'afibrinogénémie se traduit par des tendances
hémorragiques modérées à graves.
-Diminution : L'hypofibrinogénémie: (taux
inférieur à la normale):
En présence de cette anomalie, le fibrinogène est
présent, mais à un taux inférieur à la normale : il
se situe entre 0,2 g/l et 0,8 g/l. Cette anomalie est moins fréquente
que l'afibrinogénémie. Les problèmes de saignements
peuvent être légers, modérés ou graves.
Les taux de fibrinogène sont nettement diminués
dans l'afibrinogénémie héréditaire, la coagulation
intravasculaire, la fibrinolyse primaire et secondaire ainsi que dans les
maladies hépatiques.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
47
|
|
Un taux de fibrinogène bas est retrouvé dans
l'afibrinogénémie congénitale, dans
l'hypofibrinogénémie et dans certains cas de
dysfibrinogénémie, mais aussi dans différentes pathologies
comme la coagulation intravasculaire disséminée (CIVD), la
fibrinolyse, la pancréatite et les insuffisances hépatiques
sévères. Le fibrinogène est une protéine
réactive de la phase aiguë dont la concentration augmente en
réponse à différents stimuli physiologiques.
-Augmentation : (6 à 8 g/l) dans les
processus inflammatoires:
Il peut être augmenté au cours d'une inflammation,
d'une infection, au cours de la grossesse et après un traumatisme. Le
fibrinogène est augmenté chez les fumeurs.
Un taux plasmatique élevé de fibrinogène a
été associé à des états
pré-thrombotiques. La concentration en fibrinogène est
corrélée positivement au développement de
l'athérosclérose, de l'infarctus du myocarde et des accidents
vasculaires cérébraux.
- La dysfibrinogénémie: (mauvais
fonctionnement)
En présence de dysfibrinogénémie, le taux de
fibrinogène est normal, c'est-à-dire entre 2 et 4 g/l, mais le
fibrinogène ne fonctionne pas adéquatement. Environ une personne
sur un million en est affectée. En fait, on a répertorié
plus de 100 types différents de dysfibrinogénémie.Les gens
atteints souffrent rarement de problèmes hémorragiques. Ils
peuvent même présenter la situation contraire : une thrombose (le
sang coagule dans la circulation sanguine).
AF I B RI NOG É N ÉMIE HYPO FI B RI N OG É N
ÉMIE DYSF I B RI NOG É N ÉMIE
|
TRANSMISSION Autosomal récessif Autosomal dominant
Autosomal dominant et
(les deux parents et récessif un seul récessif un
seul parent
sont porteurs). parent est porteur les est porteur les deux
deux parents le sont parents le sont
|
INCIDENCE 5 sur 10 millions moins que 1 sur 1 million
l'afibrinogénémie
|
TAUX DEFIBRINOGENE < 0,2 g/l plasma entre 0,2 -0,8 g/l entre 2
et 4 g/l plasma
plasma
|
|
SYMPTOMS - saignement cordon
ombilical
- saignement cutanéo- muqueux -hémorragie gastro-
intestinale
- saignement intracrânien - saignement articulaire (chez
20
% des sujets)
|
- saignement cordon ombilical
- saignement cutanéo muqueux
- hémorragie gastro- intestinale
- saignement intracrânien (peu fréquent)
- saignement articulaire (chez 20 % des sujets)
|
-sans symptôme
-hémorragie
- thrombose
|
|
TRAITEMENT FIBRINOGÈNE FIBRINOGÈNE
FIBRINOGÈNE OU
ANTICOAGULANT
|
Tableau 3: tableau comparatif de déficience en
fibrinogène congénital.
48
Chapitre 2 : Etude descriptive des principales
protéines sériques D. LE GROUPE DES
GAMMA-GLOBULINES:
La réponse humorale se fait à travers un groupe de
protéines ayant des propriétés semblables, mais des
fonctions différentes = les Immunoglobulines.
Les gammaglobulines présentent 9.2 à 18 % (6.4
à 13 g/l).
1) Définition:
Ce sont des protéines animales glycosylée
(glycoprotéines). Elles migrent à l'électrophorèse
dans la zone ã.
Elles sont présentes dans le plasma, les autres
liquides biologiques et les sécrétions. Ce sont les agents de
l'immunité humorale, ce sont des protéines douées
d'activité anticorps.
· Ac : globuline apparaissant dans le
sérum d'un sujet, soumis à un Ag qu'il ne possède pas et
capable de se lier spécifiquement à cet Ag.
2) Propriétés:
a. Physico-chimiques:
> Les Ig sont des molécules bipolaires : 2 pôles
fonctionnels :
· Régions variables : impliquées dans les
fonctions de reconnaissance de l'Ag.
· Région constante : responsable des fonctions
effectrices.
>A côté de cette dualité fonctionnelle,
on a :
· Dualité structurelle : constitution par 2 types de
chaînes : légères et lourdes.
· Dualité génétique : 2 types de
gènes codant chacun pour un type de chaînes.
> On en a 5 classes : IgG, IgM, IgA, IgD, IgE,
synthétisés par le lymphocyte B et surtout plasmocyte et peuvent
être : intracellulaires - membranaires (=récepteurs d'Ag du
lymphocyte) - sécrétées.
> Leur migration dans la zone ã de l'EPPS est à
l'origine de l'appellation = gammaglobulines.
b. Métaboliques:
Elles sont synthétisées par des cellules
spécifiques qui sont dans la moelle osseuse : les plasmocytes,
dérivant des lymphocytes B activés. Cette synthèse est
secondaire au contact de l'organisme avec une substance
étrangère: antigène ou immunogène. Ces anticorps
sont produits et sécrétés dans la circulation
générale.
c. Biologiques:
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
49
|
|
La réponse immunitaire est spécifique; une
immunoglobuline (Ig) est spécifique de l'antigène (Ag) qui a
déclenché sa synthèse. La spécificité est le
plus souvent absolue.
3) Structure générale des immunoglobulines:
On remarque l'extraordinaire
hétérogénéité des Ig. a.
chaînes polypeptidiques:
L'unité de base d'un Ac (monogène d'Ig) comprend 4
chaînes polypeptidiques: - 2 chaînes lourdes identiques
(chaînes « H » pour Heavy).
- 2 chaînes légères identiques (chaînes
« L » pour Light).
La structure générale est du type H2L2.
Cet édifice moléculaire a une masse
moléculaire d'environ 150 KDa. Au microscope électronique, ces Ig
se présentent sous la forme d'un Y avec un axe de symétrie entre
les 2 chaînes lourdes (donc la molécule est symétrique).
> Les chaînes lourdes:
Leur nature varie selon la classe et la sous classe d'Ig. Chaque
chaîne lourde est constituée de 450 acides aminés, ce qui
correspond à une masse moléculaire de 50KDa.
Les deux chaînes lourdes sont reliées
entre-elles:
- par des liaisons covalentes: un ou plusieurs ponts disulfures.
Cette liaison est située dans la zone charnière.
- par de nombreuses interactions non covalentes qui stabilisent
aussi l'ensemble (liaisons ioniques, hydrogène...).
> Les chaînes légères:
Comme pour les deux chaînes lourdes, les deux chaînes
légères sont identiques entrent-elles. Elles sont du type ê
ou ë, commun à toutes les classes d'Ig: Ig G, Ig M, Ig A, Ig D, Ig
E. Leur masse moléculaire est d'environ 25 KDa chacune.
Chaque chaîne légère est reliée
à une chaîne lourde:
- par un pont disulfure inter caténaire (entre
l'extrémité carboxylique de la chaîne légère
et la région charnière de la chaîne lourde).
- par de nombreuses liaisons non covalentes.

Chapitre 2 : Etude descriptive des principales
protéines sériques
>>On distingue deux caractéristiques
principales à cette structure de base: - la grande
stabilité de la molécule H2L2.
- la grande flexibilité des chaînes lourdes (au
niveau de la zone charnière). En effet, l'Y a un angle d'ouverture
très variable, de 0 à 180°. Cette flexibilité permet
l'adaptation de l'Ac à l'Ag qui a suscité sa production.
Figure 1: Structure biochimique d'une
immunoglobuline.
Figure2 : Les différents types des
immunoglobulines.
Belaouar Hamza/Lamri Adlène
50
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
51
|
|
b. Autres composants:
· Les chaînes oligosaccharidiques
Les Ig sont des glycoprotéines.
Les chaînes lourdes contiennent sur leur partie carboxy
terminale des chaînes oligosaccharidiques (glycanniques) en nombre
variable (1 à 7) selon la classe.
· Les chaines de Jonction ou chaînes J.
On les trouve dans la classe des Ig A et M. Elles permettent
la polymérisation de l'unité de base. On a donc le motif (H2L2)
n. Le degré de polymérisation est: n=2 pour les Ig A et n=5 pour
les Ig M.
· La pièce sécrétoire S
Elle se rencontre dans les Ig A sécrétoires qui
sont dimériques.
c. Les domaines d'Ig:
Au sein de chaque chaîne lourde et chaque chaîne
légère, il existe des ponts disulfures intra caténaires
qui obligent la séquence d'acide aminé à se replier sur
elle-même en des boucles peptidiques de 60 à 70 résidus
d'acide aminé. Chaque boucle représente la partie centrale d'une
région globulaire comprenant 110 acides aminés; cette
région est appelée domaine.
Le nombre de domaines varie selon la classe et le type d'Ig: >
sur chaque chaîne lourde: 4 à 5 domaines.
>sur chaque chaîne légère: 2 domaines.
Au cours de l'évolution, on a constaté la
duplication d'un gène ancestral commun. Quand on compare la composition
en acides aminés de deux domaines différents, on remarque
l'existence d'un haut degré d'homologie des séquences.

Figure3 : Organisation en domaines.
Belaouar Hamza/Lamri Adlène
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
53
|
|
d. Variabilité des chaînes:
Quand on compare les chaînes lourdes entre-elles ou les
chaînes légères entre-elles, les séquences en acide
aminé sont partiellement différentes.
Les différences sont localisées dans la
région N terminale de ces chaînes; ces régions sont en
conséquence dénommées régions variables ou V.
Les régions C terminales ont une structure relativement
conservée : elles sont de ce fait appelées régions
constantes ou C.
- Cas des chaînes
légères:
On constate deux domaines de longueur équivalente:
- 1 domaine variable N terminal appelé VL (pour Variable
Light) -1 domaine constant C terminal appelé CL (pour Constant
Light).
- Cas des chaînes lourdes:
On constate 4 à 5 domaines de longueur
équivalente:
- 1 domaine variable N terminal appelé VH (pour Variable
Heavy)
- 3 à 4 domaines constants C terminaux appelés CH
(pour Constant Heavy).
Il existe des appariements des domaines entre les chaînes
lourdes et légères ; dans tous les cas, un domaine V s'associe
à un V et un domaine C avec un C.
Ainsi, bien qu'ayant une structure de base commune, les Ig ont un
certain degré de variabilité.
e. Dualité structurale et fonctionnelle des
Ig:
Les Ig peuvent faire l'objet d'un clivage sous l'action d'enzymes
protéolytiques (comme la papaïne d'origine végétale
et la pepsine d'origine animale).
Les principaux résultats sont obtenus avec la
papaïne; on assiste à une scission de l'Ig en 3 fragments de 50 KDa
environ:
- 2 fragments Fab identiques. -1 fragment Fc.
*Les fragments Fab (ab pour "Ag-Binding")
correspondent à la moitié N terminale d'une chaîne lourde
reliée par un pont disulfure à une chaîne
légère.
Ils ont la propriété de se lier à l'Ag mais
sont univalents c'est à dire ils ne possèdent qu'un seul site de
fixation antigénique.
Le site de liaison à l'Ag Fab est constitué:
- du domaine variable d'une chaîne légère
(VL)
- du domaine variable d'une chaîne lourde (VH).
· Le fragment Fc : cristallise
facilement et correspond à deux moitiés C terminales de
chaînes lourdes reliées entre-elles par au moins un pont
disulfure.
Le fragment Fc (constitué des domaines constants des
chaînes lourdes, principalement CH2 et CH3) ne s'associe pas a l'Ag mais
est le support des autres propriétés biologiques des Ig (comme
leur capacité à s'associer au complément...).
f. Structure tridimensionnelle des Ig:
A l'aide de méthodes résolutives physiques
(diffraction, RMN, Microscope Electronique), on a confirmé
l'organisation spatiale des Ig en domaines.
-Figure ci-dessous: exemple de la conformation
d'une Ig. Ce schéma indique l'organisation des chaînes entre elles
et notamment la forme en Y induite par les chaînes lourdes.

Figure 4: structure tridimensionnel d'une
immunoglobuline
4) Structure particulière des
immunoglobulines:
a. Les IgG : 75% des Ig sériques,
concentration = 12g!l.
- Elle a une structure de base en Y, constituée de 2
chaînes légères K ou ë et 2 chaînes lourdes
ã.
- 4 sous classes décrites : IgG1, IgG2, IgG3 et IgG4
(ã1 - ã2 + ã3 - ã4 = chaînes lourdes).
- Leur déploiement dans l'espace est variable d'une sous
classe à une autre.
- L'IgG est bivalent car elle possède 2 sites Ac (2
paratopes).
b. Les IgA : 10 à 15%. 3.5g!l.
- 2 formes :
* Monomérique : IgA sérique : prédominante
dans le sérum, structure semblable à l'IgG.
* Dimérique : IgA sécrétoire : très
dominante au niveau des sécrétions : salive, larmes,
sécrétions nasales, trachéobronchiques, intestinales,
colostrum...etc.
Formée de 2 monomères d'IgA, réunis par une
pièce J (de jonction) et une pièce S (sécrétoire)
et opposés par leur fragment Fc.
- Chaque molécule comporte : 2 chaînes
légères K ou ë et 2 chaînes lourdes á.
c. Les IgM : 1.5 g!l.
- Elle est pentamérique. Chaque unité a une
structure semblable à celle de l'IgG.
- Les 5 unités sont réunies au niveau de
l'extrémité COOH terminale, par les ponts disulfures d'une
pièce J.
- Chaque unité comporte : 2 chaînes
légères ë ou K et 2 chaînes lourdes ì (chaque
chaine lourde comporte un domaine variable VH mais 4 domaines constants CH.
- La structure pentamérique explique la grande
affinité de l'IgM pour les Ag et ses propriétés
agglutinantes.
- 2 sous classes : IgM1 et IgM2.
d. Les IgE :
- Chaque molécule comprend 2 chaînes lourdes
å et 2 chaînes légères K ou ë. - Les
chaînes lourdes sont formées de 5 domaines chacune (idem IgM).
- Concentrations faibles dans le sérum, localisation
essentiellement tissulaire.
e. Les IgD :
- 2 chaînes légères K ou ë et 2
chaînes lourdes ä.
- concentration sérique faible, joue un rôle en tant
que récepteur de membrane des lymphocytes B.

|
IgA
|
IgM
|
IgD
|
IgE
|
|
á
|
u
|
ä
|
å
|
|
Ê ou ë
|
Ê ou ë
|
Ê ou ë
|
Ê ou ë
|
|
IgA 1 à 2
|
|
|
|
|
H2L2 ou (H2L2)2JS
|
(H2L2)5J
|
H2L2
|
H2L2
|
|
160KDa ou
400KDa
|
950KDa
|
185KDa
|
190KDa
|
|
6 J
|
5 J
|
4 J
|
2 à 3 J
|
|
2 à 4
|
0.5 à 2
|
0.05 à 0.4
|
0.1 à 1
|
|
10
|
0.4 ou 06
|
02
|
02
|
Fonction -Réponse
secondaire. -Anticorps; protection à long terme.
-Réponse primaire. -Anticorps des secrétions.
-Protection des muqueuses. -Protection à cours terme.
-Protection contre les parasites. -rôle plutôt
mineur.
- Anticorps de la réaction allergique.
Structure en Y
Classes IgG
Chaine H ã
Chaine L Ê ou ë
Sous classe IgG 1 à 4
Structure H2L2
Masse Moléculaire 150KDa
Demi-vie moyenne 24 J
[g/l] 8 à 16
Valence 02
Chapitre 2 : Etude descriptive des principales
protéines sériques
5) Classes et sous -classes:
C'est la nature de la chaîne lourde d'une immunoglobuline
qui détermine sa classe et éventuellement sa sous classe.
L'Isotypie de classe ou de sous classe est la
propriété liée à la présence chez tous les
individus de la même espèce, des mêmes marqueurs
antigéniques spécifiques.
Chez les mammifères par exemple existe 5 classes d'Ig
(immunoglobulines) qui
correspondent à un type différent de chaîne
lourde :
- Ig G: chaîne lourde de type ã (Gamma). - Ig A :
chaîne lourde de type á (Alpha). - Ig M : chaîne lourde de
type u (Mu).
- Ig D : chaîne lourde de type ä (Delta).
- Ig E : chaîne lourde de type î (Epsilon).
En ce qui concerne les Ig A et les Ig D la nature de la
chaîne lourde peut faire l'objet d'une variabilité
définissant une sous classe :
- Il existe 4 sous classes d'Ig G: Ig G1, Ig G2, Ig G3, Ig G4 car
il existe 4 sortes différentes de chaînes lourdes gamma.
- Il existe 2 sous classes d'Ig A: Ig A1, Ig A2 car il existe 2
types de chaînes lourdes alpha.
Le tableau ci-dessus indique les principales
propriétés physiques et biologiques des classes et des
sous-classes.
Tableau 4: Classes et sous classes des
immunoglobulines.
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
57
|
|
Quelques précisions :
. Dans la catégorie « association moléculaires
possibles », le symbole « J» signifie qu'il existe une
chaîne de jonction, et le symbole « S» signifie qu'il existe
une pièce sécrétoire.
. La valence de l'anticorps correspond au nombre de segments Fab
(nombre de sites de liaison à l'antigène).
. Ig D est plus lourde Que Ig G ou Ig A car elle est plus
glycosylée.
. Ig E est lourde car il existe un 5ème domaine et Ig M
est encore plus lourde car c'est un pentamère. La masse d'Ig A est de
400 000 quand il existe une chaîne de
jonction et une pièce sécrétoire.
.Ig G et Ig A sont les plus synthétisées par jour
par un individu.
.Ig M sédimente plus vite car c'est un pentamère.
6) Exploration des immunoglobulines sériques:
L'exploration des immunoglobulines est de règle quand:
- il existe des infections répétées,
inexpliquées, surtout bactériennes,
- on évoque un déficit immunitaire compliqué
de manifestations infectieuses, auto- immunes ou
lymphoprolifératives,
- il existe des éléments en faveur d'une
prolifération lymphoplasmocytaire susceptible de sécréter
une IM (cf. exploration d'une gammapathie monoclonale),
- la VS est accélérée avec ou sans syndrome
inflammatoire. > Méthodes d'exploration des Ig :
Elle comporte une électrophorèse des
protéines sériques complétée par un dosage
pondéral des Ig sériques : IgG, IgA et IgM, éventuellement
des sous-classes d'IgG.
* Electrophorèse des protéines
sériques;
La séparation électrophorétique du
sérum humain donne 5 (ou 6) fractions. A l'état normal, un grand
nombre de molécules d'Ig d'isotypes, d'allotypes et d'idiotypes
différents provenant d'une multitude de clones lymphoplasmocytaires
circulent dans le sang : ce sont les Ig polyclonales. Les Ig migrent
essentiellement dans la zone des ãglobulines. La concentration en
ã-globulines estimée à l'EP varie selon l'âge,
physiologiquement elle est de 6 à 13 g/l chez l'adulte.
* Dosage pondéral des Ig (IgG, IgA, IgM):
Le dosage pondéral (quantitatif) des Ig
(néphélémétrie) donne plus de précisions.
Les concentrations en Ig varient en fonction de l'âge. Chez
l'adulte sain, les concentrations sériques sont les suivantes :
IgG : 7,20 -14,70 g/l, IgA : 1,10 - 3,60 g/l, IgM : 0,48 - 3,10
g/l. *Dosage des sous-classes d'IgG (IgG1, G2, G3, G4).
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
58
|
|
Il s'effectue essentiellement par
néphélémétrie. Les concentrations varient en
fonction de l'âge. L'interprétation des résultats est
délicate lorsque les concentrations sont à la limite
inférieure de la normale et chez l'enfant de moins de 18 mois.
a. Dosage: á) Prélèvement de sang du foetus
dans les derniers mois de grossesse:
- La teneur en augmente jusqu'à la naissance où
elle atteint son point culminant. Mais ce stock d'Ig G à la naissance
provient essentiellement de la mère car les Ig G sont les seuls capables
de passer la barrière placentaire.
- Les IgM qui sont moins nombreuses sont elles d'origine
foetale.
- On ne trouve ni Ig A ni Ig D ni Ig E.
â) Prélèvement à la naissance:
- Il y a diminution des Ig C} d'origine maternelle (1/2 vie
d'environ 3 semaines) mais la production d'Ig G démarre dès la
naissance et compense cette chute.
- La production des Ig M se poursuit jusqu'à atteindre un
plateau vers le sixième mois. - La production des autres Ig augmente
progressivement.
· Réponses immunitaires primaires et
secondaires.
Lors du premier contact entre l'organisme et l'antigène:
pendant quelques jours rien ne se passe (temps de latence) puis au bout d'une
semaine apparaissent dans le sang des anticorps spécifiques de
l'antigène puis le taux d'anticorps se stabilise avant de diminuer.
Lors du second contact entre l'anticorps et l'antigène:
la réaction immunitaire secondaire est très rapide (pas de
latence) et beaucoup plus ample. Elle traduit l'existence chez un individu
d'une mémoire antigénique portée par les lymphocytes B
mémoires.
b. Typage par immunofixation d'une gammapathie monoclonale: + Le
principe de l'immune fixation repose sur 2 propriétés:
-Mobilité électrophorétique dans un champ
électrique.
-Caractère antigénique des protéines. C'est
une propriété inhérente à toutes les
protéines.
Ex: si on injecte une protéine purifie (ex albumine
humaine) à un mouton, il ne reconnaît pas cette albumine et donc
fabrique des anticorps anti-albumine. Le mouton est alors immunisé
contre l'albumine humaine et il est possible d'isoler ses anticorps
anti-albumine humaine. D.
+ Technique de l'immunofixation (lors de cette
expérience):
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
59
|
|
- On dispose d'un support plastifié sur lequel on coule un
gel hydraté et tamponné par un Ph de 8,6.
- A l'aide d'un applicateur on dépose sur ce support
quelques microlitres de sérum sur les 6 pistes correspondantes.
- On applique alors un courant électrique entre les
électrodes (200 V).
- Les protéines migrent alors en fonction de leur
taille.
- Sur la piste de gauche on applique un colorant des
protéines (électrophorèse normale).
- Sur les 3 pistes suivantes on dépose un anticorps
spécifique d'une Ig (G, A, M). - Sur les 2 dernières pistes on
dépose un anticorps anti-chaîne légère (K et L).
Anticorps et antigène forment un complexe et donnent une
réaction colorée. + Analyse de cette immunofixation:
- Sur la première piste on repère une zone intense
qui correspond à une production anormale d'une catégorie d'Ig.
- On détermine cette classe d'Ig en étudiant les
complexes antigène/anticorps. - La chaîne lourde correspondante
est de type G et la chaîne légère de type L.
- Il y a donc une synthèse trop importante d'Ig de type
ë2ê2.
7) FONCTIONS DES IMMUNOGLOBULINES :
Ils assurent plusieurs fonctions dans le déroulement de la
réaction immunitaire :
a) Reconnaissance de l'Ag :
- La principale fonction d'une Ig est de reconnaître et de
se lier spécifiquement à un Ag.
- Cette fonction est assurée par une région
appelée : site Ac ou paratope, située sur le fragment Fab, et
constituée de 6-10 acides aminés, qui ne sont pas voisins, et qui
appartient aux régions « hypervariable » de la chaine lourde
et de la chaine légère.
- Ainsi, se forment des complexes Ag-Ac= complexe immuns
(lorsque l'Ag est soluble).
- Lorsque les Ac se fixent aux cellules cibles, leur forme se
modifie faisant apparaître des sites de 4 fixation du complément,
sur le fragment Fc.
b) Fixation et activation du complément
:
- En fonction de leurs classes et sous-classes les Ig peuvent
activer le complément par les deux voies : Classique et alterne.
Ce qui déclenche la fixation de certains facteurs du
complément sur la surface de la cellule antigénique et par
conséquent sa lyse.
c) Propriétés cytophylitiques
:
- Le fragment Fc présente également des sites de
fixation de nombreuses cellules immunitaires : macrophage, PNN, lymphocytes et
mastocytes...
|
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
60
|
|
- Les Ig en reliant l'Ag ou la cellule aux PNN et macrophages ou
monocytes jouent le rôle d'opsonines (facilitent la phagocytose).
d) La neutralisation :
- L'Ig peut bloquer des sites spécifiques sur les
exotoxines bactériennes et les virus. Ce qui les empêche
d'endommager les cellules normales de l'organisme = neutralisation.
e) Agglutination et précipitation :
- Agglutination : lorsque plusieurs cellules
étrangères, en l'occurrence, sont réunies par des Ig,
formant un amas.
- Précipitation : lorsqu'il s'agit de molécules
solubles réunies, pour former de grands complexes immuns.
- Ce qui facilite la phagocytose de ces bactéries ou
molécules d'Ag précipités.
Neutralisation, agglutination et précipitation
découlent de la fonction de fixation et de connaissance des Ac et donc
du fragment Fab.
f) Passage transplacentaire des IgG :
- Le site qui permet ce passage est situé sur le fragment
Fc des IgG : les seules à pouvoir traverser le placenta.
g) Propriétés particulières
:
· IgM :
- Les premières à apparaître au cours de
l'ontogénie et de la réponse immune.
- Puissants agents agglutinants et dans la fixation du
complément et son activation. - Récepteurs antigéniques
à la surface des lymphocytes B.
· IgG : - Principal Ac des
réactions primaires et secondaires.
· IgA :
- Interviennent dans les réponses immunitaires locales au
niveau de la sécrétion des muqueuses :
* En empêchant l'adhérence des germes aux cellules
épithéliales. * En neutralisant certaines toxines.
* En agglutinant les bactéries ou champignons.
· IgE :
- Se lient au mastocytes et basophiles, lorsque
associés aux Ag, déclenchent la libération de
médiateurs : histamine.... (Dégranulation) qui participe à
des réactions allergiques et à la défense
antiparasitaire.
· IgD : Belaouar Hamza/Lamri
Adlène
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
61
|
|
|
- Leur rôle n'est pas bien connu : probablement =
rôle de récepteur à la surface des lymphocytes B5
immunocompétents.
- Bipolarité fonctionnelle :
* Le fragment Fab reconnaît et se fixe à l'Ag.
* Le fragment Fc est responsable des propriétés
biologiques. N.B= Niveaux
d'hétérogénéité des immunoglobulines
:
- Isotypie : les isotypies : déterminants
antigéniques identiques chez les individus d'une même
espèce. Ils sont portés par la partie constante des chaînes
lourdes et légères.
L'Isotypie définit les classes et les sous classes
d'Ig.
- Allotypie : les allotypies sont des déterminants
antigéniques provenant des variations génétiques
interindividuelles au sein d'une même espèce de structure des
chaînes lourdes á, ã et des chaînes
légères kappa K.
_ Ils sont portés par les parties constantes de ces
chaînes.
_ Il existe 28 allotypes pour les chaînes lourdes gamma
appelés Gm. _ Il existe 2 allotypes pour les chaînes lourdes alpha
appelés Am.
- Idiotype :
* Sont des déterminants antigéniques (ou Epitopes)
localisés sur le fragment Fv formé par l'association des domaines
variables des chaînes lourdes et légères= VL et VH. La
spécificité idiotypique = étroite individuelle, produit
d'un clone cellule.
* La cascade d'auto-anticorps anti-idiotypes = le réseau
idiotypique, a pour rôle de réguler la réponse humorale.
8) Principales anomalies des immunoglobulines:
a. Les hypogammaglobulinémies:
> Hypogammaglobulinémies
physiologiques:
Les déficits de l'immunité humorale se
caractérisent par un trouble de la production globale des anticorps par
les lymphocytes B responsable d'une hypogammaglobulinémie plus ou moins
sévère selon l'étiologie. Quatre cas cliniques illustrent
les principales causes hypogammaglobulinémies de l'enfant, la maladie de
Bruton - dans sa forme typique et dans sa forme atypique -,
l'hypogammaglobulinémie transitoire de l'enfance et de la
déficience immunitaire commune variable.
Les manifestations cliniques que partagent ces diverses
pathologies sont les infections bactériennes à
répétition touchant principalement le tractus respiratoire.
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
62
|
|
|
Les infections opportunistes et les manifestations auto-immunes
sont plus fréquentes dans la déficience immunitaire commune
variable et dans l'hypogammaglobulinémie avec hyper IgM qui, en raison
de sa rareté, n'est que brièvement abordée.
Les récents progrès de la génétique
et de la biologie moléculaire ont partiellement
révélé l'origine et la physiopathologie de ces affections.
L'administration intraveineuse d'immunoglobulines améliore
considérablement la qualité de vie des patients et le pronostic
de leur affection.
> Hypogammaglobulinémies
pathologiques:
Dites globales lorsque la concentration de toutes les classes
d'Ig est diminuée, sélectives lorsqu'elle ne touche qu'une ou
deux classes d'Ig, les hypogammaglobulinémies relèvent de
différentes étiologies. On distingue :
>Les déficits immunitaires acquis
(étiologie la plus fréquente) :
- maladies infectieuses, syndromes lymphoprolifératifs
(LLC, myélome), - atteinte médullaire néoplasique,
toxique, post-radique,
- médicaments : immunosuppresseurs, APS, ...
- pertes excessives : fuites rénales, cutanées,
digestives.
-Hémopathies malignes.
-Causes iatrogènes.
-Pertes Protéiques.
-Certaines maladies virales.
> Les déficits immunitaires primitifs :
Le dosage des différents isotypes des Ig permet de
détecter les déficits en IgA, déficits immunitaires
humoraux les plus fréquents (1/700 sujets), les déficits
immunitaires communs variables, les déficits avec hyper-IgM.
L'agammaglobulinémie ou maladie de Bruton (absence d'Ig et de
lymphocytes B) est exceptionnelle.
Déficits congénital en IgA (<50mg/l).
Déficits immunitaires combinés
sévères(DICS).
>>Les déficits en sous-classes
d'Ig
Les déficits en IgG2 sont les mieux
caractérisés (infections des voies aériennes
supérieures à germes encapsulés). Parfois il existe des
déficits combinés IgG2 et IgA, IgG2-IgG4. L'existence du
déficit en IgG4 est controversée : 20 % des sujets sains ont des
concentrations en IgG4 à la limite des possibilités de
détection.
b. Les hypergammaglobulinémies polyclonales:
> Caractéristiques:
Une hypergammaglobulinémie (augmentation des
gammaglobulines) inférieure à 30 g/l a rarement une valeur
d'orientation diagnostique décisive car elle s'observe dans de
nombreuses circonstances inflammatoires ou infectieuses chroniques mais
également dans certaines MAI (S. de GougerotSjögren+++,
lupus systémique [on le revoie dans la partie
expérimental], ...). Une
hypergammaglobulinémie supérieure à 30 g/l oriente vers
une infection VIH, une parasitose ou une hépatite auto- immune.
> Situation pathologique:
+ Maladies infectieuses:
· infections aiguës: Ig monoclonale transitoire.
· infections chroniques.
· virus: VIH, EBV, CMV, VHB, VHC.
· bactéries: salmonelles, leptospires, EI.
· parasites: paludisme, toxoplasmose.
+ Maladies auto-immunes:
· syndrome de Gougerot-Sjögren essentiellement
· autres maladies auto-immunes (PR, LED...):
fréquence peu élevée
d 'Ig monoclonale posant la
question d'une association fortuite.
+ Hépatopathies:
· capacité de synthèse hépatique
diminuée: o Diminution de l'albumine et d'autres protéines.
· autres perturbations biochimiques: o Augmentation des
enzymes hépatiques (transaminases, PAL, ...) (cytolyse).
o Augmentation de la bilirubine (ictère).
· hypergammaglobulinémie polyclonale (IgA): o
compensation de synthèse par les plasmocytes. o bloc â /
ã.
o diagnostic différentiel des autres
hypergammapolyclonales.
c. Les dysglobulinémies monoclonales:
> Caractéristiques:
Anomalie des globulines qui constituent, avec l'albumine, les
protéines du sang. En pratique on réserve ce mot à des
modifications des gammaglobulines ou anticorps. On regroupe ainsi sous le nom
de dysglobulinémies, ou gammapathies monoclonales, des maladies dans
lesquelles existe, dans le sang ou dans les urines, une immunoglobuline
monoclonale en excès. Elle peut être mise en évidence dans
le sérum par des réactifs qui identifient la classe de
chaînes lourdes et le type de chaînes légères.
Chez un sujet normal, les différentes classes
d'immunoglobulines sont présentes à des taux stables, leur
production étant soumise à une régulation. Les
dysglobulinémies monoclonales sont caractérisées par une
rupture de cette régulation et par la prolifération excessive et
maligne d'un clone qui entraîne une synthèse importante d'une
espèce moléculaire dite monoclonale.
La présence d'une immunoglobuline monoclonale anormale a
été longtemps synonyme de myélome ou de
macroglobulinémie de Waldenström. On sait maintenant qu'il existe
d'autres gammapathies monoclonales, au cours d'autres cancers, d'états
inflammatoires chroniques et de certaines maladies auto-immunes. Il
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
64
|
|
|
y a aussi des modifications modérées et
bénignes qui régressent sans traitement (Tableau 5).
DYSGLOBULINÉMIES MONOCLONALES
Malignes :Myélome
Macroglobulinémie de Waldenström
Lymphomes malins (leucémie lymphoïde
chronique, lymphomes) non-hodgkiniens
Maladies des chaînes lourdes
Non malignes : Associées à une autre
affection
· Cancers
· Cirrhoses
· Inflammation chronique · Maladies
auto-immunes Formes dites« essentielles bénignes »
· Formes sporadiques
· Formes familiales (prédisposition
génétique).
Tableau 5: Dysglobulinémies monoclonales.
Le diagnostic est assez souvent évoqué par un
examen biologique sanguin fait pour une autre raison, s'il révèle
une ou plusieurs anomalies : une augmentation de la vitesse de
sédimentation, une précipitation du sérum ou du plasma au
froid, des «rouleaux» de globules rouges sur un frottis sanguin, une
pseudo-agglutination lors de la détermination d'un groupe sanguin, une
anémie isolée, une augmentation des lymphocytes dans le sang. Ces
modifications amènent à analyser les protéines par
électrophorèse du sang et des urines. L'immunoglobuline
monoclonale recherchée peut exister sous forme de molécules
entières d'anticorps ou de chaînes isolées. On identifie de
façon précise l'anomalie et l'anticorps concerné et on
constate que les autres immunoglobulines sont diminuées.
Les anomalies les plus fréquentes portent sur les
immunoglobulines et en cas de myélome. L'augmentation des
immunoglobulines monoclonales correspond à la maladie de
Waldenström.
Remarque:
Dans les cas de gammapathie bénigne, sans signe
clinique, les immunoglobulines normales ne sont pas abaissées. Il n'y a
pas de cellules anormales dans le sang ni dans la moelle osseuse. Il faut
cependant surveiller ces formes bénignes car elles peuvent
évoluer vers un myélome.
> Situations pathologiques:
+ Maladie de Kahler: (myélome multiple
classique):

· Prolifération maligne monoclonale des plasmocytes
dans la moelle osseuse- Maladie de Kahler-
· 20 % des Ig monoclonales; IgG (53 %), IgA (25 %),
chaînes légères isolées (20 %),
IgD (1 %), IgE exceptionnelle.
· Manifestations: - Signes osseux:
Douleurs lombaires, costales, des membres; fracture
pathologique; tuméfaction osseuse.
- Signes radiologiques:
Lacunes à l'emporte-pièce des os du crâne,
des côtes, du bassin; déminéralisation osseuse ; tassements
vertébraux.
- Signes rénaux :
Tubulopathie chronique, insuffisance rénale. -
Signes neurologiques:
Paraplégie par compression épidurale; neuropathie
périphérique.
Amylose.
· Manifestations hémorragiques:
Infection bactérienne.
· Manifestations cutanées:
nodules de coloration rose-chamois.
· Critères diagnostiques du myélome
multiple:
· Critères majeurs:
1- Tumeur plasmocytaire sur une biopsie.
2- Plasmocytose médullaire > 30 %.
3- Pic monoclonal sérique: IgG >30 g/l, IgA > 20
g/l, excrétion urinaire de chaînes légères Kappa ou
Lambda > 1 g/24heures.
· Critères mineurs:
a- Plasmocytose médullaire comprise entre 10 et 30 %.
b- Composant monoclonal sérique ou urinaire à un
taux inférieur à ceux cités dans 3.
c- Lésions osseuses lytiques.
d- Baisse des Ig résiduelles: IgM < 0,5 g/l, IgA< 1
g/l, IgG < 6 g/l.
Chez des malades symptomatiques: anémiques et/ou
hypercalcémiques et/ou hyperazotémiques et/ou
hypoalbuminémiques et/ou présentant une
déminéralisation osseuse et des fractures compressives.
Le diagnostic de myélome multiple est retenu si: á)
1 + b ou c ou d;
â) 2+ b ou c ou d;
ã) 3;
ä) a + b + c ou a+ b + d.
· Variant du myélome multiple:
-3 % des Ig monoclonales. - Smoldering myeloma:
· 3 % des Ig monoclonales
· Critères de définition:
-Malade asymptomatique.
-Taux de l'Ig monoclonale sérique > 30 g/l.
-Plasmocytose médullaire entre 10 et 30 %. -stabilité de l'Ig
monoclonale au cours de l'évolution.
· Surveillance à vie en raison du risque
d'évolution vers un myélome multiple.
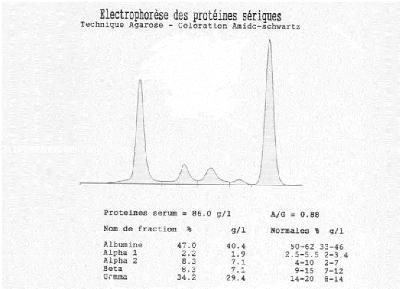
Figure 5: Profile électrophoritique d'un
patient atteint le myélome multiple classique.
+ Macroglobulinémie de
Waldenström:
· Macroglobulinémie de Waldenström:
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
67
|
|
|
2 % des Ig monoclonales.
· prolifération de cellules lymphoïdes B de
maturation intermédiaire entre le petit lymphocyte et le plasmocyte,
excrétant une IgM monoclonale dite
macroglobuline.
· manifestation cliniques: fièvre, sueurs nocturnes,
adénopathies,
hépatosplénomégalie, neuropathie
périphérique, syndrome d'hyperviscosité.
· diagnostic:
· Ig monoclonal IgM > 5 g/l.
· myélogramme et BOM: prolifération
lymphoïde polymorphe comportant
lymphocytes, lymphoplasmocytes et plasmocytes.
+ Maladies des chaînes lourdes:
· syndromes immunoprolifératifs
caractérisés par la production d 'Ig monoclonales
incomplètes sous forme de chaînes lourdes
délétées sans chaines légères.
· électrophorèse le plus souvent normale (Ig
< 1g/l).
· diagnostic sur l'immunoélectrophorèse ou
l'immunofixation.
· trois types:
-Maladie des chaînes lourdes alpha: la plus
fréquente; sujets jeunes du pourtour méditerranéen;
tableau de malabsorption intestinale sévère.
-Maladie des chaînes lourdes gamma: présentation de
type lymphome. -Maladie des chaînes lourdes mues: très rares.
+ MGUS:
· Gammapathies monoclonales de signification
indéterminée (MGUS):
· 60 % des Ig monoclonales; IgG (70 %), IgA (15 %), ou IgM
(15 %).
· découverte d'une Ig monoclonale de manière
fortuite.
· examens para cliniques:
Électrophorèse des protéines
sériques.
Immunoélectrophorèse ou immunofixation des
protéines sériques. NFP, calcémie,
créatininémie.
Myélogramme.
Radiographies osseuses: crâne, bassin, colonne dorsale et
lombaire, humérus, fémur, thorax; éventuellement.
IRM du squelette axial.
Électrophorèse et
immunoélectrophorèse ou immunofixation des protéines
urinaires.
· Critères de définition des MGUS:
Chapitre 2 : Etude descriptive des principales
protéines sériques
|
68
|
|
|
Malade asymptomatique ne présentant pas de: lésion
lytique osseuse, anémie, hypercalcémie, insuffisance
rénale.
Taux de l'Ig monoclonale sérique < 30 g/l.
Pas d'excrétion urinaire de chaînes
légères (ou taux très faible). Plasmocytose
médullaire < 10 %.
Stabilité de l'Ig monoclonale au cours de
l'évolution. ? Evolution des M GUS:
Évolution possible vers un myélome multiple (IgG
et IgA) ou une lymphopathie maligne (IgM) après parfois de très
nombreuses années: risque actuariel de transformation maligne de 15 %
à 10 ans et 30 % à 20 ans.

Surveillance:
Après 3 mois puis tous les 6 mois.
Clinique et biologique: électrophorèse des
protéines sériques, NFP, calcémie,
créatininémie, excrétion urinaire de chaînes
légères.
Figure 6 : Profile électrophoritique d'un
patient atteint le syndrome MOUS.
d. Profils immunitaires oligoclonaux: >
Immunodéficience sévère.
> Certains types de cancers.
> Maladies auto-immunes.
Chapitre 3
Etude de quelques syndromes
Chapitre 3: Etude de quelques syndromes
|
68
|
|
|
Introduction:
Il y a plusieurs syndromes qui dues a cause des anomalies des
protéines sériques parmi ses syndromes les plus important sont
les suivants, en les résumé tous, mais en prend le syndrome
inflammatoire comme exemple on l'étude plus détaillé.
A) SYNDROME DE DÉNUTRITION:
> Définition : Dénutrition =
déficit d'apport nutritionnel principalement
quantitatif.
> Mécanismes :
· Dénutrition exogène :
· Carence d'apport (anorexie mentale, cancer,
malabsorption).
· Dénutrition endogène :
· Maladies inflammatoires (Maladie infectieuses,
auto-immunes,
Cancers...).
· Fuites (cutanées, rénales,
intestinales).
· Défaut de synthèse (Insuffisance
hépatocellulaire).
· Dénutrition mixte.
> Evaluation : Clinique,
anthropométrique, biologique.
> Marqueurs biochimiques:
· Marqueur « idéal » :
· Dépendre essentiellement de l'état
nutritionnel.
· Varier significativement de façon
précoce.
· Profil de base :
· 2 marqueurs de dénutrition = ALB + PALB.
· 1 marqueur d'inflammation = ORO.
· plus éventuellement RBP ou TRF.
> Index biologique ou clinico-biologique:
· Index de Buzby ou N R I :
· 1,519 x ALB (g/l) + 0,417 x (poids actuel / poids
idéal) x 100.
· N > 97,5 ; 83,5 < modérée < 97,5 ;
sévère < 83,5.
· P I N I :
· [CRP (mg/l) x ORO (mg/l)] / [ALB (g/l) x PALB (mg/l)].
· Risque : faible 1-10 ; modéré 11-20 ; de
complications 21-30 ; vital >30.
> Exemples de profils nutritionnels
:(Figure7)
|
Chapitre 3: Etude de quelques syndromes
|
69
|
|

Figure 7: Comparaison entre des profils nutritionnels.
a) Dénutrition exogène débutante sans
inflammation, PALB diminue ALB et ORO = N.
b) Dénutrition exogène chronique sans inflammation
PALB et ALB diminue ORO = N.
c) Dénutrition endogène isolée avec
inflammation PALB et ALB diminue ORO augmenté.
d) Dénutrition mixte, endogène avec inflammation
et exogène PALB et ALB diminue, ORO augmenté.
B) SYNDROME INFLAMMATOIRE:
> Définition : Réaction
inflammatoire = réponse de l'organisme à une agression tissulaire
;
· d'origine exogène (infection, traumatisme physique
ou chimique....).
· d'origine endogène (immunologique, tumorale ).
> Mécanisme:
PRI-(ALB, PALB, RBP, TRF).
PRI+ (CRP, AAT, ORO, HPT, CER, FIB).
Foyer inflammatoire Cytokines Foie


Schéma 2 : mécanisme du syndrome
inflammatoire.
> Marqueurs biochimiques:
· Marqueur « idéal » :
Varier exclusivement avec une inflammation, sans liaison à la
cause, Cinétique de variation rapide, amplitude de variation
significative et proportionnelle au degré de l'inflammation.
· Profil de base : 1 marqueur
cinétique rapide = CRP et 2 marqueurs cinétique
intermédiaire = ORO + HPT.
· Recherche de pathologies associées
:
|
Chapitre 3: Etude de quelques syndromes
|
70
|
|
|
|
|
|
|
|
|
mri Adlène
|
|
|
|
|
|
Hémolyse ? HPT, Carence martiale ? TRF.
Dénutrition ? ALB, TRF, Fuites protéiques Ur ? ALB,
ORO. ? Electrophorèse des protéines sériques
:

Figure 8: Electrophorèse des protéines
sériques au cours du syndrome inflammatoire.
C) SYNDROME NEPHROTIQUE:
> Définition : purement biologique
associant 3 signes: - protéinurie d'origine glomérulaire > 3
g/24h,
- hypoprotidémie < 60 g/l,
- hypoalbuminémie < 30 g/l.
> Electrophorèse des protéines
sériques:
|
Chapitre 3: Etude de quelques syndromes
|
71
|
|
Protéinurie = 10,1 g/24H
Diminution d'Albumine.
Augmentation d'á2-globulines. Diminution de ã
globulines.
Figure 9: Electrophorèse des protéines
sérique au cours du syndrome néphrotique.
D) GAMMAPATHIES:
|
Chapitre 3: Etude de quelques syndromes
|
72
|
|
> Schéma d'investigation dans le sérum
:(Schéma 3)

Figure 10: Electrophorèse des
protéines sérique d'une
personne atteint de gammapathies.
|
Chapitre 3: Etude de quelques syndromes
|
73
|
|
Etude détaillé d'un syndrome : Le
syndrome inflammatoire.
1) INFLAMMATION:
PHLEGMASIE OU INFLAMMATION : classe de maladie
très fréquente, consistant en une surexcitation qui appelle le
sang dans les vaisseaux capillaires d'un organe, d'où résulte de
la douleur, de la chaleur, du gonflement, etc., phénomènes
caractéristiques de l'inflammation. Le mot phlegmasie, qui, selon
Gallien, signifiait toute inflammation avec fièvre, est plus
particulièrement consacré aujourd'hui à désigner
l'état inflammatoire des organes intérieurs.
LITTRÉ E. et ROBIN Ch.
Dictionnaire de
médecine, de chirurgie et de
pharmacie
Éditions J.B. Baillère et Fils, Paris, 1878
2) DEFINITION:
La réaction inflammatoire (RI) : est un
processus non spécifique de défense de l'organisme contre une
agression tissulaire visant; tout en empêchant la progression de
l'inflammation, à cicatriser le tissu blessé.
C'est une Processus tissulaire dont la finalité est de
rétablir l'homéostasie. L'agression peut être d'origine:
® Exogène: infectieuse
(bactéries, virus, parasites, champignons), tumorale, chimique, physique
(traumatique, thermique, microcristaux, radique).
® Endogène: immunologique,
hypersensibilité, secondaire à une nécrose tissulaire
(IDM).
La réaction inflammatoire comporte des
phénomènes : ® Locaux : cellulaires, humoraux, vasculaires.
® Généraux : PRI, hormones, hématologiques.
3) SYNDROME INFLAMMATOIRE:
Modifications biologiques systémiques survenant au
cours des RI, principalement : augmentation de la Vitesse Sédimentaire,
modification du tracé de l'électrophorèse des
protéines sériques, modification du taux des PRI.
Les conséquences cliniques peuvent être:
|
Chapitre 3: Etude de quelques syndromes
|
74
|
|
· Purement locales:
· Ou s'accompagner de signes généraux :
? Fièvre.
? Altération de l'état général :
Amaigrissement ++.
4) INTERET:
® Prévalence: 25-30% des patients consultants ou
hospitalisés. ® Témoigne d'une pathologie organique non
spécifique.
® Marqueur évolutif de nombreuses maladies et
permettra de confirmer
l'efficacité des traitements proposés.
® Valeur discriminative de certains marqueurs.
® Gravité : état de choc avec SDMV si RI
généralisée.
5) PHYSIOPATHOLOGIE: Quatre séquences
d'évènements complexes et intriqués composent la RI:
1. Phase d'initiation.
2. Phase d'amplification.
3. Phase de stabilisation.
4. Phase de résolution.
|
Chapitre 3: Etude de quelques syndromes
|
75
|
|
1) INITIATION : fait suite à un signal de
danger d'origine exogène ou endogène et qui met en jeu des
effecteurs primaires.


Figure 11: Phase d'initiation du syndrome
inflammatoire.
|
Chapitre 3: Etude de quelques syndromes
2) AMPLIFICATION : mobilisation et l'activation
d'effecteurs secondaires.
|
76
|
|
|
|
|
|
|
|
|
|
|
|
|
Figure 12: Phase d'amplification du syndrome
inflammatoire (pré activation des cellules
inflammatoires).
|
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
|
Chapitre 3: Etude de quelques syndromes
AMPLIFICATION (suite):
|
77
|
|
|
|
|
|
|
|
|
|
Figure 13: Phase d'amplification du syndrome
inflammatoire (activation des cellules inflammatoires).
|
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|

78
Chapitre 3: Etude de quelques syndromes
Belaouar Hamza/Lamri Adlène
|
Chapitre 3: Etude de quelques syndromes
3) STABILISATION : Par neutralisation des
facteurs de l'inflammation.
4) REPARATION ou RESOLUTION : tend à
restaurer l'intégrité du tissu agressé.
|
79
|
|
|
|
|
|
|
|
|
|
|
|
|
Tableau 6 : répartition de la réponse
inflammatoire.
|
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
6) MARQUEURS BIOLOGIQUES DU SYNDROME INFLAMMATOIRE: a.
VITESSE DE SEDIMENTATION(VS):
VS : distance parcourue en une heure par des
hématies sédimentant dans un tube sous l'action de la
gravité.
C'est un marqueur classique du Syndrome inflammatoire. ®
Méthode de Westergren (Fahreus, 1920);
· Simple, rapide, économique.
· Dépistage et suivi du SI.
Mesure VS à la 2e heure: pas
d'intérêt spécifique. > Le résultat de la
lecture de la VS dépend :
® Des hématies ; nombre, forme et volume.
® Du plasma : facteurs qui favorisent la formation de
rouleaux de sédimentation :
· Protéines asymétriques lourdes
chargées négativement : le Fibrinogène
++, les L- et ã-globulines et #177; á2-globulines.
· chaleur et acidose.
® De l'hématocrite : influence la VS à la
2°heure. ® Non influencée par la température
corporelle. > VS : DELAIS DE MODIFICATIONS:
® Fibrinogène ++ (80%) :
s'élève en 3-4 jours et retour à la normale plusieurs
semaines après une infection.
® VS = indicateur tardif du SI avec une cinétique
très lente.
® VS = marqueur global et indirect du SI.
® VS non spécifique du SI.
VS : VARIATIONS PHYSIOLOGIQUES ET VALEURS NORMALES A LA
1ère HEURE:
Age Hommes Femmes
< 50 ans 15 mm 20 mm
> 50 ans 20 mm 30 mm
Tableau 7 : Variation de la VS du Fibrinogène
selon l'âge et le sexe.
> FACTEURS ABAISSANT LA VS :
· Anomalie des GR : microcytose, polyglobulie,
hémoglobinopathie.
· Hémolyse: Haptoglobine diminue.
· Hypofibrinémie: fibrinolyse.
· Syndrome néphrotique et fuites urinaires de
protéines.
· Hypogammaglobulinémie Hyperviscosité.
· Cryglobulinémie.
· Leucocytose > 50 000 /mm3.
· Corticoïdes.
· Cachexie.
· Mesure VS plus de 2H après le
prélèvement.
> FACTEURS AUGMENTANT LA VS :
· Âge avancé.
· Sexe féminin.
· Grossesse.
· oestrogènes (via fibrinogène).
· Anémie si Ht < 30%.
· Macrocytose.
· Hypogammaglobulinémie.
· Hypercholestérolémie,
hypertriglycéridémie.
· Héparine.
· Insuffisance rénale.
· Insuffisance cardiaque.
· Tube non vertical.
· VS élevée : peut
refléter un syndrome sédimentaire uniquement.
· VS normale : n'élimine pas un
syndrome inflammatoire. b. MODIFICATIONS DE L'HEMOGRAMME :
® Anémie ;
· Normochrome, normocytaire puis microcytaire,
arégénérative et modérée dès la
3e semaine.
· Fer sérique bas, ferritinémie
élevée, transferrine abaissée (CPT normale ou basse).
· Séquestration de fer par les macrophages.
® Thrombocytose.
® Hyperleucocytose à neutrophile > inconstante.
® Action des growth factors et IL-1 sur la moelle osseuse. c.
MODIFICATIONS NON SPECIFIQUES :
o LECTROPHORESE DES PROTEINES SERIQUES :
> Signification :
® Hyper alpha globulinémie évoque un SI ;
· Migrent en a 1 : Orosomucoïde, Alpha
chymotrypsine.
· Migrent en a 2 : Haptoglobine,
Céruléoplasmine.
® Migrent en Bêta : Fibrinogène, Bêta
globulines.
® Migrent en Gamma : CRP, y-globulines.
® Fibrinogène et CRP ne modifient pas le
tracé.
® L'albumine = PRI négative.
® Explore aussi :
· La fonction hépatique.
· L'état nutritionnel.
® L'interprétation est difficile en cas ;
· Entéropathie exsudative.
· Syndrome néphrotique.
· Malnutrition protéique.
· Insuffisance hépatocellulaire.
® Délai de modifications : Très lent et peu
spécifique.
® Examen peu sensible mais permet d'identifier "au coup
d'oeil".
® Hyper alpha globulinémie et hypoalbuminémie
en rapport avec un SI.
® Gammapathie poly- ou monoclonale =:). augmentation de la
VS.
® un bloc h évocateur d'une cirrhose.
® EPP = marqueur global et indirect de
l'inflammation. Quel marqueur idéal de la réaction inflammatoire
?
® Le marqueur idéal de la réaction
inflammatoire doit avoir les qualités suivantes:
· Rapport exclusif avec la réaction
inflammatoire.
· Non lié à la cause de l'inflammation.
· Cinétique rapide.
· Augmentation significative pour une RI
modérée.
· Augmentation proportionnelle au degré de la RI.
· Dosage facile, reproductible, standardisable.
· Coût modéré du dosage.
· Excellentes VPP et VPN.
7) PROTEINE DE LA REPONSE INFLAMMATOIRE (PRI):
> ACUTE PHASE PROTEINS:
Les PRI = protéines dont le taux varie au moins de 25%
lors de la réaction inflammatoire. Aucune PRI parfaite.
> MODIFICATION DES TAUX DES PRI:
· AUGMENTATION - PRI ? : V'
Protéine C-réactive (CRP).
V' Protéine sérique amyloïde A (SAA).
V' Orosomucoïde (á1-glycoprotéine acide). V'
á2-macroglobuline.
V' Procalcitonine (PCT).
V' á2-macroglobuline.
V' Anti-protéases ; á1-antitrypsine;
á1-antichymotrypsine.
V' Protéines de transport ;
Céruléoplasmine; Haptoglobine.
V' Fractions du complément ; C3; C4; C1-INH (inhibiteur) ;
Facteur B.
V' Protéines de la coagulation et fibrinolyse;
· Fibrinogène; Plasminogène; Protéine
S.
· Activateur tissulaire du plasminogène.
· Inhibiteur de l'activateur du plasminogène.
· DIMINUTION - PRI È: V'
Albumine.
V' Transferrine.
Chapitre 3: Etude de quelques syndromes
|
84
|
|
|
V' Apolipoprotéine A1.
V' Préalbumine.
V' á-foeto-protéine (fetuine).
V' Facteur XII.
V' Insulin-like growth factor I (IGF-I). >
Propriétés des PRI:
® Production ++ FOIE.
® Influence principale de IL6 ++, IL1, TNFá.
® Rôle de défense;
· Opsonisation.
· activation du système du complément.
· élimination de substances toxiques.
· transport protéines.
· inhibition protéases.
> PROPRIETES BIOLOGIQUES DES PRI ? :
|
|
|
PROTEINE
|
GROUPE
|
MOBILITE
ELECTROPHORETIQUE
|
DEMI-VIE
(JOUR)
|
CONCENTRATION
(g/l)
|
VARIATIONS
PATHOLOGIQUE
|
OROSOMUCOIDE
|
II
|
a 1
|
2,3
|
0,5-1
|
1,5-2,5
|
á 1 ANTITRYPSINE
|
II
|
a 1
|
4,0
|
1,5-3
|
|
á 1 ANTICHYMOTRYPSINE
|
II
|
a 1
|
?
|
0,2-0,5
|
|
SERUM AMYLOID A
|
IIII
|
a1
|
1,0
|
10x10-3
|
|
HAPTOGLOBINE
|
II
|
a 2
|
4,0
|
0,8-2
|
3-8
|
CERULOPLASMINE
|
I
|
a 2
|
2,5
|
0,3-0,6
|
|
FIBRINOGENE
|
II
|
13-y
|
4-6
|
2-4
|
|
CRP
|
III
|
y
|
1,0
|
<0,006
|
0,015-0,3
|
|
Tableau 8 : Propriétés biologiques
des protéines inflammatoires.
> Problèmes rencontrés avec les
PRI?
® L'amplitude de variation au cours de la RI est
différente d'une PRI à l'autre.
· x 1,5 : fraction C3, Céruléoplasmine.
Chapitre 3: Etude de quelques syndromes
|
85
|
|
|
· x 2- 4 : Orosomucoïde, á1-antitrypsine,
á1-antichymotrypsine, fibrinogène, haptoglobine.
· x 1000: CRP, SAA.
· Diminué : Albumine, Transferrine.
® La cinétique de variation des protéines non
homogène.
· Rapide : CRP, SAA, Alpha-1-antichymotrypsine.
· Plus lente pour les autres PRI.
· L'Albumine a une demi-vie de 15-20 j et la
pré-Albumine de 2 jours. ® La réponse aux ttt non
identique.
· La CRP n'est pas modifiée par les
corticoïdes.
® L'association de plusieurs situations pathologiques peut
aboutir à des valeurs normales ou basses pour certaines
protéines:
· TRF et carence martiale; dénutrition
protéique.
· Haptoglobine et hémolyse.
· Orosomucoïde et fuite urinaire de protéines
(moindre poids moléculaire).
· C3 et activation du complément par les CIC
(baisse) et la RI (hausse).
· Albumine et fuite protéique;
dénutrition.
· PRI et insuffisance hépatiques.
Chapitre 3: Etude de quelques
syndromes
|
86
|
|
|
|
|
|
Tableau 9: Facteurs susceptibles de modifier le
dosage sérique des protéines de l'inflammation.
+ HAPTOGLOBINE:
® Alpha 2 glycoprotéine
synthétisée par le foie et qui se combine à l'Hb libre
pour le recyclage du fer.
® Délais de modifications;
·
Cinétique lente ? Redondance avec la
VS.
· Variant parallèlement à
l'Orosomucoïde (x1, 3 en pourcentage).
· Augmente après 3-4 jours et 1/2
vie 3 à 6 j. ® Variations physiologiques;
· Hausse:
?
Réaction inflammatoire chronique.
· Baisse:
?
Hémolyse; Traitement par la Dapsone
(hémolyse).
|
|
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
|
Chapitre 3 : Etude de quelques syndromes
o Nouveau né.
o Insuffisance hépatique très sévère
(TP < 50%).
® Permet (avec la CRP) :
· d'infirmer un SI à VS
accéléré.
· ou d'affirmer un SI à VS normale.
· Diagnostic des syndromes hémolytiques (LED,
anémie hémolytique auto
immune...).
TRANSFERRINE : PRI 0:
® Protéine de transport du fer,
synthétisée par le foie.
® Délai de modification :
· Lent.
· Augmente après 3-4 jours et 1/2 vie de 8 jours.
® Diagnostic des carences martiales.
® Utile au dépistage des hémochromatoses.
® Variations physiologiques;
· Varie peu avec l'âge, régulé par les
niveaux de fer.
· Augmentation de sa synthèse pendant la grossesse
(oestrogènes).
· Le taux varie chez l'adulte sain de 2 à 3 g/l.
® Baisse;
· RI de façon parallèle à
l'albumine.
· Dénutrition, carence en vit C.
· Insuffisance hépatocellulaire.
· Fuite protéique (glomérulaire, intestinale,
brûlures).
® Hausse;
· Carence martiale.
· Hépatite virale.
|
87
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
|
Chapitre 3 : Etude de quelques syndromes
· Oestrogénothérapie.
· Thiazidiques.
· Hypoandrogénie.
v FERRITINE:
® Famille des isoferritines, protéines de haut
PM:
· Intracellulaires, réserve échangeable du
fer.
· Ou sériques de contenu faible en fer.
® Délai de modification : Lent.
® Variations physiologiques;
· Homme : 30-300 ug/l.
· Femme : 20 à 200 ug/l.
· Basse à la puberté son taux augmente avec
l'âge.
® Diagnostic de la carence martiale et des surcharges en
fer.
® N'est pas un marqueur de l'inflammation en
première intention.
® Baisse:
· Carence martiale.
® Hausse:
· Syndromes inflammatoires.
· Maladie de Still (très spécifique).
· Anomalie de l'érythropoïèse.
· Lyse cellulaire aiguë : infarctus, hépatite,
rhabdomyolyse, hémolyse.
· Cirrhose, hépatocarcinome.
· Hémochromatose.
v ALPHA -1 - ANTICHYMOTRYSINE:
® 6-6 Alpha-1-antichymotrypsine.
® Anti protéase dont la synthèse est
hépatique.
|
88
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
|
89
Chapitre 3 : Etude de quelques syndromes
® La demi-vie courte= 2 jours.
® Taux habituel = 20,3-0,6 g/l.
® Augmentation précoce en de SI : 1 à 2 g
/l.
® Marqueur le plus sensible et le plus spécifique de
la RI (VPN 95%).
v FRACTION C3 DU COMPLEMENT:
® Activation en cascade des protéines du
complément au cours de nombreux processus : lyse cellulaire,
opsonisation, activité des neutrophiles et monocytes etc.
® Synthèse foie et macrophage.
® Trois voies d'activation:
· classique, initiées par le complexe Ag-Ac.
· alterne, initiée par des substances naturelles
(paroi bactérienne, venin..).
· voie des lectines.
· Carrefour : fraction C3 dont le clivage aboutit à
la voie terminale et à action biologique.
® La fraction C3 baisse lorsque le complément est
activé (présence de complexes immuns circulants):
· LED en poussée, PR avancée.
· Certaines infections: endocardite, infection à
méningocoque coli.
· Anémie hémolytique.
· Glomérulonéphrite.
· Insuffisance hépatocellulaire
sévère.
® La fraction C3 augmente dans les autres SI et en cas de
cirrhose biliaire primitive.
® Son taux est de 0,15 à 2 g/l et ne varie pas avec
l'âge.
v SAA (serum amyloïde A protein):
® Apolipoprotéine de type HDL épurant le
cholestérol lors de la RI.
® Synthèse : foie, poumon, rein, rate, intestin.
Chapitre 3 : Etude de quelques syndromes
|
90
|
|
|
® effet chimiotactique pour les leucocytes et favorise leur
adhésion sur les parois vasculaires.
® Peut être dégradée en protéine
A amyloïde.
® Taux habituel = 2,5 mg /l.
® 1/2 vie courte = un jour.
® Augmentation précoce en cas de SI: 50-1000 mg
/l.
® Serait plus spécifique et meilleure VPN que la
CRP. ® Marqueur d'une évolution possible vers l'amylose. C
- REACTIVE PROTEINE (CRP) :
® Protéine pentamérique non glycosylée
dont la synthèse est hépatique sous l'action des cytokines (IL6
surtout).
® Connue depuis 1930 : protéine qui précipite
en présence du polysaccaride (protéine - C) du pneumocoque.
® Prépare la phagocytose (opsonisation) en se fixant
sur les cellules altérées et aux substances
étrangères facilitant leur reconnaissance et leur
élimination.
® Induit la sécrétion des cytokines et active
le complément.
® Délais de modifications :
· Cinétique très rapide :
· S'élève dès la 8°heure et sa
1/2 vie est de 12 H.
· Peut varier d'un facteur 10 à 400.
® Variations physiologiques :
· Pas de modification avec l'âge.
· Non modifiée par les corticoïdes et
immunosuppresseurs.
® La CRP ne fait pas partie des PRI impliquées dans
la VS.
® Sa sensibilité permet de détecter des
inflammations modérées comme les manifestations
athéromateuses.
® L'élévation de la CRP est
corrélée au risque de fracture de la plaque d'athérome et
à celui d'infarctus du myocarde chez les patients souffrant de syndrome
coronaire aigu.
|
Chapitre 3: Etude de quelques syndromes
® Baisse:
· IHC (très sévère uniquement).
® Hausse:
· Réaction inflammatoire jusqu'à 300 mg.
· Infections : bactériennes ++.
® Témoin (diagnostique et efficacité
thérapeutique) de l'infection.
® Marqueur d'évolutivité des pathologies
inflammatoires.
® Excellent rapport coût / rentabilité
diagnostique.
® Marqueur sérique le plus utile au clinicien pour
confirmer et suivre un SI. 8) PROFIL PROTEIQUE:
y' Concept né en 1984.
y' Dosage de 3 PRI ? (CRP, HPT, ORO) -3 PRI È (pré
ALB, ALB, TRF) - Fraction
C3, IgA, IgG, IgM.
y' Orienter la recherche en cas de SI inexpliqué.
y' La lecture simultanée des variations des
différentes protéines permet en plus : ® De palier aux plus
beaucoup de variations (âge, sexe, cinétique).
® D'apprécier les variations d'amplitudes des
protéines.
® De mettre en évidence des mécanismes
contradictoires.
® De retrouver une anomalie des immunoglobulines.
® D'envisager ensuite un profil plus ciblé :
· Profil protéique inflammatoire : (ORO, HPT, CRP)
(CRP, HPT) (CRP,
ORO).
· Profil protéique hémolytique: (ORO,
HPT).
· Profil protéique nutritionnel : (AlB, ORO,
préALB, RBP).
® Expression des concentrations en % des valeurs normales
pour le sexe et l'âge. ® Aucun bénéfice : le
meilleur profil ne donnera jamais un diagnostic.
|
91
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
|

Chapitre 3: Etude de quelques syndromes
Figure 14,15: Profil protéique des
protéines sériques inflammatoires. >
Distinction infection - inflammation:
® PROCALCITONINE:
· Intéressante pour différencier les maladies
inflammatoires non infectieuses des infections,
· Cinétique rapide (augmentation dès la
3e heure).
· N'augmente pas au cours des poussées des
principales affections inflammatoires, ni au cours des viroses.
· Augmente au cours des infections bactériennes,
parasitaires ou fongiques sévères.
· Marqueur de gravité?
· Non pathognomonique d'infection bactérienne.
· Étude en association avec le tableau clinique et
les autres anomalies biologiques.
Chapitre 3: Etude de quelques syndromes
|
93
|
|
|
9) DEMARCHE DIAGNOSTIQUE
> Circonstances de découverte:
® Le plus souvent, le syndrome inflammatoire est
associé à une pathologie connue ou aisément
identifiable;
® Parfois mis en évidence chez des sujets sans
affection évolutive connue mais présentant une altération
de l'état général, une fièvre;
® Parfois de découverte fortuite chez un sujet
asymptomatique.
> DIAGNOSTIC POSITIF:
® Il est purement biologique.
® Un syndrome inflammatoire est
défini par :
· l'élévation d'au moins 2 protéines
de l'inflammation.
· ou de la vitesse de sédimentation et d'une
protéine de l'inflammation. > DIAGNOSTIC
ETIOLOGIQUE:
® Un syndrome inflammatoire témoigne le plus souvent
d'un processus pathologique.
® La démarche diagnostique passe
systématiquement par;
· l'interrogatoire.
· l'examen physique.
· et la réalisation d'un bilan paraclinique.
® En pratique, 2 situations peuvent s'observer :
· SI est associé à une pathologie
connue ou aisément identifiable.
· Aucune maladie ne semble expliquer le
SI.
® Deux situations sont possibles:
· soit le SI est associé à une
fièvre.
· soit il est associé à une AEG.
· fièvre et AEG peuvent coexister.
|
Chapitre 3 : Etude de quelques syndromes
|
94
|
|
> Le syndrome inflammatoire est associé
à une symptomatologie fébrile :
® Recherche d'une infection systématique.
® CRP.
· Supérieure à 100 mg + PPN : infection
bactérienne dans 85% des cas dans les fièvres prolongées
(réserve pour Horton).
· Marqueur d'efficacité des antis infectieux
grâce à sa cinétique rapide.
® Affections parfois silencieuses sur le plan clinique.
® Endocardite subaiguë.
· Impose la réalisation d'hémocultures
répétées.
· Échographie cardiaque (ETO ++).
> Maladies systémiques et
connectivites.
® Etape difficile en raison de la richesse des
étiologies possibles et de l'incertitude diagnostique liée aux
formes de début ou aux formes atypiques.
® Maladies systémiques et connectivites ;
· Polyarthrite rhumatoïde (FR, Radio
squelette) :
® CRP augmente > 40 mg plus sensible de
l'activité que VS, haptoglobine et fibrinogène.
® CRP restant élevée : indice de progression
rapide des lésions radiologiques.
® Dosage SAA ou á1-antichymotrypsine dépiste
les PR en activité avec CRP normale (synovite).
· Syndrome Gougerot-Sjögren (biopsie
salivaire) :
® Gammapathie polyclonale (hyper IgG) VS
élevée.
® CRP normale ou basse.
® Les autres PRI varient peu.
· Maladie lupique (FAN, anti-DNA natifs)
;
® VS élevée (> 80mm/h dans 50%).
® VS négligeable => rechercher une
Cryoglobulinémie. Belaouar Hamza/Lamri Adlène
Chapitre 3 : Etude de quelques syndromes
|
95
|
|
|
® Gammapathie polyclonale : 75% des cas.
® Anémie inflammatoire ou hémolytique
fréquente.
® Leucopénie avec lymphopénie < 1500 / ml
et thrombopénie < 100 000 /ml.
® CRP normale ; si élevée rechercher une
infection.
® SAA peut être élevée.
® La baisse du complément précède une
poussée.
· Sclérodermie ;
® VS normale si élevée rechercher une hyper
gamma globulinémie.
® CRP normale, SAA discrètement augmentée.
® Autres PRI négligeables.
· Dermatopolymyosites ;
® VS légèrement augmentée.
® CRP négligeable si élevée rechercher
une infection.
® PRI négligeable et si élevées
rechercher un cancer.
· Maladie de Horton et PPR ;
® VS peut dépasser 100 mais peut être normale
< 20 mm dans 8,5 % des cas (le pronostic oculaire est le même).
® La CRP (et SAA) permet d'infirmer ou non la persistance
d'activité de la maladie devant une VS négligeable.
· Autres Vascularités (Takayashu,
PAN, Churg-Strauss) ;
® VS et PRI élevée + Gammapathie
polyclonale.
® CRP corrélée à l'activité de
la maladie.
® Pas de SI, si atteinte muqueuse localisée.
|
Chapitre 3: Etude de quelques syndromes
|
96
|
|
Conclusion:
® VS = marqueur classique du SI.
® CRP = meilleur marqueur /cinétique rapide.
® Recherche de la cause fonction des tableaux cliniques et
biologiques. ® Principales causes : infections ++, maladies de
système, cancers.
® Traitement du SI = celui de sa cause.
Matériels et Méthodes
Il s'agit d'une étude qui concerne le fractionnement des
protéines sériques de deux groupes des sujets ; malades et sains,
basée sur la technique d'électrophorèse sur gel
polyacrylamide.
Ce travail a été réalisé sur 04
échantillons présentant une maladie auto- immune ; Lupus (la
Lupus est une maladie généralement cutanée). Et 2
témoins (des sujets sains).
Les échantillons présentant la maladie auto-immune
appartiennent aux patients admis au service de médecine interne du CHU
Constantine.
Ce coté expérimental du mémoire a
été réalisé au laboratoire de Biochimie
Génétique-Centre de biotechnologie-Université Mentouri
Constantine.
Les protéines sériques extraites de ces
échantillons ont été fractionnées par 3
méthodes d'électrophorèse ; PAGE, SDS-PAGE, Acide-PAGE.
1. Matériel biologique:
Après la collecte des échantillons (sang
veineux) ces derniers sont
soumis à une centrifugation pendant 10 min
à 10000 rotations par
minutes (rpm). Le sérum récupéré est
conservé à - 20 °C.
N° d'échantillon 1 2 3 4 5
6
Symbole marqué sur l'eppendorf 16 26 H
25 AS A
Statut Malade Malade Témoin Malade
Malade témoin
Tableau 10: Les échantillons utilisés
pour l'électrophorèse sur gel polyacrylamide.
2. Méthode d'étude:
2-1 L'électrophorèse:
C'est un procédé biochimique qui permet le
fractionnement des molécules biologiques (protéines, acides
nucléiques) par le passage du courant électrique sur support
poreux en fonction de leur charge nette ou de leur poids moléculaire.
La vitesse de migration dépend non seulement de la charge
des protéines, de leur taille et de leur forme mais aussi des conditions
expérimentales de tels que le pH, la composition des solutions et le
support électrophorétique.
La révélation se fait après coloration
des protéines avec du bleu d'Aniline ou du bleu de Coomassie en
présence d'un fixateur acide le TCA (acide trichloracétique) ou
par la coloration d'un composé chimique associé à la
protéine comme dans
|
Matériels et Méthodes
|
100
|
le cas des glycoprotéines (réaction de SHIFF) et
des lipoprotéines (réaction au noir de sodium) ou, dans le cas
des enzymes, avec leur substrat en présence du coenzyme.
Le dispositif d'électrophorèse est constitué
d'un gel dans lequel sont déposés des échantillons et dont
deux extrémités opposées sont en contacte avec une
solution tampon dans laquelle baignent les électrodes. On distingue
différents types d'électrophorèse ; en milieu acide
(Acide-PAGE), l'électrophorèse en présence du
Sodium-Dodecyl-Sulfate (SDS-PAGE), l'isoélectrofocalisation...
4La technique SDS-PAGE:
Cette technique a été mise au point par LAEMMLI
(1970) où la séparation des molécules se fait en milieu
basique à pH=8.8 en présence d'un détergent, le
Sodium-Dodecyl-Sulfate qui masque la charge des protéines par sa propre
charge négative et permet donc de faire migrer les protéines
selon leurs poids moléculaires et leurs conformations uniquement.
2-2 Caractérisation des protéines
sériques:
2-2-1 Extraction des protéines sériques:
Elle a été réalisée à partir
du sérum des patients malades (lupus) obtenu après centrifugation
et recueilli dans des eppendorfs de 1.5 ml.
En premier lieu, on rajoute aux sérums 100ul de la
solution d'extraction composée de la solution stock à base de SDS
à 10% (voir annexe) et d'un réducteur de Dithiothréitol
(DTT) à 1% pour extraire et réduire nos protéines.
En second lieu, le contenu de chaque tube est vortexé puis
incubé à 60°C pendant 30min.
2-2-2 Réalisation de
l'électrophorèse:
Il s'agit d'une électrophorèse monodimensionnelle
en présence du SodiumDodécyl-Sulfate sur gel polyacrylamide
(SDS-PAGE) selon la méthode de LAEMMLI (1970) modifiée par SINH
et al. (1991) et par AMIOUR et al. (2002).
a. Préparation des gels:
Dans la méthode de séparation par SDS-PAGE nous
devons préparer deux types de gels : Un gel de séparation qui
permet de fractionner les différentes protéines et les
sous-unités protéiques selon leurs poids moléculaires et
un gel de concentration permettant de retenir les impuretés et de tasser
les protéines.
|
Matériels et Méthodes
|
101
|
Avant de préparer les gels on doit procéder au
montage des plaques, après les avoir nettoyées à
l'éthanol. On les place l'une contre l'autre en les séparant avec
deux éspaceurs dont la largeur est choisie, (voire annexe 2).
? Le gel de séparation (running gel):
Le gel est à T=12.8% et C=0.97%.Ces dimensions sont de
180x160x1.5 mm. Il est constitué d'acrylamide à 35% (p/v), de
N-N'-Méthylen-Bisacrylamide à 2% (p/v), de Tris HCL à
pH=8.8, de SDS à 10% (p/v) et d'eau distillée. La réaction
de polyacrylamide est catalysée par l'ammonium persulfate (APS) à
1% (p/v) et le TEMED. Une fois tous les constituants mélangés
(les catalyseurs sont ajoutés en dernier lieu), il est coulé
entre les plaques (montées auparavant) doucement pour ne pas faire de
bulles jusqu'à un niveau délimité sur la plaque pour
laisser la place au gel de concentration (à 4 cm de l'encoche). Ensuite,
on coule une fine couche de butanol pour égaliser la surface du gel et
pour éviter son contact avec l'air (pour faciliter la
polymérisation). Au bout de 30 à 45 minutes le gel prend, on se
débarrasse du butanol et on rince à l'eau distillée.
? Le gel de concentration (stacking gel):
Le gel est à T=2.8% et C=1.4%. Il a les dimensions de
180x40x1.5 mm.
Il est constitué de la même façon que le gel
de séparation avec une seule différence au niveau du Tris HCL qui
a un pH de 6.8.Le gel est coulé sur le gel de séparation, les
peignes sont posés bien centrés entre les plaques et sans faire
de bulles. Le gel prend après 45 à 60 minutes, les peignes sont
retirés soigneusement pour ne pas casser les puits. Enfin, on verse du
tampon dans les puits est on fait les dépôts.
b. Le tampon d'électrophorèse:
Le tampon de migration est constitué de glycine à
1.41% (p/v), de Tris à 0.3% (p/v) et de SDS à 0.1% (p/v), (voir
annexe 1).
c. La migration:
Après le dépôt des différents
échantillons ; la cuve d'électrophorèse (bac
inférieur) est remplie à un niveau suffisant avec le tampon
d'électrophorèse.
Ensuite, le bac supérieur situé entre les deux
plaques (bien serré contre les joints pour éviter les fuites) est
rempli lui aussi avec le même tampon jusqu'à ce que les faces
supérieures des gels soient immergées. Ensuite, ce dernier est
placé dans la cuve d'électrophorèse pour que les faces
inférieures des gels plongent dans le tampon. Enfin, la cuve est
fermée et est reliée à un générateur
102
Matériels et Méthodes
qui va assurer le passage du courant électrique. La
migration est menée à une intensité constante de
40mA/gel.
d. Fixation et coloration:
Après la sortie du front de migration (coloré en
bleu), la migration est arrêtée. Les gels sont
démoulés et récupérés dans des bacs en
plastique puis recouverts avec une solution de coloration est constituée
d'un fixateur des protéines, le TCA (acide trichloracétique)
à 60% et d'un colorant, le bleu de Coomassie R250. Les gels doivent
être maintenus en agitation pendant 24 heures pour éviter le
dépôt du colorant. Après ils sont décolorés
dans de l'eau.
4La technique PAGE:
Dans cette technique, la séparation des molécules
se fait en milieu basique à pH=8.8 en absence d'un détergent, le
Sodium-Dodecyl-Sulfate. Donc la migration des protéines se fait selon
leurs poids moléculaires, leurs conformations et leur charge
électriques.
2-3 Caractérisation des protéines
sériques:
2-3-1 Extraction des protéines
sériques:
Elle a été réalisée à partir
des mêmes échantillons utilisés dans la technique
SDS-PAGE.
En premier lieu, on rajoute aux sérums 100ul de la
solution d'extraction composée de l'urée, le glycérol,
triton x100 et d'un réducteur de Dithiothréitol (DTT) à 1%
pour extraire et réduire nos protéines.
En second lieu, le contenu de chaque tube est vortexé puis
incubé à 60°C pendant 30min.
2-3-2 Réalisation de
l'électrophorèse:
Il s'agit d'une électrophorèse
monodimensionnelle, cette méthode de séparation, par rapport
à la méthode SDS-PAGE est une méthode non
dénaturante en raison de l'absence de Sodium-Dodécyl-Sulfate
(SDS).
a. Préparation des gels:
Dans la méthode de séparation par PAGE nous devons
aussi préparer deux types de gels : Un gel de séparation et un
gel de concentration ressemblant à celle la méthode SDS-PAGE,
mais dans cette méthode on élimine le SDS dans les deux gels
(voir annexe 3).
|
Matériels et Méthodes
|
103
|
Avant de préparer les gels on doit procéder au
montage des plaques, après les avoir nettoyées à
l'éthanol. On les place l'une contre l'autre en les séparant avec
deux éspaceurs dont la largeur est choisie.
b. Le tampon d'électrophorèse:
Le tampon de migration est constitué de glycine à
1.41% (p/v), de Tris à 0.3% (p/v).
c. La migration:
Après le dépôt des différents
échantillons ; la cuve d'électrophorèse (bac
inférieur) est remplie à un niveau suffisant avec le tampon
d'électrophorèse.
Ensuite, le bac supérieur situé entre les deux
plaques (bien serré contre les joints pour éviter les fuites) est
rempli lui aussi avec le même tampon jusqu'à ce que les faces
supérieures des gels soient immergées. Ensuite, ce dernier est
placé dans la cuve d'électrophorèse pour que les faces
inférieures des gels plongent dans le tampon. Enfin, la cuve est
fermée et est reliée à un générateur qui va
assurer le passage du courant électrique. La migration est menée
à une intensité constante de 80mA/gel.
d. Fixation et coloration:
Après la sortie du front de migration (coloré en
bleu), la migration est arrêtée. Les gels sont
démoulés et récupérés dans des bacs en
plastique puis recouverts avec une solution de coloration est constituée
d'un fixateur des protéines, le TCA (acide trichloracétique)
à 60% et d'un colorant, le bleu de Coomassie R250. Les gels doivent
être maintenus en agitation pendant 24 heures pour éviter le
dépôt du colorant. Après ils sont décolorés
dans de l'eau.
4La technique Acide-PAGE:
La séparation des molécules se fait en milieu acide
à pH=3.2 en présence de l'acide ascorbique, ce dernier
accélère la réaction entre l'acrylamide et bis acrylamide,
donc une polymérisation rapide.
2-4 Caractérisation des protéines
sériques: 2-4-1 Extraction des protéines sériques:
Toujours réalisée à partir du même
sérum des patients malades (lupus) obtenu après centrifugation et
recueilli dans des eppendorfs de 1.5 ml.
En premier lieu, on rajoute aux sérums 100ul de la
solution d'extraction composée de la N N' méthyle Formamid,
saccharose (voir annexe 4).
|
Matériels et Méthodes
|
104
|
En second lieu, le contenu de chaque tube est vortexé.
2-4-2 Réalisation de l'électrophorèse:
Il s'agit d'une électrophorèse monodimensionnelle,
en présence de l'acide ascorbique.
a. Préparation des gels:
Dans la méthode de séparation par Acide-PAGE nous
devons préparer un seul type de gel:
Avant de préparer les gels on doit procéder au
montage des plaques, après les avoir nettoyées à
l'éthanol. On les place l'une contre l'autre en les séparant avec
deux éspaceurs dont la largeur est choisie.
Le gel est constitué d'acrylamide à 35% (p/v), de
N-N'-Méthylen-Bisacrylamide à 2% (p/v), d'acide ascorbique
à pH=3.2, de Lactate d'Aluminium et d'eau distillée. La
réaction de polyacrylamide est catalysée par le sulfate ferreux
et l'eau oxygénée (H2O2). Une fois tous les
constituants mélangés (les catalyseurs sont ajoutés en
dernier lieu), il est coulé entre les plaques (montées
auparavant) doucement pour ne pas faire de bulles. Ensuite, les peignes sont
posés bien centrés entre les plaques et sans faire de bulles. Le
gel prend après 45 à 60 minutes, les peignes sont retirés
soigneusement pour ne pas casser les puits. Enfin, on verse du tampon dans les
puits est on fait les dépôts.
b. Le tampon d'électrophorèse:
Le tampon de migration est constitué de glycine à
1.41% (p/v), de Tris à 0.3% (p/v).
c. La migration:
Après le dépôt des différents
échantillons ; la cuve d'électrophorèse (bac
inférieur) est remplie à un niveau suffisant avec le tampon
d'électrophorèse.
Ensuite, le bac supérieur situé entre les deux
plaques (bien serré contre les joints pour éviter les fuites) est
rempli lui aussi avec le même tampon jusqu'à ce que les faces
supérieures des gels soient immergées. Ensuite, ce dernier est
placé dans la cuve d'électrophorèse pour que les faces
inférieures des gels plongent dans le tampon. Enfin, la cuve est
fermée et est reliée à un générateur qui va
assurer le passage du courant électrique. La migration est menée
à une intensité de 400mA/gel et d'un voltage de 505v/gel.
La migration est achevée en 1heur 45 minutes.
|
Matériels et Méthodes
|
105
|
d. Fixation et coloration:
Après la sortie du front de migration (coloré en
bleu), la migration est arrêtée. Les gels sont
démoulés et récupérés dans des bacs en
plastique puis recouverts avec une solution de coloration est constituée
d'un fixateur des protéines, le TCA (acide trichloracétique)
à 60% et d'un colorant, le bleu de Coomassie R250. Les gels doivent
être maintenus en agitation pendant 24 heures pour éviter le
dépôt du colorant. Après ils sont décolorés
dans de l'eau.
Résultats et Discussion

«PAGE» « SDS-PAGE» «Acide PAGE»
Résultats et Discussion
Après la réalisation de différentes
techniques électrophorétique (Acide PAGE, PAGE 8.8, SDS-PAGE)
pour le fractionnement des protéines sériques de 6
échantillons dont 4 ayant une maladie auto-immune (LUPUS) et 2
témoins ; les résultats obtenus montrent que la séparation
au gel de polyacrylamide est satisfaisante par rapport au gel Acétate
cellulose.

«Gel de polyacrylamide» «Gel d'Acétate
cellulose»
Figure 16 : comparaison entre le résultat de
fractionnement sur gel d'acétate cellulose et sur gel
de
polyacrylamide.
D'après les figures ci-dessus on peut facilement
constate une différence dans la séparation entre les deux gels
qui réside dans le nombre des bandes protéiques et la
qualité de celles-ci.
En plus une nette différence a été
observée dans la séparation protéique sur gel de
polyacrylamide lui-même en allant d'Acide PAGE, PAGE 8.8, SDS-PAGE qui
est présent dans la localisation, l'intensité et la
qualité des bandes. (Voir figures ci-dessous).
Figure 17: Comparaison entre les résultats de
fractionnement sur gel Acide PAGE, SDS-PAGE, PAGE.

Bande claire : taux de protéine réduit.
Bande foncé : taux de protéine
élevé.
Les deux bandes identiques : même
taux de protéine.
Figure 18: variation des bandes protéiques;
malade-malade.
Taux élevé de cette protéine chez le
malade.
Taux réduit de la même protéine chez le
témoin.
Même taux de cette protéine chez le malade et le
témoin.
Résultats et Discussion
Quant aux profils protéiques, on peut dire qu'il existe
une variation entre les bandes protéiques des patients malades entre eux
d'une part et entre les patients malades et les témoins d'autre part
(voir figures ci-dessous).
Figure 19: variation des bandes protéiques;
malades-témoins.
|
Résultats et Discussion
|
109
|
Cette variation est due à l'élevation du taux des
protéines sériques qui caractérisent la maladie du lupus
plus particulièrement les protéines du fractionnement ã
par rapport aux témoins (gens non malades) et qui sont traduit par
l'intensité et/ou l'absence de la bande protéique ã (voir
figure ci- dessous).

26 H 25 A
Figure 20: comparaison entre deux profils;
malade-témoin.
Aussi une différence a été observée
entre les malades eux même et qui peut être probablement due
à la différence de ; l'âge, le stade de la maladie et/ou la
pathologie elle-même (voir figure ci-dessous).

Figure 21: comparaison entre les profils des malades.
De même les profils protéiques des témoins
présent aussi des faibles variations qui sont probablement en relation
avec ; l'âge et l'état physiologique de la
personne (voir figure).
Figure 22: comparaison entre les profils des
témoins.
Belaouar Hamza/Lamri Adlène
25 AS
16 26
Résultats et Discussion
110
H A
|
Résultats et Discussion
|
111
|
Cela implique que l'électrophorèse est un bon moyen
qui permet la séparation des protéines sériques et de
détecté les différences entre celle-ci
qualitativement et quantitativement.
Notre travail a été divisé en deux
parties;
Une partie bibliographique portant d'une part sur des
généralités sur les protéines sériques voir
l'hétérogénéité structurale, fonctionnelle
et sur l'échelle de concentration ; aussi sur les valeurs
sémiologiques de ces protéines dans le sang qui varient selon
l'état physiologique et pathologique.
D'autre part, sur l'étude descriptive des principales
protéines sériques et de quelques syndromes.
La partie expérimentale nous a permis de conclure que la
séparation des protéines sur gel de polyacrylamide donne une
meilleure résolution par rapport au gel acétate de cellulose
quantitativement et qualitativement.
Aussi, elle permet de visualiser le profil général
des protéines et ainsi elle permet d'orienter le diagnostic et de
déceler les maladies liées à ces protéines qu'il
conviendra d'explorer par la suite.
Références bibliographiques
|
Référence bibliographique
|
115
|
|
A.ADA, M. DJIBRILLOU, I. SOLY 1998 INTERET DU
DOSAGE DE L'ALPHA-FOETO-PROTEINE PLASMATIQUE-Médecine d'Afrique Noire-P
: 464.
A .Chaouia et all 1996 Dosage des
protéines sériques en vue d'établir des normes
Algérienne chez les enfants .Mémoire Constantine.
Baillargeon, Sylvie Lacroix 2004 LA DÉFICIENCE EN
FACTEUR
1 FIBRINOGÈNE UNE MALADIE HÉRÉDITAIRE DE LA
COAGULATION DU SANG.
Brabi Nedjoua, Nasri Keltoum, Zeghad Meriem 2000
Dosage des protéines plasmatiques mémoire de fin d'études
Constantine.
Charles A.Janeway, Kenneth Murphy, Paul Travers, Mark
Walport 2008 Immunobiology septième édition chapitres 3
et 4 Antigen Recognition by B-cell.
Céline Triboulet, Stephane Winnock 2005
Marqueurs biologiques en réanimation : inflammation et infection
(c-réactive, protein, procalcitonine)- Département
anesthésie réanimation 3 hôpital Saint André-CHU
Bordeaux-P : 3.
CL.AUDESE, F. Zouszair et all. 1978.Manipulation
d'analyses biochimiques, dosage colorimétrique .Ed Doin, Paris p168.
D. Laurent. 1992.Atlas de poche de
physiologie. Le sang 2eme édition .Ed. Flammarion Médecine
Sciences p: 60,63 -64,222- 223,336.
Dr. Fernando KEMTA LEKPA SYNDROME INFLAMMATOIRE.
G.Schapira1 970.Eléments de biochimie humaine.
Chimie
physiologique et sémiologique, les protéines
plasmatiques .Ed Flammarion, Paris P : 61,65-66,76-77,80-81,84-86.
Ginette Lupien, Nathalie Aubin, Claudine Amesse,
Louisette
Guy Gorochov Synthèse et Structure des
Immunoglobulines- Service d'Immunologie A Groupe Hospitalier
Pitié-Salpêtrière-
H. Lambart. L. Manuila et all 1972.Dictionnaire
français de Médecine et de Biologie .Tome 3.Ed. Masson, Paris
p225.
|
Référence bibliographique
|
116
|
|
Henniche Satouf et all 1996/1997.Dosage de la
protéine plasmatique en vue d'établir des normes
Algériennes chez les adultes .Mémoire Constantine.
HERBETH B., HENNY J. et SIEST G. 1983 Variations
biologiques et valeurs de référence de la transferrine, des
immunoglobulines et d'Ann. Biologie clinique. P: 41, 23-32.
J. Kruh, 1973 .Biochimie : étude
médicale et biologique 2eme édition, Ed .Herman, Paris: 115,
149,153.
Dr. Joëlle GOETZ 2006 Exploration
biologique de l'Immunité Humorale-Laboratoire
d'immunologie-Hôpital de Haute pierre (cours d'immunologie D 1/2006).
L. Guenet Année 2007-2008 LES
DYSGLOBULINÉMIES.
L. Guenet Année 2007-2008 Les
protéines plasmatiques DCEM 1- 1011043836.
Pr. Le Treut 5 octobre 2001 Les
protéines plasmatiques- Sémiologie Biochimique CHU de Rennes-2
rue Henri Le Guilloux, 35033 Rennes Cedex.
Dr. LIMEM Khalifa Cours de biochimie
clinique.
M.J. Foglietti, Percheron et all,
1980.Abrégée biochimie générale tome 1: les
protéines du sérum sanguin. Ed Masson, Paris, p : 71, 73,
78,79.
Pr. Marc Zandecki décembre 2006 MALADIE
DE
WALDENSTROM (et autres situations avec pic IgM)
Hématologie biologique- Faculté de Médecine - CHU 49000
Angers France.
MOUSSA IBRAHIM 2002-2003. Le
Protéinogramme chez les donneurs de Sang à Bamako.
Thèse-Bamako-Mali.
N. COLLET Novembre 2008 EXPLORATION BIOCHIMIQUE
DES PROTEINES- Laboratoire de Biochimie-.
Norman Dcherier, François Dragon, Mario Houde,
François Ouellet 2009 Protocoles de laboratoire
d'enseignement-Méthodologie biochimique-p: 13, 14,15.
|
Référence bibliographique
|
117
|
|
Dr. Omar DAHMANI, Dr. Amal BELCAID, Dr. Ouafa EL AZZOUZI,
Dr. Hayat EL HAMI LES IMMUNOGLOBULINES : STRUCTURE ET FONCTION.
P.Boulanger,J.Polonovski et all 1 966,Biochimie
médicale, Fascicule 1 ,les constituants des organismes vivants,8eme
édition, Ed Masson ,Paris :162,188,189,194,200.
P.Kamoun 1975 appareils et méthodes en
biochimie. Ed Flammarion médecine - sciences P: 19, 20,21.
P.Métais /J.Agneray
/G.Fernard/JC.Fruchart/JC.Jardiller/A.Hevo l/G.Siest/A.Stahl1
985Bioclinique 2 :Biochimie
métabolique ,Ed :Simep,Paris,p :183,184,185,187,188.
Dr. Pascal Sève, Professeur Christiane
Broussolle 2007 Immunoglobuline monoclonale-Faculté de
Médecine-Lyon Sud.
POL S., B. NALPAS, A. BEZEAND, CH. BRECHOT,
P.
BERTELOT Fréquence d'augmentation de
l'alpha-foeto-protéine au cours des hépatopathies non
néoplasiques d'origine alcoolique ou non.
Gastro. Entérol. Clin. Biol. 1983, 10 (2) : 112-116.
R.Walbaum 1971 Déficit congénital
en transferrine -Lille Médical3eme série. Tome XVI N°8.P
:1122-1124.
Véronique Phan Février 2008
Syndrome néphrotique: les nouveautés MD, MSc, FRCP(C)
Néphrologue-Pédiatre CHU Sainte-Justine.
Zenone T, Jaubert J. 1999 Les gammapathies
monoclonales. In : Rousset H, Vital Durand D, Dupont J.L. : Diagnostics
difficiles en médecine interne. Maloine ed, Paris ; 381-410.
Sites internet:
Syndrome de malabsorption septembre 1999 Société
Nationale Française de Gastroentérologie ;
http://www. snfge.org.
www.med.univ-rennes 1 .fr.
www.wikipedia.com.
www.orpha.net/data/patho/Pub/fr/LupusErythemateuxSystemique-FRfrPub124v01.pdf
|
Annexes
|
119
|
|
Annexe 1:
Solutions utilisées pour la SDS-PAGE
Solution mère d'acrylamide à 35%
(à prépare avec gants et masque):
Acrylamide 35 g
Eau distillée 100 ml
Solution mère de bis acrylamide à 2%
(à préparer avec gants et masque): Bis
acrylamide 2 g
Eau distillé 100 ml
Solution stock de SDS
à 10%:
Sodium Dodécyl Sulfate 10 g
Eau distillée 100 ml
Solution d'APS (Ammonium
Persulfate) à 1%:
A préparer ex temporairement
APS 0.1 g
Eau distillée 10 ml
Tampon Tris HCL pH 8.8 (à préparer
sous la hotte, avec gants et masque): Tris (hydroxyméthyl aminomethan)
60.57 g
Eau distillée QSP 400 ml
Ajuster à pH 8.8 avec du HCL fumant 8 à 10 ml
Eau distillée QSP 500 ml
Tampon Tris HCL pH 6.8 (à préparer
sous la hotte, avec gants et masque): Tris (hydroxyméthyl aminomethan
30.285 g
Eau distillée QSP 200 ml
Ajuster à pH 8.8 avec du HCL fumant 19.5 ml
Eau distillée QSP 250 ml
|
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
|
Annexes
|
120
|
Tampon d'électrophorèse:
Glycine 70.55 g
Tris (hydroxyméthyl aminomethan) 15 g
SDS 5 g
Eau distillée QSP 5000 ml
Solution de
coloration (pour deux gels):
Acide trichloracétique (TCA) 60 % 100 ml
Solution mère de Bleu de Coomassie R250 25 ml
Eau distillée QSP 500 ml
Solution mère de Bleu de Coomassie
R250:
Bleu de Coomassie R250 10 g
Ethanol 95° QSP 1000 ml
L'éthanol doit être mis en agitation dans
l'éprouvette, avec un barreau aimanté.
Le bleu de Coomassie est ensuite ajouté (sinon le bleu
prend en masse au fond du contenant).Laisser en agitation au moins deux heurs,
puis filtrer la solution.
Annexe 2:
Préparation des
gels
(Quantités pour une cuve de deux gels)
Gel de séparation (running gel):
Acrylamide à 35% 35 ml
Bis acrylamide à 2 % 6 ml
Eau distillée 16.6 ml
Tris-HCL pH 8.8 37.6 ml
SDS à 10 % 1 ml
APS à 1% 2.5 ml
TEMED 50 ul
Gel de concentration (stacking-gel):
Acrylamide à 35 % 3.42 ml
Bis acrylamide à 2 % 0.86 ml
Eau distillée 30.4 ml
Tris-HCL pH 6.8 5 ml
SDS à 10 % 0.4 ml
APS à 1 % 2 ml
TEMED 40 ul
|
Annexes
|
122
|
|
Annexe 3:
Solutions utilisées pour la PAGE
Solution mère d'acrylamide à 35%
(à prépare avec gants et masque):
Acrylamide 35 g
Eau distillée 100 ml
Solution mère de bis acrylamide à 2%
(à préparer avec gants et masque): Bis
acrylamide 2 g
Eau distillé 100 ml
Solution d'APS (Ammonium
Persulfate) à 1%:
A préparer ex temporairement
APS 0.1 g
Eau distillée 10 ml
Tampon Tris HCL pH 8.8 (à préparer
sous la hotte, avec gants et masque): Tris (hydroxyméthyl aminomethan)
60.57 g
Eau distillée QSP 400 ml
Ajuster à pH 8.8 avec du HCL fumant 8 à 10 ml
Eau distillée QSP 500 ml
Tampon Tris HCL pH 6.8 (à préparer
sous la hotte, avec gants et masque): Tris (hydroxyméthyl aminomethan
30.285 g
Eau distillée QSP 200 ml
Ajuster à pH 8.8 avec du HCL fumant 19.5 ml
Eau distillée QSP 250 ml
Tampon d'électrophorèse:
Glycine 70.55 g
Tris (hydroxyméthyl aminomethan) 15 g
Eau distillée QSP 5000 ml
|
|
|
|
Belaouar Hamza/Lamri Adlène
|
|
|
|
|
|
Annexe 4:
Solutions utilisées pour l'Acide-PAGE
Préparation du gel (à
prépare avec gants et masque):
Acrylamide 12 ml
Bis acrylamide 12 ml
Tampon lactate d'aluminium 1.6 ml
Eau distillé 57.5 ml
Accélérateur:
Acide Ascorbique 80 ul
Sulfate ferreux 08 ul
Catalyseur:
Eau oxygénée 0.73 ml
Tampon d'électrophorèse:
Glycine 70.55 g
Tris (hydroxyméthyl aminomethan) 15 g
Eau distillée QSP 5000 ml
Solution de
coloration:
Acide trichloracétique (TCA) 60 % 30 g
Solution mère de Bleu de Coomassie R250 12.5 ml
Eau distillée QSP 250 ml
Solution mère de Bleu de Coomassie
R250:
Bleu de Coomassie R250 10 g
Ethanol 95° QSP 1000 ml
L'éthanol doit être mis en agitation dans
l'éprouvette, avec un barreau aimanté. Le bleu de Coomassie est
ensuite ajouté (sinon le bleu prend en masse au fond du
contenant).Laisser en agitation au moins deux heurs, puis filtrer la
solution.
Les solutions d'extraction pour les 3
méthodes:
Méthode d'électrophorèse Solution
d'extraction
|
PAGE -2.4g urée.
-0.100256g de DTT. -2ml Glycérol.
-0.005% Triton x100
|
SDS-PAGE -2.125 ml solution Stock*
-0.05g de DTT.
-QSP (5ml) H2O pure.
|
Acide-PAGE -1.96 ml NN'de méthyle
Formamid.
-2g Saccharose.
-QSP (10ml) eau distillé.
|
Annexe 5:
La maladie LUPUS
Qu'est-ce que le lupus systémique (LS)
?
Le lupus systémique (LS) ou lupus
érythémateux aigu disséminé (LEAD) est une maladie
inflammatoire au long cours (chronique) pouvant affecter de nombreux organes et
notamment la peau, les reins, les articulations, les poumons et le
système nerveux. Les manifestations de cette maladie sont
extrêmement variées.
Le terme « systémique » signifie que la maladie
atteint plusieurs organes. Le mot « lupus » (loup en latin) fait
référence à l'aspect caractéristique, en forme de
masque, de l'atteinte du visage. Enfin, « érythémateux
» (rouge en grec) traduit la couleur rouge de l'éruption
cutanée.
Lorsque le lupus ne se manifeste qu'au niveau de la peau, on
parle de lupus érythémateux cutané.
Qui peut en être atteint ?
Le lupus se rencontre surtout chez les femmes en âge
d'avoir des enfants, c'està-dire entre 15 et 45 ans. Il peut aussi
toucher l'homme (10 fois moins souvent que la femme) et les enfants.
Est-il présent partout dans le monde ?
Le lupus est présent partout dans le monde, mais il
apparaît que certaines ethnies sont plus touchées, comme les
populations noires (et notamment les Antillais et Afro-américains et
asiatiques.
A quoi est-il dû ?
Le LS est une maladie auto-immune, ce qui signifie que les
défenses immunitaires, qui normalement ne s'attaquent qu'aux
éléments « extérieurs » (bactéries,
virus...), se retournent contre les cellules mêmes de l'organisme et
l'attaquent. L'organisme produit des anticorps (molécules de
défense) nocifs, appelés auto-anticorps, qui entraînent
l'autodestruction de certains tissus (articulations, peau, reins, etc.) et
occasionnent d'importantes réactions inflammatoires. On ne sait pas
encore pour quelle raison les défenses immunitaires se
dérèglent, mais plusieurs facteurs (environnementaux, hormonaux
et génétiques) sont probablement en cause.
Comme le lupus touche souvent les femmes en âge de
procréer, il pourrait y avoir un lien entre le lupus et les hormones
féminines. En outre, les chercheurs pensent que des facteurs
génétiques entrent en jeu. Certaines personnes ont probablement
une prédisposition génétique, c'est-à-dire qu'elles
ont des gènes qui les rendent plus susceptibles de déclencher la
maladie.
Dans certains cas, une infection virale, le stress, une
exposition au soleil ou encore une grossesse (à cause des changements
hormonaux qu'elle provoque)
peuvent déclencher le lupus, ou plutôt le «
réveiller » par un mécanisme qu'on ignore encore.
Enfin, certains médicaments utilisés pour traiter
d'autres maladies (Dpénicillamine, chlorpromazine, certains
anticonvulsivants, â-bloqueurs, minocycline) peuvent déclencher
les symptômes du lupus : on parle alors de lupus « induit ». Ce
lupus peut disparaître à l'arrêt du traitement.
Est-il contagieux ?
Non, le LS n'est pas contagieux.
|
Belaouar Hamza. Lamri Adlène.
|
Date d'exposition: 21 / 06 / 2009
|
|
Titre : Fractionnement des protéines
sériques par électrophorèse sur gel polyacrylamide.
Diplôme: DES en biologie.
|
|
Résumé:
Les protéines sériques présentent une
hétérogénéité structurale, fonctionnelle,
sur l'échelle de concentration et sur les valeurs sémiologiques
dont les variations pathologiques peuvent êtres détectables par
électrophorèse sur gel de polyacrylamide.
Le fractionnement des protéines sériques par
électrophorèse sur gel acétate cellulose donne 5 groupes
présentant les principales fractions et qui sont ; d'abord le
Sérum albumine ; elle représente 60% des protéines du
sérum, le Sérum globulines ; dans ce groupe
hétérogène, on rencontre des protéines
d'activité biologique très variée : Transporteur de
métaux, hormones, anticorps et enzymes.
Il y a la globuline a ; l'électrophorèse permet la
distinction entre globuline a-1 qui représente 4% des protéines
sériques et globuline a-2 qui représente 7% des protéines
sériques, la globuline l; groupe hétérogène
représentant 12% des protéines sériques et la globulines y
ou immunoglobulines : ce groupe le moins mobile à
l'électrophorèse, représentent environ 17% des
protéines sériques, revêt une
homogénéité structurale remarquable, une diversité
exceptionnelle par le nombre quasi infini d'individualités
protéiques qu'on peut y rencontrer., quant a la séparation sur
gel de polyacrylamide les bandes protéiques sont beaucoup plus
nombreuses avec meilleur qualité.
Les anomalies de la protéinémie (taux des
protéines dans le sang) peuvent illustrer l'existence des syndromes
suspects indiqués par la différence qui existe entre les
diagrammes protéiques des patients malades et des sains.
L'électrophorèse sur gel de polyacrylamide est une
bonne technique pour le fractionnement des protéines par rapport
d'autres techniques comme la séparation sur gel d'Acétate
cellulose.
Mots clés : protéines
sériques, électrophorèse, protéinémie,
polyacrylamide, acétate cellulose.
|
|
Laboratoire de biochimie génétique-centre
de biotechnologie-Département de biologie Animale. Faculté des
sciences de la nature et de la vie. Université Mentouri
Constantine.
|
|
Encadreur:
Mr. Douadi Khelifi Professeur. Université Mentouri
Constantine.
|



