|
ÇáÌãåæÑíÉ
ÇáÌÒÇÆÑíÉ
ÇáÏíãÞÑÇØíÉ
ÇáÔÚÈíÉ
République
Algérienne Démocratique et
Populaire
Ministère de l'enseignement supérieur et de la
recherche scientifique
Université Djillali Liabes -Sidi Bel Abbes-
Faculté des sciences
Département de biologie

Mémoire de fin d'étude
Pour l'obtention du diplôme d'ingénieur
d'état en biologie
Option : contrôle de qualité et analyses
Dosage biochimique des polyphénols dans les dattes et le
miel récoltés dans le sud algérien
Thème
Présenté par Mrs : BESSAS Ahmed
BENMOUSSA Larbi
KERARMA Mohamed
Soutenu le : 21.06.2008
Devant le jury composé de:
Présidente : Mme BEREKSI K.
MC UDL Sidi Bel Abbès
Encadreur
: Mme BENDAHMANE M. MC UDL Sidi Bel Abbès
Examinateurs
: Mr OUGHILAS A. MACC UDL Sidi Bel
Abbès
Mr MEGHERBI S. MACC UDL Sidi Bel
Abbès
Année universitaire 2007- 2008

Dédicaces
A ceux qui m'ont tout donné sans rien en retour
A ceux qui m'ont encouragé et soutenu dans mes moments
les plus difficiles
Et ceux à qui je dois tant
A mes parents Said et Kheira pour leur amour et leur support
continu
A mon frère Mohamed, au nouveau né Mahdi et toute
ma famille
Que ce travail soit le témoignage sincère et
affectueux de ma profonde reconnaissance pour tout ce que vous avez fait pour
moi.
Ahmed

Dédicaces
Je dédie ce modeste travail à ma famille,
notamment:
· A celle qui ma comblé d'amour d'affection et
d'encouragement pour que je devienne l'homme que je suis aujourd'hui. Merci
maman MEBARKA.
· A mon grand frère Noreddine qui a sacrifié
tout ce qu'il avait de chère pour que nous gardions le sourire et pour
nous voire grandir en hommes fiers.
· A mes frères Sofiane et Houcine, qui ont toujours
été présent pour moi.
· A mes soeurs Fouzia et Yasmina qui mon toujours
soutenus.
· A mon neveu Khaled, et mes nièce Khouloud et Imane,
ces petits anges qui nous comble de joie.
· Je dédie cet ouvrage à l'âme de mon
père qui avait toujours souhaité notre réussite.
· A mes collaborateurs Ahmed et Mohamed, ces frères
qui m'ont constamment épaulé.
· A toute personne ayant contribué de près ou
de loin à la réalisation de ce travail.
Larbi

Dédicaces
Je dédie ce modeste travail :
· A mes chers parents qui m'ont éclairé le
chemin de la vie par leur grand soutien et leurs encouragements, par leurs
dévouements exemplaires et les énormes sacrifices qu'ils m'ont
consentis durant mes études et qui ont toujours aimé me voire
réussir .Je les remercie pour tout ce qu'ils mon fait.
· A mes très chers frères Adda et Toufik
· A ma très chère soeur Badra
· A toute ma grande famille qui m'a permis de vivre dans un
environnement serein et paisible.
· A touts mes amies en qui j'ai toujours trouvé le
soutien et le réconfort.
· A toute la promotion 5ème année
C.Q.A 2008.
Mohamed
Remerciements
Nous remercions DIEU tout puissant, maître des cieux et
de terre, qui nous a permis de mener à bien ce travail.
Tout d'abord on tient surtout à adresser nos plus vifs
remerciements au Dr Bedahmane M, qui nous a permis de réaliser ce
travail sous sa direction. Nous ne saurons jamais oublier sa
disponibilité, son assistance et ses conseils judicieux pour nous.
Nous remercions vivement le Dr Bereksi K qui nous a fait
l'honneur de présider le jury de ce mémoire. Nos remerciements
vont aussi à Mr Oughilas A et Mr Megherbi S pour avoir bien voulu
examiner ce travail.
Un grand merci à madame Baya chef service du
laboratoire du Centre de Mesure de Chimie de la Faculté des Sciences et
Mr Djamil Ingénieur de laboratoire de biotoxicologie pour sa
disponibilité et sa gentillesse.
Au staff de l'université de Ouargla qui ont su nous
accueillir chaleureusement, nous adressons nos plus sincères gratitudes.
Au personnel de l'université de Mascara, qu'il trouve
ici la marque de notre plus haut respect.
A nos amis de l'Université d'El-Harrach et ceux du
département de pharmacie de l'Université d'Es-Sénia,
auxquels nous nous sommes très reconnaissants.
Nous remercions également le personnel du laboratoire
de biotoxicologie CFTE, pour leur coopération.
A mademoiselle Chenni FZ et Mr Hazem Z nous adressons nos
sincères remerciements, pour leur générosité
scientifique et soutient moral.
Un remercîment spécial à Belaouni hadj
Ahmed qui nous a sacrifié généreusement tant d'effort et
de temps aussi précieux soient-il, pour sa disponibilité, sa
largesse d'esprit et ses valeureux conseils. Nous lui souhaitons le bon heur et
réussite dans sa carrière estudiantine.
Résumé
Les polyphénols sont des
composés très précieux, présents
spécifiquement chez les végétaux et jouent un rôle
antioxydant puissant Il existe trois grandes classes : les acides
phénols, les flavonoïdes (dont les anthocyanes) et les tanins. Vu
les vertus nutritionnelles et thérapeutiques de ces composés nous
nous sommes intéressés à déterminer leur teneur
dans deux aliments succulents très prisés en
Algérie : les dattes et le miel. Notre étude
effectuée à l'Université de Sidi-Bel-Abbès (UDL)
concerne le dosage biochimique (par la méthode colorimétrique et
spectrométrique) des polyphénols sur deux variétés
de dattes (Deglet Nour et Hamraia) et le miel (Bayadh)
récoltés dans la région sud de l'Algérie. Les
résultats obtenus se sont avérés très
intéressants : le dosage des composés phénoliques en
particulier les C.P.S.T. dans les dattes a démontré une grande
richesse de la variété Hamraia (141,5 ug/ml) par rapport à
celle de Deglet Nour (81,5 ug/ml). Quant à la teneur en tanins
condensés et en anthocyanes elle ne présente pas une grande
différence au niveau de ces deux variétés de dattes elle
est estimée respectivement à 20,25 ug/ml et 14,04 ug/ml dans la
variété Deglet Nour et à 24 ug/ml et 13,08 ug/ml pour la
variété Hamraia. Concernant la teneur en polyphénols
totaux recherchés dans le miel, elle est de 90 ug/ml pour une solution
de miel à 2,5 % et 205 ug/ml à 10%. Ces résultats sont
très encourageants et démontrent la richesse de ces deux
nutriments en composés phénoliques qui sont connus pour leur
rôle anti-radicalaire, anti-inflammatoire, anti-sénescence etc.
En conclusion, vu les teneurs
élevées en polyphénols constatées dans les deux
aliments, on pourrait exhorter la communauté scientifique
algérienne à prendre conscience des trésors de notre pays,
surtout les merveilles du Sud que sont les dattes et le miel.
Mots clés: Polyphénols, Deglet
Nour, Hamraia, Miel et Dosage biochimique.
Summary
The polyphenols are very precious compounds
which exist specifically at the plants and play a powerful antioxydant role.
There are three large classes which are acid phenols, flavonoïdes (of
which anthocyanes) and tannins. Considering their nutritional and therapeutic
virtues we were interested to determine their content in two succulent foods
very snuffed in Algeria: dates and honey. Our study carried out at
Sidi-Bel-Abbès University consists to analyze the biochemical assay
(colorimetric and spectrometric method) of polyphenols on two varieties of
dates (Deglet Nour and Hamraia) and honey (Bayadh) collected in the southern
area of Algeria. The results obtained proved to be very interesting, the
proportioning of the phenolic compounds in particular the C.P.S.T in dates
showed a hight content in Hamraia variety (141,5 ug/ml) compared to that of
Deglet Nour (81,5 ug/ml). As for the content of condensed tannins and
anthocyanes it does not present a significant difference in these two varieties
of dates it is estimated respectively at 20,25 ug/ml and 14,04 ug/ml in the
variety of Deglet Nour and at 24 ug/ml and 13,08 ug/ml for the Hamraia variety.
Concerning the amount of total polyphenols found in honey, it is about 90 ug/ml
for the solution honey at 2,5 % and 205 ug/ml at 10 %. These results are very
encouraging and show the richness of these two nutrients in phenolic compounds
which are known for their anti-oxidant, anti-aging and anti-inflammatory
effects.
In conclusion, considering the high amount of
polyphenols in these two analyzed food, we could exhort the Algerian scientific
community to become aware of the treasures of our country, especially the
wonders of the South which are the dates and honey.
Key words: Polyphenols, Deglet Nour, Hamraia,
Honey, Biochemical assay.
ãáÎÕ
ÊÚÊÈÑ
ÇáãÑßÈÇÊ
ÇáíæäæáíÉ
ÚäÇÕÑ ÐÇÊ
åãíÉ ÈÇáÛÉ æ
Ðáß íÚæÏ Åáì
äÔÇØåÇ
ÇáÈíæáæÌí
ÇáÚÇá ßãÖÇÏ
ááßÓÏÉ æ
íäÍÕÑ
æÌæÏåÇ Úáì
æÌå ÇáÊÍÏíÏ
í ÇáããáßÉ
ÇáäÈÇÊíÉ.
ÊÊÑÚ åÐå
ÇáÚÇÆáÉ
ÇáßíãíÇÆíÉ
Åáì ËáÇËÉ
ÞÓÇã
ÑÆíÓíÉ:
ÇáãÑßÈÇÊ
ÇáíæäæáíÉ
ÇáÅÌãÇáíÉ
ÇááÇæäÇÊ (ãä
ÖãäåÇ
ÇáäËæÓíÇäÇÊ)
æ ÇáÊÇäíäÇÊ.
ÈåÏ ÊËãíä
äæÚíä ãä
ÇáÛÐíÉ
ÇáÌÒÇÆÑíÉ
ÇáßËÑ ÔÚÈíÉ
í ÇáÌäæÈ:
ÇáÊãÑ( ÏÞáÉ
äæÑ ÍãÑÇíÉ) æ
ÇáÚÓá áÌäÇ
Åáì ÊÍÏíÏ
äÓÈÉ
ÇáãÑßÈÇÊ
ÇáíäæáíÉ
ÖãäåÇ äÙÑÇ
áãÒÇíÇåÇ
ÇáÛÐÇÆíÉ æ
ÇáÚáÇÌíÉ
ÇáãÚÊÈÑÉ. æ
Úáì ÅËÑ Ðáß
ÞãäÇ ÈåÐå
ÇáÞíÇÓÇÊ
Úáì ãÓÊæì
ãÎÇÈÑ
ÌÇãÚÉ
ÌíáÇáí
ÇáíÇÈÓ
ÈÓíÏí
ÈáÚÈÇÓ æ Ðáß
ÈØÑíÞÊíä
ãÎÊáÊíä:
ÞíÇÓ áæäí æ
ÞíÇÓ Øíí. ÍÕ
ÇáãÑßÈÇÊ
ÇáíäæáíÉ í
ÇáÊãÑ ÙåÑ ä
Õä ÍãÑÇíÉ
Ûäí (141,5ãßÛ/ãá)
ÈÇáãÞÇÑäÉ
ãÚ Õä ÏÞáÉ
äæÑ (81,5 ãßÛ/ãá).
ãÇ íãÇ íÎÕ
ÇáÇäËæÓíÇäÇÊ
æ ÇáÊÇäíäÇÊ
ÇáãßËÉ áÇ
íæÌÏ ÑÞ ßÈíÑ
Èíä ÇáÕäíä
ÍíË ÊÞÏÑ
äÓÈÊåÇ Úáì
ÇáÊæÇáí
ÈäÍæ20,25 ãßÛ/ãá
æ 14,04 ãßÛ/ãá áÕä
ÏÞáÉ äæÑ 24
ãßÛ/ãá æ
13,08ãßÛ/ãá áÕä
ÍãÑÇíÉ.
íãÇ
íÊÚáÞ ÈäÓÈÉ
ÇáãÑßÈÇÊ
ÇáíäæáíÉ
ÇáÅÌãÇáíÉ
í ÇáÚÓá ÊÞÏÑ
È 90 ãßÛ/ãá í
ÇáÚíäÉ ÐÇÊ
ÊÑßíÒ 2,5%. æ 205
ãßÛ/ãá í ÊÎí 10%.
ÊÚÊÈÑ
ÇáäÊÇÆÌ
ÇáãÊÍÕá
ÚáíåÇ ÌÏ
ãÔÌÚÉ ÍíË
ËÈÊÊ ËÑÇÁ
åÐíä
ÇáÛÐÇÆíä
ÈÇáãÑßÈÇÊ
ÇáíäæáíÉ
ÇáãÚÑæÉ
ÈÏæÑåÇ
ÇáãÖÇÏ
ááÅáÊåÇÈ æ
ßÈÍ
ÇáÔíÎæÎÉ
ÇáãÈßÑÉ æ
ÇáãÖÇÏ
ááÌÐæÑ
ÇáÍÑÉ.
æ í
ÇáÎÊÇã
ÅËÈÇÊ Ûäì
ÇáÛÐÇÆíä ãä
ÍíË
ÇáãÑßÈÇÊ
ÇáíäæáíÉ
íÍÓÓ
ÈåãíÊåÇ
æÈÇáÊÇáí
íÍÒ
ÇáÚáãÇÁ
ÇáãÎÊÕíä
Úáì ÇáÈÍË
ßËÑ í åÐÇ
ÇáãÌÇá áÇ
ÓíãÇ íãÇ
íÎÕ ÇáÊãÑ æ
ÇáÚÓá
ÇááÐÇä
íÚÊÈÑÇä ãä
åã ßäæÒ
ÇáÌäæÈ
ÇáÌÒÇÆÑí.
ßáãÇÊ
ÇáãÊÇÍ :
ÇáãÑßÈÇÊ
ÇáíäæáíÉ
ÏÞáÉ äæÑ
ÍãÑÇíÉ
ÇáÚÓá ÇáÍÕ
ÇáÈíæ
ßíãíÇÆí.
Page
Introduction..........................................................................................
1
|
|
PARTIE BIBLIOGRAPHIQUE
|
|
Chapitre I : les dattes
|
|
|
I.1. Généralités sur le
palmier dattier.........................................................
|
2
|
|
I.1.1.
Historique.............................................................................
|
2
|
|
I.1.2.
Taxonomie...........................................................................
|
2
|
|
I.1.3.
Morphologie.........................................................................
|
3
|
|
I.1.3.1. Système
racinaire..............................................................
|
3
|
|
I.1.3.2. Système
végétatif..............................................................
|
3
|
|
I.1.3.2.1.
Tronc......................................................................
|
3
|
|
I.1.3.2.2.
Couronne..................................................................
|
4
|
|
I.1.3.2.3.
Palme......................................................................
|
4
|
|
I.1.3.2.4. Les
fleurs..................................................................
|
4
|
|
I.1.3.2.5. Le
fruit.....................................................................
|
4
|
|
I.1.4.
Ecologie..............................................................................
|
6
|
|
I.4.1.1. Cycle
végétatif..................................................................
|
6
|
|
I.1.5. Exigences écologiques du palmier
dattier.......................................
|
7
|
|
I.1.5.1. Les exigences
climatiques....................................................
|
7
|
|
I.1.5.1.1. La température
...........................................................
|
7
|
|
I.1.5.1.2. La
lumière................................................................
|
7
|
|
I.1.5.1.3. L'humidité de
l'air......................................................
|
8
|
|
I.1.5.1.4. Le
vent....................................................................
|
8
|
|
I.1.5.2. Les exigences
édaphiques....................................................
|
8
|
|
I.1.5.3. Les exigences
hydriques......................................................
|
8
|
|
I.1.6. La répartition
géographique et la production du palmier dattier..............
|
9
|
|
I.1.6.1. Production
mondiale..........................................................
|
9
|
|
I.1.6.2. Production algérienne et sa
répartition géographique.....................
|
9
|
|
I.2. Les
dattes...................................................................................
|
10
|
|
I.2.1.
Définition.............................................................................
|
10
|
|
I.2.2. Evolution physiologique de la
datte..............................................
|
11
|
|
I.2.3. Caractéristiques morphologiques
des dattes ....................................
|
12
|
|
I.2.3.1. Deglet
Nour....................................................................
|
13
|
|
I.2.3.2
Ghars.............................................................................
|
13
|
|
I.2.4. Composition
physicochimique....................................................
|
14
|
|
I.2.4.1. La teneur en
eau...............................................................
|
14
|
|
I.2.4.2. Le
pH...........................................................................
|
14
|
|
I.2.4.3.
L'acidité.........................................................................
|
14
|
|
I.2.5. La composition
biochimique......................................................
|
15
|
|
I.2.5.1. Fraction
glucidique............................................................
|
15
|
|
I.2.5.1.1. Les sucres totaux et
réducteurs.........................................
|
15
|
|
I.2.5.1.2. Pectines et
cellulose.....................................................
|
16
|
|
I.2.5.2. Les
protides....................................................................
|
16
|
|
I.2.5.3. Les
lipides......................................................................
|
17
|
|
I.2.5.4. Les
minéraux...................................................................
|
17
|
|
I.2.5.5. Les
vitamines..................................................................
|
17
|
|
I.2.5.6. Les fibres
alimentaires.......................................................
|
17
|
|
I.2.5.7. Les composés
phénoliques...................................................
|
18
|
|
I.2.5.8. Les
enzymes....................................................................
|
18
|
|
I.2.6. Valeur nutritionnelle des
dattes...................................................
|
19
|
|
I.2.6.1. Composition en acides aminés
essentiels..................................
|
19
|
|
I.3. Les variétés
cultivées.....................................................................
|
19
|
|
I.3.1. Deglet
Nour..........................................................................
|
20
|
|
I.3.2. Les variétés
communes.............................................................
|
20
|
|
I.3.3. Les variétés
secondaires............................................................
|
20
|
|
Chapitre II : le miel
|
|
|
II.1.
Définition.................................................................................
|
21
|
|
II.2.
Caractéristiques..........................................................................
|
21
|
|
II.3.
Origine....................................................................................
|
21
|
|
II.3.1. Le
Nectar............................................................................
|
22
|
|
II.3.1.1.
Définition......................................................................
|
22
|
|
II.3.1.2.
Formation.....................................................................
|
22
|
|
II.3.1.3.
Composition..................................................................
|
22
|
|
II.3.2. Le
miellat...........................................................................
|
23
|
|
II.3.2.1.
Définition......................................................................
|
23
|
|
II.3.2.2. Types du
miellat..............................................................
|
23
|
|
II.4. Fabrication du miel par les
abeilles...................................................
|
23
|
|
II.4.1. Transformation du
nectar.........................................................
|
23
|
|
II.4.2.
L'emmagasinage...................................................................
|
24
|
|
II.4.3.
Maturation...........................................................................
|
24
|
|
II.5. Composition
chimique..................................................................
|
24
|
|
II.5.1. Teneur en eau du
miel.............................................................
|
25
|
|
II.5.2. Les
sucres...........................................................................
|
26
|
|
II.5.2.1. Rapport fructose/
glucose...................................................
|
27
|
|
II.5.2.2.
Saccharose.....................................................................
|
28
|
|
II.5.2.3.
Maltose........................................................................
|
28
|
|
II.5.2.4. Mélézitose (tri
saccharides).................................................
|
28
|
|
II.5.3. Les sels
minéraux..................................................................
|
29
|
|
II.5.4. Les
protéines........................................................................
|
30
|
|
II.5.5. Les
enzymes........................................................................
|
30
|
|
II.5.6. Les
lipides...........................................................................
|
30
|
|
II.5.7. Les
vitamines.......................................................................
|
31
|
|
II.5.8. Le
pH.................................................................................
|
31
|
|
II.5.9.
L'acidité.............................................................................
|
32
|
|
II.5.10.
Hydroxyméthylfurfural..........................................................
|
32
|
|
II.5.11. Les composés
phénoliques......................................................
|
33
|
|
II.5.12. Substances aromatiques
.......................................................
|
33
|
|
II.6. L'Apithérapie et
intérêts du
miel......................................................
|
33
|
|
Chapitre III : les composés
phénoliques
|
|
|
III.1.
Généralités...............................................................................
|
35
|
|
III.2. Classification des composés
phénoliques...........................................
|
35
|
|
III.2.1. Les acides phénols et les
coumarines..........................................
|
36
|
|
III.2.1.1. Les acides
benzoïques......................................................
|
36
|
|
III.2.1.2. Les acides cinnamiques
....................................................
|
37
|
|
III.2.1.3. Les
coumarines..............................................................
|
37
|
|
III.2.2. Les
flavonoïdes....................................................................
|
38
|
|
III.2.2.1.
Structure......................................................................
|
38
|
|
III.2.2.2. Biosynthèse des
flavonoides...............................................
|
39
|
|
III.2.2.3. Propriétés des
flavonoides.................................................
|
40
|
|
III.2.2.3.1. Les
flavonols...........................................................
|
40
|
|
III.2.2.3.2. Les
flavanones.........................................................
|
41
|
|
III.2.2.3.3. Les
anthocyanes.......................................................
|
41
|
|
III.2.2.3.3.1.
Présentation......................................................
|
41
|
|
III.2.2.3.3.2.
Structures.........................................................
|
42
|
|
III.2.2.3.3.3. Propriétés des
anthocyanes....................................
|
43
|
|
a) Le spectre
d'absorption......................................
|
43
|
|
b) Modification de la structure en fonction de
l'acidité........
|
43
|
|
c) Décoloration par le Bisulfite de Sodium
....................
|
43
|
|
III.2.3. Les
tanins...........................................................................
|
44
|
|
III.2.3.1. Les tanins condensés
(flavan-3-ols).......................................
|
44
|
|
III.2.3.1.1.
Structure.................................................................
|
44
|
|
III.2.3.2. Les tanins
hydrolysables...................................................
|
45
|
|
III.2.3.2.1.
Structure................................................................
|
45
|
|
III.3. Intérêts des
composés
phénoliques...................................................
|
45
|
|
III.3.1. Rôle nutritionnel et
thérapeutique..............................................
|
45
|
|
III.3.2. Rôle
physiologique...............................................................
|
47
|
|
III.3.3. Rôle
technologique...............................................................
|
48
|
|
PARTIE EXPERIMENTALE
|
|
|
Chapitre I : Matériels et méthodes
|
|
|
I.1. Analyses des
dattes.......................................................................
|
49
|
|
I.1.1. Matériels
végétal....................................................................
|
49
|
|
I.1.2. Caractérisation
physico-chimique................................................
|
50
|
|
I.1.2.1. Le
poids.........................................................................
|
50
|
|
I.1.2.2. Détermination du
pH..........................................................
|
50
|
|
I.1.2.3. Détermination de la teneur en
eau...........................................
|
50
|
|
I.1.3. Composition
chimique..............................................................
|
50
|
|
I.1.3.1. Préparation des solutions
à base de dattes.................................
|
50
|
|
I.1.3.2. Extraction des composés
phénoliques......................................
|
50
|
|
I.1.3.3. Dosage des polyphénols totaux
(réactif de Folin Ciocalteu)................
|
51
|
|
I.1.3.3.1.
Principe....................................................................
|
51
|
|
I.1.3.3.2. Mode
opératoire.........................................................
|
51
|
|
I.1.3.4. Dosage des tanins
condensés................................................
|
53
|
|
I.1.3.4.1.
Principe....................................................................
|
53
|
|
I.1.3.4.2. Mode
opératoire.........................................................
|
53
|
|
I.1.3.5. Dosage des
anthocyanes......................................................
|
55
|
|
I.1.3.5.1.
Principe....................................................................
|
55
|
|
I.1.3.5.2. Mode
opératoire.........................................................
|
55
|
|
I.2. Analyses du
miel..........................................................................
|
57
|
|
I.2.1.
L'échantillon.........................................................................
|
57
|
|
I.2.2. Caractérisation
physico-chimique................................................
|
57
|
|
I.2.2.1. La teneur en
eau...............................................................
|
57
|
|
I.2.2.2. Conductivité et
pH.............................................................
|
58
|
|
I.2.3. Composition
chimique..............................................................
|
58
|
|
I.2.3.1. Préparation de la solution de
miel...........................................
|
58
|
|
I.2.3.2. Dosage des polyphénols totaux (
réactif de Folin Ciocalteu).............
|
58
|
|
I.2.3.2.1. Mode
opératoire.........................................................
|
58
|
|
Chapitre II : résultats et discussion
|
|
|
II.1. Résultats d'analyses des
dattes.........................................................
|
61
|
|
II.1.1. Caractérisation
physico-chimique................................................
|
61
|
|
II.1.1.1. Le
poids.....................................................................
|
61
|
|
II.1.1.2. La mesure du
pH.............................................................
|
61
|
|
II.1.1.3. La teneur en
eau..............................................................
|
62
|
|
II.1.2. Composition
chimique............................................................
|
62
|
|
II.1.2.1. Teneur en composés
phénoliques solubles totaux........................
|
62
|
|
II.1.2.2. Teneur en tanins
condensés.................................................
|
65
|
|
II.1.2.3. Teneur en
anthocyanes......................................................
|
67
|
|
II.2. Résultats d'analyses du
miel............................................................
|
69
|
|
II.2.1. Caractérisation
physicochimique................................................
|
69
|
|
II.2.1.1. La teneur en
eau..............................................................
|
69
|
|
II.2.1.2. Conductivité et
pH...........................................................
|
69
|
|
II.2.2. Composition
chimique............................................................
|
70
|
|
II.2.2.1. Teneur en composés
phénoliques solubles totaux...........................
|
70
|
|
Conclusion..........................................................................................
|
71
|
|
Références
bibliographiques....................................................................
|
73
|
|
Annexes.............................................................................................
|
81
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Liste des abréviations
m : mètre
cm : centimètre
mm : millimètre
nm : nanomètre
°C : degré Celsius
ha : hectare
g : gramme
mg : milligramme
qx : quintaux
g/100g de M.S : gramme/100 gramme de
Matière sèche
M.F : matière fraiche
C6 : six atomes de carbone
D.N : Deglet Nour
UE : Union Européenne
min : minimum
max : maximum
HPLC : high pressure liquid chromatography
F/G : rapport fructose/glucose
HMF: Hydroxyméthylfurfural
UI : unite internationale
meq : millie-Quivalent
LDL: low density lipoprotéines
UV : ultra violet
ug : microgramme
l : litre
ml : millilitre
q.s.p : quantité suffisante pour
DO : densité optique
mn : minute
C.P.S.T.: composés phénoliques
solubles totaux
T.C. : Tanins condensés
Page
Liste des tableaux
|
Tableau 01 : Les dix principaux producteurs
des dattes (FAO 2002)...........................
|
9
|
|
Tableau 02 : Principales
variétés de dattes algériennes et leur
localisation.....................
|
10
|
|
Tableau 03 : Teneur en eau de quelques
variétés...................................................
|
14
|
|
Tableau 04 : Modification de pH de
Deglet Nour au cours de son développement............
|
15
|
|
Tableau 05 : Composition en sucres
(g/100g de M.S) des dattes stockées......................
|
16
|
|
Tableau 06 : Classement des dattes en
fonction de leur teneur en sucre........................
|
16
|
|
Tableau 07 : Composition de 100 g de
dattes en éléments minéraux.............................
|
17
|
|
Tableau 08 : Composition vitaminique de
la pulpe de datte.......................................
|
17
|
|
Tableau 09 : Teneurs en acides
aminés essentiels des dattes et les besoins humains..........
|
19
|
|
Tableau 10 : Recommandations et exigences
internationales....................................
|
25
|
|
Tableau 11 : Rapport entre la teneur en eau
et la température....................................
|
26
|
|
Tableau 12 : Teneur des
différents sucres dans les miels de fleurs et de
miellat...............
|
27
|
|
Tableau 13 : Sels minéraux et
oligo-éléments dans le miel de différentes
provenances......
|
29
|
|
Tableau 14 : Teneur en vitamines dans
100 g de miel.............................................
|
31
|
|
Tableau 15 : Valeurs de pH et la teneur en
acides libres de différentes sortes de miel .......
|
32
|
|
Tableau 16: Activités biologiques des
composés polyphénoliques...............................
|
46
|
|
Tableau 17 : Description des
variétés Deglet Nour et
Hamraia..................................
|
49
|
|
Tableau 18 : Valeur d'étalonnage
pour le dosage des anthocyanes ..............................
|
55
|
|
Tableau 19 : Poids des deux
variétés récoltés en
2007.............................................
|
61
|
|
Tableau 20 : Valeurs du pH pour les deux
variétés Deglet Nour et Hamraia..................
|
62
|
|
Tableau 21 : Teneurs en eau pour les deux
variétés Deglet Nour et Hamraia..................
|
62
|
|
Tableau 22 : Densités optiques de
différentes concentration d'acide gallique..................
|
63
|
|
Tableau 23 : Densités optiques des
C.P.S.T. des deux variétés de dattes.......................
|
63
|
|
Tableau 24 : Teneurs en C.P.S.T. chez les deux
variétés Deglet Nour et Hamraia............
|
64
|
|
Tableau 25 : Densités optiques des
concentrations de l'acide tannique.........................
|
65
|
|
Tableau 26 : Densités optiques des T.C.
chez les deux variétés de dattes......................
|
66
|
|
Tableau 27 : Teneurs en T.C. chez les deux
variétés Deglet Nour et Hamraia..................
|
66
|
|
Tableau 28 : Densités optiques des
anthocyanes chez les deux variétés Deglet Nour et
Hamraia...................................................................................................
|
68
|
|
Tableau 29 : Teneurs en anthocyanes chez les
deux variétés Deglet Nour et Hamraia.......
|
68
|
|
Tableau 30 : Résultats de la mesure
du pH et de la conductivité.................................
|
69
|
|
Tableau 31 : Densités optiques des
différentes concentrations du miel..........................
|
70
|
|
Tableau 32 : Teneurs en C.P.S.T. pour les deux
dilutions de miel................................
|
70
|
Liste des figures
Page
|
Figure 01 : Schéma d'une
palme......................................................................
|
4
|
|
Figure 02 : Schéma du palmier
dattier................................................................
|
5
|
|
Figure 03 : Fruit et graine du
dattier...................................................................
|
11
|
|
Figure 04 : Composition biochimique globale
de la datte..........................................
|
15
|
|
Figure 05 : Les différentes
classes des composés phénoliques
..................................
|
36
|
|
Figure 06 : Structures chimiques de
quelques dérivés de l'ester hydroxycinnamiques.......
|
37
|
|
Figure 07 : Structure chimique de
quelques coumarines..........................................
|
38
|
|
Figure 08 : Squelette de base des
flavonoïdes......................................................
|
38
|
|
Figure 09 : Biosynthèse des
flavonoides............................................................
|
39
|
|
Figure 10 : Structures chimiques de
quelques flavonols..........................................
|
41
|
|
Figure 11 : Structure de quelques
anthocyanidine..................................................
|
42
|
|
Figure 12 : Structure chimique des
tanins condensés..............................................
|
45
|
|
Figure 13 : Protocole de dosage des
polyphénols totaux dans les dattes........................
|
52
|
|
Figure 14 : Protocole de dosage des tanins
condensés.............................................
|
54
|
|
Figure 15 : Protocole de dosage des
anthocyanes..................................................
|
56
|
|
Figure 16 : Appréciation de la
densité...............................................................
|
58
|
|
Figure 17 : Protocole de dosage des
polyphénols totaux dans le miel...........................
|
60
|
|
Figure 18 : Courbe d'étalonnage pour
le dosage des composés phénoliques solubles totaux
(C.P.S.T)..........................................................................................
|
63
|
|
Figure 19 : Courbe d'étalonnage pour
le dosage des T.C..........................................
|
65
|
|
Figure 20 : Courbe d'étalonnage pour
le dosage des anthocyanes...............................
|
67
|
INTRODUCTION

Les composés phénoliques ou
polyphénols sont des métabolites secondaires
caractérisés par la présence d'un cycle aromatique portant
des groupements hydroxyles libres ou engagés avec un glucide. Ils sont
présents dans toutes les parties des végétaux
supérieurs (racines, tiges, feuilles, fleurs, pollens, fruits, graines
et bois) et même dans le miel (naturellement, puisqu'il tire son origine
des plantes que butinent les abeilles), ils sont aussi impliqués dans de
nombreux processus physiologiques comme la croissance cellulaire, la
rhizogenèse, la germination des graines ou la maturation des fruits. Les
plus représentés sont les acides phénols, les
flavonoïdes (anthocyanes), et les tanins [Lugasi et al., 2003].
Ces précieuses molécules
possèdent des propriétés biologiques très
intéressantes, qui trouvent des applications dans divers domaines,
à savoir en médecine, pharmacie, nutrition...etc. Bahorun (1997),
a signalé que ça fait longtemps qu'on emploie des remèdes
traditionnels à base de plantes sans savoir à quoi étaient
dues leurs actions bénéfiques, il reste difficile de
définir les molécules responsables de l'action bien que certains
effets pharmacologiques prouvés sur l'animal aient été
attribués à des composés tels que les composés
phénoliques.
Les dattes, fruits du palmier dattier
(phoenix dactylifera L.), très exploité en Afrique
méditerranéenne, en particulier dans le Sud algérien,
constituent un aliment fondamental pour les musulmans durant toutes les
saisons, et, particulièrement, pendant le mois sacré de Ramadhan,
et ce par sa richesse en différents éléments nutritifs
tels que les composés phénoliques indispensables à notre
santé.
Autre produit naturel aussi important que les
dattes, le miel. Cet aliment complet, la première substance
sucrée connue par l'humanité, est l'un des mets les plus
raffinés et recherchés par l'homme depuis les temps les plus
reculés, autant pour son goût incomparable que pour ses vertus
nutritionnelles et thérapeutiques indéniables, d'ailleurs
rapportées par le saint Coran.
Dans le but de valoriser ces deux produits
locaux (les dattes et le miel du Sud Algérien) et d'évaluer
l'importance de ces aliments, vu leur impact sur notre santé par leur
richesse en substances a propriétés antioxydantes et
antiradicalaires, des dosages biochimiques ont été
effectués (le dosage des polyphénols totaux, des tanins et des
anthocyanes) au niveau du laboratoire de biotoxicologie ainsi qu'au centre de
mesure d'UDL de SBA.
Les variétés de dattes faisant
objet de cette étude sont: la variété Deglet Nour, et
celle de Hamraia (récoltés au Sud-est de l'Algérie), quant
au miel, il est issu d'apiculture du Sud Algérien (Wilaya d'El Bayadh).
Notre travail sera donc répartit en
deux parties, initié par une recherche bibliographique où nous
apportons trois chapitres (les dattes, le miel et les composés
phénoliques). La deuxième partie (expérimentale)
élucide les matériels et méthodes ainsi que les
résultats et leur discussion.
PARTIE
BIBLIOGRAPHIQUE


CHAPITRE I :
LES DATTES
I.1. Généralités sur le palmier
dattier
I.1.1. Historique
Le palmier dattier est l'un des arbres fruitiers le plus
anciennement cultivé. Les documents les plus anciens en
Mésopotamie (Irak actuellement) montrent que sa culture se pratique
depuis 3500 ans avant J.C. Dans la même époque, les dattiers
étaient cultivés en Irak occidental, à travers l'Arabie et
jusqu'en l'Afrique du Nord.
Ce n'est qu'au milieu du XIXème
siècle que les plantations furent établies dans les
vallées chaudes de Californie et dans l'Arizona méridional. Au
cours des siècles et au Maghreb, le palmier a fait l'objet de
différentes plantations réparties dans des lieux disposants
relativement d'eau. Le palmier dattier permet une pérennité de la
vie dans les régions désertiques. Ses fruits sont un excellent
aliment grâce à leurs effets toniques et légèrement
laxatifs [Munier, 1973].
I.1.2. Taxonomie
Le palmier dattier a été dénommé
Phoenix dactyliféra par Linne en 1934. Phoenix
dérivé de Phoinix, nom du dattier chez les grecs de
l'antiquité qui le considéraient comme arbre des
phéniciens ; dactyliféra vient du latin
dactylis, dérivant du grec dactylus, signifiant doigt
(en raison de la forme du fruit), associé au mot latin fero,
porté, en référence aux fruits.
Le genre Phoenix dactylifera L fait parti de
la classe des Monocotylédones, d'une famille de plantes tropicales
(Palmoe ou Arecaceae), la mieux connue sur le plan
systématique. Elle est représentée par 200 genres et 2700
espèces réparties en six familles. La sous famille des
Coryphoideae est elle-même subdivisée en trois tribus [Ridakare et
al., 1990].
Ø Systématique:
La classification botanique du palmier dattier donnée
par [Djerbi, 1994] est la suivante:
· Groupe : Spadiciflore.S ;
· Embranchement : Angiospermes ;
· Classe : Monocotylédones ;
· Ordre : Palmales ;
· Famille : palmoe ;
· Tribu : Phoenixées ;
· Genre : Phoenix ;
· Espèce : Phoenix dactyliféra
L.
I.1.3. Morphologie
C'est un grand palmier de 20 à 30 m de haut, au tronc
cylindrique (le stipe), portant une couronne de feuilles, les feuilles sont
pennées divisées et longues de 4 à 7 m.
L'espèce est dioïque et porte des inflorescences males ou femelles,
les fleurs femelles aux trois carpelles sont indépendants, dont une
seule se développe pour former la datte (le fruit)
[Hadjari et Kadi Hanifi, 2005].
I.1.3.1. Système racinaire
Le système racinaire du palmier dattier est
fasciculaire, les racines ne se ramifient pas et n'ont relativement que peu de
radicelles. Le bulbe ou plateau racinal est volumineux et émerge en
partie au dessus du niveau du sol. Le système présente quatre
zones d'enracinement :
Zone 1 : Ce sont les racines
respiratoires, localisées à moins de 0,25 m de profondeur qui
peuvent émerger sur le sol.
Zone 2 : Ce sont les racines de nutrition,
allant de 0,30 à 0,40 m de profondeur.
Zone 3 : Ce sont les racines d'absorption qui
peuvent rejoindre le niveau phréatique à une profondeur varie
d'un mètre à 1,8 m.
Zone 4 : Ce sont les racines d'absorption de
profondeur, elles sont caractérisées par un géotropisme
positif très accentué. La profondeur des racines peut atteindre
20 m, (figure 02) [Munier, 1973 ; Djerbi, 1994].
I.1.3.2. Système végétatif
I.1.3.2.1. Tronc
C'est un stipe, généralement cylindrique, son
élongation s'effectue dans sa partie coronaire par le bourgeon terminal
ou phyllophore [Munier, 1973].
I.1.3.2.2. Couronne
La couronne ou frondaison est l'ensemble des palmes vertes qui
forment la couronne du palmier dattier. On dénombre de 50 à 200
palmes chez un palmier dattier adulte. Les palmes vivent de trois à sept
ans, selon les variétés et le mode de culture. Elles sont
émises par le bourgeon terminal ou « phyllophore », pour cela,
on distingue : la couronne basale, la couronne centrale et les palmes du
coeur [Peyron, 2000].
I.1.3.2.3. Palme
La palme ou « Djérid » est une
feuille pennée dont les folioles sont régulièrement
disposées en position oblique le long du rachis. Les segments
inférieurs sont transformés en épines, plus ou moins
nombreuses, et plus ou moins longues [Munier, 1973].
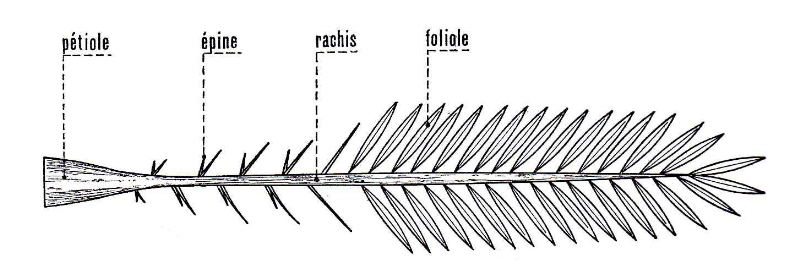
Fig. 01 : Schéma d'une palme [Munier,
1973].
I.1.3.2.4. Les fleurs
Le dattier est une plante dioïque, c'est-à-dire
qu'il excite des dattiers mâles (Dokar) et des dattiers femelles
(Nakhla). Seuls les dattiers femelles donnent des fruits, donc elles
sont à l'origine des multiples variétés des dattes. De
façon générale deux des trois carpelles, uniovulés,
avortent et les fruits sont monospermes ce qui peut s'expliquer par la grande
densité des inflorescences. Les mâles forment une population
hétéroclite, mal connue et ne sont pas tous utilisés pour
la pollinisation. La protection des fleurs d'une même inflorescence est
réalisée par une bractée membraneuse appelée
spathe, les nombreuses fleurs ainsi protégées se simplifient
: les pétales sont souvent réduits à des écailles
et les fleurs unisexuées [Guignard et
al., 2001].
I.1.3.2.5. Le fruit
Le fruit de dattier, la datte est une baie
contenant une seule graine, vulgairement appelée noyau. La datte est
constituée d'un mésocarpe charnu, protégé par un
fin épicarpe, le noyau est entouré d'un endocarpe
parcheminé, il est de forme allongée, plus ou moins volumineux,
lisse ou pourvu de protubérances latérales en arêtes ou
ailettes, avec un sillon ventral; l'embryon est dorsal, sa consistance est dure
et cornée.
La couleur de la datte est variable selon les
espèces : jaune plus ou moins clair, jaune ambré
translucide, brun plus ou moins prononcé, rouge ou noire [Munier,
1973].
I- Racines respiratoires ;
II- Racines de nutrition ;
III- Racines d'absorption ;
IV- Racines d'absorption et de profondeur.

V-
Fig. 02 : Schéma du palmier dattier
[Munier, 1973].
I.1.4. Ecologie
Le palmier dattier ne vit pas en région tropicale
humide comme les autres palmae, mais en région subtropicale
sèche, spontané dans la plupart des régions du vieux monde
où la pluviométrie est inférieure à 100 mm par an.
[Riedacker et al., 1990].
Le palmier dattier est un arbre qui résiste mieux au
froid, à la sécheresse et qui exige beaucoup de chaleur, il est
sensible à l'humidité surtout pendant la période de
fructification et de floraison [Munier, 1973].
I.4.1.1. Cycle végétatif
Le genre Phoenix est unique dans sa morphologie mais
aussi dans son développement, il est possible de distinguer aussi bien
au niveau pratique que théorique cinq phases de développement
dans la croissance des palmiers. Ces cinq phases ne sont pas définies
strictement, elles sont décrites sur des critères morphologiques
alors qu'elles correspondent en réalité à des
périodes physiologiques qui ne sont ni connues avec exactitude, ni bien
comprises.
Stade 1 : La graine
Elle possède un albumen (endosperme) dur et
corné dont l'embryon dorsal est toujours très petit par rapport
à l'albumen (2 à 3 mm).
Stade 2 : Phase germinative
A ce stade, la plantule ou la germination vit sur les
réserves de l'albumen. La première feuille est de forme
linière et lancéolée, cette forme est une des
caractéristiques du genre Phoenix.
Stade 3 : Construction de la plante
Cette phase post germinative est la plus importante dans
l'ontogénie des palmiers car elle aboutit à la constitution de
l'axe primaire. La plante devient autotrophe et son système vasculaire
doit se construire, durant cette phase appelée aussi "phase
d'établissement" observe une série de feuilles à limbe
para penné puis penné et qui ont une insertion spiralée
caractéristique des genres Phoenix.
Stade 4 : la phase adulte végétative
Le dattier va construire son tronc ou stipe et acquérir
son « porte de palmier » par extension continue de l'axe
végétatif. Cette phase ou il produit essentiellement des feuilles
et accumule des réserves peut durer de 3 à 8 ans. Le tronc
couvert par la base des feuilles anciennes mortes et/ou coupées, peut
atteindre 20 à 30 m de haut et environs 1 m de diamètre.
Stade 5 : La phase adulte reproductive
Entre la 5ème et la 8ème
année (pouvant aller jusqu'a 10 ans) le dattier commence à
produire des inflorescences. Le dattier étant dioïque, ce n'est
qu'à ce stade que l'on peut reconnaître son sexe (les quatre
stades précédents apparaissent identiques chez les pieds
mâles et femelles). Ce dioïque entraîne une allogamie
obligatoire qui permet un brassage génétique mais aussi une
hétérozygotie [Riedacker et al., 1990].
I.1.5. Exigences écologiques du palmier dattier
I.1.5.1. Les exigences climatiques
I.1.5.1.1. La température
Le palmier dattier est une espèce thermophile. Son
activité végétative se manifeste à partir de 7
à 10°C selon les individus, les cultivars et les conditions
climatiques. Elle atteint son maximum de développement vers 32°C et
commence à décroître à partir de 38°C. La
floraison se produit après une période fraîche ou froide
[Djerbi, 1994 ; Peyron, 2000]. La somme des températures
nécessaire à la fructification (indice thermique) et de 1000
à 1660°C, selon les régions phoenicicoles (1854°C
à Touggourt et 1620°C à Bechar) [Munier, 1973]. La
période de la fructification débute à la nouaison et se
termine à la maturation des dattes, elle varie de 120 à 200 jours
selon les cultivars et les régions [Djerbi, 1994].
I.1.5.1.2. La lumière
Le dattier est une espèce héliophile, et la
disposition de ses folioles facilite la photosynthèse, la faible
luminosité favorise le développement des organes
végétatifs au dépend de la production de dattes, ainsi les
fortes densités de plantation sont à déconseiller [Munier,
1973].
I.1.5.1.3. L'humidité de l'air
Les faibles humidités de l'air stoppent
l'opération de fécondation et provoque le dessèchement des
dattes au stade de maturité, au contraire les fortes humidités
provoquent des pourritures des inflorescences et des dattes, respectivement au
printemps et à l'automne. Donc le dattier est sensible à
l'humidité de l'air [Munier, 1973]. Les meilleures dattes sont
récoltées dans les régions où l'humidité de
l'air est moyennement faible (40%) [Bouguedoura, 1991].
I.1.5.1.4. Le vent
Les vents ont une action mécanique et un pouvoir
desséchant. Ils augmentent la transpiration du palmier, entraine la
brûlure des jeunes pousses et le dessèchement des dattes. Les
vents ont aussi une action sur la propagation de quelques prédateurs des
palmiers dattiers comme l'Ectomyelois cératoniae [Haddad,
2000].
I.1.5.2. Les exigences édaphiques
Le palmier dattier s'accommode aux sols de formation
désertique et subdésertique très divers, qui constitue les
terres cultivables de ces régions. Il croit plus rapidement en sol
léger qu'en sol lourd, où il entre en production plus
précocement. Il exige un sol neutre, profond, bien drainé et
assez riche, ou susceptible d'être fertilisés [Toutain, 1979].
I.1.5.3. Les exigences hydriques
Malgré que le palmier dattier est cultivé dans
les régions les plus chaudes et plus sèches du globe, il est
toujours localisé aux endroits ou les ressources hydriques du sol sont
suffisant pour subvenir assez aux besoins des racines. Les besoins du palmier
en eau dépendent de la nature de sol, des variétés ainsi
que du bioclimat. La période des grands besoins en eau du palmier se
situe de la nouaison à la formation du noyau de fruit [Lakhdari,
1980].
Les services agricoles et de l'hydraulique du sud
algérien estiment les besoins en eau d'irrigation à 21.344
m3/ha/an, soit 173,45 m3/palmier/an [Lakhdari, 1980].
Munier (1973), situe les besoins en eau du palmier en sol sableux entre 22
863,6 m3 à 25 859,5 m3/ha/an, soit 183,95
m3 à 210,24 m3/palmier/an.
I.1.6. Répartition géographique et
production du palmier dattier
I.1.6.1. Production mondiale:
Le palmier dattier a fait l'objet d'une exploitation intense
en Afrique méditerranéenne, au Moyen-Orient et à l'U.S.A.
On distingue deux groupes de pays :
· Les pays grands exportateurs ;
· Les pays principalement consommateurs.
La production mondiale pour l'an 2002 est estimée
à 6 405 178 tonnes, à travers environ 34 pays, occupant
une superficie de 2,7 millions d'hectares. La production globale du monde a
doublé en l'an 2002 par rapport à l'an 1980. Les dix principaux
pays producteurs estimés en 2002 par la FAO sont figurés dans le
tableau 01.
Tableau 01 : Les dix principaux producteurs des
dattes (FAO 2002).
|
Pays
|
Pourcentage de la production mondiale (%)
|
|
Egypte
|
17
|
|
Iran
|
14
|
|
Arabie Saoudite
|
13
|
|
Emirats
|
12
|
|
Iraq
|
10
|
|
Pakistan
|
10
|
|
Algérie
|
7
|
|
Oman
|
4
|
|
Soudan
|
4
|
|
Libye
|
2
|
I.1.6.2. Production Algérienne et sa
répartition géographique
Le patrimoine phoenicicole Algérien, estimé en
1996 à plus de 10 millions de palmiers, se caractérise par une
diversité exceptionnelle aussi bien dans les variétés que
les techniques utilisées. Ces palmiers, peuplées de cultivars peu
intéressants (non commercialisables et à conservation difficile)
sont aujourd'hui menacés de disparition. Ainsi les véritables
palmeraies commencent sur le versant Sud de l'Atlas saharien, par les
palmeraies Deglet Nour de Biskra (Tolga) à l'Est, par celles du M'Zab au
centre de Bni-Ounif à l'Ouest. A l'extrême Sud du Sahara, l'Oasis
de Djanet constitue la limite méridionale de la palmeraie
Algérienne. C'est dans le Nord-Est du Sahara qu'on trouve le 3/4 du
patrimoine phoenicicole, à la région de Ziban, de Oued-Righ et la
cuvette de Ouargla dont la production a été estimée de
849 082 qx en 2006 (voir annexe 01).
C'est aussi dans ces régions que sont produites les
belles dattes, Deglet Nour et autres variétés commerciales:
Ghars, Mech Degla, Degla Baida... [Quinten, 1996].
Pendant la campagne phoenicicole (2003/2004), la production de
dattes a été estimée de 4 721 540 qx soit une
augmentation de 13 % par rapport aux années écoulées. Il
est à noter que 49 % du volume global de la production sont
représentés par la variété Deglt Nour.
Tableau 02 : Principales variétés de
dattes algériennes et leur localisation [Amrani, 2002].
|
Variétés
|
Nombre de palmiers
|
Localisation
|
|
Ghars
|
2.500.000
|
Oued Righ, Zibens, Oued souf, Ouargla, M'zab, El golia.
|
|
Deglet Nour
|
1.500.000
|
Oued Righ, Zibens, Oued souf, Ouargla, M'zab, El golia.
|
|
Mech Degla
|
1.500.000
|
Oued Righ, Zibens, Oued souf.
|
|
Tilemson
|
500.000
|
Touat, El Boléa, Gourara, Tidikelt.
|
|
Tin-Nacer
|
400.000
|
Touat, El golia, Tidikelt.
|
|
Degla Beida
|
300.000
|
Oued Righ, Zibens, Oued souf.
|
|
Tazerzait
|
100.000
|
M'zab, Tidikelt, Saoura.
|
|
Tegaza
|
70.000
|
Tidikelt, Touat, El golia, Hoggar.
|
|
Temjouhart
|
50.000
|
El golia, Gourara, M'zab.
|
|
Takerboucht
|
42.000
|
Tidikelt, Touat.
|
|
Tafezouine
|
35.000
|
M'zab, Oued souf, Oued Righ,
|
|
Tanteboucht
|
10.000
|
Oued Righ, Ouargla, Tidikelt.
|
|
Timedouel
|
8.000
|
M'zab, El golia.
|
|
Total des palmiers
|
7.015.000
|
|
I.2. Les dattes
I.2.1. Définition
La datte est une baie, de forme généralement
allongée, leurs dimensions sont très variables de 1,5 à 8
cm de longueur et d'un poids de 2 à 20 g. Leur couleur va du blanc
jaunâtre au sombre très foncé presque noir, en passant par
les ambres, rouges et bruns. La datte contient une seule graine dite "noyau".
La partie comestible de la datte, est dite "chair" ou "pulpe", donc elle se
compose de :
a. Partie comestible, représentée par le
mésocarpe dont la consistance peut être selon les
variétés, le climat ainsi que la période de
maturation :
· Molle : le mésocarpe est très
humidifié avec peu de saccharose (31% d'eau).
· Demi molle : telle que la Deglet Nour (18%
d'eau).
· Sèche : telle que la Degla Beida, Hamraia
et la Mech Degla (12% d'eau).
b. Partie non comestible, formée par la graine ou le
noyau, ayant une consistance dure. Le noyau représente 10 % à 30
% du poids de la datte [Etienne, 2002].

Fig. 03 : Fruit et graine du dattier [Munier,
1973].
I.2.2. Evolution physiologique de la datte
Depuis la pollinisation jusqu'à la maturation
complète de la datte et la récolte, on peut observer trois types
d'évolution physiologique de la datte, qui sont [Kharoubi,
1995] :
· Une évolution de taille ;
· Une évolution pondérale ;
· Une évolution de la couleur.
A partir de cette évolution, on peut classer
physiologiquement toutes ces périodes en cinq grands stades :
a. Loulou ou Hababouk : c'est le stade
"nouaison" qui vient juste après la pollinisation. Les dattes ont une
croissance lente, une couleur verte jaunâtre et une forme
sphérique. Il dure 4 à 5 semaines après
fécondation.
b. Khalal ou Kimri, Blah : ce stade dure
sept semaines environs, il se caractérise par une croissance rapide en
poids et en volume des dattes. Les fruits ont une couleur verte vive et un
goût âpre à cause de la présence des tanins.
c. Bser ou Bsir, Bissir : les sucres
totaux atteignant un maximum en fin du stade. La couleur vire au jaune, au
rouge et au brun, suivant les clones. La datte atteint son poids maximum, au
début de ce stade. Il dure en moyenne quatre semaines.
d. Martouba ou Routab : c'est le stade
de la datte mure pour certains cultivars. Le poids et la teneur en eau vont
diminuer à la fin. La durée de ce stade où le fruit prend
une couleur brune est de 2 à 4 semaines. Les tanins émigrent vers
les cellules situées à la périphérie du
mésocarpe et sont fixés sous forme insoluble.
e. Tamar ou Tmar : c'est la phase ultime
de la maturation au cours de laquelle, l'amidon de la pulpe se transforme
complètement en sucres réducteurs (glucose et fructose), et en
sucres non réducteurs (saccharose) [Djerbi, 1994].
I.2.3. Caractéristiques morphologiques des
dattes
La datte est constituée d'une partie charnue (la
chaire) et d'un noyau. Les dattes des cultivars présentent des
caractéristiques morphologiques différentes. Les dattes se
varient selon la couleur, la forme et le goût. Une datte est dite de
qualité physiologique acceptable, quand elle présente
[Açouren, 2001] :
· Aucune anomalie et aucun endommagement ;
· Un poids supérieur ou égal à 6
g ;
· Un poids en pulpe supérieur ou égale
à 5 g ;
· Une longueur supérieure ou égale à
3,5 cm.
En Algérie, les dattes les plus populaires sont :
Deglet Nour et Ghars.
I.2.3.1. Deglet Nour
La Deglet Nour / Deglet-En-Nour qui veut dire
« doigts de lumière » a été
ramenée en Algérie vers le 8ème siècle.
C'est un fruit très énergétique. Cette datte est
légendaire pour la perfection qu'on lui connait. Elle est
qualifiée de « la renne des dattes » et l'un des
produits phares de l'agriculture algérienne. Dotée d'un
goût très doux, juteuse et quasi-transparente, elle est la plus
populaire des dattes.
La datte Deglet Nour est une datte demie molle et excellente.
Ses dimensions, selon Maatallah S, 1970 sont les suivantes:
· Un poids moyen de 12 g ;
· Une longueur moyenne de 6 cm ;
· Un diamètre moyen de 1,8 cm.
· Un noyau lisse, de petite taille
0,8-3cm, pointu aux deux extrémités. La rainure ventrale est peu
profonde, le micropyle est central.
La datte Deglet Nour est de forme fuselée, ovoïde,
légèrement aplatie du coté périanthe. Au stade
Tmar, la datte devient ombrée, avec un épicarpe lisse et
brillant. Le mésocarpe est fin, de texture fibreuse [Bennamia et
Messaoudi, 2006].
I.2.3.2. Ghars
La datte Ghars se caractérise essentiellement par une
consistance très molle, à maturité complète. Ses
dimensions sont selon Belguedj, 2002 les suivantes :
· Un poids moyen de 9 g ;
· Une longueur moyenne de 4 cm ;
· Un diamètre moyen de 1,8 cm.
Cette datte au stade Bser est de couleur jaune, mielleuse au
stade Routabe et brun foncé à maturité. L'épicarpe
est vitreux brillant, collé et légèrement plissé.
Le mésocarpe est charnu, de consistance molle et de texture fibreuse. Le
périanthe est de couleur jaune-clair, légèrement
voûté.
I.2.4. Composition physicochimique
I.2.4.1. La teneur en eau
D'une manière générale, les dattes
présentent des humidités inférieures à 40%. Elles
sont classées parmi les aliments à humidité
intermédiaire dont la conservation est relativement aisée
[Bennamia et Messaoudi, 2006].
Tableau 03 : Teneur en eau de quelques
variétés [Barreveld, 1993]
|
Variété
|
Teneur en eau en %
|
|
Degla Beidha
|
12 à 17,45
|
|
Ghars
|
15 à 18
|
|
Mech degla
|
23
|
|
Deglet Nour
|
20 à 31
|
|
Arechti ou Hamraia
|
14,5 à, 19
|
|
Horra
|
12,27 à 13
|
I.2.4.2. Le pH
Le pH de la datte est légèrement acide, il varie
entre 5 et 6. Ce pH est préjudiciable aux bactéries mais
approprié au développement de la flore fongique [Reynes et al.,
1994].
I.2.4.3. L'acidité
L'acidité de la datte est faible est varie entre 2,02
et 6,3 g d'acide/Kg [Rygg et al., 1953]. Une forte acidité est souvent
associée à une mauvaise qualité. Le taux de
l'acidité de la datte est proportionnel à la teneur en eau et
donc inversement proportionnel au degré de maturité. Des travaux
faits par les mêmes chercheurs sur la variété Deglet Nour,
montrent qu'au cours des différents stades de l'évolution de
cette variété, les acides organiques décelés sont
l'acide malique et acétique, ils apparaissent et disparaissent entre le
stade Kimri et le début de stade Khalal, puis à partir de ce
stade ils se stabilisent en quantité égale, c'est ce qui est
indiqué par le tableau suivant [Maatalah, 1970].
Tableau 04 : Modification de pH de Deglet Nour au
cours de son développement [Maatalah, 1970].
|
Stades de maturation
|
pH
|
|
Kimri (bleh vert)
|
5,5
|
|
Khalal
|
5,7
|
|
50% Martouba
|
6
|
|
Martouba 100%
|
6,2
|
I.2.5 La composition biochimique

Fig. 04 : Composition biochimique globale de la
datte [Sawaya et al., 1982].
I.2.5.1. Fraction glucidique
I.2.5.1.1. Les sucres totaux et réducteurs
D'après Reynes et al, 1996 la datte contient trois
sucres majeurs: le saccharose, le glucose et le fructose, ceci n'exclut pas la
présence d'autres sucres tels que le galactose, le xylose et
l'arabinose. Le glucose et le fructose (sucres réducteurs), proviennent
probablement de l'inversion du saccharose (non réducteur); puisque
l'invertase (enzyme responsable de cette inversion) est décelée
à des taux différents dans un grand nombre de
variétés de dattes [Hadjari et Kadi Hnifi, 2005].
La réaction qui se produit l'hydrolyse, s'exprime de
façon simplifiée par la formule suivante:
C12H22O11 + H2O
C6H12O6 +
C6H12O6
Saccharose + eau
Glucose + fructose
La teneur en sucres totaux ainsi que la proportion de sucres
réducteurs et de saccharose varient selon les variétés
dans les limites de 50 à 85% pour les sucres totaux, et de 20 à
60% du poids de la pulpe en sucre réducteurs [Bennamia et Messaoudi,
2006].
Tableau 05 : Composition en sucres (g/100g de M.S)
des dattes stockées [Sawaya et al., 1982].
|
Variété
|
Sucre totaux
|
Sucre réducteurs
|
Saccharose
|
|
Degla Beida
|
67
|
37
|
28,7
|
|
Ghars
|
62,4
|
57,4
|
5
|
|
Mech Degla
|
72
|
28
|
42,3
|
|
Arechti ou Hamira
|
66,7
|
60,4
|
3,4
|
|
Horra
|
75,6
|
22,4
|
38
|
Tableau 06 : Classement des dattes en fonction de
leur teneur en sucre [Dubost, 2002].
|
Classe
|
Teneur en eau
|
Saccharose
|
Sucre C6
|
|
Classe I
Deglet nour
|
15 à 52 %
|
40 à 65 %
|
20 à 40 %
|
|
Classe II
Tin naceur
|
10 à 30 %
|
10 à 35 %
|
40 à 75 %
|
|
Classe III
Ghars
|
10 à 35 %
|
0 à 10 %
|
65 à 90 %
|
|
Classe IV
Les autres variétés
|
35 à 65 %
|
0%
|
35 à 75 %
|
I.2.5.1.2. Pectines et cellulose
Pour l'ensemble des cultivars, les pulpes des dattes ont un
taux en fibres (cellulose et pectine) de 4,5%. La teneur en pectine soluble est
respectivement de 1.21%, 0.67% et de 0.51% pour la datte, le noyau et la pulpe,
ceux- ci contiennent aussi 1.66%, 3.12% et de 2.65% en acide pectique brut et
0.77%, 1.43% et de 1.02% en prépectine ainsi que 2.30%, 3.21% et de
2.77% en pectine totale [Barreveld, 1993].
I.2.5.2. Les protides
La pulpe de datte ne renferme qu'une faible quantité de
protéines. De nombreuses analyses faites par différents auteurs
ont montré que les matières protéiques représentent
environ 2%. La composition en acides aminés des protéines de la
pulpe de datte révèle la présence de 6 à 8 acides
aminés indispensables pour l'homme avec une absence de la
méthionine et de phénylalanine [Ghazi et Teffahi, 2007].
I.2.5.3. Les lipides
La pulpe des dattes contient une faible quantité de
lipides. Elle est de l'ordre de 0,13 à 1,9% du poids frais. Cette
quantité de lipides est concentrée dans l'épicarpe de la
datte, sous forme d'une couche de cires [Maatallah, 1970].
I.2.5.4. Les minéraux
Les dattes peuvent être considérées comme
les fruits les plus riches en éléments minéraux [Munier,
1973].
Tableau 07 : Composition de 100 g de dattes en
éléments minéraux [Frenot et Vierling,
1997].
|
Eléments minéraux
|
Na
|
K
|
P
|
Ca
|
Mg
|
Fe
|
Zn
|
|
Quantité (mg)
|
35
|
65
|
57
|
63
|
50
|
1,9
|
0,34
|
I.2.5.5. Les vitamines
La pulpe de datte contient des vitamines en quantités
variable selon les types de dattes et leur provenance. En
général, elle contient des caroténoïdes et des
vitamines du groupe B en quantité appréciable, mais peu de
vitamine C [Munier, 1973].
Tableau 08 : Composition vitaminique de la pulpe
de datte [Répertoire général des aliments].
|
Vitamines
|
Quantité (mg/100g)
|
|
Acide ascorbique (C)
|
5-20
|
|
Thiamine (B1)
|
0,06-0,13
|
|
Riboflavine (B2)
|
0,05-0,17
|
|
Acide nicotinique (PP)
|
0,5-0,6
|
|
Acide pantothénique (B5)
|
0,06-0,07
|
|
Biotine
|
0,004-0,006
|
I.2.5.6. Les fibres alimentaires
La consommation de dattes contribue à l'apport en
fibres, souvent faible dans l'alimentation. Une portion de 25 g de dattes
(trois fruits) fournit 2 g de fibres, ce qui représente 5 à
8 % de la quantité de fibres recommandée par jour, soit
38 g pour les hommes et 25 g pour les femmes. Les fibres des dattes
sont constituées à 57 % de fibres insolubles et à
43 % de fibres solubles [Barreveld, 1993].
I.2.5.7. Les composés phénoliques
Mansouri (2005) et ses collaborateurs ont mené une
étude sur des variétés de dattes mures
récoltés sur des palmeraies de Ghardaia. Les différentes
variétés analysées ont présenté un contenu
phénolique dans la gamme 2,49 - 8,36 mg/100 g du poids à
l'état frais. Ces résultats ont prouvé que la datte a un
contenu phénolique bas comparée à d'autres fruits. La
quasi-totalité des dattes est marquée par une astringence plus ou
moins prononcée due au dépôt d'une couche de tanins en
dessous de la peau au cours du stade loulou. Les teneurs en tanins insolubles
pour les dattes vertes, mûres stockées sont respectivement de
l'ordre de 55.39 et 219 mg/100 g de M.S.
I.2.5.8. Les enzymes
Les enzymes jouent un rôle important dans les
processus de la conversion qui ont lieu pendant la formation et la maturation
du fruit. Parmi ces enzymes, on peut citer l'invertase, les polygalacturonases
et pectinesterases, les polyphénoloxydases et les peroxydases.
a) Invertase
Responsable de l'inversion de saccharose en glucose et
fructose et apparenter la texture et la flexibilité [Barreveld,
1993].
b) Polygalacturonases et pectinesterases
Leur activité pectinolytique ne leur permet pas
d'être pressentes dans les derniers stades de maturation [Rygg, 1975].
c) Les polyphénoloxydases et les peroxydases
Les cellules végétales renferment souvent en
abondance des composés phénoliques qui s'oxydent facilement en
quinones en présence d'oxygène sous l'action d'enzymes dont les
principales sont les polyphénoloxydases et les peroxydases. Les quinones
formées s'oxydent à leur tour, et se polymérisent en
donnant des composés bruns qui sont responsables du brunissement [Rabah
et Merabbi, 2006].
I.2.6. Valeur nutritionnelle des dattes
La datte est un aliment énergétique qui renferme
beaucoup de sucre, où 100g de pulpe de Deglet Nour donnent 306 Kilo
calories. Néanmoins, Patron cité par Munier (1973), affirme que
100 g de pulpe de variétés communes donnent 260 Kilo calories.
I.2.6.1. Composition en acides aminés
essentiels
Dans le tableau suivant, les besoins journaliers sont
exprimés en mg pour un homme de 65-70 kg par 24h, en activité
moyenne [Bennamia et Messaoudi, 2006].
Tableau 09 : Teneurs en acides aminés
essentiels des dattes et les besoins humains [Açouren,
2001].
|
Acides aminés essentiels
|
Teneurs
(mg/100g de MF-DN*)
|
Besoins journaliers
(mg)
|
|
Isoleucine
|
41,95
|
700
|
|
Leucine
|
86,25
|
1100
|
|
Lysine
|
64,5
|
800
|
|
Méthionine
|
39,35
|
1100
|
|
Cystine
|
31,85
|
|
Phenyl-alanine
|
55,10
|
1100
|
|
Tyrosine
|
46,35
|
|
Tryptophane
|
19,5
|
250
|
|
Thréonine
|
76,35
|
|
Valine
|
91,10
|
80
|
*MF-DN: matière fraîche de Dglet Nour
La datte ne peut à elle seule satisfaire tous les
besoins de l'organisme en acides aminés essentiels. D'après le
tableau 09, un homme d'une activité moyenne doit consommer
quotidiennement une quantité élevée de dattes, soit 1,3
à 1,6 kg. Des résultats similaires ont été
rapportés par Dowson et Aten (1963) sur les variétés
des dattes irakiennes, Halawi et Zahdi. Ces résultats montrent que
malgré leurs faibles quantités, les protéines des dattes
sont assez équilibrées qualitativement.
I.3. Les variétés cultivées
Il existe environ 200 variétés de dattes
cultivées en Algérie qui se différencient par leur
qualité et leur appréciation sur le marché. Les
principales variétés sont les suivantes :
· Deglet Nour ;
· Degla Beida ;
· Mech Degla ;
· Ghars.
Les autres variétés ont une importance
économique très réduite car elles sont peu
appréciées dans le Nord du pays et nullement à
l'étranger [Hadjari et Kadi Hanifi, 2005].
I.3.1. Deglet Nour
Variété commerciale par excellence, datte molle
considérée comme étant la meilleure variété
de datte, du fait de son aspect, de son onctuosité et sa saveur. Le
rendement varie de 150 à 200 kg/arbre. Cette variété est
caractérisée par une maturation échelonnée sur un
même régime qui fait qu'elle se subdivise en plusieurs
classes [Amrani, 2002] :
· Dattes extra (1er choix) ;
· Dattes standards ;
· Dattes marchandes.
I.3.2. Les variétés communes
La production est estimée à 53% et est
représentée par trois (03) variétés :
Ø Ghars : variété
très rustique ; 2 500 000 palmiers en production en 1985. La
région de Biskra produit environ 1 242 000 tonnes [Amrani, 2002]. Cette
variété se trouve dans la plus part des palmeraies
algériennes. Le fruit mûr est à consistance molle de forme
oblongue irrégulière (plus gros vers l'apex), la chair est peu
éparse avec une peau résistante qui se décale de la chair.
Le rendement varie entre 60 et 70 kg/arbre [Amrani, 2002].
Ø Degla Beida :
variété se trouvant principalement dans l'Afrique Noir
(Sénégal et Mali) il s'agit d'une datte sèche dont 80% du
poids constitue la pulpe.
Ø Mech Degla : datte sèche
dont la chaire est fermée et résistante. Son rendement
varié entre 50 et 60 kg/arbre.
I.3.3. Les variétés secondaires
Elles comportent plus de 150 variétés dont la
majorité est très peu appréciée [Maatalah, 1970].
Parmi elles, citons la variété Hamraia qui a été
étudiée par Hannachi et ces collaborateurs (1998), cette
variété abondante au Tassili, elle se caractérise par une
couleur marron ou rouge au stade Tamar et a un goût parfumé ou
acidulé. Le tableau 17 donne plus d'information sur cette
variété.
CHAPITRE II :
LE MIEL

II.1. Définition
Le miel est la substance naturelle sucrée produite par
les abeilles Apis mellifera à partir du nectar de plantes ou
à partir de sécrétions provenant de parties vivantes de
plantes ou à partir d'excrétions d'insectes butineurs
laissées sur les parties vivantes de plantes, que les abeilles butinent,
transforment en les combinant avec des substances spécifiques qu'elles
sécrètent elles-mêmes, déposent,
déshydratent, emmagasinent et laissent affiner et mûrir
dans les rayons de la ruche [Codex Stan, 1981].
II.2. Caractéristiques
Voici quelques caractéristiques spécifiques du
miel:
· La couleur du miel dépend du nectar dont il est
issu et est accentuée par son vieillissement.
· Son odeur est subtile et typique pour chaque
variété, il possède une prédominance selon son
origine botanique.
· Sa saveur est très sucrée ou douce, au
goût très prononcé.
· Sa densité moyenne est d'environ 1,4 à
20°C. Elle peut varier si les conditions de conservation sont
mauvaises.
· Son pH est acide (environs 3-5) il dépend de son
origine botanique (nectar ou miellat).
· Sa consistance est très variable: fluide ou
solide ainsi que tous les intermédiaires possibles. Elle varie aussi
selon la température, la teneur en eau et la richesse du miel en glucose
ou en lévulose [@1].
II.3. Origine
Les principales variétés de miel se classent en
fonction de l'origine (miel de nectar ou miel de miellat) ou bien selon le mode
d'obtention (miel en rayon, miel avec morceau de rayon, miel
égoutté, miel centrifugé et miel pressé).
Le mot miel peut par ailleurs, être
éventuellement complété par une indication ayant trait
à l'origine florale ou végétale, si le produit provient de
façon prépondérant de l'origine indiquée, ou par un
nom régional, territorial ou topographique [Nacer Chergui, 1994].
II.3.1. Le Nectar
II.3.1.1. Définition
Le nectar est un liquide sucré
sécrété par les nectaires dont sont dotés certains
végétaux à la base des corolles [@ 2].
Les nectars sont les sources les plus « naturelles »
puisqu'elles résultent de l'étroite coévolution des
angiospermes avec les insectes butineurs. Selon Biri (1986), la teneur en
sucres et le degré de densité du nectar sont en fonction de
l'espèce végétale et du climat.
II.3.1.2. Formation
A l'intérieure des fleurs, les tissus
nectarifères accumulent les sucres. Cette provision de sucres constitue
une réserve qui sera utilisée ultérieurement par la plante
pour assurer les premiers stades de développement des fruits et des
graines après la floraison. Le nectar est donc produit par une sorte
d'exsudation de l'eau venant des racines traversant la plante, et
entraînant avec lui une partie des sucres contenus dans le tissus
nectarifère [Bendahou, 2002].
II.3.1.3. Composition
Selon certains auteurs, le nectar peut contenir jusqu'à
80% d'eau, 7 à 60% de sucre, mais aussi de nombreuses
autres substances à l'état de traces, tels que des acides
aminés, des acides organiques, des substances aromatiques, des
vitamines, des minéraux, etc... Ces substances sont responsables de la
valeur aromatique d'un miel et lui confèrent sa personnalité
[Philipe, 1999]. La composition glucidique du nectar montre qu'il renferme
trois principaux sucres: saccharose, fructose et glucose et une faible
proportion de maltose, mélézitose, raffinose, mélibiose,
tréhalose [Philipe, 1991].
II.3.2. Le miellat
II.3.2.1. Définition
Il s'agit d'un liquide sucré
sécrété par des hémiptères essentiellement
des pucerons (Buchneria) ou des cochenilles (Physokermes
hemicryphus), à partir de la sève des végétaux
et dont se nourrissent les fourmis et les abeilles [Querzy et Zuthum, 1997].
Ravazzi (1996), ajoute que ce dernier
se distingue du miel par sa composition plus poisseuse et par sa forte teneur
en protéines ; Il note aussi qu'il y a plusieurs types de miellats
différents en leur couleur, parfum, saveur, composition et vitesse de
cristallisation.
II.3.2.2. Types du miellat
· Miellat d'origine animale
Produit par des pucerons qui attaquent les feuilles
particulièrement riche en liquide sucré, ces pucerons ne
digérant qu'une faible partie de matière absorbée, et
expulsent la plus grande portion de liquide qui retombe sur les feuilles en
gouttes.
· Miellat d'origine végétale ou
miellée
Provient d'une d'exsudation des feuilles on peut alors la voir
perler par toutes les orifices stomatiques et se réunir en gouttelettes
sucrées sur toute la surface da la feuille, surtout sur la face
inférieure [Bendahou, 2002].
II.4. Fabrication du miel par les abeilles
II.4.1. Transformation du nectar
Une butineuse effectue entre 20 et 50 voyages par jour, chacun
demandant environ 15 minutes. Le rayon d'action moyen se situe entre 500 m et 2
km, elle prélève sur les fleurs le nectar, sécrète
par des glandes dites nectarifères, présenté sur des
nombreuses plantes.
Le changement de la solution sucrée en miel commence
déjà lors du voyage, au cours du quel elle est accumulée
dans le jabot de l'abeille. C'est dans sont tube digestif que s'amorce la
longue transformation, des enzymes agissent sur le nectar. Le saccharose sous
l'action de l'invertase, se transforme en glucose, fructose, maltose et autres
sucres.
II.4.2. L'emmagasinage
Les modifications physico-chimiques se poursuivent dès
l'arrivée à la ruche. A sont retour, la butineuse
régurgite, la passe aux ouvrières, qui elles-mêmes la
communique à d'autres et ainsi de suite. D'individu en individu, la
teneur en eau s'abaisse en même temps que le liquide s'enrichit de sucs
gastriques et de substances salivaires : invertase, diastase, et gluco-oxydase.
D'autres sucres qui n'ont pas existé au départ sont
synthétisés simultanément. La goutte épaissie et
déversée ensuite dans une alvéole, d'où l'eau du
miel s'évapore.
II.4.3. Maturation
La solution sucrée transformée (contenant 50%
d'eau) va subir une nouvelle concentration par évaporation, qui se fait
sous double influence :
Ø D'abord de la chaleur régnant dans la ruche
qui est d'environ 36 °C.
Ø Ensuite de la ventilation par le travail des
ventileuses qui entretiennent un puissant courant d'air ascendant par un
mouvement très rapide de leurs ailes.
Dans la ruche, le miel se garde bien, car il est très
concentré en sucre. Mais on dit que les abeilles, pour plus de
sécurité, injectent dans chaque cellule une gouttelette de venin.
Et celui-ci est un produit conservateur ! Quand tout ce travail sera
terminé, la cellule pleine du miel sera fermée par un opercule de
cire [Bernadette et Roger, 1985].
II.5. Composition chimique
La composition chimique du miel varie selon la qualité
du nectar et du miellat récoltés, la nature du sol et
l'état physiologique de la colonie [Gonnet, 1982]
Cane (1980), cité par Philippe (1999), rapporte que 181
substances ont été identifiées et qu'il est évident
qu'en réalité cette composition est beaucoup plus complexe.
Le tableau 10 figure les exigences et les
recommandations les plus importantes de l'Union européenne (1974) et du
Codex Alimentarius (1993) concernant le miel, mettant en avant les
différentes proportions moyennes (min-max) des principaux constituants
du miel.
Tableau 10 : Recommandations et exigences
internationales [Codex Alimentarius, 1993 ;
UE, 1974]
|
Caractéristique qualitative
|
Exigences
|
Recommandations
|
|
UE1
|
Codex2
|
|
Eau (g/100g)
|
|
Miel, en général
|
max. 21
|
max. 21
|
|
Miel de bruyère, miel de trèfle
|
max. 23
|
max. 23
|
|
Teneur apparente en sucres réducteurs (g/100
g)
|
|
Miel de fleurs
|
min. 65
|
min. 65
|
|
Miel de miellat, ou mélanges avec miel de fleurs
|
min. 60
|
min. 60
|
|
Teneur apparente en saccharose (g/100 g)
|
|
Miel en général
|
max. 5
|
max. 5
|
|
Miel de miellat, ou mélanges avec miel de fleurs (miel
d'acacias, de lavande, de Banksia, d`Eucryphia)
|
max. 10
|
max. 10
|
|
Substances non hydrosolubles (g/100 g)
|
0,1
|
0,1
|
|
Sels minéraux (g/100g)
|
|
Miel en général
|
max. 0,6
|
max. 1
|
|
Miel de miellat ou mélanges de miel de fleurs
|
max. 1
|
pas d'indication
|
|
Acides libres (milliéquivalent/kg)
|
40
|
40
|
|
Indice d'amylase (en unités de Schade)
|
|
Miel en général
|
min. 8
|
min. 3
|
|
Miels pauvres en enzymes, comme le miel d'acacias, de fleurs
d'oranger
|
min. 3
|
pas d'indication
|
|
Hydroxyméthylfurfurol (mg/kg)
|
max. 40
|
max. 80
|
1 Union Européenne
2 Codex Alimentarius
II.5.1. Teneur en eau du miel
La teneur en eau varie dans les limites assez vastes (15%
à 22%) suivant l'origine du miel : le miel de montagne et le miel
de fleurs provenant du Mexique sont généralement pauvres en eau.
Le miel de Bruyère en revanche, peut en contenir jusqu'à 25% pour
que le miel se conserve bien, sa teneur en eau ne devrait pas être trop
élevé (18% à 20%), faute de quoi une fermentation
superficielle peut se produise. Une forte teneur en eau peut aussi être
l'indice d'un manque de maturité ou encore une adjonction d'eau [Nacer
Chergui, 1994].
Dans les régions normalement sèches, les
abeilles ont coutume de stoker de miels très riche en eau (24% et plus).
On peut supposer que leur lente déshydratation au travers des opercules
assure une régulation hydrique de la ruche [Bendahou, 2002].
Le tableau 11 donne des indications sur la relation entre la
teneur en eau et la température de trois miels différents [Horn
et al. 1992].
Tableau 11 : Rapport entre la teneur en eau et la
température [Horn et al., 1992].
|
Teneur en eau
|
Température
|
|
Miel d'acacia (liquide)
|
19,3
|
24 °C
|
|
Miel de sapin (liquide)
|
19,2
|
20 °C
|
|
Miel de fleurs
(crémeux, cristallisation fine)
|
19,4
|
20 °C
|
II.5.2. Les sucres
Selon Geanne, (1983), cité par Bendahou, (2002), les
sucres représentent de 90% à 95% de la matière
sèche du miel. Chaque miel est susceptible de contenir une bonne dizaine
de sucres ce sont des mono, di, tri, ou polysaccharidases représentant
80% du poids total du miel. Deux d'entre eux: le glucose et le fructose
dominent, nettement et représentent à eux seuls près de
70% ; les autres sucres peuvent se trouver à l'état de
traces ou en quantité plus ou moins importantes, mais toujours dans des
proportions qui ne dépassent pas quelques pourcentages.
La présence de saccharose est totalement artificielle.
Il est plus ou moins normal cependant qu'un peu de saccharose se trouve dans le
miel, il provient des restes de nourriture d'hiver ou de nourriture d'appoint
au printemps. Ça valeur moyenne admise est de 10 % [Alippi, 2000].
Les teneures en sucre inverti du miel Algérien selon
les résultats obtenus par Kerrar, 1994 varient de 32,8 à
41,66%.
Le spectre des différents types de sucres est parfois
caractéristique pour certaines sortes de miel (tableau 12). Le
mélézitose et le raffinose font partie de la composition des
miels de miellat. Il n`est toutefois pas toujours possible de déterminer
avec sûreté la sorte de miel au seul moyen du spectre de
sucres.
Tableau 12 : Teneur des différents sucres
dans les miels de fleurs et de miellat [@ 3]
|
Type de sucre
|
Miel de fleurs (g/ 100g)
|
Miel de miellat (g/ 100g)
|
|
IC* (m)
|
HPLC (m)
|
Domaine**
|
IC*(m)
|
HPLC (m)
|
Domaine**
|
|
Fructose
|
37,8
|
39,6
|
32,5-45,2
|
35,7
|
2,3
|
28,3-39,8
|
|
Glucose
|
30,2
|
30,9
|
24,3-39,9
|
25,0
|
23,9
|
19,0-31,5
|
|
Saccharose
|
0,05
|
0,7
|
0,05-6,2
|
0,07
|
0,5
|
0,05-1,0
|
|
Maltose1
|
0,9
|
0,6
|
0,1-2,3
|
--
|
1,4
|
0,5-2,5
|
|
Turanose
|
1,1
|
1,4
|
0,8-2,9
|
1,7
|
1,8
|
0,5-2,5
|
|
Trehalose
|
<0,05
|
0,3
|
0,05-1,5
|
0,5
|
1,1
|
0,1-2,4
|
|
Isomaltose2
|
1,3
|
0,3
|
0,2-2,2
|
4,1
|
0,3
|
0,1-10,8
|
|
div.disaccharides
|
--
|
2,3
|
1,1-5,5
|
--
|
1,8
|
0,5-5,0
|
|
Erlose
|
0,4
|
0,7
|
0,1-6,0
|
0,4
|
1,4
|
0,1-5,3
|
|
Mélézitose
|
0,1
|
0,2
|
0,1-1,0
|
1,8
|
5,3
|
0,3-22,0
|
|
Mélézitose +
Raffinose
|
--
|
0,2
|
0,1-1,1
|
--
|
5,8
|
1,1-23,5
|
|
Maltotriose
|
0,2
|
--
|
0,1-04
|
0,6
|
--
|
0,1-1,3
|
|
Oligosaccharides
inconnus
|
4
|
--
|
1-3
|
2
|
--
|
1-3
|
|
Total sucre
|
78,1
|
77
|
61,5-82,5
|
74,8
|
70,4
|
60,5-81,0
|
*IC: Valeurs obtenues par ampérométrie
pulsée (méthode provisoire)
**domaine: est valable pour les deux méthodes
m: valeurs moyennes arithmétiques
-- : pas analysé; div. disaccharides = nigerose,
maltulose et kojibiose.
1 : avec la méthode HPLC, le maltulose est souvent
détecté
2 : avec la méthode IC, le maltulose est aussi
détecté
II.5.2.1. Rapport fructose/ glucose
Les hexoses (fructose et glucose) dominent toujours, leur
somme présente 80 à 90% ou même d'avantage des sucres
totaux. Le rapport de ces hexoses (F/G) entre eux est la caractéristique
de certains miel et déterminé aussi pour leur consistance dans le
miel (mélange de nectar et de miellat). Le rapport F/G dépasse
à peine dans la règle 1; c'est à dire que ces miels
contiennent des quantités à peu près égales de ces
deux hexoses, le fructose domine légèrement. En revanche, le miel
que les abeilles ont butiné presque de la même espèce
végétale, contiennent souvent passablement plus de fructose que
de glucose, ou le contraire (mais c'est toute fois plus rare) d'avantage de
glucose que de fructose. Parmi les miels riche en fructose (F/G = 1,5 à
1.7), il faut citer par exemple: le miel de sauge et le miel de
châtaignier.Les miels riches en fructose restant longtemps liquides et ne
cristallisent souvent qu'au bout de plusieurs années. Les miels riches
en glucose (F/G inférieur à 1) sont plus rares. Ils cristallisent
en général aussitôt après la récolte et
parfois déjà dans les rayons, ce sont par exemple le miel de
pissenlit et du colza [Chauvin, 1968].
II.5.2.2. Saccharose
Des récentes analyses ont montré que la teneur
en saccharose des miels naturels est généralement plus basse
qu'on le supposait jusqu'à présent, souvent elle n'atteint
même pas des quantités mesurables. Le miel de châtaignier,
tilleul, bruyère, de fleurs d'oranges et de certaines espèces de
Labiacées sont riches en saccharose, alors que les miels de colza de
trèfle et de sarrasin sont pauvre en saccharose.
La limite maximale de la teneur en saccharose est de 10 % et
il est rare de trouver des teneurs très élevées de cette
quantité.
L'abeille est en effet capable de transformer le saccharose en
glucose et en fructose grâce à une enzyme appelée
l'invertase. Une relation étroite existe entre l'activité de
l'invertase et le pourcentage de saccharose résiduel dans les miels,
les plus fortes teneurs en saccharose sont observées lorsque la
miellée est très courte, ou lorsque les colonies sont faibles
[Nacer Chergui, 1994].
II.5.2.3. Maltose
La teneur en maltose est sensiblement plus
élevée que la teneur en saccharose, aussi bien dans les miels des
fleurs que dans les miels de miellat. Ces derniers lorsque ils sont purs,
contiennent souvent 2 à 3 fois et parfois jusqu'à 10 fois de
maltose que de saccharose, compte tenu de l'ensemble du groupe maltose, il est
possible de rencontrer du miel contenant 10% de maltose et du iso-maltose
[Pourtallier, 1983].
II.5.2.4. Mélézitose (tri
saccharides)
Une teneur élevée en mélézitose
est caractéristique de certains miels de meillat, tandis que ce sucre
fait défaut dans les miels des fleurs (miels de nectar). Le
mélézitose est considéré comme étant le
sucre prépondérant dans les relations pucerons-fourmis [Buckley,
1987 ; Yao et Akimoto, 2001]. Ainsi dans l'expérience de Volkl et
al., 1999, le mélézitose et le raffinose ne sont retrouvés
que chez les pucerons myrmécophiles. Le mélézitose serait
synthétisé à partir du glucose et du sucrose dans le but
d'attirer les fourmis [Yao et Akimoto, 2001]. La production de
mélézitose et de certains trisaccharides ont été
sélectionnés car l'entretien par les fourmis présentes des
avantages pour le puceron [Dixon 1985]. Les miels riches en
mélézitoses se cristallisent souvent alors qu'ils sont encore
dans les rayons, de sorte qu'ils sont difficiles à récolter.
Parmi ces miels riches en mélézitose et difficiles à
centrifuger on trouve par exemple des miels élaborés à
partir du miellat de mélèze, et de tilleul ou certaines
variétés d'épicéa ; d'après Pourtalier
(1983), certains miellats arrivent à renfermer des taux de
mélézitoses atteignant 15 à 18%.
II.5.3. Les sels minéraux
La teneur en sels minéraux du miel et en moyenne de
l'ordre de 0.1 à 0.2 % dont le potassium est le plus dominant et
représente 80 % de la matière minérale [Gonnet, 1982].
En 1996 le même auteur ajoute que sa teneur en
éléments minéraux dépend des plantes
visitées par les abeilles ainsi que du type du sol sur lequel elles
poussent.
Les éléments les mieux présentés
dans les miels en dehors du potassium, sont le Chlore, le Calcium, le Sodium,
le Phosphore, le Magnésium, le Chrome, le Zinc le Fer... etc
[Donadieu, 1978].
La teneur en sels minéraux et en
oligo-éléments du miel est indiquée dans le tableau 13,
ces valeurs ont été mesurées dans des miels de
différentes provenances.
Tableau 13 : Sels minéraux et
oligo-éléments dans le miel de différentes provenances.
[Morse, et Lisk, 1980].
|
mg/kg
|
|
mg/kg
|
|
Potassium
|
200 - 1500
|
Manganèse
|
0,2 - 10
|
|
Sodium
|
16 - 170
|
Chrome
|
0,1 - 0,3
|
|
Calcium
|
40 - 300
|
Cobalt
|
0,01 - 0,5
|
|
Magnésium
|
7 - 130
|
Nickel
|
0,3 - 1,3
|
|
Fer
|
0,3 - 40
|
Aluminium
|
3 - 60
|
|
Zinc
|
0,5 - 20
|
Cuivre
|
0,2 - 6,0
|
|
Plomb2
|
<0,02 - 0,8
|
Cadmium
|
<0,005 - 0,15
|
2 : Contamination.
II.5.4. Les protéines
La teneur en protéines varie avec la quantité de
grains de pollens dans les miels, ces derniers sont généralement
pauvres en protéines. Anchling (2003), signale que les protides sont
présents dans le miel en faible quantité 1.7 g/kg,
soit une teneur de 0.26 %, ainsi il confirme qu'il s'agit
essentiellement de peptone, d'albumines, de globulines et d'acides
aminés libres telle que la proline, qui provient des
sécrétions salivaires de l'abeille. La teneur en proline donne
des informations sur la maturité du miel et peut servir à
détecter des falsifications. On considère qu'un miel est
arrivé à maturité lorsque sa teneur en proline est
supérieure à 183 mg/kg. Des valeurs plus basses indiquent un
manque de maturité ou une falsification [Von der Ohe et al., 1991].
II.5.5. Les enzymes
Le miel contient plusieurs enzymes dans la présence est
à rattacher à l'origine double de miel :
végétale et animale. On sait que le nectar contient dès sa
récolte des enzymes qui agissent sur les sucres ; les
sécrétions de l'abeille viennent y ajouter les enzymes de glandes
pharyngiennes. L'á-amylase et â-amylase, diastase ou enzyme de la
digestion de l'amidon sont présentes dans tous les miels frais en
quantités variables suivant l'origine du miel. Les invertases
(fructo-invertase et gluco-invertase), sont les enzymes responsables de la
transformation du saccharose du nectar, en lévulose et dextroses du
miel. La glucose-oxydase est présente dans le miel et donne naissance
à du peroxyde d'hydrogène ou eau oxygénée et
à la gluconolactone. Ces trois types d'enzymes sont sensibles à
la chaleur : à 10 °C, elles peuvent se conserver pendant de
nombreuses années, à 20 °C, seulement quelques heures. Pour
rester naturel, le miel ne doit pas être chauffé. D'autres
enzymes sont également présents tels que la Catalase et
la Phosphatase [White 1980].
Jeanne, 1993 indique que l'indice diastasique doit être
supérieur à 8 (échelle de Schade) toléré
à 3 pour les miels à faibles teneurs en diastase comme les miels
d'agrumes et ayant un taux d'HMF<15. Les miels chauffés ont un indice
diastasique faible et varient de 0,71 à 0,82 [Kerar, 1994]
II.5.6. Les lipides
De très faibles quantités de lipides ont
été isolées dans le miel, principalement l'acide
palmitique, acide oléique et très peu d'acide laurique,
myristolique, stéarique et linoléique [Philippe (1999)].
II.5.7. Les vitamines
L'ensemble des recherches effectuées jusqu'à ce
jour permet d'affirmer que, si l'on reste dans le cadre des consommations
journalières normales, le miel est totalement incapable de couvrir les
besoins vitaminiques de l'homme: on peut considérer que les vitamines
qu'il apporte, et qu'il semble bien provenir surtout de grains de pollen en
suspension puisqu'une filtration poussée les élimine en grande
partie, représentent une quantité pratiquement négligeable
[Chauvin, 1968]. On n'y trouve aucune vitamine liposoluble (vitamine A et
vitamine D), mais un peu de vitamine C [Louveaux, 1984].
Les vitamines du groupe B présentes dans le miel sont
la thiamine, la riboflavine, la pyridoxine, l'acide folique, l'acide
nicotinique et la biotine voir tableau 14.
Tableau 14 : Teneur en vitamines dans 100 g de
miel [White, 1980].
|
Vitamines
|
Teneur dans 100 g de miel
|
|
A
|
UI
|
|
B1
|
0,004 à 0,006 mg
|
|
Complexe B
|
-----
|
|
Riboflavine
|
0,002 à 0,006
|
|
Acide nicotinique
|
0,11 à 0,36 mg
|
|
B6 (pyroxidine)
|
0,008 à 0,32 mg
|
|
Acide pantothénique
|
0,02 à 0,18 mg
|
|
Acide folique
|
-----
|
|
B12
|
-----
|
|
C (acide ascorbique)
|
2,2 à 2,4 mg
|
|
D
|
IU
|
|
E
|
IU
|
|
H
|
IU
|
UI: unité internationale
----: non mesuré
II.5.8. Le pH
Les miels de fleurs possèdent le plus souvent des
valeurs de pH faibles (3,3 à 4,6) à l'exception les miels de
fleurs de châtaignier ont une valeur de pH relativement
élevée allant de 5 à 6 (voir tableau 15). Les miels de
miellat ont, en raison de leur teneur plus élevée en sels
à effet tampon, des valeurs de pH en moyenne plus élevées
(4,2 à 5,5) [Bieri et al, 1995].
II.5.9. L'acidité
L'acidité est un critère de qualité
important tous les miels ont une réaction acide. Elle peut varier de 10
à 60 meq, par exemple pour le miel de colza elle est au moyenne, pour le
miel de sapin de 18,6 [Chauvin, 1968].
Selon Poutailler (1983), un miel de bonne qualité ne
doit pas avoir une acidité libre supérieure à 4 meq pour
100g. L'acidité naturelle du miel s'accroît avec le vieillissement
du miel, lors qu'il est extrait de rayons fortement propolisés et
notamment lorsqu'il s'altère par fermentation [Horn et Lullmann,
1992].
Les valeurs de pH et la teneur en acide libre de
différentes sortes du miel sont indiquées dans le tableau 15.
Tableau 15 : Valeurs de pH et la teneur en acides
libres de différentes sortes de miels [Talpay, 1985].
|
Types de miel
|
Valeur pH
|
Acides libres (meq/kg)
|
|
Acacia
|
3,5-4,3
|
6-11
|
|
Châtaignier
|
4,2-6,5
|
12-32
|
|
Bruyère
|
4,0-5,4
|
29-53
|
|
Lavande
|
3,2-3,9
|
22-42
|
|
Fleurs d'origine
|
3,5-4,2
|
9-32
|
|
Colza
|
3,7-4,3
|
5-26
|
|
Romarin
|
3,2-4,1
|
4-11
|
|
Forêt
|
4,2-6,0
|
28
|
II.5.10. Hydroxyméthylfurfural
On appelle l'hydroxyméthyl furfural (HMF), un
dérivé de déshydratation des hexoses qui se forme dans le
miel conservé à une température de15 à 20°C.
Le taux d'HMF augmente progressivement, lentement tout d'abord pour
s'accélérer par la suite, la teneur initiale en HMF serait
à multiplier par 1,1 au bout de 6 mois et par 2 au bout d'un an. Cette
progression serait plus rapide dans les miels à pH faible (compris entre
3 et 3,5). L'élévation de la température a une action
importante sur la formation de l'HMF. Deux paramètres entrent en jeu
dans cette formation: la température et la durée de stockage ou
concervation [Bendahou et al, 2002].
II.5.11. Les composés phénoliques
De nombreuses études sont consacrées à la
propolis, source importante de composés phénoliques, notamment
les flavonoïdes [Ghisalberti, 1979; Walker et Crane, 1987]. Une trentaine
de composés a été identifiée, dont les acides
phénols, les flavones, les flavonols et des flavanones [Vanhaelen et
Vanhaelen-Fastre, 1979]. Ces substances phénoliques se trouvent dans les
sécrétions de bourgeons et d'exsudats de divers organes des
plantes [Villanueva et al., 1970; Scogin,1979]. Ces substances pourraient se
retrouver dans les miels [Bogdanov,1984]. Elles peuvent être
considérées comme des marqueurs de l'origine florale [Alix et
al., 1985; Tomas-Lorente et al.,1986].
II.5.12. Substances aromatiques
Environ 100 à 150 différentes substances
aromatiques ont été isolés dans le miel et certaines ont
même été caractérisées du point de vue
chimique [Bousseta et al.,1992 ; Häusler et al., 1990]. Elles jouent un
rôle important dans l'appréciation sensorielle du miel. Les
substances aromatiques se conservent le mieux si le miel est stocké au
froid dans des récipients fermés. Si l'on chauffe le miel, une
part de ces substances est anéantie.
II.6. L'Apithérapie et intérêts du
miel
On entend par apithérapie, toute thérapeutique
ayant pour substances actives des produits apicoles. L'Apithérapie est
un concept global de santé, parce que ses composants sont issus de la
nature. En plus du miel; la cire, le pollen, la gelée royale, la
propolis et même le venin sont valorisés en Apithérapie.
Produit phare de la ruche, le miel est utilisé depuis
toujours pour ses vertus nutritives, curatives et spirituelles. Par sa
composition très variée (sucres, vitamines,
polyphénols...) ses applications sont innombrables. Les miels ont une
action thérapeutique variable, selon leur origine florale, sur tous les
systèmes du corps humain : croissance, système immunitaire,
système respiratoire, système digestif. Ils agissent aussi sur la
peau comme cicatrisants des plaies normales, surinfectées ou des
brûlures.
Le miel naturel montre une activité cicatrisante
importante. Outre son activité antibactérienne, il jouit d'une
propriété nettoyante et désinfectante.
En plus, son action énergétique profite aux
cellules jeunes, en favorisant notamment la multiplication cellulaire. Des
études comparatives ont montré des résultats très
intéressants dans la cicatrisation de brûlures ou de plaies
nécrosées.
En plus de leurs propriétés
thérapeutiques intrinsèques, les miels présentent
également un intérêt comme vecteur d'autres agents
thérapeutiques. Cela signifie que, grâce à leur pression
osmotique favorable, ils constituent de bons véhicules permettant
d'améliorer le degré d'assimilation par l'organisme d'autres
produits à action thérapeutique [@ 4].

CHAPITRE III :
LES COMPOSÉS PHÉNOLIQUES
III.1. Généralités
Les polyphénols sont des métabolites secondaires
présents chez toutes les plantes vasculaires [Lebham, 2005]. Ils
constituent un des groupes le plus nombreux et largement distribué des
substances dans le royaume des végétaux avec plus de 8000
structures phénoliques présents dans tous les organes de la
plante. Ils résultent biogénétiquement de deux voies
synthétiques principales : la voie shikimate et acétate
[Lugasi et al., 2003].
Les composés phénoliques (acides
phénoliques, flavonoïdes simples et proanthocyanidines) forment le
groupe des composés phytochimiques le plus important des plantes [Beta
et al., 2005].
L'élément structural de base est un noyau
benzoïque auquel sont directement liés un ou plusieurs groupes
hydroxyles, libres ou engagés dans une autre fonction chimique
(éther, méthylique, ester, sucre...) [Bruneton, 1993].
Les fonctions principales attribuées à ces
composés chez les végétaux sont la protection contre les
pathogènes et les herbivores ainsi que la limitation des dommages dus
aux radiations UV. Dans ce cas, ils agissent par effet d'écran et par
effet antioxydant [Lebham, 2005].
III.2. Classification des composés
phénoliques
Les composés phénoliques regroupent un vaste
ensemble de substances chimiques comprenant au moins un noyau aromatique, et un
ou plusieurs groupes hydroxyle, en plus d'autres constituants [Salunkhe, 1990].
Les polyphénols naturels vont de molécules simples, comme les
acides phénoliques, à des composés hautement
polymérisés comme les tanins.
Il existe différentes classes de polyphénols,
notamment : les acides phénoliques, les flavonoïdes, les
tanins, les stilbènes, les lignanes, les saponines, les
phytostérols ou bien phytostanols. Les plus importants sont: les acides
phénols, les flavonoïdes et les tanins.

Fig. 05 : Les différentes classes des
composés phénoliques [@5]
III.2.1. Les acides phénols et les coumarines
Les acides phénoliques sont contenus dans un certains
nombre de plantes agricoles et médicinales [Psotovà et al.,
2005]. Les acides phénoliques sont formés d'un squelette à
sept atomes de carbone. Ils sont principalement représentés dans
la variété de datte Deglet Nour par la présence de l'acide
gallique, qui est généralement lié par une liaison ester
à l'épicatéchine [Singleton et Timbreuse, 1978].
III.2.1.1. Les acides benzoïques
Les acides benzoïques sont formés d'un squelette
à sept atomes de carbones. Ils sont principalement
représentés par les acides p-hydroxybenzoïques,
protocatéchiques, vanilliques, galliques, cyringiques, salicyliques,
o-hydroxybenzoïques et gentisiques.
Les acides protocatéchiques et galliques ont
probablement une origine et des fonctions différentes dans la plante. Le
premier est très largement répandu, le second est plus rare, on
le rencontre dans la nature surtout sous forme de dimère [Ribereau,
1968]
III.2.1.2. Les acides cinnamiques
Ces acides possèdent une structure du type
C6-C3. Les composés les plus fréquents sont
l'acide p-coumarique, l'acide caféique, l'acide fertarique et l'acide
sinapique (figure 6) [Ribereau, 1968 ; Goetz et al., 1999]

|
Esters hydroxycinnamiques
|
R1
|
R2
|
|
Acide t-caféique
|
OH
|
H
|
|
Acide p-coumarique
|
H
|
H
|
|
Acide t-fertarique
|
OCH3
|
H
|
|
Acide t-sinapique
|
OCH3
|
OCH3
|
Fig. 06 : Structures chimiques de quelques
dérivés de l'ester hydroxycinnamiques.
On rencontre au moins un de ces quatre acides dans
pratiquement tous les végétaux supérieurs. Ces acides
existent dans les tissus sous formes de différentes combinaisons
[Ribereau, 1968]
III.2.1.3. Les coumarines
On peut considérer que les différentes
coumarines dérivent des acides cinnamiques ortho-hydroxylés, de
même que la coumarine elle-même dérive de l'acide
o-coumarique. Les coumarines les plus fréquentes sont
l'umbelliférone ou ombelliférone, l'aesculétine, la
scopolétine, dont les substitutions correspondent, respectivement, aux
acides : p-coumarique, caféique et
férulique. Signalons également la fraxétine et la
daphnétine (voir figure 7) [Dean, 1963].

Fig. 07 : Structure chimique de quelques
coumarines [Dean, 1963].
III.2.2. Les flavonoïdes
Les flavonoïdes (du latin flavus, jaune) sont
des substances généralement colorées répondues chez
les végétaux ; on les trouve dissoutes dans la vacuole
à l'état d'hétérosides ou comme constituants de
plastes particuliers, les chromoplastes [Guigniard, 1996].
Le terme flavonoïdes rassemble une très large
gamme de composés naturels appartenant à la famille des
polyphénols. Sont présents dans toutes les parties des
végétaux supérieurs: racines, tiges, feuilles, fleurs,
pollens, fruits, graines, bois. Leur fonction principale semble être la
coloration des plantes (au-delà de la chlorophylle, des
caroténoïdes et des bétalaïnes), même si leur
présence est parfois masquée par leur présence sous forme
"leuco", ce qui explique leur intérêt commercial dans l'industrie
alimentaire [Gabor ,1988].
III.2.2.1. Structure
Les flavonoïdes ont une origine
biosynthétique commune et ils possèdent tous un même
squelette de base à quinze atomes de carbone constitué de deux
unités aromatiques, de cycle en C6 (A et B), reliés
par une chaine en C3 (figure 08) [Bruneton, 1999].

Fig. 08 : Squelette de base des flavonoïdes
[Dean, 1963].
III.2.2.2. Biosynthèse des flavonoïdes

Elle se fait à partir d'un précurseur commun,
la 4, 2', 4', 6'-tétrahydroxychalcone (figure 09). Cette chalcone
métabolisée sous l'action d'enzyme, la chalcone isomérase,
en naringenine (1). Sur cette dernière agit la flavone synthase pour
donner: apigénine (2) ou le dihydroflavonol (3). Le dihydroflavonol, en
présence de la flavonol synthase, se métabolise en
kaempférol (4) ou en le leucoanthocyanidol. Ce dernier semble etre le
précurseur des flavan-3,4-ols (6) et anthocyanidols (7), ce dernier sous
l'action de la 3-O-glycosyltransférase, se transforme en anthocyanoside
(8) [Marfek, 2003].
Fig. 08 : Biosynthèse des flavonoides
[Bruneton, 1999].
Fig. 09 : Biosynthèse des flavonoides
[Bruneton, 1999].
III.2.2.3. Propriétés des
flavonoïdes
Comme on a cité les flavonoïdes
sont présents en toutes les parties des végétaux
supérieurs. Certains, sont plus spécifiques de certains tissus,
comme par exemple les anthocyanes sont plutôt localisés dans les
parties externes des fruits, fleurs et feuilles. Les chalcones se retrouvent
plus fréquemment dans les pétales des fleurs. Se sont des
pigments naturels au même titre que les chlorophylles (couleur verte) et
les caroténoïdes (nuance jaunes et orangées).
De nos jours, les propriétés les
flavonoïdes sont largement étudiées dans le
domaine médical où on leur reconnaît des activités
antivirales, anti-tumorales, anti-inflammatoires, anti-allergiques et
anti-cancéreuses [Middleton et Kardasnami, 1993]. La famille des
flavonoides peut se diviser en six classes qui diffèrent par leurs
structures chimiques: flavanols, flavones, flavonols, flavanones, isoflavones
et anthocyanidines [Medic et al., 2004].
Parmi les nombreux pigments dérivants de cette
structure, il convient de citer notamment:
III.2.2.3.1. Les flavonols
Les flavonols (hydroxy-3 flavone) sont largement
répondus et incolores, ils sont caractérisés par la
présence carbonylme en position 4 et d'un groupement hydroxyle en
position 3. Les flavonols qui possèdent en plus des hydroxydes en 6 ou 8
colorent certaines fleurs au jaune primevère [Guignard, 1996 ;
Alais et Linden, 1997].
Parmi les flavonols les plus répondus, on trouve le
kaempférol (OH en 4', 5, 7), le quercétol (OH en 3', 4', 5, 7)
ces deux flavonols sont incolores; le myricétol est l'isorhamétol
(figure 10).

Fig. 10 : Structures chimiques de quelques
flavonols [GNU, 2007].
III.2.2.3.2. Les flavanones
Ces composés ne comportent pas des groupements OH en
position 3, et présentent de fortes similitudes de structures avec les
flavonols. Dans cette catégorie, il faut ranger les flavonoides
responsables de la saveur amère de certaines pamplemousses, citrons,
orange: la naringine (naringénol lié à du glucose et du
rhamnose), l'hespéridine. [Alais et Linden, 1997].
III.2.2.3.3. Les anthocyanes
III.2.2.3.3.1. Présentation
Les anthocyanes (du grec anthos, fleur et Kuanos,
bleu violet) terme général qui regroupe les anthocyanidols
et leurs dérivés glycosylés [Guignard, 1996]. Ces
molécules faisant partie de la famille des flavonoïdes
et capables d'absorber la lumière visible, sont des pigments
qui colorent les plantes en bleu, rouge, mauve, rose ou orange [Harborne, 1967;
Brouillard, 1986].
Leur présence dans les plantes est donc
détectable à l'oeil nu. A l'origine de la couleur des fleurs, des
fruits et des bais rouges ou bleues, elles sont généralement
localisées dans les vacuoles des cellules épidermiques, qui sont
de véritables poches remplis d'eau [Mclure, 1979; Harbone et Grayer,
1988; Merlin et al., 1985].
Si la coloration des fleurs et des fruits est leur rôle
le plus connu, on trouve également les anthocynes dans les racines,
tiges, feuilles et graines. En automne, les couleurs caractéristiques
des feuilles des arbres sont du aux anthocyanes et aux carotènes qui ne
sont plus masqués par la chlorophylle.
III.2.2.3.3.2. Structures
Leur structure de base est caractérisée par un
noyau "flavon" généralement glucosylé en position
C3 [Ribereau, 1968]. Les anthocyanes se différencient par
leur degré d'hydroxylation et de méthylation, par la nature, le
nombre et la position des oses liés à la molécule.
L'aglycone ou anthocyanidine constitue le groupement chromophore du pigment
(figure 11).

|
Anthocyanidines
R=H
|
R1
|
R2
|
|
Malvidine
|
OCH3
|
OCH3
|
|
Péonidine
|
OCH3
|
H
|
|
Delphinidine
|
OH
|
OH
|
|
Pétunidine
|
OCH3
|
OH
|
|
Cyanidine
|
OH
|
H
|
Si la forme est
monoglucoside: R= glucose
Fig. 11 : Structure de quelques anthocyanidine
[Ribereau, 1968].
III.2.2.3.3.3. Propriétés des
anthocyanes
d) Le spectre d'absorption
Comme tous les flavonoides, les anthocyanidines
présentent une absorption caractéristique dans le domaine UV
[Markham, 1982]. La forme cationique de l'anthocyanidine est
caractérisée par deux bandes d'absorption, dont une bande intense
dans le domaine du visible, caractéristique pour chacune d'ente elles
[Harbone, 1967]. Ce maximum d'absorption subi un effet bathochrome quand la
polarité des solvants diminue (solvatochromie négative), par
contre on observe un effet hypsochrome quand les positions 3' et 5' sont
méthoxylées ou glycosylées. Les sucres augmentent la
solubilité et la stabilité des anthocyanes.
e) Modification de la structure en fonction de
l'acidité
Le pH est un facteur important dans le changement de couleur
des anthocyanes. La variation de structure de l'anthocyane en fonction du pH
est une particularité de ces molécules. Les observations
visuelles d'une solution aqueuse d'anthocyane montrent la forte coloration
rouge d'une solution à pH très acide, la coloration
décroît quand le pH augmente vers la neutralité. Une
solution neutre d'anthocyane fraîchement préparée est bleue
mais se décolore rapidement. Ces changement de couleurs sont dus
à des équilibres chimiques entre différentes formes que
peut prendre l'anthocyane [Brouillard et Delaporte, 1977; Brouillard, 1982].
f) Décoloration par le Bisulfite de Sodium
La décoloration des anthocyanes par l'acide sulfureux
et les bisulfites alcalins est une réaction connue depuis longtemps.
Cette réaction se fait mieux à pH 3 qu'à pH 1. D'autre
part la réaction est réversible mais uniquement dans le cas des
anthocyanines. La difficulté de la réaction en milieux acide
s'explique par le passage du bisulfite sous forme d'acide sulfureux moins
dissocié, avec diminution de la concentration en ions HSO3
[Ribéreau, 1968].
III.2.3. Les tanins
Les tanins sont des polyphénols que l'on trouve dans de
nombreux végétaux tels que les écorces d'arbre et les
fruits (raisin, datte, café, cacao...). Leur structure complexe est
formée d'unités répétitives monomériques qui
varient par leurs centres asymétriques, leur degré d'oxydation
[Hemingway, 1992].
Les tanins sont divisés en deux groupes :
· Les tanins condensés, formés de
proanthocyanidines (sous forme d'oligomères)
· Les tanins hydrolysables, esters des acides
phénols et de glucose.
III.2.3.1. Les tanins condensés
(flavan-3-ols)
Les tanins condensés, appelés aussi
polyphénols ou proanthocyanidine, sont largement répandus dans
l'alimentation humaine (fruits, légume, thé, dattes, ...).
Certains auteurs ont trouvé pour la variété Deglet- Nour
que le taux est 16,66 ug/ml d'acide tannique, au stade Tmar, cette teneur reste
faible par rapport à celle notée par Yahiaoui, 1999 (70 ug/ml
d'acide tannique).
Il a été rapporté par Haslam (1998) que
les tanins jouent un rôle important dans les qualités
organoleptiques et nutritionnelles des produits [Haslam, 1998]. Ces tanins sont
des oligomères ou polymères de flavan-3-ols qui ont la
propriété de libérer des anthocyanes en milieu acide
à chaud par rupture de la liaison inter monomérique [Porter et
al. 1986]. Ils ne s'hydrolysent pas sous l'action des acides minéraux
dilués mais forment à l'ébullition des composés
insolubles appelés phlobaphènes ou rouge de tanins [Guignard,
1996].
III.2.3.1.1. Structure
La structure complexe des tanins condensés est
formée d'unités répétitives monomériques qui
varient par leur centre asymétrique et leur degré d'oxydation
[Hemingway, 1992]. Les formes naturelles monomériques des flavan-3-ols
se différencient par la stéréochimie des carbones
asymétrique C2 et C3 et par le niveau
d'hydroxylation du noyau B (figure 12). On distingue ainsi les
catéchines (dihydroxylées) des gallocatéchines
(trihydroxylées).

Fig. 12 : Structure chimique des tanins
condensés [Guignard, 1996].
III.2.3.2. Les tanins
hydrolysables
Les tanins hydrolysables sont des esters de glucides ou
d'acide phénols, ou de dérivés d'acides
phénols ; la molécule glucidique est en
général du glucose, mais dans certains cas des polysaccharides
[Ribereau, 1968]. Ce groupe de tanins est caractéristique des
Dicotylédones ; on le rencontre notamment chez les rosidaes dans
tous les organes : racines, tiges, feuilles ou fruits avant la
maturité. Ces tanins en raison de leurs nombreux groupements OH se
dissolvent plus ou moins (en fonction de leur poids moléculaire) dans
l'eau, en formant des solutions collodales [Guignard, 1996].
III.2.3.2.1. Structure
Les tanins hydrolysables sont constitués d'un noyau
central -le glucose- et de chaînes latérales (en position 1, 2, 3,
4 ou 6 sur le glucose) comprenant 1 à n monomère(s) d'acide
phénol. Des liaisons carbone à carbone entre noyaux (liaisons
biphényle réalisées par couplage oxydatif), conduisent
à des molécules ramassées plus rigides de
solubilité diminuée dites les tanins éllagiques.
[Guignard, 1996].
III.3. Intérêts des composés
phénoliques
III.3.1. Rôle nutritionnel et
thérapeutique
Les polyphénols sont probablement les composés
naturels les plus répandus dans la nature et de ce fait, sont des
éléments qui font partie de l'alimentation animale. A titre
d'exemple, l'homme consomme jusqu'à 10 g de ces composés par
jour. Ces substances sont dotées de certaines activités
résumées dans le tableau 16.
Tableau 16: Activités biologiques des
composés polyphénoliques [Frankel et al.,
1995].
|
Polyphénols
|
Activités
|
Auteurs
|
|
Acides phénols (cinnamique et benzoïque)
|
Antibactériens
Antifongiques
Antioxydants
|
[Didry et al., 1982]
[Ravn et al., 1984]
[Hayase et Kato, 1984]
|
|
Coumarines
|
Vasoprotectrices et antioedémateuses
|
[Mabry et Ulubelen, 1980]
|
|
Flavonoides
|
Antitumorales
Anticarcinogènes
Anti-inflammatoires
Hypotenseurs et diurétiques
Antioxydants
|
[Stavric et Matula, 1992]
[Das et al., 1994]
[Bidet et al., 1987]
[Bruneton, 1993]
[Aruoma et al., 1995]
|
|
Anthocyanes
|
Protection des veines et capillaires
|
[Bruneton, 1993]
|
|
Proanthocyanidines
|
Effets stabilisants sur le collagène
Antioxydants
Antitumorfales
Antifongiques
Anti-inflammatoires
|
[Masquelier et al., 1979]
[Bahorun et al., 1996]
[DE Oliveira et al., 1972]
[Brownlee et al., 1992]
[Kreofsky et al., 1992]
|
|
Tanins galliques et catéchiques
|
Antioxydants
|
[Okuda et al., 1983]
[Okamura et al., 1993]
|
Les poyphénols jouent un grand rôle dans la
quantité nutritive et hygiénique des aliments, certain d'entre
eux ont des propriétés vitaminiques utilisées par
l'industrie pharmaceutique. Ils interviennent également dans la
digestibilité des aliments, dans l'utilisation physiologique des
protéines (avec les quelles les tanins se combinent), ...etc. Les
décès dus au infractus du myocarde ou par
athérosclérose coronarienne sont à associés au taux
élevé des cholestérols du type LDL (Low density
Lipoprotéines) circulant dans le sang. Des études ont
démontré qu'une consommation importante d'antioxydants
phénoliques (vitamine E, queucétine...) pouvaient être
corrélée avec une baisse significative des décès
par athérosclérose, en diminuant l'oxydation des LDL [Frankel et
al., 1995].
Les polyphénols agiraient aussi en inhibant
l'agrégation plaquettaire impliquée dans le
phénomène de thrombose qui peut conduire à l'occlusion des
artères. Ils sont actifs contre de nombreux cancers (colon, estomac,
foie, sein, prostate, poumons, peau, vessie,...etc) à tout les stades de
cancérogénèse. Au stade d'initiation, ils agissent comme
agent bloquant en empêchant l'activation de pro carcinogène. Au
stade de promotion et de progression, ils agissent comme agent suppresseur de
tumeurs. Les mécanismes impliqués peuvent la encore être
très variés: prévention du stress oxydant, inhibition du
métabolisme de l'acide arachidonique et des réactions
inflammatoires associées, inhibition de la protéine kinase C et
de la prolifération cellulaire, induction de l'apoptose et l'inhibition
de l'angiogénèse.
Les polyphénols pourraient aussi exercer des effets
protecteurs contre les maladies hormonodépendantes telle que
l'ostéoporose en modulant la réponse aux oestrogènes
endogènes [Scalbert et Williamson, 2000]. Enfin, les composés
phénoliques et en particulier, l'acide salicylique (acide
hydroxybenzoique) ont également des propriétés
antiseptiques [Ribereau, 1964].
Cependant les preuves de leurs effets chez l'homme restent
encore insuffisantes.
III.3.2. Rôle physiologique
L'intégration du métabolisme phénolique
dans le programme général du développement d'un organe
végétal pose en elle-même la question d'un rôle
éventuel de ces substances.
Des travaux plus anciens ont monté que les
phénols seraient associés à de nombreux processus
physiologiques: croissance cellulaires, différenciation,
organogenèse, dormance des bourgeons, floraison et tubérisation
[Alibert et al., 1977].
Les flavonoïdes sont des pigments responsables de la
coloration des fleurs, des fruits et des feuilles. Ils sont universellement
présents dans la cuticule foliaire et dans les cellules
épidermiques de feuilles, ils sont susceptibles d'assurer la protection
des tissus contre les effets nocifs des rayonnements UV [Hadi, 2004].
Les pigments responsables de la coloration des fleurs
représentent des signaux visuels qui attirent des animaux
pollinisateurs. La plus part de ces pigments sont des anthocyanes, des aurones
et des chalcones. D'autres polyphénols incolores tels que des flavonols
et flavanones interagissent avec des anthocyanes pour altérer, par
co-pigmentation, la couleur des fleurs et des fruits [Brouillard et al., 1997].
La capacité d'une espèce végétale
à résister à l'attaque des insectes et des microorganismes
est souvent corrélée avec la teneur en composés
phénoliques [Rees et Harborne, 1985]. Des chercheurs
s'intéressent de plus en plus à l'identification des principes
actifs dans les extraits avec l'étude complémentaire intensive de
leur mécanisme d'action [Sun et al., 2002].
Ziouti et al., (1998), ont étudié l'implication
des composés phénoliques du palmier dattier dans la
réaction de défense de cette plante contre le bayoud, maladie
infectieuse due à un champignon tellurique Fusarium oxysporum f.sp
et il ont étudié aussi les résultats relatifs
à l'effet de l'inoculation par l'agent pathogène sur la
composition phénolique et sur les enzymes d'oxydation des
phénols. Ces composés pourraient contribuer dans la
défense du palmier puisque l'insolubilisation des phénols dans
les parois cellulaires participe au renforcement et à la rigidification
de celles-ci qui deviennent alors moins dégradables par les parasites
[Tan et al., 1992].
Le monde animal et lui aussi très concerné par
les composés phénoliques et en particulier les flavonoides. On
trouve par exemple de: la chrysine, la quercétine, la galangine dans la
propolis des abeilles. Ces insectes la fabriquent à partir des
secretions des bourgeons de nombreux arbres comme le bouleau, l'aulne,
l'épicéa, le sapin, le saule, l'orme et la modifient par leurs
enzymes salivaires. Les abeilles mettent instinctivement en oeuvre les
propriétés antifongiques et antibactériennes des
polyphénols pour aseptiser leur ruche et en colmatant les fentes. Les
propriétés cicatrisantes et anti-infectieuses de la propolis
étaient, entre autre, utilisées par les civilisations
égyptienne, romaine, grecque et inca [Ghazi et Shraoui, 2005].
III.3.3. Rôle technologique
Généralement les polyphénols sont
partiellement responsables des qualités sensorielles et alimentaires des
aliments végétaux. L'astringence et l'amertume des nourritures et
des boissons dépendent de la teneur en polyphénols [Lugasi et
al., 2003].
L'astringence est la capacité des tanins à
former des complexes stables avec les protéines et les sucres qui leur
confère leurs propriétés gustatives et leur astringence,
car ils précipitent les protéines salivaires entraînant
avec elles leur "cortège" de molécules d'eau qui lubrifiaient
alors la muqueuse buccale et qui crée une sensation d'assèchement
dans la bouche [Bravo, 1998 ; Vergé et al., 1999]. L'astringence est
liée à la polymérisation des tanins puisque la diminution
de l'astringence dans les fruits lors de leur maturation est due à une
augmentation de la polymérisation des tanins [Peronny, 2005].
Ainsi dans la technologie de certains produits
végétaux, les transformations des composés
phénoliques jouent un rôle important: ceci est valable aussi bien
pour la fermentation des feuilles de thé et des grains de cacao...etc
[Ribereau, 1964].
PARTIE
EXPÉRIMENTALE


CHAPITRE I :
MATÉRIELS ET MÉTHODES
I.1. Analyses des dattes
I.1.1. Matériel végétal
Deux variétés de dattes (phoenix
dactylifera) "Deglet Nour "et "Hamraia" ont été
utilisées dans notre étude. Elles ont été
récoltées dans les palmeraies au Sud-Est de l'Algérie et
plus exactement à Tolga (Biskra) et dans la région de Ouargla
durant la compagne phoenicicole de 2007.
Les deux variétés ont été
achetées au niveau du marché des dattes (Souk Tmar) dans la
wilaya de Ouargla au mois de mars 2008, puis stockées à
l'obscurité au réfrigérateur dans un emballage
alimentaire.
Les principales caractéristiques
géo-morphologiques des deux variétés de dattes
analysées sont rapportées dans le tableau ci-dessous.
Tableau 17 : Description des
variétés Deglet Nour et Hamraia
[Hannachi et al., 1998].
|
Caractéristiques
générales
|
Deglet Nour
|
Hamraia
|
|
Distribution géographique
|
Fréquente à Oued Righ et Touggourt. Peu
fréquente à Ouargla, Mzab et El Méniaa. Rare dans la
Saoura.
|
Abondante au Tassili. Peu fréquente dans la Saoura, El
Méniaa, Metlili, Ouargla, Oued-Righ. Rare au Mezab et Oued Souf.
|
|
Date de mâturité
|
Août- Septembre
|
Août- Septembre
|
|
Commercialisation
|
Importante aux marchés nationaux et internationaux
|
Faible
|
|
Caractères morphologiques
|
|
Forme de fruit
|
Fuselée ou ovoïde
|
Droite ou ovoïde
|
|
Taille de fruit
|
Moyenne à grande
|
Moyenne
|
|
Poids de 20 fruits (g)
|
180 à 200
|
130 à 140
|
|
Couleur au stade Tmar
|
Marron
|
Marron ou rouge
|
|
Consistance
|
Demi-molle
|
Demi-sèche
|
|
Plasticité
|
Elastique
|
Tendre ou élastique
|
|
Texture
|
Fibreuse
|
Fibreuse
|
|
Goût
|
Parfumé
|
Parfumé ou acidulé
|
I.1.2. Caractérisation physico-chimique
I.1.2.1. Le poids
La mesure du poids d'une unité de datte a
été déterminée sur 25 fruits choisis au hasard
d'après le protocole de Dowson et Aten (1963) et est exprimée en
gramme (g).
I.1.2.2. Détermination du pH
Dans une fiole de 200 ml, 4g de dattes
dénoyautées et broyées, sont dispersées dans de
l'eau chaude. Après refroidissement, la fiole est
complétée jusqu'au trait de Jauge avec de l'eau distillée.
La solution obtenue sert à la détermination du pH en utilisant un
pH mètre [Dowson et Aten, 1963].
I.1.2.3. Détermination de la teneur en
eau :
La teneur en eau a été déterminée
par dessiccation d'un échantillon de 2 g de dattes dans une
étuve isotherme à une température de 70°C #177;
2°C pendant 48 h pour éviter la caramélisation de
sucres [Reynes et al., 1994].
I.1.3. Composition chimique
I.1.3.1. Préparation des solutions à
base de dattes
5 g de dattes sont broyées dans un mortier-pilon.
Après dissolution dans une fiole de 200 ml avec de l'eau chaude, la
solution est refroidie puis ajustée avec de l'eau distillée.
I.1.3.2. Extraction des composés
phénoliques
L'objectif de cette extraction est de libérer les
polyphénols présents dans des structures vacuolaires par rupture
du tissu végétal et par diffusion. Ces derniers sont extraits par
extraction liquide-liquide en utilisant l'eau comme solvant, mais d'autres
solvants peuvent être utilisés tels que le méthanol,
acétonitrile, l'acétone et l'acétate d'éthyle
[@6].
I.1.3.3. Dosage des polyphénols totaux
(réactif de Folin Ciocalteu)
Le dosage des polyphénols a été
effectué au centre de mesure de chimie à l'aide d'un
spectrophotomètre à UV visible à double faisceaux de type
SHIMADZU UV-2401PC, la technique à double faisceaux nous a
aidé à éliminer l'absorbance du blanc et donner
directement la densité optique de l'échantillon. Pour s'assurer
que les résultats sont fiables, le dosage de chaque composé
phénolique a été réalisé en trois essais,
après on a calculé la moyenne des densités optique
mesurées.
Le dosage des polyphénols totaux par la méthode
utilisant le réactif de Folin-Ciocalteu a été
décrite en 1965 par Singleton et Rossi. Depuis, son utilisation s'est
largement répandue pour caractériser les extraits
végétaux d'origines plus diverses [@7].
I.1.3.3.1. Principe
Le réactif de Folin Ciocalteu est un acide de couleur
jaune constitué par un mélange d'acide phosphotungstique
(H3PW12O40) et d'acide phosphomolybdique
(H3PMo12O40). Il est réduit, lors de
l'oxydation des phénols, en un mélange d'oxydes bleus de
tungstène et de molybdène [Ribereau, 1968].
La coloration produite, dont l'absorption maximum à 760
nm, est proportionnelle à la quantité de polyphénols
présents dans les extraits végétaux [Ghazi et
Sahraoui, 2005].
I.1.3.3.2. Mode opératoire
Dans une fiole Jaugée de 20 ml, on introduit :
Ø La solution de dattes (0,2 ml)
Ø Réactif de Folin Ciocalteu (1 ml)
Ø Le bicarbonate (CO3Na2)
à 4,25% (quantité suffisante pour 20 ml).
On prépare dans les mêmes conditions un
témoin avec de l'eau distillée à la place de la solution
de dattes puis on porte au bain-marie à 70°C pendant 20 minutes.
Après refroidissement on détermine la
densité optique à 760 nm par rapport au témoin (voir
figure 13).
L'indice de Folin Ciocalteu est exprimé en degré
ou en gramme d'acide gallique/l, on peut utiliser une gamme-étalon
établie dans les mêmes conditions avec de l'acide gallique (0
à 1 g/l) ou de la D-catéchine [Ghazi et Sahraoui, 2005].

Fig. 13 : Protocole du dosage des polyphénols
totaux dans les dattes
I.1.3.4. Dosage des tanins
condensés
Les tanins sont dosés selon la méthode
colorimétrique de Folin Denis, décrite par Joslyn, 1970.
I.1.3.4.1. Principe
Il est basé sur la réduction de l'acide
phosphomolybdique et tungstique en milieu alcalin, en présence de tanins
pour donner une coloration bleue dont l'intensité est mesurée
à 760 nm sous 1 cm d'épaisseur.
I.1.3.4.2. Mode opératoire
Dans une fiole de 100 ml, on introduit :
Ø 75 ml d'eau distillée ;
Ø 1 ml de la solution de datte ;
Ø 5 ml de réactif de Folin Denis ;
Ø 10 ml de la solution saturée de
CO3Na2
Cette solution saturée est préparée
à partir de 43,75 g de carbonate de sodium dissous dans 100 ml d'eau
chaude (70° à 80°C) après refroidissement la solution
est filtrée puis ajustée à 125 ml. Après agitation
mécanique, la préparation repose pendant 30 minutes, la mesure de
la densité optique est faite à 760 nm.
Une gamme étalon d'acide tannique est
préparée dans les mêmes conditions dont les concentrations
allant de 0 à 0,1 g/l.
Un témoin avec de l'eau distillée à la
place de la solution de datte est réalisé dans les mêmes
conditions (voir figure 14).

Fig. 14 : Protocole du dosage des tanins
condensés
I.1.3.5. Dosage des anthocyanes
Les anthocyanes sont déterminés par la
méthode basée sur la décoloration par l'acide sulfureux
[Jur, 1967].
I.1.3.5.1. Principe
Le principe est basé sur la décoloration des
solutions d'anthocyanes en utilisant une solution de Bisulfite de Sodium. Le
chercheur Jur (1967) a montré que ce phénomène
était dû à l'existence d'une réaction entre le
cation flavylium et l'hydrogénosulfite HSO3. Cette
réaction est équilibrée et conduit à la formation
d'un produit d'addition incolore et plus ou moins stable selon le pigment.
Cette méthode suppose que les autres composés phénoliques
n'interfèrent pas sur le dosage.
I.1.3.5.2. Mode opératoire
Dans un Erlenmeyer de 50 ml, on introduit : 1 ml de la
solution de dattes ; 1 ml d'éthanol de 0,1 % Hcl et 20 ml d'Hcl
concentrée à 2 %. A partir de cette solution, on place dans un
premier tube à essai 10 ml de la solution et 4 ml d'eau
distillée ; dans un deuxième tube on met 10 ml de la
solution et 4 ml de bisulfite de sodium à 15%.
On procède après une attente de 20 mn, aux
mesures des densités optiques à 520 nm par rapport à l'eau
distillée (voir figure 15).
Les résultats sont exprimés en gramme (g)
d'anthocyanes par millilitre (ml) en se référant à une
courbe d'étalon tracée à partir du tableau 18.
Tableau 18 : Valeur d'étalonnage pour le
dosage des anthocyanes [Anonyme, 1978].
|
Anthocyanes en mg/ml
|
D-O - témoins
|
D-O échantillons
décolorés
|
Différence
|
|
375
187,5
93,5
75
37,5
|
0,450
0,234
0,112
0,086
0,042
|
0,020
0,012
0,003
0,004
0,002
|
0,430
0,222
0,109
0,082
0,040
|

Fig. 15 : Protocole du dosage des
anthocyanes
I.2. Analyses du miel
I.2.1. L'échantillon
La variété du miel analysée est de
provenance de la wilaya d'El Bayadh aux environs d'El Abiad Sidi Chikh (30 km
au sud du chef wilaya) plus exactement dans la région d'Arbaouate. Cette
région riche en eaux souterraines est riche en cultures et plantations
de divers légumes.
L'échantillon ramené a été
récolté durant le mois de Mars 2008. Après la
récolte, le miel est conditionné dans un bocal en verre puis
conservé au réfrigérateur.
I.2.2. Caractérisation physico-chimique
I.2.2.1. La teneur en eau
Pour l'estimation de la teneur en eau de notre
échantillon, la technique de séchage au four sous vide a
été retenue. On procède de la manière suivante:
Ø Conditionner des capsules pendant 15 mn dans un four
à 103 °C ;
Ø Dessécher pendant 30 mn ;
Ø Peser des capsules vides avec
numérotation ;
Ø Introduire 2 g de l'échantillon dans les
capsules tout en ajoutant une quantité d'eau pour diluer ce
dernier (assez pour l'homogénéiser);
Ø Introduire des capsules remplies dans le four
Pasteur, et ce pendant 2 h à une température de 103 °C.
Ø Retirer les capsules du four et les mettre dans le
dessiccateur, ensuite on effectue la première pesée.
Ø Remettre de nouveau les capsules au four Pasteur
pendant 2 h à 103 °C, ensuite faire la deuxième
pesée.
Le pourcentage de la matière sèche est
donné par la formule suivante :

% matière sèche =
x 100
I.2.2.2. Conductibilité et
pH
Ø Peser 4 g de miel dans 100 ml d'eau distillée
;
Ø Mélanger bien jusqu'à
homogénéisation du mélange ;
Ø Passer le mélange dans un agitateur lié
à deux électrodes, un correspond au pH-mètre et l'autre au
conductimètre ;
Ø Laisser agiter pendant 2 minutes ;
Ø Faire la lecture après stabilisation des
appareils.
I.2.3. Composition chimique
I.2.3.1. Préparation de la solution de
miel
Pour procéder au dosage des polyphénols totaux,
on a préparé deux dilutions à base de miel pour comparer
les deux résultats. La première dilution est effectuée en
diluant 2,5 g de miel dans 100 ml d'eau distillée (2,5%), la
deuxième en diluant 2,5 g de miel dans 25 ml d'eau distillée
(10%).
I.2.3.2. Dosage des polyphénols totaux
(réactif de Folin Ciocalteu)
Pour l'analyse des composés phénoliques du miel,
on effectue juste le dosage des polyphénols totaux en utilisant la
méthode de Folin Ciocalteu. On se base dans ce dosage sur les
mêmes démarches suivies dans le cas des dattes, et ça pour
les deux dilutions préparées auparavant.
I.2.3.2.1. Mode opératoire
Dans une fiole jaugée de 20 ml, on
introduit : 0,2 ml de la solution du miel ; 1 ml de
réactif de Folin Ciocalteu et une quantité suffisante pour 20 ml
de la solution de CO3Na2 à 4,25%.
On prépare dans les mêmes conditions un
témoin avec de l'eau distillée à la place de la solution
de miel, on utilise aussi une gamme étalon de l'acide gallique pour
exprimer les résultats obtenus, puis on porte toutes ces
préparations au bain-marie à 70°C pendant 20 minutes.
Après refroidissement, on détermine la densité optique
à 760 nm par rapport au témoin (voir figure 17).

Fig. 17 : Protocole du dosage des polyphénols
totaux dans le miel
CHAPITRE II :
RÉSULTATS ET DISCUSSION

II.1. Résultats d'analyses des dattes
II.1.1. Caractérisation physico-chimique
II.1.1.1. Le poids
La pesée des dattes a été
réalisée sur 25 fruits chez deux variétés ; Deglet
Nour et Hamraia. Les résultats exprimés en gramme (g) sont
indiqués dans le tableau ci-dessous :
Tableau 19 : Poids des deux variétés
récoltés en 2007
Poids (g)
Dattes
|
min
|
max
|
Moyenne
|
Yahiaoui
(1999)
|
Ghazi et Sahraoui
(2005)
|
|
Deglet Nour
|
6,48
|
11,55
|
9,44 #177; 2,53
|
8 à 10
|
-
|
|
Hamraia
|
4,27
|
9,9
|
6,63 #177; 2,81
|
-
|
7,76
|
D'après les résultats le poids moyen de Deglet
Nour est 1.5 fois plus élevé (9,44 g) que celui de la
variété Hamraia (6,63 g). Cette différence de poids est
ressentie du point de vue commercial puisque cette datte est plus vendue et
recherchée au niveau du marché national que la
variété Hamraia. Nos données corroborent avec celles de
certains auteurs (Yahiaoui, 1999 ; Ghazi et Sahraoui (2005).
II.1.1.2. La mesure du pH
L'analyse des résultats obtenus indique que les valeurs
de pH mesurées présentent une légère
différence entre les deux variétés de dattes
étudiées (tableau 20). La variété Hamraia montre un
pH légèrement acide (5,3) par rapport à celui de Deglet
Nour (5,7). Ce qui confirme le goût acidulé de la datte Hamraia
rapportée par Hanachi (1998). Ces résultats semblent être
plus ou moins contradictoires avec ceux de la littérature car Ghazi et
Sahraoui (2005) ont trouvé un pH moins acide (5,8) pour la
variété Hamraia et Yahiaoui (1999) a rapporté un pH de 5,1
au stade Tamar pour variété Deglet Nour. Ce faible pH
trouvé par rapport au notre peut s'expliquer par l'effet du stockage
comme il a été suggéré par Meftah et Saadi (1992)
qui ont confirmé que cette variété de Deglet Nour atteint
une valeur de pH = 5,1 au bout de 7 mois de stockage avec une valeur de
départ égale à 6,9. Heller (1990) a également
indiqué que le pH peut varier suivant l'état physiologique du
fruit, mais aussi suivant les conditions climatiques, de stockage et les
façons culturales.
Tableau 20 : Valeurs du pH pour les deux
variétés Deglet Nour et Hamraia
Valeur de pH
Dattes
|
Nos résultats
(2008)
|
Yahiaoui
(1999)
|
Ghazi et Sahraoui (2005)
|
|
Deglet Nour
|
5,7 #177; 0,1
|
5,1
|
-
|
|
Hamraia
|
5,3 #177; 0,4
|
-
|
5,8
|
II.1.1.3. La teneur en eau
Après le séchage des dattes, la mesure de la
teneur en eau de nos deux variétés a donné les valeurs
illustrées dans le tableau 21.
D'après le tableau, la teneur en eau de la
variété Deglet Nour (27,13 %) est presque 3 fois plus
élevée que celle de Hamraia (10,83 %). Ces résultats sont
en accord avec ceux trouvés par Benharrats et Benazzouk (1999) pour la
variété Deglet Nour récoltée dans la même
région (Biskra) que la notre mais pas par Ghazi et Sahraoui (2005) qui
ont rapporté une valeur de 25,48 % pour la variété
Hamraia. Cette grande différence trouvée dans nos
résultats peut s'expliquer probablement par une longue exposition au
marché des dattes ce qui entraîne l'évaporation de
l'eau.
Par ailleurs, Hannachi et ses collaborateurs (1998) confirment
la différence de teneur en eau entre ces deux variétés
puisqu'ils les ont classé, selon leur consistance, dans la
catégorie demi-molle pour Deglet Nour et demi-sèche pour
Hamraia.
Tableau 21: Teneur en eau pour les deux
variétés Deglet Nour et Hamraia
Teneur enEau (%)
Dattes
|
Nos résultats
(2008)
|
Benharrats et Benazzouk (1999)
|
Ghazi et Sahraoui (2005)
|
|
Deglet Nour
|
27,13 #177; 0,13
|
28
|
-
|
|
Hamraia
|
10,83 #177; 0,19
|
-
|
25,48
|
II.1.2. Composition chimique
II.1.2.1. Teneur en composés
phénoliques solubles totaux
Après la préparation de la gamme des
concentrations de l'acide gallique (0,25g/l ; 0,5g/l ; 0,75g/l ;
1g/l), la mesure de la densité optique a été
effectuée à la longueur d'onde de 760 nm (tableau
22). Les absorbances obtenues ont été
représentées en fonction des concentrations, la courbe
d'étalonnage réalisée montre la linéarité de
la réponse du détecteur en fonction des différentes
concentrations (figure 18).
Tableau 22 : Densités optiques des
différentes concentrations de l'acide gallique
|
Concentrations d'acide gallique (g/l)
|
Densité optique (D-O)
|
|
0,25
|
0,3379
|
|
0,5
|
0,6144
|
|
0,75
|
0,9788
|
|
1
|
1,2255
|

Fig. 18 : Courbe d'étalonnage pour le
dosage des C.P.S.T.
Les absorbances moyennes des deux variétés de
dattes (Deglet Nour et Hamraia) sont indiquées dans le tableau 23.
Tableau 23 : Densités optiques des C.P.S.T
des deux variétés de dattes.
|
Echantillons
|
Densité optique (D-O)
|
|
Deglet Nour
|
0,0996
|
|
Hamraia
|
0,1926
|
La concentration de chaque échantillon a
été obtenue par projection de l'absorbance moyenne sur la courbe
d'étalonnage. Les résultats exprimés en g/l d'acide
gallique sont mentionnés dans le tableau 24.
Tableau 24: Teneur en C.P.S.T chez les deux
variétés Deglet Nour et Hamraia
C.P.S.T. (ug/ml)
Dattes
|
Nos résultats
(2008)
|
Yahiaoui
(1999)
|
Ghazi et Sahraoui (2005)
|
|
Deglet Nour
|
81,5 #177; 1,5
|
77
|
16,6
|
|
Hamraia
|
141,5 #177; 13,5
|
-
|
26,66
|
Après extrapolation des résultats de la D.O sur
la courbe d'étalonnage, la teneur en composés phénoliques
solubles totaux (C.P.S.T) de la variété Deglet Nour est
estimée de 0,0815 g/l d'acide gallique soit 81,5 ug/ml. Cette
quantité est légèrement supérieure à celle
trouvée par Yahiaoui (1999) (77 ug/ml), cependant, elle est 5 fois
supérieure (16,6ug/ml) à celle communiquée par Ghazi et
Sahraoui (2005).
Quant à la variété Hamraia, la teneur en
C.P.S.T. est de 0,141 g/l d'acide gallique (soit 141,5 ug/ml) et donc là
aussi 5,5 fois supérieure (26,66 ug/ml) à celle rapportée
par Ghazi et Sahraoui (2005). Cette large différence est probablement
due aux conditions de stockage, de l'origine de provenance et au
différent taux de matière sèche des
échantillons.
D'après Harris (1977), ces différentes teneurs
en C.P.S.T. entre les deux variétés de dattes résultent de
l'effet d'un certain nombre de facteurs dont les principaux sont la
génétique, la lumière, les précipitations, la
topographie, la fertilisation et le type de sols, la saison et la
maturité. A ce propos, Macheix et ses collaborateurs (1990) signalent
que la concentration des polyphénols est très variable d'une
espèce à une autre et d'une variété à autre
et diminue régulièrement durant la maturation et le stockage par
différentes voies du brunissement. La réaction se fait en
présence d'O2 par l'intermédiaire de plusieurs
facteurs à savoir la température, le pH ainsi que les variations
quantitatives et qualitatives des C.P.S.T. contenus dans les fruits [Amiot et
al., 1995 ; Nicolas et al., 1994].
La valeur élevée des C.P.S.T. trouvée
dans notre échantillon peut probablement s'expliquer par la
concentration importante en caroténoïdes (inhibiteurs du
brunissement enzymatique) présents dans le fruit de la
variété de Hamraia fraîchement récoltée et
n'ayant pas subit un conditionnement de stockage.
II.1.2.2. Teneur en tanins condensés
Pour déterminer la teneur en tanins condensés
dans les dattes, on procède d'abord au traçage de la courbe
d'étalonnage (Fig.19) par la mesure de la D-O d'une gamme de
concentrations de l'acide tannique (0,025g/l ; 0,05g/l ;
0,075g/l et 0,1g/l). Le tableau 25 présente les absorbances
obtenues.
Tableau 25 : Densités optiques des
concentrations de l'acide tannique
|
Concentrations d'acide tannique (g/l)
|
Densité optique (D-O)
|
|
0,025
|
0,0060
|
|
0,05
|
0,0120
|
|
0,075
|
0,0174
|
|
0,1
|
0,0240
|

Fig. 19 : Courbe d'étalonnage pour le
dosage des T.C.
Après la réalisation de la courbe
d'étalonnage, la mesure des densités optiques des deux
variétés de dattes a été effectuée et les
résultats sont indiqués dans le tableau 26.
Tableau 26 - Densités optiques des T.C.
chez les deux variétés de dattes
|
Echantillons
|
Densité optique (D-O)
|
|
Deglet Nour
|
0,0050
|
|
Hamraia
|
0,0059
|
Après les calculs effectués à partir de
la courbe d'étalonnage, les résultats de la teneur en T.C. sont
indiqués dans le tableau 27
Tableau 27: Teneur en T.C. chez les deux
variétés Deglet Nour et Hamraia
T.C. (ug/ml)
Dattes
|
Nos résultats
(2008)
|
Yahiaoui
(1999)
|
Ghazi et Sahraoui (2005)
|
|
Deglet Nour
|
20,25 #177; 1,25
|
70
|
16,66
|
|
Hamraia
|
24 #177; 1
|
-
|
50
|
D'après l'analyse des résultats obtenus la
variété Hamraia s'avère riche en T.C. (24ug/ml) par
rapport à celle de Deglet Nour (20.25 ug/ml), mais cette
différence n'est pas significative.
Quant à la comparaison de nos résultats par
rapport à ceux rapportés dans la littérature nous
remarquons que les teneurs trouvées par Yahiaoui (1999) pour la
variété Deglet Nour (70ug/ml) sont largement plus
élevées que les notre (20.25 ug/ml) et celle communiquées
par Ghazi et Sahraoui (2005) (16,66 ug/ml). En revanche, ces derniers auteurs
ont trouvé une valeur très élevée en T.C. pour la
variété Hamraia (50 ug/ml) comparativement à la notre.
Cette variabilité entre les teneurs en T.C. peut
être due par l'effet de plusieurs facteurs tels que : la
sensibilité des tanins à des plusieurs voie de dégradation
(l'oxydation, la lumière...), le stade de maturité des fruits,
les conditions culturales et plusieurs d'autres facteurs.
Par ailleurs, Turrel et collaborateurs (1940) signalent que
les tanins de variété Deglet Nour de Californie atteignent leur
maximum de concentration (de l'ordre de 6% du poids frais) lorsque les dattes
sont petites et vertes et régressent graduellement à un taux de
1% au stade Routab. D'autre part, Peyron et Gay (1998) rapportent qu'au stade
Tamar, la datte perd son astringence et les tanins précipitent sous la
peau en passant de la forme soluble à la forme insoluble, cela explique
les faibles teneurs obtenus en T.C. à ce stade pour les deux
variétés étudiées. Il est à noter
également que la teneur en tanins condensés diminue
légèrement au stade Tamar par leur oxydation par voie non
enzymatique en polymère coloré par la formation de complexe
métal-polyphénols et la conversion des leuco-anthocyanes en
anthocyanes [Mathe et Parpia, 1971].
D'autre part, le brunissement enzymatique affecte le contenu
en T.C. puisqu'on considère que les (+)-catéchine et la
(-)-épicatéchine sont parmi les substrats
préférentiels de la PPO [Nicolas et al., 1994 ; Clifford,
1999]. La réaction d'oxydation se fait en présence de
l'oxygène moléculaire ; les premiers produits de la
réaction sont les quinones qui se condensent ensuite rapidement pour
former des polymères bruns ou noirs de haute masse moléculaire
[Taylor et Clydesdale, 1987].
II.1.2.3. Teneur en anthocyanes
Les résultats de la teneur en anthocyanes pour les deux
variétés de dattes sont exprimés en gramme (g)
d'anthocyanes par millilitre (ml) en se référant à une
courbe d'étalonnage (figure 20) tracée à partir du tableau
18.

Fig. 20 : Courbe d'étalonnage pour le
dosage des anthocyanes
Les valeurs de la densité optique des anthocyanes non
décolorés (tubes témoins) et décolorés par
le Bisulfite de Sodium (tubes décolorés) ainsi que leur
différence sont indiquées dans le tableau ci-dessous :
Tableau 28 : Densités optiques des
anthocyanes chez les deux variétés Deglet Nour et
Hamraia
|
Dattes
|
Tubes témoins
|
Tubes décolorés
|
Différence
|
|
Deglet Nour
|
0,0303
|
0,0142
|
0,0161
|
|
Hamraia
|
0,0296
|
0,0146
|
0,0141
|
Après les calculs effectués à partir de
la courbe d'étalonnage, les résultats de la teneur en anthocyanes
sont indiqués dans le tableau 29
Tableau 29: Teneur en anthocyanes chez les deux
variétés Deglet Nour et Hamraia
Anthocyanes (ug/ml)
Dattes
|
Nos résultats
|
Ghazi et Sahraoui (2005)
|
|
Deglet Nour
|
14,04 #177; 1,75
|
16,83
|
|
Hamraia
|
13,08 #177; 2,02
|
15,83
|
Après extrapolation des résultats de la D.O sur
la courbe d'étalonnage, la teneur en anthocyanes pour les deux
variétés Deglet Nour et Hamraia est estimée respectivement
de 14,04ug/ml et 13,08ug/ml, ces deux valeurs semblent proches et
présentent une légère différence. Quant à la
comparaison de nos résultats par rapport à ceux trouvés
par Ghazi et Sahraoui (2005) (16,83ug/ml et 15,83ug/ml respectivement pour
Deglet Nour et Hamraia) nous remarquons que le taux en anthocyanes pour nos
échantillons est légèrement faible par rapport à
ces auteurs.
Il est important de signaler que les anthocyanes, sur le plan
théorique augmentent avec la maturation des fruits, atteignant un
maximum puis diminuent. Cette évolution est étroitement
corrélée avec la nature des fruits. Par ailleurs, les
différentes réactions qui peuvent prendre place dans la
diminution des anthocyanes sont :
· Les réactions de condensation des anthocyanes
et/ou flavanols avec d'autres molécules inférieures comme l'acide
puracique, venyl phénole ou l'acide glycoxylique [Bakker et al.,
1997 ; Dos Santos et al., 1996]
· La combinaison des anthocyanes avec les tanins pour
donner des polymères qui possèdent des propriétés
et des couleurs différentes à celles des anthocyanes.
II.2. Résultats d'analyses du miel
II.2.1. Caractérisation physicochimique
II.2.1.1. La teneur en eau
L'analyse après le séchage indique que la teneur
en eau du miel analysé est de 13,5%, soit 86,5 % de matière
sèche. Ces résultats sont apparemment conformes aux normes
européennes et codex alimentarius Cependant, selon Chauvin (1968), un
miel tirant environ 14 % d'humidité peut être
considéré comme exposé à la fermentation pendant le
temps de conservation.
Donc, notre miel présente une faible teneur en eau ce
qui peut être due au :
· Mauvais conditionnement
· Mauvaise extraction
· Origine botanique
II.2.1.2. Conductivité et pH
Tableau 30 : Résultats de la mesure du pH et de
la conductivité
|
Solution du miel
|
pH
|
Conductivité (mS/cm)
|
|
Solution à 4%
|
4,38
|
0,53
|
La mesure de pH de notre échantillon de miel à
4% a donné la valeur de 4,38 donc un pH acide. Sachant que la gamme
des valeurs théoriques de pH est comprise entre 3,4 et 4,5 indique
l'origine du miel de type nectar ou de mélange avec un peu de miellat.
On pourra dire que notre miel est nectarifère et que notre
résultat est conforme aux normes internationales.
La mesure de la conductivité vient de confirmer
l'origine du miel analysé car selon le Codex Alimentarius (1998), les
miels qui présentent une conductivité inférieure à
0,8 mS/cm ont pour origine le nectar. On pourrait aussi déduire
l'importance de la conductibilité en se basant sur la couleur, plus elle
est foncée plus le miel est conducteur. De plus la conductibilité
électrique est fonction de la teneur en matières
minérales.
II.2.2. Composition chimique
II.2.2.1. Teneur en composés
phénoliques solubles totaux
Les absorbances optiques des deux concentrations de la
solution de miel à 2,5% et 10% sont indiquées dans le tableau 31.
Tableau 31 : Densités optiques des
différentes concentrations de miel
|
Concentration du miel
|
Densités optiques
|
|
2,5 %
|
0,1139
|
|
10 %
|
0,2542
|
Ensuite les valeurs de la D-O obtenues sont projetées
sur la courbe d'étalonnage tracée à partir des
différentes concentrations d'acide gallique (figure 18). Les
résultats de la teneur en C.P.S.T sont indiqués dans le tableau
32.
Tableau 32: Teneurs en C.P.S.T. pour les deux dilutions
de miel
|
Concentration du miel
|
C.P.S.T (ug/ml)
|
|
2,5 %
|
90
|
|
10 %
|
205
|
On remarque que la teneur en C.P.S.T augmente avec
l'augmentation de la concentration du miel. Si on compare les résultats
du miel à 2,5% avec ceux des dattes, on peut dire que le miel
présente une valeur importante par rapport à la
variété Deglet Nour (81,5ug/ml), par contre la
variété Hamraia nous donne une valeur plus élevée
que le miel (141,5ug/ml). En général, et sur le plan nutritionnel
il est préférable de manger une cuillère de miel à
la place d'une datte pour un apport optimum en polyphénols.
CONCLUSION

L'industrie pharmaceutique utilise encore une
forte proportion de médicaments d'origine végétale et les
chercheurs trouvent chez les plantes des molécules actives nouvelles, ou
des matières premières pour la semi synthèse. Parmi ces
molécules, les polyphénols sont probablement les composés
naturels les plus répandus dans la nature, ils sont présents dans
toutes les parties des végétaux supérieurs (racines,
tiges, feuilles, fleurs, pollens, fruits, graines et bois) et même dans
le miel. Les Polyphénols végétaux, en particulier les
flavonoïdes et les anthocyanes sont largement utilisés en
thérapeutique comme vasculoprotecteurs, anti-inflammatoires, inhibiteurs
enzymatiques, antioxydants et anti-radicalaires...
Parmi les plantes les plus utiles à
l'homme, le palmier dattier est l'un des arbres fruitiers le plus anciennement
cultivé reconnu par la taxonomie végétale comme
étant porteurs du nom Phoenix dactylifera L. Les dattes
constituent un aliment de choix dans les régions désertiques, et
ce tout au long de l'année de par sa bonne conservation et son apport
nutritionnel considérable. Ces merveilles des Oasis constituent une
source importante d'énergie, de sels minéraux et de fibres
alimentaires, ainsi que de polyphénols dont l'importance
indéniable fait des dattes une panacée.
Autre source de polyphénols, le miel,
cet aliment présent sur nos tables depuis belle lurette est issu soit du
nectar des fleurs butinées par les abeilles ouvrières, soit du
miellat.
Afin de valoriser les produits du Sud
algérien, nous nous sommes intéressés à faire le
dosage biochimique des polyphénols présents dans les dattes de
Biskra (variété Deglet Nour) et de Ouargla (variété
Hamraia) et dans le miel de la région de Bayadh. De même, pour
enrichir cette étude, quelques paramètres physico-chimiques
(poids, teneur en eau, pH et conductivité électrique) ont
été recherchés.
Les résultats obtenus ont
montré que nos échantillons analysés sont riches en
composés phénoliques. Pour les dattes, la variété
Hamraia présente un meilleur taux en polyphénols totaux
(141,5ug/ml) par rapport à celle de Deglet Nour (81,5u/ml). De
même, la teneur des tanins condensés de la variété
Hamraia est légèrement élevée (24 ug/ml)
comparativement à Deglet Nour (20,25 ug/ml). Quant à la teneur
des anthocyanes, les deux variétés présentent presque les
mêmes taux : 14,04 ug/ml pour Deglet Nour et 13,08 ug/ml pour
Hamraia.
En ce qui concerne les paramètres
physico-chimiques, le poids moyen de Deglet Nour est plus élevé
(9,44 g) par rapport à celui de la variété Hamraia (6,63
g). Pour les valeurs de pH, la variété Hamraia présente un
pH légèrement acide (5,3) par rapport à celui de Deglet
Nour (5,7). Quant à la mesure de la teneur en eau, une différence
nette (~3 fois plus élevé) est observée entre la
variété Deglet Nour (27,13 %) et celle de Hamraia (10,83 %). Ces
résultats confirment les données de la littérature qui ont
classé la variété Hamraia dans la catégorie demi
sèche.
Concernant les résultats obtenus pour
le deuxième aliment précieux le miel, la teneur en
polyphénols solubles totaux a été estimée à
90ug/ml pour la concentration de 2,5 % et 205ug/ml pour 10 %. Les analyses
physicochimiques ont montré que le miel présente une teneur en
eau égale à 13,5 % (miel fermenté), la conductivité
est de 0,53 mS/cm (miel est d'origine nectarifère) et une valeur de pH
égale à 4,38 (miel de nectar). Ces résultats sont
conformes aux normes internationales (codex alimentarius et U.
Européenne).
En général, on peut conclure
que nos deux variétés de dattes et le miel du sud algérien
sont riches en composés phénoliques et en particulier la
variété Hamraia. Cette dernière devrait être
valorisée au niveau du marché local et d'inciter les agriculteurs
à augmenter sa production et donc sa commercialisation sur tout le
territoire algérien voire à l'échelle internationale comme
Deglet Nour qui est une variété la plus prisée.

RÉFÉRENCES BIBLIOGRAPHIQUES
I. Ouvrages :
· Açouren S, 2001.
Caractérisation, évaluations de la qualité de la datte et
identification des cultivars rares de palmier de la région Ziban, revue
de l'I.N.R.A., 21-39 p.
· Alais C, Linden G, 1997. Biochimie
alimentaire. Masson, Paris, 120-125 p.
· Alidert J, Ranjeva R et Boudet M A,
1977. Organisation subcellulaire des voies de synthèses des
composés phénoliques. Physiol. Veg. 15, 279-301 p.
· Alix J et al., 1985. Contribution de
la cromatografia en capa fina al analisis del origen floral de las mieles, Vida
Apic, 15,31-33 p.
· Allipi A M, 2000. La cite des abeilles
de Bruno Corbara, Découvertes Gallimard, 1991p.
· Amiot M J, Tacchini M, Aubert S Y, olezek W.,
1995. Influence of cultivar, maturity stage, and storage condition on
phenolic composition and enzymatic browning of pear fruits. Journal of
Agricultural and Food Chemistry.
· Amrani Y, 2002. Comportement d'un
stock de la pâte de datte traitée par thermisation en
atmosphère modifié et au froid, mémoire
d'ingéniorat d'état en agronomie, Mostaganem, 16 p.
· Anonyme, 1978. Manuel d'exercice de
laboratoire. Ecole supérieur d'oenologie de Montpelier. France.
· Anonyme, 1996. Cahier de charge
concernant le mode de production biologique du miel
· Aruoma OI, Spencer JPE, Butler J et Hlliwell B,
1995. commùentary reaction of plant derived and syntitic
antioxidants whith tricloromethylperopxyl radicals. Free rad. Res. 22, 187-190
p.
· Bahorun T, 1997. substances naturelles
actives: la flore mauricienne, une source d'approvisionnement potentielle.
AMAS. Food and agricultural rsearch council. Reduit. Mauritius.
· Bakker J, Bridle P, Honda T, Kuwano H, Saito N,
Terahara N, Timberlake C F., 1997. Identification of anthocyanin
occurring in some red wines. Phytochemistry.
· Barreveld W H. FAO, 1993. Agricultural
Services Bulletin N° 101, Date Palm Products. FAO, Rome, 39p.
· Bendahou H, Hasnat N., 2005.
Contribution à l'étude de l'influence de durée de
conservation sur la qualité du miel dans la wilaya de Mascara ;
Mémoire d'ingéniorat en sciences alimentaires, centre
universitaire de Mascara. 22-28 p.
· Benharrats I M, Benazzouk S, 1999.
Extraction et identification de l'arome de datte « Deglet
Nour ». mémoire d'ingéniorat, I.N.A. (El-Harrach).
· Bennamia A, Messaoudi B, 2006.
Contribution à l'étude de la composition des dattes
« Deglet Nour » et « Ghars » dans le
pédopaysage de la cuvette de Ouargla, mémoire de diplôme
d'études supérieur en biochimie, Ouargla, 4-5-6 p.
· Bernadette et Roer Darhem, 1985. La
vie des abeilles, Nathan, Paris, 54-55 p.
· Beta T, Nam S, Dexter J E et Sapirstein H D,
2005. Phenolic content and antioxidant activity of pearled wheat and
roller-milled fractions. Cereal chem.. 390-393 p.
· Bidet D, Gaignault J, Girard P et Trotin F,
1987. Inflammation, allergie douleurs et acide arachidonique: du
jardin des Hespérides à la cascade de l'acide arachidonique: les
flavonoides. L'actualité chimique. 89-97 p.
· Bieri, K, et al., 1995. centre siusse de
recherche apicoles, station de recherche laitières, liebefeld,
ch-3003."miel : définition et directives pour analyse et
l'appréciation ".
· Biri. M., 1986. L'élevage moderne
des abeilles. Manuel pratique. Ed DEVECCHI.S.A. (paris), 91 p.
· Bogdanov S, 1984. Characterisation of
antibacterial substances in honey. Lebensm. Wiss. Technol. 17, 74-76 p.
· Bousseta A et al., 1992.Characteristic
aroma profiles of unifloral honeys obtained with dynamic headspace GC-MS
system, J. Apic. Res. 31,96-109.
· Bravo L, 1998. plyphenols; dietary
source, metabolisme, and nutritional significance. Nutrition. 317-333p.
· Brouillard R, 1982. Anthocyanins as
food colors. Marcaris P. Academic press. New York. 1-40 p.
· Brouillard R, 1986. The flavonoids
Advances. In: research since 1993. Harborne J B, Chapman and Hall, London.
525-538 p.
· Brouillard R, Délaporte B,
1997. J.Am. Chem. Soc. 1999. 8461-8468 p.
· Brownlee H, Hedjer J et Scott I, 1992.
Effects of a rangs of procianidins on the cocoa pathogen Crinipallis
perniciosa. Phys. Mol. Plant pathol. 40, 227-232 p.
· Bruneton J, 1993. Pharmacognosie et
phytochimie plantes médicinales. Paris, France: Lavoisier. 278-279p.
· Bruneton J, 1999. Pharmacognosie,
phytochimie, plantes médicinales, 3ème éd.
Lavoisier, Paris. 1120 p.
· Buckley RC, 1987. Interactions
involving plants, homoptera, and ants. Annual Review of Ecology and Systematics
8: 111-135 p.
· Clifford M N., 1999. Chlorogenic acids
and other cinnamates-nature, occurrence and dietary burden. J Sci. Food
Agric.
· Codex norme pour le miel Codex Stan
1981. Norme adoptée en 1981. Révisions en 1987 et 2001,
www.codexalimentarius.net/download/standards/310/cxs_012f.pdf
consulter le 01/05/2008.
· Das H, Wong J et Lien E, 1994.
Carcinogenicity andcancer prévening acntivitis of flavonoides: A
structure-system-activity-relationship (SSAR) analysis.
· De Oliveira M, Sampaio M, Simon F, Gibert B et
Mors W, 1972. Antitumor activity of condensed flavenols. An.Acad.
Brazil. 41-44 p.
· Dean F M, 1963. Naturall occuring
Oxygen Ring Compounds, Buttrworths. Londres.
· Didry N, Pinkas M et Torck M, 1982. La
composition chimique et l'activité antibactérienne des feuilles
de diverses espèces de gaindelia. PI med. Phytother. XVI. 7-15
p.
· Dixon A F G, 1985. Aphid ecology.
Blackie and Son limited, New York. 157 p.
· Djerbi M, 1994. Précis de
phéniculture, F.A.O, Rome, 191 p.
· Donadieu Yves., 1978. Les
thérapeutiques naturelles in le miel. Ed Maloine S.A. Paris, 12-16 p.
· Dos-Santos P J, Brillouet J M, Cheynier V,
Moutounet M., 1996. Detection and parttial characterisation of new
anthocyanin-derived pigments in wine. J. Sci. food Agric.
· Dowson et Aten, 1963. Composition et
maturation, récolte et conditionnement des dattes, collection F.A.O.
Rome, 397 p.
· Etienne E, 2002. Introduction à
la transformation industrielle des fruits, Tec Lavoisier, Paris, New York,
147-149-150-151 p.
· Fleuriet A et Macheix J J, 1977. effet
des blésures sur les composés phénoliques des fruits de
tomate "cerises" (Lycopersicon esculentum var cerasiforme)
phys. Veg. 15. 239-250 p.
· Frankel E N. Water house A L, Teissedre P L,
1995. Agric. Food. Chem., 43,221-235 p.
· Frenot M et Vering E, 1997. Biochimie
des aliments, diététique des sujets bien portent, Dion, 282 p.
· Gàbor M, Cody V, Middleton E J,
Harborne J B, Beretz A, Liss A R, 1988. Plants Flavonoids in biology
and Medecine II; Biochemical, Cellular and Medecinal properties. New York, 1-15
p.
· Ghazi F et Teffahi M, 2007. Mis en
valeur et étude de l'utilité technologique de la fermentation de
dattes « cas de la variété Hmira »,
mémoire d'ingéniorat d'état en sciences alimentaires,
Mascara, 3-6-9-21p.
· Ghazi F et Sahraoui S., 2005.
Evolution des composés phénoliques et des
caroténoïdes totaux au cours de la maturation de deux
variétés de datte communes Tantboucht et Hamraia, mémoire
d'ingéniorat en agronomie, El Harrach.
· Ghisalberti E L, 1979. Propolis, a
review. Bee World, 59-84 p.
·
GNU Free Documentation License., 19 April 2007.
· Gonnet Michel., 1982. Le miel
(composition, propriétés, conservation). Ed Echauffour.
Argentan, Ornes, 9-12 p.
· Gonnet, M., 1986 l'analyse du miel.
20p.
· Guignard J et al, 2001. Botanique
systématique moléculaire, 2ème édition,
Paris, 122 p.
· Guingard J, 1996. Biochimie
végétale. Lavoisier, Paris, 175-192 p.
· Haddad L, 2000. Quelques
données sur la bio-écologie d'Ectomyelois ceratoniae
dans les régions de Touggourt et de Ouargla, en vue d'une
éventuelle lutte contre ce prédateur, mémoire
d'ingéniorat en agronomie, I.A.S., Ouargla, 62 p.
· Hadi M, 2004. La quercétine et
ces dérivés: molécules à caractères
pro-oxydant ou capteurs de radicaux libres; études et applications
thérapeutiques. Thèse présentée en vue de
l'obtention du grade du docteur en sciences de l'université Louis
Pasteur domaine: Pharmacochimie. 155 p.
· Hadjari M et Kadi Hanifi M, 2005.
La mise en oeuvre de la fermentation de jus de datte étude
cinétique et biochimique, mémoire d'ingéniorat en sciences
alimentaire, Mascara, 21-22-23 p.
· Hadou I, 2005. Etude comparative entre
quinze variétés de dattes et leur taux d'infestation par
Ectomyemlois ceratoniae Zeller
(Lepidoptera- Pyralidae) dans la région de Ouargla,
mémoire d'ingéniort en agronomie saharienne, Ouargla. 10-13-14
p.
· Hannachi S, Khitri D, Benkhalifa A, et Brac de
la perrière R A, 1998. Inventaire variétal de la
palmeraie algérienne. U.S.T.H.B., U.R.Z.A.
· Harbone J B, 1967. Comparative
biochimitry of the flavonoides. Academic press. New York, 1-130 p.
· Harbone J B, Grayer R J, 1988. The
flavonoids, Advances. In: research since 1980. Harboirne J B, Chapman and Hall,
London, 1-20 p.
· Harris R S, Karmas E, Editors, 1977.
Nutritional evaluation of food processing , The Avi Publishing company
Inc., Westport, CT.
· Haslam E, 1998. Preatical
polyphénolics: from structure to molecular recognition and
physiologicals action, Cambridge University press, Combridge.
· Häusler M, Montag A, 1990.
Minorbestandteile des Honigs mit Aromarelevanz, Dtsch. Lebensm.-Rundsch.
86,171-174 p.
· Hayase F et Kato M, 1984. Antioxydant
compounds of sweet potatoes. J. Nutri. Sci. vetaminol. 30, 37-46 p.
· Heller W., 1990. Abrégé
de physiologie végétale. Tome2. Déveleppement. Masson.
Paris.
· Hemingway R W, 1992. Structural
variation in proanthocyanidins and their derivatives. In : Lpant polyphenols:
synthesis, properties, significande. Hemingway R W, Laks P. E. New York.
· Horn H, und Lüllmann, 1992. Das
grosse Honigbuch. Verlag Ehrenwirth. München.
· Joslyn M. A., 1970. A serie of
monographie. Food. Sci. techn. Second Edition Board.
· Kerrar N, 1994. Contribution à
la connaissance physico-chimique des miels Algériens, mémoire de
fin d'études, I.N.F.S.A de Mostaganem, 12,15-21 p.
· Kharoubi H, 1995. Essai comparatif de
l'effet de deux méthodes de ciselage, avec trois dattes de deux
cultivars « Deglet Nour » et « Ghars »,
mémoire d'ingéniorat en agronomie, I.N.F.S.A.S. Ouargla, 103
p.
· Kreofsky T, Scalager G, Vuk-Pavlovic Z, Abraham
R et Rohrabach M, 1992.
Condensed tannins promotes the release of
arachidonic acid from rabbit residents alveolar macrophages. Am J. Resir. Cell.
Mol. Boil. 7. 172-181 p.
· Lakhdari F, 1980. Influence de
l'irrigation sur l'évolution de la salinité dans le sol,
mémoire d'ingéniorat en agronomie, INA, Alger, 15 p.
· Lebham, 2005. Thèse au
Laboratoire d'Ecophysiologie et de Biotechnologie des Halophytes et des Algues
au sein de l'Institut Universitaire Européen de la Mer
(IUEM)-Université de Bretagne Occidentale (UBO).
· Louveaux, J. Pessonet, P., 1984. Edition
INRA.Paris pallimisation et production végétales. 565-566 p.
· Lugasi A, Hovari J, Sagi, K V et Biro L,
2003. The role of antioxidant phytonutrients in the prevention of
diseases. Acta Biologica Szegedientsis.1-4, 119-125 p.
· Maatalah S, 1970. Contribution
à la valorisation de la datte algérienne, mémoire
d'ingéniorat en agronomie, I.N.A., Alger, 120 p.
· Mabry T et Ulubelen A, 1980. Chemistry
and utilization of phenilpropanoides including flavonoids, coumarins and
lignans. J. Agric. Food Chem. 28, 188-196 p.
· Macheix J J, Fleuret A., Billot J.,
1990. Fruit phenolics. CRC Press, Inc., Boca. Raton.
· Mansouri A., Guendez E., Kokkalouc E., et
Panagiotis K., 2005. Phenolic profile and antioxidant activity of the
Algerian ripe date palm pruit (Phoenix dactylifera). Food Chemistry .89,
411-420.
· Marfak A, 2003. Radiolyse gamma des
flavonoides, Etude de leur reactive avec les radicaux issus des alcools :
formation de depsides. Thèse pour obtenir le grade de docteur de
l'université de Limoges. Spécialité : biphysique. 187
p.
· Markham k R, 1982. Techniques of
flavonoides identification. Academic press, London, 36-53 p.
· Masquelier J, Dumon M et Dumas J,
1979. Stabilisation des collagènes par des oligomères
procyanidoliques. Acta thérapeutique. 1, 101-104 p.
· Mathe A G., Parpia H., 1971. Food
browning as polyphenol reaction advances. Food research (U.S.A).
· Mclure J W, 1979. Biochemistry of
plant phenolics. Swain T, Harbone J B. Van Sumere C F, plenum press, New York,
525 p.
· Meddleton E, Kardasnami J C, 1993. The
flavonoids Advances. In: research since 1986. J B Harborne, Chapman and Hall,
London, 617-652 p.
· Medic Sanic M, jasprica I, Smolcic Bubalo A et
Mornar A. 2004. Optimization of chromatographic conditions in thin
layer chromatography of flavonoides and phenolic acids. Croatica chemica acta.
361-366 p.
· Meftah F, Saadi A., 1992. Etude de la
composition chimique de la datte algérienne au cours de la maturation et
du stockage. Mémoire d'ingéniorat., I.N.A. (El-Harrach).
· Merlin J C, Statoua A, Brouillard R,
1985. Phytochemistry. 24, 1575-1581 p.
· Misirli A, Kuden A, Demir G et Gulcan R,
2001. Determination of phenolic compounds in some almond hydrids
varying in resistance to Pceudomonas amygdale. 71-86 p.
· Morse R, Lisk DJ, 1980. Elemental
analysis of honeys from several nations, Am. Bee J.Nr. 7, 522-523 p.
· Munier P, 1973. Le palmier dattier,
Maison neuve et larose, Paris. 25-28-31-32-40-48-141-142-221-367p.
· Nacer Chergui S, 1994. Influence
d'un biotope sur le rendement et la qualité d'un miel, mémoire de
fin d'études, université de Mostaganem, 14-15,23-25 p.
· Nicolas J.J., Richrd-Forget F.C., Goupy P.M.,
Amiot M.J., Aubert S.y., 1994. Enzymatic browning reaction in apple
products. Crit. Rev. food Sci. Nutr.
· Okamura H, Mimura A, Yakou Y, Niwano M et
Takahara Y, 1993. Antioxydant activity of tannins and flavonoids in
eucaliptus rostarata. Phytochimie. 33, 557-561 p.
· Okuda T, Kimura Y, Yoshida T, Hatano T, Okuda H
et Arichi S, 1983. Studies on the activitis of tannins and related
compounds from medicinal and drugs. Inihibitory effects of lipid peroxydation
in mitochandria and microsome of lever. Chem. Pharm. Bull. 31, 1625-1631 p.
· Peronny S, 2005. La perception
gustative et la consummation des tannins chez le Maki (Lemure Catta), these de
doctorat en éco-ethologie, Muséum national d'histoire naturelle,
France. 22 p.
· Peyron G, 2000. Cultiver le palmier
dattier, G.R.I.D.A.O., Montpellier, 109-129 p.
· Peyron G., Gay F., 1988. Contribution
à l'evaluation du patrimoine génétique Egyptien.
Phénologie du palmier dattier (Phoenix dactylifera L). rapport
de Mission Gridao, Dsa-Cirad.
· Phillippe Jean Marie.,
1991. La pollinisation des abeilles. Ed edisud la calade.
13090 Aix en .Provence.
· Phillippe Jean Marie., 1999. Le guide de
l'apiculture. Ed Edisud la calade.13090 Aix en. Provence, 209-228 p.
· Pilet.C, Bouroon, B. Toma,N.Marchal,C.
Balbaster,J.M.Person., 1987. Bactériologie médicale et
vétérinaire .Systématique bactérienne. Ed Dion
éditeur .Paris. 205p.
· Porter L J, Hirtstich L N, Change B J,
1986. The convertion of procianidins and prodlephinidins to cyanidines
and delphenidins, phytochemitry. 25, 223-230 p.
· Pourtallier . J, talercio.Y., 1983. Les
caractéristiques physico-chimiques des miels en fonction de leur origine
florale.
· Psotova J, Lasovsky J et Vicar J,
2003. Metal chelating properties, electrochemical behavior, scavenging
and cytoprotective activities of six natural phenolic. Biomed. Papers 174-153
p.
· Querzi et Zuttum., 1997.Grand usuel
Larousse dictionnaire encyclopédique. Ed Larousse Bourdas.
· Quinten M, 1996. Diversité et
structure génétique des populations algérienne de
Fusaium oxyporum agent de la fusariose
vasculaire (bayoudh) du palmier dattier, thèse de
doctorat, El Harrach, 52 p.
· Rabah N et Merabbi N, 2006. Essai de
préparation de boissons gazeuses à base de sirop de datte,
mémoire d'ingéniorat d'état en biologie option CQA, Sidi
bel Abbes, 21p.
· Ravazzi. G., 1996. Cours d'apiculture. Ed
devacchi .S.a. Paris, 92p.
· Ravrn H, Andary C, Kovacs G et Molgaard P,
1984. cafféic acid esters as in vitro inhibitors of plant
pathogenic bacteria and fungi. Biochimie. Syst. Ecol. 17, 175-184 p.
· Rees S et Harbone G, 1985. The role of
sesquiterpene lactones and phenolics in the chemical defence of the chicory
plant. Phitochimie. 24, 2225-2231 p.
· Repertoire general des aliments», REGAL .,
1995. »Fruits Exotiques» (1993) ;
« Compositon des aliments », Sousi, Fachmann et
Kraut ; « The composition of Food », Mc Cance et
Widdoson.
· Reynes M, Bouabidi H, Piombo G, Risterucci A
M., 1994. Caractérisation des principales
variétés de dattes cultivées dans la région des
Djerid en Tunisie. Fruit, 49,289-298 p.
· Ribereau G P, 1964. Les
composés phénoliques du raisin et du vin. Ann. Physiol. Veg.,
I.N.R.A.
· Ribereau G P, 1968. Les
composés phénoliques des végétaux. Dunod, Paris,
254 p.
· Ribereau G P, J Peynaud E, Sudraud P,
1976. Traité d'oenologie, science et technique du vin. Dunod.
Paris.
· Riedacker A et al., 1990. Physiologie
des arbres et arbustes en zone aride, John Libbey, Eurotext, 323-324-325-327
p.
· Rygg G L., et al, 1953. Factors
affecting the spoilage of dates at room temperature. Annu, Rep, Date Growers'
ins., 30 ; 10-14p.
· Salunkhe, DK, 1990. Dietary tannins:
consequences and remedies. Boca Raton, Florida: CRC press.
· Sawaya W N, Khatchadourian H, Khalil J.,
1982. Growth and chemical characterization of three Saudi date
cultivars at various stages of development. Can.inst. Food Sci. Technol., 16,
87-91 p.
· Scalbert A, Williamson G, 2000.
Dietary intake and bioavailability of polyphénols J Nutr. 130, 2073-2085
p.
· Singleton V L, Timberlake C F, Lea A G H,
1978. The phenolic cinnamates of grapes and wine, Journal of Sciences
and Food Agriculture. 29, 403-410 p.
· Stavric B et Matula T, 1992.
Flavonoids in food. Their significance for nutrition and health. 274-294 p.
· Sun G, Khtan B, Huang S, Whiteman M et Zhu Y,
2002. Effects of naturals products on ischemic heart diseases and
cardiovascular system. Acta pharmaco. 23, 1142-1151 p.
· Talpay B, 1985. Spezifikationen
für Trachtenhonige. Deutsch. Lebensm.-Rundsch. 81,148-151 p.
· Tan K S, Tosont T, Masuda Y, Kamisaca S,
1992. Involvment of cell Wall-bound diferulic acid in light-indused
decrease in growth Rat and cell wall extensibility of Oryza
coleoptles. Plant cell physiol. 30, 103-108 p.
· Taylor A.J., Clydesdale F.M., 1987.
Potential of oxidized phenolic as food colorants. Food Chem.
· Toutain G, 1979. Eléments
d'agronomie saharienne et la recherche au développement, Marrakech,
Maroc, 277 p.
· Turrel F.M., Sinclair W.B., Bliss D.E.,
1940. Structural and chernical factors in relation to fungus spoitage
of dates. Date growers Inst. Rept.
· Union Européenne: Directive
74/409/CEE; J.O. CE L221/14 (12.8.1974).
· Vanhaelen M, Vanhaelen Fastre R, 1979.
Propolis - II. Identification par chromatographies haute-performance (liquide,
gaz-liquide et sur couches minces) des constituants. Bioautographie des
chromatogrammes des composés anfibactériens. J. Pharm. Boig.
34,317-328 p.
· Vergé S, Soulet S, Lacan F, Mas T,
Arnaudinaud V, Nay B, 1999. les plyphenols du vin: de la chimie pour
la vie. Bull. Soc. Pharm. Bordeaux. 138, 75-90 p.
· Villanueva V R et al., 1970. Les
flavonoïdes de la propolis. Isolement d'une nouvelle substance
bactériostatique: la pinocembrine (dihydroxy-5, 7 flavanone). Ann. tnst
Pasteur. 18,84-87 p.
· Völkl W et al., 1999. Ant-aphid
mutualisms: the impact of honeydew production and honeydew sugar composition on
ant preferences, Oecologia 118,483-491 p.
· Von Der Ohe et al., 1991. Prolin als
Kriterium der Reife des Honigs, Dtsch. Lebensm.-Rundsch, 87,383-386 p.
· White, 1980. Report on the analysis of
hony, ASSOC.OFF agric, Chemists 34-48 p.
· Yahiaoui K, 1999.
Caractérisation physico-chimique et évolution du brunissement de
la datte « D-N » au cours de la maturation. Thèse
Mag. I.N.A. El-Harrach.
· Yao I et S Akimoto, 2001. Ant
attendance changes the sugar composition of the honeydew of the drepanosiphid
aphid Tuberculatus quercicola. Oecologia, 36-43 p.
· Ziouti A, el Madafar C, Boustani E,
1998. Rôle des composés phénoliques du palmier
dattier (Phoenix dactylifera L) dans sa défense contre le
bayoud (Fusarium oxysporum F.sp. albedinis). Université Cadi
Ayad, Maroc.
II. Biblionet
(consultés le 23.04.2008) :
· @1:
http://www.perigueux.u-bordeaux4.fr/iut/geniebio/sapik/produit/miel.php
· @2:
http://www.beekeeping.com/abeille-de-france/articles/raconte-moi.htm#top
· @3 :
http://www.bag-anw.admin.ch/SLMB_Online_PDF/MSDA/Version%20F/23A_Miel.pdf
· @4 :
http://www.docteur-abeille.com
· @5:
http://www.fr.sgs.com/fr/polyphenols_oct_04_y.gervaise.pdf
· @6:
http://www.labo-nutrinov.com/data/files/BIBFILE_FILE_KTHGozj.pdf
· @7:
http://www.inra.fr/prodinra/pinra/data/2007/07/PROD2007fc88fd2_20070703080830.pdf

ANNEXES
Annexe 1 :



Annexe 2 :
Tableau 1 : Norme concernant la qualité du
miel selon le projet CL 1998/12-S du Codex Alimentarius et selon le projet de
l`UE 96/0114 (CNS)
|
Critères de qualité
|
Projet du Codex-
|
Projet de l'UE
|
|
Teneur en eau
-Général
-Miel de bruyère, de trèfle
-Miel industriel ou miel de pâtisserie
|
£ 21 g/100g
£ 23 g/100g
£ 25 g/100g
|
£ 21 g/100g
£ 23 g/100g
£ 25 g/100g
|
|
Teneur en sucres réducteurs
-Miels qui ne sont pas mentionnés ci-dessous
-Miel de miellat ou mélanges de miel de miellat et de
nectar
-Xanthorrhoea pr.
|
65 g /100g
45 g /100g
53 g /100g
|
65 g /100g
60 g /100g
53 g /100g
|
|
Teneur en saccharose apparent
-Miels qui ne sont pas mentionnés ci-dessous
-Robini, Lavandula, Hedysarum, Trifolium, Zitrus, Medicago,
Eucalyptus cam., Eucryphia luc. Banksia menz.
-Calothamnus san., Eucalyptus scab., Banksia
gr.,Xanthorrhoea pr. Miel de miellat et mélanges de miel
de miellat et de nectar
|
£ 5 g/100g
£ 10 g/100g
£ 15 g/100g
|
£ 5 g/100g
£ 10 g/100g
-
|
|
Teneur en matières insolubles dans l`eau
-Général
-Miel pressé
|
£ 0,1 g/100g
£ 0,5 g/100g
|
£ 0,1 g/100g
£ 0,5 g/100g
|
|
Teneur en matières minérales
(cendres)
-Miel de miellat ou mélanges de miel de miellat et de
nectar, -miel de châtaignier
|
£ 0,6 g/100g
£ 1,2 g/100g
|
£ 0,6 g/100g
£ 1,2 g/100g
|
|
Acidité
|
£ 50 meq/kg
|
£ 40 meq/kg
|
|
Activité diastasique, (indice diastasique
en unités de Schade)
Après traitement et mise en pot (Codex)
Tous les miels du commerce (UE)
-Général
-Miels avec une teneur enzymatique naturellement faible
|
8
3
|
8
3
|
|
Teneur en hydroxyméthylfurfural
Après traitement et mise en pot (Codex)
Tous les miels du commerce (UE)
|
£ 60 mg/kg
|
£ 40 mg/kg
|
Tableau 2 : Teneur en sucre et conductivité
électrique: Proposition d`une nouvelle norme
|
Nouveaux critères de qualité
proposés
|
Valeur proposée
|
|
Teneur en sucre
Somme du fructose et du glucose
Miel de nectar
Miel de miellat ou mélanges de miel de miellat et de
nectar
Saccharose
Miels qui ne sont pas énumérés ci-dessous
Banksia, Zitrus, Hedysarum, Medicago, Robinia,
Rosmarinus
Lavandula
|
60 g / 100g
45 g / 100g
£ 5 g/ 100g
£ 10 g/ 100g
£ 15 g/ 100g
|
|
Conductivité électrique
-Miel de nectar à l`exception des miels
énumérés ci-dessous et des mélanges de ceux-ci;
mélanges de miel de miellat et de nectar.
-Miel de miellat et de chataîgnier, à l`exception
des miels énumérés ci-dessous et des mélanges de
ceux-ci.
Exceptions: Banksia, Erika, Eucalyptus, Eucryphia,
Leptospermum, Melaleuca, Tilia.
|
£ 0,8 mS/cm
0,8 mS/cm
|
Résumé
Les polyphénols sont des
composés très précieux, présents
spécifiquement chez les végétaux et jouent un rôle
antioxydant puissant Il existe trois grandes classes : les acides
phénols, les flavonoïdes (dont les anthocyanes) et les tanins. Vu
les vertus nutritionnelles et thérapeutiques de ces composés nous
nous sommes intéressés à déterminer leur teneur
dans deux aliments succulents très prisés en
Algérie : les dattes et le miel. Notre étude
effectuée à l'Université de Sidi-Bel-Abbès (UDL)
concerne le dosage biochimique (par la méthode colorimétrique et
spectrométrique) des polyphénols sur deux variétés
de dattes (Deglet Nour et Hamraia) et le miel (Bayadh)
récoltés dans la région sud de l'Algérie. Les
résultats obtenus se sont avérés très
intéressants : le dosage des composés phénoliques en
particulier les C.P.S.T. dans les dattes a démontré une grande
richesse de la variété Hamraia (141,5 ug/ml) par rapport à
celle de Deglet Nour (81,5 ug/ml). Quant à la teneur en tanins
condensés et en anthocyanes elle ne présente pas une grande
différence au niveau de ces deux variétés de dattes elle
est estimée respectivement à 20,25 ug/ml et 14,04 ug/ml dans la
variété Deglet Nour et à 24 ug/ml et 13,08 ug/ml pour la
variété Hamraia. Concernant la teneur en polyphénols
totaux recherchés dans le miel, elle est de 90 ug/ml pour une solution
de miel à 2,5 % et 205 ug/ml à 10%. Ces résultats sont
très encourageants et démontrent la richesse de ces deux
nutriments en composés phénoliques qui sont connus pour leur
rôle anti-radicalaire, anti-inflammatoire, anti-sénescence etc.
En conclusion, vu les teneurs
élevées en polyphénols constatées dans les deux
aliments, on pourrait exhorter la communauté scientifique
algérienne à prendre conscience des trésors de notre pays,
surtout les merveilles du Sud que sont les dattes et le miel.
Mots clés: Polyphénols, Deglet
Nour, Hamraia, Miel et Dosage biochimique.

| 


