|

REPUBLIQUE DEMOCRATIQUE DU CONGO
ENSEIGNEMENT SUPERIEUR ET
UNIVERSITAIRE
ECOLE REGIONALE DE SANTE PUBLIQUE
(ERSP)
UNIVERSITE CATHOLIQUE DE BUKAVU
U.C.B
Faculté de Médecine
Programme de
Master en Santé Publique
Orientation :
Santé Communautaire
LA CO-INFECTION PAR LE VIRUS DE
L'IMMUNODEFICIENCE
HUMAINE ET LE VIRUS DE L'HEPATITE B :
ETUDE DU PROFIL EPIDEMIOLOGIQUE ET DETERMINANTS
DANS
LE DISTRICT SANITAIRE DE BUKAVU.
Mémoire présenté et défendu en vue de
l'obtention du Diplôme de Master en Santé Publique
Par Dr LUNJWIRE MULEMANGABO Pierre Prince
Directeurs : Pr. Dr. MUNYANGA MUKUNGO Sylvain Professeur
Ordinaire
Dr. KABINDA MAOTELA Jeff
Chef des Travaux
Octobre 2011
Chap. 0. INTRODUCTION GENERALE
O.O. INTRODUCTION
La co-infection du virus immunodéficience
humaine et du virus de l'hépatite B est devenue un facteur important de
comorbidité et de mortalité chez les personnes vivant avec le VIH
(1).
L'Organisation Mondiale de la Santé estime que
2 milliards de personnes sont infectées par le virus de
l'hépatite B. Parmi eux 350 millions de personnes sont porteurs
chroniques du virus. Ces derniers présentent un important risque de
développer un jour une cirrhose ou un cancer du foie. Le risque de
carcinome hépatocellulaire chez les malades atteints de cirrhose est de
l'ordre de 15 %. Chaque année, au moins 1 million de personnes meurent
de suite de l'hépatite B ou de ses complications (2).
L'hépatite B sévit intensément
dans toute la zone intertropicale. Elle touche donc particulièrement
l'Afrique noire, l'Extrême-Orient et certaines îles du Pacifique
(2, 3).
En Afrique, le duo infectieux VIH/Hépatite B
passe généralement inaperçu. Les études montrent
que la propagation de cette co-infection est rapide alors que les moyens
diagnostics sont insuffisants (1, 2).
Bien plus, des études ciblant les
déterminants de cette co-infection restent insuffisantes.
En effet, ces deux virus partagent des modes de
transmission communs (4). Au vu du taux de prévalence
élevé de la co-infection VIH/VHB en Afrique (1, 2), nous pouvons
en déduire que le taux de l'infection à hépatite B (et
VHC) est élevé au sein de la population des PVVIH en RD Congo.
Les rares études faites à ce sujet méritent d'être
complétées par des études plus larges.
Dans les pays industrialisés, depuis l'emploi
d'associations antirétrovirales puissantes (HAART) dans le traitement de
l'infection à VIH, la durée de vie des patients s'est
allongée. La morbidité et la mortalité liées au VHB
deviennent dès lors des facteurs essentiels à prendre en compte
dans la prise en charge des PVVIH (5). L'infection à VIH aggrave le
pronostic de la maladie hépatique liée au VHB (5, 6).
L'avènement des trithérapies
antirétrovirales hautement actives (HAART) a notablement
révolutionné la prise en charge de l'infection VIH. Les patients
coinfectés VIH-VHB ne meurent plus directement des complications de
l'infection à VIH mais sont plutôt rattrapés par la
pathologie liée au VHB et au VHC : l'atteinte hépatique chronique
par le VHB et le cancer du foie sont devenus une des préoccupations
majeures des équipes de soins car elle est responsable d'une part
importante de la morbidité et mortalité de ces patients (1). Dans
les pays industrialisés l'évolution des traitements actifs sur le
VHB a été marquée par l'apparition des molécules
antirétrovirales actives à la fois contre le VIH et contre le VHB
(1).
En RD Congo et particulièrement au Sud-Kivu, la
tendance de cette comorbidité n'est pas clairement établie et la
problématique de l'infection par l'hépatite B et C chez les
personnes séropositives au VIH demeure un sujet pour lequel des
réponses méritent d'être données.
En effet, la faible connaissance objective sur la
situation réelle de la prévalence et de l'incidence de cette
comorbidité dans notre pays ; le manque de données sur ses
déterminants et le manque d'interventions thérapeutiques et
prophylactiques adéquates dans le cadre de la prise en charge de cette
co-infection restent une préoccupation majeure de santé publique
en RD Congo.
Ces questions de santé publique qui restent
sans réponse pour la RD Congo le sont aussi pour le Sud-Kivu en
général et le district sanitaire de Bukavu en
particulier.
Notre étude va tenter d'apporter une
réponse à cette problématique en ciblant
particulièrement l'épidémiologie et les
déterminants de la co-infection VIH/VHB dans le district sanitaire de
Bukavu.
0.1 REVUE DE LA LITTERATURE
Les infections sexuellement transmissibles (IST)
demeurent un problème majeur de santé publique en Afrique (1, 2).
Elles sont exacerbées par l'épidémie du VIH. Elles sont la
majeure cause des maladies aigues, de l'infertilité, de la
chronicité et de décès (2).
Les IST sont aussi la cause des sévères
perturbations psychologiques. Le VHB, le VIH et le treponema pallidum sont
parmi les plus importantes causes d'IST dans le monde (7). Elles peuvent
majorer la cause de risque de contamination par le VIH (1, 2).
L'OMS estime que 350 millions d'épisodes
curables d'IST sont rapportés chaque année dans le
monde.
Cependant la prévention et le traitement des
IST peuvent réduire le risque de VIH (7). Chaque année, environ
400 millions de porteurs chroniques du virus VHB sont rapportés par
l'OMS. Au plan mondial, le taux d'infection est plus important chez les hommes
que chez les femmes, chez les enfants que chez les adultes, dans les
populations urbaines que dans les populations rurales.
Près de 5% de la population mondiale est
infectée de façon chronique avec le VHB (2). Parmi les individus
infectés par le VIH, cette prévalence est 10 fois plus
élevée (8, 9)
Il est connu que la prévalence de l'infection
à hépatite B est faible en Europe par rapport à l'Afrique.
En Belgique, un peu moins de 1% de la population est porteur chronique, et 6
à 7% de la population a été en contact avec le virus.
L'hépatite B, est en Belgique, la première maladie sexuellement
transmissible.
En France, l'Institut de veille sanitaire donne des
informations sur le nombre d'hépatites B aigues survenues en France
chaque année (1). Dans son bulletin épidémiologique, il
estime que le nombre des nouvelles infections est d'environ 500 infections par
an, ceci étant le chiffre minimum. Ces cas étaient pour la
plupart symptomatiques et les facteurs de risque le plus souvent
identifiés étaient sexuels (partenaires multiples, relations
homosexuelles, partenaire porteur du VHB), ou plus rarement un usage de
drogues, des soins invasifs, une exposition familiale. A noter qu'aucun facteur
de risque n'a été identifié
dans 30% des cas. En France toujours, Il y a trois
fois plus d'hommes atteints que de femmes. Ce chiffre de 500 cas est plus
faible que ce que l'on attendait, et témoigne de l'efficacité de
la vaccination contre l'Hépatite B. En effet, les jeunes adultes de
moins de trente ans, tranche d'âge très largement vaccinée
entre 1994 et 1998, sont peu représentés dans ces nouvelles
infections. Le bulletin épidémiologique affirme que plus de la
moitié de ces cas auraient pu être évités si les
recommandations vaccinales avaient été respectées, et si
le dépistage dans l'entourage d'un cas connu était
renforcé. À la différence du nombre d'hépatites B
aiguë, le passage à la chronicité du VHB chez les personnes
résidant en France est plus important que prévu.
En Afrique par contre, la prévalence est
élevée (2). Dans une étude faite en Côte d'Ivoire
sur le diagnostic de VHB par la polymerase chain reaction (PCR) (ADN) la
co-infection VIH/hépatite était plus fréquente dans
l'ordre de 26,7
% chez les femmes enceintes VIH positives
comparées aux femmes enceintes séronégatives
(10).
La transmission horizontale, très
fréquente chez les enfants et les adolescents, serait responsable de la
majorité des infections en Afrique et au Moyen-Orient. En revanche, la
transmission périnatale est beaucoup plus répandue en
Asie.
Au Malawi où la prévalence du VIH est de
18% en milieu rural et de 26% en milieu urbain auprès des femmes
enceintes, on note une prévalence élevée de l'infection
à VHB traduisant ainsi de futurs taux élevés des troubles
liés aux hépatites chroniques incluant la cirrhose et le
carcinome hépatocellulaire chez les PVVIH (11).
En Afrique du Sud, plus de 80% de patients
infectés par le VIH ont des marqueurs sérologiques de la
présence du passage du VHB. Globalement, plus de 10% de PVVIH
présentent une infection chronique de VHB (12).
Tous comptes faits, la co-infection
VIH/hépatite pose un problème de santé publique en Afrique
(2). Dans la partie noire de l'Afrique (sub-saharienne) où la
majorité de gens sont beaucoup plus longtemps exposés au VHB
avant d'être exposés au VIH, la prévalence de l'infection
à hépatite chronique apparaît
d'autant plus élevée auprès des
PVVIH au stade SIDA que chez celles qui sont asymptomatiques (1, 2,
13).
En effet il est rapporté une fréquence
plus élevée de positivité de HBsAg chez les patients VIH
asymptomatiques par rapport aux patients qui présentent les
symptômes du SIDA (12).
Au Mali, les chiffres de la co-infection VIH/VHB sont
proches de ceux d'autres pays africains. Dao S., Ba A. et al.,
présentent le taux de cette comorbidité à 21,5%, le taux
de VIH-VHC à 8,3% et celui de la positivité aux trois marqueurs
à 1,2% (11).
Cette situation est particulièrement
rapportée chez les hommes âgés de 18 à 30 ans
à Bamako. C'est sur base de cette triple infection que la recherche
systématique des marqueurs biologiques des hépatites B et C est
désormais recommandée dans la prise en charge des PVVIH/SIDA au
Mali (13).
Partout en Afrique, la transmission du virus est
classiquement parentérale à la faveur de transfusion de sang ou
de plasma contaminé, d'injection, des gestes chirurgicaux ou
traditionnels (les polytransfusés, les hémodialysés, les
toxicomanes intraveineux, le personnel médical et paramédical
surtout dans les unités d'hémodialyse et les laboratoires
d'analyse, lors de la circoncision et lors des scarifications qui sont faites
sans asepsie).
En Afrique, le rôle de la transmission sexuelle
du VIH et de l'hépatite B est connu chez l'adulte. Cette transmission
qui fait de l'infection à VHB une IST est cependant limitée dans
les zones d'hyper endémie où l'infection survient le plus souvent
dans l'enfance, mais est très importante chez les touristes sexuels ; ce
qui justifie la vaccination préventive chez ces derniers.
Dans la transmission parentale la virémie est
importante (jusqu'à > 100 particules infectieuses par ml de
sérum) et prolongée. Cette forte virémie explique la forte
contagiosité et en fait le mode de transmission essentiel (outre les
polytransfusés, les hémodialysés, les toxicomanes
intraveineux). Le personnel médical et paramédical surtout dans
les unités d'hémodialyse et les laboratoires d'analyse est
particulièrement exposé. Il faut signaler que l'Hépatite B
est une maladie professionnelle chez les personnels soignant et la vaccination
anti VHB exigée pour cette population (2).
Les mères porteuses chroniques d'HBsAg (surtout
lorsqu'elles possèdent HBeAg) peuvent contaminer leurs enfants lors de
l'accouchement et au début de la vie, voire in utero (1,
14).
Pour les enfants, le risque atteint 90% s'ils naissent
d'une mère HBe ag+ et HBs ag +. Il est de 20% si la mère a
déjà éliminé l'HBe ag et est uniquement HBs ag +.
Les enfants contaminés à la naissance développeront une
forme chronique à 90% tandis que si la contamination a eu lieu à
l'adolescence ou à l'âge adulte, 90% des hépatites B
évoluent sur un mode aigu, et 10% passent à la chronicité
(14).
Cette chronicité de l'hépatite B se
joint à celle du VIH chez les PVVIH. En effet, la longue
évolution de la forme chronique explique l'immense réservoir
humain pour le virus de l'hépatite B.
On sait aussi que le portage chronique de l'Ag HBS
pendant une période supérieure à 6 mois peut survenir
après une hépatite aiguë ou une forme asymptomatique. Ceci
est particulier chez les sujets immunodéprimés. En cas de portage
chronique asymptomatique de l'antigène HBs, une réactivation de
l'hépatite peut survenir chez les sujets immunodéprimés.
En plus, chez les sujets présentant une immunodépression
avancée, la réapparition de l'Ag HBs a été
décrite occasionnellement chez des sujets Ac anti-HBs positif ou chez
des sujets Ag HBs négatif présentant des Ac anti-HBs
isolés (2).
Chez l'immunodéprimé présentant
la forme évolutive, le pronostic est réservé du fait des
complications de suite des épisodes fréquentes de
réactivation de l'Hépatite chronique.
Dans la cirrhose post-hépatique, plusieurs
facteurs sont reconnus comme facteurs de risque de progression vers la
cirrhose. Parmi ces facteurs figurent la co-infection avec le VIH, le virus
Delta et le VHC. Il est donc important de détecter précocement
une réactivation du VHB particulièrement chez les
immunodéprimés (2) et de rechercher les autres
hépatites.
Du fait d'une meilleure prise en charge des infections
opportunistes (I.O), l'infection par le VIH est devenue une infection «
Chronique ». Cette chronicité favorise l'allongement de la
durée de vie des PVVIH. Elle est à l'origine de la modification
de l'histoire naturelle de l'infection par le VHB qui a maintenant le temps de
se développer chez les patients VIH (1, 2,15, 16).
Il est aussi actuellement connu que la manifestation
clinique de l'infection aigue par le VHB chez les patients infectés par
le VIH n'est pas différente de celle décrite chez les patients
non infectés par le VIH. Ce qui est particulier c'est le passage
à la chronicité qui apparaît plus fréquemment chez
les patients positifs au VIH que chez les patients VIH négatifs.
Près de 20% des patients VIH positifs co-infectés par le VHB et
faisant une hépatite virale aiguë B deviennent porteurs chroniques
de l'antigène HBs et de l'antigène HBc. Dans la population non
VIH ce chiffre est de l'ordre de seulement 5% (17).
La corrélation entre le passage à la
chronicité et le taux de LT CD4 est établie. En effet, une
étude effectuée en Ouganda montre que le passage à la
chronicité pour l'hépatite B chez les PVVIH est lié au
taux de CD 4. La chronicité semble arriver chez les PVVIH d'autant plus
fréquemment que le taux de CD4 est bas. (17).
Le lien avec la mortalité chez les
co-infectés a aussi été établi. Des études
plus récentes ont rapporté une incidence plus
élevée de la cirrhose et de la mortalité chez les patients
co-infectés VIH-VHB par rapport aux sujets mono-infectés par le
VIH mais également par le VHB seul (17, 18).
Les facteurs de risque de l'hépatite B chez les
PVVIH font l'objet des recherches et les résultats sont parlants: Le
risque de co-infection par le VIH /VHB est fonction de l'âge auquel le
patient est exposé au virus. Aux USA et en Europe Occidentale,
l'exposition à l'hépatite B est plus fréquente à
l'adolescence et chez l'adulte jeune (5, 6).
On distingue donc schématiquement trois zones
endémiques de l'hépatite B. La Chine, l'Asie du Sud-est, Afrique
subsaharienne où 70-95% des sujets ont des Ac Anti-HBs et où
8-15% sont porteurs chroniques d'Ag HBs (2).
Un autre phénomène important qui est
apparu dans la co-infection VIH/VHB peut être décrit comme une
hépatite B, l'IRIS (Syndrome inflammatoire de reconstitution
immunitaire). En effet, la restauration immunitaire qui est occasionnée
par l'initiation du traitement ARV hautement actif favoriserait le passage de
la phase de tolérance de l'infection à hépatite B qui se
caractérise parfois par un contrôle complet de la
réplication du VHB. De l'autre côté, et c'est ce qui est
fréquent, le HAART favoriserait l'exacerbation de l'hépatite
chronique avec progression rapide des lésions hépatiques
(18).
Cependant, l'intérêt des ARV n'est plus
à démontrer dans le traitement de la co-infection VIH/VHB. Une
amélioration des lésions hépatiques et une
indétectabilité de la charge virale (CV) VHB ont
été observées sous ARV. L'Emtricitabine, le Tenofovir et
la Lamivudine (en association avec d'autres ARV habituels de première
ligne) sont connus comme étant actifs à la fois sur le VIH et le
VHB (1, 2, 18, 19, 20).
Il faut signaler que l'objectif thérapeutique
dans le cas de la co-infection VIHVHB est d'obtenir au minimum une suspension
de la réplication virale VHB, une régression de la fibrose
hépatique et plus rarement, une séroconversion dans le
système HBc (1, 18).
La prophylaxie contre l'infection à
hépatite B chez les PVVIH est un facteur important de la
prévention. La vaccination est surtout disponible dans les pays
développés. Le vaccin est constitué d'antigènes
recombinant, et donne lieu à l'apparition d'anti HBs. Administré
en bas âge, en trois doses (0-1-6 ou 12 mois), il suscite une
réponse chez plus de 95% des enfants. En cas de contact chez un sujet
non vacciné (nouveau né de mère porteuse, piqûre par
du matériel infecté,...), on administre à la fois le
vaccin et des gammaglobulines. Chez l'adulte, le préservatif doit
être utilisé en cas de contact sexuel avec un sujet porteur
chronique, tant qu'une vaccination efficace n'aura pas été
effectuée (2).
Le diagnostic de l'hépatite B est
facilité chez les PVVIH. Il y a la présence de protéines
virales antigéniques dans le sérum pendant la phase aiguë ou
chez le porteur chronique: les antigènes e (HBe ag) et s (HBs ag). Un
troisième antigène, HBc, est uniquement retrouvé dans le
foie. Ces trois antigènes donnent naissance à des anticorps. Les
anti HBc sont présents dès le début de la maladie et ne
signent donc pas la guérison. Ils sont d'abord de nature IgM, et ensuite
IgG qui persistent à vie. Les anti-HBc sont le témoin d'un
contact actuel ou antérieur avec le virus naturel (les anti-HBc ne sont
pas retrouvés chez un sujet vacciné).
Un patient qui a eu une hépatite B aura donc des
anti- HBs et des anti HBc.
0. 2. PROBLEMATIQUE
La co-infection VIH/VHB est fréquente du fait
des voies de transmissions communes à ces deux virus. La
prévalence de cette co-infection va donc varier en fonction du mode de
contamination du patient par le VIH. Il s'agit de la voie sexuelle, de la voie
sanguine et de la voie materno-infantile (21).
Actuellement, on connaît les interactions
délétères entre ces virus notamment
l'accélération de l'histoire naturelle de l'infection par le VHC
et le VHB par le VIH (16). Cette superposition des groupes à risque rend
compte d'une fréquence élevée de la co-infection VIH-VHB.
L'importance des interactions entre ces deux virus a été
récemment soulignée, d'une part par l'augmentation de
l'espérance de vie des patients infectés par le VIH depuis
l'utilisation des multithérapies antirétrovirales et, d'autre
part, depuis la survenue d'échappements fréquents du VHB à
la Lamivudine chez les patients coinfectés (1). Ces deux
événements ont révélé l'importance
pronostique de l'hépatite B chronique chez les patients
co-infectés. Une amélioration des lésions
hépatiques a été observée chez les patients soumis
aux combinaisons antirétrovirales contenant la Lamivudine
(1).
L'allongement de la durée de vie liée
à l'administration des ARV pose le problème de la survenue des
complications à long terme de l'hépatite chronique. En effet,
l'histoire naturelle de l'hépatite chronique B est modifiée par
le développement de la cirrhose et des hépatocarcinomes. Il est
donc important de comprendre l'impact réciproque de ces deux virus en
termes épidémiologiques et cliniques afin de prendre en charge au
mieux les patients co-infectés.
On dispose actuellement des molécules
antirétrovirales actives à la fois sur le VIH et le VHB mais le
plus grand problème qui se pose est relatif à la
disponibilité de ces molécules dans les pays à ressources
limitées (14, 20). En RD Congo, il se pose donc un sérieux
problème de disponibilité d'un plateau technique VIH/VHB
adéquat pour assurer la généralisation du dépistage
et de la prise en charge globale de cette
co-épidémie.
devenues une des principales causes des
décès dus à l'infection chronique par le virus
hépatite B (VHB) (21, 22, 23).
Les études et les publications sur l'infection
à hépatite B au cours de l'infection à VIH sont rares en
Afrique et particulièrement en Afrique subsaharienne. Ceci est
confirmé par des auteurs anglo-saxons qui estiment cette
comorbidité à une prévalence de à 20 et 30% (24).
L'Organisation des Nations Unies pour la lutte contre le Sida (ONUSIDA)
confirme cette tendance en avançant des chiffres de
séroprévalence qui varient entre 10 et 20% de 1984 à 1999
dans la tranche d'âge 15-49 ans en RD Congo (25,26).
L'hépatite B est l'une des principales maladies
humaines qui pose un sérieux problème de santé publique
à l'échelle mondiale et en RD Congo (1,2). On estime que la RD
Congo se trouve dans une zone de haute endémicité avec 20% de
taux de porteur chronique (27).
Chacune de ces maladies virales (VIH et VHB) prises
séparément et les deux prises ensemble posent des nombreuses
questions de santé publique en RD Congo : le premier problème
concerne la connaissance sur la situation épidémiologique
réelle de la co-infection VIH/Hépatite B, l'autre question qui se
pose concerne les facteurs des risques liés à la survenue de
l'infection à hépatite B dans la population des PVVIH de Bukavu,
et il se pose enfin le problème de la prise en charge médicale de
cette bi-épidémie.
La problématique du diagnostic du VHB chez les
PVVIH n'est pas aussi moindre dans notre contexte. Le dépistage
systématique de l'infection à VHB n'est pas organisé chez
les PVVIH de Bukavu. D'une part, les professionnels de santé ne sont pas
toujours informés de la gravité de la co-infection au plan
épidémiologique dans la population des PVVIH et d'autre part les
PVVIH viennent se faire soigner de l'hépatite B au stade tardif de la
maladie hépatique.
Bien plus, les facteurs de risque de
développement de l'hépatite B dans la population des PVVIH qui
sont fort peu documentés dans notre contexte méritent
d'être recherchés : on sait à ce jour que le pourcentage de
patients ayant un Ag HBs positif est supérieur chez les PVVIH par
rapport aux patients VIH négatifs (29). Il se pose alors la question de
savoir quelle est la situation de cette co-infection à
Bukavu.
Le mode de contamination prépondérant de
l'hépatite B chez les PVVIH n'est pas connu à Bukavu. Il est
théoriquement connu que le virus de l'Hépatite B se transmet par
le contact avec le sang ou les liquides biologiques d'une personne
infectée (28). Ainsi donc, la transmission de l'Hépatite B se
fait par :
1) la transmission de la mère à l'enfant :
c'est la transmission verticale,
2) la transmission sanguine se rencontre surtout lors
des transfusions,
3) l'usage des objets tranchants non stériles (se
rencontre surtout chez les usagers des drogues injectables), perçage des
oreilles, des injections,
4) les rapports sexuels non protégés :
c'est la transmission horizontale.
Plusieurs auteurs affirment que, dans le monde, 85
à 90% d'individus infectés par le VHB deviennent des porteurs
chroniques de l'infection (30, 31).
La fréquence élevée des porteurs
chroniques du VHB serait fonction de la précocité de la
contamination. Ceci signifie que la contamination se passerait dans la petite
enfance ou dans l'adolescence (2).
Chez les immunodéprimés au stade SIDA il
y aurait un risque élevé d'acutisation de l'infection chronique.
Plusieurs études avaient identifié que l'activité sexuelle
non protégée était liée à un risque
significatif de contracter le VHB chez les PVVIH (33). L'état actuel de
cette question n'est pas connu à Bukavu et mérite d'être
éclairci.
A Bukavu, selon une étude
réalisée par le CPTS (Centre provincial de transfusion sanguine),
le taux de séroprévalence de l'hépatite B chez les
donneurs bénévoles de sang est estimé à 8% (32), il
serait opportun de connaître l'ampleur de ce problème
auprès des PVVIH afin d'améliorer la qualité de vie de ces
dernières en leur assurant une prise en charge combinée de ces
deux infections.
Etant donné l'importance des porteurs
chroniques dans la transmission de l'hépatite B, il s'avère aussi
important de connaître la part de chronicité de l'hépatite
B au sein de la population des PVVIH de Bukavu.
Il est donc impérieux de connaître la
prévalence ainsi que les déterminants de l'hépatite
aiguë chez ceux souffrant déjà d'une hépatite
chronique.
La corrélation entre le stade OMS du SIDA et la
survenue de l'hépatite, la disponibilité des ARV actifs sur le
VHB prescrits aux co-infectés, le suivi biologique des
co-infectés sont autant des questions pour lesquelles des
réponses méritent d'être données en rapport avec la
co-infection VIH/VHB à Bukavu.
0.3. QUESTIONS DE RECHERCHE
Les études sur la co-infection VIH/VHB
méritent une attention particulière d'autant plus que cette
co-infection est un problème de santé (1, 2, 3, 32). La
problématique de cette co-infection et la revue de la littérature
nous conduisent vers un certain nombre d'interrogations.
La première interrogation est celle de savoir quel
est le profil épidémiologique des PVVIH co-infectées dans
le district sanitaire de Bukavu.
La deuxième est celle de savoir quels sont les
déterminants de l'infection à VHB dans la population des PVVIH de
Bukavu.
Il se pose donc des questions spécifiques et qui
attirent notre attention particulière:
1. Il s'agit de savoir parmi les PVVIH soignées
à Bukavu quelle est la proportion de celles qui
bénéficient de la recherche de l'hépatite B
2. Il est également important de savoir si les
PVVIH co-infectées bénéficient d'un traitement
approprié contre le VHB ou d'un traitement combinant la prise en charge
à la fois du VIH et du VHB.
3. Une autre interrogation est celle de savoir la
proportion des co-infectés VIH/VHB qui évoluent vers la
chronicité de l'hépatite B.
4. La vaccination anti-VHB fait aussi partie de nos
préoccupations. La question qui se pose est celle de savoir si les PVVIH
de Bukavu bénéficient de la vaccination contre le
VHB.
A la lumière de cet ensemble de
préoccupations concernant la co-infection VIH/VHB à Bukavu la
question majeure qui se pose au cours de cette étude est celle de savoir
le profil épidémiologique et les déterminants de
l'infection par le Virus de l'hépatite B chez les personnes vivant avec
le SIDA pris en charge dans les centres de traitement ambulatoire de
Bukavu.
0.4. HYPOTHESES
Pour réaliser cette étude nous
avançons les hypothèses suivantes :
1. Le taux de l'hépatite B serait
élevé chez les PVVIH du district sanitaire de Bukavu par rapport
à la population générale ;
2. La voie sexuelle serait la voie
prépondérante pour la transmission du VHB chez les PVVIH de
Bukavu ;
3. Les antirétroviraux actifs à la fois
sur le VHB et le VIH présenteraient une faible accessibilité pour
les PVVIH co-infectées par le VIH et le VHB
à Bukavu.
0.5. OBJECTIFS/BUT
But :
Contribuer à l'amélioration des
connaissances sur la co-infection VIH/VHB pour assurer la prévention et
la prise en charge adéquates de la co-infection VIH/VHB en RD
Congo.
0.5.1. Objectif general de l~etude :
Déterminer le profil épidémiologique
ainsi que les déterminants de l'infection à hépatite B
chez les séropositifs au VIH de Bukavu.
0.5. 2. Objectifs specifiques:
> Etablir la prévalence de l'infection
à hépatite B auprès des PVVIH de Bukavu ;
> Etablir ou déterminer les facteurs de risque
de l'Hépatite B chez les personnes vivant avec le VIH de Bukavu
;
> Etablir l'interaction entre le VIH et
l'Hépatite B auprès des PVVIH de Bukavu.
Chap. I. PATIENTS ET METHODES
I.1. Cadre et type d'étude
1.1.1. Cadre de rétude
La présente étude s'est
déroulée dans le district sanitaire de la ville de Bukavu.
Située à l'Est de la RD Congo, Bukavu est le chef lieu de la
province du Sud Kivu.
C'est la capitale administrative et politique de la
province du Sud Kivu. Bukavu a actuellement une population estimée
à 544.857 habitants répartis dans les trois communes urbaines.
Les trois communes sont composées de 20 quartiers dans lesquels il y a
un total de 322 avenues. Cette population croît rapidement à cause
de l'exode rural exacerbé surtout par l'insécurité
grandissante dans les territoires des régions rurales.
Les personnes âgées de moins de 20 ans
constituent 58% (316.017 habitants) de la population pour 42%
âgées de plus de 26 ans (228.840 habitants).
La Ville de Bukavu est administrativement
subdivisée en trois communes : celle de Bagira/Kasha, de Kadutu et
d'Ibanda. Ces communes correspondent aux trois Zones de santé qui
constituent le district sanitaire de Bukavu.
La prévalence nationale du VIH est
estimée à 4,1% tandis qu'au Sud-Kivu elle est estimée
à 4%. La prévalence du VIH dans la ville de Bukavu (selon les
sites sentinelles de la ville de Bukavu) est estimée à
3,1%.
La prise en charge du VIH est organisée dans
tous les hôpitaux généraux de chaque zone de santé
(HGR de Bagira, HGR de Kadutu et HGR d'Ibanda/Panzi). Elle l'est aussi dans
certains centres hospitaliers et dans certains centres médicaux des
entreprises privées (Bralima et Pharmakina). On compte au total 7 grands
centres de prise en charge des PVVIH/SIDA dans le district sanitaire de Bukavu
à savoir : le CTA de Bagira, le CTA de Kadutu, le CTA de la Pharmakina,
le Centre médical Bralima, le programme de prise en charge des PVVIH de
Panzi, le CTA de la CELPA et celui de l'Hôpital provincial de
Bukavu.
En fonction de la disponibilité et de la
complétude des informations recherchées dans notre étude,
nous avons considéré trois CTA à savoir : celui de Bagira,
de Kadutu et celui de la Pharmakina qui sont aussi les centres les plus anciens
du district sanitaire de Bukavu.
1.1.2. Type d'étude
Il s'agit d'une étude analytique de type
cohorte rétrospective : Nous nous sommes servi pour cela des bases des
données des trois Centres de traitement ambulatoire du VIH de Bukavu (le
CTA Bagira, le CTA Kadutu et le CTA Pharmakina).
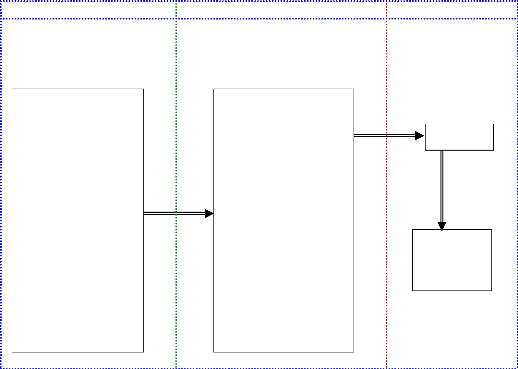
Y a-t-il des susceptibilités
/
vulnérabilités chez les PVVIH
de Bukavu ?
PVVIH
Susceptibilite sociodemographique
Susceptibilite immuno-virologique
- Age,
- Sexe,
- Profession,
- Etat civil,
- Lieu de résidence
- Taux de CD4,
- Stade OMS,
- Vaccination,
-
Susceptibilité/vulnérabilité Risques
Résultats
Dépistage VHB
Quels sont les facteurs de
risque chez les PVVIH
de
Bukavu ?
Exposition aux facteurs de risque
- Rapports sexuels non
protégés,
- Tatouage,
- Transfusion sanguine
- Taux de CD4 < 200,
- Stade OMS III & IV,
- Vaccination absente
Dépistage VHB
Quelle est la
prévalence
de
l'hépatite B chez les
PVVIH de Bukavu ?
Quels sont les
schémas ARV chez
les
co-infectés ?
ARV disponibles ?
Lesquels ?
AgHBS +
Suivi clinique, biologique, imagarie
I. 2. Cadre conceptuel de l'étude (Figure
n° 1)
1.3. Definition des variables
Tableau n° 1 : Définition
opérationnelle des variables de l'étude sur la co- infection
VIH/VHB
|
Types de
variables
|
Noms de
variables
|
Définition opérationnelle
|
|
Variable dépendante
|
VIH+
|
Le test est positif au réactif habituel ;
rapide
Determine/Unigold puis Elisa
|
|
VHB
|
Le test est positif au réactif habituel ; rapide
(HBS) détermine puis Elisa
|
|
Variables Indépendants
|
Sexe
|
Masculin ou féminin
|
|
Age en année
|
Age en année au moment de
l'étude
|
|
Transfusion sanguine
|
Antécédents de transfusion sanguine avant
la
séropositivité au VIH
|
|
Rapport
sexuel non
protégé
|
Rapport sexuel contracté sans préservatif
durant les 6 mois au moins avant l'étude
|
|
Tatouage et
scarifications
|
Présence de tatouage et scarifications
|
|
CD4
|
Nombre du comptage par FASCOUNT
|
1.4. Echantillonnage et population d'etude
L'échantillonnage a été réalisé à
deux niveaux :
· Le premier niveau était
constitué par les CTA (Centres de traitement ambulatoire des PVVIH). Ces
derniers ont été choisis en fonction de la disponibilité
dans leurs bases des données des informations recherchées dans
notre étude. Les trois CTA les plus anciens et ayant un bon
système d'archivage des données ont été
sélectionnés.
· Le deuxième niveau était
constitué par les PVVIH suivis dans les CTA. Nous avons
procédé à une étude exhaustive : tous les patients
chez qui le dépistage du VHB avait été
réalisé dans les CTA ont été
sélectionnés pour faire partie de notre cohorte
d'étude.
.4.1. La selection des patients
Toutes les PVVIH/SIDA ayant été soumises au
test de dépistage de l'hépatite B depuis janvier 2003 et ayant
dans leurs dossiers médicaux les informations recherchées ont
été sélectionnées pour notre
étude.
a. Sujet VIH+ / VHB+ (cas) Critires
d'inclusion
- Etre PVVIH/SIDA avec une confirmation
sérologique (Determine, Unigold/Double check),
- Etre suivie dans l'un de trois centres de prise en
charge (CTA) sélectionnés pour l'étude,
- Avoir un dossier médical comprenant les
paramètres recherchés dans l'étude.
Critires d'exclusion
- sujets séronégatifs au VIH,
- sujets séronégatifs au VHB,
- sujets non suivis dans les CTA
sélectionnés,
- dossier médical incomplet.
b. Selection des sujets VIH+/VHB- (contrele)
Criteres d'inclusion
- être PVVIH/SIDA avec une confirmation par les
tests sérologiques (Determine, Unigold/Double check),
- être séronégatif au VHB avec
confirmation sérologique par HBS,
- être suivi dans l'un des 3 centres de prise en
charge sélectionnés par l'étude,
- avoir un dossier médical comprenant les
paramètres recherchés dans l'étude.
Critires d'exclusion
- Etre séronégatif au VIH,
- Etre séronégatif au VHB,
- ne pas être suivi dans l'un des trois centres
sélectionnés,
- avoir un dossier médical incomplet.
1.4.2. Taille de l'échantillon
La taille de l'échantillon a été
calculée par la formule de Schwartz (33) :
pq
n = = z d2
avec n = nombre minimal de personnes
d'études.
z = 1,96 pour un risque d'erreur de 5%, p = 20%
prévalence trouvée par une étude similaire
effectuée au Nigeria (30), q = 1-p et d = 0,10 (précision de nos
résultats) est de 246 personnes au minimum de groupe (PVV). Le nombre
total de l'échantillon de l'étude est de 470
PVVIH/SIDA.
.4.3. Technique de collecte des donnees
Nous avons utilisé la base des données
des CTA de Kadutu, de Bagira et de la Pharmakina Bukavu. La collecte des
données s'est effectuée proportionnellement à la taille de
la cohorte du centre de traitement. La collecte a été faite sur
base d'un questionnaire d'enquête élaboré à cet
effet (Voir annexe n° 1). Nous avons dépouillé les dossiers
des patients traités dans ces CTA à la recherche de ceux chez qui
la recherche de l'hépatite B était faite. Parmi ces derniers nous
avons retenu ceux chez qui les résultats étaient
enregistrés dans le dossier médical. De ces dossiers, seuls ceux
ayant la totalité des informations recherchées ont
été retenus pour la collecte définitive des
données.
Notre unité statistique est la
PVVIH/SIDA.
1.S. Durée de l'étude
L'étude est menée dans le district
sanitaire de Bukavu pendant la période allant de mars 2011 à
septembre 2011. Les informations collectées concernent la période
allant de janvier 2003 à septembre 2011.
1.6. Plan de collecte des données
Nous avons recueilli les informations suivantes dans
les dossiers des PVVIH : âge, sexe, état civil, type d'union,
antécédents de transfusion sanguine, types de rapports sexuels,
antécédents de tatouage, antécédents de
scarification, année de connaissance de la sérologie VIH,
année de début des ARV, Stade OMS du SIDA, schéma de
traitement ARV, présence d'ARV actifs sur le VHB,
antécédent d'hépatite aiguë.
Les informations suivantes ont été
recherchées pour la Biologie : le comptage des lymphocytes CD4 et le
taux des transaminases. Toutes les informations recueillies ont
été placées sur des fiches de collecte
préparées pour cette fin.
Le contrôle de qualite des donnees a ete realise a
deux niveaux :
Un premier contrôle de la qualité des
données a été effectué sur le terrain, au cours de
la collecte des données. Ceci nous a permis de nous rassurer de la
complétude des informations, de leur précision et de leur
enregistrement correct. Le deuxième contrôle a été
effectué avant le traitement des données. Ce contrôle nous
a permis de vérifier la cohérence des données. Lorsqu'il
manquait des informations sur certaines variables, celles-ci étaient
traitées comme ayant des données manquantes.
1.7. Plan de traitement et d'analyse des donnees
Les données ont été
collectées par l'investigateur principal assisté d'une
équipe de trois enquêteurs. Les données collectées
ont été traitées et analysées sous environnement
Epi-Info 2000. Les paramètres statistiques dont nous nous sommes servi
dans l'analyse des données sont : la fréquence, la proportion
(avec intervalle de confiance), la moyenne arithmétique (avec intervalle
de confiance), la déviation standard. Nous nous sommes servi des
tests
d'hypothèse pour comparer les différents
paramètres statistiques. Nous avons utilisé le test t-Student
pour comparer les différentes moyennes et le test Chicarré pour
comparer les différentes proportions par groupe. L'estimation de
l'association entre VIH et l'hépatite B a été faite par le
calcul d'Odd ratio (avec intervalle de confiance). Le seuil de 0,05 a
été considéré comme significatif. Un modèle
de régression logistique a été posé sur base de
certains facteurs prédictifs.
I.B. Considerations ethiques
Les dispositions nécessaires ont
été prises pour garantir l'anonymat des PVVIH. Les données
de cette étude ont été utilisées aux seules fins de
résultats des analyses ; c'est pour cela que les échantillons et
les fiches de collecte des données étaient codés. Le
chercheur principal a fourni aux responsables des CTA toutes les informations
relatives à la nature de la recherche.
I.9. Impact prevu (interet)
Cette étude permettra d'améliorer les
connaissances sur l'épidémiologie et les déterminants de
la co-infection VIH/Hépatite B en RD Congo.
Ceci permettra d'améliorer la prise en charge
des PVVIH/SIDA. En effet, dans un contexte de prévalence
élevée du VIH et du virus de l'hépatite B, il est
impérieux d'envisager une prévention et une prise en charge
commune de ces deux infections. Notre étude trace les jalons des
études transversales et prospectives plus poussées sur la
question de co-infection VIH/VHB en RD Congo.
I.10. Limites et difficultés
Les difficultés rencontrées
étaient essentiellement liées à la complétude de
l'information recherchée dans les bases des données des CTA.
Depuis la réduction de l'appui du Fonds Mondial de lutte contre le SIDA
et le désengagement de plusieurs organisations internationales jadis
impliquées
dans la prise en charge des PVVIH comme le
MAP/BM/PNMLS, les conditions de suivi et les conditions diagnostiques en faveur
des PVVIH sont devenues très limitées et l'accès à
certaines explorations paracliniques reste très difficile. Même
l'accessibilité à la numération des LT CD4 est devenue
limitée, la CRP, le rapport CD4/CD8 n'étant plus disponibles et
les transaminases faites rarement.
Chap. II. GENERALITES SUR LA CO-INFECTION VIH/VHB
II.1. Epidemiologie de la co-infection VIH/VHB
L'incidence de l'hépatite B est mal connue dans
la population des PVVIH du fait de l'absence de la recherche initiale de la
sérologie du VHB et du suivi de cette sérologie (31,
32).
Le VIH et le VHB ont des voies de transmission
commune. En effet ces deux virus se transmettent par la voie sanguine, la voie
sexuelle et par celle de la mère à l'enfant.
La prévalence de la co-infection VIH/VHB dans
la population des personnes infectées par le VIH est
élevée (1, 2, 12, 33). En 2004, on estimait en France, que 37,6%
de personnes atteintes par le VIH présentaient des marqueurs
sérologiques témoignant d'une infection ou d'un contact ancien
avec le VHB [34]. On notait en plus que 6,3% des patients infectés
restaient ignorants de leur statut sérologique vis-à-vis du VHB.
On notait aussi que la prévalence de l'infection chronique par le VHB
(Ag HBs+ ou ADN-VHB+) était estimée à 7% chez les patients
infectés par le VIH.
Les plus fortes prévalences de la co-infection
VIH/VHB sont relevées chez les homosexuels et les toxicomanes. Les
PVVVIH sont aussi également majoritairement infectées par un VHB
« sauvage » (35) et les mutants préC sont fréquemment
associés à des lésions hépatiques plus
sévères. Le diagnostic généralisé de
l'infection à hépatite B est encore très limité
parce que le génotypage VHB n'est encore que trop rarement
réalisé (35).
En Afrique, il y a très peu de données
sur la prévalence de cette co-infection. Les informations disponibles se
rapportent surtout à la population générale. Au
Sénégal par exemple, 95% des adultes possèdent un marqueur
sérique de l'hépatite B (1).
Chez les PVVIH, les nouvelles
antigénémies HBS+ correspondent souvent à des
contaminations récentes, y compris chez des patients vaccinés
contre le VHB ayant perdu leur immunité (32).
Mais le pourcentage de patients co-infectés
VIH-VHB ayant eu une évaluation histologique est entre 16 et 35% alors
que 71 à 87% bénéficient d'un traitement actif contre le
VHB (surtout dans le cadre du traitement antirétroviral)
(33).
11. 2. Histoire naturelle de la co-infection
V1H/VHB
Effets de l'infection par le VIH sur
l'hépatite B
L'infection par le VIH modifie inexorablement
l'histoire naturelle du VHB et aggrave le pronostic de l'hépatite
chronique B (35, 36, 37, 38). L'infection par le VIH accroît
également le passage à la chronicité de l'hépatite
aiguë B. Au fait, l'état d'immunodépression du stade SIDA
est à l'origine de l'augmentation de la réplication virale B.
Elle diminue aussi les séroconversions HBe ou HBs
spontanées.
Le VIH augmente la fréquence des
réactivations du VHB chez les porteurs inactifs du VHB
(séroréversions HBe ou HBs) (39). Il accélère en
même temps la vitesse de progression de la fibrose, le
développement de la cirrhose et du carcinome
hépatocellulaire.
Les facteurs de mauvais pronostic de l'infection
à VHB sont l'âge, une réplication virale B importante, un
taux de lymphocytes CD4 bas et la persistance de l'Ag HBe. D'autres facteurs
non moins rares comme les triples infections VIH-VHC-VHB ou VIH-VHB-VHD, la
consommation d'alcool, le génotype G du VHB sont aussi des facteurs
indépendants d'aggravation de la fibrose (40).
Effets de l'infection par le VHB sur la progression
de l'infection par le VIH
L'intérêt pour la co-infection VIH/VHB
est récent. Les études effectuées n'ont pas montré
d'influence de l'infection virale VHB sur la progression de l'infection par le
VIH, par contre elle semble augmenter la mortalité globale des PVVIH
(41).
Face aux connaissances acquises à ce jour sur
cette co-infection, des protocoles de traitements sont proposés. D'abord
sous forme de monothérapie, les multithérapies sont à ce
jour proposées.
Rôle des multithérapies sur
l'évolution de la co infection VIH VHB (32)
Lors de la co-infection VIH-VHB les
élévations des transaminases sont fréquentes et d'origines
diverses : elles peuvent être liées à
l'hépato-toxicité des antirétroviraux ou aux traitements
prophylactiques des infections opportunistes. L'élévation des
transaminases peut aussi être liée à l'apparition de
mutants résistants aux analogues nucléosi(ti)diques anti-VHB ou
à l'arrêt de molécules actives contre le VHB dans le cadre
du traitement contre le VIH.
Elles peuvent enfin être dues au syndrome de
reconstitution immunitaire (IRIS) sous antirétroviraux, lorsque le taux
de CD4 est < 200/mm3 et en présence de taux
élevés d'ADN-VHB.
Ceci plaide en faveur de l'inclusion du
Ténofovir et de la Lamivudine ou de l'Emtricitabine dans les
multithérapies données pour le traitement du SIDA (1, 2, 12,
32).
11.3. Diagnostic et bilan de l~hepatite B chez les
co-infectes
La recherche des marqueurs de l'infection par le VHB
(antigène HBs, anticorps anti-HBc) doit être systématique
chez les PVVIH, de même que la recherche d'une immunisation contre le VHB
(anticorps anti-HBs).
Chez les patients porteurs de l'Ag HBs, une
évaluation de la sévérité de l'hépatite B et
du profil virologique doit être réalisée et comprendra : un
examen clinique à la recherche de signes et de symptômes d'une
hépatopathie chronique, un dosage répété des
transaminases, surtout chez les patients Ag HBe négatifs, car les
fluctuations sont fréquentes. Bien qu'il n'y ait pas de
corrélation absolue entre le niveau des transaminases et
l'activité de la maladie, un taux élevé de transaminases
est plus souvent associé à la présence d'une maladie
évolutive et à la présence d'une fibrose (1, 2, 12,
32).
La détermination du profil HBe permet de
différencier, d'une part, les patients porteurs d'un virus sauvage (Ag
HBe+) des patients porteurs d'un virus mutant pré-C (Ac anti-HBe+ et
ADN-VHB+) et, d'autre part, d'évaluer la séroconversion HBe sous
traitement, qui est un critère relatif d'efficacité(12,
32).
Les patients Ag HBe+ ont plus souvent un niveau
élevé d'ADN du VHB indépendamment du taux d'ALAT. Les
sujets Ac anti-HBe+ ont souvent une virémie plus faible voire
indétectable et souvent fluctuante (32).
Pour la détermination de la charge virale du
VHB (ADN du VHB), le test utilisé doit être quantitatif avec une
bonne sensibilité. Les meilleurs tests sont actuellement ceux reposant
sur l'amplification génique en temps réel et les résultats
sont exprimés en UI/mL et en log UI/mL (1, 32).
L'utilisation d'un même test est
recommandée pour suivre la cinétique de la charge virale chez un
patient donné. Afin d'identifier les patients ayant de faibles
réplications virales, il est parfois utile, notamment chez les patients
Ac anti-HBe+, de répéter les mesures des charges virales du fait
de leur fréquente fluctuation.
Chez les patients qui ont une cytolyse
inexpliquée et un profil sérologique de type anti- HBc
isolé, il faut effectuer un dosage d'ADN du VHB afin d'éliminer
une infection occulte à VHB qui serait plus fréquente chez les
patients coinfectés par le VIH ou/et le VHC.
Devant la présence isolée d'un Ac
anti-HBc, une surveillance de l'ADN du VHB et de l'Ag HBs doit être
systématique en cas d'immunosuppression, que celle-ci soit
iatrogène ou liée à l'infection par le VIH ; en effet, une
réactivation virale (réapparition d'une charge virale VHB et/ou
de l'Ag HBs) peut se produire et l'instauration d'un traitement
présomptif doit être discutée. Les triples et quadruples
infections VIH-VHB-VHD (6% des sujets infectés par le VIH), VIHVHB-VHC
(0,6 à 50% des sujets infectés par le VIH, selon l'origine
géographique et les modes de contamination) et VIH-VHB-VHD-VHC ont en
commun d'être fréquentes chez les usagers de drogues
intraveineuses, d'être sous-dépistées et d'évolution
plus sévère (32). Leur traitement n'est pas toujours bien
codifié. Ce type de situation nécessite une prise en charge en
hépatologie.
Evaluation de l'atteinte hipatique
Devant une élévation des transaminases
et en présence d'une charge virale détectable du VHB (> 2 000
UI/mL), une évaluation de l'atteinte hépatique doit être
réalisée pour déterminer le stade de la maladie, le risque
de progression vers la cirrhose et ses complications, et aider à la
décision thérapeutique. Cette évaluation, qui a pour but
d'évaluer l'activité nécrotico-inflammatoire et la
fibrose, repose sur l'étude histologique du foie par la PBH (1, 2,
32).
Cependant, la place des marqueurs sériques de
fibrose (Fibrotest®, Fibromètre®, hepascore et score de Zeng)
(42) et de l'élastométrie ultrasonore impulsionnelle (43)
(Fibroscan) est superposable à celle proposée pour le VHC. Une
échographie abdominale et un dosage de l'alpha-foetoprotéine
permettent de rechercher d'une part des signes directs ou indirects de cirrhose
et d'autre part un carcinome hépatocellulaire qui peut survenir à
n'importe quel stade de l'infection VHB. Parmi les porteurs de
l'antigène HBs, le bilan des marqueurs biologiques de réplication
du VHB (ADN-VHB, statut HBe qui permet de différencier les patients
porteurs d'un virus sauvage Ag HBe+ et ceux porteurs d'un virus mutant
préC avec anticorps anti-HBe+) n'est pas réalisé dans un
tiers des cas au début de la prise en charge et reste incomplet chez 24%
en cours de suivi (44).
11.4. Traitement de la co-infection V1H/VHB
Objectifs et indications du traitement de l'hipatite
B
L'objectif idéal est d'obtenir une
séroconversion HBS : Cette dernière n'est réalisée
que chez moins de 10% des mono-infections par le VHB. Elle est encore plus rare
chez les PVVIH infectées par le VHB (1, 32).
Un objectif plus réaliste est d'obtenir une
suppression efficace et durable de l'ADN VHB, et une séroconversion HBE
(chez les patients AG HBE+), ce qui permet de réduire les lésions
nécrotico-inflammatoires du foie, et de stopper ou de ralentir la
progression de la fibrose et la survenue d'une cirrhose et ses
complications.
Facteurs a prendre en compte dans Vindication du
traitement seront:
La sévérité de la maladie
hépatique : il s'agit de rechercher les preuves histologiques de maladie
active et/ou avancée comme une fibrose septale > F2, ou F1
associé à des signes d'activité importante > A2, et le
niveau de la réplication virale (32).
Il est important de noter qu'en cas de co-infection
VIH-VHB, les traitements sont institués plus largement, compte tenu de
l'activité anti-VHB de certaines molécules anti VIH (1,
32).
Tableau n° 2 : Classification de la fibrose
hépatique selon Metavir et Ishak Classification Metavir et Ishak
:
Grade de fibrose Metavir Ishak
Pas de fibrose F0 F0
Fibrose portale F1 F1/F2
Quelques septa F2 F3
Nombreux septa F3 F4
Cirrhose F4 F5/F6
Grade d'activite (necrose)
Nulle Minime Modérée
Sévère
A0 A1 A2 A3
Médicaments anti - VHB
Les médicaments actifs sur le VHB sont
nombreux, mais induisent le plus souvent une diminution de la
réplication virale, parfois une séroconversion HBE (à
l'exception des mutants pré-C). Rarement une séroconversion HBS
(seule garante de la guérison). La durée du traitement n'est pas
codifiée.
Interferon pegyle :
Chez les patients mono-infectés VHB, la forme
pégylée est mieux tolérée et plus efficace que
l'interféron, la séroconversion HBE survient chez 22 à 24%
des patients Ag HBE+. Une réponse combinée (ALAT normale et ADN
VHB < 20.00 cop/mL ou 400 copies/mL) est obtenue chez 36 ou 15% des patients
Ag HBE négatifs.
En cas de co-infection VIH-VHB, l'interféron
peut être une option s'il n'existe pas d'indication à
débuter un traitement antirétroviral, et surtout en
présence de l'Ag HBE, d'une réplication virale faible
(prédictifs d'une meilleure réponse au traitement
(32).
La durée du traitement est de 48 semaines quel
que soit le statut HBE. L'intérêt d'un traitement prolongé
(suggéré avec l'interféron standard sur l'Ag HBE
négatif) n'a pas été étudié avec
l'interféron pégylé (1).
L'association interféron pégylé +
nucléotides (en particulier Ténofovir) est en cours
d'évaluation (32).
Strategies therapeutiques
Peu d'études ont été
réalisées sur la co-infection VIH-VHB (1, 2, 32). Les indications
sont donc déduites des études en mono-infection VHB (1, 31).
L'initiation du traitement repose sur 3 paramètres à savoir
:
1. ADN VHB sérique > 2.000 UI/mL ;
2. Elévation des ALAT ;
3. Lésions histologiques hépatiques (>
A2 et > F2)
Le choix thérapeutique quant à lui repose
sur 2 éléments à savoir :
1. L'indication ou non d'un traitement
antirétroviral : en l'absence d'indication au traitement anti-VIH
à court terme (2 à 3 ans), les médicaments ayant une
double activité anti VIH et anti VHB ne devront pas être
utilisés ;
2. La présence éventuelle d'une
cirrhose hépatique.
On observe souvent des réactivations de
l'infection VHB, en cas de détérioration immunitaire ou
d'arrêt brutal d'un traitement antirétroviral actif sur le VHB
(3TC, FTC, TDF) (45, 46) chez des patients ayant soit des anticorps anti-HBS
isolés, soit initialement une cicatrice sérologique
d'hépatite B guérie (anticorps anti-HBC et anticorps anti HBS
positifs (32).
D'une manière générale, la
décision de mise sous traitement anti-VHB chez les patients sans
indication de traitement anti VIH sera prise en fonction des
éléments suivants :
a) ADN VHB < 2.000 UI/mL :
· pas de traitement;
· surveillance ALAT tous les 6 à 12
mois.
b) ADN VHB > 2.000 UI/mL :
· ALAT normales :
1. Surveillance ALAT tous les 3 mois ;
2. Evaluation histologique;
3. Traitement si lésions : Metavir > A2 et
> F2
· ALAT élevées :
1. Peg-IFN (si facteurs favorables de réponse)
: 48 semaines + adéfovir + Telbivudine : jusqu'à 6 mois
après la séroconversion HBS et/ou HBE ;
2. Adéfovir + telbivudine d'emblée
(après avis d'expert).
Pour les patients initiant un traitement anti VIH on
privilégiera une multithérapie incluant Ténofovir
associée à l'Emtricitabine ou à la Lamivudine.
Si le patient est déjà sous traitement
anti VIH et qu'il présente une cirrhose, la multithérapie
incluant Ténofovir + (Emtricitabine ou Lamivudine) sera
privilégiée.
Et si l'ADN VHB > 2.000 UI/mL, le choix sera
porté à la multithérapie au choix.
Certains experts conseillent d'inclure
systématiquement Ténofovir + (Entricitabine ou Lamivudine) si un
traitement antirétroviral est indiqué, même sans indication
du traitement VHB (2, 31).
Si l'ADN < 2.000 UI/Ml et qu'il n y `a pas de
résistance à la Lamivudine, on donnera la multithérapie
incluant Ténofovir + (Entricitabine ou Lamivudine).
Mais s'il y a résistance à la
Lamivudine, si possible et approprié au maintien du contrôle du
VIH : remplacer la Lamivudine par le Ténofovir ; ou lui ajouter du
Ténofovir (32).
11.5. La surveillance du traitement en cas de
co-infection V1H/VHB
Chez les patients Ag HBS+ traités pour leur
infection à VHB la surveillance consistera au dosage des transaminases
et ADN VHB au moins tous les 3 mois ;
L'efficacité du traitement est
appréciée sur la baisse continue de l'ADN jusqu'à
l'indétectabilité. Elle est aussi évaluée sur base
de la séroconversion HBE.
La répétition de la recherche de l'Ag
HBE et des anti- HBE n'est pas utile chez les porteurs d'un virus mutant «
précoce » et la recherche de l'Ag HBS tous les 6 mois, pour guetter
la perte de ce marqueur, puis l'acquisition des anticorps anti HBS en
particulier si le traitement assure un bon contrôle de la
réplication virale. (31)
Si l'ADN VHB augmente de > 1 log Ul/mL : il faudra
vérifier l'observance au traitement, puis suspecter une
résistance du VHB.
Le séquençage du gène de la
polymérase peut alors permettre d'identifier des mutations de
résistance pour adapter le traitement, et déterminer le
génotype qui est prédictif de la réponse à
l'interféron.
11.6. La vaccination contre l'hepatite B
La vaccination anti VHB n'est pas assez
réalisée chez les patients VIH+. Elle est moins efficace chez les
patients VIH+ si les CD4 sont < 500/mm3. Elle doit être
faite chez toute personne sans aucun marqueur du VHB, avec détermination
du titre des anticorps anti HBS.
Si celui-ci est insuffisant (< 10 mU/mL), il faudra
proposer des schémas plus intensifs pour augmenter la réponse
vaccinale, si possible dans le cadre d'essais thérapeutiques
(32).
L'ensemble de ces éléments
épidémiologiques, cliniques et paracliniques plaide pour (31)
:
1. Un dépistage sérologique et virologique
VHB complet systématique chez tous les patients VIH+ (traités ou
non) ;
2. Ces éléments plaident aussi pour un
titrage des anticorps anti HBS ou la recherche de l'ADN VHB chez les PVVIH
;
3. La fréquence élevée d'autres
hépatites associées (VHC, VHD, VHA) plaide pour la recherche
d'une co-infection par les virus des hépatites non B le cas
échéant ;
4. Une attention particulière devra être
portée sur la prévention, notamment la vaccination anti VHB :
plusieurs essais de vaccination ou de revaccination sont en cours chez les
patients co-infectés VIH/VHB (32) ;
5. Parmi les PVVIH/SIDA, des groupes sociaux
possédant un risque élevé d'infection du VHB et ceux
possédant un risque élevé d'évoluer vers la
chronicité doivent être systématiquement recherchés
;
6. Ces informations plaident aussi en faveur d'une
prise en charge et d'un suivi médico-biologique des personnes porteuses
de cette double infection.
Chap. III. PRESENTATION DES RESULTATS
Le traitement des données à l'aide du
logiciel Epi-Info 2011, version 3.5.3 nous a permis d'arriver aux
résultats ci-après :
III.1. Caracteristiques generales de la population
d'etude
M.1.1. Caracteristiques sociodentographiques
Figure n° 2 : Taux de depistage dans la population
des PVVIH soignees dans les CTA de l'etude (4630 personnes)
Taux de dépistage dans la population de PVVIH
soignées dans les
CTA (4630 personnes)

10,1 % (n = 470)
Population des PVVIH soignées dans les CTA de
l'étude (n = 4630 PVVIH)
Personnes dépistées

Cette figure montre que 10,1% des PVVIH suivies ont
bénéficié du dépistage de l'hépatite
B.
Tableau n° 3 : Caracteristiques likes a l'age, au
sexe, a l'etat civil, au domicile et a la profession de la population
d'etude.
|
Caractéristiques
|
|
n
|
%
|
Moyenne + DS
|
|
Age
|
|
470
|
|
39,0 +10,4
|
|
< 20 ans
|
21
|
4,5
|
|
|
21-40 ans
|
254
|
54,0
|
|
|
> 40 ans
|
195
|
41,5
|
|
|
Sere
|
|
470
|
|
|
|
Homme
|
190
|
40,4
|
|
|
Femme
|
280
|
59,6
|
|
|
Etat civil
|
|
470
|
|
|
|
Célibataire
|
129
|
27,4
|
|
|
Divorcé
|
56
|
11,9
|
|
|
Marié
|
214
|
45,5
|
|
|
Veuf
|
71
|
15,1
|
|
|
Domicile
|
|
470
|
|
|
|
Bagira
|
126
|
26,9
|
|
|
Ibanda
|
139
|
29,6
|
|
|
Kadutu
|
133
|
28,3
|
|
|
Milieu rural
|
72
|
15,5
|
|
|
Profession
|
|
440
|
|
|
|
Fonctionnaire de l'Etat
|
48
|
10,2
|
|
|
Agents d'entreprise
|
47
|
10,0
|
|
|
Agriculture
|
33
|
7,0
|
|
|
Commerçant
|
59
|
12,6
|
|
|
Ouvrier
|
23
|
4,9
|
|
|
Policier - Militaire
|
40
|
8,5
|
|
|
Professionnel de sexe
|
59
|
12,6
|
|
|
Chômeur
|
112
|
30,2
|
|
|
Transporteur
|
19
|
4,0
|
|
L'âge moyen de la cohorte de notre étude
est de 39,0 ans. Les patients âgés de 21 à 40 ans ont
représenté plus de la moitié de la population des PVVIH de
notre étude (54,0%).
Les femmes ont été plus nombreuses à
bénéficier de la recherche de l'infection VHB. Elles
représentent 59,6% de la cohorte d'étude.
Les PVVIH mariées ont été les plus
nombreuses à être soumises au dépistage du VHB : elles
représentent 45,5% de la population d'étude.
En fonction du lieu d'habitation, les PVVIH d'Ibanda
ont été dépistées à 29,6 %, celles de Kadutu
à 28,3% et celles de Bagira à 26,8% tandis que celles habitant en
milieu rural représentent 15,5% de la cohorte.
Les PVVIH sans profession au moment du
dépistage ont représenté 30% de notre cohorte tandis que
les militaires et policiers représentaient 8,5% de la population
d'étude.
III.1.2. Caracteristiques immuno-virologiques et celles
lives au traitement antiretroviral de la population d'etude
Tableau n° 4 : Caracteristiques likes au CD4, au
Stade OMS, au TARV
|
Caracteristiques
|
|
n
|
% Moyenne+DS
|
|
CD4 (elt/mm3)
|
|
469
|
285,3 + 194,6
|
|
1< 50
|
35
|
7,5
|
|
51-100
|
41
|
8,7
|
|
101-200
|
125
|
26,7
|
|
> 200
|
268
|
57,1
|
|
Stade OMS
|
|
470
|
|
|
I
|
70
|
14,9
|
|
II
|
90
|
19,1
|
|
III
|
164
|
34,9
|
|
IV
|
146
|
31,1
|
|
TARV - VIH
|
|
470
|
|
|
Patients sous ARV
|
310
|
66,0
|
|
Patients ne prenant pas les ARV
|
160
|
34,0
|
La valeur moyenne des CD4 est de 285,3 + 195
elt/mm3. Les PVVIH ayant des taux de LT CD4 > 200 ont
représenté 57,1% parmi les PVVIH de l'étude, tandis que
celles ayant des CD4 < 200 représentaient 42,9%.
Notre cohorte était constituée
majoritairement des PVVIH au Stade III OMS (34,9%) et Stade IV
(31,1%).
Figure n° 3 : Schéma de traitement
antirétroviral contre le VIH

300
250
200
150
100
50
0
AZT + 3TC +
NVP
281
90,6
D4T + 3TC +
NVP
26
8,4 1 0,3 2 0,6
AZT + 3TC +
EFV
ABC + DDI + L/r
Nombre Pourcentage
Parmi nos patients, 66% étaient sous traitement
ARV. Le régime thérapeutique qui était prescrit
majoritairement (90,6%) était la thérapie conventionnelle de
première ligne (AZT + 3TC + NVP).
III.1.3. Caracteristiques relatives a l'hipatite B chez les
PVVIH de l'etude
Tableau n° 5 : Caracteristiques likes a la
vaccination contre l'hepatite B et la serologie HBS
Caractéristiques n %
Vaccination contre HBS 470
Positifs 12 2,6
Négatifs 458 97,4
Sérologie HBS 470
Positifs 255 54,3
Négatifs 215 45,7
Dans notre cohorte 97,4% de sujets n'avaient jamais
bénéficié de la vaccination contre l'hépatite B
contre 2,6% vaccinés (12 PVVIH pour n=470).
Nous avons noté que la fréquence de
l'hépatite B chez les PVVIH est de 54,3% (49,6-58,8).
111.2. Analyse des facteurs de risque de
l'hépatite B chez les PVVIH de l'étude
111.2.1. Evaluation des risques lies aux modes de
contamination de VHB
Tableau n° 6 : Risque lié a la transfusion,
au tatouage et au rapport sexuel non protégé.
VHB+ VHB- OR (IC 95 %) p- valeur
n (%) n (%)
Transfusion 253 251 0,16
Patients 67(26,5) 45(20,9) 1,36 (0,86-2,14)
transfusés
Patients non 186(73,5) 170(79,1) 1
transfusés
Tatouage 255 215 0,33
Patients tatoués 58(22,7) 41(19,1) 1,25
(0,78-2,01)
Patients non
tatoués
Rapport
sexuel
non
protégé
Patients ayant
des rapports
sexuels non
protégés
Patients ayant des rapports sexuels
protégés
107(77,3) 174(80,9) 1
55 215
208(81,6) 170(79,1) 1,17 (0,72-1,90) 0,49
47(18,4) 45(20,9) 1
Au vu des résultats présentés
dans ce tableau, parmi tous ces facteurs, aucun n'entraîne un risque
élevé d'hépatite B. Il n'y a pas d'association
significative entre la transfusion sanguine (OR : 1,36 ; p : 0,16), le tatouage
(OR : 1,25 ; p : 0,33), le rapport sexuel non protégé (OR : 1,17
; p : 0,49) avec la positivité du HBS.
111.2.2. Evaluation des risques lies aux facteurs
sociodemographiques
Tableau n° 7 : Risque de l~hepatite B chez les PVVIH
lie au sexe, a l~age, a la profession, au domicile et a l~etat
civil.
|
|
VHB+
n (%)
|
VHB-
n (%)
|
OR
|
IC
|
p- valeur
|
|
Sexe
|
|
255
|
215
|
|
|
0,98
|
|
Homme
|
103(40,4)
|
87(40,5)
|
0,99
|
(0,68-1,44)
|
|
|
Femme
|
152(59,6)
|
128(59,5)
|
1
|
|
|
|
Age
|
|
245
|
204
|
|
|
0,3
|
|
< 20
|
10(3,9)
|
11(5,1)
|
0,69
|
(0,26-1,84)
|
|
|
21 - 40
|
134(52,5)
|
120(55,8)
|
0,85
|
(0,57-1,25)
|
|
|
> 40
|
111(43,5)
|
84(39,1)
|
1
|
|
|
|
Profession
|
|
255
|
215
|
|
|
0,51
|
|
Fonctionnaire de l'Etat
|
27(10,6)
|
21(9,8)
|
1,23
|
(0,51-2,99)
|
0,61
|
|
Agent Entreprise
|
24(9,4)
|
23(10,7)
|
1
|
|
|
|
Agriculture
|
17(6,7)
|
16(7,4)
|
1,02
|
(0,38-2,73)
|
0,96
|
|
Commerçant
|
30(11,8)
|
29(13,5)
|
0,99
|
(0,43-2,29)
|
0,98
|
|
Ouvrier
|
13(5,1)
|
10(4,7)
|
1,25
|
(0,41-3,83)
|
0,66
|
|
Policier -
|
23(9,0)
|
17(7,9)
|
1,30
|
(0,51-3,31)
|
0,54
|
|
Militaire
|
|
|
|
|
|
|
Professionnel de sexe
|
28(11,0)
|
31(14,4)
|
0,87
|
(0,37-2,00)
|
0,71
|
|
chômeur
|
84(32,9)
|
58(27,0)
|
1,39
|
(0,68-2,84)
|
0,33
|
|
Transporteur
|
9(3,5)
|
10(4,7)
|
0,86
|
(0,26-2,85)
|
0,78
|
|
Domicile
|
|
255
|
215
|
|
|
0,52
|
|
Bagira
|
66(25,9)
|
60(27,9)
|
0,86
|
(0,51-1,44)
|
|
|
Ibanda
|
78(30,6)
|
61(28,4)
|
1
|
|
|
|
Kadutu
|
72(28,2)
|
61(28,4)
|
0,92
|
(0,56-1,53)
|
|
|
Milieu rural
|
39(15,3)
|
33(15,3)
|
0,92
|
(0,50-1,70)
|
|
|
Etat civil
|
|
255
|
215
|
|
|
0,27
|
|
Célibataire
|
66(25,9)
|
63(29,3)
|
1
|
|
|
|
Divorcé
|
32(12,5)
|
24(11,2)
|
1,27
|
(0,65-2,51)
|
|
|
Marié
|
117(45,9)
|
97(45,2)
|
1,15
|
(0,73-1,53)
|
|
|
Veuf
|
40(15,7)
|
31(14,4)
|
1,23
|
(0,66-2,30)
|
|
L'évaluation du risque par rapport au sexe
montre qu'il n'y a pas de différence statistiquement significative entre
les patients HBS (+) et HBS (-) (p : 0,98) en fonction du sexe : il n'y a pas
de risque particulier en fonction du sexe. Il n'y a pas de risque d'HBS (+)
lié en rapport avec l'âge des patients. Aucune profession ne
présente un risque élevé d'hépatite B (tous les OR
sont < 2). Il n'y a pas de différence significative statistiquement
selon le lieu de domicile (p : 0,52) et l'état civil (p : 0,27). Le lieu
de résidence et l'état civil ne constituent pas des facteurs de
risque (OR < 2).
111.2.3. Evaluation des risques en rapport avec la
vaccination anti VHB Tableau n° 8 : Risque de l'hépatite B
en rapport avec la vaccination
Parametres VHB+ VHB- OR (IC) p-
valeur
n (%) n (%)
Vaccination 255 215 0,04
Oui 10(3,9) 2(0,9) 1
Non 245(96,1) 213(99,1) 0,23 (0,03-1,13)
On remarque une différence statistiquement
significative entre les PVVIH vaccinées et les non vaccinées (p :
0,04). La proportion des co-infectées VIH/VHB est faible parmi les
vaccinées (3,9%) par rapport aux non vaccinées (96,
1%).
111.2.4. Risques de l'Hipatite B chez les PVV1H en fonction
de l'etat immuno- virologique
Tableau n° 9 : Risque de l'hépatite B lie au
Stade clinique et au CD4
|
Parametres
|
|
VHB+
n (%)
|
VHB-
n (%)
|
OR
|
1C
|
P-
valeur
|
|
Stade OMS
|
|
255
|
215
|
|
|
0,06
|
|
I
|
33(12,9)
|
37(17,2)
|
1
|
|
|
|
II
|
50(19,6)
|
40(18,6)
|
1,40
|
(0,71-2,76)
|
|
|
III
|
100(39,2)
|
64(29,8)
|
1,75
|
(0,96-3,20)
|
|
|
IV
|
72(28,2)
|
74(34,4)
|
1,09
|
(0,59-2,01)
|
|
|
Numeration LT
|
|
55
|
215
|
|
|
0,82
|
|
CD4
|
|
|
|
|
|
|
|
1< 50
|
18(7,1)
|
17(7,9)
|
0,87
|
(0,41-1,86)
|
|
|
51-100
|
22(8,6)
|
19(8,9)
|
0,95
|
(0,47-1,94)
|
|
|
101-200
|
68(26,7)
|
57(26,6)
|
0,98
|
(0,63-1,54)
|
|
|
> 200
|
147(57,6)
|
121(56,5)
|
1
|
|
|
Le stade clinique du SIDA ou stade OMS
n'apparaît pas comme un facteur de risque de l'hépatite B (OR <
2 pour les quatre stades). En plus, il n'y a pas de différence
significative entre les stades OMS par rapport à la
séropositivité HBS.
On constate qu'il n'y a pas de différence
significative statistiquement (p : 0,82 entre les PVVIH HBS (+) et ceux HBS (-)
en fonction du taux des CD4 et du Stade OMS.
III.3. Evaluation des risques par analyse
multivariee
Tableau n° 10 : Analyse multivariee des facteurs de
risque de l~hepatite B chez les PVVIH de Bukavu
|
Parametres
|
OR ajusté
|
IC à
|
95%
|
P-Value
|
|
Age (<40 /> 40 ans)
|
0,8817
|
0,57
|
1,35
|
0,56
|
|
CD4 (< 200 /> 200)
|
1,0298
|
0,79
|
1,34
|
0,82
|
|
Domicile (Ibanda/Bagira)
|
0,89
|
0,52
|
1,52
|
0,67
|
|
Etat civil
(divorcé/célibataire)
|
0,85
|
0,38
|
1,88
|
0,68
|
|
Etat civil (marié/célibataire)
|
741048,12
|
0,00
|
+ 8
|
0,97
|
|
Profession (professionnel de sere/agent de
l'Etat)
|
1,45
|
0,55
|
3,78
|
0,44
|
|
Rapports sexuels non proteges (Oui/Non)
|
0,89
|
0,54
|
1,48
|
0,67
|
|
Sere
|
1,02
|
0,66
|
1,58
|
0,91
|
|
Stade OMS (Stade IV/Stade I)
|
0,94
|
0,46
|
1,91
|
0,86
|
|
Tatouage (Non/Oui)
|
0,76
|
0,45
|
1,29
|
0,31
|
|
Transfusion (Non/Oui)
|
0,80
|
0,50
|
1,28
|
0,37
|
|
Vaccination (Non/Oui)
|
4,40
|
0,89
|
21,69
|
0,06
|
L'analyse multivariée faite sur le
modèle de régression logistique de toutes les
caractéristiques nous a permis d'identifier les facteurs
indépendants prédictifs de la survenue de l'hépatite B
(chez les PVVIH de Bukavu) suivants :
L'état civil/marié (OR : 741048 ; 13,5 [IC
0,00 > 1,0 E 12 ; p = 0,97]) présente un risque élevé
d'hépatite B par rapport au célibataire.
La vaccination/l'absence de la vaccination expose 4 fois
à l'hépatite B (OR : 4,4054 ; 1,4 p : 0,06) par rapport aux
vaccinés.
Chap. IV. DISCUSSIO~
La présente étude de cohorte
rétrospective a consisté à évaluer
l'épidémiologie et les déterminants de la co-infection
VIH/VHB à l'Est de la RD Congo dans la province du Sud-Kivu, district
sanitaire de Bukavu. Nous avons procédé à la comparaison
de deux groupes de PVVIH : ceux positifs au HBS (255) soit 54,3 % et ceux
négatifs au test HBS (215) soit 45,7%. Les patients de notre cohorte
sont tous pris en charge dans 3 CTA à savoir celui de Bagira, de Kadutu
et de la Pharmakina.
Ces résultats ont montré que plus de 50% de
la population d'étude sont positifs aux marqueurs HBS.
Ces résultats nous paraissent excessifs quand
nous les comparons à ceux de l'étude de JM Kabinda d'août
2008 où la prévalence de l'hépatite B était de 8 %.
Néanmoins, ces chiffres corroborent la tendance générale
de l'infection par le VHB qui varie selon les études entre 20 et 90% (1,
2, 55).
Ce taux se justifie aisément d'autant plus que
notre étude se déroule dans une zone de haute endémie de
l'hépatite B (2). Le Collège des universitaires de Maladies
infectieuses et tropicales avancent des chiffres qui confirment cette haute
endémicité : 95% des sujets ont des Ac anti HBS et 8 à 15%
sont des porteurs chroniques d'Ag HBS. Ceci confirme la prévalence
trouvée dans la population de notre étude (12).
En effet, au Sénégal, 85% des enfants
sont contaminés avant 15 ans et 95% des adultes possèdent au
moins un marqueur sérique de l'hépatite B. En outre, en Afrique
noire, 20% des adultes sont porteurs chroniques de l'HBS Ag (2).
En France 37,6% de la population atteinte du VIH
présentaient des marqueurs sérologiques qui témoignaient
d'une infection ou d'un contact ancien avec le VHB en 2004 (32).
La population des PVVIH de notre cohorte soumise
à la recherche du HBS ne représentent que 10,15% (470 pour un peu
plus de 4630 PVVIH) de l'ensemble des PVVIH suivies depuis 8 ans (2004-2011
dans les cliniques de prise en charge de Bukavu. Ceci confirme le peu
d'intérêt que les professionnels de
santé accordent à la recherche du VHB
dans la population des PVVIH de Bukavu. Cette situation s'observe aussi sous
d'autres cieux.
En effet, plusieurs auteurs rapportent le faible taux
de dépistage du VHB dans la population des PVVIH (2, 15). Si la
prévalence de l'hépatite B est élevée chez les
PVVIH, la recherche de l'hépatite B n'est pas systématiquement
recherchée dans la population VIH, ce qui justifie de faibles taux de
couverture en rapport avec le dépistage du VHB (1, 8, 15).
Age, sexe et VHB
Dans notre étude, l'âge moyen est de 39,0
ans. Ceci se rapporte à l'âge moyen général des
PVVIH sous traitement en RD Congo qui varie entre 30 ans et 45 ans. La
co-infection VIH/VHB touche cette même tranche d'âge. Cette
situation n'est pas différente dans plusieurs pays d'Afrique (Afrique du
Sud, Zambie, Burundi, Rwanda) où l'âge moyen varie entre 25 ans et
45 ans selon le rapport ONUSIDA 2010 sur le VIH dans le monde tandis qu'en
Europe, l'âge moyen se situe autours de 40 ans (57).
Si les hommes sont les plus nombreux à
contracter le VIH en Occident (du fait de la toxicomanie et de
l'homosexualité), en Afrique par contre les femmes sont plus nombreuses.
En RD Congo, elles représentent 56% des PVVIH. Ceci s'explique du fait
de leur vulnérabilité biologique, sociale et économique et
corrobore le fait que les femmes représentent 59,6% de la cohorte
d'étude. Celle-ci est la situation générale de l'Afrique
(2). En effet, les femmes constituent à la fois plus de 50% des PVVIH et
des co-infectées VIH/VHB. La tendance est différente en Occident
où les hommes représentent une plus grande
proportion.
Ceci serait lié au fait que la majorité
de VIH+ est constituée des usagers des drogues injectables et des
homosexuels qui sont surtout en Occident des hommes.
Les hommes représentent, en effet, plus de 60%
des co-infectés exception faite, quand cette population est
classée selon l'origine des patients ou dans le groupe des originaires
d'Afrique Subsaharienne (37,2 [IC 95% ; 31,7-43,2]) où les femmes
représentent la plus grande proportion. Une attention
particulière devrait donc être accordée aux femmes
co-infectées du fait du double risque de transmission verticale du VIH
et du VHB en Afrique et en RD Congo.
Prise en charge par les ARV et VHB
Concernant la prise en charge thérapeutique,
notre étude confirme que les PVVIH sont soumises au régime de
pays à ressources limitées (AZT + 3TC + NVP).
Aucun patient HBS+ ne recevait un traitement actif sur
l'hépatite B expressément prescrit. Cependant, 99,3% des patients
sous ARV recevaient une combinaison d'ARV dans laquelle il y a une
molécule active sur le VHB (la Lamivudine). Ceci serait lié au
manque des combinaisons d'ARV doublement actives sur le VIH et le VHB. Des
nombreux auteurs s'accordent sur le fait que l'inaccessibilité aux ARV
est un facteur limitant la prise en charge correcte du VIH et des co-infections
(1, 2).
La 3TC (300 mg/jr) entraîne la disparition de
l'ADN viral après 2 mois de traitement mais présente des grandes
risques de résistance virale chez 20 % des patients à 1 an et 66%
à 4 ans (1, 12, 18).
L'administration de la Lamivudine en
monothérapie antirétrovirale contre le VHB comme c'est le cas
chez nos co-infectés VIH/VHB induit constamment des mutations de
résistance vis-à-vis du VHB de l'ordre de 15 à 25% par an
et de 70 à 80% à 4 ans. Cet usage doit donc être
évité (1, 12, 32).
En France, 71 à 87% des PVVIH
bénéficient du traitement ARV actif contre le VHB tout en
bénéficiant en même temps du traitement du VIH (33). Cette
situation est l'idéal pour assurer une meilleure prise en charge par les
ARV de la co-infection VIH/VHB dans le contexte africain.
Des études plus approfondies devraient
évaluer le risque de résistance à la Lamivudine chez les
PVVIH sous ARV co-infectées VIH/VHB à Bukavu.
Cependant, la 3TC a pour avantage sa simplicité
d'utilisation et sa faible toxicité (31). L'arrêt brutal sans
relais par un traitement comporte un risque élevé de
réactivation virale avec rebond clinique et biologique de
l'hépatite B, parfois grave.
Bien que 99,3% de HBS+ de notre cohorte
reçoivent une molécule active sur le VIH et VHB, il
s'avère que cette monothérapie contre le VHB est dangereuse pour
les PVVIH co-infectées.
Vaccination et VHB
Le taux de vaccination contre l'hépatite B est
très faible chez les PVVIH de notre cohorte soit 2,6% seulement. Ce taux
est aussi faible dans plusieurs études faites chez les PVVIH. En France,
seulement 10,3% [8,2-12,9]) de VIH+ étaient vaccinés en 2004
(33).
Les résultats de l'analyse multivariée
dans notre étude a montré que l'absence de la vaccination contre
le VIH constitue un facteur de risque d'hépatite B chez les PVVIH de
Bukavu (OR : 4,40). Une littérature abondante confirme la place de la
vaccination dans la réduction des risques de l'hépatite B. Ces
risques varient en fonction de l'endémicité de l'infection. Ils
sont élevés dans les régions à haute
endémicité qui sont l'Afrique et l'Asie (2).
Les résultats de l'enquête Aquitaine
montrent que 22% des patients VIH ont été vaccinés contre
le VHB en France en 2006 (56).
Ce pourcentage est faible dans un contexte où
le plateau technique vaccinal est disponible. Ce taux est inconnu en Afrique
chez les PVVIH mais tout porte à croire qu'il est très faible
(2).
Des recommandations sont formulées dans
certains pays comme le Mali, le Sénégal et le Rwanda mais le
passage à l'échelle n'est pas effectif. Les résultats de
notre étude ne sont que l'image de cette situation. Signalons
néanmoins que cette vaccination est moins efficace chez les patients VIH
quand les LT CD4 sont inférieurs à 500 cellules/mm3
(32).
Il apparaît donc clairement que la vaccination
s'impose chez tous les PVVIH présentant un risque d'hépatite B
à Bukavu.
Les rapports sexuels a risque ou non
protégés
Les rapports sexuels non protégés se
retrouvent dans 81,6% de cas chez les HBS+. Bien qu'il ne soit pas un risque
(OR 1,17 [0,72-1,90]) par rapport à ceux ayant des rapports sexuels
protégés, il y a lieu de constater que d'autres études en
ont prouvé le risque.
Selon l'Institut National de Prévention et
d'Education pour la Santé (INPES), en 2005, en France 41% des nouveaux
cas présentaient des pratiques sexuelles à risque et le rapport
sexuel non protégé était confirmé comme facteur de
risque.
Des études plus poussées (Etude
d'incidence) permettraient de mieux appréhender le risque lié aux
rapports sexuels non protégés chez les PVVIH de
Bukavu.
Taux de CD4, Stade OMS du VIH et VHB
La moyenne des CD4 de notre étude était
de 284+194 elt/mm3. Dans cette cohorte, plus de 50% de patients
(57,1%) soumis au dépistage du VHB avaient des CD4 > 200
éléments/mm3. D'autre part, les PVVIH aux stades III
et IV de l'OMS pris ensemble représentaient 66% de la cohorte. Ceci
signifie que 66% des patients sont au Stade SIDA et sont donc en
immunodépression modérée et profonde.
L'analyse uni et multivariée n'a pas
trouvé de risque lié aux taux de CD4 surtout chez les patients
ayant des CD4 < à 200 elt/mm3 (OR : 1,02 ; p : 0,82), ni
au Stade clinique III (OR : 0,59 [0,31-1,13 ; p=0,11]) ni au Stade IV qui est
le stade d'immunodépression avancée (OR : 0,4 ; p :
0,86).
Ces résultats contredisent l'ensemble de la
littérature consacrée au facteur de risque de l'hépatite B
chez les PVVIH qui affirme que le risque d'hépatite B est
corrélé au Stade clinique du patient (1, 15). Il est aussi
affirmé que les PVVIH courent d'autant plus de risque de contamination
ou de réactivation du VHB que leur niveau immunitaire est bas. Ceci
s'expliquerait aussi par le fait que l'immunodépression induite par le
VIH favorise la réplication VHB. Les personnes VIH+ ayant des taux de
CD4 < 200 sont celles qui sont les plus à risque (1, 32, 33, 35).
Cette discordance peut s'expliquer dans notre étude par le fait que la
plupart de patients au stade III et IV sont déjà sous traitement
ARV qui améliore leur réponse immunitaire en empêchant (1)
soit la séroconversion VHB soit encore la réactivation du
VHB.
Cependant, le niveau de réplication virale (qui
justifie l'infection) n'est pas toujours corrélé au taux de LT
CD4 circulants mais dépend essentiellement de l'ancienneté de
l'infection par le VHB (1, 31, 32). Bien qu'il soit difficile dans notre
étude de déterminer la durée de portage de l'Ag HBS, nous
pouvons penser que la plupart de co-infectés étaient nouvellement
infectés.
Cependant, des informations complémentaires
seraient nécessaires pour corréler aisément ces
paramètres (taux CD4 et Stade OMS) à la positivité de l'Ag
HBS. Des études prospectives seront nécessaires pour cette
fin.
La profession et le VHB
L'analyse uni et multivariée des
catégories professionnelles avec le HBS n'a pas montré qu'il
existait une différence statistiquement significative selon la
profession (p : 0,51).
Ces résultats contredisent l'ensemble de la
littérature (32, 33) qui affirme qu'il existe un risque
d'hépatite B en fonction de la profession. Il est, en effet,
rapporté que certains métiers présentent des risques. Il
s'agit des professionnels de sexe et des travailleurs du domaine médical
(2, 33).
Des études avec un design différent
permettraient de mieux apprendre ce risque. La corrélation est ici
difficile dans une étude rétrospective.
Etat civil et VHB
L'analyse multivariée a identifié un
risque élevé d'hépatite B chez les PVVIH mariés par
rapport aux célibataires (OR : 741048, 12). Les PVVIH mariés
présentent donc un risque élevé d'avoir des Ag HBS+. Cela
reviendrait donc à déduire que la transmission serait surtout
sexuelle chez les PVVIH de notre cohorte. L'association entre le fait
d'être marié et le risque d'infection à VHB n'est pas
clairement établie. La transmission étant surtout parentale en
Europe (1, 2, 12, 32, 33), le risque lié au fait d'être
marié identifié chez les PVVIH de notre cohorte dans un contexte
épidémiologique africain pourrait s'expliquer par le fait que la
plupart de ces patients sont mariés à des partenaires eux aussi
VIH+. On sait que le risque d'hépatite B est élevé chez
les PVVIH (1, 2, 55).
Il faudrait cependant des études plus
approfondies pour expliquer le risque lié
à l'état
civil des PVVIH à Bukavu. Ce résultat pourrait aussi être
influencé par
le fait que notre cohorte est constituée en
majorité par des PVVIH mariées.
CONCLUSION
L'étude de la co-infection VIH/VHB recherchait
à établir les profils épidémiologiques et les
déterminants de la co-infection VIH/VHB à Bukavu.
Il s'agissait d'une étude analytique de cohorte
rétrospective. Les paramètres et les caractéristiques
sociodémographiques, ceux liés à l'état immunitaire
des PVVIH et à la vaccination contre le virus de l'hépatite B ont
été analysés. Les facteurs de risque de l'hépatite
B ont été recherchés au moyen d'une comparaison entre
patients VIH+ séropositifs au HBS (255) et ceux ayant des
résultats d'HBS négatifs (215).
La modélisation du risque d'hépatite B
dans la population des PVVIH a été réalisée dans
une régression logistique multiple. Une valeur inférieure
à 0,05 définissant le seuil de signification.
A l'issue de cette étude, il apparaît que
:
· La recherche de l'hépatite B
n'était réalisée qu'auprès de 10,1% des PVVIH
;
· Les PVVIH co-infectées ne
reçoivent pas d'ARV spécifiques pour le traitement du VIH et du
VHB mais sont sous monothérapie anti VHB, ce qui est dangereux pour leur
avenir thérapeutique ;
· La transfusion sanguine, les rapports sexuels
non protégés et le tatouage n'ont pas été retenus
comme des facteurs de risque tant par l'analyse univariée que par la
multivariée ;
· L'immunodéficience profonde (LT CD4
> 200 elt/mm3), les stades OMS (III et IV), le sexe et
l'âge ne semblaient pas affecter significativement le risque
d'hépatite B, contrairement aux données de la littérature
;
· Le fait d'être marié
opposé au célibat et l'absence de la vaccination versus la
vaccination contre l'hépatite B constituent des facteurs de risque de
l'hépatite B dans la population des PVVIH de Bukavu.
Le profil épidémiologique de la
co-infection VIH/VHB est donc celui d'un patient VIH+, de 39 ans d'âge
moyen, de sexe féminin, non vacciné contre l'hépatite B,
d'état civil marié.
Vu le design de cette étude et la
méthode d'échantillonnage, les autres facteurs de risque ne
pouvaient clairement se dégager. Elle a cependant le mérite de
poser les jalons des études d'incidence et des études
expérimentales sur la co-infection VIH/VHB à Bukavu.
RECOMMANDATIONS
A la lumière de nos conclusions, les
recommandations suivantes méritent d'être formulées
:
· Au Programme National de Lutte contre le SIDA
(PNLS) : Coordination Nationale et Pro vinciale
- De considérer l'hépatite B comme une
infection majeure qui touche les PVVIH et de mettre sur pied des
stratégies appropriées pour son contrôle ;
- De faire un consensus national sur la
prévention, le dépistage et la prise en charge de la co-infection
VIH/VHB ;
- D'accroître l'accessibilité des PVVIH aux
moyens diagnostics, thérapeutiques et de suivi de la double infection
VIH/VHB ;
- De favoriser la recherche sur le VIH et les
hépatites.
· Aux CTA et aux Centres de prise en charge des
PVVIH/SIDA :
- De renforcer des messages de prévention pour
prévenir la contamination par le VHB chez les PVVIH ;
- De rechercher systématiquement une infection
à VHB lors de la découverte d'une infection à VIH
;
- D'assurer le maintien d'une surveillance
sérologique régulière au moins une fois l'an, chez les
PVVIH négatives exposées ;
- De vacciner contre le VHB les patients non
immunisés. Les PVVIH non répondeuses à un premier
protocole vaccinal devraient être revaccinées ;
- D'évaluer l'atteinte hépatique et la
fibrose. Il faut pour cela des tests biochimiques explorant la fonction
hépatique, des tests anatomo pathologiques et même des examens
d'imagerie médicale ;
- La décision de l'indication du traitement de
l'hépatite B chez les PVVIH se passera dans le cadre d'une concertation
pluridisciplinaire ;
- Rechercher la pluri infection VIH/VHB/VHC/VHD/VHA
;
- La stratégie thérapeutique suivante
nécessiterait d'être évaluée :
>
Le dépistage et le traitement précoces du VIH et du VHB
;
> Le 3TC plus le TDF ayant une action anti VHB et
anti VIH, les trithérapies antirétrovirales doivent
intégrer le traitement concomitant et efficace du VIH et du VHB
;
> La monothérapie anti VHB devrait être
évitée ;
> Une évaluation particulière et des
traitements adéquats devraient être proposés aux femmes
VIH+ en âge de procréation étant donné le risque de
transmission verticale des deux virus ;
> Toute personne sans aucun marqueur du VHB doit
être vaccinée contre le VHB et les patients Ag HBS+ doivent
être traités pour leur infection à VHB ;
> Une surveillance au moins trimestrielle des
transaminases et de la CV du VHB doit être réalisée. La
recherche de l'Ag HBS doit être faite tous les 6 mois pour
apprécier une perte de ce marqueur puis l'acquisition des anticorps anti
HBS ;
> Il faudrait assurer l'accès aux conseils de
prévention de l'hépatite B aux PVVIH.
BIBLIOGRAPHIE
1. Pierre Marie GIRARD & al., VIH Edition 2007,
Ed. Dion, 2007, 727 pges gilles Pialoux & al., Co-Infection par le VIH et
le virus des Hépatites B ou C, In HIV Edition 2007, Ed, dion, 2007, p
728
2. Marc Gentilini, Eric Caumes, Médecine
Tropicale, 5è Edition, Flammarion, 2005, p 928.
3. Hervé Zylberberg, Stanislas Pol, Histoire
naturelle de l'infection virale B Médecine thérapeutique, 1998,
Hépatite virale B, 4(1) : 21-20.
4. Christine Larsen, Gilles Pialoux, et al.,
Prévalence des co-infections par les virus des hépatites B et C
dans la population VIH+, France,bulletin épidémiologique
hebdomadaire,n° 22/2005 ;juin 2005
5. Bonacini M, Louie S, Bzowej N, Wohl AR. Survival in
patients with HIV infection and viral hepatitis B or C: a cohort study. AIDS
2004;18(15):2039-45.
6. Graham CS, Baden LR, Yu E, Mrus JM, Carnie J, Heeren
T, Koziel MJ.Influence of human immunodeficiency virus infection on the course
of hepatitis C virus infection: a meta-analysis. Clin Infect Dis 2001;
33(4):562-9.
7. Maite Gutie'rrez,Pilar Tajada, et al., Prevalence
of HIV-1 Non-B Subtypes, Syphilis,HTLV, and Hepatitis B and C Viruses
AmongImmigrant Sex Workers in Madrid, Spain,Journal of Medical Virology
74:521-527 (2004),
8. Rochat TJ, Richter LM, Doll HA et al. Depression
among pregnant rural South African women undergoing HIV testing. JAMA 2006; 295
: 1376 - 80
9. Sterling RK, Sulkowski MS,Hepatitis C virus in the
setting of HIV or hepatitis B virus co-infection, Richmond, 2004;24 Suppl
2:61-8 , Virginia, PMID: 15346248
10. S. Gloria Selabe, Azwidowi Lukhwareni, et al.;
Mutations Associated
With Lamivudine-Resistance in
Therapy-Naý·ve Hepatitis B Virus (HBV) Infected patients With and
Without HIV Co-Infection: Implications for
Antirétroviral Therapy in HBV and HIV Co-Infected
South African Patients, Journal of Medical Virology, 2007, 79
:1650-1654
11. Dao S, Ba A., et al, marqueurs biologiques des virus
des hépatites B et C (VHB ET VHC), Médecine d'Afrique Noire,
2007.
12. Collège des universitaires de maladies
infectieuses et tropicales, E.PILY, Maladies infectieuses et tropicales,
21ème édition, 2008, Vivactis Plus, Paris, 2008, p
736
13. Lincoln D, Petoumenos K, Dore GJ,HIV/HBV and
HIV/HCV co-infection, and outcomes following highly active
antirétroviral therapy ,National Centre in HIV Epidemiology and Clinical
Research,, Australia Arch Intern Med. 2006;166:1632-1641.
14. Weber R, Sabin CA, Friis-Moller N et al.:
Liver-related deaths in persons infected with the human immunodeficiency
virus:the D:A:D study. Arch Intern Med. 2006;166:1632-1641.
15. Kaharuza FM, Bunnell R, Moss S et al. Depression
and CD4 cell count among persons with HIV infection in Uganda, AIDS Behav 2006;
IO : S105- 11
16. Gibbie T, Mijch A, Ellen S et al. Depression and
neurocognitive performance in individuals with HIV/AIDS : 2 Years follow up,
HIV Medecine 2006 ; 7 : 112-21.
17. J-M Dariosecq, A-M.Thaburet,P.M Girard,Memento
thérapeutique du VIH 2009,Dion ,juin 2009, p 470
18. P.Yeni, prise en charge des personnes
infectées par le VIH, recommandations du groupe
d'experts.Médecine-sciences Flammarion, juillet 2008, p 412
19. Weber R, Sabin CA, Friis-Moller N et al.:
Liver-related deaths in persons infected with the human immunodeficiency
virus:the D.A.D study. Arch Intern Med. 2006;166:1632-1641.
20. Salmon-Ceron D, Lewden C, Morlat P et al.: Liver
disease as a major cause of death among HIV infected patients: role of
hepatitis C and B viruses and alcohol. J Hepatol. 2005; 42:799-805.
21. Benhamou Y: Antirétroviral therapy and
HIV/hepatitis B virus co-infection. Clin Infect Dis. 2004; 38 (Suppl .2):
S98-S103.
22. Margaret James Koziel, Marion G Peters, Viral
Hepatitis in VIH Infection, New England Jmed 356, 1445-54, 2007 .
23. Valsa Madhava et all, How much hepatitic C in
Africa, The Lancet infectious disease, Vol 2 (5) may 2002, p 293
24. Karen Den Besten, HIV epidemiology, pathogenesis,
opportunistic infections, treatment and prevention, Journal Médical des
grands lacs, 2002, p 19.
25. Rapport Banque de sang HPGRB, 2005,
Bukavu
26. Margolis HS, Alter MJ, Hadler SC, Viral
hepatitis, In Evans AS, Kaslow RA (eds), Viral infections of humans,
Epidemiology and control (Fourth Edition), New York, Plenum Publishing
Corporation, 1997: 363 - 418.
27. Christine Larsen, Gilles Pialoux, et al.,
Prévalence des co-infections par les virus des hépatites B et C
dans la population VIH+, France, juin 2004,bulletin
épidémiologique hebdomadaire, num 22/2005 ;juin 2005.
28. Margolis HS, Alter MJ, Hadler SC, Viral
hepatitis, In Evans AS, Kaslow RA (eds). Viral infections of humans,
Epidemiology and control (Fourth Edition). New York, Plenum Publishing
Corporation, 1997 : 363 - 418.
29. Okada K et al, E antigen and anti-e in the serum
of asymptomatic carrier mothers as indicators of positive and negative
transmission of hepatitis B virus to their infants, New England Journal of
Medicine, 1976, 294 : 746 - 749
30. Unek CJ, Oggbu O. Inyama PUL, Anyanvu G1, al,
Prevalence of hepatitis
B surface antigen among blood donors and human
immunodeficiency virus infected patients in Jos, Nigeria, Mem Inst. Oswaldo
curz, 2005, 100 : 13-6.
31. Pr. Patrick YENI, Rapport 2010 sur la prise en
charge médicale des personnes infectées par le VIH
Recommandations du groupe d'experts La documentation française,
Ministère de la Santé et des Sports, Paris, 2010,
32. Larsen C, Pialoux G, Salmon D et al.
Prévalence des co-infections par les virus des hépatites B et C
dans la population VIH, France, juin 2004. Bull Epidemiol Hebd, 2005, 23 :
109-112.
33. Piroth L, Sene D, Pol S et al. Epidemiology,
diagnosis and treatment of chronic hepatitis B in HIVinfectedpatients (EPIB
2005 STUDY). AIDS, 2007, 21 : 1323-1331.
34. McHutchison JG, Everson GT, Gordon SC et al.
Telaprevir with peginterferon and ribavirin for chronic HCV genotype 1
infection. N Engl J Med, 2009, 360 : 1827-1838.
35. Soriano V, Barreiro P, Nunez M. Management of
chronic hepatitis B and
C in HIV-coinfected patients.J Antimicrob Chemother,
2006, 57 (5): 815- 818.
36. Nunez M, Soriano V. Management of patients
co-infected with hepatitis B virus and HIV. Lancet Infect Dis, 2005, 5:
374-382.
37. Konopnicki D, Mocroft A, de Wit S et al. Hepatitis
B and HIV: prevalence, AIDS progression, response to highly active
antirétroviral therapy and increased mortality in the Eurosida cohort.
AIDS 2005, 593-601.
38. Dieterich DT. Special considerations and treatment of
patients with HBVHIV co-infection. Antivir Ther, 2007, 12 Suppl 3 :
H43-51.
39. Gilson RJ, Hawkins AE, Beecham MR et al.
Interactions between HIV and hepatitis B virus in homosexual men : effects on
the natural history of infection. AIDS, 1997, 11 : 597-606.
40. Lacombe K, Massari V, Girard PM et al. Major role
of hepatitis B genotypes in liver fibrosis during co-infection with HIV. AIDS,
2006, 20 : 419-427.
41. Nikolopoulos GK, Paraskevis D, Hatzitheodorou E
et al. Impact of hepatitis B virus infection on theprogression of AIDS and
mortality in HIV-infected individuals : a cohort study and meta-analysis.Clin
Infect Dis, 2009, 48 : 1763-1771.
42. Bottero J, Lacombe K, Guechot J et al.
Performance of 11 biomarkers for liver fibrosis assessment inHIV/HBV
co-infected patients. J Hepatol, 2009, 50 : 1074-1083.
43. Miailhes P, Pradat P, Chevallier M et al.
Proficiency of transient elastography compared to liver biopsy for the
assessment of fibrosis in HIV/HBV-coinfected patients. J Viral Hepat,
2010.
44. Larsen C, Pialoux G, Salmon D et al.
Prévalence des co-infections par les virus des hépatites B et C
dans la population VIH+, France, juin 2004. BEH, 2005 : 109-112.
45. Benhamou Y, Fleury H, Trimoulet P et al.
Anti-hepatitis B virus efficacy of tenofovir disoproxil fumarate in
HIV-infected patients. Hepatology, 2006, 43 : 548-555.
46. Lacombe K, Gozlan J, Boelle PY et al. Long-term
hepatitis B virus dynamics in HIV-hepatitis B virusco-infected patients treated
with tenofovir disoproxil fumarate. AIDS, 2005, 19 : 907-915.
47. RESAPSI, Mémento thérapeutique du
VIH/SIDA en Afrique, 2005, Dion éditeurs, Paris, 2005, 242
p.
48. Benhamou Y., Katlana C, Lunel F et al., Effects
of lamivudine on replication of hépatite B virus in HIV-infected men.
Ann inten Med, 1996, 125: 705-712.
49. Alfred M. Rockstroh JK, Addo M & al,
Reactivation of hépatitis B in a long term anti HBS positive patients
with AIDS following lamivudine vithdrawal, J.Hepatol, 1998, 29:
306-309
50. Benhamou Y. Katlama C, lunel F et al. Effect of
lamivudine on replication of hépatitis B virus in HIV-infected men, Ann.
Intern Med, 1996, 125 : 705- 712.
51. Ching Lung Lai, Vlad.Ratjûr, Man Fung Yeun,
al, viral hepatitis B, lancet 2003, Vol 362, 2089-94
52. Chloc L.Thio, Eric C. Seaberg, VIH1, hepatitis B
virus, and risk of liver-related mortality in the multicenter cohort study, The
lancet, 2002, vol 360.
53. Ministère de la Santé
publique/Secrétariat Général, Plan Stratégique de
lutte contre le VIH et le SIDA du secteur de la santé (2008-2012),
janvier 2008, inédit, p 107.
54. PNMLS, Plan stratégique national de lutte
contre le SIDA 2010-2014, janvier 2010, inédit, p 84.
55. J.M-Kabinda, B.-Katchunga, Les hépatites
virales B et C chez les porteurs du virus de l'immunodéficience humaine
à Bukavu (Sud-Kivu, République Démocratique du Congo),
Journal africain d'hépatogastroentérologie, 2010, 4 (4) :
230-235.
56. Winno Neav D, Castera L et al. Hepatitis B
vaccination in HIV infected patients : a survey of physicians and patients
participating in the Aquitaine cohort. Gastroenterol Clin Biol, 2006, 30 :
189-195
57. Conseil National du SIDA (CNS), rapport sur
l'évaluation du dispositif de dépistage de l'enfant par le VIH en
France, novembre 2006.
TABLE DES MATIERES
EPIGRAPHE I
DEDICACE II
AVANT-PROPOS III
SIGLES ET ABREVIATIONS IV
RESUME VII
Chap. 0. INTRODUCTION GENERALE 1
00. Introduction 1
1. Revue de la littérature 3
2. Problématique 9
3. Question de recherche 12
4. Hypothèses 13
5. Objectifs de l'étude 13
05.1. Objectif général 13
05.2. Objectifs spécifiques 13
Chap. I. PATIENTS ET METHODES 14
1.1. Cadre et type d'étude 14
1.1.1. Cadre d'étude 14
1.1.2. Type d'étude 15
1.2. Cadre conceptuel de la recherche 16
1.3. Définition opérationnelle des concepts
17
1.4. Echantillonnage et population d'étude
17
1.4.1. Sélection des patients 18
1.4.2. Taille de l'échantillon 19
1.4.3. Technique de collecte des données
19
1.5. Durée de l'étude 20
1.6. Plan de collecte des données 20
1.7. Plan de traitement et analyse des données
20
1.8. Considérations éthiques 21
1.9. Impact prévu 21
1.10. Limites et difficultés 22
Chap. II. GENERALITES SUR LA CO-INFECTION VIH/VHB
23
II.1. Epidémiologie de la co-infection VIH/VHB
23
II.2. Histoire naturelle de la co-infection VIH/VHB
24
II.3. Diagnostic et bilan de l'hépatite B chez
les co-infectés 25
II.4. Traitement de la co-infection VIH/VHB
27
II.5. Surveillance du traitement 31
II.6. Vaccination contre l'hépatite B
31
Chap. III. PRESENTATION DES RESULTATS 33
III.1. Caractéristiques générales de
la population d'étude 33
III.1.1. Caractéristiques
sociodémographiques 33
III.1.2. Caractéristiques immuno-virologiques
35
III.1.3. Caractéristiques relatives à
l'hépatite B 37
III.2. Analyse des facteurs de risque 38
III.2.1. Evaluation des risques liés au mode de
contamination de
l'hépatite B 38
III.2.2. Evaluation des risques liés aux facteurs
sociodémogr 39
III.2.3. Evaluation des risques en rapport à la
vaccination anti-VHB 40
III.2.4. Risques de l'hépatite B en fonction
de l'état immuno-virol 41
III.3. Analyse multivariée 42
Chap. IV. DISCUSSION 43
CONCLUSION ET RECOMMANDATIONS 49
BIBLIOGRAPHIE 52
TABLE DES MATIERES 58
Annexes
Annexe n° 1 : Questionnaire d'enquête
Sujet : La co-infection VIH/VHB : Profil
épidémiologique et déterminants. Cas du District sanitaire
de Bukavu »
Numéro : Nom CTA : I. Caractéristique
socio-démographiques des PVVIH
Données générales
Nom et prénom ou Code patient :
Sexe : M F
Age :
Profession : Sans Agriculteur Commerçant
PS
Ouvrier Agent d'Ese Agent de l'Etat
Transporteur Policier/Militaire
Chômeur


Ibanda Domicile actuel : Milieu urbain Bagira
Kadutu
Milieu rural
Etat civil : Marié Célibataire
Divorcé Veuf (Veuve)
Informations en rapport avec le dépistage
VHB
Année de dépistage : Durée de la
séropositivité
année = 1 an
2 - 5 ans
6 - 10 ans
plus de 10 ans
Sous ARV ? Oui Non
Depuis quand sous ARV Durée TARV
|
|
|
|
|
= 1 an
2 - 5 ans
6 - 10 ans
plus de 10 ans
|
|
|
année
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Schéma d'ARV actuel
Informations en rapport avec l'état immunitaire
Taux de CD4 mm3
Stade OMS du patient : Stade 1
Stade 2
Stade 3
Stade 4
Informations en rapport avec Pllepatite B
Vaccination anti-Hépatite B : Oui
Non
Sérologie VHB (Hbs) : Oui Non
Traitement reçu contre Hépatite B
expressément prescrit (traitement spécifique VHB):
Oui Non
Antécédent de transfusion : Oui
Non
Antécédent de tatouage : Oui
Non
Rapports sexuels non protégés : Oui
Non
Partenaire sexuel PVVIH : Oui Non
Schéma ARV contenant une molécule active
sur l'Hépatite B :
Oui Non
Antécédent d'hépatite aiguë :
Oui Non
Transaminases : Normales Anormales
Valeur transaminase
Annexe n° 2 : Liste des tableaux et figures
a) Liste des tableaux
Tableau n° 1 : Définition
opérationnelle des variables de l'étude sur la co~infection
VIH/VHB 17
Tableau n° 2 : Classification de la fibrose
hépatique selon Metavir et dishak 28
Tableau n° 3 : Caractéristiques liés
à l'âge, au sexe, à l'état civil, au domicile et
à la profession de la
population d'étude 34
Tableau n° 4 : Caractéristiques liés
au CD4, au Stade OMS, au TARV 35
Tableau n° 5 : Caractéristiques liés
à la vaccination contre l'hépatite B et la sérologie HBS
37
Tableau n° 6 : Risque lié à la
transfusion, au tatouage et au rapport sexuel non protégé
38
Tableau n° 7 : Risque lié au sexe, à
l'âge, à la profession, au domicile et à l'état
civil 39
Tableau n° 8 : Risque lié à la
vaccination 40
Tableau n° 9 : Risque lié au Stade clinique
et au CD4 41
Tableau n° 10 : Analyse multivariée des
facteurs de risque de l'hépatite B chez les PVVIH de Bukavu
42
b) Liste des figures
Figure n° 1 : Cadre conceptuel 16
Figure n° 2 : Taux de dépistage dans la
population des PVVIH soignées dans les CTA de l'étude
(4630 personnes) 33
Figure n° 3 : Schéma de traitement
antirétroviral contre le VIH 36
I
EPIGRAPHE
« Ce qui m'effraie, ce n'est pas l'oppression des
mechants ;
c'est l'indifference des bons P
Martin Luther King
II6
DEDICACE
A toi ami ,
Patrick MUYENDWE M.,
Complice et
conseiller,
Compagnon d'école d'Hippocrate.
A toi ami,
Dont le
souvenir de vitalité nous revient sans cesse,
A toi, que le destin
nous prît,
A l'aube de l'achèvement de nos rêves,
De
nos aspirations de blouse blanche.
A toi ami, dont le temps n'a pas terni
les souvenirs ;
A toi, Paix éternelle.
PP L M.
III
REMERCIEMENTS
Ce travail ne pouvait être réalisé
sans le concours de plusieurs personnes : Notre gratitude va donc vers toutes
les personnes qui ont contribué à sa
matérialisation.
Notre gratitude va premièrement ou Professeur
Dr MUNYANGA M. et au CT Dr KABINDA M. Jeff qui ont dirigé avec
conscience et rigueur nos investigations. Merci de nous avoir conduit et
éclairé à chaque étape. Et merci d'avoir
comblé nos limites.
Merci à nos enfants, Marc-Prince ANSIMA L.,
Marie-Thérèse AMBIKA L. et Marie-Grâce AKONKWA pour avoir
accepté les sacrifices d'un père passionné de la
médecine et de Santé Publique.
Une pensée spéciale à notre
épouse, Dr Lilly CISHAGALA, pour avoir grandement contribué
à la réalisation des enquêtes dans les CTA/VIH.
Un grand merci au CT Gustave LUNJWIRE, notre
père, pour ses conseils et orientations, à notre mère
Jacqueline BALIMWABO, à nos beaux-parents, Cyprien et Marie Goreth
CISHAGALA ; à nos frères et soeurs Ir. Julien LUNJWIRE et
Pauline, à Astrid et Ir. Guillaume BISIMWA; à Ir. Déo et
Sifa LUNJWIRE, Tino et Yvette LUNJWIRE, Maître Xavier L., Mathilde L.,
Jonas C., Joëlle L., Rosalie L., Lydia, Roseline, Grâce et Robert
pour leurs encouragements.
Merci au Dr Denis KIKOBYA Sambili, à Mr
François KAJIRAMUGABI, à Senghor GURHANENWA, à
Fidèle BISIMWA pour leurs riches contributions
scientifiques.
Merci enfin, au Dr Livingstone MUGISHO B., au Dr
Bijoux BULINDI B., au Dr Blandine NDETURUYE, au Dr Freddy NDONGOZI, au CT
MUDIMBA LAMATA, au Dr André NTABOBA, à Mr Rodrigue TACO L., Dr
Augustin MILABYO et aux collègues de l'ERSP/UCB, 1ère
Promotion Santé Publique pour l'amitié et la
fraternité.
SIGLES ET ABREVIATIONS UTILISES
3TC : Lamivudine
ABC : Abacavir
Ac anti-HBs : Anticorps de l'hépatite
ADN : Acide
Désoscyrubonucléique
Ag HBS : Antigène HBS
ARV : antirétroviral
AZT : Zidovudine
BM : Banque Mondiale
CD4 : Classe de différentiation 4
CD8 : Classe de différentiation 8
CELPA : Communauté des Eglises Libres de
Pentecôte en Afrique
CPTS : Centre provincial de transfusion
sanguine
CRP : Centre de Recherche Pédagogique
CTA : Centre de Traitement Ambulatoire
CV : Charge virale
d : degré
DDI : Didanosine
Ed. : Edition
elt : élément
FM : Fonds Mondial
FTC : Entricitabine
HAART : Hight Active Antiretroviral Therapy
I.O : Infection Opportuniste
IC : Intervalle de confiance
IST : Infection Sexuellement Transmissible
jr : jour
L/r : Lopinavir / Ritonavir
log : logarithme
LT : Lympocytes T
MAP/BM : Multicountry AIDS Project / Banque Mondiale mg :
milligramme
mL : Millilitre
mm3 : millimètre cube
n : nombre
NVP : Nevirapine
OMS : Organisation Mondiale de la
Santé
ONUSIDA : Organisation des Nations Unies de lutte contre
le Sida
OR : Odd ratio
p : page
p : valeur p
PCR : Polymerase chain reactive
PNLS : Programme National de Lutte contre le
Sida
PNMLS : Programme National Multisectoriel de lutte contre
le Sida
PNUD : Programme des Nations Unies pour le
Développement
PVVIH : Personne vivant avec le VIH
RD Congo : République Démocratique du
Congo
VI
RESAPSI : Réseau Africain des Praticiens du
Sida
SIDA : Syndrome d'Immunodéficience
Acquise
TARV : Traitement antirétroviral
UI : Unité Internationale
VHB : Virus de l'hépatite B
VHC : Virus de l'hépatite C
VHD : Virus de l'hépatite D
VIH- : VIH négatif
VIH : Virus de l'immunodéficience
humaine
VIH+ : VIH positif
% : Pourcentage
< : Inférieur
< : Inférieur ou égal
= : Egal
> : Supérieur ou égal
> : Supérieur
+ : Plus ou moins
VII
RESUME
Problématique :
L'épidémiologie et les déterminants de l'infection
à VHB ne sont pas connus dans la population des PVVIH de Bukavu. On sait
que les PVVIH présentent un risque élevé d'hépatite
B et l'évaluation de ce risque mérite d'être faite ainsi
que l'évaluation de l'accès au traitement ARV
spécifique.
Objectifs : Déterminer le profil
épidémiologique ainsi que les déterminants de
l'infection à hépatite B chez les
séropositifs au VIH de Bukavu
Méthodologie : Il s'agit d'une
étude d'observation de cohorte rétrospective. Les
paramètres et les caractéristiques sociodémographiques,
ceux liés à l'état immunitaire des PVVIH, et ceux
liés à la vaccination contre le VHB ont été
analysés. Les facteurs de risque de l'hépatite B ont
été recherchés en comparant les PVVIH avec HBS positif
(255) à ceux ayant des résultats d'HBS négatif (215). Le
risque d'hépatite B chez les PVVIH de Bukavu a été
modélisé dans une régression logistique multiple. Une
valeur de p < 0,05 définissait le seuil de signification
statistique.
Résultats : Notre étude a
montré que les femmes constituent 59,6 % (IC 55,0 -
64,0) de la population d'étude et l'âge
moyen de la cohorte était de
39,0 + 10,4.
Le dépistage du VHB a été
réalisé chez 10,1 % de PVVIH de Bukavu. En analyse
univariée, aucun facteur de risque n'a été
identifié mais il existait une différence statistiquement
significative entre les vaccinés et les non vaccinés (p =
0,04).
L'analyse multivariée a clairement mis en
évidence les risques liés à la non vaccination (OR :
4,4053 [0,8946-21,6935 ; p = 0,0683]) et celui lié au fait d'être
marié vs célibataire (OR : 741048,1287 [0,000 > 1,0E12 ; p =
0,9760])
Conclusion : Le dépistage du VHB n'est
pas systématiquement réalisé chez les PVVIH de Bukavu. Les
PVVIH co-infectés ne reçoivent pas de traitement approprié
contre le VHB. Le risque d'hépatite B est élevé chez les
PVVIH non vaccinés contre l'hépatite B et chez les PVVIH
mariés.
| 


