|

UNIVERSITÉ DE KOLWEZI
FACULTÉ DE MÉDECINE
DÉPARTEMENT DE PEDIATRIE
PROFIL PLAQUETTAIRE DU NOUVEAU-NE A TERME A L'HOPITAL SENDWE DE
LUBUMBASHI
Par : CHEGNINZEBOU NGOMSI DIEUNEDORT
BLESTEL
Mémoire présenté et défendu en vue
de
l'obtention du grade de Docteur en Médecine
Année Académique 2022-2023

UNIVERSITÉ DE KOLWEZI
FACULTÉ DE MÉDECINE
DÉPARTEMENT DE PEDIATRIE
PROFIL PLAQUETTAIRE DU NOUVEAU-NE A TERME A L'HOPITAL SENDWE DE
LUBUMBASHI
Par : CHEGNINZEBOU NGOMSI DIEUNEDORT
BLESTEL
Mémoire présenté et défendu en vue
de
l'obtention du grade de Docteur en Médecine
Directeur : Pr MONGA KALENGA JOSEPHINE
Année Académique 2022-2023
I
EPIGRAPHE
« Conserver la santé et guérir les
maladies : tel est le problème que la médecine a posé
dès son origine et dont elle poursuit encore la solution
scientifique. »
-Claude Bernard
II
DEDICACE
Je dédie ce mémoire :
A mes chers parents,
M. NGOMSI Jean et Mme NGANTCHOM Romaine
Voici, je mets entre vos mains, le fruit de longues années
d'étude, de longs mois de distance de votre amour de votre tendresse, de
longs jours d'apprentissage. Loin de vous, votre soutien m'a donné la
force pour persévérer dans la vie.
A mes frères et soeurs,
Dr Pierrette, Martial, Cyril, Sorel, Ariane, Merveille
Merci d'avoir pris soin de moi depuis mes premiers cris, votre
amour, vos encouragements dans mes moments de doute, votre soutien
inconditionnel m'ont façonné et m'ont donné la force
d'avancer.
A la famille Sopbwe Achille,
Merci, grâce à vous mon rêve a pris vie, merci
de m'avoir fait confiance. Vous avez été présents à
mes côtés pour m'encourager et me soutenir sur tous les plans. Ce
travail traduit ma gratitude et mon affection, ceci est votre
réussite.
A mes tantes et oncles,
Mamans : Monique, Lucienne, Flore, Nadège, Rosette... ;
Tontons : Valère, Jacques, Hervé... merci pour votre soutien.
A mes cousins et cousines,
Dr Yannick, merci de m'avoir offert mon premier livre de
médecine. Dr Rodrigues, tata Edwige, Trésor, Luciole, Franck,
Jeanne d'Arc, Pélagie, Inès vos encouragements m'ont
galvanisé.
III
A mes neveux et nièces,
Crépin, Kéliane, Emilie, Grace, Evann, Isaac,
Freddy, Zoé et tous les autres aucun mot ne pourrait exprimer à
leur juste valeur l'amour que je vous porte.
A mes amis,
Dr Patricia, merci pour ta présence et ton précieux
soutien.
Christian Betrobo, Serge Dewa, Franck Djeutow, Junior Yansen,
Dieudonné, Armand Yandal, Guy Mbassi, Darile Kouam, Christian Bete.
Edlyne Pigha, Nelissa Feudjio, Roddy Mwad, Ornella Signing,
Hilary Djepeng.
Au nom de nos souvenirs inoubliables, je nous souhaite une vie
pleine de bonheur et de réussite.
A la famille Kasongo
Vous avez été d'une hospitalité sans
précédent à mon égard recevez toute ma
gratitude.
A ceux qui ont fermé les yeux,
Dr Kamgang Alain, Papa Nynkam, grands-pères et
grand-mères...j'aurai tant aimé que vous soyez
là.
IV
REMERCIEMENTS
Au bout de ce travail qui met fin à notre formation en
médecine générale à l'université de Kolwezi,
nous rendons grâce au Seigneur Dieu Tout-Puissant, pour la grâce
qu'il a accordé à nous et à notre famille.
Nous témoignons notre reconnaissance à notre cher
maître,
Professeur Docteur MONGA JOSEPHINE pour avoir accepté
la direction lors de cet exercice laborieux malgré le temps
précieux.
Nos remerciements s'adressent également à tout
le personnel académique et administratif de l'université de
Kolwezi, pour leur accompagnement.
Nous tenons à exprimer notre profonde gratitude et
reconnaissance à tout le personnel de l'Hôpital provincial
général de référence JASON SENDWE de Lubumbashi
pour l'accueil et l'encadrement durant notre stage de seize mois ;
Nous citons particulièrement ici le Médecin
directeur
Le médecin directeur adjoint
Le chef de service de gynéco obstétrique
Le chef de service de chirurgie
Le chef de service de pédiatrie
Le chef de service de médecine interne
Nous remercions les collègues apprenants de la
cinquième promotion de la faculté de médecine et
santé publique de l'université de Kolwezi pour l'entraide, les
encouragements qui nous ont accompagnés au fil du temps malgré
des moments difficiles passés ensemble.
Nous remercions l'ambassade du Cameroun en république
démocratique du Congo, l'association des étudiants camerounais de
l'université de Kolwezi.
Que toute personne ayant contribué de près ou de
loin à la réalisation de ce travail, trouve ici l'expression de
notre plus haute gratitude.
V
LISTE DES TABLEAUX
Tableau I : Intervalles de référence de la
numération globulaire et plaquettaire de la
naissance à 2 mois. 8
Tableau II : Répartition selon l'âge de la
mère. 20
Tableau III: Répartition des mères selon la
profession. 20
Tableau IV : Répartition des mères selon le
suivi des consultations prénatales. 22
Tableau V : Répartition des mères selon les
antécédents de consommation d'alcool, de
tabac et antécédent de transfusion
sanguine. 23
Tableau VI : Répartition des mères selon la
parité. 24
Tableau VII : Répartition des mères selon
la gestité. 24
Tableau VIII: Répartition des mères en
fonction des pathologies au cours de la
grossesse. 25
Tableau IX:
Répartition des nouveau-nés en fonction du poids de naissance
(en
grammes) 26
Tableau X: Répartition des nouveau-nés en
fonction de la voie d'accouchement 27
Tableau XI: Répartition des nouveau-nés en
fonction du lieu d'accouchement. 28
Tableau XII : Répartition des nouveau-nés
en fonction du motif d'hospitalisation. 29
Tableau XIII : Répartition des nouveau-nés
selon le groupe sanguin. 30
Tableau XIV : Répartition des nouveau-nés
selon le groupe rhésus. 30
Tableau XV: Répartition des cas selon le taux
d'hémoglobine 32
Tableau XVI: Répartition des nouveau-nés
selon le taux de plaquettes. 32
Tableau XVII: association entre pathologies au cours de
la grossesse et thrombopénie. 33
Tableau XVIII: association entre le sexe et la
thrombopénie. 33
Tableau XIX : association entre le motif d'admission et
le taux de plaquettes 34
Tableau XX : association entre manifestation
hémorragique et le taux de plaquettes : 35
VI
LISTE DES FIGURES
Figure 1: Les compartiments de
l'hématopoïèse 6
Figure 2: Répartition des mères selon la
commune de résidence. 21
Figure 3 : Répartition des nouveau-nés
selon l'âge gestationnel (morphologique) en
semaines d'aménorrhée (SA).
26
Figure 4: Répartition des nouveau-nés en
fonction du sexe. 27
Figure 5: Répartition des nouveau-nés
selon la réanimation à la naissance. 31
Figure 6 : Répartition des cas selon la
transfusion sanguine. 31
Figure 7 : Répartition des cas selon
l'issue. 35
VII
LISTE DES SYMBOLES ET ABREVIATIONS
% : pourcent
/mm3 : par millimètre cube
CFU-B : colony forming unit basophils
CFU-E : colony forming unit érythroïd
CFU-Eo : colony forming unit eosinophils
CFU-GEMM : colony forming unit ganulocyts erythrocuts monocyts
megakaryocyts
CFU-M : colony forming unit monocyts
CFU-MK : colony forming unit megakaryocyts
CIVD : coagulation intravasculaire disséminée
CMP : common myéloïd progenitor
CPA : concentré de plaquettes
d'aphérèse
CPN : consultation prénatale
CSH : cellule souche hématopoïétique
EPO : érythropoïétine
ETF : échographie transfontanellaire
Fc : fragment constant
g : gramme
GM-CSF : granulocytes-macrophage colony stimulating factor
HELLP : hemolysis elevated enzymes low platelets
HGPR : hôpital général provincial de
référence
HTA : hypertension artérielle
IgE : immunoglobuline E
IL-11 : interleukine 11
IL-3 : interleukine 3
IL-6 : interleukine 6
IUG : infection urogénitale
Kg : kilogramme
MCPS : mélange de concentré de plaquettes
standard
MEC : matrice extracellulaire
MEP : megakaryocyte érythrocyte progénitor
VIII
MK : méga caryocytes
MPP : multipotent progénitor
NP : numération des plaquettes
PDGF : facteur de croissance dérivé des
plaquettes
RCIU : retard de croissance intra-utérin
RDC : République démocratique du Congo
SA : semaine d'aménorrhée
SCF : sterm cell factor
SFA : souffrance foetale aigue
TNN : thrombopénie néonatale
TORCH : toxoplasmose, rubéole, cytomégalovirus
et herpès
TPO : thrombopoïètine
USA : états unis d'Amérique
VIH : Le virus de l'immunodéficience humaine
VWF : von Will brand factor
IX
RESUME
Introduction : À partir de la
17e semaine de gestation, le foetus sain an un nombre moyen de plaquettes de
250.000/l. Ce chiffre ne change pas jusqu'à la fin de la grossesse. Le
nombre moyen de plaquettes augmente considérablement dès la fin
de la première semaine. Les valeurs typiques pendant cette
période varient de 150 000/l à 650000/l. Notre objectif est de
déterminer le taux de plaquettes chez les nouveau-nés à
terme ainsi que les signes cliniques associés aux variations de
plaquettes.
Matériel et méthodes : il
s'agit d'une étude descriptive transversale à collecte
prospective allant d'avril à aout 2023 portant sur 104
nouveau-nés à l'hôpital général provincial de
référence Jason Sendwe de Lubumbashi. Nous avons
élaboré un questionnaire pour récolter les données.
La saisie et l'analyse ont été réalisées à
l'aide des logiciels Epi.info.7.2.2.6, Excel 2016 et Word 2016.
Résultats : Le taux de
plaquettes moyen est de 230673/mm3 la valeur la plus basse est de
51000 /mm3 et la plus haute est de 583000
/mm3; il n'y a aucune thrombocytose mais un taux de
thrombopénie de 18,27% on note une prédominance masculine avec un
sexe ratio de 1,71. Les thrombopénies s'accompagnent de certains
facteurs tels que les antécédents d'infections
urogénitales au cours de la grossesse ; et chez les nouveau-nés,
une infection néonatale précoce mais sans lien de cause à
effet avec un taux de plaquettes bas.
Conclusion : Les troubles du taux des
plaquettes constituent donc une réalité chez le nouveau-né
à terme dans notre milieu.
Mots clés : Plaquettes
sanguines, Nouveau-né à terme, profile, Lubumbashi.
X
ABSTRACT
Introduction: From the 17th week of
gestation, the healthy fetus has an average platelet count of 250000/l. This
figure does not change until the end of the pregnancy. The average platelet
count increases significantly by the end of the first week. Typical values
during this period range from 150000/l to 650000/l. Our objective is to
determine the platelet count in full-term newborns as well as the clinical
signs associated with platelet variations.
Material and methods: this is a
cross-sectional descriptive study with prospective collection from April to
August 2023 covering 104 newborns at the Jason Sendwe provincial general
referral hospital in Lubumbashi. We developed a questionnaire to collect the
data. The entry and analysis were carried out using the software
Epi.info.7.2.2.6, Excel 2016 and Word 2016.
Results: The average platelet count is
230673/mm3, the lowest value is 51000/mm3 and the highest is 583000/mm3; there
is no thrombocytosis but a thrombocytopenia rate of 18.27%; there is a male
predominance with a sex ratio of 1.71. Thrombocytopenia is accompanied by
certain factors such as a history of urogenital infections during pregnancy;
and in newborns, early neonatal infection but not causally linked to low
platelet counts.
Conclusion: Platelet count disorders
are therefore a reality in full-term newborns in our environment.
Keywords: Blood platelets, Full-term
newborn, profile, Lubumbashi.
XI
TABLE DES MATIERES
EPIGRAPHE I
REMERCIEMENTS IV
LISTE DES TABLEAUX V
LISTE DES FIGURES VI
LISTE DES SYMBOLES ET ABREVIATIONS VII
RESUME IX
ABSTRACT X
TABLE DES MATIERES XI
INTRODUCTION 1
Définition 1
Etat de la question 1
Choix et intérêt du sujet 3
Objectifs 3
Objectif général 3
Objectif 3
Délimitation spatiotemporelle et méthode
3
Subdivision 3
PREMIERE PARTIE : 5
ASPECTS THEORIQUES 5
CHAPITRE I : GENERALITES SUR LES PLAQUETTES 6
I.1. L'hématopoïèse 6
I.2. Fonctions des plaquettes
7
CHAPITRE II : PROFIL PLAQUETTAIRE DU NOUVEAU-NE ET
TROUBLES DES
PLAQUETTES 8
II.1. PROFIL PLAQUETTAIRE DU NOUVEAU-NE 8
II.2. LES VARIATIONS ANORMALES DU TAUX DES PLAQUETTES
9
II.3. ETIOLOGIES DES THROMBOPENIES NEONATALES
9
II.3.1. Thrombopénie néonatale en rapport
avec une pathologie maternelle 9
II.3.2. Thrombopénie néonatale en rapport
avec des Complications liées à la grossesse 10
II.3.3. Thrombopénie en rapport avec une
pathologie néonatale 11
II.3.4. Étiologies diverses 12
XII
II.4. MANIFESTATIONS CLINIQUES D'UNE THROMBOPENIE
NEONATALE 12
II.5. EXAMENS COMPLEMENTAIRES 13
II.6. PRISE EN CHARGE THÉRAPEUTIQUE
13
II.6.1. DE FAÇON GENERALE 13
II.6.2. DIFFERENTES THERAPEUTIQUES 13
II.6.3. SCHEMAS THERAPEUTIQUES 14
II.7. SURVEILLANCE DU TAUX PLAQUETTAIRE 15
DEUXIEME PARTIE : 16
ASPECTS PRATIQUES 16
CHAPITRE III : METHODOLOGIE 17
CHAPITRE IV : PRESENTATION DES RESULTATS 20
CHAPITRE V : DISCUSSION 36
CONCLUSION 41
RECOMMANDATIONS 42
ANNEXES 43
REFERENCES 46
INTRODUCTION
Définition
Le chiffre moyen de plaquettes chez le foetus sain à
partir de la 17e semaine de gestation est de 250.000/l. Cette valeur reste
inchangée jusqu'au terme. Au bout de la première semaine de vie,
la moyenne des plaquettes augmente de façon importante. Pendant cette
période, les valeurs normales se situent entre 150.000/l et 650.000
/l.[1]
Une thrombopénie néonatale toujours transitoire
est observée dans 10 à 20% des cas.[2]
Les plaquettes sanguines sont de petites cellules
anucléées mesurant 2 à 4 ìm de diamètre, qui
vivent 7 à 10 jours dans le sang elles sont issues de la fragmentation
cytoplasmique de leurs précurseurs, les mégacaryocyte (MK) et
jouent un rôle essentiel dans le maintien de l'hémostase.[3,4]
Etat de la question
Les thrombopathies constituent un ensemble de pathologies
acquises ou héréditaires liées à une ou plusieurs
anomalie(s) fonctionnelle(s) des thrombocytes. Les troubles plaquettaires
comprennent une augmentation anormale des plaquettes (thrombocytémie),
une diminution des plaquettes (thrombopénie). Toutes ces maladies
peuvent perturber la fonction d'hémostase et favoriser
l'hémorragie. Le risque de saignement est inversement proportionnel au
nombre de plaquettes et à la fonction plaquettaire.[5]
La thrombocytose est installée quand le nombre des
plaquettes dépasse 400 000/mm3. La limite de 450 000/mm3 est
généralement revue à la hausse chez le nouveau-né
chez qui le taux de plaquettes a physiologiquement tendance à être
supérieur à 500 000/mm3.[6]
La thrombopénie est une anomalie hématologique
fréquente durant la période néonatale
particulièrement chez les nouveau-nés hospitalisés en
unité de soins intensifs. Elle est définie par un taux de
plaquettes inférieure à 150 000/mm3.[7]
Aux états unis d'Amérique les
thrombopénies néonatales sont fréquentes chez les enfants
hospitalisés en unités de néonatalogie les principales
étiologies sont les infections néonatales, l'hypertension
artérielle gravidique, l'incompatibilité foeto-maternelle
rhésus ainsi que les thrombopénies immunes.[8] selon un travail
mené à Atlanta en Géorgie les saignements surviennent chez
25 % des nouveau-nés en unité de soins intensifs néonatals
et la
1
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
thrombocytopénie touche 22 à 35 % et une partie
de nouveau-nés à terme présentent un risque
élevé de saignement.[9]
Une incidence de thrombopénie néonatale de 1,9%
a été retrouvé dans une étude prospective
réalisée dans un établissement de soins tertiaires dans le
centre de l'Arabie saoudite en 2018.[10]
En Inde, des travaux effectués à l'hôpital
de la marine de Bombay, parus en 2011 font état d'une incidence globale
de la thrombocytopénie de 70,5 % dans le groupe des nouveau-nés
classés en haut risque (risque élevé et faible risque de
thrombocytopénie, selon la présentation,
antécédents maternels, tout événement
prénatal/périnatal) en unité de soins intensifs
néonatals sur une période de deux années allant
d'août 2007 à août 2009.[11]
Des recherches réalisées en Turquie,
publiées en 2012 menée sur trois ans ont mentionné une
incidence de thrombopénie néonatale de 9.4% entre 2009 et
2012.[12]
Le département de néonatologie de
l'université de médecine de Berlin en Allemagne rapporte
qu'environ 0,1 à 2 % de nouveau-nés développent une
thrombocytopénie pendant la période néonatale.[13]
Les thrombopénies néonatales touchent 20
à 40 % des nouveau-nés hospitalisés en réanimation
en France ; Environ 30 % de ceux qui présentent une thrombopénie
sévère reçoivent une transfusion plaquettaire. L'infection
bactérienne, la CIVD et les thrombopénies allo- ou auto-immunes
sont les causes les plus fréquentes. Le risque majeur est celui d'une
hémorragie cérébrale grave.[14]
Au Maroc, les thrombopénies néonatales (TNN)
sont fréquentes, elles représentent 20 % des hospitalisés
en unités de néonatologie et de soins intensifs, elles sont
rencontrées chez 0,8 à 4 % de nouveau-nés sains à
terme et le risque de thrombopénie sévère est
évalué à 10 à 15%.[15,16]
En Éthiopie, des travaux menés à
l'Hôpital spécialisé d'Anbessa à Addis-Abeba
publiés en juin 2021 rapportent une incidence de la
thrombocytopénie de 55,8 % chez les nouveau-nés admis avec des
troubles chirurgicaux.[17]
Selon une analyse menée en Côte d'ivoire, la
thrombopénie serait le stigmate hématologique obtenu à
l'hémogramme qui refléterait de la manière la plus exacte
la gravite des affections néonatales en milieu hospitalier tropical
urbain.[18]
Sur le plan national, en République Démocratique
du Congo (RDC) les chiffres ne sont pas rapportés, cependant, les
résultats des recherches publiée en 2021 réalisées
aux Cliniques universitaires de Lubumbashi rapportent un taux de 17% de
thrombopénie néonatale.[19]
2
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Choix et intérêt du sujet
Présentement, les anomalies des plaquettes en
période néonatale sont évidentes, de ce fait, une
attention particulière doit y être portée afin d'avoir plus
d'informations sur ces troubles et améliorer la prise en charge ; le
profil des plaquettes chez le nouveau-né à terme est une
information peu documentée dans notre milieu et la découverte de
thrombopénies néonatales se fait souvent de manière
fortuite. De ce fait, nous nous proposons d'établir le profil
plaquettaire du nouveau-né à terme ; c'est dans cette perspective
que nous nous posons la question suivante :
Quel est le profil des plaquettes chez les nouveau-nés
à terme à l'hôpital Sendwe de Lubumbashi ?
Objectifs
Objectif général
Pour cette étude, nous nous sommes fixés pour
objectif de contribuer à l'amélioration de la prise en charge
globale des nouveau-nés à l'hôpital général
provincial de référence Jason Sendwe de Lubumbashi.
Objectifs spécifiques
Afin d'atteindre cet objectif général, nous avons
défini les objectifs spécifiques suivants : -Déterminer le
taux des plaquettes chez les nouveau-nés à terme.
-Identifier les signes cliniques accompagnant les variations
des plaquettes chez les nouveau-nés à terme.
Délimitation spatiotemporelle et
méthode
Pour réaliser cette étude, nous avons
mené nos recherches à l'hôpital général
provincial de référence Jason Sendwe de Lubumbashi pendant la
période allant d'avril à aout 2023 par une méthode
descriptive transversale à collecte prospective.
Subdivision
Le présent travail est divisé en deux grandes
parties, en dehors de l'introduction générale et de la
conclusion. La première partie traite des
généralités et du profil des plaquettes chez le
3
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
nouveau-né, tandis que la seconde partie est
consacrée aux aspects pratiques, suivis de la discussion des
résultats.
4
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
PREMIERE PARTIE :
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
5
ASPECTS THEORIQUES
CHAPITRE I : GENERALITES SUR LES PLAQUETTES
I.1. L'hématopoïèse
L'hématopoïèse est l'ensemble des processus
qui concourent à la fabrication et au remplacement continu et
régulé des cellules sanguines. Au cours de la vie
intra-utérine, elle a lieu au niveau du tissu conjonctif durant les deux
premiers mois ; puis au niveau hépatique et splénique pour
être exclusivement médullaire après la naissance.[20]
L'hématopoïèse se déroule en quatre étapes
successives :
-Les cellules souches totipotentes
-Les pro géniteurs
- Les précurseurs
- Enfin les cellules matures
Le passage d'une étape à une autre est sous
influence de signaux (cytokines et autres).
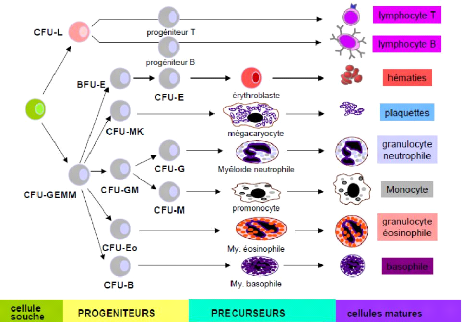
Figure 1: Les compartiments de
l'hématopoïèse [21]
6
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
I.2. Fonctions des plaquettes
Par leur implication dans l'hémostase primaire, les
plaquettes jouent un rôle crucial. En effet, en comblant les
brèches qui peuvent apparaître suite à une lésion
des vaisseaux sanguins, elles permettent de maintenir l'intégrité
vasculaire. L'hémostase primaire, qui comprend l'ensemble des
interactions entre les plaquettes et les vaisseaux sanguins, l'hémostase
secondaire, également connue sous le nom de coagulation, qui comprend
l'ensemble des processus qui conduisent à la transformation du
fibrinogène en fibrine, et la fibrinolyse, qui est l'étape de
dégradation du caillot sanguin.[3]
Bien que l'hémostase constitue le rôle principal
des plaquettes, ces dernières participent également à
d'autres processus :
-Inflammation : les plaquettes peuvent majorer la
réaction inflammatoire par la sécrétion de facteurs de
perméabilité vasculaire elles peuvent promouvoir le
chimiotactisme des Polynucléaires Neutrophiles.[22]
-Immunologie : par le fait qu'elles portent à leur
surface des récepteurs pour les fragments constants (Fc) des IgE.
-Action sur la paroi vasculaire, la
néo-angiogenèse ou la formation des vaisseaux lymphatiques,
à travers la sécrétion de leur contenu granulaire, par la
sécrétion de PDGF, un mitogène qui stimule la
prolifération des fibres musculaires lisses, les plaquettes jouent aussi
un rôle important dans l'embryogenèse en particulier dans le
développement des reins, des vaisseaux sanguins, des poumons et du
système nerveux central.[23] Il leur est aussi reconnu un rôle
dans la dissémination métastatique notamment par l'interaction
directe des glycoprotéines membranaires.[24]
7
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
CHAPITRE II : PROFIL PLAQUETTAIRE DU NOUVEAU-NE ET
TROUBLES DES PLAQUETTES II.1. PROFIL PLAQUETTAIRE DU
NOUVEAU-NE
Le chiffre moyen de plaquettes retrouvé chez le foetus
sain à partir de la 17e semaine de gestation est de 250.000/l. Ce
chiffre ne varie pas jusqu'au terme. Dès la fin de la première
semaine, le chiffre moyen de plaquettes augmente significativement. Pendant
cette période, les valeurs normales se situent entre 150 000/l et
650000/l. une étude américaine a montré que le chiffre de
plaquettes est sujet à de nombreuses variations pendant la
période néonatale. Il suit une courbe sinusoïdale pendant
les 9 premières semaines de vie avec un premier pic entre la 2e et 3e
semaine puis un second pic entre la 6e et la 7e semaine et peut atteindre
jusqu'à 750000/l. Ces chiffres élevés sont en rapport avec
une production accrue de thrombopoïètine (TPO) dès le 2e
jour de vie et jusqu'à la fin du premier mois. Le nombre de plaquettes
diminue ensuite progressivement pour devenir comparable à celui de
l'adulte (150-450.000/l) vers l'âge de 12 ans.[1]
Tableau I : Intervalles de
référence de la numération globulaire et plaquettaire de
la naissance à 2 mois.[25]
|
Catégories
|
Hématies
|
Hématocrite
|
Hémoglobine
|
VGM
|
TCMH
|
CCMH
|
IDR
|
Réticulocytes
|
Plaquettes
|
VMP
|
Erythroblaste
|
|
d'âge
|
1012 /l
|
%
|
g/dl
|
fl
|
pg
|
g/dl
|
%
|
109/l
|
109/l
|
fl
|
109/l
|
|
Nouveau-né
|
3.9-6.4
|
43.4-67.5
|
14.1-21.6
|
96.5-
|
32-39
|
|
15-
|
160-300
|
|
8.7-
|
0-1
|
|
|
|
|
114
|
|
|
18
|
|
|
11.6
|
|
|
|
|
|
|
|
|
|
|
150-400
|
|
|
|
2 jours
|
3.8-6.1
|
40.6-64.1
|
13.8-22.1
|
95-
|
180-325
|
0-0.2
|
|
|
|
|
|
|
|
|
|
116
|
|
31.5-
|
|
|
|
|
|
|
|
|
|
|
|
36.5
|
|
|
|
|
|
|
3 à7 jours
|
3.8-6.2
|
39.2-62.7
|
13.5-21.9
|
92-
|
170-323
|
<0.005
|
|
|
|
|
|
|
|
|
|
112
|
|
|
|
|
|
|
|
|
8 à 14 jours
|
3.7-5.7
|
35.7-58.5
|
12.3-19.9
|
88.5-
|
30-
|
|
|
20-200
|
|
9-
|
0
|
|
|
|
|
110
|
37.5
|
|
|
|
|
12.2
|
|
|
|
|
|
|
|
|
|
|
150-600
|
|
|
|
15 jours
|
3.1-5.2
|
30.2-49.5
|
10.8-17.5
|
88.5-
|
28-
|
|
|
25-65
|
|
|
0
|
|
à 1 mois
|
|
|
|
110
|
36.5
|
|
|
|
|
|
|
|
2 mois
|
3.1-4.3
|
27.341.2
|
9.7-13.5
|
80.5-
|
27-
|
|
|
|
|
8.5-
|
0
|
|
|
|
|
101
|
33.3
|
|
|
|
|
11.4
|
|
8
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
II.2. LES VARIATIONS ANORMALES DU TAUX DES
PLAQUETTES
La thrombocytose est définie comme une
numération plaquettaire supérieure à la limite normale
pour l'âge. Il est décrit qu'après la première
semaine postnatale, la limite supérieure des numérations des
plaquettes chez les nouveau-nés à terme ou proches du terme est
systématiquement supérieure à la valeur adulte standard de
450 000/l.[1]
La thrombopénie néonatale est définie par
un taux plaquettaire inférieur à 150 000/mm3 quel que soit le
terme ; un taux plaquettaire inférieur à 50 000/mm3 est une
thrombopénie sévère et un taux plaquettaire
inférieur à 30 000/mm3 constitue une thrombopénie
très sévère.[26]
La thrombopénie néonatale représente
l'anomalie d'hémostase du nouveau-né la plus fréquente.
Elle est définie par un chiffre de plaquettes inférieur à
150 000/mm3 (< 100 000 chez le prématuré ou l'hypotrophe et
est sévère si inférieur à 30 000 (< 50 000 chez
le prématuré ou l'hypotrophe). La conséquence principale
de cette affection est la survenue d'hémorragie intracrânienne
à l'origine de décès ou de séquelles
neurologiques.[16,27]
II.3. ETIOLOGIES DES THROMBOPENIES NEONATALES
II.3.1. Thrombopénie néonatale en
rapport avec une pathologie maternelle II.3.1.1. La thrombopénie
gestationnelle
Ici, le risque de thrombopénie néonatale est
exceptionnel. Elle résulte d'une thrombopénie
modérée, tout à fait isolée, survenant entre le
5eme et le 8ème mois de grossesse et peut être
décelée chez certaines femmes en dehors de toute pathologie. Le
mécanisme est mal connu, mais semble pouvoir s'expliquer par
l'hémodilution notée au cours de la grossesse.[28]
1I.3.1.2. La thrombopénie auto-immune
Lors de la grossesse, les auto-anticorps maternels de type IgG
peuvent franchir le placenta et provoquer une thrombopénie chez le
foetus. Ces auto-anticorps peuvent persister dans le sérum maternel au
long cours, Le risque de thrombopénie néonatale concerne 15
à 30 % des nouveau-nés de mère ayant des
antécédents de thrombopénie auto-immune et le risque de
thrombopénie sévère est évalué à 5
à 10 %. Chez le nouveau-né, la thrombopénie peut
apparaître secondairement avec un nadir entre le 4ème et le
7ème jour et avoir une durée variable de 10 à 60 jours.
Cependant l'intervention d'autres facteurs individuels actuellement
9
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
mal connus pourrait expliquer l'atteinte isolée de l'un
des deux jumeaux lors de certaines grossesses gémellaires.[4]
II.3.2. Thrombopénie néonatale en
rapport avec des Complications liées à la
grossesse
II.3.2.1. L'éclampsie et HELLP (hemolysis
eleveted liver enzymes low
platelets) Syndrome
Les pathologies réno-vasculaires, hypertensives,
s'intégrant ou non dans le cadre d'une pré éclampsie font
également courir un risque de thrombopénie néonatale.
Cette dernière a pu être décrite chez 9,2 % des
nouveau-nés de mères présentant une hypertension
artérielle gravidique contre 2,2 % des nouveau-nés de
mères normo tendues. En cas de HELLP syndrome, la thrombopénie
maternelle peut entraîner de façon inconstante, une
thrombopénie néonatale dont le mécanisme reste mal
connu.[29]
II.3.2.2. Le retard de croissance intra-utérin
(RCIU)
L'incidence de la thrombopénie néonatale est six
à vingt fois plus élevée chez les nouveau-nés
hypotrophiques que chez les eutrophiques. Les mécanismes sont multiples
(périphériques, centraux et mixtes) et souvent intriqués.
L'hypothèse d'une déviation de l'hématopoïèse
au profit de la lignée rouge et aux dépens des deux autres
lignées, expliquerait la polyglobulie, la leuco neutropénie et la
thrombopénie observées chez le nouveau-né hypotrophique.
Cependant, dans 25 à 67 % des cas, la thrombopénie est dite
idiopathique. L'HTA gravidique et l'hypoxie per-natale sont des facteurs de
risques supplémentaires de thrombopénie néonatale. Le plus
souvent, la thrombopénie est modérée avec un nadir
à deux trois jours de vie et évolue spontanément de
façon favorable en huit à dix jours.[30]
II.3.2.3. Infection par le VIH
Au cours des infections par le VIH, la thrombopénie
maternelle est d'ordre immunologique et fait donc courir un risque de
thrombopénie au nouveau-né. Plus rarement, l'origine est
multifactorielle : défaut de production médullaire en rapport
avec une toxicité directe du VIH sur les mégacaryocytes,
infections opportunistes, toxicité médicamenteuse.[31]
10
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
II.3.2.4. Les thrombopénies immunoallergiques
d'origine médicamenteuse
Le médicament ou son métabolite pris par la
mère forme en se liant à une protéine une structure
antigénique responsable de la synthèse d'anticorps. La prise
médicamenteuse sensibilisante peut être ancienne ou récente
mais l'éviction du médicament doit être définitive
du fait de la persistance au long cours de cette sensibilité. La liste
des principaux agents médicamenteux en cause est longue ; il s'agit
essentiellement de la méthyl dopa, des pénicillines, du valproate
de sodium et de l'héparine (le risque de thrombopénie induite par
l'héparine est plus élevé chez les femmes enceintes, mais
le risque foetal est minime car l'héparine ne passe pas la
barrière placentaire). Plus rarement, les barbituriques, le rimifon, le
diamox, les thiazidiques, les sulfamides, la quinine et la quinidine, l'hydroxy
chloroquine, les digitaliques, les glycopeptides.[31]
II.3.3. Thrombopénie en rapport avec une
pathologie néonatale II.3.3.1. L'allo immunisation
La thrombopénie néonatale par allo-immunisation
foeto-maternelle est le résultat de la destruction des plaquettes
foetales par les immunoglobulines de type G dirigées contre les
antigènes plaquettaires (HPA) d'origine paternelle et absents chez la
mère. Cette affection est le résultat d'un conflit entre les
antigènes plaquettaires du foetus et des anticorps maternels. Les
anticorps maternels traversent la barrière placentaire dès 14
semaines et les antigènes foetaux s'expriment dès 18 semaines. Le
nouveau-né, en bonne santé par ailleurs, présente une
thrombopénie avec un purpura ou des pétéchies survenant
tout de suite ou quelques heures après la naissance.[7]
II.3.3.2. Les infections
Les germes sont ceux des infections materno-foetales notamment
la Toxoplasmose, rubéole, cytomégalovirus, virus de
l'herpès et autres infections telles que la syphilis (TORCH).[32]
II.3.3.3. Souffrance foetale aigu (SFA) - Syndrome de
consommation
En dehors des infections néonatales graves, un syndrome
de consommation (CIVD) peut également survenir en cas
d'anoxo-ischémie périnatale (anoxie, acidose),
d'entérocoliteulcéro-nécrosante, d'hypothermie.[31]
11
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
II.3.4. Étiologies diverses
II.3.4.1. Thrombopénie Secondaire à une
transfusion massive
Les transfusions, exsanguino-transfusions, circulation
extracorporelle actuellement d'indication beaucoup plus exceptionnelle peuvent
également engendrer une thrombopénie. Les mécanismes sont
divers : déperdition importante, dilution des plaquettes du donneur,
défaut de compensation des mégacaryocytes du receveur.[31]
II.3.4.2. Thrombopénies centrales et/ou
congénitales
Les thrombopénies néonatales centrales
représentent des étiologies qui restent rares, dont le diagnostic
se fait en partie par la réalisation d'un myélogramme. Les causes
sont multiples, elles peuvent être :
Médicamenteuses : susceptibilité
particulière de certains nouveau-nés aux diurétiques
thiazidiques pris par la mère en cours de la grossesse.
Tumorales : leucémie et neuroblastome néonatal.
Hématologiques : amégacaryocytose
congénitale. Une thrombopénie néonatale peut s'observer
également dans le cadre de la trisomie 21, le syndrome de Turner, de
pathologies métaboliques Il existe également des thrombopathies
héréditaires dont le diagnostic est évoqué devant
une anamnèse familiale qu'il est important de reconstituer. La
confirmation diagnostique est le plus fréquemment tardive et la
révélation néonatale exceptionnelle.[32]
II.4. MANIFESTATIONS CLINIQUES D'UNE
THROMBOPENIE
NEONATALE
Le nouveau-né peut présenter des signes
cliniques hémorragiques plus ou moins graves : purpura
pétéchial, ecchymotique, bulles hémorragiques
intra-buccales, céphalhématome, saignements aux points de
ponction. Ou des signes évocateurs de complications
sévères : signes neurologiques d'hémorragie
intracrânienne, pâleur cutanéomuqueuse. Mais il peut
également être asymptomatique. [33]
12
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
II.5. EXAMENS COMPLEMENTAIRES
Des examens complémentaires sont réalisés
selon le contexte anamnestique :
· Recueil des antécédents maternels et
notamment le taux plaquettaire.
· NFS-Plaquettes : retrouve un taux de plaquettes
inférieur à 150000/mm3, vérifier une atteinte ou non des
autres lignées.
· Frottis sanguin : met en évidence une
éventuelle anomalie de forme des plaquettes.
· Phénotype plaquettaire (nouveau-né,
mère, et le père)
· Recherche d'AC - Anti plaquettes (nouveau-né, et
mère)
· Bilan infectieux avec CRP, PCR CMV urinaire, PCR VIH,
EBV, HCV
· Recherche d'une hémorragie : ETF,
échographie abdominale (reins, surrénales),
· L'examen du fond d'oeil doit être
systématique en cas de signes purpuriques et/ou de thrombopénie
profonde à la recherche d'une hémorragie rétinienne, ce
qui constituerait un facteur de risque pour une hémorragie
cérébroméningée
· Myélogramme à discuter dans de rares cas
· Recherche d'Ac antinucléaires chez la mère
(même si taux plaquettaire maternel normal).[26]
II.6. PRISE EN CHARGE THÉRAPEUTIQUE II.6.1. DE
FAÇON GENERALE
Contre-indication aux injections intramusculaires,
contre-indication à la prise de température rectale. Limitation
des manipulations.[26]
II.6.2. DIFFERENTES THERAPEUTIQUES
Transfusion plaquettaire : l'utilisation de concentrés
de plaquettes d'aphérèse issues d'un seul donneur (CPA) est
indiquée en pédiatrie. La quantité nécessaire est
déterminée en fonction du poids de l'enfant et du taux
plaquettaire (maximum 20 ml/kg). La transfusion se fait sur 60 mn en
débit libre ou avec l'aide d'une pompe spécifique.
Immunoglobulines polyvalentes : 1 g/kg/j en perfusion lente
progressive sur 3 heures. Mais, attention les immunoglobulines peuvent
augmenter la pression oncotique et la viscosité sanguine, de ce fait il
est important d'assurer une bonne hydratation.[26]
13
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
II.6.3. SCHEMAS THERAPEUTIQUES
v Thrombopénie néonatale en attente
d'étiologie : si la numération de plaquettes est
inférieure à 30.000 /l, cela constitue une indication
transfusionnelle, plus ou moins associé à une cure
d'immunoglobulines.
v Thrombopénies immunes
Ø Allo-immunisation anti-HPA avec un taux plaquettaire
maternel normal.
§ si la numération de plaquettes est
inférieure à 30.000 /l :
Transfusion de 15 ml/kg sans dépasser 20 ml/kg. En cas
d'indisponibilité des plaquettes un traitement par immunoglobulines est
instauré en IV en dose unique de 1 g/kg. Un contrôle de NP est
recommandé une heure après la fin de la transfusion.
Cependant, l'action des immunoglobulines n'est observée
qu'après un délai de 18h.
§ si la numération de plaquettes est comprise entre
30.000 et 50 .000/l :
La transfusion prophylactique n'est pas indiquée, mais
une surveillance clinique étroite et un contrôle régulier
de la NP jusqu'à obtenir un taux supérieur ou égal
à 100.000/l.
§ si la numération de plaquettes est
inférieure ou égale à 50.000 /l :
Il est recommandé une surveillance clinique
régulière et contrôle régulier de la NP
jusqu'à un taux supérieur ou égal à 100.000/l.
Ø Thrombopénie auto-immune (PTI maternel, lupus) :
avec un taux plaquettaire maternel bas.
La thrombopénie est souvent lente à se corriger et
peut durer jusqu'à 6 semaines voire 3 mois.
§ la numération de plaquettes est inférieure
à 20.000/l ou hémorragie : transfusion de concentrés de
plaquettes associée à un traitement par immunoglobulines IV en
dose unique de 1 g/kg.
§ la numération de plaquettes est comprise entre
20.000/l et 50.000 /l : traitement par immunoglobulines IV en dose unique de 1
g/kg.
§ la numération de plaquettes est supérieure
à 50.000 /l : surveillance clinique et de la NP. L'allaitement maternel
est autorisé sauf si persistance de la TNN au-delà de 12
semaines.
14
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
v Thrombopénies non immunes
· La numération de plaquettes est
inférieure à 30.000 /l : transfusion chez le nouveau-né
à terme ou prématuré même si stabilité
clinique.
· La numération de plaquettes est entre 30.000 et
50.000 /l : transfusion recommandée pour les nouveau-nés
présentant :
§ Soit des facteurs de risque : âge post-natal
< 1 semaine (à discuter)
§ Soit des signes cliniques pathologiques :
d'hémorragie, d'instabilité hémodynamique.
§ Soit dans les situations suivantes : CIVD, chirurgie
ou exsanguino-transfusion.
· La numération de plaquettes est
supérieure à 50.000 /l : pas d'indication de transfusion.
En cas de geste invasif ou de chirurgie mineure, le seuil
admis est de 50.000 /l et en cas de chirurgie majeure seuil de
100.000/l.[26]
II.7. SURVEILLANCE DU TAUX PLAQUETTAIRE
· En période aigüe : les contrôles seront
réalisés en fonction de la profondeur de la thrombopénie,
de l'étiologie et de la cinétique de variation de la NP.
· En phase de normalisation, 2 NP normales à une
semaine d'intervalle permettent d'arrêter la surveillance.[26]
15
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
16
DEUXIEME PARTIE :
ASPECTS PRATIQUES
CHAPITRE III : METHODOLOGIE
III.1. Cadre d'étude
Nous avons mené nos recherches à
l'hôpital général provincial de référence
Jason Sendwe de Lubumbashi.
· SITUATION GEOGRAPHIQUE ET ORGANISATION
ADMINISTRATIVE
Il est situé dans la commune urbaine de Lubumbashi,
délimité :
Ø Au nord : par l'avenue Likasi
Ø Au sud : par le couvent des soeurs et le
bâtiment du lycée WEMA
Ø A l'Est : par le marché MZEE L.D. KABILA
Ø A l'ouest : par le ministère provincial de la
santé du Haut Katanga et le camp assistant.
Coordonnées GPRS :
· Latitude : -11.672298
· Longitude : 27.487299
La capacité d'accueil de ce grand hôpital est
estimée à environ 1200 lits. L'hôpital est dirigé
par un comité de gestion avec à sa tête un médecin
directeur. Celui-ci s'occupe de l'administration courante de l'hôpital,
coordonne les différents services, et engage son personnel soignant.
Plusieurs médecins directeurs se sont succédé à la
tête de l'hôpital et l'actuel est le Dr. MWELWA André,
spécialiste en anesthésie - réanimation.
· LE SERVICE DE PEDIATRIE
Le service de Pédiatrie a constitué le cadre
spécifique de notre étude. Le service comprend trois sous
unités : la néonatologie ; les urgences pédiatriques et la
nutrition.
L'hôpital provincial général de
référence Jason Sendwe est constitué de 2 blocs :
Ø Le bloc à étages, constitué par
quatre niveaux
Ø Le bloc pavillonnaire constitué des pavillons
Le service de pédiatrie qui nous a servi de cadre est
situé dans le bloc pavillonnaire.
17
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
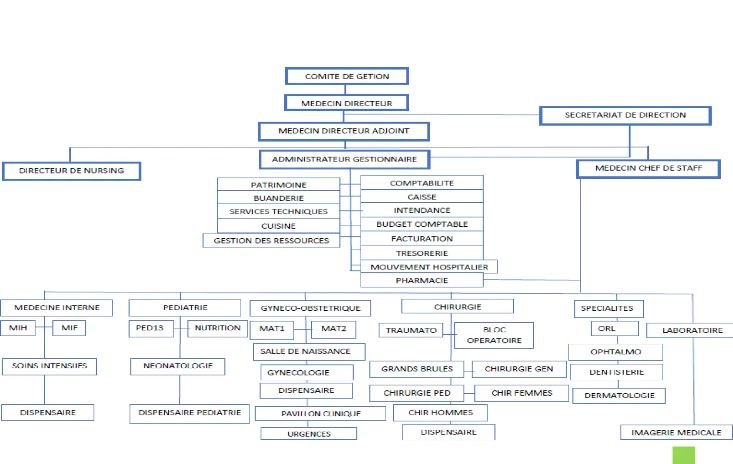
· ORGANIGRAMME DE L'HOPITAL
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
18
1. Matériel
Le recueil des données a été
effectué à l'aide d'un questionnaire préétabli
(voir annexe) reprenant d'une part les données contenues sur les fiches
d'hospitalisation et d'autres part les informations prises auprès des
mères.
2. Méthode
a. Population d'étude
Notre population d'étude était constituée
des nouveau-nés à terme dans le service de pédiatrie
de l'HGPR Jason Sendwe de Lubumbashi. La taille de notre
échantillon était de 104 cas.
b. Type d'étude
Nous avons mené une étude descriptive transversale
à collecte prospective.
c. Critère d'inclusion Ont
été inclus dans notre enquête :
· Les nouveau-nés à terme incluant
également ceux issus de grossesses gémellaire dans le service de
néonatologie au cours de la période d'étude.
· Les nouveau-nés à terme dont les
mères ont donné leur consentement verbal
éclairé.
d. Critère d'exclusion Ont
été exclus :
· Les nouveau-nés prématurés et post
matures.
· Les nouveau-nés dont les mères n'ont pas
donné leur consentement.
· Les nouveau-nés dont les paramètres de
récolte étaient incomplets.
e. Période d'étude
Notre étude s'est déroulée pendant une
période allant de 10/04/2023 au 10/08/2023 soit une période de
quatre mois.
f. Gestion des données et analyses
statistiques
Les données ont été
récoltées sur des fiches individuelles d'enquête,
encodées et analysées à l'aide des logiciels Epi-info
version 7.2.2.6 et Microsoft Excel 2016, nous avons comparé les
proportions à l'aide du test Chi carré ; significatif lorsque la
probabilité du test était inférieure à la
probabilité de référence (p=0,05). Les données ont
été confiées et saisies dans le logiciel Microsoft Word
2016. Les résultats obtenus après traitement seront
représentés dans les tableaux et les figures du chapitre
suivant.
19
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
CHAPITRE IV : PRESENTATION DES RESULTATS
v Répartition des mères selon les données
relatives aux facteurs sociodémographiques : Tableau II :
Répartition selon l'âge de la mère.
Age
|
Fréquence
|
Pourcentage (%)
|
Paramètre (année)
|
15 - 20
|
7
|
6,73
|
|
21 - 25
|
34
|
32,69
|
|
26 - 30
|
36
|
34,62
|
Médiane = 27
|
31 - 35
|
18
|
17,31
|
DS = 5,46
|
36 - 40
|
6
|
5,77
|
|
41 - 45
|
3
|
2,88
|
|
Total
|
104
|
100,00
|
|
|
La tranche d'âge la plus représentée est
celle comprise entre 26 et 30 ans (34,62 %), une médiane de 27 ans avec
des extrêmes de 18 ans comme minimum et 44 ans comme maximum.
Tableau III: Répartition des mères selon
la profession.
Profession Fréquence Pourcentage (%)
Commerçante 16 15,38
Couturière 6 5,77
Cultivatrice 1 0,96
Élève 3 2,88
Enseignante 1 0,96
Infirmière 2 1,92
Ménagère 75 72,12
Total 104 100,00
20
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
La profession de ménagère était la plus
récurrente (72,12 %), ensuite venaient les commerçantes (15,38
%).
Annexe Kamalondo Kampemba Katuba Kenya Lubumbashi Ruashi
25,00
20,00
15,00
10,00
5,00
Figure 2: Répartition des mères selon la
commune de résidence.
Trois communes étaient retrouvées dans des
proportions proches pour la provenance dans notre étude, Kampemba (25%),
annexe (24,04%) et Lubumbashi (23,08%).
21
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
v Répartition des mères selon les données
relatives aux antécédents :
Tableau IV : Répartition des mères selon
le suivi des consultations prénatales.
CPN suivies Fréquence Pourcentage (%)
Non 25 24,04
Oui 79 75,96
Total 104 100,00
Les consultations prénatales ont été
suivies par 75,5% de mères.
22
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau V : Répartition des mères selon
les antécédents de consommation d'alcool, de tabac et
antécédent de transfusion sanguine.
Prise d'alcool Fréquence Pourcentage
(%)
Non 101 97,12
Oui 3 2,88
Total 104 100,00
Tabagisme
Non 104 100,00
Total 104 100,00
Transfusion sanguine
Non 98 94,23
Oui 6 5,77
Total 104 100,00
Sur l'ensemble de notre population d'étude, 3
mères consommaient de l'alcool soit 2,88% ; aucune ne fumait. Par
ailleurs 5,77% avaient déjà été transfusées
par le passé.
23
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau VI : Répartition des mères selon
la parité.
Parité Fréquence Pourcentage
(%)
Primipare (1) 16 15,38
Paucipare (2 - 3) 57 54,81
Multipare (=4) 31 29,81
Total 104 100,00
Les Paucipares étaient les plus nombreuses (54,81%)
suivies des multigestes (29,81%).
Tableau VII : Répartition des mères selon
la gestité.
Gestité Fréquence Pourcentage
Primigeste 21 20,19
Paucigeste 56 53,85
Multigeste 23 25,96
Total 104 100,00
Les Paucigestes étaient les plus nombreuses (53,85%)
24
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau VIII: Répartition des mères en
fonction des pathologies au cours de la grossesse.
Pathologie Fréquence Pourcentage (%)
Infection urogénitale 79 75,96
Paludisme 5 4,80
Prééclampsie 5 4,80
Hypertension artérielle chronique 1 0,96
Aucune 14 13,48
Total 104 100,00
Les infections urogénitales étaient les
pathologies les plus fréquentes au cours de la grossesse (75,96%) ; les
sujets de notre étude dont les gestantes n'ont présenté
aucune pathologie durant la grossesse constituaient 13,48%.
25
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
v Répartition selon les données relatives aux
nouveau-nés :
42 SA
41 SA
40 SA
39 SA
38 SA
37 SA
Age gestationnel
0 5 10 15 20 25 30 35 40 45
Figure 3 : Répartition des nouveau-nés
selon l'âge gestationnel (morphologique) en semaines
d'aménorrhée (SA).
Le plus grand nombre de nouveau-né est né à
39 semaines d'aménorrhée soit une proportion de 38,46%.
Tableau IX: Répartition des nouveau-nés en
fonction du poids de naissance (en grammes)
Poids de naissance (en
grammes)
|
Fréquence
|
Pourcentage (%)
|
Paramètres
|
[1400 - 2500[
|
9
|
8,65
|
|
[2500 - 3500[
|
85
|
81,73
|
Médiane = 3000
|
[3500 - 5600]
|
10
|
9,62
|
DS= 548,43
|
|
Sur notre population d'étude, 81,73% ont pesé
entre 2500 et 3500 grammes, avec un poids médian de 3000 grammes.
26
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
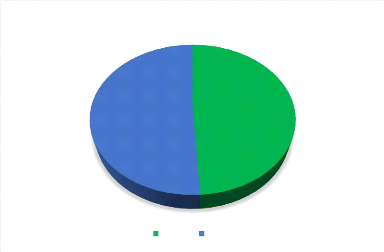
51%
Feminin Masculin
49%
Figure 4: Répartition des nouveau-nés en
fonction du sexe.
Les nouveau-nés de sexe masculin étaient plus
représentés avec une fréquence de 53 soit un sex-ratio de
1,03 pour le sexe masculin.
Tableau X: Répartition des nouveau-nés en
fonction de la voie d'accouchement
Voie d'accouchement
|
Fréquence
|
Pourcentage (%)
|
Voie basse
|
81
|
77,88
|
Voie haute
|
23
|
22,12
|
Total
|
104
|
100,00
|
|
Sur l'ensemble de nos sujets d'étude, 81 sont nés
par voie basse soit un pourcentage de 77,88.
27
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau XI: Répartition des nouveau-nés
en fonction du lieu d'accouchement.
Lieu d'accouchement Fréquence Pourcentage
(%)
Sendwe 65 62,50
Transféré 39 37,50
Total 104 100,00
Les nouveau-nés ayant vu le jour au sein de notre
structure hospitalière représentaient 62,5% tandis que 37,5%
provenaient d'ailleurs.
28
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau XII : Répartition des nouveau-nés
en fonction du motif d'hospitalisation.
Motif d'admission/ hospitalisation Fréquence
Pourcentage (%)
Asphyxie périnatale 11 10,58
Encéphalopathie anoxo-ischémique 1 0,96
Hémorragie digestive 4 3,85
Ictère 6 5,77
Infection néonatale précoce 41 39,42
Infection néonatale tardive 1 0,96
Luxation de l'épaule gauche 1 0,96
Omphalocèle 1 0,96
Risque infectieux majeur 9 8,65
Risque infectieux mineur 22 21,15
Risque infectieux mineur + syndrome polymalformatif 1 0,96
Risque infectieux mineur + asphyxie périnatale 1
0,96
Babysitting 4 4,81
Total 104 100,00
L'infection néonatale précoce était le
motif d'hospitalisation le plus fréquent avec un pourcentage de
39,42.
29
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau XIII : Répartition des
nouveau-nés selon le groupe sanguin.
Groupe sanguin Fréquence Pourcentage
(%)
A 25 24,04
AB 4 3,85
B 20 19,23
O 55 52,88
Total 104 100,00
Le groupe sanguin le plus présent était le groupe
O (52,88%) suivi du groupe A (24,04%).
Tableau XIV : Répartition des nouveau-nés
selon le groupe rhésus.
Rhésus Fréquence Pourcentage
Négatif (-) 0 0
Positif (+) 104 100
Total 104 100,00
Tous les nouveau-nés étaient de groupe
rhésus positif.
30
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
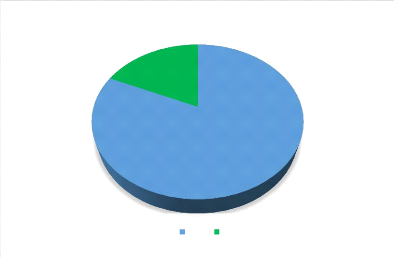
18%
Non Oui
82%
Figure 5: Répartition des nouveau-nés selon
la réanimation à la naissance.
Il y a eu recours à la réanimation après la
naissance pour 18 % des nouveaux nés.
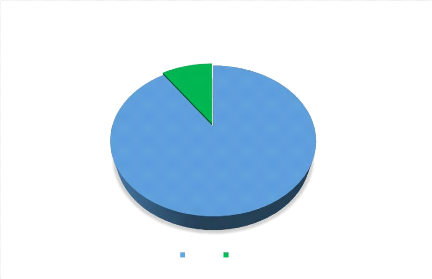
10%
Non Oui
90%
Figure 6 : Répartition des cas selon la
transfusion sanguine.
Une transfusion sanguine a été faite chez 10% des
nouveau-nés.
31
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
v Répartition des nouveau-nés selon les
données relatives aux résultats de laboratoire : Tableau
XV: Répartition des cas selon le taux d'hémoglobine
Taux d'hémoglobine (en g/l)
|
Fréquence
|
Pourcentage (%)
|
11 - 14
|
19
|
18,63
|
15 - 17
|
48
|
47,06
|
18 - 24
|
37
|
34,31
|
Total
|
104
|
100,00
|
|
Une anémie a touché une proportion de 18,63% de
nouveau-né.
Tableau XVI: Répartition des nouveau-nés
selon le taux de plaquettes.
Taux de plaquettes
(/mm3)
|
Fréquence
|
Pourcentage (%)
|
Paramètres
|
[50.000 - 150.000[
|
19
|
18,27
|
|
[150.000 - 600.000]
|
85
|
81,73
|
Moyenne = 230673
|
Total
|
104
|
100,00
|
DS = 104141,1
|
|
Le taux de plaquettes chez 81,73 % des nouveau-nés
était normal ; une thrombopénie était retrouvée
dans 18,27% de cas ; il n'y avait pas de thrombopénie
sévère ni de thrombocytose. La valeur la plus basse était
de 51000 / mm3 et la plus haute était de
583000 /mm3 avec un taux moyen de 230673 / mm3.
32
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau XVII: association entre pathologies au cours
de la grossesse et thrombopénie.
Pathologie Thrombopénie
Paramètre
Infection urogénitale 14 (73,68) P = 0.0001
Paludisme 1 (5,26)
Prééclampsie 2 (10,52)
Aucune 2 (10,52
Total 19 (100%)
L'antécédent d'infection urogénitale est
présente chez 73,68% des nouveau-nés ayant une
thrombopénie. Nous observons qu'il existe une différence
hautement significative entre l'infection urogénitale et la
thrombopénie (p=0,0001).
Tableau XVIII: association entre le sexe et la
thrombopénie.
Sexe Thrombopénie Paramètre
Masculin 12 (63,16%) P = 0,001
Féminin 7 (36,84%)
Total 19 (100%)
Nous avons noté une prédominance masculine de
thrombopénie soit 63,16% et avec une sex-ratio de 1,71 sans toutefois de
lien de cause à effet entre le sexe masculin et la
thrombopénie.
33
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau XIX : association entre le motif
d'admission et le taux de plaquettes
Taux de plaquettes
Motif d'admission
|
Normal
|
Thrombopénie
|
Total
|
Paramètre
|
Asphyxie périnatale
Encéphalopathie anoxo
ischémique
Hémorragie digestive
Ictère
Infection
néonatale précoce
Luxation épaule
gauche
Omphalocèle
Risque infectieux majeur
Risque infectieux
mineur
Risque mineur + syndrome poly malformatif
Risque mineur + asphyxie
périnatale
Babysitting
TOTAL
|
10 (11,77)
1 (1,18)
2 (2,35)
6 (7,06)
32 (37,65)
1 (1,18)
1 (1,18)
7 (8,24)
19(22,35)
1 (1,18)
1 (1,18)
4 (4,71)
85(81,73)
|
1 (10,00)
0 (0,00)
2 (10,53)
0 (0,00)
10 (52,63)
0
0
2 (10,53)
3 (15,79)
0
0
1 (5,26)
19 (18,27)
|
11
1
4
6
42
1
1
9
22
1
1
5
104 (100,00)
|
P < 0,005
|
|
Les nouveau-nés présentant une thrombopénie
étaient hospitalisés pour infection néonatale
précoce (47,37%) et nous notons une relation significative (p <
0,005).
34
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
Tableau XX : association entre manifestation
hémorragique et le taux de plaquettes :
Taux de plaquettes P-value
Saignement Normal Thrombopénie Total
Non 81 (86,17) 13 (13,83) 94 (90,38) 0,0001
Oui 4(4,71) 6(31,58) 10 (9,62)
TOTAL 85 (81,73) 18 (18,27) 104 (100)
Des manifestations hémorragiques étaient
présentes chez 31,58% de nouveau-nés avec thrombopénie.
Nous constatons qu'il existe une différence hautement significative
entre la thrombopénie et les manifestations hémorragiques
(p=0,0001).
v Répartition des nouveau-nés selon les
données sur l'hospitalisation
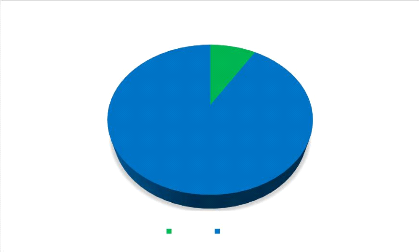
91%
Décès Guérison
8,65%
Figure 7 : Répartition des cas selon
l'issue.
Nous avons enregistré 9 décès, ce qui
représente un taux de mortalité de 8,65 %.
35
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
CHAPITRE V : DISCUSSION
1. Caractéristiques sociodémographiques des
mères Age
Dans notre étude, La tranche d'âge la plus
représentée est celle comprise entre 26 et 30 ans (34,62 %), une
médiane de 27 ans avec p25 et 75 respectivement de 18 ans et 44 ans.
Ceci est inférieur au résultat obtenu au bout d'une étude
sur la distribution des plaquettes maternelles et néonatales par
Semakuba et al. aux cliniques universitaires de Lubumbashi en 2021, dans
laquelle 78,6 % des mères avaient entre 20 et 35 ans [19]. Bocoum et al.
en 2019 au Mali rapportent que la majorité des mères avait entre
18 et 25 ans (54,2 %). Avec une moyenne d'âge de 24,41 ans[34] ce qui est
inférieur à nos résultats. Ceci pourrait être
s'expliquer par le fait que ce soit un pays où la quasi-totalité
de la population est d'obédience musulmane et de ce fait les femmes vont
en mariage relativement tôt, mais aussi par le fait qu'il y ait une
différence du type de milieu d'étude d'une part rural qui ne
favorise pas de longs cursus scolaires et d'autres part en milieu urbain
où les femmes sont généralement sujettes aux longues
études.
La profession
Nos résultats font état du fait que les
mères étaient pour la plupart des ménagères (72,12
%), suivies des commerçantes (15,38 %). Dans son étude en 2019
à Bamako, Bocoum rapporte que les femme au foyer (assimilable aux
ménagères) représentaient 77,5 et les commerçantes
1,8%[34] % ce qui se rapproche de nos résultats ce constat peut
s'expliquer par les conditions socio-culturelles dans notre milieu qui font en
sorte que communément les femmes jouent un rôle de mère au
foyer et ce parfois malgré les compétences qu'elles pourraient
avoir.
La commune de résidence
Nous avons retrouvé dans notre étude que trois
communes étaient dans des proportions proches pour la provenance :
Kampemba (25%), annexe (24,04%) et Lubumbashi (23,08%). En plus de situation
géographique quasiment au centre-ville ceci peut s'expliquer par le fait
l'hôpital Sendwe possède un plateau technique assez
élevé en termes de prise en charge en néonatologie, mais
aussi par la situation géographique de certaines communes qui cernent
pratiquement la ville.
Le suivi des consultations prénatales
Nous avons constaté qu'une proportion de 75,5% de
gestantes ont suivi des consultations prénatales. Ces résultats
sont supérieurs aux 61,05% des mères ayant suivi les
consultations prénatales qu'a rapporté l'étude
menée à Madagascar par Harivony et al en 2022.[35] Cette
différence s'explique par le fait que dans notre milieu les dispositions
sont prises de plus en plus par les pouvoirs publiques pour minimiser les couts
liées au suivi des femmes enceintes tout au long de la gestation.
|
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
|
36
|
|
2. Antécédents
Les antécédents de consommation d'alcool,
tabac et de transfusion sanguine
Sur l'ensemble de notre population d'étude, 3
mères consommaient de l'alcool soit 2,88% ; aucune ne fumait. Nous
n'avons pas pu discuter de ces résultats néanmoins la
littérature fait état du fait que l'alcool a un effet toxique
direct sur la moelle osseuse et par conséquent causer une
thrombopénie ; cependant ce constat peut s'expliquer par le fait que
dans notre milieu de par la censure morale les femmes s'adonnent relativement
moins à certaines pratiques en occurrence la consommation d'alcool et du
tabac.
La parité
Au cours de notre étude les paucipares étaient les
plus nombreuses (54,81%) ; nos résultats sont inférieurs par
rapport aux observations faites par Asrie et al publié en 2017 en
Ethiopie faisant état de 67,3% de paucipares[36], par contre, Semakuba
et al en 2021 qui rapportaient que les multipares étaient les plus
nombreuses ( 37%).[19] Cette différence s'explique par le type de
population étudiée dans ce sens où bien qu'ayant connu
plusieurs expériences de maternité, les femmes nanties
choisissent préférentiellement les structures sanitaires de renom
pour y donner naissance.
La gestité
Selon nos résultats, les paucigestes étaient les
plus nombreuses (53,85%) ce qui se rapproche des 54,9% obtenus par Amazouz at
al. en 2022 en Algérie.[37] ils sont cependant inférieurs
à ce qu'ont rapporté Asrie et al en 2017 au bout d'une
étude sur la prévalence de la thrombocytopénie chez les
femmes enceintes fréquentant à l'hôpital universitaire de
Gondar. Cette différence s'explique par le type de population
étudiée ainsi que la taille de l'échantillon.
.
Les pathologies au cours de la grossesse
Les infections urogénitales étaient les
pathologies les plus fréquentes au cours de la grossesse (75,96%) ;
cependant, 13,48% des mères n'ont présenté aucune maladie
durant la grossesse. Nos résultats sont supérieurs à ceux
de Dipak et al. obtenus en 2019 en Inde qui avait un taux de 72.72 %
d'infection urogénitale durant la gestation.[38] Ils sont
également supérieurs à ceux de Nyenga et al. qui au cours
d'une étude publiée en 2021 réalisée dans deux
grands centres de prise en charge néonatale à Lubumbashi ont
rapporté que l'antécédent d'infections urogénitales
au cours de la gestation était fréquent avec un taux de 42,59%.
[39] Mbarambara et al. en 2015 dans l'Est de la RD Congo notaient la notion
d'infection urogénitale pendant la grossesse chez 34,5% des cas ce qui
est inférieur à nos chiffres.[40] cette différence
s'explique par la taille d'échantillon et le type d'étude.
3. Données générales relatives aux
nouveau-nés Age gestationnel
Le plus grand nombre de nouveau-né est né à
un âge morphologique de 39 semaines d'aménorrhée soit une
proportion de 38,46%. Au centre hospitalier universitaire de Bamako
|
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
|
37
|
|
en 2019, Bocoum a eu un taux de 34,8% de nouveau-nés
à terme dans son étude[34], ce qui est sensiblement en dessous de
ce que nous avons. Nos résultats sont inférieurs à ceux de
Hebbar obtenu en 2018 en Algérie qui avait plus de 60% des nouveaux
nés au-delà de 37 semaines d'aménorrhée.[41] cette
différence s'explique par le type d'étude.
Poids de naissance
L'intervalle de poids de 2500 à 3500 grammes était
le plus représenté avec 81,73%. Nos résultats sont
supérieurs à ceux de Nyenga et al. qui en 2021 rapportaient que
47,53% des nouveau-nés avaient un poids supérieur à
2500grammes.[39] en 2010 en Inde Kusumasari et al. avaient vu aussi dans leurs
études une prédominance de nouveau-nés eutrophique qui
représentaient 75,5% de cas.[42] ce qui est plus bas que nos
observations ; ceci s'explique par le type d'étude dans lesquelles la
majorité des sujets sont nés à terme.
Sexe
Les nouveau-nés de sexe masculin étaient plus
représentés avec une fréquence de 53 soit un sexe-ratio de
1,03 pour le sexe masculin. Oulmati et al ont obtenu un résultat allant
dans le même sens à l'issue d'une étude menée au
Maroc publiée en 2013 cependant avec un sexe ratio de 2,03.[43] nos
résultats sont aussi similaires à ceux de Nyenga et al. en 2021
à Lubumbashi qui mentionnent un sex-ratio de 1,07 en faveur du sexe
masculin.[39]. Nous n'avons pas pu trouver d'explication à cela.
Voie d'accouchement
Sur l'ensemble des cas que nous avions au cours de notre
étude, 81 sont nés par voie basse soit un pourcentage de 77,88.
Nos résultats sont inférieurs mais vont dans le même sens
que ceux obtenus l'an dernier par Harivony qui mentionnait que les nés
par voie basse représentaient 82,11%.[35] par contre, en 2012 en Turquie
Bolat F et al. ont pu objectiver une prédominance des accouchements par
césarienne (53,56%).[12] Cette différence s'explique par les
dissemblances des conception socio-culturelles dans différents milieux
milieu, sous d'autres cieux la césarienne est perçue
différemment par les femmes par contre elle reste
généralement un recours ultime dans notre milieu.
Lieu d'accouchement
Nos résultats font état du fait que 62,5% de
nouveau-nés ont vu le jour au sein de l'hôpital
général provincial de référence Jason Sendwe tandis
que 37,5% provenaient d'ailleurs. Ce chiffre est supérieur aux 26,4%
rapportés par l'étude de Bocoum A en 2019 à Bamako.[34] De
même il est supérieur à celui de 38,27% retrouvé il
y a deux ans dans une étude réalisée à Lubumbashi
par Nyenga et al.[39] Cette différence s'expliquer par le fait que ces
études ont été menées au seins des hôpitaux
de troisième échelon qui disposent des unités de
néonatologie relativement mieux équipées que les
hôpitaux d'échelon inferieurs.
|
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
|
38
|
|
4. Résultats de laboratoire de biologie Groupe
sanguin
Nous avons observé que le groupe sanguin le plus
représenté était le groupe « O » rhésus
positif (52,88%) suivi du groupe « A » rhésus positif
(24,04%). Nos résultats sont supérieurs à ceux de Monga et
al. lors d'une étude faite à l'hôpital Sendwe de Lubumbashi
entre 2016 et 2017 montrant que le groupe « O » constituait 2,3% et
le groupe « B » était le plus répandu avec 49,4%.[44]
Par contre, nos chiffres sont inférieurs aux constats fait par Hebbar et
al. en 2018 en Algérie selon lequel le groupe sanguin « O »
était représenté avec un taux de 56,59% ; mais
superposable au pourcentage du groupe « A » avec un taux de
24,81%.[41] Ces résultats s'expliquent par le fait que ces groupes
sanguins sont respectivement les plus répandus en Afrique sub-saharienne
mais avec une variation en fonction de la région du monde
considérée et du type d'étude. Nous trouvons une
explication à cela par le fait qu'il existe une variabilité du
groupe rhésus dans différentes populations.
Groupe rhésus
Nous avons constaté que tous les nouveau-nés
étaient du groupe rhésus positif, c'est supérieur à
ce qu'ont observés Monga et al. dans un article paru en 2017 faisant
état de 98% de nouveau-nés appartenant au groupe rhésus
positif.[44] L'an dernier en Algérie, les résultats des travaux
menés sur l'allo-immunisation foeto-maternelle dans le système
ABO au service de Néonatologie du CHU de Tizi-Ouzou, Amazouz et al. ont
constaté que la quasi-totalité des nouveau-nés (95,10%)
étaient de rhésus positif.[37] Ce qui est inférieur
à nos résultats.
Taux des plaquettes
Nous avons eu comme résultat aucun cas de thrombocytose
mais un taux de thrombopénie néonatale de 18,27%, ce qui est
sensiblement au-dessus des 17% observés en 2021 par Semakuba et al aux
cliniques universitaires de Lubumbashi [19]; mais nos résultats
étaient supérieurs à ceux obtenus en 2012 par Bolat et al
rapportant 9,4% de thrombopénie au bout d'une étude menée
en Turquie.[12] ils sont également supérieurs aux observations
faites en 2018 par Mohamed E et ses collaborateurs faisant état d'une
valeur de 1,9% de thrombopénies[10]. L'an dernier à Antananarivo,
Harivony et al découvrent un taux de thrombopénie de 1,74% chez
les nouveau-nés ce qui est inférieur à nos
résultats.[35]. Cependant nos résultats sont inférieurs
à ceux de Chabernaud et al. qui avaient trouvé que les
thrombopénies néonatales touchent 20 à 40 % des
nouveau-nés hospitalisés en réanimation en France.[14]
Cette différence serait probablement due au type d'étude mais
aussi aux particularités sociodémographiques des
différentes populations et la taille des échantillons.
Association entre pathologies au cours de la grossesse et
thrombopénie.
Nos résultats montrent que l'infection urogénitale
au cours de la grossesse est présente chez 73,68% des nouveau-nés
ayant une thrombopénie vient ensuite la prééclampsie avec
10,52%. Nos chiffres sont supérieurs mais vont dans le même sens
que ceux obtenus à la suite des travaux dont les résultats ont
été publiés par Bonifacio L et al en 2012 : l'infection
39
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
maternelle durant la gestation avait été
observé chez 27,65% des cas. [45] ces résultats peuvent
s'expliquer par les différents mécanismes mis en jeu lors des
réactions
inflammatoires pouvant avoir un impact sur les plaquettes
maternelles et retentir sur les plaquettes chez le nouveau-né comme le
suggère certaines littératures.[19]
Association entre le sexe et la
thrombopénie.
Nous avons noté une prédominance masculine de
thrombopénie soit 63,16% et avec un sex-ratio de 1,71 sans toutefois de
lien de cause à effet entre le sexe masculin et la thrombopénie ;
c'est aussi ce que Bolat F. et al ont eu comme résultat à la fin
de leur étude en 2012 en Turquie[12] ; il en est de même des
observations faites par Ulusoy E. et son équipe qui font état
d'un taux de thrombopénie néonatale masculine de 64% avec une
sex-ratio de 1,73.[46] ces résultats suggèrent ainsi que le
chromosome Y pourrait y avoir un rôle.
Association entre le motif d'admission et le taux de
plaquettes
Les nouveau-nés présentant une
thrombopénie étaient admis pour infection néonatale
précoce (47,37%), risque infectieux mineur (15,79%) et risque infectieux
majeur (10,53%). A Madagascar en 2022 Harivony a également trouvé
que l'infection néonatale précoce était la cause la plus
fréquente (69,48%) des admissions des nouveau-nés
thrombopéniques ce qui concorde également avec les
résultats de Robert et al 15 ans plus tôt. [35,47] Ceci pourrait
s'expliquer par le fait qu'il existe une multitude de mécanismes
complexes mis en jeu lors des infections néonatales et qui incluent
entre autres une destruction plaquettaire par activation macrophagique.
Association entre manifestation hémorragique et le
taux de plaquettes
Nous avons trouvé que 31,58% de nouveau-nés avec
thrombopénie présentaient des manifestations hémorragiques
sans toutefois pouvoir établir une relation directe entre la
thrombopénie et les saignements (p= 0,001). Cette observation trouve sa
raison dans le fait que la littérature dit que le seuil de plaquettes
exposant le patient au risque d'hémorragie spontanée est de
50.000 /mm3 [27] et nous n'avons pas eu de taux en dessous.
5. Données sur l'hospitalisation
Durant notre étude, neuf décès ont
été enregistrés soit un taux de mortalité de 8,65
%, nos résultats sont inférieurs au taux de 42,7% retrouvé
dans l'étude de Bocoum et al. en 2019 au Mali.[34] de même, ils
sont inférieurs à ceux de Nyenga et al. obtenus en 2022 en
république démocratique du Congo [39] par contre, nos
résultats sont supérieurs à ceux de Dipak M et al en 2019
qui avaient révélé une mortalité de 3,7%.[38] ces
différences s'expliquent par la taille de l'échantillon et le
type d'étude.
40
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
CONCLUSION
Parvenu au bout de cette étude descriptive transversale
à collecte prospective. Qui avait comme objectif d'établir le
profil plaquettaire du nouveau-né à terme à
l'hôpital général provincial de référence J.
Sendwe de Lubumbashi nous observons que le profile plaquettaire du
nouveau-né à terme se présente avec un taux moyen de
plaquette de 230673 / mm3 ; avec aucune thrombocytose mais, un taux
de thrombopénie de 18,27%, qui s'accompagne de certains facteurs tels
que les antécédents d'infections urogénitales au cours de
la grossesse ; et chez le nouveau-nés de l'infection néonatale
précoce cependant sans lien de cause à effet avec un taux de
plaquettes bas ; une prédominance masculine est notée avec un
sexe ratio de 1,71.
41
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
RECOMMANDATIONS
De ce qui découle de notre étude, nous formulons
les recommandations suivantes : Aux autorités sanitaires de la
République Démocratique du Congo
· Renforcer les unités de néonatologie par la
dotation des laboratoire propres à l'unité ;
· Rendre accessible et systématique la
réalisation de la numération formule sanguine (NFS) pour tous les
nouveau-nés ;
· Envisager un système permettant l'utilisation
de concentrés de plaquettes d'aphérèse pour réagir
efficacement en cas de besoin.
Au personnel sanitaire
· Faire une surveillance hématologique chez les
nouveau-nés ;
· Faire une surveillance hématologique
particulière chez les nouveau- thrombopéniques jusqu'à la
normalisation du taux de plaquettes.
A la population
· Suivre précocement et régulièrement
les consultations prénatales (CPN) afin de dépister de
façon précoce et prendre en charge les pathologies sous-jacentes
et les situations à risque en occurrence les infections au cours de la
grossesse ;
· Se rendre plus tôt possible dans une formation
sanitaire dès qu'un nouveau-né va mal.
42
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
ANNEXES
FICHE DE COLLECTE DE DONNEES : PROFIL PLAQUETTAIRE
DU NOUVEAU-NE A TERME A L'HOPITAL SENDWE DE LUBUMBASHI
Numéro de la fiche:
SECTION I : FACTEURS
SOCIODEMOGRAPHIQUES
1. Identité de la mère :
Nom : ; Prénom :
Age : ans ; Commune : ; Profession :
SECTION II : ANTECEDENTS
1- Gynéco-obstétricaux :
1- Identité obstétricale : 1a-Parité ; 1b-
Gestité ; 1c-
Avortement ; 1d- Décès
1e- CPN réalisées : Oui Non
2- Pathologie au cours de la grossesse :
2a-Hypertension artérielle préexistante : Oui
Non
2b-Prééclampsie : Oui Non
2c-Eclampsie : Oui Non
2d-Infections urogénitales : Oui Non
2e-Diabète gestationnel : Oui Non
2f-Drépanocytose : Oui Non
2g-Paludisme : Oui Non
3- Toxicologiques et immunologiques : 3a-
alcool 3b- tabac ;
3c- Groupe sanguin (ABO) : 3d- Rhésus (D) :
3e-Transfusion : Oui Non ; si oui pour quelle
indication ?
4- Familiaux :
4a- Trouble de l'hémostase chez la mère : Oui
Non
(Saignement prolongé : lors des règles,
après accouchement, en cas de blessures...)
43
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
4b- Trouble de l'hémostase chez le père : Oui
Non
(Saignement prolongé : lors de la circoncision, en cas de
blessures...) SECTION III : DONNEES GENERALES RELATIVES AU
NOUVEAU-
NE
1-Date de naissance : ....../ /
2- Age gestationnel :
SA
3-Poids de naissance : g 4-
Age post natal :
5- Sexe :
6-Voie d'accouchement : voie basse voie haute
:
indication
7-Réanimation à la naissance : Oui
Non
8-Lieu d'accouchement : Sendwe
Transféré
9-Motif d'admission/
hospitalisation
10- Clinique : saignement (au point d'injection,
épistaxis, rectorragie, méléna)
Oui Non
11-Transfusion sanguine : Oui Non ; si oui,
indication :
12- Type de transfusion : Sang total : Oui Non
13- Administration de la vitamine K1 à la naissance : Oui
Non
SECTION IV : RESULTATS DE LABORATOIRE BIOLOGIE :
1-Taux de plaquettes : /mm 3
2-Groupe sanguin (système ABO) :
3- Rhésus :
4-Taux d'hémoglobine : g/l
5-CRP : Positive Négative
44
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
SECTION V : DONNEES SUR L'HOSPITALISATION
1- Durée de l'hospitalisation :
jours
2. Issue : Guérison Bonne
évolution Décès Perdue de
vue
45
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
REFERENCES
1. Lainey E et al. Hémogramme en pédiatrie :
variations physiologiques. Rev Francoph Lab. nov 2009 ; (416) :49-59.
2. Purpura thrombopénique immunologique de l'enfant et de
l'adulte. Haute autorité de santé. mai 2023.
3. Strassel C et al. Plaquettes sanguines de culture :
état de l'art. Bull Académie Natl Médecine. 1 déc
2020 ;204(9):971-80.
4. Donato H. Neonatal thrombocytopenia: A review. I.
Definitions, differential diagnosis, causes, immune thrombocytopenia. Arch
Argent Pediatr. 1 juin 2021
5. David J K. Revue générale des troubles
plaquettaires - Hématologie et oncologie. Édition professionnelle
du Manuel MSD. cité 23 nov 2022.
6. Serraj K et al. Les thrombocytoses : physiopathologie,
diagnostic et traitement. 2012;18.
7. Toughza J et al. Diagnostic et prise en charge d'une
thrombopénie néonatale sévère par allo-immunisation
materno-foetale: rapport d'un cas et revue de la littérature. Pan Afr
Med J. 29 déc 2020;37:382.
8. Homans A. Thrombocytopenia in the neonate. Pediatr clin north
am. juin 1996;43(3):737-56.
9. Patel R et al. Neonatal and pediatric platelet transfusions:
current concepts and controversies. Curr Opin Hematol. nov
2019;26(6):466-72.
10. Eltawel M et al. A prospective study on the incidence and
outcomes of neonatal thrombocytopenia at a tertiary care facility in central
saudi arabia. adv neonatal care. oct 2018;18(5):E3-12.
11. Gupta A, et al. Incidence of thrombocytopenia in the
neonatal intensive care unit. Med J Armed Forces India. juill
2011;67(3):234-6.
12. Bolat F et al. The prevalence and outcomes of
thrombocytopenia in a neonatal intensive care unit: a three-year report.
pediatr hematol oncol. 25 oct 2012;29(8):710-20.
13. Cremer M, et al. Thrombocytopenia and platelet transfusion
in the neonate. Semin Fetal Neonatal Med. févr 2016;21(1):10-8.
Mémoire rédigé par Chegninzebou Ngomsi Blestel 45
|
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
|
46
|
|
14. Chabernaud JL, et al. Transfusions plaquettaires en
néonatalogie.fevr 1995 :10.
15. Oulmaati A et al. Le profil épidémiologique
du syndrome hémorragique thrombopénique du nouveau-né
à propos de 91 cas. J Pédiatrie Puériculture. févr
2013;26(1):1-5.
16. Lemouakni S, et al. Thrombopénie sévère
chez un nouveau-né de mère splénectomisé pour
purpura thrombopénique idiopathique : Severe thrombopenia in an infant
born to mother splenectomized for idiopathic thrombopenic purpura. Pan Afr Med
J. 2017 ;28.
17. Abebe Gebreselassie H et al. Incidence and risk factors of
thrombocytopenia in neonates admitted with surgical disorders to neonatal
intensive care unit of tikur anbessa specialized hospital: a one-year
observational prospective cohort study from a low-income country. j blood med.
juill 2021;volume 12:691-7.
18. Sawadogo D et al. Perturbation de l'hémogramme au
cours des pathologies néonatales. Les plus fréquentes en milieu
hospitalier à Abidjan - Côte d'Ivoire. 2001;
19. Semakuba M et al. Distribution des taux des plaquettes
maternelles et neonatales aux cliniques universitaires de lubumbashi. janv
2021;57-64.
20. Guillot N. plaquettes sanguines et megacaryocytes humains:
impact de differentes concentrations d'acide docosahexaenoïque sur leur
activation et leur etat redox. 10 déc 2008;
21. Polycopié d'hématologie dcem3s1. ·
Aplastic anemia . dokumen.tips. [cité 1 juin 2023]. disponible sur:
https://dokumen.tips/documents/polycopi-dhmatologie-dcem3s1e-aplastic-anemia-.html
22. Rondina MT et al. platelets as cellular effectors of
inflammation in vascular diseases. circ res. 24 mai 2013;112(11):1506-19.
23. Alvarez RH et al. Biology of platelet-derived growth
factor and its involvement in disease. mayo clin proc. sept
2006;81(9):1241-57.
24. Labelle M et al. Direct signaling between platelets and
cancer cells induces an epithelial-mesenchymal-like transition and promotes
metastasis. cancer cell. nov 2011;20(5):576-90. Mémoire
rédigé par Chegninzebou Ngomsi Blestel 46
47
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
25. Lainey É et al. Particularités de la
numération formule sanguine et apport de la cytologie en période
néonatale. Rev Francoph Lab. 1 mars 2018;2018(500):36-47.
26. Dr Maillotte et al. Réseau
Méditerranée. 26 juill 2021;12.
27. Beuchee A et al. Mise à disposition des protocoles
médicaux du CHU de Rennes : filière pédiatrique. 2016 oct
p. 3.
28. Kaplan C, et al. Les thrombopénies maternelles au
cours de la grossesse, conséquences foetales et néonatales.
Hématologie. 31 janv 2000;5(6):461-8.
29. Brazy J et al. Neonatal manifestations of severe maternal
hypertension occurring before the thirty-sixth week of pregnancy. fev 1982;
30. Christensen RD et al. Thrombocytopenia in
small-for-gestational-age infants. pediatrics. 1 août
2015;136(2):e361-70.
31. Maury B et al. Diagnostic d'une thrombopénie
néonatale. Médecine Thérapeutique Pédiatrie. 6 mai
2002;5(1):59-64.
32. Sillers L et al. Neonatal thrombocytopenia: etiology and
diagnosis. pediatr ann [internet]. juill 2015;44(7).
33. Themes ufo. 335: Thrombopénie | medicine key
[internet]. 2017 [cité 10 mai 2023]. Disponible sur :
https://clemedicine.com/335-thrombopenie
34. Bocoum A. Profil de l'hémogramme des
nouveau-nés hospitalisés pour infection maternofoetale dans le
service de néonatologie du CHU Gabriel Touré, Bamako.2019 :91.
35. Harivony TL. Aspect epidemio-clinique, etiologique et
therapeutique des thrombopenies au service pediatrie chujrb [antananarivo];
2022
36. Asrie F et al. Prevalence of thrombocytopenia among pregnant
women attending antenatal care service at Gondar University Teaching Hospital
in 2014, northwest Ethiopia. J Blood Med. juin 2017;Volume 8:61-6.
37. Amazouz et al. Étude de l'allo-immunisation
foeto-maternelle dans le système ABO au service de Néonatologie
du CHU de Tizi-Ouzou. 2022
38. Dipak M et al. Prevalence and etiology of neonatal
thrombocytopenia in tertiary care NICU - paripex - indian journal of research
.Sept 2019
|
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
|
48
|
|
39. Nyenga AM et al. Epidémiologie de la
septicémie néonatale à Lubumbashi, République
démocratique du Congo.janvier 2021 Mémoire rédigé
par Chegninzebou Ngomsi Blestel 47
40. Mbarambara PM et al. Fréquence et facteurs de risque
des infections néonatales à l'Hôpital Général
de Référence d'Uvira (Est de la RD Congo). 2015;9.
41. Hebbar A. Etude des thrombopenies neonatales. 2018.
42. Kusumasari N et al. Incidence and risk factors of neonatal
thrombocytopenia: a preliminary study. Paediatr Indones. 3 mars
2010;50(1):31-7.
43. Oulmaati A et al. Le profil épidémiologique du
syndrome hémorragique thrombopénique du nouveau-né
à propos de 91 cas. J Pédiatrie Puériculture. févr
2013;26(1):1-5.
44. Monga J et al. Maladie hémolytique du
nouveau-né: du diagnostic à la prise en charge en milieu
sous-équipé. Cas de l'hôpital Jason Sendwe à
Lubumbashi, République Démocratique du Congo. 2019
45. Bonifacio L et al. Thrombocytopenia related neonatal outcome
in preterms. Indian J Pediatr. mars 2007;74(3):269-74.
46. Ulusoy E et al. Thrombocytopenia in neonates: causes and
outcomes. Ann Hematol. juill 2013;92(7):961-7.
47. Roberts I et al. Thrombocytopenia in the Neonate. Blood Rev.
juill 2008;22(4):173-86.
49
Mémoire rédigé par Chegninzebou Ngomsi
Blestel
| 


