|
Année académique : 2016-2017
REPUBLIQUE DEMOCRATIQUE DU CONGO
ENSEIGNEMENT SUPERIEUR UNIVERSITAIRE ET RECHERCHE
SCIENTIFIQUE
UNIVERSITE EVANGELIQUE EN AFRIQUE
U.E.A.

B.P : 3323
FACULTE DES SCIENCES AGRONOMIQUES
ET
L'ENVIRONNEMENT
|
Epidémiologie, diversité et
pathogénicité de la cercosporiose noire du
|
|
|
bananier (Musa ssp.) à Kabare et Walungu
au Sud Kivu
|
|
Par : DIEUMERCI MASUMBUKO Roosevelt
Travail de fin d'études présenté en
vue de l'obtention du diplôme d'Ingénieur (A0) en Sciences
Agronomiques et Environnement Option : Phytotechnie
Directeur : Professeur BISIMWA BASENGERE Espoir
Codirecteur : Ass. MUGISHO ZIRHUMANA Janvier

Prélude.
«Aux âmes bien-nées, la valeur n'attend point
le nombre d'années » dit-on.
Pierre Corneille
II
Dédicace.
A ma mère Régina M'NTALINDWA.
A la chère femme de mon oncle CHIREZI BUDUNDWA
Sarah.
A mon grand et petit frère IMANI MASUMBUKO et MURHABAZI
MASUMBUKO.
A mes chers cousins et cousines Espoir BAGULA, Esperance
BAGULA, Olivier
BAGULA, Willy BAGULA, Patience BAGULA, NYOTA BAGULA,
Timothée BAGULA,
Joël BAGULA, Christelle BAGULA, et MUKENGE NAMUBAMBA.
Aux familles NTALINDWA et LUMESHA.
A tous mes cousins, cousines, oncles et tantes.
A tous mes amis et connaissances.
A celle qui portera la charge du coeur de ce grand homme que
l'UEA vient de
former pendant cinq ans.
Je dédie ce travail
Roosevelt MASUMBUKO.
Roosevelt Masumbuko
III
In memorium.
En mémoire de mon regretté cher oncle BAGULA
NTALINDWA,
C'est avec un coeur déchiré et plein de larme,
chagrin que nous évoquons ce souvenir. Que la terre de nos
ancêtres vous soit douce.
IV
Remerciements.
C'est par cet adage de François Rabelais, « la
science sans conscience n'est que ruine de l'âme » que nous
avions débuté ces quelques mots de remerciement pour toutes les
personnes qui ont contribué à l'achèvement de ce
travail.
Nos remerciements les plus sincères s'adressent au
professeur BISIMWA BASENGERE Espoir qui a accepté non seulement de
superviser ce travail, mais également il nous a facilité d'avoir
les vitroplants de bananier pour l'étude en serre.
Nos remerciements sont adressés à l'assistant
MUGISHO ZIRHUMANA Janvier qui a accepté de codiriger le présent
travail.
Nos remerciements les plus spécifiques sont
adressés au chef des travaux Espoir BAGULA pour son soutien en ce qui
concerne les frais académiques durant nos cinq années
d'université et son soutien pour la réalisation de ce travail,
nous n'avons pas à vous donner ou à vous dire, mais le petit mot
suffit.
Nous tenons à remercier Erick NUNDA, Rosine, KALUBI
Armande et Steve pour leur accompagnement pendant les récoltes de nos
données.
Notre gratitude est exprimée à l'UEA,
particulièrement la Faculté des Sciences Agronomiques et
Environnement qui nous a offert les enseignements de qualité pour notre
formation.
A CHIREZI BUDUNDWA Sarah, nous lui disons grand merci pour
tous ce qu'elle a fait pour nous, en nous offrant de bonnes conditions
d'étude et les conseils malgré les difficultés qui
surgissent, maman, je ne sais pas quoi vous dire, seul l'avenir nous donnera
raison.
Nos remerciements s'adressent aussi à notre très
chère maman Régina M'NTALINDWA qui a supporté toutes nos
caprices durant le moment passé ensemble, chère mère,
quand nous nous rappelons de la récitation « Femme noire, femme
africaine », nous nous souvenons de toi.
Nous remercions également le chef des travaux AYAGIRWE
BASENGERE de ses conseils scientifiques pour la réalisation de ce
travail.
Nos remerciements les plus sincères s'adressent
également à nos amis Arsène MUKOME, MAJALIWA MAITAPO et
AGANZE MWEZE pour les conseils prodigués.
Nous tenons enfin, à remercier nos collègues et
camarades de promotion pour leur soutien pendant des bons et mauvais moments
passés ensemble.
V
Sigles et abréviations
PDA : Patato Dextrose Agar.
CMI: Commonwealth Mycological Institute.
r: Taux de développement de la maladie.
T: Témoin.
R2: coefficient de détermination.
P-value: Probabilité.
F: Test de Fisher.
FHIA: Fundacion Hondurena de Investigacion Agricole.
BAR-KAT: Barhabesha-Katana.
KIS-WAL: Kisamunyu-Walungu.
GRO- BUSH: Gros Michel-Bushumba.
MUSH-MUM: Musheba-Mumosho.
NAK-IKO: Nakasimbu-Ikoma.
KAM-IZE: Kamera-Izege.
LIT-TSH: Litete-Tshopo.
LIT-MAK: Litete-Makiso.
MAN-MAN: Magboba-Magboba.
LUX-MAK : Gros-Michel-Makiso.
KIS-MAN : Kisangani-Magboba.
NPK: azote phosphore potassium.
MRN : Maladie des Raies Noires.
A : un génome Musa acuminata.
AA : bananiers diploïdes à deux génomes
Musa acuminata.
AAB : bananiers triploïdes à deux génomes
Musa acuminata et un génome Musa balbisiana. ABB :
bananiers triploïdes à deux génomes Musa
balbisiana.
B : un génome Musa balbisiana.
VI
Résumé
Dans le cadre d'améliorer la gestion de la
cercosporiose noire du bananier, cette étude avait comme objectif
d'étudier la diversité de la cercosporiose noire du bananier dans
le territoire de Walungu et de Kabare. Une enquête a été
organisée à Walungu (dans les groupements d'Izege, Ikoma, Walungu
centre, Mushinga, Nyangezi, Irhongo, Burhale et la collectivité de
Kaziba) et à Kabare (dans les groupements de Katana, Bushumba, Miti,
Mudaka, Mumosho, Bugorhe, Mudusa et Chirunga). Il a été question
de déterminer l'incidence et la sévérité da la
cercosporiose noire du bananier, d'évaluer les moyens de lutte
utilisés par les paysans et de récolter les feuilles
présentant les symptômes de la maladie pour une
caractérisation morphologique et la réalisation du test de
pathogénicité. Un questionnaire d'enquête à des
questions fermées et une observation des plantes malades ont
été réalisés pour avoir les informations sur les
variétés et les maladies et la détermination de
l'incidence et la sévérité. L'isolement de
Mycosphaerella fijiensis sur milieu PDA ainsi que leurs observations
microscopiques ont été réalisées dans le
laboratoire de biologie moléculaire de la Faculté des Sciences
Agronomiques et Environnement. Le test de la pathogénicité s'est
effectué en serre sur trois variétés (FHIA17, NARITA4 et
NARITA13) provenant du Burundi au laboratoire d'Agro BioTech. Après
analyse, les résultats suivant ont été observés :
la maladie présente une forte incidence (71.9 %) et une
sévérité élevée à Walungu qu'à
Kabare (41.9 %). Six isolats ont été identifiés (M.
fijiensisBAR-KAT, M.
fijiensisKIS-WAL, M. fijiensisGRO-
BUSH, M. fijiensisMUSH-MUM, M.
fijiensisNAçIKO et M.
fijiensisKAM-IZE) et ont présenté des
caractéristiques morphologique typiques à M. fijiensis.
Pour l'évaluation du pouvoir pathogène, deux isolats ont
été utilisés en fonction de deux territoires, et ces
premiers ont affiché un pouvoir pathogène vis-à-vis de
NARITA4 et NARITA13. M. fijiensisKIS-WAL a
été plus virulent que M.
fijiensisBAR-KAT. Les deux isolats ont
présenté les symptômes typiques de la sigatoka noire, mais
la FHIA17 a présenté une résistance vis-à-vis de
ces deux isolats. En serre, les deux isolats de M. fijiensis ont
présenté une incidence élevée et ils y
étaient plus sévères. Ceci étant, nous recommandons
aux autres chercheurs qu'une étude sur la caractérisation
moléculaire de Mycosphaerella fijiensis soit
réalisée afin d'évaluer la variabilité
génétique des isolats à Kabare et Walungu. Que des
formations soient réalisées auprès des paysans pour
améliorer leur connaissance sur la lutte des maladies fongiques du
bananier.
Mots-clés : Cercosporiose noire,
épidémiologie, diversité, Bananier, Walungu et Kabare.
VII
Abstract
In the case of amelioration and black cigatoka management on
banana in our region. This study had as an object to study the diversity of
black cigatoka on banana in Walungu and Kabare territories. An inquiry was done
in Walungu (Izege, Ikoma, Walungu center, Mushinga, Nyangezi, Irhongo, Burhale
and the collectivity of Kaziba) and in Kabare (at Katana, Bushumba, Miti,
Mudaka, Mumosho, Bugorhe, Mudusa and Chirunga). It was a question of
determining the incidence and severity of black cigatoka on banana, evaluate
means to fight utilize by peasants and to harvest some leaves which present the
symptoms of this disease by morphologic characterization and the execution of
pathogenicity test. An inquiry questionnaire was used and the observation of
plants infected also to have some informations on varieties and diseases and
the determination of the incidence and severity. The isolation of
Mycosphaerella fijiensis on a PDA environment and the microscopic
observation was realized in biomolecular laboratory at U.E.A. pathogenitic test
was done under hothouse on three varieties (FHIA17, NARITA4 and NARITA13) from
Burundi at BioTechnological laboratory. After analyses, the following results
were observed: the disease presents a sturdy incidence and severity (seventy
one dots nine) a Walungu and forty one dot nine at Kabare. Six isolators were
identified (M. fijiensisBAR-KAT, M.
fijiensisKIS-WAL, M. fijiensisGRO- BUSH,
M. fijiensisMUSH-MUM,
M. fijiensisNAK-IKO and M.
fijiensisKAM-IZE) and have presented some typics morphologic
characteristics at M. fijiensis. For the evaluation of pathogenic
ability two isolating was utilized over two territories at the first have
showed a pathogenic ability against NARITA4 and NARITA13. M.
fijiensisKIS-WAL was very virulent than M.
fijiensisBAR-KAT. The two insulants have presented
some typics symptoms of black cigatoka but FHIA17 has presented a resistance on
two insulants, on hothouse the two insulants of M. fijiensis has
presented a high incidences and they were very severe. Seeing that we recommend
to others researchers that one study on molecular characterization of
Mycosphaerella fijiensis should be realized to evaluate the genetic
variability of insulants at Kabare and Walungu, those informations should be
diffused nearby the paysans to improve their knowledge on black cigatoka
stuggle on banana.
Key words: Black cigatoka, epidemiology, diversity, Banana,
Walungu and Kabare.
VIII
Listes des tableaux et figures
Tableau 1 : Les variétés/cultivars
rencontrées à Walungu et Kabare 19
Tableau 2 : Moyens de gestion des bananeraies 21
Tableau 3 : Susceptibilité des cultivars à la
cercosporiose noire du bananier quant aux paysans
dans le Walungu et Kabare 22
Tableau 4 : Incidence et sévérité de la
cercosporiose noire du bananier 23
Tableau 5 : Les dénominations des isolats
rencontrés 24
Tableau 6 : La couleur, la forme des mycéliums de
différents isolats et la couleur du fond de la
boite de pétrie. 27
Tableau 7. Le taux de développement de la maladie par
jour 30
Fig. 1 : Stades de développement de la
cercosporiose noire en champs d'après Fouré (1982) .... 7
Fig. 2 : Conidiophore et conidies (A) ; Spermogonie et
spermaties (B) ; périthèce, asques et
ascospores (C) de M. fijiensis (Onautshu et al., 2013).
8
Fig. 3 : Le cycle infectieux de M. fijiensis (Carlier,
2010). 9
Fig. 4 : les morceaux de feuilles avec symptômes de
M. fijiensis dans la boite de pétrie 15
Fig. 5 : Dispositif expérimental en block
complètement aléatoire avec trois répétitions
16
Fig. 6 : Les maladies rencontrées sur les bananiers
dans le Walungu et Kabare 20
Fig. 7 : Nombre de cloisons des conidies des isolats de M.
fijiensis 25
Fig. 8 : La structure des ascospores observés sur
microscope optique agrandis 40x. 25
Fig. 9 : La croissance mycélienne des
différents isolats de M. fijiensis 26
Fig. 10 : La coloration noire de M. fijiensis à la
face inferieure de la boite de pétrie. 28
Fig. 11 : symptômes de M. fijiensis en serre
29
Fig.12 : Sensibilité de différentes
variétés face à M.
fijiensisKIS-WAL et M. fijiensisBAR-KAT
29
Fig. 13 : L'indice de sévérité de la
MRN pour les différentes variétés 30
1
Introduction
1. Problématique et présentation du
travail
Dans le monde, la banane fait partie des aliments de base et
occupe la quatrième place après le riz, le blé et le lait.
Elle est une source d'énergie quotidienne pour 600 millions de personnes
et elle est un supplément alimentaire non négligeable pour 400
millions d'individus (Van den houwe et Swennen, 1998). Riche en fibres et
glucides, la banane constitue également une source en vitamines (Van den
houwe et Swennen, 1998 ; Bakry et al., 1997 ; Mobambo, 2002 et Forum
mondial bananier, 2016). La production mondiale est passée de 138,7
millions des tonnes en 2012 à 312,629 millions de tonnes en 2014, dont
84% constituent une consommation locale et 16% le commerce international
(FAOSTAT, 2017).
En Afrique, particulièrement l'Afrique occidentale,
25% des glucides ou hydrates de carbone ont comme origine la banane alors qu'en
Afrique orientale et spécifiquement dans la région des Grands
Lacs (Ouganda, Rwanda, Burundi et Est de la RDC), la consommation annuelle est
de l'ordre de 200 à 400kg de bananes par personne (Mercierlaan, 1998 et
Lassoudière, 2007). En République Démocratique du Congo,
la production estimée à plus de deux millions de tonnes en 2014
(FAOSTAT, 2017 ; Onautshu et al., 2013) occupe la deuxième
place après celle du manioc (Onautshu et al., 2013 ; Byenda,
2015). Le vin, l'un des sous-produits de la banane joue un grand rôle
social et culturel et est rencontré sur presque toutes les
cérémonies en RDC (Byenda, 2015).
Au Sud-Kivu, notamment dans les territoires de Walungu et
Kabare, les bananes et bananes plantains font parties des aliments de base et
constituent des ressources de revenu pour les paysans (Nyabyenda, 2006).
2. Problématique
Cultivés dans le monde entier, les bananiers sont
menacés par diverses maladies et ravageurs, dont les attaques les plus
dangereuses sont celles des champignons (Mycosphaerella fijiensis
Morelet), et Fusarium oxysporum f. ssp. Cubense, des
virus (Banana Bunchy Top Virus (BBTV), les nématodes
(Helicotylenchus mulicinetus, Pratylenchys speijeri n. ssp.
Meloidogyne
spp. et Radopholus similis), des
bactéries (Xanthomonas campestris pv. musacearum,
certaines lignées
2
pathogènes de Pseudomonas solanacearum) ou
d'insectes (le charançon Cosmopolites sordidus) (Mourichon
et al., 2000 ; Jones, 2000 et Onautshu et al., 2013).
La Cercosporiose noire du bananier ou maladie des raies noires
causée par un champignon ascomycète M. fijiensis,
constitue la maladie la plus destructrice du bananier plantain (Onautshu
et al., 2013), et elle s'étend à toutes les
régions de culture (Meredith et Lawrence, 1970 et Wilson, 1987). La
maladie des raies noires est plus disséminée dans le monde et
évolue rapidement chez les variétés déjà
sensibles à M. musicola (Onautshu et al., 2013).
Ainsi dit, elle induirait des pertes des rendements de 76 % et
la réduction de la qualité des fruits surtout pendant le second
cycle de production, tandis que les effets combinés de la maladie, des
ravageurs et du déclin de fertilité du sol réduirait le
rendement de 93 % (Ramsey et al., 1990 ; Mobambo et al.,1996
; Damme, 2008 ; Chillet et al., 2009 ; Daniells, 2009 et Kassi et
al., 2014).
Au Sud-Kivu, elle cause des dégâts plus
importants chez le bananier et le bananier plantain. Elle attaque uniquement le
feuillage et provoque la réduction de l'activité
photosynthétique de la plante conduisant à la baisse des
rendements (Byenda, 2015). Combiné à d'autres facteurs et
maladies, notamment l'absence de semences de qualité, la
sensibilité des variétés disponibles à certaines
maladies telles que la cercosporiose et la rosette (Mobambo et al.,
1996a ; Martinez et al., 2000 ; Chausse et al., 2012 et
Bizimana et al., 2012), le flétrissement bactérien du
bananier ou Banana Xanthomonas wilt (BXW), la fusariose, le bunchy top, le
charançon du bananier, les fourmis prédatrices et les
nématodes constituent un problème dans la production
bananière (Tushemereirwe et al., 2003; Youdeowei, 2004 et
Byenda, 2015). Beaucoup de travaux ont été effectués
l'état phytosanitaire du bananier dans la région et au cours
desquels plusieurs maladies ont été détectées (le
bunchy top (BBTV), le wilt bactérien du bananier les cercosporioses
ainsi que l'helminthosporiose (Byenda, 2015).
Malgré ces travaux, peu d'études ont
été orientées vers l'évaluation de la distribution
de la cercosporiose noire et la caractérisation des isolats de M.
fijiensis dans la région ainsi que fournir l'information sur la
sensibilité des génotypes cultivés. La gestion durable de
cette maladie, nécessite une évaluation
épidémiologique de la cercosporiose noire dans la région
ainsi qu'une caractérisation des isolats de l'agent pathogène qui
sont en circulation.
3
Quelques questionnements sont à considérer :
> Quel serait l'incidence et la sévérité
de la cercosporiose noire le Walungu et Kabare ?
> Quelles seraient les diversités des isolats de
M. fijiensis dans le Sud-Kivu comparativement aux populations de
M. fijiensis trouvées dans le monde ?
> Quelle devrait être la pathogénicité
de ces différents isolats de M. fijiensis sur quelques
nouvelles variétés de bananier ?
3. Hypothèses
> L'incidence et la sévérité de la
cercosporiose noire seraient élevées à Walungu et Kabare
et réduiraient les rendements des bananiers.
> Les isolats de M. fijiensis rencontrés
à Walungu et Kabare seraient différents selon le nombre de
cloisons des conidies, leur forme, la couleur des mycéliums et leur
vitesse de croissance.
> Les isolats de M. fijiensis rencontrés
à Walungu et Kabare présenteraient un pouvoir pathogène,
mais qui est différent suivant les variétés de
bananier.
4. Objectifs du travail
4.1. Objectif général
L'objectif général de ce travail est
l'étude de la diversité de la cercosporiose noire du bananier
dans le territoire de Walungu et Kabare en vue de proposer les
stratégies de contrôle et de gestion de la maladie.
4.2. Objectifs spécifiques
Spécifiquement notre travail a comme objectifs :
> Déterminer l'incidence et la
sévérité de la cercosporiose noire du bananier et bananier
plantain dans les territoires de Kabare et Walungu.
> Evaluer les caractéristiques phénotypiques
des différents isolats de M. fijiensis retrouvés dans
les deux territoires par rapport à ceux rapportés dans le
monde.
> Tester la pathogénicité des isolats de M.
fijiensis identifiés au Sud-Kivu.
4
Chapitre 1. Généralités sur le
bananier 1.1. Le bananier
1.1.1. Origine, description et
classification
Le bananier est une culture originaire de l'Asie du Sud-Est,
où il est cultivé depuis près de 10000 ans (Raemaekers,
2001 ; Abadie et al., 2003 ; Kouassi, 2005 ; Lassois et al.,
2009 ; Bizimana et al., 2012). La Malaisie ou l'Indonésie
parait être le centre probable de diversification (Daniells et al.,
2001 ; Lassois et al., 2009).
Le bananier cultivé est une plante herbacée
vivace, géante et monocotylédone appartenant à l'ordre des
Zingibérales ou scitaminales et à la famille des Musaceae
et au genre Musa (Lassois et al., 2009).
Botaniquement, le genre Musa est divisé en
espèces séminifères possédant des fruits non
comestibles et en variétés à fruits charnus sans graines
(fruits parthénocarpiques). Dans la section Eumusa, Musa
acuminata (symbole de génome : A) et Musa balbisiana
(symbole de génome : B) sont des espèces sauvages qui sont
à l'origine des variétés cultivées (Abadie et
al., 2003 ; Cirad-Flhor, 2003 ; Lassois et al., 2009).
Les espèces sauvages non comestibles, aux fruits
à graines, servent à d'autres fins que l'alimentation humaine
(fibre, alimentation du bétail, etc.). Elles sont toutes diploïdes
(AA et BB) (Abadie et al., 2003 ; Cirad-Flhor, 2003 ; Lassois et
al., 2009). Tandis que les variétés cultivées
à présent sont en général des clones
triploïdes stériles et aspermes (AAB et ABB), provenant soit des
croisements interspécifiques entre les deux espèces
séminifères sauvages diploïdes principales dont Musa
acuminata et M. balbisiana, soit de la seule M. acuminata
(AAA) (Lassoudière, 2007 et Lassois et al., 2009).
1.1.2. Description morphologique
a) L'appareil végétatif
Le bananier est une plante monocotylédone, elle
constitue une herbe géante et vivace chez laquelle le pseudo-tronc est
constitué par l'emboitement des gaines foliaires (Champion, 1963). Le
méristème terminal de la tige vraie souterraine appelé
improprement « bulbe » émet les feuilles (Bakry et al.,
1997).
5
Le bananier peut atteindre une hauteur allant de 1,5 à 6m
en Afrique (Raemaekers, 2001).
Un bananier adulte est constitué d'un cormus (partie
souterraine ou vraie tige du bananier) avec racines et rejets, d'un
pseudo-tronc ayant de feuilles et un régime des fruits (Raemaekers,
2001).
Chez le bananier, il y a deux sortes de bourgeons ; le
bourgeon apical et les bourgeons latéraux. Le bourgeon apical disparait
lorsque le méristème apical se transforme en inflorescence,
tandis que les bourgeons latéraux deviennent des rejets, qui constituent
en réalité les branches du tronc principal. Etant donné
que ces rejets deviennent des nouvelles plantes à fruits, il est
considéré comme plante vivace (Raemaekers, 2001 et Dhed'a et
al., 2011).
Ce sont les premières rangées de fleurs,
appelées mains, qui forment les régimes de fruits. Ces
premières constituent les fleurs femelles (Lassois et al.,
2009). Après les fleurs femelles, il y a deux à trois mains
de fleurs neutres qui apparaissent avec toutes les pièces florales
avortées, suivies par les mains de fleurs mâles composées
d'ovaires réduits et d'étamines bien développées
(Lassois et al., 2009).
1.1.3. Ecologie du bananier
Les bananiers et bananiers plantains se rencontrent dans des
zones agro-écologiques se situant entre 30° latitude Nord et Sud
(Dhed'a et al., 2011 et Onautshu et al., 2013).
a) Le climat
Le bananier, est une culture exigeante en eau. Les racines
n'absorbant aisément que le tiers de la tranche dite habituellement
utile. En climats chauds et humides, les besoins de la plante sont couverts
lorsque les précipitations atteignent 35 mm de pluie par semaine, soit
en moyenne 2500 mm de pluie repartie au cours de l'année (Dhed'a et
al., 2011 ; Onautshu et al., 2013). La grande
particularité du bananier est qu'elle est une herbe très riche en
eau, considéré dans son ensemble, il est composé à
plus de 90% d'eau (Lassoudière, 2007).
La température optimale est comprise entre 25 et
30°C, au-delà de 35 à 40°C et en deçà de
14°C, des anomalies surviennent, la croissance des feuilles est
retardée (Swennen et Vuylsteke, 2001 ; Lassoudière, 2007 ; Dhed'a
et al., 2011 et Onautshu et al., 2013). Le bananier supporte
des fortes insolations si l'approvisionnement en eau est suffisant ; elle est
une culture des jours longs facultatifs. Le seuil limite pour les heures
d'insolation est de 1500 à 1800 heures, mais
6
2000 à 2400 heures sont favorables. Le manque de
lumière agit donc sur la hauteur des plants et peut faire « filer
» les rejets (Dhed'a et al., 2011 et Onautshu et al.,
2013).
Le vent intervient sur la culture par l'incidence de sa
vitesse sur le feuillage par lacération de ce dernier jusqu'à la
destruction des cultures (Lassoudière, 2007) ; des pertes sont dues par
des vents violents, soit en brisant les feuilles aux pétioles, soit en
cassant les pseudos troncs (Dhed'a et al., 2011).
b) le sol
Les sols pour l'implantation des bananeraies sont très
variés dans le monde. Les sols profonds, limoneux et bien drainés
conviennent mieux pour la culture du bananier ; le N, P, K, Ca et Mg sont les
éléments indispensables pour un bon développement et une
production élevée, ces éléments sont
apportés sous forme d'engrais organique comme le fumier, le compost, les
engrais biologiques et les déchets agroindustriels (Laprade et Ruiz,
1999 ; Raemaekers, 2001). Un pH variant entre 4,0 et 8,0 est nécessaire
pour la bonne croissance et le bon développement des plantes
(Raemaekers, 2001). La croissance et le rendement sont fonction de la
fertilité des sols (Swennen et Vuylsteke, 2001).
1.2. La cercosporiose noire du bananier
1.2.1. Son origine et sa distribution
La cercosporiose noire ou maladie des raies noires a
été identifiée pour la première fois en 1963 sur la
côte sud-est de Viti Levu (îles Fidji) (Mourichon et al.,
1997). Un champignon ascomycète, est à l'origine de la
maladie de cercosporiose noire (Onautshu et al., 2013). Elle est
considérée comme la maladie la plus dévastatrice des
bananiers (Lassoudière, 2007). Avec le temps, la cercosporiose jaune
s'est vu rapidement remplacée par la cercosporiose noire en Asie et en
Amérique centrale, en raison de sa virulence plus grande et du spectre
d'hôtes plus large (Onautshu et al., 2013). En Afrique, la
maladie des raies noires a été signalée pour la
première fois en Zambie en 1973 (Onautshu et al., 2013). Elle a
été signalée en R.D.C par Mourichon en 1986. A Kinshasa,
des études de l'épidémiologie ont été
réalisées (Mobambo, 2002) et à Kisangani (Onautshu, 2007)
ont confirmé la présence de cette maladie en R.D.C.
7
1.2.2. Symptômes
Il est souvent difficile de donner les différences
entre les symptômes de la cercosporiose noire et celle de la
cercosporiose jaune. Sur la face supérieure du limbe apparait le premier
symptôme sous une forme de tiret jaune pâle pour la cercosporiose
jaune ou marron foncé sur la face inférieure du limbe de 1
à 2mm de long pour la cercosporiose noire (Mourichon et al.,
1997).
Elle affecte plusieurs cultivars résistants à la
cercosporiose jaune, tels ceux du sous-groupe des bananiers plantains (AAB). La
diminution des rendements peut aller dans certains cas, à plus de 50 %
(Mourichon et al., 1997).

Fig. 1 : Stades de développement de la
cercosporiose noire en champs d'après Fouré (1982).
A= Stade 1 : Décolorations et ponctuations brunes de moins de
0,5 mm sur la surface inférieure de la feuille ; B = Stade 2 : Raies
brunes rouilles inférieures à 4 mm et visible sur les deux faces
; C = Stade 3 : Raies allongées et élargies ; D = Stade 4 :Taches
brun-noir elliptiques ; E = Stade5: Taches brun-noir entourées d'un halo
jaune ; F = Stade 6 : Taches desséchées virant au gris avec en
son centre des points noirs qui correspondent aux fructifications du
pathogène (Onautshu et al., 2013).
1.2.3. Biologie, classification et diversité
génétique de M. fijiensis
Mycosphaerella fijiensis Morelet est l'agent causal
de la maladie des raies noires du bananier. C'est un champignon qui appartient
au Phylum des Ascomycota, dans la classe des Dothideomycètes,
Sous-classe des Dothideomycetidées, Ordre des Capnodiales, Famille des
Mycosphaerellaceae, Genre Mycosphaerella (Onautshu et al.,
2013).
Létude des populations pathogènes en
utilisant de marqueurs génétiques montre l'existence d'une
diversité génétique très importante notamment chez
M. fijiensis (Carlier et al., 1994). Il existe deux
caractéristiques biologiques qui doivent avoir un effet
déterminant sur la structure de ces parasites :
8
? la présence d'une forme parfaite,
hétérothallique, très développée; ce facteur
est connu pour être un facteur important de diversité;
? Les capacités de dispersion élevées,
augmentant d'autant les flux de gènes entre populations (Mourichon,
sd).
Champignon hétérothallique, M.fijiensis
se reproduit de façon sexuée et asexuée. La forme
asexuée (anamorphe) est appelée Paracercospora fijiensis
et celle sexuée (téléomorphe) est appelée
Pseudocercospora fijiensis.
Il a une croissance qui est lente en culture in vitro. Le
diamètre de croissance d'une culture issue d'une seule conidie est
presque 1cm après 38 jours d'incubation à 26°C (Meredith,
1970). Pour une bonne croissance, la température optimale est dans les
intervalles de 24-28°C tandis que celle de la germination optimale est aux
environs de 26°C. De 10 à 21 jours d'incubation, les colonies
peuvent produire des conidies (Onautshu et al., 2013).
L'observation au microscope montre que ce champignon
présente un conidiophore plus ou moins septé (0 à 5
septa), droit ou courbé souvent renflé à la base
(jusqu'à 8 um de diamètre), mesurant 16,5-62,5 um de long et 4 -7
um de large. Les conidies présentent une forme de massue, droites ou
incurvées, pointues à l'apex, tronquées ou arrondies
à la base, et peuvent avoir jusqu'à 10 cloisons
(généralement 5 à 7 cloisons), mesurant 30-132 um de long
et 2,5-5 um de large. Pour la production de la forme sexuée
(téléomorphe), le champignon développe des spermogonies
qui vont spécifier des spermaties (en forme de bâtonnet de 2,5-5 x
1,0-2,5 um de large). Il s'en suit la formation des périthèces
(47-85 um) dans lesquels se spécifient les asques et les ascospores
(11.5-16.5 x 2.5-5.0 um) (Onautshu et al., 2013).

Fig. 2 : Conidiophore et conidies (A) ; Spermogonie et
spermaties (B) ; périthèce, asques et ascospores (C) de M.
fijiensis (Onautshu et al., 2013).
Génétiquement, la structure des populations de
M. fijiensis provenant des différentes régions de la
planète a été étudiée avec les marqueurs
RFLP (polymorphisme de longueur des fragments
9
de restriction) ; ces études prouvent qu'il existe un
niveau élevé de variabilité génétique entre
les isolats de Philippines et de la Papouasie Nouvelle Guinée (Carlier
et al.,1994 et Onautshu et al, 2013).
1.2.4. Etude épidémiologique de la
cercosporiose noire
Les ascospores et les conidies de M. fijiensis
forment le potentiel d'inoculum qui est à la base des
épidémies dangereuses. La propagation de M. fijiensis
sur de longues distances est assurée par les ascospores qui sont
chez cette espèce la principale source d'inoculum. Les
différentes étapes de l'infection (pollution, germination,
développement épiphylle, pénétration stomatique)
sont sous le contrôle de conditions abiotiques (vent, rosée,
pluie, évaporation, température) (Meredith et Laurence, 1970).
1.2.5. Cycle d'infection de M.
fijiensis
M. fijiensis a un cycle infectieux qui soit
haplobionte et comprenant quatre phases: l'infection, l'incubation et latence
correspondant au début de la colonisation des tissus, la sporulation
suivie de la formation de propagules infectieuses, et la propagation de
l'inoculum secondaire (Onautshu et al., 2013).
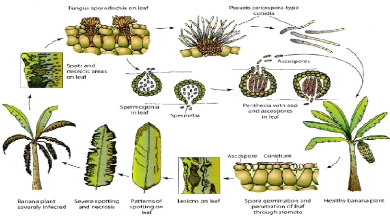
Fig. 3 : Le cycle infectieux de M. fijiensis (Carlier,
2010).
Différemment des conidies, les ascospores sont
constituées dans des pseudothèces se trouvant sur les feuilles
vieilles des bananiers ou bien sur les feuilles mortes posées à
même le sol. Le
10
mode de dissémination des ascospores est le vent et
sont lancées violemment suite au desséchement du
périthèce elles sont donc responsables de la dispersion à
une longue distance. Mais les conidies sont disséminées par les
pluies. En ce qui concerne les infections, les ascospores ou les conidies
donnent le même type de taches et de développement
subséquent de la maladie (Onautshu et al., 2013).
Pour la germination des ascospores de M. fijiensis,
une température variant 10 et 38°c, mais l'optimum de 27°C
avec un minimum de 20°C (Perez, 1996).
1.2.6. Sensibilité des
variétés
Trois grands types de comportements vis-à-vis de la
maladie caractérisent l'ensemble des variétés
étudiées que l'on peut classer en trois catégories bien
distinctes :
1. Bananiers très résistants (tR)
présentant un blocage de l'évolution de la maladie dès le
premier stade de l'infection (stade 1-2). Ce comportement met en oeuvre une
réaction de type « hypersensibilité »,
ex. la variété Yangambi Km5 et
Calcutta.
2. Bananiers partiellement résistants (pR).
L'évolution de la maladie est normale du premier stade au stade
nécrotique, mais lent. Le nombre de feuilles fonctionnelles à la
récolte reste élevé.
3. Bananiers sensibles (S). L'évolution de la maladie
vers le stade nécrotique est rapide ; le nombre de feuilles
fonctionnelles est faible, ex. Grande Naine (Mourichon, sd).
1.2.7. Moyens de lutte contre la MRN
Pour la lutte contre la MRN, plusieurs techniques de lutte
sont utilisées telles que la lutte biologique, la lutte chimique (les
fongicides systémiques), les pratiques culturales, mais également
l'utilisation des variétés améliorées. Pour une
lutte intégrée de la cercosporiose noire, toutes ces
méthodes sont utilisées simultanément dans
différentes régions de la production des bananes (Mourichon
et al., 1997, Orozco-Santos et al., 2011 et Onautshu et
al., 2013).
Il a été utilisé pour la
détermination du positionnement global du milieu d'étude et son
niveau d'élévation.
11
Chapitre 2. Milieu d'étude, matériels et
méthodes 2.1. Milieu d'étude
Le travail s'était déroulé dans les
territoires de Walungu et Kabare. Ces deux territoires se situent dans le
Sud-Kivu à l'Est de la R.D.Congo ; où une enquête a
été réalisée et la récolte des feuilles
présentant les symptômes de la MRN sur lesquelles les isolats de
M. fijiensis ont été obtenus. La caractérisation
des isolats de M. fijiensis s'était réalisée dans
le laboratoire de biologie moléculaire de la Faculté des Sciences
Agronomiques et Environnement à l'Université
Évangélique en Afrique (U.E.A).
Dans le territoire de Walungu, les groupements suivants ont
été concernés par notre travail : Izege, Ikoma, Walungu
centre, Mushinga, Nyangezi, Irhongo, Burhale et la collectivité de
Kaziba. A Kabare les groupements suivants ont été
considérés : Katana, Bushumba, Miti, Mudaka, Mumosho, Bugorhe,
Mudusa et Chirunga.
2.2. Méthodes et matériels
2.2.1. Matériels
a) Le matériel végétal
Les matériels végétaux utilisés sont
:
? Les bananiers ont étaient observés pendant
l'enquête.
? Les feuilles de bananiers présentant les
symptômes de la MRN ont été récoltées dans
différents groupements pour l'isolement et la caractérisation
morphologique de M. fijiensis.
? Les variétés FHIA17, NARITA4 et NARITA13 de
bananier provenant du Burundi, au laboratoire d'Agro BioTech, ont
été utilisées pour l'évaluation du pouvoir
pathogène des isolats identifiés.
b) Le GPS (Système de Positionnement
Global)
12
c) Le matériel fongique
Les différents isolats de M. fijiensis
identifiés M.
fijiensisBAR-KAT, M.
fijiensisGRO-BUSH, M. fijiensisMUSH-MUM,
M. fijiensisKAM-IZE,
M. fijiensisNAK-IKO et M.
fijiensisKIS-WAL, ont été
utilisés pour la caractérisation morphologique et les isolats
M. fijiensisBAR-KAT et M.
fijiensisKIS-WAL ont été
utilisés pour le test de pathogénicité.
d) Les matériels du laboratoire
Les matériels non fongiques utilisés au
laboratoire pour l'isolement et la caractérisation de M. fijiensis
ont été, entre autre les matériels du laboratoire la
boite de pétrie (dans laquelle le milieu de culture était
coulé, c'est un bocal de conservation de la gélose), la balance
de précision (a été utilisée dans la
détermination de la quantité de réactifs à utiliser
dans la composition du milieu de culture), le stérilisateur ou
hôte à flux laminaire (a permis de travailler sans contamination),
les éprouvettes, l'erlenmeyer (ballon à fond plat) (ont
aidé pour le mélange des solutions), l'autocuiseur et l'autoclave
(pour stériliser les récipients destinés à recevoir
les milieux de culture et autres outils), les écouvillons
(nécessaires pour l'écouvillonnage consistant à faire
rouler délicatement les écouvillons sur les milieux
sélectifs), l'incubateur (pour l'incubation à 25°C pendant
14 jours).
? Le milieu Pomme de terre Dextrose Agar
(PDA)
A constitué le milieu de culture de M. fijiensis
dont la préparation est de Prendre 200g de pomme de terre bouilli
puis filtré; ajouter 20g de dextrose et 20g d'agar dans un litre d'eau
distillé et chauffé pendant quelques minutes pour dissoudre
l'agar et en fin stériliser dans l'autoclave pendant 20 minutes à
une température de 120°C sous une pression d'une à une et
demi atmosphère. Le milieu est coulé dans des boites de
pétri à raison d'au moins que toute la base de la boite soit
couverte par le milieu. D'autres matériels utilisés sont : le
para film (utilisé pour coller les boites de pétri.
2.3. Méthodes
2.3.1. Enquête
Les travaux d'enquête et d'observation s'étaient
déroulés pendant la période pluvieuse, du 21
décembre 2016 au 21 janvier 2017.
13
Une observation des bananiers malades suivie d'une
enquête à un questionnaire fermé et d'une méthode
quantitative ont été réalisées. Pour l'obtention
des résultats escomptés, les personnes ayant des bananeraies ont
été enquêtées et les différentes questions
leur ont été adressées.
Il était question de connaitre les différents
cultivars (variétés) des bananiers rencontrés dans la
région ; les maladies qui attaquent les bananiers, l'incidence et la
sévérité de la cercosporiose noire du bananier à
Walungu et Kabare, les cultivars sensibles et résistants à cette
maladie ainsi que les moyens de lutte utilisés par les paysans.
? Echantillonnage
Pour ce qui concerne l'échantillonnage, en vue de la
détermination de l'incidence et de la sévérité de
la maladie des raies noires, deux territoires ont été pris en
compte ; Walungu et Kabare, avec huit groupements à Kabare et sept
groupements à Walungu plus la collectivité de Kaziba. Deux champs
ou bananeraies ont été pris dans chaque groupement en raison d'un
champ par localité. Ensuite 20 plantes ont été choisies
dans chaque champ de bananier selon la méthode de diagonale.
Les feuilles présentant des symptômes de la
cercosporiose noire du bananier ont été récoltées
et en fin, ces feuilles ont été utilisées pour l'isolement
de M. fijiensis.
160 personnes étaient enquêtées en raison
de 10 personnes par groupement d'où 80 par territoire. L'enquête
s'est déroulée du 21 décembre 2016 au 21 janvier 2017.
2.3.2. Evaluation de l'intensité de la
cercosporiose noire du bananier
L'intensité a été
déterminée en fonction de deux paramètres qui sont
l'incidence et la sévérité. L'incidence étant la
proportion des unités malades ou organes d'une des parties
analysées ; c'est le dégât causé par une maladie
donnée. Cette incidence a été déterminée par
la formule suivante : incidence= Nbre de plants malades * 100/Nbre de plants
observés. La sévérité étant une
évaluation qualitative du degré d'attaque (par exemple le
pourcentage de la surface foliaire nécrosée). L'indice de
sévérité mesure à un moment donné le taux de
surface foliaire détruite par la maladie des raies noies sur un bananier
(Craenen, 1998).
14
L'indice de sévérité (IS) de la maladie
des raies noires a été calculée selon la formule suivante
(Craenen, 1998) : Indice de Sévérité = ? (
N-1) T*100, où b = niveau de lésion des
feuilles notées
sur une échelle allant de 0 à 6 : 0 = pas de
symptôme ; 1 = Moins de 1 % de surface foliaire touchée
(uniquement stries et/ou au plus 10 lésions) ; 2 = 1 à 5 % de
surface foliaire touchée ; 3 = 6 à 15 % de surface foliaire
touchée ; 4 = 16 à 33 % de surface foliaire touchée ; 5 =
34 à 50 % de surface foliaire touchée ; b 6 = 51 à 100 %
de surface foliaire touchée ; n = Nombre de feuilles présentant
de lésion ; N = 7= nombre d'indices dans l'échelle de notation
des lésions des feuilles ; T = nombre total de feuilles
évaluées.
2.3.4. Isolement et caractérisation des isolats de
M. fijiensis
Pour la caractérisation des isolats, les feuilles
présentant les symptômes de M. fijiensis provenant de
Walungu et Kabare, ont été utilisées dans le laboratoire
de biologie moléculaire de la Faculté des Sciences Agronomiques
et Environnement de l'Université Evangélique en Afrique (UEA).
Le milieu PDA (Pomme de terre Dextrose Agar) a
été utilisé pour la culture des différents isolats
de M. fijiensis.
? Isolement proprement dit
Les isolats de M. fijiensis ont été
obtenus par la technique de décharge des ascospores sur milieu
gélosé (H2O Agar), qui ont été ensuite
repiquées sur milieu Potato Dextrose Agar (PDA) (Carlier et
al., 2003).
Pour la mise à décharge, les morceaux de
feuilles nécrosées de 1cm ont été pris, ensuite mis
à tremper dans un litre d'eau de javel pendant cinq secondes afin de les
humidifier. Les morceaux de feuilles ont été ensuite
placés à l'intérieur des boites de Pétri contenant
20ml pour chacune. La face supérieure de la feuille était
dirigée vers le haut, face inférieure au milieu de culture. Les
boites ont été incubées à température
ambiante pendant quatre jours, puis le repiquage sur PDA s'est effectué.
Après repiquage, les boites étaient incubées à
25°C pendant 14 jours. L'observation au microscope a été
réalisée pour l'identification des conidies 14 jours
après. Les isolats obtenus ont été repiqués en
boites de Pétrie afin de conserver la collection établie.
La figure suivante illustre la procédure de l'isolement
des populations de M. fijiensis.
15
Fig. 4 : les morceaux de feuilles avec symptômes de M.
fijiensis dans la boite de pétrie ? Caractérisation
phénotypique ou morphologique
Les caractéristiques phénotypiques
macroscopiques, visent à connaitre la coloration, la forme, l'aspect du
mycélium et la vitesse de croissance des mycéliums des isolats en
croissance sur milieu PDA pendant 10 jours. La croissance radiale fongique a
été mesurée et calculée selon
la formule suivante : avec, ri comme rayon spécifique,
di le diamètre spécifique et do
le diamètre de la rondelle fongique de départ
(Onautshu et al., 2013).
Les caractéristiques phénotypiques
microscopiques ont concerné la forme et le nombre de cloisons (septa)
des conidies et ont eu lieu 14 jours après incubation sur milieu PDA par
la méthode de scotch au grossissement 40x, et ont été
réalisées à partir des petits fragments de culture
prélevés dans la boite de pétrie et montés entre
lames et lamelles microscopiques avec une goutte du Gemsa concentré
placée sur la lame puis le scotch a été placé sur
la goutte de Gemsa. La face contenant les fragments de culture dirigée
vers le haut ensuite, une autre goutte a été mise sur le scotch
(sur la face dirigée vers le haut) et en fin, une lamelle y a
été placée.
2.3.5. Tests de pathogénicité et
évaluation de la résistance de certaines variétés
à la MRN. Deux isolats de M. fijiensis dont M.
fijiensisKIS-WAL et M.
fijiensisBAR-KAT ont été
utilisés pour le test de pathogénicité sur le bananier en
fonction de nos deux territoires d'étude. Leur choix a été
influencé par la vitesse de croissance mycélienne (la faible et
la plus grande vitesse de croissance). L'activité s'était
passée en serre, à une température de 25-27°C. Les
variétés de bananier FHIA17 (à cuire/bière),
NARITA4 et NARITA13 (à cuire) ont été utilisées
pour ce test. L'essai s'est déroulé en serre avec un dispositif
complètement aléatoire avec deux facteurs (isolats et
variétés). Le dispositif expérimental est parenté
à la figure suivante :

FHIA17
M. f.BAR-KAT
T
M. f.KIS-WAL
NARITA4
M. f.BAR-KAT T
M. f.KIS-WAL
NARITA13
M. f.BAR-KAT
T
M. f.KIS-WAL
FHIA17
M. f.BAR-KAT
T
M. f.KIS-WAL
NARITA4
M. f.BAR-KAT T
M. f.KIS-WAL
NARITA13
M. f.BAR-KAT
T
M. f.KIS-WAL
FHIA17
M. f.BAR-KAT
T
M. f.KIS-WAL
NARITA4
M. f.BAR-KAT T
M. f.KIS-WAL
NARITA13
M. f.BAR-KAT
M. f.KIS-WAL T
16
Légende : M. f.: M. fijiensis, T :
Témoin.
Fig. 5 : Dispositif expérimental en serre en block
complétement aléatoire
Le taux de développement (r) de la maladie a
été déterminé en appliquant l'équation
suivante :
i e xi e xo
r = ( Log - Log ; où t1= temps final, t0= temps initial,
x1= indice de sévérité final
ti-to i-xi i-xo)
et x0= indice de sévérité initial
(Castâno, 2002). Et la formule de l'indice de
sévérité de Craenen,
(1998) était ensuite utilisée, Indice de
Sévérité = ?nb(1V-i) T * 100.
Préparation de l'inoculum
L'inoculum a été préparé en
prenant les boites de pétrie contenant des mycéliums d'isolats
M. fijiensisKIS-WAL et M.
fijiensisBAR-KAT. Dix millilitres d'eau
distillée y ont été ajoutés et les mycéliums
ont été lentement grattés. Cette solution a ensuite
été centrifugée pendant 20 minutes pour une
homogénéisation. L'inoculation de la solution a été
réalisée par pulvérisation sur les bananiers d'une
quantité de 3ml.
17
La pathogénicité a été
évaluée au 11ème et au 18ème
jour après inoculation des bananiers.
2.4. Analyse des données
Les données ont été encodées dans
le logiciel Microsoft Excel 2010 ; les analyses des données
quantitatives et qualitatives se sont faites par le logiciel STATISTIX 9.0. Les
résultats en graphiques ont été
générés par Microsoft Excel 2010. L'analyse de la variance
a été utilisée pour l'incidence et l'indice de
sévérité à Walungu et Kabare. La comparaison entre
l'incidence et l'indice de sévérité à Walungu et
Kabare a été effectuée par le test T de Tukey HSD. Au
laboratoire, les données obtenues par observation au microscope et sur
boite de pétrie pour la croissance des mycéliums ont
été récoltées dans un carnet et encodées
dans Excel 2010.
18
Chapitre 3. Présentation, interprétation
et discussion des résultats 3.1. Présentation et
interprétation des résultats
3.1.1. Objectif 1. Incidence et
sévérité de la cercosporiose noire du bananier
a) Caractéristiques des enquêtés
dans les territoires de Walungu et Kabare
Les résultats de l'enquête montrent que la
plupart des cultivateurs des bananiers dans le territoire de Walungu et Kabare
sont en majorité des hommes. L'âge de nos enquêtés
est autour de 53#177;14ans, c'est-à-dire que le plus âgé a
67ans et le moins âgé possède 39ans.
En ce qui concerne leur expérience en culture des
bananiers, les cultivateurs des bananiers de Walungu et Kabare ont un âge
moyen de 28#177;14ans dans la culture des bananiers, signifie que le plus
expérimenté possède 42ans et le moins
expérimenté possède 18ans en culture bananière.
b) Les principales caractéristiques de la culture
des bananiers dans le Walungu et Kabare.
Les résultats de notre enquête montrent que les
bananiers à Walungu et Kabare sont généralement en
association (71.2 % des agriculteurs). Les principales cultures
associées aux bananiers dans les deux territoires sont les maniocs, les
haricots, les maïs, les ignames, les taros, les patates douce, les pommes
de terre, les caféiers, les amarantes, les courges, etc.
Dans les deux territoires, l'utilisation de la matière
organique occupe une grande importance dans la fertilisation de la culture du
bananier avec 97.5 % des enquêtés à Walungu et 98.7 % des
enquêtés à Kabare. L'utilisation des engrais chimiques se
trouve encore à un niveau très bas dans cette région. Ce
n'est qu'à Burhale qu'on a trouvé 20 % des enquêtés
qui utilisent le NPK dans leurs bananeraies.
c) Les cultivars des bananiers rencontrés dans le
Walungu et Kabare
Le tableau ci-dessous donne toutes les variétés
des bananiers rencontrées dans les territoires de Walungu et celui de
Kabare.
19
Tableau 1 : Les variétés/cultivars
rencontrées à Walungu et Kabare
|
Variétés
|
Walungu
|
|
|
Kabare
|
|
|
|
Oui %
|
Non %
|
Total %
|
Oui %
|
Non %
|
Total %
|
|
Magizi
|
87.5
|
12.5
|
100
|
72.5
|
27.5
|
100
|
|
Kisamunyu
|
85.0
|
15.0
|
100
|
71.2
|
28.8
|
100
|
|
Barabesha
|
60.0
|
40.0
|
100
|
37.5
|
62.5
|
100
|
|
Kamera
|
60.0
|
40.0
|
100
|
53.7
|
46.3
|
100
|
|
Musheba
|
57.5
|
42.5
|
100
|
61.2
|
38.8
|
100
|
|
Gros-Michel
|
58.7
|
41.3
|
100
|
71.2
|
28.8
|
100
|
|
Buganda
|
11.2
|
88.8
|
100
|
11.2
|
88.8
|
100
|
|
Chineke
|
12.5
|
87.5
|
100
|
13.7
|
86.3
|
100
|
|
Bisukari
|
11.2
|
88.8
|
100
|
38.7
|
61.3
|
100
|
|
Ndundu
|
3.7
|
96.3
|
100
|
28.7
|
71.3
|
100
|
|
Malaya
|
17.5
|
82.5
|
100
|
61.2
|
38.8
|
100
|
|
Nakasimbu
|
7.5
|
92.5
|
100
|
42.5
|
57.5
|
100
|
|
Chingulube
|
7.5
|
92.5
|
100
|
13.7
|
86.3
|
100
|
|
Poyo
|
10.0
|
90.0
|
100
|
0.0
|
100
|
100
|
|
Mukombozi
|
0.0
|
100
|
100
|
33.7
|
66.3
|
100
|
Le tableau ci-haut montre que dans le territoire de Kabare,
toutes ces variétés y sont cultivées excepté la
variété Mukombozi, de même qu'à Walungu on a toutes
ces variétés sauf Poyo.
Quel que soit le territoire, le Magizi est le cultivar le plus
rencontré, suivi par le Kisamunyu, Kamera et Gros Michel. A Kabare le
cultivar Ndundu est le moins rencontré tandis que Buganda est le moins
cultivé à Walungu. D'autres cultivars sont cultivés dans
les deux territoires presqu'avec les mêmes proportions. Les plantains et
les cultivars à bière sont les plus cultivés dans cette
partie de la province du Sud-Kivu (Magizi, Kisamunyu, Ndundu et Buganda).
d) Les principales maladies des bananiers
rencontrées dans le Walungu et Kabare.
Le graphique ci-après montre les différentes
maladies rencontrées sur les bananiers dans les territoires de Walungu
et Kabare.
20

Wilt BBTV Cercosporiose Helminthosporiose Fusariose
Kabare Walungu
Maladies rencontrées en %
40
80
70
60
50
30
20
10
0
Fig. 6 : Les maladies rencontrées sur les bananiers
dans le Walungu et Kabare
La figure 6 montre que les maladies les plus
rencontrées chez les bananiers dans les territoires de Walungu et Kabare
sont principalement la fusariose du bananier, le flétrissement
bactérien du bananier ou wilt bactérien du bananier, la
cercosporiose noire du bananier ou maladie des raies noires (MRN), la Banana
Bunchy Top Virus (BBTV) et l'helminthosporiose du bananier. Ce sont des
maladies qui font plus de dégâts dans cette région,
l'helminthosporiose ne cause que peu de dégâts à la culture
du bananier.
Dans les villages enquêtés, il y a eu toujours
présence de ces cinq maladies dont le wilt bactérien et la
fusariose sont les maladies les plus rencontrées sur les bananiers
cultivés et cela beaucoup plus à Kabare qu'à de Walungu.
Elles sont suivies par la maladie de la cercosporiose noire dans les deux
territoires, mais cette dernière est plus rencontrée chez les
bananiers à Walungu qu'à Kabare. La BBTV connu sous le nom de
« Syndicat » est plus rencontrée à Walungu.
e) Les principaux moyens de gestion et lutte contre les
maladies chez les bananiers
Le tableau suivant explique les différents moyens de
gestion et de lutte contre les maladies du
bananier.
21
Tableau 2 : Moyens de gestion des bananeraies
|
Walungu
|
Entretien
|
Type entretien
|
Lutte
|
Fongicide
|
|
Oui %
|
Non %
|
Tot %
|
Coupe %
|
Sarcl %
|
Tot %
|
Dess %
|
Ster %
|
Tot %
|
Non %
|
|
100
|
0
|
100
|
46.3
|
53.7
|
100
|
27.5
|
72.5
|
100
|
100
|
|
Kabare
|
100
|
0
|
100
|
28.7
|
71.3
|
100
|
77.5
|
22.5
|
100
|
100
|
|
Moyenne %
|
100
|
0
|
100
|
37.5
|
62.5
|
100
|
52.5
|
47.5
|
100
|
100
|
Légende : Dess= Dessouchage, Ster=
Stérilisation, Sarcl= Sarclage, Tot= Total.
Il ressort du tableau 2 que l'entretien constitue le moyen
essentiel de gestion des bananeraies et de lutte contre les maladies à
Walungu et Kabare. La majorité de nos enquêtés, les
agriculteurs des bananiers font l'entretien de leurs bananeraies, cela est
dû par le manque de la connaissance sur l'utilisation des produits
phytosanitaires et le manque des moyens financiers.
Dans les deux territoires, pour lutter contre les maladies, le
dessouchage des plantes malades constitue la solution la plus efficace (52.5 %
de nos enquêtés). A Walungu ; c'est beaucoup plus la
stérilisation des outils ou instruments qui est utilisé pour
l'entretien (58 % de nos enquêtés) alors qu'à Kabare c'est
le dessouchage qui est plus pratiqué (77.5 % de nos
enquêtés).
De nos enquêtés, quel que soit le territoire,
personne n'utilise les produits phytosanitaires (les pesticides) pour lutter
contre les maladies des bananiers. Les causes principales de non utilisation
des pesticides sont le manque des connaissances sur les produits
phytosanitaires et le manque des moyens financiers pour s'en procurer.
f) Susceptibilité des cultivars à la
cercosporiose noire du bananier
Le tableau suivant donne des renseignements sur les
cultivars/variétés résistants et sensibles
rencontrés à Walungu et Kabare selon l'appréciation des
paysans.
22
Tableau 3 : Susceptibilité des cultivars à
la cercosporiose noire du bananier quant aux paysans dans le Walungu et
Kabare.
|
Cultivars/Variétés
|
Groupe
|
Sous-groupe
|
Usage
|
Cultivars sensibles/résistants
|
|
Magizi
|
AAA
|
Plantain
|
Plantain/bière
|
-
|
|
Kisamunyu
|
AAA
|
Plantain
|
Plantain/cuire
|
++
|
|
Barhabesha
|
AAB
|
Plantain
|
Plantain/cuire
|
+++
|
|
Musheba
|
AAB
|
Plantain
|
Plantain/cuire
|
++
|
|
Gros-Michel
|
AAA
|
Gros Michel
|
Dessert
|
++
|
|
Kamera
|
AAA
|
Cavendish
|
Dessert
|
++
|
|
Buganda
|
AAB
|
Plantain
|
Cuire
|
++
|
|
Chineke
|
AAA
|
Gros Michel
|
Dessert/bière
|
++
|
|
Bisukari
|
AAA
|
Cavendish
|
Dessert/bière
|
++
|
|
Ndundu
|
AAA
|
Gros Michel
|
Bière/cuire
|
--
|
|
Malaya
|
AAA
|
Cavendish
|
Dessert/bière
|
-
|
|
Nakasimbu
|
ABB
|
Pisang awak
|
Bière
|
++
|
|
Chingulube
|
AAA
|
Cavendish
|
Dessert
|
++
|
|
Poyo
|
AAA
|
Cavendish
|
Dessert
|
+
|
|
Mukombozi
|
AAB
|
Plantain
|
Cuire/bière
|
- - -
|
Légende : + : cultivars moyennement
susceptible, ++ : susceptibles, +++ : très susceptibles ; -
: moyennement resistant, - - : resistants, - - - : pas
susceptible.
Du tableau 3, il est à noter que le cultivar qui n'est
susceptible à la maladie des raies noires est le Mukombozi ;
après les enquêtes réalisées dans les territoires de
Walungu et Kabare, les résultats montrent Mukombozi est le cultivar le
plus résistant à la cercosporiose noire du bananier. Selon les
explications de certains cultivateurs des bananiers dans les deux territoires,
le nom « Mukombozi » dérive de la résistance du
cultivar aux maladies notamment le wilt bactérien du bananier, la Banana
Bunchy Top Virus (BBTV) et la maladie de la sigatoka noire. Les Malaya et
Magizi sont les cultivars moyennement résistants, tandis que Ndundu est
résistant à la cercosporiose noire du bananier, mais sa
résistance est faible par rapport à Mukombozi. Les
résultats montrent que le Kisamunyu et Barhabesha sont les cultivars
susceptibles à la maladie et cela est justifié par le fait qu'ils
sont des cultivars d'altitude.
23
g) L'incidence et la sévérité de la
maladie des raies noires et analyse de la variance pour l'incidence dans les
territoires.
Le tableau ci-après illustre l?incidence et la
sévérité de la MRN à Walungu et Kabare.
Tableau 4 : Incidence et sévérité de
la cercosporiose noire du bananier
|
Territoire
|
Groupement
|
Incidence (%)
|
Sévérité
|
I.S (%)
|
|
Collectivité de
|
35.0
|
D
|
30.3
|
|
Kaziba
|
|
|
|
|
Nyangezi
|
80.0
|
E
|
41.6
|
|
Ikoma
|
90.0
|
E
|
40.0
|
|
Izege
|
85.0
|
E
|
50.0
|
|
Walungu
|
Walung centre
|
75.0
|
E
|
54.5
|
|
Mushinga
|
70.0
|
E
|
40.0
|
|
Burhale
|
75.0
|
E
|
45.4
|
|
Irhongo
|
65.0
|
E
|
36.4
|
|
|
71.9a
|
E
|
42.3a
|
|
Katana
|
50.0
|
D
|
33.3
|
|
Bushumba
|
10.0
|
B
|
13.6
|
|
Miti
|
30.0
|
C
|
26.7
|
|
Mudaka
|
80.0
|
E
|
63.6
|
|
Kabare
|
Mumosho
|
75.0
|
E
|
60.0
|
|
Bugorhe
|
55.0
|
D
|
41.6
|
|
Mudusa
|
5.0
|
A
|
9.1
|
|
Chirunga
|
30.0
|
C
|
33.3
|
|
|
41.9b
|
B
|
35.2b
|
|
F : 6.77 P-value : 0.0209
|
|
56.9
|
B
|
38.7
|
Légende : A et B: moins sévère, C :
sévère, D : moyennement sévère et E : très
sévère.
24
Du tableau 4, il ressort que l'incidence de la maladie des
raies noires est de 56.9 % à Walungu et Kabare. Elle est plus
élevée à Walungu (72 %) qu'à Kabare (42 %). En ce
qui concerne l'indice de sévérité, qui mesure à un
moment donné le taux de surface foliaire détruite par la maladie
sur un bananier. Cet indice est très élevé à
Walungu avec 42.3% de surface foliaire des bananiers sont détruites par
la maladie de la cercosporiose noire du bananier tandis qu'à Kabare il
est de 35.2 %.
Après analyse de la variance (ANOVA), il ressort que
l'incidence et l'indice de sévérité de la maladie ont
variée en fonction de deux territoires d'étude de façon
significative (P-value ? 0.05, voire en annexe). La séparation de
moyenne a montré une forte incidence à Walungu (71.9) avec un
indice de sévérité de 42.3 % par rapport à Kabare
(41.9) avec un indice de sévérité de 35.2 %.
3.1.2. Objectif 2 : Caractérisation
phénotypique des isolats de M. fijiensis a) Dénomination
des différents isolats identifiés dans le Walungu et
Kabare.
Le tableau qui suit donne les dénominations des isolats
identifiés à Walungu et Kabare.
Tableau 5 : Les dénominations des isolats
rencontrés
|
Origine
|
Groupement
|
Variétés
|
Isolats M. fijiensis
|
|
Katana
|
Barhabesha
|
M. fijiensisBAR-KAT
|
|
Kabare
|
Bushumba
|
Gros-Michel
|
M. fijiensisGRO-BUSH
|
|
Mumosho
|
Musheba
|
M. fijiensisMUSH-MUM
|
|
Izege
|
Kamera
|
M. fijiensisKAM-IZE
|
|
Walungu
|
Ikoma
|
Nakasimbu
|
M. fijiensisNAçIKO
|
|
Walungu centre
|
Kisamunyu
|
M. fijiensisKIS-WAL
|
Légende: BAR-KAT: Barhabesha Katana, GRO-BUSH:
Gros-Michel-Bushumba, MUSH-MUM: Musheba-Mumosho, KAM-IZE: Kamera-Izege,
NAK-IKO: Nakasimbu-Ikoma, KIS-WAL : Kisamunyu-Walungu centre.
Le tableau 5 donne les différents isolats de M.
fijiensis qui ont été identifiés dans le laboratoire
de biologie moléculaire à la faculté des sciences
agronomiques et environnement. Ces isolats concernent la variété
sur laquelle les feuilles d'isolement ont été
prélevées et le groupement d'origine des feuilles.
25
b) Nombre de cloisons des conidies des différents
isolats obtenus et leurs ascospores.
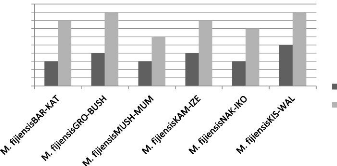
La figure qui suit donne les informations sur le nombre de
cloisons ou segments des conidies des isolats de M. fijiensis.
Nombre de cloisons des conidies
10
9
8
7
6
5
4
3
2
1
0
cloison minimal cloison maximal
Les isolats identifiés à Walungu et Kabare
Fig. 7 : Nombre de cloisons des conidies des isolats de M.
fijiensis
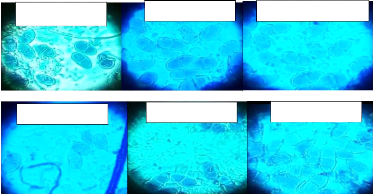
La figure suivante illustre la structure des ascospores des
isolats de M. fijiensis.
M. f. BAR-KAT
M. f. KAM-IZE
M. f. GRO-BUSH
M. f. NAK-IKO M. f. KIS-WAL
M. f. MUSH-MUM
Fig. 8 : La structure des ascospores observées sur
microscope optique agrandis 40x.
La figure 8 montre comment les conidies de M. fijiensis
sont cloisonnées et cela est fonction des différents isolats
rencontrés à Walungu et Kabare. L?isolat M.
fijiensisBAR-KAT présente des
26
conidies avec des cloisons allant de 3 à 8 cloisons, le
M. fijiensisGRO-BUSH présente des
cloisons allant de 4 à 9. Pour le M.
fijiensisKIS-WAL, ses conidies ont marqué
beaucoup plus de cloisons que tous les autres isolats (5 à 9 cloisons).
Le M. fijiensisMUSH-MUM possède des
cloisons de 3 à 6, c'est l'isolat avec moins de cloisons. Mais le M.
fijiensisNAK-IKO, a des cloisons allant de 3
à 7. Et en fin, le M. fijiensisKAM-IZE, a
des cloisons qui vont de 4 à 8. Les clés d'identification pour le
M. fijiensis, prouvent que cette dernière a des conidies avec
des cloisons allant de 1 à 10.
La figure 11 montre que les ascospores de M. fijiensis
sont constituées de deux cellules et ces derniers présentent
une forme séparée.
c) La croissance mycélienne de différents
isolats de M. fijiensis
La figure ci-après donne les longueurs et vitesses de
croissance des différents isolats de M. fijiensis
identifiés à Walungu et Kabare.
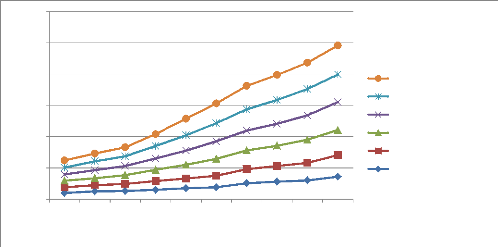
Croissance mycéliènne en mm
40
60
50
30
20
10
0
1 2 3 4 5 6 7 8 9 10
Jours de croissance
M. fijiensisKIS-WAL M. fijiensisNAK-IKO M. fijiensisKAM-IZE M.
fijiensisMUSH-MUM M. fijiensisGRO-BUSH M. fijiensisBAR-KAT
Fig. 9 : La croissance mycélienne des
différents isolats de M. fijiensis
La figure 9 montre qu'après 10 jours, la croissance des
mycéliums est arrivée à 9,3mm (M.
fijiensisKIS-WAL, la croissance la plus élevée) en
général. Mais cette croissance est fonction de chaque isolat.
L'isolat M. fijiensisBAR-KAT est arrivé
à 7,2mm et M. fijiensisGRO-BUSH
présente la croissance la plus faible avec 6,9mm. D'autres isolats ont
atteint presque une même longueur
Légende : M. f. : M. fijiensis
27
mycélienne (8,8mm). Tout au début, cette
croissance est un peu rapide et se ralentit petit à petit. La vitesse de
croissance est fonction de chaque isolat c'est-à-dire ; pour l'isolat
M. fijiensisKIS-WAL, sa vitesse de croissance est de 0,93mm/jour, pour
l'isolat M. fijiensisBAR-KAT, elle est de
0,72mm/jour. L'isolat M. fijiensisGRO-BUSH
enregistre la vitesse de croissance la plus faible et est de 0,69mm/jour.
Tandis que les isolats M. fijiensisKAM-IZE et
M. fijiensisNAK-IKO ont atteint une vitesse de
croissance de 0,88mm/jour. Les populations de M. fijiensis ayant une
croissance lente avec un maximum de 25mm pendant 45jours, ceci démontre
que les isolats obtenus à Walungu et Kabare appartiendraient à
M. fijiensis.
d) La couleur des mycéliums de ces
différents isolats de M. fijiensis
Le tableau suivant montre les différentes
caractéristiques macroscopiques des différents isolats de M.
fijiensis qui ont été isolés dans les territoires de
Walungu et celui de Kabare.
Ce tableau donne des renseignements sur la couleur des
mycéliums de différents isolats, la forme et la couleur du fond
de la boite de pétrie.
Tableau 6 : La couleur, la forme des mycéliums
de différents isolats et la couleur du fond
|
de la boite de pétrie.
|
|
|
|
|
|
Isolats
|
Couleur mycélienne
|
Forme
|
|
Couleur fond boite de pétrie
|
|
M. f. BAR-KAT
|
Blanc-verdâtre
|
Irrégulière, bombée
|
légèrement
|
Noirâtre
|
|
M. f. GRO-BUSH
|
Blanc-rosâtre
|
Irrégulière et légèrement
bombée
|
Noirâtre
|
|
M. f. MUSH-MUM
|
Verdâtre
|
Irrégulière, bombée
|
légèrement
|
Noirâtre
|
|
M. f. KAM-IZE
|
Grisâtre
|
Irrégulière, bombée
|
légèrement
|
Noirâtre
|
|
M. f. NAK-IKO M. f. KIS-WAL
|
Verdâtre Blanc-verdâtre
|
Irrégulière, bombée
Irrégulière,
légèrement
bombée
|
Noirâtre
Noirâtre
|
28
La figure suivant illustre la couleur des mycéliums de
M. fijiensis à la face inférieure de la boite de
pétrie.

Fig. 10 : La coloration noire de M. fijiensis à la
face inferieure de la boite de pétrie.
Du tableau 6, il y ressort que les différents isolats
de M. fijiensis obtenus dans les territoires de Walungu et Kabare sont
différents par leur couleur, leur forme et sont tous identiques pour ce
qui concerne la face inferieure ou le fond de la boite de pétrie. En
observant la face inférieure de la boite de pétrie ou le fond de
la boite de pétrie, on observe une coloration noirâtre ; ce qui
caractérise les populations de M. fijiensis.
Ainsi dit, l'isolat M.
fijiensisBAR-KAT et M.
fijiensisKIS-WAL possèdent une couleur
blanc-verdâtre, l'isolat M.
fijiensisGRO-BUSH présente une coloration
blanc-rosâtre, l'isolat M.
fijiensisMUSH-MUM et M.
fijiensisNAK-IKO ont une coloration verdâtre ;
tandis que l'isolat M. fijiensisKAM-IZE
présente une coloration grisâtre. Toutes ces colorations font
parties des caractéristiques principales des populations de M.
fijiensis. Ces isolats présentent presque la même forme des
mycéliums qui est la forme irrégulière
légèrement bombée. C'est-à-dire que leur forme dans
la boite de pétri n'est pas constante, elle varie d'un endroit à
un autre.
3.1.3. Objectif 3 : Evaluation de la
pathogénicité
Il ressort des résultats que l'inoculation des
bananiers par ces deux isolats a donné lieu à des symptômes
typiques de la maladie des raies noires dans les conditions de la serre dont,
les premiers signes visibles (face inferieure de la feuille) de la maladie sont
des petits jaunes ou rouges qui sont apparues au onzième jour. Au
18ème jour, les petits points jaunes étaient devenus
des tirets brun-foncés parallèles aux nervures secondaires.
La figure suivante montre les symptômes de M. fijiensis
en serre.
29

Fig. 11 : Symptômes de M. fijiensis en serre
a) Le pouvoir pathogène d'isolat M.
fijiensisKIS-WAL et M.
fijiensisBAR-KAT sur certaines
variétés
La figure suivante explique le pouvoir pathogène de M.
fijiensisBAR-KAT et M.
fijiensisKIS-WAL sur les trois
variétés utilisées.
FHIA17 NARITA13 NARITA4
120
|
100
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80 60 40 20
|
|
|
|
|
|
|
|
|
|
|
Sensibilité en %
|
|
|
|
|
|
|
|
M. fijiensisKIS-WAL M. fijiensisBAR-KAT
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fig.12 : Sensibilité de différentes
variétés face à M.
fijiensisKIS-WAL et M. fijiensisBAR-KAT.
Il ressort de la figure 12 que l'isolat M.
fijiensisKIS-WAL est plus virulent que l'isolat
M. fijiensisBAR-KAT. Cela est dû par les conditions de
développement des isolats dans les milieux, leur constitution
génomique, mais également, il peut y avoir des mutations
génétiques. Tous les plants de la variété NARITA13
et NARITA4 ont été infectés. M.
fijiensisBAR-KAT a infecté plus NARITA4 (68%
des plants) que NARITA13 (37% des plants). La variété FHIA17 a
présenté une résistance face à ces deux isolats, il
n'y avait pas de symptôme jusqu'au 18ème jour.
b) L'indice de sévérité de la
cercosporiose noire
La figure ci-dessous montre comment l'indice de
sévérité est différent suivant les
variétés et le temps d'observation.
30

30
M. fijiensisKIS-WAL M. fijiensisBAR-KAT
Indice de sévérité en %
25
20
15
10
0
5
11e jour 18e jour
FHIA17
11e jour 18e jour
NARITA13
11e jour 18e jour
NARITA4
Fig. 13 : L'indice de sévérité de la MRN
pour les différentes variétés
La figure 13 explique que l'indice de
sévérité le plus élevé était de
M. fijiensisKIS-WAL sur NARITA13 (25%). Ce qui
confirme que le M. fijiensisKIS-WAL est plus
sévère que le M. fijiensisBAR-KAT.
c) Le taux de développement de la maladie (en %
par jour) Le tableau suivant donne le taux de développement de
la MRN.
Tableau 7. Le taux de développement de la maladie
par jour
|
Cultivars
|
Isolats
|
IS0 (%)
|
IS1 (%)
|
r (%)/jour
|
|
FHIA17
|
M. fijiensisKIS-WAL
|
0.0
|
0.0
|
0.00
|
|
M. fijiensisBAR-KAT
|
0.0
|
0.0
|
0.00
|
|
NARITA4
|
M. fijiensisKIS-wAL
|
16.5
|
22.2
|
0.14
|
|
M. fijiensisBAR-KAT
|
14.6
|
16.6
|
0.05
|
|
NARITA13
|
M. fijiensisKIS-WAL
|
18.4
|
24.9
|
0.10
|
|
M. fijiensisBAR-KAT
|
10.8
|
22.1
|
0.28
|
Il ressort du tableau 7 que le M.
fijiensisBAR-KAT avait un taux de
développement élevé sur NARITA13. Le M.
fijiensisKIS-WAL a présenté un taux de
développement élevé sur les deux cultivars, ce qui
explique sa plus forte virulence. On constate que lorsque l'indice de
sévérité augmente, le taux de développement
augmente aussi. Le faible taux de développement de la maladie a
été observé chez le M.
fijiensisBAR-KAT sur NARITA4.
31
3.2. Discussion des résultats
Eu égard aux résultats obtenus lors de
l'étude de ce travail dont l'objectif était d'étudier la
diversité de la cercosporiose noire du bananier dans les territoires de
Walungu et Kabare dans le sens de mettre au point des stratégies pour
lutter contre cette maladie causée par un champignon ascomycète
Mycosphaerella fijiensis.
Pour ce qui concerne les maladies rencontrées sur la
culture du bananier dans les territoires de Walungu et Kabare, la fusariose du
bananier et le wilt bactérien du bananier occupent la première
position, suivie de la cercosporiose noire du bananier, l'helminthosporiose et
la Banana Bunchy Top (BBTV). Nos résultats corroborent ceux
trouvés par Ndungo (2008), Damme et al., (2013) et Byenda
(2015) en ce qui concerne la maladie du wilt bactérien du bananier, tous
ont déterminé son incidence et sa sévérité
montrant que l'incidence était très élevée parce
qu'il y n'a pas de variétés qui soient résistantes
d'où la maladie est très sévère. Selon Bizimana
et al., (2012), le wilt bactérien, la fusariose, la Banana
Bunchy Top Virus et le cercosporiose noire du bananier sont les maladies plus
redoutables pour la culture du bananier, ces résultats sont semblables
à ceux que nous avons trouvé, parce que ce sont toujours les
quatre maladies qui sont dominants dans notre région d'étude.
Quant à la fusariose, elle prédomine dans la région de
façon endémique par sa capacité à se maintenir dans
le sol pendant plus de 30ans.
Pour l'évaluation de la situation de la cercosporiose
noire du bananier dans les territoires de Walungu et Kabare, cette maladie
présentait une incidence qui est de 57% et une
sévérité très élevée de façon
générale. Mais dans certains groupements l'incidence arrivait
jusqu'à 80%. L'incidence et la sévérité les plus
élevées se trouvaient dans le territoire de Walungu que dans le
territoire de Kabare, ceci peut être due par le fait la cercosporiose
jaune du bananier était déjà signalée dans le
territoire de Walungu (Zihalirhwa, 2011), or les variétés
déjà attaqués par cette dernière sont très
sensibles à la cercosporiose noire et attaque les bananiers de haute et
basse altitude différemment de la Sigatoka jaune qui est
rencontrée uniquement en basse altitude (Mourichon et al.,
1997). D'après les résultats de Onautshu (2007) et Onautshu
et al., (2013), dans la région de Kisangani, il montre que
l'incidence de la maladie des raies noires varie entre 40 - 90%, ces
résultats sont les mêmes que les nôtres. Mobambo et Naku
(1993), dans la région du Haut-Zaïre, et De Lapeyre et al.,
(2010) ont déterminé l'incidence de cette maladie et ont
trouvé que, cette dernière avait une forte agressivité.
Les études de Mobambo et al., (1996), dans
32
la ville de Kinshasa a trouvé la même incidence
de la sigatoka noire. Selon Mourichon et al., (1997), il a
démontré que cette maladie présentait une gravité
élevée (très agressif) et a également montré
que la maladie présentait une incidence et une
sévérité très élevée.
La variété Mukombozi présente une
certaine résistance à la cercosporiose noire du bananier, les
autres variétés sont sensibles à cette maladie.
D'où le nom de Mukombozi provient de la résistance qu'a cette
variété face à la maladie des raies noires. Contrairement
à nos résultats, Dhed'a et al., (2011) et Onautshu
et al., (2013) dans la région de Kisangani, ont trouvé
que la variété Yangambi km5 était très
résistante à la cercosporiose noire.
Pour la caractérisation morphologique des isolats
obtenus à Walungu et Kabare, nos résultats montrent que la
dénomination des isolats est faite suivant la variété sur
laquelle la feuille présentant des symptômes a été
tirée et le groupement d'origine. Les isolats suivants ont
été obtenus : M. fijiensisBAR-KAT
(Barhabesha-Katana), M. fijiensisGRO-BUSH
(Gros-Michel-Bushumba), M. fijiensisMUSH-MUM
(Musheba-Mumosho), M. fijiensisKAM-IZE
(Kamera-Izege), M. fijiensisNAK-IKO (Nakasimbu-Ikoma) et M.
fijiensisKIS-WAL (Kisamunyu-Walungu centre). Le
nombre de cloisons des conidies pour les différents isolats obtenus
varient entre 3 et 9. D'après les résultats de Tshidibi et
al., (2013), le nombre de cloisons se situant dans les intervalles de 310.
La moyenne pour le nombre de cloisons de conidies étant de 1 à 10
(CMI, 1974 ; Jones, 2000 ; Carlier et al., 2003 et Onautshu et
al., 2013), ce qui a confirmé nos résultats.
En ce qui concerne la vitesse de croissance mycélienne
moyenne, elle était de 0,68mm/jour sur milieu PDA à
température ambiante (25°C) après 10 jours. En comparaison
avec les isolats de Tshidibi et al., (2013) la croissance
mycélienne moyenne de LIT-TSH (1,38mm/jour) suivi de LIT-MAK
(1,25mm/jour) alors que MAN-MAN (1,00mm/jour), LUX-MAK (1,00mm/jour), KIS-MAN
(1,00mm/jour) après 14 jours, alors que les nôtres avaient une
croissance de M. fijiensisKIS-WAL (0,93mm/jour), le M.
fijiensisBAR-KAT (0,72mm/jour), le M.
fijiensisGRO-BUSH (0,69mm/jour) et les M.
fijiensisKAM-IZE et M.
fijiensisNAK-IKO (0,88mm/jour). Contrairement
à nos résultats ; Onautshu et al., (2013) a
trouvé que les isolats plus lents avaient 0,19mm/jour et les plus
rapides 0,36mm/jour sur PDA à 25°C, M. fijiensis
étant un champignon à croissance lente (Tshidibi et
al., 2013).
Pour la couleur du mycélium à la face
inférieure de la boite de pétrie, cette dernière est de
couleur noire, qui est l'une des caractéristiques principales de M.
fijiensis. Les résultats de
33
(Tshidibi et al., 2013 et Onautshu et al.,
2013) confirment les nôtres selon lesquels, la présence de la
couleur noire à la face inférieure du mycélium. La couleur
du mycélium à la partie supérieure étant de
blanc-verdâtre, blanc-rosâtre, verdâtre ou grisâtre
selon l'isolat et leur forme étant irrégulière et
légèrement bombée, ces mêmes résultats ont
été trouvés par Tshidibi et al., (2013) et
Onautshu et al., (2013).
Eu égard à ces caractéristiques, nous
pouvons confirmer l'hypothèse selon laquelle ces isolats
appartiendraient à M. fijiensis.
Pour le test de pathogénicité, les
lésions macroscopiques sont apparues au 11ème jour
après inoculation jusqu'au 18ème jour, les isolats
M. fijiensisKIS-WAL et M.
fijiensisBAR-KAT avaient un pouvoir pathogène
face à deux cultivars NARITA4 et NARITA13, le M.
fijiensisKIS-WAL était plus virulent que le
M. fijiensisBAR-KAT. Cette virulence peut
être expliquée par le fait qu'il existe plusieurs souches en
fonction des zones de développement, de leur génétique et
des mutations qui peuvent surgir au cours de leur développement. Le
cultivar FHIA17 a présenté une certaine résistance
à la cercosporiose noire du bananier. Les résultats
trouvés par Rosales et al., (2010) et Kodjo et al.,
(sd), ont démontré que les FHIA étaient résistants
à la cercosporiose noire. Par contre l'étude de Onautshu et
al., (2013), dans la région de Kisangani où il a
inoculé 20 isolats dans les mêmes conditions ; les premiers
symptômes visibles sont observés à partir du
17ème jour et il est arrivé au stade nécrotique
(stade 5) au 30-35ème jour. Or notre étude s'est
limitée au deuxième stade.
34
Conclusion et recommandation
Le présent travail a consisté à une
diversification de la cercosporiose noire du bananier dans le territoire de
Walungu et Kabare afin d'en améliorer de manière efficace la
gestion.
Une enquête auprès des paysans combinés
à une observation des plantes a été réalisée
à Walungu et Kabare, au Sud-Kivu. 160 cultivateurs de bananiers ont
été enquêtés en raison de 80 par territoire.
L'isolement et la caractérisation morphologique des isolats de M.
fijiensis ont été réalisés dans le laboratoire
de biologie moléculaire de l'U.E.A. Un test de
pathogénicité a été réalisé en
serre.
Après analyse des données, les résultats
suivants ont été atteints:
? Les maladies rencontrées dans la région sont
généralement la fusariose, le wilt bactérien, la
cercosporiose noire, la Banana Bunchy Top Virus et l'helminthosporiose du
bananier sont des maladies qui font des dégâts sur la culture
bananière. La fusariose et le wilt sont les maladies les plus
rencontrées sur le bananier à Walungu et Kabare.
? L'incidence de la cercosporiose noire a été
plus élevée à Walungu (72%) par rapport au territoire de
Kabare (57%). La sévérité également a
été plus élevée à Walungu qu'à
Kabare.
? Les travaux d'entretien des bananeraies constituent le
principal moyen de lutte utilisé par les paysans dans la lutte contre la
maladie des raies noires (58% à Walungu et 52% à Kabare).
L'utilisation des fongicides contre la MRN est encore très faible dans
la région.
? Pour les paysans de Walungu et Kabare la
variété Mukombozi présente une forte tolérance
à la MRN. Les variétés Malaya et Magizi ont une
tolérance moyenne.
? Pour la caractérisation phénotypique de M.
fijiensis, les isolats obtenus ont été nommés suivant
la maladie, la variété sur laquelle l'isolat a été
obtenu et le milieu d'origine notamment, M.
fijiensisBAR-KAT (Barhabesha Katana), M.
fijiensisGRO-BUSH (Gros-Michel-Bushumba), M.
fijiensisMUSH-MUM (Musheba-Mumosho), M.
fijiensisKAM-IZE (Kamera-Izege), M.
fijiensisNAK-IKO (Nakasimbu-Ikoma), M.
fijiensisKIS-WAL (Kisamunyu-Walungu centre). Le
nombre de cloisons, la croissance mycélienne, ainsi que la couleur
35
mycélienne ont permis de confirmer que les isolats
identifiés dans le travail sont morphologiquement semblables à
ceux obtenus par d'autres chercheurs.
? En ce qui concerne le test de pathogénicité,
les deux isolats utilisés ont été virulents, mais celui de
Walungu était plus virulent que celui de Kabare.
Partant de nos résultats nous pouvons recommander:
? Qu'une étude sur la caractérisation
moléculaire de M. fijiensis soit réalisée afin
d'évaluer la variabilité génétique des isolats de
Walungu et Kabare.
? Que des formations soient réalisées
auprès des paysans pour améliorer leur connaissance sur la lutte
des maladies fongiques du bananier.
36
Bibliographie
1. Abadie C.F., Bakry J., Carlier M.L., Caruana F.,
Cote J., Gan ry T., Lescot P., Marie J.L., Sarah, Sanchez C. et Loeillet D.,
2003. Bananes For Ever, Fruit Trop. N° 99 P5.
2. Abadie C., Zapater M.F., Pignolet L., Carlier J.
and Mourichon X., 2008.Artificial inoculation on plants and banana
leaf pieces with Mycosphaerella spp., responsible for Sigatoka leaf
spot disease. Fruits 63, 319-323.
3. Bakry F., Charrier A., Hamon S., Jacquot M. et
Nicolas D., 1997. L'amélioration des plantes tropicales.
MontPellier, France : CIRAD/ ORSTOM, 109-139.
4. Bizimana S., Ndayihanzamaso P., Nibasumba A. et
Niko N., 2012. Conduite culturale et protection du bananier au
Burundi. Publication ISABU : Référentiel sur la culture du
bananier ISABU Avenue de la Cathédrale. BP 795 Bujumbura Burundi. P1.
67P.
5. Byenda M.B., 2015. Effet des pratiques
culturales dans la lutte contre le flétrissement bactérien du
bananier, Banana Xanthomonas Wilt, (BXW) à Kadjucu, Sud Kivu,
République Démocratique Du Congo. Agronomie
générale. International Journal of Innovation and Scientific
Research .ISSN 2351-8014 Vol. 13 No. 2, pp. 432-442.
6. Carlier J., Mourichon X., Gonzalez-de-Léon
D., Zapater M.F. and Lebrun M.H., 1994. DNA restriction fragment
length polymorphisms in Mycosphaerella species causing banana leaf
spot diseases. f'hyfopathokgy (in press).
7. Carlier J., De Waele D. et Escalant J.V.,
2003. Evaluation globale de la résistance des bananiers
à la fusariose, aux maladies foliaires causées par les
Mycosphaerella
spp. et aux nématodes.
Evaluation de la performance (A. Vézina et C. Picq, eds). Guides
techniques INIBAP 7. Réseau international pour l'amélioration de
la banane et de la banane plantain, Montpellier, France. 62p.
8. Carlier J., 2010. Génétique
des populations et adaptation de champignons parasites de plantes.
Université Montpellier II. Sciences et techniques du Languedoc,
Académie de Montpellier, p4.
9. Castaño Z.J., 2002. Principios
básicos de fitoepidemiología. Centro editorial, Universidad de
Caldas. Manizales, Colombia. 398pp.
37
10. Champion J., 1963. Le bananier. Paris:
Maisonneuve et Larose.
11. Chausse J.P., Thomas K. et Ngonde R.,
2012. «L'agriculture : pierre angulaire de l'économie de
la RDC», dans Johannes Herderschee, Daniel Mukoko Samba et Moïse
Tshimenga Tshibangu (éditeurs), Résilience d'un Géant
Africain : Accélérer la Croissance et Promouvoir l'Emploi en
République Démocratique du Congo, Volume II : Etudes
sectorielles, MÉDIASPAUL, Kinshasa, pages 1-97.
12. Chillet M., Abadie C., Hubert O., Chilin-Charles
Y. et De Lapeyre de Bellaire L., 2009. Sigatoka disease reduces the
green life of bananas. Crop Protection, 28 (1): 41-45.
13. Conde-Ferraez L., Waalwijk C.,
Canto-Canché B.B., Kema G.H.J., Crous P.W., James A.C. and Abeln E.C.A.,
2007. Isolation and characterization of the mating type locus of
Mycosphaerella fijiensis, the causal agent of black leaf streak
disease of banana. Molecular Plant Pathology 8(1): 111-120.
14. Craenen K. 1998. Technical manuel on
black Sigatoka disease of banana and plantain International Institute of
Tropical Agriculture. Ibadan, Nigeria.
15. Cirad-Flhor, 2003. Bananes forever. La
diversité génétique des bananiers, fruitstrop, 99. 5.
16. Cirad, 2008. Memento de l'agronome.
17. CMI., 1974. Description of pathogenic
fungi and bacteria. N° 413 et 414.
18. Damme J.V., 2008. Analyse
systémique des contraintes en culture bananière au Rwanda.
Diplôme en vue de l'obtention du diplôme de bioingénieur ;
Université Catholique de louvain.
19. Damme J.V., Philippe B. et Bruno D.,
2013. Analyse systémique des processus d'innovation dans les
systèmes agraires de la région des Grands Lacs basés sur
la culture de la banane ; Université catholique de Louvain
Faculté d'ingénierie biologique, agronomique et environnementale.
Thèse présentée en vue de l'obtention du grade de docteur
en sciences agronomiques et ingénierie biologique.
20. Daniells, J.W., 2009. Global banana
disease management-getting serious with sustainability and food security.Acta
Hortic. 828, 411-416.
38
21. Daniells J.W., 2001. Musalogue: a catalogue
of Musa germplasm. Diversity in the genus Musa. MontPellier, France :
INIBAP.
22. Dhed'a D., Moango M. et Swennen R., 2011.
La culture des bananiers et bananiers.
23. De Lapeyre de Bellaire L., Ngando E.J., Abadie
C., Carlier J., Lescot T. et Fouré E., 2006. Management of
black sigatoka in Cameroon. In: E.Soprano, F.A. Tcacenco, L.A.
Lichtemberg and M.C. Silva, eds. Banana: A sustainable business.
Proceeding of the XVII meeting of ACORBAT held at Joinville - Santa Catarina,
Brasil, from 15 to 20october 2006. 2: 122-132.
24. De Lapeyre de Bellaire L., Abadie C., Carlier J.,
Ngando J. et Kema H.J.G., 2010. Les cercosporioses des bananiers
(Mycosphaerella spp) : vers une lutte intégrée.
25. FAOSTAT., 2017. Food and Agriculture
Organization of the United Nations.
http://faostat3.fao.org/home/index_fr.html.
26. Forum mondial bananier, 2016. La banane,
un profil de produit de base par INFOCOMM. Fonds de la CNUCED pour
l'information sur les marchés des produits de base agricoles.
27. Fouré E., 1994. Leaf spot
diseases of banana and plantain caused by Mycosphaerella fijiensis and M.
musicola. Pp. 37-46 in The improvement and testing of Musa: a
global partnership. Proceedings of the first Global conference of the
International Testing Programme held at FHIA, Honduras (D. Jones, ed.). INIBAP,
Montpellier, France.
28. Gauhl F., 1994. Epidemiology and ecology
of black Sigatoka (Mycosphaerella fijiensis Morelet) on plantain and
banana in Costa Rica. INIBAP, Montpellier, France. 120 pp.
29. Jones D.R., 2000. Diseases of banana,
Abacá and Enset. CABI Publishing International, Wallingford, UK. 323
p.
30. Kassi M.F., Badou J.O., Tonzibo F.Z., Salah Z.,
Bolou A.B.B., Camara B., Amari L. et Kone D., 2014. Potentiel
antifongique de l'huile essentielle de Ocimum gratissimum dans la
lutte biologique contre la maladie des raies noires du bananier causée
par Mycosphaerella fijiensis Morelet (Mycosphaerellacea).
Laboratoire de physiologie végétale, UFR Biosciences,
Université Félix Houphouët Boigny, 22 BP 582 Abidjan 22,
Côte d'Ivoire. Email :
fernand2kassi@yahoo.fr.
Laboratoire de chimie organique et biologique, UFR SSMT, Université
Félix Houphouët Boigny, 22 BP 582 Abidjan 22, Côte
d'Ivoire.
39
31. Kodjo T., Christophe N.J. et Escalant J.V.,
sd. Revue des stratégies d'amélioration conventionnelle
de Musa.
32. Kouassi K.S., Gnonhouri G.P., Yao N.T., Kobenan
K.A. et Bernard, 2005. Bien cultiver la banane plantain en Côte
d'Ivoire. Centre National de Recherche Agronomique (CNRA).
33. Laprade C.S. and Ruiz B.R.,
1999.Productive behaviour of FHIA-01 (AAAB)and FHIA-02 (AAAB), under
inorganic and organic fertilization programmes. Pp.171-176 in
Organic/environmentally friendly banana production. Proceedings of a
workshop held at EARTH, Guácimo, Costa Rica, 27-29 July 1998 (F.E.
Rosales, S.C. Tripon and J. Cerna, eds). INIBAP, Montpellier, France.
34. Lassois L., Busogoro J.P.et Jijikli H., 2009.
La banane : de son origine à sa commercialisation, Univ.
Liege-Gembloux Agro-Bio Tech. Plant Pathology Unit. Passage des
Déportés, 2. B-5030 Gembloux (Belgium), E-mail :
jijikli.h@fsagx.ac.be 13 (4),
575-586.
35. Lassoudière A., 2007. Le bananier et
sa culture. Editions Quae. 384p.
36. Lee S.B., Milgroom MG. and Taylor J.W.
1988. A rapid, high yield miniprep method for isolation of total
genomic DNA fromfungi. Fungal Genetics Newsletter 35: 23-24.
37. Martínez G., Hernández J. and
Aponte A., 2000. Distribución y epidemiología de la
Sigatoka negra en Venezuela. Serie C 48. FONAIAP. FundaciteGuayana. 50 pp.
38. Mbida M.C., 2001. First archaeological
evidence of banana cultivation in central Africa during the third millennium
before present, Veg. Hist. archaeobotany, 10, 1-6.
plantains en République Démocratique du Congo.
Support didactique, Saint Paul, Kinshasa 85p.
39. Meredith D.S. and Lawrence J.S., 1970.
Black leaf streak disease of bananas (Mycosphaerella fijiensis):
susceptibility of cultivars. Tropical Agriculture 27: 275-287.
40. Ministère de l'agriculture et du
développement rural, ministère de commerce, ministère de
la recherche et de l'innovation, 2010. Stratégie du
développement de la filière banane plantain au Cameroun. P14.
41. Mobambo P.K.N., Naku M. et Nganga Z.,
1993. Situation de la maladie des raies noires des bananiers et
bananiers plantain au Zaïre. Infomusa2: 14-15.
40
42. Mobambo P.K.N., Gauhl F. and Swennen R.,
1996.Assessment of the cropping cycle effects on black leaf streak
severity and yield decline of plantain and plantain hybrids. International
Journal of Pest Management 42: 1-7.
43. Mobambo P.K.N., 2002. Stratégies
de gestion intégrée des cultures pour la production de bananes
plantain et le contrôle de la cercosporiose noire en République
démocratique du Congo ; InfoMusa, vol11, n°1 P3.
44. Mourichon X., Carlier J. et Fouré E.,
1997. Les cercosporioses : Maladie des raies noires (cercosporiose
noire), Maladie de Sigatoka (cercosporiose jaune). Maladies des Musa :
fiche technique N°8, en collaboration avec le groupe de travail sur les
cercosporioses de PROMUSA.
45. Mourichon X., Lepoivre P. and Carlier J.,
2000. Black leaf streak: hostpathogen interactions, pp 67-72.
46. Mourichon X., Sd. Les cercosporioses des
bananiers et plantains : éléments sur la biologie des
interactions et les stratégies de lutte. Laboratoire de pathologie
végétale, CIRAD-FLHOR, Montpellier. P 2.
47. Ndungo V., 2008. Situation du wilt
bactérien du bananier dans la région de Minova. Cartographie,
impact sur la sécurité alimentaire et recommandations pour le
contrôle durable. ACF/Rapport de consultance sur le wilt, RDC, septembre
pp.16-25.
48. Ngama B.J-F., 2010. Etude diagnostique
de banana bunchy top disease (BBTD) dans la région forestière du
bassin du Congo en district de la Tshopo dans la Province Orientale en RDC. DEA
inédit, Fac. IFAYangambi, 78p.
49. Nsabimana A., Gaidashova S.V., Nantale G., Karamura
D. and Van Staden J., 2010. «Banana Cultivar Distribution in
Rwanda.» African Crop Science Journal16 (1). Retrieved September 19,
2012.
50. Nsabimana A., 2011. «Establishing
Genetic Diversity of Rwanda Highland Banana Using Random Amplified Polymorphic
DNA Markers.»Retrieved January11, 2013, from
http://146.230.128.141/jspui/handle/10413/4670.
51. Nyabyenda P., 2006. Les
plantes cultivées en régions tropicales d'altitudes d'Afrique,
Gembloux, Belgique : Les Presses Agronomiques de Gembloux, pp. 238.
41
52. Onautshu O., 2007. Etude de l'incidence des
maladies et ravageurs chez les bananiers (Musa spp.) de la
région de Kisangani (R.D.CONGO), D.E.A. inédit, Faculté
des Sciences, UNIKIS, 54p.
53. Onautshu O., Legreve A. et Dhed'A D., 2013.
Caractérisation des populations de Mycosphaerella fijiensis et
épidémiologie de la cercosporiose noire du bananier dans la
région de Kisangani, RDC. Life Sciences. Université Catholique de
Louvain. P26.
54. Orozco-Santos M.J., Farías-Larios G.,
Manzo-Sánchez et Guzmán-González S., 2011. La
cercosporiose noire (Mycosphaerella fijiensis Morelet) au Mexique. La
Revue Internationale sur Bananiers et Plantains, INFOMUSA Vol. 10 N° 1 p
36.
55. Pérez L., 1996. Manual para el
control integrado de Sigatoka negra (Mycosphaerella fijiensis) y
Sigatoka amarilla (Mycosphaerella musicola Leach ex Mulder) en banano
y plátano. Proyecto TCP/CUB/4454. 27pp.
56. Raemaekers H, 2001. Agriculture en
Afrique Tropicale. Direction générale de la coopération
internationale (DGCI), Rue des petits Carmes, 15-Karmelietenstraat 15, B-1000
Bruxelles, Belgique. ISBN 90-806822-2-5.
57. Ramsey M.D, Daniells J.W. et Anderson V.J.,
1990. Effects of sigatoka leaf spot (Mycospherella musicola
Leach) on fruit yield, field ripening and greenlife of bananas in North
Queensland. Scientia Horticulturae 41: 305-313.
58. Rosales F.E., Alvarez J.M. et Vargas A., 2010.
Guide pratique pour la production de bananes plantains sous haute
densité de plantation - Retours d'expériences d'Amérique
latine et des Caraïbes (Rosales FE, éd.). Bioversity International,
Montpellier, France.
59. Stover R.H., 1987. Sigatoka leaf spots of
bananas and plantains. Plant Disease 64: 750-755.
60. Swennen R. et Vuylsteke D., 2001. Bananier.
In Raekemaekers R.H., eds., Agriculture en Afrique tropicale, DGCI, Bruxelles,
Belgique. p.611-637.
61. Tushemereirwe W., Kangire A., Smith J., Ssekiwoko
F., Nakyanzi M., Kataama D., Musiitwa C. et Karyaija R., 2003.
Epidémie de flétrissement bactérien sur le bananier en
Ouganda. INFOMUSA 12(2): pp. 6-8.
42
62. Tshidibi T., Lebisabo B., Onautshu O., Dhed'A D.,
2013. Isolement et caractérisation des souches de
Mycosphaerella fijiensis des bananiers (musa spp.) dans la
région de Kisangani, R.D.C. Université de Kisangani,
Faculté des Sciences, Laboratoire de culture in vitro des
plantes.
63. Van den houwe I. et Swennen R., 1998. La
collection mondiale du bananier (Musa spp.) au Centre de Transit de
l'INIBAP à la K.U. Leuven : stratégies de conservation et mode
d'opération. Biotechnol. Agron. Soc. Environ. 2 (1), 36-45.
64. Wilson G.F., 1987.Status of bananas and
plantains in West Africa. Pp. 29-35 in Banana and plantain breeding strategies
(G.J. Persley and E.A. De Langhe, eds). Proceedings of an International
Workshop, 13-17 October 1986, Cairns, Australie. ACIAR Proceedings No. 21.
65. Wiese, 1980. RDC, Landsnatur, Bevolkerung,
Wirtshaft. Darmastadt.
66. Youdeowei A., 2004. La lutte
intégrée en production des plantes à racines et tubercules
et des bananiers plantains, Guide du vulgarisateur de la lutte
intégrée-3, Ministère de l'alimentation et de
l'agriculture (MOFA) du Ghana et GTZ, CTA, PP. 47.
67. Zihalirhwa, K.P., 2011. Evaluation de la
situation phytosanitaire du bananier (Musa spp.) dans les
systèmes culturaux des zones agroécologiques de la Province du
Sud-Kivu à l'Est de la R.D. Congo. Mémoire inédit, UCL,
111p.
43
Table des matières
Prélude I
Dédicace ..II
In memorium. III
Remerciement IV
Sigles et abréviations ..V
Résumé VI
Abstract VII
Listes des tableaux et figures VIIIVIII
Introduction 1
1. Problématique et présentation du travail
Erreur ! Signet non défini.
2. Problématique 1
3. Hypothèses 3
4. Objectifs du travail 3
4.1. Objectif général 3
4.2. Objectifs spécifiques 3
Chap.1. Généralités sur le bananier 4
1.1. Le bananier 4
1.1.1. Origine, description et classification 4
1.1.2. Description morphologique 4
1.1.3. Ecologie du bananier 5
1.2. La cercosporiose noire du bananier 6
1.2.1. Son origine et sa distribution 6
1.2.2. Symptômes 7
44
1.2.3. Biologie, classification et diversité
génétique de M. fijiensis 7
1.2.4. Etude épidémiologique de la cercosporiose
noire 9
1.2.5. Cycle d'infection de M.fijiensis 9
1.2.6. Sensibilité des variétés 10
1.2.7. Moyens de lutte contre la MRN 10
Chapitre 2. Milieu d'étude, matériels et
méthodes 11
2.1. Milieu d'étude 11
2.2. Méthodes et matériels 11
2.2.1. Matériels 11
2.3. Méthodes 12
2.3.1. Enquête 12
2.3.2. Evaluation de l'intensité de la cercosporiose noire
du bananier 13
2.3.4. Isolement et caractérisation des isolats de M.
fijiensis 14
2.3.5. Tests de pathogénicité et évaluation
de la résistance de certaines variétés à la MRN
15
2.4. Analyse des données 17
Chapitre 3. Présentation, interprétation et
discussion des résultats 18
3.1. Présentation et interprétation des
résultats 18
3.1.1. Objectif 1 : Incidence et sévérité de
la cercosporiose noire du bananier ..18
3.1.2. Objectif 2 : Caractérisation phénotypique
des isolats de M. fijiensis 24
3.1.3. Objectif 3 : Evaluation de la pathogénicité
28
3.2. Discussion des résultats 31
Conclusion et recommandation 34
Bibliographie ..36
45
Annexes
A. Questionnaire d'enquête
Ce questionnaire concerne uniquement le premier objectif qui
est l'évaluation de l'état phytosanitaire des bananiers dans les
territoires de Walungu et Kabare.
Identité de l'enquêté
Groupement/ Territoire
Localité :
I. Questions par rapport aux
enquêtés
1.

Genre : Homme Femme
2. Age moyen de l'enquêté :
3. Expériences en culture du bananier (en
années)
II. Questions par rapport à la culture du
bananier.
4. Quels sont les cultivars des bananiers
rencontrés ?
5. quel est le type de système de culture pratiqué
?
a. monoculture.
b. culture associée.
c. Types
d'association :
6. Quel est le niveau de la fertilité des sols ?
Quel le type de sol utilisé pour la culture du bananier
?
a. sol pauvre
b. moyennement riche
c. riche.
46
7. Utilisez- vous des fertilisants ? Oui Non
8. Quels sont ces fertilisants ?
a. Matière organique. b. les engrais minéraux
c. Types d'engrais minéraux.
II. Questions par rapport aux maladies des
bananiers:
9. Quelles sont les maladies observées sur les
bananiers :
10. Comment ces maladies se présentent-elles sur les
bananiers (symptômes de chaque
maladie)
11. comment se présente la cercosporiose du bananier :
12. Quels sont les dégâts observé en cas
d'attaque de la maladie par la cercosporiose noir du bananier :
12. Quel sont les cultivars:
a. Les plus sensibles à la cercosporiose :
b. les plus résistants à la cercosporiose:
III. Questions par rapport aux moyens utilisés
pour lutter contre ces maladies.
12. Entretien permanent : Oui Non
Comment ?
18. Quels sont les moyens de lutte contre la
cercosporiose noire du bananier maladie :
47
14. Utilisation des fongicides. Oui Non
15. Types de fongicides utilisés
IV.
Observations
Groupement:
Localité : Champs n0 :
Cordonnées : latitude : . Longitude :
Alt:
Commentaires sur la maladie des raies noires ou cecosporiose
noire du bananier.
1.

Estimation du nombre total des bananiers dans une
bananeraie.
2. Nombre des plantes malades dans les deux diagonales
(sur 20 plants).
b = niveau de lésion des feuilles notées
sur une échelle allant de 0 à 6 : 0 = pas de
symptôme
1 = Moins de 1 % de surface foliaire touchée
(uniquement stries et/ou au plus 10 lésions)
2 = 1 à 5 % de surface foliaire
touchée
3 = 6 à 15 % de surface foliaire
touchée
4 = 16 à 33 % de surface foliaire
touchée
5 = 34 à 50 % de surface foliaire
touchée
6 = 51 à 100 % de surface foliaire
touchée
n = Nombre de feuilles de chaque niveau de
lésion.
N = 7= nombre d'indices dans l'échelle de notation
des lésions des feuilles ; T = nombre total de feuilles
évaluées.
48
3. Autres informations nécessaires pour la maladie des
raies noires ou cercosporiose noire du
bananier
B. Préparation du milieu Eau-Agar
? Prendre 1l d'eau distillée +15g de gélose ;
? Mettre dans le bain marie pour la dissolution ;
? Autoclave à 120°C sous une pression d'une
atmosphère pendant 15-20minutes. C. Analyse de la variance
(ANOVA) pour l'incidence entre territoires
Territoire
Statistix 8.0 12/07/2017,
03:02:47
Completely Randomized AOV for incidence
|
Source
|
DF
|
SS MS
|
F
|
P
|
|
Territoir
|
1
|
3600.0 3600.00
|
6.77
|
0.0209
|
|
Error
|
14
|
7443.8 531.70
|
|
|
|
Total
|
15
|
11043.8
|
|
|
|
Grand Mean
|
56.875
|
CV 40.54
|
|
|
Tukey HSD All-Pairwise Comparisons Test of incidence by
Territoir
|
Territoir Walungu Kabare
|
Mean
71.875
41.875
|
Homogeneous Groups A
B
|
|
|
Analysis
|
of Variance Table
|
for IS
|
|
|
|
Source
|
DF
|
SS
|
MS
|
F
|
P
|
|
Territoir
|
1
|
283.61
|
283.61
|
6.53
|
0.0240
|
|
incidence
|
1
|
2534.77
|
2534.77
|
58.35
|
0.0000
|
|
Error
|
13
|
564.73
|
43.44
|
|
|
|
Total
|
15
|
|
|
|
|
Note: SS are marginal (type III) sums of squares
Grand Mean 38.375 CV 17.18
test de Tukey à
Tukey HSD All-Pairwise Comparisons Test of IS for
Territoir
Territoir Mean Homogeneous Groups
49
Kabare 43.503 A
Walungu 33.247 B
D. Quelques images de M. fijiensis


1. Stade jeune 2. Stade intermédiaire 3. Stade
intermédiaire
4. Stade avancé 5. Stade avancé 6.
Stade avancé
7. Stade jeune 8. Stade avancé 9. Stade
avancé

10. Stade avancé 11. Stade
avancé
50
Tableau 4 : caractéristiques de la culture des
bananiers à Walungu et Kabare
|
Territoire
|
Groupement
|
Système de culture
|
Utilisation des fertilisants
|
Typesde fertilisants
|
|
Walungu
|
|
Asso
|
%
|
mono
|
%
|
Eff.
|
%
|
Oui
|
%
|
Non
|
%
|
Eff.
|
%
|
M.0
|
%
|
NPK
|
%
|
Eff.
|
%
|
|
Kaziba
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Nyangezi
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Ikoma
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Izege
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Walungu ce
|
7
|
70
|
3
|
30
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Mushinga
|
6
|
60
|
4
|
40
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Burhale
|
4
|
40
|
6
|
60
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
8
|
80
|
2
|
20
|
10
|
100
|
|
Irhongo
|
4
|
40
|
6
|
60
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
61
|
76.3
|
19
|
23.7
|
80
|
100
|
80
|
100
|
0
|
0
|
80
|
100
|
78
|
97.5
|
2
|
2.5
|
80
|
100
|
|
Kabare
|
Katana
|
6
|
60
|
4
|
40
|
10
|
100
|
7
|
70
|
3
|
30
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Bushumba
|
4
|
40
|
6
|
60
|
10
|
100
|
8
|
80
|
2
|
20
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Miti
|
7
|
70
|
3
|
30
|
10
|
100
|
7
|
70
|
3
|
30
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Mudaka
|
6
|
60
|
4
|
40
|
10
|
100
|
8
|
80
|
2
|
20
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Mumosho
|
7
|
70
|
3
|
30
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Bugorhe
|
7
|
70
|
3
|
30
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
51
|
Mudusa
|
6
|
60
|
4
|
40
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
Chirunga
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
10
|
100
|
0
|
0
|
10
|
100
|
|
|
53
|
66.3
|
27
|
33.8
|
80
|
100
|
70
|
87.5
|
10
|
12.5
|
80
|
100
|
80
|
100
|
0
|
0
|
80
|
100
|
|
|
114
|
71.2
|
46
|
28.8
|
160
|
100
|
150
|
93.8
|
10
|
6.2
|
160
|
100
|
158
|
98.7
|
2
|
1.3
|
160
|
100
|
Légende : Asso= Association, mono= monoculture, M.O=
matière organique, NPK= azote, phosphore, potassium, Eff=
effectif
| 


