|
La toxoplasmose constitue un problème de
santé publique. C'est une zoonose cosmopolite. Elle peut constituer un
danger permanent pour l'homme qui consomme la viande comme sources de
protéines, mais également qui utilise certaines espèces
animales comme animaux de compagnie. Les chats par exemple hébergent
plusieurs espèces de parasites surtout les helminthes et les
protozoaires. Parmi les protozoaires les plus importants du chat, figure le
toxoplasme responsable de la toxoplasmose.
La toxoplasmose est une zoonose due à des
protozoaires api-complexes appartenant à l'ordre des Eimariida
et au genre Toxoplasma. La Toxoplasmagondiiest la seule
espèce connue impliquées dans la maladie.
L'hôte définitif est le chat. Plusieurs
mammifères (y compris l'homme) et les oiseaux servent d'hôte
intermédiaire. Cette maladie est souvent asymptomatique chez les
animaux. Les lésions se localisent généralement dans les
muscles où se forment des kystes à bradyzoïdes chez le chat
et les autres animaux infestés.
Généralement bénigne chez
l'homme, cette maladie peut être grave chez les sujets
immunodéficients et la femme enceinte. Ainsi la femme enceinte une
primo-infection toxoplasmique peut être transmise au foetus et être
à l'origine de la toxoplasmose congénitale pouvant entrainer par
l'ordre de gravité décroissante : mort foetal,
encéphalomyélite, hydrocéphalie, atteintes
viscérales ou formes pauci-symptomatiques avec le plus souvent une
choriorétinite isolée.
Les hôtes intermédiaires
(mammifères, oiseaux), se contaminent en ingérant les kystes
éliminés par les chats et souillant les aliments ou l'eau de
boisson. L'hôte définitif s'infeste en ingérant la viande
crue infestée ou des aliments souillés par des oocystes
libérés par d'autres chats. Ces derniers occupent une place toute
particulière dans le cycle évolutif de Toxoplasmagondii.
En effet, en plus d'être hôtes définitifs en permettant le
développement sexué du parasite dans l'intestin grêle, les
chats peuvent également jouer le rôle d'hôtes
intermédiaires en raison de l'existence d'un cycle exentérale
asexué dans les tissus.
L'objectif de ce travail est d'englober sur les
différentes formes de la maladie, les symptômes, le diagnostic et
le traitement. La dernière partie est posée sur la contamination
de la femme enceinte et le rôle du vétérinaire dans la
lutte contre la maladie.
PREMIERE PARTIE: GENERALITES
I. Définition de la toxoplasmose
La Toxoplasmagondiiest le parasite
responsable de la toxoplasmose. C'est une zoonose parasitaire cosmopolite que
les animaux transmettent aux hommes. Elle est présente chez nombreux
mammifères, des oiseaux domestiques et sauvages. Les personnes atteintes
ne semblent pas nécessairement malades. Chez ceux qui présentent
des symptômes, la maladie est bénigne et elle se traduit seulement
par une hypertrophie des ganglions lymphatiques et par un inconfort vague.
Le cycle de multiplication de la
Toxoplasmagondii est sexuée, mais rarement asexuée. Ce
cycle s'accomplit chez les félins. A propos des autres espèces,
l'infection est strictement extra-intestinale (asexuée) a localisation
musculaire. Le parasite existe d'une part sous la forme de trachyzoïtes et
de bradyzoïdes dans les kystes tissulaires.
La manifestation de cette maladie est souvent
asymptomatique. Elle peut causer des répercussions graves chez les
individus immunodéficients ou très jeunes. La toxoplasmose est
à l' origine des avortements et des mortalités natales
très graves chez les femmes enceintes. Les modes de transmission sont
multiples. Son importance tient essentiellement du fait de son retentissement
sur la santé publique. ²
II. Historique de la maladie
En 1908, Nicolle et Manceaux ont découvert le
toxoplasme dans le foie, la rate et le sang d'un rongeur d'Afrique du Nord,
Ctenodactylus gondi, entretenu en laboratoire à l'Institut
Pasteur de Tunisie. ²
En 1909, des toxoplasmes ont été
identifiés chez le lapin par Splendore. En 1910, Mello a
découvert la Toxoplasmacuniculichez les chiens à Turin.
Castellani décrit la maladie humaine acquise en 1914. Le parasite
reçoit ainsi le nom Toxoplasmapyrogenes. ²
En 1928, Mesnil dénombre 24 espèces
différentes de toxoplasmoses. Il soutient `'qu'il n'existe qu'une seule
et même espèce de toxoplasmose ayant plusieurs hôtes''. A
partir de 1937, des recherches débutent le travail sur l'immunité
anti-toxoplasmique et l'infestation expérimentale. ²
Sabin et Feldman, en 1948, mettent au point un test
sérologique, le `'Dye test'' utilisé en médecine humaine
pour le diagnostic de la toxoplasmose. En 1969, Work et Hutchison permettent la
mise en évidence des oocystes dans les excréments de chat. La
compréhension du cycle de ce parasite et des modes de transmission n'a
eu lieu qu'au cours des années 1970. ²
III. Impacts médicale, sanitaire et
économique de la maladie
III. 1. Impact sanitaire
La toxoplasmose est une zoonose qui peut avoir des
conséquences très graves surtout chez la femme enceinte et les
individus souffrants d'une immunodépression. L'homme peut la contracter
par ingestion des kystes contenants des bradyzoïdes et provenant de
viandes crues ou bien insuffisamment cuites ou même par contact avec des
chats qui sont les seuls félidés domestiques hôtes
définitifs. ²
Les signes cliniques et la gravité de la
maladie diffèrent selon la période de la vie au cours de laquelle
la toxoplasmose a été contractée. On distingue ainsi la
toxoplasmose acquise et la toxoplasmose congénitale.
La toxoplasmose acquise comprend :
1) Une phase d'incubation, entre 1 et 3 semaines ;
2) Une phase aiguë caractérisée par des
adénopathies de petites tailles non douloureuses présentent au
niveau des chaines cervicales et associées à des signes cliniques
bénins : asthénie, myalgies légères. La phase
septicémique est très dangereuse pour la femme enceinte car les
tachyzoïdes traversent le placenta et contaminent le foetus ;
3) Une phase subaiguë qui se suit d'une phase
chronique : caractérisée par un tropisme viscéral de
la toxoplasmose. Une possibilité de complications graves peut avoir lieu
en addition de quelques atteintes neurologique, sanguine, hépatite ou
atteinte myocardique.
Chez les hommes, la toxoplasmose acquise passe
presque inaperçue. L'infection peut être grave, voire mortelle
dans le cas d'une immunodéficience (SIDA par exemple). On observe une
invasion massive et la multiplication intense des parasites dans divers tissus,
surtout dans les tissus cérébraux (toxoplasmose
cérébrale), qui s'avère quasiment toujours fatale.
La toxoplasmose congénitale est acquise par
transmission transplacentaire du toxoplasme de la mère au foetus. Elle
est généralement redoutable et son pronostic dépend de la
période de contamination. Chez la femme enceinte, elle provoque souvent
l'avortement si la contamination a lieu dans les trois premiers mois de la
grossesse. Si elle se produit plus tardivement, soit au cours du
deuxième trimestre de la grossesse, elle entraine de très graves
lésions neurologiques, oculaires ainsi que d'autres atteintes
multi-viscérales (ictère, syndromes hémorragiques). Si la
contamination a lieu au cours du troisième trimestre de la grossesse,
les lésions sont souvent moins sévères.4
III. 2. Impact médicale
L'importance médicale est liée aux
différents troubles cliniques qu'engendre la maladie chez les
espèces affectées. Les troubles varient en fonction non seulement
de l'espèce mais aussi de l'état sanitaire des individus
atteints.
Tous les ruminants dont la chair est
consommée par l'homme sont réceptifs à la toxoplasmose. On
distingue plusieurs formes :
- La forme inapparente qui est la plus fréquente. Elle
s'appelle aussi infection toxoplasmique ;
- La forme diffuse aiguë se traduit par des
symptômes variés entre autres des troubles locomoteurs pouvant
aboutir à la paraplégie, des troubles génitaux entrainant
une perturbation du cycle oestral et la non délivrance ;
- La forme subaiguë qui présente des troubles
oculaires, respiratoires et quelquefois des troubles nerveux.
La toxoplasmose congénitale est
présente chez le foetus qui peut aboutir des résorptions
embryonnaires, des avortements, de la mortinatalité mais
également de l'encéphalite associée à des
lésions oculaires.4
Elle apparait chez les chiots, chez le poulet
surtout chez les Gallus gallusdomesticus, chez les chats et rarement
chez les bovins.5
III. 3. Impact économique
La prédominance de l'infestation est
liée à la population des chats, en particulier les chats errants
qui ont accès au pâturage des autres animaux. Les volailles qui se
nourrissent de vers de terre peuvent aussi servir d'hôte de la maladie.
Ces animaux ingèrent des oocystes déposés avec les
fèces de chat. ²
Les pertes les plus lourdes ont lieu chez les
chèvres et les moutons. Des pertes économiques
considérables sont notées dans les élevages de grande
dimension comme dans les pays développés. Des crises liées
à la toxoplasmose chez les ruminants domestiques sont essentiellement
dues aux formes aiguës de la maladie qui entraînent des
mortalités élevées. Quant aux morbidités, elles
proviennent d'avortements répétés provoquant la baisse des
naissances dans les élevages. ²
Chez les hommes, l'incidence de la maladie est
faible. L'importance économique réside essentiellement dans les
dépenses liées aux frais de traitement des personnes
séropositives ainsi que celles liées à l'infestation des
enfants et aux séquelles que la maladie engendre chez eux.5
IV. Espèces Infectées
En
biologie,
un hôte est un organisme qui héberge un
parasite, un partenaire
mutuel ou un partenaire commensal, lui fournissant, en général,
le gîte et le couvert. Un hôte
primaire ou hôte définitif est un hôte chez
lequel le parasite atteint sa maturité; un hôte
secondaire ou hôte intermédiaire est un hôte
qui héberge le parasite seulement pour une courte période de
transition.6
Les espèces affectées sont nombreuses.
Ainsi, tous les ruminants, le porc et les équidés sont des
hôtes intermédiaires du toxoplasme. Des études ont
montré que des ours sont fréquemment parasités aux Etats
Unis. En dehors des mammifères, les oiseaux sont également
réceptifs à la maladie. Cependant, seuls quelques
félidés sauvages et domestiques, notamment le chat, demeurent les
hôtes définitifs. Quant à l'homme, il constitue un cul de
sac épidémiologique puisqu'il n'est pas capable de transmettre le
parasite aux autres espèces animales. 5
DEUXIEME PARTIE: ETUDE DU PARASITE - TOXOPLASMA
GONDII
I. Classification
Le genre Toxoplasmane renferme qu'une seule
espèce : gondii selon les travaux de Sabin et Olitsky
effectués en 1937. 7
La classification du parasite est la
suivante :8
- Domaine : Eukaryota
- Règne : Chromalveolata
- Division : Alveolata
- Embranchement : Apicomplexa
- Classe : Conoidasida
- Ordre : Eucoccidiorida
- Sous-ordre : Eimeriorina
- Famille : Sarcocystidae
- Genre : Toxoplasma
- Espèce : gondii
II. Morphologie des toxoplasmes
Le parasite se présente en
général chez les hôtes sous deux formes principales :
les formes isolées et les formes groupées.
II. 1. Formes isolées : les
tachyzoïtes
Les tachyzoïtes sont généralement
intracellulaires et peuvent être libérés lors de
l'éclatement des cellules contenant le parasite.5

Figure 1 : Eléments morphologiques typiques
de Toxoplasma, les tachyzoïtes5
La forme est en croissant de longueur 5 à 8
ìm et de largeur 3 à 5 ìm et d'extrémité
effilée. Ces éléments apparaissent au microscope à
contraste de phase avec un cytoplasme homogène et réfringent. Le
noyau est très net et il occupe une position centrale. Des
phénomènes de glissements aident à la mobilité des
tachyzoïtes mais ils ne possèdent pas d'organes locomoteurs. 5
II. 2. Formes groupées
Les formes groupées sont divisées en
trois parties : les pseudokystes, les kystes et les oocystes.
- Les pseudokystes
Les pseudokystes sont responsables de la forme
aiguë de la maladie. Ils sont en effet intracellulaires. Ils se logent
dans une vacuole parasitophore de la cellule hôte qui constitue la paroi
du pseudokyste. Ils peuvent mesurer entre 15 et 30 ìm. Leur
présence caractérise la phase proliférative de
l'infection.8

Figure 2 : Schéma et vue microscopique des
pseudokystes5
Les pseudokystes renferment 100 à 200
tachyzoïtes qui n'occupent pas la totalité de la cellule hôte
dont le noyau demeure net. Ils sont colorables par la fuchsine. Ces
pseudokystes n'ont qu'une durée momentanée, et libèrent
des tachyzoïtes qui envahissent d'autres cellules.?
- Les kystes
Egalement intracellulaires, ils sont
différés des pseudokystes par l'occupation quasi-totale de la
cellule parasitée dont le noyau est déformé, aplati et
réduit à une lame qui occupe la périphérie. Les
kystes sont plus volumineux que les pseudokystes. La forme est principalement
subspherique. Les kystes mesurent 60 à 100 ìm et causent une
déformation de la cellule hôte. ?

Figure 3 : Schéma et vue microscopique des
kystes 5
Les kystes contiennent des milliers de
bradyzoïtes en croissant dont le noyau occupe une position excentrique
à l'extrémité arrondie. La présence des kystes
correspond à la phase chronique de la maladie. La rupture de la cellule
qui les porte libère des kystes enveloppés. Les kystes se
transforment en pseudokystes quand l'immunité de l'hôte est
rompue. Ils sont le plus souvent localises dans le système
réticulo-histiocytaire (SRH). 5
- Les oocystes
C'est la forme parasitaire rencontrée dans
les cellules épithéliales de l'hôte définitif. Le
zygote est issu de la fécondation d'un gamète femelle par un
gamète mâle et qui reste enkyste dans la coque ovulaire. Un
éclatement des cellules épithéliales hôtes aident
à l'élimination des oocystes dans le milieu extérieur et
le mélange aux excréments. Leurs formes est subspheriques de
longueur de 10ìm et de largeur de 12ìm. Ils subissent la
sporogonie en milieu extérieur. La sporulation des oocystes renferme
deux sporocystes contenant chacun 4 sporozoïtes en virgule mesurant
7ìm de longueur et 1.5ìm. 5
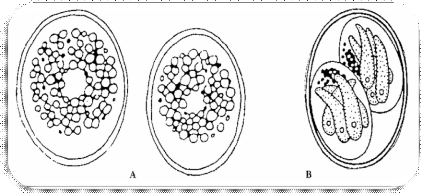
Figure 4 : Schéma des oocystes immatures (A)
et oocystes sporulés (B) de la T. gondii5
L'hôte définitif, le chat en
particulier, la sporogonie à la production d'un oocyste suite à
la fécondation des gamètes femelles qui a lieu dans l'estomac de
cet animal. Ce dernier est la seule espèce animale domestique à
héberger la reproduction sexuée du toxoplasme. L'oocyste est la
forme la plus résistante dans le milieu extérieur lors de
l'élimination avec les selles du chat.²
L'oocyste contient 8 sporozoïtes groupes en 2
sporocystes accoles dans le tube digestif du chat. Cet oocyste
représente l'aboutissement du cycle sexué chez le chat et
constitue la forme infectieuse metacyclique ou forme contaminant pour
l'homme.²
III. Etude biologique
III. 1. Modalités de la reproduction
Il existe une reproduction sexuée, trouvée chez
les chats et certains félidés sauvages ; c'est-à-dire
chez les hôtes définitifs, et reproduction asexuée chez
tous les hôtes, définitifs et intermédiaires.
III. 1. 1. La reproduction sexuée de T.
gondii
Elle ne peut avoir lieu que chez un hôte
définitif.
a) La gamètogonie
Au lieu de continuer à subir la multiplication
asexuée, certains schizontes vont se différencier en gamontes
puis en gamètes. Le moment de survenue de la gamètogonie pourrait
être influence par différents facteurs qui rendent les conditions
environnementales plus mauvaises : une surpopulation des formes
asexuées, le début de la mise en place de la réponse
immune ou bien l'initiation d'un traitement antitoxoplasmique. Elle se
déroule généralement dans l'iléon.°
La micro-gamétogenèse est à l' origine
des gamètes males (appelés microgamète). La
différenciation a lieu dans la vacuole parasitophore des
entérocytes de l'hôte. Il présente un appareil perforateur
apical, un volumineux noyau associéà une grande
mitochondrie.°
La macro-gamétogenèse est à
l' origine des gamètes femelles. Ses formes ovoïdes subspheriques
possèdent un noyau central, plusieurs micropores qui favorisent la
pénétration et donc la fécondation par un
microgamète.°
La pénétration du microgamète
dans la cellule hôte puis dabs le macrogamonte est permise par le
fonctionnement des flagelles et du perforatorium. La fusion de deux
noyaux haploïdes aboutit à la formation d'un zygote diploïde
et est suivie de la formation d'une paroi à cinq couches constituant
l'endokyste et l'ectokyste. L'oeuf est donc enkysté dans la cellule
hôte, au sein de l'épithélium intestinal : il porte
alors le nom d'oocyste et il est alors immature.°
b) La sporogonie
Elle aboutit, à partir d'un zygote
diploïde, à la formation de huit sporozoites haploïdes. La
sporulation est exogène (en milieu extérieur) et ne se
réalise que si les conditions environnementales sont
favorables :°
- Une humidité relative de 30% minimum avec un optimum
de 90% environ ;
- Une température de 10 à 30°C ;
- Une teneur en oxygène atmosphérique suffisante
pour la réalisation du métabolisme aérobie important.
Dans les conditions optimales, la sporulation
s'achève en un à cinq jours.
III. 1. 2. La reproduction
asexuée
a) Lors du cycle entero-épithélial
C'est un type de division qui ne se déroule qu'au cours
du cycle coccidien, dans les entérocytes et à l'intérieur
de la vacuole parasitophore : le noyau de la cellule
mèreappeléeschizonte se divise en nombreux noyaux-fils separes.
Cette multiplication entraine une dilatation de la vacuole parasitophore, la
compression des élémentscellulaires et enfin l'éclatement
de l'entérocyte qui libère alors de nombreux
schizozoïtes ; ces derniers vont alors parasiter d'autres
entérocytes et subir de nouvelles schizogonies.
b) Lors du cycle extra-intestinal
Dans la vésicule parasitophore de la cellule
hôte, il y a formation d'ébauches de cellules filles. Ce processus
est très rapide, c'est pourquoi les endodyozoïtes ainsi
formés ont été appelés par Frenkel, en 1973,
`'tachyzoïtes'' (tachus = rapide) : les
tachyzoïtes sont donc les formes de multiplications rapide du parasite.
Ce phénomène se poursuit à
l'intérieur de la vacuole de la cellule hôte. Des multiplications
successives aboutissent à la formation des pseudokystes dont la paroi
est fine. La membrane finit par éclater et les tachyzoïtes sont
libérées et peuvent alors parasiter d'autres cellules de
l'hôte (intermédiaire ou même définitifs).
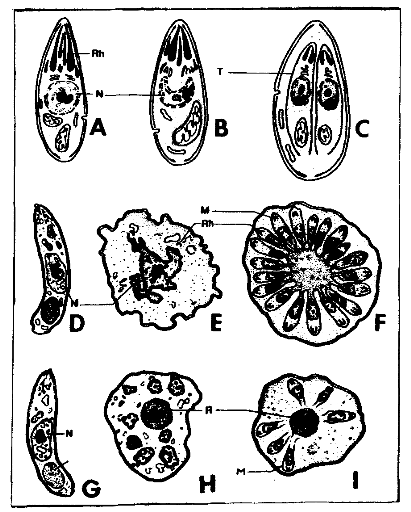
Figure 5 :Schémas des différents
types de multiplication asexuée : endodyogenie (A, B et C),
endopolygenie (D, E et F), merogonie (G, H et I) ; corps residuels (R),
schizozoïtes (M), noyaux (N), rhoptries (Rh) et tachyzoïtes
(T)²
III. 2. Autres fonctions biologiques
III. 2. 1. La locomotion
Les flux lymphatiques et surtout sanguins,
assurent la dissémination du parasite la position enterale. Le
péristaltisme gastro-intestinal assure la progression des oocystes
sporulés et des kystes ingérés vers l'intestin
grêle, et l'excrétion dans le milieuextérieur.?
De nombreux facteurs extérieurs vont
intervenir dans la dissémination de la T. gondii(le vent,
l'eau, les animaux, les engins et les vêtements humains,...).?
Aussi, le parasite est capable de petits
déplacements permettant de se rapprocher des cellules hôtes
grâce à la mobilisation de son cytosquelette interne très
développé et la mise en action du système de
pénétration (mécanique et enzymatique) dans la cellule
hôte. Enfin les flagelles des gamètes males jouent un rôle
important dans la fécondation du gamète femelle.?
III. 2. 2. La nutrition
La toxoplasmose est un parasite intracellulaire et cette
fonction est réaliséegrâceà des échanges
transmembranaires intenses. Les
élémentsnécessairesà la réalisation des
différentes fonctions biologiques du parasite sont présents dans
le cytoplasme de la cellule hôte. Le parasite utilise les réserves
glucidiques et l'oxygènetrouvé dans la cellule hôte pour la
réalisation du métabolisme respiratoire.
III. 2. 3. La protection : résistance
et sensibilité
La paroi des oocystes, trèsépaisse et
très peu perméableconfère aux sporozoïtes une grande
résistance face à divers facteurs mécaniques et
physico-chimiques de l'environnement nombreux désinfectants. En
revanche, il est sensible à la sècheresse et à la chaleur
(66°C pendant vingt minutes).
IV. Cycle biologique
IV. 1. Le cycle entero-épithélial ou
coccidien
Il n'a lieu que chez l'hôte définitif
(félidés) et peut se produire suite à l'ingestion des
kystes tissulaires. Le devenir du kyste ingéré : la paroi du
kyste est détruite par l'action simultanée des contractions
stomacales, du péristaltisme intestinal et des sucs digestifs (phase
d'excystement). Certains bradyzoïtespénètrent alors dans les
entérocytes de l'intestin grêle. En position intracellulaire, le
bradyzoïte devient schizonte : stade intermédiaire. Les
schizontes subissent alors la multiplication asexuée ; il en
résulte de nombreuses générationsconstituantes cinq types
morphologiques différents : les types A, B, C, D et E. Seulement
les types D et E subissent la reproduction sexuée. Apres la
fécondation, les zygotes s'enkystent et deviennent des oocystes
immatures ; ces derniers sont libérés dans le milieu
extérieur avec les selles de l'hôte. Lorsque les conditions
d'humidité, de température et d'oxygénation du milieu sont
favorables, la sporulation peut se produire.4
Une minorité de bradyzoïtes ne subit
pas le cycle entero-épithéliale mais pénètre
directement la lamina propriade l'intestin grêle puis passe dans
le sang et la lymphe.4
IV. 2. Le cycle extra-intestinal
Il a lieu aussi bien chez les
hôtesdéfinitifs que chez les hôtes intermédiaires et
résulte le plus souvent de l'ingestion d'oocystes sporules ou de kystes
tissulaires.4
Les sporozoïtes sont libérés
par l'action mécanique et enzymatique de la partie antérieure du
tube digestif, vont pénétrer dans la paroi de l'intestin et le
parasite subit une série de divisions. La multiplication cause
l'éclatement de la cellule hôte et les rends libres pour parasiter
les autres cellules.4
Une grande partie d'entre eux peut alors se
répandre dans les tissus extra-intestinaux via les circulations. Les
tachyzoïtes sont capables de se multiplier dans la plupart des types
cellulaires. Lorsqu'une réponse immune efficace est mise en place, la
multiplication tachyzoïtique ralentit et les pseudokystes se transforment
en kystes. Ces derniers, s'ils sont consommes par un nouvel hôte,
pourront initier un nouveau cycle selon l'hôte.4

Figure 6: Schema du cycle biologique de T.
gondii5
TROISIEME PARTIE:
ETUDE EPIDEMIOLOGIQUE DE LA TOXOPLASMOSE
I. Les populations atteintes
I. 1. Les hôtes définitifs
Chez les hôtes définitifs, T. gondii
peut effectuer le cycle entero-épithélial mais aussi le cycle
extra-intestinal. Le chat domestique (Feliscatus) n'est pas le seul
hôte définitif connu ; en effet, l'observation a
démontré l'excrétion d'oocystes chez d'autres
félidés comme : le chat sauvage, le puma, l'ocelot, le
margay, le jaguar, le lynx, le tigre, le lion,...°
I. 2. Les hôtes
intermédiaires
Contrairement aux précédents, les hôtes
intermédiaires ne peuvent subir que le cycle extra-intestinal. La
plupart des vertébrés homéothermes semblent
concernes : de nombreux mammifères (rongeurs, lagomorphes,
mustélidés, canidés, équidés,
bovidés, suidés, primates, homme) et de nombreux oiseaux. En
addition de nombreux vertébrés a sang froid (reptiles,
amphibiens, poissons).°
I. 3. Les hôtes
parénétiques
Il existe aussi des hôtes capables de
véhiculer les oocystes ou des kystes qui n'évoluent pas mais qui
peuvent être disperses, intacts, de cette manière. Ces derniers
sont les insectes carnassiers, coprophages, des lombrics, des mollusques... Ils
conservent le caractère infectant du parasite, et, s'ils sont consommes
par les hôtes sensibles, T. gondii peut poursuivre son cycle de
développement.°
II. Les sources du parasite
II. 1. Les réservoirs d'oocystes : les
fèces des hôtes définitifs
Ce n'est vrai que pendant la phase
d'excrétion. Seuls les félidés domestiques et certains
félidés sauvages comme le lion, le jaguar, le lynx, le tigre,
peuvent êtreexcréteurs.
Ainsi, les selles des chats infectées et
excréteurs peuvent contaminer :
- L'eau (mares, lacs, étangs, ruisseaux,
rivières...) ;
- Le sol (terre des jardins, terrains de jeu, bac à
sable, sol des prairies...) ;
- Les végétaux (fruits, légumes,
pâturages...).
II.2. Les réservoirs de tachyzoïtes
Les animaux infectés et dont la
réponse immune spécifique est absente ou insuffisante,
hébergent des tachyzoïtes libres et des pseudokystes tissulaires
à tachyzoïtes ; la plupart des tissus (pulmonaire,
hépatique, musculaire, nerveux...) sont colonisés par le parasite
et notamment le sang qui dissémine la forme libre du parasite.
Il est important de noter que chez de nombreux animaux, les
secrétions peuvent aussi héberger le parasite dans les
secrétions :
- Le lait et le colostrum (chèvre)
- Le sperme (bouc, bélier, homme)
- La salive (rare, source de parasite négligeable)
II.3. Les réservoirs de kystes tissulaires
à bradyzoïtes
Ce sont les hôtes infectes et ayant
développé une réponse immune efficace contre le parasite
ainsi que les espèces non sensibles ayant ingère ou transportant
des kystes localises jusque-là dans les tissus d'animaux appartenant
à une espèce sensible (animaux vivants, cadavre, produits
animaux).
III. Les modalités de contamination et de
transmission
III. 1. Contamination et transmission par
ingestion
Ce mode de contamination possède une
importance variable, selon le régime alimentaire ; c'est le
principal pour les prédateurs carnassiers (félidés), mais
il est très secondaire pour les herbivores stricts.6
Certains comportements alimentaires peuvent
favoriser la contaminationà partir de kystes tissulaires : le
cannibalisme observé chez de nombreuses espèces (porc, rat...),
le saprophagisme, le necrophagisme, la consommation d'insectessarcophiles (qui
peuvent consommer les tissus d'animaux infectés et morts, ou tout
simplement souilles par des kystes).6
La consommation de tissus d'animaux
infectés, contenant des kystes tissulaires àbradyzoïtes,
entraine la réalisation du cycle extra-intestinal. Tous les animaux de
boucherie et de charcuterie (volailles comprises) sont des sources probables de
kystes (voire de pseudokystes), mais le risque de contamination varie avec
l'espèce (porc : 70%, mouton : jusqu'à 48%, risque
faible chez le boeuf, veau, cheval, volailles).6
La plupart des chats s'infectent
trèstôt, dans les six premiers mois de la vie, juste après
le sevrage quand ils commencent à chasser ou à consommer les
proies rapportés par la mère. Lors de l'ingestion de kystes, la
périodepré-patente est courte, le plus souvent de trois à
cinq jours. Lors d'ingestion d'oocystes sporulés ou tachyzoïtes, la
périodepré-patente est beaucoup plus longue et sure au minimum
trois semaines.6
L'ingestion d'oocystes sporulésrevêt
une grande importance chez de nombreuses espèces et plus
particulièrement chez les herbivores et l'homme
végétarien. La contamination est rendue possible par
différents comportements :6
- Geophagie : ingestion de terre
souillée ;
- Hydropinie : ingestion d'eau souillée par les
fèces d'un félidéexcréteur ;
- Phytophagie : ingestion de
végétauxsouillées ;
- Ingestion d'hôte parateniques (porteurs passifs
d'oocystes sporulées).
La contamination à partir de
tachyzoïtes libres est rare. En effet, elle peut se produire lors de
l'ingestion de lait provenant de femelles infectées.6
III. 2. Contamination et transmission par
inoculation
Elle a lieu lors de :6
- Transfusions : à partir d'un donneur en phase
active de l'infection
- Repas de sang d'arthropodes piqueurs : les poux et les
tiques (Pediculushumanus, Dermacentorreticulatus, Ixodes
ricinus) ;
- Morsure par un animal en phase active d'infection : si
sa salive contient des tachyzoïtes ;
- Manoeuvres obstétricales sur une femelle
infectée, avec des lésions sur les mains ;
- Manipulation en laboratoire avec du matériels
contaminé (aiguilles...).6
III. 3. Contamination et transmission
vénérienne
A partir de sperme contaminé en contact avec une
muqueuse lésée. Ce mode de contamination demeure exceptionnel car
il est peu probable.6
III.4. Contamination et transmission par
allogreffes
Ceci concerne les hommes. Cette activité
thérapeutique étant beaucoup plus rarement pratiquée en
chirurgie vétérinaire, chez les carnivores domestiques. Le risque
est important si le greffon provient d'un donneur en phase active de
l'infection et est destiné à un donneur n'hébergeant pas
le parasite. La mise en place d'un traitement immunosuppresseur peut
néanmoins avoir de graves conséquences cliniques, même si
le greffon n'est pas issu d'un donneur infecté.6
III.5. Transmission placentaire
La colonisation et l'infection du foetus par voie
sanguine n'est possible qu'en phase active de l'infection, c'est-à-dire
lors de la réalisation du cycle extra-intestinal par le parasite, chez
une femelle gestante, quelle que soit son espèce d'appartenance, tandis
que sa réponse immune spécifique est absente, insuffisante ou
inefficace. Ce mode de contamination est beaucoup plus fréquent chez
certaines espèces comme les ruminants, les humains...6
III. 6. Contamination maternelle et foetale chez les
humains
La consommation de viande crue expose à une
contamination par des kystes. Ce risque peut varier selon la nature du
réservoir animal. La réfrigération est insuffisante
puisque le parasite peut vivre 68 jours à une température de
4°C. Il est sensible à la salaison et au chauffage (67°C
pendant 3 minutes).7
La contamination par les chats peut aussi être
importante. Les séroprévalences sont plus élevés
chez les chats chasseurs que chez les chats domestiques. Les jeunes chats
peuvent émettre plusieurs milliers d'oocyste plusieurs mois sans
présenter des symptômes.7
La transmission materno-foetale s'effectue en
moyenne 4 à 8 semaines après la colonisation du placenta. Cette
placentopathie précède toujours une infection foetale, le passage
du parasite du placenta au foetus n'est pas obligatoire. La période la
plus dangereuse se situe entre la deuxième et la vingt-quatrième
semaine d'aménorrhée. C'est le moment où la
fréquence et la gravité se conjuguent ; atteintes
multi-viscérales, oculaires et cérébrales. 7
Le risque d'infection foetale croit
régulièrement du débit à la fin de la grossesse,
passant progressivement de 1% en période periconceptionnelle à
20% autour de la 20éme semaine pour atteindre 75% à 90% au
voisinage du terme. 7
La toxoplasmose congénitale
sévère est une forme rare mais redoutable qui s'observe surtout
lorsque le foetus a été infecté durant le ter trimestre de
la grossesse.7
IV. Facteurs augmentant les risques de
contamination
IV. 1. La réceptivité de
l'espèce
Il semble que les différentes
espèces-cibles du parasite ne sont pas sur un pied
d'égalité. Certaines espèces (bovines et équines)
sont moins réceptives que d'autres (rongeurs, ovins, caprins, porcins,
homme, félidés).6
IV.2. L'âge
Dans la nature, la plupart des chats semblent
s'infecter très tôt, peu après leur sevrage, lorsqu'ils
commencent à chasser (consommation d'hôtes intermédiaires)
ou à consommer les proies rapportés par la mère. En outre,
les jeunes individus (âgés de moins d'un an) sont les plus
sensibles, notamment les très jeunes chatons. Ceci est probablement
liéà une efficacité moindre du système immunitaire
à cet âge. En revanche, les vieux chats ne semblent pas plus
sensibles que les individus adultes plus jeunes.6
IV. 3. Le sexe
Il ne semble pas jouer de rôle majeur
direct.6
IV.4. Les particularités physiologiques
Les conséquences de l'infection d'une
chatte au cours de la gestation peuvent etre dramatiques car une transmission
transplacentaire du parasite par la mère au foetus peut induire chez ce
dernier une toxoplasmose grave, voire mortelle. Le stade de
développement du foetus au cours duquel a lieu la phase d'infection
active chez la mère influe directement sur le risque d'infection du
foetus et sur la gravite de la maladie que ce dernier peut
développer.6
IV.5. Le statut immunitaire
Le système immunitaire joue un rôle
primordial dans la lutte contre la multiplication des tachyzoïtes et le
contrôle de l'infection latente chronique représentée par
le stade kystique. Cependant, différents facteurs endogènes ou
exogènes peuvent déprimer ce système immunitaire et
empêcher le passage de la phase aiguë active de l'infection à
la phase latente chronique. Les maladies qui peuvent déprimer le
système immunitaire sont la FIV,FeLV.6
IV. 6. Le mode de vie
Les chats sauvages et ceux qui vivent dehors ou
qui ont la possibilité de sortir et de chasser (rongeurs, oiseaux) sont
beaucoup plus exposes au parasite que les chats ''d'intérieur'' ou ceux
qui peuvent sortir mais n'ont pas la possibilité de chasser. 6
IV. 7. Alimentation
Les chats qui peuvent se nourrir de rongeurs,
d'oiseaux, de viande ou d'abats crus et de légumes non laves
présentent un risque d'infection élevé, contrairement aux
animaux qui ne sont nourris qu'avec une alimentation industrielle.6
IV. 8. Les facteurs liés au
parasite
La nature de la souche, la quantité de
parasites infectants, le stade parasitaire infectant et le mode de
contamination jouent probablement un rôle important dans la
sensibilité des chats à l'infection toxoplasmique. 6
IV. 9. Les autres facteurs
Ils sont nombreux, mal définis et regroupés sous
le terme de stress. 6
QUATRIEME PARTIE: PATHOGENICITE ET DIAGNOSTIC DE LA
TOXOPLASMOSE
I. Pouvoir pathogène direct de T.
gondii
Le parasite est bien adaptéà ses
hôtes et en particulier aux chats ; la maladie clinique est
considérablement moins fréquente que ne l'est la toxoplasmose
asymptomatique. Le pouvoir pathogènerésulte principalement d'une
cytotoxicité directe, induite lors de la croissance intracellulaire
(réplication) intense du parasite. Il s'ensuit donc une nécrose
localisée (mort cellulaire) au site de réplication, liée
à l'éclatement des cellules parasitées. A cette phase de
nécrose succède une phase inflammatoire. ?
I. 1. Cellules et tissus-cibles chez les
hôtes
La quasi-totalité des types cellulaires peut
être parasitée (pratiquement les cellules nucléées
de tous les tissus) ; à l'exception des cellules
anucléées (hématies matures des mammifères) et de
cellules de quelques tissus (ostéoblastes des tissus osseux notamment).
Cependant, les cellules de certains tissus apparaissent comme des cibles
préférentielles ; les cellules du système de
phagocytose mononuclée (histiocytes, macrophages spécifiques des
différents tissus de l'organisme), les cellules des tissus
intraoculaires (iris, corps ciliaire, choroïde et rétine),
pulmonaires, hépatiques, pancréatiques, spléniques,
nerveux centraux et musculaires (lisses et striés, squelettiques et
myocardiques).²
I. 2. Invasion des cellules-hôtes et action
cytotoxique directe
La pénétration de T.
gondiidans la cellule-hôte (quelle qu'elle soit) ne résulte
pas d'une phagocytose mais de l'activité même du parasite :
il induit ainsi la formation d'un nouveau compartiment cellulaire (la vacuole
parasitophore) en générant lui-même l'énergie
nécessaire à l'internalisation. La vacuole est constituée
par les phospholipides de la membrane cytoplasmique de la cellule hôte.
La fixation du pole apical du parasite à la cellule hôte est
déterminée par l'affinité de certaines
protéinestoxoplasmiques de surface pour des récepteurs
particuliers de la cellule hôte. La pénétration est
assurée par le fonctionnement d'un moteur actino-myosinique ; elle
commence par la protrusion de conoïde ; les rhoptries et les
micronemes participent à l'internalisation grâceà
l'exocytose d'élément indispensables.6
La vacuole parasitophore est formée en
quelques secondes et le parasite entame alors une multiplication intense qui
aboutit à la formation des pseudokystes. En quelques heures, les kystes
entrainent la destruction de la cellule hôte puis, de proche en proche,
induisent une lyse cellulaire massive (à l'exception des oocystes qui
sont excrétés avec les selles). C'est la nécrose
tissulaire.7
I. 3. Origine et chronologie des lésions dans
un tissu
Lors de la primo-infection, le parasite va passer
dans la lamina propria intestinale et gagner les noeuds lymphatiques
mésentériques, puis les organes extra-intestinaux via les
circulations sanguine et lymphatique. Il se multiplie alors intensément
sous la forme tachyzoïtique. Selon la forme infectieuse
ingérée par l'hôte, le cycle coccidien débutera
avant ou après l'initiation du cycle extra-épithélial. Le
parasite disséminé par la circulation générale vers
les différents tissus cibles, va alors se multiplier dans les cellules
de ces tissus, causer leur éclatement et donc leur mort (lésions
de nécrose). La présence du parasite et la lyse des cellules sont
à l'origine d'une réaction inflammatoire déterminée
par la libération des médiateurs de l'inflammation et par
l'arrivée de cellules de l'inflammation.6
I. 4. Conséquences cliniques
Dans de rares cas, l'hôte peut
présenter des signes cliniques graves, voire mourir, si la
nécrose et l'inflammation intestinale sont intenses. La
sévérité de la maladie dépend des organes atteints,
de l'intensité des lésions dans les différents tissus mais
aussi de la dose infectante ingérée, de la virulence de la souche
de T. gondii en presence, et de facteurs relatifs à
l'hôte (âge, maladies intercurrentes, compétences
immunitaires...).6
Cependant, chez un hôte immunocompétent,
une immunité non spécifique se met rapidement en place. Les
principaux agents actifs contre la T. gondii sont des macrophages
activés, les lymphocytes et les anticorps spécifiques. 6
Les formes libres (extracellulaires) du parasite,
sont directement détruites par la réponse immune humorale. Dans
la plupart des cas, l'immunité mise en place après une infection
naturelle, semble persister toute la vie de l'hôte. Ainsi, l'infection
toxoplasmique est subclinique.6
L'hôte n'éradique pas
définitivement le parasite : les kystes persistent pendant
plusieurs années, voire durant toute sa vie.6
I. 5. Particularités de la toxoplasmose
congénitale
Lors de la transmission verticale, seuls les
tachyzoïtes peuvent traverser le placenta et aller infecter les tissus
foetaux. Le passage transplacentaire ne peut se faire directement par voie
sanguine ; il se fait par voie tissulaire : les tachyzoïtes
colonisent le placenta, se multiplient et causent de nécroses qui
permettent leur passage dans la circulation foetale et donc la colonisation et
l'infection du foetus.7
Il semble que le risque de transmission transplacentaire du
parasite aux foetus est maximal lors de la primo-infection de la
mère ; au début de la gestation. Le risque est de moins en
moins important au fur et à mesure que le terme se rapproche.7
II. Pouvoir pathogène indirect :
uvéites
L'oeil apparait relativement isolé du reste
de l'organisme d'un point de vue immunitaire ; il n'y a notamment pas de
drainage lymphatique. En outre les milieux intraoculaires sont isolées
de la circulation sanguine par des barrières : les espaces
intercellulaires de certains épithéliums (corps ciliaires en
partie et épithélium pigmentaire de la rétine) et des
endothéliums des capillaires de l'iris et de la rétine, sont
rendus étanches grâce à l'existence
zonulaoccludens continues qui s'opposent ainsi au passage des
molécules. Parallèlement, les échanges avec le sang sont
réalisés grâce à des mécanismes de transport
actif ou de diffusion facilitée, qui permettent un passage
sélectif des molécules. 8
Malgré cet isolement partiel, l'oeil possède de
nombreux éléments immunitaires spécifiques ; ces
cellules immunocompétentes sont localisées principalement dans
l'uvée (iris, corps ciliaire et choroïde) qui est assimiléea
un `'ganglion accessoire'' pour le milieu intraoculaire. 8
Chez les animaux, même chez l'homme, les
lésions oculaires sont généralementliées au pouvoir
cytotoxique direct de T. gondii et les épisodes de rechute
semblent lies à la recrudescence des kystes rétiniens
par l'émergence de bradyzoïtes et l'infection des cellules
rétiniennes voisines. Néanmoins, la mise en évidence des
toxoplasmoses est souvent difficile, même avec une technique sensible
comme la PCR. 8
III. Sémiologie
III. 1. Signes pulmonaires
- Tachypnée ;
- Dyspnée ;
- Détresse respiratoire ;
- Cyanose ;
- Toux ;
- Eternuements ;
- Jetage nasal ;
- Bruits anormaux. ?
III. 2. Signes digestifs
- Inconfort et douleur à la palpation de
l'abdomen ;
- Masses anormales à la palpation abdominale (noeuds
lymphatiques) ;
- Hépatomégalie ;
- Ascite mise en évidence par le signe du flot ;
- Vomissements ;
- Diarrhée parfois hémorragique ;
- Constipation (lorsque le transit est gêné du fait
de la compression des intestins par un noeud lymphatique de taille
augmentée). ?
III. 3. Signes nerveux et musculaires
Il semble que ces signes soient principalement
liés a des lésions d'encéphalite et
méningo-encéphalite chez les animaux :
- Hypothermie ;
- Comportement affectif exacerbé ;
- Stupeur ;
- Tremblements ;
- Ataxie ;
- L'animal tourne en rond ;
- Mouvement de têtes anormales ;
- Cris atypiques ;
- Crispation des oreilles ;
- Difficultésàmâcher ;
- Nystagmus ;
- Coma. ?
III. 4. Signes oculaires
- Photophobie ;
- Baisse de la vision ;
- OEdèmecornéen ;
- Modification de la couleur de l'iris ;
- Reflexes pupillaires indirect, incomplet et instables ;
- Modification du diamètre pupillaire ;
- Modification de la pression intraoculaire ;
- Modification du cristallin (cataracte et luxation) ;
- Modification de la transparence du vitré.8
III. 5. Autres signes
- Abattement, faiblesse ou léthargie ;
- Perte de poids (anorexie) ;
- Ictère ;
- Muqueuses pales ;
- Incontinence urinaire ;
- Déshydratation ;
- Polydipsie liée à la fièvre ;
- Mort subite. ?
IV. Diagnostic
IV. 1. Diagnostic chez les animaux
IV. 1. 1. Diagnostic clinique
Le diagnostic clinique est difficile car la
toxoplasmose est le plus souvent asymptomatique, et même quand elle
s'exprime cliniquement, le cadre anato-clinique est polymorphe. Chez les
animaux, la toxoplasmose congénitale est prise en compte en cas
d'avortements collectifs dans les troupeaux. ²° Ainsi, un
tableau clinique peut résumer l'évolution des signes cliniques
selon les cas rencontrés.
|
Généralisé
|
Respiratoire
|
Abdominal/
digestif
|
Nerveux central
|
Musculaire
|
Oculaire
|
|
Signes respiratoires
|
Fréquents
|
Toujours
|
Rares
|
Rares
|
Rares
|
Parfois
|
|
Signes abdominaux/digestifs
|
Fréquents
|
Rares
|
Toujours
|
Rares
|
Rares
|
Parfois
|
|
Signes nerveux centraux
|
Parfois
|
Rares
|
Rares
|
Toujours
|
Rares
|
Parfois
|
|
Signes musculaires
|
Rares
|
Rares
|
Rares
|
Rares
|
Toujours
|
Parfois
|
|
Signes oculaires
|
Fréquents
|
Fréquents
|
Fréquents
|
Fréquents
|
Fréquents
|
Toujours
|
|
Fréquence
|
36%
|
26%
|
29%
|
7%
|
0%
|
Non établie mais 81.5% en association
|
Table 1: Tableau présentant les principaux
tableaux cliniques de la toxoplasmose et leurs fréquence relative
²
IV. 1. 2. Diagnostic nécropsique
Ce diagnostic est également difficile à cause de
la faible densité de l'infection, mais aussi de la ressemblance avec les
kystes Sarcocystis. La différence réside dans l'absence
de vacuoles parasitophores dans les cellules parasitées par ce dernier.
Cependant, les lésions nécrotiques focales de quelques mm,
siégeant dans les muscles, les poumons, la rate et éventuellement
les centres nerveux doivent attirer l'attention du vétérinaire
inspecteur. Le contenu de ces foyers de nécrosé,
étalé sur la lame et coloré au Giemsa permet de
révéler la présence de bradyzoïtes. ²°
IV. 1. 3. Diagnostic différentiel
Il doit être fondé avec toutes les
pathologies entrainant des avortements à savoir la brucellose, la forme
chronique des trypanosomoses. Ajoutant à celle-ci les pathologies
cérébrales comme les méningites et les
encéphalites.²°
IV. 1. 4. Diagnostic du laboratoire
Les diagnostics précédemment
cités sont difficiles et peu fiables. Le recours aux méthodes de
laboratoire pour confirmer les suspicions est souvent effectué.
- Examen coprologique
Il est uniquement réalisé chez le chat, ce
dernier étant le seul animal domestique excrétant les oocystes de
toxoplasme. Cet examen est facile mais en même temps peu fiable car la
période patente dure environ une quinzaine de jours seulement. En effet,
le chat ne devient évacuateur d'oocystes que lorsqu'il atteint
l'âge auquel il commence à se nourrir d'aliments carnés, un
mois et demi, et ces oocystes ne deviennent infectant qu'au terme de leur
sporulation dans le milieu extérieur. Les oocystes sont souvent de forme
globuleuse de diamètre 13 à 15 microns. Ils sont semblables aux
oocystes de genre Hammondiaet Besnoïtia. ²°
- Examen histologique
Cet examen est basé sur l'observation au microscope des
toxoplasmes, soient sous formes libres, soient sous forme de pseudo-kystes dans
de nombreux prélèvements de tissus, organes ou exsudats. Ces
éléments peuvent être prélevés directement
sur des animaux vivants (biopsie) ou morts. Elle nécessite une
infestation parasitaire importante pour faciliter l'observation. Le travail se
fait sur des étalements ou frottis de pulpe d'organes (cerveau, foie,
rein, poumons, coeur, muscle) ou de placenta fixés dans le formol 10% et
colorés à l'hématoxyline éosine pour rechercher les
foyers de nécrose et les kystes parasitaires. ²°
- Inoculation aux souris
C'est la méthode la plus fiable. Elle nécessite
l'usage des matières infectantes notamment les fragments d'organes, le
liquide céphalo-rachidien, du sang ou la pulpe ganglionnaire.
L'apparition de kyste est lente et nécessite environ 4 jours.
²°
- Inoculation à des cultures cellulaires
Elle nécessite des laboratoires
spécialisés et la marge d'échec est très vaste.
²°
- Examen sérologique
Les épreuves sérologiques sont les
méthodes de diagnostic les plus utilisés et permettent la mise en
évidence d'anticorps circulants. Le test de lyse de Sabin-Feldman (Dye
Test) a été fondé sur le fait de perte d'affinité
des cellules parasitées, et par suite leurs lyses. Il est
délaissé à cause de nombreux inconvénients qui
limitent son utilisation : la nécessité d'utiliser des
souches vivantes de la toxoplasmose ce qui expose le personnel a des risques de
contamination. ²°
ELISA (Enzyme LinkedImmuno-SorbentAssay) est la
réaction de référence universellement acceptée en
médecine humaine. Elle est difficile et délicate mais
possède une bonne spécificité et une bonne
sensibilité. Dans cette méthode, l'antigène (cytoplasmique
et membranaire) est fixé au fond des cupules des plaques en
polystyrène utilisés en microtitration. Le sérum suspect
est ajouté, puis l'excès est éliminé par lavage. Un
sérum anti-immunoglobuline spécifique marqué à la
phosphatase est ensuite introduit dans la réaction. Les anticorps
anti-immunoglobuline se fixeront sur les anticorps spécifiques
éventuellement retenus par l'antigène. L'enzyme est alors
révélé par un substrat qui donne à l'ensemble, une
coloration dont l'intensité est fonction de la positivité du
sérum étudié.²°
D'autres techniques immuno-enzymologiques peuvent être
associées à l'ELISA ce qui permettrait d'aboutir à de
meilleurs résultats. Il s'agit d'ELIFA et de SAGA. ²°
- Examen moléculaire
Enfin, des techniques moléculaires (PCR)
récentes ont été mises au point pour le diagnostic de la
toxoplasmose. Grace à cette technique (Polymerase Chain Reaction),
l'identification de la présence de l'ADN de Toxoplasmagondii a
pu avoir lieu chez les chiens et dans des échantillons biologiques de
félins. ²°
IV. 2. Diagnostic chez les femmes enceintes
Le diagnostic premier établi jusqu'à
ce jour par des examens effectué à la naissance s'est
modifié en raison de techniques nouvelles permettant un dépistage
in utero de l'infection. L'objectif majeur est de ne pas proposer des
interruptions de grossesse, des avortements et de mettre en oeuvre un
traitement des foetus infectés avant la naissance. Ce diagnostic repose
sur trois éléments : l'échographie,
l'amniocentèse et la ponction du sang foetal.²²
- L'échographie ²²
L'anomalie détectées sont graves ;
dilatation vestibulaire, bilatérale et symétrique, calcifications
intracrâniennes, hyperdensités hépatiques et
hépatomégalie, épaississement placentaire, ascite,
épanchements pleuraux et péricardiques.
- L'amniocentèse et ponction de sang foetale
²²
Cette méthode est réalisée sous
contrôle échographique. La ponction de sang foetal n'est possible
qu'à partir de la vingtième semaine de la grossesse. Avant cet
âge, l'immaturité du système immunitaire foetal augmente le
risque de faux négatif. Un délai de 1 mois entre la date
présumée de l'infestation et la ponction de sang de cordon doit
être recommandé. Les signes généraux d'infection
foetale sont : un syndrome hématologique, associant une
hyperleucocytose avec éosinophilie, et une thrombopénie.
CINQUIEME PARTIE: TRAITEMENT ET PROPHILAXIE
I. Traitement
Les différents schémas de traitement de la
toxoplasmose reposent sur un nombre très limitéde
médicaments. Les médicaments reconnus actifs se regroupent en
deux grandes familles: les inhibiteurs de la synthèse de l'acide folique
et les macrolides. Ces médicaments ne sont actifs que sur les
tachyzoïtes et sont sans effet sur les kystes. Le traitement consiste
à utiliser différents type de molécules ; inhibiteurs
de la synthèse de l'acide folique, les macrolides et l'atovaquone.
Les inhibiteurs de la synthese de l'acide folique comprennent
les inhibiteurs de la déhydrofolate réductase (DHFR) et les
sulfamides. Cesmédicaments ont un effet antiparasitaire puissant mais ne
sont pas dénués d'effetsindésirables car ils agissent
également sur la synthèse de l'acide folique de l'hôte.
Parmi les inhibiteurs de la DHFR, l'un des plus actifs est la
pyriméthamine, qui a un effet parasiticide sur les tachyzoïtes de
T. gondiià de très faibles concentrations. Le
triméthoprime(composant du cotrimoxazole) est également actif sur
T. gondii, mais à des concentrations 100 fois plus
élevées que la pyriméthamine. Ces médicaments
diffusent bien dans l'organisme, avec cependant un temps de latence pour la
pyriméthamine (ce qui impose l'utilisation d'une dose de charge) et
franchissent le placenta. Chez l'animal, un effet tératogène a
été rapporté lors de l'administration de fortes doses en
début de gestation, contre-indiquant leur utilisation chez la femme au
cours du
premier trimestre de la grossesse.²
De nombreux sulfamides sont actifs sur T. gondiiet
leur choix est surtout orienté par leur pharmacocinétique. La
sulfadiazine et le sulfaméthoxazole ont des demi-vies courtes (10-12
heures) et leur administration doit être quotidienne ; la sulfadoxine est
un sulfamide retard, moins actif que la sulfadiazine mais dont
l'administration peut être hebdomadaire. Les sulfamides diffusent bien
dans l'organisme et franchissent la barrière placentaire.²
L'association d'un inhibiteur de la DHFR et d'un sulfamide est
remarquablement synergique sur T. gondiipar un effet «en
cascade» sur deux enzymes essentiels au métabolisme de l'acide
folique du parasite. Parmi les associations les plus actives, figurent
pyriméthaminesulfadiazine, pyriméthamine + sulfadoxine (effet
retard), et triméthoprime + sulfaméthoxazole. Ces associations
sont utilisées en priorité pour le traitement et la prophylaxie
secondaire des formes graves de toxoplasmose. Elles sont efficaces, mais
fréquemment responsables d'effets indésirables
hématologiques (neutropénie, thrombopénie, justifiant
l'administration systématique d'acide folinique) et/ou de signes
d'intolérance cutanées, parfois graves (épidermolyse,
syndrome de Lyell).²
Les macrolides sont les antibiotiques sont actifs sur T.
gondiimais leur effet est uniquement parasitostatique et ne s'observe
qu'à des concentrations élevées. Or, aussi bien chez
l'adulte que chez le foetus, ces concentrations ne sont atteintes que dans
certains tissus, comme le foie, le poumon mais pas dans le cerveau ou l'oeil,
ce qui limite considérablement leur intérêt dans le
traitement des formes graves de toxoplasmose. Par contre, les macrolides se
concentrent bien dans le placenta et pourraient permettent de réduire la
transmission materno-foetale du parasite.²
La spiramycine est le principal macrolide utilisé dans
le traitement de la toxoplasmose acquise et en cours de grossesse. Les autres
macrolides comme la roxithromycine, l'azithromycine ou la clarithromycine ont
des caractéristiques pharmacocinétiques plus favorables
(meilleures concentrations tissulaires) mais sont encore contre-indiqués
chez la femme enceinte. Les kétolides, nouvelle famille de
médicaments apparentés aux macrolides, sont efficaces dans la
toxoplasmose expérimentale animale mais n'ont pas encore
été utilisés chez l'homme. La clindamycine (famille des
lincosamides) a des caractéristiques pharmacologiques voisines de celles
des macrolides ; elle est habituellement utilisée en association avec la
pyriméthamine dans le traitement des toxoplasmoses
cérébrales (traitement de deuxième intention) ou
oculaires. ²
Les macrolides et médicaments apparentés sont
généralement bien tolérés ; des intolérances
digestives, parfois graves, sont observées avec la
clindamycine.²
I. 1. Traitement chez les animaux
Chez les animaux, autres que chez les humains, le
traitement est rarement justifié. Sulfadiazine (15-25 mg / kg) et la
pyriméthamine (0,44 mg / kg) agissent en synergie et sont largement
utilisés pour le traitement de la toxoplasmose. Bien que ces
médicaments sont bénéfiques s'il figure dans la phase
aiguë de la maladie quand il ya une multiplication active du parasite, ils
ne sont généralement éradiquer l'infection. Ces
médicaments sont soupçonnés d'avoir peu d'effet sur ??la
scène bradyzoïte. Certains médicaments, y compris
diaminodiphénylsulfone, l'atovaquone et la spiramycine sont
également utilisés pour traiter la toxoplasmose dans les cas
difficiles. La clindamycine est le traitement de choix pour les chiens et les
chats, à 10-40 mg / kg et 25-50 mg / kg, respectivement, pendant 14-21
jours. ²4
I. 2. Traitement chez les humains
Actuellement, le médicament recommandédans le
traitement de la toxoplasmose acte en premier lieu contre la forme de
tachyzoïtes de T. gondii; donc, ils n'ont pas d'éradiquer la forme
enkystée (bradyzoïte). La pyriméthamine est l'agent le plus
efficace et est inclus dans la plupart des schémas de drogue.
Leucovorine (c.-à-acide folinique) doit être administré de
façon concomitante à empêcher la suppression de moelle
osseuse. Sauf circonstances ne permettent pas l'utilisation de plus d'un, un
médicament secondaire (par exemple, la sulfadiazine, la clindamycine)
devrait être ajouté. ²5
L'efficacité de l'azithromycine, la clarithromycine,
l'atovaquone, la dapsone, et le cotrimoxazole n'est pas clair, par
conséquent, ils doivent être utilisés uniquement comme des
solutions de rechange en combinaison avec la pyriméthamine. La
combinaison la plus efficace disponible thérapeutiquement est la
pyriméthamine + sulfadiazine ou trisulfapyrimidines (par exemple, une
combinaison de sulfamérazine, la sulfaméthazine, et
sulfapyrazine). Ces agents sont actifs contre les tachyzoïtes et sont
synergiques lorsqu'il est utilisé en combinaison. ²6
Une attention particulière à posologie est
nécessaire, car il varie en fonction de variables du patient (par
exemple, le statut immunitaire, la grossesse). Pyriméthamine peut
être utilisé avec les sulfamides, la quinine, et des
antipaludéens et d'autres avec d'autres antibiotiques. ²7
- Chez les sujets sains²6
Les patients non enceintes ne nécessitent
généralement pas de traitement. Le traitement des patients non
enceintes est décrit ci-dessous.Le schéma thérapeutique
6-semaine est le suivant:
· Pyriméthamine (100 mg dose de charge par voie
orale suivie par 25-50 mg / jour) + sulfadiazine (2-4 g / jour à diviser
4 fois par jour) ;
· Pyriméthamine (100 mg dose de charge par voie
orale suivie par 25-50 mg / jour) et la clindamycine (300 mg par voie orale 4
fois par jour) ;
· Acide folinique (leucovorine) (10-25 mg / jour) doit
être administrée à tous les patients pour prévenir
la toxicité hématologique de la pyriméthamine ;
· Triméthoprime (10 mg / kg / jour)
sulfaméthoxazole (50 mg / kg / jour) pendant 4 semaines.
La sulfadiazine ou clindamycine peut être
remplacée par l'azithromycine 500 mg par jour ou atovaquone 750 mg deux
fois par jour chez les patients immunocompétents ou chez les patients
ayant des antécédents d'allergie aux médicaments
anciens.
- Chez les femmes enceintes²6
Le diagnostic d'infection aiguë est souvent difficile de
faire pendant la grossesse et l'administration de traitement antimicrobien
empirique est déconseillée.Une importante discussion existe quant
à l'efficacité du traitement pendant la grossesse en termes de
réduction du risque de l'exposition du foetus et le développement
ultérieur de la maladie clinique comme rétinochoroïdite ou
des anomalies du système nerveux central.Une controverse existe
également en ce qui concerne le régime optimal pour traiter une
infection maternelle acquise. Spiramycine et la pyriméthamine-sulfamide
sont utilisés, mais étant donné la rareté de
l'infection foetale et de la nature asymptomatique de la plupart des infections
foetales, les effets du traitement sont difficiles à mesurer.
Spiramycine semble être un peu plus facilement tolérée que
la pyriméthamine-sulfamide.
Un schéma posologique pour les patients enceints se
présente comme suit:
· Spiramycine 1 g par voie orale toutes les 8 heures. Si
le résultat de test liquide amniotique pour T gondii est positif:
semaines 3 de la pyriméthamine (50 mg / jour par voie orale) et la
sulfadiazine (3 g / jour par voie orale en 2-3 doses divisées) en
alternance avec un stage de 3 semaines de spiramycine 1 g 3 fois par jour pour
le traitement de la mère ;
· Pyriméthamine (25 mg / jour par voie orale) et
la sulfadiazine (4 g / jour par voie orale), divisé 2 ou 4 fois par jour
jusqu'à l'accouchement (cet agent peut être associée
à la suppression de moelle et de pancytopénie) et Leucovorin
10-25 mg / jour par voie orale pour prévenir la suppression de moelle
osseuse.
- Chez les sujets immunodéprimés (SIDA)
²7
Les patients atteints du SIDA soient traités avec
pyriméthamine 200 mg par voie orale au début, suivie par 50-75 mg
/ jour par voie orale et d'acide folinique 10 mg / jour par voie orale ainsi
que la sulfadiazine 4-8 g / jour par voie orale pendant aussi longtemps que 6
semaines, suivie d'un traitement suppressif à vie ou jusqu'à ce
que la reconstitution immunitaire.Le traitement suppressif chez les patients
atteints du SIDA (taux de CD4 <100 cellules / uL) est pyriméthamine +
sulfadiazine par voie orale 50mg/jour 1-1,5 g / jour par voie orale et d'acide
folinique 10 mg / jour par voie orale pour la vie ou jusqu'à ce que la
reconstitution immunitaire.
Les patients atteints du SIDA, la toxoplasmose du
système nerveux central, et une preuve de changement de ligne
médiane ou l'augmentation de la pression intracrânienne peuvent
également bénéficier d'une corticothérapie.
Le diagnostic de la toxoplasmose en l'absence de
preuve du tissu ou de la culture définitif peut être dangereux
parce que la sérologie peut être trompeuse et un résultat
IgM faussement positifs est assez courant. Par conséquent, un traitement
empirique doit être évité.
II. Prophylaxie
II. 1. Mesures prophylactiques chez les animaux
Les mesures prophylactiques sanitaires doivent
s'appliquer à tous les acteurs du cycle biologique du parasite, voire le
chat (hôte définitif), l'homme et les ruminants (hôte
intermédiaires) et le milieu extérieur. Elles seraient d'une
grande efficacité si elles étaient faciles à mettre en
placent. Ces mesures consistent à :
- Empêcher l'accès des bâtiments et des
réserves de céréales aux chats ;
- Ne pas laisser les placentas des femelles ayant
avorté à la portée des autres femelles ;
- Conserver les brebis qui auront été
infectées par ce processus pathologique puisqu'elles sont
immunisées ;
- Surveiller les mises-bas surtouts lors d'avortements
enzootiques chez les petits ruminants.
La prophylaxie médicale est aussi difficile
puisque aucun vaccin anti-toxoplasmique n'est encore efficacement disponible.
²8
II. 2. Prévention de la femme enceinte
- Porter des gants avant ou se laver soigneusement les mains
après avoir :
1) Manipuler de la viande crue ;
2) Manipuler des crudités ;
3) Faire le jardinage. ²?
- Eviter tout contact avec les chats sinon :
1) Eliminer des fèces du chat et changer sa
litière avec des gants et à des intervalles réguliers
inferieures à 24 heures ;
2) Désinfecter les objets souillés par de l'eau
bouillante pendant 5 minutes. ²?
- Suivre un régime alimentaire :
1) Consommer toute viande bien cuite (ovins, bovins,
volailles) ;
2) Eviter la consommation de crudités ou les laver
soigneusement ;
3) Eviter la consommation d'oeufs crus et de lait
cru. ²?
III. Rôle du vétérinaire
Il n'est pas rare de voir des femmes enceintes se
renseigner chez leur vétérinaire sur le niveau toxoplasmique de
leur chat. Ici, le vétérinaire doit prendre le temps d'instaurer
un dialogue avec sa cliente et d'éclairer toutes les interrogations de
celle-ci.
Dans un premier temps, il doit insister sur le fait
que le chat n'est pas la seule origine de contamination par la toxoplasmose, et
qui ne représente pas nécessairement le risque majeur. Les
mesures préventives concernant l'alimentation doivent être
rappelées à la propriétaire avant même de parler du
chat.
Les examens disposées pour détecter
les chats `'dangereux'' sont les examens coprologiques et les examens
sérologiques. Le premier permet de mettre en évidence du rejet
d'oocystes dans les matières fécales. Le second est utile pour
diagnostiquer une éventuelle toxoplasmose clinique affectant le chat.
Une sérologie positive indique que le chat est infectée par
T. gondii depuis plusieurs semaines au moins et souvent plusieurs
mois. Cet animal n'est donc pas dangereux sauf dans le cas d'une
immunodépression récente.
Le vétérinaire doit dicter les mesures
prophylactiques pour éviter l'infection ou la réinfection du
chat. La nourriture des chats doit être régulièrement
contrôlée. Le chat ne doit plus pouvoir chasser ni manger des
proies potentiellement contaminées, des abats ou de la viande crue. Ils
doivent être nourris avec de la viande bien cuite, voire exclusivement
avec des aliments industriels.Qu'il exerce en zone rurale, ou urbaine, ou qu'il
soit spécialisé en hygiène alimentaire, le
vétérinaire a donc toujours un rôle
prépondérant dans l'information nécessaire à la
prévention de la toxoplasmose.
CONCLUSION
La toxoplasmose est une maladie parasitaire due
à un protozoaire, Toxoplasmagondii, qui affecte un grand nombre
d'espèces animales domestiques et sauvages et également l'homme.
Parmi les animaux domestiques, on peut citer les animaux d'élevage
(ovins, caprins, bovins, porcins, équins, volailles), les animaux de
compagnie (chiens et chats). Les chats constituent avec les autres
félidés, les seuls animaux domestiques considérés
comme hôtes définitifs du parasite.
La maladie humaine a été
décrite dans plusieurs pays. La plupart des études qui ont
été menées dans ces pays rapportent la consommation de
viande infestée et de légumes crus ou mal cuits comme
étant les principales sources de contamination pour l'homme. Le
rôle du chat comme hôte définitif domestique du parasite,
dans l'épidémiologie de la toxoplasmose est rarement
rencontré dans la littérature. Or, plusieurs facteurs peuvent
influencer l'épidémiologie de la maladie d'une région
à l'autre parmi lesquels on peut citer les mesures d'hygiène
appliquées dans les abattoirs, les technologies et
procédés de cuisson des aliments, les conditions climatiques mais
également la densité des chats et des félidés
sauvages dans l'environnement.
Les professionnels en contact avec la viande crue,
des animaux vivants ou des selles de félins contaminés, voire des
objets portant le germe sont les plus exposés. Ainsi, les
recommandations générales sont:
Pour les vétérinaires: bien
respecter les règles d'hygiène du métier en utilisant
des gants pour la consultation des chats et en changeant ces gants d'un animal
à un autre ou encore se laver les mains d'une consultation à
l'autre.
Pour les propriétaires et gardiens des chats:
- Nettoyer chaque jour les cages des chats. Eviter le plus
possible que ce nettoyage soit fait par une personne immunodéficiente ou
une femme enceinte. Mais en cas de nécessité, utiliser des gants
et de l'eau chauffée à une température supérieure
à 70°C et un détergent car les ookystes non sporulés
ne sont pas infestant;
- Faire examiner les chats: la coprologie est peu
coûteuse et efficace si l'animal est positif mais en cas de
négativité, faire la sérologie ;
- Bien se laver les mains avant et après la
préparation des aliments;
- Eviter de consommer la viande crue ou peu cuite, ne manger
que de la viande bien cuite, fumée ou salée car le parasite est
détruit à plus de 65°C.
- Préférer des aliments (viande, poisson etc.)
soumis à une congélation de -12°C pendant plus de 24h;
- Bien laver les fruits et les légumes avant de les
consommer avec de l'eau vinaigrée;
- Ne donner aux chats que des aliments cuits, en conserve ou
secs (croquettes);
- Essayer de garder les chats à l'intérieur pour
les empêcher de se nourrir de leur chasse.
BIBLIOGRAPHIE
1- ACHA P. N., SZYFRES B. Toxoplasmose ; Zoonoses et
maladies transmissibles communes à l'homme et aux animaux.
2nd éd. Paris, office international des
épizooties, 1990.
2- BEND L. R., Enquête coprologique sur la
toxoplasmose dans la population des chats de la ville de Dakar.
Thèse, 2006.
3- EUZEBY J., Protozoologie médicale
comparée - Volume II. Paris : Fondation Merieux, 1987.
4- EUZEBY J., Les sarcocystoseszoosiques. Bull. Soc.
Patho. Exot., 1997.
5- DUBEY J.P., KARHEMERE S. et coll. First biologic and
genetic characterization of Toxoplasma gondii isolates from chickens from
Africa (Democratic Republic of Congo, Mali, Burkina Faso, and Kenya). J
Parasitol., 2005.
6- Wikipedia; fr.wikipedia.org/wiki/Hote_(biologie)
7- OLITSKY et coll., Perspectives in Medical Virology -
Volume,.1937.
8- DUBEY J. P., T. gondii, Parasitic protozoa,
2nd edition, Volume 6: 5-57 Ed. Julius, P. Kreler, Academic
Press Inc., San Diego, California. 1997.
9- LINDSAY D. S., BLAGBURN B. L., DUBEY J. P., Feline
toxoplasmosis and the importance of the T. gondiioocyst. Comend. Cont. Educ.
Sm. Anim; Volume 19, N4: 448-460, 1997.
10- EUZEBY J., La toxoplasmose; Les parasites des viandes,
E.M. Inter, 45-90, 1998.
11- LAPPIN M. R., Toxoplasmosis, Practical small animal
internal medecine, W. B. Sauders Company, Chapitre 40: 917-927, 2008.
12- HENDRIX C.M.,Diagnostic veterinary parasitology (2nd
edition). Mosby inc (Ed), Saint-Louis, 1998.
13- LAPPIN M. R., Feline infectious uveitis. J. Fel. Med.
Surg., Vol. 2: 159-163, 2000.
14- SATO K., IWAMOTO I., YOSHIKI K., Experimental
toxoplasmosis in pregnant cats. J. Vet. Med. Sci., Vol 55; 1005-1009,
1993.
15- ROSE M., Les uvéites du chat, Prat. Med. Chir.
Anim. Comp,; Vol 33, N2 : 123-130, 1998.
16- POWELL C. C., LAPPIN M. R., Clinical ocular
toxoplasmosis in neonatal kittens. Ophthalmol. Vol 4, N2:87-92, 2001.
17- BUSSIERAS J, CHERMETTE R. Les protozoaires parasites
des animaux domestiques, In : Parasitologie vétérinaire :
Protozoologie.Maison-Alford,service de parasitologie, 1992.
18- DUBREMETZ J. F., Biologie du toxoplasme et
toxoplasmose. Ann. Inst; Past. Actual. Vol 10, N1: 107-122, 1999.
19- DAVIDSON M. G., Toxoplasmosis, Vet. Clin. North Am.:
Sm, Vol 30, N5; 1051-1062, 2000.
20- BOISSON D., Etude Bibliographique de la Toxoplasmose
Féline: Aspect clinique et conduite du vétérinaire, lors
d'une suspicion de toxoplasmose féline, Ecole Nationale
Vétérinaire de Lyon, 2002.
21- MATSUO J., KIMURA D., RAI S. K., UGA S. Detection of
Toxoplasma oocysts from soil by modified sucrose flottation and PCR methods.
Southeast Asian J. Trop .Med .Public Health, 2004.
22- CARPENTER J. L., DUBEY J. P., Histologically confirmed
clinical toxoplasmosis in cats: 100 cases (1952-1990), J. Am. Vet. Med. Assoc.
Vol 2003, N11: 1556-1566, 1993.
23- BUSSIERAS J, CHERMETTE R. Les protozoaires parasites
des animaux domestiques, In : Parasitologie vétérinaire :
Protozoologie.Maison-Alford, service de parasitologie, 1992.
24- M
erck
Sharp &Dohme Corp., a subsidiary of Merck & Co., Inc.Whitehouse
Station, NJ, USA, 2011.
25- Sobrin L, Kump LI, Foster CS. Intravitreal clindamycin for
toxoplasmicretinochoroiditis. Retina. Sep 2007.
26- Soheilian M, Ramezani A, Azimzadeh A, Sadoughi MM, Dehghan
MH, Shahghadami R, et al. Randomized trial of intravitreal clindamycin and
dexamethasone versus pyrimethamine, sulfadiazine, and prednisolone in treatment
of ocular toxoplasmosis. Ophthalmology, 2011.
27- Soheilian M, Sadoughi MM, Ghajarnia M, Dehghan MH, Yazdani
S, Behboudi H, et al. Prospective randomized trial of
trimethoprim/sulfamethoxazole versus pyrimethamine and sulfadiazine in the
treatment of ocular toxoplasmosis. Ophthalmology. Nov 2005.
28- MATSUO J., KIMURA D., RAI S. K., UGA S. Detection of
Toxoplasma oocysts from soil by modified sucrose flottation and PCR methods.
Southeast Asian J. Trop .Med .Public Health, 2004.
29- COUVREUR J. Toxoplasmose congénitale, prise en
charge et devenir. Med. Mal. Infec., 1993.
RESUME
Toxoplasmagondii, protozoaire intracellulaire
obligatoire, est l'agent causal de la toxoplasmose. Cette anthropo-zoonose
cosmopolite pose de sérieux problèmes en médecine et
médecine vétérinaire. Chez l'homme, cette parasitose est
très fréquente. Elle peut être grave ou mortelle chez le
foetus en cas de transmission transplacentaire. Ainsi la toxoplasmose
congénitale est à l'origine d'un sérieux problème
de santé publique, qui impose à la femme enceinte puis à
l'enfant des mesures de prévention lourdes et couteuses. Des formes
aussi sérieuses sont observées chez
l'immunodéprimé. En médecine vétérinaire,
elle provoque de nombreux avortements chez certains animaux de rente et pose
donc un important problème économique. La consommation de viande
infectée est la première cause de l'infection humaine. La prise
en charge vaccinale, motivée par une primo-infection, conduit à
une protection spécifique et définitive contre une
ré-infestation. Les connaissances actuelles bien qu'incomplètes
sur le parasite et sur l'immunité de protection qu'il induit, permettent
de concevoir un vaccin sur des bases solides. Une bonne hygiène
sanitaire, vétérinaire et locale peur servir comme prophylaxie de
la maladie. Le vétérinaire, ainsi que le médecin, jouent
un rôle important dans la sensibilisation que le chat n'est pas un danger
si toutes les mesures sont prises en considération.
Mots-clés : Toxoplasmose,
Toxoplasmagondii, zoonose, femme enceinte, infection, foetus,
hôtes intermédiaires, cycle complexe, chat domestique.
ABSTRACT
Toxoplasma gondii, an obligate intracellular
protozoan, is the causative agent of toxoplasmosis. The anthropo-zoonosis
cosmopolitan poses serious problems in medicine and veterinary medicine. In
humans, this parasite is very common. It can be serious or even fatal to the
fetus in case of transplacental transmission. Congenital toxoplasmosis is
causing a serious public health problem, which makes the pregnant woman and the
child prevention heavy and expensive. Forms of this disease can also be as
serious in immunocompromised patients. In veterinary medicine, it causes many
abortions in some livestock and poses a major economic problem. Consumption of
infected meat is the primary cause of human infection. Support vaccination,
motivated by a primary infection leads to a specific and definitive protection
against re-infestation. Current knowledge on the parasite although incomplete
along with the protective immunity it induces, can lead to the design of a
vaccine on a solid foundation. Good sanitary, veterinary and localhygiene can
serve as a prophylaxis from the disease. The vet and the doctor, play an
important role in raising awareness that the cat is not a danger if all
measures are taken into account.
Keywords: Toxoplasmosis, Toxoplasma gondii,
zoonosis, pregnant woman, infection, fetal hosts, complex cycle, domestic
cat.
| 


