DEDICACE
A Dieu tout puissant ;
A nos regrettés parents, frères et
soeurs ;
A notre soeur Chantal ;
A tous les victimes du génocide des tutsi
REMERCIEMENTS
Au terme de ce travail, nous tenons à exprimer nos vifs
remerciements aux personnes dont la collaboration et la
générosité ont contribué de près ou de loin
efficacement à sa réalisation
Mes remerciements s'adressent premièrement au Prof.
KADIMA NTOKAMUNDA Justin, qui, malgré ses multiples
responsabilités, a accepté de diriger ce travail.
Mes remerciements s'adressent également à tout
le corps professoral de la faculté des sciences de l'Université
Nationale du Rwanda, spécialement celui du Département de
Pharmacie pour son encadrement durant notre cycle de formation.
Je tiens à remercier également la direction du
CHUK et la commission de recherche et information de la dite institution, pour
nous avoir autorisé d'accéder à des données
relatives à ce mémoire
Ma gratitude va également à la famille RWAMUHIZI
Fidèle et la famille KAGAME Straton pour leur contribution au bon
déroulement de mes études.
En fin, je suis reconnaissant envers mes amis et
collègues de classe pour les expériences partagées au
cours de notre formation.
NDAYAMBAJE Théogène
RESUME
Notre étude avait pour objectif global de contribuer
à l'évaluation du suivi des règles de bonne pratique de
prescription des médicaments dans les centres hospitaliers du Rwanda et
particulièrement l'adéquation des posologies
médicamenteuses dans le cas d'insuffisance rénale.
Pour atteindre cet objectif, nous avons effectué une
étude rétrospective et analytique sur un total de 111 patients
souffrant d'insuffisance rénale qui ont été
hospitalisés pendant une période allant du Janvier 2005 à
Décembre 2006 dans le service de médecine interne du CHUK. Nous
avons déterminé le degré d'insuffisance rénale de
chacun de ces patients après calcul de la clairance de
créatinine. Nous avons également relevé les
différentes pathologies associées à l'insuffisance
rénale et le profil de la polymédication appliquée
à ces patients. Enfin, nous avons fait une analyse
pharmacocinétique à l'aide des paramètres
pharmacocinétiques calculés selon les théories
préexistantes.
Les résultats ont montré que parmi les trois
degrés d'insuffisance rénale, la majorité des patients
(49.6%) étaient au stade terminal. Cette pathologie est fréquente
à l'âge moyen car 48.6% des patients avaient l'âge
situé entre 21 et 40 ans. Parmi les pathologies associées
à l'IR, l'HTA et les atteintes cardiaques fréquentes
respectivement à 33,3% et 31.5% arrivent au premier rang. Les
résultats de l'analyse pharmacocinétique de digoxine et de
gentamycine dégagent les équations modèles qui peuvent
être utilisés pour déterminer, chez un patient, la
posologie adéquate à son propre degré d'insuffisance
rénale. Cette analyse montre qu'un nombre important des patients a
été exposé à la toxicité
médicamenteuse à cause de l'inadéquation des posologies au
degré d'insuffisance rénale.
En conclusion, l'inadéquation des posologies chez les
insuffisants rénaux les expose à des concentrations supra
thérapeutiques. Les prescripteurs doivent tenir compte du degré
d'insuffisance rénale pour pouvoir réduire dans la mesure du
possible les cas de toxicité médicamenteuse dans cette population
particulière en ce qui concerne le médicament.
LISTE DES TABLEAUX
Table 1:Posologie des médicaments usuels en
cas d'insuffisance rénale
8
Table 2: Paramètres et formules pour la
digoxine
11
Table 3: Paramètres et formules pour la
gentamycine
11
Table 4: Répartition des patients
insuffisants rénaux selon l'âge et le sexe
12
Table 5: Degré d'insuffisance rénale
des patients
13
Table 6: Fréquence des pathologies
associées à l'insuffisance rénale
14
Table 7: Quelques médicaments
utilisés et leurs posologies
15
Table 8: Paramètres
pharmacocinétiques de gentamycine
26
Table 9: Paramètres
pharmacocinétiques de digoxine
27
LISTE DES FIGURES
Figure 1: Relation entre la créatinine
sérique (en mg/dl) et la clairance de créatinine (en ml/min)
17
Figure 2: Relation entre Cl (ml/min) selon
Cockcroft et Gault et valeurs modelées
18
Figure 3 : Relation entre Scr et Clcr sans
distinction de sexe
18
Figure 4: Relation entre Clcr (ml/min) selon
Cockcroft et Gault et valeurs modélées
19
Figure 5: Valeur de Cl de digoxine (en ml/min)
selon la formule 0.33Poids+0.9Clcr en utilisant Clcr calculée par la
relation de Cockcroft-Gault et celle obtenue par l'équation
modèle
19
Figure 6: Cp (ng/ml) obtenues avec Cl (Cockcroft et
Gault) et Cl (modelées)
20
Figure 7: Calcul de la dose ajustée à
la clairance du médicament
20
Figure 8: Calcul de la dose ajustée en
fonction de la Cl (x=0.25 mg digoxine/j)
21
Figure 9: Relation entre la dose (en mg) et
clairance de créatinine (en ml/min)
21
Figure 10: Relation entre dose administrée
(mg) et Cp (ng/ml) attendue
22
Figure 11: Relation entre clairance de
créatinine et la créatinine sérique
22
Figure 12: Relation entre Clcr (ml/min) selon
Cockcroft et Gault et valeurs modelées
23
Figure 13: Relation entre Cppeak et Cptrough
correspondante
23
Figure 14: Relation entre Clairance en L/H et Cp en
mg/l
24
Figure 15: Facteur multiplicatif de la dose usuelle
80 mg/12H en fonction de Cl (modelée) pour obtenir CP médian=6
mg/l
24
Figure 16: Relation entre dose (en mg) et Clairance
(en ml/min)
25
Figure 17: Relation entre dose (en mg) et
Créatinine sérique (en mg/dl)
25
SIGLES ET ABREVIATIONS
%: Pourcentage
CHF: Congestive Heart Failure
CHUK: Centre Hospitalier Universitaire de Kigali
Cl : clairance individuelle du médicament
Clcr: Clairance de Créatinine
Cp: concentration plasmatique efficace
Da : dose d'attaque
Dl: décilitre
Dm: Dose de maintien
F: facteur de biodisponibilité
HTA: Hypertension Artérielle
IR: Insuffisance Rénale
IRA: Insuffisance Rénale Aiguë
IRC: Insuffisance Rénale Chronique
Kg: Kilogramme
ng: nanogramme
Scr: Serum Creatinine
SD : standard deviation/ Ecart type
STP: Suivi Thérapeutique Pharmacologique
T : intervalle d'administration
Vd : Volume de distribution
TABLE DES MATIERES
DEDICACE
i
REMERCIEMENTS
ii
RESUME
iii
LISTE DES TABLEAUX
iv
LISTE DES FIGURES
v
SIGLES ET ABREVIATIONS
vi
TABLE DES MATIERES
vii
CHAPITRE I : INTRODUCTION
1
I.1. MOTIVATION
1
I.2. OBJECTIFS
2
I.3. HYPOTHESES
2
I.4. INTERET DU SUJET
2
CHAPITRE II: REVUE DE LA LITERATTURE
3
II.1. PHYSIOPATHOLOGIE DE L'INSUFFISANCE RENALE
3
II.1.1. Physiopathologie de l'insuffisance
rénale aiguë
3
II.1.1.1. Définition de l'IRA
3
II.1.1.2. Mécanismes physiopathologiques de
l'IRA
4
II.1.1.3 Types et étiologies des
insuffisances rénales aiguës
4
II.1.2. Physiopathologie de l'insuffisance
rénale chronique
4
II.1.2.1. Définition de l'IRC
4
II.1.2.2. Étiologie de l'insuffisance
rénale chronique
5
II.1.2.3. Manifestation extra rénale de
l'insuffisance rénale chronique
5
II.1.2.4. Degrés d'insuffisance
rénale
5
II.2. SUIVI THERAPEUTIQUE PHARMACOLOGIQUE (STP)
6
II.2.1. Définition et intérêt
du STP
6
II.2.2. Intervalle thérapeutique
6
II.2.3. Pharmacocinétique du
médicament chez l'insuffisant rénal
7
II.2.4. Adaptation posologique des
médicaments au cours de l'insuffisance rénale
7
CHAPITRE III: CADRE METHODOLOGIQUE
9
III.1. TYPE ET DUREE DE L'ETUDE
9
III.2. SITE DU TRAVAIL
9
III.3. OUTIL DE COLLECTE DES DONNEES
9
III.4. CRITERES D'INCLUSION ET D'EXCLUSION
9
III.5. TAILLE DE L'ECHANTILLON
10
III.6. DESCRIPTION DES METHODES UTILISEES
10
III.7. OUTIL DU TRAITEMENT DES DONNEES
11
CHAPITRE IV : RESULTATS ET DISCUSSION
12
IV.1. TYPOLOGIE DE L'INSUFFISANCE RENALE DES
PATIENTS
12
IV.2. PATHOLOGIES MULTIPLES ASSOCIEES A
L'INSUFFISANCE RENALE
14
IV.3. PROFIL DE LA POLYMEDICATION ADMINISTREE AUX
PATIENTS
15
IV.4. ANALYSE PHARMACOCINETIQUE DE QUELQUES
MEDICAMENTS
16
IV.4.1. Modélisation du calcul de clairance
de créatinine
16
IV.4.2. Analyse de l'adaptabilité de la
posologie de digoxine
18
IV.4.2.1 Modélisation du calcul de la
clairance de digoxine
18
IV.4.3. Analyse de l'adaptabilité de la
posologie de Gentamycine
22
IV.5. CONSEQUENCES DE L'INADEQUATION DES
POSOLOGIES
26
CONCLUSION ET RECOMMANDATIONS
29
1. CONCLUSION
29
2. RECOMMANDATIONS
29
REFERENCES
31
ANNEXES
33
CHAPITRE I :
INTRODUCTION
I.1. MOTIVATION
Parmi les changements physiologiques qui altèrent la
pharmacocinétique des médicaments, le plus important est la
réduction de la fonction rénale, cette dernière
étant impliquée dans l'excrétion d'une grande
quantité de médicaments et/ou de métabolites.
La détermination de la capacité fonctionnelle
des reins par mesure de la clairance de créatinine est alors importante
pour préserver l'insuffisant rénal contre des intoxications par
des médicaments qui sont éliminés par voie rénale
[1].
Le résultat de la diminution de la clairance de
créatinine est une prolongation de la demi-vie de beaucoup de
médicaments et la possibilité de leur accumulation dans le sang
jusqu'à des concentrations toxiques, si le dosage n'est pas
réduit en quantité ou en fréquence d'administration. Les
problèmes de sécurité augmentent quand le malade ayant une
insuffisance rénale doit être traité par un
médicament présentant une marge thérapeutique
étroite et qui est en grande quantité éliminé par
les reins [2].
Partant des doses habituelles, la correction peut être
faite pour obtenir les posologies adéquates chez les insuffisants
rénaux afin d'éviter les erreurs thérapeutiques
résultant de l'augmentation des concentrations plasmatiques des
médicaments.
L'insuffisance rénale étant l'une des causes
majeurs d'intoxications médicamenteuses, il y a intérêt de
mener des études pouvant apporter une contribution significative dans
l'amélioration des pratiques de prescription chez des patients
insuffisants rénaux.
C'est dans cet optique que nous avons ressenti la
nécessité d'entreprendre la présente étude qui
vise à analyser la pratique de prescription des médicaments telle
qu'elle est actuellement appliquée dans le service de médecine
interne du Centre Hospitalier Universitaire de Kigali (CHUK). La question
principale est de savoir de quelle manière les médecins du CHUK
adaptent la posologie chez l'insuffisant rénal afin d'en tirer des
conséquences éventuelles.
I.2. OBJECTIFS
L'objectif global de cette étude est d'évaluer
le suivi des règles de bonnes pratiques de prescription des
médicaments, particulièrement l'adéquation des posologies
médicamenteuses dans le cas d'insuffisance rénale. Cinq objectifs
spécifiques ont été fixés:
1. Décrire la typologie des patients souffrant de
l'insuffisance rénale;
2. Décrire les pathologies multiples, cause ou
conséquence de l'insuffisance rénale rendant souvent
inévitable la polymédication;
3. Identifier les médicaments utilisés dans
cette polymédication éventuelle;
4. Faire une analyse pharmacocinétique de quelques
médicaments;
5. Montrer les conséquences éventuelles
des posologies inadaptées.
I.3. HYPOTHESES
D'emblée, il est établi que le CHUK manque
d'équipement complet et présente une insuffisance en personnel
spécialisé dans le monitoring thérapeutique, ce qui rend
l'individualisation de la posologie pratiquement irréalisable. Chez des
insuffisants rénaux, les posologies mal adaptées entraînent
des conséquences néfastes, en particulier la toxicité des
médicaments utilisés.
I.4. INTERET DU SUJET
Les résultats de cette étude permettront de
proposer un système d'adaptation de la posologie médicamenteuse
au CHUK, ce qui pourra contribuer à l'amélioration des
traitements médicamenteux des patients souffrant de l'insuffisance
rénale.
CHAPITRE II: REVUE DE LA LITERATTURE
Pour réaliser cette étude nous avons
consulté différents ouvrages et publications à partir
desquels nous avons tiré quelques précisions
résumées dans les publications ayant un rapport direct avec le
domaine de l'étude.
Les informations utiles englobent des aspects ayant trait
à la physiopathologie de l'insuffisance rénale d'une part, et aux
principes de monitoring thérapeutique d'autre part.
II.1. PHYSIOPATHOLOGIE DE L'INSUFFISANCE RENALE
L'insuffisance rénale est une maladie silencieuse,
symptomatique seulement en phase terminale. Les causes de cette maladie sont
multiples, entre autre, l'hypertension, infections ainsi que des
médicaments [3].
Cette pathologie se manifeste le plus souvent chez les
personnes âgées. Il existe deux principaux types d'insuffisance
rénale (IR) à savoir l'insuffisance rénale aiguë
(IRA) et l'insuffisance rénale chronique (IRC) [1]. Ces deux types d'IR
sont évalués après l'estimation de la filtration
glomérulaire de l'individu [4].
II.1.1. Physiopathologie de l'insuffisance rénale
aiguë
II.1.1.1. Définition
de l'IRA
C'est une défaillance aiguë et brutale des
fonctions rénales, qui est caractérisée par une
montée brutale de l'urée ainsi qu'une chute brutale de la
filtration glomérulaire qui se traduit par l'effondrement de la
clairance de créatinine [5].
L'analyse des cas d'insuffisance rénale aiguë
où les étiologies sont multiples permet de distinguer les
lésions anatomiques et les facteurs physiopathologiques qui
entraînent l'oligo-anurie. Ces lésions anatomiques sont capables
d'entraîner l'anurie sans mettre en jeu des facteurs complexes [5].
II.1.1.2. Mécanismes
physiopathologiques de l'IRA
Selon Zech, les mécanismes possibles par lesquels peut
s'expliquer l'arrêt du débit urinaire au cours de l'insuffisance
rénale aiguë sont les suivants :
- Rétro diffusion de l'urine tubulaire c'est à
dire la réabsorption d'un filtrat glomérulaire au niveau du
tube lésé;
- Blocage tubulaire par la précipitation
intra-tubulaire du matériel insoluble ou par occlusion de la
lumière tubulaire par oedème cellulaire ;
- Augmentation de la pression interstitielle ;
- Arrêt de la filtration glomérulaire par chute
de la pression efficace de filtration.
II.1.1.3 Types et
étiologies des insuffisances rénales aiguës
On y distingue:
- Insuffisance rénale aiguë pré
rénale ou fonctionnelle : dans ce cas il existe un défaut de
perfusion rénale dépassant les capacités d'adaptation
vasculaires et endocriniennes
- Insuffisance rénale aiguë organique : elle
se caractérise par la nécrose tubulaire aiguë.
L'étiologie est une ischémie ou une néphrotoxicité
qui provoque une baisse profonde du débit sanguin rénal
contribuant à une résistance vasculaire ainsi que l'abolition du
débit de filtration glomérulaire [4].
- Insuffisance rénale aiguë
post-rénale : elle est due à un obstacle dont le plus
courant est une lithiase
II.1.2. Physiopathologie de l'insuffisance rénale
chronique
II.1.2.1. Définition
de l'IRC
L'IRC est une dégradation lente, progressive et
irréversible de la fonction rénale. On parle
généralement d'insuffisance rénale lorsque le débit
de filtration glomérulaire est inférieur à 60 ml/min [6].
C'est une altération progressive des fonctions excrétoires et
endocriniennes du parenchyme rénal, conséquence de lésions
anatomiques irréversibles [4].
II.1.2.2. Étiologie
de l'insuffisance rénale chronique
L'orientation étiologique de l'IRC revient à
énumérer tous les antécédents des maladies
rénales, cette pathologie étant en effet la voie finale commune
de la majorité d'entre elles [7].
L'hypertension, le diabète ainsi que les infections
bactériennes, le plus souvent urinaires, sont à l'origine d'un
grand nombre de cas de cette pathologie. Chez les sujets âgés, les
néphropathies vasculaires d'origines variées sont mises en
cause.
L'utilisation des médicaments chez les sujets
à risque nécessite un suivi régulier puisqu'ils peuvent
être à l'origine de l'insuffisance rénale. C'est le cas des
anti-inflammatoires non stéroïdiens et des inhibiteurs de l'enzyme
de conversion de l'angiotensine [3].
II.1.2.3. Manifestation
extra rénale de l'insuffisance rénale chronique
Les manifestations cardio-vasculaires (hypertension, arythmies
ventriculaires insuffisances cardiaques, ...), hématologiques (troubles
de l'hémostase, anémies), neurologiques centrales ou
périphériques (oedèmes cérébrales, troubles
de la conscience et accidents neuropsychiques en rapport avec une intoxication
médicamenteuse, ou polynévrite urémique), etc. sont
fréquentes en cas d'insuffisance rénale à des
degrés divers [5,8, 9].
II.1.2.4. Degrés
d'insuffisance rénale
Après évaluation de la filtration
glomérulaire, les degrés d'insuffisance rénale sont
déterminés comme suit [10]:
o Une insuffisance rénale est dite
modérée si la clairance est comprise entre 30 ml/min et 60
ml/min ;
o Une insuffisance rénale est dite sévère
quand la clairance de créatinine est comprise entre 30 ml/min et 15
ml/min ;
o Une insuffisance rénale est dite terminale, si la
clairance de créatinine est inférieure à 15 ml/min, un
degré qui justifie la préparation du malade aux méthodes
de remplacement de la fonction rénale.
II.2. SUIVI THERAPEUTIQUE PHARMACOLOGIQUE (STP)
II.2.1. Définition et intérêt du STP
Appelé aussi monitoring thérapeutique, c'est
une spécialité clinique pluridisciplinaire visant à
améliorer la prise en charge du patient en ajustant individuellement la
dose des médicaments pour lesquels le bénéfique clinique
du suivi thérapeutique a été démontrée dans
la population générale ou dans la population particulière.
Il intervient dans le traitement des sujets à risque et pour les
médicaments à intervalle thérapeutique étroit
[11].
C'est une aide précieuse pour ajustement posologique
dans les situations délicates. Elle se base à l'hypothèse
qu'il existe une relation entre la concentration sanguine et la réponse
d'un médicament qu'il s'agisse d'un effet thérapeutique ou des
manifestations toxiques [10]
Une posologie normale peut s'avérer inefficace pour
plusieurs raisons: mauvaise absorption digestive, accélération du
métabolisme, augmentation de l'élimination ou le non compliance
du malade. De même, cette posologie peut s'avérer trop
élevée en cas de diminution du métabolisme par
insuffisance hépatique ou interaction médicamenteuse, diminution
de l'élimination rénale, etc. [12].
II.2.2. Intervalle thérapeutique
C'est l'intervalle entre la concentration plasmatique minimale
du médicament qui produit un effet thérapeutique jusqu'à
une concentration plasmatique maximale qui ne produit pas d'effet toxique
[10].
Il intervient dans le traitement des sujets à risque
et pour les médicaments à intervalle thérapeutique
étroit, pour ne pas les exposer aux effets toxiques induits par des
concentrations plasmatiques supra thérapeutiques [11].
Les sujets à risque sont ceux pour lesquels la
posologie moyenne habituelle du médicament n'est pas adaptée pour
des raisons physiopathologiques, tandis que les médicaments à
marge thérapeutique étroite sont ceux dont la dose
thérapeutique et la dose toxique sont très proches [12].
II.2.3. Pharmacocinétique du médicament chez
l'insuffisant rénal
Le devenir du médicament est profondément
modifié par l'insuffisance rénale chronique dans ces
différentes étapes. Le risque principal est le défaut
d'excrétion avec accumulation dans l'organisme suivie des effets
toxiques [8].
L'absorption, le transit hépatique, le
métabolisme, la fixation aux protéines, la distribution, ainsi
que l'élimination des médicaments sont généralement
perturbées d'une façon ou d'une autre chez un insuffisant
rénal. De ce fait, un suivi thérapeutique régulier
s'avère nécessaire en cas d'utilisation des médicaments,
en particulier ceux qui sont exclusivement éliminés par voie
rénale [8 ; 9, 13 et 14].
II.2.4. Adaptation posologique des médicaments au cours
de l'insuffisance rénale
L'adaptation de posologie est l'objet de toute surveillance.
Toute modification d'une posologie établie, doit être la
conséquence d'un raisonnement basée sur les règles de la
pharmacocinétique [10]. Si chez un sujet donné, les dosages
montrent des concentrations élevées, s'il s'agit des
médicaments à intervalle thérapeutique étroit, on
pourra discuter une diminution de la posologie [15].
Lorsqu'un insuffisant rénal reçoit un
médicament qu'il n'élimine pas (ou dont il n'élimine pas
le métabolite pertinent) aussi bien qu'un non insuffisant rénal,
la demi-vie de ce médicament sera plus longue que d'habitude. Ceci
implique que l'équilibre des concentrations se fera plus lentement et si
on a prescrit les posologies habituelles, il se fera à un niveau de
concentration plus élevé. Il faudra donc adapter la posologie
soit en diminuant chaque prise, soit en conservant la dose unitaire, mais en
écartant les prises [15].
Quelques médicaments sont connus comme
nécessitant l'adaptation posologique chez les patients souffrant
d'insuffisance rénale ; d'autres sont administrés à
des posologies normales.
Table 1:Posologie des
médicaments usuels en cas d'insuffisance rénale
|
Médicaments
|
Posologie fortement diminuée
|
Posologie modérément
diminuée
|
Posologie non modifiée
|
|
Antibiotiques
|
Streptomycine
Kanamycine
Aminosides
Céphaloridine
Tétracyclines
Sulfamides
A.nalidixique
Amphotéricine B
|
Pénicilline G
Ampicilline
Céphalotine
Isoniazide
Ethambutol
S.Fluorocytosine
|
Doxycycline
Chloramphénicol
Erythromycine
Lincomycine
Rifampicine
|
|
Autres
Médicaments
|
Digitalines
Barbituriques
|
Ac.acétylsalicylique
Phénothiasines Méprobamate
Morphiniques
Méthyl-Dopa
Clonidine
Immuno-dépresseurs
|
Diazépam
Hydralazine
Réserpine
Propranolol
Héparine
Dicoumariniques
Prédnisone
Indométacine
|
Source : [4].
CHAPITRE III: CADRE METHODOLOGIQUE
Dans ce chapitre, nous précisons les techniques
utilisées pour rassembler et traiter les données obtenues en vue
d'atteindre les objectifs de cette étude.
III.1. TYPE ET DUREE DE L'ETUDE
Notre étude est de type rétrospectif et
analytique. Elle couvre les cas d'insuffisances rénales
confirmées dont les patients ont été hospitalisés
sur une période allant de Janvier 2005 à Décembre 2006.
III.2. SITE DU TRAVAIL
Cette étude a été réalisée
au sein du Centre Hospitalier Universitaire de Kigali (CHUK), dans le service
de médecine interne. L'accessibilité de l'emplacement de cet
hôpital considéré comme référence et la
présence d'agents qualifiés ont motivé le choix de ce
site.
III.3. OUTIL DE COLLECTE DES DONNEES
C'est sur base d'une fiche de collecte des données que ces
dernières on été recueillies. Cette fiche était
composée des éléments suivants :
- Identification du malade : No du dossier,
âge, sexe et poids ;
- Degré d'insuffisance rénale :
Créatinémie ;
- Pathologie(s) associée(s) à l'insuffisance
rénale ;
- Médicaments prescrits et leurs posologies.
Le remplissage de fiches de collecte des données a
été fait par nous-mêmes afin d'éviter la
récolte des données biaisées.
III.4. CRITERES D'INCLUSION ET D'EXCLUSION
Tout sujet hospitalisé soit pour la prise en charge de
son insuffisance rénale, soit pour traiter une (des) pathologie(s)
associée(s) à l'insuffisance rénale faisait partie de
cette étude.
On a exclu de cette étude, les sujets dont les fiches
manquaient la concentration de la créatinine, cette dernière
étant un élément nécessaire pour estimer le
degré d'insuffisance rénale.
III.5. TAILLE DE L'ECHANTILLON
Notre étude a été faite sur 111 patients
dont 57 d'entre eux, soit 51.4% étaient des femmes et 54, soit 48.6% des
hommes.
III.6. DESCRIPTION DES METHODES UTILISEES
Pour déterminer le degré d'insuffisance
rénale des patients, nous avons calculé la clairance de
créatinine de chacun, qui est un moyen plus sûr pour estimer la
filtration glomérulaire de chaque patient, en utilisant les formules
suivantes :
 pour les hommes pour les hommes
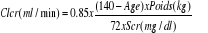 pour les femmes pour les femmes
Pour les patients dont le poids ne figurait pas dans la
fiche, nous avons pris 60kg comme poid standard pour les patients
âgées de plus de 20 ans et 50kg pour les patients
âgées de moins de 20 ans.
L'analyse pharmacocinétique a été faite
sur la digoxine et la gentamycine car ce sont ces médicaments dont
l'adaptation des posologies est particulièrement nécessaire en
cas d'insuffisance rénale [16]. En plus, ce sont eux dont tous les
éléments nécessaires dans les calculs des posologies
adaptées sont facilement disponibles.
Les paramètres et formules pharmacocinétiques
utilisés pour la modélisation sont présentés dans
les tableaux suivants :
Table 2: Paramètres
et formules pour la digoxine
|
Cp
|
1-2 mcg/L
|
Cp=(FxDm/T)/Cl
Da=VdxCp/F
Dm= ClxCpxT/F
|
|
F
|
0.7
|
|
Vd
|
7.3 L/kg
226+(298xClcr)/(29+Clcr) L/kg
(3.8 L/kg)x poids + 3.1xClcr L
|
|
Cl
|
57 ml/min + 1.02 Clcr
(0.8 ml/min/kg) x (poids) + Clcr
|
|
Cl CHF
|
(0.33 ml/min/kg)x(poids) + 0.9xClcr
|
Source : [17].
Table 3: Paramètres
et formules pour la gentamycine
|
Cp
|
4-8mg/L Peak
<2mg/L Trough
|
Cppeak (1hr)=((Dose/Vd)/(1-exp(-ke x T)))x exp(-ke x 1)
Cptrough(12hr)=((Dose/Vd)/(1-exp(-ke x T)))x exp(-ke x 12)
|
|
F
|
1
|
Dm=Cpss x(1-exp(-ke x T)/((tin/Clx(1-exp(-ke x tin)x exp(-ke x
t2)
|
|
Vd
|
0.25 L/kg
|
|
|
Cl modéré
|
0.0043 L/hr/kg
|
|
|
Cl severe
|
0.0021 L/hr/kg
|
|
|
Cl
|
= Clcr
|
Ke=Cl/Vd
|
Source : [17].
III.7. OUTIL DU TRAITEMENT DES DONNEES
La saisie et l'analyse des données, la configuration
des tableaux et figures ainsi que les calculs ont été faits dans
le logiciel EXCEL 2003. Le logiciel WORD 2003 nous a aidé au traitement
du texte et l'harmonisation des tableaux.
CHAPITRE IV : RESULTATS ET DISCUSSION
Dans ce chapitre, on donne les
résultats obtenus pour chaque objectif, suivis de commentaires
basés sur les études faites ailleurs ou les théories
préexistantes en rapports avec ces résultats. Les
résultats sont représentés sous forme des tableaux et des
figures.
IV.1. TYPOLOGIE DE L'INSUFFISANCE RENALE DES PATIENTS
Le tableau 4 montre la répartition des patients
insuffisants rénaux traités au CHUK, en fonction
de l'âge et du sexe. Les résultats de ce tableau montrent que
l'insuffisance rénale chez les sujets moins âgés (=20ans)
survient à un faible pourcentage (6.3%). Dans ce pourcentage, on y
trouve 3.6% des femmes et 2.7% des hommes. La prévalence de cette
maladie s'accentue à l'âge moyen (21-40 ans) car elle
s'élève à 48.6% dont 28.8% sont les femmes et 19.8% sont
les hommes. Dans la tranche d'âge (41-60 ans), cette maladie survient
à 32.4% dont 11.7% sont les femmes et 20.7% sont les hommes. A
l'âge avancé (>60 ans), elle survient à 12.6% dont 7.2%
sont les femmes et 5.4% sont les hommes.
Table 4:
Répartition des patients insuffisants rénaux selon l'âge et
le sexe
|
Genre
|
Féminin
|
Masculin
|
Total
|
|
Age
|
N
|
%
|
N
|
%
|
N
|
%
|
|
=20 ans
|
4
|
3.6
|
3
|
2.7
|
7
|
6.3
|
|
21-40 ans
|
32
|
28.8
|
22
|
19.8
|
54
|
48.6
|
|
41-60 ans
|
13
|
11.7
|
23
|
20.7
|
36
|
32.4
|
|
>60 ans
|
8
|
7.2
|
6
|
5.4
|
14
|
12.6
|
|
Total
|
57
|
51.4
|
54
|
48.6
|
111
|
100
|
Une étude réalisée dans l'hôpital
Européen George Pompidou de Paris dans le service de néphrologie
montre que l'insuffisance rénale est une maladie des personnes les plus
âgées. Elle conclit que l'insuffisance rénale est 5 fois
plus fréquente chez les sujets âgés que chez les sujets
d'âge moyen [18] ; Ce qui n'est pas le cas pour notre étude.
En effet, notre étude montre que l'insuffisance rénale
apparaît plus tôt dans notre population. En considérant les
étiologies connues de cette maladie, entre autre l'HTA, très
fréquente dans la population d'étude, et l'incidence
élevée des maladies dans notre pays contribueraient à
l'apparition précoce de cette maladie [3].
La répartition des patients selon le degré de
l'insuffisance rénale est présentée dans le tableau 5. Les
données de ce tableau montrent que la majorité des patients de la
population d'étude, soit 49.6%, étaient au stade avancé
dit terminal, puis 29.7% avec une insuffisance rénale
sévère et en fin 20.7% avec une insuffisance rénale
modérée.
Table 5: Degré
d'insuffisance rénale des patients
|
Distribution des patients par catégorie en fonction de
Clcr (ml/min)
|
|
Stade Terminal
|
Stade Sévère
|
Stade Modéré
|
|
Clcr (ml/min)
Moyenne
|
8.1
|
22.1
|
36.4
|
|
SD
|
3.2
|
4.1
|
6.2
|
|
N
|
55
|
33
|
23
|
|
(%)
|
49.6
|
29.7
|
20.7
|
Terminale (Clcr <15 ml/min); Sévère
(15=Clcr=30ml/min) ; Moyen >30ml/min Clcr=60ml/min)
Une étude faite au Centre Hospitalier de Saint Denis en
France montre que sur 59 patients, 13 soit 22% seulement avaient une
insuffisance rénale sévère et 46 soit 78%, une
insuffisance rénale modérée [19]
.
Une autre étude rétrospective a
été menée dans deux unités de médecine
gériatrique de l'hôpital du Sud Fribourgeois de novembre 2005
à février 2006. Sur 151 patients, 57% d'entre eux
présentaient une insuffisance rénale diagnostiquée. La
majorité présentait une IR modérée car leur
clairance de créatinine variait entre 30-60 ml/min. La même
étude montre qu'un grand nombre d'insuffisance rénale
modéré se révèle non diagnostiqué [6].
Ces deux études simulaires qui ont été
faites ailleurs contredisent les résultats de notre étude car
elles montrent que les insuffisances rénales modérées
prédominent sur les insuffisances rénales sévères.
La détection précoce de l'insuffisance
rénale et une bonne prise en charge de cette pathologie peuvent
réduire les cas d'insuffisance rénale sévère
à 10% [20]. Donc, la survenue de l'insuffisance rénale au stade
terminal à un pourcentage élevé serait due au retard
à la détection de cette pathologie.
IV.2. PATHOLOGIES MULTIPLES ASSOCIEES A L'INSUFFISANCE
RENALE
Dans notre population de l'étude, la moyenne des
pathologies associées à l'insuffisance rénale est de 2.4
pour un patient. Le tableau 6 montre le type et la fréquence d'autres
pathologies associées décrits dans le tableau clinique des
patients étudiés. Ce tableau montre que l'hypertension
artérielle (HTA) est fréquente à 33.3%, les atteintes
cardiaques à 31.5% et les atteintes néphroniques à 27%.
Les atteintes hépatiques, les infections, le diabète et autres
sont respectivement fréquents à 12.6%, 12.6, 4.5% et 24.3%.
Table 6: Fréquence
des pathologies associées à l'insuffisance
rénale
|
Pathologies associées
|
Total
|
Degré d'insuffisance
rénale
|
|
Modéré
|
Sévère
|
Terminale
|
|
Femme
|
Homme
|
Femme
|
Homme
|
Femmes
|
Hommes
|
|
N
|
%
|
N
|
%
|
N
|
%
|
N
|
%
|
N
|
%
|
N
|
%
|
N
|
%
|
|
Hypertension arterielle
|
37
|
33.3
|
7
|
6.3
|
6
|
5.4
|
4
|
3.6
|
3
|
2.7
|
9
|
8.1
|
8
|
7.2
|
|
Atteintes cardiaques
|
35
|
31.5
|
5
|
4.5
|
3
|
2.7
|
6
|
5.4
|
2
|
1.8
|
14
|
12.6
|
5
|
4.5
|
|
Atteintes néphroniques
|
24
|
27.0
|
4
|
3.6
|
2
|
1.8
|
3
|
2.7
|
3
|
2.7
|
5
|
4.5
|
7
|
6.3
|
|
Atteintes hépatiques
|
14
|
12.6
|
2
|
1.8
|
1
|
0.9
|
3
|
2.7
|
1
|
0.9
|
3
|
2.7
|
4
|
3.6
|
|
Infections
|
14
|
12.6
|
1
|
0.9
|
0
|
0
|
1
|
0.9
|
2
|
1.8
|
7
|
6.3
|
3
|
2.7
|
|
Diabète
|
5
|
4.5
|
0
|
0
|
1
|
0.9
|
2
|
1.8
|
1
|
0.9
|
0
|
0
|
1
|
0.9
|
|
Autres
|
27
|
24.3
|
0
|
0
|
4
|
3.6
|
8
|
11.7
|
3
|
2.7
|
5
|
4.5
|
7
|
6.3
|
L'HTA occupe la première place parmi les manifestations
cardiovasculaires de l'insuffisance rénale chronique. C'est une
pathologie qui doit être maîtrisée, car elle conditionne la
survenue des accidents circulatoires, cardiaques et cérébraux qui
constituent la principale cause de mort au cours de cette néphropathie
[21].
C'est donc un syndrome très fréquent au cours de
l'insuffisance rénale qui est interprété comme la
conséquence de la réduction néphronique progressive
[4] ; et ceci justifie la prédominance de l'HTA à 33.3% chez
les patients présentant une insuffisance rénale.
L'insuffisance ventriculaire gauche constitue une menace
permanente au cours de l'insuffisance rénale chronique, surtout s'il
existe une hypertension artérielle. La péricardite est aussi une
complication de l'insuffisance rénale chronique dans la moitié
des cas avant l'institution de la dialyse, dont elle impose la mise en route
[21]. Ceci justifie cette fréquence élevée des
manifestations cardiaques au cours de l'insuffisance rénale à
31.5%.
IV.3. PROFIL DE LA POLYMEDICATION ADMINISTREE AUX PATIENTS
Compte tenu de la fréquence de multiples pathologies
associées à l'insuffisance rénale, on a prescrit beaucoup
de médicaments chez ces patients de tel point que la moyenne de
médicaments prescrits par patient était de 5.8 pendant la
période de son hospitalisation. Parmi ces médicaments, il y en a
ceux qui sont connus pour avoir nécessité une adaptation de
posologie en cas d'insuffisance rénale. Le tableau suivant montre
quelques médicaments qui ont pris part dans les différentes
prescriptions et les posologies pour lesquelles ils ont été
utilisés.
Table 7: Quelques
médicaments utilisés et leurs posologies
|
Nom du médicament
|
Posologie utilisée
|
Nombre de patients traités par ce médicament
|
% sur le nombre total des patients traités par ce
médicament
|
|
Digoxine
|
0.25 mg/jour
|
31
|
88.5
|
|
0.125 mg/jour
|
4
|
11.5
|
|
Phénobarbital
|
20 mg/jour
|
4
|
100
|
|
Captopril
|
25 mg deux fois par jour
|
13
|
52
|
|
25 mg trois fois par jour
|
7
|
28
|
|
12.5 mg deux fois par jour
|
5
|
20
|
|
Gentamycine
|
80 mg/12 heures
|
8
|
100
|
|
Ampicilline
|
1gr trois fois par jour
|
25
|
100
|
|
Amoxicilline
|
500 mg trois fois par jour
|
11
|
100
|
|
Cotrimoxazole
|
960 mg/jour
|
12
|
100
|
Dans une étude rétrospective menée dans
deux unités de médecine gériatrique de l'hôpital du
Sud Fribourgeois, une adaptation de la médication a été
bonne puisque environ 75% des médications qui nécessitaient une
adaptation ont été administrés aux posologies
recommandées. Toutefois, la prescription pouvait être
améliorée puisqu'en moyenne 44% des patients en insuffisance
rénale chronique recevaient une médication non adaptée
à leur degré d'insuffisance rénale à cause d'un
retard à la confirmation du diagnostic [6].
Une autre étude mené au centre hospitalier de
Toulouse en France a montré que parmi les 25 patients présentant
une insuffisance rénale connue, 23 patients (92%) avaient une
prescription comportant au moins un médicament connu pour
nécessiter une adaptation posologique. Néanmoins, sur 21
médicaments nécessitant une adaptation, 11 d'entre eux n'ont pas
été adaptés, ce qui a exposé les patients à
un risque de surdosage et d'événements iatrogènes
potentiellement graves [22].
Dans notre étude, on a réduit la posologie de
digoxine chez 4 patients et ces patients avaient tous une insuffisance
rénale terminale. Cependant, il y a beaucoup d'autres patients qui
avaient le même degré d'insuffisance rénale mais dont on a
prescrit la posologie non réduite. Il en est de même pour le
Captopril où on a adapté la posologie chez les uns et non chez
les autres alors qu'ils avaient un degré d'insuffisance rénale
critique. Tous les autres médicaments ont été
administrés à des posologies habituelles sans tenir compte de
l'insuffisance rénale.
L'adaptation des posologies ne se fait donc pas en
général et quand on essaye de le faire, on ne tient pas compte du
degré d'insuffisance rénale.
IV.4. ANALYSE PHARMACOCINETIQUE DE QUELQUES MEDICAMENTS
IV.4.1. Modélisation du calcul de clairance de
créatinine
La figure 1 montre la relation mathématique entre la
créatinémie dosée et la clairance de créatinine
calculée selon Cockcroft et Gault. Cette relation obéit à
la loi de puissance selon l'équation Clcr=65.926Scr-0.9724
pour la population féminine et Clcr=
84.658Scr-0.0317 pour la population mâle.


Figure 1: Relation entre
la créatinine sérique (en mg/dl) et la clairance de
créatinine (en ml/min)
La figure 2 montre la correspondance entre la valeur de Clcr
obtenue par la relation de Cockcroft et Gault et la valeur correspondante
obtenue en utilisant les équations modèles chez la femme et chez
l'homme.


Figure 2: Relation entre
Cl (ml/min) selon Cockcroft et Gault et valeurs modelées
IV.4.2. Analyse de l'adaptabilité de la posologie de
digoxine
IV.4.2.1
Modélisation du calcul de la clairance de digoxine
La figure 3 montre la tentative de modélisation de la
relation entre Clcr et Scr dans toute la population de 35 patients.
L'équation de la relation de puissance est donnée par
Clcr=63.412Scr-0.9469 quelque soit le sexe.

Figure 3 : Relation
entre Scr et Clcr sans distinction de sexe
La figure 4 montre la correspondance entre la valeur de Clcr
obtenue par la relation de Cockcroft et Gault et la valeur correspondante
obtenue en utilisant l'équation du modèle ci-dessus chez 35
patients traités par la digoxine sans distinction de sexe.
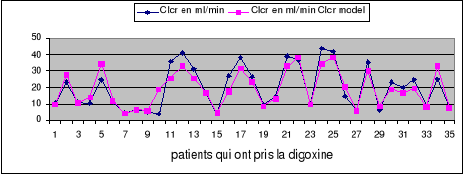
Figure 4: Relation entre
Clcr (ml/min) selon Cockcroft et Gault et valeurs modélées
La figure 5 montre la correspondance entre la valeur de
clairance de digoxine (Cl en ml/min), obtenue par la formule
CL=0.33Poids+0.9Clcr en utilisant Clcr
calculée par la relation de Cockcroft et Gault et Clcr obtenue en
utilisant l'équation du modèle ci-dessus chez 35 patients
digitalisés sans distinction de sexe.

Figure 5: Valeur de Cl de
digoxine (en ml/min) selon la formule 0.33Poids+0.9Clcr en utilisant Clcr
calculée par la relation de Cockcroft-Gault et celle obtenue par
l'équation modèle
La concentration plasmatique de digoxine attendue après
administration d'une dose quotidienne a été calculée par
la formule Cp= (FxDm/T)/Cl.
La figure 6 montre la concentration plasmatique attendue chez
35 patients digitalisés en utilisant la valeur de Cl calculée par
la relation Cl=0.33Poids+0.9Clcr en utilisant
Clcr calculée par la relation de Cockcroft et Gault et Clcr
obtenue en utilisant l'équation du modèle chez 35 patients
digitalisés sans distinction de sexe.
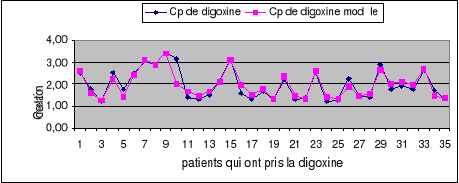
Figure 6: Cp (ng/ml)
obtenues avec Cl (Cockcroft et Gault) et Cl (modelées)
Cette figure montre qu'à la posologie utilisée
à ces patients, la concentration plasmatique attendue varie de 1.23
ng/ml à 3.41ng/ml en fonction du degré individuel de
l'insuffisance rénale.
La figure 7 montre une relation linéarisée entre
la Cl de digoxine et la dose de maintien ajustée au niveau du
fonctionnement rénale. Il montre qu'à une clairance de 59.2
ml/min, la dose peut être ajustée à 0.30mg/j
tandisqu'à une clairance de 21.36 ml/min, on devrait administrer
0.11mg/j.

Figure 7: Calcul de la
dose ajustée à la clairance du médicament
La figure 8 montre une relation linéarisée entre
la dose de digoxine et la clairance de digoxine obtenue par
modélisation. Chez des patients dont la Cl est supérieure
à 42.89 ml/min, la dose peut être supérieure à 0.25
mg/j sans dépasser 0.30 mg/j.
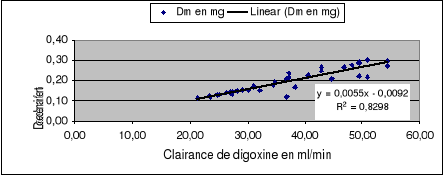
Figure 8: Calcul de la
dose ajustée en fonction de la Cl (x=0.25 mg digoxine/j)
La figure 9 montre une relation linéarisée entre
la dose de digoxine et la clairance de créatinine obtenue par
modélisation. Chez des patients dont la Clcr est supérieure
à 31.2 ml/min, la dose peut être supérieure à 0.25
mg/j sans dépasser 0.30mg/j.

Figure 9: Relation entre
la dose (en mg) et la clairance de créatinine (en ml/min)
La figure 10 montre qu'en donnant à chaque patient la
dose ajustée en fonction de sa Clcr, la concentration plasmatique
attendue reste dans la zone thérapeutique entre 1.50 et 1.61 ng/ml.

Figure 10: Relation entre
dose administrée (mg) et Cp (ng/ml) attendue
IV.4.3. Analyse de l'adaptabilité de la posologie de
Gentamycine
La figure 11 montre la tentative de modélisation de la
relation entre Clcr et Scr dans la population de 8 patients traités par
la gentamycine. L'équation de la relation de puissance est donnée
par Clcr=56.1362Scr-0.8721 sans distinction de sexe.

Figure 11: Relation entre
clairance de créatinine et la créatinine
sérique
La figure 12 montre la correspondance entre la valeur de Clcr
obtenue par la relation de Cockcroft et Gault et la valeur correspondante
obtenue en utilisant l'équation du modèle correspondante chez les
patients sous la gentamycine sans distinction de sexe.
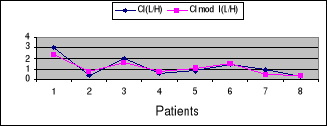
Figure 12: Relation entre
Clcr (ml/min) selon Cockcroft et Gault et valeurs modelées
La figure 13 montre la relation entre la concentration
plasmatique maximale attendue (Cppeak) et la concentration plasmatique minimale
correspondante (Cptrough) après administration d'une dose quotidienne
de 80 mg toutes les 12 heures.
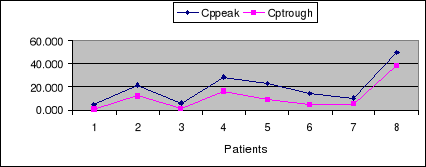
Figure 13: Relation entre
Cppeak et Cptrough correspondante
La figure 14 montre la relation obtenue entre la valeur de
Clcr modèle et les concentrations plasmatiques (maximale et minimale) de
gentamycine attendues après une administration de 80 mg/12 heures. La
relation est de type puissance négative avec comme équation
Cp'(ng/ml)=13.933xClcr(L/H)-0.86 pour la concentration maximale et
Cp'(ng/ml)=2.83xClcr(L/H)-0.91 pour la concentration
minimale.
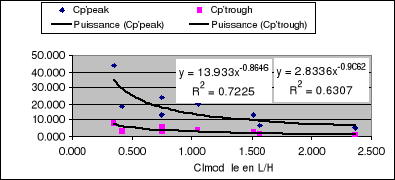
Figure 14: Relation entre
Clairance en L/H et Cp en mg/l
Pour ajuster la dose chez chaque patient, en fonction de sa
valeur de Cl de gentamycine, il faut modifier la dose d'un certain facteur pour
rester dans la zone thérapeutique de 4-8 mg/l.
La figure 15 montre une relation
linéarisée entre la Cl de gentamycine et le facteur de correction
pour la posologie usuelle de 80 mg/12h.

Figure 15: Facteur
multiplicatif de la dose usuelle 80 mg/12H en fonction de Cl (modelée)
pour obtenir CP médian=6 mg/l
La figure 16 montre la relation entre la clairance de
gentamycine obtenue en utilisant l'équation modèle et la dose
à laquelle il fallait prescrire en considérant le degré
individuel d'insuffisance rénale
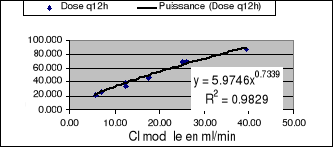
Figure 16: Relation entre
dose (en mg) et Clairance (en ml/min)
La figure 17 montre la relation entre la dose ajustée
en fonction du degré individuel de chaque patient et sa
créatinine sérique
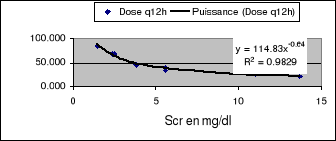
Figure 17: Relation entre
dose (en mg) et Créatinine sérique (en mg/dl)
Grâce à la mesure du taux de médicament
dans l'organisme (essentiellement dans le sérum), il est possible
d'étudier la distribution de ce médicament et de définir
des modèles mathématiques pour essayer d'ajuster au plus juste la
prescription et éviter ainsi un surdosage et une toxicité accrue
[23].
Les résultats de l'analyse pharmacocinétique de
digoxine et de gentamycine relèvent des différentes
équations mathématiques pouvant être utilisées pour
déterminer les doses à administrer chez un patient
présentant n'importe quelle clairance de créatinine. On a
commencé par la modélisation du calcul de créatinine car,
à l'hôpital, on ne fait que la mesure de la créatinine
sérique. Les résultats de cette analyse, nous ont permis de
connaître la concentration plasmatique attendue, ce qui a
facilité de savoir si les patients traités par ces
médicaments ont été longtemps exposés à des
concentrations thérapeutiques ou supra thérapeutiques.
IV.5. CONSEQUENCES DE L'INADEQUATION DES POSOLOGIES
La détermination des paramètres
pharmacocinétiques en particulier la concentration plasmatique attendue
montre que l'inadéquation des posologies expose les patients à la
toxicité des médicaments comme le montre les tableaux
ci-dessous
Table 8: Paramètres
pharmacocinétiques de gentamycine
|
Age
|
Sexe
|
DM en mg/12H
|
Scr en mg/dl
|
Clcr en ml/min
|
Poids en kg
|
Vd (L)
|
Cl (L/H)
|
Ke (H1)
|
Cppeak
|
Cptrough
|
|
71
|
M
|
80
|
1.5
|
50.5
|
60
|
15
|
3.03
|
0.202
|
4.781
|
0.518
|
|
27
|
M
|
80
|
5.6
|
6.6
|
30
|
7.5
|
0.396
|
0.053
|
21.559
|
12.061
|
|
31
|
F
|
80
|
2.4
|
33
|
60
|
15
|
1.98
|
0.132
|
5.880
|
1.377
|
|
54
|
M
|
160
|
5.6
|
10
|
45
|
11.25
|
0.6
|
0.053
|
28.524
|
15.865
|
|
32
|
F
|
160
|
3.8
|
14.4
|
39
|
9.75
|
0.864
|
0.089
|
22.939
|
8.654
|
|
27
|
F
|
160
|
2.5
|
23.8
|
60
|
15
|
1.428
|
0.095
|
14.242
|
4.998
|
|
43
|
F
|
80
|
11
|
15
|
60
|
15
|
0.9
|
0.060
|
9.786
|
5.058
|
|
40
|
M
|
160
|
13.7
|
5
|
53
|
13.25
|
0.3
|
0.023
|
49.619
|
38.680
|
Lorsque la filtration glomérulaire diminue environ de
moitié, la demi-vie de la gentamycine augmente d'autant plus que la part
de ce médicament éliminé sous forme active par le rein est
plus élevée [14]. Or, cet antibiotique est éliminé
inchangé à 90 % dans les urines [24]. De ce fait,
l'administration de ce produit chez des patients à une même
posologie devrait exposer pas mal de gens. Ceci est conforme aux
résultats du tableau 8 qui montrent que 6 patients soit 75% ont
été exposés à des concentrations supra
thérapeutiques (>8mg/L).
Table 9: Paramètres
pharmacocinétiques de digoxine
|
Age en ans
|
Sexe
|
Poids en kg
|
Scr en mg/dl
|
Clcr en ml/min
|
Cl de digoxine
|
Cp de digoxine
|
CP'(ng/ml)
|
DM en mg
|
DM' en mg
|
|
44
|
F
|
60
|
7.5
|
10.6
|
29.34
|
2.49
|
1.55
|
0.25
|
0.15
|
|
73
|
M
|
60
|
2.4
|
23.1
|
40.59
|
1.80
|
1.56
|
0.25
|
0.24
|
|
35
|
F
|
60
|
6.8
|
11
|
29.70
|
1.23
|
1.50
|
0.125
|
0.15
|
|
60
|
F
|
60
|
5
|
10.2
|
28.98
|
2.52
|
1.53
|
0.25
|
0.17
|
|
76
|
F
|
60
|
1.9
|
24.3
|
41.67
|
1.75
|
1.55
|
0.25
|
0.27
|
|
50
|
F
|
60
|
6
|
10.7
|
29.43
|
2.48
|
1.54
|
0.25
|
0.16
|
|
22
|
F
|
60
|
18.9
|
4.4
|
23.76
|
3.07
|
1.50
|
0.25
|
0.12
|
|
68
|
M
|
60
|
12
|
6
|
25.20
|
2.89
|
1.50
|
0.25
|
0.13
|
|
18
|
F
|
50
|
13.4
|
5.4
|
21.36
|
3.41
|
1.55
|
0.25
|
0.11
|
|
50
|
F
|
60
|
3.6
|
3.6
|
23.04
|
3.16
|
1.58
|
0.25
|
0.20
|
|
27
|
M
|
60
|
2.6
|
35.7
|
51.93
|
1.40
|
1.56
|
0.25
|
0.23
|
|
25
|
F
|
60
|
2
|
41.1
|
56.79
|
1.28
|
1.53
|
0.25
|
0.26
|
|
24
|
F
|
60
|
2.6
|
31.2
|
47.88
|
1.52
|
1.56
|
0.25
|
0.23
|
|
34
|
F
|
60
|
4.2
|
16.4
|
34.56
|
2.11
|
1.52
|
0.25
|
0.18
|
|
38
|
F
|
60
|
18
|
4
|
23.40
|
3.12
|
1.61
|
0.25
|
0.13
|
|
23
|
M
|
65
|
3.9
|
27.1
|
45.84
|
1.59
|
1.57
|
0.25
|
0.20
|
|
27
|
F
|
60
|
2.1
|
38.1
|
54.09
|
1.35
|
1.58
|
0.25
|
0.26
|
|
47
|
M
|
60
|
2.9
|
26.6
|
43.74
|
1.67
|
1.58
|
0.25
|
0.22
|
|
27
|
F
|
60
|
8.5
|
9.4
|
28.26
|
1.29
|
1.60
|
0.125
|
0.15
|
|
25
|
F
|
60
|
5.5
|
14.8
|
33.12
|
2.20
|
1.59
|
0.25
|
0.17
|
|
27
|
F
|
60
|
2
|
39.3
|
55.17
|
1.32
|
1.53
|
0.25
|
0.26
|
|
52
|
F
|
60
|
1.7
|
36.7
|
52.83
|
1.38
|
1.57
|
0.25
|
0.29
|
|
35
|
F
|
60
|
7.5
|
9.9
|
28.71
|
2.54
|
1.55
|
0.25
|
0.15
|
|
24
|
F
|
60
|
1.9
|
43.8
|
59.22
|
1.23
|
1.55
|
0.25
|
0.27
|
|
56
|
M
|
60
|
1.7
|
41.8
|
57.42
|
1.27
|
1.56
|
0.25
|
0.29
|
|
75
|
F
|
60
|
3.3
|
14
|
32.40
|
2.25
|
1.53
|
0.25
|
0.20
|
|
47
|
M
|
60
|
13.4
|
5.8
|
25.02
|
1.46
|
1.54
|
0.125
|
0.13
|
|
31
|
F
|
60
|
2.2
|
35.5
|
51.75
|
1.41
|
1.56
|
0.25
|
0.25
|
|
65
|
F
|
60
|
8.6
|
6.2
|
25.38
|
2.87
|
1.61
|
0.25
|
0.15
|
|
23
|
F
|
60
|
3.6
|
23.1
|
40.59
|
1.80
|
1.59
|
0.25
|
0.20
|
|
25
|
F
|
60
|
4.1
|
19.9
|
37.71
|
1.93
|
1.60
|
0.25
|
0.19
|
|
20
|
F
|
60
|
3.5
|
24.3
|
41.67
|
1.75
|
1.57
|
0.25
|
0.20
|
|
49
|
M
|
60
|
8.9
|
8.5
|
27.45
|
2.66
|
1.51
|
0.25
|
0.14
|
|
34
|
F
|
60
|
2
|
25
|
42.30
|
1.72
|
1.53
|
0.25
|
0.26
|
|
50
|
M
|
60
|
9.7
|
7.7
|
26.73
|
1.36
|
1.54
|
0.125
|
0.14
|
La digoxine fait partie de l'arsenal thérapeutique de
la fibrillation auriculaire avec réponse ventriculaire rapide, de la
tachycardie supra ventriculaire et de l'insuffisance cardiaque congestive.
Malgré la grande familiarité avec cette molécule, son
utilisation demande toujours une attention particulière car elle
possède un intervalle thérapeutique étroit (1-2 ng/ml)
[25].
Les résultats du tableau 9 montrent que 14 patients
soit 40% ont été exposés à des concentrations supra
thérapeutiques de digoxine (>2ng/ml).
CONCLUSION ET
RECOMMANDATIONS
1. CONCLUSION
Notre étude avait pour objectif global de contribuer
à l'évaluation du suivi des règles de bonnes pratiques de
prescriptions des médicaments et particulièrement
l'adéquation des posologies médicamenteuses dans le cas
d'insuffisance rénale.
D'après les résultats obtenus nous pouvons tirer
des conclusions suivantes :
· La typologie de notre population d'étude montre
que l'insuffisance rénale est une maladie plus fréquente à
l'âge moyen. L'incidence des maladies dans les pays en voie de
développement serait à l'origine de cette maladie. Beaucoup de
patients ont une insuffisance rénale avancée ce qui impose une
adaptation des posologies d'un grand nombre de médicaments ;
· L'HTA, les différentes maladies cardiaques, les
différentes maladies néphroniques, atteintes hépatiques et
infection sont les pathologies rendant inévitable la
polymédication en cas d'insuffisance rénale. Les autres
pathologies apparaissent comme chez les autres populations ayant la fonction
rénale normale ;
· Les médicaments qui font partie de la
polymédication en cas d'insuffisance rénale sont ceux
utilisés dans le traitement des pathologies plus fréquentes chez
les patients présentant la dite néphropathie, entre autre, les
antihypertenseurs, les digitaliques, les diurétiques les antibiotiques
et autres ;
· Les prescripteurs du CHUK ne tiennent pas compte du
degré d'insuffisance rénale. Les posologies n'étant pas
adaptées, beaucoup de patients ont été exposés
à des concentrations toxiques des médicaments qui leur ont
été prescrits.
2. RECOMMANDATIONS
Dans le cadre d'améliorer la prise en charge des
insuffisances rénales, nous formulons les recommandations suivantes:
a) Aux médecins prescripteurs
Ø De prescrire les médicaments connus pour ne
pas être toxiques en cas d'insuffisance rénale et, au cas
où il s'avère nécessaire, adapter la posologie au
degré d'insuffisance rénale de chaque patient.
b) Au pharmaciens cliniciens des
hôpitaux
Ø Collaborer étroitement avec les prescripteurs
dans la fixation des doses en particulier chez les insuffisants
rénaux.
c) Au ministère de la santé
Ø Renforcer les services de pharmacie clinique des
hôpitaux de référence;
Ø Etablir les schémas posologiques de quelques
médicaments, pour les différents degrés d'insuffisance
rénale, guidant les prescripteurs.
d) Au chercheurs
Ø Mener d'autres études permettant
l'amélioration de la prise en charge des insuffisances rénales,
particulièrement, en ce qui concerne l'adéquation posologiques
des médicaments.
REFERENCES
1. BERTRAM, G., KATZUNG (1987). Basic and Clinical
Pharmacology, 4th ed. Norwalk: Appleton:and Lange: 29-30,
36-50
2. LAURENCE, L. et BENNETT, J. (1980). Clinical
Pharmacology, 5th ed. Edinbourgh : Churchill Livington:
132-137
3. Insuffisance rénale dans les pays en
développement Disponible sur
www.ifmt.auf.org/IMG/pdf/IFMT_MB3_Insuffisance_renale.pdf
consulté le 20/11/2006
4. LEGRAIN, M., SUC, J.M., DURAND, D., LEBON, P., JACOBS, Cl.,
TONTHAT, H. (1985). Néphrologie, 3ème
edition. Paris:Masson:84,282-319,384-388
5. ZECH, P., et REVILLARD, J.P. (1978). Néphrologie
Clinique, Cimep édition : Villeurbanne : 132-184
6. C. VOILAT (2006). Résumé du travail de
diplôme de masters en pharmacie. Disponible sur
http://files.chuv.ch/internet-docs/pha/recherche/pha_abstract_mastervoillat.pdf
consulté le 25/7/2007
7. A.CASTAIGNE et al., (1992). Sémiologie
médicale ; initiation à la physiopathologie Rueli
Malmaison : Laboratoire Sandoz : 110-135
8. RICHET, G. (1988). Néphrologie. Paris:
Ellipses:99-299
9. GIROUD, J.P., MATHE, G., MEYNEL, G. (1988).
Pharmacologie Clinique. Base de la Thérapeutique,
2ème édition. Paris : 56,66-75, 583-611
10. LEGRAIN (1988). Néphrologie clinique.
Paris : Masson : 79-100
11. A. PREMAUD (2004). Suivi thérapeutique
pharmacologique. Disponible sur
http://www.unilim.fr/theses/2004/sante/2004limo0100c/premaud_a.pdf
consulté le 22/5/207
12. SADO, P.A (1990). Pharmacie clinique
générale, Rennes : Mc Graw-hill : 173-209
13. T. HANNEDOUCHE (2000). Adaptation posologique des
médicaments. Disponible sur
http://www.nephrohus.org/s/spip.php?article19#sommaire_2
consulté le 22/5/2007
14. C.LOICHOT et M.GRIMA (2004). Médicaments et
pathologies- insuffisance rénale et insuffisance hépatique.
Disponible sur
http://www-ulpmed.u-strasbg.fr/medecine/cours_en_ligne/e_cours/pharmaco/pdf/DCEM1_Pharmacologie_chapitre_10_Médicaments_et_pathologies_septembre_2005.pdf
consulté le 27/7/2007
15. Ph. LECHAT (2006). Prescription dans les populations
particulières. Disponible sur
http://134.157.193.4/polys/pharmaco/poly/Pharmaco.pdf
consulté le 22/5/2007
16. L.DETTLI (1996). Base de la thérapeutique
médicamenteuse 14ème édition disponible
sur
http://www.hcuge.ch/Pharmacie/listemed/tableaux/ir.pdf
consulté le 22/11/2006
17. MICHAEL E. WINTER (1988). Basique clinical
pharmacokinetics, 2nd Edition.
18. C. JACQUOT (2007). Insuffisance rénale
chronique chez les patients âgés. Disponible sur
http://www.chups.jussieu.fr/polys/capacites/capagerontodocs/annee1pathologie/JACQUOTIRCages2007.pdf
consulté le 14/5/2007
19. RESPAUD R., GERVAIS R., MINVIELLE M., TALBERT M. (2006).
Evaluation de l'adaptation des posologies des médicaments chez les
sujets âgés insuffisants rénaux. Disponible sur
http://www.adiph.org/sfpc/Ep_103pdf.
consulté le 22/11/2006
20. BERNARD KOUCHNER (2001). Insuffisance rénale
chronique et santé publique. Disponible sur
www.sante.gov.fr. Consulté
le 4/9/2007.
21. RICHET, G., BEAUFILS (1977). Néphrologie
Physiopathologie Clinique, 2ème édition.
Paris : J.B Baillière : 262-269,329-343
22. A. AMAZAN, D. CHENEVRIER, V. FAVRE B. Bellon (2005).
Evaluation de l'adaptation des posologies des médicaments chez les
sujets âgés insuffisants rénaux. Disponible sur
http/www.adiph.org/spfc/EP_103pdf consulté le 22/11/2006
23. Principe de pharmacocinétique. Disponible
sur
http://www.baclesse.fr/cours/fondamentale/c15-chimiotherapie/Chimio-6.htm
consulté le 01/09/2007
24. BERTRAM, G., KATZUNG (2001). Basic and Clinical
Pharmacology, 8th ed. Norwalk: Appleton:and Lange:
37-38,47-47
25. A. DUBUC (2000). Intoxications à la
digoxine. Disponible sur
http://www.pharmactuel.com/sommaires/200001/17-20.pdf
consulté 25/7/2007
ANNEXES
| 


