|
|
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE
SCIENTIFIQUE
UNIVERSITE MENTOURI DE CONSTANTINE - FACULTE DES
SCIENCES
|
DEPARTEMENT VETERINAIRE
EL-KHROUB
ANNEE 2007 MEMOIRE N° 07-014.
L'activité sexuelle de la brebis.
(Etude bibliographique)
MEMOIRE
pour obtenir le grade de
DOCTEUR
VETERINAIRE
présenté et soutenu en 2007
Au
Département des Sciences Vétérinaires
d'El-Khroub
Par
DJAMAÏ Abdelhadi.
Né le 14
Janvier 1984 à Bejaia.
Et
ZEBIRI Mohamed
ezzine.
Né le 20 Juin 1983 à Colla, BBA.
Promoteur:
Mm : ALLAOUA Sofia
Amel
Maître assistante chargée de cours en
reproduction animale.
Devant le JURY
PRESIDENT:
M. BENSAGNI ABDERRAHMANE.
Maître
assistant chargé de cours en chirurgie animale.
ASSESSEUR:
M. DEHIMI MOHAMED ELAZIZ
Directeur de
l'I.T.E.L.V. à Ain M'lila.

Introduction 01
Le but 01
La problématique .. 01
L'historique 03
Premier chapitre:
Rappel anatomique et histologie de
l'appareil génital de la brebis.
1. L'embryologie de l'appareil génital de la brebis
06
1. 1. L'appareil génital de la brebis adulte . 07
1. 1. 1. Section glandulaire 07
1. 1. 1. 1. Les ovaires 07
1. 1. 1. 2. La conformation de l'ovaire 07
1. 1. 1. 3. L'histologie de l'ovaire . 07
1. 1. 1. 4. Innervation, irrigation et moyen de fixité
07
1. 1. 2. Section tubulaire 08
1. 1. 2. 1. L'oviducte 08
1.1.2.1.1. Lepavillon . 08
1. 1. 2. 1. 2. L'ampoule .. 08
1. 1. 2. 1. 3. L'isthme 09
1. 1. 2. 1. 4. L'histologie de l'oviducte . 09
1. 1. 2. 1. 5. Innervation, irrigation et moyen de fixité
de l'oviducte ... 09
1. 1. 2. 2. L'utérus 09
1. 1. 2. 2. 1. Les cornes 09
1. 1. 2. 2. 2. La conformation de l'utérus 09
1. 1. 2. 2. 3. Moyen de fixité de l'utérus 10
1. 1. 2. 2. 4. L'histologie de l'utérus 10
1. 1. 2. 2. 5. Le cervix 10
10
11 11 11 11 11
12
1. 1. 2. 2. 6. Innervation et irrigation de l'utérus
1. 1. 3. Section copulatrice
1.1.3.1. Levagin
1. 1. 3. 2. La conformation intérieure
1. 1. 3. 3. L'histologie du vagin
1. 1. 3. 4. Innervation, irrigation et moyen de fixité
1. 1. 3. 5. Les organes génitaux externes
Deuxième chapitre:
Endocrinologie de la
reproduction chez la brebis.
2.
16
16
16
17
20
20
21
24
25
25
26
26
27
27 27 27 27
Endocrinologie de la reproduction
2. 1. Le rôle du système nerveux central
2. 2. La perception de l'information
photopériodique .
2. 3. La glande pinéale et ses hormones
.
2. 4. L'hypothalamus et ses hormones
2. 5. L'hypophyse et ses hormones
2. 6. L'axe hypoyhalamo-hypophyso-ovarien et le
rétrocontrôle
2. 7. Les hormones gonadiques .
2. 8. Autres substances et hormones .
2. 8. 1. Laleptine ..
2. 8. 2. L'hormone lactogène placentaire (OPL)
2. 8. 3. La noradrénaline
2. 8. 4. Acides aminés excitateurs
2. 8. 5. Les hormones thyroïdiennes
2. 8. 6. Hormone (ou protéine) spécifique
de la gestation .
2. 8. 7. La prostaglandine
2. 8. 8 L'oestradiol 175
Troisième chapitre:
La physiologie de la
reproduction chez la brebis.
3. La physiologie de la reproduction 29
3. 1. Le déroulement de la gamétogenèse chez
la brebis . 29
3. 1. 1. Ovogenèse 29
3. 1. 1. 1. Définition et étapes 29
3. 1. 1. 2. Régulation de la maturation de l'ovocyte
30
3. 1. 2. Folliculogenèse 31
3. 1. 2. 1. Définition, notions et étapes . 31
3. 1. 2. 2. Régulation de la croissance du follicule
34
3.2. Lapuberté 35
3. 2. 1. Déclenchement de la puberté 35
3. 2. 2. L'ovulation 38
3. 2. 3. L'ovulation silencieuse 38
3. 3. Le cycle sexuel de la brebis 39
3. 3. 1. Définition 39
3. 3. 2. Les différentes phases 39
3. 3. 2. 1. La phase folliculaire 39
3. 3. 2. 2. Phase lutéale . 41
3. 4. L'accouplement 44
3. 5. La fécondation 44
3. 6. La progestation . 44
3. 6. 1. La segmentation . 45
3. 6. 2. Nidation ou implantation 45
3. 7. La gestation proprement dite . 46
3. 8. La mise bas ou l'agnelage . 47

3. 9. La lactation
3. 10. La sénilité
Quatrième chapitre:
Les facteurs qui
influençant sur la reproduction de la brebis.
5. Les facteurs qui influençant sur la reproduction
4. 1. Généralités
4. 2. Les facteurs externes
4. 2. 1. La latitude
4. 2. 2. La photopériode
4. 2. 3. La température
4. 2 .5. L'alimentation
4. 2. 6. L'effet mâle
4. 3. Les facteurs internes .
4. 3. 1. La génétique
4. 3. 2. L'état sanitaire
4. 4. Quelques paramètres de reproduction
Cinquième chapitre:
La brebis de races
locales.
5. La brebis de races ovines locales
5. 1. Effectif et élevage
5. 1. 1. Elevage extensif nomade
5. 1. 2. Elevage semi extensif sédentaire
5. 2. Description générale
5. 2. 1. Les races principales ..
5. 2. 1. 1. Race Arabe Blanche dite Ouled Djellal
5. 2. 1. 2. Race Hamra ou Beni-Ighil
48
51
53
53
53
53
53
55
56
58
59
59
60
60
62
62
62
62
63
63
63
65
5. 2. 1. 3. Race Rumbi . 65
5. 2. 2. Les races secondaires . 66
5. 2. 2. 1. Race Berbère 66
5. 2. 2. 2. Race Barbarine . 66
5.2.2. 3.RaceD'men 67
5. 2. 2. 4. Race Targuia-Sidaou 68
5. 3. Les caractéristiques des brebis de races locales
68
5. 3. 1. Les caractéristiques physiques des races ovines
algériennes 68
5. 3. 2. Les caractéristiques physiologiques et
génitiques .. 69
5. 3. 3. La sélection et l'amélioration
génitique . 75
Conclusion générale:
Recommandations et perspectives:
Références:

06
08
12
17
18
Figure 1: L'anatomie de l'appareil génital de la brebis
Figure 2 : Coupe schématique d'un ovaire
Figure 3 : Structure histologique de l'épithélium
vaginal
Figure 4 : Coupe sagittale de cerveau et d'hypothalamus de mouton
Figure 5 : Structure de la mélatonine
(N-acetyl-5-methoxytryptamine)
23
Figure 6 : Régulation neuro-hormonale du cycle sexuel des
mammifères (brebis)
26
30
31
Figure 7 : Hypothèses sur des boucles de régulation
par lesquelles la leptine
pourrait moduler la fonction de reproduction
Figure 8 : Ovocyte 2ème ordre
Figure 9: Schéma récapitulatif du
déroulement de l'ovogenèse
Figure 10: Schéma de l'évolution d'un follicule du
stade primordial au stade ovulatoire «DE GRAFF » en passant par le
stade primaire, secondaire et tertiaire
34
35
37
48
Figure 11 : L'évolution des concentrations des hormones
hypophysaires au cours du cycle sexuel de la brebis
Figure 12 : Conditionnement neuro-hormonal de la puberté
chez la femelle .
Figure 13 : Les déférentes présentations
lors de la phase d'expulsion ....
50
Figure 14 : Evolution de la glande mammaire pendant la vie
génitale de la femelle .
54
Figure 15 : Modèle pour la régulation
photopériodique du cycle annuel de Reproduction chez la brebis
59
Figure 16 : Fréquence des décharges pulsatiles de
LH chez des brebis anovulatoires avant et après mise en contact avec un
bélier .
63
Figure 17 : Aire de répartition des races et localisation
des types d'ovins en Algérie
13
14
Photo 1: Photos des différentes parties de l'appareil
génital de la brebis
Photo 2 : Photos des appareils génitaux et les ovaire de
la brebis
Photo 3 : Ovocyte 2ème ordre .. 30
Photo 4 : La brebis en instance d'agnelage se couche par terre et
regarde en l'air . 47
Photo 5 : Les déférentes étapes du
déroulement de l'agnelage 48
Photo 6 : La structure histologique d'un follicule mûr de
«De Graaf », d'une
brebis de la race `Ouled-Djellal' . 71
Photo 7 : Coupe sagittale au niveau d'un ovaire de brebis de race
`Ouled Djellal'. 71
Photo 8 : L'aspect d'un frottis cellulaire vaginal de brebis
... 74
Tableau 1: Evolution du cheptel ovin (milliers de têtes)
Sources Statistiques
Agricoles 62
Tableau 2 : Les performances de la reproduction de la race Ouled
Djellal à la
station de Ain M'lila . 64
Tableau 3 : Les caractéristiques physiques des races
ovines locales . 69
Tableau 4 : Les performances de reproduction des brebis
algériennes . 72
Tableau 5 : Fréquence des agnelages des brebis de nos
trois principales races
ovines Algériennes au cours des différents mois de
l'année . 73
Tableau 6 : les résultats de croisement entre les brebis
de races arabes (Ouled
Djellal) et des béliers de races importées 76

A notre enseignante et promotrice, madame ALLAOUA.S.A, qui
nous a aidé, orienté et soutenu, un grand remerciement plein de
respects. Nous vous souhaitons, madame, une bonne carrière et de
très beaux souvenirs avec vos étudiants.
Comme nous portons nos salutations fraternelles à
monsieur et madame BENSEGHENI qui ont manifesté une solide
volonté pour un meilleur enseignement, et une clairvoyance spectaculaire
pour un bon accompagnement des étudiants dans leur cursus.
Permettez-nous de vous dire que vous être vraiment les élites du
département des sciences vétérinaires à
ELKHROUB.
A monsieur DEHIMI M. directeur de l'I.T.E.L.V., un remerciement
particulier pour son aide en enrichissant notre étude par des
références introuvables.
Merci monsieur BOUKEROU.A, le directeur du laboratoire
régional vétérinaire, et mademoiselle BEROUAL.K de votre
aide pour notre première tentative malgré qu'elle n'ait pas
réussi mais elle nous a donné la chance de voyager dans notre
pays. A monsieur Nasser, le responsable de la bibliothèque, et à
madame RIACHI, nous vous remercions infiniment pour l'apport de vos aides.
A monsieur NIAR.A, qui faisait des travaux remarquables sur la
race ovine locale, nos salutations à vous et merci pour votre
coopération en nous envoyant une copie originale de votre thèse
de doctorat.
Finalement nous aimons vraiment de dire à monsieur
BENSEGUENI.A, à madame BENSEGUENI.L et à madame ALLAOUA.S.A que
vous êtes dans le coeur et dans la mémoire.

C'est grâce à Allah, à Lui Seul la
louange, que nous avons pu finir ce travail; et je tiens fermement à
signaler que cette aventure nous a permet d'apprendre énormément
de connaissances que l'amphithéâtre nous les a pas appris.
Comme je saisis cette occasion pour dédie cette oeuvre
à ma chère mère Hayette, mon paradis et ma joie, ma raison
de vivre et la source de mes inspirations ; à mon père Saleh, ma
fierté, ma force et ma gloire ; à mes deux soeurs, Dalal et
Cherifa, mon honore et ma dignité; à mon frère Ibrahim, ma
main droite, mon partenaire et mon associé, à ma future femme
Elyamna, mon trésor et la fleur de ma vie; aux membres de ma grande
famille maternelle et paternelle et mes alliés à mon ami et mon
binôme Mohamed ainsi qu'à tous mes amis de Bejaia, de Bechar, de
Sétif, de Tiaret et de Constantine sans citer leurs prénom pour
ne pas vexer personne si je l'oublie.
DJAMAÏ Abdelhadi.

Qu'Allah soit loué, puisque c'est grâce à Lui
que je termine mes études universitaires par ce travail que je le
dédie à mon père Abdellah et à ma mère
Tassâdit, à ma grand-mère maternelle Dhrifa le
trésor de la famille ; à mes soeurs et mes frères :
Âicha, Souhila, Djawia, Hassan et Abdelmoumen ; à mes
beaux-frères ainsi qu'à mon gendre et ma nièce:
Abdelrahman l'ange de la famille, et Yasmine le jasmin de notre vie ; et
à toute la famille petit et grand.
A notre cher ami Mosrane Hamza qui nous a aidés dans
l'impression de ce travail.
Comme je dédie mon oeuvre à mon
binôme et à mes amis sans exception.
Mohamed ezzine.
Résumé des abréviations:
ACTH:
Adréno-Cortico-Trophic
Hormone.
ADH : Antidiurétique
Hormone.
FSH: Follicle Stimulating
Hormone.
GnRH: Gonadotrophine
Releasing Hormone. ICSH:
Interstitial Cell Stimulating
Hormone. LH: Hormone
Lutéinisante.
LHRH : Luteinising
Hormone-Releasing
Hormone)
LTH : Lutéotrope
Hormone, ou la prolactine.
MIF : Melatonine Inhibting
Factor.
MSH: Mélano-Stimuline
Hormone.
PIF: Prolactin Inhibiting
Factor.
PRF: Prolactin Releasing
Factor.
STH: Somatotrope
Hormone. PIF: Prolactin
Inhibiting Factor.
PRF: Prolactin Releasing
Factor.
STH: Somatotrope
Hormone.
TRH: Thyroïd Releasing
Hormone.
% : pourcent.
cm: Centimètre.
mm: millimètre.
ml: millilitre.
Kg: Kilogramme.
g: gramme.
ug : microgramme.
UI : unité internationale.
°C : Degré Celsius.
L'introduction:
Pour qu'un élevage rationnel des ovins réussisse,
nous devons maîtriser trois volets capitaux, à savoir
l'hygiène, l'alimentation et la reproduction.
L'hygiène résumant l'ensemble des mesures
offensives et défensives ainsi que le choix de la bonne thérapie
vis-à-vis des différentes pathologies qui touchent et menacent
cette espèce.
En ce qui concerne l'alimentation, ce sont des calculs des
besoins d'entretien, de croissance et de production et le contrôle de la
qualité de la ration tout en colmatant les périodes critiques
où la végétation est très réduite, exemple:
sécheresse ; par l'adopte d'une politique de réserve et de
supplémentation.
La maîtrise de la reproduction stipule des connaissances
approfondies et plus ou moins élargies sur l'activité sexuelle de
la brebis et du bélier - quoique nous nous contentons dans notre
étude que de la brebis - notamment ceux de nos races locales; ainsi que
la mise en profit de toutes ces connaissances et la coordination entre-elles,
en vue d'en exploiter au maximum.
Nous accordons une importance primordiale et majeure à
la reproduction puisqu'elle est influencée par l'hygiène et
l'alimentation, et elle décide rigoureusement le sort de l'animal au
sein d'une exploitation.
Le but:
Comprendre l'activité sexuelle de la brebis notamment
de nos races locales ouvre des perspectives prometteuses pour un élevage
rationnel, productif et une amélioration de nos cheptels.
La problématique:
La présence des brebis cyclées en dehors de la
saison d'activité sexuelle nous a poussé de poser quelques
questions à savoir:
· Est-ce que le saisonnement est une règle
générale pour toutes les races?
· Si oui; Est-ce qu'il est influencé par des
facteurs ou prédisposé à être modifié ou bien
est-il codé par un support génétique, donc toute tentative
en ce sens est en vain?
· Si non; A qui appartiennent nos races locales,
à des races saisonnières ou à des races
non saisonnières?
· Finalement quelles sont les solutions et les
recommandations envisageables pour
atteindre le but escompté?
L'historique:
Comme l'a remarqué Stephan Jay Gould (2000): «
Les bons naturalistes sont par nécessité des historiens »
(41).
La classification est hiérarchique et binomiale, chaque
animal étant nommé en Latin par un nom de genre et un nom
d'espèce. Le mouton appartient au:
- Règne animal.
- Embronchement : les Chordés.
- Super-classe ou classe: les Vertébrés.
- Classe ou super-ordre: les Mammifères.
- Ordre : les Artiodactyles (40).
- Famille: les Bovidés.
- Sous-famille: les Caprinés (03).
- Genre : Ovis.
- Espèces : A titre d'exemple : Ovis orientalis, le
mouflon, avec deux sous-espèce:
· Ovis orientalis musimon (le mouflon d'Europe).
· Ovis orientalis laristanica (le mouflon d'Asie)
(41).
L'ovin est une espèce grégaire
(42), Il est l'une des plus anciennes espèces
domestiquées, après le chien et la chèvre. Plusieurs
auteurs évoquent une date «classique» oscillant autour du
VIIIème millénaire, av.J.C.
On propose une origine moins lointaine aux alentours de
6500-6000 av.J.C pour sa domestication. Défaut d'éléments
concrets pousse à considérer cette estimation avec beaucoup de
prudence.
Le premier endroit de domestication du mouton est
localisé au Proche-Orient avec une diffusion progressive à partir
de ce centre unique. Nombreux auteurs avancent la possibilité d'une
origine multicentrique (41).
En Algérie nous avons trois principales races locales.
La race arabe blanche dite Ouled Djellal ou djellalia a une origine qui demeure
un mystère; est-elle venue avec les Beni-Hillal du Hidjaz (Arabie) au
XIème siècle ou avec les Romains au
Xème siècle de Tarente (Italie) ? Elle serait
même à l'origine de la Mérinos introduite de Barbarie en
Espagne par Don pédré roi du Castille.
Pour la race Hamra dite Beni-Ighil, elle est bien Autochtone
d'Afrique du Nord plus précisément du haut atlas marocain
où elle est élevée par la tribu Beni-Ighil d'où
elle tire son nom (19).
I
lei Mi# e 'BIS
1. L'embryologie de l'appareil génital de la
brebis:
L'appareil génital femelle est d'origine
Mésoblastique (05). Pendant la vie embryonnaire et
foetale se développent les caractères sexuels primaires : les
gonades (ovaires), les conduits génitaux et organes génitaux
externes. Les premières ébauches de l'appareil urinaire et
génital sont en contact étroit. L'appareil génital passe
par un stade indifférencié pendant lequel se mettant en place des
éléments indifférenciés : crête
génitale, gonades, canaux de Wolff et de Müller et ébauches
des organes génitaux externes (32).
L'épithélium germinal fournit des cellules qui restent incluses
dans la profondeur de l'ébauche gonadique; ces éléments
vont se diviser pour donner plus tard les follicules primordiaux
(26).
L'ovogenèse se déroule pendant la vie foetale en
quatre phases:
Phase de la différenciation sexuelle à l'apparition
des ovocytes au stade leptotène, la phase dure 15 à 17 jours.
Phase de l'apparition des stades leptotène à
l'apparition des premiers follicules primordiaux, la durée de 13
à 17 jours.
Phase de l'apparition des follicules primordiaux à la
disparition des gonies et des premiers stades de la prophase méiotique,
la durée de 30 jours.
Phase de la disparition des premiers stades de la prophase
méiotique à l'apparition des premiers follicules à antrum,
la durée de 45 jours (35).
Chez le foetus femelle il y a 5 x 106 follicules
primordiaux (12). Les cycles de la croissance et de
l'atrésie des follicules se succèdent depuis la fin de
4ème phase jusqu'à la puberté
(35). Il reste 400000 follicules primordiaux à la
naissance dont 300 à 400 seulement seront utilisés dans la vie
génitale (12).

Figure 1 : L'anatomie de l'appareil
génital de la brebis (39), (15).
1. 1. L'appareil génital de la brebis adulte
(Figure 1):
1. 1. 1. Section glandulaire:
1. 1. 1. 1. Les ovaires (ovarium): Ils sont
aplatis (35) et enveloppés dans des bourses ovariques
qui résultent d'un dédoublement du ligament large
(02), et ils sont suspendus dans la cavité abdominale
par ce ligament (39). Dans l'épaisseur de ce dernier,
entre le pavillon et l'ovaire et au contact à celui-ci se trouve un
vestige du corps de Wolff: Organe de Rosenmüller ou époophoron
(35), qui fait défaut chez la chèvre
(03).
1. 1. 1. 2. La conformation de l'ovaire : La
couleur des ovaires est en général blanc-rosé ou
grisâtre. La consistance est ferme, un peu élastique
(02). Leur poids individuel dépend de la saison et du
moment du cycle oestral, et il est compris entre 3 et 5 grammes
(39). Il a 2,5 centimètres de longueur
(03), 10 à 15 millimètres de large
(02). Sur chaque ovaire on distingue des bosselures plus ou
moins apparentes qui sont des follicules à différents stades
d'évolution (35).
1. 1. 1. 3. L'histologie de l'ovaire : Sur
une coupe, l'ovaire présente, au-dessous d'un mince revêtement,
une faible albuginée conjonctive (tunica albuginea)
(03), et un parenchyme nettement divisé en deux zones:
une zone médullaire (le stroma) ou la zone centrale vasculaire (zona
vasculosa) qui comprend du fibroblaste, des nerfs et des vaisseaux sanguins, et
une zone périphérique ou le cortex dans lequel les
différents types de follicules se développent. C'est dans ce
dernier que se déroule la folliculogénèse
(35).
1. 1. 1. 4. Innervation, irrigation et moyen de
fixité: Les nerfs sympathiques, qui proviennent du plexus
mésentérique postérieur, accompagnent l'artère
ovarienne pour former un plexus ovarien (03). L'ovaire
reçoit le sang de l'artère ovarienne qui naît à la
partie caudale de l'aorte abdominale (02). Les veines sont
satellites (03) et aboutissent à la veine cave
(02). Les vaisseaux lymphatiques sont abondants, ils
aboutissent aux noeuds lymphatiques lombo-aortiques (02).
Les moyens de fixité de l'ovaire sont constitués
: de mésovarium, de ligament suspenseur de l'ovaire, de ligament propre
de l'ovaire anciennement appelé ligament utéro-ovarien, la fimbia
ovarica jadis appelé ligament tubo-ovarique et le mésosalpinx,
les vaisseaux sanguins et les nerfs (02).

Figure 2 : Coupe schématique d'un ovaire
(58).
1. 1. 2. Section tubulaire:
La longueur moyenne de l'extrémité
postérieure du cervix au pavillon est de 38 centimètres
(35).
1. 1. 2. 1. L'oviducte (trompe utérine ou
trompe de Fallope ou bien salpinx): Il constitue la partie initiale
des voies génitales femelles (02). C'est un organe
tubulaire circonvolutionné qui va de l'ovaire à la corne
utérine correspondante (39). Il a une longueur de 10
à 12 centimètres (15), et il est
constitué, dans l'ordre, du pavillon (infundibulum) qui capture l'ovule
pondu par l'ovaire lors de l'ovulation, de l'ampoule et de l'isthme qui est
relié à la corne utérine.
1. 1. 2. 1. 1. Le pavillon (infundibulum) :
Il est en forme d'entonnoir et il a une surface d'environ 6 à
10 centimètres carrés chez la brebis. L'ouverture du pavillon est
rattachée en un seul point central à l'ovaire
(39).
1. 1. 2. 1. 2. L'ampoule : C'est la partie la
plus longue et la plus large de l'oviducte où les oeufs sont
conservés plusieurs jours après l'ovulation
(39). Sa cavité est relativement large et ses parois
minces et molles (02). La fécondation se produit dans
cet endroit.
1. 1. 2. 1. 3. L'isthme : Il forme la partie
la plus courte et la plus étroite de l'oviducte (39),
les plis longitudinaux de la muqueuse y sont moins élevés et sa
paroi est plus épaisse et plus rigide (02). La jonction
utéro-tubaire constituée par des plis et des muscles circulaires
ne peut être franchie que par des spermatozoïdes vivants
(35).
1. 1. 2. 1. 4. L'histologie de l'oviducte:
L'oviducte est composé d'un tissu épithélial
formé de cellules ciliées, de cellules sécrétoires
et d'un tissu musculaire (39). La muqueuse est
dépourvue de muscularis mucosae et sa propria tient lieu de la
sous-muqueuse par sa partie profonde, qui s'adhère à l'intima de
la musculeuse. Cette dernière est modifiée par les adaptations
fonctionnelles de chaque segment. Elle est formée d'une couche
superficielle de fibres longitudinales et une couche profonde de fibres
circulaires entre les deux se trouve une couche conjonctivo-vasculaire. La
séreuse est représentée par les deux lames
péritonéales qui constituent le mésosalpinx. La
sous-séreuse est formée d'un tissu conjonctif riche en fibres
collagènes et mêlées de fibres musculaires lisses
(02).
1. 1. 2. 1. 5. Innervation, irrigation et moyen de
fixité de l'oviducte : Les nerfs gagnent le mésosalpinx
en suivant leurs rameaux tubaires. Les artères tubaires et les veines
tubaires assurent la circulation sanguine. Les vaisseaux lymphatiques sont
drainés par le noeud lymphatique lombo-aortique. Placé
latéralement à l'ovaire, la trompe utérine en partage les
moyens de fixité et les rapports (02).
1. 1. 2. 2. L'utérus (matrice): Il est
bipartitus (02) et constitué de trois parties: les deux
cornes utérines 10 à 15 centimètres de long
(39), le corps utérin 4 centimètres
(35), et le cervix (le col de l'utérus) 4 à 5
centimètres de long (03) et 2 à 3
centimètres de diamètre (39).
1. 1. 2. 2. 1. Les cornes: Ils sont
cylindroïdes, incurvées (02) et accolées
l'une contre l'autre dans toute la partie postérieure de leur segment
libre et elle sont circonvolutionnées à leur sommet
(03).
1. 1. 2. 2. 2. La conformation de l'utérus :
La couleur de l'utérus est jaune rosé, parfois
rougeâtre. Sa consistance est ferme et élastique sur le cadavre,
elle est souple et plus molle, mais variable avec les périodes du cycle
chez le vivant.
1. 1. 2. 2. 3. Moyen de fixité de
l'utérus : Les moyens de fixité sont : le ligament
large, le mésométrium, le ligament rond de l'utérus ainsi
que les vaisseaux sanguins et les nerfs et la continuité avec le vagin
et l'oviducte (02).
1. 1. 2. 2. 4. L'histologie de l'utérus:
Les trois tuniques qui composent la parois de l'utérus sont:
une séreuse, une musculeuse et une muqueuse, respectivement
nommées périmétrium, myomètre et
l'endomètre.
Le périmétrium est formé d'un tissu
conjonctivo-élastique riche en vaisseaux et nerfs et revêtu en
surface par le mésothélium péritonéal. Le
myomètre est épais (02) et composé de
muscles circulaires profonds et longitudinaux superficiels (39)
et une couche musculaire moyenne (02).
L'endomètre est la muqueuse de l'utérus
(02). Il comprend un épithélium cylindrique
simple fait de cellules ciliées et de cellules sécrétrices
(32) et il est pseudo-stratifié par endroits
(02). Un chorion de tissu conjonctif, logeant les
invaginations glandulaires (32) dont la structure est
tubulaire, ramifiée ou torsadée (39).
L'endomètre présente des tubercules pédiculés ou
cotylédons, concave (03) de couleur jaunâtre en
forme de disque arrondis ou ellipsoïde et sont creusés en cupule
à leur centre (voir les photos) (32). Leur nombre est
parfois de 80 par corne et ils sont disposés en quatre rangées
(35).
1. 1. 2. 2. 5. Le cervix (col de l'utérus) :
C'est est une partie très importante qui sépare, en
permanence, la cavité utérine de la cavité vaginale
(39). Sa muqueuse est mince (02)
sécrétant le mucus cervical (39),
l'épithélium est columnaire, avec seulement un petit nombre de
cellules et de mucocytes. Le chorion est dense moins riche en cellules que
celle de l'endomètre (02). Le tissu musculaire
comprenant des muscles lisses et des fibres de collagène. Les anneaux
cervicaux consistent en une série de crêtes dures ou de plis
annulaires (39).
1. 1. 2. 2. 6. Innervation et irrigation de
l'utérus : L'innervation est assurée surtout par des
fibres sympathiques provenant des ganglions mésentériques caudaux
et des ganglions pelviens. L'artère utérine naît de
l'iliaque interne en commun avec l'artère ombilicale. Les veines de la
paroi utérine constituent des réseaux similaires à ceux
des artères mais plus anastomosées. Les vaisseaux lymphatiques
sont nombreux (02).
1. 1. 3. Section copulatrice:
1. 1. 3. 1. Le vagin: C'est l'endroit
où la semence est déposée lors du coït
(39). Un organe impair et médian (02),
cylindroïde musculo-membraneux s'étendant du col de l'utérus
à la vulve ou sinus uro-génital (32) dans une
longueur de 10 à 12 centimètres (35). Le vagin
est dérivé de la partie la plus caudale des conduits
paramésonéphriques (02) et il est très
irrigué et sensible (39).
1. 1. 3. 2. La conformation intérieure:
les canaux de Gaertner (vestiges des canaux de Wolff) sont
généralement absents (35). La surface
intérieure est lubrifiée par un mucus abondant et plissée
longitudinalement (32), elle est jaune rosé dans les
périodes de repos, plus rouge et congestionnée lors de l'oestrus
(02).
1. 1. 3. 3. L'histologie du vagin: La
muqueuse vaginale est relativement mince (02).
L'épithélium est stratifié et pavimenteux (02)
se kératinise et se desquame au cours du cycle
(32). Le chorion ou la propria est un tissu conjonctif dense
(02), caractérisé par l'absence de glandes
(32).
La musculeuse est relativement mince de teinte rosée
(02). Elle est faite de faisceaux de cellules musculaires
lisses, circulaires et longitudinales (32).
L'adventice est constitué d'un tissu conjonctif dense
pourvu de fibres élastiques (32). (Voire figure 3).
1. 1. 3. 4. Innervation, irrigation et moyen de
fixité : Les nerfs proviennent du système sympathique
par l'intermédiaire du nerf hypogastrique et du système
parasympathique par l'intermédiaire des nerfs sacraux. Le sang est
apporté au vagin par l'artère vaginale; une veine vaginale
satellite de cette artère. Les lymphatiques sont disposés en
trois réseaux largement communicants et sont drainés par des
troncs volumineux qui aboutissent aux noeuds lymphatiques iliaques internes.
Le vagin est fixé crânialement par son insertion
autour du col de l'utérus et par le péritoine, et caudalement par
sa continuité avec son vestibule, qui le solidarise à la vulve,
au périnée et à la paroi du bassin
(02).

Figure 3: Structure histologique de
l'épithélium vaginal (20).
1. 1. 3. 5. Les organes génitaux externes:
Le vestibule qui a une longueur d'environ le quart de celle du vagin,
le méat urinaire est très petit, à 1 centimètre en
arrière ; parfois, on note un hymen rudimentaire (35).
La paroi ventrale montre deux sillons longitudinaux séparés par
un pli médian (02) et dans lesquels débouchent
les glandes de Bartholin et les glandes de Skene (35) et des
glandes vestibulaires mineures (02). La grande et la petite
lèvre possèdent des glandes sécrétant un liquide
visqueux qui facilite la copulation (39). Elles sont peu
saillantes et le relief qui porte la commissure ventrale est nettement plus
court (02).
Le clitoris est court (35). C'est un organe
érectile et sensible (39); ses racines sont deux corps
clairs, aplatis, minces, 2,5 centimètres de longueur et 0,6
centimètres de largeur, recouverts de muscles ischio-caverneux
rudimentaires (35). Le gland est pourvu d'un rudiment tissu
spongieux (02).

A
A
A
B
B
B
B
B
B
Photo 1 : Différentes parties de
l'appareil génital de la brebis.
A : brebis Ouled Djellal âgée de
6 ans.
B : brebis Ouled Djellal âgée de
5 ans.
Réalisé par : ZEBIRI Med
ezzine et DJAMAÏ Abdelhadi. Le 19 Avril 2007.

1 : Follicule cavitaire.
2 : Follicule préovulatoire.
3 : Follicule de De Graaf.
4 : Corps jaune fonctionnel.
1
2
3
4
5 : Coupe d'un ovaire portant des corps
noirs.
5
elV I i I iDignw
. L LB ' iwoo
2. Endocrinologie de la reproduction:
2. 1. Le rôle du système nerveux
central:
L'organe du système nerveux central, situé dans la
boîte crânienne, est le siège des fonctions
supérieures et végétatives (48).
Chez l'animal comme dans l'espèce humaine, le cerveau
par toutes les perceptions agit sur le fonctionnement hormonal et donc sur
toute l'activité sexuelle. Les perceptions telles que la vue, l'ouie et
l'odorat, perçus par le cerveau supérieur (le cortex), excitent
l'hypothalamus à la fois par les fibres nerveuses et par une hormone, la
sérotonine. Ces stimulations sont indispensables à « la mise
en condition» des mécanismes sexuels (34).
Les hormones sont les substances véhiculées par
la circulation sanguine et elles permettent à différents organes
de communiquer entre eux. Quelques hormones (glycoprotéines)
sécrétées par le système hypothalamo-hypophysaire
contrôlent le fonctionnement des ovaires. En réponse, ceux-ci
produisent les gamètes, mais aussi d'autres hormones qui, par un
mécanisme de rétroaction, régulent le fonctionnement de
l'hypophyse et de l'hypothalamus (54).
2. 2. La perception de l'information
photopériodique:
L'information photopériodique est perçue par la
rétine (50) (c'est le seul photorécepteur, elle
possède des cellules capables de synthétiser la mélatonine
(16)) et transmise par voie nerveuse à la glande
pinéale en plusieurs étapes. Au niveau hypothalamique, le signal
est transporté au noyau hypothalamique paraventriculaire, puis dans une
colonne de cellules intermédio latérales située dans la
moelle thoracique et ensuite aux ganglions cervicaux supérieurs
(50). (Voire figure 4).

Figure 4: Coupe sagittale de cerveau (a) et
d'hypothalamus (b) de mouton.
a. L'information lumineuse chemine de l'oeil à la glande
pinéale. La fenêtre grisée constitue le cadre de la partie
b de la figure.
b. Ce schéma illustre les sites potentiels d'action de la
mélatonine dans l'hypothalamus de la brebis.
Chaque sphère représente le site d'implantation
de la mélatonine chez l'animal et sa taille est indicative de
l'étendue de la diffusion de la mélatonine. Les sphères
rouges et blanches indiquent respectivement les sites où la
mélatonine est active ou inactive pour modifier l'activité de
l'axe gonadique (25), (56).
2. 3. La glande pinéale et ses hormones:
La glande pinéale, aussi appelée
l'épiphyse, est une petite glande endocrine (49), son
poids est de 50 à 350 milligrammes (32), située
dans le cerveau, attachée à la partie postérieure du
troisième ventricule (49), (51),
(52).
Elle est riche en amines biogènes (histamine,
catécholamine) et dérivés indoliques (sérotonine et
mélatonine) (32).
Ce n'est qu'en 1958 que la mélatonine a
été isolée par LERNER à partir d'épiphyses
de boeufs (27), (49), (55)
et en 1959 il a établi sa structure (55)
(voire figure 5). Elle est considérée comme le
médiateur de photopériode influençant les
sécrétions de
gonadotropines par l'hypophyse (01). La
sécrétion épiphysaire de la mélatonine
(01), (27), (30),
(49), (51), (52),
(59), qui est dérivée de la sérotonine
(12), se produit à partir de tryptophane et de la
sérotonine sous l'effet des enzymes (Tryptophane hydroxylase, Aminoacide
aromatique décarboxylase,
Arylalkylamine-N-acétyltransférase,
HydroxyineO-méthyltransférase) dont l'activité est
commandée par la perception jour/nuit (59). La
formation de cet enzyme est inhibée par la lumière
(32). Des études comparatives d'embryologie ont
montré que cette glande est un oeil avorté (49),
troisième oeil que l'on retrouve chez de nombreux animaux
(12), (49). La sécrétion de la
mélatonine n'est faite que pendant la nuit (54),
(59) et c'est par sa durée de sécrétion
nocturne que les animaux perçoivent la durée du jour
(54).
Pour son action directe sur le fonctionnement gonadique, certains
auteurs ont obtenu des résultats négatifs
(12).

Figure 5: Structure de la mélatonine
(N-acetyl-5-methoxytryptamine) (25), (57),
(59).
La mélatonine a des actions multiples:
Elle a un effet inhibiteur sur la sécrétion par
l'hypothalamus de TRH (Thyroïd Releasing Hormone) (52).
Le traitement par des extraits épiphysaires est suivi d'un
hypofonctionnement thyroïdien (12);
Elle inhibe la sécrétion par l'hypophyse de La
corticostimuline ou ACTH (AdrénoCortico-Trophic Hormone), de la
thyréostimuline ou hormone thyréotrope ou STH (somatotrope
hormone).
Elle avait une action sur la sécrétion de LHRH
(Luteinising Hormone-Releasing Hormone) ou GnRH (gonadotrophine releasing
hormone) ; cette action explique qu'elle puisse freiner la maturation gonadique
du sujet jeune;
Elle bloque la sécrétion hypothalamique de MIF
(Melatonine Inhibiting Factor). Elle stimule la sécrétion par
l'hypophyse de prolactine (52).
Action sur les divers métabolismes: métabolismes
hydrominéral (effet sur les échanges de sodium et de potassium),
métabolisme des glucides (l'injection des extraits épiphysaires
provoque une hypoglycémie), métabolisme des lipides (diminution
des
lipides hépatiques après l'injection des
extraits épiphysaires) et métabolisme des protides (l'injection
des extraits épiphysaires provoque une inhibition de la
désamination hépatique) (12).
Chez les mammifères, la mélatonine est
métabolisée en 6-hydroxy-mélatonine par le foie et les
reins. Ce métabolite est excrété dans l'urine sous forme
sulphatée ou glucuronée. La mélatonine est
également métabolisée dans le cerveau en
N-acétyl-5- méthoxykénurénamine
(25), (56).
Médiateurs de l'action de la mélatonine sur
les neurones à LHRH:
Au niveau du système nerveux central, le point final de
l'action de la mélatonine est la modification de la
sécrétion pulsatile des neurones à LHRH que leur corps
cellulaire sont localisés en majorité (60 %) dans l'aire
pré-optique (figure 4 a et b).
Ces neurones se projettent dans l'éminence
médiane pour libérer le LHRH dans le système porte
hypothalamo-hypophysaire (figure 4 a et b). L'absence des récepteurs
à la mélatonine et l'effet de microimplants de mélatonine
dans la région septo-réoptique suggère que l'action de la
mélatonine sur les neurones à LHRH est indirecte et met en jeu
des interneurones (56).
Cette hypothèse est renforcée par le long
délai entre le début de l'action de la mélatonine et la
modification de la sécrétion de LHRH (40 à 60 jours en
moyenne). L'implication de différents types de neurones et de
neuromédiateurs est suspectée ainsi qu'une interaction de ces
neurones avec les hormones thyroïdiennes.
Cependant, des microimplants de mélatonine
disposés contre la pars-tuberalis ou à l'intérieur de
celle-ci sont incapables de stimuler la sécrétion de LH chez des
brebis ovariectomisées et traitées avec un implant d'oestradiol.
Ces microimplants étant capables de stimuler la sécrétion
de LH lorsqu'ils sont disposés dans le troisième ventricule,
cette observation suggère que la pars-tuberalis n'est pas le site
d'action de la mélatonine pour ses effets sur la fonction de
reproduction (25).
La pose de microimplants de mélatonine dans divers
sites hypothalamiques a permis d'identifier des sites potentiels d'action. En
effet, des microimplants de mélatonine disposés dans
l'hypothalamus médiobasal permettent de stimuler la
sécrétion de LH chez la brebis ou l'activité testiculaire
chez le bélier de la même manière que des jours courts
ou des implants sous-cutanés. Lorsque ces microimplants
sont disposés dans l'hypothalamus antérieur ou
dorso-latéral ou dans l'aire pré-optique, ils n'ont aucun effet
détectable sur la sécrétion de LH. Ces résultats
suggèrent une localisation des sites d'action de la mélatonine
dans l'hypothalamus médiobasal (25),
(56).
2. 4. L'hypothalamus et ses hormones:
Au sein de l'hypothalamus ont été
individualisés un certain nombre de noyaux (supra- optiques, noyau
paraventriculaire, noyau infundibulaire, noyaux accessoires, etc.). Ces noyaux
sont les lieux d'élaboration des hormones hypothalamiques.
Ces hormones hypothalamiques sont les suivantes:
Le facteur de contrôle de l'hormone thyréotrope : ce
facteur appelé TRH, stimule la sécrétion et la
libération de TSH hypophysaire (Thyroïd Stimulating Hormone).
Les facteurs de contrôle de l'hormone corticotrope.
Les facteurs de contrôle de l'hormone somatotrope (STH).
Les facteurs de contrôle des hormones gonadotropes. Il
semble qu'il n'existe, en fait, qu'un seul facteur de libération des
hormones gonadotropes. Ce facteur appelé LHRH ou GnRH
(52). Cette hormone stimule les sécrétions
hormonales de l'antéhypophyse, la FSH (follicule stimulating hormone) et
de la LH (hormone lutéinisante) (34).
Les facteurs de contrôle de la prolactine. Ils semblent
être au nombre de deux : un facteur stimulant, le PRF (prolactin
releasing factor) ; un facteur inhibiteur, le PIF (prolactin inhibiting
factor).
Les facteurs de contrôle de l'hormone mélanotrope
(52).
La dopamine, selon de nombreux résultats, exerce une
action inhibitrice sur la sécrétion de LH et que
l'intensité de cette action peut être modulée par l'action
de la photopériode. La synthèse et la libération de la
dopamine dans le noyau dopaminergique hypothalamique (A1 5) sont
stimulées par l'oestradiol chez des brebis exposées à des
jours longs, ce qui suggère que cette structure pourrait être
impliquée dans les variations de rétroaction négative de
l'oestradiol (25), (56).
2. 5. L'hypophyse et ses hormones:
La glande pituitaire du Latin pituita veut dire
mucosité, glaire, sécrétion. Elle est plus connue sous le
nom d'hypophyse (49). C'est est une glande endocrine de petite
taille, située à la base du crâne dans une loge
hypophysaire. Elle est attachée au cerveau (diencéphale)
(52), (53) par la tige pituitaire. On
distingue trois zones (52), (53) ou lobes,
dans l'hypophyse : L'antéhypophyse (adénohypophyse)
située en avant, la posthypophyse (neuro-hypophyse) située en
arrière et le lobe intermédiaire.
L'antéhypophyse sécrète un certain nombre
d'hormones:
L'hormone de croissance : STH (27),
(53);
Les stimulines hypophysaires : TSH, ACTH, FSH, LH
(26), (27), (34),
(53).
La FSH, hormone gonadotrope (53) existe
déjà dans l'hypophyse d'agneaux femelles de 80 à 100 jours
(26). Chez la brebis, La FSH favorise les mitoses
folliculaires pendant la période de croissance folliculaire
(27), (44) la maturation du follicule de De
Graaf et le rend sensible à LH (53), active l'aromatase
et stimule l'apparition des récepteurs à la LH et à la FSH
(44).
La LH ou ICSH (interstitial cell stimulating hormone)
(26), (53) a une action complexe sur l'ovaire
(53). Elle agit sur le follicule préovulatoire en
diminuant le taux de récepteurs à la FSH, déclenche la
reprise de la méiose (44), et sous son influence le
follicule donne des oestrogènes et le corps jaune donne de la
progestérone (53). Au cours de la gestation, aucune
augmentation en ICSH dans le sang ne se produit chez la brebis, les taux se
maintiennent aux alentours de 2 ug/ml (26).
Le pic des gonadotrophines (LH et FSH) déclenche : La
maturation folliculaire, la reprise de la deuxième division
méiotique, et l'ovulation (44).
La prolactine ou LTH (lutéotrope hormone)
(26), (27), (53): Cette
hormone entretient la lactation et inhibe les contractions du myomètre
(32).
La post-hypophyse sécrète:
L'hormone antidiurétique ADH ou vasopressine
(12), (26), (27),
(53).
L'ocytocine (12), (26),
(27), (53) qui agit au cours de la mise bas en
déclenchant la contraction utérine. Elle permet également
l'éjection du lait lors de l'allaitement (32),
(53).
Le lobe intermédiaire sécrète :
La mélanostimuline hormone ou MSH (12),
(26), (53).
2. 6. L'axe hypothalamo-hypophyso-ovarien et le
rétrocontrôle:
Le système hypothalamo-hypophysaire commande
l'activité des ovaires (54). L'hypothalamus
sécrète la gonadolibérine ou la GnRH qui stimule
l'hypophyse antérieure
(34). La réponse de cette dernière
au stimulus hypothalamique se fait par la sécrétion des hormones
gonadotropes LH et FSH (08), (54).
Au niveau des ovaires, la LH et la FSH induisent le
développement de la thèque du follicule ainsi que la production
de l'oestrogène seulement ou avec la progestérone si
c'était un corps jaune (34).
La sécrétion de LH n'est pas un
phénomène continu de même pour la GnRH qui le conditionne,
c'est plutôt sous forme de pulsation. Chaque pulse est le résultat
d'une stimulation des cellules hypophysaires par la GnRH.
La FSH est sécrétée d'une manière
plus complexe que la LH, même s'il est possible d'identifier quelques
pulses dans une série chronologique, la liaison n'est pas aussi
étroite avec la GnRH, et la FSH est sécrétée
plutôt de façon continue qu'épisodique
(54).
La sécrétion de l'oestradiol prévient
l'hypothalamus qu'il doit intensifier la libération de la GnRH. A son
tour, l'hypophyse renforce la production de LH et FSH. Il arrive un moment
où ce renforcement mutuel (oestradiol-GnRH-FSH et LH) aboutit à
une telle montée que l'ovulation se produit (voire figure 6).
La progestérone freine la sécrétion de
GnRH d'où diminution des taux de FSH et LH. Lorsque le corps jaune
régresse (34), la chute du taux progestéronique
enclenche un nouveau cycle (08). Par contre, s'il y a
fécondation, l'embryon produit une hormone d'effet comparable à
LH: le corps jaune est stimulé et devient gestatif. Au bout d'un mois
c'est le placenta qui prend le relais des ovaires en sécrétant la
progestérone et l'oestrogène (34) (voire figure
6).

Cortex
Stimuli externes
Hypothalamus
Hypophyse
(-)
(-)
PRL
FSH
LH
Ovaire
Follicule
Ovulation
C. jaune
Lutéolysine
PgF2á
O
V
I
D
U
C
T
E
U
T
E
R
U
S
Vagin
(-)
O
E
S
T
R O G E N E
S
Figure 6 : Régulation neuro-hormonale du
cycle sexuel des mammifères (brebis) (32).
P
R O G E
S
T E R O N E
2. 7. Les hormones gonadiques:
Les ovaires commandent la physiologie des organes génitaux
et tout particulièrement la préparation à la gestation
(12).
Les hormones de l'ovaire sont:
Les oestrogènes sont des facteurs
lutéotrophiques (32) sécrétés par
le follicule (26), (32) (oestradiol,
oestrone), par le placenta (oestriol) (32) mais aussi par le
cortex surrénalien (26), (32). Leur
sécrétion est sous le contrôle direct de la
pulsatilité de la LH.
L'oestradiol 1 7béta est la principale hormone
sécrétée par le follicule (32),
(54). Les différentes actions connues de cette hormone
sont les suivantes :
a) Induction du pic préovulatoire de LH et de FSH au
début de l'oestrus, par la mise en jeu d'une rétroaction positive
sur l'axe hypothalamo-hypophysaire;
b) Déclenchement direct du comportement sexuel femelle
avant l'ovulation (54).
c) Modification de l'activité des cellules
utérines pour faciliter le transport des spermatozoïdes
(54), par l'augmentation de nombre de contractions
utérines en direction de l'oviducte (32), et
préparer l'utérus à l'action de la progestérone;
d) Contrôle de la synthèse et la libération
de la prostaglandine F2á par l'utérus, avant la
lutéolyse;
e) Rétroaction négative sur l'axe
hypothalamo-hypsophysaire (en dehors de la période
préovulatoire);
f) Les effets sur la glande mammaire en fin de gestation
(54) qui entraînent la croissance du système
canaliculaire et la prolifération du stroma de la glande
(26), (32), ce qui conduit à la mise
en route de la production lactée après la parturition
(54);
g) Effets généraux positifs sur le
métabolisme qui facilitent la croissance corporelle
(54).
Le sulfate d'oestrone est quantitativement le principal
oestrogène présent dans la circulation maternelle durant la
gestation. Au début, il provient des ovaires. Il est ensuite produit par
le placenta, surtout pendant les deux derniers tiers de la gestation. Selon
certains auteurs, Illera et alle dosage de cette hormone pourrait
offrir un intérêt pour prédire le nombre de foetus, mais
cela reste à confirmer (31), (39).
La progestérone est élaborée par le corps
jaune (26), (32), (54) la
corticosurrénale (26) et par le placenta pendant la
gestation (26), (32). Sa
sécrétion est sous le contrôle de la LH; ses effets connus
sont les suivants :
a) Blocage des ovulations cycliques par
rétroaction négative sur l'axe hypothalamohypophysaire;
b) Sensibilisation du système nerveux à l'action
des oestrogènes pour l'induction du comportement d'oestrus;
c) Préparation de l'utérus à l'implantation
de l'embryon (54);
d) Maintient la gestation (31),
(32), (39);
e) Développement de la glande mammaire pendant la
gestation (54) en provoquant, en association avec les
oestrogènes, la prolifération du système
lobulo-alvéolaire (26), (32);
f) Augmente la sécrétion de prolactine en
diminuant la libération de PIH (32).
Les androgènes sont sécrétés par
les cellules du hile de l'ovaire et rentrent dans la biosynthèse des
hormones ovariennes stéroïdes (32). Ils sont
représentés principalement par l'androstènedione
(69) qui est transformée en testostérone pour
ensuite être aromatisée en 17 bêta oestradiol dans les
cellules de la granulosa du follicule sous l'action de la FSH
(01). L'androstènedione est impliquée dans
l'atrésie folliculaire (69).
L'inhibine synthétisée par la granulosa
(06). Sa production s'élève lors de la
maturation folliculaire mais moins nettement que l'estradiol
(07). Son effet est inconnu, mais on lui attribue cette
dénomination en raison de la rétroaction négative sur la
sécrétion de la FSH (01).
La relaxine est une hormone polypeptidique extraite du corps
jaune ovarien (06), (32), elle a comme
rôle :
a) Dans la parturition en relâchant les ligaments
pelviens.
b) Provoque l'inhibition des contractions utérines.
c) Agit en synergie avec l'oestradiol et la progestérone
sur la croissance de la glande mammaire (32).
2. 8. Autres substances et hormones:
2. 8. 1. La leptine:
Hormone sécrétée par le tissu adipeux,
agit par l'intermédiaire de récepteurs disséminés
dans l'organisme (65). Chez les ovins ces récepteurs
spécifiques existent dans l'hypothalamus et l'hypophyse
(28), (67). Son rôle est d'informer
l'organisme sur le niveau de ses réserves lipidiques
(10), dans la satiété, l'équilibre
énergétique et la thermorégulation. Elle tient une place
centrale dans le développement et la régulation de la
reproduction. Dans l'hypothalamus, elle règle la sécrétion
pulsatile de la LHRH, dans l'hypophyse elle module la sécrétion
des gonadotrophines ; elle agirait aussi directement

sur les gonades. Elle contribue largement au contrôle de
l'ovulation, informant l'axe
hypotha
pour me
e
Figure 7 : Hypothèses sur des boucles
de régulation par lesquelles la leptine pourrait moduler la
fonction
de reproduction (65).
2. 8. 2. L'hormone lactogène placentaire
(OPL):
L'hormone lactogène placentaire (oPL: Ovine Placental
Lactogenic Hormone) appelée aussi hormone chorionique somatomammotrope
ovine (oCS) est sécrétée par le trophoblaste dès
l'apparition des cellules mono et binucléées à partir du
16ème ou 17ème jour de gestation. Elle est
déversée dans la circulation maternelle à partir du
40e-50e jours de gestation (31),
(39) et intervient dans le développement du foetus et dans
l'activité des glandes mammaires (31),
(32), (39).
2. 8. 3. La noradrénaline:
C'est une neurohormone (26). Elle peut
stimuler la synthèse de la mélatonine par l'intermédiaire
de récepteurs adrénergiques (16) et pourrait
être impliquée dans l'établissement du
rétrocontrôle négatif de la sécrétion de LH
par l'oestradiol lors de l'exposition à des jours longs.
2. 8. 4. Acides aminés excitateurs:
Les acides aminés excitateurs tels que les acides
aspartique et glutamique causent une libération massive de LH quand
l'activité gonadotrope est inhibée par le photopériode. A
l'opposé, la libération de LH induite par ces acides
aminés est faible ou inexistante quand l'activité gonadotrope est
élevée (25), (56).
2. 8. 5. Les hormones thyroïdiennes:
Des brebis thyroïdectomies ne montrent plus de variations
saisonnières d'activité sexuelle ou de sécrétion de
LH. L'administration de T4 (Thyrosine) annule les effets de la
thyroïdectomie en rétablissant l'inhibition de la
sécrétion de LH au moment normal de la fin de la saison sexuelle.
Le mécanisme intime n'est pas encore élucidé
(25), (56).
2. 8. 6. Hormone (ou protéine) spécifique
de la gestation:
Elles sont synthétisées très tôt
par les cellules binucléées du trophoblaste du placenta
(24), (31), (39). Elles sont
détectées dés le 15ème jour pour la PSPB
(Pregnancy Specific Protein B) (24) ou le
22ème jour pour la PAG (Pregnancy Associated Glycoprotein)
après la fécondation (24),
(31), (39).
2. 8. 7. La prostaglandine:
La PgF2á de faible poids moléculaire (environ
300 Daltons) n'est pas un stéroïde, mais un dérivé de
l'acide arachidonique. Elle est sécrétée par
l'utérus, en réponse aux pulses d'oestradiol provenant de
l'ovaire, lors de la lutéolyse. Elle est responsable de la disparition
du corps jaune à la fin du cycle, si la femelle n'est pas gestante
(54).
2. 8. 8. L'oestradiol 175:
L'oestradiol 175 et d'autres oestrogènes ainsi que la
progestérone sont également sécrétés par
l'unité foeto-placentaire (54).

4fiRE:
i! à
firl'
. ,
3. La physiologie de la reproduction:
3. 1. Le déroulement de la
gamétogenèse chez la brebis:
Les ovocytes sont entourés de quelques cellules
aplaties ; l'ensemble est enclos dans une membrane et constitue le follicule
(primordial) entité physiologique et anatomique qui implique donc
toujours la présence d'un ovocyte (14).
3. 1. 1. Ovogenèse:
3. 1. 1. 1. Définition et
étapes:
L'ovogenèse est l'ensemble des processus qui
transforment la cellule germinale initiale ou ovogonie, diploïde (2n
chromosomes), en une cellule apte à être fécondée,
l'ovocyte, (ovocyte secondaire ou ovule), haploïde (n chromosomes).
Ce processus est discontinu, il débute au cours de la vie
foetale et se termine à la sénilité
(44).
La maturation de l'ovocyte comprend quatre étapes
distinctes relativement indépendantes (14):
a) La croissance de l'ovocyte: Au cours de
la phase de maturation, les gonies souches subissent plusieurs mitoses
équationnelles et donnent les ovogonies (26) au
début du stade de la gonade différenciée
(32). Pendant la période d'accroissement, celles-ci se
transforment en ovocytes de 1èr ordre à 2n chromosomes
(26). La croissance de l'ovocyte débute en même
temps que la croissance du follicule quand celui-ci échappe à la
réserve des follicules primordiaux. Cette croissance est d'abord rapide
et parallèle à la croissance folliculaire, puis, tandis que
s'accélère la croissance folliculaire avec apparition de
l'antrum, celle de l'ovocyte se poursuit plus lentement.
C'est par l'intermédiaire des cellules du cumulus que
l'ovocyte reçoit les éléments nécessaires à
sa croissance. Cet apport est favorisé par l'existence de prolongations
de certaines de ces cellules péri-ovocytaires qui s'accrochent à
l'ovocyte.
Pendant la période de croissance rapide de l'ovocyte se
forme la membrane pellucide (14).
b) La constitution des réserves d'ARNs :
Au cours de la phase de maturation folliculaire se produit dans
l'ovocyte une synthèse de protéines et d'acides
ribonucléiques, ce qui augmente leur teneur en ribosomes et en ARN
(26). L'ovocyte synthétise et accumule des ARNs qui
serviront au cours de la fécondation et au début du
développement avant que ne s'exprime le génome du zygote. On ne
sait pas si les synthèses des différents ARNs sont
modulées par les gonadotropines ou les stéroïdes
(14).
c) La reprise de la méiose (maturation
nucléaire) : C'est dans le follicule tertiaire que se produit
la maturation de l'ovocyte. Elle commence par une mitose équationnelle,
au cours de laquelle est éliminé le premier globule polaire qui
va subir une nouvelle division (26). Aussitôt
après, commence la mitose réductionnelle destinée à
réduire de moitié le nombre des chromosomes. Au moment de
l'ovulation, l'ovocyte de 2ème ordre est au stade de la
métaphase (32) (voire figure 8).
Cette reprise spontanée de la méiose n'est
possible qu'à partir d'un certain état de développement de
l'ovocyte correspondant grossièrement à la formation de l'antrum.
La granulosa pendant toute sa croissance exerce un effet inhibiteur sur
l'ovocyte, la reprise de la méiose témoigne une suppression de
cet effet après la décharge ovulante (14).
d) Transformation finale de l'ovocyte (maturation
cytoplasmique): La membrane pellucide subit une transformation qui ne
peut se produire que dans le follicule pour être digérable par les
enzymes de l'acrosome du spermatozoïde. l'ovocyte doit avoir un facteur
qui permet la transformation de la chromatine spermatique. La maturation
cytoplasmique est tardive, elle est 14 heures après la décharge
ovulante, donc elle se produit sensiblement après la rupture de la
vésicule germinative (14).
La formation de 2ème globule polaire a lieu
environ quatre heures avant l'ovulation (32) au cours des
mitoses de la maturation. Il semble avoir pour but d'éviter les pertes
de réserves nutritives. Les deux globules polaires sont en somme des
ovocytes rudimentaires incapables de se développer
(26).

Figure 8: Ovocyte 2ème ordre
(58). Photo 3 : Ovocyte
2ème ordre (58).
3. 1. 1. 2. Régulation de la maturation de
l'ovocyte:
La maturation complète n'est pas observée
après culture d'ovocytes isolés en présence de LH, de FSH
ou de prolactine. On peut affirmer que contrairement aux
Vertébrés inférieurs, la progestérone n'intervient
pas.
Chez la brebis, pour les ovocytes maturés in vitro dans
leur follicule, l'addition d'estradiol à la culture entraîne une
augmentation du pourcentage de blastocytes normaux et de jeunes à terme.
Or ces stéroïdes sont représentatifs du contenu folliculaire
au moment de la maturation ovocytaire (14).

Les gonies souches.
Les ovogonies.
Ovocyte de 1er ordre.
Ovocyte de 2ème ordre.
Ovule.
2n 2n 2n 2n
n
2n
n
2n
2n
2n
2n
2n
Globule polaire.
Des globules polaires à n chromosomes.
Figure 9: Schéma récapitulatif
du déroulement de l'ovogenèse (Lamotte) (32).
3. 1. 2. Folliculogenèse:
3. 1. 2. 1. Définition, notions et
étapes:
La folliculogenèse est un phénomène continu,
s'étend depuis la sortie du follicule primordial de la réserve
jusqu'à sa rupture au moment de l'ovulation (06) (voire
figure 10).
Avant d'aborder les différentes étapes que passe le
follicule primordial, nous tentons de définir quelques notions relatives
à la folliculogenèse.
· Notion d'une vague folliculaire: La vitesse de
croissance des follicules n'est pas constante, car la courbe de distribution de
taille de tous les follicules d'un ovaire à un instant donné
montre plusieurs maximums (classes), d'où la notion de vagues
folliculaires (14).
· Notion de recrutement: C'est l'entrée en
croissance terminale de groupes de follicules gonadopépendants.
· Notion de sélection: C'est un processus par
lequel parmi les nombreux follicules recrutés, seul un nombre de ces
derniers arriveront au stade préovulatoire. Il correspond à la
taille où apparaissent les récepteurs en LH sur la granulosa.
· Notion de dominance: Correspond à la
régression des follicules en croissance (recrutés) et le blocage
du recrutement d'autre follicules. Ces deux effets sont exercés par le
follicule dominant.
· Notion de pulsatilité: Elle se définit
comme étant un épisode de libération hormonale dans le
sang durant un temps très bref; caractérisé par un
monté rapide des concentrations suivie d'une diminution de type
exponentiel (06).
Quand un follicule s'échappe de la réserve des
follicules primordiaux et commence sa croissance, celle-ci continuera
jusqu'à ce que le follicule subisse l'atrésie ou ovule
(14).
a) Follicule primordial: À la
naissance la femelle possède des follicules primordiaux
(26). Ils sont très petits, se trouvent à la
périphérie de l'ovaire. Leurs noyaux sont appelés:
vésicules germinatives, et on observe une polarisation des organites :
noyau vitellin de Balbiani (44). Chaque follicule primordial
est formé d'un ovocyte entouré dans une seule couche de cellules
épithéliales (26).
b) Follicule primaire: L'ovocyte est de plus
grande taille (07). Le follicule primaire montre une perte de
la polarisation, et l'apparition des granules corticaux. Il y a synthèse
d'ARNm et d'ARNr et début de sécrétion de la zone
pellucide qui est constituée de glycoprotéines
(44). Il y a aussi l'apparition des récepteurs à
FSH, ceux spécifiques à l'oestradiol au niveau de la granulosa et
des récepteurs aux endogènes. Des jonctions perforées
apparaissent. Ces modification ne sont pas sous la dépendance de la
sécrétion de FSH ni celle de LH (07).
c) Follicule secondaire: Il est
entouré de plusieurs couches cellulaires folliculeuses
(26), leurs mitoses sont intenses (44). Il
est nommé aussi «follicule à antrum»
(07). L'antrum est un liquide sécrété par
les cellules de la granulosa. Il renferme des protéinases et des
peptidases qui jouent un rôle important dans l'ovulation
(26). Cette étape se caractérise par une
accumulation de réserves cytoplasmiques et un début de
constitution de la thèque interne (44).
Quelques observations permettent de penser qu'au cours de la
première étape (avant la formation de l'antrum), le
déterminisme de la croissance est surtout intra-ovarien, alors qu'au
cours de la seconde (à partir de la formation de l'antrum jusqu'à
l'ovulation), il est surtout gonadotrope (14).
d) Follicule tertiaire ou dominant: Il y
avait un accroissement du nombre des couches cellulaires: en dedans, les
cellules de la granulosa qui sécrètent le liquide folliculaire
(26) (riche en acide hyaluronique à ce stade) dans de
petites cavités (44) ; en dehors, la couche
cellulo-vasculaire des thèques folliculaires (26). La
thèque externe se constitue (44). Un massif cellulaire
qui entoure l'ovocyte: le cumulus oophorus, ce massif reste
accolé à la granulosa (14).
Le follicule dominant sécrète l'oestradiol et
il exerce une action inhibitrice au niveau du reste du parenchyme et sur
l'ovaire controlatéral. Les autres follicules secondaires subissent une
atrésie (07).
e) Follicule préovulatoire : Les
mitoses diminuent au niveau des cellules folliculeuses. Le follicule s'approche
de l'apex (surface de l'ovaire). Les thèques s'amincissent et les
cellules du cumulus oophorus commencent à se dissocier
(44).
f) Follicule de De Graaf: C'est un follicule
mûr qui subit plusieurs modifications parmi elles : augmentation de
volume et disparition des mitoses (07). L'ovocyte n'est
entouré que d'une seule couche de cellules folliculeuses : la corona
radiata (44). La thèque externe à
prédominance fibreuse (comprenant des fibres conjonctives, des cellules
mésenchymateuses et des vaisseaux) est très mince. La
thèque interne est une glande endocrine à prédominance
cellulaire, contenant des capillaires et des cellules thécales
stéroïdogènes (32). Le follicule de De
Graff, réceptif aux hormones sexuelles de l'hypophyse, peut alors
devenir sécrétoire (06).
g) Les follicules atrésiques:
L'évolution d'un follicule à antrum en follicule
ovulatoire ne se réalise que pour un petit nombre; dans la
majorité des cas, il devient une structure
dégénérative non fonctionnelle: le follicule
atrésique.
Les follicules atrésiques ne secrètent plus
d'hormones. Il ne faut pas confondre l'atrésie avec la
dégénérescence qui atteint les follicules primordiaux
avant la naissance (06).

Figure 10 : Schéma de
l'évolution d'un follicule du stade primordial au stade ovulatoire
« DE GRAFF » en
passant par le stade primaire, secondaire et
tertiaire (20), (32).
3. 1. 2. 2. Régulation de la croissance du
follicule:
La FSH induit le recrutement mais la présence d'un
niveau basal de LH est indispensable (06), elle active la
division des cellules folliculeuses et la croissance de
l'épithélium germinatif (26), ainsi que la
sécrétion des oestrogènes par l'ovaire
(12). In vitro, elle stimule la multiplication des cellules de
la granulosa et la formation de l'antrum. Les oestrogènes stimulent
aussi la multiplication des cellules de la granulosa mais pas la formation de
l'antrum. Donc la croissance folliculaire normale implique la présence
de l'estradiol et de FSH (14). La FSH induit l'apparition des
récepteurs à la LH sur les membranes cellulaires
(06).
Par opposition, la LH ne stimule ni les multiplications
cellulaires, ni la formation de l'antrum des follicules en croissance. Elle
freine même l'activité mitotique des cellules de la granulosa. Par
contre, elle permet la différenciation des cellules de la thèque
interne en cellules stéroïdogènes (14), et
son action entraîne une réduction de l'aromatisation des
androgènes en oestrogènes (06). La LH provoque
la rupture du follicule et la formation du corps jaune et stimule la
sécrétion de la folliculine par la thèque (12)
(voire figure 11).
Cette action spécifique des deux gonadotropines
s'explique bien par la présence de récepteurs à LH mais
pas à FSH sur les cellules de la thèque, et inversement de
récepteurs à FSH et non à LH sur les cellules de la
granulosa des petits follicule à antrum.
Les récepteurs à FSH existent très
tôt. Or, Au cours de la croissance du follicule des récepteurs
à LH apparaissent sur les cellules de la granulosa sous l'effet de la
FSH. Ainsi la FSH et la LH exercent leur action d'abord et respectivement sur
la granulosa et sur la thèque.
Il paraît exister une perméabilité
différentielle du follicule à FSH et LH. Si la LH
pénètre prématurément, la croissance de la
granulosa est freinée et le follicule est appelé à
dégénérer (14).

Figure 11 : L'évolution des
concentrations des hormones hypophysaires au cours du cycle sexuel de
la
brebis (15), (37).
3. 2. La puberté:
La puberté (du latin puber, provenant lui-même de
pubes, poil) est la période de la vie marquée par le début
d'activité des gonades et la manifestation de certains caractères
sexuels secondaires (32). On la définit aussi comme
étant l'âge où la femelle devient apte à produire
des gamètes féconds, c'est les premières chaleurs chez la
brebis (15).
3. 2. 1. Déclenchement de la
puberté:
La puberté se manifeste entre le
5ème (15) ou 6èmemois
(34), (37), (43) et le
9ème (34), (39) ou le
10ème mois (37), selon les races.
L'apparition des chaleurs sont en fonction de : mois de naissance, la race, la
température (15), le poids (15),
(37), (43), qui correspond 40 à 60%
(43) du poids adulte (37) et l'environnement
(15).
La puberté se caractérise par un ensemble de
manifestations qui ont pour origine les sécrétions d'hormones
sexuelles (l'oestradiol) (34). Le facteur essentiel du
déclenchement de la puberté est la mise en route de l'axe
hypothalamo-hypophysaire qui sécrète alors des
quantités importantes d'hormones gonadotropes
(32). L'âge de la puberté ne signifie pas
l'âge de la mise à la reproduction qui est entre le
10ème et 15ème mois (34)
(voire figure 12).
Si l'âge de puberté est atteint pendant
l'automne, les agnelles viendront en chaleurs mais cette première saison
sexuelle est très courte. S'il est atteint au printemps, les agnelles ne
viendront pas en chaleurs (anoestrus saisonnier), il faudra attendre la saison
sexuelle suivante pour les voir venir en chaleurs (37).

Epiphyse
(-)
Hypothalamus
Afférence
nerveuses
Oestrogènes
Hypothalamus
+
Animal impubère
Corticosurrénale
Androgènes
Hypothalamus
Comportement
sexuel
Figure 12 : conditionnement neuro-hormonal de la
puberté chez la femelle (32).
(-)
P
R
O
G
E
S
T E R O N E
Animal prépubère
Animal pubère
OVAIRE
Follicule
FSH/LH
Hypophyse
C. jaune
LH/PRL
H.Hypothalamiques
Ovulation
O
E
S
T
R O G E N E
S
(-)
Carat. Sexuels
I. II et III
Fonctionnt cyclique type somatique femelle
3. 2. 2. L'ovulation:
C'est un phénomène mécanique de rupture
de la paroi folliculaire qui est déclenché par le pic de LH
(06). Cette décharge ovulante est suivie d'un
changement profond de la stéroïdogenèse et d'une
élévation de la synthèse des prostaglandines dans le
follicule. L'inhibition de la synthèse des stéroïdes ou des
prostaglandines (par l'indométhacine) empêche l'ovulation
(14). Cette dernière se produit brutalement
(12), sous la pression du liquide folliculaire
(05), (06), (12) et par
suite de l'activation d'une enzyme protéolytique située dans la
paroi (sous l'influence de la FSH et de la LH) (12). La
progestérone est nécessaire à la rupture du follicule
(14). Le follicule de De Graff s'ouvre en un point: le stigma
(05), et il y a libération d'un ovocyte de
2ème ordre bloqué en métaphase de
deuxième division méiotique (05),
(18).
L'ovulation est spontanée chez la brebis
(21), elle est simple ou multiple (34) et
libère 1 à 3 ovocytes. Elle se produit dans la
2ème moitié de l'oestrus entre la
20ème (18), (43) et la
30ème (43) ou la 40ème
heure après le début de rut. L'ovule non fécondé se
dégénère au niveau de l'oviducte (18).
Certains auteurs ont fait quelques remarques sur l'ovulation chez
la brebis:
Il n'y a pas de corrélation entre le début de
l'oestrus et le moment de l'ovulation;
Bien que l'ovulation soit spontanée chez la brebis, elle
est hâtée par l'accouplement qui en plus augmente le taux
d'ovulation;
L'injection intraveineuse de 800 U.I. d'hormone gonadotrope
H.C.G. (Human Chorionic Gonadotropin) juste au début des chaleurs
produit l'ovulation régulièrement 24 heures plus tard
(18).
3. 2. 3. L'ovulation silencieuse:
L'ovaire peut être actif, mais on n'observe pas
d'extériorisation du comportement des chaleurs (15),
cela pose un problème dans les élevages extensifs, à
l'aire libre (26). La majorité des brebis ovule dans
les 6 jours qui suivent l'introduction des mâles mais la première
ovulation est souvent silencieuse (01). Des techniques
appropriées permettent de stimuler l'extériorisation des chaleurs
sont :
Le flushing: Suralimentation énergétique
momentanée (voir le chapitre quatre); Le stress : transfert d'animaux
(transhumance par exemple);
L'effet bélier (voir le quatrième chapitre)
(15).
3. 3. Le cycle sexuel de la brebis:
3. 3. 1. Définition:
Pendant la saison de reproduction, l'activité sexuelle
se manifeste par le fait que les brebis viennent régulièrement en
chaleurs. L'intervalle entre chaleurs constitue le cycle sexuel (37)
qui comprend le cycle ovarien et le cycle oestrien. Ce dernier
correspond à l'intervalle entre deux oestrus (06) ou
entre deux périodes de chaleurs consécutives (15)
; avec l'ensemble des phénomènes qui l'accompagnent
(12): les transformations périodiques des organes
génitaux de la femelle qui influencent profondément sur tout
l'organisme et en particulier sur le comportement et le métabolisme de
l'animal (26).
Les agnelles commencent à avoir des cycles à la
puberté, se poursuivent tout au long de la vie génitale et ne
sont interrompues que par la gestation (32). Ces cycles durent
en moyenne 17 jours (01), (15),
(21), (26), (34), avec une
variabilité de 14 à19 jours (01). Les chaleurs
sont assez longues de 2 à 3 jours (34). Cependant, en
période de transition entre l'anoestrus et la saison sexuelle (à
la fin de l'été), des cycles courts de moins de 12 jours sont
fréquemment observés (01).
3. 3. 2. Les différentes phases:
3. 3. 2. 1. La phase folliculaire ou la phase
oestrogénique:
Le prooestrus:
Il dure 3 à 4 jours (01), (37)
et représente la période de transition entre la fin d'un
cycle et le début du cycle suivant (06)
L'état de l'ovaire: A ce stade, un ou
plusieurs follicules sont en voie de maturation sous l'influence de FSH et de
l'ICSH (26).
L'état de l'utérus: Sous
l'influence des quantités importantes d'oestrogènes produites par
l'épithélium folliculaire à la fin du prooestrus, les
glandes utérines prolifèrent et le volume de l'utérus
augmente (phase de prolifération où l'utérus
s'hypertrophie (06) due à la congestion
(06), (32) et à une imbibition
oedémateuse de la muqueuse (06),
(26)). Les cornes sont rigides et épaisses et le col
congestionné et humide (32).
Le comportement : - Rien à signaler -
L'oestrus (ou chaleurs):
Le passage de la phase de prooestrus à l'oestrus est
lié à une production suffisante de gonadotrophines
antéhypophysaires (26).
C'est la période pendant laquelle la femelle accepte le
chevauchement, elle est hormonodépendante (21). La
durée de l'oestrus varie avec l'âge de l'animal (plus longue chez
les adultes que chez les antenaises et les agnelles), la race (les races
prolifiques ont des chaleurs plus longues), la saison (maximum en
october-november), le climat (les températures élevées
sont défavorables), l'alimentation (flushing) (15), le
taux d'ovulation, la présence du mâle (21), les
individus (34), le statut physiologique (lactation) et
l'état corporel (01).
La durée des chaleurs varie de 18 à 72 heures
(01), elles peuvent durer plus longtemps en cas d'ovulation
double ou multiple (26) et se manifestent en plus grand nombre
de minuit à midi que de midi à minuit (18).
L'ovulation survient 24 heures après le pic de LH
(21).
La détection des chaleurs est très difficile
chez l'espèce ovine (01), (15) puisque
les manifestations de l'oestrus sont peu visibles et passent facilement
inaperçues (26), elle nécessite absolument le
bélier (34).
L'état de l'ovaire: Présence de
follicule de De Graaf (1 à 1,3 centimètres de diamètre)
(32). En général 1 à 7 follicules
arrivent à maturité à chaque cycle
(26).
L'état de l'utérus: L'oviducte
entoure étroitement l'ovaire avec son infundibulum. La
sécrétion maximale de l'oviducte et de l'utérus
après le début de l'oestrus coïncide avec le moment de
l'ovulation (32). La muqueuse est très
oedématiée, congestionnée (06),
(12) et quelque fois des petites hémorragies se
produisent (hémorragies oestrales) (26);
l'activité électro-physio logique du myomètre est maximale
et le col est ouvert pendant peu de temps (32).
L'état de vagin: Il est
congestionné (15). Le mucus cervico-vaginal (la glaire)
est abondant et filant avec une faible viscosité (32)
et sort par la vulve (15).
Le comportement: Excitation,
agressivité. La recherche et l'acceptation du bélier sont
beaucoup plus constatées chez les brebis que chez les agnelles,
d'où l'intérêt qu'il y a séparation entre les brebis
et les agnelles pour la lutte (34). Il y a une baisse de la
production
laitière (15). La tête est
tournée vers le mâle si celui-ci se trouve derrière elle ;
des bêlements plus fréquents si le mâle est absent
(36). La brebis va présenter des mouvements rapides de
la queue (01), (36) et elle reste immobile au
chevauchement (01).
3. 3. 2. 2. Phase lutéale ou la phase
progestéronique:
Cette phase dure de 14 à 16 jours. L'ovocyte se trouve
dans l'oviducte où aurait lieu la fécondation
(07). Dans ce cas le corps jaune persiste tout en produisant
constamment de la progestérone (15).
Le métoestrus ou post-oestrus:
Une transformation métaplasique des follicules rompus en
corps jaune fonctionnel se produit (32). Elle dure 2 jours
(32).
L'état de l'ovaire: Début du
développement du corps jaune non décelable à la palpation
(32), et son fonctionnement (12). Les
concentrations élevées de progestérone inhibent
l'ovulation (21), (26) et empêche la
maturation de nouveaux follicules (26) mais n'arrêtent
pas la croissance folliculaire (21).
L'état de l'utérus: Un
développement non considérable des invaginations glandulaires de
l'endomètre. Le myomètre est au repos (32) suite
à l'action de la progestérone qui diminue son tonus et sa
sensibilité à l'ocytocine (26).
L'état de vagin: Le mucus
cervico-vaginal est visqueux et compact. Les cellules cornifiées et les
cellules squameuses sont rares (32). Le développement
des glandes et la kératinisation sont plus marquées que chez la
vache (18).
Le comportement: La femelle retrouve son calme
(33).
Le dioestrus ou anoestrus:
C'est la période de régression du corps jaune
(05) c'est-à-dire la période de repos sexuel qui
correspond à la lutéolyse. Elle est de 10 à 12 jours
(32).
L'état de l'ovaire : Présence
d'un ou plusieurs corps jaunes (1 centimètre de diamètre)
L'état de l'utérus: Une
régression marquée de l'endomètre, de ses glandes et ses
cryptes (18), (32). Le col est fermé
(33) et devient un milieu défavorable pour les
spermatozoïdes (18).
L'état de vagin: Le mucus est
caséeux et épais. Les neutrophiles sont abondantes
(32). La muqueuse vaginale est pâle
(06).
Le comportement: La femelle refuse le mâle
(33).
Le corps jaune:
La formation: Le follicule rompu est le
siège des remaniements cytologiques et biochimiques
(06), c'est la lutéogénèse (08)
qui conduit à la formation du tissu lutéal
(06). Ce dernier se constitue à partir des cellules de
la granulosa qui sécrétaient principalement l'oestradiol et de la
thèque interne qui sécrétait la progestérone
(14). La constitution du corps jaune est rapide
(18), voire extrêmement rapide et linéaire du
2ème au 1 2ème jour, et ceci est dû
à une hyperplasie et une prolifération importante des petites et
grandes cellules lutéales (20) ; et il peut prendre des
formes très différentes (18).
Dans un premier stade, il se produit des petites
hémorragies et la cavité folliculaire se remplit de globules
rouges; puis les cellules de la granulosa entrent en prolifération et
édifient le corps jaune caractérisé par la présence
dans ses cellules d'un pigment jaune : la lutéine
(26).
La période de croissance du corps jaune est suivie d'une
période du maintien de son activité et enfin de la
lutéolyse (06).
La fonction: Le corps jaune de la brebis
atteint son activité sécrétoire maximale et son
développement maximal en 6 jours (18) ou aux alentours
du 6ème au 8ème jour du cycle oestral
(20), et continue de sécréter de la
progestérone (08), (14),
(20), (26), jusqu'au 15ème
jour (20). Si la brebis devient gestante, le corps jaune
persistera tout au long de la gestation (20). Le principal
effet de la progestérone est de provoquer la phase de
sécrétion de la muqueuse utérine et de la préparer
à la nidation et à la nutrition de l'oeuf fécondé
(26).
La lutéolyse: Elle est sous la
dépendance de deux facteurs principaux, PGF2á et l'estradiol
(14). Cependant, en absence de fécondation, du fait de
la baisse du taux de la progestérone plasmatique et sous l'action d'un
facteur lutéolytique: la prostaglandine F2á endométriale;
le corps jaune régresse et devient une masse fibro-hyaline
appelée: corpus
albicans (un corps fibreux blanchâtre) qui semble jouer
aucun rôle (08). C'est l'oestradiol qui stimule la
sécrétion de PGF2á par l'endomètre
préalablement soumis à l'action de la progestérone
(14).
La lutéolyse se réalise selon plusieurs
modalités : indirectement, l'ocytocine et la PGF2 ovarienne
entraînent une vasoconstriction provoquant une ischémie du corps
jaune. Directement, la PGF2á endométriale se fixe sur les
récepteurs dans le corps jaune, elle diminue l'action lutéotrope
de la LH par blocage de l'activité adenyl-cyclase et entraîne
l'augmentation du Ca++et l'activation de la
phosphocréatinine-kinase (06).
Finalement, la lutéolyse doit être divisée
en deux séquences: la chute de la sécrétion de
progestérone (lutéolyse fonctionnelle) et la destruction de la
structure lutéale (lutéolyse structurale)
(14).
Les anoestrus:
Anoestrus saisonnier:
L'activité sexuelle est saisonnière et se
manifeste lorsque la durée du jour diminue. La période de
reproduction atteint son maximum en septembre-octobre mais sa durée
varie fortement selon les races et la latitude. Le reste de l'année
(période de jours longs) l'activité sexuelle est faible ou nulle
; c'est l'anoestrus saisonnier.
Il y a des races dont l'anoestrus saisonnier est long et
marqué (Texel, Suffolk, le bleu du Maine, le charolaise, rouge de
l'Ouest...) et des races dessaisonnées qui ont une saison sexuelle plus
longue (Ile-de-France, la Mérinos, le berrichon du cher ...).
Pour une même race, les agnelles ont une saison sexuelle
plus courte que celle des antenaises et des adultes (15),
(64).
Anoestrus de post-partum et de lactation:
Après la mise bas, l'ovaire est au repos sexuel.
L'involution utérine est de 40 à 50 jours, donc il faut compter
en moyenne un mois avant l'apparition des premières chaleurs (qui ne
sont pas suivies d'une fécondation), c'est l'anoestrus de
post-partum.
Au cours de la lactation, la brebis ne présente aucune
manifestation oestrale, c'est l'anoestrus de lactation
(15).
Lorsque les agnelages ont lieu en hiver ou au printemps, les
effets de post-partum se confondent avec ceux de l'anoestrus saisonnier et il
devient donc difficile de les étudier. Lorsque les brebis mettent bas
durant la saison sexuelle, ce retard de la reprise de l'activité
ovarienne est proportionnel à la taille de la
portée. Ceci semble être en rapport avec l'intensité
d'allaitement (21).
3. 4. L'accouplement:
Au cours de coït, une quantité variable du sperme
est déposée dans la partie crâniale du vagin
(06), (24) et dans le cervix (24).
L'éjaculât est de faible volume et de forte concentration
(24), avec 1 (06) ou 3 à 4 milliards
de spermatozoïdes (38) par éjaculat dont 600
à 700 arrivent à l'ampoule. L'ovule reste fécondable
pendant 15 heures (18), soit, la potentialité vitale
est entre 11 à 24 heures (24). Le pourcentage des
ovules pondus fécondés est de 80% (38).
La remontée des spermatozoïdes dans le tractus
génital femelle est surtout facilitée par: Les contractions
musculaires du cervix, de l'utérus et de l'oviducte.
La présence de liquide utérin
sécrété par les glandes endométriales.
Et, dans une moindre mesure, par la mobilité propre des
spermatozoïdes (06).
Pendant la période périovulatoire, le col
utérin sécrète un mucus vaginal abondant qui joue un
rôle important dans le cheminement des spermatozoïdes du vagin vers
l'utérus (07).
Les gamètes mâles sont incapables de
féconder l'ovule tant qu'ils n'ont pas subi un processus appelé
capacitation. Ce dernier est induit par les sécrétions des voies
génitales femelles dans lesquelles ils doivent séjourner quelques
heurs pour que cela s'accomplisse (06). La durée de vie
d'un spermatozoïde dans le tractus génital femelle n'excède
jamais 48 heures et celle de son pouvoir fécondant est environ 30
heures.
Un oeuf met 72 heures pour parcourir l'oviducte où la
fécondation a lieu. La superovulation accélère la descente
qui ne dure alors que 48 heures (38).
3. 5. La fécondation:
C'est la fusion des gamètes mâle et femelle
après une succession d'évènements dans les voies
génitales femelles (08). Cette fusion aboutit à
la formation d'une cellule unique : le zygote (ou embryon de stade 1 cellule)
(05), (06). Elle se fait 3 à 4 heures après
l'ovulation
(24).
3. 6. La progestation:
La progestation dure environ 20 jours. Pendant cette
période l'oeuf mène une vie libre (15) tout en
effectuant une migration, une répartition dans l'utérus et une
segmentation. La
nidation ou l'implantation marque la limite entre deux phases de
la gestation: la progestation et la gestation proprement dite
(32).
Wintenberger, étudiant la descente de l'ovule
fécondé dans l'oviducte, constate que 2 heures après
l'ovulation il se trouve à la moitié ou au tiers inférieur
de l'organe, mais qu'il faut 6 à 8 heures pour qu'il atteigne la partie
inférieurs de celui-ci (vitesse moyenne 1,4 centimètres à
l'heure) où il séjourne jusqu'à la 44ème
heure. De la 49ème au 56ème heure l'oeuf
s'engage dans l'isthme et enfin à la 72ème heure il
atteint l'utérus.
Il y a dépendance entre l'état de segmentation de
l'oeuf et l'endroit qu'il occupe dans l'appareil génital femelle
(18).
3. 6. 1. La segmentation:
C'est le processus de division de l'oeuf en nombreuses cellules
(blastomères) qui forme la morula (32). Dans la morula
on distingue 2 types de cellules inégaux:
Des petites cellules à la périphérie :
Micromères.
Des grandes cellules centrales : Macromères
(08).
La morula migre vers l'utérus par trois
mécanismes à savoir les mouvements des cils de
l'épithélium tubaire, le flux du liquide péritonéal
causé par les mouvements péristaltiques de la musculeuse de la
trompe (05), (32).
Au stade blastula, les micromères ont donné une
couche périphérique, annexielle de l'oeuf (couche trophoblastique
ou trophoblaste), tandis que les macromères ont constitué le
bouton embryonnaire. A ce stade cet embryon est désigné par le
terme de blastocyste (32). Cette période de
pré-implantation dure environ 3 semaines chez la brebis
(05).
3. 7. La gestation proprement dite:
C'est l'état d'une femelle qui porte son ou ses petits
depuis la nidation jusqu'à la parturition (32) avec des
transformations intéressent non seulement le tractus génital (y
compris la mamelle) mais aussi la totalité de l'organisme
(26). La durée varie avec la race, la parité et
la taille de la portée (28), elle est en moyenne de
145-146 jours. Mais pour une même race, elle peut varier de 8 jours d'une
brebis à l'autre (38).
Nidation ou implantation:
Sur le plan anatomique, la nidation est la
pénétration active et plus au moins complète de l'oeuf
dans l'endomètre utérin préparé à cet effet
(06), et sur le plan physiologique, c'est le début des
relations privilégiées entre la mère et le foetus
(32). Elle est tardive vers le 15ème et le
17ème jours (06), (15) et
présente deux stades évolutifs :
La fixation et l'orientation du blastocyste;
L'invasion trophoblastique (32).
Avant l'implantation, le blastocyste signale sa
présence en sécrétant une substance capable
d'empêcher la lutéolyse (32) (la production de la
PGF2á). Cette substance est la trophoblastine (il y a une autre
molécule c'est la PGE2) (09).
La nidation est sous la dépendance de la
progestérone sécrétée par le corps jaune qui ne
subit pas d'involution (12) et qui bloque les contractions
intempestives du myomètre (01); ainsi la survie du
blastocyste dépend des sécrétions utérines ou lait
utérin qui contient du glutathion, de la vitamine B 12 et de l'acide
folique (05). Notons également que des carences en
vitamines A et B interdisent la nidation (32).
Remarque: Pendant les 20 jours de la vie libre de l'oeuf (la
progestation), il est vivement conseillé de renoncer à toute
intervention ou manipulation et à tout changement brusque dans la
conduite, par exemple: l'alimentation, en but d'éviter toute
mortalité embryonnaire (15).
Pendant la gestation, les enveloppes foetales se mettent en
place : l'amnios qui contient un liquide nourricier, l'allantoïde (encore
appelée la 1ère poche des eaux) dans laquelle
s'accumulent les déchets, et le chorion qui enveloppe le tout. La
membrane externe de ce dernier porte des villosités rassemblées
sous forme de cotylédons d'où l'appellation placentation
cotylédonaire (15).
Le placenta (ensemble des tissus maternels et foetaux)
(15) qu'est anatomiquement de type cotylédonaire
(cotylédons concaves. Voir la photo 1) et histologiquement
conjonctivochorial ou syndesmochorial (32) assure: la fixation
du foetus, le passage des éléments nutritifs et d'autre part un
rôle protecteur et hormonal (15) qui assurent le
maintien de la gestation et le développement du foetus
(06).
Le placenta ne laisse pas passer les anticorps
fabriqués par la mère, d'où la nécessité
absolue de faire boire le colostrum au jeune le plus rapidement possible
après la naissance (15).
3. 8. La mise bas ou l'agnelage:
Encore appelée parturition (15), elle
se produit souvent entre le 144 et 157ème jour de gestation
(26). Elle se définit comme l'ensemble des
phénomènes mécaniques et physiologiques qui ont pour
conséquence l'expulsion du ou des foetus et leurs annexes hors des voies
génitales femelles au terme de la gestation (32). Dans
ce phénomène il y a intervention de l'ocytocine, qui provoque la
contraction des muscles utérins, et la relaxine
(12).

Le déclenchement de la mise bas est conditionné
en partie par un certain état de maturité du système
endocrinien du foetus (26) surtout l'axe
hypotalamo-hypophyso-corticosurrenalien déclenchant la variation du
rapport progestérone/oestradiol (P4/E2), et par voie de
conséquence l'augmentatioostaglandines, catécholamine et
l'ocytocine (06).
Photo 4 : La brebis en instance d'agnelage se
couche par terre et regarde en l'air (45).
La parturition se déroule en trois phases:
La phase de préparation: La brebis manifeste de
nombreux signes annonciateurs de la mise bas à savoir: l'agitation,
l'inquiétude (07), (15), si elle est
en liberté elle cherche à s'isoler (07),
(15), (45) ; la perte de l'appétit
(15), la vulve est tuméfiée
(15), (26), (45), un
écoulement provenant de cette dernière se produit quelques jours
avant la parturition (45), les ligaments sarco-sciatiques
situés de chaque côté de l'attache de la queue sont
relâchés (grâce à la relaxine) (15),
(26). Des symptômes de coliques apparaissent
accompagnés de couchers et de levers et d'agitation de la queue
(07), cependant la brebis se couche en tendant le cou en
arrière pour regarder en l'air et elle se lèche les lèvres
(45) (Voir la photo 4).
La phase de contraction utérine et dilatation
cervicale: Pendant cette seconde phase, le col de l'utérus se dilate,
avant de laisser échapper les poches des eaux, qui ont pour rôle
de dilater ce col et la vulve (15) et aussi un rôle de
matelas protecteur (26). Les contractions deviennent de plus
en plue fréquentes.
La phase de préparation et la phase de dilatation durent
environ 16 heures (15).
La phase d'expulsion: Après la rupture de la
première poche (allantoïde) puis la seconde, apparaissent les
extrémités des onglons des pattes antérieures et la
tête (ou des pattes postérieurs et la queue (voir la figure 13)
(15). Sous l'action des contractions utérines,
aidées de plus en plus par des efforts de la presse abdominale
(26) l'agneau est engagé puis expulsé (selon son
poids) dans les 10 à 20 minutes qui suivent (15),
(45) (voire photo 5). En cas de gémellité le
second est expulsé 10 à 15 minutes (45) voire
même 20 minutes après le premier (07). La
rétention du placenta est rare chez la brebis (45), les
enveloppes foetales sont expulsées 1 à 3 heures après la
mise bas (07).

Figure 13 : Les déférentes
présentations lors de la phase d'expulsion (45).

Photo 5: Les déférentes
étapes du déroulement de l'agnelage (45).
3. 9. La lactation:
La mamelle de la brebis comporte deux quartiers dont chacun a
un trayon (46). La lactation c'est la période pendant
laquelle, à la suite de la parturition, la femelle allaite ses petits.
L'entretien de la sécrétion lacté résulte d'un
réflexe neuro-endocrinien:
Arc ascendant du réflexe: Excitation par la succion des
terminaisons nerveuses sensitives du trayon et transmission au système
nerveux central au niveau des noyaux para- ventriculaires et supra-optiques qui
agissent sur l'hypophyse.
Arc descendant du réflexe: L'ocytocine agit au niveau des
cellules myo-épithéliales des acini mammaires, ce qui a pour but
de provoquer la vidange de ces derniers (32).
Le lait est produit dans la mamelle à partir des
nutriments contenus dans le sang qui parcourt les vaisseaux dans chaque
quartier (46).
Dans les premiers jours qui suivent le part, la femelle
sécrète du colostrum qu'est très dense, jaunâtre,
visqueux, doué de propriétés laxatives. Par contre le
lait, qu'est le produit intégral de la traite totale et ininterrompue
d'une femelle laitière bien portante, bien nourrie et non
surmenée ; doit être recueilli proprement et ne pas contenir de
colostrum (32).
En cas d'élevage de brebis laitières, la traite
manuelle dure de 5 à 10 minutes. La mamelle doit se vider à
chaque traite, ce qui la stimule à produire plus de lait. Il faut
toujours traire l'animal au repos. Les heures qui conviennent le mieux à
la traite sont le matin, avant que l'animal ne se rende au pâturage, et
le soir. Il faut toujours traire à la même heure chaque jour
(46).
Les agneaux doivent être sevrés
précocement (46) aussitôt qu'ils commencent
à manger suffisamment d'aliments solides. Une règle pratique
consiste à sevrer les agneaux dès qu'ils atteignent 3 fois leur
poids à la naissance (47). L'allaitement doit durer un
mois et demi et les agneaux pèsent au minimum 15 à 18
kilogrammes. Les agneaux allaités artificiellement doivent être
sevrés à 45-50 jours d'âge. Les agneaux sous la mère
doivent être sevrés à 70- 80 jours d'âge
(46).
L'allaitement ralentit la reprise de l'activité
sexuelle (l'activité de l'axe hypothalamohypophysaire). Les facteurs
responsables sont mal connus, bien que la prolactine joue un rôle mais
pas seule. La stimulation mécanique du mamelon au moment de la
tétée entraîne une décharge de
béta-endorphine qui amplifie la sécrétion de la prolactine
et inhibe la décharge de LH (16).
Régulation neuro-hormonale

OEstrogène
Glande mammaire

Conduits lactifères


Vie génitale

Avant puberté

Puberté

Développement Canaliculaire

Gestation

OEstrogène Progestérone

Développement caniculaire et
tubulo-alvéolaire

Prolactine
Parturition
Lactogenèse
Hypothalamus
Hyp
Excrétion, éjection du lait
Sécrétion
MI., Mi
Cellule mammaire


Prolactine


Ocytocine
Succion

Lactation
Cell.myo-épithéliales
Galactopoïèse
3. 10. La sénilité:
La brebis peut porter jusqu'à 7 à 8 ans
(34). Après la sénilité, il ne reste plus
de follicules en activité au sein des ovaires. Il n'y a plus qu'un tissu
conjonctif fibreux parsemé de cicatrices fibreuses. Il n'y a plus
désormais d'ovulation et la sécrétion de
progestérone disparaît. L'absence de sécrétion
oestrogénique entraîne l'atrophie progressive de l'utérus,
de l'épithélium vaginal et de la glande mammaire
(05).

SUR
4. Les facteurs influençant sur la
reproduction:
4. 1. Généralités:
Les variations annuelles de la durée du jour, ou
photopériode, sont responsables de l'alternance entre une saison
d'activité et une saison de repos sexuels (01),
(61). L'expression oestrale peut être
déprimée par les photopériodes longues
(60).
Comme nous avons décrit, l'information lumineuse est
perçue par la rétine et, après un trajet nerveux, elle est
transformée en un signal endocrinien (la sécrétion de
mélatonine) (61).
Enfin, la saisonnalité n'est pas un
phénomène limité à la femelle mais aussi le
mâle est concerné (10), et elle agit non
seulement sur les animaux sexuellement matures mais aussi sur l'apparition de
la puberté chez les jeunes (01).
4. 2. Les facteurs externes:
4. 2. 1. La latitude:
Sous les latitudes moyennes et élevées, les
petits ruminants ont une saison de reproduction d'une durée
limitée (10), (30) dont la
période principale d'activité sexuelle se situe en automne
(30). Sous des latitudes faibles, un allongement de la saison
sexuelle est observé.
En revanche, dans l'ensemble du monde intertropical et
subtropical, la plupart des auteurs décrivent généralement
les races locales ovines comme susceptibles de se reproduire toute
l'année (10).
4. 2. 2. La photopériode:
Selon sa durée, la photopériode peut exercer une
action stimulante ou inhibitrice sur l'activité de reproduction
(61).
La modification de sécrétion de LHRH est
observable avec un délai important par rapport au changement du rythme
de sécrétion de mélatonine (en général de 40
à 60 jours chez la brebis). Les modifications de sécrétion
de LHRH induisent à leur tour des changements de sécrétion
des gonadotrophines et en conséquence des variations de
l'activité des gonades (10).
Des états réfractaires critiques au
déroulement normal de la saison sexuelle pourraient être
l'expression d'un rythme endogène de reproduction. L'existence d'un tel
rythme a été démontrée chez les ovins comme dans de
nombreuses autres espèces : des animaux maintenus en jours courts ou
longs constants pendant plusieurs années continuent à montrer
des alternances entre périodes de repos et
d'activité sexuels. Toutefois, ces périodes d'activité
deviennent désynchronisées entre animaux et par rapport à
la saison sexuelle normale. La période de ce cycle endogène varie
généralement entre 8 et 10 mois. Par exemple, des brebis Suffolk
exposées à des jours courts constants pendant 4 ans, montrent des
variations d'activité gonadotrope. Ces cycles de sécrétion
de LH ne sont pas synchronisés entre animaux et sont
caractérisés par une période différente de 1 an. Le
rôle de la photopériode dans les conditions naturelles pourrait
donc être de synchroniser ce rythme endogène de reproduction pour
lui imposer une période égale à un an. Il est important de
noter que la perception de la photopériode durant certaines
périodes critiques de l'année pourrait suffire à
entraîner le rythme endogène de reproduction. Ainsi, chez la
brebis, les résultats de diverses expériences suggèrent
que les jours longs de printemps jouent un rôle central pour
entraîner le rythme endogène de reproduction et, en particulier,
déterminer le moment de déclenchement de la saison sexuelle en
fin d'été. Les jours courts interviendraient ensuite pour
maintenir cette activité (Voir la figure 15) (10).

Figure 15 : Modèle pour la
régulation photopériodique du cycle annuel de
Reproduction
chez la brebis.
Les variations de la durée d'éclairement
quotidien sont le principal facteur qui entraîne les variations
saisonnières de reproduction. Lorsque les jours sont longs, JL (dans la
plupart des cas, plus de 12 heures de lumière, succédant à
des jours courts), les nuits sont courtes et la durée de
sécrétion de mélatonine est donc courte; au contraire,
lorsque les jours sont courts, JC (moins de 12 heures de lumière,
succédant à des jours longs), les nuits sont longues et la
durée de sécrétion de la mélatonine est longue.
C'est par la durée de cette
sécrétion que les animaux connaissent la longueur
du jour. (Voir le deuxième chapitre; perception de l'information
photopériodique) (10).
Les jours courts: Les JC appliqués
pendant suffisamment longtemps, environ 50 jours pour la brebis Ile de France
après le changement de JL/JC (10), ont un effet
stimulateur sur la reproduction (01), (10).
Cependant ces JC ne sont pas toujours stimulateurs, puisque après
environ 70 jours d'activité sexuelle, celle-ci s'arrête et les
animaux deviennent réfractaires aux JC. C'est l'installation de cet
état réfractaire aux jours courts de l'hiver qui est responsable,
en partie au moins, de l'arrêt saisonnier de l'activité sexuelle,
les femelles ayant reçues alors «trop » de JC.
Les jours longs: Les JL appliqués
pendant suffisamment longtemps, environ 35 jours pour la brebis Ile de France
après le passage de JC/JL (10), ont un effet inhibiteur
sur la reproduction (01), (10). Les JL
«perdent» cette inhibition puisque après un certain temps en
JL l'activité sexuelle reprend et cela s'explique par l'installation
d'un état réfractaire aux JL, il s'en suit un
déclenchement du début de la saison sexuelle
(10).
Donc, la même durée de photopériode peut
induire des effets stimulants ou inhibiteurs selon la photopériode
à laquelle les animaux ont été préalablement
soumis. C'est relativement aux événements antérieurs que
la photopériode joue un rôle sur la reproduction.
Les modifications artificielles de la photopériode
semblent montrer qu'il existe un seuil de la durée de la
photopériode au-dessus ou en dessous duquel l'activité
gonadotrope n'est pas stimulée (16).
4. 2. 3. La température:
La température, surtout les hautes températures,
affecte la reproduction et cela pour toutes les espèces
(62), (68). Chez la brebis Mérinos,
l'augmentation de la charge thermique radiative (qui survient lorsque les
animaux sont exposés au rayonnement solaire) pendant les 10 à
15ème jour du cycle, diminue fortement ou même supprime
complètement le comportement d'oestrus, accroît la durée du
cycle, diminue la fertilité (10) et la
fécondité et augmente la mortalité embryonnaire
précoce (68).
La température agit aussi indirectement sur la
reproduction de la brebis puisque les béliers soumis à une
température élevée atteignant 40 °C pendant 2
à 4 jours augmente les risques d'avortement si la saillie est
fécondante (effet de la chaleur sur les spermatozoïdes)
(21). Il est possible que la réduction du taux
d'ovulation précoce soit due à un effet de stress,
particulièrement d'origine climatique (20).
Reste à signaler que les ovins résistent au froid
grâce à leur toison (15) et que les races locales
sont mieux adaptées à leur climat (10).
4. 2. 4. L'alimentation:
La disponibilité alimentaire et les variations
annuelles de la quantité de la nourriture consommée interagissent
avec le photopériodisme pour moduler l'activité sexuelle ou la
contrôler complètement (16).
Un bon état corporel a une action positive sur le
développement de l'ovaire, le taux d'ovulation, le taux de
fécondation et l'implantation embryonnaire et diminue la
mortalité embryonnaire (64).
Le niveau d'alimentation au moment de la lutte influence sur
la fertilité et la prolificité. En effet, la stimulation de
l'activité ovarienne, favorisera le taux d'ovulation
(15), (06). Machensie et Edey enregistrent un
fort pourcentage de non gestation suivie de cycles oestraux prolongés
chez des brebis sous-alimentées (22).
Sachant que l'alimentation des brebis en gestation est
primordiale pour le développement des foetus, la survie et la croissance
des agneaux; de même, l'alimentation des brebis en lactation
détermine leur capacité de production laitière et donc la
croissance des jeunes, ce qui fait, on a recours au steaming et au flushing
(11), (15), (64).
Le Steaming: Il consiste à donner une
complémentation avec un aliment peu encombrant et surtout riche en
énergie en fin de gestation (pendant les deux derniers mois de
gestations). Il représente 30 à 50 Þ des besoins
d'entretien au 4éme et 5éme mois de gestation (13)
soit 200 à 400 grammes de concentré par brebis et par
jour en fonction de l'état corporel et du stade de gestation (la
quantité apportée augmente au fur et à mesure qu'on se
rapproche de la mise bas) (11).
Ne pas omettre qu'un état d'engraissement important
compromet la fertilité (11), (15),
(64).
Le Flushing: Le concept du `flushing' a
été connu dans les élevages ovins, vers le 1
9ème siècle. Il est généralement
utilisé pour évaluer l'état d'engraissement dans lequel se
trouve la brebis au moment de l'accouplement (20).
Il consiste en une suralimentation énergétique
temporaire (plus de 20 à 30% des besoins d'entretien) avec de sels
minéraux et de vitamines (11). Un flushing
pré-oestral (de 3 semaines) améliore le nombre d'agneaux
nés de 10 à 20% (15), (20).
Ainsi un flushing post- oestral (de 5 semaines) réalisé sur des
femelles en bon état corporel, assure un taux d'ovulation
élevé et un taux de perte embryonnaire faible. Ce flushing
représente 300 à 500 grammes de concentré par brebis et
par jour selon l'état des animaux (15).
Un des mécanismes de l'effet de l'alimentation sur
l'ovulation a été proposé par SMITH (1988). Le flushing
produit une augmentation de la taille du foie et une élévation de
la concentration des enzymes microsomiales hépatiques. Il en
résulte une augmentation du niveau métabolique des
oestrogènes, et par suite, celle du niveau de la FSH avant et pendant la
lutéolyse. Cette élévation de la FSH dans l'organisme peut
être responsable du développement d'un plus grand nombre des
follicules ovulants (20).
L'effet des phytoestrogènes:
Des substances à activité oestrogénique
ont été identifiées en grande quantité dans divers
fourrages et elles peuvent amener des troubles de reproduction (26)
notamment les syndromes d'infertilité et
d'infécondité chez les ovins (red clover syndrome)
(76). Les moutons seraient plus vulnérables aux
phytoestrogènes car ils sont sensibles à des concentrations
oestrogéniques faible par apport aux autres ruminants (la concentration
de récepteurs d'oestradiol dans l'utérus de la brebis serait de 2
à 4 fois plus élevée que chez la vache, ce qui peut amener
une réponse plus accentuée) (77).
Les deux principales sources de ces substances (estrogen
like) sont les végétaux qui contiennent des
phytoestrogènes qui sont formés plus abondamment au printemps et
en automne durant les périodes de croissance rapide des
végétaux (coumestrans, isoflavones et lignans essentiellement) et
les moisissures productrices de mycotoxines (zéaralénone,
fusariotoxines...).
Les isoflavones (la daïdzéine et la
génistéine) sont largement répandus dans la famille des
légumineuses avec des taux significativement élevés dans
le soja, le trèfle et la luzerne principalement durant les premiers
stades de la germination et ensuite de la croissance des
végétaux. Par contre, on ne les retrouve pas dans
la luzerne conservée sous forme de fourrages et dans les
céréales.
Le coumestrol est plus abondant dans la luzerne, il est aussi
présent dans la plupart des légumineuses mais en faible
quantité.
Les lignans représentés par le
seco-isolariciresinol et le matairesinol sont faible dans les fourrages de
légumineuses et riche dans les grains de lin.
Les brebis exposées aux phytoestrogènes peuvent
présenter deux types d'infertilité : une temporaire et une
permanente (76), (77).
L'infertilité temporaire disparaît après 3
à 5 semaines de régime alimentaire pauvre en substance
oestrogénique (76).
L'atteinte permanente est causée par des pâturages
à forte concentration de légumineuses (trèfle rouge ou
luzerne) et de très longues périodes (16),
(77).
La diminution de la fertilité se marque par: Une chute
importante du taux de gémellité, une diminution du taux de
l'ovulation (76), échec des premières
fécondations, faible activité ovarienne, accroissement du poids
de l'utérus et diminution des follicules ovariens chez les agnelles
(77) et la mortalité embryonnaire semble augmenter
légèrement.
Comme nous pouvons avoir une infertilité permanente par
modification morphologique et histologique du col cervical et
impossibilité pour ce dernier d'assurer le stockage et le transport des
spermatozoïdes (76).
En résumé, la mauvaise nutrition, du point de
vue quantitatif ou qualitatif (les insuffisances et les
déséquilibre nutritionnels), se répercute sur
l'état sanitaire et en conséquence sur la reproduction
(15), (18), (11).
4. 2. 5. L'effet mâle:
L'effet mâle consiste à réintroduire les
béliers dans un troupeau de brebis en anoestrus anovulatoire (en
général 1 mâle pour 25 à 30 femelles) après
une période de séparation complète d'un mois
(15), (21). Il induit dans les 2 à 4
jours une ovulation silencieuse, c'està-dire non associée
à un comportement de chaleur, suivie soit par un cycle ovulatoire de
durée normale (voisine de 17 jours) puis d'une nouvelle ovulation
associée à un comportement de chaleur (21),
(63) soit par un cycle ovulatoire de durée courte mais
constante (6 jours) suivi d'une nouvelle ovulation silencieuse puis,
après un cycle ovulatoire
de durée normale (17 jours), par une nouvelle ovulation
associée à un comportement d'oestrus (63).
Le contact physique ou visuel des béliers avec les
brebis n'est pas indispensable car l'effet mâle peut se produire
même si les animaux sont séparés par une clôture de
grillage ou par une cloison opaque. Ceci laisse à penser que l'odorat
(21), (émission des phéromones par les
béliers), est donc l'origine de la stimulation des gonadotropines et de
l'ovulation chez les brebis en anoestrus (01),
(30).
L'effet bélier est utilisé, soit pour avancer le
début de la saison sexuelle, soit pour rompre l'anoestrus post-partum
(60). Il permet aussi de regrouper la lutte pour faire
coïncider la période de mise bas avec celle de la pousse de l'herbe
(21). Les béliers sont soit entiers ou des substituts
(mâles castrés et traités aux stéroïdes
«androgènes ») (21), (60).
Cet effet est d'autant plus marqué que l'on se rapproche du début
de la saison sexuelle.
Le stimulus du mâle induit une
accélération des décharges pulsatiles de LH conduisant
à un pic préovulatoire et donnant lieu à l'ovulation 48 h
environ après la mise au mâle (60) (voire figure
16) Lorsque la présence des mâles est limitée à
moins de 24 heures, l'ovulation ne se produit pas (21).

4. 3. Les facteurs internes:
4. 3. 1. La génétique:
Tandis que le photopériodisme est le principal facteur
de saisonnalité, la génétique peut avoir un effet
(01). D'après les constations, c'est un effet
génétique réel qui correspond sans doute à une
lente adaptation des races à leur environnement (29),
(66). Transportés dans les zones intertropicales, les
ovins originaires des zones tempérés conservent leur
saisonnalité (10). De même, les races ovines du
nord de la France exploitées dans le sud garde une saisonnalité
très nette, alors que la Mérinos (originaire du sud) et les races
mérinisées (comme l'Ile de France) sont naturellement plus
désaisonnées (29), (66).
4. 3. 2. L'état sanitaire:
La pathologie de la reproduction chez les ovins doit
être étudiée au niveau du troupeau et non de l'individu.
Elle avait des répercutions relativement grave sur l'activité
sexuelle de la brebis (01). Ainsi les dysfonctionnements du
système hypophyso-diencéphalique d'origine parasitaire ou
infectieuse peuvent aboutir à un arrêt de l'activité des
gonades et à une disparition de l'instinct sexuel
(26).
4. 4. Quelques paramètres de
reproduction:
Nombre de brebis agnelant.
Le taux de fertilité = X 100 (01),
(15).
Nombre de brebis mises au mâle ou
inséminées.
L'objectif est de se rapprocher de 100%. Ce taux doit être
d'au moins 90% (15).
Nombre d'agneaux nés.
Le taux de prolificité = X 100 (01),
(15).
Nombre de brebis agnelant.
On recherche un taux d'au moins 150%. Il varie selon les races
(15).
Nombre d'agneaux nés (vivants ou morts).
Le taux de fécondité = X 100
(01), (15).
Nombre de brebis mises au mâle ou
inséminées.
On peut calculer le taux de fécondité comme
suit:
Taux de fertilité x taux de prolificité
(15).

N.B : Ce chapitre est important mais bref vu la
rareté des références.
5. La brebis de races ovines locales:
5. 1. Effectif et élevage:
Les ovins prédominent et représentent 80 pourcent
de l'effectif national avec plus de 10 millions de brebis
(71).
Tableau 1: Evolution du cheptel ovin (milliers
de têtes) Sources Statistiques Agricoles 1990-1999 et FAO 2002
(71).
* (78) : NEPAD Référence. 06/47
F.
|
1990
|
1995
|
1999
|
2000
|
2001
|
2004
|
|
17697000
|
17302000
|
18200000
|
19500000
|
19300000
|
18 522 417
|
(10314384 brebis) *
Dans les régions telliennes, l'élevage ovin est
peu important. C'est un élevage sédentaire et en stabulation
pendant la période hivernale. Il est très souvent associé
à l'élevage des caprins.
La population steppique, composée essentiellement de
pasteurs-éleveurs pratiquait le nomadisme (concernant le
déplacement de l'ensemble de la famille), et la transhumance (qui ne
concerne que le berger et son troupeau) (71).
5. 1. 1. Elevage extensif nomade:
Avec un effectif intéressant sur la zone steppique et la
zone saharienne.
5. 1. 2. Elevage semi extensif
sédentaire:
Sur les hauts plateaux céréaliers, le Tell et le
littoral (19).
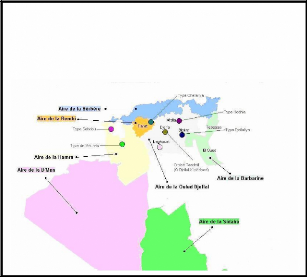
Figure 17 : Aire de répartition des races
et localisation des types d'ovins en Algérie (70).
5. 2. Description générale:
La classification des ovins en Algérie repose sur
l'existence de trois grandes races qui à leurs tours présentent
intrinsèquement des variétés, souvent identifiées
à des régions (72).
5. 2. 1. Les races principales:
Elles sont au nombre de trois : Ouled Djellal, Hamra et Rumbi.
5. 2. 1. 1. Race Arabe Blanche dite Ouled
Djellal:
Introduite avec les invasions Hilaliennes (Hedjaz), elle est
de loin la plus importante, en terme d'effectif (72) (environ
58 pourcent du cheptel national) (71), et la plus
intéressante en terme de productivité. Elle peuple les hautes
plaines telliennes et les vastes zones de la steppe. Ce type d'ovin aux membres
forts est actuellement en pleine expansion. C'est le véritable mouton de
la steppe, le plus adapté au nomadisme (72), il est le
plus intéressant par ses aptitudes tant physiques que productives
(71), (73), (75).
· Description:
C'est un ovin entièrement blanc (71),
(72), (73), (75) à
laine et à queue fines. La laine couvre tout le corps jusqu'au genou et
même jusqu'au jarret pour certaines variétés. Le
ventre et le dessous du cou sont nus pour une majorité
des animaux de cette race. Sa tête est blanche avec des oreilles
pendantes. Il présente une légère dépression
à la base de son nez. Ces cornes spiralées sont de longueur
moyenne. Sa taille est haute et sa hauteur est égale à la
longueur du tronc.
La forme de son corps est proportionnée, sa poitrine est
légèrement étroite, les côtes et le gigot sont
plats. Ses pattes sont longues solides et adaptées à la marche
(72).
L'âge à la puberté est de 8 à 10
mois mais il peut y avoir une puberté à l'âge de 6 mois
(04). La brebis est mise à la lutte à
l'âge de 18 mois (19) et l'agneau de cette race
pèse à la naissance 3 kg 500 g et à 5 mois 30 kg
(73), (75).
Le pourcentage de la prolificité est bas (110%), un
seul agneau est le résultat de la porté en
générale. Le pourcentage de double porté est
inférieur à 5% dans la station de Ain M'lila mais on peut avoir
un pourcentage de gemelarité aller jusqu'à 10% avec un flushing
et un contrôle de l'alimentation. Le tableau si dessous représente
le résultat obtenu par Lagoun en 2001 durant une période de plus
de cinq ans sur le même troupeau dans la station de Ain M'lila
(04).
Tableau 2 : Les performances de la reproduction
de la race Ouled Djellal au station de Ain M'lila (04).

Fertilité % Fécondité %
Prolificité
Les caractères
Accouplement en
automne (n=2000)
87(+ ou - 6,5)
98(+ ou - 5,4)
1,1(+ ou - 0,2)
Accouplement en printemps (n=1340)
89(+ ou -5,5)
87(+ ou - 7,3)
1,05(+ ou - 0,1)
· Variété : La race
Ouled-djellal comprend trois variétés:
- Variété Chellalia: Représente 5 à
10% de la population de Ouled Djellal (04). C'est le type du
mouton le plus petit de taille et le plus léger.
C'est parmi cette variété que l'on classe la race
TAADMIT qui est un croisement Ouled
Djellal x Mérinos d'Arles, qui est créée
pour la production de la laine. Il est, aussi,
intéressant de citer la variété Zâarez
utilisée à cette fin (72). On trouve cette
variété dans les régions de Ksar Chellala, Taguine, et
Boghari (04).
- Variété lourde (Hodnia): Ce mouton
représente 70% de la population de Ouled Djellal (04).
C'est le plus recherché par les éleveurs à cause de son
poids corporel. Cet ovin est de
forme bien proportionnée, taille élevée
et de couleur paille clair ou blanche. La laine couvre tout le corps jusqu'aux
jarrets (72). On la trouve dans les régions de Ouled
naïl, Djelfa, Sidi Aissa, Boussâada, M'sila, Barika, Sétif,
Ain M'lila, et Ain Beidha (04).
- Variété Djellalia: Elle représente 16%
approximativement (04). C'est un mouton longiligne, haut sur
pattes, adapté au grand nomadisme. Une laine blanche, fine et jarreuse.
Le ventre et le dessus du cou sont nus pour une majorité des moutons de
cette variété (72). On la trouve dans les wilaya
de Biskra et M'sila. Elle tire son nom de la tribu Ouled djellal
(04).
5. 2. 1. 2. Race Hamra ou Beni-Ighil:
La race rouge Beni-Ighil dite Hamra, en rappel de sa couleur,
présente 21 pourcent du cheptel national des ovins
(71). On la considère comme la meilleure race à
viande en Algérie en raison de la finesse de son ossature et de la
rondeur de ses lignes. C'est une race très résistante au froid et
aux vents glacés des steppes de l'Oranie (72). L'aire
de répartition de cette race est située dans les hauts plateaux
de l'Ouest (71) et le sud-ouest, elle est rencontrée
également au niveau du piémont de l'atlas saharien. Cette race
devrait occuper la 2ème place pour certaines aptitudes
qu'elle possède notamment sa résistance au froid. Elle est en
nette régression à cause de sa taille non
préférée par rapport à la race blanche. Le poids de
l'agneau à la naissance est de 2 kg 500 grammes et 25 kg à
l'âge de 5 mois (73), (75).
· Description:
C'est un animal à peau brune avec des muqueuses noires.
La tête et les pattes sont bruns rouge foncé presque noir.
Présence de cornes moyennes et spiralées.
· Variété : Trois
variétés composent cette race:
- Le type d'El-bayadh, Mecheria à couleur acajou
foncé.
- Le type d'El-arricha, à couleur presque noire, c'est le
type le plus performant, le type même de la race.
- Le type de Malakou du chott chergui, à couleur acajou
clair (72).
5. 2. 1. 3. Race Rumbi:
La race Rumbi, des djebels de l'Atlas Saharien, à
tête et membres fauves, représente environ 12 pourcent du cheptel
(71).
L'aire de répartition de cette race est comprise entre
le chott El-Gharbi à l'ouest et l'Oued-touil à l'est, on peut le
retrouver au nord jusqu'au piémont du massif de l'Ouarsenis
(72).
L'agneau à la naissance pèse 3 kg 500 g et à
5 mois 25 à 30 kg (73), (75).
· Description:
Elle se distingue des deux dernières races par une couleur
de la tête et des membres qui varient entre le fauve rouge et l'acajou,
mais la laine est blanche, présence de cornes massives et
spiralées.
C'est un animal haut sur pattes, il est
considéré comme le plus grand format de mouton d'Algérie.
Sa conformation est meilleure que celle de la Ouled Djellal. La forte dentition
résistante à l'usure lui permet de valoriser au mieux les
végétations ligneuses et de retarder à 9 ans l'âge
de la réforme contrairement aux autres races réformées
à l'âge de 6-7 ans. Il semble ainsi qu'elle est mieux
adaptée que la Ouled Djellal aux zones d'altitude
(72).
5. 2. 2. Les races secondaires:
5. 2. 2. 1. Race Berbère:
Considéré comme l'ancêtre du mouton
d'Afrique du nord. C'est un animal de petite taille avec une toison de laine
mécheuse, blanche et brillante dite aussi Azoulai. Il existe quelques
spécimens tachetés de noir. Les cornes sont présentes chez
les deux sexes, elles sont petites et spiralées.
On rencontre auparavant principalement en Kabylie, et à
un degré moindre dans l'Ouarsenis, avec les caractéristiques
légèrement différentes. Généralement, il
peuple les zones montagneuses du Tell jusqu'à l'ouest où il se
rapproche pour se confondre avec le BENI-GUIL.
Actuellement, le berbère semble complètement en
voie de disparition des régions qui font son berceau. On le rencontre
encore dans l'Oranie où de plus en plus il fait place au BENIGUIL
(72).
La mise à la lutte se fait à l'âge de
12-18 mois du printemps jusqu' au début d'été donc la mise
bas sera en automne. L'agneau pèse à la naissance 1,8 à 2
kilogrammes. La longévité est de 11 à 12 ans
(19).
5. 2. 2. 2. Race Barbarine:
Originaire de Tunisie, on le rencontre dans l'est du pays,
dans la partie sud orientale. C'est un mouton à grosse queue peu
apprécié qui, de plus en plus, est concurrencé dans son
aire de prédilection par le mouton Arabe. Il vit en vase clos,
cantonné prés des frontières tunisiennes à El-oued.
C'est un animal de bonne conformation, de couleur blanche, sauf la tête
et les pattes qui peuvent être bruns ou noirs .La toison est fournie. Les
cornes sont développées chez le mâle et absentes chez la
femelle. La queue est grasse d'où l'appellation de mouton à queue
grasse ou mouton de Oued-Souf(72).
Son aire de répartition est limitée à
l'est Algérien par l'erg oriental (71), (72)
à l'est de l'oued Rhigh et dans les régions avoisinantes
de la frontière Tunisienne. Cette race est remarquablement
adaptée au désert de sable et aux grandes chaleurs estivales
(19) (72). Les chaleurs réapparaissent dès la
mise bas même pendant le mois d'août (Température est de 45
degrés Celsius).Il y a deux périodes d'oestrus de août
à septembre et de janvier à février. L'agnelage se
déroule entre janvier et mars avec 14 à 18 mois d'âge au
premier agnelage. L'agneau pèse à la naissance 2,5 kilogrammes en
moyenne (19).
5. 2. 2. 3. Race D'men:
Race très rustique et supporte très bien les
conditions sahariennes (19). Il parait morphologiquement
défectueux avec un squelette très fin à côtes
plates. De petit format, il semble tiré en arrière. La toison est
généralement peu étendue. Le ventre, la poitrine et les
pattes sont dépourvus de laine. Les cornes sont absentes, parfois des
ébauches peuvent apparaître chez le mâle, mais qui finissent
par tomber. L'absence de cornage est un caractère constant chez les deux
sexes. La queue est fine et longue à bout blanc
(72).
La très grande
hétérogénéité morphologique de la D'men,
laisse apparaître trois types de populations:
- Type noir acajou, le plus répandu et
apprécié.
- Type brun.
- Type blanc.
Les trois types présentent des queues noires à bout
blanc et des caractères de productivité ne signalant aucune
différence significative.
Cette race saharienne est répandue dans les oasis du
sud ouest Algérien: Gourara, Touat, Tidikelt et va jusqu'à
El-Goléa à l'est et se prolonge dans les zones désertiques
au sud de Bechar sous le nom de race de Tafilalet, ou D'men
(72).
La race est très bien implantée au Maroc
où elle est la plus étudiée et bien
préservée (72). Elle est très
intéressante par sa prolificité élevée
(19), (71) et sa faculté à
donner des naissances double couramment voir cinq agneaux. La brebis, en
oestrus dès l'âge de7 mois, peut accepter le mâle toute
l'année parce qu'il y a aucun saisonnement, et peut donner trois
agnelages en deux ans voir deux agnelages par an. L'agneau pèse à
la naissance 2,5 kilogrammes et 1,8 kg pour les doubles ou triples
(19).
5. 2. 2. 4. Race Targuia-Sidaou:
C'est la seule race Algérienne dépourvue de
laine, mais à corps couvert de poils ressemble à une
chèvre, la queue étant longue (presque au ras du sol) et fine
(19), (72). La couleur des poils est noire ou
paille ou mélangé, sa poitrine est étroite et les pattes
sont longues et hautes aptes à la marche sur de longue distance
(jusqu'à 1000 kilomètres) (04),
(19). Cette race se trouve dans le grand Sahara
Algérien allant de Bechar et passant par Adrar jusqu'à Janet. On
qualifie cette race de résistante au climat saharien
(19), (72) (très chaud en
été plus de 45 degrés Celsius et plus froid en hiver moins
de 0 degré Celsius). L'âge de puberté est de 7 mois mais la
mise en lutte est à l'âge de 12 mois. La brebis est
fécondée deux fois par an et donne un agneau qui pèse 2,5
kilogrammes. Elle est réformée à l'âge de 7 ans et
peut vivre jusqu'à 12 ans (19). C'est ainsi qu'elle est
la seule race qui peut pâturer les étendues du grand Sahara
(72), (19).
5. 3. Les caractéristiques des brebis de races
locales:
5. 3. 1. Les caractéristiques physiques des races
ovines algériennes:
Tableau 3 : Les caractéristiques
physiques des races ovines locales.
|
Les races
|
sexe
|
H
Cm
|
LC
cm
|
TP
cm
|
PV
kg
|
La couleur
|
La queue
|
La conformation
|
|
Arabe*
|
M
|
84
|
84
|
40
|
81
|
Peau blanche
|
Fine et
moyenne
|
bonne
|
|
F
|
74
|
67
|
35
|
49
|
Peau blanche
|
|
|
|
Hamra*
|
M
|
76
|
71
|
36
|
71
|
Peau brun
|
Fine et
moyenne
|
Très bonne
|
|
F
|
67
|
70
|
27
|
40
|
Laine blanche
|
Fine et
moyenne
|
|
|
Rumbi**
|
M
|
77
|
81
|
37
|
80
|
Peau brune
|
Fine et
moyenne
|
moyenne
|
|
F
|
71
|
76
|
33
|
62
|
Laine blanche
|
|
|
|
Berbère
|
M
|
65
|
78
|
37
|
45
|
Peau blanche
|
Fine et
moyenne
|
bonne
|
|
F
|
60
|
64
|
30
|
37
|
Laine blanche
|
|
|
|
Barbarine
|
M
|
70
|
66
|
32
|
45
|
Peau brune
|
Grasse et
moyenne
|
bonne
|
|
F
|
64
|
65
|
29
|
37
|
Tête marron
|
|
|
|
D'man
|
M
|
75
|
74
|
34
|
46
|
Peau brune
|
Fine et
noire, très
|
faible
|
|
F
|
69
|
67
|
32
|
37
|
|
longue
|
|
|
Sidaou
|
M
|
77
|
64
|
33
|
41
|
Peau noire
|
Fine et très
|
faible
|
|
F
|
76
|
64
|
32
|
33
|
ou brune
|
longue
|
|
H = hauteur au garrot (cm) ; LC = longueur du corps (cm) ; TP =
tour de poitrine (cm) ; PV =poids vif (kg) ; M = mâle ; F = femelle. * 3
variétés, **2 variétés
5. 3. 2. Les caractéristiques physiologiques et
génitiques:
En Algérie, les populations ovines locales sont
constamment soumises à l'adversité du milieu (74)
(climat rude, parcours vastes et rocailleux, sources d'eau
éloignées, végétation spéciale et
limitée) (75), et se caractérisent par une
rusticité remarquable ; mais elles
présentent des résultats de production
hétérogènes et des caractéristiques morphologiques
diverses qui semblent avoir une origine génétique
différente (74).
Les observations enregistrées par les auteurs durant
plusieurs années et par l'institut vétérinaire de Tiaret
indiquent que la race Ouled Djellal et les races qui vivent dans les basses
latitudes ne présentent pas des anoestrus saisonniers ce qui permet
d'avoir une activité sur toute l'année. Mais il y a des facteurs
de régulation qui sont responsables d'une diminution de la conception
par exemple une forte température en été, le manque de
l'alimentation et les périodes longues de sécheresse
(04).
NIAR constate que les brebis de nos trois principales races
ovines peuvent se reproduire à n'importe quel moment de l'année.
Cependant il a relevé une courbe d'agnelage réalisée sur
7207 brebis gestantes avec deux pic d'agnelages dont le plus important est
celui de l'automne (environ 45 % des agnelages), et le pic du printemps
(environ 25 % des agnelages). Cette étude clinique a été
complétée par une autre, cytologique et histologique des
muqueuses vaginales recueillies aux abattoirs et à la ferme
expérimentale du Centre Universitaire sur des vagins de brebis
appartenant à ces mêmes races. 253 prélèvements
étalés sur toute l'année, n'a permis de remarquer aucun
arrêt de la cyclicité à aucun moment de l'année; le
diagnostic des brebis cycliques (aux différentes phases du cycle), des
brebis gestantes, de même que celles ménopausées, peut
facilement être établi par cette méthode (20)
(voire photo 8).
L'étude histologique des prélèvements
d'ovaires a aussi permis de constater que les races locales
(particulièrement la race Ouled-Djellal) sont capables de produire
plusieurs follicules mûrs par cycle, et de ce fait sont suffisamment
prolifiques pour pouvoir produire des jumeaux, des triplets, des
quadruplés et même des quintuplés (voire photos 6 et 7).
Il est capable de programmer deux gestations par an, et
démontrer que la deuxième gestation n'a aucune influence sur les
paramètres de reproduction. Ces derniers peuvent même être
améliorés par un bon programme alimentaire aux alentours de la
période des luttes (flushing) (20).

Photo 6. Photo 7.
Photo 6: La structure histologique d'un
follicule mûr de «De Graaf», d'une brebis de la race
`Ouled-Djellal'.
(Coloration H. E; Gr X 1000, Immersion).
Ant-Fol =
Antrum Folliculaire; Ovo = Ovocyte; C-C.R = Cellules de la Corona
Radiata;
C-Gra = Cellules de la Granulosa; C-Thè = Cellules
Thècales; Z-P = Zone Pellucide.
Photo 7 : Coupe sagittale au niveau d'un
ovaire de brebis de race `Ouled Djellal';
A noter la présence
simultanée de trois follicules mûrs de «De
Graaf».
(Coloration : H.E; Gr X 400). T-Ovi = Tissu ovigère de
l'ovaire (20).
La baisse dans la courbe d'agnelage durant l'été
(Mai à Juillet) correspond à des luttes à l'hiver. Ceci
est expliqué par l'effet du stress thermique (le froid) et les faibles
pâturages (non application de flushing) qui sont responsables de la
diminution des performances de la reproduction (la fertilité et la
prolificité) et en conséquence l'augmentation du mortalité
embryonnaire (33) (voire tableau 5).
Tableau 4: Les performances de reproduction des
brebis algériennes (04).
|
La race
|
Fertilité
|
Fécondité
|
Prolificité
|
Source
|
|
Ouled Djellal
|
87
|
95
|
110
|
Dehimi et al
|
|
|
|
|
(1999)
|
|
Hamra
|
93
|
105
|
113
|
Aouisset (2000)
|
|
Rembi
|
90
|
103
|
115
|
Ministère de l'agriculture*
|
|
Taadmit
|
76
|
84
|
107
|
Ministère de l'agriculture*
|
|
Berbère
|
nd
|
90
|
110
|
Chellig (1992)
|
|
D'man
|
nd
|
nd
|
185-200
|
Chellig (1992)
|
|
Terguia-
|
98
|
nd
|
nd
|
Chellig (1992)
|
sidaou
nd: non disponible. * : l'année (2000).
Dans les dernières années, les
vétérinaires et techniciens qui s'intéressent à la
filière d'élevage des petits ruminants ont conclu que la
mortalité ovine en Algérie, qui est de 5 à 20%, en
relation directe avec la saison d'agnelage, conditions d'élevage et
d'entretient, le poids à la naissance, fourrage disponible et la gestion
d'élevage (04).

Janvier
Avril
Juin
Juillet
Août
Novembre
Décembre
Mois
Février
Mars
Mai
Octobre
Total
Septembre
N° %
Brebis agnelantes Fermes Privées
6069 100.00
1529 25.19
331 05.45
734 12.09
608 10.02
562 09.26
486 08.01
589 09.70
717 11.81
188 03.10
102 01.68
166 02.73
57 00.94
N°
Brebis agnelantes
Fermes Etatiques
1138
347
132
116
93
58
55
72
63
53
58
41
50
% N°
100.00 7207
30.49 1876
08.17 281
05.10 666
04.83 617
06.33 558
05.54 394
04.66 155
05.10 115
03.60 207
04.39 639
11.60 866
10.19 833
Total
%
100.00
03.90
09.24
08.56
07.74
05.47
02.15
01.60
02.87
08.86
26.03
12.02
11.56
Tableau 5 : Fréquence des agnelages des
brebis de nos trois principales races ovines Algériennes au cours
des
différents mois de l'année (20).

S.C
D
L
C.C
I.C
1
C.C
S.C
I.C
A
E
I.C
L
C.C
S.C
S.C
C.C
B
L
S.C
F
I.C
L
C
C.C
Photo 8 : photos de l'aspect d'un frottis
cellulaire vaginal de brebis (20).
Commentaire sur la figure:
A: Microphotographie d'un frottis cellulaire vaginal de brebis
durant le pro-oestrus; A noter la présence de quatre
variétés de cellules, avec la prédominance des cellules
kératinisées (C.K), et des cellules intermédiaires (C.I).
(H.E x 225).
B : Microphotographie d'un frottis cellulaire vaginal de brebis
durant l'oestrus; A noter la prédominance des cellules
kératinisées (C.C) (H.E X 225).
C : Microphotographie d'un frottis cellulaire vaginal de
brebis durant le métoestrus; A noter la présence des cellules
intermédiaires en grand nombre (I.C) et des leucocytes (L) fortement
adhérents aux filets de mucus (H.E X 225).
D: Microphotographie d'un frottis cellulaire vaginal de brebis
durant le dioestrus; A noter la forte dominance des cellules
intermédiaires (I.C) et des neutrophiles (H.E X 225).
E: Microphotographie d'un frottis cellulaire vaginal de
brebis durant la gestation; A noter la prédominance des cellules
intermédiaires (I.C) ou cellules de type `naviculaire' (H.E X 225).
F: Microphotographie d'un frottis cellulaire vaginal de
brebis durant la ménopause; A noter la prédominance des cellules
Parabasales cyanophiles (C.P.Cya) et de cellules Intermédiaires
Cyanophiles (C.I.Cya) (H.E X 225) (20).
5. 3. 3. La sélection et l'amélioration
génitique:
D'après les résultats de diagnostic des
systèmes d'élevage, on note que les éleveurs affectent aux
animaux reproducteurs une fonction essentiellement pastorale, c'est à
dire de collecte et de valorisation des ressources spontanées, en
exigeant des brebis un maximum d'adaptation à la marche et aux
intempéries, une capacité de mobilisation des réserves
corporelles tout en se reproduisant régulièrement et le plus
longtemps possible. Cela montre que le premier critère de
sélection, quel que soit le niveau d'intensification du système
d'élevage, est la capacité des brebis à exploiter les
ressources pastorales. Celle de se reproduire est mesurée par le nombre
d'agneaux durant la carrière de la brebis.
Les travaux de croisement entre la race Ouled Djellal et d'autres
races sont résumés dans le tableau ci-dessous.
Tableau 6 : les résultats de croisement
entre les brebis de races arabes (Ouled Djellal) et des béliers de
races
importées (74).
|
Référence
|
Zone
|
Nombre de
|
Taux de
|
Taux de
|
Types
|
|
d'élevage
|
brebis
|
fertilité
|
prolificité
|
génétiques'
|
|
Sou kehal
|
Steppe
|
2050
|
73,5
|
102,3
|
ODõOD
|
|
(1979)
|
|
|
|
|
|
|
Abbas (1986)
|
Steppe
|
272
|
90
|
116,7
|
ODxOD
|
|
Krid (1985)
|
Steppe
|
|
84,5
|
112
|
ODxOD
|
|
Madani
|
Steppe
|
195
|
97,6
|
112
|
ODxOD
|
|
(1987)
|
|
|
|
|
|
|
Mamou
|
Steppe
|
|
67,5
|
102
|
ODxOD
|
|
(1986)
|
|
|
|
|
|
|
Madani
|
Steppe
|
|
91,7
|
113,4
|
ODxOD2
|
|
(1987)
|
|
|
|
|
|
|
Benyoucef et
|
Steppe
|
120
|
35
|
107,1
|
MxOD3
|
|
Belhadi
|
|
|
|
|
|
|
(1990, non publié).
|
Steppe
|
150
|
30,6
|
106,5
|
MxOD2
|
|
Benyoucef et
|
Mitidja
|
293
|
40,3
|
115,2
|
BLxOD
|
|
Bhehioueche
|
|
|
|
|
|
|
(1990, non publié).
|
Mitidja
|
130
|
52,3
|
126,4
|
VxOD
|
|
Benyoucef et Bouchoul
|
Zone
céréalière
|
25
|
40
|
110
|
TxOD
|
|
(1992, non publié).
|
|
|
|
|
|
|
Zone
céréalière
|
26
|
34,6
|
110
|
SxOD
|
|
Zone
céréalière
|
71
|
46,2
|
130,3
|
IxOD
|
1: OD= race Ouled Djellal ; V=Vendeen (10
béliers); M=Mérinos de l'Australie (9 béliers);
I= Il de France (5 béliers) ; T=Texel (2 béliers) ;
BL=Borde Leicester; S=Suffolk (2 Béliers).
2 : première lutte.
3 : brebis adultes.
_
_
_
La réalisation des objectifs d'amélioration
génétique des races ovines locales s'appuie sur la mise en place
de dispositifs d'enregistrement des données en ferme qui porteront sur
l'analyse des conditions de conduite du troupeau (lutte, agnelage, allaitement)
et sur des caractères maternels, de croissance (gain de poids des
agneaux et des animaux adultes) et des mensurations des animaux.
L'assistance technique et scientifique dans le cadre de la
coopération régionale est recherchée principalement pour
les volets relatifs à l'indexation des reproducteurs sur la base des
performances contrôlées (74).
L'assistance scientifique et technique réalisée
dans le domaine de l'étude des systèmes de production et de
l'analyse des objectifs de recherche est demandée pour consolider le
projet et permettre d'aboutir à la mise en oeuvre de programmes
d'amélioration génétique appliqués aux races
locales et adaptés aux conditions de leurs milieux d'élevage.
L'évolution vers de nouveaux systèmes de
production ovine peut être accompagnée de formes
d'amélioration génétique et d'intégration des
activités d'élevage (élevage de reproducteurs,
stratégies d'utilisation des ressources alimentaires, formes d'expertise
et de diversification de produits ovins de qualité)
(74).
Notre recherche bibliographique nous a permet de conclure que
le saisonnement n'est pas une règle générale pour toutes
les races, bien que certaines le manifestent clairement. Il est
démontré que plusieurs facteurs l'influencent avec une action
variable.
On ne peut pas fuir la réalité de
présence d'un code génétique pour le saisonnement puisque
toutes les tentatives de modifications des milieux originaux des races
saisonnières se sont avérées en vains (transfert des
animaux de basses latitudes aux hautes latitudes).
Les races locales algériennes sont loin d'être
saisonnières. Des travaux ont montré que la brebis garde son
activité sexuelle toute l'année avec deux pics en automne et en
printemps.
Enfin, la reproduction chez la brebis est relativement
éclaircie quoique quelques points sollicitent encore de recherches
à savoir l'action exacte de la mélatonine sur les cellules
à GnRH et la notion du seuil de la mélatonine qui induit la
reprise de l'activité sexuelle.
Une rareté des travaux sur nos races locales entrave le
progrès d'amélioration et l'obtention des races à pur sang
ainsi que la réalisation d'un livre généalogique qui vont
sans doute avoir des répercutions bénéfiques sur
l'économie national, et aident fortement les chercheurs à mieux
perfectionner la production et la reproduction ovines.

çw et
gelaegii
petit "eége
Après cette étude, nous envisageons quelques
recommandations:
· La prolificité des brebis de nos races locales
et leur cyclicité pendant toute l'année augmente leur
productivité au sein d'une exploitation, ce qui rendent l'élevage
ovin bénéfique et le favorisent. Décrocher la
dénomination «Bled elghnem» (pays de moutons) est une
perspective.
· Il est possible de maîtriser les facteurs qui
influencent sur la reproduction par l'adopte d'une politique d'élevage
basée sur des connaissances scientifiques.
Par exemple pour la température (haute ou basse), elle
est combattue par la constriction des bergerie en respectant les normes, par la
tonte et par l'élevage des races rustiques et adaptées au
milieu.
Pour l'alimentation, l'application correcte du flushing et du
steaming lors de périodes critiques de la vie sexuelle de la brebis
pallient aux exigences métaboliques imposées.
Pour l'état sanitaire, on vise que la brebis soit
vaccinée, vermifugée, déparasitée et en bonne
santé pour une meilleur manifestation de ses performances de
reproduction et cela par une bonne hygiène et une thérapie
adaptée à la pathologie.
· Puisque on peut avoir deux portée par an, la
sélection génétique afin d'en sortir avec des races
à pur sang est réalisable dans un temps record en raccourcissant
les intervalles entre les générations. Il en est de même
pour la perfection des performances en se basant sur le croisement
interracial.
· Lorsque l'activité sexuelle est à son
pic (l'automne et le printemps) il est préférable d'utiliser les
méthodes naturelle de la synchronisation et de l'extériorisation
des chaleurs, à titre d'exemple : effet de mâle et le flushing ;
qui sont moins coûteuses. Par contre, lors de la période
d'activité basse (l'hiver et l'été) ainsi que pour les
brebis non saillies dans la période de pics, on recommande l'utilisation
des méthodes médicales de synchronisation: les éponges
progestéroniques.
· L'utilisation des implants de la mélatonine est
déconseillée puisque nos races ne sont pas saisonnières.
Les frais de ces produits doivent être orientés vers
l'amélioration de la ration.
· L'état doit subventionner l'élevage
ovin, et cela tant sur le plan sanitaire et médical par la production
des médicaments et l'adopte des décrets ministériels pour
des vaccinations obligatoires et gratuites, le dépistage et
l'éradication des maladies; que sur le plan alimentaire.
Les recherches seraient encouragées,
intensifiées et soutenues par une bonne volonté et des budgets
largement suffisants. La formation des techniciens et des
vétérinaires devrait se faire sur des connaissances et les
données qu'offre le terrain algérien.
ALLAOUA S. A. (07).
Cours de la physiologie de la reproduction. 2006.
Département des sciences vétérinaires, Elkhroub,
Constantine.
B. DEDIEU, A. GIBON, M. ROUX (23).
Notation d'état corporel des brebis et diagnostic des
systèmes d'élevage ovin. Etudes et Recherche sur les
Systèmes Agraires et le Développement, INRA 1991, N°22. Page
22.
B. EL AMIRI et al (31).
Productions animales .INRA Mai 2003 volume16
N° 2. Pages: 80,81.
B. MALPAUX, C. VIGUIE, J. C. THIERY, P. CHEMINEAU
(25).
Photopériode et reproduction. Production animale. INRA.
Février 1996, volume 9 N° 1. Pages: 13,18, 19.
C. BRESSOU (03).
Anatomie régionale des animaux domestiques. Tome II, les
ruminants. 2èmè édition J-B Baillière. 1978. Pages:
14, 15, 20, 43, 355, 357, 364.
C. CRAPLET / M. THIBIER (18).
Le mouton. Edition Vigot. 1980. Pages: 160, 161, 162, 163, 164,
165, 166, 167, 168, 169, 266.
C. CRAPLET (79)
Reproduction normale et pathologique des bovins. Première
édition. Vigot. 1952. Page : 207. CHARLES THIBALUT, Marie-Claire
LEVAS SEUR (14).
La fonction ovarienne chez les mammifères. Edition MASSON,
Paris, 1979. Pages: 09, 10,
14, 15, 16, 17, 20, 21, 35, 36, 37, 38, 39, 40, 42.
CHARLES THIBAULT, Marie-Claire LEVAS SEUR
(16).
La reproduction chez les mammifères et l'homme. Edition
INRA, Ellipses. 1991. Pages: 512, 602, 603, 604, 605, 606.
CHOUITER. M ET SERAOUI. A (13).
Evaluation de la production laitière de la brebis Ouled
Djellal en élevage rationnel par le calcul indirect. Mémoire de
fin de cycle en vue de l'obtention d'un diplôme de Docteur
Vétérinaire. Année 2006, N° 06-042. Pages : 55.
CHRISTIAN DUDOUET (15).
La production du mouton. 2èmeédition.
Edition France agricole. 2003. Pages: 60, 62, 63, 64,
65, 66, 67,77, 78, 83, 87, 88, 149,150, 240, 263.
DEHIMI MOHAMED ELAZIZ (04).
Characterization of small ruminant breeds in west Asia and
North Africa. Vol 2. Technical institute of animal production (ITELV). Ministry
of agriculture. Algiers, Algeria. Editor: Luis iòiguez. . Pages: 71, 72,
74, 76, 77, 78, 79, 80.
DERRADJI AOUAT RACHID NAAMOUNE SAMY (17).
La rationalisation de l'élevage ovin dans le Nord
Algérien. Mémoire de fin de cycle en vue de l'obtention d'un
diplôme de Docteur Vétérinaire 2002- 2003. Pages 34, 35.
DOMINIQUE SOLTNER (34).
Zootechnie générale Tome I. La reproduction des
animaux d'élevage. Collection sciences et techniques agricoles.
3ème édition 2001. pages : 29, 39, 41, 67,75.
ERICH KOLB (26).
Edition Vigort et frères, Physiologie des animaux
domestiques. Paris, 1975. pages: 88 95, 96, 118, 119, 623, 625, 641, 642, 643,
644, 645, 646, 647, 648, 649, 650, 651, 652, 653, 654, 663, 667.
GHORIBI LOTFI (24).
Obstétrique des animaux domestiques et gestion de la
reproduction des bovins. Edition Office des publications universitaires.
Constantine. 2004. Pages : 21, 24, 25, 26, 27, 28,59.
J. M. PAYNE (22).
Maladies métaboliques des animaux domestiques. Edition du
point vétérinaire, Maisons- Alfort 1983. Pages: 135.
J-P. VAISSAIRE (32).
Edition Maloine S.A. Sexualité et reproduction des
mammifères domestiquer et du
|
laboratoire. Paris. 1977. Pages: 56, 57,61,62, 63,
67,163,186,195, 215, 216,
|
225,
|
234,
|
236,
|
|
242, 245, 246, 247, 249, 250, 262, 300, 333, 334, 336, 338, 343,
345, 350,378,
|
387,
|
388,
|
389.
|
|
J. STOLKOWSKI (12).
|
|
|
|
|
Endocrinologie des vertébrés. Edition Paris
librairie VUILBERT. 1974. Pages: 89, 92,
|
107,
|
108, 109, 110, 112, 116,122, 141, 146, 178.
KAYOUACH (08).
Cours de la physiologie de la reproduction. 2004.
Département des sciences vétérinaire, Elkhroub,
Constantine.
LAFRI (06).
Cours de physiologie de la reproduction. 2001. Département
des sciences vétérinaires, Blida. LAURENT TIRET, THIERRY
LEFRANÇOIS (09).
Cours de la physiologie de l'appareil reproducteur. Unité
pédagogique de physiologie et thérapeutique. E.N.V.Alfort.
France. 2004-2005.
L. BODIN (29).
Productions animales. INRA Février 1999, volume 12
N° 2. Pages: 91.
E.S.A.K. Tunisie (21).
Maîtrise de la reproduction et l'insémination
artificielle des ovins Actes du cours national organisé par E.S.A.K
duTunisie en collaboration avec l'O.E.P. 24-29 avril 1998. Pages: 07, 08, 09,
19,32, 35, 36, 37.
M. COUROT et PATRICIA VOLLAND-NAIL (30).
Productions animales. INRA Février 1991 volume 4 N°
1. Pages : 22, 23.
MOURAD REKIK et MOKHTAR MAHOUACHI (11).
Élevage des ovins et des caprins dans les régions
semi-aride de la Tunisie. Ecole supérieure d'Agriculture du Kef
(E.S.A.K) Année 1997. Pages : 23, 25, 26 40.
NIAR ABDELLATIF (20).
Maîtrise de la reproduction chez les ovins en
Algérie. Thèse en vue d'obtention de diplôme de doctorat en
reproduction animal. 2000-2001.
P. BROERS (01).
Abrégé de reproduction animale. Edition Intervet
International B.V. 1994. Pages: 06, 07, 105, 106, 109, 114, 116, 119.
P. CHEMINEAU, M. BLANC, A. CARATY, G. BRUNEAU, P.MONGET
(28). Productions animales. INRA Juillet 1999, volume 12 N° 3.
Pages : 219.
RABAH CHELLIG (19).
Les races ovines algériennes. Office des publications
universitaires. 1992. Pages: 9, 48, 49, 50, 53, 55, 57, 60, 63, 64, 65, 66.
ROBERT BARONE (02).
Anatomie comparée des mammifères domestiques.
Tome III splanchnologie. Edition Vigot. 1978. Page 283, 389, 309,311, 315, 317,
318, 319, 321, 323, 327, 331, 335, 337, 339, 345, 347, 349, 351, 357, 359, 361,
363, 365, 413, 419.
SERACTA MENOUBA (05).
Cours d'embryologie. 2003. Département des sciences
vétérinaire, Elkhroub, Constantine. THIMONIER et al
(10).
Curso de reproduccion animal. Instituto agronomico mediterraneo
de ZARAGOZA. 24 Abril29 Junio 1990.
YVES RUCKEBUSCH (27).
Édition MALOINE S.A. Physiologie et pharmacologie
thérapeutique animales. 2ème édition. 1981. Pages: 239,
241, 242, 243, 244, 245, 246, 248, 265.
ZIDANE Khaled (33).
Suivie clinique et histologique des paramètres de la
reproduction chez la brebis. thèse en vue d'obtention du grade de
magister en médecine vétérinaire. 1998-1999.
Les sites d'Internet:
http://ressources.ciheam.org/om/pdf/a38/99600166.pdf
(35)
(dimanche 4 février 2007).
http://www.refer.org.ma/ovirep/cours2/compofemelle.htm
(36)
(dimanche 4 février 2007).
http://www.refer.org.ma/ovirep/cours2/brebis.htm
(37)
(dimanche 4 février 2007).
http://www.refer.org.ma/ovirep/cours2/gametes.htm
(38)
(dimanche 4 février 2007).
http://www.inra.fr/productions-animales/an2003/tap2003/be232.pdf
(39)
(dimanche 4 février 2007).
http://vbeaud.free.fr/Sciences/Biologie/especes.html
(40)
(dimanche 4 février 2007).
http://wwwbibli.vet-nantes.fr/theses/2002/lallemand02_100/part1.pdf
(41)
(dimanche 4 février 2007).
http://www.inra.fr/productions-animales/an2001/num212/boissy/ab212.htm
(42)
(dimanche 4 février 2007).
http://www.iav.ac.ma/veto/filveto/guides/repro/students/ouattara.pdf
(43)
(dimanche 4 février 2007).
http://membres.lycos.fr/jbdemars/embryo/frames/gamet.htm
(44)
(dimanche 4 février 2007).
http://www.refer.org.ma/ovirep/cours3/agnel.htm
(45)
(mercredi 7 mars 2007).
http://www.refer.org.ma/ovirep/cours3/prodlait.htm
(46)
(mercredi 7 mars 2007).
http://www.refer.org.ma/ovirep/cours3/sevrage.htm
(47)
(mercredi 7 mars 2007).
http://www-rocq.inria.fr/who/Marc.Thiriet/Glosr/Bio/Neuro/AnatCervo.html
(48)
(mardi 3 avril 2007).
http://georges.dolisi.free.fr/Terminologie/G/glande.htm#Glande%20pinéale
(49)
(mardi 3 avril 2007).
http://wcentre.tours.inra.fr/prc/internet/resultats/melatonine/photoper.htm
(50)
(mardi 3 avril 2007).
http://fr.wikipedia.org/wiki/Glande_pin%C3%A9ale
(51)
(mardi 3 avril 2007).
http://www.etudiantinfirmier.com/index_endocrino.php
(52)
(mardi 3 avril 2007).
http://www.doctissimo.fr/html/sante/encyclopedie/sa_679_hypophyse_general.htm
(53) (mardi 3 avril 2007).
http://www.refer.org.ma/ovirep/cours2/hormones.htm
(54)
(lundi 9 avril 2007).
http://lyon-sud.univ-lyon1.fr/P2/Physio-LK/Pineale.pdf
(55)
(mercredi 11 avril 2007).
http://www.inra.fr/productions-animales/an1996/tap1996/bm961.pdf
(56)
(mercredi 11 avril 2007).
http://www.tours.inra.fr/prc/internet/resultats/melatonine/chemfig.htm#fig1
(57)
(mercredi 11 avril 2007).
http://www.gfmer.ch/Medical_education_En/Cameroon/Pdf/Ovogenese.pdf
(58)
(vendredi 02 février 2007).
http://www.inra.fr/productions-animales/an1996/tap1996/pc961.pdf
(59)
(samedi 14 avril 2007).
http://www.ilri.org/InfoServ/Webpub/Fulldocs/X5489b/x5489b0y.htm#TopOfPage
(60) (samedi 14 avril 2007).
http://www.inra.fr/productions-animales/an1996/num961/resumes/bm961.htm
(61)
(samedi 14 avril 2007).
http://www.fao.org/docrep/v1650t/v1650T01.htm#TopOfPage
(62)
(samedi 14 avril 2007).
http://www.inra.fr/internet/Produits/PA/an2000/num204/thimoni/jt204.htm
(63)
(samedi 14 avril 2007).
http://www.fundp.ac.be/facultes/sciences/departements/veterinaire/recherche/centres/physiol
ogie/doc/rentabilite_mouton. (64)
(samedi 14 avril 2007).
http://selections.medecine-sciences.com/archives/Volume0/sms16/Art11.pdf
(65)
(samedi 14 avril 2007).
http://www.inra.fr/internet/Produits/PA/an1999/tap1999/bodin992.pdf
(66)
(samedi 14 avril 2007).
http://www.inra.fr/internet/Produits/PA/an1999/tap1999/chemineau993.pdf
(67)
(samedi 14 avril 2007).
http://www.fao.org/docrep/v1650t/v1650T06.htm#TopOfPage
(68)
(jeudi 26 avril 2007).
http://www.refer.org.ma/ovirep/cours2/hormones.htm
(69)
(samedi 23 décembre 2006).
http://www.gredaal.com/biodiversite/fichiers_biodiv/Articles%20specifiques/ressources_anim
ale s/images/carte_ovins.jpg (70)
(mercredi 2 mai 2007).
http://www.fao.org/ag/AGP/AGPC/doc/Counprof/Algeria/Algerie.htm
(71)
(samedi 28 avril 2007).
http://www.gredaal.com/biodiversite/fichiers_biodiv/Articles%20specifiques/ressources_anim
ale s/document/Ovins_algerie.htm (72)
(samedi 28 avril 2007).
http://www.djelfa.org/faune.htm
(73)
(samedi 28 avril 2007).
http://ressources.ciheam.org/om/pdf/a43/00600474.pdf
(74)
(samedi 28 avril 2007).
http://ressources.ciheam.org/om/pdf/a38/99600166.pdf
(75)
(samedi 28 avril 2007).
http://www.facmv.ulg.ac.be/amv/articles/2005_149_4_03.pdf
(76)
(samedi 28 avril 2007).
http://www.agrireseau.qc.ca/ovins/documents/Les%20phytoestrogenes.PDF
(77)
(samedi 28 avril 2007).
ftp://ftp.fao.org/docrep/fao/009/aH209f/aH209f00.pdf
(78)
(samedi 28 avril 2007).
L'activité sexuelle de la brebis.
Résumé:
La brebis partage presque la même conformation
anatomique au niveau de son appareil génital avec touts les
mammifères. Les hormones intervenantes dans la reproduction sont
diverses avec des interactions entre-elles et aboutissent à une
stimulation, inhibition, amplification ou une modulation de la sexualité
de la brebis sans omettre une participation signifiante des organes de sens.
Le cycle sexuel de la brebis est classique avec ses deux
phases : phase folliculaire et la phase lutéale. Ce cycle est de 17
jours en général avec des variations raciales. La gestation est
de 5 mois et la portée peut donner naissance à 2 à 4 voire
même 5 agneaux selon toujours les races.
La notion de photopériode, qui conditionne la
sécrétion de la mélatonine, est primordiale pour
l'espèce ovine. L'alternance des jours courts et des jours longs
détermine la reprise ou l'arrêt de l'activité sexuelle.
Cependant, cette dernière est influencée par plusieurs facteurs
de sorte que le saisonnement est clairement manifesté chez certaines
races que chez d'autres.
Mots clés :
La brebis.
La photopériode. La mélatonine. Les jours
courts. Les jours longs. Le saisonnement.
ZEBIRI Med ezzine.
DJAMAÏ
Abdelhadi.
N° : 07-014.
| 


