EPIGRAPHE
Dr. Michel KASWA
DEDICACE
A mon Père
A ma mère
A mes frères
A tous mes amis et connaissances
Je vous dédie ce travail
AVANT-PROPOS
Au terme de notre premier cycle de graduat à
l'école de santé publique il est d'une obligation de produire un
travail scientifique dont sa réalisation n'étais pas notre
affaire seule, cependant Nous rendons grâce à SEIGNEUR JESUS
CHRIST, maitre des temps et des circonstances en qui nous avons la vie et
l'espérance Nous exprimons notre profonde gratitude au
Pr. Dr CHENGE MUKALENGA Faustin pour la direction et plus
particulièrement à Dr. CHUY KALOMBOLA Didier
pour la codirection, le sacrifice et l'intérêt tout particulier
accordé à ce travail si riche suite à ses orientations.
Un grand hommage mérité est rendu aux
Professeurs, Chefs de Travaux et Assistants de notre Chère école
pour la qualité de leurs enseignements dont nous sommes
bénéficiaires.
Nous saisissons aussi cette opportunité qui nous est
offerte pour remercier les membres de notre famille pour leur soutien tant
financier, matériel que moral.
Nos sincères remerciements à nos parents
KARUBANDIKA GULA Anaclet et RIZIKI COLLETTE
et à mes frères BUKWEKWE JUSTIN GULA, DANIEL BIJA GULA, ESPOIR
SALEH GULA, JEANNETTE GULA, PAPY GULA et ANACLET GULA pour leurs conseils et
encouragements très riche tout au long de notre parcours
académique.
A nos amis et combattants de lutte ALPHA BYADUNIA, FADHILI
GLOIRE, EXAUCEE BINTI, LEVIS BUNGUKE, SUMAILI ALEXANDRE, MALEGA TRESOR, RODRICK
MUTOMBO, NATHAN BOMANA, LAURENT KAPANGA, SANZU Jean-Pierre et tous les
héros dans l'ombre non cités. Qu'ils trouvent ici l'expression de
notre indéfectible attachement.
BIENFAIT SOBANUKA
SIGLES ET ABBREVIATIONS
ADN : Acide Désoxyribo Nucléique
BAAR : Bacille Acide alcoolorésistant
OMS : Organisation mondiale de la santé
CSDT : Centre de santé de Diagnostic et
traitement
PNLT : Programme National de Lutte contre la
Tuberculose
SIDA : Syndrome d'Immunodéficience Acquise
HGR : Hôpital Général de Reference
BK : Bacille de Koch
R : Rifampicine
H : isoniazide
Z : Pyraziramide
E : Etambutol
IDR : Intradermoréaction à Tuberculine
S : Streptomycine
TB : Tuberculose
TEP : Tuberculose Extra Pulmonaire
TP+ : Tuberculose Pulmonaire bacteriologiquement
confirmée
TP/C : Tuberculose Pulmonaire cliniquement
diagnostiquée
PATI : Programme Antituberculeux Intégré
TB-MR : Tuberculose Multirésistant
MF : Microscopie à fluorescence
VIH : Virus d'Immunodéficience Humaine
ZS : Zone de Santé
ZN : Ziehl-Neelsen
Liste annexe
Fiche d'extraction des données
Liste des tableaux
Tableau I. Répartition des cas par tranche
d'âge
Tableau II. Répartition des cas par Sexe
Tableau III. Répartition des cas par Provenance
Tableau IV. Répartition des cas par Diagnostic
Tableau V. répartition des cas par localisation TEP
Tableau VI. Répartition des cas par unité de
traitement
Tableau VII. Répartition des cas par co-infection
TB/VIH
Liste des figures
Figure 1. Répartition des cas par mois d'enregistrement
RESUME
Objectif : L'objectif de notre travail
était de déterminer le profil épidémiologique des
patients et les types de tuberculose chez les patients reçus à
l'Hôpital général de référence, Zone de
santé Kenya, ville de de Lubumbashi, République
Démocratique du Congo.
Méthode : C'est une étude
descriptive transversale des patients diagnostiqués et traités
pour tuberculose du 1er Janvier 2019 au 31 décembre 2019 dans la zone de
santé de la Kenya. Une de 11 zones de santé que compte la ville
de Lubumbashi dans la province du Haut-Katanga (RD Congo). Ont
été inclus tous les patients tuberculeux diagnostiqués et
traités dans la zone de santé pendant la période
d'étude. Les données ont été collectées par
la technique dite, technique documentaire. L'âge, le sexe, la provenance,
provenance, diagnostic, co-infection TB/VIH ont été les
paramètres d'analyse. Les analyses ont été
faitesgrâce aux logiciels Epi-Info et Excel
Résultat :sur un total de
260.975habitants que compte la zone, 1561 patients tuberculeux ont
étés enregistrés soit une prévalence de 0.6%. Le
sexe masculin représentait 59, 39% contre 40,61% de sexe
féminin avec un sexe ratio de 1.46 en faveur des hommes. La moyenne
d'âge était de 33#177;. La majorité des patients soit
24,42% appartiennent à la tranche d'âge entre 28 et 37 ans. La
tuberculose pulmonaire a représenté 71,43% contre 28.57% de
tuberculose extrapulmonaire dont la localisation pleurale avait 38,56%. Avec
une co-infection au VIH+ de 11,40%
Conclusion ; la tuberculose pulmonaire est
une maladie fréquente avec une prévalence de 71,4% sur
l'ensemble des patients reçus.
Mots-clés : Profil
épidémiologique, Tuberculose, Zone de santé.
INTRODUCTION
1. ETAT DE LA QUESTION
La tuberculose est une maladie très dangereuse et
contagieuse car elle occupe la neuvième cause de la mortalité
dans le monde et la principale cause d'un seul agent infectieux, en tête
de classement de décès par rapport au VIH/SIDA. La tuberculose
touche tous les pays et toutes les tranches d'âge, mais c'est une maladie
qui peut être prévenue et guérie. Elle peut toucher tout le
monde, partout, mais la plupart des personnes qui développent la maladie
sont des adultes, plus souvent des hommes que des femmes, et les 30 pays
à forte charge de morbidité due à la tuberculose
totalisent près de 90 % des cas de tuberculose survenant chaque
année. La tuberculose constitue, à l'échelle mondiale, un
sérieux problème de santé publique. L'Organisation
mondiale de la santé (OMS) estimait ainsi qu'en 1993, un tiers de la
population mondiale (soit 1,7 milliard de personnes) était
infecté par le bacille de Koch (BK, Mycobacterium tuberculosis), dont,
chaque année, environ 8,8 millions de personnes développeront la
maladie et 3 millions mourront (OMS, 1993).
En 1996, la tuberculose fut responsable de 22,7% du nombre
total des morts indigènes pour maladies infectieuses et parasitaires
(2,2% des décès pour toutes les causes), c'est-à-dire deux
fois le taux mondial de mortalité spécifique par tuberculose
(Amarante, 1999).
L'Organisation mondiale de la santé rapporte à
travers son rapport annuel consacré à la tuberculose et sorti en
2015 que 1,5 million de personnes sont mortes de la tuberculose l'année
précédente. En 2016, 6,3 millions de nouveaux cas de tuberculose
ont été signalés contre 6,1 millions en 2015, soit 61% de
l'incidence estimée 10,4 millions. La tuberculose est l'une des
principales causes de mortalité chez les personnes séropositives:
en 2016, 40 % des décès dus au VIH étaient dus à
cette dernière (OMS, 2016). Environ 82 % des
décès dus à la tuberculose chez les personnes
séronégatives se sont produits en 2016. En 2017, à
l'échelle mondial 6,4 millions de nouveaux cas ont été
notifiés, contre 7,0 millions en 2018 (OMS, 2019). Au
total, 1,4 million de personnes sont mortes de la tuberculose en 2019 dont 208
000 présentaient également une infection à VIH dans le
monde. 10 millions de personnes ont contracté la tuberculose dans le
monde entier en 2019 dont, 5,6 millions d'hommes, 3,2 millions de femmes et 1,2
million d'enfants. Chez les enfants et les adolescents, la maladie n'est
souvent pas reconnue par les prestataires de soins et elle peut être
difficile à diagnostiquer et à traiter. Parmi les nouveaux cas de
tuberculose enregistrés en 2019, 87 % sont survenus dans les 30 pays
présentant la plus forte charge de la maladie (OMS,
2020).
Bien que la maladie soit curable, la forte prévalence
dans les pays les plus pauvres s'explique par la conjonction d'un ensemble de
facteurs : précarité, promiscuité, dénutrition,
analphabétisme, infrastructure médicale insuffisante, et surtout
épidémie d'infection par le VIH. La prévalence
s'accroît en cas de guerre ou de famine. On constate également que
l'accès au diagnostic et au traitement pose un problème dans les
pays concernés. (OMS, 2020). Le risque que l'infection
tuberculeuse se transforme en tuberculose évolutive est 18 (15-21) fois
plus élevé chez les personnes infectées par le VIH que
chez celles qui ne le sont pas. La tuberculose et le VIH forment une
association meurtrière, chacun accélérant
l'évolution de l'autre. En 2019, environ 208 000 personnes sont mortes
d'une tuberculose associée au VIH. Le pourcentage de cas notifiés
de tuberculose pour lesquels un résultat attesté de test de
dépistage du VIH était disponible s'établissait à
69 % en 2019, contre 64 % en 2018 (OMS, 2020). En 2020, 198
pays et territoires représentaient plus de 99 % de la population
mondiale et du nombre estimé de cas de tuberculose ont fourni des
données. (OMS, 2021)
En Afrique 2016, 2,5 millions de personnes ont
contracté la tuberculose, soit un quart des nouveaux cas de tuberculose
dans le monde, Les enquêtes de prévalence menées de 2010
à 2016 ont révélé que, dans certains États
Membres, jusqu'à la moitié des cas de tuberculose existants
n'étaient pas dépistés, 417 000 personnes sont mortes de
cette maladie en 2016. Plus de 25 % des décès dus à la
tuberculose surviennent dans, En 2016, on estime qu'un million d'enfants ont
contracté la tuberculose et que 250 000 d'entre eux en sont morts y
compris les enfants atteints de tuberculose associée au VIH.
(OMS Afrique, 2017). La tuberculose demeure un problème
de santé majeur malgré la baisse constante et remarquable de son
incidence entre 2010 et 2017, En 2017 près de 2,5 millions de nouveaux
cas de tuberculose, ce qui équivaut à 25 % des cas
notifiés dans le monde (OMS Afrique, 2018). Comme
l'indique le rapport sur la lutte contre la tuberculose en 2018, La
prévalence de la tuberculose qui était estimée à
237 cas pour 100000 habitants en 2017, était la plus forte au monde, la
moyenne mondiale étant alors de 133 cas de tuberculose pour 10000
habitants. Seulement 50 % des cas de tuberculose multi-résistante sont
détectés et traités convenablement. En outre, le nombre de
personnes vivant avec le VIH dont le risque de contracter la tuberculose est au
moins dix fois supérieur à celui des personnes
séronégatives, reste très élevé. Par
ailleurs, 16 des 30 pays à forte charge de tuberculose dans le monde se
trouvent dans cette région et quarante-six pour cent des budgets
destinés à la lutte contre la tuberculose dans les États
Membres n'étaient pas financés. La tuberculose est une
maladie encore largement répandue et où les mesures visant
à freiner son expansion souffrent souvent de faiblesses liées aux
contraintes financières, au niveau de vie de la population et au
système de santé en place. (OMS Afrique, 2019).
La charge de la tuberculose associée au VIH est la plus
élevée, 86 % des patients atteints de tuberculose disposaient
d'un résultat attesté au test de dépistage du VIH.
(OMS Afrique, 2020)
La République Démocratique du Congo est parmi
les trente pays de la planète les plus touchés. Il occupe le 9e
rang dans le monde et le 2e en Afrique. En 2019, 180 178 malades ont
été confirmés comme porteurs de la tuberculose, parmi eux,
13 878 ont été aussi coinfectés par le VIH. 92% des
personnes affectées par la tuberculose et mises en traitement ont
été traitées avec succès. La tuberculose constitue
un problème de santé publique majeure, Notre pays est
classé en Afrique en deuxième position en termes de fardeau de la
tuberculose et neuvième au niveau mondial. En 2020, nous avons
notifié plus de 200 000 cas de tuberculose sur l'ensemble du territoire
national, il faut de moyens conséquents pour réduire le fardeau
de la Tuberculose, « Chaque personne a les bacilles avec lui. Mais le
bacille est dormant. Il attend des conditions favorables pour se
réveiller. Et donc, chaque centimètre de ce pays est
supposé couvert par les activités de lutte contre la tuberculose
» (kayomo, 2020) Directeur du Programme
national de lutte 1(*)contre
la tuberculose (PNLT), à l'occasion de la Journée mondiale de
lutte contre la tuberculose, célébrée le 24 mars de chaque
année par les Nations unies, La lutte contre la tuberculose est
coordonnée par le programme national de lutte contre la tuberculose,
Ce programme a intégré un protocole de prise en
charge dans les centres de santé de dépistage et de traitement de
la tuberculose (CSDT) réunissant théoriquement un
équipement minimum pour répondre aux besoins de la population
dans cette matière. En passant de 180.000 cas de tuberculose en 2019
à plus de 202.145cas en 2020 constitue une raison de plus pour
s'inquiéter (Kayomo, 2021). La tuberculose est une
maladie infectieuse d'origine bactérienne potentiellement grave qui
touche principalement les poumons, l'année dernière (2020), en
dépit de la survenue de la maladie à covid-19, pour la
première fois, nous avons dépassé la barre de 200000cas de
tuberculose notifiés en une seule année (E. Longondo,
2021) Au niveau de la coordination Provinciale de lutte
contre la tuberculose Katanga Sud, l'incidence de la tuberculose est
estimée à 0.18% pour une population estimée à 3 636
747 habitants en 2010 et le taux de décès chez les nouveaux cas
de tuberculose à microscopie positive a été estimé
à 5% pour 3687 cas enregistrés au cours de la même
année. Au cours de 2011 la Zone de santé de Lubumbashi a
rapporté 708cas de tuberculose sur une population de 134 804
habitants soit une prévalence de 0,5%. (Tshamba, 2014).
La propagation de la tuberculose est plus favorisée par des
facteurs tels que la promiscuité qui est très manifesté
surtout en milieu urbain congolais. Peu d'étude ont cependant
porté sur le profil épidémiologique de la tuberculose dans
les villes congolaises telles que Lubumbashi, c'est pourquoi notre étude
consistera à combler les vides en ce qui concerne la connaissance de
cette maladie par la population lushoise tout en contribuant à lutter
contre la tuberculose.
2. PROBLEMATIQUE ET HYPOTHSES DE RECHERCHE
Sur une population mondiale estimable en 2020 de
7,7millliards, voir la tuberculose elle-même rapporter plus de 10millions
de nouveaux cas, c'est vraiment une question préoccupante (OMS,
2020). Chaque individu a les bacilles avec lui. Mais le bacille est
dormant, il attend des conditions favorables pour se réveiller. Et donc,
chaque centimètre de ce pays est supposé couvert par les
activités de lutte contre la tuberculose (Kayomo,
2021).
La tuberculose touche principalement les adultes pendant les
années les plus productives de leur vie, mais le risque existe pour
toutes les tranches d'âge. Parmi les sujets infectés par le
bacille tuberculeux, le risque de développer la maladie à un
moment quelconque de la vie se situe entre 5 % et 15 %. Ce risque est toutefois
beaucoup plus élevé chez les personnes qui ont un système
immunitaire déficient, notamment celles qui vivent avec le VIH ou qui
souffrent de malnutrition ou de diabète, ainsi que chez les
consommateurs de tabac (OMS, 2020). Le
présent travail vise à répondre à la quête
principale de savoir : Quel est le profil épidémiologique
(Incidence, Prévalence et facteurs de risques), de la tuberculose dans
la zone de santé de la Kenya ?
3. OBJECTIFS DU TRAVAIL
Objectif général
Ce travail a pour objectif, de contribuer à la lutte
contre la tuberculose dans la zone de sante de la Kenya
Objectifs spécifique
Les objectifs spécifiques de notre travail
sont :
- Déterminer l'incidence et la prévalence de la
tuberculose dans la zone de sante de la Kenya
- Identifier les caractéristiques
sociodémographiques et cliniques de la tuberculose au sein la zone de
santé Kenya
4. CHOIX ET INTERET DU SUJET
Nous avons porté notre choix sur ce sujet, en vue de
son importance dans la population Congolaise toute entière et plus
précisément celle de la Zone de santé de Kenya, car nous
trouvons qu'il est vraiment nécessaire que cette dernière change
de perspective sur cette maladie autre fois considérée comme tant
d'autres.
Notre étude comprend trois volets
d'intérêt
Intérêt personnel : Ce
sujet nous permettra d'approfondir les connaissances sur la tuberculose partant
de nos recherches que nous aurions à faire tout au long de ce
travail.
Intérêt scientifique : Le
présent travail avec comme sujet, profil épidémiologique
de la tuberculose dans la zone de sante de la Kenya, constitue un support de
référence utile pour les chercheurs qui voudront avoir une
connaissance dans ce domaine.
Intérêt social : Ce travail
aidera la population Lushoise à bien observer les mesures des
préventions de la tuberculose en vue d'éviter la survenue de
cette dernière.
5. DELIMITATION SPACIO-TEMPOREL DU TRAVAIL
Dans l'espace notre recherche sera limitée dans la zone
de santé de Kenya car elle constitue notre lieu d'étude.
Dans le temps, la recherche s'étendra de l'année 2O19-2020
ce choix porté sur cet intervalle nous permettra de faire une
comparaison entre les années antérieures et une année
postérieure.
6. SUBDIVISION DU TRAVAIL
Le présent travail est subdivisé en deux grandes
parties excepté l'introduction et la conclusion. La première
partie de considérations théoriques comprend deux chapitres. Le
chapitre premier traite de manière générale la
tuberculose. La deuxième partie, expose le cadre empirique. Il comporte
trois chapitres. Le chapitre deuxième présente les
matériels et méthodes. Le chapitre troisième
présente les résultats. Le chapitre quatrième, discute sur
les résultats.
PREMIERE PARTIE : CONSIDERATIONS
THEORIQUES
CHAPITRE I. LA TUBERCULOSE
Il s'agit d'une maladie à évolution et
dissémination lentes dans les sociétés humaines. Elle se
distingue des autres maladies contagieuses (grippe ou rougeole, par exemple)
par divers aspects. Sa période d'incubation est de durée
variable, parfois de plusieurs années. Elle est également
silencieuse sur le plan clinique. Bien que sa période de
contagiosité soit plus longue (quelques semaines à quelques mois,
voire plusieurs années), elle est peu contagieuse. Contrairement
à la rougeole ou autrefois à la variole, par exemple, qui
infectent une population entière lors d'une première exposition
à leur virus, on estime qu'un individu porteur d'une tuberculose
pulmonaire peut infecter dix personnes par an dans des conditions naturelles,
c'est-à-dire en l'absence de traitement (Styblo,
1980).
La tuberculose est une maladie infecto-contagieuse due
à une mycobactérie (le bacille de Koch) qui se transmet par voie
aérienne d'une personne malade à un individu sain. En parlant,
chantant, éternuant ou toussant, le malade projette dans l'air de fines
gouttelettes de salive infectées. Le risque de transmission est
lié à la densité de bacilles dans l'air inspiré
mais aussi à la fréquence, à la durée et à
l'intensité des contacts avec un individu contagieux [Sudre, 1993] La
tuberculose est une maladie infectieuse causée par la bactérie
Mycobacterium tuberculosis, contagieuse, avec des signes cliniques variables.
Elle arrive en tête des causes de mortalité d'origine infectieuse
à l'échelle mondiale, devant le sida. L'Organisation mondiale de
la santé rapporte à travers son dernier rapport annuel
consacré à la tuberculose et sorti en 2015 que 1,5 million de
personnes sont mortes de la tuberculose l'année précédente
(OMS, 2016)
I.1 HISTOIRE DE LA TUBERCULOSE
Maladie au long cours aux manifestations très diverses
et affectant aussi bien humains et animaux, la tuberculose est une maladie
très ancienne, mais dont l'unité nosologique et
l'étiologie ne furent établies qu'au XIXe siècle.
Une ancienne théorie du XXe siècle postulait que la tuberculose
humaine à M. tuberculosis dérivait de la tuberculose bovine
à M. bovis, en étant une conséquence de la domestication
animale. Les études génomiques indiquent que M. tuberculosis et
bovis ont évolué à partir d'un ancêtre commun
présent chez les mammifères et qui aurait infecté les
hominidés d'Afrique de l'est, il y a trois millions d'années. Cet
ancêtre commun aurait Co-évolué avec ses hôtes pour
aboutir aux mycobactéries humaines et animales actuelles. Les souches
modernes pathogènes M. tuberculosis seraient issues d'un clone apparu il
y a 15 000 à 20 000 ans, ou 11 000 ans, à partir d'une souche
ancestrale de M. tuberculosis. (Ousamma, 2015)
Dès l'Antiquité gréco-romaine, plusieurs auteurs ont
décrit une maladie amaigrissante au long cours, dénommée
suivant les uns « phtisie » (pour dépérissement),
suivant les autres « tabès ». Hippocrate (Vè -?IVe
siècle av. J.-C.) puis Galien (IIe siècle apr. J.-C.) et Caelius
Aurelianus (Vè siècle) en ont dressé les symptômes,
notamment pulmonaires. Arrêtée de Cappadoce (fin du IIe
siècle) en a cependant dressé la description la plus
détaillée. Ces descriptions initiales n'ont guère subi de
modifications notables jusqu'au début du XIXe siècle. L'origine
de la maladie a été débattue durant l'Antiquité,
entre héréditaire ou contagieuse, plus tard, Avicenne
décrira la tuberculose comme uniquement contagieuse. (Berche,
2007) C'est en 1733 que Pierre Desault, chirurgien à
Bordeaux, fait paraître un Essai sur la phtisie où il affirme
notamment que la lésion fondamentale de la phtisie est le tubercule, et
est encore un des premiers à signaler la parenté entre la phtisie
pulmonaire et les formes ganglionnaires. L'invention du stéthoscope par
René Laennec en 1817 facilite le diagnostic de la maladie. En
1839, le médecin allemand Johann Lukas Schönlein rassemble en une
description unifiée les manifestations cliniques disparates de la
maladie. Jusqu'alors, « phtisie » et « tuberculose »
étaient souvent considérées comme deux entités,
voisines mais distinctes. Si Schönlein forge en 1834 le terme de
tuberculose, composé d'un nom latin et d'une terminaison grecque, la
littérature médicale, tout comme le langage commun, continuera
d'utiliser indistinctement, jusqu'au début du XXe siècle, les
termes de « phtisie », « consomption » et «
tuberculose ». (Codell, 2010)
De 1865 à 1868, le médecin Jean-Antoine Villemin
reproduit chez les animaux (lapins, cobayes) les lésions de la
tuberculose humaine, par inoculation de tissu altéré humain. Il
peut ainsi affirmer que cette maladie, de nature jusqu'alors inconnue, est due
à un microbe invisible par les moyens techniques de l'époque. Il
démontra en 1869 que la transmission se fait par voie aérienne.
Ses conclusions se heurtent à une forte opposition, en France notamment.
Elles inspirent cependant des travaux comme ceux d'Edwin Klebs, Julius
Cohnheim, Carl Salomonsen et Tappeiner qui aboutissent à établir
de façon indubitable la contagiosité de la maladie
(Regan, Morisky, 2010).
En 1882 enfin, à la suite des travaux de Louis Pasteur,
Robert Koch met en évidence le bacille tuberculeux à partir de
lésions humaines : le 24 mars 1882, il communique d'abord à la
Société de Physiologie de Berlin une note sur la recherche et la
culture du bacille de la tuberculose ; le 10 avril, il publie dans le Berliner
klinische Wochenschrift un mémoire sur l'étiologie de la
tuberculose qu'il rapporte à un bacille décelé dans les
crachats et les lésions tuberculeuses humaines.(Svetlana,
2020)
I.2Symptômes DE LA TUBERCULOSE
Fièvre légère ; Toux persistante
; Expectorations (crachats) de couleur inhabituelle
ou sanguinolentes; Perte
d'appétit et de poids ; Sueurs
nocturnes ; Douleurs dans la poitrine à
la respiration ou pendant la toux ; Douleurs à
la colonne vertébrale ou aux articulations. (J. Allard,
2013)
I.3 FORMes DE TUBERCULOSE
La tuberculose peut revêtir différentes formes
selon la localisation du foyer infectieux. Sa manifestation clinique la plus
fréquente est la forme pulmonaire (la phtisie selon Hippocrate). C'est
elle qui est principalement responsable de la transmission des BK. Les
symptômes de la tuberculose pulmonaire sont bien connus. Certains sont
assez évocateurs, telles la toux prolongée (de plus de trois
semaines), l'expectoration ou encore l'hémoptysie. Fatigue et faiblesse
sont aussi des plaintes communes. Le malade peut également
présenter amaigrissement, perte de l'appétit, fièvre
nocturne de faible intensité, douleur thoracique, transpiration nocturne
et tremblements (Gentilini, 1993).
On distingue 3 formes de tuberculose.
La tuberculose pulmonaire ou phtisie : C'est
la forme la plus courante de tuberculose (environ 70 % des cas). Les
bactéries détruisent les tissus pulmonaires, créant ainsi
des cavités. La maladie reste localisée dans les poumons ;
La tuberculose extra pulmonaire : Dans ce
cas, les bactéries attaquent d'autres parties du corps, comme les os,
les reins, les ganglions lymphatiques, les méninges ou le système
nerveux central. La tuberculose extra pulmonaire s'accompagne ou non d'une
tuberculose pulmonaire ;
La tuberculose disséminée ou
miliaire : (comme des graines de millet disséminées dans
tout le poumon, lui donnant une apparence caractéristique). Les
bactéries se répandent par le système sanguin et attaquent
l'ensemble de l'organisme. Il s'agit donc d'une tuberculose pulmonaire et extra
pulmonaire. (Passeport santé, 2011)
I.4 TYPES DE TUBERCULOSE
I.4.1 La tuberculose ganglionnaire : Elle est
très fréquente au même titre que la tuberculose pulmonaire.
Les adénopathies sont souvent médiatisnales et hilaires. Elles
sont en général de taille modérée, mais peuvent
parfois obstruer une bronche. En périphérie les
adénopathies sont surtout cervicales, puis axillaires et inguinales.
Initialement fermes et mobiles, les ganglions sont ensuite fixés par une
péri-adénite avec peu de signes inflammatoires. Les fistules
externes à bord irrégulier laissent ensuite sourdre (suinter) un
pus caséeux qui se recouvre de croûtes. C'est cette maladie,
nommée scrofule ou écrouelles que les rois de France et
d'Angleterre étaient censés guérir par simple toucher. La
croyance et les cérémonies qui y étaient attachées
ont perduré jusqu'au XIXe siècle. Le diagnostic repose sur
l'examen bactériologique du liquide de ponction et l'examen
anatomopathologique à la suite de la biopsie ganglionnaire. L'apparition
des signes généraux doivent encourager un traitement sans
attendre le diagnostic microbiologique dans ces pays. Selon la même
étude faite en Tunisie (une région endémique de la
tuberculose) qui a porté sur cinquante patients atteints de la
tuberculose ganglionnaire, il a été remarqué que les
adénopathies étaient principalement cervicales (75 %), puis
médiastinales (21 %), sus-claviculaires (9,4 %) et axillaires (6,3 %).
Les tailles ont été retrouvées surtout entre 3 et 5 cm.
Les adénopathies étaient inflammatoires ou fermes. Dans 21,9 %
des cas, la tuberculose ganglionnaire était associée à
d'autres types de tuberculose. La bactériologie a permis le diagnostic
chez 65,6 % des cas. (Marrakchi, Maaloul, 2010)
I.4.2 Tuberculose urogénitale : La
tuberculose urogénitale est responsable de 14 à 41 % des
atteintes extra pulmonaires. Le rein est très souvent infecté
lors d'une tuberculose miliaire le plus souvent au niveau du cortex
rénal. Cliniquement, les lésions sont très souvent
unilatérales. Au niveau du rein, elles sont
préférentiellement situées dans la médullaire
où elles vont produire des granulomes épithélioïdes
avec une nécrose caséeuse (lésion spécifique
à la tuberculose) aboutissant à une destruction tissulaire
(Watfa et Frederic, 2005). L'atteinte se manifeste par des
symptômes liés à la distension rénale en cas
d'atteinte urétérale. Elle peut se manifester cliniquement par
une cystite banale. Or, le diagnostic est évoqué devant une
pyurie sans germe. En cas de lésion génitale, les lésions
touchent fréquemment l'épididyme se traduisant par une
épididymite. Environ 50 à 75 % des hommes avec une atteinte
génitale ont des anomalies radiologiques au niveau de l'appareil
urinaire (W. Saeed, 2012) Un bilan radiologique de tout
l'appareil urinaire (uroscanner) est toujours indiqué ainsi qu'une
radiographie du thorax à la recherche d'une localisation pulmonaire. Le
clinicien oriente vers l'examen cytobactériologique des urines afin de
confirmer son diagnostic. (L. Wang et al, 2003)
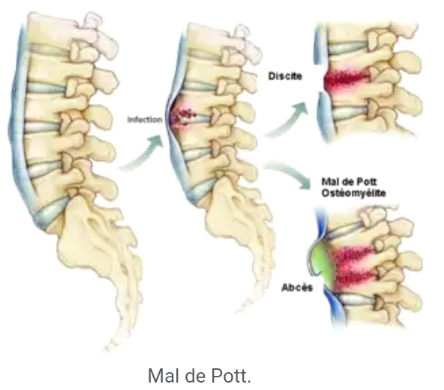
I.4.3 Tuberculose ostéoarticulaire :
La forme la plus fréquente et la plus redoutable est la tuberculose
rachidienne dite mal de Pott ; La localisation au niveau de l'espace
intervertébral (mal de Pott) est la plus fréquente des
localisations ostéoarticulaires et la plus grave car elle siège
au voisinage des structures nerveuses importantes. Elle représente 10 %
des cas de tuberculose (L. Boussel, B. Marchand, 2002). Selon
la même étude faite en Tunisie (une région endémique
de la tuberculose) qui a porté sur cinquante patients atteints de la
tuberculose ganglionnaire, il a été remarqué que les
adénopathies étaient principalement cervicales (75 %), puis
médiastinales (21 %), sus-claviculaires (9,4 %) et axillaires (6,3 %).
Les tailles ont été retrouvées surtout entre 3 et 5 cm.
Les adénopathies étaient inflammatoires ou fermes. Dans 21,9 %
des cas, la tuberculose ganglionnaire était associée à
d'autres types de tuberculose. La bactériologie a permis le diagnostic
chez 65,6 % des cas (Marrakchi, Maaloul, 2010).
I.4.4 Méningite tuberculeuse : Une
forme extrêmement rare, mais très redoutable. Le tableau clinique
et radiologique est atypique. Elle touche les enfants et les adultes jeunes.
Dans sa forme typique la méningite tuberculeuse associe un syndrome
méningé et un syndrome infectieux progressif et peu intense :
fièvre au long cours, otalgie, vomissement. À la suite de la
pratique de la PL, le LCR est classiquement clair, avec une lymphocytose, une
hyperalbuminorachie et une hypoglucorachie. Sa gravité nécessite
la mise en route rapide du traitement. Des séquelles fonctionnelles
s'observent dans plus d'un tiers des cas : hémiplégie, paralysie
des paires crâniennes, troubles sensoriels, calcifications
intracrâniennes, etc. (S. Hafaied, Hamdi, 2015)
I.4.5 Tuberculose cutané : Rare
en Occident où elle ne représente que 1,5 à 2,1 % de
l'ensemble des formes que peut prendre la tuberculose, la forme cutanée
de la tuberculose est cependant endémique en région tropicale et
au Maghreb (H. Lakhdar 2005). Elle adopte alors des formes
cliniques variées : chancre tuberculeux, tuberculose cutanée
miliaire, lupus tuberculeux, scrofulodermes ou gommes tuberculeuses, ou encore
tuberculose péri-orificielle (Beyt, Ortbalds, 1980). La
classification de Beyt de 1980, basée sur des critères
physiopathologiques, est aujourd'hui la référence pour distinguer
les diverses formes : tuberculose d'inoculation (source exogène) :
chancre tuberculeux, tuberculose verruqueuse, certains lupus vulgaris ;
tuberculose secondaire (source endogène) : scrofuloderme (par
contiguïté); tuberculose orificielle (auto-inoculation)
;tuberculose hématogène : certains lupus vulgaris, tuberculose
miliaire aiguë, gomme tuberculeuse ; tuberculose éruptive
(tuberculides) : lichen scrofulosorum, tuberculose papulonécrotiques,
érythème induré de Bazin, vascularite nodulaire
(Tigoulet, Fournier, 2001)
I.5 CONTAGION DE LA TUBERCULOSE
La primo-infection tuberculeuse, consécutive à
l'inhalation du BK et à son implantation dans les alvéoles
pulmonaires, est généralement asymptomatique, la personne
infectée n'étant pas contagieuse. Dans 90% des cas, les
défenses immunitaires de l'individu sont suffisantes pour empêcher
la multiplication et la dispersion des BK dans son corps, ce qui se traduit par
une réaction tuberculinique positive. Dans 10% des cas, l'infection
devient patente. C'est la tuberculose-maladie ou tuberculose primaire : on
considère généralement que 5% des personnes
infectées développeront la maladie dans les deux ans qui suivent
l'infection, les 5% restants à n'importe quel moment de leur vie
(Sudre, 1993) La
primo-infection regroupe les manifestations cliniques, radiologiques et
bactériologiques, survenant après un premier contact infectant
avec le bacille de Koch. Elle est souvent asymptomatique chez l'adulte mais la
littérature rapporte qu'elle peut être symptomatique chez les
enfants à 90 % associant les signes généraux ; les
symptômes sont dominés par la toux chez plus de la moitié
des cas, les douleurs thoraciques chez 20 % des cas, et la dyspnée
(L. Jeannin, 1997). L'examen clinique met en évidence
des adénopathies périphériques chez 37,5 % et la
confirmation du diagnostic se fait à travers l'intradermoréaction
à tuberculine (IDR). Le dépistage de la
tuberculose pulmonaire se fait généralement au cours de
consultation habituelle par un interrogatoire auprès des malades qui
présentent principalement des signes d'imprégnation ainsi que des
symptômes respiratoires persistant pendant plus de deux semaines
(Fikal, Sajiai, 2016).
Cependant, le tableau symptomatique peut être polymorphe,
représentatif dans son ensemble de toute la séméiologie
broncho-pulmonaire.
Symptômes et signes clinique de la tuberculose
|
Symptômes
|
Primo infection
|
TBC pulmonaire
|
|
Toux
|
|
+++
|
|
Fatigue/malaise
|
+
|
++
|
|
Perte pondérale
|
+
|
++
|
|
Sudations nocturnes
|
|
++
|
|
Hémoptysies
|
|
+
|
|
Douleurs thoracique
|
+
|
+
|
|
Signes Clinique
|
|
|
|
Fièvre
|
+
|
++
|
|
Râles à l'auscultation
|
|
+
|
+++ = courant (> 50 %), ++ occasionnel, + rare
Le diagnostic repose sur les différents
éléments allant de l'interrogatoire à l'examen physique et
clinique. L'interrogatoire doit enquêter sur la notion de contagion en
tenant compte de la physiopathologie de la maladie et les modalités du
développement de la lésion. L'installation de la maladie peut se
faire progressivement en s'étalant sur plusieurs semaines et l'examen
clinique se révèle utile à la recherche des
éléments d'orientation vers l'affirmation du diagnostic
(L. Jeannin, 1997). Quant à l'examen clinique, les
éléments qui peuvent faire suspecter la TBC sont nombreux : Signe
généraux : signes d'imprégnation tuberculeuse,
fébricule, sueurs nocturnes et aménorrhée chez la femme.
Signes fonctionnels apparents au début de
l'affection et sont durables à plus de 15 jours. Ils sont marqués
principalement par les signes suivants : toux productive, expectoration
purulente, dyspnée. L'examen physique relève à son tour
à travers l'auscultation et la palpation de la poitrine des râles
crépitant mais il se peut qu'il s'avère neutre et sans
particularité (Brandlia et al, 2003). En revanche quand
il s'agit d'une installation brutale, l'hémoptysie et crachats sanguins
sont plus observés chez les personnes atteintes ainsi que
l'épanchement pleural est observé que ce soit aérien ou
liquidien (A.Tazi, 1998). Le clinicien devant un contexte de
symptomatologie pulmonaire qui persiste au-delà de 15 jours, et en
tenant également compte de la prévalence dans la région en
cause, est en mesure de suspecter la tuberculose et procède à la
procédure de l'affirmation de diagnostic. Cela doit conduire vers des
examens complémentaires : radiographie du thorax et l'examen
cytobactériologique des crachats (Hochedez, Zeller,
2003). Le diagnostic définitif est fondé sur l'isolement
ou la culture du bacille, habituellement à partir des crachats. Les
cavernes sont une complication fréquente de la tuberculose
pulmonaire (Catherine, Paul, 2014). On appelle caverne une
cavité creusée au sein du parenchyme pulmonaire. Les bacilles
tuberculeux se développent initialement dans le poumon sous forme de
nodules, appelés granulomes, qui sont peu à peu entourés
de lymphocytes et de macrophages destinés à contenir l'infection.
Un granulome peut évoluer soit vers la disparition sans cicatrice, soit
vers la caverne, sans que les mécanismes sous-jacents soient compris en
totalité. Les vestiges de macrophages détruits occupent le centre
du granulome et forment la majeure partie de la nécrose caséeuse
(keertan, Helen, 2005). Chez certains patients, cette
nécrose caséeuse se liquéfie et devient un milieu de
culture adapté aux bacilles, qui prolifèrent. Des enzymes
protéolytiques érodent alors la capsule fibreuse située en
périphérie du granulome, et son centre liquide peut alors se
vider peu à peu (keertan, Helen, 2005). Lorsqu'une
caverne tuberculeuse arrive en communication avec l'arbre bronchique, la
dissémination des bacilles dans l'air expiré augmente la
contagiosité. Par ailleurs, la quantité importante de bacilles
contenus dans les cavernes favorise le développement de
résistances aux anti-tuberculeux (W.Saeed, 2012).
La primo-infection peut évoluer de trois façons
· La guérison complète après un
stade exsudatif plus ou moins aigu, avec présence d'assez nombreux
bacilles et polynucléaires
· Formation de tubercules (stade prolifératif),
guérison lente par fibrose et finalement calcification (lésions
pauci bacillaires)
· Évolution par extension et confluence des
tubercules, la liquéfaction du caséum crée une
cavité ; si celle-ci s'ouvre dans une bronche, il y a apport
d'oxygène nécessaire au bacille qui est aérobie, et la
lésion devient pluri bacillaire (un million de bacilles dans une caverne
de 2cm). Cette évolution défavorable se produit dans environ 5%
des cas
Quelques faits relatifs à la transmission de la
tuberculose :
Le bacille de Koch se transmet par des gouttelettes de salive
qui se retrouvent en suspension dans l'air lorsqu'une personne tousse,
éternue, chante ou joue d'un instrument à vent, et non en
touchant une personne contagieuse ; Il faut généralement un
contact répété ou prolongé avec une personne
contagieuse pour contracter l'infection ;Seules les personnes qui
présentent des symptômes sont contagieuses; une personne
contagieuse qui suit un traitement médicamenteux n'est plus contagieuse
après deux ou trois semaines de traitement.(J. Allard,
2013)
I.6 PERSONNES À RISQUE DE LA
TUBERCULOSE
La tuberculose touche principalement les adultes pendant les
années les plus productives de leur vie, mais le risque existe pour
toutes les tranches d'âge. Plus de 95 % des cas et des
décès concernent les pays en développement. Le risque
de développer une tuberculose évolutive est 18 fois plus
élevé parmi les personnes infectées par le VIH. Les sujets
atteints d'autres affections affaiblissant le système immunitaire
présentent également un risque accru de tuberculose
évolutive. Chez les personnes souffrant de dénutrition, le risque
est trois fois plus élevé que la normale. En 2019, 2,2 millions
de nouveaux cas de tuberculose étaient imputables à la
dénutrition dans le monde.
Les troubles liés à la consommation d'alcool et
le tabagisme augmentent le risque d'apparition de la maladie d'un facteur 3,3
et 1,6, respectivement. Parmi les nouveaux cas de tuberculose survenus dans le
monde en 2019, 0,72 million étaient imputables à des troubles
liés à la consommation d'alcool et 0,70 million au tabagisme.
(OMS, 2020)
I.7 FACTEURS DE RISQUE DE LA TUBERCULOSE
La maladie comprend deux étapes : la
tuberculose-infection qui peut rester latente et silencieuse, puis la
tuberculose-maladie où les troubles se manifestent. Le risque de
contracter une tuberculose dépend d'abord du risque d'exposition au
bacille (infection), puis du risque de développer la maladie
après infection.
1. Un premier facteur de risque est le contact étroit
avec un cas contagieux ; la promiscuité respiratoire (familles
nombreuses sous un même toit, personnes ayant vécu ou vivant dans
des pays de forte endémie tuberculeuse, conditions de logement,
populations pénitentiaires, etc.) est généralement en
cause.
2. Un second risque est lié à l'état de
santé du sujet infecté : malnutrition (carence en
protéines), enfant de moins de cinq ans, personnes âgées,
diabétique (Thanh, 2015), personnes en situation de
déficience immunitaire (par infection VIH ou sous traitement
immunosuppresseur, etc. (D. Che, 2012)
3. Enfin la promiscuité et la pauvreté sont deux
facteurs historiques connus : au cours du XVIIIe siècle, près
d'une personne sur quatre était atteinte de tuberculose en occident.
L'épidémie atteint son apogée au XIXe siècle au
cours duquel près de dix millions de personnes sont victimes de la
tuberculose. Environ un tiers des décès enregistrés aux
États-Unis et en Europe sont causés par cette « peste
blanche » (S. Henry, 2013).
La révolution industrielle provoque en effet une
augmentation de la population et, conséquemment une recrudescence des
maladies contagieuses. De plus, les conditions de travail du XIXe siècle
européen, qui subsistent encore dans plusieurs pays, ont
été et sont des facteurs aggravants : les travaux
pénibles, de longues journées de travail, des ateliers
surpeuplés, l'atmosphère empoussiérée
(poussières textiles, métalliques, minérales, organiques,
etc.), ainsi que les conditions de logements (promiscuité, manque d'air
et de soleil, maisons « meurtrières »), la malnutrition, le
tabagisme et les mauvaises moeurs (crachats, saleté, manquement aux
règles d'hygiène corporelle) (Flurin, Worboys,
2010) ; tous ces facteurs peuvent se combiner pour favoriser ou
aggraver l'infection tuberculeuse.
La tuberculose est un indicateur de la précarité
sociale, et du niveau des systèmes de santé (dépistage,
diagnostic et soin). (D. Che, 2012)
4. Le diabète semble être un facteur favorisant :
alors que cette maladie est en voie de « pandémisation » dans
les pays riches notamment, mais de plus en plus aussi dans les pays
émergents et pauvres où d'après l'OMS en 2013, plus de 80
% des 3,4 millions de décès annuels par diabète sont
survenus. Des études trouvent une incidence de tuberculose deux à
huit fois plus élevée chez le diabétique par rapport
à la population moyenne (Banyai1993),
(Stevenson, 2007), (Jeon, 2008) ce qui ferait
du diabète un facteur de risque. En outre, le diabète modifie la
présentation clinique de la tuberculose (âge d'apparition et poids
corporel plus élevés) ; il pourrait modifier la réponse
aux médicaments antituberculeux (temps de « négativation
» bactériologique plus long) et il pourrait aggraver la
transmission et la mortalité par tuberculose (Alisjahbana,
Sahiratmadja, 2007).
5. Le fait de vivre en Asie est un facteur prédisposant
: la plupart des nouveaux cas (49 %) se situent dans les zones peuplées
d'Asie : Bangladesh, Pakistan, Inde, Chine et Indonésie. Il existe une
augmentation dans les pays de l'Europe de l'Est dont la Russie
(Christopher Dye, 2006) ou l'Ukraine. La croissance reste
très forte en Afrique, avec près de 13 % contre moins de 1 % dans
les pays asiatiques.
6. Prise de drogues : l'injection par voie intraveineuse et
surtout chez les porteurs du virus de l'immunodéficience humaine (VIH),
aggrave son incidence, qui atteint ici 12,5 %, soit environ 1,2 million de
personnes en 2014 (P. Benkimoun, 2016)
Cette infection touche l'adulte jeune, et les hommes sont
près de deux fois plus atteints que les femmes. La malnutrition et les
intoxications médicamenteuses sont des causes reconnues de
l'augmentation du nombre de cas.
I.8 MESURES PRÉVENTIVES DE BASE DE LA
TUBERCULOSE
Respecter les mesures d'hygiène. Pour les personnes qui
sont souvent en relation avec des tuberculeux : lavage des mains
fréquent, port d'un masque au besoin. Prendre soin de sa santé.
Avoir une alimentation saine et équilibrée, dormir suffisamment,
faire de l'exercice physique régulièrement, éviter
d'être en situation de stress chronique, etc. Cela offre les meilleures
chances d'avoir un système immunitaire vigoureux. Pour en savoir
davantage, consulter notre fiche Renforcer son système immunitaire et
notre section Vivre en santé. Détecter et traiter une infection
latente. Les personnes qui travaillent dans des milieux à risque ou qui
ont été en contact prolongé avec un malade en phase active
peuvent subir un test cutané afin de déceler la présence
de la bactérie dans le corps (voir la description du test dans la
section Traitements médicaux). Si le résultat est positif, un
traitement préventif aux antibiotiques permet généralement
d'éviter que la maladie se déclenche. Ce traitement
préventif est plus simple et nécessite l'utilisation de moins de
médicaments que pour traiter une tuberculose active. S'informer
auprès de son médecin ou des autorités compétentes
de son lieu de travail. (J. Allard 2013)
I.8 DIAGNOSTIC DE LA TUBERCULOSE
Diagnostic bactériologique, après avoir extrait
des expectorations ou du liquide de ponction auprès du malade,
l'échantillon du prélèvement fait l'objet d'un examen
cytobactériologique à travers les différentes
techniques (Brandlia, 2003) : coloration de Ziehl-Neelsen
(ZN) : La méthode de ZN, datant de 1880 est la méthode la plus
fréquemment utilisée. C'est un examen rapide, simple, et
très spécifique (> 95 % dans les pays à haute
prévalence). Elle permet de mettre en évidence le
caractère Acid alcoolorésistant des bactéries.
L'observation et l'identification des bactéries s'effectuent à
l'aide du microscope optique, avec objectif à immersion. Les
mycobactéries apparaissent alors comme des bacilles rouges sur fond
bleu-gris (Bonnet 2011). Microscopie à fluorescence
(MF) : après coloration à l'auramine elle augmente de 10% la
sensibilité de la détection au microscope par rapport à la
méthode classique de ZN, cet examen reposant sur le microscope à
fluorescence, n'est pas utilisé dans tous les laboratoires au pays de
sud en raison de son cout élevé. Examen de culture : C'est
l'examen de référence des TBC utilisant traditionnellement un
milieu solide Löwenstein-Jensen riche en protéines et ressources
énergétiques nécessaires à la prolifération
de la bactérie (L.Kivihya, 2003). En comparaison avec
la méthode classique sur milieu solide, l'utilisation des milieux
liquides augmente la sensibilité de plus de 10 % tout en
réduisant le délai de la culture de six à deux semaines.
Les performances se révèlent excellentes avec une
sensibilité de 99 % et une spécificité de 100 %.
(Maugein et Bébéar, 2003).
La spécificité des modalités de
diagnostic a fait l'objet de plusieurs études d'évaluation
d'efficacité. Une étude rapporte que la méthode de
coloration Z de N et la MF bénéficient d'une
spécificité élevée allant jusqu'à 98 % dans
le cas de la MF. Une étude montre également que la
concordance diagnostique entre la MF et la culture (souvent prise comme
référence) est largement supérieure à celle qui
existe entre la méthode de ZN et la culture (95,1 % contre 69,6
%) (Bonnet, 2011). Les méthodes de ZN et l'examen de
culture apportent une grande valeur diagnostique vue leur caractère
économique en termes de cout. Ils sont des examens peu couteux et
accessibles et fortement recommandés dans le diagnostic de la TBC. Ils
se révèlent très pratiques et efficaces dans le diagnostic
des tuberculoses ganglionnaire, pulmonaire, méningée et
ostéoarticulaire. (Maugein et Bébéar,
2003)
Diagnostic anatomopathologique, l'examen anatomopathologique
se pratique sur l'échantillon résultant de la biopsie. Il met en
évidence une lésion spécifique à la tuberculose
dite : granulome épitheloide gigantocellulaire à centre
caséeux nécrosé. Le terme de granulome désigne
l'ensemble des éléments cellulaires présents dans un foyer
inflammatoire. Le foyer tuberculeux est entouré d'une grande cellule
polynucléaire résultant de la fusion des macrophages tel que
mentionné dans la physiopathologie de la maladie. (P.Hochedez,
2003)
Diagnostic moléculaire, met en évidence la
présence de l'ADN du germe dans l'échantillon issu de la ponction
ou des crachats en cas de TBC pulmonaire. La technique de l'art et telle que
recommandée par l'OMS est réalisée à l'aide d'un
dispositif nommé GeneXpert et l'utilisation du test rapide Xpert
MTB/RIF. La technique s'appuie sur l'amplification de l'ADN germique via la
cartouche Xpert MTB/RIF riche en ADN polymérase (enzyme intervenant dans
la réplication de l'ADN au cours du cycle cellulaire) et les ressources
énergétiques et protéiques nécessaires à
cette procédure. Son utilisation a largement augmenté depuis
2010, date à laquelle l'OMS a recommandé pour la première
fois son utilisation (D. Alland, 2015). Cela comporte un
avantage majeur portant sur son efficacité et son faible coût. De
nombreuses études ont évalué l'efficacité de la
cartouche dans la mise en évidence des BK et BK résistants
à la Rifampicine ; il est rapporté par une méta-analyse
compilant plusieurs études que le test MTB/RIF est spécifique
à plus de 90 % et présente un outil important facilitant
l'accès à un diagnostic précis à faible cout. La
mise en évidence des BK est établie dans 2 heures après le
test. (M. Bates, 2016) Diagnostic radiologique, la
modalité de diagnostic radiologique se révèle très
utile et indiquée comme étant un examen de première
intention en cas de tuberculose pulmonaire et ostéoarticulaire. Cela est
justifié par les images radiologiques plus ou moins spécifiques
à la tuberculose. La littérature rapporte que la
spécificité varie de 27 à 81 % selon l'étude. Les
imageries idéales et révélatrices de la tuberculose
répondent à certains attributs dont le premier est lié au
siège. En raison de l'affinité que les BK ont envers les
régions aérées, la lésion radiologique est souvent
observée dans les parties hautes des poumons. Néanmoins, l'image
radiographique peut contenir différentes formes : infiltrat : traduisant
des lésions débutantes de l'infection via une opacité peu
dense, hétérogène et étendue ; nodule: granulome de
taille variable, isolé ou groupé ; tuberculome : nodule
isolé pseudo tumoral ; caverne : excavation par perte de substance au
sein d'un infiltrat, aux parois épaisses. (J. Andreu,
2005)
Types de patients diagnostiqués
Tuberculose bactériologiquement
confirmée : Sera défini comme cas de tuberculose
bactériologiquement confirmé (TB+) : tout malade
présentant au moins 1 frottis positif sur 2 échantillons quelle
que soit sa sérologie VIH ; Tout cas avec crachat positif au TDR Xpert :
MTB présent (very low, low, medium, high) ou MDRTB plus (Hain test) sans
résistance à la Rifampicine. Tout patient produisant un
échantillon dont la culture est positive. Les cas de tuberculose
pulmonaire bactériologique ment confirmés sont les plus nombreux.
Tuberculose cliniquement diagnostiquée
(TB/C) : Il s'agit des cas de tuberculose dont la présence des
bacilles n'est pas prouvée (décision du clinicien tenant compte
de l'histologie de la radiographie, etc. Les critères d'orientation
seront les mêmes que pour la tuberculose bactériologiquement
confirmée, mais la preuve bactériologique manque : Excepté
les cas de miliaire aiguë pulmonaire (avec symptômes et radiographie
typique), le traitement des cas présumés de tuberculose
pulmonaire à frottis négatif peut être
différé pour une période de surveillance de 7 jours
permettant de répéter les examens microscopiques de crachats
(jusqu'à 2 séries de 2 frottis Ziehl ou Auramine) à
coupler avec l'avis médical pour le tuberculeux avec test VIH
négatif ; Tandis que le cas présumé tuberculeux pulmonaire
à microscopie négative mais avec test VIH positif ne devra pas
être gardé plus d'une semaine sans traitement spécifique.
Pendant cette période d'attente, le patient sera sous
antibiothérapie à large spectre durant au moins 5 jours. Il peut
s'agir d'une forte présomption à la radiographie pulmonaire sans
résultats par la culture ou TDR. Mais dès qu'un de ces examens
est positif, les malades sera reclassé dans le groupe des
bactériologiquement confirmé ; Si seul les résultats des
frottis à la recherche des BAAR sont disponibles et qu'ils
négatifs alors on notera TP0 ou TP-. Dans le cas
où l'examen de TDR est facilement accessible, il peut être
utilisé en test de diagnostic initial chez les malades
présumés tuberculeux VIH+ positifs Les figures 1 et 2
schématisent le résumé de la démarche diagnostique
pour le présumé tuberculeux et le sujet contact.
I.9 TRAITEMENT DE LA TUBERCULOSE
En 1894, Carlo Forlanini met au point la première
méthode thérapeutique invasive avec le pneumothorax artificiel
intrapleural : par une injection d'air dans la cavité thoracique,
entraînant la rétraction du poumon infecté, il obtient une
amélioration de la maladie. En 1940, Selman Waksman découvre
l'action antituberculeuse de l'actinomycine puis, en 1942, de la
streptothricine. Ces antibiotiques ne peuvent toutefois être
utilisés en thérapeutique humaine ou vétérinaire du
fait de leur trop grande toxicité. En 1943, Waksman découvre
enfin la streptomycine qui permet, un an plus tard, la première
guérison par antibiotique d'un malade gravement atteint de tuberculose
(M. Lubin, 2010). En 1948, a lieu le premier essai clinique
randomisé de l'histoire de la médecine :
l'épidémiologiste Austin Bradford Hill montre que la
streptomycineest plus efficace que la collapsothérapie (R. Doll,
1998)
Le traitement est d'une durée de six mois pour une
tuberculose pulmonaire à bacille de Koch sensible chez un patient
immunocompétent, comprenant 2 mois de quadrithérapie antibiotique
(isoniazide, rifampicine, pyrazinamide et éthambutol), puis 4 mois de
bithérapie (isoniazide et rifampicine). Le traitement prolongé
est indispensable afin de guérir la maladie et éviter
l'émergence de souches résistantes dont l'évolution est
souvent beaucoup plus grave.La rifadine est un traitement qui peut être
utilisé pour traiter la tuberculose osseuse. L'isoniazide est
utilisé généralement à la dose de 5 mg, en
association avec trois autres antibiotiques. L'isoniazide inhibe la
multiplication des bactéries responsables de la tuberculose. Ce
médicament doit être administré à jeun.
Antibiorésistance : une large épidémie de cas de
tuberculose résistante à ce médicament s'est
déclarée à Londres de 1995 à 2006 (HAS,
2016). La rifampicine est utilisée habituellement à la
dose de 10 mg/kg et par jour, pendant une durée de six mois, pour le
traitement de la tuberculose. Cet antibiotique est un fort inducteur
enzymatique : il accélère la dégradation des autres
médicaments, notamment les contraceptifs oraux. Les femmes sous
contraceptifs sont donc invitées à revoir leur traitement
à la hausse (après consultation du gynécologue), voire
à passer à une contraception mécanique
(préservatif...) pendant la durée du traitement. La rifampicine
provoque une coloration orangée des urines. C'est un bon moyen
d'objectiver l'observance du traitement. La streptomycine (découverte
par Selman Waksman vers 1946) fut le premier antibiotique actif contre le
bacille de Koch. Il est contre-indiqué chez la femme enceinte et doit
impérativement être associé à d'autres
antituberculeux (INH et PAS). Par voie intramusculaire chez l'adulte : 15
à 25 mg/kg et par jour. Par voie intrarachidienne : pour l'adulte, 25
à 100 mg/j, pour un enfant, 20 à 40 mg/kg et par jour en deux ou
quatre injections. Surveillance du traitement : les fonctions auditives et
rénales devront être surveillées
régulièrement. L'éthambutol est utilisable chez la femme
enceinte. Elle doit être utilisée le matin à jeun en une
seule prise, quinze à vingt milligrammes par kilogramme. Ne pas
dépasser vingt-cinq milligrammes par kilogramme par 24 heures sans
dépasser soixante jours, puis réduire à quinze
milligrammes par kilogramme et par jour. Surveillance par un fond d'oeil et un
examen de la vision des couleurs mensuels. Le bédaquiline (R207910), une
molécule de la famille des diarylquinolines, pourrait se
révéler prometteuse contre Mycobacterium tuberculosis. Elle fait
naître trois espoirs : raccourcissement de la durée du traitement
; envisager des prises une seule fois par semaine en association avec un autre
antituberculeux ; être active sur des souches multi résistantes,
avec une efficacité bactéricide bien supérieure à
celle de l'isoniazide et de la rifampicine. Ce médicament est
actuellement en phase très précoce de son développement.
Seules des études approfondies chez l'humain permettront de
vérifier que ces espoirs sont fondés. Des corticoïdes sont
ajoutés au traitement antituberculeux en cas de méningite
tuberculeuse, de résistances ou de rechute de traitement. La
corticothérapie doit être commencée après
instauration de l'antibiothérapie, à la dose de 0,5 à 1
mg/kg et par jour pour une durée d'un à deux mois. (H.
Maguire, 2006).
Les antibiotiques de première ligne peuvent vaincre la
tuberculose dans presque tous les cas. On demande aux personnes atteintes de
rester chez elles ou de porter un masque en public jusqu'à ce que le
médecin détermine qu'elles ne sont plus contagieuses
(habituellement, après deux ou trois semaines de traitement). Traitement
de première ligne. On prescrit généralement les quatre
antibiotiques suivants : l'isoniazide, le rifampine, l'éthambutol et le
pyrazinamide, qui sont administrés par voie orale. Pour être
efficace et tuer complètement les bactéries, le traitement
médical exige de prendre les médicaments quotidiennement sur une
période minimale de 6 mois, parfois jusqu'à 12 mois. Tous ces
antibiotiques peuvent causer des dommages au foie à différents
degrés. Il faut donc aviser son médecin si certains
symptômes se manifestent, tels des nausées et vomissements, une
perte d'appétit, une jaunisse (un teint jaunâtre), des urines
foncées ou une fièvre sans cause apparente
Traitements de
seconde ligne. Si les bactéries sont résistantes aux deux
principaux antibiotiques (isoniazide et rifampine), on parle alors de
multi-résistance (TB-MR) et il faut recourir aux médicaments de
2e ligne. On combine parfois de 4 à 6 antibiotiques. Ils doivent souvent
être pris sur une plus longue période, parfois jusqu'à 2
ans. Ils peuvent aussi provoquer des effets indésirables, par exemple,
des engourdissements dans les mains ou les pieds, et une toxicité du
foie. Certains d'entre eux sont administrés par intraveineuse.
(J. Allard, 2013)
La tuberculose est une maladie que l'on peut traiter et
guérir. Les patients atteints de tuberculose évolutive pharmaco
sensible suivent un traitement standard de 6 mois associant 4
médicaments antimicrobiens et reçoivent des informations et un
soutien de la part d'un agent de santé ou d'un volontaire
qualifié. Sans ce soutien, il est plus difficile pour les patients
d'adhérer au traitement. Le diagnostic et le traitement de la
tuberculose ont permis de sauver plus ou moins 63 millions de vies depuis
2000 (OMS, 2020).
I.10 CO-INFECTION TB/VIH
La Tuberculose et le VIH sont deux maladies qui s'influencent
mutuellement et qui s'accompagnent d'un lourd fardeau socioéconomique
pour les populations du monde en général et de la RDC en
particulier. En effet, la tuberculose est la principale cause de
décès observés chez les PVVIH. L'infection à VIH a
un effet amplificateur sur la tuberculose. D'une part, la TB liée au VIH
est évitable et guérissable, et ses effets néfastes sur le
VIH peuvent donc être limités ; d'autre part, le traitement
antirétroviral (TAR) prévient la TB et réduit le risque
d'apparition d'une TB évolutive.
I.10.1 Dépistage Systématique du VIH
chez les Tuberculeux
Pour arriver au dépistage du VIH, le personnel soignant
les tuberculeux doit assurer systématiquement des services de conseil
et dépistage à visée diagnostic du VIH à tous les
tuberculeux. Il doit convaincre le malade tuberculeux de faire les tests de
dépistage au VIH dans un délai acceptable, qui n'excèdera
pas un mois. Les services de conseil et de dépistage du VIH seront
offerts de manière systématique aux patients tuberculeux dans les
structures sanitaires. Le conseil inclut les points suivants :
1. L'explication du lien entre le VIH et la TB ;
2. L'explication de la signification des
différents résultats du test ; 3. L'explication des
possibilités de prise en charge qui existent.
Pour ce faire, le
prestataire aura à suivre les étapes suivantes :
- Informer le caractère volontaire et confidentiel du
service avec le patient tuberculeux ; - Obtenir le
consentement éclairé du patient tuberculeux ;
- Informer sur les différents résultats du test de
dépistage VIH ; - Ne donner les
résultats du test préférentiellement qu'à la
personne concernée ; - Assurer le suivi
psychologique du patient tuberculeux ; -
Assurer la référence si nécessaire vers les structures de
prise en charge appropriée ; - Prendre en
charge le patient co-infecté.
I.11 TUBERCULOSE PHARMACORESISTANTE
Une résistance aux médicaments antituberculeux
selon que les antécédents thérapeutiques seront
définie comme une résistance primaire ou acquise.
La résistance primaire est la
présence d'une souche résistance à un ou plusieurs
antituberculeux chez un nouveau patient tuberculeux n'ayant jamais reçu
de médicaments antituberculeux auparavant.
La
résistance acquise est celle rencontrée chez un patient
déjà traité, comme conséquence d'un traitement mal
prescrit ou mal appliqué.
Cas résistant : Cas de
tuberculose qui présente des bacilles résistants à un ou
plusieurs antituberculeux de première intention.
Monorésistance : Résistance
à un seul antituberculeux de première intention
Poly résistance : Résistance à plus d`un
antituberculeux de première intention autre que la Rifampicine et
l'Isoniazide.
Multirésistance (TB-MR) : Résistance à au
moins la Rifampicine et l'Isoniazide
Ultrarésistance (TB-XDR) : Résistance à une
fluoroquinolone et à au moins un des trois médicaments
injectables de deuxième intention (amikacine, capréomycine et
kanamycine), en plus de la multirésistance
Résistance à la rifampicine : résistance
à la rifampicine : détectée au moyen de
méthodes phénotypiques ou génotypiques, avec ou sans
résistance aux autres antituberculeux
La prise en charge des cas de TB pharmacorésistante
fait partie de la stratégie « Halte à la Tuberculose »
dans sa 2ème composante et aussi est restée un des axes
prioritaires dans le 1er pilier de la stratégie End TB. L'un des
objectifs prioritaires du PNLT est de prévenir la survenue de la
tuberculose multi résistante par la prise supervisée des
médicaments à des doses correctes et pendant une durée
précise.
DEUXIEME PARTIE : CADRE EMPIRIQUE
Chapitre ii. Matérielles et méthodes
II.1 Type d'étude
En ce qui concerne notre travail, nous avons mené une
étude d'observation descriptive transversale
II.2 Milieu d'étude
II.2.1 La ville de Lubumbashi
Fondée en 1910 par les Belges sous le nom
d'Élisabethville, la ville fut renommée Lubumbashi en 1966. Elle
fut aussi la capitale de l'éphémère État
autoproclamé du Katanga (1960-1963), né sous l'impulsion de
Moïse Tshombe. Elle se trouve en République démocratique du
Congo et chef-lieu de la province du haut-Katanga avec une population estimable
à 2 988 170hab. et une superficie de
747Km² et elle est la deuxième ville de la RDC.
Le Maire de la ville : Guylain Lubaba Buluma
Altitude : 1 230 m
Latitude : entre 11° 20' et 12° Sud
Longitude : entre 27° 10' et 27° 40' Est
Climat : tropical à
deux saisons : sèche : d'avril
à octobre pluvieuse : novembre à
mars avec une pluviométrie moyenne de 1 228 mm d'eau
Températures : moyenne : 20 °C
les plus basses : 15,8 °C en moyenne, mais pouvant
descendre jusqu'à 10 °C au mois de juillet; les plus hautes : 22,5
°C en moyenne pouvant monter à 38 °C en octobre.
Elle est divisée en sept communes dont une rurale :
Commune Annexe (rurale) Kamalondo
Kampemba
Katuba Kenya
Lubumbashi
Rwashi
II.2.2 Historique de la zone de santé
Kenya
La zone de santé Kenya est une entité urbano -
rurale. Elle a actuellement une population élevée à
260.975 habitants sur une superficie de 25 Km2. Elle s'étend sur la
totalité de la commune de Kenya et sur une partie de la commune
Annexe.
Son historique est étroitement lié à
celui de l'HGR Kenya. Ce dernier fut construit vers les années 1954-1955
afin d'accueillir les malades de tuberculose dont la prévalence
était très élevée dans cette partie de la ville de
Lubumbashi, alors Elisabethville. La politique coloniale Belge de
l'époque dans le secteur de la santé visait l'éradication
de certaines maladies dont la tuberculose, cette pathologie qui ravageait la
population autochtone. Il est cependant important de retenir qu'à cette
époque, seuls les soins octroyés à la population
comptaient, et l'organisation administrative en tant que zone de santé
était inexistante.
Au fil des années, le centre de dépistage de la
tuberculose prit la forme d'une formation hospitalière ou d'autres
services venaient l'élargir le paquet minimum d'activités
autrefois limité au dépistage de la TBC. Le souci d'organiser
administrativement le ministère national de la santé poussa le
gouvernement à mettre sur pieds les structures de représentation
au niveau tant national, provincial, urbain que local. C'est dans cet ordre
d'idées qu'est née d'abord la zone de santé Kenya -
Kamalondo, devenue avec le dernier aménagement, zone de santé
Kenya. Elle a en son sein un HGR et d'autres structures sanitaires
disséminées sur son étendue. Elle est actuellement
constituée de dix - huit aires de santé dont dix dans la partie
urbaine et trois dans la partie rurale.
La zone de santé Kenya est dirigée par un
Médecin Chef de Zone de Santé (MCZS) qui est entouré des
autres membres de l'Equipe Cadre de la Zone de Santé (ECZS)
II.2.3 Situation géographique
La zone de sante Kenya est limitée :
- Au Nord par la zone de santé Mumbunda avec laquelle
elle est séparé par le Boulevard Katuba,
- Au Nord - Est par la zone de santé Kamalondo avec
laquelle elle est séparée par le rail allant aux usines GECAMINES
de Lubumbashi,
- À l'Est par la zone de Santé Kampemba avec
laquelle est séparée par le rail allant vers Sakania
- Au Sud - Est par la zone de santé Kisanga avec
laquelle elle est séparée par la rivière Kasungami
- À l'Ouest par la zone de santé Katuba avec
laquelle est séparée par la rivière Lubumbashi.
II.3Unité d'analyse
Les structure dans lesquelles nous avions mené notre
étude sont l'hôpital général de
référence de la Kenya qui est une structure de deuxième
échelon et fournissant le paquet complémentaire d'activité
et qui est encore un (CSDT) et le Centre de santé Kenya I, structure de
premier échelon et fournissant le PMA qui est en soit un (CST).
II.4Population d'étude
Notre travail avait pour population d'étude, l'ensemble
de tuberculeux traités dans la Zone de santé Kenya.
II.5 Échantillonnage
- Technique
Nous avions procédé par l'échantillonnage
non-probabiliste
- Critère d'inclusion et
d'exclusion
Sont inclus dans notre étude tous les tuberculeux
traités dans la zone de santé de Kenya pendant la période
d'étude (Du 1er janvier 2019 au 31decembre 2019) et sont
exclus dans notre étude les tuberculeux non traités dans la zone
de santé de Kenya.
- Taille : Nous avions
considéré 1561 patients de la tuberculose dans la zone de
santé Kenya
II.6Collecte des données
Nature : Notre collecte s'est basée
sur les informations sociodémographiques et Cliniques de patients
tuberculeux.
Sources: nos données ont
été trouvées dans les Registres des malades
Technique de collecte: la technique dont nous
avions opté pour la collecte des données est la technique
documentaire.
Outil de collecte : l'outil qui nous a permis
à récolter les données est la fiche d'extraction
Mode de collecte : nous avions eu les
renseignements sur le tuberculeux en faisant des captures de photos dans les
registres
II.7 Analyse des données
Pour analyser les variables nous avions procédé
par :
- Dépouillement et classification par structure
- Encodage par masque de saisie
- Traitement : pour traiter les
données nous avions fait recours au logiciel d'analyse statistique
Epi-info et Microsoft Excel
Nous avons calculé la prévalence de la
tuberculose de la manière suivante : 1561*100/260975 = 0,6%
II.8 Aspects Éthiques
La conduite de l'étude a été
approuvée par le MCZ de la Kenya. Etant
donné que dans toute recherche, des règles éthiques et
déontologiques sont à respecter. De ce fait lors de notre
recherche, le consentement libre et éclairé a été
respectées et pour garantir la confidentialité, les
données obtenues ont été récolté et
traité dans l'anonymat
II.9 Difficultés rencontrées
Lors de notre étape de collecte des données nous
avions connu quelques contraintes pour atteindre notre objectif, mais une seule
a attiré notre attention :
- Difficultés d'accéder aux registres des
tuberculeux suite à la grève et là on était
obligé de payer quelques choses pour y accéder malgré
l'approbation du MCZ de la Kenya
Chapitre III. Présentation des
résultats
III.1 Caractéristiques de patients inclus dans
cette étudeTableau I. Répartition par tranche
d'âge
|
Tranche
|
Fréquence
|
Pourcentage
|
|
>1 - 10
|
63
|
4,04%
|
|
>10 - 19
|
159
|
10,19%
|
|
>19 - 28
|
358
|
22,95%
|
|
>28 - 37
|
381
|
24,42%
|
|
>37 - 46
|
295
|
18,91%
|
|
>46 - 55
|
170
|
10,90%
|
|
>55 - 64
|
73
|
4,68%
|
|
>64 - 73
|
47
|
3,01%
|
|
>73 - 80
|
7
|
0,45%
|
|
>80
|
7
|
0,45%
|
|
Total
|
1561
|
100,00%
|
Ce tableau nous montre que la majorité des patients
soit 24,42% appartiennent dans la tranche d'âge entre 28 et 37 ans. La
moyenne d'âge était de 33ans.
|
Sexe
|
Fréquence
|
Pourcentage
|
|
F
|
634
|
40,61%
|
|
M
|
927
|
59,39%
|
|
Total
|
1561
|
100,00%
|
Tableau II. Répartition par
sexe
Ce tableau nous
renseigne que les patients de sexe masculin étaient plus touché
avec 59,39% soit 927 cas contre 40,61% soit 634 cas avec un sexe ratio de 1,46
pour les hommes.
Tableau III. Répartition par
provenance
|
PROVENANCE
|
Fréquence
|
Pourcentage
|
|
HORS ZONE
|
1106
|
70,85%
|
|
ZONE
|
455
|
29,15%
|
|
Total
|
1561
|
100,00%
|
La majeure partie des sujets concernés par notre
étude venaient Hors Zone soit 70,85% contre 29,15% qui venaient de la
Zone.
III.2 Fréquences de la tuberculose chez les
patients considérés dans cette étude
Tableau IV. Répartition par
diagnostic
|
DIAGNOSTIC
|
Fréquence
|
Pourcentage
|
|
TEP
|
446
|
28,57%
|
|
TP/C
|
212
|
13,58%
|
|
TP+
|
903
|
57,85%
|
|
Total
|
1561
|
100,00
|
Les résultats nous montrent que la tuberculose
pulmonaire a été la plus représenté avec 71,43%
dont 57,85% pour le la tuberculose pulmonaire bactériologiquement
diagnostiqué (TP+) et 13,58% pour la tuberculose pulmonaire cliniquement
confirmé (TP/C) contre 28,57% de cas la tuberculose extra
pulmonaire(TEP)
|
LOCALISATION
|
Fréquence
|
pourcentage
|
|
Abdominale
|
70
|
15,70%
|
|
Ganglionnaire
|
78
|
17,49%
|
|
Méningée
|
5
|
1,12%
|
|
Osseuse
|
121
|
27,13%
|
|
Pleurale
|
172
|
38,56%
|
|
Total
|
446
|
100,00%
|
Tableau V. Répartition de la TBC par
localisation
Les données de 446 patients nous montrent qu'il y
avait plus autant la TEP Pleural avec 172 cas soit 38,56% et la localisation
la moins représentée est la TEP méningée avec 5cas
soit 1,12%.
Tableau VI. Répartition par co-infection
TB/VIH
|
COINFECTION
|
Fréquence
|
Pourcentage
|
|
NON
|
1383
|
88,60%
|
|
OUI
|
178
|
11,40%
|
|
Total
|
1561
|
100,00%
|
Le ci-haut nous montre que 1383 cas qui occupent 88,60% de notre
taille n'étaient pas Co-infecté contre 178 qui
représentent 11,40% étaient Co-infecté
Tableau VII. Répartition des patients
unité de traitement
|
UNITE
|
Fréquence
|
Pourcentage
|
|
CS
|
65
|
4,16%
|
|
HGR
|
1496
|
95,84%
|
|
Total
|
1561
|
100,00%
|
La majeure partie de patients soit 1496 cas qui
représentent 95,84% ont été pris en charge par
l'hôpital général de référence contre 65cas
soit 4 ,16% qui ont été prise en charge par le centre de
santé.
Cette figure nous montre que la courbe est ascendante au
mois de mars avec 234 cas qui représentent 14,99%. Ce qui ressort que la
saison sèche domine avec 51,4% contre 48,6% pour la saison
pluvieuse.
Figure 1. Répartition des patients
par mois d'enregistrement
Chapitre IV. Discussion des résultats
Notre étude revêt un intérêt
particulier en ce sens qu'elle permet de nous donner un aperçu sur le
fonctionnement des centres de santé de dépistage et de traitement
de la Zone de Santé de la Kenya. Elle a porté sur 1561 cas de
tuberculose enregistré dans ces centres de dépistage et de
traitement.
Au cours de la période d'étude, une
prévalence de 455 cas de tuberculose pour 100 000 habitants a
été notée dans la Zone de Santé de la Kenya. Cette
prévalence semble confirmer la position de la République
Démocratique du Congo où celle-ci est placée dans la zone
à 300 et plus de cas pour 100 000 habitants (M.Muteya,
2014) et est sensiblement supérieure aux constats
observés par d'autres auteurs (Mitiraoui et Al. 2014), (Brudey,
2006). Ceci serait le reflet probable de la gravité de la
maladie dans notre zone de santé mais ce taux élevé
pourrait être lié à une amélioration du dispositif
de surveillance.
Dans notre étude, les hommes (59,39%) sont plus
affectés que les femmes (40,61%). Nos résultats sont presque
identiques à ceux d'autres études (Muteya, 2014. Baroux,
2010). Les patients tuberculeux enregistrés
dans les CSDT de la Zone de Santé de la Kenya avaient un âge moyen
de 33 ans #177; et les tranches d'âge les plus atteintes étaient
celles de 28-37 ans (24.42%) et 19-28 ans (22.59%).Ces résultats se
rapprochent de ceux de (Mtiraoui et al. 2014) qui ont fait au
cours d'une étude effectuée dans la région sanitaire de
Sousse en Tunisie. Le protocole national de prise en
charge de la tuberculose recommande que les CSDT couvrent toute la juridiction
de la zone de santé pour une facilité d'accès. Les CSDT de
la Zone de Santé de la Kenya ont été
fréquentés par les habitants venant de toute la ville de
Lubumbashi mais la fréquentation des habitants provenant de la Zone de
santé Kenya (29,15%) a été plus importante.
La forme clinique de la tuberculose est dominée par
la localisation Pulmonaire (71.43%) et la forme clinique des tuberculoses
extrapulmonaires la plus fréquente est l'atteinte pleurale (38,56%).
Bien que, l'atteinte pleurale soit la forme la plus fréquente des
atteintes extrapulmonaires de la tuberculose, comme l'ont aussi constaté
(Baroux et D'Ortenzio, 2010) dans leurs études faites
dans l'île de la Réunion « notre constat par
rapport à la forme clinique la plus fréquente diffère de
celui obtenu dans la région sanitaire de Sousse, en France et
l'île de la Réunion où la forme pulmonaire est la plus
fréquente dans les proportions respectives de 66%, 71.1% et
81% »
CONCLUSION
Cette étude sur la tuberculose dans la zone de
santé de la Kenya, nous a permis de noter que la sur un total de 260.975
habitants que compte la zone, 1561 patients tuberculeux ont étés
enregistrés soit une prévalence de 0.6%. Le sexe masculin
représentait 59, 39% contre 40,61% de sexe féminin avec un
sexe ratio de 1.46 en faveur des hommes. La moyenne d'âge était de
33#177;. La majorité des patients soit 24,42% appartiennent à la
tranche d'âge entre 28 et 37 ans. La tuberculose pulmonaire a
représenté 71,43% contre 28.57% de tuberculose extrapulmonaire
dont la localisation pleurale avait 38,56%. Avec une co-infection au VIH+ de
11,40% et nous pouvons rappeler que cet effectif est celui qui a
consulté seulement, que dirons-nous des autres cas qui sont pour
l'instant méconnu et dont n'ont pas accès au service de
santé ?
Nous estimons que le système pour la prise en
charge des patients tuberculeux est encore à améliorer dans la
Zone de santé Kenya.
Vous remarquerez que dans nos résultats il n'y a pas des variables comme
(profession, niveau d'étude, Etat civil...) c'est tout simplement parce
que ces informations ne figurent pas dans le registre des tuberculeux
SUGGESTIONS
Eu égard aux résultats obtenus dans cette
étude, nous suggérons :
Aux autorités sanitaires
- Intensifier les mesures préventives contre la
tuberculose tout en travaillant avec toutes les couches de la population car
c'est ensemble qu'on peut assister à l'éradication de cette
maladie
Au PNLT
- organiser régulièrement des campagnes
d'éducation et de communication pour le changement de comportement des
populations qui observent avec négligences les mesures des
préventions de la maladie tout en rappelant que la RDC a notifié
202.145 en 2020
- envisager des formations de renforcement de capacité
de personnelles santés prenant en charge les tuberculeux
Aux personnels soignants de la zone de santé
Kenya
- Adopter une meilleure méthode de sensibilisation et
surtout de l'éducation pour les patients car il ne suffit pas seulement
de soigner mais éduquer aussi permettra la réduction des cas dans
la zone.
A la population
- Accompagner les patients à suivre le traitement
correctement
- Donner aux patients le soutien et toute l'assurance dont ils
ont besoin
RÉFÉRENCES
Alisjahbana B, Sahiratmadja E, Nelwan EJ et al. (2007), The
effect of type 2 diabètes mellitus on the presentation and treat- ment
response of pulmonary tuberculosis, Clin. Infect. Dis., 45 (4):428-35
Amarrante,
https://www.cairn.info/revue-autrepart-2001-3-page-71.htm
Banyai A.L. (1931), Diabetes and pulmonary tuberculosis, Am.
Rev. Tuber., 24:17.Brändlia, O. et al. Clinique et diagnostic de la
tuberculose, dans Forum Med Suisse, 2003.
Beyt E, Ortbalds DW, Santa Cruz DJ. Cutaneous mycobacteriosis:
analysis of 34 cases with a new classification of the disease. Medicine.
1980;60:95-109.
Bonnet, M., [New diagnostic tests for tuberculosis in southern
countries: from theory to practice in Southern countries]. Revue des maladies
respiratoires, 2011.
Catherine W. M. Ong, Paul T. Elkington et Jon S. Friedland,
« Tuberculosis, Pulmonary cavitation, and matrix Metalloproteinases
», Am J Respir Crit Care Med, American Thoracic Society, vol. 190, no
1,ý juillet 2014, p. 9-18 (ISSN 1073-449X, DOI
10.1164/rccm.201311-2106pp, lire en ligne).
C Ben Taarit, S Turki et H.Ben Maïz, « La
tuberculose ostéoarticulaire en Tunisie : étude
rétrospective de 180 cas », Médecine et Maladies
Infectieuses, Elsevier BV, vol. 33, no 4,ý avril 2003, p. 210-214 (ISSN
0399-077X, DOI 10.1016/s0399-077x(03)00009-x, lire en ligne).
C. Marrakchi, I. Maâloul, D. Lahiani, B. Hammami, T.
Boudawara, M. Zribi et M. Ben Jemaâ, « Diagnostic de la tuberculose
ganglionnaire périphérique en Tunisie », Médecine et
Maladies Infectieuses, Elsevier BV, vol. 40, no 2,ý février 2010,
p. 119-122 (ISSN 0399-077X, DOI 10.1016/j.medmal.2009.10.014, lire en ligne).
Christopher Dye, « Global epidemiology of tuberculosis
», The Lancet, Elsevier BV, vol. 367, no 9514,ý mars 2006, p.
938-940 (ISSN 0140-6736, DOI 10.1016/s0140-6736(06)68384-0, lire en ligne).
D. Alland, M. Rowneki, L. Smith, S. Chakravorty, J. Ryan et M.
Chancellor (2015) « Xpert MTB/RIF Ultra: a new near-patient TB test with
sensitivity equal to culture » dans Conference on Retroviral and
Opportunistic Infections, Seattle, WA.
D. Che, « Épidémiologie de la tuberculose
», La Revue du Praticien, no 4,ý avril 2012, p.473-478.
Dr Michel Kaswa Kayomo PNLT
https://www.radiokapi.net/2021/03/24/actualite/sante/rdc
Dr Eteni Longondo ministère de la santé RDC
https://zoom-eco.net
Dr Jacques Allard,
https://www.passeportsante.net/fr/Maux/Problemes/Fiche.aspx?doc=tuber)culose-pm-prevention-de-la-tuberculose
Dr. Robert Koch, « The Aetiology of Tuberculosis »
[« L'étiologie de la tuberculose »] [PDF], sur deltaomega.org
(consulté le 16 juillet 2010).
Formes cliniques de la tuberculose cutanée. F.
Tigoulet, V. Fournier & E. Caume (2001)
Global tuberculosis report », sur World Health
Organization (consulté le 9 novembre 2017Guide infection longue
durée, tuberculose active, sur Haute Autorité de Santé
(consulté le 2 mars 2016)H. Lakhdar, « Tuberculose cutanée
», sur Thérapeutique dermatologique, septembre 2005
(consulté le 23 juillet 2012).
J. Andreu, J. Cáceres, E. Pallisa et M.
Martinez-Rodriguez, « Manifestations radiologiques de la tuberculose
pulmonaire », EMC - Radiologie, Elsevier BV, vol. 2, no 1,ý
février 2005, p. 121-132 (ISSN 1762-4185, DOI
10.1016/j.emcrad.2004.11.005, lire en ligne).
Jad Watfa et Frédéric Michel, « Tuberculose
uro-génitale », Progrès en Urologie, vol. 15, no 4,ý
septembre 2005, p. 602-603 (lire en ligne, consulté le 17 mai 2016).
Jeon CY, Murray MB (2008) Diabetes mellitus increases the risk
of active tuberculosis: a systematic review of 13 observational studies. PLoS
Med 5(7):e152
J Maugein et C Bébéar, « Diagnostic
microbiologique de la tuberculose et intérêt de la PCR »,
Médecine et Maladies Infectieuses, Elsevier BV, vol. 33,ý mars
2003, p. 153-158 (ISSN 0399-077X, DOI 10.1016/s0399-077x(03)00069-6, lire en
ligne)
Kay Codell Carter, « The rise of causal concepts of
disease: case histories », sur books.google.fr (consulté le 16
juillet 2010), p. 18
Keertan Dheda, Helen Booth, Jim F. Huggett, Margaret A.
Johnson, Alimuddin Zumla et Graham W. Rook, « Lung Remodeling in Pulmonary
Tuberculosis », The Journal of Infectious Diseases, Oxford University
Press (OUP), vol. 192, no 7,ý octobre 2005, p. 1201-1209 (ISSN
0022-1899, DOI 10.1086/444545, lire en ligne).
L Boussel, B Marchand, N Blineau, C Pariset, M Hermier, G
Picaud, M Emin, A Coulon, P Pagnon, A Rode, J Pin-Leveugle, A Boibieux et Y
Berthezène, « Imagerie de la tuberculose ostéo-articulaire
», Journal de radiologie, Elsevier Masson, vol. 83, no 9-C1,ý
septembre 2002, p. 1025-1034 (lire en ligne).
L. Jeannin, « Tuberculose pulmonaire et primo-infection
tuberculeuse : Épidémiologie, diagnostic, évolution,
traitement, prévention », La Revue du praticien, vol. 47, no
1,ý 1997, p. 97-106.
Li-Jen Wang, Ching-Fang Wu, Yon-Cheong Wong, Cheng Keng
Chuang, Sheng-Hsien Chu et Chi-Jen Chen, « Imaging Findings of Urinary
Tuberculosis on Excretory Urography and Computerized Tomography », The
Journal of Urology, Elsevier BV, vol. 169, no 2,ý février 2003,
p. 524-528 (ISSN 0022-5347, DOI 10.1016/s0022-5347(05)63947-x, lire en
ligne)
L. Kivihya-Ndugga et al. « A comprehensive comparison of
Ziehl-Neelsen and fluorescence microscopy for the diagnosis of tuberculosis in
a resource-poor urban setting », The International Journal of Tuberculosis
and Lung Disease, vol. 7, no 12,ý 2003, p. 1163-1171. Accès
direct.
Large outbreak of isoniazid-monoresistant tuberculosis in
London, 1995 to 2006: case-control study and recommendations
Matthew Bates et Alimuddin Zumla, « The development,
evaluation and performance of molecular diagnostics for detection
ofMycobacterium tuberculosis », Expert Review of Molecular Diagnostics,
Informa Healthcare, vol. 16, no 3,ý 17 février 2016, p. 307-322
(ISSN 1473-7159, DOI 10.1586/14737159.2016.1139457, lire en ligne).
Oussama Baker et al ; Tuberculosis ; 25 février 2015
OMS | Co-infection tuberculose/VIH », sur WHO
(consulté le 16 juin 2020)
OMS, « Tuberculose : Principaux faits », sur
www.who.int (consulté le 1er mars 2021)
Organisation mondiale de la santé, « Global
tuberculosis control 2008 », sur who.int, 2008 (consulté le 17 mai
2016).
P Hochedez, V Zeller, C Truffot, S Ansart, É Caumes, R
Tubiana, C Katlama, F Bricaire et P Bossi, « Caractéristiques
épidémiologiques, cliniques, biologiques et thérapeutiques
de la tuberculose ganglionnaire observée chez des patients
infectés ou non par le VIH », Pathologie Biologie, Elsevier BV,
vol. 51, nos 8-9,ý octobre 2003, p. 496-502 (ISSN 0369-8114, DOI
10.1016/s0369-8114(03)00145-7, lire en ligne).
Patrick Berche, Une histoire des microbes, Paris, John Libbey
Eurotext, 2007 (lire en ligne).
P. Benkimoun, « Tuberculose : malgré les
avancées, la maladie tue plus de 4 000 personnes pas jour », sur Le
Monde, 28 octobre 2015 (consulté le 17 mai 2016).
Rapport mondial sur la tuberculose, Organisation mondiale de
la santé (1993, 2016, 2018, 2019 & 2020)
Rapport sur la tuberculose, Organisation mondiale de la
santé Région Africaine (2017, 2018, 2019 & 2020)
Stéphane Henry, Vaincre la tuberculose (1879-1939) : La
Normandie en proie à la peste blanche, Publication Universitaire Rouen
Havre, 2013, p. 47.
S. Hafaied, B. Hamdi, A. Berraies, H. Cherif, J. Ammar et A.
Hamzaoui, « Localisations rares de tuberculose chez l'enfant : à
propos de 8 cas », Revue des Maladies Respiratoires, Elsevier BV, vol.
32,ý janvier 2015, A231-A232 (ISSN 0761-8425, DOI
10.1016/j.rmr.2014.10.377, lire en ligne).
S. Fikal, H. Sajiai, H. Serhane, S. Aitbatahar, H. Rachid, N.
Moumen et L. Amro, « Primo-infection tuberculeuse », Revue des
Maladies Respiratoires, Elsevier BV, vol. 33,ý janvier 2016, A158 (ISSN
0761-8425, DOI 10.1016/j.rmr.2015.10.311, lire en ligne).
Sudre,
https://www.cairn.info/revue-autrepart-2001-3-page-71.htm
Svetlana Kouznetsova, « Tuberculose :
l'épidémie jamais éradiquée », Courrier
International, no 1568,ý 19 novembre 2020, traduction d'un article paru
le 19 septembre dans Kommersant.
Thanh, N. P., Khue, P. M., Sy, D. N. et Strobel, M. (2015),
Diabète chez les nouveaux cas de tuberculose pulmonaire à
Hanoï, Vietnam, Bulletin de la Société de pathologie
exotique, 108(5), 337-341, lire en ligne.
Stevenson CR, Critchley JA, Forouhi NG et al. (2007), Diabetes
and the risk of tuberculosis: a neglected threat to public health?, Chronic
Illn, 3(3):228-45
Sébastien Gobert, « L'Ukraine livrée aux
maladies infectieuses », Le Monde diplomatique, vol.
Styblo,
https://www.cairn.info/revue-autrepart-2001-3-page-71.htm
Tshamba, July 2014Pan African Medical Journal 17(70):70DOI:
10.11604/pamj.2014.17.70.2445 PubMedTuberculose », sur who.int
(consulté le 16 juin 2020)
Waseem Saeed, « Cavitating pulmonary tuberculosis: a
global challenge », Clinical Medicine, Royal College of Physicians, vol.
12, no 1,ý 1er février 2012, p. 40-41 (ISSN 1470-2118, DOI
10.7861/clinmedicine.12-1-40, lire en ligne).
ANNEXE
FICHE D'EXTRACTION DES DONNEES
« PROFIL EPIDEMIOLOGIQUE DE LA TUBERCULOSE
DANS LA ZONE DE SANTE DE LA KENYA »
Sexe :...
Age :.........
Diagnostic :....................................................
Localisation TEP:..........................................
Unité de
traitement :..........................................
Co-infection TB/VIH : Oui Non
Date
d'enregistrement :.......................................
Provenance : dans la Zone Hors zone
TABLE DES MATIÈRES
EPIGRAPHE
Erreur ! Signet non
défini.
DEDICACE
II
AVANT-PROPOS
III
SIGLES ET ABBREVIATIONS
IV
Liste annexe
V
RESUME
VI
INTRODUCTION
1
1.
ETAT DE LA QUESTION
1
2.
PROBLEMATIQUE ET HYPOTHSES DE RECHERCHE
4
3.
OBJECTIFS DU TRAVAIL
4
4.
CHOIX ET INTERET DU SUJET
5
5.
DELIMITATION SPACIO-TEMPOREL DU TRAVAIL
5
6.
SUBDIVISION DU TRAVAIL
5
PREMIERE PARTIE : CONSIDERATIONS THEORIQUES
6
CHAPITRE I. LA TUBERCULOSE
7
I.1 HISTOIRE DE LA TUBERCULOSE
7
I.2 SYMPTÔMES DE LA TUBERCULOSE
9
I.3 FORMES DE TUBERCULOSE
9
I.4 TYPES DE TUBERCULOSE
10
I.5 CONTAGION DE LA TUBERCULOSE
12
I.6 PERSONNES À RISQUE DE LA TUBERCULOSE
15
I.7 FACTEURS DE RISQUE DE LA TUBERCULOSE
15
I.8 MESURES PRÉVENTIVES DE BASE DE LA
TUBERCULOSE
17
I.8 DIAGNOSTIC DE LA TUBERCULOSE
17
Types de patients diagnostiqués
19
I.9 Traitement de la tuberculose
20
I.10 CO-INFECTION TB/VIH
22
I.10.1 Dépistage Systématique du VIH
chez les Tuberculeux
22
I.11 TUBERCULOSE PHARMACORESISTANTE
23
DEUXIEME PARTIE : CADRE EMPIRIQUE
24
CHAPITRE II. MATÉRIELLES ET
MÉTHODES
25
II.1 Type d'étude
25
II.2 Milieu d'étude
25
II.2.1 La ville de Lubumbashi
25
II.2.2 Historique de la zone de santé
Kenya
26
II.2.3 Situation géographique
26
II.3 Unité d'analyse
27
II.4 Population d'étude
27
II.5 Échantillonnage
27
II.6 Collecte des données
27
II.7 Analyse des données
28
II.8 Aspects Éthiques
28
II.9 Difficultés rencontrées
28
CHAPITRE III. PRÉSENTATION DES
RÉSULTATS
29
III.1 Caractéristiques de patients inclus
dans cette étude
29
III.2 Fréquences de la tuberculose chez les
patients considérés dans cette étude
30
CHAPITRE IV. DISCUSSION DES RÉSULTATS
32
CONCLUSION
33
SUGGESTIONS
33
RÉFÉRENCES
35
ANNEXE
40
TABLE DES MATIÈRES
41



