EPIGRAPHE
Oui, le bonheur et la grâce m'accompagneront tous les
jours de ma vie, et j'habiterai dans la maison de l'éternel
jusqu'à la fin de mes jours.
Psaumes : 23.6
DEDICACE
A toi l'être suprême, tout puissant et infini, ton
nom est l'éternel, Dieu de bonté et de grâce sois
béni à jamais pour ta grâce qui n'a cessé de tomber
sur moi et sur mes études.
A toi mon père Alfred MAWISA pour ton soutien, ton sens
de responsabilité, durant le peu de temps que tu as vécu avec
nous, toi qui m'exhortais à poursuivre sans relâche mes
études tout en mettant à ma disposition les moyens
nécessaires suivant tes capacités, que la terre de nos
ancêtres tes soit douce.
A toi ma mère Georgine NDUKATE toi qui ne te laisse pas
malgré les difficultés, tu t'époumone toujours pour
subvenir à mes besoins afin d'assurer mon épanouissement tant
sur le plan de l'éducation que de l'instruction, tu restes la source
d'amour de ma vie irremplaçable et que pour vous tous, je n'oublierai
jamais tous vos bienfaits à mon égard en symbole de
bénédiction.
AVANT-PROPOS
En ce moment où nous réjouissons
d'acquérir péniblement le grade de gradué en
médecine vétérinaire, il nous semble opportun d'exprimer
profondément notre gratitude à tous ceux d'une manière ou
d'une autre, de loin ou de près ont aidé durant toute notre vie
en général et en particulier durant notre formation
universitaire.
C'est avant tout, grâce au conseil prodigué et
aux remarques particulières du professeur Docteur Victor NDIBUALONJI
B.B. qui en dépit de ses occupations a accepté la direction
scientifique de ce travail. C'est pour cette raison que nous témoignons
notre profonde reconnaissance et nous lui adressons nos vifs remerciements.
Nous sommes reconnaissants envers toutes les autorités
académiques de la faculté de médecine
vétérinaire grâce à leurs conseils éducatifs
nous devenus ce que nous sommes.
Nous adressons nos sentiments de gratitude à nos
parents Alfred MAWISA et Georgine NDUKATE pour tant de sacrifices et amour
consentis pour notre croissance physique, morale et intellectuelle.
Nous disons également merci à vous nos
frères, soeurs, cousins, et cousines Martin KIRIKA, Zephyrin
KIRIKA, Charles MAWISA KUSAMBA, Thérèse MAWISA, Agnesse
MAWISA, Akazia MAWISA, Via MAWISA, Pélagie MAWISA, Joachim LEBU,
Joël LEBU, Jérémie KATAKA Wolir KIRIKA pour nous avoir
soutenus financièrement et spirituellement tout au long de ce premier
cycle d'études universitaires.
A tous les compagnons de lutte, particulièrement Bedel
KAPITENE, Serge KAYEMBE, Théophile KILUBA WA KILUBA, Indrick SHAKO,
Fabrice NGOIE ILUNGA, Alex ILELE, Marie Claire MAPOKO, Pascal MANEMATCHU,
nous disons merci pour tant d'échanges et de soutiens mutuels.
INTRODUCTION
Le cholestérol est indispensable à la vie, il
est le principal stérol de l'organisme tant animal qu'humain sous forme
de cholestérol libre et de cholestérol estérifié
(RUSSEL,1992).
L'organisme a besoin non seulement des constituants organiques
tels que les protéines, les vitamines et les glucides pour subsister,
mais aussi de cholestérol.
Le cholestérol intervient dans des divers processus
tels que la synthèse des hormones sexuelles, des acides biliaires et
dans le traitement des cancers (KOLB, 1975).
Le cholestérol présent dans l'organisme peut
avoir deux sources : soit l'alimentation qui constitue l'apport
exogène, soit la biosynthèse. On considère que chez
l'humain, l'apport du cholestérol par la nourriture est compris entre
300 et 500 mg par jour alors que la production endogène est comprise
entre 600 et 900 mg par jour.
Le cholestérol peut aussi être la source de
pathologies comme l'athérosclérose d'artères vitales, des
troubles cérébrovasculaires et coronariens, ainsi que les
maladies cardiovasculaires(LISCUM, 2008).
L'objectif principal de notre étude est
d'évaluer le rôle que joue le cholestérol comme composant
structural essentiel des membranes cellulaires et comme précurseur des
autres stéroïdes de l'organisme, en précisant son rôle
dans le développement de la lithiase biliaire et
l'athérosclérose. De même, nous voulons expliquer le
rôle des lipoprotéines plasmatiques, à savoir les
chylomicrons, les lipoprotéines de très faible
densité(VLDL), les lipoprotéines de faible densité (LDL)
et les lipoprotéines de haute densité (HDL),dans le transport
plasmatique du cholestérol entre les tissuset enfin nous voulons
préciser le mécanisme de synthèse, de transport et
d'excrétion de cholestérol.
Outre l'introduction et la conclusion, notre travail est
subdivisé en deux chapitres :
- Le premier chapitre est consacré aux
généralités sur le cholestérol et
- Le second chapitre parle sur la synthèse, le
transport et l'excrétion du cholestérol.
CHAPITRE I. GENERALITES SUR
LE CHOLESTEROL
I.1 DEFINITION
Le cholestérol est un lipide de la famille des
stérols qui joue un rôle central dans de nombreux processus
biochimiques. Le cholestérol tire son nom du grec ancien `'chole''
(bile) et `'stéréos'' (solide), car il fut découvert sous
forme solide dans les calculs biliaires en 1758 par François Poulletier
de la Salle. Mais ce n'est qu'en 1814 que le chimiste français
Eugène Chevreul lui donnant le nom decholestérine.
Le mot « cholestérol désigne une
molécule unique. Ce qui signifie que les termes de bon et mouvais
cholestérol ne servent pas à désigner deux
molécules différentes, mais font référence aux
lipoprotéines de haute densité(HDL) et lipoprotéines de
basses densités (LDL),les transporteurs du cholestérol dans le
sang voir en particulier la teneur en cholestérol dans l'alimentation et
athérosclérose(PHILIPPE EVEN,2013).
I.2. HISTORIQUE
Le cholestérol fut découvert sous forme solide
dans les calculs biliaires en 1758 par François Poulletier dela Salle.
Le nutritionniste américain AncelKeys réalisa après la
seconde guerre mondiale une étude épidémiologique sur
plusieurs décennies dans 7 pays qui mit en évidence une
corrélation entre le taux de cholestérol sanguin et les accidents
cardiovasculaires. Ces résultats lui firent émettre
l'hypothèse selon laquelle le cholestérol est le facteur de
risque majeur responsable de la forte mortalité cardio-vasculaire mais
cette étude soufra de biais de comparaison ou des confondeurs.
A la suite de cette étude longitudinale, des essais
cliniques furent menés sur des populations d'anciens combattants
américains mis au régime hypocholestérolémiant mais
ces tentatives n'eurent pas d'impact significatif sur leur mortalité.
En 1954, le chercheur français Jean Cottet
réalisa que des ouvriers agricoles intoxiqués par le pesticide
qu'ils répandaient dans les champs avaient un taux de cholestérol
qui s'était effondré.
Un de ses amis chimistes du nom de Michel Oliver de l'Imperial
chemical industries synthétisa un médicament dérivé
de ce pesticide, le clofibrate. Le test de cette molécule sur des rats
puis sur des patients confirma son effet hypolipémiant (MICHAEL OLIVER,
2O12).
L'Organisation Mondiale de la Santé (OMS)
réalisa un essai clinique sur 1500 européens pour évaluer
l'effet du clofibrate sur la prévention de l'infarctus mais cette
étude fut négative, l'essai devant même être
arrêté prématurément, car le groupe sous clofibrate
avait une prévalence plus élevée que le groupe sous
placebo.
Malgré cette étude réfutant le lien entre
la baisse du cholestérol et la surmortalité, une famille de
molécules médicamenteuses fut lancée, les fibrates.
Dans les années 1990, deux études sur la
simvastatine et la pravastatines montrèrent leur effet de
prévention sur des hommes ayant un taux de cholestérol
élevé.
Certains soulignent que les recommandations tendant à
viser un taux optimal de cholestérol (plus particulièrement sa
fraction LDL),ne sont en fait étayées par aucune étude
,ces dernières ayant toujours été faites à des
doses fixes de statines quel que soit le taux initial de cholestérol,
la baisse de ce dernier n'étant pas un objectif .il semble que ,les
statines ont un effet de prévention vasculaire mais sans lien avec le
taux de cholestérol.
I.3. STRUCTURE CHIMIQUE
La structure chimique de la molécule
decholestérol met en évidence, substituéssur le noyau
cyclique planaire, d'une part, unechaîne hydrocarbonée hydrophobe,
sur lecarbone 17, d'autre part, un groupe OHpolaire hydrophile sur le carbone
3. La molécule decholestérol est une molécule
amphiphile(pourvued'affinités différentes à chacune deses
extrémités), cette caractéristique étant
àl'origine de ses propriétés physico-chimiqueset
biologiques.Sur une phase aqueuse les molécules decholestérol,
orientées par la présence dugroupe OH, constituent une
monocoucheordonnée fluide, chaque molécule occupantune surface de
0,37 nm². Associées àdes molécules de
lécithines insaturées enmilieu aqueux, les molécules de
cholestérolont un effet condensant, la surface occupéepar les
molécules de lécithines décroissant de0,62 à 0,48
nm² (ATOMIC WEIGHTS, 2007).
L'analyse par spectroscopie de
résonancemagnétique nucléaire et de spin
d'électronmontre que le cholestérol ordonne les couchesmixtes
phospholipides-cholestérol et réduit lamobilité des
chaînes carbonées insaturées.L'état structural des
membranes lipidiquesartificielles et des membranes biologiquesnaturelles est
fonction de la température : gelcristallin au-dessous d'une
températurecritique dite température de transition,
cristalliquide au-dessus de cette température. Laprésence de
molécules de cholestérol affecteconsidérablement cette
transition (allant jusqu'à l'abolir complètement de tellesorte
que, même à des températures infra physiologiques, la
couche lipidiqueconserve sa structure aérée de cristal liquide.La
séparation et l'isolement du cholestérollibre et de ses esters
d'un extrait lipidique,sérique ou tissulaire, sont effectués
parchromatographie sur colonne ou sur plaqued'acide silicique à l'aide
de différents mélanges éluants.
La molécule de cholestérol comprend quatre
cycles carbonés notés A ,B,C et D (noyau
cyclopentano-perhydro-phénanthrénique), 8 carbones
asymétriques (les carbones 3,8,9,10,14,17,et 20),ce qui fait 256
stéréo-isomères dont un seul existe :le 3B-ol
lévogyre.Le cholestérol possède un hydroxy-OH sur le
carbone 3 (C3). Ce groupe chimique constitue la tête polaire .Ce
groupement R-OH constitue donc la partie hydrophile du cholestérol.
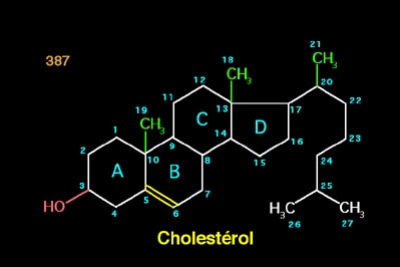
La fonction OH du cholestérol peut être
estérifié par un acide gras qui rend la molécule
totalement insoluble dans l'eau. (FERNANDEZ M.L et coll., 2005).
Figure 1. Structure du cholestérol
I.4. ROLE DE CHOLESTEROL
Le cholestérol est présent dans les tissus et le
plasma soit comme cholestérol libre soit sous forme de réserve
,où il est combiné à un acide gras à longue chaine
sous forme d'ester de cholestérol .Dans le plasma, les deux formes sont
transportées dans des lipoprotéines .
Le cholestérol est un lipide amphiphile et de ce fait,
c'est un constituant structural essentiel des membranes importantes pour le
maintien d'une perméabilité et d'une fluidité correcte, et
un constituant de la couche externe des lipoprotéines plasmatiques. Il
est synthétisé dans de nombreux tissus à partir
d'Acétyl-CoA et sert de précurseur à tous les
stéroïdes de l'organisme tels que les
corticostéroïdes, les hormones sexuelles, les acides biliaires et
la vitamine D.
Dans la membrane, il permet la formation de radeaux
lipidiques, zone essentielle à l'ancrage de protéines
fonctionnelles. Dans le neurone, il permet la synthèse des
neurotransmetteurs par exocytose et donc la propagation de l'influx nerveux.
C'est un produit caractéristique du métabolisme animal et il se
trouve dans des aliments d'origine animale comme le jaune d'oeuf, la viande, le
foie et le cerveau.
Le cholestérol est le principal constituant des
calculs biliaires. Il joue cependant un rôle majeur dans divers processus
pathologiques comme facteur de genèse de l'athérosclérose
d'artères vitales, entrainant des troubles
cérébrovasculaires et coronariens,ainsi que les maladies
vasculaires périphériques (JIANG X.C et coll. 2006).
I.5. DERIVES DE CHOLESTEROL
Le cholestérol est aussi utilisé pour la
formation de dérivés tels que les acides biliaires, les
stéroïdes, les oxystérol, et la dendrogénine.
I.5.1.LES ACIDES BILIAIRES
Les acides biliaires (également connu sousle nom de
sels biliaires) sont formés pardes dérivés du
cholestérolet par desstéroïdes acides secrétés
par le foie et setrouvant principalement dans la bile demammifères.Ils
permettent la fragmentation des grosglobules de lipides alimentaires
conduisantainsi à la formation de microgouttelettes.Cette
émulsion facilite alors la digestion deslipides par la lipase
pancréatique.Leur deuxième rôle est d'inhiber (par
effetantiseptique voire antibiotique) laprolifération des
bactéries de la floreintestinale dans la partie haute de
l'appareildigestif. Certaines bactéries pathogènes (tel que
Salmonella enterica) ont développé desrésistances aux sels
biliaires.
Chez l'homme, l'acide taurocholique etl'acide glycocholique
(dérivés de l'acidecholique) représentent environ 80 % de
tousles acides biliaires. Les deux principauxacides biliaires sont l'acide
cholique etl'acide chénodésoxycholique. Leurglycine etleur
taurine, ainsi que leurs dérivés
7-alpha-déshydroxylé (acide désoxycholique etacide
lithocholique) se trouvent dans la bileintestinale humaine. Une augmentation
del'écoulement de la bile est corrélée à
uneaugmentation de la sécrétion d'acidesbiliaires. Les acides
biliaires ont commefonction principale de faciliter la formationde micelles, ce
qui favorise l'absorption desgraisses alimentaires.
Production et sécrétion
Les acides biliaires sont produits dans lefoie par l'oxydation
du cholestérol. Ils sontconjugués avec la taurine ou
l'acideaminé glycine, ou encore avec un sulfate ouun glucuronide et sont
ensuite stockés dansla vésicule biliaire. Les acides biliaires
ontégalement pour but de briser les graisses.Lors d'un repas contenant
des matièresgrasses, le contenu de la vésicule biliaire
estsécrété dans l'intestin. Chez l'homme, l'étape
limitant le taux est l'ajout d'ungroupe hydroxyle sur la position 7 du
noyaustéroïde par l'enzyme de cholestérol
7-alphahydroxylase. Les acides biliaires servent demultiples fonctions,
notamment : l'élimination du cholestérol de l'organisme ; faire
que le flux de bile va éliminer descatabolites du foie, des lipides
émulsifiantset des vitamines liposolubles dansl'intestin ; aider
à la réduction de la flore de bactéries trouvées
dans l'intestingrêle et lesvoies biliaires.Le terme acide biliaire se
réfère à laforme conjuguée.
Dans le milieu alcalin duduodénum, les acides
biliaires peuventdevenir des sels biliaires à la suite de labaisse de pH
et du pKa des acides. Selsbiliaires se réfère à la forme
ionique de lasécrétion d'acides biliaires.La synthèse des
acides biliaires est unimportant consommateur de cholestéroldans la
plupart des espèces (autres que leshumains). Le corps produit environ
800 mgde cholestérol par jour et près de la moitiéest
utilisé pour la synthèse des acidesbiliaires. Au total, environ
20-30 grammesd'acides biliaires sont sécrétées
dansl'intestin par jour ; environ 90 % del'excrétion d'acides biliaires
sont réabsorbés (par transport actif dans l'iléon) et
recyclés.On parle alors de la circulationentérohépatique.
La bile est égalementutilisée pour briser la graisse dans
deminuscules gouttelettes. La bile d'animauxtués peut servir à
faire du savon.
Les acides biliaires sont synthétisés
exclusivement par le foie. Leur formation constitue la principale voie du
catabolisme du cholestérol (plus de la moitié du
cholestérol synthétisé par le foie). La cellule
hépatique synthétise au niveau du réticulum endoplasmique
les deux acides biliaires dits primaires, l'acide cholique et l'acide
chénodésoxycholique. (Pearson A. et coll, 2003).
I.5.2.LES OXYSTEROLS
Les oxystérols ou hydroxy-cholestérols sont
desmolécules d'origine biologique ou chimiqueproduites par oxydation ou
hydroxylation ducholestérol. Ce sont des composés ayant
unrôle important en physiologie et enphysiopathologie chez les
mammifères.Certainsoxystérols sont considérés comme
desmolécules de signalisation pouvant avoir uneactionrégulatrice
dans plusieurs métabolismescomme la biosynthèse du
cholestérol, deshormones stéroïdiennes et des acides
biliaires.D'autres oxystérols, par contre, sontconsidérés
comme des composés toxiquespouvant induire des perturbations
structuraleset métaboliques ausein des cellules aveccomme
conséquence, le renforcement depathologies comme lalithiase
biliairecholestérolique et l'athérosclérose.
Enfin,plusieurs oxystérols semblentégalementcapables de perturber
des mécanismesbiologiques comme le processusinflammatoire.Dans cette
revue seront mises en avant lesdernières connaissancesconcernant
lespropriétés et effets biologiques des oxystérolsavec le
souci de distinguer dans leurs effets, etpar analogie avec le
cholestérol, les « bons »et les « mauvais »
oxystérols.

Figure 2. Structure des principaux
oxystérols
Les oxystérols sont des dérivés
oxydés ducholestérol, possédant comme lui 27 atomesde
carbone et un noyau stérol commun .L'oxydation peut avoir lieu sur
lenoyau stérol et plus particulièrement sur lespositions 4, 5, 6
et 7 qui sont les plussensibles à l'oxydation. Les oxydations
peuventégalement se produire sur les positions 24, 25et 27 de la
chaîne latérale, ce qui conduit à unegrande
diversité de molécules créant ainsi lafamille des
oxystérols. Parmi ces composés,plusieurs sont détectables
dans le sang et labile et dans des organes comme le foie, lespoumons ou le
cerveau où leur présencepourrait induire bon nombre
d'effetsbiologiques (SCHROEPFER.GJ,2000).
Origine des oxystérols circulants
Les oxystérols plasmatiques présents chez
lesmammifères peuvent avoir deux originesdifférentes : une
origine endogène, en étantgénérés in vivo
par voie enzymatique etchimique et une origine exogène par unapport
alimentaire Il est actuellement admis que parmi lesoxystérols produits
in vivo et que l'on retrouveau niveau plasmatique de manière
significative,il y a ceux synthétisés exclusivement par
voieenzymatique comme le 27-hydroxycholestérol,l'acide
3ß-OH-5-cholesténoïque, le 7á-hydroxy
cholestérol, le 24S-hydroxycholestérolet le
4ß-hydroxycholestérol D'autres, comme le
25-hydroxycholestérol,peuvent être produits à la fois par
voieenzymatique et par auto-oxydation ducholestérol. D'autres enfin,
comme le 7 céto-cholestérol et le
7ß-hydroxycholestérol ontune origine chimique presque exclusive.
Dansdes conditions physiologiques, la grandemajorité
des oxystérols circulants proviennentde la transformation du
cholestérol enoxystérols sous l'action d'enzymes de
typecytochrome P450 présente dans différentsorganes. Les
oxystérols circulants sonttransportés par les
lipoprotéines à l'exceptionde l'acide
3ß-OH-5-cholesténoïque qui estvéhiculé
principalement par l'albumine. Ilssont alors rapidement épurés
par le foie pourêtre ensuite essentiellement transformés enacides
biliaires .Tout ce processuscontribue à maintenir l'homéostasie
ducholestérol dans l'organisme en facilitant sonélimination
lorsqu'il se trouve en excès. Lesoxystérols pourraient
également jouer un rôleimportant dans la régulation de
certaines voiesdu métabolisme lipidique.Oxystérols majeurs du
plasma,Le 27-hydroxycholestérol et l'acidecholesténoïque
sont synthétisés in vivo parvoie enzymatique. En effet, plusieurs
équipes ont observé laformation de 27-hydroxycholestérol
enincubant du cholestérol marqué au carbone 14avec des
mitochondries hépatiques. L'enzymequi permet l'hydroxylation en position
27 du cholestérol, lacholestérol 27-hydroxylase, appartient
à la famille des enzymes àcytochrome P450, et est encore
appeléeCYP27A1.
Le cholestérol27-hydroxylase estlocalisé dans la
membrane interne desmitochondries. Cette enzyme est présente cheztous
les mammifères et dans la plupart destissus. Elle contribue à un
mécanismed'élimination ou de détoxification
ducholestérol pour les cellules qui contiennent cecomposé en
excès. Ainsi, dans l'hépatocyte, lecholestérol
27-hydroxylase joue un rôle clefdans le métabolisme des acides
biliaires, entransformant le cholestérol en des
composésintermédiaires de ce métabolisme, le 27-hydroxy
cholestérol et l'acide cholesténoïque.
Cette enzyme participe aussi au
métabolismeextra-hépatique du cholestérol, puisque
lespoumons, l'endothélium vasculaire et lesmacrophages
synthétisent ces oxystérols. Ilssont transportés
essentiellement dans le sangpar les HDL pour le 27-hydroxycholestérol
etpar l'albumine pour l'acide 3 ß-hydroxy-5-cholesténoïque.
Ces oxystérols plushydrophiles que le cholestérol vont être
plusrapidement captés par le foie poury être
métabolisés en acides biliaires.Le 24S-hydroxycholestérol
est égalementsynthétisé in vivo par voie enzymatique.
L'enzyme qui permet l'hydroxylationen position 24S du cholestérol, la
cholestérol24S-hydroxylase, appartient à la famille desenzymes
à cytochrome P450, d'où sonappellation abrégée,
CYP46A1.
La cholestérol24S-hydroxylase est localisée dans
le réticulumendoplasmique. Cette enzyme a été
détectéechez l'homme mais également chez quelques
mammifères comme la souris. L'enzymeest exprimée essentiellement
dans les neuronesdu cerveau où son action contribue aurenouvellement du
cholestérol des cellulesneuronales en favorisant son élimination
sousforme de 24S-hydroxycholestérol.Sa concentration plasmatique est
considéréecomme un indicateur du métabolisme
ducholestérol dans cet organe. Cet oxystérol esttransporté
au niveau plasmatique par les HDLet les LDL puis rapidement épuré
par le foie. Ilentre ensuite dans la biosynthèse des acidesbiliaires
grâce à l'action d'une 7 -hydroxylasespécifique, la
24S-hydroxycholestérol 7á-hydroxylase ou CYP39A1. Le
mécanisme de 24hydroxylation du cholestérol semble ne
pasêtre exclusivement neuronal puisque lacholestérol
24S-hydroxylase est déceléeégalement au niveau
hépatique où elleparticipe directement à la
biosynthèse desacides biliaires. Pour certains auteurs, le tauxde
24S-hydroxycholestérol plasmatiquepourrait être un indicateur de
diagnostic decertaines pathologies neuro-dégénératives.Le
7á-hydroxy cholestérol est un autreoxystérol important de
la circulation sanguinechez les mammifères. Sa productionmajoritairement
hépatique est initiée par lacholestérol
7á-hydroxylase qui transforme lecholestérol en 7á-hydroxy
cholestérol contribuant ainsi à la formation des acidesbiliaires
La cholestérol 7á-hydroxylase (ou CYP7A1), enzyme clef de
labiosynthèse des acides biliaires, appartient à lafamille des
enzymes à cytochrome P450. Elle est localisée dans le
réticulumendoplasmique des hépatocytes uniquement. Chez l'homme,
il a été montré que le 7á-hydroxy
cholestérol nouvellement synthétisédans le foie pouvait
être détecté rapidement auniveau plasmatique sous forme
estérifiée et ausein principalement des LDL .La concentration
plasmatique de cet oxystérolreflètentsa production
hépatique, ce qui en faitun bon marqueur de l'activité
enzymatique du cholestérol 7á-hydroxylase.
I.5.3.DENDROGENINE
La dendrogénine est une molécule issuedu
cholestérol aux propriétés anti-cancéreuses et
découverte le 15 mai 2013. Si le cholestérol, en trop grande
quantitédans l'organisme, est bien connu pour seseffets néfastes
sur la santé, deschercheurs pourraient réhabiliter
saréputation via l'un de ses dérivés. En
effet,l'équipe de chercheurs de l'Inserm et duCNRS dirigée par
Marc Poirot et SandrineSilvente-Poirot au "Centre de recherche
encancérologie de Toulouse" (Inserm / CNRS /Université Toulouse
III - Paul Sabatier),vient non seulement de découvrir unenouvelle
molécule issue du cholestérol, ladendrogénine A, mais,
elle apporte en plusla preuve, chez la souris, que celle-cipossède des
propriétés anti-cancéreuses.Ces travaux sont
publiés dans la revueNature Communications.
Le cholestérol est impliqué dans
diversespathologies chroniques telles que les maladiescardiovasculaires et dans
le cancer. Lesconnaissances actuelles laissaient supposer unrôle
négatif du cholestérol sur les cancersprincipalement pour deux
raisons. D'une part,le cholestérol est un précurseur
desandrogènes et des oestrogènes qui sont tousdeux
associés au développement des cancersdit
"hormono-dépendants". D'autre part, lavoie de synthèse du
cholestérol (qui comporteplus de 20 étapes différentes)
conduit àl'activation de gènes pro-tumoraux.Le blocage en amont
de la voie de biosynthèsedu cholestérol par des inhibiteurs tels
que lesstatines aurait dû conduire à une protectioncontre la
survenue de cancer voire à uneefficacité anticancéreuse,
ce qui n'a pas étéconfirmé par des études cliniques
impliquantde très larges cohortes de patients. Cecisuggère une
complexité plus importante de sonmétabolisme.
L'équipe de chercheurs dirigée par MarcPoirot et
Sandrine Silvente-Poirot s'est
doncprécisément intéressée au métabolisme
ducholestérol. Grâce à des techniques de criblageet de
synthèse chimique, les chercheurs ont puétablir que le produit de
la réaction chimiqued'un dérivé du cholestérol avec
l'histaminegénérait une nouvelle classe de stérols
appeléeDendrogénine A (DDA). Cette molécule, obtenue en
laboratoire, présente despropriétés remarquables
d'induction de ladifférenciation et de la mort de
cellulescancéreuses.Ces observations les ont conduits à
recherchercette molécule dans les tissus de mammifères.Ils ont
découvert que la DDA est présente dansles tissus et cellules
saines chez l'homme tandis qu'elle n'est pas détectable dans les
cellulestumorales. Chez la femme, son taux est 5 foisplus faible dans les
tissus de tumeursmammaires comparé au tissu normal.
Leurs résultats suggèrent que la DDA
protègeles cellules des processus de cancérisation"souligne Marc
Poirot.Pour tester cette hypothèse, les chercheurs sont ensuite
tenté de restaurer la déficience dela DDA dans des tumeurs
implantées chez lesanimaux. Chez ces derniers, l'administration dela DDA
conduit à un contrôle de laprolifération tumorale et
prolonge leur vie.
Pour les chercheurs, cette découverte estimportante car
elle constitue la preuve del'existence d'une nouvelle voie
métaboliquechez l'homme, à la croisée entre
lemétabolisme du cholestérol et celui del'histamine, mais
également parce que la DDA,grâce à ses
propriétés anticancéreuses,pourrait être
utilisée pour le traitement des différents cancers(B.D. HAMMOCK
et coll. 2013).
I.5.4.LES STEROIDES
Les stéroïdes groupent toutes les substances dont
le caractère commun est de posséder un noyau tétra
cyclique constitué par trois noyaux cyclohexaniques (A,B,C)et un noyau
cyclopentanique (D). Les trois cycles hexanaux ont le même agencement que
ceux du perhydrophénanthrène ;le noyau pentagonal est
accolé au cycle C Ce carbone d'hydrogène est
dénommé stérane. En fixant un groupement méthyl
(-CH3) sur le carbone 13 du stérane, on passe à
l'oestrane à 18 carbones d'où dérivent les hormones
oestrogènes et les hormones de la corticosurrénale. Avec un
second méthyle en C10 le carbure à 19carbones
c `est l'androstane d'où proviennent les androgènes.
I.5.4.1.LES HORMONES DELA CORTICO-SURRENALE
Elles dérivent de la corticostérone et
diffèrent par la nature de la substitution portant sur les atomes de
carbone 11et17 de la molécule initiale. La
désoxycorticostérone et l'aldostérone agissent
essentiellement sur le métabolisme minéral, sur le
métabolisme glucidique interviennent surtout la cortisone,
l'hydrocortisone et la corticortisone. Elles stimulent la
néoglucogenèse et diminuent l'oxydation de glucose. Par
ailleurs, les glucocorticoïdes jouent un rôle particulier dans
l'adaptation du métabolisme en cas de besoin anormaux. Ils jouent ce
rôle par intermédiaire de l'hypophyse, c'est ainsi qu'en cas de
stress, L'ACTH libéré au niveau du lobe antérieur de
l'hypophyse stimule la synthèse des glucocorticoïdes lesquels,
à leur tour, agissent sur le métabolisme intermédiaire
(augmentation de la néoglucogenèse à partir des acides
aminés et du glycérol...).


Cortisol
Aldostérone
I.5.4.2.HORMONES DES GLANDES GENITALES
Les glandes génitales ont un double rôle :
elles assurent l'élaboration des cellules germinales (fonction exocrine)
et la synthèse des hormones sexuelles (fonction endocrine).
a) Les androgènes
L'androgène le plus actif est la testostérone,
élaborée essentiellement dans les cellules interstitielles de
leydig de testicules. D'autres androgènes ont été
isolés du cortex surrénalien.
Les androgènes jouent un rôle déterminant
dans la croissance et dans le développement des caractères
sexuels males : Ils provoquent la masculinisation de l'organisme. Au point
de vue métabolique, les androgènes stimulent la formation des
réserves protidiques.

Testostérone
b) les oestrogènes
Les oestrogènes sont surtout synthétisés
par l'épithélium folliculaire mais aussi par les cellules de
cortex surrénalien. Dans le testicule et pendant la grossesse dans le
placenta. Les oestrogènes les plus connus sont :
oestradiol (le plus actif) , oestrone ,et oestriol.

 OestradiolOestrone
OestradiolOestrone

Oestriol
Les oestrogènes interviennent dans le
développement des caractères sexuels secondaires femelles, la
kératinisation des cellules épithéliales du vagin,la
stimulation du développement mammaire.Aux doses physiologiques, les
oestrogènes agissent sur le métabolisme dans le sens d'une
utilisation accrue des aliments.
c) La progestérone
La progestérone est synthétisée par le
corps jaune sous l'influence de l'hormone lutéotrope du lobe
antérieur de l'hypophyse. Elle est également
synthétisée dans la corticosurrénale et dans le placenta
pendant la gestation.
Cette hormone prépare la muqueuse de l''utérus
à la nidation, freine la maturation d'autres follicules et diminue la
sensibilité de l'utérus à l'ocytocine .Par ailleurs, la
progestérone joue un rôle important dans le développement
et l'entretien de l'activité fonctionnelle des cellules
sécrétrices de la mamelle (MURRAY et coll., 2013).
Progestérone
CHAPITREII.SYNTHESE,TRANSPORT ET EXCRETION DU CHOLESTEROL
II.1.LA SYNTHESE DE
CHOLESTEROL
Un peu de la moitié du cholestérol de
l'organisme est produite par la synthèse (environ 700mg /jour) et
le reste provient de la ration alimentaires moyenne. Chez l'être humain,
le foie et les intestins synthétisent chacun environ 10% du
cholestérol total. Pratiquement tous les tissus contenant des cellules
nucléées peuvent synthétiser le cholestérol. Cette
synthèse se fait essentiellement dans le réticulum endoplasmique
et le cytosol(LISCUM L et coll.,2008).
L'acétyl-CoA est à l'origine de tous
les atomes de carbone du cholestérol
Bien que la plupart des cellules animales soient capables de
faire la synthèse de cholestérol, la biosynthèse de
cholestérol est prédominante dans les cellules hépatiques.
Un des rôles des lipoprotéines est de distribuer aux autres
cellules de l'organisme le cholestérol obtenu des aliments et celui
formé dans le foie. Le premier jalon posé dans la
découverte de la voie de synthèse de cholestérol fut le
fait que ses atomes de carbone proviennent tous de l'acétyl- CoA, une
observation tirée de premières expériences de marquage
radio isotopique.
La biosynthèse du cholestérol peut être
divisée en cinq étapes :
- La synthèse du mévalonate
à partir de l'acétyl- CoA (figure 3)
- La formation d'unités
isopréniques à partir de mévalonate par perte de
Co2 (figure 4)
- Six de ces unités se condensent pour former le
squalène (figure 4 )
- Le squalène se cyclise pour donner naissance à
un stéroïde parent, le lanostérol (figure
5)
- Le cholestérol est formé à partir du
lanostérol (figure 6).
II.1.1. BIOSYNTHESE DU
MEVALONATE
L'HMG-CoA (3-hydroxy-3-méthylglutaryl) se forme selon
les mêmes réactions que celles utilisées dans la
mitochondrie pour la synthèse des corps cétoniques (figure II.
6). Cependant,la synthèse du cholestérol étant
extra-mitochondriale, les deux voies sont distinctes. Au départ la
thiolase cytosolique, catalyse la condensation de deux molécules
d'acétyl- CoA pour former l'acétoacétyl-CoA. La HMG-CoA
synthase catalyse la condensation de l'acétoacétyl-CoA avec une
autre molécule d'acétyl-CoA pour donner le HMG-COA. Le HMG-CoA
est réduit en mévalonate par la HMG-COA réductase
dépendante de NADPH. Cette dernière est l'étape militante
principale de la voie de biosynthèse du cholestérol et elle est
le site d'action des classes de médicaments les plus efficaces pour
abaisser le taux de cholestérol, à savoir les statines, qui sont
les inhibiteurs de la HMG-COA réductase (figure 3).
II.1.2. FORMATION DES UNITES
ISOPRENIQUES
Le mévalonate est phosphorylé de façon
séquentielle par l'ATP grâce à trois kinases, et
après décarboxylation (figure 4), il y a formation de
l'unité isoprénique activée, l'isopentényl
disphosphate.
II.1.3. UNITES ISOPRENIQUES
FORMENT LE SQUALENE
Il y a isomérisation de l'isopentényl
disphosphate par déplacement de la double liaisons et formation du
diméthylallyl diphosphate, qui est ensuite condensé avec une
autre molécule d'isopentényl diphosphate pour former le
géranyl diphosphate un intermédiaire à 10 atomes de
carbone (figure 4). Une autre condensation avec l'isopentényl
diphosphate forme le farnésyl diphosphate. Deux molécules de
farnésyl diphosphate se condensent en joignant leurs
extrémités diphosphates, ce qui forme le squalène. Un
pyrophosphate inorganique est d'abord éliminé lors de la
formation du pré-squalène diphosphate, lequel est ensuite
réduit par NADPH avec élimination d'une autre molécule de
pyrophosphate inorganique.

Figure 3 Biosynthèse du
mévalonate.
La H MG-CoA réductase est inhibée par les
statines.


Figure 4 Biosynthèse du squalène,de
l'ubiquinone,du dolichol et d'autres
dérivés polyisopréniques.
Un résidu farnésyle est présent dans
l'hème a de la cytochrome oxydase. L'atomede carbone marqué par
une astérisque deviendra l'atome C11 ou C12 du
squalène. La squalène synthétase est une enzyme
microsomiale ; toutes les autres enzymes apparaissant sur cette figure
sont des protéines cytosoliques solubles, et quelques-unes sont
localisées dans les peroxysomes.
II.1.4. FORMATION DU
LANOSTEROL

Le squalène peut se replier en une structure qui
ressemble beaucoup à celle du noyau des stéroïdes (figure
5).Avant la fermeture des cycles, le squalène est transformé en
2, 3-époxy squalène par la squalène époxydase, une
oxydation à fonction mixte du réticulum endoplasmique. Le
groupement méthyle du C14 va se fixer sur le C13 et celui du
C8 sur le C14, cette réaction est catalysée
par l'oxydosqualène : lanostérol cyclase.
Figure 5. Biosynthèse du
lanostérol
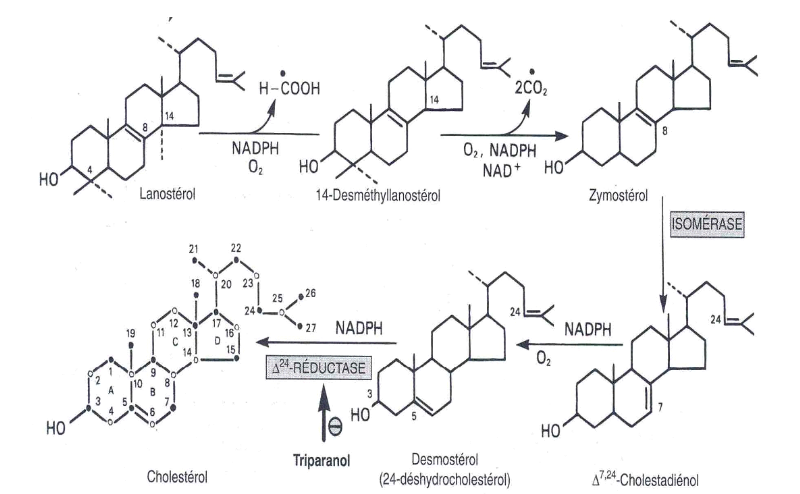
Figure 6 Biosynthèse du
cholestérol.
La numérotation des diverses positions est la
même que celle du noyau des stéroïdes.
II.1.5. FORMATION DE
CHOLESTEROL
La formation du cholestérol à partir du
lanostérol, a lieu dans les membranes du réticulum endoplasmique
et entraine des changements dans le noyau stéroïde et dans la
chaine latérale (figure 6). Les groupements méthyles fixés
sur le C14 et C4 sont éliminés pour former
le 14-desméthyl lanostérol puis le zymostérol. La double
liaison entre C8 et C9est ensuite déplacée
entre C5 et C6 en deux étapes pour former le
desmostérol. Enfin, la double liaison de la chaine latérale est
réduite pour produire le cholestérol (RUSSEL D.W, 1992).
a) Le farnesyldiphosphate donne naissance au dolichol
et à l'ubiquinone
Deux polyisoprénoides, le dolichol et l'ubiquinone se
forment à partir du farnésyl diphosphate par addition
supplémentaire d'isopentényl diphosphate, avec respectivement
jusqu'à 16 résidus (dolichol) ou 3 à 7 résidus
(ubiquinone). Au niveau de la membrane cellulaire, quelques protéines
associées au GTP, subissent une prénylation par des
résidus farnésyle ou géranyl (20 atomes de carbone). On
pense que la prénylation des protéines facilite leur ancrage dans
les membranes lipidiques et pourrait aussi être impliquée dans les
interactions entre protéines et dans le trafic des protéines
associées aux membranes.
b) La régulation de la HMG-CoA réductase
contrôle la synthèse du cholestérol
La régulation de la synthèse du
cholestérol s'exerce pratiquement au début de cette voie
métabolique à l'étape catalysée par la HMG-CoA
réductase. La réduction de synthèse du cholestérol
chez l'animal à jeun s'accompagne d'une diminution de l'activité
de cette enzyme, pourtant seule la synthèse hépatique est
inhibée par le cholestérol d'origine alimentaire. La HMG-CoA
réductase hépatique est inhibée par le mévalonate,
le produit immédiat de la réaction qu'elle catalyse, et par le
cholestérol, le produit principal de cette voie.
Le cholestérol et ses métabolites
répriment la transformation du gène de la HMG-CoA
réductase en activant un facteur de transformation, SREBP
(sterolregulatory element-binding protein), protéine se fixant à
un élément de régulation par les stérols). Les
SREBP constituent une famille de protéines qui régulent la
transcription d'une grande série de gènes de protéines
impliquées dans la capture et le métabolisme du
cholestérol et d'autres lipides par les cellules. Une variation diurne
se produit à la fois dans la synthèse du cholestérol et
dans l'activité de la réductase. Outre ces mécanismes
régulant le taux de synthèse des protéines,
l'activité des enzymes est également modulée de
façon plus rapide par des modifications post-traductionnelles (figure
7).
L'insuline ou les hormones thyroïdiennes augmentent
l'activité de la HMG-CoA réductase, tandis que le glucagon ou les
glucocorticoïdes la diminuent. L'activité est modifiée de
façon réversible par des mécanismes de
phosphorylation /déphosphorylation, dont certains peuvent
dépendre de l'AMPc, et donc être directement sensibles au
glucagon. Les tentatives d'abaisser le taux de cholestérol plasmatique
chez l'être humain en réduisant l'ingestion de cholestérol
alimentaire produisent des effets variables.
En général, une diminution de 100mg de
cholestérol alimentaire cause une diminution d'environ 0,13mnol/L dans
le sérum.

Figure 7 Mécanismes possibles de
régulation de la synthèse du cholestérol par l'HMG-CoA
réductase.
L'insuline joue un rôle dominant par rapport à
celui du glucagon.
c) Les facteurs qui influencent l'équilibre du
cholestérol dans les tissus
Au niveau tissulaire, l'équilibre du cholestérol
est régulé de la façon suivante (figure 8) :
l'augmentation du cholestérol cellulaire est due soit à une
capture de lipoprotéines contenant du cholestérol, par les
récepteurs comme celui des LDL ou le récepteur éboueur,
soit à l'incorporation dans les membranes cellulaires de
cholestérol libre à partir de lipoprotéines riches en
cholestérol,soit à la synthèse de cholestérol,soit
encore à l'hydrolyse du cholestérol estérifié par
la cholestéryl ester hydrolase. La diminution du cholestérol est
due soit à l'efflux du cholestérol membranaire vers les HDL via
ABCA-1,ABCG-1 ou SR-B1 (figure II.5),soit à l'estérification du
cholestérol par l'ACAT(acétyl-CoA :cholestérol
acyltransférase),soit encore à l'utilisation du
cholestérol pour la synthèse d'autres stéroïdes comme
les hormones ou les acides biliaires dans le foie.
Le récepteur des LDL est fortement
régulé

Les récepteurs des LDL (apo B-100,E)se trouvent
à la surface cellulaire dans des puits qui sont recouverts, du
côté cytosolique de la membrane cellulaire, par une
protéine appelée clathrine. Le récepteur est une
glycoprotéine transmembranaire, la région exposée se liant
à B-100 est du côtéamino-terminal. Après liaison au
récepteur,les LDL intactes sont capturées par endocytose.
L'apoprotéine et les esters de cholestérol sont ensuite
hydrolysés dans les lysosomes et le cholestérol est
transféré dans la cellule. Les récepteurs sont
recyclés vers la surface cellulaire. Ce flux entrant de
cholestérol inhibe la transcription des gènes de la HMG-CoA
synthase,de la HMG-CoA réductase et ceux d'autres enzymes
impliquées dans la synthèse de cholestérol. Il inhibe
aussi le récepteur des LDL lui-même via la voie de SREBP, il ya
ainsi suppression coordonnée de la synthèse et de la capture du
cholestérol. De plus, l'activité de l'ACAT est stimulée et
induit l'estérification du cholestérol. Ainsi, l'activité
des récepteurs des LDL à la surface cellulaire est
régulée par les besoins en cholestérol pour la
synthèse des membranes, des hormones stéroïdes ou des acides
biliaires (figure 8)(NESS G.C. et coll. 2000).
Figure 9. Facteurs influençant
l'équilibre du cholestérol au niveau cellulaire
II.2 LE TRANSPORT DU
CHOLESTEROL
Le cholestérol est transporté par les
lipoprotéines du plasma, en général sous forme d'esters de
cholestérol (figure 9), chez l'être humain la plus grande partie
se trouve dans les LDL(low-densitylipoprotéin). Le cholestérol
alimentaire s'équilibre avec celui du plasma en quelques jours et avec
celui des tissus en quelques semaines. Les esters de cholestérol des
aliments hydrolysés, le cholestérol libéré est
absorbé dans l'intestin en même temps que le cholestérol
alimentaire non estérifié et d'autres lipides. Il se
mélange avec le cholestérol synthétisé dans les
intestins et il est incorporé dans les chylomicrons.
80 à 90% du cholestérol absorbé sont
estérifiés par des acides gras à longue chaine dans la
muqueuse intestinale. 90% du cholestérol des chylomicrons sont
capturés par le foie dans les résidus de chylomicrons et
l'essentiel du cholestérol secrété par le foie dans les
VLDL(verylowdensitylipoprotéines) est celui
récupéré lors de la formation des IDL puis des LDL,
lesquelles sont capturées par le récepteur des LDL dans le foie
et les tissus extrahépatiques.Lorsque les chylomicrons réagissent
avec la lipoprotéine- lipase pour former les fantômes de
chylomicrons, seulement 5% des esters de cholestérol sont perdus. Le
reste est repris par le foie au niveau du quel les fantômes lient par le
récepteur à l'apo E. leurs esters, internalisés dans les
hépatocytes, se voient hydrolysés en cholestérol libre.
La concentration plasmatique en cholestérol est un bon
index de l'état pool en cholestérol de l'organisme et du niveau
de son équilibre. Chez l'adulte, le taux de cholestérol total est
approximativement de 200mg /dl. Il augmente avec l'âge et manifeste
de grandes variations individuelles. La plus grande partie du
cholestérol circule sous forme estérifiée.
La proportion de cholestérol transportée par les
VLDL augmente quand celles-ci deviennent prédominantes au niveau
plasmatique. La demi-vie du cholestérol est de plusieurs semaines.
Les VLDL formées au niveau du foie transportent de
nouveau le cholestérol dans le plasma. La portion la plus importante de
cholestérol hépatique,exportéeau niveau plasmatique, l'est
sous forme libre à cause de la faible activité LCAT de ce
parenchyme. Les esters de cholestérol, dans les VLDL, sont
dérivés de l'action de la LCAT du plasma.
L'activité de la LCAT plasmatique est responsable de
l'essentiel de la synthèse des esters de cholestérol chez
l'homme. Cette activité estérifie progressivement le
cholestérol des HDL. Le cholestérol libre de surface des HDL
diminue. Entre les HDL et les autres lipoprotéines circulantes et les
membranes plasmiques de tissu, se crée un gradient de concentrations qui
permet le relargage du cholestérol tissulaire ainsi que l'échange
avec d'autres lipoprotéines. Les HDL deviennent ainsi moins denses
formant les HDL2. Les HDL provoquent donc un transport inverse du
cholestérol, permettant l'exportation du cholestérol des tissus
périphériques.
La protéine plasmatique assurant le transfert des
esters de cholestérol, la
lipidtransferprotéin(LTP),est associée aux HDL et
facilite le transfert de ces esters des HDL aux VLDL, LDL et chylomicrons. De
cette manière, elle lève l'inhibition de la LCAT des HDL. Les
esters de cholestérol peuvent ainsi être orientés vers le
foie via les fantômes de VLDL(IDL) et les LDL. L'incorporation des esters
de cholestérol dans les tissus périphériques se fera
là où l'équipement en récepteurs aux LDL permet
leur endocytose.
La régulation de la concentration plasmatique du
cholestérol est donc, dans une large mesure, fonction des facteurs qui
assurent la régulation de l'estérification du cholestérol
plasmatique et le transfert des esters de cholestérol entre les
fractions lipoprotéiques plasmatiques.
Les deux principaux facteurs responsables sont la
lécithine : cholestérol acyl-transferase (LCAT), agissant au
niveau des lipides des HDL et la protéine de transfert des esters du
cholestérol, LTP.
La capacité des HDL d'agir comme substrat pour la LCAT
varie en fonction inverse de leur taille. Des facteurs tels que la
concentration des lipoprotéines riches en triglycérides,
l'activité de la protéine de transfert des lipides, de la lipase
hépatique et de la lipoprotéine-lipase sont des
régulateurs importants de l'estérification du cholestérol
plasmatique, par le pouvoir qu'ils ont de modifier la taille des HDL.
Le taux de cholestérol tissulaire au niveau
périphérique et hépatique dépend des
mécanismes suivants :
- Captation des lipoprotéines contenant le
cholestérol par les récepteurs, comme le récepteur
LDL ;
- Captation des lipoprotéines à
cholestérol par des voies n'utilisant pas des récepteurs
spécifiques.
- Captation du cholestérol libre à partir de son
support lipoprotéique au niveau de la membrane plasmatique ;

- Synthèse locale du cholestérol (JIANG X.C,
ZHOU H.W.2006).
Figure 9.Transport du cholestérol entre les
tissus chez l'êtrehumain
(A-l=Apo lipoprotéine
A-l ;ACAT=acyl-CoA :cholestérol acyltransférase;
C=cholestérol libre; CE=cholestérol
estérifié ; CETP=protéine de transfert des esters de
cholestérol ;HDL, lipoprotéine de haute densité
HL ; lipase hépatique ; IDL=lipoprotéine de
densité intermédiaire ;
LCAT=lécithine cholestérol acyltransferase ; LDL=
lipoprotéine de faible densité; LPL=lipoprotéine
lipase ).
II. 3. EXCRETION DE
CHOLESTEROL
Le cholestérol est excrété hors du corps
via la bile, soit sous forme non estérifiée,soit après sa
conversion en acides biliaires dans le foie. Lecoprostérol est le
principal stérol des fèces, il est formé à partir
du cholestérol par des bactériesde la partie distale de
l'intestin.
II.3.1.LES ACIDES BILIAIRES
SONT FORMES A PARTIR DU CHOLESTEROL
Les acides biliaires primaires sont synthétisés
dans le foie à partir du cholestérol. Ce sont l'acide
cholique,qui est le plus abondant, et l'acide chénodésoxycholique
(figure 10 et 11). La 7a-hydroxylation du cholestérol est la
première étape de régulation dans labiosynthèse des
acides biliaires, elle est catalysée par une enzyme microsomiale
lecholestérol 7a-hydroxylase. C'est une mono
oxygénase typique, qui requiert de l'oxygène, du NADPH et le
cytochrome P-450. Les étapes suivantes d'hydroxylation sont aussi
catalysées par des monooxygènases. La voie de biosynthèse
des acides biliaires se subdivise assez tôt en deux sous- voies, l'une
conduisant au cholyl-CoA, molécule
caractérisée par la présence d'un groupe a-OH
supplémentaire en position 12,l'autre voie conduisant au
chénodésoxycholyl-CoA,(figure 10 et 11).
Une seconde voie mitochondriale implique comme première
étape, l'hydroxylation en position 27 du cholestérol par la
stérol 27- hydroxylase, elle produit une proportion importante des
acides biliaires primaires synthétisés. Ces acides biliaires
primaires (figure 10 et 11) entrent dans la bile sous forme conjuguée
à la glycine ou à la taurine. La conjugaison a lieu dans les
peroxysomes hépatiques. Chez l'être humain, le rapport entre
conjugués de la glycine et de la taurine est normalement de 3 contre 1.
La bile étant alcaline (pH 7,6 à 8,), on pense que les acides
biliaires et leurs conjugués sont sous forme de sels, d'où le
terme de « sels biliaires ».
Dans l'intestin, les acides biliaires primaires sont
métabolisés de façon plus poussée grâce
à l'activité des bactéries intestinales. Il y a ainsi
déconjugaison et 7a-déshydroxylation, qui produisent les acides
biliaires secondaires, c'est-à-dire l'acide désoxycholique et
l'acide lithocholique.

Figure 10.Excrétions du
cholestérol
La plupart des acides biliaires retourne au foie par la
circulationentéro-hépatique. Bien que les produits de la
digestion des graisses, y compris le cholestérol, soient absorbés
dans les 100 premiers centimètres de l''intestin grêle, les acides
biliaires primaires et secondaires sont absorbés presqu'exclusivement
dans l'iléon, 98 à 99% retournant au foie par la voie de la
circulation porte. On parle de circulation entéro-hépatique
(figure 9). Cependant l'acide lithocholique, du fait de son
insolubilité, n'est pas réabsorbé à un degré
significatif. Seule une petite fraction des sels biliaires échappe
à l'absorption et se trouve donc éliminée dans les
fèces. Cette voie est néanmoins essentielle pour
l'élimination du cholestérol. Chaque jour, le pool relativement
petit de sels biliaires (environ 3 à 5g) effectue un cycle à
travers l'intestin six à dix fois et une quantité d'acides
biliaires équivalente à celle qui est perdue dans les
fèces est synthétisée à partir du
cholestérol de manière à ce que le volume du pool des
acides biliaires reste constant. Ceci est rendu possible grâce à
un système de rétrocontrôles( AGELLON L.B et coll.
2008).

Figure 11. Formation des sels
biliaires
II.3.2. ASPECTS CLINIQUES
a) Le taux de cholestérol sérique
Le taux de cholestérol sérique est
corrélé avec l'indice de l'athérosclérose et des
cardiopathies coronniennes.
Bien qu'un taux élevé de cholestérol
plasmatique (supérieur à 5,2mmol/L) soit considéré
comme un facteur majeur favorisant l'athérosclérose, il est
maintenant admis que les triglycérols sont un facteur de risque
indépendant. L'athérosclérose est
caractérisée par un dépôt de cholestérol et
d'esters de cholestérol des lipoprotéines plasmatiques dans les
parois artérielles. Les maladies dans lesquelles il y a de
manière prolongée, des niveaux élevés de VLDL,
d'IDL, de chylomicrons résiduels, ou de LDL dans le sang (comme le
diabète sucré,la néphrose lipidique,
l'hypothyroïdisme et d'autres états hyperlipidémiques), sont
souvent accompagnées d'une athérosclérose
prématurée ou plus sévère.
Il existe aussi une relation inverse entre les concentrations
des HDL (HDL2) et les cardiopathies d'origine coronarienne, le
rapport du cholestérol LDL/HDL est donc un bon paramètre
prédictif. Cette relation peut s'expliquer par le rôle que l'on
prête aux HDL dans le transport inverse du cholestérol. La
tendance à l'athérosclérose est très variable selon
les espèces, les êtres humains étant l'une des rares
espèces chez les quelles cette maladie peut être induite par une
alimentation très riches en cholestérol.
b) Les facteurs entrainant la réduction du
cholestérol sérique
1oChangement de régime
alimentaire
Des changements de régime alimentaire jouent un
rôle important dans la réduction du cholestérol
sérique. Les facteurs héréditaires jouent le rôle le
plus important en déterminant les concentrations individuelles en
cholestérol sérique. Les facteurs alimentaires et
environnementaux jouent cependant également un rôle et le plus
bénéfique consiste à remplacer dans le régime les
acides gras suturés par desacides gras polyinsaturés et mono
insaturés. Les huiles végétales de
maïs et de tournesol par exemple, contiennent une grande proportion
d'acides gras polyinsaturés,tandis que l'huile d'olive a une
concentration élevée en acides mono insaturés. Par
ailleurs, la graisse du beurre,celle de boeuf et l'huile de palme contiennent
des proportions élevées d'acides gras saturés. Le
saccharose et le fructose ont des effets plus importants que les autres
glucides sur l'élévation des taux de lipides sanguins,
particulièrement les triacylglycérols. La cause de l'abaissement
du taux de cholestérol par les acides gras polyinsaturés n'est
pas encore totalement comprise. Cependant, il est clair que l'un des
mécanismes impliqués concerne l'augmentation du nombre de
récepteurs des LDL par les acides gras polyinsaturés et
monoinsaturés par comparaison avec les acides gras saturés, cela
entraine une augmentation de métabolisme des LDL, qui sont les
principales lipoprotéines athérogènes. De plus, les acides
gras saturés sont responsables de la formation de particules de VLDL
plus petites qui contiennent relativement plus de cholestérol et qui
sont utilisées par les tissus extra-hépatiques plus lentementque
les particules plus grosses, toutes tendances qui peuvent
êtreconsidérées comme athérogènes.
2o Les médicaments
hypolipemiants
Si un changement du régime alimentaire est inefficace,
les médicaments hypolipemiants peuvent réduire le
cholestérol et les triacylglycérols sériques. La famille
de médicaments appelés statines, s'est montrée très
efficace pour abaisser le taux de cholestérol plasmatique et
prévenir les maladies cardiaques. Les statines agissent en inhibant la
HMG-CoA réductase et en régulant positivement l'activité
des récepteurs des LDL. Parmi les exemples utilisés actuellement,
on peut citer l'atorvastatine,la simvastatine, la fluvastatine et la
pravastatine.L'ézétimide réduit le taux de
cholestérol sanguin en inhibant l'absorption de cholestérol par
l'intestin en bloquant sa capture par la protéine apparentée de
Niemann-Pick NPC1 « Niemann-Pick C1-like
protein ».Parmi d'autres médicaments utilisés on trouve
les fibrates comme le clofibrate et le gemfibrozil, et l'acide nicotinique dont
l'action principale est d'abaisser le taux de triacyglycérol plasmatique
en diminuant la sécrétion hépatique de VLDL contenant des
triacylglycérols et du cholestérol.
II.3.3.LE MODE DE VIE AFFECTE
LE TAUX DE CHOLESTEROL SERIQUE
Parmi les autres facteurs jouant un rôle dans les
cardiopathies coronariennes, mentionnons : l'hypertension
artérielle, le tabagisme, le sexe masculin,l'obésité (plus
particulièrement l'obésité abdominale), le manque
d'exercice et l'absorption d'eau douce plutôt que d'eau dure.Parmi les
facteurs associés à une élévation des acides gras
libres plasmatiques suivie d'une sécrétion accrue de
triacylglycérols et de cholestérol dans la circulation au niveau
des VLDL, citons : le stress émotionnel et le café. Avant la
ménopause, les femmes semblent être protégées contre
beaucoup de ces facteurs délétères, ce qui serait
lié aux effets bénéfiques des oestrogènes. Il
existe une corrélation positive entre la consommation
modérée d'alcool et un abaissement des cardiopathies
coronariennes. Ceci pourrait êtredû à une
élévation de la concentration en HDL à cause d'une
synthèse accrue d'Apo A-I et de changements d'activité de la
protéine de transfert des esters de cholestérol. Le vin rouge
serait particulièrement bénéfique, peut-être
à cause de son contenu en antioxydants.L'exercice physique
régulier diminue le niveau plasmatique des LDL mais il augmente celui
des HDL. Les concentrations en triaglycérols sont aussi réduites,
ce qui est très probablement dû à une sensibilité
accrue à l'insuline qui stimule l'expression de la lipoprotéine
lipase.
II.3.4 LES DEFAUTS PRIMAIRES
DES LIPOPROTEINES PLASMATIQUES (dyslipoprotéinémies) SONT
HEREDITAIRES
Les défauts héréditaires primaires du
métabolisme des lipoprotéines conduisent à un état
primaire d'hypo ou d'hyperlipoprotéinémie. En outre, des maladies
telles que le diabète sucré, l'hyperthyroïdisme, la
néphropathie (symptôme néphrotique) et
l'athérosclérose sont secondairement associées à
des profils anormaux de lipoprotéines qui sont très similaires
à l'un ou l'autre des défauts héréditaires
primaires. Presque tous ces défauts primaires sont dus à un
dysfonctionnement de certaines étapes de la formation des
lipoprotéines, de leur transport ou de leur destruction. Ces anomalies
ne sont pas toutes dangereuses (DJOUSSE L. et coll.2009).
CONCLUSION
Le cholestérol est le précurseur de tous les
autres stéroïdes de l'organisme tels que
lescorticostéroïdes, les hormones sexuelles, les acides biliaires
et la vitamine D. il joue aussi un rôle structural important dans les
membranes et dans la couche externe des lipoprotéines.
Dans l'organisme, le cholestérol est
synthétisé entièrement à partir
d'acétyl-CoA. Trois molécules d'acétyl-CoA forment le
mévalonate grâce à une réaction militante pour la
voie de biosynthèse, et qui est catalysée par la HMG-CoA
réductase. Une unité isoprénique à cinq atomes de
carbone est formée à partir du mévalonate et six de ces
unités se condensent pour former le squalène. Le squalène
se cyclise pour former le lanostérol, stéroïde parent,
qui,après perte de trois groupements méthyles et d'autres
changements, forme le cholestérol.
La synthèse de cholestérol dans le foie est
régulée partiellement par l'apport de cholestérol
alimentaire. Dans les tissus, l'équilibre du cholestérol est
maintenu entre les facteurs causant une augmentation du cholestérol (par
exemple, la synthèse, la capture à partir des récepteurs
des LDL ou des récepteurs éboueurs), et les facteurs provoquant
une perte de cholestérol (comme la synthèse de
stéroïdes, la formation des esters de cholestérol et
l'excrétion).L'activité du récepteur des LDL est
modulée par le taux de cholestérol cellulairepour arriver
à l'équilibre de ce taux. Dans le transport du
cholestérol, les LDL prennent du cholestérol dans les tissus et
la LCAT l'estérifie et le dépose dans le coeur de ces particules.
Le cholestérol estérifié des HDL est capturé par le
foie soit directement, soit après transfert aux VLDL, aux IDL ou aux LDL
par la protéine de transfert des esters de cholestérol.
L'excès de cholestérol est excrété
à partir du foie dans la bile sous forme de cholestérol ou de
sels biliaires. Une proportion des sels biliaires est absorbée dans la
circulation porte et retourne au foie par la circulation
entéro-hépatique.
Les taux élevés de cholestérol
présents sous forme de VLDL, d'IDL ou de LDL sont associés
à l'athérosclérose, tandis que des taux
élevés de HDL ont un effet protecteur.
Les défauts héréditaires du
métabolisme des lipoprotéines sont une cause primaire d'hypo ou
d'hyper protéinémie. Des affections telles que le diabète
sucré, l'hypothyroïdisme, la néphropathie et
l'athérosclérose, montrent des profils anormaux de
lipoprotéines dont les causes sont secondaires mais qui sont semblables
à ceux de l'une ou l'autre des affections primaires.
BIBLIOGRAPHIE
1. AGELLON L.B: Metabolism and function of bile acids. In
biochemistry of lipids, lipoproteins and Membranes, 5th ed.
VANCE DE, VANCE JE(editors) ElSEVIER, 2008: 423-440.
2. B.D HAMMOCK, S. SILVENTE- POIROT and M. POIROT:
Dendrogenin A arises from cholesterol and histamine metabolism and shows
cell differentiation and anti-tumour properties (2013).
3. CHIANG J.L: regulation of bile acid synthesis:
pathways, nuclear receptors and mechanisms. J HEPATOL 2006; 40: 539.
4. DENKE M.A: dietary fats fatty acids and their effects
on lipoproteins. CURR atheroscler rep 2006; 8: 466.
5. DJOUSSE L. GAZIONO J.M: dietary cholesterol and
coronary disease risk: a systematic review. CURR Atheroscler Rep 2009; 11:
418.
6. DOMINIQUE DUPAGNE : Emission la tête au
carré sur France inter 22 Fev 2013
7. Dr MICHEL de lorgerilcholesterol, Mensonges et
propagande THIERRY SOUCCAR édition 2013.
8. FERNANDEZ M.L, West K.L: Mechanism by which dietary
fatty acids modulate plasma lipids. J.NUTR 2005; 135: 2075.
9. JIANG X.C, Zhou H.W: plasma lipid transfer
protein. CURR. Opinlipidol 2006; 17: 302.
10. LISCUM L: cholesterol biosynthesis. In biochemistry
of lipids, lipoproteins and membranes, 5th ed. VANCE DE, VANCE
J.E (editors) ELSEVIER, 2008: 399-422.
11. MICHEL OLIVIER: the clofibrate saga, retrospective
commentary british journal of clinical pharmacologyvol, 74 No6
December 2012.
12. MURRAY et coll.,2013.
13. NESS G.C, Chambers C.M: Feedback and hormonal
regulation of hepatic 3-hydroxy-3-methylglytaryl coenzyme A reductase: the
concept of cholesterol buffering capacity. ProcSocExpBiol Med 2000; 224:
8.
14. PARKS D.J, Blanchard S.G, Bledsoe R.K, et al: Bile
acids: natural ligands for a nuclear orphan receptor. Science 1999;
284:1365.
15. PEARSON A. et coll., 2003 phylogenetic and biochemical
evidence for sterol biosynthesis in the bacterium
GemmataObscuriglbusprocNath. Acad. Scivol 100 (26).
16. PEREZ Sala D.: protein isoprenylation in biology and
disease: general overview and perspectives from studies with genetically
engineered animals. ProntBiosci 2007; 12: 4456.
17. RUSELL D.W: cholesterol biosynthesis and metabolism.
Cardio-vascular Drugs Therap 1992; 6:103.
18. SCHROEPTER. G.J (janv 2000) Oxysterols modulators of
cholesterol metabolism.
TABLE DES MATIERES
EPIGRAPHE
I
DEDICACE
II
AVANT-PROPOS
III
INTRODUCTION
1
CHAPITRE I. GENERALITES SUR LE CHOLESTEROL
2
I.1 DEFINITION
2
I.2. HISTORIQUE
2
I.3. STRUCTURE CHIMIQUE
3
I.4. ROLE DE CHOLESTEROL
5
I.5. DERIVES DE CHOLESTEROL
5
I.5.1.LES ACIDES BILIAIRES
5
I.5.2.LES OXYSTEROLS
7
I.5.3.DENDROGENINE
10
I.5.4.LES STEROIDES
11
CHAPITREII. SYNTHESE, TRANSPORT ET EXCRETION DU
CHOLESTEROL
15
II.1.LA SYNTHESE DE CHOLESTEROL
15
II.1.1. BIOSYNTHESE DU MEVALONATE
15
II.1.2. FORMATION DES UNITES ISOPRENIQUES
16
II.1.3. UNITES ISOPRENIQUES FORMENT LE SQUALENE
16
II.1.4. FORMATION DU LANOSTEROL
19
II.1.5. FORMATION DE CHOLESTEROL
20
II.2 LE TRANSPORT DU CHOLESTEROL
24
II. 3. EXCRETION DE CHOLESTEROL
27
II.3.1.LES ACIDES BILIAIRES SONT FORMES A PARTIR DU
CHOLESTEROL
27
II.3.2. ASPECTS CLINIQUES
29
II.3.3.LE MODE DE VIE AFFECTE LE TAUX DE
CHOLESTEROL SERIQUE
31
II.3.4 LES DEFAUTS PRIMAIRES DES LIPOPROTEINES
PLASMATIQUES (dyslipoprotéinémies) SONT HEREDITAIRES
32
CONCLUSION
33
BIBLIOGRAPHIE
34
TABLE DES MATIERES
36



