|
UNIVERSITE DE KINSHASA


FACULTE DES SCIENCES
PHARMACEUTIQUES
Département de Chimie médicinale et
Pharmacognosie
Laboratoire de Recherche Bio-Organique
Troisième Epreuve Pharmacie
B.P. 212 KINSHASA XI
|
ACTIVITE ANTIFALCEMIANTE
ET SCREENING PHYTOCHIMIQUE DE LA FRACTION
ETHERO-METHANOLIQUE DE BEAT-SS
|
Mémoire en vue de l'obtention du Diplôme
de Pharmacien

Présenté par
WOUNGLY MAVIAN Paul
Promoteur : Professeur Docteur LAMI NZUNZU
José
Encadreur : Chef de Travaux NSIMBA
MIEZI Marie
Année académique 2012 - 2013
RESUME
Notre travail a porté sur BEAT-SS®, un
médicament traditionnel breveté par le Centre de
Phytothérapie Moderne NIECA, utilisé dans le traitement de la
drépanocytose et préparé à partir d'écorces
de tronc et de branches d'un grand arbre de la famille des Bombacacées
présent dans nos forêts tropicales.
Des études récentes avaient déjà
démontré que cette recette était capable de reverser la
falciformation des globules rouges à une concentration optimale de 200
ìg/mL1(*). Notre
contribution fut de déterminer les groupes phytochimiques
présents dans la fraction éthéro-méthanolique qui a
montré un certain effet antifalcémiant après un
fractionnement bio-guidé.
Le fractionnement bio-guidé fut réalisé
sur 25 g de poudre lyophilisée de BEAT-SS® et le résultat
sur le résidu sec de la solution
éthéro-méthanolique a représenté 14,16% du
matériel végétal utilisé.
L'évaluation in vitro de l'activité
antifalcémiante fut effectuée par le test d'Emmel sur quatre
principales fractions, parmi lesquelles la fraction insoluble dans le
méthanol et la fraction éthéro-méthanolique. Cette
dernière a donné un taux de réhabilitation des globules
rouges de 42,96% à la concentration optimale de 200 ìg/mL.
Le screening phytochimique de la fraction
éthéro-méthanolique a mis en évidence la
présence de polyphénols, de coumarines, de tanins
catéchiques, de stérols et triterpènes.
SUMMARY
Our work has focused on BEAT-SS®, a congolese traditional
medicine patented by the Centre NIECA, used in the management of sickle cell
disease and prepared from the bark of the trunk and branches of a big tree of
the rainforests belonging to the family of Bombacaceae.
Previous investigations had shown that this recipe was able to
reverse the sickling of red blood cells at an optimal concentration of 200
ìg/mL. Our contribution was to determine the phytochemical groups of the
ether-methanolic fraction which demonstrated some antisickling effect after
bio-guided fractionation.
Bio-guided fractionation was performed on 25 g of lyophilized
powder of BEAT-SS® and the result on the dry residue of the
ether-methanolic solution represented 14.16% of the plant material used.
The evaluation of the in vitro antisickling activity
was performed by the Emmel's test on four main fractions, of which the fraction
insoluble in methanol and ether-methanolic fraction. The latter gave a rate of
42.96% on rehabilitation of red cells at the optimal concentration of 200
ìg/mL1.
The phytochemical screening of the ether-methanolic fraction
revealed the presence of polyphenols, coumarins, catechin tannins, sterols and
triterpenes.
DEDICACES
A mes parents Rodolphe & Claire Woungly
REMERCIEMENTS
Avant de présenter le contenu de ce travail, il nous
tient à coeur de témoigner notre profonde gratitude à
toutes les personnes qui ont permis que nous puissions parvenir au terme de
notre formation que ce soit par leurs enseignements, leur soutien ou leurs
conseils :
Au Professeur Docteur José LAMI NZUNZU le promoteur de
ce travail pour nous avoir accepté au sein du Laboratoire de Recherche
Bio-Organique de la Faculté des Sciences Pharmaceutiques de
l'Université de Kinshasa et pour avoir dirigé ce travail de main
de maître ;
Au Chef de travaux Marie NSIMBA MIEZI, pour la bienveillance
et la disponibilité dont elle a fait preuve pour nous encadrer et
partager avec nous son savoir ;
A Monsieur NYEMBWE KADIATA et son Centre de
Phytothérapie Moderne NIECA, pour avoir bien voulu nous fournir le
matériel végétal pour réaliser cette
étude ;
Au Centre de Médecine Mixte d'Anémie SS Mabanga,
pour avoir bien voulu nous fournir les échantillons de sang qui ont
constitué notre matériel biologique ;
A tout le Corps Professoral de la Faculté des Sciences
Pharmaceutiques de l'Université de Kinshasa ainsi que tous nos
Maîtres de stage, pour l'ensemble des connaissances scientifiques
théoriques et pratiques reçues durant notre formation
académique ;
A nos parents Rodolphe et Claire WOUNGLY, pour tous les
sacrifices consentis pour notre réussite et épanouissement ;
à nos soeurs et frère Christèle, Yolande et Jacques
WOUNGLY ; ainsi qu'à tous nos amis et camarades.
Veuillez recevoir nos remerciements les plus sincères.
AVANT-PROPOS
La pharmacie est une science dont la place se trouve au centre
d'autres disciplines telle la biologie, la botanique, la chimie et la
médecine. Elle s'intéresse à la conception, le mode
d'action, la préparation et la dispensation des médicaments. Le
médicament quant à lui est défini comme toute substance ou
composition pouvant être utilisé chez l'homme ou chez l'animal ou
pouvant leur être administré, en vue d'établir un
diagnostic médical ou de restaurer, corriger ou modifier leur fonctions
physiologiques en exerçant une activité pharmacologique,
immunologique ou métabolique2(*).
Le médicament est composé de deux types de
substances :
D'une part, d'une ou de plusieurs substances appelées
principe(s) actif(s) en quantité donnée (dose) et ayant un effet
pharmacologique démontré et un intérêt
thérapeutique également démontré cliniquement.
Toutefois toute substance pharmacologiquement active ne constitue pas
nécessairement la base d'un médicament et encore moins d'une
thérapie médicamenteuse ; D'autre part, on a les excipients,
des substances auxiliaires inertes servant à la formulation de la forme
galénique la mieux adaptée à la voie d'administration ou
encore à la modulation de la vitesse de libération du principe
actif vers l'organisme.
Les principes actifs utilisés en thérapeutique
ont diverses origines. Certains proviennent de la synthèse chimique
totale ou partielle ou encore du génie génétique.
D'autres, puisés dans la nature, sont d'origine animale,
minérale, végétale ou microbiologique, souvent
après découverte empirique de leurs vertus chez l'homme ou
l'animal3(*). Les plantes
ont toujours été une grande source de médicaments pour
l'homme depuis les temps les plus reculés et, de nos jours, c'est l'un
des piliers de la médecine traditionnelle africaine, où elle est
devenue quasiment incontournable avec près de 80% de la population y
ayant recours pour les besoins en soins de santé primaires4(*). L'une de ses composantes
majeures est la phytothérapie qui se fonde sur l'usage des extraits de
plantes et des principes actifs naturels en thérapeutique et s'appuient
sur des connaissances et traditions anciennes.
La tendance actuelle poursuivie par la phytothérapie
est de fournir des phytomédicaments, c'est-à-dire des extraits
actifs de plantes standardisés dont les protocoles de fabrication et de
contrôle sont connus et conformes aux normes fixées par l'OMS et
dont la circulation dans un pays requiert l'autorisation de mise sur le
marché (AMM)5(*).
Malheureusement, dans le contexte de la République Démocratique
du Congo, ces critères ne sont pas toujours respectés et on se
contente de médicaments traditionnels améliorés dont les
extraits peuvent contenir d'autres substances accompagnant le principe actif ;
des substances pouvant posséder des effets pharmacologiques qui dans
certains cas peuvent bien potentialiser l'effet recherché mais dans
d'autres peuvent considérablement le diminuer, présenter des
effets indésirables gênants, ou être source de
toxicité chronique en cas d'usage à long terme.
C'est pourquoi, dans le but de présenter des
médicaments avec une meilleure efficacité, une meilleure
sécurité et un meilleur confort pour ses consommateurs, l'effort
consenti est de séparer, d'isoler, de purifier, de déterminer la
structure et de quantifier l'effet biologique du ou des principes actifs
responsables de l'activité pharmacologique et de l'effet
thérapeutique recherché dans la plante médicinale
utilisée, afin que ces composés chimiques une fois connus servent
de base soit à une formulation galénique adéquate, soit
à une pharmacomodulation visant à augmenter ses effets ou
diminuer sa toxicité, soit de modèles pour la synthèse
chimique à l'échelle industrielle.
Tel est de manière globale le cadre dans lequel
s'inscrit notre travail qui n'est en fait qu'une modeste contribution, visant
au final la conception et le développement de nouveaux
médicaments alternatifs efficaces, issus des recherches en
pharmacognosie et phytochimie, et pouvant être utilisés dans le
traitement symptomatique de la drépanocytose, une maladie qui affecte
des millions de personnes à travers le monde, particulièrement en
Afrique où le trait drépanocytaire est de 15 à 25% et les
thérapies conventionnelles assez onéreuses pour la
majorité des patients6(*).
TABLE DES MATIERES
RESUME
i
DEDICACES
iii
REMERCIEMENTS
iv
AVANT-PROPOS
v
TABLE DES MATIERES
viii
LISTE DES TABLEAUX, FIGURES ET PHOTOS
xi
LISTE DES ABREVIATIONS, ACRONYMES, SYMBOLES ET
UNITES
xii
INTRODUCTION
1
0.1. Problématique
1
0.2. Hypothèses
3
0.3. Objectifs
3
0.3.1. Objectif général
3
0.3.2. Objectifs spécifiques
4
0.4. Plan du travail
4
PARTIE BIBLIOGRAPHIQUE
5
CHAPITRE 1 : GENERALITES SUR LA
DREPANOCYTOSE
6
1.1. Définition
6
1.2. Etiologie et pathogénie
6
1.3. Symptomatologie
8
1.4. Diagnostic biologique
9
1.5. Prévention et traitement
11
1.6. Distribution géographique
14
CHAPITRE 2 : GENERALITES SUR LE DEVELOPPEMENT
DES MEDICAMENTS A PARTIR DE PLANTES
16
2.1. Enquête ethno-pharmacologique
17
2.2. Screening biologique et analyse
biologique de l'extrait brut
17
2.3. Screening phytochimique de l'extrait
brut
18
2.4. Isolement et purification des
composés de l'extrait actif
18
2.5. Analyse biologique et identification
des composés isolés
19
2.6. Quantification et comparaison des
effets biologiques à des composés de référence
19
2.7. Etudes pharmacologique et toxicologique
des produits actifs
19
2.8. Développement
galénique
19
2.9. Essais cliniques
20
2.10. Autorisation de mise sur le
marché
21
CHAPITRE 3 : APERCU ETHNO-MEDICAL ET DONNEES
ANTERIEURES SUR BEAT-SS®
22
3.1. Présentation de
BEAT-SS®
22
3.2. Données phytochimiques
22
3.3. Données pharmacologiques et
toxicologiques
23
PARTIE EXPERIMENTALE
25
CHAPITRE 4 : MATERIELS ET METHODES
26
4.1. Matériels
26
4.1.1. Matériel
végétal
26
4.1.2. Matériel biologique
26
4.1.3. Matériel de laboratoire
27
4.2. Méthodes
29
4.2.1. Fractionnement de BEAT-SS®
29
4.2.2. Evaluation de l'activité
antifalcémiante
31
a) Préparation des
échantillons témoins
32
b) Préparation des solutions
mères et des dilutions
32
c) Observation au microscope et comptage des
globules rouges
35
4.2.3. Screening phytochimique de la
fraction éthéro-méthanolique de BEAT-SS®
37
a) Détection des alcaloïdes
(Bouchardat et Dragendorff)
37
b) Détection des sucres
réducteurs (Fehling)
38
c) Détection des glycosides
cardiotoniques (Keller Killiani)
38
d) Détection des saponines (Test de
mousse)
39
e) Détection des polyphénols
(FeCl3 2%)
39
f) Détection des tanins (Bate-Smith,
Stiasny et FeCl3 2%)
40
g) Détection des anthocyanes (HCl
conc et NH4OH 25%)
41
h) Détection des flavonoïdes
(Shinoda)
41
i) Détection des
stéroïdes et triterpènes (Liebermann Burchard)
42
j) Détection des aminoacides (Test
à la ninhydrine)
42
k) Détection des coumarines
(Fluorescence à la lampe UV)
43
l) Détection des anthraquinones
(Bornträger)
43
CHAPITRE 5 : RESULTATS ET DISCUSSION
44
5.1. Résultats
44
5.1.1. Fractionnement de BEAT-SS®
44
5.1.2. Evaluation de l'activité
antifalcémiante
44
5.1.3. Screening phytochimique de la
fraction éthéro-méthanolique
49
5.2. Discussion
49
5.2.1. Fractionnement de BEAT-SS®
49
5.2.2. Evaluation de l'activité
antifalcémiante
50
5.2.3. Screening phytochimique de la
fraction éthéro-méthanolique
51
CONCLUSION
52
BIBLIOGRAPHIE
54
ANNEXES
58
LISTE DES TABLEAUX, FIGURES
ET PHOTOS
Liste des Tableaux :
Tableau 1 : Répartition normale de l'hémoglobine
chez différents types de sujet
Tableau 2 : Screening chimique des extraits bruts de
BEAT-SS®
Tableau 3 : Identification des échantillons de sang
pour les essais biologiques
Tableau 4 : Rendement du fractionnement de BEAT-SS®
Tableau 5 : Méthode de préparation des solutions
mères
Tableau 6 : Résultats des essais biologiques pour
l'échantillon de sang n°1
Tableau 7 : Résultats des essais biologiques pour
l'échantillon de sang n°2
Tableau 8 : Résultats des essais biologiques pour
l'échantillon de sang n°3
Tableau 9 : Résultats des essais biologiques pour les 3
échantillons
Tableau 10 : Screening chimique de la fraction
éthéro-méthanolique de BEAT-SS®
Liste des figures :
Figure 1 : Transmission génétique
Figure 2 : Falciformation des GR, perte
d'élasticité et occlusion des vaisseaux
Figure 3 : Schéma d'une électrophorèse
sur acétate de cellulose
Figure 4 : Schéma d'une électrophorèse
sur agarose
Figure 5 : Distribution géographique de
l'hémoglobine S
Figure 6 : Schéma de fractionnement de BEAT-SS®
Figure 7 : Méthode d'évaluation de
l'activité antifalcémiante
Liste des photos :
Photo 1 : Evaporateur rotatif Laborota 4000
Photo 2 : Agitateur magnétique avec plaque chauffante
Stuart
Photo 3 : Sonicateur VWR
Photo 4 : Balance analytique électronique Kern
& Sohn Gmbh ABS
Photo 5 : Etuve Memmert Electro Helios
Photo 6 : Observations au microscope de l'échantillon
de sang n°1
Photo 7 : Résultats du screening phytochimique de la
fraction E
Photo 8 : Résultats après filtration des
réactions de Stiasny et Fehling
Photo 9 : Fluorescence des coumarines en milieu alcalin
à la lampe UV
LISTE DES ABREVIATIONS,
ACRONYMES, SYMBOLES ET UNITES
(E) : Fraction éthéro-méthanolique
(I) : Insoluble dans le méthanol
(L) : Lyophilisat
(S) : Saponines brutes
% : Pourcentage
° : Degré alcoolique
°C : Degré Celsius
5-HMF : 5-hydroxyméthyl-2-furfural
AMM : Autorisation de mise sur le marché
BHT : Butyl hydroxy toluène
CCM : Chromatographie sur couche mince
CH3COONa : Acétate de sodium
CHCl3 : Chloroforme
cm : Centimètre
conc : Concentré
d : Densité
EDTA : Acide éthylène diamine tétra
acétique
Et2O : Ether di éthylique
EtOH : Ethanol
FeCl3 : Chlorure de fer III
g : Gramme
GLC : Chromatographie liquide en phase gazeuse
GR : Globule rouge
h : Heure
H2SO4 : Acide sulfurique
Hb : Hémoglobine
HCl : Acide chlorhydrique
HgCl2 : Chlorure de mercure II
HPLC : Chromatographie liquide haute performance
I2 : Iode
INRB : Institut National de Recherches
Biomédicales
IR : Infrarouge
KI : Iodure de potassium
L : Litre
LCD : Ecran à cristaux liquide
MeOH : Méthanol
Mg : Magnésium
mg : Milligramme
mg/mL : Milligramme par millilitre
min : Minute
mL : Millilitre
mol/L : Mole par litre
N° : Numéro
Na2S2O5 :
Métabisulfite de sodium
NaCl : Chlorure de sodium
NH4OH : Ammoniaque
O2 : Dioxygène
OMS : Organisation Mondiale de la Santé
p.a. : Pour analyse
pH : Potentiel hydrogène
ppm : Partie par million
qsf : Quantité suffisante pour faire
RMN : Résonance magnétique
nucléaire
s : Seconde
USD : Dollar US
UV : Ultra-violet
ìg : Microgramme
ìg/mL : Microgramme par millilitre
ìL : Microlitre
INTRODUCTION
0.1. Problématique
La drépanocytose demeure encore à l'heure
actuelle l'une des maladies génétiques les plus fréquentes
à travers le globe. Elle se caractérise par la présence
de globules rouges (GR) contenant l'hémoglobine S (Hb S), une forme
anormale de la molécule d'hémoglobine servant au transport de
l'oxygène dans l'organisme des poumons vers les tissus. Les personnes
qui héritent d'un gène drépanocytaire de leurs deux
parents sont des «homozygotes» (dits SS) et développent la
maladie, alors que celles qui n'héritent d'un tel gène que d'un
seul parent sont porteuses du trait drépanocytaire (dits AS) et sont
asymptomatiques, mais peuvent transmettre la maladie à leurs enfants.
On estime à 50 millions le nombre d'individus atteints
de la drépanocytose7(*) et selon l'OMS, 300 000 enfants naissent dans le monde
chaque année avec une anomalie majeure de l'hémoglobine dont la
plus fréquente est celle de l'anémie SS.6 Le continent
africain demeure la région la plus meurtrie. En effet, on y enregistre,
dans 40 pays au moins, des taux de prévalence du gène de l'Hb
muté entre 2 % et 30 %, expliquant le niveau élevé de la
mortalité et de la morbidité dues à la
drépanocytose enregistré essentiellement chez les enfants de
moins de cinq ans, les adolescents et les femmes enceintes8(*). Selon les estimations, environ
50 % à 80 % des 400 000 enfants qui naissent chaque année en
Afrique avec la drépanocytose meurent avant l'âge de cinq ans et
ceux qui survivent présentent une atteinte des organes cibles, qui
réduit considérablement leur espérance de vie8.
Ces taux élevés tiennent du fait que dans ces
pays, on ne propose pratiquement pas de conseils génétiques aux
futurs parents, les unions entre partenaires porteurs du trait
drépanocytaire donnent lieu à la naissance d'enfants
drépanocytaires et dans la plupart des pays, les politiques et plans
nationaux de santé sont inadaptés, et les infrastructures, les
outils de diagnostic, les services de traitement et les personnels
formés sont rares8. A cela s'ajoute le fait que la prise en
charge hospitalière de la maladie reste assez onéreuse. En
République démocratique du Congo par exemple, 12 % des enfants
hospitalisés dans les pavillons de pédiatrie sont
drépanocytaires et on estime que le coût annuel du traitement est
supérieur à 1 000 USD par patient9(*), un coût difficilement supportable pour la
majorité de la population dont le revenu moyen est inférieur
à 2 USD par jour et qui pour les besoins de soins de santé
primaire se tourne majoritairement vers la médecine traditionnelle.
C'est ainsi que dans la ville de Kinshasa qui compte à
elle seule environ 80 000 drépanocytaires10(*), plus
précisément sur la Rue Kisangani N°8 dans la commune de
Ngaba, le Centre Moderne de Phytothérapie NIECA, une ASBL
agréée par l'Etat Congolais et créée en 1984 par le
phytothérapeute NYEMBWE KADIATA, s'est spécialisée dans la
prise en charge des patients souffrant de drépanocytose grâce
à une préparation médicamenteuse à base de plantes
brevetée et nommée BEAT-SS®. Cette recette à base de
plantes, qui est utilisée par le centre depuis plus de 25 ans, a
montré des résultats plus que satisfaisant dans le traitement
`'symptomatique'' des crises chez les patients. C'est ainsi que plusieurs
investigations ont été menées sur BEAT-SS® par le
Laboratoire de Recherche Bio-organique de la Faculté des Sciences
Pharmaceutiques de l'Université de Kinshasa, dirigé par le
Professeur Docteur José LAMI NZUNZU.
A ce jour, nous savons que cette recette a des
propriétés de reverser la falciformation des globules rouges et
d'empêcher leur agrégation1. Nous savons
également qu'elle comporte les groupes phytochimiques suivants :
saponines (qui ont un effet perturbateur sur la réversion de la
falciformation), alcaloïdes, polyphénols, quinones, tanins
catéchiques, anthocyanes et terpénoïdes11(*),12(*). Toutefois jusqu'à présent on ignore
précisément le ou lesquels de ces groupes phytochimiques sont
responsables des principales activités mises à profit dans le
traitement symptomatique de la drépanocytose.
0.2. Hypothèses
Le fractionnement bio-guidé de BEAT-SS® se
justifie par l'hypothèse selon laquelle il possède des groupes
phytochimiques qui agissent soit individuellement, soit en synergie,
conférant ainsi à la recette la propriété de
reverser la falciformation des globules rouges chez les drépanocytaires,
groupes phytochimiques qui nécessitent d'être identifiés.
Ce travail nous permettra de mettre en évidence la ou les fractions qui
possèdent cette activité et d'en déterminer la
composition.
0.3. Objectifs
0.3.1. Objectif général
Le présent travail est une contribution à la
lutte contre la drépanocytose et s'inscrit dans le processus de
développement de médicament à partir de plantes car il
vise à isoler des composés à activité
antifalcémiante pouvant ultérieurement être identifier
structurellement et servir de point de départ pour une
pharmacomodulation, une formulation galénique ou de modèles ou
précurseurs pour une synthèse chimique à l'échelle
industrielle.
0.3.2. Objectifs spécifiques
Les objectifs spécifiques de ce travail sont :
o fractionner BEAT-SS®
o évaluer l'activité antifalcémiante de
la fraction éthéro-méthanolique issue du fractionnement
o identifier les groupes phytochimiques de cette fraction
éthéro-méthanolique
0.4. Plan du travail
En dehors de l'introduction et de la conclusion, le
présent travail s'articule sur les parties suivantes :
o Une partie bibliographique qui aura pour chapitres :
§ Généralités sur la
drépanocytose
§ Généralités sur le
développement des médicaments à partir de plantes
§ Aperçu ethno-médical et données
des travaux antérieurs sur BEAT-SS®
o Une partie expérimentale qui aura pour
chapitres :
§ Matériels et méthodes
§ Résultats et discussion
PARTIE BIBLIOGRAPHIQUE
CHAPITRE 1 :
GENERALITES SUR LA DREPANOCYTOSE
1.1. Définition
La drépanocytose (encore appelée anémie
SS ou anémie falciforme ou hémoglobinose S) est une maladie
héréditaire du sang, caractérisée par une mutation
de l'hémoglobine (Hb) se traduisant par une grave anémie
chronique souvent accompagnée de fièvres, douleurs et
infections13(*).
1.2. Etiologie et pathogénie
La drépanocytose résulte d'une mutation du
gène porté par le chromosome 11 et codant pour de la
synthèse de la chaine â de l'Hb. L'allèle muté S est
un allèle co-dominant qui peut s'exprimer : soit à l'état
homozygote SS et donner la forme grave de la maladie provoquant une
anémie souvent mortelle, avec remplacement total de l'Hb A par de l'Hb S
dans les hématies ; soit à l'état
hétérozygote AS et donner une forme cliniquement inapparente dans
laquelle le remplacement de l'Hb A par de l'Hb S est seulement
partiel14.14(*)
Les personnes qui héritent d'un gène
drépanocytaire de leurs deux parents sont des «homozygotes»
(dits SS) et développent la maladie, alors que celles qui
n'héritent d'un tel gène que d'un seul parent sont porteuses du
trait drépanocytaire (dits AS) et sont asymptomatiques, mais peuvent
transmettre la maladie à leurs enfants14.

Figure 1 : Transmission génétique
La mutation du gène du chromosome 11 est responsable
d'un défaut de synthèse de l'Hb avec modification structurale et
substitution de l'acide glutamique par la valine en position 6 dans la chaine
â protéique. Cette substitution entraine une perte de
solubilité de la molécule d'Hb qui précipitera et se
polymérisera facilement en milieu pauvre en oxygène. Les
molécules d'Hb sont normalement dispersées dans les GR chez le
drépanocytaire mais lorsque la pression partielle en oxygène
diminue, les molécules se prennent en masse, forment des filaments
(polymérisation) et déforment le globule rouge en faucille
(d'où le terme d'anémie falciforme). La falciformation du GR
s'accompagne d'une perte d'élasticité de la membrane qui entraine
une obstruction des vaisseaux de faibles calibres (occlusion vasculaire et
ischémie). L'occlusion des petits vaisseaux se fait ressentir par des
crises douloureuses, des gonflements des mains et des pieds et des douleurs
articulaires. Contrairement aux 120 jours normaux de durée de vie du GR,
les GR falciformes sont précocement détruits dans la rate
à un rythme accéléré et leur durée de vie
est d'environ 20 jours. Ainsi, dans le cas de la drépanocytose, il
s'ensuit une hémolyse très sévère qui n'est pas
compensée par la production de GR provoquant ainsi une anémie
chronique14.
http://en.m.wikipedia.org/wiki/Sickle-cell_disease
 
Figure 2 : Falciformation des globules rouges, perte
d'élasticité
et occlusion des vaisseaux de faible calibre
1.3. Symptomatologie
Les signes qui accompagnent la drépanocytose
apparaissent entre le 4e et 6e mois après la
naissance. Normalement, à la naissance le taux d'hémoglobine
foetale (Hb F), qui a une grande affinité pour l'O2, est
largement élevé pour couvrir les besoins. L'Hb F est
progressivement remplacée par l'Hb A (adulte) chez une personne normale.
Mais chez les drépanocytaires, elle est progressivement remplacée
par l'Hb S jusqu'à l'âge de 6 mois où les premiers
symptômes commencent à apparaître (fièvres,
infections à répétition, pâleur de la peau).
Les manifestations aiguës sont habituellement13
14 :
Ø Crises vaso-occlusives : les GR falciformes bloquent
la circulation au niveau des artères et des vaisseaux ce qui
empêche la distribution optimale de l'oxygène dans l'organisme. Ce
processus peut se produire dans différentes parties du corps (os,
abdomen, rein, cerveau, rétine...). Ces crises peuvent être
très douloureuses.
Ø Anémie hémolytique : les GR des
drépanocytaires, étant anormaux, sont éliminés de
manière plus précoce par l'organisme au niveau de la rate.
Ø Infections : elles sont plus fréquentes chez
les drépanocytaires, surtout à pneumocoques ou
méningocoques liées à la destruction de la rate par
infarctus tissulaires répétés ; on parle d'asplénie
fonctionnelle. Elles peuvent aussi aggraver l'anémie en cas d'infection
par le parvovirus B19.
Les manifestations chroniques de la drépanocytose
sont :
Ø Un retard de croissance,
Ø Des déficits nutritionnels (en folates, car
cette vitamine est indispensable à la création des
hématies qui sont renouvelées très rapidement lors des
crises d'anémie, épuisant ainsi le stock de folates),
Ø Un retard pubertaire fréquent,
Ø Des troubles cardio-pulmonaires (augmentation de la
taille du coeur, insuffisance respiratoire, tachycardie),
Ø Une rate hypertrophiée
(splénomégalie) ou atrophiée,
Ø Des anomalies rétiniennes (hémorragies
dues à l'endommagement des petits vaisseaux au niveau de la
rétine), etc.
1.4. Diagnostic biologique
Le diagnostic peut être établi
soit par14 :
Ø Electrophorèse des Hb sur acétate de
cellulose en milieu alcalin, pH 8,6 (technique la plus utilisée) ou sur
agarose en milieu acide, pH 6,2 :
L'électrophorèse permet la mise en
évidence de la présence d'une fraction d'hémoglobine de
migration différente de celles des hémoglobines normales. Elle
permet également de différencier les formes homozygotes des
formes hétérozygotes, ainsi que la présence
éventuelle d'une autre anomalie de l'hémoglobine associée
(autre mutation ou thalassémie). Le diagnostic de drépanocytose
est confirmé par la présence majoritaire d'hémoglobine S.
Chez le sujet hétérozygote le taux de Hb S est inférieur
à 30%. L'hémoglobine normale adulte est composée d'Hb A en
grande majorité avec un taux d'Hb A2 inférieur à 3,5%. Le
sujet drépanocytaire ne possède pas d'Hb A, mais il existe un
taux variable d'Hb F.
Remarque : Chez certains malades, lorsque deux
mutations sont associées on parle de double hétérozygote
(Exemple : S C).
Tableau 1 : Répartition normale de l'hémoglobine
chez différents types de sujet
|
Normal
Nouveau né
|
Normal
Adulte
|
Hétérozygote
|
Drépanocytose
Homozygote
|
Double hétérozygote
|
|
Hémoglobine
|
A
F ? 80%
A2
|
A
A2 ? 3,5%
|
A
S = 35 à 45%
A2 ?3,5%
|
S ? 90%
F = 2 à 20%
A2 ? 3,5%
|
S
C
|

Figure 3 : Schéma d'une
électrophorèse sur acétate de cellulose

Figure 4 : Schéma d'une
électrophorèse sur agarose
Ø Test d'Emmel ou Test de falciformation :
L'examen se fait par une observation des GR provenant d'un
échantillon de sang, à l'aide d'un microscope. On observe alors
à l'état frais, entre lame et lamelle, les GR qui prennent
progressivement la forme typique en "faucille". Ce test est positif chez les
homozygotes et hétérozygotes. L'examen du frottis sanguin d'un
drépanocytaire peut être négatif, il est alors possible de
déclencher au laboratoire la falciformation, soit en rajoutant un
réducteur comme le métabisulfite au sang du malade, soit en
créant artificiellement d'une autre manière une atmosphère
pauvre en oxygène.
Ø Test d'Itano ou Test de solubilité :
L'examen se fait dans un tube à essai transparent.
L'hémoglobine S, réduite par action d'hydrosulfite de sodium,
précipite dans une solution de phosphate 2,24 mol/L. La solution d'Hb
précipité devient opaque tandis que le témoin reste
transparent. Ce test n'est toutefois pas spécifique car d'autres
hémoglobines, plus rares, peuvent également précipiter. Ce
test ne distingue pas non plus les homozygotes des
hétérozygotes.
Actuellement, il est recommandé d'effectuer des
dépistages chez les couples afin de les informer que l'enfant
conçu par deux porteurs sains présente un risque de
probabilité d'une chance sur quatre d'être atteint d'anémie
falciforme.
1.5. Prévention et traitement
Hormis la greffe de la moelle osseuse, à l'heure
actuelle la drépanocytose n'est pas médicalement curable. Les
hématies étant produites à partir de cellules souches dans
la moelle osseuse, en détruisant celle du malade et en la
remplaçant par celle d'un donneur, il y a possibilité d'obtenir
une guérison totale. Environ 200 greffes ont été
réalisées dans le monde chez des drépanocytaires,
permettant d'obtenir la guérison dans 85 % des cas15(*), il requiert cependant un
donneur apparenté le plus possible (un frère, une soeur,
etc.).
Le traitement conventionnel est en général
symptomatique et repose sur :
- le traitement des crises vaso-occlusives : antalgiques
(pouvant aller jusqu'aux opiacés) et mise sous oxygène ;
- la prévention des facteurs déclenchant les
crises (froid, altitude, infections, déshydratation) ;
- les suppléments en folates ;
- le traitement préventif des infections à
pneumocoque et méningocoque (vaccination) ;
- la transfusion sanguine en cas d'anémie profonde ou
d'infection grave ;
- la transfusion-saignée permettant de réduire
la proportion d'Hb S ;
- L'Hydroxyurée (HYDREA®) et la Décitabine
(DACOGEN®) qui stimulent la synthèse d'Hb F et limitent le risque
d'anoxie. Cependant, tous les patients ne répondent pas à ces
drogues et des cas de myelosuppression ont été reportés
comme effets indésirables16(*), 17(*). De plus, vu qu'il s'agit d'un traitement à
long terme, l'obstacle à leur utilisation reste le coût qui
demeure exorbitant dans les pays en voie de développement.
S'agissant de la phytothérapie, plusieurs recettes
africaines sont connues :
- DREPANOSTAT® qui, selon son concepteur Dr D'ALMEIDA
AYIGAN Oscar, a comme principe actif l'acide hydroxyméthylbenzoïque
et agirait en augmentant le taux de Hb F. Il est commercialisé au Togo
et obtenu à partir d'extrait de Fagara
xanthoxyloïdes18(*)
- NICOSAN® (HEMOXIN® aux Etats Unis
d'Amérique, Nicosan ou Nix-0699), il s'agit d'une teinture obtenue
à partir de graines de Piper guineense, d'écorces de
Pterocarpus osum, de fruits d'Eugenia caryophyllum et de
feuilles de Sorghum bicolor. Cette recette possède
également des effets antifalcémiants19(*) ; initialement
lancée au Nigéria par le National Institute for Pharmaceutical
Research and Development (NIPRD), elle est actuellement en Phase 3 des essais
cliniques20(*). Son
criblage phytochimique a révélé la présence de
flavonoïdes, alcaloïdes, saponines, tanins, glycosides et des traces
d'anthraquinones21(*).
- VK-500® mis au point par Dr MEDEGAN FAGLA
Jérôme à partir de plusieurs plantes dont Fagara
xanthoxyloïdes et exploité au Bénin depuis
199922(*)
- Au Laboratoire des substances naturelles et chimie
médicinale du département de Chimie de l'Université de
Kinshasa, Professeur Docteur MPIANA TSHIMANKINDA Pius et son équipe de
recherche ont confirmé l'activité antifalcémiante des
anthocyanes de plusieurs plantes congolaises dont Annona
senegalensis, Alchornea cordifolia, Ocimum basilicum L.,
Bombax pentadrum, Ficus capensis, Jatropha curcas
L., Justicia secunda Vahl, etc.23(*)
Des recherches sur le sang, les greffes de cellules souches de
moelle osseuse, la thérapie génique et de nouveaux
médicaments pour l'anémie falciforme sont en cours ; les
chercheurs espèrent trouver de meilleurs traitements pour la maladie.
La thérapie génique est étudiée
comme un possible traitement de l'anémie falciforme. Les chercheurs
aimeraient savoir s'il est possible qu'un gène normal soit introduit
dans les cellules souches de la moelle osseuse d'un drépanocytaire afin
que ce dernier puisse induire le corps du malade à fabriquer des
globules rouges normaux. Les chercheurs étudient également une
possibilité de « désactiver » le gène
de l'Hb S ou « d'activer » un gène qui puisse
induire les globules à se comporter normalement12.
S'agissant des nouveaux médicaments, plusieurs sont en
étude :
- les agonistes des récepteurs d'adénosine A2a,
ces médicaments peuvent réduire les complications liées
à la douleur chez les personnes qui ont la drépanocytose
- 5-hydroxyméthyl-2-furfural ou 5-HMF, un
aldéhyde aromatique naturel ayant une forte affinité pour Hb S et
qui inhibe la falciformation par augmentation allostérique du taux
d'oxygène dans le GR24(*)
- Le MX-1520, une pro drogue de la vanilline, forme
également une liaison covalente avec Hb S et augmente la saturation en
oxygène du GR, ce qui permet de prévenir ou reverser la
falciformation25(*)
- La thérapie à base de supplément de
L-Glutamine semble aussi avoir un effet favorable dans la prévention des
crises. L'acide aminé naturel serait un précurseur essentiel dans
la synthèse du potentiel redox NAD, protégeant ainsi le globule
rouge du stress oxydatif26(*)
1.6. Distribution géographique
La drépanocytose affecte des millions de personnes
à travers le globe, cependant elle est plus répandue en Afrique
noire. Selon l'OMS, dans le monde entier 300 000 enfants naissent chaque
année avec une anomalie majeure de l'hémoglobine dont la plus
fréquente est celle de l'anémie falciforme6.
L'allèle S, responsable de l'anomalie, est surtout répandu dans
le continent africain (atteignant dans certaines populations la
fréquence de 30 %) ; on le trouve également en Inde, en Arabie
Saoudite et dans d'autres régions du bord de la
Méditerranée, en Italie (surtout en Sicile) et en Grèce.
Les migrations ont accru la fréquence de cette maladie sur le continent
américain.
Cette distribution se superpose assez bien avec celle de la
malaria. Ceci s'explique par le fait que les GR des porteurs AS
possèdent une certaine résistance vis-à-vis du paludisme
et on note chez eux de très rares épisodes de malaria, alors que
cette dernière tue beaucoup les enfants de moins de 5 ans qui ne sont
pas porteurs AS. Il s'ensuit à la longue, une lente sélection
naturelle qui voit le nombre de porteurs AS augmenté, multipliant les
chances d'avoir des naissances homozygotes SS, d'où au final on observe
le taux de drépanocytose augmenter avec celui de la malaria.
Association Drépavie
http://www.drepavie.org

Figure 5 : Distribution géographique de
l'hémoglobine S
CHAPITRE 2 :
GENERALITES SUR LE DEVELOPPEMENT DES MEDICAMENTS A PARTIR DE PLANTES
Le monde végétal a depuis très longtemps
constitué l'une des principales sources de médicaments
utilisés en thérapeutique pour soigner les maladies de l'homme.
Les plantes médicinales sont des drogues végétales
dont au moins une partie possède des propriétés
médicamenteuses. Elles peuvent être utilisées à leur
état naturel ou servir de modèles ou précurseurs pour la
synthèse chimique partielle ou totale.
De nombreuses plantes, connues depuis des lustres, demeurent
encore irremplaçables de nos jours à cause des principes actifs
qu'elles renferment. On peut citer parmi tant d'autres3 :
- le pavot, Papaver somniferum (dérivés
morphiniques)
- le saule, Salix spp (dérivés
salicylés)
- le colchique, Colchicum automnale (colchicine)
- la digitale, Digitalis lanata
(hétérosides cardiotoniques)
- le coca, Erythroxylum coca (cocaïne et
anesthésiques locaux)
- le quinquina, Cinchona spp et l'armoise,
Artemisia annua (antipaludéens)
- etc.
Comme nous pouvons le remarquer, ces nombreuses plantes sont
pour la plupart des plantes européennes ou asiatiques et si elles sont
universellement connues c'est parce que des recherches scientifiques ont permis
de les valoriser. L'Afrique également dispose d'une flore immense
où de nombreux principes actifs attendent d'être découverts
ou révélés au grand public.
Dans les coins les plus reculés, la médecine
traditionnelle soigne de manière empirique de nombreuses maladies
grâce aux plantes. Depuis quelques années, ces dernières
sont sujettes à de nombreuses publications scientifiques dans le cadre
du processus de découverte et de développement des
médicaments à partir de plantes. De façon
générale, ce processus implique successivement les
étapes suivantes27(*):
- Enquête ethno-pharmacologique
- Screening biologique
- Analyse biologique de l'extrait brut de la plante
- Screening phytochimique de l'extrait brut actif
- Isolement et purification des composés de l'extrait
actif
- Analyse biologique et identification des composés
isolés
- Quantification et comparaison des effets biologiques
à des composés de référence connus
- Etudes pharmacologique et toxicologique des produits
actifs
- Développement galénique
- Essais cliniques
- Autorisation de mise sur le marché.
2.1. Enquête ethno-pharmacologique
Elle vise d'une part à identifier la plante
étudiée à l'aide d'un herbier (ordre, famille, genre,
espèce), et d'autre part à connaître la partie de la plante
utilisée traditionnellement en thérapeutique et la forme sous
laquelle elle est administrée (décocté, infusion, etc.)
afin d'orienter la recherche de l'activité pharmacologique.
2.2. Screening biologique et analyse biologique de l'extrait
brut
Ici le matériel végétal est
partagé entre l'eau et un solvant organique polaire comme
l'éthanol ou le méthanol et les extraits bruts obtenus sont
examinés biologiquement. Les tests biologiques ont pour but de mettre en
évidence les activités pressenties dans la plante.
La solution la plus active est extraite avec
différents solvants organiques en vue de réaliser la
séparation de différents métabolites secondaires de
l'extrait brut et les différents extraits obtenus sont analysés
biologiquement.
2.3. Screening phytochimique de l'extrait brut
L'extrait le plus actif obtenu précédemment est
soumis à un screening phytochimique pour identifier les groupes de
composés présents et prévoir le mode d'extraction à
utiliser ultérieurement.
- Recherche des alcaloïdes (réactif de Mayer,
réactif de Dragendorff)
- Recherche des flavonoïdes (acide chlorhydrique et
copeau de Mg puis extraction par l'alcool isoamylique : réaction de
Shinoda)
- Recherche des saponines (test de mousse)
- Recherche des hétérosides cardiotoniques
(réactif de Keller-Killiani et réaction de Kedde)
- Recherche des stérols (réactif de Libermann -
H2SO4, anhydride acétique)
- Recherche des tanins (solution chlorhydrique de
FeCl3 et gélatine salée)
- etc.
2.4. Isolement et purification des composés de
l'extrait actif
Cette étape nécessite la combinaison de
plusieurs techniques chromatographiques : chromatographie sur colonne,
chromatographie sur papier, chromatographie sur couche mince CCM,
chromatographie liquide haute performance HPLC, chromatographie liquide en
phase gazeuse GLC, ainsi que la cristallisation.
2.5. Analyse biologique et identification des composés
isolés
Ici on procède à nouveaux à des tests
biologiques in vitro ou in vivo, puis on procède
à l'identification des composés isolés :
- déterminations des constantes physiques ;
- caractères organoleptiques ;
- masse moléculaire et formule brute par
spectrométrie de masse ;
- diffraction aux rayons X ;
- spectre UV, IR et RMN
2.6. Quantification et comparaison des effets biologiques
à des composés de référence
Les expériences peuvent se faire in vitro ou
in vivo. Les tests pharmacologiques spécifiques in
vivo consistent à provoquer une maladie chez l'animal et à
observer l'effet d'un échantillon (produit) sur cette maladie.
L'activité quantifiée est comparée à un produit
connu et/ou à un produit de référence, ceci pour voir si
le produit testé possède l'activité recherchée
d'une part et s'il peut par exemple remplacer un produit connu utilisé
pour la pathologie expérimentée d'autre part.
2.7. Etudes pharmacologique et toxicologique des produits
actifs
Cette étape vise à tenter d'établir les
mécanismes d'action des produits actifs sur base notamment de la
structure élucidée et est complétée d'une
étude toxicologique pour évaluer l'innocuité du
médicament.
2.8. Développement galénique
Le médicament est mis sous sa forme galénique
définitive avant de procéder aux essais cliniques. Cette forme
pharmaceutique définitive est conçue en tenant compte des
propriétés physico-chimiques du principe actif, du type de
patient auquel le produit sera destiné, son acceptabilité, la
stabilité et la biodisponibilité du principe actif.
2.9. Essais cliniques
Il s'agit des différents essais effectués sur
l'être humain sain et malade dans le but de déterminer les
conditions d'utilisation du médicament (indications, posologie,
précautions d'emploi etc.). Ils se déroulent en 4
phases :
· Phase 1: Etude de la première
administration chez l'homme
Son objectif est de déterminer le profil de
tolérance et l'innocuité du médicament, la posologie qui
entraîne les premiers effets thérapeutiques et celle qui
entraîne les premiers effets indésirables. Elle s'opère sur
des sujets volontaires en bonne santé (20 à 80 personnes) et
c'est au cours de cette phase qu'on débute les études initiales
de pharmacocinétique humaine. Sa durée maximale est de 1 an.
· Phase 2 : Etude de l'efficacité
pharmacologique
Les études sont réalisées chez des
patients volontaires (100 à 200) avec une maladie ciblée.
L'objectif poursuivi est de définir les conditions de
l'efficacité (suppression des symptômes caractéristiques de
la maladie) et à définir les modalités
thérapeutiques (dose efficace et effets secondaires observés). Sa
durée s'étend de plusieurs mois à 4 ans.
· Phase 3 : Etude de l'efficacité
thérapeutique
L'objectif poursuivi au cours de cette phase est la recherche
d'une différence entre l'évolution de deux groupes (groupe
expérimental et groupe témoin) avec modification statistique
significative du paramètre d'appréciation. Le groupe
expérimental reçoit le produit étudié tandis que le
groupe témoin reçoit soit un placebo, soit un produit de
référence (médicament reconnu actif dans l'indication). Le
nombre de patients concerné par cette étape est de 200 à 1
000 et la durée s'étend sur plusieurs années.
· Phase 4 : Etude post commercialisation ou
pharmacovigilance
Le but de cette phase est de déceler des effets
indésirables rares qui ne peuvent pas être repérés
dans les études des phases précédentes. La phase comporte
des études d'efficacité et de tolérance dans les
conditions usuelles de prescription après la mise du médicament
sur le marché.
2.10. Autorisation de mise sur le
marché
L'AMM est en quelques mots une homologation que doit obtenir
un médicament pour pouvoir être commercialisé. Le
médicament « candidat » à l'obtention d'une AMM est
examiné par l'Autorité ayant la Santé Publique dans ses
attributions à partir d'un dossier de demande d'autorisation de mise sur
le marché qui comprend 4 parties :
· Dossier pharmaceutique (galénique et
analytique)
Défini le médicament par ses conditions de
fabrication et de contrôle sur les matières premières et le
produit fini
- Composition qualitative et quantitative
- Description du procédé de fabrication
- Contrôle des matières premières et des
articles de conditionnement
- Contrôle des produits semi finis
- Contrôle des produits finis
- Description des conditions de conservation et du mode
d'administration
· Dossier toxicologique
· Dossier pharmacologique (pharmacocinétique,
biodisponibilité, marge thérapeutique)
· Dossier clinique (résultats des essais
cliniques).
CHAPITRE 3 : APERCU
ETHNO-MEDICAL ET DONNEES ANTERIEURES SUR BEAT-SS®
3.1. Présentation de BEAT-SS®
BEAT-SS® est un médicament traditionnel disposant
d'un brevet et utilisé dans le traitement de la drépanocytose. Il
est préparé et administré à des patients
drépanocytaires depuis de nombreuses années par le Centre de
Phytothérapie Moderne NIECA, dont le siège est situé dans
la commune de Ngaba sur la Rue Kingasani N°8.
BEAT-SS® est présenté sous forme de
solution buvable. Il est préparé à partir d'écorces
de tronc et de branches d'un grand arbre des régions tropicales de la
famille des Bombacacées.
Selon le centre NIECA, une amélioration significative
des symptômes cliniques a été observée chez les
patients suivant un traitement à base de ce médicament,
particulièrement en ce qui concerne la fatigue, les douleurs
aigües, le gonflement des mains et des pieds, la pâleur de la peau
et cela sans recours à des transfusions sanguines pendant de longues
périodes1.
3.2. Données phytochimiques
Des travaux antérieurs ont permis de mettre en
évidence les groupes phytochimiques présents dans
BEAT-SS® : dont les polyphénols, les saponines, les quinones,
les tanins catéchiques, les anthocyanes et les
terpénoïdes12 (voir Tableau 2) toutefois, il est
à noter que ces études antérieures ont
démontré que les saponines ont un effet néfaste sur la
réhabilitation des globules rouges falciformes.11
De plus, il a également été montré
in vitro que la fraction éthéro-méthanolique (qui
constitue d'ailleurs le point focal de ce travail) et la fraction butanolique
de BEAT-SS® améliorent la solubilité de l'Hb S dans les
conditions d'hypoxie28(*).
Tableau 2 : Screening chimique des extraits bruts de
BEAT-SS®
|
Groupes phytochimiques
|
Réactifs
|
Résultats
|
|
Extrait aqueux
|
Extrait CHCl3
|
|
Saponines
|
Test de mousse
|
++
|
|
|
Alcaloïdes
|
Dragendorff
|
+++
|
|
|
Polyphénols
|
Barton
|
+++
|
|
|
Flavonoïdes
|
Shinoda
|
-
|
|
|
Quinones
|
Bornträger
|
+++
|
|
|
Tanins catéchiques
|
Stiasny
|
+++
|
|
|
Tanins galliques
|
FeCl3 2%
|
-
|
|
|
Composés réducteurs
|
Fehling
|
-
|
|
|
Hétérosides cardiotoniques
|
Kedde
|
-
|
|
|
Composés aminés
|
Ninhydrine
|
-
|
-
|
|
Anthocyanes
|
HCl 20%
|
+++
|
-
|
|
Coumarines
|
NH4OH 10%
|
|
-
|
|
Stéroïdes et terpénoïdes
|
Lieberman
|
|
+
|

3.3. Données pharmacologiques et toxicologiques
Des études in vitro réalisées
sur BEAT-SS® ont démontré les faits suivants :
- Absence d'hémolyse aux concentrations
usuelles1 :
Pour des concentrations allant de 20 à 500 ug/mL,
l'extrait aqueux est dépourvu d'effet hémolytique même
après 24 h d'incubation (la lyse des globules rouges survient et ne
devient significative qu'à partir de 2500 ug/mL) ;
- Action reverse sur la
falciformation1 :
A la concentration optimale de 200 ug/mL, l'extrait aqueux
restaure la morphologie normale des globules rouges falciformes placés
dans des conditions d'hypoxie. C'est cette importante propriété
qui justifie son usage dans le traitement symptomatique de la
drépanocytose ;
- Inhibition de l'agrégation des globules
rouges1 :
L'extrait aqueux de BEAT-SS® s'oppose à
l'adhésion des globules rouges entre eux, ce qui permettrait
d'améliorer la viscosité du sang des malades
drépanocytaires et contribuerait également à
prévenir les occlusions au niveau des vaisseaux de faible
calibre ;
- Prolongation du temps de coagulation et diminution
de l'activité de la thrombine29(*) :
Il s'agit d'une autre propriété que
possède l'extrait aqueux. Observée aussi bien chez les
drépanocytaires que chez les sujets sains, elle pourrait être
exploitée dans la recherche de nouvelles thérapies concernant les
maladies cardiovasculaires ;
- Absence de toxicité jusqu'à 7 g de
produit par Kg de poids
corporel28 :
Ce résultat fut obtenu à l'Institut National de
Recherches Biomédicales (INRB) de Kinshasa après que la
toxicité de BEAT-SS® ait été évalué par
étude in vivo sur 15 souris males et 15 souris femelles de
poids différents, en présence de 3 souris males et 3 souris
femelles comme témoins.
PARTIE EXPERIMENTALE
CHAPITRE 4 :
MATERIELS ET METHODES
Excepté l'étape de lyophilisation, toutes les
opérations dans le cadre de ce travail ont été
effectuées au Laboratoire de Recherche Bio-Organique de la
Faculté des Sciences Pharmaceutiques à l'Université de
Kinshasa.
4.1. Matériels
4.1.1.
Matériel végétal
La poudre de BEAT-SS®, issue du broyage des
écorces séchées de troncs et de branches d'arbres, a
constitué notre matériel végétal. Il nous a
été fourni par le Centre de Phytothérapie moderne NIECA en
date du 15 mars 2013.
4.1.2.
Matériel biologique
Les échantillons de sang de patients
drépanocytaires (SS) utilisés dans ce travail ont
été collectés au Centre de Médecine Mixte
d'Anémie SS Mabanga situé à Yolo dans la ville de
Kinshasa, avec l'approbation du Comité Congolais d'Ethique. Les patients
choisis furent ceux n'ayant pas reçu de transfusion sanguine durant les
2 mois précédents leurs dons de sang.
Le sang fut introduit dans des tubes à essai contenant
l'EDTA 10% comme anticoagulant (acide éthylène diamine
tétra acétique 10% : 0,05 mL pour 3 mL de sang). Les
échantillons furent placés dans une glacière lors du
transport jusqu'au laboratoire puis conservé au
réfrigérateur à 4°C avant les essais biologiques. Ces
échantillons de sang se présentent comme indiqué au
Tableau 3.
Tableau 3 : Identification des échantillons de sang pour
les essais biologiques
|
Echantillons de sang
|
|
N°
|
Age
|
Sexe
|
|
1
|
24
|
Féminin
|
|
2
|
18
|
Masculin
|
|
3
|
11
|
Masculin
|
4.1.3. Matériel de
laboratoire
§ Pour le fractionnement
Verreries et appareillage :
- verrerie usuelle d'un laboratoire de chimie (ballon à
fond rond, bécher, pied gradué, erlenmeyer, entonnoir conique,
entonnoir Büchner, ouate, papier filtre Laborimpex, papier
indicateur de pH Macherey Nagel, etc.)
- agitateur magnétique avec plaque chauffante
Stuart
- balance analytique électronique Kern & Sohn
Gmbh ABS
- pompe à vide Knf Laboport
- évaporateur rotatif Laborota 4000
- étuve Memmert Electro Helios
- Sonicateur VWR
Réactifs et solvants :
- eau distillée
- méthanol p.a. Merck (99,9% ; d=0,79)
- éther di éthylique p.a. Panreac
(99,7% ; d=0,713)
§ Pour l'évaluation de l'activité
antifalcémiante
Verreries et appareillage :
- Microscope à écran LCD et caméra
incorporée Bresser, Gmbh & Co. KG
- lames porte-objet
- lamelles couvre-objet
- pipettes pasteur
- embouts
- tubes à essai
- micro tubes stériles de 1,5 à 2 mL
- tubes de prélèvement de sang
- seringues de 5 mL
- gants à usage unique
- papiers buvards
Réactifs et solvants :
- Métabisulfite de sodium
(Na2S2O5 2% préparée
extemporanément)
- Eau physiologique (NaCl 0,9%)
- Alcool dénaturé 75°
§ Pour le screening phytochimique
Verrerie et appareillage :
- Verrerie usuelle de laboratoire
- Plaque chauffante Stuart
- Balance analytique électronique Kern & Sohn
Gmbh ABS
- Etuve Memmert Electro Helios
- Sonicateur VWR
Réactifs et solvants :
- Réactif de Stiasny (Formol 30% 10 mL ; HCl conc
5 mL)
- Réactif de Dragendorff (Sous nitrate basique de
Bi 0,85 g ; KI 8 g ; CH3COOH glacial 10
mL ; eau distillée 70 mL)
- Réactif de Bouchardat (I2 2 g ; KI 2
g ; eau distillée qsf 100 mL)
- Réactif au Butanol chlorhydrique (Butanol 40
mL ; HCl conc 10 mL)
- Réactif Fehling A (CuSO4 4,5 g ; eau
distillée qsf 100 mL)
- Réactif Fehling B (Tartrate de Na et K 20 g ;
NaOH 15 g ; eau distillée qsf 100 mL)
- Eau distillée
- Ethanol
- Acide chlorhydrique
- Acide sulfurique
- Chloroforme
- Hydroxyde de sodium
- Hydroxyde d'ammonium
- Solution de chlorure ferrique 2%
4.2. Méthodes
4.2.1.
Fractionnement de BEAT-SS®
En se référant à la recette telle que
décrite par les phytothérapeutes (bouillir 50 g de poudre
d'écorce dans 1 L d'eau distillée pendant 5 minutes), deux
décoctions de la poudre de BEAT-SS® furent préparées
séparément puis mélangées pour obtenir un
décocté de 365 g de poudre dans 7,5 L d'eau distillée.
Celui-ci fut filtré à chaud sur de l'ouate et le marc fut
lavé 4 fois avec 100 mL d'eau chaude. Au final, nous avons obtenu 7,3 L
de décocté qui furent lyophilisés à l'INRB. Le
lyophilisat pesait 29,4354 g.
25 g de lyophilisat ont été pesés et
dissouts dans 420 mL de méthanol sous sonication. La solution fut
filtrée sous vide à l'aide d'un entonnoir Büchner. La partie
du lyophilisat insoluble dans le méthanol fut
récupérée, séchée à l'étuve
à 40°C puis pesée pour donner 13,9260 g.
A la solution méthanolique obtenue, nous avons
ajouté 1680 mL d'éther di éthylique. Il y a eu formation
d'un précipité floconneux que nous avons isolé par
filtration sur Büchner. Nous avons obtenu au final d'une part la solution
éthéro-méthanolique (eaux mères) qui fut
concentrée à l'évaporateur rotatif à 40°C et
d'autre part le précipité de saponines brutes. Les 2 fractions
obtenues furent séchées à l'étuve à
40°C et pesées. Leurs poids étant de 7,5325 g pour le
précipité sec de saponines et de 3,5412 g pour le résidu
sec de la solution éthéro-méthanolique.
Poudre de BEAT-SS®
(365 g)
-Décoction dans 7,5 L d'eau distillée pendant 5
min
-Filtration à chaud sur ouate
-Lavage du marc à l'eau bouillante
Marc Décocté de BEAT-SS®
(7,3 L)
-Lyophilisation
Poudre lyophilisée
(29,4354 g)
- Pesée de 25 g de lyophilisat
- Dissolution dans 420 mL de MeOH au Sonicateur
- Filtration sur entonnoir Büchner
Partie insoluble dans MeOH Solution
méthanolique
(13,9260 g) - Ajout de 1680
mL d'Et2O
- Filtration sur entonnoir Büchner
Précipité
Eaux mères
- Séchage à l'étuve -
Concentration à l'évaporateur rotatif
- Séchage à l'étuve
Précipité de Résidu sec
de la
saponines brutes solution
éthéro-méthanolique
(7,5325 g) (3,5412 g)
Figure 6 : Schéma de fractionnement de
BEAT-SS®
Tableau 4 : Rendement du fractionnement de BEAT-SS®
|
Poudre lyophilisée de départ = 25
g
|
|
Résidu sec des différentes
fractions
|
Quantité obtenue
(en g)
X
|
Facteur de proportionnalité
x/25
|
Pourcentage
%
|
|
Solution
éthéro-méthanolique
|
3,5412
|
0,1416
|
14,16
|
|
Saponines
brutes
|
7,5325
|
0,3013
|
30,13
|
|
Insoluble
dans le méthanol
|
13,9260
|
0,5570
|
55,70
|
|
Total
|
100,00%
|
4.2.2. Evaluation
de l'activité antifalcémiante
La falciformation des GR est induite par l'état
d'hypoxie créé par l'addition de métabisulfite de sodium
(Na2S2O5 2% préparée
extemporanément) sur les échantillons de sang de patients
drépanocytaires selon le test d'Emmel. La méthode pour
l'évaluation de l'activité antifalcémiante des
différents extraits sur un échantillon de sang peut être
brièvement décrite comme suit :
Un volume déterminé de l'échantillon de
sang d'un patient drépanocytaire a été
mélangé avec un volume équivalent de métabisulfite
de sodium (2%). Le mélange a été incubé pendant 1 h
à température ambiante pour compléter la falciformation.
Les observations au microscope ont confirmé que la falciformation des GR
commencent à se produire au moins 30 min après l'addition de
métabisulfite de sodium, ainsi la durée de 1 h d'incubation
était suffisante pour une falciformation complète pour la
majorité des GR1.
Après 1 h d'incubation du sang avec du
métabisulfite de sodium, un volume équivalent de chaque extrait
à différentes concentrations a été ajouté
à celui du mélange précédent (Sang de patient SS +
Métabisulfite de sodium) et incubé de nouveau pendant 30 ou 120
min de plus à température ambiante. Un échantillon a
été prélevé pour l'examen microscopique. Les GR ont
été comptés afin de déterminer le nombre de GR
falciformes (déformés et allongés) et de GR normaux
(arrondis). Le nombre de GR totaux a été déduit par la
somme des GR falciformes et GR normaux. Le pourcentage de GR normaux a
été obtenu par calcul et il représente le rapport des GR
normaux sur le total des GR comptés1.
Les concentrations utilisées étaient de 100, 200
et 400 ìg/mL par rapport à la poudre initiale de BEAT-SS®,
ce qui a déterminé l'introduction d'un facteur de
proportionnalité pour la préparation des différents
extraits afin que cette concentration soit la même pour toutes.
Deux témoins ont été utilisés pour
le contrôle de l'échantillon de sang du patient SS : un
Témoin positif dans lequel le sang est en hypoxie (Sang SS +
Na2S2O5 2%) et un Témoin négatif
dans lequel le sang est en milieu oxygéné (Sang SS + NaCl
0,9%).
a) Préparation des
échantillons témoins
o Témoin positif :
A 50 ìL de l'échantillon de sang, on a
ajouté 50 ìL de Na2S2O5 2% puis
on a laissé reposer 1 h avant de prélever 5 ìL pour
l'observation au microscope électronique.
o Témoin négatif :
A 50 ìL de l'échantillon de sang, on a
ajouté 50 ìL de NaCl 0,9% puis on a laissé reposer 1 h
avant de prélever 5 ìL pour l'observation au microscope
électronique.
b) Préparation des solutions
mères et des dilutions
o Préparation des solutions
mères
Les solutions mères de chaque extrait des fractions
isolées ont été préparées à une
concentration équivalente à 1 mg/mL de poudre lyophilisée
de BEAT-SS®. Pour avoir cette concentration pour chaque fraction il nous a
fallu tenir compte des facteurs de proportionnalité figurant dans le
Tableau 4 qui rendent compte de la proportion de chaque fraction par rapport
à la poudre lyophilisée de BEAT-SS® de départ.
Ainsi pour préparer un volume de 5 mL pour chacune des
fractions, chaque quantité m à peser fut dissoute sous
sonication dans quelques mL de solution physiologique (NaCl 0,9%) contenue dans
un micro tube et la solution fut portée au volume à 5 mL avec du
NaCl 0,9%. Le Tableau 5 présente de manière explicite le mode de
préparation.
 
avec m : quantité à peser en mg
f : facteur de proportionnalité
c : concentration qui est de 1 mg/mL
v : volume de la solution qui est de 5 mL
Tableau 5 : Mode de préparation des solutions
mères
|
Fractions
|
Facteur de proportionnalité
|
Concentration (en mg/mL)
|
Quantités pesées
(en mg)
|
Volume final de la solution
|
Concentration finale équivalente à la
poudre de départ
|
|
Poudre lyophilisée
de BEAT-SS®
|
1
|
1
|
5
|
5 mL
|
1 mg/mL
|
|
Résidu sec de la solution
éthéro-méthanolique
|
0,1416
|
0,1416
|
0,7080
|
|
Résidu sec des saponines brutes
|
0,3013
|
0,3013
|
1,5065
|
|
Résidu de la partie insoluble dans MeOH
|
0,5570
|
0,5570
|
2,7850
|
De manière concrète, pour préparer la
solution mère de la fraction éthéro-méthanolique de
concentration 1 mg/mL équivalente à la poudre lyophilisée
de BEAT-SS® : nous avons pesé 0,7080 mg du résidu sec
de la solution éthéro-méthanolique que nous avons dissout
sous sonication dans environ 3 mL de NaCl 0,9% contenu dans un micro tube et la
solution fut portée au volume à 5 mL avec du NaCl 0,9%. Nous
avons procédé ainsi pour chaque fraction, seule la nature des
solutés et leur quantité ont différé. Au total, 4
fractions ont été préparées et
évaluées. Il s'agit de :
- Lyophilisat (L)
- Solution éthéro-méthanolique
(E)
- Saponines brutes (S)
- Partie insoluble dans le méthanol
(I)
o Préparation des dilutions
Pour chacune des fractions, les concentrations
utilisées pour l'évaluation de l'activité
antifalcémiante étaient de 100, 200 et 400 ìg de la poudre
initiale de BEAT-SS® par mL de sang. Pour avoir exactement ces
concentrations dans les extraits à évaluer nous avons
procédé selon le schéma suivant :
Ø Pour 100 ug/mL
800 uL de solution de NaCl 0,9% ont été
mélangés avec 200 uL de la solution mère de l'extrait,
ensuite 50 uL du mélange obtenu précédemment ont
été mélangé avec 50 uL de sang traité par la
solution de Na2S2O5 2%.
Ø Pour 200 ug/mL
600 uL de solution de NaCl 0,9% ont été
mélangés avec 400 uL de la solution mère de l'extrait,
ensuite 50 uL du mélange obtenu précédemment ont
été mélangé avec 50 uL de sang traité par la
solution de Na2S2O5 2%.
Ø Pour 400 ug/ mL :
200 uL de solution de NaCl 0,9% ont été
mélangés avec 800 uL de la solution mère de l'extrait,
ensuite 50 uL du mélange obtenu précédemment ont
été mélangé avec 50 uL de sang traité par la
solution de Na2S2O5 2%.
Au final, nous avons eu 3 concentrations de travail et 4
fractions à évaluer pour 3 échantillons de sang, soit un
total de 36 solutions d'extraits à observer au microscope.
c) Observation au microscope et comptage
des globules rouges
Une fois leur préparation terminée, les
solutions d'extraits à évaluer ont été
numérotées puis laissées au repos pendant 60 min. Ensuite,
5 ìL de chaque solution d'extrait ont été observés
au microscope et pour chaque fraction, 2 champs d'observation au microscope
ont été photographiés afin de permettre le comptage des
GR.
Comme décrit dans les paragraphes
précédents, les GR ont été comptés afin de
déterminer le nombre de GR falciformes (déformés et
allongés) et de GR normaux (arrondis). Le nombre de GR total a
été déduit par la somme des GR falciformes et GR normaux.
Le pourcentage de GR normaux représente le rapport des GR normaux sur le
total des GR comptés multiplié par 100.


Figure 7 : Méthode d'évaluation de
l'activité antifalcémiante
4.2.3. Screening
phytochimique de la fraction éthéro-méthanolique de
BEAT-SS®
Les principaux groupes phytochimiques présents dans la
fraction éthéro-méthanolique (E) ont été
recherchés par les méthodes standards3, 30(*), 31(*), 32(*), 33(*), 34(*);
Des solutions aqueuse et éthanolique, à partir
desquelles les aliquotes ont été prélevées pour
servir lors des tests, ont été préparées comme
suit :
Solution aqueuse :
20 mg de résidu de poudre de la fraction (E) ont
été dissouts dans 20 mL d'eau distillée, puis la solution
obtenue fut filtrée.
Solution éthanolique :
20 mg de résidu de poudre de la fraction (E) ont
été dissouts dans 20 mL d'éthanol, puis la solution
obtenue fut filtrée.
a) Détection des alcaloïdes
(Bouchardat et Dragendorff)
Principe :
La mise en évidence des alcaloïdes est
basée sur leur capacité à former des
précipités ou des complexes insolubles avec des métaux
lourds et/ou des métalloïdes (Bi, Hg, I2, etc.)
contenus dans les « réactifs généraux des
alcaloïdes » (Mayer, Bouchardat, Dragendorff, etc.)32.
Mode opératoire :
Traitez 2 mL de solution éthanolique par HCl
dilué, répartissez la solution dans 2 tubes à essai
numérotés et enfin ajoutez respectivement 2 gouttes de
réactif de Bouchardat dans le tube n°1 et 2 gouttes de
réactif de Dragendorff dans le tube n°2. L'apparition d'un
précipité jaunâtre dans le tube n°1 et d'un
précipité orange dans le tube n°2 indique un test
positif.
b) Détection des sucres
réducteurs (Fehling)
Principe :
La réaction de Fehling sert couramment à
caractériser des aldéhydes par leur oxydation avec des ions
cuivre (II) Cu2+. En biochimie, elle permet de mettre en
évidence la présence d'aldoses et de sucres réducteurs.
La solution de Fehling (A et B) contient des ions
Cu2+ complexés par les ions tartrate en milieu basique (les
ions tartrate permettent de maintenir en solution les ions Cu2+
à un pH auquel ils seraient précipités sous forme
d'hydroxyde Cu(OH)2 s'ils n'étaient complexés). Au
cours de la réaction, s'effectuant en milieu basique, l'ion cuivre (II)
Cu2+ oxyde l'aldéhyde pour donner un ion carboxylate, et un
précipité rouge brique d'oxyde de cuivre(l) CU2O selon
l'équation d'oxydoréduction32 :
RCHO + 2Cu2+(aq) +
5HO-(aq) ? RCOO- + CU2O?
+ 3H2O
Mode opératoire :
Dans un tube à essai, à 1 mL de solution aqueuse
ajoutez quelques gouttes de HCl 0,1M, ensuite neutralisez avec quelques gouttes
de NaOH 0,1M, rajoutez 1 mL de solution de Fehling A et B (1 : 1) et
chauffez le mélange 15 min au bain-marie à 70°C.
L'apparition d'un précipité rouge indique un test positif.
c) Détection des glycosides
cardiotoniques (Keller Killiani)
Principe :
Les 2-désoxy-hexoses des cardénolides peuvent
être mis en évidence par le test de Keller Killiani. Les oses sont
dissouts dans l'acide acétique contenant des traces de chlorure ferrique
puis est superposé de l'acide sulfurique concentré. Il y a
formation d'un anneau brun à l'interface puis diffusion de la couleur
dans l'acide acétique qui devient bleu3, 32.
Mode opératoire :
Dans un tube à essai, à 1 mL de solution aqueuse
ajoutez 1 mL d'acide acétique glacial et 1 mL de
H2SO4 concentré, puis au mélange rajoutez 2
à 3 gouttes de FeCl3 2%. L'apparition d'une coloration bleu
vert indique un test positif.
d) Détection des saponines (Test
de mousse)
Principe :
Les saponines sont des hétérosides dont la
génine stéroïdique ou triterpénique (lipophile) est
reliée à des résidus sucrés (polaires), cette
structure particulière leur confère des propriétés
amphiphiles (tensioactives) qui en font de véritables savons. Leur mise
en évidence dans une drogue végétale est basée sur
leur pouvoir aphrogène c'est-à-dire, la possibilité qu'ont
leurs solutions aqueuses de mousser par agitation32.
Mode opératoire :
Dans un tube à essai, reprenez quelques mg de
résidu sec de la fraction (E) dans 5 mL d'eau distillée. Bouchez
l'ouverture du tube à essai et agitez-le vigoureusement dans le sens de
la longueur pendant 15 s. La formation d'une mousse stable de hauteur
supérieure à 1 cm, persistant pendant plus de 15 min indique la
présence de saponines.
e) Détection des
polyphénols (FeCl3 2%)
Principe :
Les polyphénols naturels regroupent un vaste ensemble
de substances chimiques comprenant au moins un noyau aromatique, portant un ou
plusieurs groupes hydroxyles, en plus d'autres constituants (phénols
simples, acides-phénols, coumarines, naphtoquinones, flavonoïdes,
anthocyanes, tanins, etc.). Ils ont la capacité de former des
chélates colorés avec des sels de métaux lourds. Leur
présence au sein d'une drogue végétale est mise en
évidence par l'apparition d'une coloration ou la formation d'un
précipité noirâtre intense, après ajout de chlorure
de fer (III) à l'extrait de cette drogue.3, 32, 34
Mode opératoire :
Dans un tube à essai, à 1 mL de solution
éthanolique ajoutez quelques gouttes de FeCl3 2%.
L'apparition d'une coloration noirâtre indique la présence de
polyphénols.
f) Détection des tanins
(Bate-Smith, Stiasny et FeCl3 2%)
Principe :
On distingue deux types de tanins :
- les tanins hydrolysables ou galliques, ce sont des esters
d'acides gallique et ellagique
- les tanins condensés ou catéchiques ou
proanthocyanidoliques, ce sont des oligomères ou polymères de
flavanols
Les tanins, étant des polyphénols,
réagissent avec le chlorure ferrique pour donner une coloration
bleu-noir avec les tanins galliques ou vert-noir avec les tanins
catéchiques. Cependant, seuls les tanins catéchiques donnent avec
le réactif de Stiasny un précipité beige3. On
peut donc se servir de ces deux réactifs (Stiasny et FeCl3)
pour mettre en évidence les différents types de tanins
présents dans une drogue végétale.
Par ailleurs toujours pour l'identification des tanins
catéchiques, on peut se servir de la réaction spécifique
de Bate-Smith dans laquelle les tanins condensés, traités
à chaud par un acide, se dégradent en anthocyanidols pigments
colorés en rouge.3, 32
Mode opératoire :
Stiasny et FeCl3 2%
Dans un tube à essai, à 2 mL de solution aqueuse
ajoutez quelques gouttes de réactif de Stiasny et chauffez au bain-marie
à ébullition pendant 15 min. L'apparition d'un
précipité beige indique la présence de tanins
catéchiques. Filtrez ensuite la solution qui a servi à la
recherche des tanins catéchiques ci-haut et au filtrat rajoutez
quelques gouttes de FeCl3 2%. L'apparition d'une coloration
bleu-noir indique la présence de tanins galliques.
Bate-Smith
Dans un tube à essai, à 1 mL de solution aqueuse
ajoutez quelques gouttes de réactif au butanol chlorhydrique et portez
au bain-marie à 90°C pendant 15 min. La formation d'une
coloration rouge indique la présence de tanins catéchiques.
g) Détection des anthocyanes (HCl
conc et NH4OH 25%)
Principe :
Les anthocyanes sont des pigments dérivés de
l'ion flavinium. Ils sont mis en évidence par leur coloration qui varie
sensiblement en fonction du pH3, 32, 34 :
- rouge à pH ? 4
- bleu à pH compris entre 4 et 6
- incolore à pH ? 7
Mode opératoire :
Dans un tube à essai, à 1 mL de solution aqueuse
présentant une coloration plus ou moins foncée, ajoutez 1 mL de
HCl concentré puis 1 mL de NH4OH 25%. Si la coloration
s'accentue par acidification puis vire au bleu violacé en milieu
basique, on peut conclure à la présence d'anthocyanes.
h) Détection des flavonoïdes
(Shinoda)
Principe :
La réaction de Shinoda (ou réaction de la
cyanidine) est basée sur l'obtention de couleurs caractéristiques
du noyau flavonoïdique après sa réduction par
l'hydrogène naissant issu d'un métal plongé dans la
solution en milieu acide. Les couleurs caractéristiques
sont3 :
- rouge avec les flavonols - orange avec les flavones
- violet avec les flavanones - test négatif avec
les chalcones
Mode opératoire :
Dans un tube à essai, à 1 mL de solution
éthanolique, 5 mL d'éthanol chlorhydrique (2 : 1, v/v) sont
additionnés 2 à 3 copeaux de Mg et quelques gouttes d'alcool
isoamylique. L'apparition d'une coloration intense rose-orange ou
violacée indique un test positif.
i) Détection des
stéroïdes et triterpènes (Liebermann Burchard)
Principe :
En milieu anhydride acétique, les noyaux stérols
réagissent avec l'acide sulfurique concentré provoquant ainsi des
changements de coloration dus à l'augmentation de la conjugaison des
doubles liaisons au sein des cycles adjacents32.
Mode opératoire :
Dans un tube à essai, dissolvez quelques mg de
résidu de poudre de la fraction (E) dans CHCl3 puis rajoutez
au filtrat 1 mL d'anhydride acétique, ensuite laissez couler le long des
parois du tube 0,5 mL de H2SO4 concentré. La
formation d'un anneau brun à la zone de contact des deux liquides avec
une couche surnageante verte ou violette indique la présence de
stéroïdes et de triterpènes.
j) Détection des aminoacides
(Test à la ninhydrine)
Principe :
La ninhydrine est un composé aromatique utilisé
comme révélateur. Elle possède la particularité de
former à chaud avec les acides aminés un produit coloré en
violet32.
Mode opératoire :
Sur un papier filtre, déposez une goutte de la solution
aqueuse. Au même endroit déposez une goutte de réactif
à la ninhydrine et chauffez le papier filtre à l'étuve
à 90°C pendant 5 min. Procédez à un essai à
blanc sur le même papier filtre. L'apparition d'une teinte bleue ou
violette nettement différente de celle de l'essai à blanc indique
un test positif.
k) Détection des coumarines
(Fluorescence à la lampe UV)
Principe :
La mise en évidence des coumarines est basée sur
leur observation sous la lumière ultraviolette après l'ouverture
du cycle lactone et solubilisation en milieu alcalin3, 32.
Mode opératoire :
Répartissez dans 2 tubes à essai chacun 2 mL de
la solution éthanolique obtenue à partir du résidu. Dans
un des tubes à essai, ajoutez 0,5 mL de NaOH 10%, puis chauffez les 2
tubes à essai au bain-marie jusqu'à ébullition.
Après refroidissement, observez les tubes à la lampe UV à
365 nm. L'absence de fluorescence jaune dans les 2 tubes indique un test
négatif.
l) Détection des anthraquinones
(Bornträger)
Principe :
La caractérisation des principes actifs
anthracéniques dans une drogue végétale est basée
sur la coloration rouge intense que fournissent les 1,8-dihydroxy
anthraquinones lorsqu'elles sont placées en milieu fortement
alcalin3, 32.
Mode opératoire :
Dans un tube à essai, dissolvez quelques mg de
résidu de poudre de la fraction (E) dans 10 mL de HCl dilué au
1/5, chauffez au bain-marie bouillant pendant 20 min, puis extrayez avec 20 mL
de CHCl3 après refroidissement. À la phase organique,
ajoutez 0,5 mL de NH4OH 25%. L'apparition d'une teinte allant du
rouge au violet indique un test positif.
CHAPITRE 5 :
RESULTATS ET DISCUSSION
5.1. Résultats
5.1.1.
Fractionnement de BEAT-SS®
Partant de 25 g de poudre lyophilisée de notre
matériel végétal, le fractionnement a abouti à 3
résidus secs dont les proportions figurent dans le Tableau 4
déjà illustré plus haut.
Tableau 4 : Rendement du fractionnement de BEAT-SS®
|
Poudre lyophilisée de départ = 25 g
(L)
|
|
Résidu sec des différentes
fractions
|
Quantité obtenue
(en g)
X
|
Facteur de proportionnalité
x/25
|
Pourcentage
%
|
|
Solution
éthéro-méthanolique
(E)
|
3,5412
|
0,1416
|
14,16
|
|
Saponines
Brutes
(S)
|
7,5325
|
0,3013
|
30,13
|
|
Insoluble
dans le méthanol
(I)
|
13,9260
|
0,5570
|
55,70
|
|
Total
|
100,00%
|
5.1.2. Evaluation
de l'activité antifalcémiante
Après observation au microscope et comptage des GR, les
résultats obtenus pour les 3 échantillons de sang sont
présentés dans les Tableaux 6, 7 et 8. Un récapitulatif de
ces 3 Tableaux, présentant les différentes moyennes obtenues par
les extraits à différentes concentrations pour les 3
échantillons, est consigné dans le Tableau 9.
Tableau 6 : Résultats des essais biologiques pour
l'échantillon de sang n°1
|
Echantillon N°1
|
|
#
|
Conc
(ìg/mL)
|
GR falciformes
|
GR normaux
|
% de GR normaux
|
|
1er champ
|
2e champ
|
Moyenne
|
1er champ
|
2e champ
|
Moyenne
|
|
L
|
100
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
200
|
18
|
-
|
18
|
23
|
-
|
23
|
56,09
|
|
400
|
7
|
29
|
18
|
59
|
9
|
34
|
65,38
|
|
E
|
100
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
200
|
25
|
27
|
26
|
30
|
41
|
35
|
57,38
|
|
400
|
50
|
-
|
50
|
4
|
-
|
4
|
07,41
|
|
S
|
100
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
200
|
40
|
61
|
50
|
28
|
15
|
21
|
29,58
|
|
400
|
49
|
-
|
49
|
7
|
-
|
7
|
12,50
|
|
I
|
100
|
26
|
17
|
21
|
43
|
33
|
38
|
64,41
|
|
200
|
23
|
3
|
13
|
66
|
32
|
49
|
79,03
|
|
400
|
20
|
-
|
20
|
171
|
-
|
171
|
89,53
|
|
Témoin
Positif
|
60
|
-
|
60
|
5
|
-
|
5
|
07,69
|
|
Témoin
Négatif
|
5
|
10
|
7
|
88
|
67
|
77
|
91,67
|
Légende :
L : Lyophilisat
E : Solution
éthéro-méthanolique
S : Saponines brutes
I : Partie insoluble dans le
méthanol
Tableau 7 : Résultats des essais biologiques pour
l'échantillon de sang n°2
|
Echantillon N°2
|
|
#
|
Conc
(ìg/mL)
|
GR falciformes
|
GR normaux
|
% de GR normaux
|
|
1er champ
|
2e champ
|
Moyenne
|
1er champ
|
2e champ
|
Moyenne
|
|
L
|
100
|
18
|
4
|
11
|
38
|
40
|
39
|
78,00
|
|
200
|
9
|
11
|
10
|
37
|
43
|
40
|
80,00
|
|
400
|
18
|
-
|
18
|
13
|
-
|
13
|
41,93
|
|
E
|
100
|
54
|
53
|
53
|
13
|
27
|
20
|
27,40
|
|
200
|
26
|
17
|
21
|
10
|
10
|
10
|
32,26
|
|
400
|
20
|
26
|
23
|
3
|
6
|
4
|
14,81
|
|
S
|
100
|
47
|
42
|
44
|
5
|
4
|
4
|
08,33
|
|
200
|
27
|
36
|
31
|
3
|
9
|
6
|
16,22
|
|
400
|
13
|
-
|
13
|
3
|
-
|
3
|
15,00
|
|
I
|
100
|
5
|
10
|
7
|
22
|
13
|
17
|
70,83
|
|
200
|
3
|
-
|
3
|
13
|
-
|
13
|
81,25
|
|
400
|
11
|
7
|
9
|
11
|
9
|
10
|
52,63
|
|
Témoin
Positif
|
96
|
-
|
96
|
4
|
-
|
4
|
04,00
|
|
Témoin
Négatif
|
5
|
-
|
5
|
42
|
-
|
42
|
89,36
|
Légende :
L : Lyophilisat
E : Solution
éthéro-méthanolique
S : Saponines brutes
I : Partie insoluble dans le
méthanol
Tableau 8 : Résultats des essais biologiques pour
l'échantillon de sang n°3
|
Echantillon N°3
|
|
#
|
Conc
(ìg/mL)
|
GR falciformes
|
GR normaux
|
% de GR normaux
|
|
1er champ
|
2e champ
|
Moyenne
|
1er champ
|
2e champ
|
Moyenne
|
|
L
|
100
|
10
|
-
|
10
|
15
|
-
|
15
|
60,00
|
|
200
|
8
|
-
|
8
|
22
|
-
|
22
|
73,33
|
|
400
|
20
|
-
|
20
|
70
|
-
|
70
|
77,78
|
|
E
|
100
|
51
|
-
|
51
|
13
|
-
|
13
|
20,31
|
|
200
|
22
|
-
|
22
|
14
|
-
|
14
|
38,89
|
|
400
|
20
|
18
|
19
|
21
|
23
|
22
|
53,66
|
|
S
|
100
|
11
|
17
|
14
|
6
|
1
|
3
|
17,65
|
|
200
|
20
|
12
|
16
|
7
|
4
|
5
|
23,81
|
|
400
|
26
|
-
|
26
|
16
|
-
|
16
|
38,09
|
|
I
|
100
|
9
|
3
|
6
|
29
|
15
|
22
|
78,57
|
|
200
|
4
|
-
|
4
|
12
|
-
|
12
|
75,00
|
|
400
|
11
|
9
|
10
|
3
|
6
|
4
|
28,57
|
|
Témoin
Positif
|
66
|
69
|
67
|
3
|
8
|
5
|
06,94
|
|
Témoin
Négatif
|
6
|
3
|
4
|
43
|
60
|
51
|
92,73
|
Légende :
L : Lyophilisat
E : Solution
éthéro-méthanolique
S : Saponines brutes
I : Partie insoluble dans le
méthanol
Tableau 9 : Résultats des essais biologiques pour les 3
échantillons
|
#
|
Concentration
(ìg/mL)
|
Echantillon 1
(%)
|
Echantillon 2
(%)
|
Echantillon 3
(%)
|
Moyennes
(%)
|
|
L
|
100
|
-
|
78,00
|
60,00
|
69,00
|
|
200
|
56,09
|
80,00
|
73,33
|
69,80
|
|
400
|
65,38
|
41,93
|
77,78
|
61,70
|
|
E
|
100
|
-
|
27,40
|
20,31
|
23,85
|
|
200
|
57,72
|
32,26
|
38,89
|
42,96
|
|
400
|
07,41
|
14,81
|
53,66
|
25,29
|
|
S
|
100
|
-
|
08,33
|
17,65
|
12,99
|
|
200
|
29,58
|
16,22
|
23,81
|
23,20
|
|
400
|
12,50
|
15,00
|
38,09
|
21,86
|
|
I
|
100
|
64,41
|
70,83
|
78,57
|
71,27
|
|
200
|
79,03
|
81,25
|
75,00
|
78,43
|
|
400
|
89,53
|
52,63
|
28,57
|
56,91
|
|
Témoin
Positif
|
7,69
|
04,00
|
06,94
|
06,21
|
|
Témoin
Négatif
|
91,67
|
89,36
|
92,73
|
91,25
|
Légende :
L : Lyophilisat
E : Solution
éthéro-méthanolique
S : Saponines brutes
I : Partie insoluble dans le
méthanol
5.1.3. Screening
phytochimique de la fraction éthéro-méthanolique
Les résultats du screening phytochimique du
résidu sec de la solution éthéro-méthanolique sont
présentés dans le Tableau ci-dessous :
Tableau 10 : Screening phytochimique de la fraction
éthéro-méthanolique de BEAT-SS®
|
Groupes phytochimiques
|
Réactifs
|
Résultats
|
|
Alcaloïdes
|
Bouchardat et Dragendorff
|
-
|
|
Sucres réducteurs
|
Fehling
|
-
|
|
Glycosides cardiotoniques
|
Keller Killiani
|
-
|
|
Saponines
|
Test de mousse
|
-
|
|
Polyphénols
|
FeCl3 2%
|
+
|
|
Tanins catéchiques
|
Stiasny et Bate-Smith
|
+
|
|
Tanins galliques
|
Stiasny et FeCl3 2%
|
-
|
|
Anthocyanes
|
HCl conc et NH4OH 25%
|
-
|
|
Flavonoïdes
|
Shinoda
|
-
|
|
Stéroïdes et triterpènes
|
Liebermann Burchard
|
+
|
|
Aminoacides
|
Test à la ninhydrine
|
-
|
|
Coumarines
|
Lampe UV
|
+
|
|
Anthraquinones
|
Bornträger
|
-
|
Légende :
Test positif : +
Test négatif : -
5.2. Discussion
Les objectifs spécifiques de ce travail étaient
de fractionner BEAT-SS®, d'évaluer l'activité
antifalcémiante de la fraction éthéro-méthanolique
et d'identifier les groupes phytochimiques présents dans cette
fraction.
5.2.1.
Fractionnement de BEAT-SS®
Au niveau du Tableau 4, on note que sur les 25 g de poudre
lyophilisée de départ (L) nous n'avons obtenu
que 3,5412 g de résidu sec de la solution
éthéro-méthanolique (E), soit
14,16% seulement de notre produit. Tandis que la fraction des
saponines brutes (S) et la partie insoluble dans le
méthanol (I) ont représenté
respectivement 30,13% et 55,70%.
La fraction (E) (et ses constituants)
représente donc quantitativement la plus faible proportion pouvant se
trouver dans la poudre de BEAT-SS.
5.2.2. Evaluation
de l'activité antifalcémiante
Les Tableaux 6, 7, 8 et 9 ont pu faire ressortir en
pourcentage les résultats de l'évaluation de l'activité
des 4 fractions évaluées pour les 3 échantillons de sang.
En comparant l'activité antifalcémiante des
différentes fractions dont les valeurs moyennes sont consignées
dans le Tableau 9, on constate que : d'une part, la concentration optimale
offrant les meilleurs résultats pour toutes les fractions est de
200 ìg/mL ; d'autre part, la partie insoluble dans
le méthanol (I) présente une meilleure
activité que le lyophilisat (L), soit
78,43% de réhabilitation des GR après
falciformation contre 69,80%, ceci dû probablement
à l'absence des saponines dans l'extrait qui exercent un effet
freinateur sur la réhabilitation des GR. Nous avons ainsi une
confirmation des résultats des travaux antérieurs.1,
11
Toutefois, la solution
éthéro-méthanolique (E) a donné un
taux de réhabilitation des GR de 42,96%, ce qui n'est
pas moindre tandis que la fraction des saponines brutes (S) ne
présente que 23,20% de réhabilitation des GR. Bien que
(I) présente la meilleure activité, il est peu
probable que les résultats du taux de réhabilitation des GR de
(E) soient dus à des traces de (I)
ayant diffusées dans les eaux mères ; quoique cette
hypothèse ne peut être totalement écartée.
Une autre hypothèse envisageable serait que les
fractions (E) et (I) possèderaient des
principes actifs différents pouvant agir en synergie pour produire les
effets antifalcémiants.
Toutes ces interrogations trouveraient un début de
solution si on pouvait comparer les résultats du screening phytochimique
de (E) et (I) et procéder à des
CCM avec détermination des Rf, on pourrait ainsi confirmer ou
infirmer chacune des hypothèses émises ci-haut.
5.2.3. Screening
phytochimique de la fraction éthéro-méthanolique
Le screening phytochimique de la fraction (E)
nous a montré la présence des groupes suivants :
- polyphénols,
- tanins catéchiques,
- coumarines,
- stéroïdes et triterpènes.
Une étude approfondie de cette fraction
(E) par des méthodes chromatographiques peut être
envisagée dans le but d'isoler chacun de ces groupes et de les tester
individuellement. De même il serait intéressant de comparer les
résultats du screening phytochimique des deux fractions
(E) et (I) pour les raisons
évoquées au point 5.2.2.
CONCLUSION
Les objectifs spécifiques de ce travail étaient
de fractionner BEAT-SS®, d'évaluer l'activité
antifalcémiante de la fraction éthéro-méthanolique
(E) et d'identifier les groupes phytochimiques présents
dans cette fraction.
Au terme de ce travail, nous avons obtenu une fraction
(E) représentant 14,16% de la poudre
lyophilisée de BEAT-SS® ; une faible proportion qui
néanmoins a été évaluée et a fourni un taux
de réhabilitation des GR non négligeable de
42,96%. S'agissant de la composition de cette fraction, le
criblage phytochimique a révélé la présence
de polyphénols, de tanins catéchiques, de coumarines, de
stéroïdes et triterpènes. Par ailleurs, la fraction
la plus active issue du fractionnement de BEAT-SS® fut la fraction de
l'insoluble dans le méthanol (I) avec un taux de
réhabilitation des GR de 78,43%.
En introduction nous avions dit que le fractionnement
bio-guidé de BEAT-SS® se justifiait par l'hypothèse selon
laquelle il possèderait des groupes phytochimiques qui agiraient soit
individuellement, soit en synergie, conférant ainsi à la recette
la propriété de reverser la falciformation des globules rouges
chez les drépanocytaires. Pour expliquer l'activité
antifalcémiante de la fraction (E), deux
éventualités furent donc envisagées :
- la première attribue l'activité
antifalcémiante de la fraction (E) à des traces
de (I) ayant diffusé dans (E) lors de
la dissolution du lyophilisat dans le méthanol ;
- la seconde attribue cette activité à un (ou
plusieurs) groupe phytochimique de (E) différent de
celui responsable de l'activité de (I) et BEAT-SS®
agirait donc par synergie.
Résoudre ce questionnement nous renvoie donc à
poursuivre nos investigations sur les deux fractions en question.
Face aux résultats obtenus au terme de ce travail, nous
convenons que la recherche doit se poursuivre et des travaux ultérieurs
doivent être effectués. Ainsi nous suggérons de :
- comparer les groupes phytochimiques présents dans la
fraction la plus active de BEAT-SS à ceux présents dans sa
fraction éthéro-méthanolique pour établir si oui ou
non nous sommes en face d'une synergie ou pas, à cet effet une
comparaison des résultats du screening chimique des deux fractions et
des CCM devraient permettre d'y répondre ;
- isoler chacun des groupes phytochimiques de la fraction
éthéro-méthanolique par des méthodes
chromatographiques et procéder à une évaluation de
l'activité antifalcémiante des groupes isolés.
Ceci pourra permettre plus tard qu'une détermination
structurale de la molécule active puisse être
effectuée ; que le mécanisme d'action de BEAT-SS®
puisse être élucidé ; qu'une pharmacomodulation puisse
être envisagée et enfin que nous puissions disposer de
modèles ou précurseurs pour une synthèse chimique totale
ou partielle à l'échelle industrielle.
BIBLIOGRAPHIE
1) Nsimba M, Lami N, Chika Y, Toshiyuki K et al (2012). In vitro
reversal of deformity and inhibition of aggregation of sickle red blood cells
by two Congolese herbal medicines. Journal of Medicinal Plants Research 6(31) :
4601-4608, DOI: 10.5897/JMPR11.376
2) Code de la Santé Publique (1961). Article L.5111-1,
France
3) Ngombe K (2012). Eléments de pharmacopée
traditionnelle et de pharmacognosie, Note de cours, Faculté de Sciences
Pharmaceutiques, Université de Kinshasa
4) OMS (2010). Partie du site consacrée aux
médecines traditionnelles,
http://www.who.int/mediacentre/factsheets/fs134/fr/, (02 juin 2014)
5) Phytothérapie - Wikipedia, the free encyclopedia,
http://fr.wikipedia.org/wiki/Phytothérapie, (02 juin 2014)
6) OMS (2006). Rapport sur la Drépanocytose,
http://apps.who.int/gb/ebwha/pdf_files/WHA59/A59_9-fr.pdf , (25 janvier
2014)
7) Arnal C et Girot R (2002). Drépanocytose chez l'adulte.
Encycl Méd Chir (Éditions Scientifiques et Médicales
Elsevier SAS, Paris), Hématologie, 13-006-D-16 :15
8) OMS (2010). Drépanocytose : une stratégie pour
la région africaine de l'OMS. Rapport du Directeur régional 3
9) Tshilolo L et al (2009). Neonatal screening for sickle cell
anaemia in the Democratic Republic of Congo: experience from a pioneer project
on 31204 newborns. Journal of Clinical Pathology 62:35-38.
10) Radio Okapi (2014). Dr Ange Ngonde : « Kinshasa compte
environ 80 000 drépanocytaires »,
http://radiookapi.net/emissions-2/linvite-du-jour/2014/01/24/dr-ange-ngonde-kinshasa-compte-environ-80-000-drepanocytaires/
(14 mars 2014)
11) Lami M (2010). Evaluation de l'activité de la recette
désaponifiée de BEAT-SS utilisée comme
anti-drépanocytaire. Mémoire, Faculté des sciences
pharmaceutiques, Université de Kinshasa
12) Ndokolo M (2003). Revalorisation scientifique des
médicaments naturels congolais : investigation chimique
préliminaire sur BEAT-SS, phytomédicament utilisé contre
la drépanocytose ; Mémoire, Faculté des Sciences
Pharmaceutiques, Université de Kinshasa
13) Drépanocytose, dans : Encyclopédie
Larousse Médical (2006), CD-Rom version électronique
14) Nsimba M (2012). Notions d'hématologie et
d'immunologie, Note de cours, Faculté de Sciences Pharmaceutiques,
Université de Kinshasa
15) Site des hôpitaux de Lyon (2008).
http://www.chu-lyon.fr/web/File/17466 (14 mars 2014)
16) Platt OS, Orkin SH, Dover G, Beardsley GP, Miller B, Nathan
DG (1984). Hydroxyurea enhances fetal hemoglobin production in sickle cell
anémia, J Clin Invest ; 74:652-656,
http://www.jci.org/articles/view/111464 (25 janvier 2014)
17) How is sickle cell anemia treated ? - National Heart, Lung,
and Blood Institute NHLBI, National Institutes of Health NIH,
http://www.nhlbi.nih.gov/health/health-topics/topics/sca/treatment (25 janvier
2014)
18) Présentation d'un médicament anti
drépanocytaire - ReMeD, http://www.remed.org/Plan-Drepanostat81 .rtf (07
mai 2014)
19) Iyamu EW et al (2002). In vitro effects of NIPRISAN
(Nix-0699) : a naturally occuring, potent antisickling agent. Br J Haematol.
118(1):337-43, http://www.nhlbi.nih.gov/m/pubmed/12100171/ (25 janvier 2014)
20) Nicosan - Wikipedia, the free encyclopedia ;
http://en.wikipedia.org/wiki/Nicosan (07 mai 2014)
21) Niprisan Brevet US5800819 Piper guineense, Pterocarpus osum,
Eugenia caryophyllum and Sorghum bicolor extracts for treating sickle cell
disease ; http://www.google.com.tr/patents/US5800819 (07 mai 2014)
22) VK-500 ; http://www.vk500.com (07 mai 2014)
23) Mpiana P, Mudogo V, Tshibangu D et al (2007). Antisickling
activity of some Congolese plants, in : Drug discovery from African flora, The
12th Symposium of the Natural Product Research Network for Eastern and Central
Africa, July 22-26; University of Makerere, Kampala, Uganda, p.45 ( PS-6 ) ;
http://www.researchgate.net/profile/Pius_Tshimankinda_MPIANA/publications/1 (07
mai 2014)
24) Abdulmalik O et al (2005). 5-hydroxyméthyl-2-furfural
modifies intracellular sickle haemoglobin and inhibits sickling of red blood
cells. Br J Haematol. ; 128(4):552-61,
http://www.nhlbi.nih.gov/m/pubmed/15686467/ (25 janvier 2014)
25) Zhang C et al (2004). Anti-sickling effect of MX-1520, a
prodrug of vanillin : an in vivo study using rodents. Br J Haematol.
125(6):788-95, http://www.nhlbi.nih.gov/m/pubmed/15180869/ (25 janvier 2014)
26) Niihara Y et al (1998). Oral L-glutamine therapy for sickle
cell anemia : I. Subjective clinical improvement and favorable change in red
cell NAD redox potential. AM J Hem. 58:117-121
27) Masiala T (2012). Méthode de recherche scientifique,
Note de cours, Faculté de Sciences Pharmaceutiques, Université de
Kinshasa
28) Mulamba B (2004). Investigation préliminaire sur le
mécanisme d'action de BEAT-SS, phytomédicament utilisé
contre la drépanocytose, Mémoire, Faculté des Sciences
pharmaceutiques, Université de Kinshasa
29) Nsimba M, Lami N, Hayakawa Y, Yamamoto C et Toshiyuki K
(2013). Decreased thrombin activity by a congolese herbal medicine used in
sickle cell anemia. Journal of ethnopharmacology 148 : 895-900
30) Prashant T, Bimlesh K, Mandeep K et al (2011). Phytochemical
screening and Extraction: A Review. Inter. Pharm. Sciencia, 1: 6 -7,
http://www.ipharmsciencia.com/Dacuments/1/11 .pdf (07 mai 2014)
31) Kone M, Ouattara K, Gnahoue G, Ouattara A, Coulibaly A.
(2013). Study ethnopharmacological and phytochemical pf somes plants involved
in the treatment of abdominal infections in the department of Kouto (Côte
d'Ivoire). Scholars Journal of Applied Medical Sciences ; 1(2) : 56 - 61
32) Bruneton J (1993). Pharmacognosie, Phytochimie : Plantes
médicinales ; 2e Ed : TEC et DOC (Paris) ; p: 914.
33) Tona L, Kambu K, Ngimbi N, Cimanga K et al (1998).
Antiamoebic and phytochemical screening of some Congolese medicinal plants. J.
Ethnopharm. 61: 57-65.
34) Kambu K (2012). Pharmacognosie II, Note de cours,
Faculté de Sciences Pharmaceutiques, Université de Kinshasa
ANNEXES
- Quelques photos de l'appareillage utilisé au
LAREBIORG

Photo 1 : Evaporateur rotatif Laborota 4000

Photo 2 : Agitateur magnétique avec plaque
chauffante Stuart

Photo 3 : Sonicateur VWR

Photo 4 : Balance analytique électronique Kern
& Sohn Gmbh ABS

Photo 5 : Etuve Memmert Electro Helios
- Quelques photos des extraits observés aux
microscopes
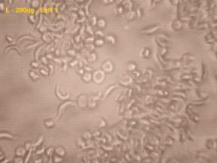 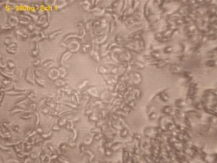
(L) : 200ìg/mL - Ech 1 (S) : 200ìg/mL
- Ech 1
 
(E) : 200ìg/mL - Ech 1 (I) : 200ìg/mL
- Ech 1
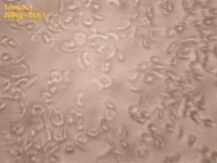 
Témoin (+) : 200ìg/mL - Ech 1
Témoin (-) : 200ìg/mL - Ech 1
Photo 6 : Observations au microscope de
l'échantillon de sang n°1
Légende :
A la concentration de 200 ìg/mL respectivement de
gauche à droite et de haut en bas : Fraction L ; Fraction
S ; Fraction E ; Fraction I ; Témoin + et Témoin
-
- Quelques photos des résultats du screening
phytochimique

Photo 7 : Résultats du screening phytochimique de la
fraction E

Photo 8 : Résultats après filtration des
réactions de Stiasny et Fehling

Photo 9 : Fluorescence des coumarines en milieu alcalin
à la lampe UV
à 365 nm (à gauche le témoin et à
droite l'essai)
* 1 Nsimba M, Lami N, Chika Y,
Toshiyuki K et al (2012). In vitro reversal of deformity and inhibition of
aggregation of sickle red blood cells by two Congolese herbal medicines.
Journal of Medicinal Plants Research 6(31) : 4601-4608, DOI:
10.5897/JMPR11.376
* 2 Code de la Santé
Publique (1961). Article L.5111-1, France
* 3 Ngombe K (2012).
Eléments de pharmacopée traditionnelle et de pharmacognosie, Note
de cours, Faculté de Sciences Pharmaceutiques, Université de
Kinshasa
* 4 OMS (2010). Partie du site
consacrée aux médecines traditionnelles,
http://www.who.int/mediacentre/factsheets/fs134/fr/, (02 juin 2014)
* 5 Phytothérapie -
Wikipedia, the free encyclopedia,
http://fr.wikipedia.org/wiki/Phytothérapie, (02 juin 2014)
* 6 OMS (2006). Rapport sur la
Drépanocytose, http://apps.who.int/gb/ebwha/pdf_files/WHA59/A59_9-fr.pdf
, (25 janvier 2014)
* 7 Arnal C et Girot R (2002).
Drépanocytose chez l'adulte. Encycl Méd Chir (Éditions
Scientifiques et Médicales Elsevier SAS, Paris), Hématologie,
13-006-D-16 :15
* 8 OMS (2010).
Drépanocytose : une stratégie pour la région africaine de
l'OMS. Rapport du Directeur régional 3
* 9 Tshilolo L et al (2009).
Neonatal screening for sickle cell anaemia in the Democratic Republic of Congo:
experience from a pioneer project on 31204 newborns. Journal of Clinical
Pathology 62:35-38.
* 10 Radio Okapi (2014). Dr
Ange Ngonde : « Kinshasa compte environ 80 000 drépanocytaires
»,
http://radiookapi.net/emissions-2/linvite-du-jour/2014/01/24/dr-ange-ngonde-kinshasa-compte-environ-80-000-drepanocytaires/
(14 mars 2014)
* 11 Lami M (2010). Evaluation
de l'activité de la recette désaponifiée de BEAT-SS
utilisée comme anti-drépanocytaire. Mémoire,
Faculté des sciences pharmaceutiques, Université de Kinshasa
* 12 Ndokolo M (2003).
Revalorisation scientifique des médicaments naturels congolais :
investigation chimique préliminaire sur BEAT-SS, phytomédicament
utilisé contre la drépanocytose ; Mémoire, Faculté
des Sciences Pharmaceutiques, Université de Kinshasa
* 13 Drépanocytose, dans
: Encyclopédie Larousse Médical (2006), CD-Rom version
électronique
* 14 Nsimba M (2012). Notions
d'hématologie et d'immunologie, Note de cours, Faculté de
Sciences Pharmaceutiques, Université de Kinshasa
* 15 Site des hôpitaux de
Lyon (2008), http://www.chu-lyon.fr/web/File/17466 (14 mars 2014)
* 16 Platt OS, Orkin SH, Dover
G, Beardsley GP, Miller B, Nathan DG (1984). Hydroxyurea enhances fetal
hemoglobin production in sickle cell anémia, J Clin Invest ; 74:652-656,
http://www.jci.org/articles/view/111464 (25 janvier 2014)
* 17 How is sickle cell anemia
treated ? - National Heart, Lung, and Blood Institute NHLBI, National
Institutes of Health NIH,
http://www.nhlbi.nih.gov/health/health-topics/topics/sca/treatment (25 janvier
2014)
* 18 Présentation d'un
médicament anti drépanocytaire - ReMeD,
http://www.remed.org/Plan-Drepanostat81 .rtf (07 mai 2014)
* 19 Iyamu EW et al (2002). In
vitro effects of NIPRISAN (Nix-0699) : a naturally occuring, potent
antisickling agent. Br J Haematol. 118(1):337-43,
http://www.nhlbi.nih.gov/m/pubmed/12100171/ (25 janvier 2014)
* 20 Nicosan - Wikipedia, the
free encyclopedia ; http://en.wikipedia.org/wiki/Nicosan (07 mai 2014)
* 21 Niprisan Brevet US5800819
Piper guineense, Pterocarpus osum, Eugenia caryophyllum and Sorghum bicolor
extracts for treating sickle cell disease ;
http://www.google.com.tr/patents/US5800819 (07 mai 2014)
* 22 VK-500 ;
http://www.vk500.com (07 mai 2014)
* 23 Mpiana P, Mudogo V,
Tshibangu D et al (2007). Antisickling activity of some Congolese plants, in :
Drug discovery from African flora, The 12th Symposium of the Natural Product
Research Network for Eastern and Central Africa, July 22-26; University of
Makerere, Kampala, Uganda, p.45 ( PS-6 ) ;
http://www.researchgate.net/profile/Pius_Tshimankinda_MPIANA/publications/1 (07
mai 2014)
* 24 Abdulmalik O et al (2005).
5-hydroxyméthyl-2-furfural modifies intracellular sickle haemoglobin and
inhibits sickling of red blood cells. Br J Haematol. ; 128(4):552-61,
http://www.nhlbi.nih.gov/m/pubmed/15686467/ (25 janvier 2014)
* 25 Zhang C et al (2004).
Anti-sickling effect of MX-1520, a prodrug of vanillin : an in vivo study
using rodents. Br J Haematol. 125(6):788-95,
http://www.nhlbi.nih.gov/m/pubmed/15180869/ (25 janvier 2014)
* 26 Niihara Y et
al (1998). Oral L-glutamine therapy for sickle cell anemia : I.
Subjective clinical improvement and favorable change in red cell NAD redox
potential. AM J Hem. 58:117-121
* 27 Masiala T (2012).
Méthode de recherche scientifique, Note de cours, Faculté de
Sciences Pharmaceutiques, Université de Kinshasa
* 28 Mulamba B (2004).
Investigation préliminaire sur le mécanisme d'action de BEAT-SS,
phytomédicament utilisé contre la drépanocytose,
Mémoire, Faculté des Sciences pharmaceutiques, Université
de Kinshasa
* 29 Nsimba M, Lami N,
Hayakawa Y, Yamamoto C et Toshiyuki K (2013). Decreased thrombin activity by a
congolese herbal medicine used in sickle cell anemia. Journal of
ethnopharmacology 148 : 895-900
* 30 Prashant T, Bimlesh K,
Mandeep K et al (2011). Phytochemical screening and Extraction: A Review.
Inter. Pharm. Sciencia, 1: 6 -7, http://www.ipharmsciencia.com/Dacuments/1/11
.pdf (07 mai 2014)
* 31 Kone M, Ouattara K,
Gnahoue G, Ouattara A, Coulibaly A (2013). Study ethnopharmacological and
phytochemical pf somes plants involved in the treatment of abdominal infections
in the department of Kouto (Côte d'Ivoire). Scholars Journal of Applied
Medical Sciences ; 1(2) : 56 - 61
* 32 Bruneton J (1993).
Pharmacognosie, Phytochimie : Plantes médicinales ; 2e Ed :
TEC et DOC (Paris) ; p: 914.
* 33 Tona L, Kambu K, Ngimbi N,
Cimanga K et al (1998). Antiamoebic and phytochemical screening of some
Congolese medicinal plants. J. Ethnopharm. 61: 57-65.
* 34 Kambu K
(2012).Pharmacognosie II, Note de cours, Faculté de Sciences
Pharmaceutiques, Université de Kinshasa
| 


